Патент на изобретение №2201217
|
||||||||||||||||||||||||||
(54) ТАБЛЕТКА С ЭНТЕРОСОЛЮБИЛЬНЫМ ПОКРЫТИЕМ И СПОСОБ ПРИГОТОВЛЕНИЯ
(57) Реферат: Изобретение относится к медицине и касается таблетки с энтеросолюбильным покрытием и способа ее приготовления. Таблетка содержит лекарственное средство, чувствительное к низким значениям рН среды, ниже 3, такое как 2′, 3′-дидезоксиинозин, энтеросолюбильное покрытие, полученное из сополимера метакриловой кислоты и пластификатора. Таблетки могут быть различного размера и могут приниматься перорально по отдельности или множество таблеток, достаточное для заданной дозы, может быть инкапсулировано в растворимой капсуле. Таблетки обладают превосходной устойчивостью к разрушению при рН ниже 3 и прекрасными свойствами по выделению лекарственного вещества при рН выше 4,5. 2 с. и 38 з.п. ф-лы, 4 табл. Изобретение относится к фармацевтической композиции в форме таблетки с энтеросолюбильньм покрытием, которая содержит неустойчивый в кислоте препарат с высокой лекарственной нагрузкой, такой как ddI, чувствительный к среде с рН менее 3, и которая включает энтеросолюбильное покрытие, такое как Eudragit L-30-D55 и пластификатор, не требующий подслоя (субпокрытия). Таблетки обладают превосходной устойчивостью к разрушению при рН менее 3, но прекрасными свойствами по выделению лекарственного вещества при рН выше 4,5. Также раскрывается новый способ приготовления указанной композиции. Энтеросолюбильные покрытия много лет использовались для предотвращения высвобождения лекарственного вещества из перорально вводимых лекарственных форм. В зависимости от композиции и/или вязкости энтеросолюбильные покрытия устойчивы к желудочной кислоте в течение необходимого периода времени прежде, чем они начнут разрушаться, делая возможным медленное выделение лекарственного вещества в нижней части желудка или в верхней части тонкого кишечника. Примеры некоторых энтеросолюбильных покрытий даны в Патенте США 5225202, такие как пчелиный воск и глицеринмоностеарат; пчелиный воск, шеллак и целлюлоза; и цетиловый спирт, смола мастикового дерева и шеллак, а также шеллак и стеариновая кислота (Патент США 2809918); поливинилацетат и этилцеллюлоза (Патент США 3835221); и нейтральный сополимер эфиров полиметакриловой кислоты (Eudragit L30D) (F.W. Goodhart et al., Pharm. Tech., pp. 64-71, April 1984); сополимеры эфиров метакриловой кислоты и метилового эфира метакриловой кислоты (Эудрагиты, Eudragits), или нейтральный сополимер эфиров полиметакриловой кислоты, содержащий стеараты металлов (Mehta et al., Патенты США 4728512 и 4794001). Большинство энтеросолюбильных полимеров начинает становиться растворимым при рН 5,5 и выше, причем максимальные скорости растворения достигаются при значениях рН выше 6,5. Многие фармацевтические композиции, покрытые энтеросолюбильными оболочками и/или пролонгированного действия, и способы приготовления этих композиций описаны в технике. Композиции предыдущего уровня техники, однако, часто, помимо лекарственных веществ, содержат много дополнительных ингредиентов, таких как наполнители, агенты для буферизации, связующие и смазывающие вещества, которые добавляются для увеличения объема композиции и уменьшения количества активного лекарственного вещества, которое может содержаться в композиции. Процессы приготовления этих вышеуказанных фармацевтических композиций требуют множества длительных стадий, включая стадии нанесения подслоя (субпокрытия) и внешнего покрытия. Кроме того, многие из этих фармацевтических композиций предназначены для доставки в нижние области желудочно-кишечного тракта, т.е. в прямую кишку, в противоположность верхней части кишечника, т.е. двенадцатиперстной кишке тонкого кишечника. В Патенте США 5225202 описаны фармацевтические композиции с энтеросолюбильными покрытиями, использующие покрытие из нейтрализованного полимера фталата гидроксипропилметилцеллюлозы (НРМСР). Описанные фармацевтические композиции содержат основу, дезинтегрант, один или более агентов для буферизации с целью обеспечения дополнительной защиты желудка, помимо энтеросолюбильного покрытия, а также энтеросолюбильное покрытие и пластификатор. Фармацевтическая композиция может также содержать один или более наполнителей – лактозу, сахар или крахмал. Согласно изобретению, охватываемому данной ссылкой, когда основу – ядро – составляет лекарственное вещество, не совместимое со слоем энтеросолюбильного покрытия, тогда для предотвращения взаимодействия неустойчивого в кислоте лекарственного вещества и кислым энтеросолюбильным покрытием используют дополнительный подслой, который ведет себя как физический барьер между ядром и внешним слоем энтеросолюбильной оболочки. Процесс растворения энтеросолюбильной оболочки из НРМСР начинается при рН 5,0. Способ приготовления такой фармацевтической композиции требует многостадийного процесса покрытия для создания подслоя, а затем энтеросолюбильной оболочки. Патент США 5026560 охватывает фармацевтическую композицию и способ приготовления указанной фармацевтической композиции, отличающиеся тем, что фармацевтическая композиция содержит ядро размером с семя яблок “чудесница”, получающееся путем покрытия сахарозы кукурузным крахмалом, напыления на ядро водного связующего в водном или этанольном растворе и напыляющего порошка, содержащего лекарственное вещество и гидроксипропилцеллюлозу с низкой степенью замещения с последующим нанесением энтеросолюбильного покрытия. В Патенте США 4524060 описывается фармацевтическая композиция пролонгированного действия для терапевтического лечения больных гипертензией, которая содержит смесь тонкоизмельченного индорамина или его фармацевтически приемлемой соли водоканалообразователя, смачивающего агента, агента, вызывающего дезинтеграцию, причем смесь находится в виде непрессованной гранулы и имеет энтеросолюбильное покрытие пролонгированного действия, проницаемое для желудочного сока. Патент США 5536507 относится к фармацевтической композиции с покрытием, обеспечивающим пролонгированное действие, или с энтеросолюбильным покрытием, при этом активный агент находится в таком виде, что основное количество лекарственного вещества выделяется близ входа в толстую кишку или в толстой кишке при рН примерно 6,4-7,0. Фармацевтические композиции, содержащие лекарственное вещество, неустойчивое в кислой среде, такой как среда в желудке, и неадекватно забуференное, требуют энтеросолюбильного защитного покрытия для предотвращения высвобождения такого лекарственного вещества до попадания в кишечник. ddI (также известный как диданозин или 2′,3′-дидезоксиинозин и выпускаемый Bristol-Myers Squibb Co. под торговой маркой Videx  ) является неустойчивым в кислой среде лекарственным веществом формулы ) является неустойчивым в кислой среде лекарственным веществом формулы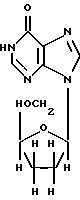 и, как было показано, является эффективным для лечения больных, инфицированных вирусом ВИЧ, вызывающим СПИД. Сообщалось о составе и способе ингибирования ВИЧ-репликации с помощью 2′,3′-дидезоксиинозина (см. Патенты США 4861759, 5254539 и 5616566). Совсем недавно Videx  стал широко применяться как компонент новых терапевтических коктейлей, используемых для лечения СПИД’а. Он также является лекарственным веществом, неустойчивым в кислой среде, чувствительным к низким значениям рН среды и разрушающимся в желудке.
Videx стал широко применяться как компонент новых терапевтических коктейлей, используемых для лечения СПИД’а. Он также является лекарственным веществом, неустойчивым в кислой среде, чувствительным к низким значениям рН среды и разрушающимся в желудке.
Videx обычно выпускают в различных дозировках для пролонгированного приема, включая жевательные/диспергируемые забуференные таблетки с содержанием диданозина 25, 50, 100 или 150 мг. Каждая таблетка забуферена карбонатом кальция и гидроксидом магния. Таблетки Videx обычно выпускают в различных дозировках для пролонгированного приема, включая жевательные/диспергируемые забуференные таблетки с содержанием диданозина 25, 50, 100 или 150 мг. Каждая таблетка забуферена карбонатом кальция и гидроксидом магния. Таблетки Videx также содержат аспартам, сорбит, микрокристаллическую целлюлозу, полиплаздон (Polyplasdone также содержат аспартам, сорбит, микрокристаллическую целлюлозу, полиплаздон (Polyplasdone ), ароматизатор с мандарино-апельсиновым запахом и стеарат магния. Videx ), ароматизатор с мандарино-апельсиновым запахом и стеарат магния. Videx – забуференный порошок для перорального раствора выпускается для перорального приема в виде пакетов с однократной дозой, содержащих 100, 167 или 250 мг диданозина. Каждый пакет, наряду с дозой продукта, содержит также цитрат-фосфатный буфер (состоящий из двухосновного фосфата натрия, цитрата натрия и лимонной кислоты) и сахарозу. Выпускается также Videx – забуференный порошок для перорального раствора выпускается для перорального приема в виде пакетов с однократной дозой, содержащих 100, 167 или 250 мг диданозина. Каждый пакет, наряду с дозой продукта, содержит также цитрат-фосфатный буфер (состоящий из двухосновного фосфата натрия, цитрата натрия и лимонной кислоты) и сахарозу. Выпускается также Videx детский порошок для перорально вводимого раствора в стеклянных флаконах емкостью 4 или 8 унций (~ 118 мл и 236 мл), содержащих 2 или 4 грамма диданозина, соответственно, который надо перед приемом (через рот) смешивать с продажным антацидом.
При том, что при терапии делается акцент на таблетки, либо принимаемые индивидуально, либо как часть комбинации (“коктейль”), современные жевательные/диспергируемые забуференные таблетки не очень удобны с точки зрения простоты применения больным. В то время как другие продукты, являющиеся частью терапевтического коктейля при СПИД’е, являются капсулами или таблетками и легко глотаются, Videx детский порошок для перорально вводимого раствора в стеклянных флаконах емкостью 4 или 8 унций (~ 118 мл и 236 мл), содержащих 2 или 4 грамма диданозина, соответственно, который надо перед приемом (через рот) смешивать с продажным антацидом.
При том, что при терапии делается акцент на таблетки, либо принимаемые индивидуально, либо как часть комбинации (“коктейль”), современные жевательные/диспергируемые забуференные таблетки не очень удобны с точки зрения простоты применения больным. В то время как другие продукты, являющиеся частью терапевтического коктейля при СПИД’е, являются капсулами или таблетками и легко глотаются, Videx (в данном описании называемый “ddI”) жевательные/диспергируемые забуференные таблетки нужно тщательно жевать, вручную измельчить или сделать однородную суспензию в воде перед приемом. Так как ddI быстро распадается при кислотных рН, ddI в жевательной/диспергируемой форме и в виде забуференного порошка для перорального раствора, содержит агенты для буферизации и вводится с антацидами в форме детского порошка. Однако присутствие в рецептуре больших количеств антацидных компонентов может привести к значительному ЖК-дисбалансу, что проявляется в виде сильной диареи. Многие больные также выражают недовольство необходимостью жевать большие таблетки ddI (доза=2 таблетки по 2,1 г каждая), вкусом таблеток или временем, требуемым для диспергирования таблеток и объемом жидкости (4 унции, 118 мл) на одну дозу. Все эти факты в сочетании с тем, что выпускаются лекарственные препараты других нуклеозидных аналогов в более доступной форме (например, капсулы или таблетки меньшего размера), требуют создания новой лекрственной формы ddI, которая легко глотается и не вызывает неприятных побочных эффектов.
В связи с этим предлагается таблетка, содержащая ядро лекарственного препарата и оболочку (покрытие), которая предотвращает выделение препарата в желудок и делает возможным высвобождение лекарственного вещества в тонкой кишке, что делает ненужным применение антацида, который при постоянном употреблении может вызвать ЖК-дисбаланс. Т.е. фармацевтические композиции, содержащие лекарственное вещество, неустойчивое в кислой среде, такой, как в желудке, требуют защитного покрытия для предотвращения высвобождения такого лекарственного вещества до попадания в кишечник.
В соответствии с данным изобретением предлагаются покрытая энтеросолюбильной оболочкой высоконагруженная фармацевтическая композиция и способ получения указанной фармацевтической композиции, содержащей лекарственное вещество, которое может распадаться в среде с низким рН, но не распадается, так как это предотвращает энтеросолюбильное покрытие. Фармацевтическая композиция по изобретению, преимущественно в форме таблеток, включает основу, содержащую лекарственное вещество, такое как ddI, чувствительное к среде с низкими значением рН, и при необходимости связующее или наполнитель, вещество, способствующее дезинтеграции, или вещество, способствующее набуханию, и смазку. Кроме того, имеется энтеросолюбильная оболочка, покрывающая основу, которая содержит сополимер метакриловой кислоты и пластификатор.
Новый фармацевтический препарат с энтеросолюбильным покрытием по изобретению обеспечивает защиту лекарственного вещества или терапевтически активного агента, такого как ddI, при рН ниже 3 (как в желудке), но разрешает высвобождение лекарствнного вещества при рН 4,5 или выше (как в верхней части кишечника).
Соответственно, фармацевтическая композиция по изобретению обычно содержит лекарственные вещества, химически неустойчивые в кислых средах. Фармацевтическая композиция по изобретению обеспечивает превосходную защиту в очень кислых средах (рН<3), не препятствуя быстрому высвобождению на участках с рН выше 4, независимо от того, происходит это в верхней части кишечника или в двенадцатиперстной кишке.
Большинство известных в технике материалов для энтеросолюбильного покрытия имеют кислую природу и, следовательно, при контакте с кислотонеустойчивыми ингредиентами могут быть причиной химической нестабильности. Это особенно справедливо при высокой температуре и во влажной атмосфере, при которых осуществляется процесс водного покрытия. Чтобы свести к минимуму эту обусловленную кислотой нестабильность, между частицами, шариками, гранулами, таблетками и т. д. и энтеросолюбильным покрытием обычно помещают защитное покрытие или подслой. Это защитное покрытие физически отделяет лабильное в кислоте лекрственное вещество от кислого энтеросолюбильного покрытия и, следовательно, повышает стабильность рецептуры. Процесс нанесения такого подслоя, однако, часто состоит из множества утомительных и длительных стадий. Кроме того, подслой может замедлять высвобождение лекарственного вещества.
Т. е. описывается способ, при котором таблетки, шарики, гранулы и/или частицы, содержащие неустойчивые в кислоте лекарственные вещества, можно с успехом покрывать энтеросолюбильной оболочкой в воде без применения защитного слоя или подслоя. Этот способ включает повышение величины рН суспензии энтеросолюбильного покрытия с помощью подщелачивающих агентов. Величину рН суспензии покрытия повышают до значения, более низкого, чем то, при котором может быть нарушена целостность полимера. Процесс может также включать введение связующих, таких как натрий-карбоксиметилцеллюлоза, наполнителей, таких как микрокристаллическая целлюлоза, веществ, способствующих дезинтеграции, таких как щелочной крахмал, и других эксципиентов, таких как оксид магния, имеющий относительно щелочной характер, в рецептуру предлагаемого энтеросолюбильного покрытия ядра. Повышение рН суспензии покрытия дает более стабильную композицию неустойчивого в кислоте лекарственного вещества в ядре. В результате отсутствует несовместимость и исчезает необходимость в защитном подслое между неустойчивым в кислой среде лекарственным веществом и кислым энтеросолюбильным покрытием. При этом способе не только отсутствует дополнительно увеличивающая стоимость стадия нанесения подслоя, но также достигается более быстрое высвобождение лекарственного вещества, так как дополнительный подслой замедляет выделение лекарственного вещества.
Способ по данному изобретению иллюстрирует приготовление таблеток с высоким содержанием (99,5% от непокрытой таблетки) неустойчивых в кислой среде лекарственных веществ, таких как ddI, с использованием водного метода. Не требуется никакого специального оборудования, так как было обнаружено, что для формования и покрытия таблеток годится обычное оборудование для перемешивания, прессования, таблетирования и нанесения покрытия.
В пищеварительном тракте покрытые таблетки проходят сначала через желудок. Время прохождения через жедудок составляет примерно два часа и рН на этом участке равен примерно 1-3. Компонент энтеросолюбильного покрытия позволяет ядру с лекарственньм веществом оставаться практически интактным и, следовательно, предотвращает выделение фармакологически активного вещества на этом участке или проникновение кислоты в ядро таблетки. Затем таблетка проходит через тонкий кишечник, при этом основная часть компонента энтеросолюбильного покрытия растворяется и высвобождает фармакологически активное вещество. При нормальном направлении потока тонкий кишечник состоит из двенадцатиперстной кишки и подвздошной кишки. Время прохождения через тонкий кишечник составляет примерно 2-4 часа и рН на этих участках равно примерно 5-7,2.
Применяемый в данном описании термин “энтеросолюбильное покрытие” означает полимерный материал или материалы, который(ые) покрывает(ют) ядро-основу с лекарственным веществом. Полимерный материал энтеросолюбильного покрытия по данному изобретению не содержит никаких активных соединений, т.е. никакого терапевтически активного агента, по данному соединению. Предпочтительно, чтобы значительное или все количество полимерного материала энтеросолюбильного покрытия растворялось, прежде чем лекарственное вещество или терапевтически активный агент высвобождается из лекарственной формы, так, чтобы достигалось пролонгированное растворение основы – лекарственного вещества. Пригодным рН-чувствительным полимером является такой, который растворяется в кишечных соках при более высоких значениях рН (рН выше 4,5), таких как в тонкой кишке, и, следовательно, позволяет высвобождение фармакологически активного вещества в области тонкого кишечника, а не в верхней области ЖК тракта, такой как желудок.
Полимерный материал покрытия выбирают так, чтобы терапевтически активный агент выделялся тогда, когда лекарственная форма достигнет тонкой кишки или участка, на котором рН выше 4,5. Предпочтительны рН-чувствительные материалы покрытия, которые остаются интактными при более низком значении рН среды в желудке, но разрушаются или растворяются при значениях рН, обычно наблюдаемых в тонкой кишке больного. Полимерный материал энтеросолюбильного покрытия начинает растворяться в водном растворе при рН примерно 4,5-5,5. Зависимость растворимости энтеросолюбильных полимеров по данному изобретению такова, что заметного растворения полимерного энтеросолюбильного покрытия не происходит до тех пор, пока лекарственная форма не покинет желудок. рН в тонкой кишке постепенно повышается примерно от 4,5 до 6,5 в луковице двенадцатиперстной кишки до примерно 7,2 в дистальных областях тонкого кишечника (подвздошная кишка). Чтобы обеспечить прогнозируемое растворение, соответствующее времени прохождения через тонкие кишки – около 3 часов, и воспроизводимое высвобождение в них, покрытие должно начать растворяться в интервале рН в двенадцатиперстной кишке и продолжать растворяться при значениях рН в тонких кишках. Следовательно, количество энтеросолюбильного полимерного покрытия должно быть таким, чтобы оно практически растворялось в течение примерно трех часов – времени прохождения через тонкую кишку.
Фармацевтическое лекарственное средство в сердцевине является неустойчивым в кислоте лекарственным веществом, таким как ddI, правастатин, эритромицин, дигоксин, панкреатин, ddA, ddC и т.п. Данное изобретение не ограничено этими лекарственными препаратами, другие лекарственные вещества также можно использовать. Данное изобретение особенно пригодно для фармацевтических композиций, таких как таблетки, которые в качестве лекарственного вещества содержат ddI. ddI присутствует в количестве, примерно, до 95% композиции в покрытых таблетках.
В ядре (основе) может присутствовать одно или более связующих или наполнителей. Микрокристаллическая целлюлоза (РН-101) является предпочтительным связующим, наиболее пригодным для использования по данному изобретению. Примеры других связующих, которые можно использовать включают натрий-карбоксиметилцеллюлозу AvicelTM PH101, AvicelTM RC 591, AvicelTM CL-611 (FMC Corp. ), Ceolus (FMC Corp.), ProSolvTM (Edward Mendell Co.), MethocelTM E-5 (Dow Corp. ), Starch 1500 (Colorcon, Ltd.), гидроксипропилметилцеллюлозу (НРМС) (Shin-Etsu Chemical Co., Ltd.), поливинилпирролидон, альгинат калия и альгинат натрия.
Ядро (основа) композиции по изобретению может также включать одно или более веществ, способствующих дезинтеграции (измельчению) или набуханию, таких как натриевое производное крахмала (щелочной крахмал), выпускаемое под торговой маркой EXPLOTAB (Edward Mendell Co.), Ac-Di-Sol (сшитая натрий-карбоксиметилцеллюлоза) (FMC Corp.), натрий-кроскармеллоза, кукурузный крахмал или сшитый поливинилпирролидон. Смазку, такую как стеарат магния, также можно использовать при приготовлении непокрытой таблетки, а именно в качестве смазки при прессовании и таблетировании.
Ядро (основу), используемое в фармацевтической композиции по изобретению, получают в форме таблетки, предпочтительно круглой, двояковыпуклой таблетки, примерно 3/16 дюйма (4,76 мм). Данное изобретение, однако, не ограничивает размера таблетки и таблетки можно готовить разного размера. Таблетки меньшего размера, однако, предпочтительны, так как они легче проходят через желудок, чем таблетки большего размера. Эксперименты показали, что таблетка по данному изобретению с ddI, содержащемся в ядре в качестве лекарственного вещества, имеет ту же биодоступность, что и гранула, описываемая в одновременно рассматриеваемой заявке США 09/083597, поданной 22 мая 1998. В зависимости от размера таблеток их можно глотать по отдельности, или множество таблеток, достаточное для получения конкретной дозы, можно инкапсулировать в растворимую капсулу.
В альтернативном варианте данного изобретения ядро можно приготовить по способу влажной грануляции, используя (если необходимо) одно из связующих для влажной грануляции, обычно применяемых в технике, такое как предварительно желатинированный крахмал, поливинилпирролидон, НРМС, натрий-карбоксиметилцеллюлоза, альгинат калия или натрия. Способ влажной грануляции содержит стадии приготовления гранул, пригодных для таблетирования путем смешения компонентов: лекарственного вещества, связующего и, при необходимости, вещества, способствующего измельчению, и наполнителя; добавления заданного количества воды или растворителя для грануляции для образования влажной смеси; рассева влажной смеси в гранулы, что способствует сушке; сушки влажных гранул для удаления избыточной влаги; рассева высушенных гранул в гранулы, пригодные для таблетирования, и добавления смазки, одного или более наполнителей, одного или более сухих связующих, при необходимости вещества, способствующего измельчению, и других эксципиентов, необходимых для таблетирования гранул.
Энтеросолюбильное покрытие по данному изобретению включает сополимер метакриловой кислоты, пластификатор и достаточное количество NaOH для корректировки рН суспензии. Можно также применять другие подщелачивающие агенты, такие как гидроксид калия, карбонат кальция, натрий-карбоксиметилцеллюлозу, оксид магния и гидроксид магния.
Для получения покрытой энтеросолюбильной оболочкой фармацевтической композиции по данному изобретению используется раствор энтеросолюбильного покрытия Eudragit L-30-D55. Eudragit L-30-D55 представляет собой водную дисперсию акрилового полимера; анионный сополимер, полученный из метакриловой кислоты и этилакрилата, с соотношением свободных карбоксильных групп к сложноэфирным примерно 1:1 и со средним молекулярным весом около 250000, выпускается в виде водной дисперсии, содержащей 30 вес.% сухого лака, и поставляется фирмой Rohn-Pharma Co., Германия. Так как покрытие на водной основе, то не используются никакие опасные или экологически вредные органические растворители.
Хотя Eudragit L-30-D55 является предпочтительным полимером для покрытия, изобретение не ограничено в этом отношении и можно применять другие энтеросолюбильные полимерные покрытия, такие как фталат гидроксипропилметилцеллюлозы НР50 (НРМСР-НР55) (USP/NF 220824), НР55 (НРМСР-НР55) (USP/NF тип 200731) и HP55S, выпускаемый Shin-Etsu Chemical, CoatericTM (поливинилацетатфталат) (Colorcon Ltd.), Sureteric Ф (поливинилацетатфталат) (Colorcon Ltd.) или AquatericTM (ацетатфталат целлюлозы) (FMC Corp.) и т.п.
Энтеросолюбильное покрытие предпочтительно содержит пластификатор, которым предпочтительно является диэтилфталат, хотя изобретение не ограничено в этом отношении и можно использовать другие пластификаторы, такие как триэтилцитрат (Citroflex-2), триацетин, трибутилсебацинат или полиэтиленгликоль.
Энтеросолюбильное покрытие, используемое в данном изобретении, значительно легче обрабатывать, чем ранее описанные системы для покрытия, и особенно предпочтительны при покрытиии частиц (таблеток) малого диаметра с малой массой, вызывая малые проблемы при работе (прилипание/сортировка) и не требуя органических растворителей.
Вообще, в тех случаях, когда ядро содержит лекарственное вещество, несовместимое с энтеросолюбильным покрытием, применяется подслой, который может содержать один или более пленкообразователей или пластификаторов, и который ведет себя как физический барьер между ядром и наружным слоем энтеросолюбильного покрытия. Однако в отличие от ранее описанных покрытий, таких как в Патенте США 5225202, новая фармацевтическая композиция по данному изобретению в результате нового способа, используемого при приготовлении композиции по данному изобретению, и корректировки рН покрытия не требуется подслоя, так как необходимость в таком изолирующем слое исчезает вследствие повышения рН водной суспензии покрытия. Так как покрытие создано так, чтобы разрушаться при рН 5,5, энтеросолюбильное покрытие при применении его при рН 5 обеспечивает относительно быстрое разрушение в кишечнике, так как требуется небольшое увеличение щелочности для достижения рН 5,5.
Предпочтительная рецептура для приготовления таблетки 50 мг без покрытия представлена в табл. 1.
Предпочтительная рецептура для приготовления суспензии энтеросолюбильного пленочного покрытия для нанесения на таблетки – 50 мг – без покрытия представлена в табл. 2.
Процентное содержание ингредиентов (интервалы) в вышепредставленных рецептурах для таблетки без покрытия и энтеросолюбильного пленочного покрытия представлены на табл. 3.
Фармацевтическую композицию в форме таблетки с энтеросолюбильным покрытием можно приготовить способом, который включает стадии смешения неустойчивого в кислой среде лекарственного вещества, связующего/наполнителя, такого как микрокристаллическая целлюлоза, вещества, способствующего измельчению, такого как щелочной (Na) крахмал, и первой порции смазки, такой как стеарат магния, для уплотнения в смесителе барабанного типа с образованием сухой смеси. Затем смесь проссеивают и снова помещают в смеситель для повторного перемешивания. Образовавшуюся смесь комкуют или уплотняют, а затем рассеивают с образованием малых гранул. Затем рассчитывают вторую порцию смазки – стеарата магния – для таблетирования и смешивают в барабанном смесителе с просеянными гранулами. Образовавшуюся смесь затем формуют в виде таблеток (без покрытия) с заданным весом и твердостью.
Затем таблетки можно покрывать суспензией энтеросолюбильного пленочного покрытия, содержащей Eudragit L-30-D55 и пластификатор (диэтилфталат) в аппарате с верхним соплом с псевдоожиженным слоем покрытия, таком как стол Aeromatic STREA-1, а затем сушить. При приготовлении суспензии пленочного покрытия к суспензии добавляют раствор NaOH до рН 5,0 (в данном описании называемый “ddI”) жевательные/диспергируемые забуференные таблетки нужно тщательно жевать, вручную измельчить или сделать однородную суспензию в воде перед приемом. Так как ddI быстро распадается при кислотных рН, ddI в жевательной/диспергируемой форме и в виде забуференного порошка для перорального раствора, содержит агенты для буферизации и вводится с антацидами в форме детского порошка. Однако присутствие в рецептуре больших количеств антацидных компонентов может привести к значительному ЖК-дисбалансу, что проявляется в виде сильной диареи. Многие больные также выражают недовольство необходимостью жевать большие таблетки ddI (доза=2 таблетки по 2,1 г каждая), вкусом таблеток или временем, требуемым для диспергирования таблеток и объемом жидкости (4 унции, 118 мл) на одну дозу. Все эти факты в сочетании с тем, что выпускаются лекарственные препараты других нуклеозидных аналогов в более доступной форме (например, капсулы или таблетки меньшего размера), требуют создания новой лекрственной формы ddI, которая легко глотается и не вызывает неприятных побочных эффектов.
В связи с этим предлагается таблетка, содержащая ядро лекарственного препарата и оболочку (покрытие), которая предотвращает выделение препарата в желудок и делает возможным высвобождение лекарственного вещества в тонкой кишке, что делает ненужным применение антацида, который при постоянном употреблении может вызвать ЖК-дисбаланс. Т.е. фармацевтические композиции, содержащие лекарственное вещество, неустойчивое в кислой среде, такой, как в желудке, требуют защитного покрытия для предотвращения высвобождения такого лекарственного вещества до попадания в кишечник.
В соответствии с данным изобретением предлагаются покрытая энтеросолюбильной оболочкой высоконагруженная фармацевтическая композиция и способ получения указанной фармацевтической композиции, содержащей лекарственное вещество, которое может распадаться в среде с низким рН, но не распадается, так как это предотвращает энтеросолюбильное покрытие. Фармацевтическая композиция по изобретению, преимущественно в форме таблеток, включает основу, содержащую лекарственное вещество, такое как ddI, чувствительное к среде с низкими значением рН, и при необходимости связующее или наполнитель, вещество, способствующее дезинтеграции, или вещество, способствующее набуханию, и смазку. Кроме того, имеется энтеросолюбильная оболочка, покрывающая основу, которая содержит сополимер метакриловой кислоты и пластификатор.
Новый фармацевтический препарат с энтеросолюбильным покрытием по изобретению обеспечивает защиту лекарственного вещества или терапевтически активного агента, такого как ddI, при рН ниже 3 (как в желудке), но разрешает высвобождение лекарствнного вещества при рН 4,5 или выше (как в верхней части кишечника).
Соответственно, фармацевтическая композиция по изобретению обычно содержит лекарственные вещества, химически неустойчивые в кислых средах. Фармацевтическая композиция по изобретению обеспечивает превосходную защиту в очень кислых средах (рН<3), не препятствуя быстрому высвобождению на участках с рН выше 4, независимо от того, происходит это в верхней части кишечника или в двенадцатиперстной кишке.
Большинство известных в технике материалов для энтеросолюбильного покрытия имеют кислую природу и, следовательно, при контакте с кислотонеустойчивыми ингредиентами могут быть причиной химической нестабильности. Это особенно справедливо при высокой температуре и во влажной атмосфере, при которых осуществляется процесс водного покрытия. Чтобы свести к минимуму эту обусловленную кислотой нестабильность, между частицами, шариками, гранулами, таблетками и т. д. и энтеросолюбильным покрытием обычно помещают защитное покрытие или подслой. Это защитное покрытие физически отделяет лабильное в кислоте лекрственное вещество от кислого энтеросолюбильного покрытия и, следовательно, повышает стабильность рецептуры. Процесс нанесения такого подслоя, однако, часто состоит из множества утомительных и длительных стадий. Кроме того, подслой может замедлять высвобождение лекарственного вещества.
Т. е. описывается способ, при котором таблетки, шарики, гранулы и/или частицы, содержащие неустойчивые в кислоте лекарственные вещества, можно с успехом покрывать энтеросолюбильной оболочкой в воде без применения защитного слоя или подслоя. Этот способ включает повышение величины рН суспензии энтеросолюбильного покрытия с помощью подщелачивающих агентов. Величину рН суспензии покрытия повышают до значения, более низкого, чем то, при котором может быть нарушена целостность полимера. Процесс может также включать введение связующих, таких как натрий-карбоксиметилцеллюлоза, наполнителей, таких как микрокристаллическая целлюлоза, веществ, способствующих дезинтеграции, таких как щелочной крахмал, и других эксципиентов, таких как оксид магния, имеющий относительно щелочной характер, в рецептуру предлагаемого энтеросолюбильного покрытия ядра. Повышение рН суспензии покрытия дает более стабильную композицию неустойчивого в кислоте лекарственного вещества в ядре. В результате отсутствует несовместимость и исчезает необходимость в защитном подслое между неустойчивым в кислой среде лекарственным веществом и кислым энтеросолюбильным покрытием. При этом способе не только отсутствует дополнительно увеличивающая стоимость стадия нанесения подслоя, но также достигается более быстрое высвобождение лекарственного вещества, так как дополнительный подслой замедляет выделение лекарственного вещества.
Способ по данному изобретению иллюстрирует приготовление таблеток с высоким содержанием (99,5% от непокрытой таблетки) неустойчивых в кислой среде лекарственных веществ, таких как ddI, с использованием водного метода. Не требуется никакого специального оборудования, так как было обнаружено, что для формования и покрытия таблеток годится обычное оборудование для перемешивания, прессования, таблетирования и нанесения покрытия.
В пищеварительном тракте покрытые таблетки проходят сначала через желудок. Время прохождения через жедудок составляет примерно два часа и рН на этом участке равен примерно 1-3. Компонент энтеросолюбильного покрытия позволяет ядру с лекарственньм веществом оставаться практически интактным и, следовательно, предотвращает выделение фармакологически активного вещества на этом участке или проникновение кислоты в ядро таблетки. Затем таблетка проходит через тонкий кишечник, при этом основная часть компонента энтеросолюбильного покрытия растворяется и высвобождает фармакологически активное вещество. При нормальном направлении потока тонкий кишечник состоит из двенадцатиперстной кишки и подвздошной кишки. Время прохождения через тонкий кишечник составляет примерно 2-4 часа и рН на этих участках равно примерно 5-7,2.
Применяемый в данном описании термин “энтеросолюбильное покрытие” означает полимерный материал или материалы, который(ые) покрывает(ют) ядро-основу с лекарственным веществом. Полимерный материал энтеросолюбильного покрытия по данному изобретению не содержит никаких активных соединений, т.е. никакого терапевтически активного агента, по данному соединению. Предпочтительно, чтобы значительное или все количество полимерного материала энтеросолюбильного покрытия растворялось, прежде чем лекарственное вещество или терапевтически активный агент высвобождается из лекарственной формы, так, чтобы достигалось пролонгированное растворение основы – лекарственного вещества. Пригодным рН-чувствительным полимером является такой, который растворяется в кишечных соках при более высоких значениях рН (рН выше 4,5), таких как в тонкой кишке, и, следовательно, позволяет высвобождение фармакологически активного вещества в области тонкого кишечника, а не в верхней области ЖК тракта, такой как желудок.
Полимерный материал покрытия выбирают так, чтобы терапевтически активный агент выделялся тогда, когда лекарственная форма достигнет тонкой кишки или участка, на котором рН выше 4,5. Предпочтительны рН-чувствительные материалы покрытия, которые остаются интактными при более низком значении рН среды в желудке, но разрушаются или растворяются при значениях рН, обычно наблюдаемых в тонкой кишке больного. Полимерный материал энтеросолюбильного покрытия начинает растворяться в водном растворе при рН примерно 4,5-5,5. Зависимость растворимости энтеросолюбильных полимеров по данному изобретению такова, что заметного растворения полимерного энтеросолюбильного покрытия не происходит до тех пор, пока лекарственная форма не покинет желудок. рН в тонкой кишке постепенно повышается примерно от 4,5 до 6,5 в луковице двенадцатиперстной кишки до примерно 7,2 в дистальных областях тонкого кишечника (подвздошная кишка). Чтобы обеспечить прогнозируемое растворение, соответствующее времени прохождения через тонкие кишки – около 3 часов, и воспроизводимое высвобождение в них, покрытие должно начать растворяться в интервале рН в двенадцатиперстной кишке и продолжать растворяться при значениях рН в тонких кишках. Следовательно, количество энтеросолюбильного полимерного покрытия должно быть таким, чтобы оно практически растворялось в течение примерно трех часов – времени прохождения через тонкую кишку.
Фармацевтическое лекарственное средство в сердцевине является неустойчивым в кислоте лекарственным веществом, таким как ddI, правастатин, эритромицин, дигоксин, панкреатин, ddA, ddC и т.п. Данное изобретение не ограничено этими лекарственными препаратами, другие лекарственные вещества также можно использовать. Данное изобретение особенно пригодно для фармацевтических композиций, таких как таблетки, которые в качестве лекарственного вещества содержат ddI. ddI присутствует в количестве, примерно, до 95% композиции в покрытых таблетках.
В ядре (основе) может присутствовать одно или более связующих или наполнителей. Микрокристаллическая целлюлоза (РН-101) является предпочтительным связующим, наиболее пригодным для использования по данному изобретению. Примеры других связующих, которые можно использовать включают натрий-карбоксиметилцеллюлозу AvicelTM PH101, AvicelTM RC 591, AvicelTM CL-611 (FMC Corp. ), Ceolus (FMC Corp.), ProSolvTM (Edward Mendell Co.), MethocelTM E-5 (Dow Corp. ), Starch 1500 (Colorcon, Ltd.), гидроксипропилметилцеллюлозу (НРМС) (Shin-Etsu Chemical Co., Ltd.), поливинилпирролидон, альгинат калия и альгинат натрия.
Ядро (основа) композиции по изобретению может также включать одно или более веществ, способствующих дезинтеграции (измельчению) или набуханию, таких как натриевое производное крахмала (щелочной крахмал), выпускаемое под торговой маркой EXPLOTAB (Edward Mendell Co.), Ac-Di-Sol (сшитая натрий-карбоксиметилцеллюлоза) (FMC Corp.), натрий-кроскармеллоза, кукурузный крахмал или сшитый поливинилпирролидон. Смазку, такую как стеарат магния, также можно использовать при приготовлении непокрытой таблетки, а именно в качестве смазки при прессовании и таблетировании.
Ядро (основу), используемое в фармацевтической композиции по изобретению, получают в форме таблетки, предпочтительно круглой, двояковыпуклой таблетки, примерно 3/16 дюйма (4,76 мм). Данное изобретение, однако, не ограничивает размера таблетки и таблетки можно готовить разного размера. Таблетки меньшего размера, однако, предпочтительны, так как они легче проходят через желудок, чем таблетки большего размера. Эксперименты показали, что таблетка по данному изобретению с ddI, содержащемся в ядре в качестве лекарственного вещества, имеет ту же биодоступность, что и гранула, описываемая в одновременно рассматриеваемой заявке США 09/083597, поданной 22 мая 1998. В зависимости от размера таблеток их можно глотать по отдельности, или множество таблеток, достаточное для получения конкретной дозы, можно инкапсулировать в растворимую капсулу.
В альтернативном варианте данного изобретения ядро можно приготовить по способу влажной грануляции, используя (если необходимо) одно из связующих для влажной грануляции, обычно применяемых в технике, такое как предварительно желатинированный крахмал, поливинилпирролидон, НРМС, натрий-карбоксиметилцеллюлоза, альгинат калия или натрия. Способ влажной грануляции содержит стадии приготовления гранул, пригодных для таблетирования путем смешения компонентов: лекарственного вещества, связующего и, при необходимости, вещества, способствующего измельчению, и наполнителя; добавления заданного количества воды или растворителя для грануляции для образования влажной смеси; рассева влажной смеси в гранулы, что способствует сушке; сушки влажных гранул для удаления избыточной влаги; рассева высушенных гранул в гранулы, пригодные для таблетирования, и добавления смазки, одного или более наполнителей, одного или более сухих связующих, при необходимости вещества, способствующего измельчению, и других эксципиентов, необходимых для таблетирования гранул.
Энтеросолюбильное покрытие по данному изобретению включает сополимер метакриловой кислоты, пластификатор и достаточное количество NaOH для корректировки рН суспензии. Можно также применять другие подщелачивающие агенты, такие как гидроксид калия, карбонат кальция, натрий-карбоксиметилцеллюлозу, оксид магния и гидроксид магния.
Для получения покрытой энтеросолюбильной оболочкой фармацевтической композиции по данному изобретению используется раствор энтеросолюбильного покрытия Eudragit L-30-D55. Eudragit L-30-D55 представляет собой водную дисперсию акрилового полимера; анионный сополимер, полученный из метакриловой кислоты и этилакрилата, с соотношением свободных карбоксильных групп к сложноэфирным примерно 1:1 и со средним молекулярным весом около 250000, выпускается в виде водной дисперсии, содержащей 30 вес.% сухого лака, и поставляется фирмой Rohn-Pharma Co., Германия. Так как покрытие на водной основе, то не используются никакие опасные или экологически вредные органические растворители.
Хотя Eudragit L-30-D55 является предпочтительным полимером для покрытия, изобретение не ограничено в этом отношении и можно применять другие энтеросолюбильные полимерные покрытия, такие как фталат гидроксипропилметилцеллюлозы НР50 (НРМСР-НР55) (USP/NF 220824), НР55 (НРМСР-НР55) (USP/NF тип 200731) и HP55S, выпускаемый Shin-Etsu Chemical, CoatericTM (поливинилацетатфталат) (Colorcon Ltd.), Sureteric Ф (поливинилацетатфталат) (Colorcon Ltd.) или AquatericTM (ацетатфталат целлюлозы) (FMC Corp.) и т.п.
Энтеросолюбильное покрытие предпочтительно содержит пластификатор, которым предпочтительно является диэтилфталат, хотя изобретение не ограничено в этом отношении и можно использовать другие пластификаторы, такие как триэтилцитрат (Citroflex-2), триацетин, трибутилсебацинат или полиэтиленгликоль.
Энтеросолюбильное покрытие, используемое в данном изобретении, значительно легче обрабатывать, чем ранее описанные системы для покрытия, и особенно предпочтительны при покрытиии частиц (таблеток) малого диаметра с малой массой, вызывая малые проблемы при работе (прилипание/сортировка) и не требуя органических растворителей.
Вообще, в тех случаях, когда ядро содержит лекарственное вещество, несовместимое с энтеросолюбильным покрытием, применяется подслой, который может содержать один или более пленкообразователей или пластификаторов, и который ведет себя как физический барьер между ядром и наружным слоем энтеросолюбильного покрытия. Однако в отличие от ранее описанных покрытий, таких как в Патенте США 5225202, новая фармацевтическая композиция по данному изобретению в результате нового способа, используемого при приготовлении композиции по данному изобретению, и корректировки рН покрытия не требуется подслоя, так как необходимость в таком изолирующем слое исчезает вследствие повышения рН водной суспензии покрытия. Так как покрытие создано так, чтобы разрушаться при рН 5,5, энтеросолюбильное покрытие при применении его при рН 5 обеспечивает относительно быстрое разрушение в кишечнике, так как требуется небольшое увеличение щелочности для достижения рН 5,5.
Предпочтительная рецептура для приготовления таблетки 50 мг без покрытия представлена в табл. 1.
Предпочтительная рецептура для приготовления суспензии энтеросолюбильного пленочного покрытия для нанесения на таблетки – 50 мг – без покрытия представлена в табл. 2.
Процентное содержание ингредиентов (интервалы) в вышепредставленных рецептурах для таблетки без покрытия и энтеросолюбильного пленочного покрытия представлены на табл. 3.
Фармацевтическую композицию в форме таблетки с энтеросолюбильным покрытием можно приготовить способом, который включает стадии смешения неустойчивого в кислой среде лекарственного вещества, связующего/наполнителя, такого как микрокристаллическая целлюлоза, вещества, способствующего измельчению, такого как щелочной (Na) крахмал, и первой порции смазки, такой как стеарат магния, для уплотнения в смесителе барабанного типа с образованием сухой смеси. Затем смесь проссеивают и снова помещают в смеситель для повторного перемешивания. Образовавшуюся смесь комкуют или уплотняют, а затем рассеивают с образованием малых гранул. Затем рассчитывают вторую порцию смазки – стеарата магния – для таблетирования и смешивают в барабанном смесителе с просеянными гранулами. Образовавшуюся смесь затем формуют в виде таблеток (без покрытия) с заданным весом и твердостью.
Затем таблетки можно покрывать суспензией энтеросолюбильного пленочного покрытия, содержащей Eudragit L-30-D55 и пластификатор (диэтилфталат) в аппарате с верхним соплом с псевдоожиженным слоем покрытия, таком как стол Aeromatic STREA-1, а затем сушить. При приготовлении суспензии пленочного покрытия к суспензии добавляют раствор NaOH до рН 5,0 0,1. Корректировка рН суспензии энтеросолюбильного пленочного покрытия до значения 5 избавляет от необходимости в подслое или в изолирующем слое. Преимущество здесь заключается в том, что нанесение энтеросолюбильного покрытия при рН 5 делает возможным его относительно быстрое разрушение в кишечнике, так как требуется лишь небольшое увеличение щелочности для доведения рН до 5,5. Корректировка рН суспензии до 5 0,1. Корректировка рН суспензии энтеросолюбильного пленочного покрытия до значения 5 избавляет от необходимости в подслое или в изолирующем слое. Преимущество здесь заключается в том, что нанесение энтеросолюбильного покрытия при рН 5 делает возможным его относительно быстрое разрушение в кишечнике, так как требуется лишь небольшое увеличение щелочности для доведения рН до 5,5. Корректировка рН суспензии до 5 0,1 не является опасной. Значение рН можно довести вплоть до 5,4, если это требуется для конкретной рецептуры. Хотя предпочтительным является аппарат с верхним соплом для псевдоожиженного слоя, изобретение не ограничено в этом отношении, и можно также использовать любые подходящие средства распыления покрытия, включая аппарат с нижним соплом или устройство для нанесения покрытий типа чана.
В зависимости от размера таблетки могут глотаться по отдельности или в другом варианте изобретения могут заполнять растворимые капсулы с твердой оболочкой, такие как желатиновые капсулы различных размеров в зависимости от дозировки заданного лекарственного вещества. Если таблетки нужно инкапсулировать, к покрытым пленкой таблеткам добавляют гидрофобный антиадгезив (0,1-4 вес.%) и перемешивают.
В примерах представлены предпочтительные варианты данного изобретения. Следующие примеры дополнительно описывают материалы и методы, используемые для осуществления данного изобретения и предназначены только для иллюстративных целей, но ни в коем случае не претендуют на ограничение объема или сущности данного изобретения или Формулы изобретения. Все температуры выдержаны в градусах Цельсия, если не указано иначе, и все размеры – количество меш – соответствуют стандартам ASTM.
ПРИМЕР 1 0,1 не является опасной. Значение рН можно довести вплоть до 5,4, если это требуется для конкретной рецептуры. Хотя предпочтительным является аппарат с верхним соплом для псевдоожиженного слоя, изобретение не ограничено в этом отношении, и можно также использовать любые подходящие средства распыления покрытия, включая аппарат с нижним соплом или устройство для нанесения покрытий типа чана.
В зависимости от размера таблетки могут глотаться по отдельности или в другом варианте изобретения могут заполнять растворимые капсулы с твердой оболочкой, такие как желатиновые капсулы различных размеров в зависимости от дозировки заданного лекарственного вещества. Если таблетки нужно инкапсулировать, к покрытым пленкой таблеткам добавляют гидрофобный антиадгезив (0,1-4 вес.%) и перемешивают.
В примерах представлены предпочтительные варианты данного изобретения. Следующие примеры дополнительно описывают материалы и методы, используемые для осуществления данного изобретения и предназначены только для иллюстративных целей, но ни в коем случае не претендуют на ограничение объема или сущности данного изобретения или Формулы изобретения. Все температуры выдержаны в градусах Цельсия, если не указано иначе, и все размеры – количество меш – соответствуют стандартам ASTM.
ПРИМЕР 1ddI-рецептура таблетки 50 мг следующего состава была приготовлена как описано в табл. 4. Получение ddI-таблеток начинают помещая ddI, микрокристаллическую целлюлозу, щелочной крахмал и первую порцию стеарата магния для уплотнения в барабанный смеситель. Ингредиенты смешивают 10  2 минуты. Перед смешением все начальные ингредиенты, содержащие комки, пропускают через сито #20 меш.
Смесь после перемешивания пропускают через сито #40 меш, снова переносят в барабанный смеситель и снова перемешивают 10 2 минуты. Перед смешением все начальные ингредиенты, содержащие комки, пропускают через сито #20 меш.
Смесь после перемешивания пропускают через сито #40 меш, снова переносят в барабанный смеситель и снова перемешивают 10 2 минуты. Образовавшуюся смесь затем штампуют пуансоном 3/4″ с ровной поверхностью. Заготовки после штамповки пропускают через сита #10 и #20 меш для сортировки (рассева).
Затем вычисляют вторую порцию стеарата магния, необходимую для таблетирования, и вносят в барабанный смеситель с грануляцией для сортировки (рассева) зерен и перемешивают 10 2 минуты. Образовавшуюся смесь затем штампуют пуансоном 3/4″ с ровной поверхностью. Заготовки после штамповки пропускают через сита #10 и #20 меш для сортировки (рассева).
Затем вычисляют вторую порцию стеарата магния, необходимую для таблетирования, и вносят в барабанный смеситель с грануляцией для сортировки (рассева) зерен и перемешивают 10 2 минуты. Образовавшуюся смесь затем таблетируют для получения таблетки заданного веса и твердости.
Для получения пленочного покрытия в количествах, достаточных для нанесения на таблетки, Eudragit L-30-D55 пропускают через сито #60 меш, чтобы удалить все имеющиеся там комки. Профильтрованный Eudragit взвешивают и затем вносят при перемешивании в просмоленный сосуд, содержащий половину количества требуемой воды. Смесь непрерывно перемешивают в течение 5 минут или до тех пор, пока однородность смеси не станет явной. При непрерывном перемешивании в сосуд добавляют диэтилфталат и продолжают перемешивание 20 минут или до тех пор, пока однородность смеси не станет явной. Затем проводят стандартизацию рН-метра, используя буферы рН 4 и рН 7. При продолжающемся перемешивании в сосуд добавляют раствор NaOH до достижения значения рН 5,0 2 минуты. Образовавшуюся смесь затем таблетируют для получения таблетки заданного веса и твердости.
Для получения пленочного покрытия в количествах, достаточных для нанесения на таблетки, Eudragit L-30-D55 пропускают через сито #60 меш, чтобы удалить все имеющиеся там комки. Профильтрованный Eudragit взвешивают и затем вносят при перемешивании в просмоленный сосуд, содержащий половину количества требуемой воды. Смесь непрерывно перемешивают в течение 5 минут или до тех пор, пока однородность смеси не станет явной. При непрерывном перемешивании в сосуд добавляют диэтилфталат и продолжают перемешивание 20 минут или до тех пор, пока однородность смеси не станет явной. Затем проводят стандартизацию рН-метра, используя буферы рН 4 и рН 7. При продолжающемся перемешивании в сосуд добавляют раствор NaOH до достижения значения рН 5,0 0,1. Рецептурного веса суспензии покрытия достигают корректируя количество воды и перемешивание продолжают еще 10 минут.
Для покрытия таблеток используют аппарат для работы в псевдоожиженном слое с верхним соплом и подходящей распределительной тарелкой, позволяющей осуществлять флюидизацию продукта (таблетки) в центре.
Перед нанесением покрытия таблетки предварительно нагревают в устройстве для нанесения покрытия до температуры 45-50oС. Было определено, что температура на входе 50 0,1. Рецептурного веса суспензии покрытия достигают корректируя количество воды и перемешивание продолжают еще 10 минут.
Для покрытия таблеток используют аппарат для работы в псевдоожиженном слое с верхним соплом и подходящей распределительной тарелкой, позволяющей осуществлять флюидизацию продукта (таблетки) в центре.
Перед нанесением покрытия таблетки предварительно нагревают в устройстве для нанесения покрытия до температуры 45-50oС. Было определено, что температура на входе 50 2oС является достаточной. Скорость распыления устанавливают такой, чтобы обеспечить равномерное покрытие и удовлетворительную сушку покрытия. Найдено, что увеличение веса на 8 2oС является достаточной. Скорость распыления устанавливают такой, чтобы обеспечить равномерное покрытие и удовлетворительную сушку покрытия. Найдено, что увеличение веса на 8 0,5% за счет пленочного покрытия является достаточным. После нанесения покрытия таблетки сушат около 10 минут при температуре на входе около 50oС.
Найдено, что полученный таким образом покрытый энтеросолюбильной оболочкой ddI-продукт отлично защищает от желудочной кислоты (рН 3), но прекрасно выделяет ddI при рН>5.
ПРИМЕР 2 0,5% за счет пленочного покрытия является достаточным. После нанесения покрытия таблетки сушат около 10 минут при температуре на входе около 50oС.
Найдено, что полученный таким образом покрытый энтеросолюбильной оболочкой ddI-продукт отлично защищает от желудочной кислоты (рН 3), но прекрасно выделяет ddI при рН>5.
ПРИМЕР 2Предпочтительную рецептуру с 50 мг ddI в форме таблеток с энтеросолюбильным покрытием готовят как описано ниже. ddI (50,00 мг), микрокристаллическую целлюлозу (17,00 мг), щелочной крахмал (2,10 мг) и первую порцию стеарата магния для уплотнения (0,60 мг) загружают в соответствующий барабанный смеситель и перемешивают 10  2 минуты. Перед смешением, если требуется избавиться от комков в ингредиентах, их пропускают через сито #20 меш.
Затем смесь пропускают через сито #40 меш и снова помещают в барабанный смеситель и снова перемешивают 10 2 минуты. Перед смешением, если требуется избавиться от комков в ингредиентах, их пропускают через сито #20 меш.
Затем смесь пропускают через сито #40 меш и снова помещают в барабанный смеситель и снова перемешивают 10 2 минуты. Затем полученную смесь штампуют с помощью 3/4″ пуансонов с ровной поверхностью, получая заготовки весом 1 2 минуты. Затем полученную смесь штампуют с помощью 3/4″ пуансонов с ровной поверхностью, получая заготовки весом 1 0,2 г и с твердостью 15-20 SCU. Заготовки затем пропускают через сита #10 и #20.
Затем в барабанный смеситель с заготовками вносят вторую порцию стеарата магния (0,3 г) для таблетирования и перемешивают 10 0,2 г и с твердостью 15-20 SCU. Заготовки затем пропускают через сита #10 и #20.
Затем в барабанный смеситель с заготовками вносят вторую порцию стеарата магния (0,3 г) для таблетирования и перемешивают 10 2 минуты. Полученную смесь затем таблетируют, используя 3/16″ круглые, гладкие, глубоковогнутые пуансоны (штампы), в таблетки заданного веса при твердости их 3-6 SCU.
Количество (в г) суспензии пленочного покрытия на 100 г для покрытия таблеток, содержащих 50 мг ddI, получают, добавляют около 50 г воды в соответствующую емкость с мешалкой. При умеренной скорости перемешивания воды к ней медленно добавляют 33,33 г Eudragit L-30-D55. Перед добавлением в воду Eudragit L-30-D55 пропускают через сито #60 меш.
Продолжая перемешивание, к смеси вода/Eudragit прибавляют 1,50 г диэтилфталата до полного растворения диэтилфталата. При перемешивании медленно добавляют раствор гидроксида натрия (0,1-1 N) для того, чтобы довести рН суспензии до 5,0. Продолжая перемешивать, добавляют воду до достижения рецептурного веса и перемешивают суспензию еще 10 минут.
Для нанесения покрытия на таблетки используют Aeromatic Table-top (STREA-1) аппарат для псевдоожиженного слоя с верхним соплом и подходящей распределительной тарелкой, такой, чтобы флюидизация продуктов (таблетки) происходила в центре. Условия нанесения покрытия, используемые в процессе, следующие: 2 минуты. Полученную смесь затем таблетируют, используя 3/16″ круглые, гладкие, глубоковогнутые пуансоны (штампы), в таблетки заданного веса при твердости их 3-6 SCU.
Количество (в г) суспензии пленочного покрытия на 100 г для покрытия таблеток, содержащих 50 мг ddI, получают, добавляют около 50 г воды в соответствующую емкость с мешалкой. При умеренной скорости перемешивания воды к ней медленно добавляют 33,33 г Eudragit L-30-D55. Перед добавлением в воду Eudragit L-30-D55 пропускают через сито #60 меш.
Продолжая перемешивание, к смеси вода/Eudragit прибавляют 1,50 г диэтилфталата до полного растворения диэтилфталата. При перемешивании медленно добавляют раствор гидроксида натрия (0,1-1 N) для того, чтобы довести рН суспензии до 5,0. Продолжая перемешивать, добавляют воду до достижения рецептурного веса и перемешивают суспензию еще 10 минут.
Для нанесения покрытия на таблетки используют Aeromatic Table-top (STREA-1) аппарат для псевдоожиженного слоя с верхним соплом и подходящей распределительной тарелкой, такой, чтобы флюидизация продуктов (таблетки) происходила в центре. Условия нанесения покрытия, используемые в процессе, следующие:Загрузка – 250 г Установка температуры – 60oС Установка вентилятора – 14 Температура на входе – 50oС Время предварительного нагрева – 5 мин Скорость напыления в первые 5 мин – 4 г/мин Скорость напыления конечная – 8 г/мин Отверстие сопла – 1,1 мм Воздушный объем – 120 Температура на выходе – 36oС Прибавка в весе – 8% Окончательная сушка при установке вентилятора 10 – 10 мин Перед напылением таблетки предварительно нагревают в устройстве нанесения покрытия до температуры 45-50oС. Найдено, что температура на входе 50  2oС достаточна. Скорость впуска (напыления) регулируют, чтобы обеспечить равномерное покрытие и удовлетворительную его сушку. Найдено, что увеличение веса на 8 2oС достаточна. Скорость впуска (напыления) регулируют, чтобы обеспечить равномерное покрытие и удовлетворительную его сушку. Найдено, что увеличение веса на 8 0,5% за счет пленочного покрытия является достаточным. После нанесения покрытия таблетки сушат около 10 минут при температуре на входе примерно 50oС.
Было найдено, что полученный таким образом ddI-продукт с энтеросолюбильным покрытием обеспечивает отличную защиту от желудочной кислоты (при рН 3), но прекрасное выделение ddI при рН>5. 0,5% за счет пленочного покрытия является достаточным. После нанесения покрытия таблетки сушат около 10 минут при температуре на входе примерно 50oС.
Было найдено, что полученный таким образом ddI-продукт с энтеросолюбильным покрытием обеспечивает отличную защиту от желудочной кислоты (при рН 3), но прекрасное выделение ddI при рН>5.
Формула изобретения
 L-30-D55).
13. Фармацевтическая композиция по п. 11, отличающаяся тем, что указанное энтеросолюбильное покрытие дополнительно содержит пластификатор.
14. Фармацевтическая композиция по п. 13, отличающаяся тем, что указанный пластификатор представляет собой триэтилцитрат, триацетин, трибутилсебацинат или полиэтиленгликоль.
15. Фармацевтическая композиция по п. 13, отличающаяся тем, что указанный пластификатор представляет собой диэтилфталат.
16. Фармацевтическая композиция по п. 6, отличающаяся тем, что ядро дополнительно содержит связующее.
17. Фармацевтическая композиция по п. 16, отличающаяся тем, что связующее выбирают из группы, состоящей из натрий карбоксиметилцеллюлозы, гидроксипропилметилцеллюлозы, поливинилпирролидона, альгината калия или альгината натрия.
18. Фармацевтическая композиция по п. 16, отличающаяся тем, что связующее представляет собой микрокристаллическую целлюлозу.
19. Фармацевтическая композиция по п. 16, отличающаяся тем, что ядро дополнительно содержит смазку.
20. Фармацевтическая композиция по п. 19, отличающаяся тем, что указанная смазка представляет собой стеарат магния.
21. Фармацевтическая композиция по п. 16, отличающаяся тем, что ядро дополнительно содержит вещество, способствующее измельчению.
22. Фармацевтическая композиция по п. 21, отличающаяся тем, что указанное вещество, способствующее измельчению, представляет собой Na щелочной крахмал, натрий-кроскармеллозу, кукурузный крахмал или сшитый поливинилпирролидон.
23. Фармацевтическая композиция по п. 21, отличающаяся тем, что указанное вещество, способствующее измельчению, представляет собой Na-щелочной крахмал.
24. Фармацевтическая композиция по п. 6, имеющая следующий состав, %: L-30-D55).
13. Фармацевтическая композиция по п. 11, отличающаяся тем, что указанное энтеросолюбильное покрытие дополнительно содержит пластификатор.
14. Фармацевтическая композиция по п. 13, отличающаяся тем, что указанный пластификатор представляет собой триэтилцитрат, триацетин, трибутилсебацинат или полиэтиленгликоль.
15. Фармацевтическая композиция по п. 13, отличающаяся тем, что указанный пластификатор представляет собой диэтилфталат.
16. Фармацевтическая композиция по п. 6, отличающаяся тем, что ядро дополнительно содержит связующее.
17. Фармацевтическая композиция по п. 16, отличающаяся тем, что связующее выбирают из группы, состоящей из натрий карбоксиметилцеллюлозы, гидроксипропилметилцеллюлозы, поливинилпирролидона, альгината калия или альгината натрия.
18. Фармацевтическая композиция по п. 16, отличающаяся тем, что связующее представляет собой микрокристаллическую целлюлозу.
19. Фармацевтическая композиция по п. 16, отличающаяся тем, что ядро дополнительно содержит смазку.
20. Фармацевтическая композиция по п. 19, отличающаяся тем, что указанная смазка представляет собой стеарат магния.
21. Фармацевтическая композиция по п. 16, отличающаяся тем, что ядро дополнительно содержит вещество, способствующее измельчению.
22. Фармацевтическая композиция по п. 21, отличающаяся тем, что указанное вещество, способствующее измельчению, представляет собой Na щелочной крахмал, натрий-кроскармеллозу, кукурузный крахмал или сшитый поливинилпирролидон.
23. Фармацевтическая композиция по п. 21, отличающаяся тем, что указанное вещество, способствующее измельчению, представляет собой Na-щелочной крахмал.
24. Фармацевтическая композиция по п. 6, имеющая следующий состав, %:Ядро Лекарственное вещество (диданозин) – 15-97,5 Микрокристаллическая целлюлоза – 0-40 Na-щелочной крахмал – 0-6 Стеарат магния – 0-3 Покрытие Eudragit L-30-D55 – 2-30 Диэтилфталат – 0,5-6,0 25. Фармацевтическая композиция по п. 6, отличающаяся тем, что таблетка содержит 2′, 3′-дидеоксиинозин в количестве, при приеме которого дважды в день достигается суточная доза. 26. Фармацевтическая композиция по п. 6, отличающаяся тем, что таблетка содержит 2′, 3′-дидеоксиинозин в количестве, соответствующем суточной дозе, и принимается один раз в день. 27. Способ получения фармацевтической композиции с энтеросолюбильным покрытием, содержащий стадии (а) смешивания неустойчивого в кислоте лекарственного средства, такого как 2′, 3′-дидеоксиинозин, правастатин, эритромицин, дигоксин, панкреатин, 2’3′-дидеоксиаденозин или 2′, 3′-дидеоксицитозин и необязательных компонентов, за исключением подщелачивающих агентов, с получением смеси, пригодной для таблетирования, (б) таблетирования указанной смеси с получением ядра в виде таблетки, (в) смешивания энтеросолюбильного покрывающего полимера с подщелачивающим агентом, повышающим рН материала энтеросолюбильного покрытия для сведения к минимуму несовместимости энтеросолюбильного покрытия и неустойчивого в кислоте ядра, и (г) нанесения указанного материала энтеросолюбильного покрытия на ядро таблетки. 28. Способ по п. 27, отличающийся тем, что указанная смесь содержит неустойчивое в кислоте лекарственное вещество, связующее и смазку. 29. Способ по п. 27, отличающийся тем, что указанное неустойчивое в кислоте лекарственное вещество представляет собой 2′, 3′-дидеоксиинозин. 30. Способ по п. 27, отличающийся тем, что указанное неустойчивое в кислоте лекарственное вещество представляет собой правастатин, эритромицин, дигоксин, панкреатин, 2′, 3′-дидеоксиаденозин или 2′, 3′-дидеоксицитозин. 31. Способ по п. 29, дополнительно включающий стадию скрининга ядер таблеток с удержанием ядер, для дальнейшего покрытия, имеющих размер приблизительно от # 10 до # 20 меш. 32. Способ по п. 29, отличающийся тем, что указанные таблетки имеют твердость 3-6 SCU. 33. Способ по п. 29, отличающийся тем, что получение указанного покрытия дополнительно включает стадии (а) смешивания энтеросолюбильного покрывающего полимера с водой с получением смеси полимер/вода, (б) смешивания пластификатора со смесью, полученной на стадии (а), и (в) смешивания подщелачивающего агента со смесью, полученной на стадии (б), для повышения рН смеси от 4,9 до 5,4. 34. Способ по п. 29, отличающийся тем, что указанная стадия нанесения покрытия дополнительно включает стадии (а) предварительного нагревания указанных таблеток в аппарате для напыления в псевдоожиженном слое примерно до 45-50oС, (б) напыления на указанные таблетки указанного покрытия, и (в) сушки указанных таблеток. 35. Способ по п. 29, отличающийся тем, что связующее представляет собой микрокристаллическую целлюлозу. 36. Способ по п. 29, отличающийся тем, что указанная смазка представляет собой стеарат магния. 37. Способ по п. 29, отличающийся тем, что указанное вещество, способствующее измельчению, представляет собой щелочной крахмал. 38. Способ по п. 29, отличающийся тем, что указанное энтеросолюбильное покрытие содержит сополимер метакриловой кислоты и пластификатор. 39. Способ по п. 38, отличающийся тем, что указанный пластификатор представляет собой диэтилфталат. 40. Способ по п. 38, отличающийся тем, что указанный сополимер метакриловой кислоты представляет собой Eudragit L-30-D55. РИСУНКИ
|
||||||||||||||||||||||||||
