Патент на изобретение №2200163
|
||||||||||||||||||||||||||
(54) КАРБОЦИКЛИЧЕСКИЕ АНАЛОГИ 20(S)-КАМПТОТЕЦИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ
(57) Реферат: Изобретение относится к новым водорастворимым С-циклическим аналогам 20(S)-камптотецина общей формулы 1 или их фармацевтически приемлемым солям, где R1, R2, R3 и R4 независимо Н, ОН, С1-С8 алкокси, NO2, замещенный NH2, имеющий один или два заместителя, выбранного из С1-С6 алкила, галоген (С1-С6)алкила, С1-С6 алкила, замещенного С1-С6 алкила, R5 – Н, С1-С6 алкил, R6 – Н, С1-С6 алкил, бензил, возможно замещенный, замещенный бензоил, замещенный С1-С6 алкил, и в случае, когда NH2 группа является дизамещенной, заместители могут быть объединены с образованием гетероциклического кольца, содержащего 5-7 атомов углерода и 1 или 2 атомов азота и необязательно кислорода. Соединения обладают сильными противораковыми и противовирусными свойствами. Все соединения 1 получают из соединений общей формулы 2, содержащих хиральный атом углерода 20(S), где заместители R1-R5 имеют указанные значения. 5 с. и 9 з.п. ф-лы, 5 табл. 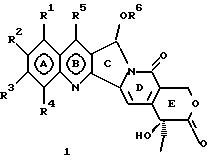 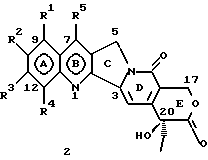
Изобретение относится к новым водорастворимым карбоциклическим (С-циклическим) аналогам 20(S)-камптотецина, имеющим общую формулу 1: 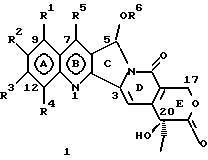 В приведенной выше формуле 1 R1, R2, R3 и R4 являются, независимо, одинаковыми или различными и представляют водород, гидрокси, арилокси, низший алкокси, низший алканоил, нитро, циано, галоген, карбокси, карбонилокси, амино, замещенный амино, низший алкил, замещенный низший алкил, или R2 и R3 вместе представляют -О-(CH2)n-О-, где n=1 или 2; R5 представляет водород, низший алкил, замещенный низший алкил, низший аралкил, гидроксиметил, карбоксиметил, аминометил, замещенный аминометил, где аминогруппа может быть моно- или дизамещенной и в которой оба заместителя являются независимыми или объединены с образованием циклической ядерной системы в целом из 5-6 атомов, содержащей атомы углерода и, необязательно, один или два гетероатома, выбранных из кислорода, азота или серы; и R6 представляет водород, фенил или бензил, где фенильная группа может быть незамещенной или с моно-, ди- или три-заместителями, которые могут быть выбраны из галогена, гидрокси, низшего алкокси, циано, карбоксила, нитро, амино или замещенного амино, низшего алкила, замещенного низшего алкила; циклоалкил или циклоалкил низшего алкила, где циклическое кольцо представляет 3-7-членную кольцевую систему, содержащую только атомы углерода; низшие алкильные группы, замещенные гетероциклическими ядрами, где гетероциклическая ядерная система содержит, в целом, 3-7 атомов, причем гетероциклические ядра содержат атомы углерода и, по меньшей мере, один гетероатом, такой как атом кислорода, азота или серы; низший алканоил; бензоил, где фенильная группа может быть незамещенной или замещенной; низший алкенил; низший алкил; замещенный низший алкил, замещенный низший алкенил или замещенный низший алканоил, где заместители могут представлять собой галоген, гидрокси, низший алкокси, арилокси, тио, тиоалкил, тиоарил, арил, гетероарил, карбокси, циано, нитро, амидо или амино, при этом аминогруппа может быть незамещенной или моно- или дизамещенной, где оба заместителя являются независимыми или объединены с образованием 5- или 6-членной циклической кольцевой системы, содержащей атомы углерода, и, необязательно, один или два гетероатома, выбранных из кислорода, азота или серы, а общее число атомов в циклической ядерной системе равно 5 или 6; при условии, что (I) когда R1 представляет метоксигруппу, R6 не является водородом или низшей алкильной группой; (II) когда R2 представляет собой гидрокси, низший алкокси, тиоалкил, нитро, амино, алкиламино, ациламино или галоген, R6 не является водородом или низшей алкильной группой; (III) когда R5 представляет низший алкил, низший аралкил, CH2OH, СООН, СООМе или CH2OR”, где R” представляет низшую алкильную или ацильную группу, R6 не является водородом или низшей алкильной группой; (IV) когда R1 представляет собой метоксигруппу, R2 представляет гидрокси, низший алкокси, тиоалкил, нитро, амино, алкиламино, ациламино или галоген, R5 представляет низший алкил, низший аралкил, CH2OH, COOH, СООМе или CH2OR”, где R” представляет низшую алкильную или ацильную группу, R6 не является водородом или низшей алкильной группой; (V) когда R1-R5 представляют собой атомы водорода, R6 не является водородом или низшей алкильной группой. Все указанные соединения формулы 1 получают из соединений общей формулы 2 с хиральным центром 20(S): 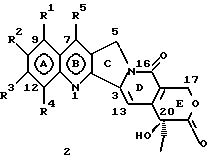 где заместители R1-R5 имеют значения, указанные выше. Камптотецин, имеющий формулу 3: 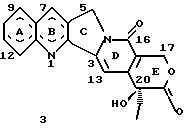 представляет собой алкалоид с сильной противоопухолевой активностью, который выделен из Camptotheca acuminata Wall с сотр. в 1966 г. Однако работать с ним, как с потенциальным лекарственным средством для лечения рака, отказались из-за неприемлемого побочного действия на людей и из-за его низкой растворимости в воде, а также из-за проблем, связанных с высокой токсичностью. После раскрытия механизма его действия как ингибитора топоизомеразы [Liu с сотр. в 1985 (L.F. Liu, et al., J. Biol. Chem., 260, 14873 (1985)] интерес исследователей к камптотецину тотчас же снова набрал силу. Чтобы преодолеть указанную проблему низкой водорастворимости и высокой токсичности камптотецина, в последние 30 лет несколько групп исследователей по всему миру получили и исследовали ряд аналогов камптотецина, включающих модификацию колец А-Е или введение различных заместителей во все пять колец камптотецина формулы 3 [М.Е. Wall et al., J. Med. Chem., 36, 2689 (1993); R. P. Hertzberg et al., J. Med. Chem., 715, (1989); S.W.Sawada et al., Chem. Pharm. Bull., 41(2), 310 (1993)]. Среди различных аналогов камптотецина, полученных на сегодня, только два из них, а именно, СРТ-11, имеющий формулу 4 [Chem. Pharm. Bull., 39, 1446 (1991)]: 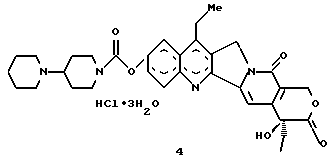 и топотекан формулы 5 [J. Med. Chem., 34, 98 (1991)]: 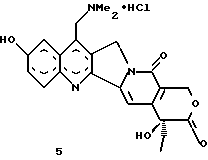 представлены в последнее время на рынке в качестве противораковых лекарственных средств. Еще одно соединение, а именно, 9-аминокамптотецин формулы 6 [J. Med. Chem., 29, 2358 (1986)]: 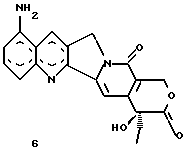 проходит в настоящее время широкие клинические испытания. Разносторонние исследования соотношения структуры и активности (SAR) камптотецина формулы 3 [М. Е. Wall et al. , J. Med. Chem., 36, 2689 (1993)] показали, что группа 20(S)-  -гидрокси- -гидрокси- -лактона (Е-кольцо) в камптотецине существенно важная для его активности. Однако согласно последним сообщениям Ejima и др., замещение гидроксильной группы аминогруппой в положении С-20 ведет к такому соединению, как производное 7-этил-10-метоксикамптотецин формулы 7 [A. Ejima et al. , Chem. Pharm. Bull., 40(3), 683 (1992)]: -лактона (Е-кольцо) в камптотецине существенно важная для его активности. Однако согласно последним сообщениям Ejima и др., замещение гидроксильной группы аминогруппой в положении С-20 ведет к такому соединению, как производное 7-этил-10-метоксикамптотецин формулы 7 [A. Ejima et al. , Chem. Pharm. Bull., 40(3), 683 (1992)]: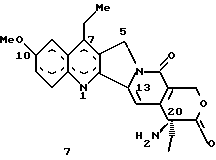 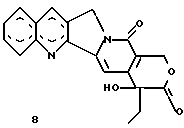 которое обнаруживает повышенную, по сравнению с 20(RS)-камптотецином формулы 8, противоопухолевую активность in vivo. Также еще сообщается (Lawrence Snyder et al., J.Org.Chem., 59, 7033 (1994)], что аналог 18-норангидрокамптотецина формулы 9: 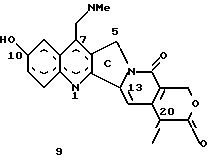 обнаруживает сильное, подобное камптотецину, ингибирование активности топоизомеразы I. Оба эти сообщения противоречат предположению, что функциональная 20(S)-  -гидроксильная группа в камптотецине является важным признаком его биологической активности.
На основании приведенных в литературе результатов исследований строения и активности, полученных для аналогов камптотецина, признается, что модификация заместителей в положении С-9 и С-7 камптотецина формулы 3 играет важную роль в усилении противораковой активности, придавая устойчивость лактону Е-цикла [T. G. Burke et al., J. Med. Chem., 37, 40 (1994)]. Также выяснилось, что раскрытая форма группы лактона, а именно, “карбоксилатная форма”, является терапевтически менее эффективной, чем замкнутая “лактоновая форма” [Hertzberg et al., J. Mod. Chem., 32, 715 (1989); J.M. Covey, C. Jaxel et al., Cancer Research., 49, 5016 (1989); Giovanella et al., Cancer Research. , 51, 3052 (1991)]. Последние исследования T.G. Burke и др. по устойчивости “замкнутой лактоновой формы” различных аналогов камптотецина в присутствии белка, называемого “человеческий сывороточный альбумин” (HSA), показали, что такие соединения, как СРТ-11 формулы 4 и 7-этил-10-гидроксикамптотецин (SN-38) формулы 7а: -гидроксильная группа в камптотецине является важным признаком его биологической активности.
На основании приведенных в литературе результатов исследований строения и активности, полученных для аналогов камптотецина, признается, что модификация заместителей в положении С-9 и С-7 камптотецина формулы 3 играет важную роль в усилении противораковой активности, придавая устойчивость лактону Е-цикла [T. G. Burke et al., J. Med. Chem., 37, 40 (1994)]. Также выяснилось, что раскрытая форма группы лактона, а именно, “карбоксилатная форма”, является терапевтически менее эффективной, чем замкнутая “лактоновая форма” [Hertzberg et al., J. Mod. Chem., 32, 715 (1989); J.M. Covey, C. Jaxel et al., Cancer Research., 49, 5016 (1989); Giovanella et al., Cancer Research. , 51, 3052 (1991)]. Последние исследования T.G. Burke и др. по устойчивости “замкнутой лактоновой формы” различных аналогов камптотецина в присутствии белка, называемого “человеческий сывороточный альбумин” (HSA), показали, что такие соединения, как СРТ-11 формулы 4 и 7-этил-10-гидроксикамптотецин (SN-38) формулы 7а: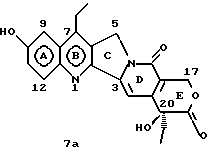 и топотекан формулы 5, в присутствии HSA при 37oС обнаруживают в равновесном состоянии более высокое процентное содержание (%) лактоновой формы, чем 20(S)-камптотецин формулы 3 и 9-аминокамптотецин формулы 6 [T.G. Burke and Zihou Mi., J. Med. Chem., 33, 40 (1994); те же, Biоchemistry, 3J3, 12540 (1994)]. На основании этих исследований выяснилось, что представление о факторах, влияющих на равновесие лактон-карбоксилат, становится важным решающим моментом при создании новых и терапевтически эффективных предполагаемых лекарственных средств группы камптотецина. Хотя для быстроты получения новых аналогов СРТ предпринималась модификация колец А и В камптотецина, получение аналогов камптотецина с модификацией кольца “С” ограничивалось, вероятно, из-за исследований, выполненных Sawada и др., которые заявили, что введение заместителей в положение С-5 камптотецина приводит, в результате, к снижению противоопухолевой активности камптотецинов и к образованию неактивных аналогов [Sawada S. et al., Chem. Pharm. Bull. , 39(10), 2574 (1991)]. Заявленные Sawada и др. С-5-замещенные камптотецины (патент Японии 58154584; патенты США 4513138; 4473692; 4545880; 4339282) имеют структурную формулу 10: 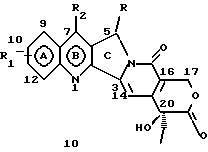 где R представляет гидроксильную, низшую алкильную, низшую алкоксильную, ацилоксильную группы, R1 представляет водород, метокси в положении 9; водород, гидрокси, низший алкокси, ацилокси, SH, тиоалкил, тиоацил, нитрогруппу, аминогруппу, алкиламиногруппу, ациламиногруппу и галоген в положении 10, и R2 представляет водород, низший алкил, низший аралкил, СН2ОН, СООН, СООМе, CH2OR’, где R’ представляет низшую алкильную или ацильную группу. Недавние исследования К.Н. Lee и др. [Bio. Org. Med. Chem. Lett., 5(1), 77 (1995)] , включающие получение 5-гидроксиметил-камптотецина посредством взаимодействия формальдегида в N,N-диметилформамиде и 4-пиперидинопиперидине с 20(S)-камптотецином, показали пониженную противоопухолевую активность этих соединений. Также, Danishefsky и др. получили некоторые С-5-замещенные производные 20(RS)-камптотецина при полностью синтетическом подходе [патенты США 5391745 и 5446047]. Однако заявлено [Terasawa et al., Heterocycles, 28, 81 (1994)], что полученное синтетическим путем 5-замещенное производное камптотецина формулы 11 обладает противоопухолевой активностью, сравнимой с активностью 20(S)-камптотецина. 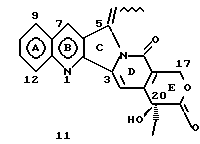 Имея в виду все эти факторы, авторы сосредоточили свои исследования на 20(S)-камптотецине с целью создания новых аналогов камптотецина, которые могут обнаруживать повышенную растворимость в воде и повышенную устойчивость лактоновой формы в растворе. Авторы идентифицировали реакцию окисления в спиртовых растворителях для этой цели. Полученные в результате данные завершились открытием нового синтетического изменения, которое можно осуществить в различных алкоксильных группах в С-5-положении 20(S)-камптотецинов. Изменение функциональной группы таких 5-алкоксикамптотецинов дает широкий ряд новых аналогов С-5-замещенных 20(S)-камптотецинов формулы 14: 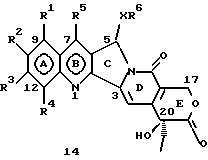 в которой Х представляет NH или NR и СН2 или CHR, a R6 имеет значения, указанные выше, что является предметом одновременно рассматриваемой заявки авторов на патенты США под регистрационными номерами заявок на патенты США по реестрам поверенного U 011025-3 и U 011026-1. Итак, указанное открытие привело к легкой и универсальной полусинтетической методологии, с помощью которой фактически каждое производное камптотецина, известное из литературы, можно превратить в различные 5-замещенные аналоги камптотецина. Следовательно, настоящее изобретение относится к новому способу получения различных С-5-замещенных производных 20(S)-камптотецина, в формуле которых R6 имеет указанные выше значения. Кроме того, по настоящему изобретению, в камптотецины общей формулы 2 вводится второй хиральный центр в положении С-5, без нарушения существующей 20-гидроксильной группы – хирального центра C-20(S). Кроме того, широкое разнообразие заместителей OR6 при С-5-углероде 20(S)-камптотецинов формулы 1 приводит к соединениям с улучшенной растворимостью в воде в интервале от 1 до 10 мг/мл. Все соединения, полученные по настоящему изобретению, проявляют существенную противоопухолевую активность in vitro против широкого ряда клеточных линий опухолей человека. Подробное описание изобретения Настоящее изобретение относится, в особенности, к водорастворимым С-5-О-замещенным аналогам 20(S)-камптотецина, имеющим формулу 1: 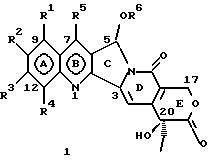 где R1, R2, R3, R4, R5 и R6 имеют указанные ранее значения. В настоящем изобретении термины, представляющие заместители R1-R6, имеют следующие определения. Термин “низший алкил” обозначает одновалентную, разветвленную или линейную, углеводородную цепь, содержащую 1-8 атомов углерода. Представителями таких алкильных групп являются метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, пентил, изопентил, трет-пентил, гексил, изогексил и октил. Термин “низший алкенил” обозначает разветвленную или линейную углеводородную цепь с sр или sp2 углеродными центрами, содержащую 1-8 атомов углерода. Представителями таких алкенильных групп являются винил, пропенил, бутенил, пентенил, изопропенил, изобутенил, пропаргинил, гексенил и октенил. Термин “галоген” или “гало” представляет хлор, бром или фтор. Термин “галогеналкил” обозначает алкильные группы, замещенные гелогенами, предпочтительно, фтором, бромом или хлором. Представителями галогеналкильных групп являются хлорэтил, бромпропил, фторэтил, трифторэтил, трихлорэтил и трифторбутил. Термин “низший алкокси” обозначает низшие алкильные группы, определение которых дается выше, присоединенные к остальной части молекулы через кислородную связь. Представителями таких групп являются метокси, этокси, изопропокси, трет-бутокси, гексокси, гептокси и октокси. Термин “низший алканоил” обозначает низшие алкильные или алкенильные группы, определение которых дается выше, присоединенные к остальной части молекулы через карбонильную группу. Представителями этих групп являются ацетил, пропионил, пропеноил, кротаноил, бутаноил, пентаноил и изопентаноил. Термин “аминоалкил” представляет низшие алкильные группы, определение которых дается выше, замещенные аминогруппами. Представителями таких аминоалкильных групп являются 2-аминопропил, 4-аминобутил, 5-аминопентил. Аминогруппы также могут быть моно- или дизамещенными, и представителями таких замещенных аминогрупп являются диметиламино, диэтиламино, дибензиламино, этилизопропиламино, пирролидино, пиперидино, морфолино или пиперазино. Термин “гетероатом” относится к атому кислорода, азота или серы. Термин “арил или гетероарил” представляет группы ароматического характера с 5- или 6-членными кольцами, которые можно выбирать среди фенила, бифенила, нафтила, пиридила, хинолина, изохинолина, индола, пиролла, фурана, бензофурана, тиофена, пиримидина, пиперазина, тиазолидина или имидазола. Термин “замещенная фенильная” группа, используемый в настоящем изобретении, относится к группе с заместителями, которые могут быть выбраны из таких заместителей, как гидроксил, низший алкил, галогеналкил, фенил, бензил, галоген, низший алкокси, тиоалкокси, бензилокси, карбоксил, циано, нитро, амидо, амино и алкиламино. Примерами таких групп являются 4-гидроксифенил, 3-метоксифенил, 4-фторфенил, 4-трифторметилфенил, N,N-диметиламинофенил и 4-карбометоксифенил. Термин “замещенная алкильная” группа, используемый в настоящем изобретении, относится к группе с заместителями, которые могут быть выбраны из таких заместителей, как гидроксил, алкил, галогеналкил, фенил, бензил, галоген, алкокси, тиоалкокси, бензилокси, карбоксил, карбонилокси, циано, нитро, амидо, амино и алкиламино. Примерами таких групп являются фторэтил, хлорпропил, гидроксиэтил, метоксипропил, N,N-диэтиламиноэтил, N-бензоиламинопропил, трифторэтоксиэтил, феноксиэтил, карбометоксиэтил, (п-фторбензоилокси)этил, аминопропил и 2-тиоэтил. Термин “замещенная аминогруппа”, используемый в настоящем изобретении, относится к группам с заместителями, которые могут быть выбраны из таких заместителей, как гидроксил, алкил, галогеналкил, бензил, бензоил, алкокси, карбоксил, амидо, амино и алкиламино. Примерами таких групп являются N,N-диэтиламино-, N-бензоиламино-, N-метоксиамино-, N-карбоэтоксиамино- и N-хлорэтиламиногруппы. Кроме того, оба заместителя в аминогруппе могут объединяться с образованием 5- или 6-членной циклической системы, которую представляют пирролидино, пиперидино, пиперазино, морфолино, имидазолино или тиазолидино. В соответствии с настоящим изобретением, предлагается способ получения соединений общей формулы 1: 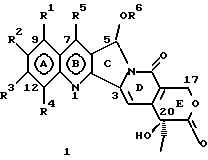 где R1, R2, R3, R4, независимо, являются одинаковыми или различными и представляют водород, гидрокси, арилокси, низший алкокси, низший алканоил, нитро, циано, галоген, карбокси, карбонилокси, амино, замещенный амино, низший алкил, замещенный низший алкил, или R2 и R3 вместе представляют -О-(СН2)n-O-, где n=1 или 2; R5 представляет водород, низший алкил, замещенный низший алкил, низший аралкил, гидроксиметил, карбоксиметил, аминометил, замещенный аминометил, где аминогруппа может быть моно- или дизамещенной, при этом оба заместителя являются независимыми или объединены с образованием циклической системы в целом из 5-6 атомов, содержащей атомы углерода и, необязательно, один или два гетероатома, выбранных из кислорода, азота или серы; и R6 представляет водород; фенил или бензил, где фенильная группа может быть незамещенной или замещенной моно-, ди- или три-заместителями, которые могут быть выбраны из галогена, гидрокси, низшего алкокси, циано, карбоксила, нитро, амино или замещенного амино, низшего алкила, замещенного низшего алкила; циклоалкил или циклоалкил низшего алкила, где циклическое кольцо является 3-7-членной кольцевой системой, содержащей только атомы углерода; низшие алкильные группы, замещенные гетероциклическими ядрами, в которых гетероциклическая система имеет, в целом, 3-7 атомов, циклическая система содержит атомы углерода и, по меньшей мере, один гетроатом, такой как атом кислорода, азота или серы; низший алканоил; бензоил, в котором фенильная группа может быть незамещенной или замещенной; низший алкенил; низший алкил; замещенный низший алкил, замещенный низший алкенил или замещенный низший алканоил, где заместителями могут быть галоген, гидрокси, низший алкокси, арилокси, тио, тиоалкил, тиоарил, арил или гетероарил, карбокси, циано, нитро, амидо или амино, при этом аминогруппа может быть незамещенной или моно- или дизамещенной, и оба заместителя являются независимыми или объединены с образованием 5- или 6-членной циклической кольцевой системы, содержащей атомы углерода, и содержит, необязательно, один или два гетероатома, выбранных из кислорода, азота или серы, причем общее число атомов в циклической системе составляет 5 или 6; при условии, что (I) когда R1 представляет метоксигруппу, R6 не является водородом или низшей алкильной группой; (II) когда R2 представляет собой гидрокси, низший алкокси, тиоалкил, нитро, амино, алкиламино, ациламино и галоген, R6 не является водородом или низшей алкильной группой; (III) когда R5 представляет низший алкил, низший аралкил, CH2OH, COOH, СООМе или CH2OR”, где R” представляет низшую алкильную или ацильную группу, R6 не является водородом или низшей алкильной группой; (IV) когда R1 представляет собой метоксигруппу, R2 представляет гидрокси, низший алкокси, тиоалкил, нитро, амино, алкиламино, ациламино или галоген, R5 представляет низший алкил, низший аралкил, СН2OН, СООН, СООМе или CH2OR”, где R” представляет низшую алкильную или ацильную группу, R6 не является водородом или низшей алкильной группой; (V) когда R1-R5 представляют атом водород, R6 не является водородом или низшей алкильной группой, который включает (I) взаимодействие соединений формулы 2: 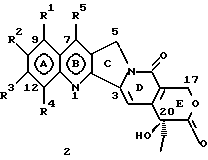 где заместители R1-R5 имеют указанные выше значения, в присутствии кислоты и окислителя, который представляет собой соль железа (3), с соединением, имеющим формулу: R6-OH, где R6 представляет низший алкил, низший алкенил, (С3-С7)-циклоалкил, галогеналкил или гидроксиалкил, с получением соединений формулы 12 и соединений формулы 13: 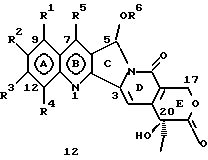 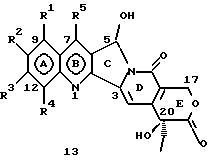 где R1, R2, R3, R4, R5 имеют указанные выше значения, (II) разделение соединений формул 12 и 13, полученных на стадии (I), обычными способами, (III) гидролиз соединений формулы 12 обычными способами с получением дополнительного количества соединений формулы 13, (IV) взаимодействие соединения формулы 13 в присутствии кислоты с соединением, имеющим формулу: R6-ОН, с получением соединений формулы 1: 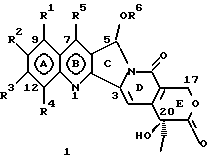 где R1, R2, R3, R4 и R5 имеют указанные выше значения, и R6 имеет указанные выше значения. В соответствии с другой своей особенностью, настоящее изобретение относится к альтернативному способу получения известных С-5-замещенных соединений формулы 1: 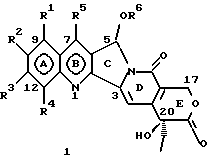 где R6 представляет водород или низший алкил, R1 представляет водород или метокси; R2 представляет водород, гидрокси, низший алкокси, ацилокси, тиоалкил, SH, тиоацил, нитро, амино, алкиламино, ациламино и галоген; R3 и R4 представляют водород, и R5 представляет водород, низший алкил, низший аралкил, CH2OH, СООН, СООМе или CH2OR’, где R’ представляет низшую алкильную или ацильную группу, который включает (I) взаимодействие соединений формулы 2: 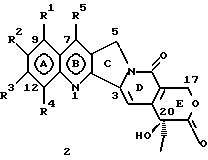 где заместители R1-R5 имеют указанные выше значения, в присутствии кислоты и окислителя, такого как соль железа (3), с соединением, имеющим формулу: R6-OH, где R6 представляет низшие алкильные группы, с получением соединений формулы 12 и соединений формулы 13: 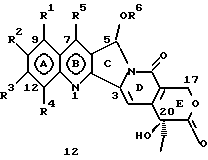 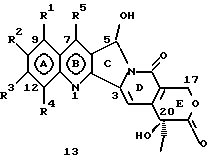 где R1, R2, R3, R4 и R5 имеют указанные выше значения, (II) разделение соединений формул 12 и 13, полученных на стадии (I), обычными способами, (III) гидролиз соединений формулы 12 обычными способами с получением дополнительного количества соединений формулы 13, (IV) взаимодействие соединения формулы 13 в присутствии кислоты с соединением, имеющим формулу: R6-OH, с получением соединений формулы 1, где R6 представляет низшие алкильные группы, R1 представляет водород или метокси, R2 представляет водород или гидрокси, низший алкокси, ацилокси, SH, тиоалкил, тиоацил, нитро, амино, алкиламино, ациламино и галоген; R3 и R4 представляют водород, и R5 представляет водород, низший алкил, низший аралкил, CH2OH, COOH, СООМе или CH2OR’, где R’ представляет низшую алкильную или ацильную группу. Методология, разработанная и описанная в настоящем изобретении, создает новый хиральный центр при позиции С-5 в соединениях формулы 2 без нарушения целостности лактоновой группы 20(S)-  -гидрокси Е-кольца. Разработанный способ составляет легкий и универсальный полусинтетический метод получения С-5-звмещенных, известных и новых, производных камптотецина формулы 1, исходя из соединений формулы 2. Соединения формулы 1, полученные по способу настоящего изобретения, представляют, таким образом, диастереомеры, содержащие вновь образованный хиральный центр С-5. В самом деле, соединения общей формулы 1 выделяются в виде смеси 20(S),5(R) и 20(S),5(S)-диастереомеров. Однако посредством применения обычных аналитических методов, два указанных диастереомера разделяют на их отдельные оптически чистые данности.
Вообще, все соединения формулы 1, где R1, R2, R3, R4, R5 и R6 имеют указанные выше значения, можно синтезировать, исходя из соединений формулы 2, по описанному выше способу, и можно проиллюстрировать примерами, описанными в разделе “Примеры”. Получение соединений формулы 12, где R1, R2, R3, R4, R5 и R6 имеют указанные выше значения, из соединений формулы 2, как упоминается на стадии (I), является новым превращением, при котором достигается непосредственное введение различных алкоксизаместителей в положение С-5.
Замещенные в кольце А или кольце А/В производные 20(S)-камптотецина общей формулы 2, где R1, R2, R3, R4 и R5 имеют указанные выше значения, используемые в качестве исходных веществ в настоящем изобретении, являются широко известными, и их получают в соответствии с известным уровнем техники, отраженным в литературе. Например, 7-этилкамптотецин, 10-гидроксикамптотецин, 9-нитрокамптотецин, 12-нитрокамптотецин, 10-гидрокси-7-этилкамптотецин (SN-38), 9-аминокамптотецин, 9-метоксикамптотецин, 9-гидроксикамптотецин, 9-метокси-7-этилкамптотецин, 9-гидрокси-7-этилкамптотецин, 10,11-метилендиоксикамптотецин, 10,11-этилендиоксикамптотецин, 10-гидрокси-9-(N,N-диметиламинометил)камптотецин получают по способам, известным из литературы [T.R. Govindachari et al. , Ind. J. Chem., 10(B), 453 (1972); S. Sawada et al., Chem. Pharm. Bull., 39(10), 2574 (1991), там же, 39(12), 3183 (1991); патент США 4604463 и патент США 4545880; Jaffery L. Wood et al., J. Org. Chem., 60, 5739 (1995)] , и используют в качестве исходных веществ для получения новых С-циклических замещенных аналогов 20(S)-камптотецина общей формулы 1, описанных в настоящем изобретении.
Например, соединения формулы 12, где R1, R2, R3, R4, R5 и R6, независимо, являются одинаковыми или разными и имеют указанные выше значения, можно получить так, как описано на стадии (I), посредством взаимодействия соединений формулы 2 с соединениями, имеющими формулу: R6-OH, где R6 представляет водород, низший алкил, низший алкенил, галогеналкил, гидроксиалкил, (С3-С7)-циклоалкил, в присутствии сильной кислоты и соли железа (3). Кислоты, используемые при этом взаимодействии, могут быть выбраны из перхлорной кислоты, хлористоводородной кислоты, азотной кислоты, серной кислоты или кислот Льюиса, таких как трифторид бора, хлорид цинка, хлорид олова, тетрахлорид титана. Соль железа (3), используемая в указанной выше реакции, может быть выбрана из нитрата железа (3), двойной соли сульфата железа (3) и сульфата аммония, хлорида железа (3). Как правило, упомянутое выше взаимодействие осуществляют при температуре в интервале 40-150oС, предпочтительно – 60-120oС.
На стадии (II) способа настоящего изобретения для разделения смеси соединений формул 12 и 13, полученной на стадии (I), смесь подвергают, предпочтительно, либо кристаллизации, либо колоночной хроматографии с использованием силикагеля. Смеси растворителей, применяемые при вышеупомянутых методах, могут содержать сочетание органических растворителей, таких как хлороформ, этилацетат, метанол, этанол, диэтиловый эфир, ацетон и гексан.
Соединения формулы 13 также можно получить на стадии (III) способа настоящего изобретения посредством обработки соединений формулы 12 кислотами в сочетании с водой при температуре в интервале 40-120oС. Кислоты, применяемые для этой цели, могут быть выбраны из хлористоводородной кислоты, бромистоводородной кислоты, серной кислоты, п-толуолсульфоновой кислоты, уксусной кислоты и перхлорной кислоты. Растворителями, используемыми при этой реакции, могут быть метанол, этанол, бутанол, изопропанол или 1,4-диоксан.
На стадии (IV) способа настоящего изобретения соединения формулы 13 вводят во взаимодействие с соединениями формулы: 6-ОН, где R6 имеет указанные выше значения, при наличии кислой среды при температуре в интервале от 20 до 140oС, что дает соединения формулы 1. Кислоты, используемые при указанной реакции, могут быть выбраны из серной кислоты, хлористоводородной кислоты, уксусной кислоты, п-толуолсульфоновой кислоты, пиридиний-п-толуол-сульфоновой кислоты, камфорсульфоновой кислоты, метансульфоновой кислоты, перхлорной кислоты или кислот Льюиса, таких как тетрахлорид титана, эфират ВF3 и хлорид цинка. Растворители, используемые при указанной реакции, могут быть выбраны из гексана, бензола, толуола, ксилола, хлороформа, тетрахлорида углерода, дихлорэтана, дихлорметана и 1,4-диоксана.
Таким образом, настоящее изобретение имеет особое значение для разработки С-5-замещенных производных 20(S)-камптотецина как нового класса С-циклических модифицированных аналогов камптотецина, которые полезны в качестве противоопухолевых и/или противовирусных средств. Настоящее изобретение также имеет особое значение, так как разработанный и описанный здесь способ является универсальным и приемлемым для получения в крупном масштабе таких производных камптотецина общей формулы 1.
Методология, разработанная и описанная в настоящем изобретении, позволит подступиться к различным С-5-замещенным С-циклическим аналогам с различными заместителями на кольцах А и В 20(S)-камптотецтина. Отдельными предпочтительными соединениями являются соединения, в которых R1 представляет нитро, амино, аминоалкил, гидрокси, метокси; R2 представляет гидрокси, карбонилокси, галоген; R2 и R3, соединенные вместе, представляют метилендиокси или этилендиокси; R4 представляет водород или нитро; R5 представляет этил, аминометил или замещенный аминометил; R6 представляет 2′-гидроксиэтил, алкоксиэтил, хлорэтил, фторэтил, трифторэтил или аминоэтил или аминопропил, в которых аминогруппа может представлять собой диметиламино, диэтиламино, пирролидино, пиперидино, морфолино, пиперазино, имидазолино.
Характерными представителями соединений формулы 1 являются -гидрокси Е-кольца. Разработанный способ составляет легкий и универсальный полусинтетический метод получения С-5-звмещенных, известных и новых, производных камптотецина формулы 1, исходя из соединений формулы 2. Соединения формулы 1, полученные по способу настоящего изобретения, представляют, таким образом, диастереомеры, содержащие вновь образованный хиральный центр С-5. В самом деле, соединения общей формулы 1 выделяются в виде смеси 20(S),5(R) и 20(S),5(S)-диастереомеров. Однако посредством применения обычных аналитических методов, два указанных диастереомера разделяют на их отдельные оптически чистые данности.
Вообще, все соединения формулы 1, где R1, R2, R3, R4, R5 и R6 имеют указанные выше значения, можно синтезировать, исходя из соединений формулы 2, по описанному выше способу, и можно проиллюстрировать примерами, описанными в разделе “Примеры”. Получение соединений формулы 12, где R1, R2, R3, R4, R5 и R6 имеют указанные выше значения, из соединений формулы 2, как упоминается на стадии (I), является новым превращением, при котором достигается непосредственное введение различных алкоксизаместителей в положение С-5.
Замещенные в кольце А или кольце А/В производные 20(S)-камптотецина общей формулы 2, где R1, R2, R3, R4 и R5 имеют указанные выше значения, используемые в качестве исходных веществ в настоящем изобретении, являются широко известными, и их получают в соответствии с известным уровнем техники, отраженным в литературе. Например, 7-этилкамптотецин, 10-гидроксикамптотецин, 9-нитрокамптотецин, 12-нитрокамптотецин, 10-гидрокси-7-этилкамптотецин (SN-38), 9-аминокамптотецин, 9-метоксикамптотецин, 9-гидроксикамптотецин, 9-метокси-7-этилкамптотецин, 9-гидрокси-7-этилкамптотецин, 10,11-метилендиоксикамптотецин, 10,11-этилендиоксикамптотецин, 10-гидрокси-9-(N,N-диметиламинометил)камптотецин получают по способам, известным из литературы [T.R. Govindachari et al. , Ind. J. Chem., 10(B), 453 (1972); S. Sawada et al., Chem. Pharm. Bull., 39(10), 2574 (1991), там же, 39(12), 3183 (1991); патент США 4604463 и патент США 4545880; Jaffery L. Wood et al., J. Org. Chem., 60, 5739 (1995)] , и используют в качестве исходных веществ для получения новых С-циклических замещенных аналогов 20(S)-камптотецина общей формулы 1, описанных в настоящем изобретении.
Например, соединения формулы 12, где R1, R2, R3, R4, R5 и R6, независимо, являются одинаковыми или разными и имеют указанные выше значения, можно получить так, как описано на стадии (I), посредством взаимодействия соединений формулы 2 с соединениями, имеющими формулу: R6-OH, где R6 представляет водород, низший алкил, низший алкенил, галогеналкил, гидроксиалкил, (С3-С7)-циклоалкил, в присутствии сильной кислоты и соли железа (3). Кислоты, используемые при этом взаимодействии, могут быть выбраны из перхлорной кислоты, хлористоводородной кислоты, азотной кислоты, серной кислоты или кислот Льюиса, таких как трифторид бора, хлорид цинка, хлорид олова, тетрахлорид титана. Соль железа (3), используемая в указанной выше реакции, может быть выбрана из нитрата железа (3), двойной соли сульфата железа (3) и сульфата аммония, хлорида железа (3). Как правило, упомянутое выше взаимодействие осуществляют при температуре в интервале 40-150oС, предпочтительно – 60-120oС.
На стадии (II) способа настоящего изобретения для разделения смеси соединений формул 12 и 13, полученной на стадии (I), смесь подвергают, предпочтительно, либо кристаллизации, либо колоночной хроматографии с использованием силикагеля. Смеси растворителей, применяемые при вышеупомянутых методах, могут содержать сочетание органических растворителей, таких как хлороформ, этилацетат, метанол, этанол, диэтиловый эфир, ацетон и гексан.
Соединения формулы 13 также можно получить на стадии (III) способа настоящего изобретения посредством обработки соединений формулы 12 кислотами в сочетании с водой при температуре в интервале 40-120oС. Кислоты, применяемые для этой цели, могут быть выбраны из хлористоводородной кислоты, бромистоводородной кислоты, серной кислоты, п-толуолсульфоновой кислоты, уксусной кислоты и перхлорной кислоты. Растворителями, используемыми при этой реакции, могут быть метанол, этанол, бутанол, изопропанол или 1,4-диоксан.
На стадии (IV) способа настоящего изобретения соединения формулы 13 вводят во взаимодействие с соединениями формулы: 6-ОН, где R6 имеет указанные выше значения, при наличии кислой среды при температуре в интервале от 20 до 140oС, что дает соединения формулы 1. Кислоты, используемые при указанной реакции, могут быть выбраны из серной кислоты, хлористоводородной кислоты, уксусной кислоты, п-толуолсульфоновой кислоты, пиридиний-п-толуол-сульфоновой кислоты, камфорсульфоновой кислоты, метансульфоновой кислоты, перхлорной кислоты или кислот Льюиса, таких как тетрахлорид титана, эфират ВF3 и хлорид цинка. Растворители, используемые при указанной реакции, могут быть выбраны из гексана, бензола, толуола, ксилола, хлороформа, тетрахлорида углерода, дихлорэтана, дихлорметана и 1,4-диоксана.
Таким образом, настоящее изобретение имеет особое значение для разработки С-5-замещенных производных 20(S)-камптотецина как нового класса С-циклических модифицированных аналогов камптотецина, которые полезны в качестве противоопухолевых и/или противовирусных средств. Настоящее изобретение также имеет особое значение, так как разработанный и описанный здесь способ является универсальным и приемлемым для получения в крупном масштабе таких производных камптотецина общей формулы 1.
Методология, разработанная и описанная в настоящем изобретении, позволит подступиться к различным С-5-замещенным С-циклическим аналогам с различными заместителями на кольцах А и В 20(S)-камптотецтина. Отдельными предпочтительными соединениями являются соединения, в которых R1 представляет нитро, амино, аминоалкил, гидрокси, метокси; R2 представляет гидрокси, карбонилокси, галоген; R2 и R3, соединенные вместе, представляют метилендиокси или этилендиокси; R4 представляет водород или нитро; R5 представляет этил, аминометил или замещенный аминометил; R6 представляет 2′-гидроксиэтил, алкоксиэтил, хлорэтил, фторэтил, трифторэтил или аминоэтил или аминопропил, в которых аминогруппа может представлять собой диметиламино, диэтиламино, пирролидино, пиперидино, морфолино, пиперазино, имидазолино.
Характерными представителями соединений формулы 1 являются1) 5-метокси-СРТ*; 2) 5-этокси-СРТ*; 3) 5-бутокси-СРТ*; 4) 5-хлорэтокси-СРТ*; 5) 9-метокси-5-этокси-СРТ*; 6) 9-гидрокси-5-этокси-СРТ; 7) 10-гидрокси-5-этокси-СРТ*; 8) 7-этил-5-этокси-СРТ*; 9) 7-этил-5-гидрокси-СРТ*; 10) 9-нитро-5-этокси-СРТ; 11) 9-нитро-5-гидрокси-СРТ; 12) 7-этил-5-хлорэтокси-СРТ; 13) 10-гидрокси-7-этил-5-этокси-СРТ*; 14) 5-(2′-гидроксиэтокси)-СРТ; 15) 7-этил-9-гидрокси-5-этокси-СРТ; 16) 10-гидрокси-5-(2′-гидроксиэтокси)-СРТ; 17) 7-этил-10-гидрокси-5-(2′-гидроксиэтокси)-СРТ; 18) 9-нитро-5-фторэтокси-СРТ; 19) 9-нитро-5-трифторэтокси-СРТ; 20) 10-гидрокси-5-трифторэтокси-СРТ; 21) 7-этил-10-гидрокси-5-трифторэтокси-СРТ; 22) 7-этил-5-пирролидиноэтокси-СРТ; 23) 7-этил-5-диметиламинопропокси-СРТ; 24) 7-этил-10-гидрокси-5-фторэтокси-СРТ; 25) 5-(2′-гидроксиэтокси)-7-этил-СРТ; 26) 5-(2′-метоксиэтокси)-СРТ; где СРТ обозначает 20(S)-камптотецин, а * отмечает соединения, известные из литературы. Большинство соединений, полученных по настоящему изобретению, имеют растворимость в воде в интервале от 1 до 10 мг/мл при 37oС. В таблице 1А приводятся данные по максимально переносимой дозе (MTD), определенной на мышах Swiss Albino, устойчивости лактона в цельной крови (через 3 часа), растворимости, фармакокинетики MTD и активности in vitro после воздействия в течение 1 часа для соединений примеров 11, 26 и 27. Эксперименты проводят в соответствии с приведенными ниже протоколами. 1. Определение MTD на мышах Swiss Albino Каждой мыши Swiss Albino инъецируют однократную дозу испытываемого соединения в день, обозначаемый как день 1. Дозы, которые испытывают, составляют 400, 200, 100, 50, 25, 12,5, 8,3, 6,25 и 3,13 мг/кг массы тела. За животными наблюдают каждый день на предмет смертности и заболеваемости и регистрируют массу тела выживающих животных в 1, 5, 10 и 14 день. Максимальную переносимую дозу определяют как дозу, при которой испытываемое соединение не вызывает какой-либо болезненности и снижения массы тела более чем на 30% по сравнению с днем 1. (В соответствии с протоколом, которому следуют в Национальном институте рака США.) 2. Устойчивость лактона в цельной крови У здорового добровольца берут 2 мл крови в пробирку, содержащую 40 мкл гепарина (572 ME) для предотвращения коагуляции, готовят 4 мМ и 40 мкМ рабочие растворы лекарственного средства в ДМСО и добавляют к аликвотам цельной крови для получения конечной концентрации 100 мкМ и 1 мкМ, соответственно. Лекарственное средство инкубируют в цельной крови при 37oС и отбирают 20-мкл образцы в 180 мкл охлажденного метанола (-30oС) через различные промежутки времени (0, 1, 2 и 3 часа). Встряхивают и перемешивают, а затем центрифугируют при 11000 об/мин в течение 3 мин на микроцентрифуге при комнатной температуре. Разбавляют 100 мкл супернатанта водой до 300-500 мкл, в зависимости от сигнального отклика (УФ в случае концентрации соединения 100 мкМ и флуоресценция в случае концентрации соединения 1 мкМ). Разбавленный образец (200 мкл) вводят в колонку для ВЭЖХ, предварительно уравновешенную подвижной фазой. Измеряют площадь под пиком, соответствующим формам лактона. Площадь пика в нулевой момент времени принимают за 100% и вычисляют долю площади пика лактона в различные моменты времени, чтобы определить равновесную устойчивость лактона как приобретенную при установившейся доле лактона в два последовательных момента времени (Biochemistry, 1994; 33:10325-10336, и J. Pharm. Sci., 1995, 84:518-519). 3. Фармакокинетика при МТР Все исследования проводят на мышах Swiss albino с массой в интервале 35-40 г. Животных не кормят в течение ночи перед введением дозы лекарственного средства и дают корм через 3 часа после введения дозы. Животным вводят дозу интраперитонеально в виде раствора в смеси ДМСО-вода (50:50, о/о). Образцы крови отбирают в пробирки с гепарином из глазной впадины через 1, 2, 4, 6 и 8 часов после введения дозы и центрифугируют при 13000 об/мин в течение 10 мин. Отделяют образцы плазмы и анализируют с помощью ВЭЖХ. К 50 мкл образца добавляют 100 мкл охлажденного подкисленного метанола и перемешивают для осаждения белков. Образец центрифугируют при 13000 об/мин в течение 10 мин. Доводят 100 мкл супернатанта до объема 200 мкл смесью метанол – вода (50: 50, о/о) и 100 мкл вводят в установку ВЭЖХ. Для количественной оценки используют площадь пика лекарственного средства. Образцы для калибровки, контроля и извлечения готовят посредством внесения 50 мкл контрольной плазмы с известным количеством лекарственного средства и обрабатывают их так же, как образцы (J. Natl. Cancer Inst., 1996, 88:817-824). 4. Растворимость по методу ВЭЖХ Избыток соединения замачивают в 0,5 мл 0,1 М натрий-ацетатного буфера при рН 5,0 в течение 24 часов при комнатной температуре. Раствор фильтруют через насадку для шприца с 0,45-мкм поливинилиденфторидным (PVDF) фильтром (Gelman Sciences). Фильтрат вводят в установку для ВЭЖХ в разных объемах (10 и 20 мкл). Регистрируют хроматограммы. Зарегистрированные отклики экстраполируют от калибровочной кривой и вычисляют растворимость соединения (J. Med. Chem., 1995; 38: 400). 5. Растворимость по традиционному методу Соединение суспендируют в 5 мл деионизованной воды и греют при 37oС в течение 10 мин. Затем раствор фильтруют и фильтрат упаривают досуха с использованием метанола, и взвешивают твердый остаток. 6. Активность in vitro после воздействия в течение 1 часа Выращивают клетки в 15 мл полной среды (RPMI-1640 с 10% фетальной коровьей сыворотки и 0,2% NaHCO3) в течение 3-5 суток и получают клетки в количестве 106 клеток/матрас. Среду удаляют, а связанные клетки промывают забуференным фосфатом физиологическим раствором (ЗФР). Добавляют 1 мл 0,1% трипсин-ЭДТК и инкубируют в течение 5 мин при 37oС. Осторожно извлекают матрасы и добавляют 5 мл полной среды. Извлекают клеточную суспензию и центрифугируют при 2000 об/мин в течение 5 мин. Супернатант отбрасывают и клеточный осадок суспендируют в 5 мл полной среды. Подсчитывают число клеток в гемоцитометре. Разводят клеточную суспензию до 10000 клеток на 100 мкл в полной среде. Высевают 100 мкл клеточкой суспензии в каждую из 96 лунок титрационного микропланшета и инкубируют в течение 24 час при 37oС и 5% СО2. Прекращают процесс в “пустышке” для сравнения (засеянной отдельно) 25 мкл 50% холодной трихлоруксусной кислоты (ТСА). Инкубируют в течение 1 часа при 4oС. Промывают планшет (пять раз) деионизованной водой. Планшет сушат на воздухе и хранят при 4oС для определения величины Т0. Осуществляют подходящее разведение испытываемого соединения в полной среде и добавляют 100 мкл в каждую лунку, чтобы поддержать конечную концентрацию в интервале от 10-4 до 10-8 М. Инкубируют в течение 1 часа при 37oС и 5% CO2. Центрифугируют титрационный микропланшет при 1000 об/мин в течение 5 мин. Удаляют супернатант. Промывают клетки дважды 100 мкл ЗФР для удаления следов испытываемого соединения. Добавляют 200 мкл полной среды в каждую лунку и инкубируют в течение 48 час при 37oС и 5% CO2. Обрывают рост клеток посредством добавления 50 мкл холодной 50% ТСА. Инкубируют планшет в течение 1 часа при 4oС. Промывают планшеты деионизованной водой (пять раз) и сушат на воздухе. Добавляют в каждую лунку 100 мкл раствора сульфородамина В (0,4% в 1% уксусной кислоте). Выдерживают при комнатной температуре в течение 15 минут. Промывают (пять раз) 1% уксусной кислотой и сушат на воздухе. Добавляют 100 мкл 10 мМ основания Trizma (Sigma), осторожно встряхивают на планшетном шейкере в течение 15 минут и считывают оптическую плотность при 490 нм на спектрофотометре для прочтения планшетов (в соответствии с протоколом, которому следуют в Национальном институте рака США). Кроме того, некоторые соединения, полученные по настоящему изобретению, обнаруживают хорошую противораковую активность in vitro по отношению к клеточным линиям различных опухолей человека, в соответствии с результатами, полученными при анализе 60 клеточных линий опухолей человека, выполненном в Национальном институте рака (NCI), Bethesda, Мэриленд, США. В табл.1 приводится активность по отношению к клеточным линиям in vitro, выраженная в величинах IC50, для различных С-циклических аналогов 20(S)-камптотецина, полученных по настоящему изобретению. В картах 1-3 приводятся данные, полученные на основе усредненных графиков NCI для полного ингибирования роста (TGI) различных типов человеческих раковых клеточных линий для соединений, полученных в примерах 27, 28 и 43. В целях сравнения, включены также подобные данные для топотекана, полученные на основе усредненного графика NCI. Данные, представленные в табл. 2 и 3, показывают, что С-циклические аналоги 20(S)-камптотецина, полученные по настоящему изобретению, проявляют противоопухолевую активность, равную или превосходящую активность топотекана в отношении некоторых клеточных линий различных панелей раковых клеток. В табл.4 приводятся данные, полученные для соединения, полученного в примере 32, по отношению к клеточным линиям лимфомы, связанной со СПИДом (ARL). Все соединения, использованные в программе противоракового скрининга in vitro NCI, являются смесями, по существу содержащими как диастереомеры с 20(S),5(S), так и конфигурации 20(S),5(R) в различных соотношениях. Результаты, представленные в картах 1-3 и табл. 1-4, получают при проведении экспериментов в соответствии с протоколами Национального института рака (NCI), приведенными ниже. Каждое испытываемое соединение скринируют по отношению к группе из 60 человеческих клеточных линий, полученных из восьми органов. При типичной процедуре, клеточные суспензии, которые разводят в соответствии с конкретным типом клеток и ожидаемой плотностью клеток-мишеней (5000-40000 клеток на лунку, основываясь на особенностях клеточного роста), вносят в 96-луночные титрационные микропланшеты. Инокуляты оставляют перед инкубацией на 24 часа при 37oС для стабилизации. В лунки титрационного микропланшета в момент времени “ноль” добавляют 100-мкл аликвоты разведенных в два раза предназначенных для испытаний концентраций. Обычно испытываемые соединения оценивают при пяти-10-кратном разведении. Самая высокая концентрация в лунке, применяемая при испытаниях, составляет 10-4 М. Затем клетки инкубируют в присутствии лекарственного средства (испытываемое соединение) еще в течение 48 ч в атмосфере с 5% СО2 и 100% влажности. По окончании этого периода прилипшие клетки фиксируют на планшете с помощью трихлоруксусной кислоты, и после нескольких промываний клеточный слой обрабатывают красителем для белка сульфородамином В. Затем, с помощью автоматического спектрофотометра для прочтения планшетов, при длине волны 515 нм, считывают оптическую плотность, которая пропорциональна массе белка. Данные вносят в микрокомпьютер, и с использованием специально разработанной программы получают окончательные результаты. Соединения формулы 1 настоящего изобретения и их фармацевтически приемлемые соли, описанные выше, и содержащие их композиции являются полезными как противораковые и противовирусные средства. Введение новых активных соединений формулы 1, в чистой форме или в форме подходящей фармацевтической композиции, можно осуществить посредством любого способа введения, принятого для доставки подобных средств. Так, например, активные средства можно вводить перорально, назально, парентерально или местно, в твердой, полутвердой, форме лиофилизованного порошка или жидкой лекарственной форме, например, в форме таблеток, суппозиториев, пилюль, капсул, порошков, растворов, суспензий, эмульсий, кремов, лосьонов, аэрозолей, мазей, инъекций или подобной форме, предпочтительно в виде подходящих стандартных лекарственных форм, для упрощения введения точных доз. Композиции будут включать обычный фармацевтический носитель, разбавитель или эксципиент и активное новое соединение формулы 1 и, кроме того, могут включать любые лекарственные средства, фармацевтические средства, носители, адъюванты и т.п. Настоящее изобретение описывается подробно с помощью конкретных примеров, приведенных ниже, которые даются только для иллюстрации и не должны рассматриваться как ограничивающие объем изобретения. Примеры Пример 1 Получение 5-метоксикамптотецина (известное соединение) Стадия 1. К смеси 20(S)-камптотецина формулы 3 (2 г) и хлорида железа (3) (2 г), растворенной в 80 мл метанола, добавляют по каплям 10 мл серной кислоты и нагревают при 70oС в течение 24 ч. Избыток кислоты и метанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает 1,8 г желтоватого порошка, содержащего 5-метоксикамптотецин и 5-гидроксикамптотецин в соотношении 5:1. Стадия 2. Разделение смеси посредством колоночной хроматографии на силикагеле с использованием в качестве элюента смеси растворителей метанол – хлороформ, дает 1,5 г 5-метоксикамптотецина и 300 мг 5-гидроксикамптотецина. Результаты анализа 5-метоксикамптотецина: т. пл. 156oС; [  ]D при 28oС = +41,74 (с 0,103, СНСl3); ИК: 3426, 1747, 1664, 1616, 1228, 1155, 1046, 762 см-1; 1H ЯМР (CDCl3, 200 МГц): ]D при 28oС = +41,74 (с 0,103, СНСl3); ИК: 3426, 1747, 1664, 1616, 1228, 1155, 1046, 762 см-1; 1H ЯМР (CDCl3, 200 МГц):  8,42 (с, 1Н), 8,26 (д, J=8 Гц, 1H), 7,96 (д, J= 8 Гц, 1H), 7,88 (т, J=6,8 Гц, 1H), 7,68 (т, J=6,8 Гц, 1H), 7,58 (c, 0,5Н), 7,54 (с, 0,5Н), 6,95 (с, 0,5Н), 6,80 (с, 0,5Н), 5,74 (д, J=16,5 Гц, 0,5Н), 5,72 (д, J= 16,5 Гц, 0,5Н), 5,25 (д, J=16,5 Гц, 1H), 3,75 (с, 1H), 3,70 (с, 1,5Н), 3,50 (с, 1,5Н), 2,01-1,82 (м, 2Н), 1,06 (т, J=7 Гц, 3Н); М. -с. (m/z): 379 (М+Н), 348, 319.
Пример 2 8,42 (с, 1Н), 8,26 (д, J=8 Гц, 1H), 7,96 (д, J= 8 Гц, 1H), 7,88 (т, J=6,8 Гц, 1H), 7,68 (т, J=6,8 Гц, 1H), 7,58 (c, 0,5Н), 7,54 (с, 0,5Н), 6,95 (с, 0,5Н), 6,80 (с, 0,5Н), 5,74 (д, J=16,5 Гц, 0,5Н), 5,72 (д, J= 16,5 Гц, 0,5Н), 5,25 (д, J=16,5 Гц, 1H), 3,75 (с, 1H), 3,70 (с, 1,5Н), 3,50 (с, 1,5Н), 2,01-1,82 (м, 2Н), 1,06 (т, J=7 Гц, 3Н); М. -с. (m/z): 379 (М+Н), 348, 319.
Пример 2Получение 5-гидроксикамптотецина (известное соединение) Стадия 1. Получение 5-метоксикамптотецина 5-Метоксикамптотецин формулы 1, где R1=R2=R3=R4=R5=H, R6=Me, получают из 20(S)-камптотецина формулы 3 так, как описано в примере 1. Стадия 2. Растворяют 1,5 г 5-метоксикамптотецина формулы 1, где R1=R2= R3= R4=R5=H, и R6=Me, в 50 мл метанола и обрабатывают 50 мл 50% НСl. Раствор кипятят с обратным холодильником в течение 30 ч. По окончании нагревания избыток воды и метанола удаляют в виде азеотропной смеси, а остаток экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над безв. сульфатом натрия. После выпаривания растворителя и очистки с помощью колоночной хроматографии на силикагеле с использованием смеси растворителей этилацетат – хлороформ получают 1,2 г 5-гидроксикамптотецина; т.пл. 220oС; [  ]D при 26oС = +28,00 (с 0,1 в СНСl3); ИК: 3367, 1749, 1658, 1591, 1159, 1046 см-1; 1H ЯМР (СDСl3+ДМСО-d6, 200 МГц): ]D при 26oС = +28,00 (с 0,1 в СНСl3); ИК: 3367, 1749, 1658, 1591, 1159, 1046 см-1; 1H ЯМР (СDСl3+ДМСО-d6, 200 МГц):  8,50 (с, 1H), 8,20 (д, J=8 Гц, 1H), 7,94 (д, J=8 Гц, 1H), 7,85 (т, J=6,8 Гц, 1H), 7,64 (т, J=6,8 Гц, 1H), 7,58 (c, 0,5Н), 7,56 (с, 0,5Н), 7,06 (с, 0,5Н), 7,01 (с, 0,5Н), 6,95 (ушир. д, 1H, D2O обмениваемый), 5,67 (д, J=16,5 Гц, 1H), 5,25 (д, J=16,5 Гц, 1H), 5,05 (ушир. д, 1H, D2О обмениваемый), 2,05-1,86 (м, 2Н), 1,06 (т, J=7 Гц, 3H); М.-с. (m/z): 364 (М+1), 348, 320, 277, 236, 91, 57.
Пример 3 8,50 (с, 1H), 8,20 (д, J=8 Гц, 1H), 7,94 (д, J=8 Гц, 1H), 7,85 (т, J=6,8 Гц, 1H), 7,64 (т, J=6,8 Гц, 1H), 7,58 (c, 0,5Н), 7,56 (с, 0,5Н), 7,06 (с, 0,5Н), 7,01 (с, 0,5Н), 6,95 (ушир. д, 1H, D2O обмениваемый), 5,67 (д, J=16,5 Гц, 1H), 5,25 (д, J=16,5 Гц, 1H), 5,05 (ушир. д, 1H, D2О обмениваемый), 2,05-1,86 (м, 2Н), 1,06 (т, J=7 Гц, 3H); М.-с. (m/z): 364 (М+1), 348, 320, 277, 236, 91, 57.
Пример 3Получение 5-этокси-7-этилкамптотецина (известное соединение) Стадия 1. К смеси 7-этилкамптотецина формулы 2, где R1=R2=R3=R4=H, и R5= Et (1,5 г), и хлорида железа (3) (1,35 г), растворенной в 150 мл этанола, добавляют по каплям 9 мл серной кислоты и греют при 85oС в течение 30 ч. Избыток кислоты и этанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом, и сушат над безв. сульфатом натрия. Выпаривание растворителя дает 1,6 г коричневатого порошка, содержащего 5-этокси-7-этилкамптотецин и 5-гидрокси-7-этилкамптотецин в соотношении 10:1. Стадия 2. Разделение смеси посредством колоночной хроматографии дает 1 г 5-этокси-7-этилкамптотецина и 100 мг 5-гидрокси-7-этилкамптотецина; т.пл. 150oС; [  ]D при 27oС = +10,526 (с 0,085, СНСl3); ИК: 3419, 1751, 1662, 1613, 1157, 1075, 1050, 764 см-1; 1H ЯМР (CDCl3, 200 МГц): ]D при 27oС = +10,526 (с 0,085, СНСl3); ИК: 3419, 1751, 1662, 1613, 1157, 1075, 1050, 764 см-1; 1H ЯМР (CDCl3, 200 МГц):  8,20 (д, J=8 Гц, 1H), 8,15 (д, J=8 Гц, 1H), 7,81 (т, J=6,8 Гц, 1H), 7,66 (т, 7,3 Гц, 1Н), 7,54 (с, 0,5Н), 7,51 (с, 0,5Н), 7,01 (с, 0,5Н), 6,89 (с, 0,5Н), 5,72 (д, J=16,5 Гц, 0,5H), 5,71 (д, J=16,5 Гц, 0,5H), 5,28 (д, J=16,5 Гц, 0,5Н), 5,26 (д, J=16,5 Гц, 0,5H), 4,3-3,6 (м, 3Н), 3,5-3,1 (м, 2Н), 2,05-1,71 (м, 2Н), 1,45 (т, J= 7,5 Гц, 3H), 1,06 (т, J=7 Гц, 3H).
Пример 4 8,20 (д, J=8 Гц, 1H), 8,15 (д, J=8 Гц, 1H), 7,81 (т, J=6,8 Гц, 1H), 7,66 (т, 7,3 Гц, 1Н), 7,54 (с, 0,5Н), 7,51 (с, 0,5Н), 7,01 (с, 0,5Н), 6,89 (с, 0,5Н), 5,72 (д, J=16,5 Гц, 0,5H), 5,71 (д, J=16,5 Гц, 0,5H), 5,28 (д, J=16,5 Гц, 0,5Н), 5,26 (д, J=16,5 Гц, 0,5H), 4,3-3,6 (м, 3Н), 3,5-3,1 (м, 2Н), 2,05-1,71 (м, 2Н), 1,45 (т, J= 7,5 Гц, 3H), 1,06 (т, J=7 Гц, 3H).
Пример 4Получение 5-гидрокси-7-этилкамптотецина (известное соединение) Стадия 1. Получение 5-этокси-7-этилкамптотецина 5-Этокси-7-этилкамптотецин формулы 1, где R1=R2=R3=R4=H, и R5=R6=Et, получают из 20(S)-камптотецина формулы 2 так, как описано в примере 3. Стадия 2. Добавляют 50 мл 25% H2SO4 к 1,0 г 5-этокси-7-этилкамптотецина формулы 1, где R1=R2=R3=R4=H, и R5=R6=Et, растворенного в 30 мл этанола, и кипятят с обратным холодильником в течение 30 ч. По окончании нагревания избыток воды и этанола удаляют в виде азеотропной смеси, а остаток экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над безв. сульфатом натрия. После выпаривания растворителя и очистки с помощью колоночной хроматографии на силикагеле получают 700 мг 5-гидрокси-7-этилкамптотецина; т. пл. 252oС; ИК: 3349, 1752, 1656, 1605, 1159, 1054, 766 см-1; частичные результаты 1H ЯМР (CDCl3+ДМСО-d6):  7,19 (ушир. с, 1Н, D2O обмениваемый), 7,15 (с, 0,5Н), 7,05 (с, 0,5Н), 5,75 (ушир. с, 1Н, D2O обмениваемый), 5,65 (д, J=16,5 Гц, 1Н), 5,25 (д, J=16, 6Гц, 1Н), 3,52-3,19 (м, 2Н), 1,45 (т, J=7,5 Гц, 3Н), 1,02 (м, 3Н).
Пример 5 7,19 (ушир. с, 1Н, D2O обмениваемый), 7,15 (с, 0,5Н), 7,05 (с, 0,5Н), 5,75 (ушир. с, 1Н, D2O обмениваемый), 5,65 (д, J=16,5 Гц, 1Н), 5,25 (д, J=16, 6Гц, 1Н), 3,52-3,19 (м, 2Н), 1,45 (т, J=7,5 Гц, 3Н), 1,02 (м, 3Н).
Пример 5Получение 5-этокси-9-метоксикамптотецина формулы 1, где R1=OMe, R2=R3= R4=R5=H, R6=Et Стадия 1. К смеси 9-метоксикамптотецина формулы 2, где R1=OMe, R2=RЗ=R4= R5=H (1 г), и хлорида железа (3) (500 мг), растворенной в 50 мл этанола, добавляют по каплям 10 мл серной кислоты, и греют при 85oС в течение 22 ч. Избыток кислоты и этанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает темный коричневатый порошок. Стадия 2. Очистка указанного выше остатка посредством колоночной хроматографии с использованием силикагеля дает 500 мг 5-этокси-9-метоксикамптотецина формулы 1 и 300 мг 5-гидрокси-9-метоксикамптотецина; т.пл. 235oС; [  ]D при 30oС = +34,18 (с 0,093, МеОН); ИК: 3436, 1748, 1665, 1619, 1461, 1366, 1093, 814 см-1; 1H ЯМР (CDCl3, 200 МГц): ]D при 30oС = +34,18 (с 0,093, МеОН); ИК: 3436, 1748, 1665, 1619, 1461, 1366, 1093, 814 см-1; 1H ЯМР (CDCl3, 200 МГц):  8,81 (с, 1Н), 7,78 (м, 2Н), 7,53 (д, J= 5,5 Гц, 1H), 6,96 (д, J=7 Гц, 1H), 6,88 (с, 1H), 6,77 (с, 1H), 5,72 (д, J= 16 Гц, 0,5H), 5,75 (д, J=16 Гц, 0,5Н), 5,27 (д, J=16 Гц, 1H), 4,24-3,90 (м, 2Н), 4,06 (с, 3Н), 3,80 (с, 1H, D2О обмениваемый), 1,90 (м, 2Н), 1,31 (м, 3Н), 1,01 (м, 3Н); М.-с. (m/z): 422 (М+1), 394, 378, 350, 305, 98, 57.
Пример 6 8,81 (с, 1Н), 7,78 (м, 2Н), 7,53 (д, J= 5,5 Гц, 1H), 6,96 (д, J=7 Гц, 1H), 6,88 (с, 1H), 6,77 (с, 1H), 5,72 (д, J= 16 Гц, 0,5H), 5,75 (д, J=16 Гц, 0,5Н), 5,27 (д, J=16 Гц, 1H), 4,24-3,90 (м, 2Н), 4,06 (с, 3Н), 3,80 (с, 1H, D2О обмениваемый), 1,90 (м, 2Н), 1,31 (м, 3Н), 1,01 (м, 3Н); М.-с. (m/z): 422 (М+1), 394, 378, 350, 305, 98, 57.
Пример 6Получение 5-гидрокси-9-метоксикамптотецина (известное соединение) Стадия 1. Сначала получают 5-этокси-9-метоксикамптотецин формулы 1, где R1=OMe, R2=R3=R4=R5=H, R6=Et, так, как описано в примере 5. Стадия 2. Добавляют 25 мл 80% НСl к 560 мг 5-этокси-9-метоксикамптотецина формулы 1, где R1=OMe, R2=R3=R4=R5=H, и R6=Et, растворенного в 25 мл этанола, и кипятят с обратным холодильником в течение 16 ч. По окончании нагревания избыток воды и этанола удаляют в виде азеотропной смеси, а остаток экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над безв. сульфатом натрия. После выпаривания и очистки с помощью колоночной хроматографии на силикагеле получают 520 мг 5-гидрокси-9-метоксикамптотецина; т.пл. 162oС; [  ]D при 30oС = +39,68 (с 0,012, МеОН); ИК: 3398, 1749, 1656, 1616, 1577, 1465, 1383, 1154 см-1; 1Н ЯМР (СDСl3+ДМСО-d6): ]D при 30oС = +39,68 (с 0,012, МеОН); ИК: 3398, 1749, 1656, 1616, 1577, 1465, 1383, 1154 см-1; 1Н ЯМР (СDСl3+ДМСО-d6):  8,81 (с, 1H), 7,81-7,61 (м, 2Н), 7,50 (д, J=5,5 Гц, 1H), 7,12-6,71 (м, 2Н), 5,70 (д, J= 16 Гц, 1H), 5,30 (д, J=16 Гц, 1H), 4,06 (с, 3Н), 1,98-1,75 (м, 2Н), 1,10-0,98 (м, 3Н); М.-с. (m/z): 394 (М+1), 377, 348, 266, 149, 88, 57.
Пример 7 8,81 (с, 1H), 7,81-7,61 (м, 2Н), 7,50 (д, J=5,5 Гц, 1H), 7,12-6,71 (м, 2Н), 5,70 (д, J= 16 Гц, 1H), 5,30 (д, J=16 Гц, 1H), 4,06 (с, 3Н), 1,98-1,75 (м, 2Н), 1,10-0,98 (м, 3Н); М.-с. (m/z): 394 (М+1), 377, 348, 266, 149, 88, 57.
Пример 7Получение 5-этокси-9-метокси-7-этилкамптотецина формулы 1, где R1=OMe, R2=R3=R4=H, R5=R6=Et Стадия 1. К смеси 9-метокси-7-этилкамптотецина формулы 2, где R1=OMe, R2= R3=R4=H, и R5=Et (100 мг), и хлорида железа (3) (100 мг), растворенной в 32 мл этанола, добавляют по каплям 2 мл серной кислоты и греют при 85oС в течение 4 ч. Избыток кислоты и этанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает 120 мг остатка, содержащего 5-этокси-9-метокси-7-этилкамптотецин и 5-гидрокси-9-метокси-7-этилкамптотецин в соотношении 1:4. Стадия 2. Разделение смеси посредством колоночной хроматографии с использованием смеси растворителей этилацетат-хлороформ дает 15 мг 5-этокси-9-метокси-7-этилкамптотецина формулы 1 и 55 мг 5-гидрокси-9-метокси-7-этилкамптотецина; т. пл. 240oС; ИК: 3443, 1747, 1663, 1609, 1458, 1254, 1160, 1074 см-1; 1H ЯМР (СDСl3, 200 МГц):  7,80-7, 68 (м, 2Н), 7,50 (с, 0,5Н), 7,47 (с, 0,5Н), 7,01 (с, 0,5Н), 6,98 (д, J=8 Гц, 1H), 6,89 (с, 0,5Н), 5,76 (д, J= 16 Гц, 1H), 5,28 (д, J=16 Гц, 0,5H), 5,26 (д, J=16 Гц, 0,5Н), 4,25-3,81 (м, 2Н), 4,02 (с, 3H), 3,72-3,28 (м, 2Н), 3,15 (ушир. с, 1H, D2О обмениваемый), 2,02-1,82 (м, 2Н), 1,37-1,33 (м, 3Н), 1,05-0,95 (м, 3Н); М.-с. (m/z): 451 (М+1), 406, 377, 362, 347, 331, 261, 181, 149, 97.
Пример 8 7,80-7, 68 (м, 2Н), 7,50 (с, 0,5Н), 7,47 (с, 0,5Н), 7,01 (с, 0,5Н), 6,98 (д, J=8 Гц, 1H), 6,89 (с, 0,5Н), 5,76 (д, J= 16 Гц, 1H), 5,28 (д, J=16 Гц, 0,5H), 5,26 (д, J=16 Гц, 0,5Н), 4,25-3,81 (м, 2Н), 4,02 (с, 3H), 3,72-3,28 (м, 2Н), 3,15 (ушир. с, 1H, D2О обмениваемый), 2,02-1,82 (м, 2Н), 1,37-1,33 (м, 3Н), 1,05-0,95 (м, 3Н); М.-с. (m/z): 451 (М+1), 406, 377, 362, 347, 331, 261, 181, 149, 97.
Пример 8Получение 5-гидрокси-9-метокси-7-этилкамптотецина формулы 13, где R1= OMe, R2=R3=R4=H, R5=R6=Et Стадия 1. Сначала получают 5-этокси-9-метокси-7-этилкамптотецин формулы 1, где R1=OMe, R2=RЗ=R4=H, и R5=R6=Et, так, как описано в примере 7. Стадия 2. Добавляют 5 мл 50% НСl к 100 мг 5-этокси-9-метокси-7-этилкамптотецина формулы 1, где R1=OMe, R2=R3=R4=H, и R5=R6=Et, растворенного в 5 мл этанола, и кипятят с обратным холодильником в течение 26 ч. По окончании нагревания избыток воды и этанола удаляют в виде азеотропной смеси, а остаток экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над безв. сульфатом натрия. После выпаривания растворителя и очистки с помощью колоночной хроматографии на силикагеле получают 80 мг 5-гидрокси-9-метокси-7-этилкамптотецина; т.пл. 242oС; ИК: 3440, 1742, 1660, 1610, 1456, 1250, 1160 см-1. Пример 9 Получение 5-этоксикамптотецина (известное соединение) Стадия 1. К смеси 20(S)-камптотецина формулы 3 (1 г) и хлорида железа (3) (1 г), растворенной в 50 мл этанола, добавляют по каплям 12 мл эфирата ВF3 и нагревают при 85oС в течение 40 ч. Избыток кислоты и этанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает 1 г желтоватого порошка, содержащего 17-этоксикамптотецин и 5-гидроксикамптотецин в соотношении 6:1. Стадия 2. Разделение указанной смеси посредством колоночной хроматографии на силикагеле с использованием в качестве элюента смеси растворителей этилацетат – гексан дает 700 мг 5-этоксикамптотецина и 120 мг полученного ранее 5-гидроксикамптотецина; т.пл. 140oС; [  ]D при 28oС = +29/703 (с 0,101, СНСl3); ИК: 3423, 1746, 1663, 1616, 1155, 1070, 1040 см-1; частичные данные 1Н ЯМР в CDCl3: ]D при 28oС = +29/703 (с 0,101, СНСl3); ИК: 3423, 1746, 1663, 1616, 1155, 1070, 1040 см-1; частичные данные 1Н ЯМР в CDCl3:  6,9 (с, 0,5Н), 6,78 (с, 0,5Н), 4,25-3,85 (м, 2Н), 3,70 (с, 1Н), 2,00-1,80 (м, 2Н), 1,40-1,22 (м, 3Н), 1,12-0,98 (м, 3Н); М.-с. (m/z): 393 (М+1), 378, 362, 348, 319, 247, 219, 57.
Пример 10 6,9 (с, 0,5Н), 6,78 (с, 0,5Н), 4,25-3,85 (м, 2Н), 3,70 (с, 1Н), 2,00-1,80 (м, 2Н), 1,40-1,22 (м, 3Н), 1,12-0,98 (м, 3Н); М.-с. (m/z): 393 (М+1), 378, 362, 348, 319, 247, 219, 57.
Пример 10Получение 5-бутоксикамптотецина (известное соединение) Стадия 1. К смеси 20(S)-камптотецина формулы 3 (500 мг) и хлорида железа (3) (500 мг), растворенной в 15 мл н-бутанола, добавляют по каплям серную кислоту и нагревают при 100oС в течение 20 ч. Избыток кислоты и н-бутанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает порошкообразное вещество. Стадия 2. Очистка указанного выше вещества посредством колоночной хроматографии на силикагеле с использованием в качестве элюента смеси растворителей этилацетат – гексан дает 300 мг 5-бутоксикамптотецина и 50 мг полученного ранее 5-гидроксикамптотецина; т.пл. 82oС; [  ]D при 28oС = +28,00 (с 0,1, СНСl3); частичные данные 1Н ЯМР в СDСl3: ]D при 28oС = +28,00 (с 0,1, СНСl3); частичные данные 1Н ЯМР в СDСl3:  6,92 (с, 0,5Н), 6,79 (с, 0,5Н), 4,12-3,75 (м, 2Н), 3,80 (ушир. с, 1Н, D2O обмениваемый), 2,00-1,82 (м, 2Н), 1,75-1,52 (м, 2Н), 1,50-1,29 (м, 2Н), 1,15-0,82 (м, 6Н); М.-с. (m/z): 422 (М+1), 363, 348, 319, 84, 51.
Пример 11 6,92 (с, 0,5Н), 6,79 (с, 0,5Н), 4,12-3,75 (м, 2Н), 3,80 (ушир. с, 1Н, D2O обмениваемый), 2,00-1,82 (м, 2Н), 1,75-1,52 (м, 2Н), 1,50-1,29 (м, 2Н), 1,15-0,82 (м, 6Н); М.-с. (m/z): 422 (М+1), 363, 348, 319, 84, 51.
Пример 11Получение 5-этокси-9-гидроксикамптотецина формулы 1, где R1=OH, R2=R3= R4=R5=H, R6=Et Стадия 1. К смеси 9-гидроксикамптотецина формулы 2, где R1=OH, R2=R3=R4= R5= H (200 мг), и хлорида железа (3) (250 мг), растворенной в 40 мл этанола, добавляют по каплям 1,5 мл серной кислоты и греют при 85oС в течение 26 ч. Избыток кислоты и этанола удаляют в вакууме, а остаток экстрагируют смесью 5% метанол – хлороформ. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает 170 мг остатка, содержащего 5-этокси-9-гидроксикамптотецин и 5,9-дигидроксикамптотецин в соотношении 3:1. Стадия 2. Разделение смеси посредством колоночной хроматографии с использованием смеси растворителей этилацетат – хлороформ дает 75 мг 5-этокси-9-гидроксикамптотецина формулы 1 и 25 мг 9,5-дигидроксикамптотецина; т.пл. 230oС; ИК: 3400, 2920, 1745, 1663, 1597, 1360, 1280, 1228, 1157, 1083, 902, 816 см-1; 1H ЯМР (CDCl3):  8,83 (с, 1Н), 7,78 (д, J=6,8 Гц, 1H), 7,67-7,56 (м, 2Н), 7,01 (с, 0,5Н), 6,98 (с, 0,5Н), 6,91 (с, 0,5Н), 6,81 (с, 0,5Н), 5,70 (д, J= 16 Гц, 1H), 5,33 (д, J=16 Гц, 1H), 4,15-3,91 (м, 2Н), 1,90 (м, 2Н), 1,05 (т, J=7 Гц, 3Н); М.-с. (m/z): 409 (М+1), 364, 335, 320, 291, 267, 263, 221, 206, 171, 159, 129, 111, 98, 85.
Пример 12 8,83 (с, 1Н), 7,78 (д, J=6,8 Гц, 1H), 7,67-7,56 (м, 2Н), 7,01 (с, 0,5Н), 6,98 (с, 0,5Н), 6,91 (с, 0,5Н), 6,81 (с, 0,5Н), 5,70 (д, J= 16 Гц, 1H), 5,33 (д, J=16 Гц, 1H), 4,15-3,91 (м, 2Н), 1,90 (м, 2Н), 1,05 (т, J=7 Гц, 3Н); М.-с. (m/z): 409 (М+1), 364, 335, 320, 291, 267, 263, 221, 206, 171, 159, 129, 111, 98, 85.
Пример 12Получение 9,5-дигидроксикамптотецина формулы 13, где R1=OH, R1=R2=R3=R4= H Стадия 1. Сначала получают 5-этокси-9-гидроксикамптотецин формулы 1, где R1=OH, R2=R3=R4=R5=H, и R6=Et, так, как описано в примере 11. Стадия 2. Добавляют 25 мл 80% НСl к 560 мг 5-этокси-9-гидроксикамптотецина формулы 1, где R1=OH, R2=R3=R4=R5=H, и R6=Et, растворенного в 25 мл этанола, и кипятят с обратным холодильником в течение 16 ч. По окончании нагревания избыток воды и этанола удаляют в виде азеотропной смеси, а остаток экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над безв. сульфатом натрия. После выпаривания растворителя и очистки с помощью колоночной хроматографии на силикагеле получают 320 мг 9,5-дигидроксикамптотецина (13): т.пл. 102oС; ИК: 3400, 1744, 1659, 1594, 1462, 1361, 1280, 1229, 1049, 820 см-1. 1H ЯМР (ДМСО-d6):  10,82 (с, 1Н, D2О обмениваемый), 7,63-7,69 (м, 2Н), 7,22 (с, 0,5Н), 7,19 (с, 0,5Н), 7,11 (д, J=7 Гц, 1Н), 6,98 (с, 0,5Н), 6,95 (с, 0,5Н), 6,50 (с, 1H, D2O обмениваемый), 5,42 (с, 2Н), 1,89 (м, 2Н), 0,90 (т, J=7 Гц, 3H); М.-с. (m/z): 380 (М+1), 320, 305, 293, 264.
Пример 13 10,82 (с, 1Н, D2О обмениваемый), 7,63-7,69 (м, 2Н), 7,22 (с, 0,5Н), 7,19 (с, 0,5Н), 7,11 (д, J=7 Гц, 1Н), 6,98 (с, 0,5Н), 6,95 (с, 0,5Н), 6,50 (с, 1H, D2O обмениваемый), 5,42 (с, 2Н), 1,89 (м, 2Н), 0,90 (т, J=7 Гц, 3H); М.-с. (m/z): 380 (М+1), 320, 305, 293, 264.
Пример 13Получение 5-этокси-9-гидрокси-7-этилкамптотецина формулы 1, где R1=OH, R2=R3=R4=H, R5=R6=Et Стадия 1. К смеси 9-гидрокси-7-этилкамптотецина формулы 2, где R1=OH, R2= R3=R4=H, и R5=Et (150 мг), и хлорида железа (3) (150 мг), растворенной в 30 мл этанола, добавляют по каплям 2 мл серной кислоты и греют при 85oС в течение 40 ч. Избыток кислоты и этанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает 120 мг остатка, содержащего 5-этокси-9-гидрокси-7-этилкамптотецин и 5,9-дигидрокси-7-этилкамптотецин в соотношении 5:1. Стадия 2. Разделение смеси посредством колоночной хроматографии с использованием смеси растворителей ацетона и хлороформа дает 85 мг 5-этокси-9-гидрокси-7-этилкамптотецина формулы 1 и 15 мг 5,9-дигидрокси-7-этилкамптотецина; т. пл. 240oС; ИК: 3500, 2976, 1749, 1662, 1588, 1555, 1461, 1390, 1147, 1079, 921 см-1; 1H ЯМР (ДМСО-d6):  10,77 (с, 1Н, D2O обмениваемый), 7,62-7,67 (м, 2Н), 7,57 (д, J=8 Гц, 1Н), 7,08-7,18 (м, 2Н), 6,50 (с, 1H, D2O обмениваемый), 5,39 (с, 2Н), 4,08 (м, 2Н), 3,42 (м, 2Н), 1,87 (м, 2Н), 1,35 (т, J= 7 Гц, 3H), 0,87 (т, J=7 Гц, 3H); М.-с. (m/z): 437 (М+1), 392, 363, 348, 333, 291, 261, 246, 219, 191, 149, 119, 89.
Пример 14 10,77 (с, 1Н, D2O обмениваемый), 7,62-7,67 (м, 2Н), 7,57 (д, J=8 Гц, 1Н), 7,08-7,18 (м, 2Н), 6,50 (с, 1H, D2O обмениваемый), 5,39 (с, 2Н), 4,08 (м, 2Н), 3,42 (м, 2Н), 1,87 (м, 2Н), 1,35 (т, J= 7 Гц, 3H), 0,87 (т, J=7 Гц, 3H); М.-с. (m/z): 437 (М+1), 392, 363, 348, 333, 291, 261, 246, 219, 191, 149, 119, 89.
Пример 14Получение 9,5-дигидрокси-7-этилкамптотецина формулы 13, где R1=OH, R2= R3=R4=H, R5=Et Стадия 1. Сначала получают 5-этокси-9-гидрокси-7-этилкамптотецин формулы 1, где R1=OH, R2=R3=R4=H, и R5=R6=Et, так, как описано в примере 13. Стадия 2. Добавляют 35 мл 80% НСl к 560 мг 5-этокси-9-гидрокси-7-этилкамптотецина формулы 1, где R1=OH, R2=R3=R4=H, и R5=R6=Et, растворенного в 25 мл этанола, и кипятят с обратным холодильником в течение 16 ч. По окончании нагревания избыток воды и этанола удаляют в виде азеотропной смеси, а остаток экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над безв. сульфатом натрия. После выпаривания растворителя и очистки с помощью колоночной хроматографии на силикагеле получают 380 мг 5,9-дигидрокси-7-этилкамптотецина формулы 13; т.пл. 165oС; ИК: 3351, 2929, 1744, 1657, 1606, 1460, 1218, 1162, 1035, 872 см-1. 1H ЯМР (ДМСО-d6):  10,62 (с, 1H, D2O обмениваемый), 7,60-7,57 (м, 2Н) 7,16-7,00 (м, 3Н), 5,40 (с, 2Н), 3,42 (кв, J= 7,6 Гц, 2H), 2,08 (м, 2Н), 1,33 (т, J=7 Гц, 3Н), 0,89 (т, J=7 Гц, 3Н); М. -с. (m/z): 408 (М+1), 380, 336, 319, 291, 267, 235, 219, 185, 127, 99, 83.
Пример 15 10,62 (с, 1H, D2O обмениваемый), 7,60-7,57 (м, 2Н) 7,16-7,00 (м, 3Н), 5,40 (с, 2Н), 3,42 (кв, J= 7,6 Гц, 2H), 2,08 (м, 2Н), 1,33 (т, J=7 Гц, 3Н), 0,89 (т, J=7 Гц, 3Н); М. -с. (m/z): 408 (М+1), 380, 336, 319, 291, 267, 235, 219, 185, 127, 99, 83.
Пример 15Получение 9-нитро-5-этоксикамптотецина формулы 1, где R1=NO2, R2=R3=R4= R5=H, R6=Et Стадия 1. К смеси 9-нитрокамптотецина формулы 2, где R1=NО2, R2=R3=R4= R5=H (1 г), и хлорида железа (3) (1 г), растворенной в 100 мл этанола, добавляют по каплям 10 мл серной кислоты и греют при 85oС в течение 24 ч. Избыток кислоты и этанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает 900 мг желтоватого порошка. Стадия 2. Очистка полученного выше твердого вещества посредством колоночной хроматографии с использованием в качестве элюента смеси растворителей ацетон – хлороформ дает 700 мг 9-нитро-5-этоксикамптотецина формулы 1 и 80 мг 9-нитро-5-гидроксикамптотецина формулы 13, где R1=NO2, R2=R3=R4=R5=H; т. пл. 202oС; ИК (КВr): 3474, 1743, 1668, 1622, 1526, 1344, 1154, 1073, 831 см-1; 1H ЯМР (CDCl3, 200 МГц):  9,23 (с, 1Н), 8,52 (д, J=9 Гц, 1H), 8,47 (д, J= 9 Гц, 1H), 7,92 (т, J=8,2 Гц, 1H), 7,55 (c, 1H), 6,91 (c, 1H), 5,71 (д, J= 16 Гц, 1H), 5,28 (д, J=16 Гц, 1H), 4,39-3,98 (м, 2H), 3,75 (ушир. с, 1H, D2O обмениваемый), 1,99-1,79 (м, 2H), 1,32 (т, J=7 Гц, 3Н), 1,04 (т, J=7 Гц, 3Н); М.-с. (m/z): 438 (М+1), 407, 393, 364, 349, 319, 262, 118.
Пример 16 9,23 (с, 1Н), 8,52 (д, J=9 Гц, 1H), 8,47 (д, J= 9 Гц, 1H), 7,92 (т, J=8,2 Гц, 1H), 7,55 (c, 1H), 6,91 (c, 1H), 5,71 (д, J= 16 Гц, 1H), 5,28 (д, J=16 Гц, 1H), 4,39-3,98 (м, 2H), 3,75 (ушир. с, 1H, D2O обмениваемый), 1,99-1,79 (м, 2H), 1,32 (т, J=7 Гц, 3Н), 1,04 (т, J=7 Гц, 3Н); М.-с. (m/z): 438 (М+1), 407, 393, 364, 349, 319, 262, 118.
Пример 16Получение 12-нитро-5-этоксикамптотецина формулы 1, где R1=R2=R3=R5=H, R4=NO2, R6=Et Стадия 1. К смеси 12-нитрокамптотецина формулы 2, где R4=NO2, R1=R2=R3= R5= H (2 г), и хлорида железа (3) (2 г), растворенной в 150 мл этанола, добавляют по каплям 15 мл серной кислоты и греют при 85oС в течение 24 ч. Избыток кислоты и этанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает смолистое твердое вещество. Стадия 2. Очистка полученного выше остатка посредством колоночной хроматографии с использованием в качестве элюента смеси растворителей ацетон – хлороформ, дает 1,4 г желтоватого порошка, содержащего 12-нитро-5-этоксикамптотецин формулы 1 и 100 мг 12-нитро-5-гидроксикамптотецина формулы 13, где R4= NO2, R1=R2=R3=R5=H; т.пл. 250oС; ИК (КВr): 3450, 1750, 1666, 1618, 1525, 1357, 1154, 1042, 766 см-1; 1H ЯМР (CDCl3, 200 МГц):  8,49 (с, 1Н), 8,17 (д, J=9 Гц, 1H), 8,14 (д, J=9 Гц, 1H), 7,75 (т, J=8,2 Гц, 1H), 7,54 (c, 1H), 6,95 (c, 0,5H), 6,82 (c, 0,5H), 5,71 (д, J=16 Гц, 1H), 5,26 (д, J=16 Гц, 1H), 4,31-3,91 (м, 2Н), 3,75 (м, ушир. с, 1H, D2O обмениваемый), 2,05-1,81 (м, 2Н), 1,35 (1, J=7 Гц, 3Н), 1,05 (1, J=7 Гц, 3H); M.-c. (m/z): 438 (М+1), 420, 393, 376, 364, 349, 319, 84.
Пример 17 8,49 (с, 1Н), 8,17 (д, J=9 Гц, 1H), 8,14 (д, J=9 Гц, 1H), 7,75 (т, J=8,2 Гц, 1H), 7,54 (c, 1H), 6,95 (c, 0,5H), 6,82 (c, 0,5H), 5,71 (д, J=16 Гц, 1H), 5,26 (д, J=16 Гц, 1H), 4,31-3,91 (м, 2Н), 3,75 (м, ушир. с, 1H, D2O обмениваемый), 2,05-1,81 (м, 2Н), 1,35 (1, J=7 Гц, 3Н), 1,05 (1, J=7 Гц, 3H); M.-c. (m/z): 438 (М+1), 420, 393, 376, 364, 349, 319, 84.
Пример 17Получение 10-гидрокси-5-этоксикамптотецина (известное соединение) Стадия 1. К смеси 10-гидроксикамптотецина формулы 2, где R2=OH, R1=R3= R4= R5= H (200 мг) и хлорида железа (3) (200 мг), растворенной в 10 мл этанола, добавляют по каплям 1,5 мл серной кислоты и нагревают при 85oС в течение 24 ч. Избыток кислоты и этанола удаляют в вакууме, а остаток экстрагируют смесью 5% метанол – этилацетат. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает желтое твердое вещество. Стадия 2. Очистка полученного выше твердого вещества посредством колоночной хроматографии на силикагеле с использованием в качестве элюента смеси растворителей ацетон – хлороформ дает 100 мг 10-гидрокси-5-этоксикамптотецина формулы 1 и 20 мг 10,5-дигидроксикамптотецина формулы 13, где R2=OH, R1= R3= R4= R5=H; т.пл. 165oС; ИК (КВr): 3384, 1747, 1662, 1608, 1229, 1044, 831 см-1. 1H ЯМР (СDСl3+ДМСО, 200 МГц):  9,8 (1Н, ушир. с, D2O обмениваемый), 8,25 (с, 1Н), 8,05 (д, J=6 Гц, 1Н), 7,56-7,39 (м, 2Н), 7,25 (с, 1Н), 6,85 (с, 0,5Н), 6,70 (с, 0,5Н), 5,58 (д, J=16 Гц, 1H), 5,35 (д, J=16 Гц, 0,5H), 5,21 (д, J=16 Гц, 0,5Н), 4,35-3,75 (м, 4Н), 3,50 (ушир. с, 1H, D2O обмениваемый), 2,10-3,78 (м, 2Н), 1,22 (т, J=7 Гц, 3Н), 1,05 (т, J=7 Гц, 3Н); М.-с. (m/z): 409 (М+1), 392, 364, 349, 335, 320, 291, 235, 117, 84.
Пример 18 9,8 (1Н, ушир. с, D2O обмениваемый), 8,25 (с, 1Н), 8,05 (д, J=6 Гц, 1Н), 7,56-7,39 (м, 2Н), 7,25 (с, 1Н), 6,85 (с, 0,5Н), 6,70 (с, 0,5Н), 5,58 (д, J=16 Гц, 1H), 5,35 (д, J=16 Гц, 0,5H), 5,21 (д, J=16 Гц, 0,5Н), 4,35-3,75 (м, 4Н), 3,50 (ушир. с, 1H, D2O обмениваемый), 2,10-3,78 (м, 2Н), 1,22 (т, J=7 Гц, 3Н), 1,05 (т, J=7 Гц, 3Н); М.-с. (m/z): 409 (М+1), 392, 364, 349, 335, 320, 291, 235, 117, 84.
Пример 18Получение 10-гидрокси-7-этил-5-этоксикамптотецина (известное соединение) Стадия 1. К смеси 10-гидрокси-7-этилкамптотецина формулы 2, где R2=OH, R1=R3=R4=H, R5=Et (200 мг), и хлорида железа (3) (200 мг), растворенной в 10 мл этанола, добавляют по каплям 1,7 мл серной кислоты и нагревают при 80oС в течение 20 ч. Избыток кислоты и этанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает твердое вещество. Стадия 2. Очистка полученного выше твердого остатка посредством колоночной хроматографии на силикагеле с использованием в качестве элюента смеси растворителей ацетон – хлороформ дает 85 мг 10-гидрокси-7-этил-5-этоксикамптотецина в виде желтоватого порошка и 20 мг 10,5-дигидрокси-7-этилкамптотецина формулы 13, где R2= OH, R1=R3=R4=H, R5=Et; т.пл. 190oС; ИК (КВr): 3227, 1746, 1660, 1599, 1231, 1078, 800 см-1. 1Н ЯМР (СDСl3+ДМСО):  9,6 (ушир. с, 1Н, D2O обмениваемый), 8,01 (д, J=8,7 Гц, 1H), 7,51-7,35 (м, 3Н), 6,92 (с, 0,5Н), 6,80 (с, 0,5Н), 5,66 (д, J=16 Гц, 1H), 5,22 (д, J=16 Гц, 1H), 3,85-3,65 (м, 2Н), 3,35-2,95 (м, 2Н), 1,95-1,75 (м, 2Н), 1,37 (т, J= 7,4 Гц, 3Н), 1,17 (т, J=7,2 Гц, 3Н), 0,99 (т, J=7,4 Гц, 3Н); М.-с. (m/z): 437 (М=1), 392, 363, 348, 333, 291, 147, 84.
Пример 19 9,6 (ушир. с, 1Н, D2O обмениваемый), 8,01 (д, J=8,7 Гц, 1H), 7,51-7,35 (м, 3Н), 6,92 (с, 0,5Н), 6,80 (с, 0,5Н), 5,66 (д, J=16 Гц, 1H), 5,22 (д, J=16 Гц, 1H), 3,85-3,65 (м, 2Н), 3,35-2,95 (м, 2Н), 1,95-1,75 (м, 2Н), 1,37 (т, J= 7,4 Гц, 3Н), 1,17 (т, J=7,2 Гц, 3Н), 0,99 (т, J=7,4 Гц, 3Н); М.-с. (m/z): 437 (М=1), 392, 363, 348, 333, 291, 147, 84.
Пример 19Получение 9-амино-5-этоксикамптотецина формулы 1, где R1=NH2, R2=R3=R4= R5=H, R6=Et Стадия 1. К смеси 9-аминокамптотецина формулы 2, где R1=NH2, R2=R3=R4= R5= H (120 мг), и хлорида железа (3) (112 мг), растворенной в 10 мл этанола, добавляют по каплям 1,5 мл эфирата трифторида бора (BF3-Et2O) и греют при 80oС в течение 16 ч. Этанол удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия, и после выпаривания растворителя получают твердое вещество в виде густой смолы. Стадия 2. Очистка полученного выше остатка посредством колоночной хроматографии с использованием в качестве элюента смеси растворителей ацетон – хлороформ дает 65 мг 9-амино-5-этоксикамптотецина формулы 1; т.пл. 170oС; ИК: 3221, 1744, 1661, 1231, 1157, 1074, 815 см-1; 1H ЯМР (СDСl3+ДМСО-d6):  8,69 (с, 1H), 7,64 (c, 1H), 7,63-7,51 (м, 2Н), 7,06 (д, J=5,41 Гц, 1H), 6,90 (с, 0,5Н), 6,80 (с, 0,5Н), 5,65 (д, J=16 Гц, 1H), 5,26 (д, J=16 Гц, 1H), 4,19-3,98 (м, 1H), 3,97-3,78 (м, 1H), 2,98 (ушир. с, 3Н, D2O обмениваемый), 1,95-1,80 (м, 2Н), 1,39-1,19 (м, 3Н), 1,11-0,95 (м, 3Н); М.-с. (m/z): 407 (М+2), 389, 363, 334, 319, 290, 262, 233, 101.
Пример 20 8,69 (с, 1H), 7,64 (c, 1H), 7,63-7,51 (м, 2Н), 7,06 (д, J=5,41 Гц, 1H), 6,90 (с, 0,5Н), 6,80 (с, 0,5Н), 5,65 (д, J=16 Гц, 1H), 5,26 (д, J=16 Гц, 1H), 4,19-3,98 (м, 1H), 3,97-3,78 (м, 1H), 2,98 (ушир. с, 3Н, D2O обмениваемый), 1,95-1,80 (м, 2Н), 1,39-1,19 (м, 3Н), 1,11-0,95 (м, 3Н); М.-с. (m/z): 407 (М+2), 389, 363, 334, 319, 290, 262, 233, 101.
Пример 20Получение 9-амино-5-метоксикамптотецина формулы 1, где R1=NH2, R2=R3=R4= R5=H, R6=Me Стадия 1. К смеси 9-аминокамптотецина формулы 2, где R1=R2=R3=R4=R5=H (180 мг), и хлорида железа (3) (162 мг), растворенной в 15 мл метанола, добавляют по каплям 2 мл эфирата трифторида бора (ВF3-Еt2О) и греют при 80oС в течение 16 ч. Метанол удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия, и после выпаривания растворителя получают твердое вещество в виде густой смолы. Стадия 2. Очистка полученного выше остатка посредством колоночной хроматографии с использованием в качестве элюента смеси растворителей ацетон – хлороформ дает 125 мг 9-амино-5-метоксикамптотецина формулы 1; т.пл. 200oС; ИК: 3364, 2925, 1744, 1660, 1610, 1156, 1081, 811 см-1; 1H ЯМР (СDСl3+ДМСО-d6):  8,82 (с, 1H), 7,60 (c, 1H), 7,63-7,46 (м, 2Н), 6,97 (д, J=7 Гц, 1H), 6,89 (с, 0,5Н), 6,80 (с, 0,5Н), 5,6 (д, J=16 Гц, 1H), 5,25 (д, J=16 Гц, 1H), 3,57 (с, 1,5Н), 3,46 (с, 1,5Н), 3,41 (ушир. с, 1H, D2O обмениваемый), 3,15 (ушир. с, 2Н, D2O обмениваемый), 2,05-1,89 (м, 2Н), 1,01 (т, J=7 Гц, 3Н); М. -с. (m/z): 393 (М+1), 376, 363, 349, 334, 319, 290, 262, 233, 205, 116.
Пример 21 8,82 (с, 1H), 7,60 (c, 1H), 7,63-7,46 (м, 2Н), 6,97 (д, J=7 Гц, 1H), 6,89 (с, 0,5Н), 6,80 (с, 0,5Н), 5,6 (д, J=16 Гц, 1H), 5,25 (д, J=16 Гц, 1H), 3,57 (с, 1,5Н), 3,46 (с, 1,5Н), 3,41 (ушир. с, 1H, D2O обмениваемый), 3,15 (ушир. с, 2Н, D2O обмениваемый), 2,05-1,89 (м, 2Н), 1,01 (т, J=7 Гц, 3Н); М. -с. (m/z): 393 (М+1), 376, 363, 349, 334, 319, 290, 262, 233, 205, 116.
Пример 21Получение 9-нитро-5-гидроксикамптотецина формулы 13, где R1=NO2, R2=R3= R4=R5=H Стадия 1. Сначала получают 9-нитро-5-этоксикамптотецин формулы 1, где R1=NO2, R2=R3=R4=R5=H, R6=Et, как описано в примере 15. Стадия 2. Добавляют 80 мл 50% НСl к 1,0 г 9-нитро-5-этоксикамптотецина формулы 1, где R1=NO2, R2=R3=R4=R5=H, и R6=Et, растворенного в 20 мл этанола, и кипятят с обратным холодильником в течение 30 ч. По окончании нагревания избыток воды и этанола удаляют в виде азеотропной смеси, а остаток экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над безв. сульфатом натрия. После выпаривания растворителя и очистки с помощью колоночной хроматографии на силикагеле получают 700 мг 9-нитро-5-гидроксикамптотецина формулы 13; т. пл. 278oС; ИК (КВr): 3402, 1744, 1657, 1602, 1533, 1155, 1051, 833 см-1; 1Н ЯМР (СDСl3+ДМСО, 200 МГц):  9,28 (с, 1Н), 8,50 (д, J=8,6 Гц, 1Н), 8,45 (д, J=8,6 Гц, 1H), 7,96 (т, J=8,2 Гц, 1H), 7,59 (c, 0,5Н), 7,58 (с, 0,5Н), 7,12 (с, 0,5Н), 7,08 (с, 0,5Н), 5,67 (д, J=16 Гц, 1H), 5,27 (д, J=16 Гц, 1H), 1,92 (кв, J=7,2 Гц, 2H), 1,07 (т, J=7 Гц, 3H).
Пример 22 9,28 (с, 1Н), 8,50 (д, J=8,6 Гц, 1Н), 8,45 (д, J=8,6 Гц, 1H), 7,96 (т, J=8,2 Гц, 1H), 7,59 (c, 0,5Н), 7,58 (с, 0,5Н), 7,12 (с, 0,5Н), 7,08 (с, 0,5Н), 5,67 (д, J=16 Гц, 1H), 5,27 (д, J=16 Гц, 1H), 1,92 (кв, J=7,2 Гц, 2H), 1,07 (т, J=7 Гц, 3H).
Пример 22Получение 10,5-дигидроксикамптотецина (известное соединение) Стадия 1. Сначала получают 10-гидрокси-5-этоксикамптотецин формулы 1, где R2=OH, R1=R3=R4=R5=H, и R6=Et, так, как описано в примере 17. Стадия 2. Добавляют 10 мл 50% НСl к 250 мг 10-гидрокси-5-этоксикамптотецина формулы 1, где R2=OH, R1=R3=R4=R5=H, и R6=Et, растворенного в 10 мл этанола, и кипятят с обратным холодильником в течение 20 ч. По окончании нагревания избыток воды и этанола удаляют в виде азеотропной смеси, а остаток экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над безв. сульфатом натрия. После выпаривания растворителя и очистки с помощью колоночной хроматографии на силикагеле получают 210 мг 10, 5-дигидроксикамптотецина (13); т. пл. 240oС; ИК (КВr): 3226, 1743, 1659, 1596, 1382, 1231, 1048, 832 см-1. 1H ЯМР (СDСl3+ДМСО):  10,0 (ушир. с, 1Н, D2O обмениваемый), 8,31 (с, 0,5Н), 8,29 (с, 0,5Н), 8,05 (д, J=6 Гц, 0,5H), 7,95 (д, J=6 Гц, 0,5Н), 7,95 (д, J=6 Гц, 0,5Н), 7,50-7,31 (м, 2Н), 7,21 (с, 1Н), 6,95 (с, 0,5Н), 6,85 (с, 0,5Н), 5,55 (д, J=16 Гц, 1Н), 5,25 (д, J=16 Гц, 1Н), 3,99 (ушир. с, 1Н, D2О обмениваемый), 2,05-1,81 (м, 2Н), 1,0 (т, J=7 Гц, 3Н); М.-с. (m/z): 381 (М+1), 352, 336, 320, 264, 149, 83.
Пример 23 10,0 (ушир. с, 1Н, D2O обмениваемый), 8,31 (с, 0,5Н), 8,29 (с, 0,5Н), 8,05 (д, J=6 Гц, 0,5H), 7,95 (д, J=6 Гц, 0,5Н), 7,95 (д, J=6 Гц, 0,5Н), 7,50-7,31 (м, 2Н), 7,21 (с, 1Н), 6,95 (с, 0,5Н), 6,85 (с, 0,5Н), 5,55 (д, J=16 Гц, 1Н), 5,25 (д, J=16 Гц, 1Н), 3,99 (ушир. с, 1Н, D2О обмениваемый), 2,05-1,81 (м, 2Н), 1,0 (т, J=7 Гц, 3Н); М.-с. (m/z): 381 (М+1), 352, 336, 320, 264, 149, 83.
Пример 23Получение 12-нитро-5-гидроксикамптотецина формулы 13, где R1=R2=R3=R5=H, R4=NO2 Стадия 1. Сначала получают 12-нитро-5-этоксикамптотецин формулы 1, где R4=NO2, R1=R2=RЗ=R5=H, R6=Et, как описано в примере 16. Стадия 2. Добавляют 125 мл 50% HCl к 2 г 12-нитро-5-этоксикамптотецина формулы 1, где R4=NO2, R1=R2=R3=R5=H, и R6=Et, растворенного в 30 мл этанола, и кипятят с обратным холодильником в течение 24 ч. По окончании нагревания избыток воды и этанола удаляют в виде азеотропной смеси, а остаток экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над безв. сульфатом натрия. После выпаривания растворителя и очистки с помощью колоночной хроматографии на силикагеле получают 1,5 г 12-нитро-5-гидроксикамптотецина формулы 13; т. пл. 247oС; ИК (КВr): 3371, 1746, 1664, 1602, 1532, 1380, 1048, 829 см-1; 1H ЯМР (CDCl3, 200 МГц):  8,58 (с, 1Н), 8,17 (д, J=9 Гц, 1H), 8,12 (д, J=9 Гц, 1H), 7,74 (т, J=8,2 Гц, 1H), 7,58 (c, 1H), 7,12 (с, 0,5Н), 7,08 (с, 0,5Н), 5,71 (д, J=16 Гц, 1H), 5,26 (д, J=16 Гц, 1H), 3,90 (ушир. с, 1H, D2O обмениваемый), 1,99-1,85 (м, 2Н), 1,05 (т, J=7 Гц, 3Н); М.-с. (m/z): 409 (М+1), 393, 380, 363, 348, 333, 318, 149, 85.
Пример 24 8,58 (с, 1Н), 8,17 (д, J=9 Гц, 1H), 8,12 (д, J=9 Гц, 1H), 7,74 (т, J=8,2 Гц, 1H), 7,58 (c, 1H), 7,12 (с, 0,5Н), 7,08 (с, 0,5Н), 5,71 (д, J=16 Гц, 1H), 5,26 (д, J=16 Гц, 1H), 3,90 (ушир. с, 1H, D2O обмениваемый), 1,99-1,85 (м, 2Н), 1,05 (т, J=7 Гц, 3Н); М.-с. (m/z): 409 (М+1), 393, 380, 363, 348, 333, 318, 149, 85.
Пример 24Получение 5-(2′-хлорэтокси)камптотецина формулы 1, где R1=R2=R3=R4=R5=H, R6=CH2CH2Cl Стадия 1. К смеси 20(S)-камптотецина формулы 3 (1 г) и хлорида железа (3) (1 г), растворенной в 25 мл 2-хлорэтанола, добавляют по каплям 5 мл серной кислоты и нагревают при 90oС в течение 24 ч. Избыток кислоты и 2-хлорэтанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает 1,2 г коричневатого твердого вещества. Стадия 2. Полученную выше смесь разделяют посредством колоночной хроматографии и получают 650 мг 5-(2′-хлорэтокси)камптотецина формулы 1 и 150 мг полученного ранее 5-гидроксикамптотецина формулы 13, где Rl=R2=R3=R4=R5=H; т. пл. 202oС; [  ]D при 28oС = +5,37 (с 0,093, СНСl3); ИК: 3354, 1744, 1662, 1622, 1223, 1160, 1090, 1044, 752, 663 см-1; частичные данные 1H ЯМР в CDCl3: ]D при 28oС = +5,37 (с 0,093, СНСl3); ИК: 3354, 1744, 1662, 1622, 1223, 1160, 1090, 1044, 752, 663 см-1; частичные данные 1H ЯМР в CDCl3:  6,92 (с, 0,5Н), 6,82 (с, 0,5Н), 4,51 (т, J=5 Гц, 1,5H), 4,38 (т, J= 5 Гц, 1,5H), 3,75 (с, 1Н, D2О обмениваемый), 3,85-3,58 (м, 2Н), 2,00-1,78 (м, 2Н), 1,06 (т, J=7,5 Гц, 3Н); M.-c. (m/z): 426 (М+1), 391, 377, 363, 348, 319, 105, 84, 51.
Пример 25 6,92 (с, 0,5Н), 6,82 (с, 0,5Н), 4,51 (т, J=5 Гц, 1,5H), 4,38 (т, J= 5 Гц, 1,5H), 3,75 (с, 1Н, D2О обмениваемый), 3,85-3,58 (м, 2Н), 2,00-1,78 (м, 2Н), 1,06 (т, J=7,5 Гц, 3Н); M.-c. (m/z): 426 (М+1), 391, 377, 363, 348, 319, 105, 84, 51.
Пример 25Получение 5-трифторэтоксикамптотецина формулы 1, где R1=R2=R3=R4=R5=H, R6=CH2CF3 Стадия 1. К смеси 20(S)-камптотецина формулы 3 (0,5 г) и хлорида железа (3) (0,5 г), растворенной в 18 мл 2,2,2-трифторэтанола, добавляют по каплям серную кислоту и нагревают при 80oС в течение 24 ч. Избыток кислоты и трифторэтанола удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает 600 мг твердого вещества. Стадия 2. Полученное выше твердое вещество очищают посредством колоночной хроматографии и получают 250 мг 5-трифторэтоксикамптотецина формулы 1 и 150 мг полученного ранее 5-гидроксикамптотецина формулы 13; т.пл. 188oС; ИК: 3438, 1748, 1667, 1620, 1160, 1106, 1003 см-1; частичные данные 1H ЯМР в СDСl3:  6,84 (с, 0,5Н), 6,75 (с, 0,5Н), 5,21-4,90 (м, 1Н), 4,60-4,38 (м, 2Н), 3,70 (с, 1Н, D2О обмениваемый), 2,0-1,79 (м, 2Н), 1,15-0,99 (м, 3Н); М. -с. (m/z): 447 (М+1), 378, 348, 304, 111, 69.
Пример 26 6,84 (с, 0,5Н), 6,75 (с, 0,5Н), 5,21-4,90 (м, 1Н), 4,60-4,38 (м, 2Н), 3,70 (с, 1Н, D2О обмениваемый), 2,0-1,79 (м, 2Н), 1,15-0,99 (м, 3Н); М. -с. (m/z): 447 (М+1), 378, 348, 304, 111, 69.
Пример 26Получение 5-(2′-гидроксиэтокси)камптотецина формулы 1, где 1=R2=R3=R4= R5=H, R6=CH2CH2OH Стадия 1. К смеси 20(S)-камптотецина формулы 3 (1 г) и хлорида железа (3) (1 г), растворенной в 10 мл этиленгликоля, добавляют по каплям 5 мл серной кислоты и нагревают при 70oС в течение 36 ч. Избыток кислоты и этиленгликоля удаляют в вакууме, а остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает 1,1 г желтоватого порошка. Стадия 2. Полученное выше твердое вещество подвергают очистке колоночной хроматографией с использованием смеси растворителей этилацетат – гексан и получают 700 мг 5-(2′-гидроксиэтокси)камптотецина формулы 1 и 200 мг полученного ранее 5-гидроксикамптотецина формулы 13, где R1=R2=R3=R4=R5=H; т.пл. 190oС; [  ]D при 26oС = +28,30 (с 0,106, СНСl3); ИК: 3300, 3285, 1745, 1665, 1620, 1605, 1227, 1160, 1112, 1047 см-1; частичные данные 1H ЯМР в СDСl3: ]D при 26oС = +28,30 (с 0,106, СНСl3); ИК: 3300, 3285, 1745, 1665, 1620, 1605, 1227, 1160, 1112, 1047 см-1; частичные данные 1H ЯМР в СDСl3:  7,01 (с, 0,5Н), 6,92 (с, 0,5Н), 4,30-3,71 (м, 4Н), 3,75 (ушир. с, 2Н, D2О обмениваемый), 2,0-1,79 (м, 2Н), 1,15-0,95 (м, 3Н); М.-с. (m/z): 408 (М+1), 390, 378, 364, 348, 319, 101, 76.
Пример 27 7,01 (с, 0,5Н), 6,92 (с, 0,5Н), 4,30-3,71 (м, 4Н), 3,75 (ушир. с, 2Н, D2О обмениваемый), 2,0-1,79 (м, 2Н), 1,15-0,95 (м, 3Н); М.-с. (m/z): 408 (М+1), 390, 378, 364, 348, 319, 101, 76.
Пример 27Получение 10-гидрокси-5-трифторэтоксикамптотецина формулы 1, где R1=R3= R4=R5=H, R2=OH, R6=CH2CF3 Стадия 1. Сначала получают 10,5-дигидроксикамптотецин формулы 13, где R1=R3=R4=R5=H, R2=OH, как описано в примере 22. Стадия 2. Смесь 10,5-дигидроксикамптотецина формулы 13, где R2=OH, R1= R3= R4= R5=H (200 мг), и трифторэтанола (200 мг) суспендируют в 50 мл дихлорэтана и кипятят с обратным холодильником в присутствии серной кислоты (0,5 мл) в течение 18 ч. Реакционную смесь упаривают досуха и остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает маслянистый остаток, который очищают на колонке с силикагелем с использованием в качестве элюента смеси ацетон – хлороформ, и получают 140 мг 10-гидрокси-5-трифторэтоксикамптотецина формулы 1 в виде твердого вещества; т.пл. 237oС; ИК: 3420, 1748, 1664, 1605, 1159 см-1; 1H ЯМР (ДМСО-d6):  10,48 (с, 1H, D2O обмениваемый), 8,45 (с, 1Н), 8,04 (д, J=9 Гц, 1H), 7,47 (д, J=9 Гц, 1H), 7,40 (с, 1H), 7,18 (с, 1H), 7,11 (с, 0,5Н), 7,06 (с, 0,5Н), 6,58 (с, 1Н, D2O обмениваемый), 5,41 (с, 2Н), 5,05-4,55 (м, 2Н), 2,05-1,75 (м, 2Н), 1,00-0,8 (м, 3Н); 13С ЯМР (ДМСО-d6): 10,48 (с, 1H, D2O обмениваемый), 8,45 (с, 1Н), 8,04 (д, J=9 Гц, 1H), 7,47 (д, J=9 Гц, 1H), 7,40 (с, 1H), 7,18 (с, 1H), 7,11 (с, 0,5Н), 7,06 (с, 0,5Н), 6,58 (с, 1Н, D2O обмениваемый), 5,41 (с, 2Н), 5,05-4,55 (м, 2Н), 2,05-1,75 (м, 2Н), 1,00-0,8 (м, 3Н); 13С ЯМР (ДМСО-d6):  172,4, 161,0, 157,7, 157,1, 151,2, 147,5, 144,3, 143,7, 131,0, 130,8, 129,8, 129,1, 124,0, 121,4, 120,7, 109,6, 96,6, 89,7, 72,3, 65,1, 30,4, 7,8; M.-c. (m/z): 462 (М+1), 418, 364, 320, 291, 263.
Пример 28 172,4, 161,0, 157,7, 157,1, 151,2, 147,5, 144,3, 143,7, 131,0, 130,8, 129,8, 129,1, 124,0, 121,4, 120,7, 109,6, 96,6, 89,7, 72,3, 65,1, 30,4, 7,8; M.-c. (m/z): 462 (М+1), 418, 364, 320, 291, 263.
Пример 28Получение 9-нитро-5-трифторэтоксикамптотецина формулы 1, где R2=R3=R4= R5=H, R1=NO2, R6=CH2CF3. Стадия 1. Сначала получают 9-нитро-5-гидроксикамптотецин формулы 13, где R2=R3=R4=R5=H, R1=NO2, как описано в примере 21. Стадия 2. Смесь 9-нитро-5-гидроксикамптотецина формулы 13, где R1=NO2, R2=R3=R4=R5=H (100 мг), и трифторэтанола (0,5 мл) суспендируют в 25 мл дихлорэтана и кипятят с обратным холодильником в присутствии серной кислоты (0,3 мл) в течение 18 ч. Реакционную смесь упаривают досуха и остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает маслянистый остаток, который очищают на колонке с силикагелем с использованием в качестве элюента смеси ацетон – хлороформ, и получают 60 мг 9-нитро-5-трифторэтоксикамптотецина формулы 1 в виде твердого вещества; т.пл. 210oС; ИК: 3457, 1745, 1665, 1623, 1527, 1154, 1000 см-1; 1H ЯМР (CDCl3):  9,30 (с, 1Н), 8,53 (д, J=8,6 Гц, 1H), 8,49 (д, J=8,6 Гц, 1H), 7,94 (т, J=8 Гц, 1H), 7,62 (c, 0,5Н), 7,60 (с, 0,5Н), 6,87 (с, 0,5Н), 6,81 (с, 0,5Н), 5,69 (д, J=16 Гц, 1H), 5,29 (д, J= 16 Гц, 1H), 4,97 (м, 1H), 4,52 (м, 1H), 3,90 (ушир. с, 1H, D2O обмениваемый), 1,90 (м, 2Н), 1,05 (т, J=7 Гц, 3Н); М.-с. (m/z): 491 (М+1), 461, 446, 418, 393, 364, 349, 319, 290, 216.
Пример 29 9,30 (с, 1Н), 8,53 (д, J=8,6 Гц, 1H), 8,49 (д, J=8,6 Гц, 1H), 7,94 (т, J=8 Гц, 1H), 7,62 (c, 0,5Н), 7,60 (с, 0,5Н), 6,87 (с, 0,5Н), 6,81 (с, 0,5Н), 5,69 (д, J=16 Гц, 1H), 5,29 (д, J= 16 Гц, 1H), 4,97 (м, 1H), 4,52 (м, 1H), 3,90 (ушир. с, 1H, D2O обмениваемый), 1,90 (м, 2Н), 1,05 (т, J=7 Гц, 3Н); М.-с. (m/z): 491 (М+1), 461, 446, 418, 393, 364, 349, 319, 290, 216.
Пример 29Получение 5-(2′-фторэтокси)камптотецина формулы 1, где R1=R2=R3=R4=R5=H, R6=CH2CH2F. Стадия 1. Сначала получают 5-гидроксикамптотецин формулы 13, где R1=R2= R3=R4=R5=H, как описано в примере 2. Стадия 2. Смесь 5-гидроксикамптотецина формулы 13, где R1=R2=R3=R4=R5=H (200 мг), и 2-фторэтанола (2 мл) суспендируют в 30 мл дихлорэтана и кипятят с обратным холодильником в присутствии серной кислоты (0,3 мл) в течение 18 ч. Реакционную смесь упаривают досуха и остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает маслянистый остаток, который очищают на колонке с силикагелем с использованием в качестве элюента смеси ацетон – хлороформ, и получают 130 мг 5-(2′-фторэтокси)камптотецина формулы 1 в виде твердого вещества; т.пл. 174oС; ИК: 1745, 1664, 1615, 1160, 1040, 752 см-1; 1H ЯМР (СDСl3+ДМСО-d6):  8,46 (с, 1Н), 8,20 (д, J=8 Гц, 1H), 7,95 (д, J=8 Гц, 1H), 7,83 (т, J=6,8 Гц, 1Н), 7,65-7,55 (м, 2Н), 6,86 (с, 0,5Н), 6,78 (с, 0,5Н), 5,68 (д, J=16,5 Гц, 1H), 5,26 (д, J=16,5 Гц, 1H), 4,90-4,20 (м, 4Н), 4,44 (с, 1H, D2O обмениваемый), 2,05-1,85 (м, 2Н), 1,12-0,95 (м, 3Н); М.-с. (m/z): 410 (М+1), 365, 348, 319, 304.
Пример 30 8,46 (с, 1Н), 8,20 (д, J=8 Гц, 1H), 7,95 (д, J=8 Гц, 1H), 7,83 (т, J=6,8 Гц, 1Н), 7,65-7,55 (м, 2Н), 6,86 (с, 0,5Н), 6,78 (с, 0,5Н), 5,68 (д, J=16,5 Гц, 1H), 5,26 (д, J=16,5 Гц, 1H), 4,90-4,20 (м, 4Н), 4,44 (с, 1H, D2O обмениваемый), 2,05-1,85 (м, 2Н), 1,12-0,95 (м, 3Н); М.-с. (m/z): 410 (М+1), 365, 348, 319, 304.
Пример 30Получение 10-гидрокси-5-(2′-фторэтокси) камптотецина формулы 1, где R1= R3=R4=R5=H, R2=OH, R6=CH2CH2F. Стадия 1. Сначала получают 10,5-дигидроксикамптотецин формулы 13, где R1=R3=R4=R5=H, R2=OH, как описано в примере 22. Стадия 2. Смесь 10,5-дигидроксикамптотецина формулы 13, где R2=OH, R1= R3=R4=R5=H (100 мг), и 2-фторэтанола (2 мл) суспендируют в 25 мл дихлорэтана и кипятят с обратным холодильником в присутствии серной кислоты (0,2 мл) в течение 16 ч. Реакционную смесь упаривают досуха, и остаток экстрагируют этилацетатом. Органический слой промывают водой, рассолом и сушат над безв. сульфатом натрия. Выпаривание растворителя дает маслянистый остаток, который очищают на колонке с силикагелем с использованием в качестве элюента смеси ацетон – хлороформ, и получают 60 мг 10-гидрокси-5-фторэтоксикамптотецина формулы 1 в виде твердого вещества; т.пл. 258-260oС; ИК: 3225, 1748, 1660, 1593, 1159 см-1; 1H ЯМР (СDСl3+ДМСО-d6):  10,0 (ушир. с, 1Н, D2O обмениваемый), 8,31 (с, 1Н), 8,00 (д, J=6 Гц, 1Н), 7,80 (с, 1Н), 7,45 (д, J=6 Гц, 1H), 7,40 (с, 1H), 6,85 (с, 0,5Н), 6,80 (с, 0,5Н), 6,15 (с, 1H, D2O обмениваемый), 5,55 (д, J=16 Гц, 1H), 5,23 (д, J=16 Гц, 1H), 4,85-4,20 (м, 4Н), 2,05-1,81 (м, 2Н), 1,0 (т, J=7 Гц, 3Н); М.-с. (m/z): 426 (М+1), 382, 364, 320.
Пример 31 10,0 (ушир. с, 1Н, D2O обмениваемый), 8,31 (с, 1Н), 8,00 (д, J=6 Гц, 1Н), 7,80 (с, 1Н), 7,45 (д, J=6 Гц, 1H), 7,40 (с, 1H), 6,85 (с, 0,5Н), 6,80 (с, 0,5Н), 6,15 (с, 1H, D2O обмениваемый), 5,55 (д, J=16 Гц, 1H), 5,23 (д, J=16 Гц, 1H), 4,85-4,20 (м, 4Н), 2,05-1,81 (м, 2Н), 1,0 (т, J=7 Гц, 3Н); М.-с. (m/z): 426 (М+1), 382, 364, 320.
Пример 31Получение 5-(2′-фторэтокси)-7-этилкамптотецина Стадия 1. Сначала получают 5-гидрокси-7-этилкамптотецин формулы 13, где R1=R2=R3=R4=H, R5=Et, как описано в примере 4. Стадия 2. К смеси 80 мг 5-гидрокси-7-этилкамптотецина и 0,1 мл п-толуолсульфоновой кислоты, суспендированной в 12 мл бензола, добавляют 20 мг 2-фторэтанола и смесь кипятят с обратным холодильником в течение 14 ч. Реакцию гасят каплей пиридина и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, раствором NаНСО3, рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат – хлороформ и получают 60 мг 5-(2′-фторэтокси)-7-этилкамптотецина; т. пл. 112oС; ИК: 3070, 1748, 1665, 1605, 1456, 1155, 1038, 767 см-1; 1Н ЯМР (CDCl3):  8,21 (д, J=9,2 Гц, 1H), 8,17 (д, J=9,2 Гц, 1H), 7,82 (т, J=7,4 Гц, 1H), 7,67 (т, J=7,4 Гц, 1H), 7,57 (с, 0,5Н), 7,54 (с, 0,5Н), 7,00 (с, 0,5Н), 6,89 (с, 0,5Н), 5,69 (д, J=16 Гц, 1H), 5,27 (д, J=16 Гц, 1H), 4,81-4,12 (м, 4Н), 3,51-3,15 (м, 2Н), 1,93 (м, 2Н), 1,45 (т, J=7 Гц, 3Н), 1,05 (м, 3Н); М.-с. (m/z): 438 (М+1), 420, 406, 376, 347, 332, 317, 245, 91.
Пример 32 8,21 (д, J=9,2 Гц, 1H), 8,17 (д, J=9,2 Гц, 1H), 7,82 (т, J=7,4 Гц, 1H), 7,67 (т, J=7,4 Гц, 1H), 7,57 (с, 0,5Н), 7,54 (с, 0,5Н), 7,00 (с, 0,5Н), 6,89 (с, 0,5Н), 5,69 (д, J=16 Гц, 1H), 5,27 (д, J=16 Гц, 1H), 4,81-4,12 (м, 4Н), 3,51-3,15 (м, 2Н), 1,93 (м, 2Н), 1,45 (т, J=7 Гц, 3Н), 1,05 (м, 3Н); М.-с. (m/z): 438 (М+1), 420, 406, 376, 347, 332, 317, 245, 91.
Пример 32Получение 5-(2′-гидроксиэтокси)-7-этилкамптотецина Стадия 1. Сначала получают 5-гидрокси-7-этилкамптотецин формулы 13, где R1=R2=R3=R4=H, R5=Et, как описано в примере 4. Стадия 2. К смеси 250 мг 5-гидрокси-7-этилкамптотецина и 10 мкл конц. серной кислоты, суспендированной в 25 мл дихлорэтана, добавляют 0,5 мл этиленгликоля и смесь кипятят с обратным холодильником в течение 14 ч. Реакцию гасят каплей пиридина и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат – хлороформ и получают 180 мг 5-(2′-гидроксиэтокси)-7-этилкамптотецина и 25 мг исходного вещества. 1H ЯМР (СDСl3, 200 МГц):  8,20 (д, J=8 Гц, 1H), 8,15 (д, J=8 Гц, 1H), 7,85 (т, J=6,8 Гц, 1H), 7,69 (т, 7,3 Гц, 1H), 7,56 (с, 0,5Н), 7,54 (с, 0,5Н), 7,11 (с, 0,5Н), 6,99 (с, 0,5Н), 5,72 (д, J=16,5 Гц, 1H), 5,28 (д, J=16,5 Гц, 0,5Н), 5,26 (д, J=16,5 Гц, 0,5Н), 3,95-3,65 (м, 4Н), 3,78 (ушир. с, 2Н, D2O обмениваемый), 3,5-3,18 (м, 2Н), 1,95-1,81 (м, 2Н), 1,45 (т, J=7,5 Гц, 3Н), 1,06 (м, 3Н).
Пример 33 8,20 (д, J=8 Гц, 1H), 8,15 (д, J=8 Гц, 1H), 7,85 (т, J=6,8 Гц, 1H), 7,69 (т, 7,3 Гц, 1H), 7,56 (с, 0,5Н), 7,54 (с, 0,5Н), 7,11 (с, 0,5Н), 6,99 (с, 0,5Н), 5,72 (д, J=16,5 Гц, 1H), 5,28 (д, J=16,5 Гц, 0,5Н), 5,26 (д, J=16,5 Гц, 0,5Н), 3,95-3,65 (м, 4Н), 3,78 (ушир. с, 2Н, D2O обмениваемый), 3,5-3,18 (м, 2Н), 1,95-1,81 (м, 2Н), 1,45 (т, J=7,5 Гц, 3Н), 1,06 (м, 3Н).
Пример 33Получение 5-(2′-гидроксиэтокси)-10-гидроксикамптотецина Стадия 1. Сначала получают 10,5-дигидроксикамптотецин формулы 13, где R1=R3=R4=R5=H, R2=OH, как описано в примере 22. Стадия 2. К смеси 60 мг 10,5-дигидроксикамптотецина и 5 мг п-толуолсульфоновой кислоты, суспендированной в 10 мл дихлорэтана, добавляют 25 мг этиленгликоля и смесь кипятят с обратным холодильником в течение 16 ч. Реакцию гасят каплей пиридина и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси метанол – хлороформ и получают 40 мг 5-(2′-гидроксиэтокси)-10-гидроксикамптотецина и 10 мг исходного вещества. ИК: 3070, 1760, 1660, 1600, 1558, 1509, 1384, 1160, 1047, 832 см-1. 1H ЯМР (СDСl3+ДМСО):  10,05 (ушир, 1Н D2O обмениваемый), 8,35 (с, 1Н), 8,05 (д, J=9 Гц, 1H), 7,75 (с, 1H), 7,45 (д, J= 9 Гц, 1H), 7,28 (с, 1H), 6,95 (с, 0,5Н), 6,85 (с, 0,5Н), 5,65 (д, J= 16 Гц, 1H), 5,25 (д, J=16 Гц, 1H), 4,11 (м, 2Н), 3,78 (м, 2Н), 4,05 (ушир. с, 1H, D2O обмениваемый), 1,98 (м, 2Н), 1,05 (т, J=7 Гц, 3Н); М. -с. (m/z): 425, 408, 380, 364, 336, 320, 305, 264, 235, 147, 105.
Пример 34 10,05 (ушир, 1Н D2O обмениваемый), 8,35 (с, 1Н), 8,05 (д, J=9 Гц, 1H), 7,75 (с, 1H), 7,45 (д, J= 9 Гц, 1H), 7,28 (с, 1H), 6,95 (с, 0,5Н), 6,85 (с, 0,5Н), 5,65 (д, J= 16 Гц, 1H), 5,25 (д, J=16 Гц, 1H), 4,11 (м, 2Н), 3,78 (м, 2Н), 4,05 (ушир. с, 1H, D2O обмениваемый), 1,98 (м, 2Н), 1,05 (т, J=7 Гц, 3Н); М. -с. (m/z): 425, 408, 380, 364, 336, 320, 305, 264, 235, 147, 105.
Пример 34Получение 5,10-дигидрокси-7-этилкамптотецина Стадия 1. Сначала получают 5-этокси-10-гидрокси-7-этилкамптотецин формулы 1, где R1=R3=R4=H, R5=R6=Et, R2=OH, как описано в примере 18. Стадия 2. Добавляют 12 мл 25% HCl к 200 мг 5-этокси-10-гидрокси-7-этилкамптотецина, растворенного в 10 мл этанола, и кипятят с обратным холодильником в течение 24 ч. Избыток кислоты и этанола отгоняют, а остальное разбавляют этилацетатом. Органический слой промывают 5% раствором NaHCO3 и рассолом. Выпаривание растворителя и очистка твердого вещества на колонке с силикагелем с использованием в качестве элюента смеси ацетон – хлороформ дают 105 мг 5, 10-дигидрокси-7-этилкамптотецина; т.пл. 197oС; ИК: 3268, 2975, 1748, 1656, 1597, 1514, 1230, 1161, 1052, 841 см-1; 1H ЯМР (СDСl3+ДМСО):  10,0 (ушир. с, 1Н, D2O обмениваемый), 8,05 (д, J=9 Гц, 1H), 7,76 (с, 2Н), 7,42 (м, 1H), 7,04 (с, 0,5Н), 6,98 (с, 0,5Н), 5,65 (д, J=16 Гц, 1H), 5,23 (д, J= 16 Гц, 1H), 3,51 (ушир. с, 1H, D2O обмениваемый), 3,45-3,12 (м, 2Н), 1,94 (м, 2Н), 1,42 (т, J=7 Гц, 3Н), 1,01 (т, J=7 Гц, 3Н); М.-с. (m/z): 408 (М+1), 379, 364, 347, 335, 285, 169, 119, 101, 83.
Пример 35 10,0 (ушир. с, 1Н, D2O обмениваемый), 8,05 (д, J=9 Гц, 1H), 7,76 (с, 2Н), 7,42 (м, 1H), 7,04 (с, 0,5Н), 6,98 (с, 0,5Н), 5,65 (д, J=16 Гц, 1H), 5,23 (д, J= 16 Гц, 1H), 3,51 (ушир. с, 1H, D2O обмениваемый), 3,45-3,12 (м, 2Н), 1,94 (м, 2Н), 1,42 (т, J=7 Гц, 3Н), 1,01 (т, J=7 Гц, 3Н); М.-с. (m/z): 408 (М+1), 379, 364, 347, 335, 285, 169, 119, 101, 83.
Пример 35Получение 5-(2′-гидроксиэтокси)-10-гидрокси-7-этилкамптотецина Стадия 1. Сначала получают 7-этил-5,10-дигидроксикамптотецин формулы 13, где R1=R3=R4=H, R2=OH, R5=Et, как описано в примере 34. Стадия 2. К смеси 100 мг 10,5-дигидрокси-7-этилкамптотецина и 5 мг п-толуолсульфоновой кислоты, суспендированной в 10 мл дихлорэтана, добавляют 50 мг этиленгликоля и смесь кипятят с обратным холодильником в течение 16 ч. Реакцию гасят каплей пиридина, и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси метанол – хлороформ, и получают 60 мг 5-(2′-гидроксиэтокси)-10-гидрокси-7-этилкамптотецина и 12 мг исходного вещества; т.пл. 124oС; 1H ЯМР (СDСl3+ДМСО):  10,0 (ушир. с, 1Н, D2O обмениваемый), 8,02 (д, J= 9 Гц, 1Н), 7,55-7,39 (м, 3Н), 7,02 (с, 0,5Н), 6,93 (с, 0,5Н), 6,05 (ушир. с, 1Н, D2O обмениваемый), 5,63 (д, J=16 Гц, 1Н), 5,23 (д, J=16 Гц, 1Н), 3,94-3,54 (м, 2Н), 3,41-3,05 (м, 2Н), 1,93 (м, 2Н), 1,40 (т, J=7 Гц, 3Н), 1,02 (м, 3Н); М. -с. (m/z): 408 (М+1), 379, 364, 347, 335, 285, 169, 119, 101, 83.
Пример 36 10,0 (ушир. с, 1Н, D2O обмениваемый), 8,02 (д, J= 9 Гц, 1Н), 7,55-7,39 (м, 3Н), 7,02 (с, 0,5Н), 6,93 (с, 0,5Н), 6,05 (ушир. с, 1Н, D2O обмениваемый), 5,63 (д, J=16 Гц, 1Н), 5,23 (д, J=16 Гц, 1Н), 3,94-3,54 (м, 2Н), 3,41-3,05 (м, 2Н), 1,93 (м, 2Н), 1,40 (т, J=7 Гц, 3Н), 1,02 (м, 3Н); М. -с. (m/z): 408 (М+1), 379, 364, 347, 335, 285, 169, 119, 101, 83.
Пример 36Получение 5-(2′-аминоэтокси)камптотецина Стадия 1. Сначала получают 5-гидроксикамптотецин формулы 13, где R1=R2= R3=R4=R5=H, как описано в примере 2. Стадия 2. К смеси 60 мг 5-гидроксикамптотецина и 5 мг п-толуолсульфоновой кислоты, суспендированной в 10 мл бензола, добавляют 15 мг 2-аминоэтанола и смесь кипятят с обратным холодильником в течение 14 ч. Реакцию гасят каплей пиридина и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, раствором NаНСО3, рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси метанол – хлороформ и получают 36 мг 5-(2′-аминоэтокси)камптотецина и 10 мг исходного вещества; т.пл. 170oС; ИК: 3451, 1740, 1664, 1604, 1383, 1189, 1042 см-1; частичные данные 1Н ЯМР в (СDСl3+ДМСО-d6):  7,5 (д, D2O обмениваемый, 1Н), 7,15 (д, D2О обмениваемый, 1Н), 7,02 (с, 0,5Н), 6,92 (с, 0,5Н), 5,65 (д, J=16 Гц, 1Н), 5,28 (д, J=16 Гц, 1Н), 4,24-3,85 (м, 2Н), 2,35 (с, D2O обмениваемый, 1Н), 2,34 (м, 1Н), 2,15-1,85 (м, 3Н), 1,12-0,95 (м, 3Н); М.-с. (m/z): 408 (М+1), 364, 347, 319, 305, 291, 249, 103, 62.
Пример 37 7,5 (д, D2O обмениваемый, 1Н), 7,15 (д, D2О обмениваемый, 1Н), 7,02 (с, 0,5Н), 6,92 (с, 0,5Н), 5,65 (д, J=16 Гц, 1Н), 5,28 (д, J=16 Гц, 1Н), 4,24-3,85 (м, 2Н), 2,35 (с, D2O обмениваемый, 1Н), 2,34 (м, 1Н), 2,15-1,85 (м, 3Н), 1,12-0,95 (м, 3Н); М.-с. (m/z): 408 (М+1), 364, 347, 319, 305, 291, 249, 103, 62.
Пример 37Получение 5-(2′-аминоэтокси)-7-этилкамптотецина Стадия 1. Сначала получают 5-гидрокси-7-этилкамптотецин формулы 13, где R1=R2=R3=R4=H, R5=Et, как описано в примере 4. Стадия 2. К смеси 85 мг 7-этил-5-гидроксикамптотецина и 5 мг п-толуолсульфоновой кислоты, суспендированной в 20 мл бензола, добавляют 11 мг 2-аминоэтанола и смесь кипятят с обратным холодильником в течение 10 ч. Реакцию гасят каплей пиридина, и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, раствором NaHCO3, рассолом, упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси метанол – хлороформ и получают 65 мг 5-(2′-аминоэтокси)-7-этилкамптотецина; т.пл. 230oС; частичные данные 1Н ЯМР в (СDСl3+ДМСО-d6):  7,5 (д, D2О обмениваемый, 1Н), 7,15 (д, D2O обмениваемый, 1Н), 7,02 (с, 0,5Н), 6,92 (с, 0,5Н), 5,65 (д, J=16 Гц, 1Н), 5,28 (д, J=16 Гц, 1Н), 4,24-3,85 (м, 2Н), 2,35 (с, D2О обмениваемый, 1Н), 2,34 (м, 1Н), 2,15-1,85 (м, 3Н), 1,12-0,95 (м, 1Н); М.-с. (m/z): 408 (М+1), 364, 347, 319, 305, 103, 74, 62.
Пример 38 7,5 (д, D2О обмениваемый, 1Н), 7,15 (д, D2O обмениваемый, 1Н), 7,02 (с, 0,5Н), 6,92 (с, 0,5Н), 5,65 (д, J=16 Гц, 1Н), 5,28 (д, J=16 Гц, 1Н), 4,24-3,85 (м, 2Н), 2,35 (с, D2О обмениваемый, 1Н), 2,34 (м, 1Н), 2,15-1,85 (м, 3Н), 1,12-0,95 (м, 1Н); М.-с. (m/z): 408 (М+1), 364, 347, 319, 305, 103, 74, 62.
Пример 38Получение 5-(3′-диметиламинопропокси)-7-этилкамптотецина Стадия 1. Сначала получают 5-гидрокси-7-этилкамптотецин формулы 13, где R1=R2=R3=R4=Н, R5=Et, как описано в примере 4. Стадия 2. К смеси 50 мг 7-этил-5-гидроксикамптотецина и 0,05 мл серной кислоты, суспендированной в 20 мл бензола, добавляют 30 мг 3-диметиламино-1-пропанола и смесь кипятят с обратным холодильником в течение 12 ч. Реакцию гасят каплей пиридина и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, раствором NаНСО3, рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси метанол – хлороформ и получают 42 мг 5-(3′-диметиламинопропокси)-7-этилкамптотецина; т.пл. 113oС; частичные данные 1H ЯМР в (СDСl3+ДМСО-d6):  6,95 (с, 0,5Н), 6,85 (с, 0,5Н), 5,65 (д, J=16 Гц, 1Н), 5,35 (д, J=16 Гц, 0,5H), 5,25 (д, J=16 Гц, 0,5H), 3,95-3,57 (м, 2Н), 3,30-3,05 (м, 2Н), 2,85 (с, 3Н), 2,83 (с, 3Н), 2,15-1,72 (м, 6Н), 1,45 (т, J=7,5 Гц, 3Н), 1,12-0,95 (м, 3Н); М.-с. (m/z): 478 (М+1), 434, 375, 347, 331, 169, 102, 84; М.-с. (m/z): 478 (М+1), 434, 375, 347, 331, 169, 102, 84.
Пример 39 6,95 (с, 0,5Н), 6,85 (с, 0,5Н), 5,65 (д, J=16 Гц, 1Н), 5,35 (д, J=16 Гц, 0,5H), 5,25 (д, J=16 Гц, 0,5H), 3,95-3,57 (м, 2Н), 3,30-3,05 (м, 2Н), 2,85 (с, 3Н), 2,83 (с, 3Н), 2,15-1,72 (м, 6Н), 1,45 (т, J=7,5 Гц, 3Н), 1,12-0,95 (м, 3Н); М.-с. (m/z): 478 (М+1), 434, 375, 347, 331, 169, 102, 84; М.-с. (m/z): 478 (М+1), 434, 375, 347, 331, 169, 102, 84.
Пример 39Получение 5 -(2′-N-пирролидиноэтокси)-7-этилкамптотецина Стадия 1. Сначала получают 5-гидрокси-7-этилкамптотецин формулы 13, где R1=R2=R3=R4=H, R5=Et, как описано в примере 4. Стадия 2. К смеси 100 мг 7-этил-5-гидроксикамптотецина и 10 мг камфорсульфоновой кислоты, суспендированной в 25 мл бензола, добавляют 30 мг 1-(2-гидроксиэтил)пирролидина и смесь кипятят с обратным холодильником в течение 16 ч. Реакцию гасят каплей пиридина и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, раствором NаНСО3, рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси метанол – хлороформ и получают 85 мг 5-(2′-N-пирролидиноэтокси) -7-этилкамптотецина; т.пл. 225oС; ИК: 3424, 1749, 1666, 1616, 1384, 1156, 1078, 1049 см-1; частичные данные 1Н ЯМР в СDСl3:  7,02 (с, 0,5Н), 6,95 (с, 0,5Н), 5,70 (д, J=16 Гц, 1H), 5,33 (д, J=16 Гц, 0,5H), 5,26 (д, J= 16 Гц, 0,5Н), 4,18-3,88 (м, 2Н), 3,45-3,15 (м, 2Н), 3,06-2,58 (м, 6Н), 2,05-1,72 (м, 6Н), 1,43 (т, J=8 Гц, 3Н), 1,15-0,95 (м, 3Н); М.-с. (m/z): 446 (М+1), 375, 347, 331, 245, 169, 116, 97, 84.
Пример 40 7,02 (с, 0,5Н), 6,95 (с, 0,5Н), 5,70 (д, J=16 Гц, 1H), 5,33 (д, J=16 Гц, 0,5H), 5,26 (д, J= 16 Гц, 0,5Н), 4,18-3,88 (м, 2Н), 3,45-3,15 (м, 2Н), 3,06-2,58 (м, 6Н), 2,05-1,72 (м, 6Н), 1,43 (т, J=8 Гц, 3Н), 1,15-0,95 (м, 3Н); М.-с. (m/z): 446 (М+1), 375, 347, 331, 245, 169, 116, 97, 84.
Пример 40Получение 5-(2′-хлорэтокси)-7-этилкамптотецина Стадия 1. Сначала получают 5-гидрокси-7-этилкамптотецин формулы 13, где R1=R2=R3=R4=H, R5=Et, как описано в примере 4. Стадия 2. К смеси 500 мг 7-этил-5-гидроксикамптотецина и 0,1 мл конц. серной кислоты, суспендированной в 30 мл бензола, добавляют 700 мг 2-хлорэтанола и смесь кипятят с обратным холодильником в течение 8 ч с использованием прибора Дина-Старка. Реакцию гасят каплей пиридина и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, раствором NаНСО3, рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат – хлороформ и получают 400 мг 5-(2′-хлорэтокси)-7-этилкамптотецина; т.пл. 168oС; 1Н ЯМР (СDСl3, 200 МГц):  8,20 (д, J=9,5 Гц, 1H), 8,15 (д, J=9,5 Гц, 1H), 7,82 (т, J=8 Гц, 1H), 7,67 (т, J=8 Гц, 1H), 7,54 (д, 6,2 Гц, 1Н), 7,02 (с, 0,5Н), 6,90 (с, 0,5Н), 5,70 (д, J=16 Гц, 0,5Н), 5,69 (д, J=16 Гц, 0,5Н), 5,26 (д, J= 16 Гц, 0,5Н), 5,25 (д, J=16 Гц, 0,5Н), 4,61-3,95 (м, 2Н), 3,78-3,58 (м, 2Н), 3,50-3,15 (м, 2Н), 1,98-1,78 (м, 2Н), 1,45 (т, J=7,5 Гц, 3Н), 1,12-0,95 (м, 3Н); М.-с. (m/z): 455 (М+1), 437, 409, 392, 376, 347, 331, 245, 115, 81.
Пример 41 8,20 (д, J=9,5 Гц, 1H), 8,15 (д, J=9,5 Гц, 1H), 7,82 (т, J=8 Гц, 1H), 7,67 (т, J=8 Гц, 1H), 7,54 (д, 6,2 Гц, 1Н), 7,02 (с, 0,5Н), 6,90 (с, 0,5Н), 5,70 (д, J=16 Гц, 0,5Н), 5,69 (д, J=16 Гц, 0,5Н), 5,26 (д, J= 16 Гц, 0,5Н), 5,25 (д, J=16 Гц, 0,5Н), 4,61-3,95 (м, 2Н), 3,78-3,58 (м, 2Н), 3,50-3,15 (м, 2Н), 1,98-1,78 (м, 2Н), 1,45 (т, J=7,5 Гц, 3Н), 1,12-0,95 (м, 3Н); М.-с. (m/z): 455 (М+1), 437, 409, 392, 376, 347, 331, 245, 115, 81.
Пример 41Получение 5-(2′-диметиламиноэтокси)-7-этилкамптотецина Стадия 1. Сначала получают 5-гидрокси-7-этилкамптотецин формулы 13, где R1=R2=R3=R4=H, R5=Et, как описано в примере 4. Стадия 2. К смеси 100 мг 7-этил-5-гидроксикамптотецина и 0,1 мл конц. серной кислоты, суспендированной в 10 мл бензола, добавляют 50 мг 2-N,N-диметиламиноэтанола и смесь кипятят с обратным холодильником, с использованием прибора Дина-Старка, в течение 10 ч. Реакцию гасят каплей пиридина и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, раствором NаНСО3, рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси метанол – хлороформ и получают 65 мг 5-(2′-диметиламиноэтокси)-7-этилкамптотецина. Частичные данные 1H ЯМР в CDCl3:  7,05 (с, 0,5Н), 6,93 (с, 0,5Н), 5,74 (д, J= 16 Гц, 0,5H), 5,73 (д, J=16 Гц, 0,5H), 5,29 (д, J=16 Гц, 1H), 4,41-3,75 (м, 2Н), 3,53-3,18 (м, 2Н), 2,57 (кв, J=6 Гц, 2Н), 2,26 (с, 3Н), 2,23 (с, 3Н), 2,05-1,86 (м, 2Н), 1,47 (т, J=8 Гц, 3Н), 1,18-1,01 (м, 3Н).
Пример 42 7,05 (с, 0,5Н), 6,93 (с, 0,5Н), 5,74 (д, J= 16 Гц, 0,5H), 5,73 (д, J=16 Гц, 0,5H), 5,29 (д, J=16 Гц, 1H), 4,41-3,75 (м, 2Н), 3,53-3,18 (м, 2Н), 2,57 (кв, J=6 Гц, 2Н), 2,26 (с, 3Н), 2,23 (с, 3Н), 2,05-1,86 (м, 2Н), 1,47 (т, J=8 Гц, 3Н), 1,18-1,01 (м, 3Н).
Пример 42Получение 5-(4′-аминобутокси)камптотецина Стадия 1. Сначала получают 5-гидроксикамптотецин формулы 13, где R1=R2= R3=R4=R5=H, как описано в примере 2. Стадия 2. К смеси 53 мг 5-гидроксикамптотецина и 8 мг п-толуолсульфоновой кислоты, суспендированной в 16 мл бензола, добавляют 14 мг 4-аминобутанола и смесь кипятят с обратным холодильником в течение 10 ч. Реакцию гасят каплей пиридина и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, раствором NaHCO3, рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат – хлороформ и получают 45 мг 5-(4′-аминобутокси)камптотецина; т.пл. 150oС; ИК: 3397, 1745, 1664, 1617, 1384, 1224, 1162, 1038, 684, 570 см-1; частичные данные 1H ЯМР в (СDСl3+ДМСО-d6):  7,50 (д, D2O обмениваемый, 1Н), 6,95 (с, 0,5Н), 6,85 (с, 0,5Н), 6,25 (д, D2O обмениваемый, 1Н), 5,65 (д, J=16 Гц, 1H), 5,35 (д, J=16 Гц, 0,5H), 5,25 (д, J=16 Гц, 0,5H), 4,15-3,80 (м, 2Н), 2,15-1,65 (м, 8Н), 1,15-0,98 (м, 3Н); М.-с. (m/z): 436 (М+1), 392, 347, 333, 305, 153, 123, 105, 90, 62.
Пример 43 7,50 (д, D2O обмениваемый, 1Н), 6,95 (с, 0,5Н), 6,85 (с, 0,5Н), 6,25 (д, D2O обмениваемый, 1Н), 5,65 (д, J=16 Гц, 1H), 5,35 (д, J=16 Гц, 0,5H), 5,25 (д, J=16 Гц, 0,5H), 4,15-3,80 (м, 2Н), 2,15-1,65 (м, 8Н), 1,15-0,98 (м, 3Н); М.-с. (m/z): 436 (М+1), 392, 347, 333, 305, 153, 123, 105, 90, 62.
Пример 43Получение 5-(2′-метоксиэтокси)камптотецина Стадия 1. Сначала получают 5-гидроксикамптотецин формулы 13, где R1=R2= R3=R4=R5=H, как описано в примере 2. Стадия 2. К смеси 120 мг 5-гидроксикамптотецина и 0,13 мл серной кислоты, суспендированной в 18 мл хлороформа, добавляют 20 мг монометилового эфира этиленгликоля и смесь кипятят с обратным холодильником в течение 10 ч. Реакцию гасят каплей пиридина и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, раствором NаНСО3, рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат – хлороформ и получают 80 мг 5-(2′-метоксиэтокси)камптотецина; т. пл. 123oС; ИК: 3294, 2933, 1748, 1665, 1617, 1384, 1155, 1077, 1045, 761 см-1; 1H ЯМР (CDCl3):  8,51 (с, 1Н), 8,24 (д, J= 8 Гц, 1H), 7,93 (д, J=8 Гц, 1H), 7,79 (т, J=6,8 Гц, 1H), 7,65 (т, J= 6,8 Гц, 1H), 7,58 (c, 0,5H), 7,56 (c, 0,5H), 6,91 (c, 0,5H), 6,82 (c, 0,5H), 5,71 (д, J=16 Гц, 1H), 5,28 (д, J=16 Гц, 1H), 4,55-4,05 (м, 2H), 3,95 (ушир. с, 1H, D2O обмениваемый), 3,81-3,56 (м, 2H), 3,48 (с, 1,5Н), 3,44 (с, 1,5Н), 1,94 (м, 2H), 1,05 (т, J=7 Гц, 3Н); М.-с. (m/z): 423 (М+1), 364, 347, 319, 304, 275, 218, 128, 101, 82.
Пример 44 8,51 (с, 1Н), 8,24 (д, J= 8 Гц, 1H), 7,93 (д, J=8 Гц, 1H), 7,79 (т, J=6,8 Гц, 1H), 7,65 (т, J= 6,8 Гц, 1H), 7,58 (c, 0,5H), 7,56 (c, 0,5H), 6,91 (c, 0,5H), 6,82 (c, 0,5H), 5,71 (д, J=16 Гц, 1H), 5,28 (д, J=16 Гц, 1H), 4,55-4,05 (м, 2H), 3,95 (ушир. с, 1H, D2O обмениваемый), 3,81-3,56 (м, 2H), 3,48 (с, 1,5Н), 3,44 (с, 1,5Н), 1,94 (м, 2H), 1,05 (т, J=7 Гц, 3Н); М.-с. (m/z): 423 (М+1), 364, 347, 319, 304, 275, 218, 128, 101, 82.
Пример 44Получение 5-(2′-N-метилпирролидиноэтокси)-7-этилкамптотецина Стадия 1. Сначала получают 5-гидрокси-7-этилкамптотецин формулы 13, где R1=R2=R3=R4=H, R5=Et, как описано в примере 4. Стадия 2. К смеси 50 мг 5-гидрокси-7-этилкамптотецина и 10 мг п-толуолсульфоновой кислоты, суспендированной в 15 мл бензола, добавляют 18 мг 1-метил-2-пирролидиноэтанола и смесь кипятят с обратным холодильником в течение 8 ч. Реакцию гасят каплей пиридина и реакционную смесь экстрагируют этилацетатом. Органический слой промывают водой, раствором NаНСО3, рассолом и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси метанол – хлороформ и получают 35 мг 5-(2′-N-метилпирролидиноэтокси)-7-этилкамптотецина; т. пл. 102oС. М.-с. (m/z): 504 (М+1), 460, 375, 347, 331, 275, 245, 128, 110, 84.0 Формула изобретения
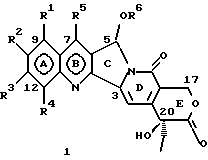 или их фармацевтически приемлемые соли, где R1, R2, R3 и R4, независимо, представляют собой водород или выбраны из группы, включающей гидрокси, (C1-С8)алкокси, нитро, замещенный амино, где аминогруппа является моно- или дизамещенной и заместители выбраны из (C1-С6)алкила или галоген(C1-C6)алкила; (C1-C6)алкил или замещенный (C1-C6)алкил, где заместители выбраны из гидрокси, (C1-C6)алкокси, галоген(C1-C6)алкила, циано, нитро, амино или (C1-C6)алкиламино; R5 представляет собой водород или (C1-C6)алкил; R6 представляет собой водород, (C1-C6)алкил, бензил, где фенильная группа может быть незамещенной или замещенной одним, двумя или тремя заместителями, выбранными из галогена, (C1-С6)алкокси, циано, нитро, (C1-C6)алкила, амино или замещенного амино, где аминогруппа является моно или дизамещенной (C1-С6)алкильной группой; замещенный бензоил, где заместители выбраны из (C1-C6)алкила, галоген(C1-C6)алкила, галогена, (C1-С6)алкокси, циано, нитро, амино или (C1-С6)алкиламино; замещенный (C1-C6)алкил, где заместители выбраны из галогена, гидрокси, (C1-C6)алкокси, фенокси или амино, в котором аминогруппа может быть незамещенной, моно- или дизамещенной, где заместитель выбран из гидрокси или (C1-C6)алкила, когда аминогруппа является дизамещенной, заместители являются независимыми или объединены с образованием циклического кольца, содержащего 5 или 6 кольцевых атомов, атомами кольца являются атомы углерода, азота и необязательно атомы кислорода; или гетероциклического кольца, содержащего от 5 до 7 атомов углерода и один или два атома азота, при условии, что (i) когда R1 представляет собой метокси, R6 не представляет собой водород или (C1-C6)алкильную группу, (ii) когда R2 представляет собой гидрокси, (C1-С6)алкокси, нитро, алкиламино, R6 не представляет собой водород или (C1-C6)алкильную группу, (iii) когда R5 представляет собой (C1-C6)алкил, R6 не представляет собой водород или (C1-С6)алкильную группу, (iv) когда R1 представляет собой метокси, R2 представляет собой гидрокси, (C1-C6)алкокси, нитро, алкиламино, R5 представляет собой (C1-С6)алкил, R6 не представляет собой водород или (C1-C6)алкил, и (v) когда R1-R5 представляют собой водород, R6 не представляет собой водород или (C1-C6)алкильную группу. 2. Соединение по п. 1, выбранное из 5-трифторэтокси СРТ; 9-нитро-5-(2′-метоксиэтокси) СРТ; 7-этил-5-(2-хлорэтокси) СРТ; 5-(2′-гидроксиэтокси) СРТ; 10-гидрокси-5-(2′-гидроксиэтокси) СРТ; 7-этил-10-гидрокси-5-(2′-гидроксиэтокси) СРТ; 9-нитро-5-фторэтокси СРТ; 10-гидрокси-5-трифторэтокси СРТ; 7-этил-10-гидрокси-5-трифторэтокси СРТ; 7-этил-5-диметиламинопропокси СРТ; 7-этил-10-гидрокси-5-фторэтокси СРТ; 5-(2′-гидроксиэтокси)-7-этил СРТ и 5-(2′-метоксиэтокси) СРТ, где СРТ обозначает 20(S)-камптотецин. 3. Соединения формулы 1 по любому из пп. 1 и 2, где R1-R6 имеют значения, указанные в любом из пп. 1 и 2, в виде смеси двух диастереомеров, где указанные диастереомеры имеют конфигурации 20(S), 5(R) и 20(S), 5(S). 4. Соединения формулы 1 по любому из пп. 1 и 2, в которых каждый из диастереомеров, имеющий конфигурации 20(S), 5(R) и 20(S), 5(S), в виде отдельного изомера, по существу, свободен от другого изомера, где R1-R6 имеют значения, указанные в любом из пп. 1 и 2. 5. Соединение формулы 1 по любому из пп. 1-4, обладающее противоопухолевым действием. 6. Соединение формулы 1 по любому из пп. 1-4 в качестве активного ингредиента лекарственного средства для лечения рака, лейкемии или связанных с ВИЧ состояний. 7. Фармацевтическая композиция, обладающая противоопухолевым действием, содержащая эффективное количество соединения формулы 1, указанное в любом из пп. 1-4, и фармацевтически приемлемый нетоксичный эксципиент, разбавитель или растворитель. 8. Фармацевтическая композиция по п. 7 в качестве активного ингредиента лекарственного средства для лечения рака, лейкемии или связанных с ВИЧ состояний. 9. Способ получения соединений формулы 1, включающий следующие стадии: (i) взаимодействие соединения формулы 2 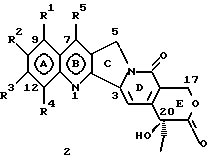 где R1-R5 имеют значения, указанные в п. 1, в присутствии кислоты, выбранной из неорганических кислот или кислот Льюиса, и соли железа(3), с соединением, имеющим формулу R6-OH, где R6 представляет собой (C1-C6)алкил или гидроксиалкил, с получением соединения формулы 12 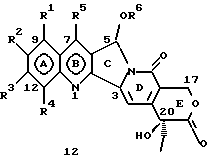 и соединения формулы 13 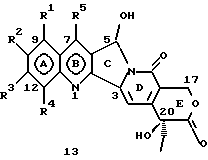 где R1, R2, R3, R4 и R6 имеют значения, указанные в п. 1, необязательно, (ii) разделение соединений формул 12 и 13, полученных на стадии (i), необязательно, (iii) гидролиз соединения формулы 12 с получением дополнительного количества соединения формулы 13, и, необязательно, (iv) взаимодействие соединения формулы 13 в присутствии кислоты, выбранной из неорганических кислот, кислот Льюиса или органических кислот, с соединением, имеющим формулу R6-OH, где R6 имеет значения, указанные в п. 1, с получением соединения формулы 1, 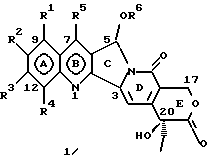 где R1, R2, R3, R4, R5 и R6 имеют значения, указанные в п. 1. 10. Способ по п. 9 получения соединения формулы 1, где R1, R3, R4 и R5 представляют собой водород, R2 представляет собой гидроксильную группу, и R6 представляет собой трифторэтильную группу, включающий следующие стадии: (i) взаимодействие соединения формулы 2 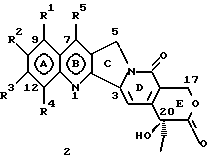 где R1, R3, R4 и R5 представляют собой водород; R2 представляет собой гидроксильную группу, в присутствии концентрированной серной кислоты и тригидрата хлорида железа (3), с этанолом, и нагревание смеси при кипячении с обратным холодильником с получением соединения формулы 12 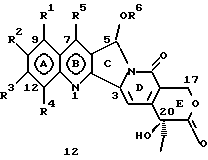 и соединения формулы 13 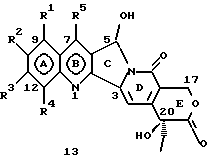 где R1, R3, R4 и R5 представляют собой водород; R2 представляет собой гидроксильную группу; R6 представляет собой этильную группу, (ii) разделение соединений формул 12 и 13, полученных на стадии (i), (iii) гидролиз соединения формулы 12 путем растворения в водном этаноле и кипячения с обратным холодильником с хлористоводородной кислотой с получением дополнительного количества соединения формулы 13, (iv) взаимодействие соединения формулы 13 в присутствии концентрированной серной кислоты с трифторэтанолом, растворенным в дихлорэтановом растворителе, с получением соединения формулы 1 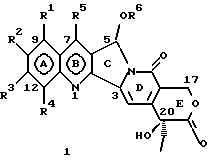 где R1, R3, R4 и R5 представляют собой водород; R2 представляет собой гидроксильную группу; R6 представляет собой трифторэтильную группу. 11. Способ по п. 9, где солью железа(3) является хлорид железа(3). 12. Способ получения соединений формулы 1 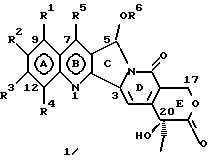 где R6 представляет собой водород или низший алкил; R1 представляет собой водород или метокси; R2 представляет собой водород, гидрокси, низший алкокси, ацилокси, SH, тиоалкил, тиоацил, нитро, амино, алкиламино, ациламино или галоген; R3 и R4 представляют собой водород; R5 представляет собой водород, низший алкил, низший аралкил, СН20Н, СООН, СООМе или СН2ОR’, где R’ представляет собой низшую алкильную или ацильную группу, включающий следующие стадии: (i) взаимодействие соединений формулы 2 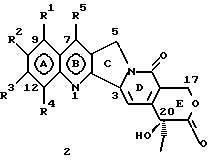 где R1-R5 имеют указанные выше значения, в присутствии кислоты, выбранной из неорганических кислот или кислот Льюиса и соли железа(3), с соединением формулы R6-OH, где R6 представляет собой низшую алкильную группу, с получением соединения формулы 12 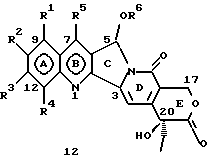 и соединения формулы 13 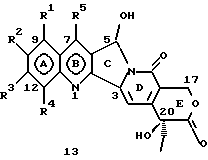 где R1, R2, R3, R4 и R5 имеют указанные выше значения, необязательно, (ii) разделение соединений формул 12 и 13, полученных на стадии (i), (iii) гидролиз соединения формулы 12 с получением дополнительного количества соединения формулы 13, и, необязательно, (iv) взаимодействие соединения формулы 13 в присутствии кислоты, выбранной из органических кислот, неорганических кислот или кислот Льюиса, с соединением, имеющим формулу R6-OH, с получением соединений формулы 1 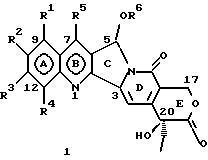 где R1, R2, R3, R4 и R5 имеют указанные выше значения; R6 представляет собой низшую алкильную группу. 13. Способ по п. 12, где солью железа (3) является хлорид железа(3). 14. Способ лечения раковых заболеваний, чувствительных к воздействию камптотецина, лейкемии или связанных с ВИЧ состояний, включающий введение соединения по любому из пп. 1-4. РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 22.03.2007 № РД0019924
Извещение опубликовано: 10.05.2007 БИ: 13/2007
MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за
Дата прекращения действия патента: 23.04.2010
Дата публикации: 27.03.2011
|
||||||||||||||||||||||||||
