Патент на изобретение №2200153
|
||||||||||||||||||||||||||
(54) АМИНОБЕНЗОФЕНОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КОЖИ
(57) Реферат: Описываются производные аминобензофенона общей формулы (I), где R1 и R2 независимо представляют собой один или несколько одинаковых или различных заместителей, выбранных из группы, включающей водород, галоген, гидрокси, трифторметил, амино, алкил, алкенил, алкокси, алкенилокси, алкилтио, алкиламино, содержание С в которых может быть 1 – 5 атомов, циано, фенил, фенилалкокси; R3 представляет собой водород, галоген, гидрокси, трифторметил, алкил, содержание С в которых может быть 1 – 5 атомов, циано, карбокси; R4, R5 и R6 независимо представляют собой водород, алкил, формил, карбамоил, алкоксикарбонил, алкилсульфонил, фенилсульфонил, алкилфенилсульфонил, алкилкарбонил, алкоксикарбонилалкил, трифторметилкарбонил, содержание С в которых может быть 1 – 5 атомов; Х обозначает кислород, N-OH, N-O-алкил, содержание С в которых может быть 1 – 5 атомов, и их соли фармацевтически приемлемых нетоксичных кислот, а также способ их получения, фармацевтический препарат, способ лечения и профилактики воспалительных заболеваний кожи. Технический результат заключается в применении препаратов на основе производных аминобензофенона для лечения и профилактики воспалительных заболеваний кожи, таких как псориаз и аллергический дерматит. 4 с. и 3 з.п. ф-лы, 4 табл. 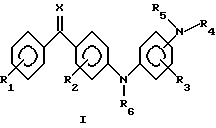
Это изобретение относится к неизвестному до настоящего времени классу соединений, которые обладают противовоспалительными действиями, к фармацевтическим препаратам, содержащим эти соединения, к лекарственным формам таких препаратов и к их применению для лечения и профилактики астмы, аллергии, ревматоидного артрита, спондилоартрита, подагры, атеросклероза, хронического воспалительного заболевания кишечника, пролиферативных и воспалительных заболеваний кожи, таких как псориаз и аллергический дерматит. Соединения настоящего изобретения представлены общей формулой I 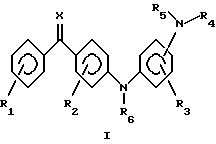 где R1 и R2 независимо представляют один или более сходных или различных заместителей, выбранных из группы, состоящей из водорода, галогена, гидрокси, меркапто, трифторметил, амино, алкил, алкокси, алкилтио, алкиламино и алкоксикарбонил, содержание С в которых может быть от 1 до 5 атомов, циано, карбокси, карбамоил, фенил или нитро; R3 представляет собой водород, галоген, гидрокси, меркапто, трифторметил, амино, алкил, алкокси, алкилтио, алкиламино или алкоксикарбонил, содержание С в которых может быть от 1 до 5 атомов, фенил, циано, карбокси или карбамоил; R4, R5 и R6 независимо представляют водород, трифторметил, алкил, карбамоил, алкоксикарбонил или алкилоксо, содержание С в которых может быть от 1 до 5 атомов; Х представляет кислород, N-OH, N-O-алкил, диалкокси, циклический диалкокси, диалкилтио или циклический диалкилтио, содержание С в которых может быть от 1 до 5 атомов. Соединения могут применяться в форме солей, которые они образуют с фармацевтически приемлемыми неорганическими и органическими кислотами, такими как соляная, бромисто-водородная и йодисто-водородная кислоты, фосфорная кислота, серная кислота, азотная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, муравьиная кислота, уксусная кислота, пропионовая кислота, лимонная кислота, винная кислота, янтарная кислота, бензойная кислота, малеиновая кислота, причем эти примеры рассматриваются как не ограничивающие изобретение. Ранее были описаны серии соединений, близкородственных аминобензофенонам (например, 4-(2-амино-4-нитрофениламино) бензофенон) (Hussein, F.A. et al., Iraqi J. Sci. , 22, 54-66 (1981)). Однако там не было никакого описания их применения. В настоящее время заявители неожиданно нашли, что новые аминобензофеноны, соответствующие общей формуле I, являются сильными ингибиторами секреции интерлейкина 1  (ИЛ-1 (ИЛ-1 ) и фактора некроза опухолей ) и фактора некроза опухолей  (ФНО- (ФНО- ) in vitro, что делает их потенциально применимыми для лечения воспалительных процессов, в патогенез которых вовлечена продукция интерлейкинов, например астмы, ревматоидного артрита, псориаза, контактного дерматита и аллергического дерматита.
Для изучения эффекта соединения настоящего изобретения in vitro измеряли торможение секреции ИЛ-1 ) in vitro, что делает их потенциально применимыми для лечения воспалительных процессов, в патогенез которых вовлечена продукция интерлейкинов, например астмы, ревматоидного артрита, псориаза, контактного дерматита и аллергического дерматита.
Для изучения эффекта соединения настоящего изобретения in vitro измеряли торможение секреции ИЛ-1 и ФНО- и ФНО- , применяя следующую процедуру.
Продукцию цитокинов измеряли в среде от мононуклеарных клеток периферической крови, стимулированных липополисахаридом (ЛПС). Мононуклеарные клетки выделяли из периферической крови человека с помощью Lymphoprep , применяя следующую процедуру.
Продукцию цитокинов измеряли в среде от мононуклеарных клеток периферической крови, стимулированных липополисахаридом (ЛПС). Мононуклеарные клетки выделяли из периферической крови человека с помощью Lymphoprep (Nicomed, Норвегия) фракционирования и суспендировали в среде RPMI 1640 (питательная среда) с сывороткой плодов телят (СПТ, 2%) до концентрации 5 (Nicomed, Норвегия) фракционирования и суспендировали в среде RPMI 1640 (питательная среда) с сывороткой плодов телят (СПТ, 2%) до концентрации 5 105 клеток/мл. Аликвоты клеток по 1 мл инкубировали в 24-луночных планшетах для культуры ткани. Тестируемые соединения растворяли в диметилсульфоксиде (ДМСО, 10 мМ) и разводили средой. Соединения инкубировали с клетками в течение 30 минут затем добавляли ЛПС (1 мкг/мл, конечная концентрация). Планшеты инкубировали в течение 18 часов и концентрацию ИЛ-1 105 клеток/мл. Аликвоты клеток по 1 мл инкубировали в 24-луночных планшетах для культуры ткани. Тестируемые соединения растворяли в диметилсульфоксиде (ДМСО, 10 мМ) и разводили средой. Соединения инкубировали с клетками в течение 30 минут затем добавляли ЛПС (1 мкг/мл, конечная концентрация). Планшеты инкубировали в течение 18 часов и концентрацию ИЛ-1 и ФНО- и ФНО- в среде определяли твердофазным иммуноферментным анализом. Рассчитывали концентрации соединений, вызывающие 50% торможение (IC50). Результаты представлены в таблице 1.
Соединения настоящего изобретения проявляют также сходную активность в отношении торможения секреции надперекиси полиморфно-ядерными гранулоцитами (ПМЯ), что также является указанием на их потенциальную полезность в качестве противовоспалительных лекарств. Соединения тестировали, применяя следующую процедуру.
Полиморфно-ядерные гранулоциты человека (ПМЯ) выделяли из крови человека путем седиментации в декстране, Lymphoprep в среде определяли твердофазным иммуноферментным анализом. Рассчитывали концентрации соединений, вызывающие 50% торможение (IC50). Результаты представлены в таблице 1.
Соединения настоящего изобретения проявляют также сходную активность в отношении торможения секреции надперекиси полиморфно-ядерными гранулоцитами (ПМЯ), что также является указанием на их потенциальную полезность в качестве противовоспалительных лекарств. Соединения тестировали, применяя следующую процедуру.
Полиморфно-ядерные гранулоциты человека (ПМЯ) выделяли из крови человека путем седиментации в декстране, Lymphoprep фракционирования и гипотонического лизиса примеси эритроцитов.
Генерацию анионов надперекиси измеряли по торможению восстановления ферроцитохрома С, вызываемого супероксиддисмутазой (Madhu, S.B., et al., Inflammation, 16, 241 (1992)).
Клетки суспендировали в сбалансированном солевом растворе Хенкса и инкубировали в течение 10 минут при 37oС с тестируемыми соединениями. Клетки активировали добавлением ФНО- фракционирования и гипотонического лизиса примеси эритроцитов.
Генерацию анионов надперекиси измеряли по торможению восстановления ферроцитохрома С, вызываемого супероксиддисмутазой (Madhu, S.B., et al., Inflammation, 16, 241 (1992)).
Клетки суспендировали в сбалансированном солевом растворе Хенкса и инкубировали в течение 10 минут при 37oС с тестируемыми соединениями. Клетки активировали добавлением ФНО- . (3 нг/мл, конечная концентрация) в течение 10 минут, затем в течение 3 минут добавляли ферроцитохром С (конечная концентрация – 750 мкг/мл), бычий сывороточный альбумин (БСА, конечная концентрация – 1 мг/мл) и формил-метионил-лейцил-фенилаланин (fMLP, конечная концентрация – 10-7 М).
Клетки охлаждали на льду и извлекали. Оптическую плотность свободного от клеток супернатанта измеряли на спектрофотометре.
Рассчитывали концентрации соединений, вызывающие 50% торможение (IC50). Результаты представлены в таблице 1.
Эти результаты показывают, что соединения настоящего изобретения способны тормозить продукцию ИЛ-1 . (3 нг/мл, конечная концентрация) в течение 10 минут, затем в течение 3 минут добавляли ферроцитохром С (конечная концентрация – 750 мкг/мл), бычий сывороточный альбумин (БСА, конечная концентрация – 1 мг/мл) и формил-метионил-лейцил-фенилаланин (fMLP, конечная концентрация – 10-7 М).
Клетки охлаждали на льду и извлекали. Оптическую плотность свободного от клеток супернатанта измеряли на спектрофотометре.
Рассчитывали концентрации соединений, вызывающие 50% торможение (IC50). Результаты представлены в таблице 1.
Эти результаты показывают, что соединения настоящего изобретения способны тормозить продукцию ИЛ-1 , ФНО- , ФНО- и надперекиси ПМЯ, что делает их потенциально полезными для лечения воспалительных процессов.
Для изучения действия соединений настоящего изобретения in vivo применяли модель индукции кожного воспаления у мышей с помощью 12-O-тетрадеканоилфорбол-13-ацетата (ТРА) (De Young, L. M. et al., Agents Actions, 26, 335-341 (1989); Carlson, R.P. et al., Agents Actions, 17, 197-204 (1985); Alford, J. G. et al., Agents Actions, 37 (1992); Stanley, P.L. et al., Skin Pharmacol, 4, 262-271 (1991)). Соединения тестировали, применяя следующую процедуру.
В группах из 6 самок мышей, весящих 18-25 грамм, индуцировали воспаление кожи уха путем множественных местных аппликаций ТРА через день в течение 10-дневного периода. Полученный участок воспаления обрабатывали местно соединениями в ацетоне (20 мкл/ухо) дважды в день на 8, 9 и 10 дни и один раз в день на 11 день. Увеличение толщины уха (ЕТ, толщина правого уха минус толщина левого уха) определяли приблизительно через 6 часов после обработки, мышей забивали и в биоптатах уха определяли активность миелопероксидазы (МРО). Результаты представлены в таблице 2.
а) Снижение веса селезенки и тимуса и надперекиси ПМЯ, что делает их потенциально полезными для лечения воспалительных процессов.
Для изучения действия соединений настоящего изобретения in vivo применяли модель индукции кожного воспаления у мышей с помощью 12-O-тетрадеканоилфорбол-13-ацетата (ТРА) (De Young, L. M. et al., Agents Actions, 26, 335-341 (1989); Carlson, R.P. et al., Agents Actions, 17, 197-204 (1985); Alford, J. G. et al., Agents Actions, 37 (1992); Stanley, P.L. et al., Skin Pharmacol, 4, 262-271 (1991)). Соединения тестировали, применяя следующую процедуру.
В группах из 6 самок мышей, весящих 18-25 грамм, индуцировали воспаление кожи уха путем множественных местных аппликаций ТРА через день в течение 10-дневного периода. Полученный участок воспаления обрабатывали местно соединениями в ацетоне (20 мкл/ухо) дважды в день на 8, 9 и 10 дни и один раз в день на 11 день. Увеличение толщины уха (ЕТ, толщина правого уха минус толщина левого уха) определяли приблизительно через 6 часов после обработки, мышей забивали и в биоптатах уха определяли активность миелопероксидазы (МРО). Результаты представлены в таблице 2.
а) Снижение веса селезенки и тимусаЭти результаты показывают, что соединения настоящего изобретения являются такими же сильнодействующими, что и известные соединения сравнения, например гидрокортизон с его известными побочными эффектами, в то время как соединения настоящего изобретения хорошо переносятся и нетоксичны. Некоторые члены представленного класса соединений характеризуются очень низким всасыванием, что, таким образом, делает их особенно полезными для лечения различных кожных заболеваний. В общем, их можно вводить перорально, внутривенно, внутрибрюшинно, интраназально, местно или трансдермально. Настоящее изобретение также относится к способам получения желаемых соединений общей формулы I. Соединения формулы I предпочтительно получают с помощью стандартных приемов, детально описанных в научной литературе. В схеме 1 реакций, приведенной в конце описания, в общих чертах описаны способы получения. Настоящие соединения, входящие в состав фармацевтических композиций, предназначены для лечения указанных выше заболеваний. Требуемое количество соединения формулы I (обозначаемого далее как активный ингредиент), необходимое для достижения терапевтического эффекта, будет, конечно, варьироваться в зависимости как от конкретного соединения, схемы введения, так и от млекопитающего, подвергаемого лечению. Подходящая доза соединения формулы I для системного введения составляет от 0,1 до 200 мг/кг веса тела, наиболее предпочтительная доза составляет от 0,2 до 50 мг/кг веса тела млекопитающего при введении один или более раз в день. Несмотря на то что можно вводить активный ингредиент как таковой в виде сырого соединения, предпочтительно представлять его в виде фармацевтической композиции. Выгодно, чтобы активный ингредиент составлял от 0,1% до 100 весовых % состава. Выгодно, чтобы единицы лекарственной формы состава содержали от 0,07 мг до 1 г активного ингредиента. При местном введении активный ингредиент предпочтительно составляет от 1% до 20 вес.% состава, но активный ингредиент может составлять и такую большую величину как 50%, вес/вес. Составы, которые подходят для назального или трансбуккального введения, могут включать от 0,1% до 20%, вес/вес, например около 2%, вес/вес, активного ингредиента. Термином “единица лекарственной формы” обозначают одинарную, т.е. единичную дозу, которую можно ввести пациенту и с которой можно легко обращаться, легко упаковать, причем оставаясь физически и химически стабильной, единица лекарственной формы включает либо активный материал как таковой, либо его смесь с твердыми или жидкими фармацевтическими разбавителями или носителями. Составы настоящего изобретения, как для ветеринарного, так и для медицинского применения, включают активный ингредиент в сочетании с фармацевтически приемлемым для него носителем и другой(ие) необязательный(ые) терапевтический(ие) ингредиент(ы). Носитель (носители) должен быть “приемлемым”, т. е. быть совместимым с другими ингредиентами состава и не являться вредным для применяющего его (их) пациента. Составы включают те из них, которые подходят для перорального введения, введения в окологлазное пространство, ректального, парентерального (включая подкожное, внутримышечное и внутривенное), чрезкожного, внутрисуставного, местного, интраназального или внутриротового введения. Составы могут быть выгодно представлены в виде единицы лекарственной формы и получены любым из способов, хорошо известным в фармакологии. Все способы включают процесс объединения активного ингредиента с носителем, который состоит из одного или более дополнительных ингредиентов. В общем виде составы готовят путем единообразного и хорошо известного способа введения активного ингредиента в жидкий носитель или окончательно размельченный твердый носитель, или в их смесь, а затем, если это необходимо, формируют продукт в виде желаемого состава. Составы настоящего изобретения, подходящие для перорального введения, могут быть в виде дискретных единиц, таких как капсулы, пакетики, таблетки или пастилки, каждая из которых содержит определенное количество активного, ингредиента; в форме порошка или гранул; в форме раствора или суспензии в воде или в жидкости, не являющейся водой; или в форме масляно-водной или водно-масляной эмульсии. Активный ингредиент может также вводиться в болюсной форме, в форме электуария или пасты. Составы для ректального введения могут находиться в форме суппозиториев, включающих активный ингредиент и носитель, такой как масло какао, или вводиться в виде клизмы. В составы, подходящие для парентерального введения, выгодно включать стерильные масляные или водные препараты активного ингредиента, которые предпочтительно являются изотоническими по отношению к крови реципиента. Составы, подходящие для внутрисуставного введения, могут быть в форме стерильного водного препарата активного ингредиента, который может находиться в микрокристаллической форме, например в виде водной микрокристаллической суспензии. Для представления активного ингредиента как для внутрисуставного введения, так и для введения в окологлазное пространство можно также применять составы в форме липосом или биологически деградируемых полимерных систем. Составы, подходящие для местного введения, включая обработку глаз, содержат жидкие или полужидкие препараты, такие как линименты, примочки, желе, компрессы, масляно-водные или водно-масляные эмульсии, такие как кремы, мази или пасты; или растворы или суспензии, такие как капли. Составы, подходящие для введения в носовую или ротовую полость, содержат порошок, саморассеивающиеся и распыляемые составы, такие как аэрозоли и распылители. Составы настоящего изобретения, кроме указанных выше ингредиентов, могут включать один или более дополнительных ингредиентов. Составы могут дополнительно содержать другие терапевтически активные соединения, обычно применяемые для лечения указанных выше патологических состояний, например глюкокортикоиды, производные витамина D, антигистамины, антагонисты фактора активации тромбоцитов (PAF), антихолинэргические агенты, метилксантины,  -адренергические агенты, салицилаты, индометацин, флуфенамат, напроксен, тимегадин, соли золота, пеницилламин, агенты, снижающие холестерин сыворотки, ретиноиды, соли цинка, салицилазосульфапиридин (салазопирин).
Изобретение будет далее описано с помощью следующих не ограничивающих его общих процедур, получений и примеров.
Примеры соединений I перечислены в таблице 3, в то время как соединения общей формулы II перечислены в таблице 4.
Все точки плавления являются неточными. Для 1H и 13С спектров ядерного магнитного резонанса (ЯМР) (300 МГц) оценивали величины химического сдвига ( -адренергические агенты, салицилаты, индометацин, флуфенамат, напроксен, тимегадин, соли золота, пеницилламин, агенты, снижающие холестерин сыворотки, ретиноиды, соли цинка, салицилазосульфапиридин (салазопирин).
Изобретение будет далее описано с помощью следующих не ограничивающих его общих процедур, получений и примеров.
Примеры соединений I перечислены в таблице 3, в то время как соединения общей формулы II перечислены в таблице 4.
Все точки плавления являются неточными. Для 1H и 13С спектров ядерного магнитного резонанса (ЯМР) (300 МГц) оценивали величины химического сдвига ( ), за исключением специально оговоренных случаев, для растворов дейтериохлороформа и гексадейтерйодиметилсульфоксида по отношению к внутренним стандартам тетраметилсилану ( ), за исключением специально оговоренных случаев, для растворов дейтериохлороформа и гексадейтерйодиметилсульфоксида по отношению к внутренним стандартам тетраметилсилану ( 0,00) или хлороформу 1Н ЯМР 0,00) или хлороформу 1Н ЯМР  7,25, 13С ЯМР 7,25, 13С ЯМР  76,81). Величины для мультиплета (m), либо определенные для дуплетов (d), триплетов (t), квартетов (q), либо неопределенные даны для приблизительно средней точки, за исключением тех случаев, когда оценен интервал (s синглет, b – широкий пик). Хроматография проведена на силикагеле.
Общая процедура 1: 76,81). Величины для мультиплета (m), либо определенные для дуплетов (d), триплетов (t), квартетов (q), либо неопределенные даны для приблизительно средней точки, за исключением тех случаев, когда оценен интервал (s синглет, b – широкий пик). Хроматография проведена на силикагеле.
Общая процедура 1:Взаимодействие соединений общей формулы III с соединениями общей формулы IVa или IVb до образования соединений общей формулы II К раствору соединения общей формулы III (50 ммоль) и соединения общей формулы IVa или IVb (50 ммоль) в ДМСО (250 мл) добавляли трет-бутоксид калия (125 г, 110 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 часов, разводили водой (2,5 л) и подкисляли до рН 5-6 путем добавления уксусной кислоты (100 мл, 3 М) при энергичном перемешивании. Реакционную смесь охлаждали и перемешивали в течение 12 часов, отфильтровывали и промывали водой. Преципитат сушили и очищали перекристаллизацией из подходящего растворителя, в результате чего получили соединение общей формулы II. Общая процедура 2: Взаимодействие соединений общей формулы III с соединениями общей формулы IVa или IVb до образования соединений общей формулы II К раствору соединения общей формулы III (10 ммоль) и соединения общей формулы IVa или IVb (10 ммоль) в ДМСО (25 мл) добавляли трет-бутоксид калия (2,36 г, 21 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 40 часов, разводили водой (300 мл) и экстрагировали этилацетатом (3 х 100 мл). Органическую фазу сушили (МgSO4), фильтровали и выпаривали для получения сырого продукта. Сырой продукт дополнительно очищали либо кристаллизацией, либо флэш- хроматографией для получения целевого соединения. Общая процедура 3: Восстановление соединений общей формулы II до соответствующих соединений общей формулы I с помощью обработки гидратом гидразина К суспензии соединения общей формулы II (30 ммоль) в этаноле (300 мл) в атмосфере аргона добавляли гидрат гидразина (99%, 3,0 мл, 60 ммоль) и 10% палладий на угле (3,0 г). Реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Смесь фильтровали через Celite  и обрабатывали водой (1,0 л). Образованный преципитат отфильтровывали, промывали водой. Преципитат сушили и очищали перекристаллизацией из подходящего растворителя, в результате получая целевое соединение общей формулы I.
Общая процедура 4: и обрабатывали водой (1,0 л). Образованный преципитат отфильтровывали, промывали водой. Преципитат сушили и очищали перекристаллизацией из подходящего растворителя, в результате получая целевое соединение общей формулы I.
Общая процедура 4:Восстановление соединений общей формулы II до соответствующих соединений общей формулы I путем обработки дигидратом двухлористого олова Смесь соединения общей формулы II (5 ммоль) и дигидрата двухлористого олова (5,64 г, 25 ммоль) в абсолютном этаноле (50 мл) нагревали до 70oС в атмосфере аргона. Через 1 час исходный материал растворялся и раствору давали остыть до комнатной температуры и затем вливали в лед. Перед экстракцией этилацетатом (3 х 100 мл) создавали слегка щелочной рН с помощью добавления насыщенного бикарбоната натрия (50 мл). Органическую фазу сушили (МgSO4), фильтровали и выпаривали для получения сырого продукта. Сырой продукт дополнительно очищали либо кристаллизацией, либо флэш-хроматографией для получения целевого соединения. Общая процедура 5: Сульфирование соединений общей формулы I (например, соединения 101) до соответствующих соединений общей формулы I (например, соединения 123) с помощью обработки различными алкил- или арилсульфонилхлоридами К холодному (лед/вода) раствору 4-(2-аминофениламино) бензофенону (0,58 г, 2 ммоль) в пиридине (10 мл) добавляли этансульфонилхлорид (0,25 мл, 2,7 ммоль). Реакционную смесь нагревали до комнатной температуры. После перемешивания в течение 75 мин реакционную смесь вливали в ледяную воду. Преципитат отфильтровывали, промывали водой и диэтиловым эфиром для получения целевого соединения. Общая процедура 6: Алкилирование соединений общей формулы I (например, соединения 101) до соответствующих соединений общей формулы I (например, соединения 134) с помощью обработки алкилгалогенидом Смесь 4-(2-аминофениламино)бензофенона (0,29 г, 1 ммоль), йодистого метила (0,1 мл, 1,7 ммоль) и карбоната калия (0,28 г, 2 ммоль) в N,N-диметилформамиде (5 мл) перемешивали при комнатной температуре в течение 4 дней. Реакционную смесь упаривали под вакуумом. Остаток экстрагировали этилацетатом (25 мл), фильтровали и упаривали для получения сырого продукта. Сырой продукт очищали флэш-хроматографией с использованием этилацетата/пентана 1:9 для получения целевого соединения. Получение 1 4-(2-нитрофениламино)бензофенон (соединение 201) Общая процедура 1 Исходное соединение III: 4-аминобензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: кристаллизация из этанола. Т. пл.: 115-117oС. 1H-ЯМР (ДМСО-d6):  7,12 (м, 1Н), 7,35 (д, 2Н), 7,50-7,80 (м, 9Н), 8,12 (дд, 1Н), 9,37 (шир.с, 1Н).
Получение 2 7,12 (м, 1Н), 7,35 (д, 2Н), 7,50-7,80 (м, 9Н), 8,12 (дд, 1Н), 9,37 (шир.с, 1Н).
Получение 24-(2-нитрофениламино)бензофенон (соединение 202) Общая процедура 1 Исходное соединение III: 4-аминобензофенон Исходное соединение IVb: 1-фтор-4-нитробензол Т. пл.: 208-210oС. 1H-ЯМР (ДМСО-d6):  7, 31 (д, 2Н), 7,37 (д, 2Н), 7,53-7,77 (м, 7Н), 8,18 (д, 2Н), 9,76 (с, 1Н).
Получение 3 7, 31 (д, 2Н), 7,37 (д, 2Н), 7,53-7,77 (м, 7Н), 8,18 (д, 2Н), 9,76 (с, 1Н).
Получение 34-(4-метил-2-нитрофениламино)бензофенон (соединение 203) Общая процедура 1 Исходное соединение III: 4-аминобензофенон Исходное соединение IVa: 4-фтор-3-нитротолуол Очистка: хроматография с использованием в качестве элюента этилацетата/пентана 3:7. Т. пл.: 131-133oС. 1H-ЯМР (ДМСО-d6):  2,34 (с, 3Н), 7,25 (д, 2Н), 7,47-7,75 (м, 9Н), 7,93 (шир.с, 1Н), 9,21 (шир.с, 1Н).
Получение 4 2,34 (с, 3Н), 7,25 (д, 2Н), 7,47-7,75 (м, 9Н), 7,93 (шир.с, 1Н), 9,21 (шир.с, 1Н).
Получение 44-(4-трифторметил-2-нитрофениламино)бензофенон (соединение 204) Общая процедура 1 Исходное соединение III: 4-аминобензофенон Исходное соединение IVa: 2-фтор-5-трифторметил-нитробензол Т. пл.: 139-141oС. 1H-ЯМР (ДМСО-d6):  7,50-7,90 (м, 11H), 8,40 (шир.д, 1Н), 9,82 (шир.с, 1Н).
Получение 5 7,50-7,90 (м, 11H), 8,40 (шир.д, 1Н), 9,82 (шир.с, 1Н).
Получение 54-(4-бензоилфениламино)-3-нитробензойная кислота (соединение 205) Общая процедура 1 Исходное соединение III: 4-аминобензофенон Исходное соединение IVa: 4-фтор-3-нитробензойная кислота Т. пл.: > 250oС (калиевая соль). 1H-ЯМР (ДМСО-d6): (калиевая соль)  7,36 (д, 2Н), 7,47 (д, 1Н), 7,52-7,77 (м, 7Н), 8,06 (дд, 1Н), 8,53 (д, 1Н), 9,44 (шир.с, 1Н).
Получение 6 7,36 (д, 2Н), 7,47 (д, 1Н), 7,52-7,77 (м, 7Н), 8,06 (дд, 1Н), 8,53 (д, 1Н), 9,44 (шир.с, 1Н).
Получение 62-(4-бензоилфениламино)-5-нитробензонитрил (соединение 206) Общая процедура 1 Исходное соединение III: 4-аминобензофенон Исходное соединение IVb: 2-фтор-5-нитробензонитрил Очистка: кристаллизация из н-пропанола. Т. пл.: 208-210oС. 1H-ЯМР (ДМСО-d6):  7,45-7,85 (м, 10Н), 8,31 (дд, 1Н), 8,65 (д, 1Н), 9,67 (шир.с, 1Н).
Получение 7 7,45-7,85 (м, 10Н), 8,31 (дд, 1Н), 8,65 (д, 1Н), 9,67 (шир.с, 1Н).
Получение 72-(4-бензоилфениламино)-5-нитробензойная кислота (соединение 207) Общая процедура 1 Исходное соединение III: 4-аминобензофенон Исходное соединение IVb: 2-фтор-5-нитробензойная кислота Т. пл.: 216-218oС. 1H-ЯМР (ДМСО-d6):  7,45-7,90 (м, 10Н), 8,26 (дд, 1Н), 8,74 (д, 1Н), 10,65 (шир.с, 1Н), 14,0 (шир.с, 1Н).
Получение 8 7,45-7,90 (м, 10Н), 8,26 (дд, 1Н), 8,74 (д, 1Н), 10,65 (шир.с, 1Н), 14,0 (шир.с, 1Н).
Получение 84-(2-метил-4-нитрофениламино)бензофенон (соединение 208) Общая процедура 1 Исходное соединение III: 4-аминобензофенон Исходное соединение IVb: 2-фтор-5-нитротолуол Т. пл.: 207-209oС. 1H-ЯМР (ДМСО-d6):  2,38 (с, 3Н), 7,31 (д, 2Н), 7,44 (д, 1Н), 7,52-7,80 (м, 7Н), 8,02 (дд, 1Н), 8,14 (д, 1Н), 8,67 (шир.с, 1Н).
Получение 9 2,38 (с, 3Н), 7,31 (д, 2Н), 7,44 (д, 1Н), 7,52-7,80 (м, 7Н), 8,02 (дд, 1Н), 8,14 (д, 1Н), 8,67 (шир.с, 1Н).
Получение 92-фтор-4′-(2-нитрофениламино)бензофенон (соединение 209) Общая процедура 2 Исходное соединение III: 4-амино-2′-фторбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента диэтилового эфира/пентана 1:2. Т. пл.: 131-132oС. 1H-ЯМР (CDCl3):  6,94 (м, 1Н), 7,17 (дд, 1Н), 7,25-7,35 (м, 3Н), 7,45-7,60 (м, 4Н), 7,87 (м, 2Н), 8,21 (дд, 1Н), 9,51 (шир.с, 1Н).
Получение 10 6,94 (м, 1Н), 7,17 (дд, 1Н), 7,25-7,35 (м, 3Н), 7,45-7,60 (м, 4Н), 7,87 (м, 2Н), 8,21 (дд, 1Н), 9,51 (шир.с, 1Н).
Получение 104-фтор-4′-(2-нитрофениламино)бензофенон (соединение 210) Общая процедура 2 Исходное соединение III: 4-амино-4′-фторбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: кристаллизация из ацетона/воды. Т. пл.: 148-150oС. 1Н-ЯМР (CDCl3):  6,92(м, 1Н), 7,18 (м, 2Н), 7,35 (д, 2Н), 7,49 (м, 2Н), 7,84 (м, 4Н), 8,23 (дд, 1Н), 9,52 (шир.с, 1Н).
Получение 11 6,92(м, 1Н), 7,18 (м, 2Н), 7,35 (д, 2Н), 7,49 (м, 2Н), 7,84 (м, 4Н), 8,23 (дд, 1Н), 9,52 (шир.с, 1Н).
Получение 114-трет-бутил-4′-(2-нитрофениламино)бензофенон (соединение 211) Общая процедура 2 Исходное соединение III: 4-амино-4′-трет-бутилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: кристаллизация из метанола. Т. пл.: 189-194oС. 1Н-ЯМР (CDCl3):  1,38 (с, 9Н), 6,90 (м, 1Н), 7,34 (д, 2Н), 7,50 (м, 4Н), 7,75 (д, 2Н), 7,87 (д, 2Н), 8,22 (дд, 1Н), 9,53 (шир.с, 1Н).
Получение 12 1,38 (с, 9Н), 6,90 (м, 1Н), 7,34 (д, 2Н), 7,50 (м, 4Н), 7,75 (д, 2Н), 7,87 (д, 2Н), 8,22 (дд, 1Н), 9,53 (шир.с, 1Н).
Получение 123-фтор-4′-(2-нитрофениламино)бензофенон (соединение 212) Общая процедура 2 Исходное соединение III: 4-амино-3′-фторбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: кристаллизация из метанола. 1H-ЯМР (CDCl3):  6,94 (м, 1Н), 7,25-7,65 (м, 8Н), 7,86 (д, 2Н), 8,23 (дд, 1Н), 9,52 (с, 1Н).
Получение 13 6,94 (м, 1Н), 7,25-7,65 (м, 8Н), 7,86 (д, 2Н), 8,23 (дд, 1Н), 9,52 (с, 1Н).
Получение 132-хлор-4′-(2-нитрофениламино)бензофенон (соединение 213) Общая процедура 2 Исходное соединение III: 4-амино-2′-хлорбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента диэтилового эфира/пентана 3:7. 1H-ЯМР (CDCl3):  6,95 (м, 1Н), 7,25-7,57 (м, 8Н), 7,83 (д, 2Н), 8,22 (дд, 1Н), 9,49 (шир.с, 1Н).
Получение 14 6,95 (м, 1Н), 7,25-7,57 (м, 8Н), 7,83 (д, 2Н), 8,22 (дд, 1Н), 9,49 (шир.с, 1Н).
Получение 143-хлор-4′-(2-нитрофениламино)бензофенон (соединение 214) Общая процедура 2 Исходное соединение III: 4-амино-3′-хлорбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол 1Н-ЯМР (CDCl3):  6,94 (м, 1Н), 7,32-7,62 (м, 6Н), 7,66 (д, 1H), 7,76 (шир.с, 1H), 7,86 (Д, 2Н), 8,23 (дд, 1Н), 9,52 (с, 1H).
Получение 15 6,94 (м, 1Н), 7,32-7,62 (м, 6Н), 7,66 (д, 1H), 7,76 (шир.с, 1H), 7,86 (Д, 2Н), 8,23 (дд, 1Н), 9,52 (с, 1H).
Получение 152-метокси-4′-(2-нитрофениламино)бензофенон (соединение 215) Общая процедура 2 Исходное соединение III: 4-амино-2′-метоксибензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента диэтилового эфира/пентана 1:2. 1H-ЯМР (CDCl3):  3,76 (с, 3Н), 6,94 (м, 1H), 7,05 (м, 2Н), 7,27 (д, 2Н), 7,36 (дд, 1H), 7,50 (м, 3Н), 7,84 (д, 2Н), 8,21 (дд, 1H), 9,50 (с, 1H).
Получение 16 3,76 (с, 3Н), 6,94 (м, 1H), 7,05 (м, 2Н), 7,27 (д, 2Н), 7,36 (дд, 1H), 7,50 (м, 3Н), 7,84 (д, 2Н), 8,21 (дд, 1H), 9,50 (с, 1H).
Получение 163-диметиламино-4′-(2-нитрофениламино)бензофенон (соединение 216) Общая процедура 2 Исходное соединение III: 4-амино-3′-(диметиламино) бензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 1H-ЯМР (CDCl3):  3,00 (с, 6Н), 6,92 (м, 2Н), 7,04 (дд, 1H), 7,15 (м, 1H), 7,28 (м, 3Н), 7,50 (м, 2Н), 7,89 (д, 2Н), 8,21 (дд, 1H), 9,52 (шир.с, 1H).
Получение 17 3,00 (с, 6Н), 6,92 (м, 2Н), 7,04 (дд, 1H), 7,15 (м, 1H), 7,28 (м, 3Н), 7,50 (м, 2Н), 7,89 (д, 2Н), 8,21 (дд, 1H), 9,52 (шир.с, 1H).
Получение 174-хлор-4′-(2-нитрофениламино)бензофенон (соединение 217) Общая процедура 2 Исходное соединение III: 4-амино-4′-хлорбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: кристаллизация из этилацетата/пентана 1:2. Т. пл.: 157-158oС. 1H-ЯМР (CDCl3):  6,93 (м, 1Н), 7,35 (д, 2Н), 7,50 (м, 4Н), 7,75 (Д, 2Н), 7,84 (д, 2Н), 8,23 (дд, 1Н), 9,52 (с, 1Н).
Получение 18 6,93 (м, 1Н), 7,35 (д, 2Н), 7,50 (м, 4Н), 7,75 (Д, 2Н), 7,84 (д, 2Н), 8,23 (дд, 1Н), 9,52 (с, 1Н).
Получение 183-метил-4′-(2-нитрофениламино)бензофенон (соединение 218) Общая процедура 2 Исходное соединение III: 4-амино-3′-метилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:9. Т. пл.: 86-87oС. 1H-ЯМР (CDCl3):  2,43 (с, 3Н), 6,92 (м, 1Н), 7,30-7,65 (м, 8Н), 7,87 (д, 2Н), 8,22 (дд, 1Н), 9,52 (с, 1Н).
Получение 19 2,43 (с, 3Н), 6,92 (м, 1Н), 7,30-7,65 (м, 8Н), 7,87 (д, 2Н), 8,22 (дд, 1Н), 9,52 (с, 1Н).
Получение 193-нитро-4-(4-нитрофениламино)бензофенон (соединение 219) Общая процедура 1 Исходное соединение III: 4-амино-3-нитробензофенон Исходное соединение IVa: 1-фтор-4-нитробензол Очистка: кристаллизация из н-пропанола. Т. пл.: 199-201oС. 1Н-ЯМР (ДМСО-d6):  7,50-7,80 (м, 8Н), 7,99 (дд, 1Н), 8,25 (д, 2Н), 8,44 (д, 1Н), 9,98 (с, 1Н).
Получение 20 7,50-7,80 (м, 8Н), 7,99 (дд, 1Н), 8,25 (д, 2Н), 8,44 (д, 1Н), 9,98 (с, 1Н).
Получение 204-(2-нитрофениламино)-4′-пентилбензофенон (соединение 220) Общая процедура 2 Исходное соединение III: 4-амино-4′-пентилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: кристаллизация из этилацетата. Т. пл.: 93-95oС. 1H-ЯМР (CDCl3):  0,92 (т, 3Н), 1,40 (м, 4Н), 1,73 (м, 2Н), 3,01 (т, 2Н), 6,92 (м, 1Н), 7,34 (м, 4Н), 7,47 (м, 2Н), 7,73 (д, Н), 7,84 (д, 2Н), 8,23 (дд, 1Н), 9,52 (с, 1Н).
Получение 21 0,92 (т, 3Н), 1,40 (м, 4Н), 1,73 (м, 2Н), 3,01 (т, 2Н), 6,92 (м, 1Н), 7,34 (м, 4Н), 7,47 (м, 2Н), 7,73 (д, Н), 7,84 (д, 2Н), 8,23 (дд, 1Н), 9,52 (с, 1Н).
Получение 214-хлор-2-изопропилтио-4′-(2-нитрофениламино)бензофенон (соединение 221) Общая процедура 2 Исходное соединение III: 4′-амино-4-хлор-2-(изопропил-тио)бензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:9. 1Н-ЯМР (CDCl3):  1,25 (д, 6Н), 3,40 (м, 1Н), 6,94 (м, 1Н), 7,27 (м, 4Н), 7,50 (м, 3Н), 7,79 (д, 2Н), 8,21 (дд, 1Н), 9,49 (шир.с, 1Н).
Получение 22 1,25 (д, 6Н), 3,40 (м, 1Н), 6,94 (м, 1Н), 7,27 (м, 4Н), 7,50 (м, 3Н), 7,79 (д, 2Н), 8,21 (дд, 1Н), 9,49 (шир.с, 1Н).
Получение 224-трифторметил-4′-(2-нитрофениламино)бензофенон (соединение 222) Общая процедура 2 Исходное соединение III: 4-амино-4′-трифторметил-бензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:9. Т. пл.: 122-123oС. 1H-ЯМР (CDCl3):  6,96 (м, 1Н), 7,36 (д, 2Н), 7,50 (м, 2Н), 7,77 (д, 2Н), 7,87 (м, 4Н), 8,23 (дд, 1Н), 9,52 (с, 1Н).
Получение 23 6,96 (м, 1Н), 7,36 (д, 2Н), 7,50 (м, 2Н), 7,77 (д, 2Н), 7,87 (м, 4Н), 8,23 (дд, 1Н), 9,52 (с, 1Н).
Получение 233,4,5-триметокси-4′-(2-нитрофениламино)бензофенон (соединение 223) Общая процедура 2 Исходное соединение III: 4′-амино-3,4,5-триметокси-бензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: растирание из этилацетата/пентана 1:2. Т. пл.: при возгонке 180-191oС. 13С-ЯМР (CDCl3):  194,4, 152,9, 143,3, 142,0, 140,4, 135,7, 135,0, 133,4, 132,8, 132,0, 126,8, 120,9, 119,5, 117,2, 107,6, 61,0, 56,4.
Получение 24 194,4, 152,9, 143,3, 142,0, 140,4, 135,7, 135,0, 133,4, 132,8, 132,0, 126,8, 120,9, 119,5, 117,2, 107,6, 61,0, 56,4.
Получение 244-(N-метил-2-нитрофениламино)бензофенон (соединение 224) Общая процедура 6, но с использованием 5 ммоль метилйодида Исходное соединение: 201 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:9. 1H-ЯМР (ДMCO-d6):  8,09 (м, 1Н), 7,87 (м, 1H), 7,68-7,57 (м, 7Н), 7,52 (м, 2Н), 6,65 (м, 2Н), 3,34 (с, 3Н).
Получение 25 8,09 (м, 1Н), 7,87 (м, 1H), 7,68-7,57 (м, 7Н), 7,52 (м, 2Н), 6,65 (м, 2Н), 3,34 (с, 3Н).
Получение 252-метил-4′-(2-нитрофениламино)бензофенон (соединение 225) Общая процедура 2 Исходное соединение III: 4 -амино-2′-метилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. Т. пл.: 87-90oС. 13С-ЯМР (CDCl3):  197,0, 144,0, 140,2, 138,7, 136,5, 135,6, 135,2, 133,3, 132,1, 131,0, 130,1, 128,1, 126,8, 125,3, 120,8, 119,6, 117,4, 19,9.
Получение 26 197,0, 144,0, 140,2, 138,7, 136,5, 135,6, 135,2, 133,3, 132,1, 131,0, 130,1, 128,1, 126,8, 125,3, 120,8, 119,6, 117,4, 19,9.
Получение 262,4-дихлор-4′-(2-нитрофениламино)бензофенон (соединение 226) Общая процедура 2 Исходное соединение III: 4′-амино-2,4-дихлорбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 13С-ЯМР (CDCl3):  192,6, 144,9, 139,6, 137,1, 136,5, 135,6, 132,3, 132,1, 131,6, 130,0, 127,2, 126,8, 120,4, 120,1, 117,7.
Получение 27 192,6, 144,9, 139,6, 137,1, 136,5, 135,6, 132,3, 132,1, 131,6, 130,0, 127,2, 126,8, 120,4, 120,1, 117,7.
Получение 273,4-этилендиокси-4′-(2-нитрофениламино)бензофенон (соединение 227) Общая процедура 2 Исходное соединение III: 4′-амино-3,4-этилендиокси-бензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. Т. пл.: 145-147oС. 13С-ЯМР (CDCl3):  193,9, 147,6, 143,2, 142,9, 140,8, 135,7, 134,8, 133,9, 131,9, 131,1, 126,8, 124,2, 121,2, 119,6, 119,2, 117,1, 117,0, 64,7, 64,2.
Получение 28 193,9, 147,6, 143,2, 142,9, 140,8, 135,7, 134,8, 133,9, 131,9, 131,1, 126,8, 124,2, 121,2, 119,6, 119,2, 117,1, 117,0, 64,7, 64,2.
Получение 282,4′-дихлор-4-(2-нитрофениламино)бензофенон (соединение 228) Общая процедура 2 Исходное соединение III: 4-амино-2,4′-дихлорбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. Т. пл.: 140-142oС. 13С-ЯМР (CDCl3):  193,3, 142,5, 140,2, 140,2, 135,8, 135,2, 135,1, 133,6, 133,2, 131,4, 131,1, 129,0, 126,9, 123,0, 120,0, 119,7, 117,0.
Получение 29 193,3, 142,5, 140,2, 140,2, 135,8, 135,2, 135,1, 133,6, 133,2, 131,4, 131,1, 129,0, 126,9, 123,0, 120,0, 119,7, 117,0.
Получение 294-(2-нитрофениламино)-4′-(1-метилбутилокси)бензофенон (соединение 229) Общая процедура 2 Исходное соединение III: 4-амино-4′-(1,1-метилбутилокси) бензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 13С-ЯМР (CDCl3):  194,1, 162,1, 142,7, 140,9, 135,7, 134,7, 134,3, 132,4, 131,8, 129,8, 126,8, 121,3, 119,1, 117,0, 115,0, 73,9, 38,5, 19,7, 18,7, 14,0.
Получение 30 194,1, 162,1, 142,7, 140,9, 135,7, 134,7, 134,3, 132,4, 131,8, 129,8, 126,8, 121,3, 119,1, 117,0, 115,0, 73,9, 38,5, 19,7, 18,7, 14,0.
Получение 302,3-диметокси-4′-(2-нитрофениламино)бензофенон (соединение 230) Общая процедура 2 Исходное соединение III: 4′-амино-2,3-диметокси-бензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента диэтилового эфира/пентана 1:1. 13С-ЯМР (CDCl3):  194,6, 152,8, 146,7, 144,0, 140,2, 135,6, 135,1, 134,2, 133,1, 132,0, 126,8, 124,2, 120,7, 120,3, 119,5, 117,4, 114,2, 61,8, 56,0.
Получение 31 194,6, 152,8, 146,7, 144,0, 140,2, 135,6, 135,1, 134,2, 133,1, 132,0, 126,8, 124,2, 120,7, 120,3, 119,5, 117,4, 114,2, 61,8, 56,0.
Получение 313-бутокси-4′-(2-нитрофениламино)бензофенон (соединение 231) Общая процедура 2 Исходное соединение III: 4-амино-3′-бутоксибензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента диэтилового эфира/пентана 1:4. 13С-ЯМР (CDCl3):  195,1, 159,2, 143,4, 140,5, 139,0, 135,7, 135,0, 133,3, 132,1, 129,2, 126,8, 122,3, 121,0, 119,4, 119,0, 117,2, 115,0, 68,0, 31,3, 19,2, 13,9.
Получение 32 195,1, 159,2, 143,4, 140,5, 139,0, 135,7, 135,0, 133,3, 132,1, 129,2, 126,8, 122,3, 121,0, 119,4, 119,0, 117,2, 115,0, 68,0, 31,3, 19,2, 13,9.
Получение 324-(2-нитрофениламино)-3′-(трифторметил)бензофенон (соединение 232) Общая процедура 2 Исходное соединение III: 4-амино-3′-(трифторметил)бензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2 с последующим растиранием в диэтиловом эфире. 13С-ЯМР (CDCl3):  193,7, 144,1, 140,0, 138,6, 135,7, 135,4, 132,9, 132,2, 132,1, 131,0, 129,0, 128,7, 126,9, 126,5, 123,7, 120,8, 119,8, 117,4.
Получение 33 193,7, 144,1, 140,0, 138,6, 135,7, 135,4, 132,9, 132,2, 132,1, 131,0, 129,0, 128,7, 126,9, 126,5, 123,7, 120,8, 119,8, 117,4.
Получение 333,5-дихлор-4′-(2-нитрофениламино)бензофенон (соединение 233) Общая процедура 2 Исходное соединение III: 4′-амино-3,5-дихлорбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента диэтилового эфира/пентана 1:2. 13С-ЯМР (CDCl3):  192,2, 144,4, 140,5, 139,8, 135,6, 135,5, 135,3, 132,2, 131,9, 131,6, 127,9, 126,9, 120,6, 119,9, 117,5.
Получение 34 192,2, 144,4, 140,5, 139,8, 135,6, 135,5, 135,3, 132,2, 131,9, 131,6, 127,9, 126,9, 120,6, 119,9, 117,5.
Получение 344-бензилокси-4′-(2-нитрофениламино)бензофенон (соединение 234) Общая процедура 2 Исходное соединение III: 4-амино-4′-бензилоксибензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 13С-ЯМР (CDCl3):  193,9, 162,1, 142,6, 140,6, 136,0, 135,4, 134,6, 133,8, 132,1, 131,6, 130,3, 128,5, 128,0, 127,3, 126,6, 121,0, 119,0, 116,8, 114,3, 70,0.
Получение 35 193,9, 162,1, 142,6, 140,6, 136,0, 135,4, 134,6, 133,8, 132,1, 131,6, 130,3, 128,5, 128,0, 127,3, 126,6, 121,0, 119,0, 116,8, 114,3, 70,0.
Получение 354-этокси-4′-(2-нитрофениламино)бензофенон (соединение 235) Общая процедура 2 Исходное соединение III: 4-амино-4′-этоксибензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: растирание в диэтиловом эфире/пентане 1:2. 13С-ЯМР (CDCl3):  194,1, 162,6, 142,8, 140,8, 135,7, 134,8, 134,2, 132,4, 131,8, 130,0, 126,8, 121,3, 119,1, 117,0, 114,1, 63,8, 14,7.
Получение 36 194,1, 162,6, 142,8, 140,8, 135,7, 134,8, 134,2, 132,4, 131,8, 130,0, 126,8, 121,3, 119,1, 117,0, 114,1, 63,8, 14,7.
Получение 364-(2-хлор-4-нитрофениламино)бензофенон (соединение 236) Общая процедура 1 Исходное соединение III: 4-аминобензофенон Исходное соединение IVb: 1-хлор-2-фтор-5-нитробензол Очистка: растирание в этаноле. Т. пл.: 214-218oС. 1H-ЯМР (ДМСО-d6):  9,08 (шир.с, 1Н), 8,33 (д, 1Н), 8,11 (дв.д, 1Н), 7,83-7,63 (м, 5Н), 7,57 (м, 2Н), 7,50 (д, 1Н), 7,43 (д, 2Н).
Получение 37 9,08 (шир.с, 1Н), 8,33 (д, 1Н), 8,11 (дв.д, 1Н), 7,83-7,63 (м, 5Н), 7,57 (м, 2Н), 7,50 (д, 1Н), 7,43 (д, 2Н).
Получение 373-метокси-4-метил-4′-(2-нитрофениламино)бензофенон (соединение 237) Общая процедура 2 Исходное соединение III: 4′-амино-3-метокси-4-метилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: растирание в метаноле. 13С-ЯМР (CDCl3):  195,2, 157,9, 143,2, 140,6, 136,5, 135,7, 134,9, 133,7, 132,3, 132,0, 130,0, 126,8, 123,0, 121,1, 119,3, 117,1, 110,5, 55,5, 16,5.
Получение 38 195,2, 157,9, 143,2, 140,6, 136,5, 135,7, 134,9, 133,7, 132,3, 132,0, 130,0, 126,8, 123,0, 121,1, 119,3, 117,1, 110,5, 55,5, 16,5.
Получение 382-хлор-4-(2-нитрофениламино)бензофенон (соединение 238) Общая процедура 2 Исходное соединение III: 4-амино-3-хлорбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4 с последующей кристаллизацией из метанола. 13С-ЯМР (CDCl3):  194,5, 142,2, 140,5, 136,8, 135,8, 134,9, 134,2, 133,6, 133,2, 131,1, 130,1, 128,6, 126,9, 123,2, 120,1, 119,5, 116,9.
Получение 39 194,5, 142,2, 140,5, 136,8, 135,8, 134,9, 134,2, 133,6, 133,2, 131,1, 130,1, 128,6, 126,9, 123,2, 120,1, 119,5, 116,9.
Получение 394-метокси-4′-(2-нитрофениламино)бензофенон (соединение 239) Общая процедура 2 Исходное соединение III: 4-амино-4′-метоксибензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: кристаллизация из этилацетата. 13С-ЯМР (CDCl3):  194,1, 163,2, 142,8, 140,8, 135,7, 134,8, 134,1, 132,4, 131,8, 130,3, 126,8, 121,3, 119,2, 117,0, 113,6, 55,5.
Получение 40 194,1, 163,2, 142,8, 140,8, 135,7, 134,8, 134,1, 132,4, 131,8, 130,3, 126,8, 121,3, 119,2, 117,0, 113,6, 55,5.
Получение 403-метил-4-(2-нитрофениламино)бензофенон (соединение 240) Общая процедура 2 Исходное соединение III: 4-амино-3-метилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: кристаллизация из этанола. 13С-ЯМР (CDCl3):  5,6, 141,7, 141,4, 137,8, 135,7, 134,3, 134,1, 133,4, 132,3, 131,7, 129,9, 129,4, 128,3, 126,8, 121,9, 118,7, 116,8, 18,1.
Получение 41 5,6, 141,7, 141,4, 137,8, 135,7, 134,3, 134,1, 133,4, 132,3, 131,7, 129,9, 129,4, 128,3, 126,8, 121,9, 118,7, 116,8, 18,1.
Получение 414-(2-нитрофениламино)-2′-фенилбензофенон (соединение 241) Общая процедура 2 Исходное соединение III: 4-амино-2′-фенилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 13С-ЯМР (CDCl3):  197,2, 143,4, 141,0, 140,4, 140,2, 138,9, 135,5, 135,0, 133,3, 131,8, 130,4, 130,0, 129,1, 128,7, 128,3, 127,4, 127,2, 126,8, 120,7, 119,4, 117,2.
Получение 42 197,2, 143,4, 141,0, 140,4, 140,2, 138,9, 135,5, 135,0, 133,3, 131,8, 130,4, 130,0, 129,1, 128,7, 128,3, 127,4, 127,2, 126,8, 120,7, 119,4, 117,2.
Получение 424-(2-нитрофениламино)-3′-фенилбензофенон (соединение 242) Общая процедура 2 Исходное соединение III: 4-амино-3′-фенилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: кристаллизация из смеси хлороформ/метанол. Т. пл.: 142-145oС. 13С-ЯМР (CDCl3):  195,2, 143,5, 141,4, 140,4, 140,2, 138,4, 135,6, 135,0, 133,1, 132,2, 130,9, 128,9, 128,8, 128,6, 128,4, 127,8, 127,2, 126,8, 120,9, 119,5, 117,2.
Получение 43 195,2, 143,5, 141,4, 140,4, 140,2, 138,4, 135,6, 135,0, 133,1, 132,2, 130,9, 128,9, 128,8, 128,6, 128,4, 127,8, 127,2, 126,8, 120,9, 119,5, 117,2.
Получение 432-хлор-2′-метил-4-(2-нитрофениламино)бензофенон (соединение 243) Общая процедура 2 Исходное соединение III: 4-амино-2-хлор-2′-метилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:9 и затем метиленхлорида/пентана 2:1. 13С-ЯМР (CDCl3):  196,4, 142,7, 140,1, 139,0, 137,6, 135,8, 135,1, 134,7, 134,0, 132,2, 131,8, 131,7, 130,6, 126,9, 125,6, 123,0, 119,8, 119,7, 117,1, 20,9.
Получение 44 196,4, 142,7, 140,1, 139,0, 137,6, 135,8, 135,1, 134,7, 134,0, 132,2, 131,8, 131,7, 130,6, 126,9, 125,6, 123,0, 119,8, 119,7, 117,1, 20,9.
Получение 443-циано-4′-(2-нитрофениламино)бензофенон (соединение 244) Общая процедура 2 Исходное соединение III: 4-амино-3′-цианобензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:3. 13С-ЯМР (CDCl3):  192,8, 144,4, 139,8, 138,9, 135,7, 135,5, 135,2, 133,6, 133,2, 132,2, 131,6, 129,5, 126,9, 120,7, 120,0, 118,0, 117,5, 112,8.
Получение 45 192,8, 144,4, 139,8, 138,9, 135,7, 135,5, 135,2, 133,6, 133,2, 132,2, 131,6, 129,5, 126,9, 120,7, 120,0, 118,0, 117,5, 112,8.
Получение 454-(2-нитрофениламино)-4′-фенилбензофенон (соединение 245) Общая процедура 2 Исходное соединение III: 4-амино-4′-фенилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: растирание в диэтиловом эфире с последующей хроматографией с применением в качестве элюента этилацетата/пентана 1:8. 13С-ЯМР (ДМСО-d6):  193,7, 145,4, 143,6, 139,0, 138,0, 137,6, 136,4, 135,4, 131,7, 130,5, 130,0, 129,0, 128,2, 126,9, 126,6, 126,1, 121,2, 120,4, 118,6.
Получение 46 193,7, 145,4, 143,6, 139,0, 138,0, 137,6, 136,4, 135,4, 131,7, 130,5, 130,0, 129,0, 128,2, 126,9, 126,6, 126,1, 121,2, 120,4, 118,6.
Получение 462-метил-4′-(4-нитрофениламино)бензофенон (соединение 246) Общая процедура 2 Исходное соединение III: 4-амино-2′-метилбензофенон Исходное соединение IVb: 1-фтор-4-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4 и затем 1:2. 13С-ЯМР (CDCl3):  197,3, 147,8, 145,2, 141,2, 138,9, 136,3, 132,4, 132,0, 131,0, 130,1, 128,0, 126,0, 125,3, 118,0, 116,2, 19,8.
Получение 47 197,3, 147,8, 145,2, 141,2, 138,9, 136,3, 132,4, 132,0, 131,0, 130,1, 128,0, 126,0, 125,3, 118,0, 116,2, 19,8.
Получение 472-гидрокси-4′-(2-нитрофениламино)бензофенон (соединение 247) К охлажденному (-78oС) раствору 2-метокси-4′-(2-нитрофениламино)бензофенона (соединение 215, 0,35 г, 1 ммоль) в метиленхлориде (10 мл) в атмосфере аргона добавляли при перемешивании трибромид бора (0,1 мл, 1 ммоль). Температуре реакционной смеси давали дойти до комнатной температуры. После перемешивания в течение 3 часов реакционную смесь выливали в насыщенный бикарбонат натрия (50 мл) и затем экстрагировали этилацетатом (2 х 50 мл). Органическую фазу сушили (MgSO4), фильтровали и упаривали для получения целевого соединения. Т. пл.: 189-193oС. 13С-ЯМР (CDCl3):  199,8, 163,1, 143,1, 140,5, 136,2, 135,7, 135,0, 133,6, 133,2, 131,4, 126,9, 121,2, 119,4, 119,2, 118,7, 118,5, 117,1.
Получение 48 199,8, 163,1, 143,1, 140,5, 136,2, 135,7, 135,0, 133,6, 133,2, 131,4, 126,9, 121,2, 119,4, 119,2, 118,7, 118,5, 117,1.
Получение 482-этил-4′-(2-нитрофениламино)бензофенон (соединение 248) Общая процедура 2 Исходное соединение III: 4-амино-2′-этилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента диэтилового эфира/пентана 1:4. 13С-ЯМР (CDCl3):  197,1, 144,1, 142,8, 140,1, 138,5, 135,6, 135,2, 133,4, 132,2, 130,2, 129,4, 128,0, 126,8, 125,2, 120,7, 119,6, 117,4, 26,4, 15,9.
Получение 49 197,1, 144,1, 142,8, 140,1, 138,5, 135,6, 135,2, 133,4, 132,2, 130,2, 129,4, 128,0, 126,8, 125,2, 120,7, 119,6, 117,4, 26,4, 15,9.
Получение 494-(2-нитрофениламино)-2′-(феноксиметил)бензофенон (соединение 249) Общая процедура 2 Исходное соединение III: 4-амино-2′-(феноксиметил) бензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 13С-ЯМР (CDCl3):  196,1, 158,4, 144,0, 140,2, 137,7, 136,7, 135,6, 135,2, 133,1, 132,2, 130,6, 129,4, 128,7, 128,6, 127,3, 126,8, 121,0, 120,7, 119,6, 117,4, 114,7, 67,5.
Получение 50 196,1, 158,4, 144,0, 140,2, 137,7, 136,7, 135,6, 135,2, 133,1, 132,2, 130,6, 129,4, 128,7, 128,6, 127,3, 126,8, 121,0, 120,7, 119,6, 117,4, 114,7, 67,5.
Получение 502-бром-4′-(2-нитрофениламино)бензофенон (соединение 250) Общая процедура 2 Исходное соединение III: 4-амино-2′-бромбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 13С-ЯМР (CDCl3):  194,2, 144,6, 140,8, 139,8, 135,6, 135,5, 133,2, 132,3, 131,6, 131,1, 128,9, 127,3, 126,8, 120,5, 119,9, 119,5, 117,6.
Получение 51 194,2, 144,6, 140,8, 139,8, 135,6, 135,5, 133,2, 132,3, 131,6, 131,1, 128,9, 127,3, 126,8, 120,5, 119,9, 119,5, 117,6.
Получение 512,3,5,6-тетраметил-4′-(2-нитрофениламино)бензофенон (соединение 251) Общая процедура 2 Исходное соединение III: 4′-амино-2,3,5,6-тетраметил-бензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента метиленхлорида/пентана 1:2 и затем 1:1. Т. пл.: 211-213oС. 13С-ЯМР (CDCl3):  200,0, 144,3, 140,0, 139,9, 135,6, 135,3, 134,2, 133,2, 131,8, 131,5, 129,7, 126,8, 120,8, 119,7, 117,5, 19,5, 16,3.
Получение 52 200,0, 144,3, 140,0, 139,9, 135,6, 135,3, 134,2, 133,2, 131,8, 131,5, 129,7, 126,8, 120,8, 119,7, 117,5, 19,5, 16,3.
Получение 523-метокси-2′-метил-4-(2-нитрофениламино)бензофенон (соединение 252) Общая процедура 2 Исходное соединение III: 4-амино-3-метокси-2′-метилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента метиленхлорида/пентана 2:3. 13С-ЯМР (CDCl3):  197,1, 150,2, 139,2, 138,9, 136,3, 136,1, 135,3, 134,3, 132,5, 130,9, 130,0, 128,0, 126,8, 125,2, 119,7, 117,8, 116,6, 111,2, 56,1, 19,8.
Получение 53 197,1, 150,2, 139,2, 138,9, 136,3, 136,1, 135,3, 134,3, 132,5, 130,9, 130,0, 128,0, 126,8, 125,2, 119,7, 117,8, 116,6, 111,2, 56,1, 19,8.
Получение 532′,3-диметил-4-(2-нитрофениламино)бензофенон (соединение 253) Общая процедура 2 Исходное соединение III: 4-амино-2′,3-диметилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:9. 13С-ЯМР (CDCl3):  197,5, 142,4, 141,0, 138,8, 136,5, 135,7, 134,6, 134,0, 133,3, 131,3, 131,0, 130,1, 129,5, 128,2, 126,8, 125,2, 121,3, 119,0, 117,0, 19,9, 18,0.
Получение 54 197,5, 142,4, 141,0, 138,8, 136,5, 135,7, 134,6, 134,0, 133,3, 131,3, 131,0, 130,1, 129,5, 128,2, 126,8, 125,2, 121,3, 119,0, 117,0, 19,9, 18,0.
Получение 542-аллилокси-4′-(2-нитрофениламино)бензофенон (соединение 254) Общая процедура 2 Исходное соединение III: 2-аллилокси-4′-аминобензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:9. 13С-ЯМР (CDCl3):  195,0, 156,2, 143,5, 140,6, 135,6, 135,0, 134,0, 132,5, 131,9, 131,7, 129,7, 129,3, 126,8, 120,9, 119,3, 117,2, 116,9, 112,8, 69,0.
Получение 55 195,0, 156,2, 143,5, 140,6, 135,6, 135,0, 134,0, 132,5, 131,9, 131,7, 129,7, 129,3, 126,8, 120,9, 119,3, 117,2, 116,9, 112,8, 69,0.
Получение 552-метокси-2′-метил-4-(2-нитрофениламино)бензофенон (соединение 255) Общая процедура 2 Исходное соединение III: 4-амино-2-метокси-2′-метилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 13С-ЯМР (CDCl3):  196,9, 160,2, 144,0, 140,8, 139,9, 137,4, 135,6, 134,8, 132,9, 131,1, 130,5, 129,3, 126,8, 125,4, 125,2, 119,2, 117,3, 113,5, 105,6, 55,9, 20,5.
Получение 56 196,9, 160,2, 144,0, 140,8, 139,9, 137,4, 135,6, 134,8, 132,9, 131,1, 130,5, 129,3, 126,8, 125,4, 125,2, 119,2, 117,3, 113,5, 105,6, 55,9, 20,5.
Получение 562-трет-бутокси-4′-(2-нитрофениламино)бензофенон (соединение 256) Общая процедура 2 Исходное соединение III: 4-амино-2′-трет-бутоксибензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:10. 13С-ЯМР (CDCl3):  196,1, 153,6, 143,4, 140,6, 135,6, 134,9, 134,8, 134,2, 131,8, 131,3, 129,7, 126,8, 123,0, 122,8, 120,9, 119,2, 117,2, 80,3, 28,8.
Получение 57 196,1, 153,6, 143,4, 140,6, 135,6, 134,9, 134,8, 134,2, 131,8, 131,3, 129,7, 126,8, 123,0, 122,8, 120,9, 119,2, 117,2, 80,3, 28,8.
Получение 572-хлор-4-(2-нитрофениламино)-2′-(трифторметил)бензофенон (соединение 257) Общая процедура 2 Исходное соединение III: 4-амино-2-хлор-2′-(трифторметил) бензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. Т. пл.: 125-127oС. 13С-ЯМР (CDCl3):  193,0, 144,4, 139,2, 135,8, 135,7, 134,3, 131,6, 131,1, 130,6, 128,8, 128,3, 127,0, 126,9, 123,6, 122,5, 120,5, 118,5, 117,8.
Получение 58 193,0, 144,4, 139,2, 135,8, 135,7, 134,3, 131,6, 131,1, 130,6, 128,8, 128,3, 127,0, 126,9, 123,6, 122,5, 120,5, 118,5, 117,8.
Получение 583-аллил-2-гидрокси-4′-(2-нитрофениламино)бензофенон (соединение 258) 2-аллилокси-4′-(2-нитрофениламино)бензофенон (соединение 254, 1,57 г, 4,2 ммоль) нагревали до 220oС в атмосфере аргона. Спустя 4 часа реакционную смесь охлаждали до комнатной температуры. Сырой продукт очищали хроматографией с применением в качестве элюента этилацетата/пентана 1:8 для получения целевого соединения. 13С-ЯМР (CDCl3):  200,1, 161,1, 143,0, 140,6, 136,3, 136,1, 135,7, 135,0, 133,8, 131,4, 129,5, 126,9, 121,2, 119,4, 118,7, 118,2, 117,1, 116,1, 33,6.
Получение 59 200,1, 161,1, 143,0, 140,6, 136,3, 136,1, 135,7, 135,0, 133,8, 131,4, 129,5, 126,9, 121,2, 119,4, 118,7, 118,2, 117,1, 116,1, 33,6.
Получение 592′-хлор-4-метокси-2,6-диметил-4′-(2-нитрофениламино) бензофенон (соединение 259) Общая процедура 2 Исходное соединение III: 4′-амино-2′-хлор-4-метокси-2,6-диметилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:9 и затем 1:4. 13С-ЯМР (CDCl3):  197,2, 160,1, 143,7, 139,5, 137,2, 135,7, 135,6, 135,2, 133,6, 133,0, 126,9, 123,0, 120,2, 118,9, 117,6, 113,4, 55,2, 20,2.
Получение 60 197,2, 160,1, 143,7, 139,5, 137,2, 135,7, 135,6, 135,2, 133,6, 133,0, 126,9, 123,0, 120,2, 118,9, 117,6, 113,4, 55,2, 20,2.
Получение 602-хлор-2′-метил-4-(2-нитро-4-метилфениламино)бензофенон соединение 260) Общая процедура 2 Исходное соединение III: 4-амино-2-хлор-2′-метил-бензофенон Исходное соединение IVa: 1-фтор-4-метил-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:9 и затем 1:4. 13С-ЯМР (CDCl3):  196,4, 143,3, 138,8, 137,8, 137,5, 136,9, 135,4, 134,1, 134,0, 132,3, 131,7, 131,6, 130,5, 130,1, 126,3, 125,5, 122,2, 118,8, 117,6, 20,8, 20,3.
Получение 61 196,4, 143,3, 138,8, 137,8, 137,5, 136,9, 135,4, 134,1, 134,0, 132,3, 131,7, 131,6, 130,5, 130,1, 126,3, 125,5, 122,2, 118,8, 117,6, 20,8, 20,3.
Получение 612-хлор-2′-метил-4-(4-нитрофениламино)бензофенон (соединение 261) Общая процедура 2 Исходное соединение III: 4-амино-2-хлор-2′-метилбензофенон Исходное соединение IVb: 1-фтор-4-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 13С-ЯМР (ДМСО-d6):  148,4, 144,7, 144,7, 139,9, 138,0, 137,4, 132,7, 132,7, 131,6, 131,5, 131,2, 129,8, 126,0, 125,9, 119,3, 116,5, 116,0, 20,2.
Получение 62 148,4, 144,7, 144,7, 139,9, 138,0, 137,4, 132,7, 132,7, 131,6, 131,5, 131,2, 129,8, 126,0, 125,9, 119,3, 116,5, 116,0, 20,2.
Получение 622-хлор-2′-метокси-4-(2-нитрофениламино)бензофенон (соединение 262) Общая процедура 2 Исходное соединение III: 4-амино-2-хлор-2′-метоксибензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента метиленхлорида/пентана 3:1. Т. пл.: 111-114oС. 13С-ЯМР (CDCl3):  ЕО 193,6, 158,8, 142,1, 140,5, 135,9, 135,8, 134,9, 133,9, 133,5, 131,7, 131,1, 128,3, 126,8, 123,0, 120,8, 119,9, 119,5, 117,0, 111,8, 55,8.
Получение 63 ЕО 193,6, 158,8, 142,1, 140,5, 135,9, 135,8, 134,9, 133,9, 133,5, 131,7, 131,1, 128,3, 126,8, 123,0, 120,8, 119,9, 119,5, 117,0, 111,8, 55,8.
Получение 632′-хлор-2,4,5-трифтор-4′-(2-нитрофениламино)бензофенон (соединение 263) Общая процедура 2 Исходное соединение III: 4′-амино-2-хлор-2,4,5-трифторбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:8. 13С-ЯМР (CDCl3):  185,1, 155,2, 147,9, 147,1, 144,8, 138,9, 136,1, 135,7, 135,4, 133,6, 131,4, 126,9, 122,1, 120,7, 119,9, 119,4, 118,6, 118,0, 111,6.
Получение 64 185,1, 155,2, 147,9, 147,1, 144,8, 138,9, 136,1, 135,7, 135,4, 133,6, 131,4, 126,9, 122,1, 120,7, 119,9, 119,4, 118,6, 118,0, 111,6.
Получение 642-хлор-2′,6′-диметил-4-(2-нитрофениламино)бензофенон (соединение 264) Общая процедура 2 Исходное соединение III: 4-амино-2-хлор-2′,6′-диметилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:9. 13С-ЯМР (CDCl3):  197,3, 144,1, 140,3, 139,2, 135,8, 135,7, 135,6, 134,6, 134,0, 131,6, 129,2, 127,9, 126,9, 123,0, 120,4, 118,6, 117,8, 19,6.
Получение 65 197,3, 144,1, 140,3, 139,2, 135,8, 135,7, 135,6, 134,6, 134,0, 131,6, 129,2, 127,9, 126,9, 123,0, 120,4, 118,6, 117,8, 19,6.
Получение 652-хлор-4′-фтор-2′-метил-4-(2-нитрофениламино)бензофенон (соединение 265) Общая процедура 2 Исходное соединение III: 4-амино-2-хлор-4′-фтор-2′-метилбензофенон Исходное соединение IVa: 1-фтор-2-нитробензол Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:10. 13С-ЯМР (CDCl3):  195,0, 162,4, 142,9, 142,8, 140,1, 135,8, 135,2, 134,7, 133,8, 133,8, 133,4, 131,9, 126,9, 123,0, 119,8, 119,7, 118,7, 117,1, 112,6, 21,2.
Получение 66 195,0, 162,4, 142,9, 142,8, 140,1, 135,8, 135,2, 134,7, 133,8, 133,8, 133,4, 131,9, 126,9, 123,0, 119,8, 119,7, 118,7, 117,1, 112,6, 21,2.
Получение 664-(5-гидрокси-2-нитрофениламино)бензофенон (соединение 266) Общая процедура 1 Исходное соединение III: 4-аминобензофенон Исходное соединение IVa: 3-фтор-4-нитрофенол Очистка: растирание в этаноле. Т. пл.: 235-238oС. 1H-ЯМР (ДМСО-d6):  10,94 (шир. с, 1Н), 9,64 (с, 1Н), 8,10 (д, 1Н), 7,84-7,63 (м, 5Н), 7,57 (м, 2Н), 7,47 (м, 2Н), 6,82 (д, 1Н), 6,47 (дв.д, 1Н).
Пример 1 10,94 (шир. с, 1Н), 9,64 (с, 1Н), 8,10 (д, 1Н), 7,84-7,63 (м, 5Н), 7,57 (м, 2Н), 7,47 (м, 2Н), 6,82 (д, 1Н), 6,47 (дв.д, 1Н).
Пример 14-(2-Аминофениламино)бензофенон (соединение 101) Общая процедура 3 Исходное соединение II: 201 Т. пл.: 115-116oС. 1H-ЯМР (CDCl3):  3,67 (шир. с, 2Н), 5,74 (шир.с, 1Н), 6,69 (д, 2Н), 6,75-6,85 (м, 2Н), 7,05-7,16 (м, 2Н), 7,40-7,60 (м, 3Н), 7,70-7,80 (м, 4Н).
Пример 2 3,67 (шир. с, 2Н), 5,74 (шир.с, 1Н), 6,69 (д, 2Н), 6,75-6,85 (м, 2Н), 7,05-7,16 (м, 2Н), 7,40-7,60 (м, 3Н), 7,70-7,80 (м, 4Н).
Пример 24-(4-Аминофениламино)бензофенон (соединение 102) Общая процедура 3 Исходное соединение II: 202 Т. пл.: 152-154oС. 1H-ЯМР (ДМСО-d6):  4,98 (шир.с, 2Н), 6,58 (д, 2Н), 6,79 (д, 2Н), 6,90 (д, 2Н), 7,50-7,65 (м, 7Н), 8,41 (шир.с, 1Н).
Пример 3 4,98 (шир.с, 2Н), 6,58 (д, 2Н), 6,79 (д, 2Н), 6,90 (д, 2Н), 7,50-7,65 (м, 7Н), 8,41 (шир.с, 1Н).
Пример 34-(2-Амино-4-метилфениламино)бензофенон (соединение 103) Общая процедура 3 Исходное соединение II: 203 Т. пл.: 153-155oС. 1H-ЯМР (ДМСО-d6):  2,19 (с, 3Н), 4,78 (шир.с, 2Н), 6,40 (дв.д, 1Н), 6,60 (шир.с, 1Н), 6,67 (д, 2Н), 6,90 (д, 1Н), 7,45-7,65 (м, 7Н), 7,98 (шир. с, 1Н).
Пример 4 2,19 (с, 3Н), 4,78 (шир.с, 2Н), 6,40 (дв.д, 1Н), 6,60 (шир.с, 1Н), 6,67 (д, 2Н), 6,90 (д, 1Н), 7,45-7,65 (м, 7Н), 7,98 (шир. с, 1Н).
Пример 44-(2-Амино-4-трифторметилфениламино)бензофенон (соединение 104) Общая процедура 3 Исходное соединение II: 204 Т. пл.: 184-186oС. 1H-ЯМР (ДМСО-d6):  5,37 (шир.с, 2Н), 6,88 (м, 3Н), 7,09 (шир.д, 1Н), 7,27 (д, 1Н), 7,50-7,70 (м, 7Н), 8,20 (шир.с, 1Н).
Пример 5 5,37 (шир.с, 2Н), 6,88 (м, 3Н), 7,09 (шир.д, 1Н), 7,27 (д, 1Н), 7,50-7,70 (м, 7Н), 8,20 (шир.с, 1Н).
Пример 53-Амино-4-(4-бензоилфениламино)бензойная кислота (соединение 105) Общая процедура 3 Исходное соединение II: 205 Очистка: кристаллизация из смеси воды и уксусной кислоты. Т. пл.: 205-207oС. 1H-ЯМР (ДМСО-d6):  5,17 (шир, 2Н), 6,92 (д, 2Н), 7,19 (м, 2Н), 7,43 (шир.с, 1Н), 7,50-7,65 (м, 8Н), 8,23 (шир.с, 1Н).
Пример 6 5,17 (шир, 2Н), 6,92 (д, 2Н), 7,19 (м, 2Н), 7,43 (шир.с, 1Н), 7,50-7,65 (м, 8Н), 8,23 (шир.с, 1Н).
Пример 65-Дмино-2-(4-бензоилфениламино)бензонитрил (соединение 106) Общая процедура 3 Исходное соединение II: 206 Т. пл.: 168-170oС. 1H-ЯМР (ДМСО-d6):  5,56 (шир.с, 2Н), 6,75 (д, 2Н), 6,91 (м, 2Н), 7,14 (м, 1Н), 7,50-7,70 (м, 7Н), 8,63 (шир.с, 1Н).
Пример 7 5,56 (шир.с, 2Н), 6,75 (д, 2Н), 6,91 (м, 2Н), 7,14 (м, 1Н), 7,50-7,70 (м, 7Н), 8,63 (шир.с, 1Н).
Пример 75-Амино-2-(4-бензоилфениламино)бензойная кислота (соединение 107) Общая процедура 3 Исходное соединение II: 207 Очистка: кристаллизация из этанола. Т. пл.: 222-223oС. 1Н-ЯМР (ДМСО-d6):  6,81 (дв.д, 1Н), 6,97 (д, 2Н), 7,18 (м, 2Н), 7,50-7,70 (м, 7Н), 7,60 (b, 3Н), 8,86 (шир.с, 1Н).
Пример 8 6,81 (дв.д, 1Н), 6,97 (д, 2Н), 7,18 (м, 2Н), 7,50-7,70 (м, 7Н), 7,60 (b, 3Н), 8,86 (шир.с, 1Н).
Пример 84-(4-Амино-2-метилфениламино)бензофенон (соединение 108) Общая процедура 3 Исходное соединение II: 208 Т. пл.: 140-142oС. 1H-ЯМР (ДМСО-d6):  2,03 (с, 3Н), 4,99 (шир.с, 2Н), 6,43 (дв.д, 1Н), 6,50 (м, 1Н), 6,56 (д, 2Н), 6,84 (д, 1Н), 7,45-7,65 (м, 7Н), 8,07 (с, 1Н).
Пример 9 2,03 (с, 3Н), 4,99 (шир.с, 2Н), 6,43 (дв.д, 1Н), 6,50 (м, 1Н), 6,56 (д, 2Н), 6,84 (д, 1Н), 7,45-7,65 (м, 7Н), 8,07 (с, 1Н).
Пример 94-(2-Аминофениламино)-2′-фторбензофенон (соединение 109) Общая процедура 4 Исходное соединение II: 209 Т. пл.: 153-154oС. 1H-ЯМР (CDCl3):  3,83 (шир.с, 2Н), 5,74 (шир.с, 1Н), 6,68 (д, 2Н), 6,78 (м, 2Н), 7,05-7,25 (м, 4Н), 7,45 (м, 2Н), 7,72 (д, 2Н).
Пример 10 3,83 (шир.с, 2Н), 5,74 (шир.с, 1Н), 6,68 (д, 2Н), 6,78 (м, 2Н), 7,05-7,25 (м, 4Н), 7,45 (м, 2Н), 7,72 (д, 2Н).
Пример 104-(2-Аминофениламино)-4′-фторбензофенон (соединение 110) Общая процедура 4 Исходное соединение II: 210 Очистка: растирание в диэтиловом эфире Т. пл.: 135-136oС. 1H-ЯМР (CDCl3):  3,79 (шир. с, 2Н), 5,73 (шир.с, 1Н), 6,69 (д, 2Н), 6,75-6,85 (м, 2Н), 7,07-7,17 (м, 4Н), 7,65-7,80 (м, 4Н).
Пример 11 3,79 (шир. с, 2Н), 5,73 (шир.с, 1Н), 6,69 (д, 2Н), 6,75-6,85 (м, 2Н), 7,07-7,17 (м, 4Н), 7,65-7,80 (м, 4Н).
Пример 114-(2-Аминофениламино)-4′-трет-бутилбензофенон (соединение 111) Общая процедура 4 Исходное соединение II: 211 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. Т. пл.: 183-185oС. 1H-ЯМР (CDCl3):  1,34 (с, 9Н), 3,81 (с, 2Н), 5,80 (шир.с, 1Н), 6,68 (д, 2Н), 6,77 (м, 2Н), 7,05-7,15 (м, 2Н), 7,45 (д, 2Н), 7,66 (д, 2Н), 7,74 (д, 2Н).
Пример 12 1,34 (с, 9Н), 3,81 (с, 2Н), 5,80 (шир.с, 1Н), 6,68 (д, 2Н), 6,77 (м, 2Н), 7,05-7,15 (м, 2Н), 7,45 (д, 2Н), 7,66 (д, 2Н), 7,74 (д, 2Н).
Пример 124-(2-Аминофениламино)-3′-фторбензофенон (соединение 112) Общая процедура 4 Исходное соединение II: 212 Очистка: растирание в диэтиловом эфире. Т. пл.: 115-116oС. 1H-ЯМР (CDCl3):  3,80 (шир. с, 2Н), 5,73 (шир.с, 1Н), 6,70 (д, 2Н), 6,75-6,85 (м, 2Н), 7,07-7,27 (м, 3Н), 7,35-7,52 (м, 3Н), 7,70 (д, 2Н).
Пример 13 3,80 (шир. с, 2Н), 5,73 (шир.с, 1Н), 6,70 (д, 2Н), 6,75-6,85 (м, 2Н), 7,07-7,27 (м, 3Н), 7,35-7,52 (м, 3Н), 7,70 (д, 2Н).
Пример 134-(2-Аминофениламино)-2′-хлорбензофенон (соединение 113) Общая процедура 4 Исходное соединение II: 213 Т. пл.: 182-183oС. 1H-ЯМР (CDCl3):  3,77 (шир. с, 2Н), 5,75 (шир.с, 1Н), 6,66 (д, 2Н), 6,72-6,85 (м, 2Н), 7,07-7,15 (м, 2Н), 7,30-7,45 (м, 4Н), 7,66 (д, 2Н).
Пример 14 3,77 (шир. с, 2Н), 5,75 (шир.с, 1Н), 6,66 (д, 2Н), 6,72-6,85 (м, 2Н), 7,07-7,15 (м, 2Н), 7,30-7,45 (м, 4Н), 7,66 (д, 2Н).
Пример 144-(2-Аминофениламино)-3′-хлорбензофенон (соединение 114) Общая процедура 4 Исходное соединение II: 214 Очистка: растирание в диэтиловом эфире. Т. пл.: 107-108oС (возгоняется). 1H-ЯМР (CDCl3):  3,00 (шир. с, 2Н), 5,73 (шир.с, 1Н), 6,70 (д, 2Н), 6,75-6,85 (м, 2Н), 7,07-7,17 (м, 2Н), 7,37 (т, 1Н), 7,50 (м, 1Н), 7,58 (м, 1Н), 7,70 (м, 3Н).
Пример 15 3,00 (шир. с, 2Н), 5,73 (шир.с, 1Н), 6,70 (д, 2Н), 6,75-6,85 (м, 2Н), 7,07-7,17 (м, 2Н), 7,37 (т, 1Н), 7,50 (м, 1Н), 7,58 (м, 1Н), 7,70 (м, 3Н).
Пример 154-(2-Аминофениламино)-2′-метоксибензофенон (соединение 115) Общая процедура 4 Исходное соединение II: 215 1H-ЯМР (CDCl3):  3,72 (с, 3Н), 3,77 (шир.с, 2Н), 5,57 (шир.с, 1Н), 6,63 (д, 2Н), 6,77 (м, 2Н), 6,95-7,15 (м, 4Н), 7,26 (м, 1Н), 7,40 (м, 1Н), 7,68 (д, 2Н).
Пример 16 3,72 (с, 3Н), 3,77 (шир.с, 2Н), 5,57 (шир.с, 1Н), 6,63 (д, 2Н), 6,77 (м, 2Н), 6,95-7,15 (м, 4Н), 7,26 (м, 1Н), 7,40 (м, 1Н), 7,68 (д, 2Н).
Пример 164-(2-Аминофениламино)-3′-(диметиламино)бензофенон (соединение 116) Общая процедура 4 Исходное соединение II: 216 1Н-ЯМР (CDCl3):  2,96 (с, 6Н), 3,79 (шир.с, 2Н), 5,69 (шир.с, 1Н), 6,68 (д, 2Н), 6,75-6,90 (м, 3Н), 7,00 (шир.д, 1Н), 7,05-7,16 (м, 3Н), 7,26 (д, 1Н), 7,76 (д, 2Н).
Пример 17 2,96 (с, 6Н), 3,79 (шир.с, 2Н), 5,69 (шир.с, 1Н), 6,68 (д, 2Н), 6,75-6,90 (м, 3Н), 7,00 (шир.д, 1Н), 7,05-7,16 (м, 3Н), 7,26 (д, 1Н), 7,76 (д, 2Н).
Пример 174-(2-Аминофениламино)-4′-хлорбензофенон (соединение 117) Общая процедура 4 Исходное соединение II: 217 Очистка: растирание в диэтиловом эфире. Т. пл.: 164-167oС. 1H-ЯМР (CDCl3):  3,80 (шир. с, 2Н), 5,60 (шир.с, 1Н), 6,70 (д, 2Н), 6,75-6,85 (м, 2Н), 7,07-7,17 (м, 2Н), 7,41 (д, 2Н), 7,65-7,75 (м, 4Н) 3,80 (шир. с, 2Н), 5,60 (шир.с, 1Н), 6,70 (д, 2Н), 6,75-6,85 (м, 2Н), 7,07-7,17 (м, 2Н), 7,41 (д, 2Н), 7,65-7,75 (м, 4Н)Пример 18 4-(2-Аминофениламино)-3′-метилбензофенон (соединение 118) Общая процедура 4 Исходное соединение II: 218 Очистка: растирание в диэтиловом эфире. Т. пл.: 119-120oС. 1H-ЯМР (CDCl3):  2,39 (с, 3Н), 3,80 (шир.с, 1Н), 5,75 (шир.с, 1Н), 6,70 (д, 2Н), 6,75-6,85 (м, 2Н), 7,05-7,17 (м, 2Н), 7,31 (м, 2Н), 7,47-7,55 (м, 2Н), 7,72 (д, 2Н).
Пример 19 2,39 (с, 3Н), 3,80 (шир.с, 1Н), 5,75 (шир.с, 1Н), 6,70 (д, 2Н), 6,75-6,85 (м, 2Н), 7,05-7,17 (м, 2Н), 7,31 (м, 2Н), 7,47-7,55 (м, 2Н), 7,72 (д, 2Н).
Пример 193-Амино-4-(4-аминофениламино)бензофенон (соединение 119) Общая процедура 3 Исходное соединение II: 219 Т. пл.: 151-153oС. 1Н-ЯМР (ДМСО-d6):  4,92 (с, 2Н), 4,96 (шир.с, 2Н), 6,58 (д, 2Н), 6,67 (д, 1Н), 6,89 (м, 3Н), 7,06 (с, 1Н), 7,16 (д, 1Н), 7,45-7,65 (м, 5Н).
Пример 20 4,92 (с, 2Н), 4,96 (шир.с, 2Н), 6,58 (д, 2Н), 6,67 (д, 1Н), 6,89 (м, 3Н), 7,06 (с, 1Н), 7,16 (д, 1Н), 7,45-7,65 (м, 5Н).
Пример 204-(2-Аминофениламино)-4′-н-пентилбензофенон (соединение 120) Общая процедура 4 Исходное соединение II: 220 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 1H-ЯМР (CDCl3):  0,91 (т, 3Н), 1,30-1,50 (м, 4Н), 1,70 (м, 2Н), 2,99 (т, 2Н), 3,80 (шир. с, 2Н), 5,70 (шир.с, 1Н), 6,70 (д, 2Н), 6,75-6,85 (м, 2Н), 7,05-7,20 (м, 2Н), 7,30 (д, 2Н), 7,66 (д, 2Н), 7,71 (д, 2Н).
Пример 21 0,91 (т, 3Н), 1,30-1,50 (м, 4Н), 1,70 (м, 2Н), 2,99 (т, 2Н), 3,80 (шир. с, 2Н), 5,70 (шир.с, 1Н), 6,70 (д, 2Н), 6,75-6,85 (м, 2Н), 7,05-7,20 (м, 2Н), 7,30 (д, 2Н), 7,66 (д, 2Н), 7,71 (д, 2Н).
Пример 214′-(2-Аминофениламино)-4-хлор-2-(изопропилтио)бензофенон (соединение 121) Общая процедура 4 Исходное соединение II: 221 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:3. 1H-ЯМР (CDCl3):  1,21 (д, 6Н), 3,38 (м, 1Н), 3,77 (шир.с, 2Н), 5,80 (шир. с, 1Н), 6,65 (д, 2Н), 6,72-6,85 (м, 2Н), 7,05-7,15 (м, 2Н), 7,20 (м, 2Н), 7,45 (шир.с, 1Н), 7,63 (д, 2Н).
Пример 22 1,21 (д, 6Н), 3,38 (м, 1Н), 3,77 (шир.с, 2Н), 5,80 (шир. с, 1Н), 6,65 (д, 2Н), 6,72-6,85 (м, 2Н), 7,05-7,15 (м, 2Н), 7,20 (м, 2Н), 7,45 (шир.с, 1Н), 7,63 (д, 2Н).
Пример 224-(2-Аминофениламино)-4′-(трифторметил)бензофенон (соединение 122) Общая процедура 4 Исходное соединение II: 222 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. Т. пл.: 83-85oС. 1H-ЯМР (CDCl3):  3,80 (шир.с, 2Н), 5,76 (шир.с, 1Н), 6,65-6,85 (м, 4Н), 7,12 (м, 2Н), 7,65-7,85 (м, 6Н).
Пример 23 3,80 (шир.с, 2Н), 5,76 (шир.с, 1Н), 6,65-6,85 (м, 4Н), 7,12 (м, 2Н), 7,65-7,85 (м, 6Н).
Пример 23N-(2-(4-бензоилфениламино)фенил)этансульфонамид (соединение 123) Общая процедура 5 Исходное соединение I: 101 T. пл.: 174-175oС. 1H-ЯМР (ДМСО-d6):  1,12 (т, 3Н), 3,01 (кв, 2H), 6,96 (д, 2H), 7,15 (дв. т, 1Н), 7,24 (дв.т, 1Н), 7,42 (дв.т, 2H), 7,50-7,70 (м, 7Н), 8,17 (с, 1Н), 9,03 (шир.с, 1Н).
Пример 24 1,12 (т, 3Н), 3,01 (кв, 2H), 6,96 (д, 2H), 7,15 (дв. т, 1Н), 7,24 (дв.т, 1Н), 7,42 (дв.т, 2H), 7,50-7,70 (м, 7Н), 8,17 (с, 1Н), 9,03 (шир.с, 1Н).
Пример 24N-(2-(4-бензоилфениламино)фенил)бензолсульфонамид (соединение 124) Общая процедура 5 Исходное соединение I: 101 Т. пл.: 175-177oС. 1H-ЯМР (ДМСО-d6):  6,69 (д, 2H), 7,03 (т, 1Н), 7,15-7,45 (м, 6Н), 7,53-7,70 (м, 9Н), 7,99 (с, 1Н), 9,59 (с, 1Н).
Пример 25 6,69 (д, 2H), 7,03 (т, 1Н), 7,15-7,45 (м, 6Н), 7,53-7,70 (м, 9Н), 7,99 (с, 1Н), 9,59 (с, 1Н).
Пример 25N-(4-(4-бензоилфениламино)фенил)метансульфонамид (соединение 125) Общая процедура 5 Исходное соединение I: 101 Т. пл.: 179-180oС. 1H-ЯМР (ДМСО-d6):  2,96 (с, 3Н), 7,05 (д, 2Н), 7,20 (с, 4Н), 7,50-7,70 (м, 7Н), 8,86 (с, 1Н), 9,54 (шир.с, 1Н).
Пример 26 2,96 (с, 3Н), 7,05 (д, 2Н), 7,20 (с, 4Н), 7,50-7,70 (м, 7Н), 8,86 (с, 1Н), 9,54 (шир.с, 1Н).
Пример 26N-(2-(4-бензоилфениламино)фенил)метансульфонамид (соединение 126) Общая процедура 5 Исходное соединение I: 101 Т. пл.: 146-148oС. 1H-ЯМР (ДМСО-d6):  2,92 (с, 3Н), 6,99 (д, 2Н), 7,17 (дв.т, 1Н), 7,25 (дв.т, 1Н), 7,43 (м, 2Н), 7,50-7,70 (м, 7Н), 8,17 (с, 1Н), 9,03 (шир.с, 1Н).
Пример 27 2,92 (с, 3Н), 6,99 (д, 2Н), 7,17 (дв.т, 1Н), 7,25 (дв.т, 1Н), 7,43 (м, 2Н), 7,50-7,70 (м, 7Н), 8,17 (с, 1Н), 9,03 (шир.с, 1Н).
Пример 27N-(2-(4-бензоилфениламино)фенил)-4-толуолсульфонамид (соединение 127) Общая процедура 5 Исходное соединение I: 101 Т. пл.: 194-195oС. 1H-ЯМР (ДМСО-d6):  2,10 (с, 3Н), 6,62 (д, 2Н), 7,00-7,70 (м, 15Н), 7,95 (с, 1Н), 9,47 (шир.с, 1Н).
Пример 28 2,10 (с, 3Н), 6,62 (д, 2Н), 7,00-7,70 (м, 15Н), 7,95 (с, 1Н), 9,47 (шир.с, 1Н).
Пример 281-(2-(4-бензоилфениламино)фенил)-3-фенилмочевина (соединение 128) К раствору 4-(2-аминофениламино)бензофенона (соединение 101, 0,58 г, 2 ммоль) в толуоле (10 мл) добавляли фенилизоционат (0,22 мл, 2 ммоль). Реакционную смесь нагревали в течение 20 часов в паровой бане. После охлаждения реакционной смеси до комнатной температуры образовавшийся осадок собирали фильтрацией и промывали толуолом. Сырой продукт растворяли в горячем изопропиловом спирте и кристаллизовали с помощью добавления воды для получения целевого соединения. Т. пл.: 154-156oС. 1H-ЯМР (ДМСО-d6):  6,79 (д, 2Н), 6,95 (т, 1Н), 7,06 (дв.т, 1Н), 7,20 (дв. т, 1Н), 7,24 (м, 3Н), 7,43 (д, 2Н), 7,47 (м, 2Н), 7,66 (м, 5Н), 8,09 (дв.д, 1Н), 8,18 (с, 1Н), 8,35 (с, 1Н), 9,21 (с, 1Н).
Пример 29 6,79 (д, 2Н), 6,95 (т, 1Н), 7,06 (дв.т, 1Н), 7,20 (дв. т, 1Н), 7,24 (м, 3Н), 7,43 (д, 2Н), 7,47 (м, 2Н), 7,66 (м, 5Н), 8,09 (дв.д, 1Н), 8,18 (с, 1Н), 8,35 (с, 1Н), 9,21 (с, 1Н).
Пример 29N-(2-(4-бензоилфениламино)фенил)ацетамид (соединение 129) 4-(2-Аминофениламино)бензофенон (соединение 101, 0,58 г, 2 ммоль) растворяли в уксусном ангидриде (10 мл) и раствор перемешивали при комнатной температуре в течение 3 часов. Осадок, который образовался за 75 мин, отфильтровывали и промывали водой для получения целевого соединения. Т. пл.: 155-157oС. 1H-ЯМР (ДМСО-d6):  2,03 (с, 3Н), 6,90 (д, 2Н), 7,07-7,20 (м, 2Н), 7,36 (дв.д, 1Н), 7,50-7,70 (м, 8Н), 8,17 (с, 1H), 9,45 (шир.с, 1Н).
Пример 30 2,03 (с, 3Н), 6,90 (д, 2Н), 7,07-7,20 (м, 2Н), 7,36 (дв.д, 1Н), 7,50-7,70 (м, 8Н), 8,17 (с, 1H), 9,45 (шир.с, 1Н).
Пример 30Оксим 4-(2-аминофениламино)бензофенона (соединение 130) К раствору 4-(2-аминофениламино)бензофенона (соединение 101, 0,58 г, 2 ммоль) и гидрохлорида гидроксиламина (0,42 г, 6 ммоль) в этаноле (30 мл) добавляли ацетат натрия (0,49 г, 6 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 30 часов, охлаждали до комнатной температуры, фильтровали и упаривали под вакуумом. Остаток обрабатывали водой (10 мл) и разбавленной гидроокисью аммония (5 мл). Образовавшийся осадок отфильтровывали, промывали водой и сушили для получения соединения, указанного в заголовке. Т. пл.: 89-91oС. 1H-ЯМР (ДМСО-d6):  4,75 (шир.с, 1H), 4,79 (шир.с, 1H), 6,50-7,50 (м, 14Н), 10,8 (с, 0,5Н), 11,10 (шир.с, 0,5Н).
Пример 31 4,75 (шир.с, 1H), 4,79 (шир.с, 1H), 6,50-7,50 (м, 14Н), 10,8 (с, 0,5Н), 11,10 (шир.с, 0,5Н).
Пример 31O-метилоксим 4-(2-аминофениламино)бензофенона (соединение 131) К раствору 4-(2-аминофениламино)бензофенона (соединение 101, 0,29 г, 1 ммоль) и гидрохлорида O-метилгидроксиламина (0,30 г, 3,5 ммоль) в этаноле (10 мл) добавляли ацетат натрия (0,30 г, 4 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 25 часов, охлаждали до комнатной температуры, фильтровали и упаривали под вакуумом. Остаток обрабатывали разведенной гидроокисью аммония (10 мл) и экстрагировали этилацетатом (2 х 25 мл). Органическую фазу сушили (МgSO4), фильтровали и упаривали под вакуумом. Остаток растворяли в диэтиловом эфире и подкисляли соляной кислотой в диэтиловом эфире. Гидрохлорид соединения, указанного в заголовке, немедленно преципитировал. Осадок растирали в этилацетате и промывали диэтиловым эфиром для получения целевого соединения в виде гидрохлорида. Т. пл.: 186-187oС (в виде гидрохлорида). 1H-ЯМР (ДМСО-d6) (в виде гидрохлорида)  3,88+3,82 (2с, 3Н), 6,90-7,50 (м, 13Н), 8,61 (шир.с, 3Н), 9,75 (оч.шир.с, 1Н).
Пример 32 3,88+3,82 (2с, 3Н), 6,90-7,50 (м, 13Н), 8,61 (шир.с, 3Н), 9,75 (оч.шир.с, 1Н).
Пример 32Этил N-(2-(4-бензоилфениламино)фенил)карбамат (соединение 132) Общая процедура 6, но с заменой йодистого метила этилхлорформиатом Исходное соединение I: 101 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4 Т. пл.: 112-114oС. 1Н-ЯМР (ДМСО-d6):  1,20 (т, 3Н), 4,09 (кв, 2Н), 6,87 (д, 2Н), 7,13 (м, 2Н), 7,32 (м, 1Н), 7,50-7,70 (м, 8Н), 8,20 (с, 1Н), 8,75 (с, 1Н).
Пример 33 1,20 (т, 3Н), 4,09 (кв, 2Н), 6,87 (д, 2Н), 7,13 (м, 2Н), 7,32 (м, 1Н), 7,50-7,70 (м, 8Н), 8,20 (с, 1Н), 8,75 (с, 1Н).
Пример 33Этил 2-(2-(4-бензоилфениламино)фениламино)ацетат (соединение 133) Общая процедура 6, но с заменой йодистого метила этилбромацетатом Исходное соединение I: 101 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 3:7. Т. пл.: 152-156oС (в виде гидрохлорида). 1H-ЯМР (ДМСО-d6) (в виде гидрохлорида)  1,18 (т, 3Н), 3,96 (с, 2Н), 4,10 (кв, 2Н), 6,58 (д, 1Н), 6,65-6,80 (м, 3Н), 7,07 (м, 2Н), 7,45-7,65 (м, 7Н), 7,70 (оч. шир. с, 3Н).
Пример 34 1,18 (т, 3Н), 3,96 (с, 2Н), 4,10 (кв, 2Н), 6,58 (д, 1Н), 6,65-6,80 (м, 3Н), 7,07 (м, 2Н), 7,45-7,65 (м, 7Н), 7,70 (оч. шир. с, 3Н).
Пример 344-(2-(метиламино)фениламино)бензофенон (соединение 134) Общая процедура 6 Исходное соединение I: 101 Т. пл.: 131-133oС. 1H-ЯМР (ДМСО-d6):  2,72 (д, 3Н), 5,06 (кв, 1Н), 6,55-6,72 (м, 4Н), 7,08 (м, 2Н), 7,45-7,65 (м, 7Н), 8,02 (с, 1Н).
Пример 35 2,72 (д, 3Н), 5,06 (кв, 1Н), 6,55-6,72 (м, 4Н), 7,08 (м, 2Н), 7,45-7,65 (м, 7Н), 8,02 (с, 1Н).
Пример 354-(2-(диметиламино)фениламино)бензофенон (соединение 135) Общая процедура 6, но при использовании 5 ммоль метилйодида. Исходное соединение I: 101 Т. пл.: 99-101oС. 1H-ЯМР (ДМСО-d6):  2,63 (с, 6Н), 6,95-7,12 (м, 5Н), 7,27 (дв.д, 1Н), 7,50-7,67 (м, 7Н), 8,18 (с, 1Н).
Пример 36 2,63 (с, 6Н), 6,95-7,12 (м, 5Н), 7,27 (дв.д, 1Н), 7,50-7,67 (м, 7Н), 8,18 (с, 1Н).
Пример 364′-(2-аминофениламино)-3,4,5-триметоксибензофенон (соединение 136) Общая процедура 4 Исходное соединение II: 223 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4 и затем 1:1. Т. пл.: сублимируется при 60oC. 13С-ЯМР (CDCl3):  194,3, 152,8, 150,0, 142,8, 141,2, 134,0, 132,7, 127,8, 127,4, 126,8, 125,9, 119,1, 116,4, 113,2, 107,3, 61,0, 56,3.
Пример 37 194,3, 152,8, 150,0, 142,8, 141,2, 134,0, 132,7, 127,8, 127,4, 126,8, 125,9, 119,1, 116,4, 113,2, 107,3, 61,0, 56,3.
Пример 37N-(2-аминофенил)-N-метил-4-аминобензофенон (соединение 137) Общая процедура 3 Исходное соединение II: 224 Очистка: кристаллизация из диэтилового эфира в виде гидрохлорида. Т. пл.: 169-172oС. 1H-ЯМР (ДМСО-d6):  8,5-5,5 (шир.с, 3Н), 7,63 (м, 4Н), 7,52 (м, 2Н), 7,36 (шир.д, 2Н), 7,23 (м, 3Н), 6,64 (д, 2Н), 3,26 (с, 3Н).
Пример 38 8,5-5,5 (шир.с, 3Н), 7,63 (м, 4Н), 7,52 (м, 2Н), 7,36 (шир.д, 2Н), 7,23 (м, 3Н), 6,64 (д, 2Н), 3,26 (с, 3Н).
Пример 384-(2-аминофениламино)-2′-метилбензофенон (соединение 138) Общая процедура 4 Исходное соединение II: 225 Очистка: растирание в диэтиловом эфире. Т. пл.: 168-170oС. 13С-ЯМР (CDCl3):  197,0, 150,5, 142,8, 139,7, 135,8, 132,7, 130,6, 129,4, 128,1, 127,6, 127,4, 126,8, 125,6, 125,1, 119,1, 116,3, 113,2, 19,7.
Пример 39 197,0, 150,5, 142,8, 139,7, 135,8, 132,7, 130,6, 129,4, 128,1, 127,6, 127,4, 126,8, 125,6, 125,1, 119,1, 116,3, 113,2, 19,7.
Пример 394′-(2-аминофениламино)-3,4-этилендиоксибензофенон (соединение 139) Общая процедура 4 Исходное соединение II: 227 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. Т. пл.: 168-170oС. 13С-ЯМР (ДМСО-d6):  192,0, 150,7, 146,4, 143,6, 142,8, 131,9, 131,6, 125,9, 125,6, 124,9, 123,0, 118,1, 116,6, 116,3, 115,4, 112,4, 64,3, 63,9.
Пример 40 192,0, 150,7, 146,4, 143,6, 142,8, 131,9, 131,6, 125,9, 125,6, 124,9, 123,0, 118,1, 116,6, 116,3, 115,4, 112,4, 64,3, 63,9.
Пример 404-(2-аминофениламино)-2,4′-дихлорбензофенон (соединение 140) Общая процедура 4 Исходное соединение II: 228 Очистка: растирание в диэтиловом эфире. 13С-ЯМР (CDCl3):  193,7, 149,2, 142,9, 139,3, 136,3, 134,1, 132,3, 131,4, 128,7, 127,7, 127,4, 126,9, 125,4, 119,2, 116,4, 115,1, 112,0.
Пример 41 193,7, 149,2, 142,9, 139,3, 136,3, 134,1, 132,3, 131,4, 128,7, 127,7, 127,4, 126,9, 125,4, 119,2, 116,4, 115,1, 112,0.
Пример 414′-(2-аминофениламино)-2,4-дихлорбензофенон (соединение 141) Общая процедура 4 Исходное соединение II: 226 Очистка: растирание в диэтиловом эфире. 13С-ЯМР (CDCl3):  192,3, 151,1, 142,8, 137,8, 135,8, 132,7, 132,1, 129,8, 129,8, 127,7, 127,0, 126,9, 126,7, 125,3, 119,1, 116,4, 113,3.
Пример 42 192,3, 151,1, 142,8, 137,8, 135,8, 132,7, 132,1, 129,8, 129,8, 127,7, 127,0, 126,9, 126,7, 125,3, 119,1, 116,4, 113,3.
Пример 424-(2-аминофениламино)-4′-(1-метилбутилокси)бензофенон (соединение 142) Общая процедура 4 Исходное соединение II: 229 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 13С-ЯМР (CDCl3):  194,2, 161,4, 149,5, 142,8, 132,5, 132,1, 130,7, 128,5, 127,2, 126,6, 126,2, 119,1, 116,3, 114,8, 113,2, 73,7, 38,5, 19,7, 18,7, 14,0.
Пример 43 194,2, 161,4, 149,5, 142,8, 132,5, 132,1, 130,7, 128,5, 127,2, 126,6, 126,2, 119,1, 116,3, 114,8, 113,2, 73,7, 38,5, 19,7, 18,7, 14,0.
Пример 434-(2-аминофениламино)-3′-(трифторметил)бензофенон (соединение 143) Общая процедура 4 Исходное соединение II: 232 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 13С-ЯМР (CDCl3):  193,6, 150,5, 142,9, 139,6, 132,9, 132,6, 130,7, 128,7, 127,9, 127,6, 127,0, 126,9, 126,2, 125,6, 123,8, 119,2, 116,4, 113,3.
Пример 44 193,6, 150,5, 142,9, 139,6, 132,9, 132,6, 130,7, 128,7, 127,9, 127,6, 127,0, 126,9, 126,2, 125,6, 123,8, 119,2, 116,4, 113,3.
Пример 444′-(2-аминофениламино)-2,3-диметоксибензофенон (соединение 144) Общая процедура 4 Исходное соединение II: 230 Очистка: кристаллизация из метанола. 13С-ЯМР (CDCl3):  194,3, 152,7, 150,4, 146,5, 142,8, 135,1, 132,6, 128,1, 127,3, 126,8, 125,7, 123,9, 120,3, 119,1, 116,3, 113,6, 113,1, 61,8, 55,9.
Пример 45 194,3, 152,7, 150,4, 146,5, 142,8, 135,1, 132,6, 128,1, 127,3, 126,8, 125,7, 123,9, 120,3, 119,1, 116,3, 113,6, 113,1, 61,8, 55,9.
Пример 454-(2-аминофениламино)-3′-бутоксибензофенон (соединение 145) Общая процедура 4 Исходное соединение II: 231 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 13С-ЯМР (CDCl3):  195,1, 159,0, 150,0, 142,8, 140,1, 132,8, 129,0, 127,9, 127,3, 126,8, 125,9, 122,0, 119,1, 118,3, 116,4, 114,8, 113,2, 67,9, 31,3, 19,2, 13,8.
Пример 46 195,1, 159,0, 150,0, 142,8, 140,1, 132,8, 129,0, 127,9, 127,3, 126,8, 125,9, 122,0, 119,1, 118,3, 116,4, 114,8, 113,2, 67,9, 31,3, 19,2, 13,8.
Пример 464-(2-аминофениламино)-4′-этоксибензофенон (соединение 146) Общая процедура 4 Исходное соединение II: 235 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 13С-ЯМР (CDCl3):  194,2, 162,0, 149,5, 142,8, 132,5, 132,0, 131,0, 128,5, 127,2, 126,6, 126,2, 119,1, 116,3, 113,8, 113,2, 63,7, 14,7.
Пример 47 194,2, 162,0, 149,5, 142,8, 132,5, 132,0, 131,0, 128,5, 127,2, 126,6, 126,2, 119,1, 116,3, 113,8, 113,2, 63,7, 14,7.
Пример 474′-(2-аминофениламино)-3,5-дихлорбензофенон (соединение 147) Общая процедура 4 Исходное соединение II: 233 Очистка: кристаллизация из этанола. 13С-ЯМР (ДМСО-d6):  190,4, 151,7, 143,7, 142,2, 134,1, 132,4, 130,3, 127,1, 126,3, 125,9, 124,4, 124,0, 116,3, 115,5, 112,6.
Пример 48 190,4, 151,7, 143,7, 142,2, 134,1, 132,4, 130,3, 127,1, 126,3, 125,9, 124,4, 124,0, 116,3, 115,5, 112,6.
Пример 484-(2-аминофениламино)-4′-бензилоксибензофенон (соединение 148) Общая процедура 4 Исходное соединение II: 234 Очистка: кристаллизация из этанола. 13С-ЯМР (CDCl3):  194,1, 161,7, 149,6, 142,8, 136,4, 132,5, 132,0, 131,4, 128,7, 128,4, 128,2, 127,5, 127,2, 126,6, 126,1, 119,1, 116,3, 114,2, 113,2, 70,1.
Пример 49 194,1, 161,7, 149,6, 142,8, 136,4, 132,5, 132,0, 131,4, 128,7, 128,4, 128,2, 127,5, 127,2, 126,6, 126,1, 119,1, 116,3, 114,2, 113,2, 70,1.
Пример 494′-(2-аминофениламино)-3-метокси-4-метилбензофенон (соединение 149) Общая процедура 4 Исходное соединение II: 237 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 13С-ЯМР (CDCl3):  195,0, 157,7, 149,8, 142,8, 137,5, 132,7, 131,1, 129,8, 128,2, 127,3, 126,7, 126,0, 122,6, 119,1, 116,3, 113,2, 110,6, 55,4, 16,4.
Пример 50 195,0, 157,7, 149,8, 142,8, 137,5, 132,7, 131,1, 129,8, 128,2, 127,3, 126,7, 126,0, 122,6, 119,1, 116,3, 113,2, 110,6, 55,4, 16,4.
Пример 504-(4-амино-2-хлорфениламино)бензофенон (соединение 150) Общая процедура 3 Исходное соединение II: 236 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 3:7. Т. пл: 133-134oС. 1H-ЯМР (ДМСО-d6):  8,25 (шир.с, 1Н), 7,69-7,55 (м, 5Н), 7,51 (м, 2Н), 7,04 (д, 1Н), 6,74 (д, 1Н), 6,63 (м, 2Н), 6,57 (дв.д, 1Н), 5,40 (шир.с, 2Н).
Пример 51 8,25 (шир.с, 1Н), 7,69-7,55 (м, 5Н), 7,51 (м, 2Н), 7,04 (д, 1Н), 6,74 (д, 1Н), 6,63 (м, 2Н), 6,57 (дв.д, 1Н), 5,40 (шир.с, 2Н).
Пример 514-(2-аминофениламино)-4′-метоксибензофенон (соединение 151) Общая процедура 4 Исходное соединение II: 239 Очистка: растирание в диэтиловом эфире. 13С-ЯМР (CDCl3):  194,2, 162,5, 149,6, 142,8, 132,5, 132,0, 131,2, 128,4, 127,2, 126,6, 126,1, 119,1, 116,3, 113,4, 113,2, 55,4.
Пример 52 194,2, 162,5, 149,6, 142,8, 132,5, 132,0, 131,2, 128,4, 127,2, 126,6, 126,1, 119,1, 116,3, 113,4, 113,2, 55,4.
Пример 524-(2-аминофениламино)-2-хлорбензофенон (соединение 152) Общая процедура 4 Исходное соединение II: 238 Очистка: растирание в диэтиловом эфире. 13С-ЯМР (CDCl3):  194,9, 148,9, 142,9, 137,9, 134,1, 132,9, 132,3, 130,0, 128,3, 127,9, 127,5, 126,8, 125,6, 119,2, 116,4, 115,1, 111,9.
Пример 53 194,9, 148,9, 142,9, 137,9, 134,1, 132,9, 132,3, 130,0, 128,3, 127,9, 127,5, 126,8, 125,6, 119,2, 116,4, 115,1, 111,9.
Пример 534-(2-аминофениламино)-3-метилбензофенон (соединение 153) Общая процедура 4 Исходное соединение II: 240 13С-ЯМР (CDCl3):  195,4, 148,2, 142,9, 138,9, 133,1, 131,4, 131,1, 129,6, 128,0, 127,6, 127,4, 127,2, 126,0, 121,9, 119,2, 116,3, 111,2, 17,5.
Пример 54 195,4, 148,2, 142,9, 138,9, 133,1, 131,4, 131,1, 129,6, 128,0, 127,6, 127,4, 127,2, 126,0, 121,9, 119,2, 116,3, 111,2, 17,5.
Пример 544-(2-аминофениламино)-3′-фенилбензофенон (соединение 154) Общая процедура 4 Исходное соединение II: 242 Очистка: хроматография с применением в качестве элюента метиленхлорида. 13С-ЯМР (CDCl3):  195,1, 150,0, 142,8, 141,1, 140,4, 139,4, 132,9, 130,1, 128,9, 128,6, 128,4, 128,2, 127,9, 127,7, 127,4, 127,2, 126,8, 125,8, 119,2, 116,4, 113,2.
Пример 55 195,1, 150,0, 142,8, 141,1, 140,4, 139,4, 132,9, 130,1, 128,9, 128,6, 128,4, 128,2, 127,9, 127,7, 127,4, 127,2, 126,8, 125,8, 119,2, 116,4, 113,2.
Пример 554-(2-аминофениламино)-2′-фенилбензофенон (соединение 155) Общая процедура 4 Исходное соединение II: 241 Очистка: кристаллизация из метиленхлорида. Т. пл.: 195-196oС. 13С-ЯМР (ДМСО-d6):  194,9, 151,1, 143,5, 140,1, 139,5, 139,5, 131,8, 129,8, 129,4, 128,4, 128,2, 127,7, 127,0, 126,9, 126,0, 125,8, 125,6, 124,6, 116,3, 115,4, 112,3.
Пример 56 194,9, 151,1, 143,5, 140,1, 139,5, 139,5, 131,8, 129,8, 129,4, 128,4, 128,2, 127,7, 127,0, 126,9, 126,0, 125,8, 125,6, 124,6, 116,3, 115,4, 112,3.
Пример 564-(2-аминофениламино)-2-хлор-2′-метилбензофенон (соединение 156) Общая процедура 4 Исходное соединение II: 243 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4 с последующим растиранием в диэтиловом эфире. Т. пл.: 113-116oС. 13С-ЯМР (CDCl3):  196,5, 149,5, 142,9, 139,3, 137,7, 135,2, 133,7, 131,2, 130,7, 129,5, 128,2, 127,7, 126,9, 125,3, 119,2, 116,4, 115,3, 111,8, 20,4.
Пример 57 196,5, 149,5, 142,9, 139,3, 137,7, 135,2, 133,7, 131,2, 130,7, 129,5, 128,2, 127,7, 126,9, 125,3, 119,2, 116,4, 115,3, 111,8, 20,4.
Пример 574-(2-аминофениламино)-4′-фенилбензофенон (соединение 157) Общая процедура 4 Исходное соединение II: 245 Очистка: растирание в метиленхлориде. Т. пл.: 179-182oС. 1H-ЯМР (ДМСО-d6):  193,0, 151,0, 143,6, 142,8, 139,1, 137,4, 132,1, 129,7, 129,0, 128,0, 126,8, 126,4, 126,0, 125,7, 125,3, 124,8, 116,3, 115,4, 112,5.
Пример 58 193,0, 151,0, 143,6, 142,8, 139,1, 137,4, 132,1, 129,7, 129,0, 128,0, 126,8, 126,4, 126,0, 125,7, 125,3, 124,8, 116,3, 115,4, 112,5.
Пример 584-(2-амино-5-гидроксифениламино)бензофенон (соединение 158) Общая процедура 3 Исходное соединение II: 266 Очистка: кристаллизация из эфира в виде гидрохлорида. Т. пл.: > 240oС (в виде гидрохлорида). 1H-ЯМР (ДМСО-d6) (в виде гидрохлорида)  9,98 (шир.с, 2Н), 9,87 (шир.с, 2Н), 9,01 (с, 1Н), 7,75-7,59 (м, 5Н), 7,54 (м, 2Н), 7,28 (д, 1Н), 7,05 (м, 2Н), 6,91 (д, 1Н), 6,61 (дв.д, 1Н).
Пример 59 9,98 (шир.с, 2Н), 9,87 (шир.с, 2Н), 9,01 (с, 1Н), 7,75-7,59 (м, 5Н), 7,54 (м, 2Н), 7,28 (д, 1Н), 7,05 (м, 2Н), 6,91 (д, 1Н), 6,61 (дв.д, 1Н).
Пример 594-(2-аминофениламино)-2′-гидроксибензофенон (соединение 159) Общая процедура 4 Исходное соединение II: 247 Очистка: кристаллизация из диэтилового эфира. 13С-ЯМР (CDCl3):  199,3, 162,7, 149,8, 142,9, 135,4, 133,1, 132,3, 128,0, 127,4, 126,8, 125,8, 119,7, 119,2, 118,4, 118,2, 116,4, 113,3.
Пример 60 199,3, 162,7, 149,8, 142,9, 135,4, 133,1, 132,3, 128,0, 127,4, 126,8, 125,8, 119,7, 119,2, 118,4, 118,2, 116,4, 113,3.
Пример 604-(4-аминофениламино)-2′-метилбензофенон (соединение 160) Общая процедура 4 Исходное соединение II: 246 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:1 с последующим растиранием в диэтиловом эфире. Т. пл.: 143-144oС. 13С-ЯМР (CDCl3):  196,9, 151,1, 143,9, 139,9, 135,8, 132,7, 130,9, 130,6, 129,3, 127,6, 125,4, 125,1, 115,9, 112,8, 19,7.
Пример 61 196,9, 151,1, 143,9, 139,9, 135,8, 132,7, 130,9, 130,6, 129,3, 127,6, 125,4, 125,1, 115,9, 112,8, 19,7.
Пример 614-(2-аминофениламино)-3′-цианобензофенон (соединение 161) Общая процедура 4 Исходное соединение II: 244 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:1 с последующим растиранием в метиленхлориде. Т. пл.: 146-149oС. 13С-ЯМР (CDCl3):  192,6, 150,8, 142,9, 140,0, 134,5, 133,4, 133,0, 132,9, 129,2, 127,7, 127,0, 126,5, 125,4, 119,2, 118,2, 116,4, 113,4, 112,5.
Пример 62 192,6, 150,8, 142,9, 140,0, 134,5, 133,4, 133,0, 132,9, 129,2, 127,7, 127,0, 126,5, 125,4, 119,2, 118,2, 116,4, 113,4, 112,5.
Пример 624-(2-аминофениламино)-2′-феноксиметилбензофенон (соединение 162) Общая процедура 4 Исходное соединение II: 249 Очистка: растирание в диэтиловом эфире. Т. пл.: 156-159oС. 13С-ЯМР (CDCl3):  195,9, 158,5, 150,5, 142,8, 138,4, 136,3, 132,9, 130,0, 129,3, 128,4, 128,2, 128,1, 127,5, 127,0, 126,8, 125,7, 120,9, 119,2, 116,4, 114,9, 113,2, 67,4.
Пример 63 195,9, 158,5, 150,5, 142,8, 138,4, 136,3, 132,9, 130,0, 129,3, 128,4, 128,2, 128,1, 127,5, 127,0, 126,8, 125,7, 120,9, 119,2, 116,4, 114,9, 113,2, 67,4.
Пример 634-(2-аминофениламино)-2′-бромбензофенон (соединение 163) Общая процедура 4 Исходное соединение II: 250 Т. пл.: 156-161oС. 13С-ЯМР (CDCl3):  194,0, 150,9, 142,8, 141,5, 133,0, 132,9, 130,5, 128,6, 127,5, 127,0, 127,0, 126,7, 125,4, 119,4, 119,1, 116,4, 113,3.
Пример 64 194,0, 150,9, 142,8, 141,5, 133,0, 132,9, 130,5, 128,6, 127,5, 127,0, 127,0, 126,7, 125,4, 119,4, 119,1, 116,4, 113,3.
Пример 644′-(2-аминофениламино)-2,3,5,6-тетраметилбензофенон (соединение 164) Общая процедура 4 Исходное соединение II: 251 13С-ЯМР (CDCl3):  199,7, 150,6, 142,8, 140,5, 134,0, 132,0, 131,4, 129,6, 128,6, 127,4, 126,9, 125,7, 119,1, 116,3, 113,4, 19,5, 16,3.
Пример 65 199,7, 150,6, 142,8, 140,5, 134,0, 132,0, 131,4, 129,6, 128,6, 127,4, 126,9, 125,7, 119,1, 116,3, 113,4, 19,5, 16,3.
Пример 654-(2-аминофениламино)-2′-этилбензофенон (соединение 165) Общая процедура 4 Исходное соединение II: 248 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 13С-ЯМР (CDCl3):  197,1, 150,5, 142,8, 142,2, 139,4, 132,7, 129,5, 129,1, 128,4, 127,6, 127,4, 126,9, 125,7, 125,1, 119,1, 116,4, 113,2, 26,3, 15,8.
Пример 66 197,1, 150,5, 142,8, 142,2, 139,4, 132,7, 129,5, 129,1, 128,4, 127,6, 127,4, 126,9, 125,7, 125,1, 119,1, 116,4, 113,2, 26,3, 15,8.
Пример 664-(3-аминофениламино)бензофенон (соединение 166) Общая процедура 4 Исходное соединение II: 4-(3-нитрофениламино) бензофенон Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 13С-ЯМР (CDCl3):  195,2, 148,2, 147,7, 141,7, 138,7, 132,7, 131,5, 130,3, 129,6, 128,5, 128,1, 114,6, 110,8, 110,3, 106,9.
Пример 67 195,2, 148,2, 147,7, 141,7, 138,7, 132,7, 131,5, 130,3, 129,6, 128,5, 128,1, 114,6, 110,8, 110,3, 106,9.
Пример 674-(4-аминофениламино)-2′-гидроксибензофенон (соединение 167) Общая процедура 4 Исходное соединение II: 2-Гидрокси-4′-(4-нитрофениламино) бензофенон Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 13С-ЯМР (CDCl3):  199,1, 162,6, 150,5, 143,8, 135,2, 133,1, 132,4, 131,1, 127,3, 125,3, 119,8, 118,3, 118,1, 116,0, 112,8.
Пример 68 199,1, 162,6, 150,5, 143,8, 135,2, 133,1, 132,4, 131,1, 127,3, 125,3, 119,8, 118,3, 118,1, 116,0, 112,8.
Пример 684-(2-аминофениламино)-2′,3-диметилбензофенон (соединение 168) Общая процедура 4 Исходное соединение II: 253 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 13С-ЯМР (CDCl3):  197,3, 148,7, 142,9, 139,8, 135,9, 132,7, 131,1, 130,6, 129,3, 128,0, 127,7, 127,5, 127,3, 125,8, 125,1, 121,9, 119,2, 116,4, 111,3, 19,7, 17,5.
Пример 69 197,3, 148,7, 142,9, 139,8, 135,9, 132,7, 131,1, 130,6, 129,3, 128,0, 127,7, 127,5, 127,3, 125,8, 125,1, 121,9, 119,2, 116,4, 111,3, 19,7, 17,5.
Пример 694-(2-аминофениламино)-3-метокси-2′-метилбензофенон (соединение 169) Общая процедура 4 Исходное соединение II: 252 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 13С-ЯМР (CDCl3):  197,1, 146,6, 142,9, 140,8, 139,8, 135,8, 130,6, 129,3, 127,6, 127,5, 127,4, 127,2, 126,9, 125,4, 125,0, 119,0, 116,2, 109,9, 109,6, 55,8, 19,7.
Пример 70 197,1, 146,6, 142,9, 140,8, 139,8, 135,8, 130,6, 129,3, 127,6, 127,5, 127,4, 127,2, 126,9, 125,4, 125,0, 119,0, 116,2, 109,9, 109,6, 55,8, 19,7.
Пример 704-(2-аминофениламино)-2-метокси-2′-метилбензофенон (соединение 170) К раствору 2-метокси-2′-метил-4-(2-нитрофениламино) бензофенона (соединение 255, 1,02 г, 2,8 ммоль) в метаноле (10 мл) добавляли в атмосфере аргона муравьиноаммониевую соль (0,80 г, 13 ммоль) и 10% палладий на угле (0,16 г). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Смесь фильтровали через Celite  и упаривали под вакуумом. Остаток обрабатывали водой (50 мл) и экстрагировали метиленхлоридом (2 х 50 мл). Органическую фазу сушили (МgSO4), фильтровали и упаривали под вакуумом для получения сырого продукта, который затем очищали хроматографией с применением в качестве элюента этилацетата/пентана 1:1.
Т. пл.: 122-125oС.
13С-ЯМР (CDCl3): и упаривали под вакуумом. Остаток обрабатывали водой (50 мл) и экстрагировали метиленхлоридом (2 х 50 мл). Органическую фазу сушили (МgSO4), фильтровали и упаривали под вакуумом для получения сырого продукта, который затем очищали хроматографией с применением в качестве элюента этилацетата/пентана 1:1.
Т. пл.: 122-125oС.
13С-ЯМР (CDCl3):  196,5, 161,8, 151,4, 142,8, 141,8, 135,9, 134,9, 130,5, 129,2, 127,9, 127,3, 126,7, 125,8, 125,0, 119,1, 119,0, 116,4, 105,9, 97,0, 55,5, 19,9.
Пример 71 196,5, 161,8, 151,4, 142,8, 141,8, 135,9, 134,9, 130,5, 129,2, 127,9, 127,3, 126,7, 125,8, 125,0, 119,1, 119,0, 116,4, 105,9, 97,0, 55,5, 19,9.
Пример 714-(2-аминофениламино)-2′-трет-бутоксибензофенон (соединение 171) Желаемое соединение получали в соответствии с процедурой примера 70, но вместо 2-метокси-2′-метил-4-(2-нитрофениламино)бензофенона (соединение 255), применяли 2-трет-бутокси-4′-(2-нитрофениламино)бензофенон (соединение 256). Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 13С-ЯМР (CDCl3):  195,7, 153,3, 149,9, 142,6, 135,7, 132,5, 130,4, 129,4, 128,9, 127,1, 126,5, 126,1, 123,0, 122,8, 119,1, 116,4, 113,1, 80,1, 28,9.
Пример 72 195,7, 153,3, 149,9, 142,6, 135,7, 132,5, 130,4, 129,4, 128,9, 127,1, 126,5, 126,1, 123,0, 122,8, 119,1, 116,4, 113,1, 80,1, 28,9.
Пример 724-(2-аминофениламино)-2-хлор-2′-(трифторметил)бензофенон (соединение 172) Общая процедура 4 Исходное соединение II: 257 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. Т. пл.: 128-129oС. 13С-ЯМР (CDCl3):  192,8, 150,6, 143,0, 140,2, 136,7, 135,3, 131,4, 129,8, 128,4, 128,0, 128,0, 127,2, 126,8, 125,6, 124,7, 123,7, 119,2, 116,5, 115,5, 111,6.
Пример 73 192,8, 150,6, 143,0, 140,2, 136,7, 135,3, 131,4, 129,8, 128,4, 128,0, 128,0, 127,2, 126,8, 125,6, 124,7, 123,7, 119,2, 116,5, 115,5, 111,6.
Пример 73Этил N-(2-(4-(2-метилбензоил)-3-хлорфениламино)фенил)карбамат (соединение 173) Общая процедура 6, но с заменой йодистого метила на этилхлорформиат Исходное соединение I: 156 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 13С-ЯМР (CDCl3):  196,6, 154,1, 149,1, 139,1, 138,0, 135,0, 133,5, 133,4, 131,3, 130,9, 130,5, 129,7, 129,2, 126,9, 126,0, 125,4, 124,9, 121,7, 116,1, 112,5, 61,7, 20,5, 14,5.
Пример 74 196,6, 154,1, 149,1, 139,1, 138,0, 135,0, 133,5, 133,4, 131,3, 130,9, 130,5, 129,7, 129,2, 126,9, 126,0, 125,4, 124,9, 121,7, 116,1, 112,5, 61,7, 20,5, 14,5.
Пример 744′-(2-аминофениламино)-3′-хлор-4-метокси-2,6-диметилбензофенон (соединение 174) Общая процедура 4 Исходное соединение II: 259 Очистка: кристаллизация из диэтилового эфира. Т. пл.: 158-159oС. 13С-ЯМР (CDCl3):  197,1, 159,6, 150,1, 142,9, 136,6, 136,0, 134,6, 134,0, 127,8, 127,2, 127,0, 125,0, 119,2, 116,4, 115,9, 113,1, 111,8, 55,1, 20,0.
Пример 75 197,1, 159,6, 150,1, 142,9, 136,6, 136,0, 134,6, 134,0, 127,8, 127,2, 127,0, 125,0, 119,2, 116,4, 115,9, 113,1, 111,8, 55,1, 20,0.
Пример 754-(4-аминофениламино)-2-хлор-2′-метилбензофенон (соединение 175) Общая процедура 4 Исходное соединение II: 261 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. 13С-ЯМР (ДМСО-d6): 194,8, 151,2, 145,9, 139,8, 135,9, 134,0, 134,0, 130,8, 130,2, 128,3, 128,1, 125,5, 124,6, 124,4, 114,5, 113,5, 110,5, 19,5. Пример 76 4-(2-аминофениламино)-2′-аллилоксибензофенон (соединение 176) Общая процедура 4 Исходное соединение II: 254 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4 и затем 1:2. 13С-ЯМР (CDCl3):  194,6, 155,9, 150,1, 142,7, 132,9, 132,5, 130,9, 130,2, 129,2, 128,7, 127,2, 126,6, 126,0, 120,7, 119,1, 116,9, 116,3, 113,1, 112,9, 69,1.
Пример 77 194,6, 155,9, 150,1, 142,7, 132,9, 132,5, 130,9, 130,2, 129,2, 128,7, 127,2, 126,6, 126,0, 120,7, 119,1, 116,9, 116,3, 113,1, 112,9, 69,1.
Пример 774-(2-амино-4-метилфениламино)-2-хлор-2′-метилбензофенон (соединение 177) Общая процедура 4 Исходное соединение II: 262 13С-ЯМР (CDCl3):  195,7, 150,0, 142,9, 139,5, 137,9, 137,7, 135,3, 133,8, 131,2, 130,6, 129,5, 128,0, 127,3, 125,3, 122,5, 120,0, 116,9, 115,1, 111,5, 21,2, 20,4.
Пример 78 195,7, 150,0, 142,9, 139,5, 137,9, 137,7, 135,3, 133,8, 131,2, 130,6, 129,5, 128,0, 127,3, 125,3, 122,5, 120,0, 116,9, 115,1, 111,5, 21,2, 20,4.
Пример 784-(2-аминофениламино)-2-хлор-2′-метоксибензофенон (соединение 178) Общая процедура 4 Исходное соединение II: 262 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. Т. пл.: 67-69oС. 13С-ЯМР (CDCl3):  193,7, 158,1, 149,2, 142,8, 135,0, 133,6, 132,5, 130,4, 129,9, 128,7, 127,5, 126,7, 125,5, 120,5, 119,1, 116,4, 115,2, 111,8, 111,6, 55,9.
Пример 79 193,7, 158,1, 149,2, 142,8, 135,0, 133,6, 132,5, 130,4, 129,9, 128,7, 127,5, 126,7, 125,5, 120,5, 119,1, 116,4, 115,2, 111,8, 111,6, 55,9.
Пример 793-аллил-4′-(2-аминофениламино)-2-гидроксибензофенон (соединение 179) Общая процедура 4 Исходное соединение II: 258 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:9. 13С-ЯМР (ДМСО-d6):  197,5, 158,1, 151,2, 143,8, 136,4, 134,6, 132,2, 130,2, 128,3, 126,2, 125,9, 125,5, 124,8, 120,7, 118,5, 116,5, 116,0, 115,5, 112,5, 33,2.
Пример 80 197,5, 158,1, 151,2, 143,8, 136,4, 134,6, 132,2, 130,2, 128,3, 126,2, 125,9, 125,5, 124,8, 120,7, 118,5, 116,5, 116,0, 115,5, 112,5, 33,2.
Пример 804′-(2-аминофениламино)-2′-хлор-2,4,5-трифторбензофенон (соединение 180) Общая процедура 4 Исходное соединение II: 263 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:3. 13С-ЯМР (CDCl3):  184,3, 154,9, 151,1, 147,5, 147,0, 143,0, 136,5, 134,8, 128,1, 127,3, 125,7, 124,4, 120,7, 119,2, 118,4, 116,5, 115,5, 112,0, 111,4.
Пример 81 184,3, 154,9, 151,1, 147,5, 147,0, 143,0, 136,5, 134,8, 128,1, 127,3, 125,7, 124,4, 120,7, 119,2, 118,4, 116,5, 115,5, 112,0, 111,4.
Пример 812,2,2-трифтор-N-(2-(4-(2-метилбензоил)-3-хлорфениламино) фенил)ацетамид (соединение 181) К холодному (лед/вода) раствору 4-(2-аминофениламино)-2-хлор-2′-метилбензофенона (соединение 156, 1,0 г, 3,0 ммоль) и пиридина (0,4 мл, 4,5 ммоль) в метиленхлориде (10 мл) добавляли ангидрид трифторуксусной кислоты (0,46 мл, 1,1 ммоль). После перемешивания в течение 30 минут реакционную смесь выливали в воду и экстрагировали этилацетатом (2 х 50 мл). Органическую фазу сушили (MgSO4), фильтровали и упаривали для получения почти чистого продукта. Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:2. 13С-ЯМР (CDCl3):  196,8, 155,2, 148,5, 138,6, 138,2, 134,9, 133,3, 131,8, 131,4, 131,2, 130,9, 130,2, 129,9, 127,6, 127,3, 126,4, 125,4, 122,9, 116,5, 15,6, 112,9, 20,5.
Пример 82 196,8, 155,2, 148,5, 138,6, 138,2, 134,9, 133,3, 131,8, 131,4, 131,2, 130,9, 130,2, 129,9, 127,6, 127,3, 126,4, 125,4, 122,9, 116,5, 15,6, 112,9, 20,5.
Пример 824-(2-аминофениламино)-2-хлор-2′,6′-диметилбензофенон (соединение 182) Общая процедура 4 Исходное соединение II: 264 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:4. Т. пл.: 139-140oС. 13С-ЯМР (CDCl3):  197,2, 150,4, 142,9, 141,1, 136,3, 135,0, 134,2, 128,6, 127,9, 127,6, 127,1, 126,0, 124,8, 119,1, 116,4, 116,1, 111,7, 19,5.
Пример 83 197,2, 150,4, 142,9, 141,1, 136,3, 135,0, 134,2, 128,6, 127,9, 127,6, 127,1, 126,0, 124,8, 119,1, 116,4, 116,1, 111,7, 19,5.
Пример 834-(2-аминофениламино)-2-хлор-4′-фтор-2′-метилбензофенон (соединение 183) Общая процедура 4 Исходное соединение II: 265 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 1:3. Т. пл.: 152-154oС. 13С-ЯМР (CDCl3):  195,3, 163,9, 149,5, 142,9, 141,5, 135,4, 135,0, 133,4, 132,3, 128,4, 127,7, 126,9, 125,3, 119,2, 118,1, 116,4, 115,3, 112,3, 111,9, 20,7.
Пример 84 195,3, 163,9, 149,5, 142,9, 141,5, 135,4, 135,0, 133,4, 132,3, 128,4, 127,7, 126,9, 125,3, 119,2, 118,1, 116,4, 115,3, 112,3, 111,9, 20,7.
Пример 843-(2-(4-(2-метилбензоил)-3-хлорфениламино)фенил)-1,1-диметилмочевина (соединение 184) Смесь 4-(2-аминофениламино)-2-хлор-2′-метилбензофенона (соединение 156, 1,2 г, 3,5 ммоль), диметикарбамилхлорид (0,32 мл, 3,5 ммоль) и карбонат калия (1,0 г, 7 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь выливали в воду (100 мл) и экстрагировали этилацетатом (3 х 75 мм). Органическую фазу сушили (МgSO4), фильтровали и упаривали под вакуумом для получения сырого продукта. Сырой продукт очищали флэш-хроматографией с применением смеси этилацетат/пентан от 1: 9 до 1:1. Растирание в диэтиловом эфире/пентане 1:1 дало чистое целевое соединение. 13С-ЯМР (CDCl3):  196,3, 150,9, 149,9, 139,8, 138,8, 136,6, 136,4, 133,1, 132,3, 132,0, 131,6, 131,0, 129,1, 127,6, 127,3, 125,7, 123,8, 123,4, 112,7, 109,0, 38,8, 37,1, 21,3.
Пример 85 196,3, 150,9, 149,9, 139,8, 138,8, 136,6, 136,4, 133,1, 132,3, 132,0, 131,6, 131,0, 129,1, 127,6, 127,3, 125,7, 123,8, 123,4, 112,7, 109,0, 38,8, 37,1, 21,3.
Пример 854-(2-(н-бутиламино)фениламино)бензофенон (соединение 185) Общая процедура 6, но с применением бромистого н-бутила в изопропаноле, нагревание с обратным холодильником Исходное соединение I: 101 Очистка: хроматография с применением в качестве элюента этилацетата/пентана 3:7. Т. пл.: 88-93oС. 1H-ЯМР (ДМСО-d6):  8,03 (шир.с, 1Н), 7,69-7,55 (м, 5Н), 7,51 (м, 2Н), 7,07 (м, 2Н), 6,76-6,66 (м, 3Н), 6,60 (м, 1Н), 4,75 (т, 1Н), 3,07 (кв, 2Н), 1,51 (м, 2Н), 1,33 (м, 2Н), 0,88 (т, 3Н).
Пример 86 8,03 (шир.с, 1Н), 7,69-7,55 (м, 5Н), 7,51 (м, 2Н), 7,07 (м, 2Н), 6,76-6,66 (м, 3Н), 6,60 (м, 1Н), 4,75 (т, 1Н), 3,07 (кв, 2Н), 1,51 (м, 2Н), 1,33 (м, 2Н), 0,88 (т, 3Н).
Пример 86N-(4-бензоилфенил)-N,N’-1,2-фенилен-ди(2,2,2-трифторацетамид) (соединение 186) К раствору 4-(2-аминофениламино)бензофенона (соединение 101, 0,29 г, 1,0 ммоль) и пиридина (0,25 мл, 3,0 ммоль) в метиленхлориде (10 мл) добавляли ангидрид трифторуксусной кислоты (0,30 мл, 2,2 ммоль). После перемешивания в течение 45 минут при комнатной температуре реакционную смесь упаривали под вакуумом. Остаток кристаллизовали при растирании с водой (10 мл) для получения после фильтрации целевого соединения. 1H-ЯМР (ДМСО-d6):  11,5-11,1 (шир.с, 1Н), 7,95-7,37 (м, 13Н).
Пример 87 11,5-11,1 (шир.с, 1Н), 7,95-7,37 (м, 13Н).
Пример 872,2,2-трифтор-N-(2-(4-бензоилфениламино)фенил)ацетамид (соединение 187) В соответствии с процедурой примера 81, но применяя 4-(2-аминофениламино)бензофенон (соединение 101) вместо 4-(2-аминофениламино)-2-хлор-2′-метилбензофенона (соединение 156), было получено желаемое соединение. Очистка: растирание в диэтиловом эфире. Т. пл.: 187-191oС. 1Н-ЯМР (ДМСО-d6):  10,80 (шир.с, 1Н), 8,47 (с, 1Н), 7,71-7,58 (м, 5Н), 7,53 (м, 2Н), 7,43 (м, 2Н), 7,33 (м, 1Н), 7,17 (м, 1Н), 6,93 (м, 2Н).
Пример 88 10,80 (шир.с, 1Н), 8,47 (с, 1Н), 7,71-7,58 (м, 5Н), 7,53 (м, 2Н), 7,43 (м, 2Н), 7,33 (м, 1Н), 7,17 (м, 1Н), 6,93 (м, 2Н).
Пример 881-(2-(4-бензоилфениламино)фенил)-3-н-пропилмочевина (соединение 188) К раствору 4-(2-аминофениламино)бензофенона (соединение 101, 0,58 г, 2,0 ммоль) в толуоле (10 мл) добавляли н-пропилизоцианат (0,23 мл, 2,4 ммоль). Реакционную смесь нагревали в течение 4 часов в паровой бане. После охлаждения реакционной смеси до комнатной температуры образовавшийся осадок собирали фильтрацией и промывали толуолом. Сырой продукт растворяли в горячем изопропаноле и кристаллизовали при охлаждении для получения целевого соединения. Т. пл.: 167-169oС. 1H-ЯМР (ДМСО-d6):  8,25 (с, 1Н), 8,03 (м, 1Н), 7,86 (с, 1Н), 7,70-7,56 (м, 5Н), 7,51 (м, 2Н), 7,81 (м, 1Н), 7,12 (м, 1Н), 6,97 (м, 1Н), 6,75 (м, 3Н), 3,02 (кв, 2Н), 1,41 (м, 2Н), 0,85 (т, 3Н).
Пример 89 8,25 (с, 1Н), 8,03 (м, 1Н), 7,86 (с, 1Н), 7,70-7,56 (м, 5Н), 7,51 (м, 2Н), 7,81 (м, 1Н), 7,12 (м, 1Н), 6,97 (м, 1Н), 6,75 (м, 3Н), 3,02 (кв, 2Н), 1,41 (м, 2Н), 0,85 (т, 3Н).
Пример 89N-(2-(4-бензоилфениламино)фенил)формамид (соединение 189) Раствор 4-(2-аминофениламино)бензофенона (соединение 101, 0,29 г, 1,0 ммоль) в этилформиате (5,0 мл, 63 ммоль) нагревали с обратным холодильником в течение 16 часов. Реакционную смесь упаривали под вакуумом и растворяли в этилацетате. Раствор фильтровали и упаривали под вакуумом. Остаток кристаллизовали добавлением диэтилового эфира для получения чистого целевого соединения. Т. пл.: 122-124oС. 13С-ЯМР (ДМСО-d6):  194,6, 144,0, 143,1, 139,3, 136,8, 135,6, 132,8, 132,5, 131,5, 129,6, 128,6, 123,7, 123,0, 122,8, 120,1, 110,9.
Пример 90 194,6, 144,0, 143,1, 139,3, 136,8, 135,6, 132,8, 132,5, 131,5, 129,6, 128,6, 123,7, 123,0, 122,8, 120,1, 110,9.
Пример 90Состав крема 4-(2-аминофениламино)бензофенон (соединение 101, 10 г) растворяли в моноэтиловом эфире диэтиленгликоля (350 г) и добавляли дистиллированную воду (350 г). Метилпарабен (1 г) и пропилпарабен (0,2 г) растворяли в феноксиэтаноле (6 г). Этот раствор смешивали с предшествующим раствором соединения 101. Парафиновое масло (183 г), цетостеариловый спирт (50 г) и ARLAGEL  (50 г) плавили в сосуде при температуре от 70 до 80oС. Смешанные растворы также нагревали до 60-70oС и медленно добавляли к расплавленной масляной фазе при высокоскоростном перемешивании. Гомогенизированные компоненты охлаждали до комнатной температуры.
Получение (50 г) плавили в сосуде при температуре от 70 до 80oС. Смешанные растворы также нагревали до 60-70oС и медленно добавляли к расплавленной масляной фазе при высокоскоростном перемешивании. Гомогенизированные компоненты охлаждали до комнатной температуры.
Получение4-(3-нитрофениламино)бензофенон Раствор 4′-бензоилацетанилида (25 ммоль), 3-бром-нитробензола (25 ммоль), карбоната калия (28 ммоль) и йодида меди (I) (0,6 ммоль) в диэтиленгликоле (70 мл) перемешивали в течение 20 часов при 240oС. Реакционную смесь фильтровали через прокладку из декалита, и фильтр еще раз промывали этилацетатом. Органическую фазу промывали бикарбонатом натрия (25%), водой (5 раз), рассолом, и сушили MgSO4. После фильтрации и концентрирования в вакууме получали неочищенный продукт. После очистки путем флеш-хроматографии с использованием смеси этилацетата/пентата 1:3 получали целевое соединение с чистотой приблизительно 80-90%, как было оценено с помощью тонкослойной хроматографии (ТСХ). Это относительно чистое соединение использовали без дополнительной очистки и характеризации в следующей стадии синтеза описанного 4-(3-аминофениламино)бензофенона (соединения 166). Получение 2-Гидрокси-4′-(4-нитрофениламино)бензофенон К раствору 4-амино-2′-гидроксибензофенона (4,3 ммоль) и 1-фтор-4-нитробензола (4,4 ммоль) в ДМСО (2 мл) добавляли трет-бутоксид калия (8,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 40 часов, разбавляли водой (50 мл) и экстрагировали этилацетатом (3 х 50 мл). Органическую фазу сушили (MgSO4), фильтровали и упаривали с получением неочищенного продукта. После очистки с помощью флеш-хроматографии с использованием смеси диэтилэфира/пентана 1:1 получали целевое соединение с частотой приблизительно 60%, как было оценено с помощью тонкослойной хроматографии (ТСХ). Вторая попытка очистки с использованием смеси этилацетата/пентата 1:4 и 1: 2 не дала более высокую чистоту целевого соединения. Это относительно чистое соединение было использовано без дополнительной очистки и характеризации в следующей стадии синтеза описанного 4-(4-аминофениламино)-2′-гидроксибензофенона (соединения 167). Формула изобретения
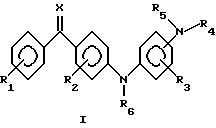 где R1 и R2 независимо представляют собой один или несколько одинаковых или различных заместителей, выбранных из группы, включающей водород, галоген, гидрокси, трифторметил, амино, алкил, алкенил, алкокси, алкенилокси, алкилтио, алкиламино, содержание С в которых может быть от 1 до 5 атомов, циано, фенил, фенилалкокси; R3 представляет собой водород, галоген, гидрокси, трифторметил, алкил, содержание С в которых может быть от 1 до 5 атомов, циано, карбокси; R4, R5 и R6 независимо представляют собой водород, алкил, формил, карбамоил, алкоксикарбонил, алкилсульфонил, фенилсульфонил, алкилфенилсульфонил, алкилкарбонил, алкоксикарбонилалкил, трифторметилкарбонил, содержание С в которых может быть от 1 до 5 атомов; X обозначает кислород, N-OH, N-О-алкил, содержание С в которых может быть от 1 до 5 атомов, и их соли фармацевтически приемлемых нетоксичных кислот. 2. Соединение по п. 1, представляющее собой соль, выбранную из группы солей, образованных хлористоводородной, бромистоводородной или йодистоводородной кислотами, фосфорной кислотой, серной кислотой, азотной кислотой, п-толуолсульфоновой кислотой, метансульфоновой кислотой, муравьиной кислотой, уксусной кислотой, пропионовой кислотой, лимонной кислотой, винной кислотой и малеиновой кислотой. 3. Соединение по п. 1, выбранное из группы, включающей 4-(2-аминофениламино)бензофенон 4-(4-аминофениламино)бензофенон 4-(2-амино-4-метилфениламино)бензофенон 4-(2-амино-4-трифторметилфениламино)бензофенон 3-амино-4-(4-бензоилфениламино)бензойная кислота 5-амино-2-(4-бензоилфениламино)бензонитрил 5-амино-2-(4-бензоилфениламино)бензойная кислота 4-(4-амино-2-метилфениламино)бензофенон 4-(2-аминофениламино)-2′-фторбензофенон 4-(2-аминофениламино)-4′-фторбензофенон 4-(2-аминофениламино)-4′-трет-бутилбензофенон 4-(2-аминофениламино)-3′-фторбензофенон 4-(2-аминофениламино)-2′-хлорбензофенон 4-(2-аминофениламино)-3′-хлорбензофенон 4-(2-аминофениламино)-2′-метоксибензофенон 4-(2-аминофениламино)-3′-(диметиламино)бензофенон 4-(2-аминофениламино)-4′-хлорбензофенон 4-(2-аминофениламино)-3′-метилбензофенон 3-амино-4-(4-аминофениламино)бензофенон 4-(2-аминофениламино)-4′-н-пентилбензофенон 4′-(2-аминофениламино)-4-хлор-2-(изопропилтио)бензофенон 4-(2-аминофениламино)-4′-(трифторметил)бензофенон N-(2-(4-бензоилфениламино)фенил)этансульфонамид N-(2-(4-бензоилфениламино)фенил)бензолсульфонамид N-(4-(4-бeнзoилфeнилaминo)фeнил)мeтaнcyльфoнaмид N-(2-(4-бензоилфениламино)фенил)метансульфонамид N-(2-(4-бензоилфениламино)фенил)-4-толуолсульфонамид 1-(2-(4-бензоилфениламино)фенил)-3-фенилмочевина N-(2-(4-бензоилфениламино)фенил)ацетамид оксим 4-(2-аминофениламино)бензофенона О-метилоксим 4-(2-аминофениламино)бензофенона этил N-(2-(4-бензоилфениламино)фенил)карбамат этил 2-(2-(4-бензоилфениламино)фениламино)ацетат 4-(2-метиламино)фениламино)бензофенон 4-(2-диметиламино)фениламино)бензофенон 4′-(2-аминофениламино)-3,4,5-триметоксибензофенон N-(2-аминофенил)-N-метил-4-аминобензофенон 4-(2-аминофениламино)-2′-метилбензофенон 4′-(2-аминофениламино)-3,4-этилендиоксибензофенон 4-(2-аминофениламино)-2,4′-дихлорбензофенон 4′-(2-аминофениламино)-2,4-дихлорбензофенон 4-(2-аминофениламино)-4′-(1-метилбутилокси)бензофенон 4-(2-аминофениламино-3′-(трифторметил)бензофенон 4′-(2-аминофениламино)-2,3-диметоксибензофенон 4-(2-аминофениламино)-3′-бутоксибензофенон 4-(2-аминофениламино)-4′-бутоксибензофенон 4-(2-аминофениламино)-3,5-дихлорбензофенон 4-(2-аминофениламино)-4′-бензилоксибензофенон 4′-(2-аминофениламино)-3-метокси-4-метилбензофенон 4-(4-амино-2-хлорфениламино)бензофенон 4-(2-аминофениламино)-4′-метоксибензофенон 4-(2-аминофениламино)-2-хлорбензофенон 4-(2-аминофениламино)-3-метилбензофенон 4-(2-аминофениламино)-3′-фенилбензофенон 4-(2-аминофениламино)-2′-фенилбензофенон 4-(2-аминофениламино)-2-хлор-2′-метилбензофенон 4-(2-аминофениламино)-4′-фенилбензофенон 4-(2-амино-5-гидроксифениламино)бензофенон 4-(2-аминофениламино)-2′-гидроксибензофенон 4-(4-аминофениламино)-2′-метилбензофенон 4-(2-аминофениламино)-3′-цианобензофенон 4-(2-аминофениламино)-2′-феноксиметилбензофенон 4-(2-аминофениламино)-2′-бромбензофенон 4′-(2-аминофениламино)-2,3,5,6-тетраметилбензофенон 4-(2-аминофениламино)-2′-этилбензофенон 4-(3-аминофениламино)бензофенон 4-(4-аминофениламино)-2′-гидроксибензофенон 4-(2-аминофениламино)-2′, 3-диметилбензофенон 4-(2-аминофениламино)-3-метокси-2′-метилбензофенон 4-(2-аминофениламино)-2-метокси-2′-метилбензофенон 4-(2-аминофениламино)-2′-трет-бутоксибензофенон 4-(2-аминофениламино)-2-хлор-2′-(трифторметил)бензофенон этил N-(2-(4-(2-метилбензоил)-3-хлорфениламино)фенил)-карбамат 4′-(2-аминофениламино)-3′-хлор-4-метокси-2,6-диметилбензофенон 4-(4-аминофениламино)-2-хлор-2′-метилбензофенон 4-(2-аминофениламино)-2′-аллилоксибензофенон 4-(2-амино-4-метилфениламино)-2-хлор-2′-метилбензофенон 4-(2-аминофениламино)-2-хлор-2′-метоксибензофенон 3-аллил-4′-(2-аминофениламино)-2-гидроксибензофенон 4′-(2-аминофениламино)-2′-хлор-2,4,5-трифторбензофенон 2,2,2-трифтор-N-(2-(4-(2-метилбензоил)-3-хлорфениламино)фенил)ацетамид 4-(2-аминофениламино)-2-хлор-2′, 6′-диметилбензофенон 4-(2-аминофениламино)-2-хлор-4′-фтор-2′-метилбензофенон 3-(2-(4-(2-метилбензоил)-3-хлорфениламино)фенил)-1,1-диметилмочевина 4-(2-(н-бутиламино)фениламино)бензофенон N-(4-бензоилфенил)-N, N’-1,2-фенилен-ди(2,2,2-трифторацетамид) 2,2,2-трифтор-N-(2-(4-бензоилфениламино)фенил)ацетамид 1-(2-(4-бензоилфениламино)фенил)-3-н-пропилмочевина N-(2-(4-бензоилфениламино)фенил)формамид или их соли. 4. Соединение по п. 1 в качестве активного ингредиента лекарственного средства для лечения и профилактики воспалительного заболевания кожи, таких, как псориаз и аллергический дерматит. 5. Фармацевтический препарат, являющийся сильным ингибитором секреции интерлейкина 1  (ИЛ-1 (ИЛ-1 ) и фактора некроза опухоли ) и фактора некроза опухоли  (ФНО- (ФНО- ), содержащий соединение по любому из пп. 1-4 и, в случае необходимости, вспомогательные добавки.
6. Способ лечения и профилактики воспалительных заболеваний кожи, таких, как псориаз и аллергический дерматит, включающий введение больным с указанными заболеваниями эффективного количества одного или более соединений по любому из пп. 1-4, если необходимо, вместе или в виде сопутствующей терапии с одним или несколькими другими терапевтически активными компонентами.
7. Способ получения соединения формулы I по п. 1, в котором ), содержащий соединение по любому из пп. 1-4 и, в случае необходимости, вспомогательные добавки.
6. Способ лечения и профилактики воспалительных заболеваний кожи, таких, как псориаз и аллергический дерматит, включающий введение больным с указанными заболеваниями эффективного количества одного или более соединений по любому из пп. 1-4, если необходимо, вместе или в виде сопутствующей терапии с одним или несколькими другими терапевтически активными компонентами.
7. Способ получения соединения формулы I по п. 1, в которома) соединение формулы III взаимодействует с соединением формулы IVa или IVb в растворителе (например, диметилсульфоксиде) в присутствии основания (например, трет-бутоксида калия), что дает соединение формулы II, 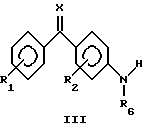 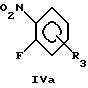 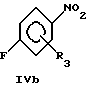 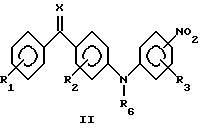 где X, R1, R2, R3 и R6 имеют значения, указанные в п. 1; b) соединение формулы II восстанавливают с помощью подходящего восстанавливающего агента (например, дихлорида олова) для образования желаемого соединения формулы I по п. 1. РИСУНКИ
|
||||||||||||||||||||||||||
