Патент на изобретение №2198171
|
||||||||||||||||||||||||||
(54) НОВАЯ КРИСТАЛЛИЧЕСКАЯ МОДИФИКАЦИЯ 5-ФТОР-1-(ТЕТРАГИДРО-2-ФУРИЛ)-УРАЦИЛА И КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ НА ЕЕ ОСНОВЕ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ
(57) Реферат: Изобретение относится к новой кристаллической модификации 5-фтор-1-(тетрагидро-2-фурил)урацила, а также комплексным соединениям этой формы с 2,4-диоксо-6-метил-1,2,3,4-тетрагидропиримидином или экстрактом корня солодки (Radices Glycyrrhzae). Эта форма по своим характеристикам отличается от ранее известной модификации этого соединения и обладает повышенной противоопухолевой активностью и используется в медицине. Новая форма устойчива и может образовывать устойчивые молекулярные комплексы с биологически активными веществами, которые проявляют аналогичные свойства. Технический результат: более высокая активность и устойчивость полученных соединений. 2 с. и 8 з.п. ф-лы, 14 ил., 2 табл. Область техники Изобретение относится к области онкологии, конкретно к полиморфным модификациям противораковых лекарственных средств и комплексным соединениям, обладающим синергическим противоопухолевым действием. Объектом изобретения является новая физически устойчивая кристаллическая модификация фторафура (МНН – тегафур) – 5-фтор-1-(тетрагидро-2-фурил)урацила, обладающая повышенной противоопухолевой активностью по сравнению с ранее известными модификациями, а также созданные на ее основе новые противораковые лекарственные вещества в виде устойчивых молекулярных комплексов. Предшествующий уровень техники Известно значительное количество лекарственных веществ и их комбинаций, являющихся результатом всестороннего исследования и усовершенствования противоопухолевых веществ. В клинической практике применяются эффективные в отношении злокачественных новообразований химиотерапевтические вещества. Хотя результаты такой терапии в последние годы существенно улучшились, следует отметить, что эффективность во многих случаях остается незначительной или недостаточной для достижения нужной степени подавления роста опухоли и существенного продления срока жизни больных. Кроме этого, большинство противоопухолевых препаратов характеризуются высокой токсичностью, что негативно сказывается на лечебном процессе. Фторафур – 5-фтор-1-(тетрагидро-2-фурил)урацил (МНН – тегафур), синтезированный С.А. Гиллером с соавторами (патент США 1168391) в качестве предшественника 5-фторурацила (далее 5-FU), является эффективным противоопухолевым препаратом и широко используется в лечении различных опухолей, в частности желудочно-кишечного тракта и молочной железы. Поскольку тегафур является достаточно токсичным соединением неоднократно предпринимались попытки снизить его токсичность и/или повысить эффективность. Тегафур фармакопейный (соответствующий ФС 42-1182-86) характеризуется на порошковой дифрактограмме следующими межплоскостными расстояниями d и относительной интенсивностью рефлексов I: d,  – I – I8,917 – 64 7,199 – 13 6,102 – 14 5,808 – 69 5,388 – 25 4,845 – 43 4,677 – 90 4,522 – 100 4,139 – 13 4,085 – 48 4,013 – 24 3,949 – 48 3,715 – 17 3,620 – 26 3,572 – 75 3,450 – 86 3,248 – 32 3,131 – 84 2,907 – 25 2,842 – 17 2,798 – 34 2,328 – 17 2,308 – 15 2,171 – 19 1,748 – 71 Кривая ДСК фармакопейного тегафура, показанная на фиг. 7, представляет собой два эндотермических эффекта. Первый, широкий эффект в диапазоне 84,8-128,1oС и второй – эффект плавления в диапазоне 172,3-192,0oС. УФ-спектр приведен на фиг.11. В частности, на протяжении многих лет предпринимались попытки модернизировать саму молекулу тегафура. Так в патенте Бельгии 855121 описаны оптически активные изомеры (2’R- и 2’S-) тегафура, являющегося в химическом отношении рацематом. Однако исследования, проведенные различными группами ученых (например, Yasumoto M. et al. “J. Med. Chem.”, 1977, vol.20, 12, 1592-1594 или Horwitz J.P. et al. “Cancer Res.”, 20, 1975, vol.35, 1301-1304), показали, что биологическая активность обоих изомеров практически одинакова и не отличается от активности рацемата. Токсичность того или иного изомера также не обнаруживает существенных отличий по сравнению с исходной субстанцией. Кроме того, были получены и исследованы четыре полиморфные формы тегафура (Uchida Т. et al. “Chem. Pharm. Bull.”, vol. 41, 9, 1632-1635). После обработки исходного тегафура (соответствующего JP XII) были выделены  -, -, -, -, -, -, -модификации. Эти кристаллические модификации отличаются порошковыми рентгенограммами, ИК – спектрами и кривыми ДСК (дифференциальной сканирующей калориметрии). Для получения -модификации. Эти кристаллические модификации отличаются порошковыми рентгенограммами, ИК – спектрами и кривыми ДСК (дифференциальной сканирующей калориметрии). Для получения  -формы тегафур растворяли в теплом ацетоне и оставляли кристаллизоваться при комнатной температуре. Бесцветные колонновидные кристаллы отделяли фильтрованием. Бесцветные призматические кристаллы -формы тегафур растворяли в теплом ацетоне и оставляли кристаллизоваться при комнатной температуре. Бесцветные колонновидные кристаллы отделяли фильтрованием. Бесцветные призматические кристаллы  -формы приготовляли из насыщенного раствора метанола выпариванием растворителя с помощью вращательного испарителя. Кристаллы -формы приготовляли из насыщенного раствора метанола выпариванием растворителя с помощью вращательного испарителя. Кристаллы  -формы получали нагреванием -формы получали нагреванием  -формы при 130oС в течение 1 часа. Кристаллы -формы при 130oС в течение 1 часа. Кристаллы  -формы выделяли рекристаллизацией из раствора метанола (очень медленное испарение метанола) при комнатной температуре. При этом ни одна из вышеперечисленных модификаций не обладает существенными терапевтическими преимуществами.
На основании вышеизложенного можно сделать вывод о том, что задача по повышению активности тегафура с помощью синтеза изомеров или получения полиморфных модификаций до настоящего времени не решена.
Параллельно проводились исследования по поиску композиций – синергических смесей, содержащих тегафур в качестве активного вещества.
Открытию комбинации лекарственных веществ, состоящей из тегафура и урацила. предшествовала идея о том, что поскольку 5-FU слишком быстро метаболизирует и теряет активность в организме, возможно применение урацила для ингибирования этих процессов (патент США 5534513). Оказалось, что хотя урацил сам по себе не проявляет противоопухолевой активности, он имеет свойство потенцировать противоопухолевый эффект. Исследование эффективности смеси тегафура и урацила (молярное соотношение тегафур : урацил 1:4) изложено например, в работе Kagawa Y. et al. “Cancer Investigation”, 1995, vol. 13, 5 470-474.
Кроме того, была получена и исследована композиция, содержащая тегафур, урацил и фолиевую кислоту (Sanchiz F., Milla A., “Jpn. Journal Clin. Oncol”, 1994, vol. 24, 6, 322-326).
В таких комбинированных препаратах чрезвычайно важным является вопрос об оптимальной дозе как активного компонента, так и вещества, вызывающего потенцирование активности. Желательно, чтобы вещество-потенциатор использовалось в минимальных дозах (для снижения собственного токсического эффекта) или это вещество само по себе практически не обладало бы токсическим эффектом. Известные в настоящее время синергические препараты, содержащие активный компонент – тегафур – и вещество-потенциатор, не всегда оптимизированы как по качественному составу компонентов, так и по их количественному соотношению. Например, урацил (который обычно используется для потенцирования активности тегафура) является токсичным соединением, хотя его токсичность менее выражена по сравнению с другими веществами, способными потенцировать действие тегафура, – тимином, тимидином или уридином (Фуджита X. Экспериментальная и клиническая фармакотерапия. В. 12, Рига, 1983, стр. 205).
Таким образом, текущее состояние терапии новообразований нуждается в усовершенствовании препаратов, использующихся в онкологии, и разработке лекарственных веществ, проявляющих высокую противоопухолевую активность наряду с минимизированной токсичностью.
Раскрытие изобретения -формы выделяли рекристаллизацией из раствора метанола (очень медленное испарение метанола) при комнатной температуре. При этом ни одна из вышеперечисленных модификаций не обладает существенными терапевтическими преимуществами.
На основании вышеизложенного можно сделать вывод о том, что задача по повышению активности тегафура с помощью синтеза изомеров или получения полиморфных модификаций до настоящего времени не решена.
Параллельно проводились исследования по поиску композиций – синергических смесей, содержащих тегафур в качестве активного вещества.
Открытию комбинации лекарственных веществ, состоящей из тегафура и урацила. предшествовала идея о том, что поскольку 5-FU слишком быстро метаболизирует и теряет активность в организме, возможно применение урацила для ингибирования этих процессов (патент США 5534513). Оказалось, что хотя урацил сам по себе не проявляет противоопухолевой активности, он имеет свойство потенцировать противоопухолевый эффект. Исследование эффективности смеси тегафура и урацила (молярное соотношение тегафур : урацил 1:4) изложено например, в работе Kagawa Y. et al. “Cancer Investigation”, 1995, vol. 13, 5 470-474.
Кроме того, была получена и исследована композиция, содержащая тегафур, урацил и фолиевую кислоту (Sanchiz F., Milla A., “Jpn. Journal Clin. Oncol”, 1994, vol. 24, 6, 322-326).
В таких комбинированных препаратах чрезвычайно важным является вопрос об оптимальной дозе как активного компонента, так и вещества, вызывающего потенцирование активности. Желательно, чтобы вещество-потенциатор использовалось в минимальных дозах (для снижения собственного токсического эффекта) или это вещество само по себе практически не обладало бы токсическим эффектом. Известные в настоящее время синергические препараты, содержащие активный компонент – тегафур – и вещество-потенциатор, не всегда оптимизированы как по качественному составу компонентов, так и по их количественному соотношению. Например, урацил (который обычно используется для потенцирования активности тегафура) является токсичным соединением, хотя его токсичность менее выражена по сравнению с другими веществами, способными потенцировать действие тегафура, – тимином, тимидином или уридином (Фуджита X. Экспериментальная и клиническая фармакотерапия. В. 12, Рига, 1983, стр. 205).
Таким образом, текущее состояние терапии новообразований нуждается в усовершенствовании препаратов, использующихся в онкологии, и разработке лекарственных веществ, проявляющих высокую противоопухолевую активность наряду с минимизированной токсичностью.
Раскрытие изобретенияЗадачей изобретения является создание физически устойчивой формы тегафура, обладающей повышенной фармакологической активностью. В результате экспериментов было неожиданно обнаружено, что повышенной специфической активностью наряду с физической устойчивостью в течение длительного промежутка времени, достаточного для коммерческого использования, обладает новая, ранее неизвестная, метастабильная кристаллическая модификация тегафура (далее упоминается как форма V). Новая форма V представляет собой легкий, “воздушный” белый порошок. Форма V характеризуется на порошковой дифрактограмме следующими межплоскостными расстояниями d и относительной интенсивностью рефлексов I: d,  – I – I9,035 – 63 7,237 – 23 6,149 – 19 5,839 – 100 5,413 – 17 4,704 – 42 4,551 – 62 4,104 – 36 4,041 – 28 3,966 – 25 3,730 – 20 3,626 – 25 3,588 – 42 3,473 – 60 3,437 – 50 3,255 – 30 3,143 – 36 2,915 – 23 2,382 – 16 2,336 – 20 Проведенный термический анализ выявил у новой формы три выраженных эндотермических пика на кривой ДСК. Первый типа  _ _  переход – в диапазоне 96,6-102oС. Второй и третий пики представляют собой суперпозицию двух эндотермических эффектов: переход переход – в диапазоне 96,6-102oС. Второй и третий пики представляют собой суперпозицию двух эндотермических эффектов: переход  _ _  в диапазоне 157,1-174,2oС и накладывающийся на него эффект плавления в диапазоне 157,1-174,2oС и накладывающийся на него эффект плавления  -формы с максимальной температурой 174oС. Точка наложения второго и третьего эффектов находится в области 167,6oС.
УФ-спектр формы V тегафура представлен на фиг. 10.
Форму V тегафура получают растворением фармакопейной субстанции тегафура или его индивидуальных полиморфных модификаций в воде, спирте или спирто-водной смеси. Растворитель желательно предварительно нагреть до температуры 40-65oС. После этого полученный раствор вводят в емкость с охлажденным до температуры не менее 10oС антирастворителем (например, диметиловый эфир, диэтиловый эфир или хлороформ). Полученный осадок отделяют, удаляют остаток растворителей и получают кристаллический порошок формы V.
Новая кристаллическая модификация тегафура физически устойчива и не теряет своих свойств при смешении с фармацевтически приемлемыми носителями или наполнителями, что позволяет использовать ее в лекарственных препаратах. Однако неожиданно было обнаружено, что указанная форма V обладает свойством образовывать молекулярные комплексы с некоторыми органическими молекулами, в том числе обладающими биологической активностью. В частности, были получены комплексные соединения с 2,4-диоксо-6-метил-1,2,3,4-тетрагидропиримидином (далее метилурацил) и биологически активными экстрактами растений, полученными, в частности, из корня солодки (Radices Glycyrrhizae).
Комплексные соединения могут быть получены при определенных технологических условиях, приводящих к образованию невалентных связей между молекулами тегафура и молекулами органических соединений, вступающих с тегафуром во взаимодействия такого рода.
Синтез комплексных соединений возможен тремя путями. Первый путь предусматривает одномоментный перевод физической смеси тегафура и других органических молекул, которые планируется включить в состав комплекса, в высокоэнергетическое (метастабильное) состояние. Как было обнаружено при этих условиях, тегафур переходит в форму V, способную образовывать устойчивые молекулярные комплексы.
Перевод физической смеси в высокоэнергетическое состояние возможен различными способами, единственным условием при их осуществлении является образование формы V тегафура.
Такими способами могут быть, например, совместная микронизация (в частности, помол) или другие известные методы, воздействующие на энергетику молекулы.
Второй путь получения комплексов заключается в смешении предварительно полученной формы V тегафура с остальными компонентами комплекса – индивидуальным веществом или смесью веществ, которые в момент смешения находятся в термодинамически стабильном состоянии.
Третий путь получения комплексов заключается в смешении предварительно полученной формы V тегафура и второго составляющего комплекса, уже находящегося в высокоэнергетическом состоянии.
Для получения комплексов могут быть использованы, в частности, метилурацил (М.Д. Машковский. Лекарственные средства, 1997, Харьков, т.2, с. 168), -формы с максимальной температурой 174oС. Точка наложения второго и третьего эффектов находится в области 167,6oС.
УФ-спектр формы V тегафура представлен на фиг. 10.
Форму V тегафура получают растворением фармакопейной субстанции тегафура или его индивидуальных полиморфных модификаций в воде, спирте или спирто-водной смеси. Растворитель желательно предварительно нагреть до температуры 40-65oС. После этого полученный раствор вводят в емкость с охлажденным до температуры не менее 10oС антирастворителем (например, диметиловый эфир, диэтиловый эфир или хлороформ). Полученный осадок отделяют, удаляют остаток растворителей и получают кристаллический порошок формы V.
Новая кристаллическая модификация тегафура физически устойчива и не теряет своих свойств при смешении с фармацевтически приемлемыми носителями или наполнителями, что позволяет использовать ее в лекарственных препаратах. Однако неожиданно было обнаружено, что указанная форма V обладает свойством образовывать молекулярные комплексы с некоторыми органическими молекулами, в том числе обладающими биологической активностью. В частности, были получены комплексные соединения с 2,4-диоксо-6-метил-1,2,3,4-тетрагидропиримидином (далее метилурацил) и биологически активными экстрактами растений, полученными, в частности, из корня солодки (Radices Glycyrrhizae).
Комплексные соединения могут быть получены при определенных технологических условиях, приводящих к образованию невалентных связей между молекулами тегафура и молекулами органических соединений, вступающих с тегафуром во взаимодействия такого рода.
Синтез комплексных соединений возможен тремя путями. Первый путь предусматривает одномоментный перевод физической смеси тегафура и других органических молекул, которые планируется включить в состав комплекса, в высокоэнергетическое (метастабильное) состояние. Как было обнаружено при этих условиях, тегафур переходит в форму V, способную образовывать устойчивые молекулярные комплексы.
Перевод физической смеси в высокоэнергетическое состояние возможен различными способами, единственным условием при их осуществлении является образование формы V тегафура.
Такими способами могут быть, например, совместная микронизация (в частности, помол) или другие известные методы, воздействующие на энергетику молекулы.
Второй путь получения комплексов заключается в смешении предварительно полученной формы V тегафура с остальными компонентами комплекса – индивидуальным веществом или смесью веществ, которые в момент смешения находятся в термодинамически стабильном состоянии.
Третий путь получения комплексов заключается в смешении предварительно полученной формы V тегафура и второго составляющего комплекса, уже находящегося в высокоэнергетическом состоянии.
Для получения комплексов могут быть использованы, в частности, метилурацил (М.Д. Машковский. Лекарственные средства, 1997, Харьков, т.2, с. 168),  -форма метилурацила (далее Betamecil), обладающая пониженной токсичностью (патент США 5543147), различные экстракты солодки, например Extractum Glycyrrhizae siccum (М.Д. Машковский. Лекарственные средства, 1997, Харьков, т.1, с. 345-346).
Молекулярный комплекс тегафур-метилурацил в мольном соотношении 1:2 (комплексное соединение 1а) представляет собой белый мелкокристаллический порошок и характеризуется на порошковой дифрактограмме следующими межплоскостными расстояниями d и относительной интенсивностью рефлексов I: -форма метилурацила (далее Betamecil), обладающая пониженной токсичностью (патент США 5543147), различные экстракты солодки, например Extractum Glycyrrhizae siccum (М.Д. Машковский. Лекарственные средства, 1997, Харьков, т.1, с. 345-346).
Молекулярный комплекс тегафур-метилурацил в мольном соотношении 1:2 (комплексное соединение 1а) представляет собой белый мелкокристаллический порошок и характеризуется на порошковой дифрактограмме следующими межплоскостными расстояниями d и относительной интенсивностью рефлексов I:d,  – I – I9,090 – 19 7,234 – 32 6,883 – 100 5,864 – 13 4,831 – 27 4,571 – 13 4,197 – 25 3,627 – 15 3,448 – 18 3,254 – 26 3,192 – 13 3,149 – 6 2,933 – 13 2,448 – 8 2,300 – 8 Кривая ДСК соединения 1а представлена на фиг. 8. Она представляет собой два эндотермических эффекта. Первый эффект типа  _ _  находится в интервале 117,1-132oС. Второй эффект плавления находится в интервале 117,1-132oС. Второй эффект плавления  -формы – в интервале 149,9-167,1oС.
УФ-спектр соединения 1а, характеризующий его индивидуальность, представлен на фиг. 12.
Молекулярный комплекс тегафур-метилурацил в мольном соотношении 1:1 (комплексное соединение 1b) представляет собой белый мелкокристаллический порошок и характеризуется на порошковой дифрактограмме следующими межплоскостными расстояниями d и относительной интенсивностью рефлексов I: -формы – в интервале 149,9-167,1oС.
УФ-спектр соединения 1а, характеризующий его индивидуальность, представлен на фиг. 12.
Молекулярный комплекс тегафур-метилурацил в мольном соотношении 1:1 (комплексное соединение 1b) представляет собой белый мелкокристаллический порошок и характеризуется на порошковой дифрактограмме следующими межплоскостными расстояниями d и относительной интенсивностью рефлексов I:d,  – I – I7,187 – 53 6,841 – 100 4,806 – 41 4,181 – 37 3,669 – 20 3,474 – 21 Комплекс тегафур-экстракт корня солодки (комплексное соединение 2) является рентгеноаморфной формой и представляет собой легкий комкующийся порошок желтого цвета с буроватым оттенком. Кривая ДСК соединения 2, показанная на фиг. 9, представляет собой совокупность двух эндотермических эффектов: широкий – в интервале 98,2-125,0oС и второй эффект, сопровождающийся разложением вещества, в интервале 125,0-171oC. УФ-спектр соединения 2, подтверждающий индивидуальность вещества, представлен на фиг. 13. Форма V превосходит по растворимости ранее известные модификации тегафура. Кроме того, новая форма тегафура по сравнению с ранее известными полиморфными формами обладает повышенной специфической активностью. Комплексные соединения проявляют еще более значительную специфическую активность (по сравнению не только с фармакопейным тегафуром, но и по сравнению с новой формой V), т.е. имеет место потенцирование фармакологического действия. Полученная новая кристаллическая модификация тегафура и комплексные соединения на ее основе могут найти широкое применение в медицине для лечения онкологических заболеваний. Это позволит расширить арсенал средств, воздействующих на опухолевые клетки, и соответственно повысить эффективность лечения больных, страдающих от злокачественных новообразований. Краткое описание рисунков Фиг.1 – порошковая рентгенограмма заявляемой формы V тегафура. Фиг.2 – порошковая рентгенограмма фармакопейного тегафура. Фиг. 3 – порошковая рентгенограмма молекулярного комплекса тегафур-метилурацил в соотношении 1:2. Фиг. 4 – порошковая рентгенограмма молекулярного комплекса тегафур-метилурацил в соотношении 1:1. Фиг. 5 – порошковая рентгенограмма комплексного соединения тегафур-экстракт корня солодки. Фиг.6 – кривая ДСК заявляемой формы V тегафура. Фиг.7 – кривая ДСК фармакопейного тегафура. Фиг. 8 – кривая ДСК молекулярного комплекса тегафур-метилурацил в соотношении 1:2. Фиг. 9 – кривая ДСК комплексного соединения тегафур-экстракт корня солодки. Фиг.10 – УФ-спектр заявляемой формы V тегафура. Фиг.11 – УФ-спектр фармакопейного тегафура. Фиг. 12 – УФ-спектр молекулярного комплекса тегафур-метилурацил в соотношении 1:2. Фиг. 13 – УФ-спектр комплексного соединения тегафур-экстракт корня солодки. Фиг.14 – результаты изучения специфической активности фармакопейного тегафура, формы V тегафура, комплексного соединения 1а и комплексного соединения 2. Примеры: Лучший вариант осуществления изобретения 1. Получение формы V тегафура. Получение кристаллической модификации тегафура по данному изобретению осуществляют следующим образом. При температуре 45oС готовят насыщенный раствор исходного компонента фармакопейного тегафура (соответствует ФС 42-1182-86) в воде. Полученный раствор в объеме 0,5 л диспергируют в емкость с хлороформом, предварительно охлажденным до 2oС. Объем хлороформа составляет 0,4 л. Суспензии дают отстояться, хлороформный слой с осадком отделяют, осадок отфильтровывают, удаляют остаток растворителя при пониженном давлении (10-1мм рт.ст.) и получают конечный продукт. Выход формы V тегафура составляет 62% от исходной фармакопейной субстанции. 2. Получение комплекса тегафур-метилурацил (1:2). При температуре 100oС готовят 0,5 л 0,1 М раствора формы V тегафура в воде и 0,5 л 0,2 М раствора Betamecil в воде. Полученные растворы осторожно смешивают и оставляют в термостате при температуре 60oС на 1,5 часа. Затем раствор охлаждают до 2oС, выпавший осадок отфильтровывают, сушат при пониженном давлении (10-1 мм рт.ст.) и получают конечный продукт. Выход составляет 71%. 3. Получение комплекса тегафур-метилурацил (1:1). При температуре 100oС готовят 0,5 л 0,2 М раствора формы V тегафура в воде и 0,5 л 0,2 М раствора метилурацила в воде. Полученные растворы осторожно смешивают и оставляют в термостате при температуре 60oС на 3 часа. Затем раствор охлаждают до 2oС, выпавший осадок отфильтровывают, сушат при пониженном давлении (10-1мм рт.ст.) и получают конечный продукт. Выход составляет 68%. 4. Получение комплекса тегафура и смеси органических составляющих экстракта корня солодки. В качестве лиганда используют сухой экстракт корня солодки (Radices Glycyrrhizae) (С. И. Успенская и др. Российский химический журнал, 1997, т. 41, 5, с. 124-129). Сухой экстракт представляет собой аморфный пористый гигроскопичный порошок характерного цвета со специфическим запахом. При хранении порошок может комковаться но при встряхивании комки легко разрушаются. Экстракт хорошо растворим в воде с образованием опалесцирующих растворов. Содержание глицирризиновой кислоты в сухом экстракте корня солодки 20,12%. При температуре 40oС растворяют в 0,25 л воды 10 г формы V тегафура, а в другом сосуде при той же температуре в 0,1 л воды растворяют 5 г сухого экстракта корня солодки. Полученные растворы смешивают и оставляют в термостате при температуре 40oС в течение 30 минут. Затем раствор быстро охлаждают до 2oС, выпавший осадок отфильтровывают, сушат и получают конечный продукт. Выход составляет 75%. Полученную новую модификацию тегафура и комплексные соединения на ее основе исследовали методом порошковой дифракционной рентгенографии. Рентгенофазовый анализ проводили на автоматизированном порошковом дифрактометре. Условия съемки: излучение CuK  , графитовый монохроматор на вторичном пуске, интервалы углов от 4 до 64 2 , графитовый монохроматор на вторичном пуске, интервалы углов от 4 до 64 2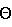  , шаг 0,1o, скорость сканирования 2o/мин. На дифрактограмме заявляемой формы V и комплексов с метилурацилом проявляются характерные рефлексы. Условия съемки ренттеноаморфного комплекса с экстрактом корня солодки были аналогичны вышеуказанным, за исключением того, что съемку проводили под тонкой полимерной (майларовой) пленкой из-за гигроскопичности образца. На дифрактограмме комплекса с экстрактом солодки проявляется характерное для аморфных веществ диффузное рассеяние (аморфное гало) (Whittaker E. J. W. Crystallography. Pergamon Press. Oxford, 1981) в области 15-30 2 , шаг 0,1o, скорость сканирования 2o/мин. На дифрактограмме заявляемой формы V и комплексов с метилурацилом проявляются характерные рефлексы. Условия съемки ренттеноаморфного комплекса с экстрактом корня солодки были аналогичны вышеуказанным, за исключением того, что съемку проводили под тонкой полимерной (майларовой) пленкой из-за гигроскопичности образца. На дифрактограмме комплекса с экстрактом солодки проявляется характерное для аморфных веществ диффузное рассеяние (аморфное гало) (Whittaker E. J. W. Crystallography. Pergamon Press. Oxford, 1981) в области 15-30 2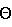  и накладывающийся на него широкий рефлекс полимера пленки с центром около 11 2 и накладывающийся на него широкий рефлекс полимера пленки с центром около 11 2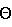  .
Результаты представлены на фиг. 1-5.
Исследования, проведенные с помощью дифференциальной сканирующей калориметрии, представленные на фиг. 6-9, служат доказательством новизны предложенных лекарственных соединений. ДСК характеристики формы V существенно отличаются как от фармакопейного образца тегафура (соответствующего ФС 42-1182-86), так и от ранее известных полиморфных модификаций.
Термоаналитические исследования проводили на термоанализаторе STA-409 фирмы NETZSCH (Германия), который позволяет проводить одновременно исследования методами термогравиметрии (ТГ) и методом дифференциальной сканирующей калориметрии (ДСК). Исследования проводили в атмосфере осушенного гелия (1 атм) при скорости сканирования по температуре 10 град/мин. При проведении экспериментов навески от 7 до 20 мг помещали в платиновые тигли.
Температура, соответствующая началу пика на ДСК-кривой, определялась по точке пересечения прямой, соответствующей базовой линии, и прямой, являющейся касательной в точке перегиба восходящей линии пика.
Для определения коэффициентов чувствительности, связывающих площадь под кривой ДСК с тепловым эффектом, проводили калибровку по индию и сапфиру в условиях, идентичных условиям рабочих экспериментов. Интегрирование пиков на ДСК-кривых и расчет тепловых эффектов производили по программам, являющимся частью математического обеспечения прибора STA-409.
УФ-спектры (фиг. 10-13) снимали на спектрофотометре “Aminec”. Растворы с концентрацией 0,02% готовили в 0,1 М фосфатном буфере с рН 6,8.
Промышленная применимость .
Результаты представлены на фиг. 1-5.
Исследования, проведенные с помощью дифференциальной сканирующей калориметрии, представленные на фиг. 6-9, служат доказательством новизны предложенных лекарственных соединений. ДСК характеристики формы V существенно отличаются как от фармакопейного образца тегафура (соответствующего ФС 42-1182-86), так и от ранее известных полиморфных модификаций.
Термоаналитические исследования проводили на термоанализаторе STA-409 фирмы NETZSCH (Германия), который позволяет проводить одновременно исследования методами термогравиметрии (ТГ) и методом дифференциальной сканирующей калориметрии (ДСК). Исследования проводили в атмосфере осушенного гелия (1 атм) при скорости сканирования по температуре 10 град/мин. При проведении экспериментов навески от 7 до 20 мг помещали в платиновые тигли.
Температура, соответствующая началу пика на ДСК-кривой, определялась по точке пересечения прямой, соответствующей базовой линии, и прямой, являющейся касательной в точке перегиба восходящей линии пика.
Для определения коэффициентов чувствительности, связывающих площадь под кривой ДСК с тепловым эффектом, проводили калибровку по индию и сапфиру в условиях, идентичных условиям рабочих экспериментов. Интегрирование пиков на ДСК-кривых и расчет тепловых эффектов производили по программам, являющимся частью математического обеспечения прибора STA-409.
УФ-спектры (фиг. 10-13) снимали на спектрофотометре “Aminec”. Растворы с концентрацией 0,02% готовили в 0,1 М фосфатном буфере с рН 6,8.
Промышленная применимостьОпределение растворимости исследуемых препаратов и тегафура Определение растворимости проводили в соответствии с требованиями статьи “Solubility”, USPXXIII (1995, р. 2071). Как видно из данных, приведенных в табл. 1, растворимость заявляемых препаратов: формы V тегафура, комплексного соединения 1а и 1b выше, чем у тегафура фармакопейного, растворимость комплексного соединения 2 не удалось определить из-за растительного компонента – экстракта корня солодки, образующего мутноватые, опалесцирующие растворы. Определение специфической активности – цитотоксичности образцов заявляемых препаратов по сравнению с тегафуром фармакопейным на культуре клеток рака шейки матки Определение проводили по методике (Mosmami N.T. J. Immunoloey Methods, 1983, vol.65, 55-63, Carmichael J. et al. Cancer Res, 1987, vol.47, 936-946) на культуре клеток рака шейки матки, клетки выращивались при 37o С на среде RPMI 1640 с добавками 10% эмбриональной сыворотки коров и 200 ед/мл гентамицина, содержание СО2 в атмосфере инкубатора составляло 10%. Клетки, находящиеся в экспоненциальной фазе роста, суспендировали трипсином и в количестве 4×103 высевали в каждую лунку 96-луночного планшета для монослойных культур. Растворы образцов исследуемых препаратов готовили, растворяя по 23 мг каждого препарата в 10 мл культуральной жидкости, получая таким образом растворы концентрации 10-2М. Эти растворы служили исходными для получения из них растворов меньшей концентрации путем разведения их культуральной жидкостью. Перед непосредственным добавлением растворов к клеткам их стерилизовали фильтрацией через миллипоровские фильтры. Через сутки после высева клеток в каждую лунку планшета добавляли растворы образцов исследуемых препаратов в заданных концентрациях, после чего клетки росли еще в течение 4 суток. Всего было испытано по 9 концентраций каждого из 4 образцов исследуемых препаратов. Количественная оценка цитотоксичности исследуемых препаратов проводилась с использованием 3-(4,5-диметилтазол-2-ил)-2,5-дифенилтетразолийбромида (МТТ). МТТ обладает избирательной способностью метаболизироваться в митохондриях клеток с образованием окрашенного продукта формазана, обладающего максимумом поглощения при длине волны 530-570 нм, при этом имеется корреляция между степенью ингибирования митохондрий и окраской клеток. В каждую лунку планшета добавляли по 0,5 мг/мл за 4 часа до окончания культивирования клеток. После окончания инкубации культуральной жидкость из лунок удаляли, кристаллы формазана растворяли и клетки сканировали на автоматическом ридере Multiscan MCC/340P при длине волны 540 нм. Результаты рассчитывали в процентах поглощения клеток при 540 нм, подвергшихся действию исследуемых препаратов, по отношению к поглощению контрольных клеток. Действие каждой концентрации исследуемых препаратов на раковые клетки оценивали по результатам 4-6 независимых экспериментов, результаты обрабатывали с помощью методов математической статистики. Данные полученных исследований приведены в табл. 2 и на фиг. 14. Как видно из данных табл. 2 и графика, приведенного на фиг. 14, все исследуемые препараты оказывают разное цитотоксическое действие на раковые клетки. Однако заявляемые препараты, а именно форма V тегафура, а также комплексные соединения 1а и 2 существенно превосходят тегафур по показателю влияния на пролиферацию раковых клеток. Так, тегафур в диапазоне концентраций 10-6-10-4M не оказывает влияния на пролиферацию раковых клеток. Форма V тегафура угнетает пролиферацию клеток при концентрации 5  10-5M, при концентрации 10-4М препарат угнетает пролиферацию на 70% интенсивнее, чем тегафур. Комплексное соединение 1а (тегафур-метилурацил) оказывает угнетающее влияние на пролиферацию клеток, уже начиная с концентрации 10-6М, это же относится и к комплексному соединению 2 (тегафур-экстракт корня солодки), при этом следует учитывать, что в комплексном соединении 1а формы V тегафура находится на 1/2 меньше, а в соединении 2 – на 1/3, таким образом, в этом случае наблюдается четко выраженный цитотоксический эффект. 10-5M, при концентрации 10-4М препарат угнетает пролиферацию на 70% интенсивнее, чем тегафур. Комплексное соединение 1а (тегафур-метилурацил) оказывает угнетающее влияние на пролиферацию клеток, уже начиная с концентрации 10-6М, это же относится и к комплексному соединению 2 (тегафур-экстракт корня солодки), при этом следует учитывать, что в комплексном соединении 1а формы V тегафура находится на 1/2 меньше, а в соединении 2 – на 1/3, таким образом, в этом случае наблюдается четко выраженный цитотоксический эффект.
Формула изобретения
d,  – I – I9,035 – 63 7,237 – 23 6,149 – 19 5,839 – 100 5,413 – 17 4,704 – 42 4,551 – 62 4,104 – 36 4,041 – 28 3,966 – 25 3,730 – 20 3,626 – 25 3,588 – 42 3,473 – 60 3,437 – 50 3,255 – 30 3,143 – 36 2,915 – 23 2,382 – 16 2,336 – 20 2. Комплексное соединение, образованное 5-фтор-1-(тетрагидро-2-фурил)-урацилом по п.1 и 2,4-гдиоксо-6-метил-1,2,3,4-тетрагидропиримидином или экстрактом корня солодки (Radices Glycyrrhizae). 3. Комплексное соединение по п.2, отличающееся тем, что 2,4-диоксо-6-метил-1,2,3,4-тетрагидропиримидин представляет собой Бетамецил. 4. Комплексное соединение по п.2, отличающееся тем, что лекарственные вещества представляют собой 5-фтор-1-(тетрагидро-2-фурил)-урацил и 2,4-диоксо-6-метил-1,2,3,4-тетрагидропиримидин при молярном соотношении компонентов 1:2. 5. Комплексное соединение по п.4, отличающееся тем, что характеризуется на порошковой дифрактограмме следующими межплоскостными расстояниями d и относительной интенсивностью рефлексов I: d,  – I – I9,090 – 19 7,234 – 32 6,883 – 100 5,864 – 13 4,831 – 27 4,571 – 13 4,197 – 25 3,627 – 15 3,448 – 18 3,254 – 26 3,192 – 13 3,149 – 6 2,933 – 13 2,448 – 8 2,300 – 8 6. Комплексное соединение по п.2, отличающееся тем, что лекарственные вещества представляют собой 5-фтор-1-(тетрагидро-2-фурил)-урацил и 2,4-диоксо-6-метил-1,2,3,4-тетрагидропиримидин при молярном соотношении компонентов 1:1 7. Комплексное соединение по п.6, отличающееся тем, что характеризуется на порошковой дифрактограмме следующими межплоскостными расстояниями d и относительной интенсивностью рефлексов I: d,  – I – I7,187 – 53 6,841 – 100 4,806 – 41 4,181 – 37 3,669 – 20 3,474 – 21 8. Комплексное соединение по п.2, отличающееся тем, что лекарственные вещества представляют собой 5-фтор-1-(тетрагидро-2-фурил)-урацил и экстракт корня солодки (Radices Glycyrrhizae) в соотношении 1:1 – 4:1 (по массе). 9. Комплексное соединение по п.8, отличающееся тем, что лекарственные вещества представляют собой 5-фтор-1-(тетрагидро-2-фурил)-урацил и экстракт корня солодки в соотношении 2:1 (по массе). 10. Комплексное соединение по п.9, отличающееся тем, что на порошковой дифрактограмме отсутствуют выраженные рефлексы, присущие кристаллическим формам. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 13.10.2004
Извещение опубликовано: 20.02.2006 БИ: 05/2006
NF4A Восстановление действия патента СССР или патента Российской Федерации на изобретение
Дата, с которой действие патента восстановлено: 10.11.2007
Извещение опубликовано: 10.11.2007 БИ: 31/2007
|
||||||||||||||||||||||||||
