Патент на изобретение №2196175
|
||||||||||||||||||||||||||
(54) ИНГИБИТОР РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ
(57) Реферат: Изобретение относится к биохимии, в частности к применению индолсодержащих производных малеимида общей формулы I, где если R=R1 – H, то R2 – H или низший алкил и R3 –  -D-ксилопиранозил (D-Xyl), -D-ксилопиранозил (D-Xyl),  -D-галактопиранозил (D-Gal), -D-галактопиранозил (D-Gal),  -L-арабинопиранозил (L-Ara), -L-арабинопиранозил (L-Ara),  -D-лактопиранозил (D-Lac) или – ОСН2ОСН2СН2ОН, или если R+R1 – простая связь, то R2 – Н или низший алкил и R3 – -D-лактопиранозил (D-Lac) или – ОСН2ОСН2СН2ОН, или если R+R1 – простая связь, то R2 – Н или низший алкил и R3 – -D-ксилопиранозил, -D-ксилопиранозил,  -D-галактопиранозил, -D-галактопиранозил,  -L-арабинопиранозил или – ОСН2ОСН2СН2ОН, в качестве ингибитора растворимой формы гуанилатциклазы (рГЦ). Изобретение может быть использовано в биохимии для изучения регуляторных эффектов оксида азота и механизма действия рГЦ. Соединения настоящего изобретения являются более эффективными ингибиторами активности рГЦ (степень ингибирования 31,4-86,1% в концентрации 50 мкМ), чем их наиболее близкий структурный аналог – доксорубицин (19,5%). 1 з.п. ф-лы, 1 табл. -L-арабинопиранозил или – ОСН2ОСН2СН2ОН, в качестве ингибитора растворимой формы гуанилатциклазы (рГЦ). Изобретение может быть использовано в биохимии для изучения регуляторных эффектов оксида азота и механизма действия рГЦ. Соединения настоящего изобретения являются более эффективными ингибиторами активности рГЦ (степень ингибирования 31,4-86,1% в концентрации 50 мкМ), чем их наиболее близкий структурный аналог – доксорубицин (19,5%). 1 з.п. ф-лы, 1 табл.
Изобретение относится к биохимии, в частности к применению известных индолсодержащих производных малеимида общей формулы I 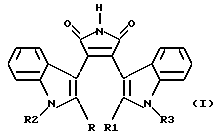 где если R=R1 – H, то R2 – Н или низший алкил и R3 –  -D-ксилопиранозил (D-Xyl), -D-ксилопиранозил (D-Xyl),  -D-галактопиранозил (D-Gal), -D-галактопиранозил (D-Gal),  -L-арабинопиранозил (L-Аrа), -L-арабинопиранозил (L-Аrа),  -D-лактопиранозил (D-Lac) или -ОСН2OСН2СН2OН, или если R+R1– простая связь, то R2 – Н или низший алкил и R3 – -D-лактопиранозил (D-Lac) или -ОСН2OСН2СН2OН, или если R+R1– простая связь, то R2 – Н или низший алкил и R3 –  -D-ксилопиранозил, -D-ксилопиранозил,  -D-галактопиранозил, -D-галактопиранозил,  -L-арабинопиранозил или -OCH2OCH2CH2OH, в качестве ингибиторов растворимой формы гуанилатциклазы (рГЦ).
Изобретение может быть использовано в биохимии для изучения регуляторных эффектов оксида азота и механизма действия рГЦ.
Гуанилатциклаза /КФ 4.6.1.2. ; гуанозин-5′-трифосфат-пирофосфатлиаза (циклизующая)/ является ферментом, катализирующим биосинтез гуанозин-3′, 5′-циклофосфата (цГМФ) – универсального регулятора внутриклеточного метаболизма (Hobbs, A. J. “Soluble guanylate cyclase: the forgotten sibling” Trends in Pharm. Sci., 1997, v.l8, 12, p.487-491[1]). ГЦ существует в двух формах – мембранной и растворимой и играет ключевую роль в регуляции таких физиологических процессов, как сокращение и расслабление гладких мышц кровеносных сосудов и агрегация тромбоцитов. Основным эндогенным активатором рГЦ является оксид азота, который в результате взаимодействия с атомом железа гема, входящего в состав фермента, образует комплекс нитрозил-гем. Известны также соединения, способные активировать рГЦ по гем-независимому механизму: например протопорфирин IX, ионы Мn2+, арахидоновая кислота и др.
В настоящее время для изучения возможного участия рГЦ в различных физиологических процессах применяют ингибиторы данного фермента, в частности 3,7-бис(диметиламино)фенотиазинийхлорид (метиленовый синий), 6-(фениламино)-хинолин-5,8-дион (LY 83583) и 1Н-[1,2,4]-оксадиазоло[4,3-а]хиноксалин-1-он (ОДХ) [1]. Данные соединения являются ингибиторами NO-зависимой активации рГЦ. Кроме того, они в аэробных условиях способствуют образованию супероксид-аниона (кроме ОДХ), а также действуют на другие биологические объекты.
Известно применение для ингибирования базальной активности рГЦ различных модификаторов тиольных групп, а именно: N-этилмалеимида и 5,5′-дитиобис(2-нитробензойной кислоты) (Tsai, S.-C., Adamik, R., et al. “Reversible inactivation of soluble liver guanylate cyclase by disulfides” Biochem. Biophys Res. Commun., 1981, v.100, 2, p.637-643).
Недостатками вышеуказанных соединений являются неспецифичность и низкая эффективность ингибирующего действия.
Известно ингибирование базальной активности рГЦ динитрилом 3,4-дигидроксибензилиденмалоновой кислоты формулы II -L-арабинопиранозил или -OCH2OCH2CH2OH, в качестве ингибиторов растворимой формы гуанилатциклазы (рГЦ).
Изобретение может быть использовано в биохимии для изучения регуляторных эффектов оксида азота и механизма действия рГЦ.
Гуанилатциклаза /КФ 4.6.1.2. ; гуанозин-5′-трифосфат-пирофосфатлиаза (циклизующая)/ является ферментом, катализирующим биосинтез гуанозин-3′, 5′-циклофосфата (цГМФ) – универсального регулятора внутриклеточного метаболизма (Hobbs, A. J. “Soluble guanylate cyclase: the forgotten sibling” Trends in Pharm. Sci., 1997, v.l8, 12, p.487-491[1]). ГЦ существует в двух формах – мембранной и растворимой и играет ключевую роль в регуляции таких физиологических процессов, как сокращение и расслабление гладких мышц кровеносных сосудов и агрегация тромбоцитов. Основным эндогенным активатором рГЦ является оксид азота, который в результате взаимодействия с атомом железа гема, входящего в состав фермента, образует комплекс нитрозил-гем. Известны также соединения, способные активировать рГЦ по гем-независимому механизму: например протопорфирин IX, ионы Мn2+, арахидоновая кислота и др.
В настоящее время для изучения возможного участия рГЦ в различных физиологических процессах применяют ингибиторы данного фермента, в частности 3,7-бис(диметиламино)фенотиазинийхлорид (метиленовый синий), 6-(фениламино)-хинолин-5,8-дион (LY 83583) и 1Н-[1,2,4]-оксадиазоло[4,3-а]хиноксалин-1-он (ОДХ) [1]. Данные соединения являются ингибиторами NO-зависимой активации рГЦ. Кроме того, они в аэробных условиях способствуют образованию супероксид-аниона (кроме ОДХ), а также действуют на другие биологические объекты.
Известно применение для ингибирования базальной активности рГЦ различных модификаторов тиольных групп, а именно: N-этилмалеимида и 5,5′-дитиобис(2-нитробензойной кислоты) (Tsai, S.-C., Adamik, R., et al. “Reversible inactivation of soluble liver guanylate cyclase by disulfides” Biochem. Biophys Res. Commun., 1981, v.100, 2, p.637-643).
Недостатками вышеуказанных соединений являются неспецифичность и низкая эффективность ингибирующего действия.
Известно ингибирование базальной активности рГЦ динитрилом 3,4-дигидроксибензилиденмалоновой кислоты формулы II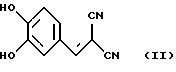 Действие данного соединения на гем-зависимую и гем-независимую активацию рГЦ не изучено (Wolbring, С.. Hollenberg M.D., Schnetkamp, P.P.M., “Inhibition of GTP-utilizing enzymes by tyrphostins” J.Biol.Chem., 1994, v. 269, 36, p.22470-22472). Известен бис(N, N-диметиламид)азодикарбоновой кислоты (диамид) формулы III 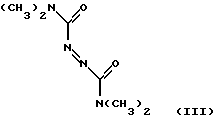 оказывающий ингибирующее действие на базальную и NO-зависимую активацию рГЦ (Craven, P.A., DeRubertis, F.R. “Effects of thiol inhibition on hepatic guanylate cyclase activity. Evidence for the involvement of vicinal dithiols in the supression of basal and agonist-stimulated activity” Biochim. Biophys. Acta, 1978, v.524, p.231-244). Основным недостатком данного соединения является низкая эффективность ингибирующего действия на фермент (IС50=0,5-20 мМ). Известно ингибирование базальной активности рГЦ макроциклическими производными азофуразана, в частности циклическим тетрамером азофуразана формулы IV 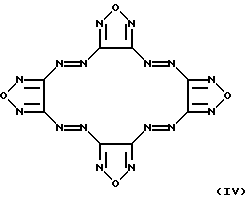 (патент РФ 2151799 (C 12 N 9/99, 9/88) 1999). Данное соединение практически не влияет на гем-зависимую активацию рГЦ под действием известного NO-донора – нитропруссида натрия. Известно уменьшение базальной и NO- зависимой активностей рГЦ под действием ингибиторов цитохром Р-450-содержащей монооксигеназы, в частности метирапона (2-метил-1,2-бис(пиридил-3)-1-пропанона) формулы V и 2,3,5-триметил-6-(12-гидроксидодека-5,10-диинил)-1,4-бензохинона (АА 861) формулы VI 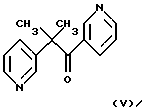 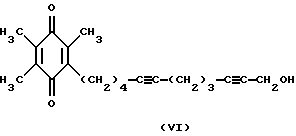 (Forstermann, U. , Alheid, U., et al. “Mechanisms of action of lipoxygenase and cytochrome P-450-mono-oxygenase inhibitors in blocking endothelium-dependent vasodilatation” Br. J. Pharm., 1988, v.93, p.569-578). Недостатками данных соединений являются неспецифичность и низкая эффективность ингибирующего действия на фермент (IС50=0,1-3 мМ). Известно, что соединения общей формулы I, где R-R3 имеют вышеуказанные значения, обладают антипролиферативными свойствами (Мельник С.Я., Бахмедова А.А. и др. “Синтез и антипролиферативные свойства гликозидов бис(индолил)фуран-2,5-диона и бис(индолил)-1H-пиррол-2,5-диона” Биоорг. химия. 1996, т.22, 6, с.458-467 [7]; Бахмедова А.А, Гараева Л.Д. и др. “N-Гликозиды производных индоло[2,3-а]карбазола” Биоорг. химия, 1997, т.23, 8, с.667-674 [8]). Способность данных соединений ингибировать активность рГЦ до настоящего времени не изучена. Наиболее близким к соединениям общей формулы I в ряду полициклических гликозильных производных является противоопухолевый антибиотик доксорубицин (адриамицин) формулы VII 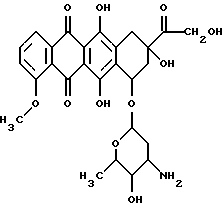 ингибирующий базальную и NO-зависимую активность рГЦ (Lehotai, D.C., Levey, В.А., et.al. “Inhibition of cardiac guanylate cyclase by doxorubicin and some of its analogs: possible relationship to cardiotoxicity” Cancer Treat. Rep., 1982, v.66, 2, p.311-316; Vesely, D.L., Levey, G.S., “Inhibition of nitroso chemical carcinogen activation of rat hepatic cyclase by anticancer reagent” Oncology, 1979, v.36, 3, p.122-126 – прототип). Недостатком данного соединения является низкая эффективность ингибирующего действия на фермент (IC50=0,26-1 мМ). Цель изобретения – поиск и выявление новых ингибиторов рГЦ, обладающих более выраженными ингибирующими свойствами. Указанная цель достигается применением известных индолсодержащих производных малеимида общей формулы I, где R-R3 имеют вышеуказанные значения, в качестве ингибиторов рГЦ. Индолсодержащие производные малеимида общей формулы I, где R=R1, были получены известным способом, основанным на реакции соответствующего N-гликозида индола в виде пер-O-ацетата с оксалилхлоридом в среде хлористого метилена с последующей циклоконденсацией промежуточного производного индол-3-илглиоксилилхлорида с 1-алкилиндол-3-илуксусной кислотой при нагревании в дихлорэтане в присутствии триэтиламина, обработкой промежуточных производных 3,4-бис(индол-3-ил)фуран-2,5-диона водным аммиаком в N,N-диметилформамиде при повышенной температуре [7]; и, при необходимости, фотоциклизацией (при синтезе соединений формулы I, где R+R1 – простая связь) [8]. Изобретение иллюстрируется следующими примерами. Пример 1. Ингибирующее действие индолсодержащих производных малеимида общей формулы I на Мn2+-зависимую активность препарата частично очищенной рГЦ из легких быка. Гемсодержащий фермент из легких быка выделяли по известному способу. Легкие измельчали при 4oС, гомогенизировали в пяти объемах буфера А (50 мМ триэтаноламингидрохлорид (рН 7,6), содержащий 5 мМ дитиотреитол и 75 мМ NaCl), и центрифугировали при 100000g в течение 1 ч. Супернатант наносили на колонку ДЭАЭ-Тойоперл 650М (Toyosoda, Япония), уравновешенную буфером А, и проводили элюцию линейным градиентом NaCl (от 0,075 до 0,5 М) в буфере А. Пик активности фермента элюировался при ионной силе, соответствующей концентрации NaCl 0,22 М. Фракции, содержащие максимальную активность, концентрировали и подвергали гель-фильтрации на колонке с сефакрилом S-300 (Pharmacia, Швеция), уравновешенной буфером А. Активные фракции объединяли, концентрировали и проводили хроматографию на колонке с голубой агарозой CL-4B (Таллиннский ХФЗ, Эстония), уравновешенной буфером В (50 мМ триэтаноламингидрохлорид (рН 7,6), содержащий 10 мМ дитиотреитол и 10 нМ гемин). Белок элюировали линейным градиентом NaCl (от 0,05 до 1 М). Активные фракции объединяли, концентрировали и хроматографировали на колонке с Q-сефарозой (Fast Flow, Pharmacia, Швеция), уравновешенной буфером А. Фермент элюировали линейным градиентом NaCl от 0,075 до 1,5 М. рГЦ хранили в атмосфере азота в буфере С (50 мМ триэтаноламингидрохлорид (рН 7,6), содержащий 30% глицерин, 10 мМ дитиотреитол и 1 М NaCl) при -70oС. Выход фермента (активность в присутствии 5 мМ МnСl2) составлял 12%, а степень очистки – 120 раз. Фермент в 12,5 раз активировался 0,1 мМ нитропруссидом натрия в присутствии 10 мМ дитиотреитола. Активность фермента определяли по количеству образовавшегося цГМФ известным радиоизотопным способом с использованием [  –32P]ГТФ в качестве субстрата рГЦ.
Инкубационная смесь для определения активности (общий объем пробы 100 мкл) содержала 50 мМ Трис-НСl (рН 7,6), 5 мМ MnCl2, 0,2 мМ ГТФ (200000 имп/мин [ –32P]ГТФ в качестве субстрата рГЦ.
Инкубационная смесь для определения активности (общий объем пробы 100 мкл) содержала 50 мМ Трис-НСl (рН 7,6), 5 мМ MnCl2, 0,2 мМ ГТФ (200000 имп/мин [ –32P]ГTФ на пробу), 5 мМ MgCl2, 5 мМ креатинфосфат, 0,4 мг/мл креатинфосфокиназы, 1 мМ 3-изобутил-1-метилксантин, 2 мМ цГМФ, ферментный препарат. Концентрация соединения в пробе составляла 1 –32P]ГTФ на пробу), 5 мМ MgCl2, 5 мМ креатинфосфат, 0,4 мг/мл креатинфосфокиназы, 1 мМ 3-изобутил-1-метилксантин, 2 мМ цГМФ, ферментный препарат. Концентрация соединения в пробе составляла 1 10-4 М, ДМСО – 0,2 об. %. В пробы вносили последовательно белок, инкубационную смесь и индолсодержащие производные малеимида общей формулы I, инкубировали 10 мин и затем начинали реакцию. Контрольная проба показала отсутствие влияния ДМСО в указанной концентрации на базальную активность рГЦ. Пробы инкубировали в термостате при 37oС в течение 15 минут. Реакцию останавливали перенесением проб на 2 минуты в кипящую водяную баню. После соосаждения непрореагировавшего ГТФ под действием карбоната цинка и центрифугирования в полученном супернатанте определяли количество образовавшегося [32Р]ГМФ вышеуказанным способом с использованием хроматографии на колонках с кислой окисью алюминия. Определение белка проводили по способу Лоури, в качестве стандарта использовали человеческий сывороточный альбумин.
Индолсодержащие производные малеимида общей формулы I оказывали ингибирующее действие на Мn2+-зависимую активность препарата частично очищенной рГЦ из легких быка. Так, эффективность ингибирующего действия ЛХС-959, ЛХС-969, ЛХС-976 и ЛХС-983 в концентрации 50 мкМ при инкубации в присутствии 10 мМ дитиотреитола составляла 64; 74,7; 94,7 и 84% соответственно.
Пример 2. Ингибирующее действие индолсодержащих производных малеимида общей формулы I на активацию препарата очищенной рГЦ из легких быка под действием 3-(4-морфолино)сиднонимина (SIN-1).
Активность рГЦ измеряли так же, как описано в примере 1, но в инкубационную смесь, не содержащую МnС12, через 10 мин инкубации в присутствии индолсодержащих производных малеимида общей формулы I добавляли раствор SIN-1 до конечной концентрации 100 мкМ.
Индолсодержащие производные малеимида общей формулы I оказывали ингибирующее действие на активацию препарата очищенной рГЦ из легких быка под действием SIN-1. Результаты представлены в таблице.
Как вытекает из примеров 1 и 2 и приведенных известных данных, соединения настоящего изобретения являются более эффективными ингибиторами активности рГЦ, чем их структурный аналог – доксорубицин.
Таким образом, применение индолсодержащих производных малеимида общей формулы I, ингибирующих рГЦ, расширяет ассортимент эффективных модуляторов активности данного фермента. 10-4 М, ДМСО – 0,2 об. %. В пробы вносили последовательно белок, инкубационную смесь и индолсодержащие производные малеимида общей формулы I, инкубировали 10 мин и затем начинали реакцию. Контрольная проба показала отсутствие влияния ДМСО в указанной концентрации на базальную активность рГЦ. Пробы инкубировали в термостате при 37oС в течение 15 минут. Реакцию останавливали перенесением проб на 2 минуты в кипящую водяную баню. После соосаждения непрореагировавшего ГТФ под действием карбоната цинка и центрифугирования в полученном супернатанте определяли количество образовавшегося [32Р]ГМФ вышеуказанным способом с использованием хроматографии на колонках с кислой окисью алюминия. Определение белка проводили по способу Лоури, в качестве стандарта использовали человеческий сывороточный альбумин.
Индолсодержащие производные малеимида общей формулы I оказывали ингибирующее действие на Мn2+-зависимую активность препарата частично очищенной рГЦ из легких быка. Так, эффективность ингибирующего действия ЛХС-959, ЛХС-969, ЛХС-976 и ЛХС-983 в концентрации 50 мкМ при инкубации в присутствии 10 мМ дитиотреитола составляла 64; 74,7; 94,7 и 84% соответственно.
Пример 2. Ингибирующее действие индолсодержащих производных малеимида общей формулы I на активацию препарата очищенной рГЦ из легких быка под действием 3-(4-морфолино)сиднонимина (SIN-1).
Активность рГЦ измеряли так же, как описано в примере 1, но в инкубационную смесь, не содержащую МnС12, через 10 мин инкубации в присутствии индолсодержащих производных малеимида общей формулы I добавляли раствор SIN-1 до конечной концентрации 100 мкМ.
Индолсодержащие производные малеимида общей формулы I оказывали ингибирующее действие на активацию препарата очищенной рГЦ из легких быка под действием SIN-1. Результаты представлены в таблице.
Как вытекает из примеров 1 и 2 и приведенных известных данных, соединения настоящего изобретения являются более эффективными ингибиторами активности рГЦ, чем их структурный аналог – доксорубицин.
Таким образом, применение индолсодержащих производных малеимида общей формулы I, ингибирующих рГЦ, расширяет ассортимент эффективных модуляторов активности данного фермента.
Формула изобретения
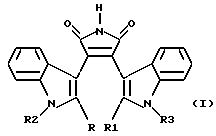 где если R= R1 – H, то R2 – H или низший алкил и R3 –  -D-ксилопиранозил, -D-ксилопиранозил,  -D-галактопиранозил, -D-галактопиранозил,  -L-арабинопиранозил, -L-арабинопиранозил,  -D-лактопиранозил или – ОСН2OСН2СН2ОН, или если R+R1 – простая связь, то R2 – H или низший алкил и R3 – -D-лактопиранозил или – ОСН2OСН2СН2ОН, или если R+R1 – простая связь, то R2 – H или низший алкил и R3 – -D-ксилопиранозил, -D-ксилопиранозил,  -D-галактопиранозил, -D-галактопиранозил,  -L-арабинопиранозил или – ОСН2OСН2СН2OН, -L-арабинопиранозил или – ОСН2OСН2СН2OН,в качестве ингибитора растворимой формы гуанилатциклазы. 2. Применение индолсодержащего производного малеимида по п. 1, где R= R1= R2 – H и R3 –  -D-ксилопиранозил, в качестве селективного ингибитора Мn2+-зависимой активации растворимой формы гуанилатциклазы. -D-ксилопиранозил, в качестве селективного ингибитора Мn2+-зависимой активации растворимой формы гуанилатциклазы.
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 17.01.2003
Номер и год публикации бюллетеня: 16-2004
Извещение опубликовано: 10.06.2004
|
||||||||||||||||||||||||||
