Патент на изобретение №2194048
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ ПИПЕРАЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
(57) Реферат: Изобретение относится к производным пиперазина формулы I, в которой R1 обозначает замещенный радикалами CN или Hal индол-3-ильный остаток, R2 обозначает незамещенный 2-оксо-2Н-1-бензопиран-6-ил или 2-оксо-2Н-1-бензопиран-4-ил. Соединения представляют собой высокоэффективные агонисты 5-НТ1А и проявляют ингибирующее действие в отношении обратного захвата 5-НТ. Они могут применяться для лечения и профилактики состояний страха, депрессий, шизофрении, невроза навязчивых состояний, для лечения и борьбы с последствиями инсульта, в частности апоплексического удара и церебральной ишемии. Описаны также способ получения соединений и фармацевтическая композиция на их основе. 3 с. и 1 з.п.ф-лы, 1 табл. 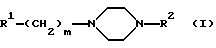
Изобретение относится к производным пиперазина формулы I 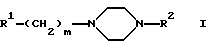 в которой R1 обозначает незамещенный или одно- либо двукратно замещенный группами Hal, CN, А, АО, ОН, CONH2, CONHA, CONA2, СООН, СООА, СН2ОН, СН2ОА, CH2NH2, CH2NHA и/или CH2NA2 индол-3-ильный остаток, R2 обозначает незамещенный или одно- либо двукратно замещенный группами А, АО, ОН, Hal, CN, NO2, NH2, NHA, NA2, COA, CONH2, CONHA, CONA2, CH2OH, CH2OA, CH2NH2, CH2NHA, СН2NА2, СООН и/или СООА 2-оксо-2Н-1-бензопиран-6-ил или 2-оксо-2Н-1-бензопиран-4-ил, где Hal обозначает F, Cl, Вr или I и А обозначает прямоцепочечный либо разветвленный алкил с 1-10 С-атомами, который может быть замещен 1-5 F- и/или Cl-атомами, или циклоалкил с 3-10 С-атомами, и m обозначает 2, 3 или 4, а также к их физиологически приемлемым солям. В основу изобретения положена задача получить новые соединения с ценными свойствами, в частности такие соединения, которые могли бы применяться для изготовления лекарственных средств. Как было установлено, соединения формулы I и их физиологически приемлемые кислотно-аддитивные соли обладают ценными фармакологическими свойствами. Соединения формулы I воздействуют на серотонинергическую трансмиссию. Благодаря тому, что эти соединения ингибируют обратный захват серотонина, они пригодны прежде всего в качестве антидепрессантов и анксилиотиков. Указанные соединения проявляют агонистические и антагонистические свойства в отношении серотонина. Они подавляют связывание тритированных лигандов серотонина с гиппокамповыми рецепторами (Cossery и др. , European Journ. Pharmacol. 140 (1987), стр. 143-155) и ингибируют синаптический обратный захват серотонина (Sherman и др., Life Sci. 23 (1978), стр. 1863-1870). Кроме того, имеют место изменения в накоплении ДОФА в полосатом теле и в накоплении 5-НТ (5-гидрокситриптамина) в различных областях головного мозга (Seyfried и др., European Journ. Pharmacol. 160 (1989), стр. 31-41). Антагонистическое действие в отношении 5-НТ1А подтверждается in vitro, например, ингибированием вызываемого 8-ОН-DPAT устранения (прекращения) электроиндуцированного сокращения подвздошной кишки у морских свинок (Fozard и Kiibinger, Br. Journ. Pharmacol. 86 (1985), 601 р.). Подтверждением антагонистического действия в отношении 5-НТ1А ex vivo служат ингибирование снижаемого под действием 8-OH-DPAT накопления 5-НТР (Seyfried и др., European Journ. Pharmacol. 160 (1989), стр.31-41) и антагонистический характер индуцированных 8-OH-DPAT эффектов поведенческой реакции, выявленных в тесте на тревожность с записью ультразвуковой вокализации (DeVry. Psychpharmacol. 121 (1995), стр. 1-26). Для подтверждения ингибирующего действия в отношении обратного захвата серотонина ex vivo используются метод синаптического подавления этого захвата (Wong и др., Neuropsychopharmacol. 8 (1993), стр. 23-33) и антагонизм по отношению к п-хлорамфетамину (Fuller и др., Journ. Pharmacol. Exp. Ther. 212 (1980), стр.115-119). Кроме того, наблюдаются анальгетические и снижающие кровяное давление эффекты. С учетом вышеизложенного предлагаемые в изобретении соединения могут применяться для лечения шизофрении, нарушений познавательной способности, состояний страха, депрессией, тошноты, замедленной дискинезии, нарушений функций желудочно-кишечного тракта, расстройств в процессе обучения, возрастных нарушений памяти, психозов, а также для положительного воздействия на невроз навязчивых состояний (обессивно-компульсивных расстройств, ОКР) и на нарушения в пищевом поведении (как, например, булимия). Эти соединения оказывают воздействие на центральную нервную систему, прежде всего дополнительное агонистическое действие в отношении 5-НТ1А и ингибирующее действие в отношении обратного захвата 5-НТ. В равной степени они могут применяться для профилактики и борьбы с последствиями инсульта (apoplexia cerebri), в частности апоплексического удара и церебральной ишемии, а также для лечения экстрапирамидально-моторных побочных действий, обусловленных нейролептическими средствами (транквилизаторами), и болезни Паркинсона. Соединения формулы I могут применяться как в ветеринарии, так и в медицине для лечения функциональных расстройств центральной нервной системы, а также воспалений. Они пригодны для акутной и симптоматической терапии болезни Альцгеймера и для лечения бокового амиотрофического склероза. Также эффективно они могут применяться в качестве терапевтических средств для лечения травм головного мозга и спинномозговых травм. Наряду с этим они пригодны в качестве активных веществ в лекарственных средствах, таких как анксилиотики, антидепрессанты, средства, предупреждающие психотические состояния, нейролептические средства, гипотензивные средства, и/или для положительного воздействия на невроз навязчивых состояний, нарушения сна, замедленную дискинезию, расстройства в процессе обучения, возрастные нарушения памяти, нарушения в пищевом поведении, такие как булимия, и/или половые расстройства. Объектом изобретения являются соединения формулы I, а также их физиологически приемлемые кислотно-аддитивные соли. Объектом изобретения являются прежде всего соединения формулы I, выбранные из группы, включающей а) 3-{4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-5-карбонитрил, б) 3-{4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}-5-фториндол, в) 3-{4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-5-карбонитрил, г) 3-{4-[4-(7-гидрокси-2-оксо-2Н-1-бензолиран-6-ил)-1-пиперазинил]бутил} индол-5-карбонитрил, а также их физиологически приемлемые соли. Касательно всех остатков, неоднократно присутствующих в соединениях, как, например, А, следует указать, что их значения не зависят друг от друга. Остаток А обозначает алкил и имеет 1-10, предпочтительно 1, 2, 3, 4, 5 или 6 и прежде всего 1 или 2 С-атома, поэтому его главным значением является, например, метил, кроме того, он обозначает этил, н-пропил, изопропил, н-бутил, втор-бутил либо трет-бутил, а также пентил, 1-, 2- либо 3-метилбутил, 1,1-, 1,2- либо 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- либо 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- либо 3,3-диметилбутил, 1- либо 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, 1,1,2- либо 1,2,2-триметилпропил, далее фторметил, дифторметил, трифторметил, 1,1,1-трихлорэтил или пентафторэтил. Циклоалкил представляет собой прежде всего, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или 1-адамантил. ОА представляет собой предпочтительно метокси, а также этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси или трет-бутокси. NHA представляет собой предпочтительно метиламино, далее этиламино, изопропиламино, н-бутиламино, изобутиламино, втор-бутиламино или трет-бутиламино. NA2 обозначает предпочтительно диметиламино, далее N-этил-N-метиламино, диэтиламино, ди-н-пропиламино, диизопропиламино или ди-н-бутиламино. Исходя из этого, CO-NHA обозначает предпочтительно N-метилкарбамоил или N-этилкарбамоил, a CO-NA2 обозначает предпочтительно N,N-диметилкарбамоил или N,N-диэтилкарбамоил. Hal обозначает фтор, хлор, бром или иод, прежде всего фтор или хлор, k обозначает 0 или 1, предпочтительно 0, m обозначает 1, 2, 3 или 4, прежде всего 3 или 4. Остаток R1 представляет собой предпочтительно незамещенный либо одно- или двукратно замещенный, но прежде всего однократно замещенный группой Hal, CN, А, АО, ОН, СОNН2, CONHA, CONA2, СООН, СООА, СН2ОН, СН2ОА, CH2NH2, CH2NHA и/или CH2NA2 2- либо 3-индолил. Предпочтительно индольный остаток в положении 5, а также в положении 6 или 7 замещен. Предпочтительными значениями R1 являются поэтому следующие: 2- либо 3-индолил, 5- либо 6-метилиндол-2-ил, 5- либо 6-метилиндол-3-ил, 5- либо 6-метоксииндол-2-ил, 5- либо 6-метоксииндол-3-ил, 5- либо 6-гидроксииндол-2-ил, 5- либо 6-гидроксииндол-3-ил, 5- либо 6-фториндол-2-ил, 5- либо 6-фториндол-3-ил, 5- либо 6-цианиндол-2-ил, 5- либо 6-цианиндол-3-ил, 5- либо 6-хлориндол-2-ил, 5- либо 6-хлориндол-3-ил, 5- либо 6-карбоксииндол-2-ил, 5- либо 6-карбоксииндол-3-ил, 5- либо 6-метоксикарбонилиндол-2-ил, 5- либо 6-метоксикарбонилиндол-3-ил, 5- либо 6-гидроксиметилиндол-2-ил, 5- либо 6-гидроксиметилиндол-3-ил, 5- либо 6-аминометилиндол-2-ил, 5-либо 6-аминометилиндол-3-ил, далее 5- либо 6-броминдол-2-ил, 5- либо 6-броминдол-3-ил, 5- либо 6-этилиндол-2-ил, 5- либо 6-этилиндол-3-ил, 5- либо 6-трифторметилиндол-2-ил, 5- либо 6-трифторметилиндол-3-ил, 5- либо 6-изопропилиндол-2-ил, 5- либо 6-изопропилинлол-3-ил, 5- либо 6-диметиламиноиндол-3-ил или 5- либо 6-диметиламиноиндол-2-ил, 5- либо 6-этоксииндол-3-ил или 5- либо 6-этоксииндол-2-ил. Остаток R2 обозначает предпочтительно незамещенный либо однократно замещенный группой А, АО, ОН, Hal, CN, NO2, NH2, NHA, NA2, COA, CONH2, CONHA, CONA2, CH2OH, CH2OA, CH2NH2, CH2NHA, CH2NA2, COOН и/или СООА 2-оксо-2Н-1-бензопиран-6-ил либо 2-оксо-2Н-1-бензопиран-4-ил. Предпочтительны в качестве заместителей группы А, АО, ОН, Hal, CN, NH2, NHA, NA2 или СН2ОН. Предпочтительными значениями R2 являются поэтому 2-оксо-2Н-1-бензопиран-6-ил либо 2-оксо-2Н-1-бензопиран-4-ил, 7-гидрокси-2-оксо-2Н-1-бензопиран-6-ил, 7-гидрокси-2-оксо-2Н-1-бензопиран-4-ил, 7-фтор-2-оксо-2Н-1-бензопиран-6-ил, 7-фтор-2-оксо-2Н-1-бензопиран-4-ил, 5-фтор-2-оксо-2Н-1-бензопиран-6-ил, 6-фтор – 2-оксо-2Н-1-бензопиран-4-ил, 5-метил-2-оксо-2Н-1-бензопиран-4-ил, 7-метил-2-оксо-2Н-1-бензопиран-6-ил, 7-диметиламино-2-оксо-2Н-1-бензопиран-6-ил, 7-гидроксиметил-2-оксо-2Н-1-бензопиран-6-ил или 7-хлор-2-оксо-2Н-1-бензопиран-6-ил. Для изобретения в целом справедливо, что все остатки, которые могут неоднократно присутствовать в молекуле, могут иметь идентичные либо разные значения, т.е. независимо друг от друга. В соответствии с этим объектом изобретения являются прежде всего такие соединения формулы I, в которых по меньшей мере один из названных остатков имеет одно из вышеуказанных предпочтительных значений. Некоторые предпочтительные группы соединений могут быть представлены нижеследующими формулами Ia-Ig, подпадающими под формулу I и где не расшифрованные более подробно остатки имеют то же значение, что и в формуле I, однако имеются и определенные отличия, а именно: в Iа R1 обозначает незамещенный 3-индолил; в Ib R1 в положении 5 обозначает замещенный 3-индолил; в Ic k обозначает 0, a m обозначает 4; в Id k обозначает 1, а m обозначает 3; в Ie R имеет значение, указанное в Ib, а заместителем является Hal, метоксикарбонил, CN или карбоксигруппа; в If R2 обозначает 2-оксо-2Н-1-бензопиран-6-ил; в Ig R обозначает 2-оксо-2Н-1-бензопиран-4-ил; в Ih R2 имеет значение, указанное в If, но при этом в положении 7 имеется еще один заместитель; в Ii R2 имеет значение, указанное в Ig, но при этом в положении 7 имеется еще один заместитель; в Ij R2 имеет значение, указанное в Ii, а заместителем является Hal или ОН. Объектом изобретения является способ получения производных пиперазина формулы I, а также их солей. Способ отличается тем, что соединение формулы II 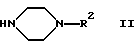 в которой R2 имеет указанное выше значение, подвергают взаимодействию с соединением формулы III R1-(CH2)m-(CO)k-L, (III) в которой L обозначает Сl, Вr, I, ОН, ОСОА, OCOPh, OSO2A, OSO2Ar, где Ar представляет собой фенил либо толил и А обозначает алкил, или какую-либо другую реакционноспособно этерифицированную ОН-группу, или легко нуклеофильно замещаемую уходящую группу, а R1, m и k имеют значения, указанные выше, или что путем восстановительного аминирования соединение формулы IV R1-(СH2)m-1-CHO, (IV) в которой R1 и m имеют значения, указанные выше, подвергают взаимодействию с соединением формулы II, или что какое-либо соединение, подпадающее под формулу I, но содержащее вместо одного либо нескольких атомов водорода одну либо несколько восстанавливаемых групп и/или одну либо несколько дополнительных С-С- и/или C-N-связей, обрабатывают восстановителем, или что какое-либо соединение, подпадающее под формулу I, но содержащее вместо одного либо нескольких атомов водорода одну либо несколько сольволизуемых групп, обрабатывают агентом сольволиза, и/или что при определенных условиях остаток R1 и/или R2 превращают в другой остаток R1 и/или R2, например, путем расщепления ОА-группы с образованием ОН-группы и/или путем дериватизации CN-, COOH- либо СООА-группы и/или путем алкилирования, например, первичного либо вторичного N-атома, и/или путем превращения полученных основания либо кислоты формулы I за счет обработки кислотой либо основанием в одну из их солей. Процесс получения соединений формулы I осуществляют в остальном по известным методам (например, описанным в публикациях, таких как Houben-Weyl, Methoden der Organischen Chemie, изд-во Georg Thieme Verlag, Штутгарт; Organic Reactions, изд-во John Wiley & Sons, Inc., Нью-Йорк; DE-OS 4101686) при соблюдении условий, известных и пригодных для проведения вышеуказанных обменных реакций. При этом можно использовать и такие варианты, которые в настоящем описании не упомянуты более подробно. Исходные вещества, требуемые для осуществления предлагаемого способа, при необходимости можно получить также in situ, не выделяя их из реакционной смеси, а непосредственно используя для последующего превращения в соединения формулы I. В соединении формулы III предпочтительным значением для остатка L является Сl или Вr, однако он может представлять собой также I, ОН или предпочтительно реакционноспособно функционально модифицированную ОН-группу, прежде всего алкилсульфонилокси с 1-6 С-атомами (например, метансульфонилокси) либо арилсульфонилокси с 6-10 С-атомами (например, бензолсульфонилокси, п-толуолсульфонилокси, 1- либо 2-нафталинсульфонилокси). Исходные вещества формул II и III, как правило, известны; неизвестные же соединения формул II и III могут быть легко получены аналогично известным соединениям. Производные пиперазина формулы II большей частью известны. Если же их нельзя приобрести коммерческим путем или если они не известны, то их можно получить с помощью известных методов. Так, в частности, их можно получить взаимодействием бис(2-хлорэтил)амина или хлорида бис(2-хлорэтил)аммония с аминозамещенными бензопирановыми соединениями. Производные индола формулы III в основном известны и частично также являются коммерчески доступными продуктами. Кроме того, эти соединения можно получить из известных соединений путем электрофильного, а в определенных случаях также путем нуклеофильного ароматического замещения. В качестве исходной субстанции используют предпочтительно соответствующую индол-3-алкановую кислоту (получаемую аналогично синтезу индола по Фишеру (тип Яппа-Клингеманна), ср.  и др., Journ. Med. Chem. 1992, 35, стр.4020-4026 или Iyer и др. , Journ. Chem. Soc. Perkin Trans. II 1973, стр.872-878). Первичные спирты формулы R1-(CH2)m-OH можно получить, например, восстановлением соответствующих карбоновых кислот либо их эфиров. Путем обработки тионилхлоридом, бромистым водородом, трибромидом фосфора или какими-либо подобными галогеносоединениями получают соответствующие галогениды формулы R2-(CH2)m-Hal. Соответствующие сульфонилоксисоединения могут быть получены из спиртов взаимодействием с соответствующими хлорангидридами сульфокислот.
Соединения иода формулы R1-(CH2)m-I можно получить, например, воздействием иодида калия на соответствующие эфиры п-толуолсульфокислоты. Амины формулы 1-(CH2)m-NH2 могут быть получены, например, из галогенидов с помощью фталимидкалия или путем восстановления соответствующих нитрилов.
Взаимодействие соединений формул II и III осуществляют по известным методам, используемым для алкилирования, соответственно ацилирования аминов. Компоненты можно расплавлять совместно в отсутствие растворителя при определенных условиях в трубке либо в автоклаве. Но можно также превращать соединения в присутствии нейтрального растворителя. В качестве растворителей пригодны среди прочих, например, углеводороды, такие как бензол, толуол, ксилол; кетоны, такие как ацетон, бутанон; спирты, такие как метанол, этанол, изопропанол, н-бутанол; простые эфиры, такие как тетрагидрофуран (ТГФ) или диоксан; амиды, такие как диметилформамид (ДМФ) или N-метилпирролидон (N-МП); нитрилы, такие как ацетонитрил, при этом при определенных условиях можно использовать также смеси этих растворителей между собой либо смеси с водой. Целесообразным может оказаться добавление связывающего кислоту агента, например гидроксида, карбоната либо бикарбоната щелочного или щелочно-земельного металла, или какой-либо другой соли слабой кислоты щелочных или щелочно-земельных металлов, предпочтительно калия, натрия или кальция, или добавление органического основания, такого как триэтиламин, диметиланилин, пиридин либо хинолин, или добавление избыточного количества производного пиперазина формулы II. Продолжительность реакции в зависимости от условий ее проведения составляет от нескольких минут до 14 дней, а температура реакции находится в интервале от приблизительно 0 до 150, обычно от 20 до 130oС.
При определенных условиях до осуществления этой реакции необходимо перед процессом алкилирования или ацилирования защищать другие содержащиеся аминогруппы, вводя соответствующие защитные группы. Понятие “аминозащитные группы” общеизвестно и относится к группам, способным защищать аминогруппу от химических превращений, но легко удаляемым по завершении требуемой химической реакции в другом месте молекулы. Поскольку такие защитные группы, равно как и методика их введения и отщепления в принципе известны специалисту в данной области техники из многочисленных литературных источников и учебников, необходимость в более подробных пояснениях отпадает.
Соединения формулы I могут быть получены, кроме того, путем восстановительного аминирования соединений формулы IV соединениями формулы II. Исходные вещества формул IV и II частично известны. Если они не известны, их можно получить с помощью известных методов. Восстановительное аминирование можно осуществлять в присутствии восстановителей, таких, например, как NaBН3CN и NаВH(ОАс)3.
Еще одна возможность получения соединения формулы I состоит в том, что форпродукт, который вместо атомов водорода содержит одну либо несколько восстанавливаемых групп и/или одну либо несколько дополнительных С-С- и/или С-N-связей, обрабатывают восстановителем предпочтительно при температурах в интервале от -80 до +250oС в присутствии по меньшей мере одного инертного растворителя. Восстанавливаемыми (заменяемыми на водород) группами являются в первую очередь кислород в карбонильной группе, гидроксил, арилсульфонилокси (например, п-толуолсульфонилокси), N-бензолсульфонил, N-бензил либо O-бензил.
В принципе соединения, которые содержат только одну либо две или более вышеуказанных групп, соответственно дополнительных связей, можно переводить путем восстановления в соединение формулы I, при этом одновременно могут восстанавливаться заместители в группе I, содержащиеся в исходном соединении. Предпочтительно использовать в этих целях выделяющийся водород или комплексные гидриды металлов, кроме того, можно проводить восстановление по Вольфу-Кишнеру, а также с помощью газообразного водорода при катализе переходными металлами.
Если в качестве восстановителя предусматривается использовать выделяющийся водород, то последний можно образовать, например, за счет обработки металлов слабыми кислотами или основаниями. Так, например, можно использовать смесь цинка с едким щелоком или железа с уксусной кислотой. Приемлемы для использования также натрий или какой-либо другой щелочной металл, растворенные в спирте, таком как этанол, изопропанол, бутанол, амиловый либо изоамиловый спирт или фенол. Кроме того, может использоваться сплав алюминия с никелем в щелочно-водном растворе, необязательно с добавками этанола. Для образования выделяющегося водорода пригодна также амальгама натрия или алюминия в водно-спиртовом либо в водном растворе. Реакцию можно проводить также в гетерогенной фазе, при этом целесообразно использовать водную и бензольную либо толуоловую фазу.
Наряду с указанными особенно предпочтительно использовать в качестве восстановителей комплексные гидриды металлов, такие как LiAlH4, NaBH4, гидрид диизобутилалюминия или NaAl(OCH2CH2OCH3)2H2, а также диборан, при необходимости с добавлением катализаторов, таких как ВF3, А1С13 или LiBr. В качестве растворителей пригодны в указанных целях прежде всего простые эфиры, в частности диэтиловый эфир, ди-н-бутиловый эфир, ТГФ, диоксан, диглимы или 1,2-диметоксиэтан, а также углеводороды, в частности бензол. При восстановлении с помощью NaBН4 предпочтительны в качестве растворителей в первую очередь спирты, такие как метанол или этанол, далее вода, а также водные растворы спиртов. Восстановление по этим методам проводят предпочтительно при температурах в интервале от -80 до +150, прежде всего от приблизительно 0 до приблизительно 100oС.
Кроме того, некоторые реакции по восстановлению можно осуществлять, используя газообразный Н2 при катализе переходными металлами, такими как никель Ренея или Pd. При такой технологии, например, Cl, Br, I, SH, а в определенных случаях и ОН-группы можно заменять на водород. В равной степени можно нитрогруппы путем каталитического гидрирования с помощью Pd/H2 в метаноле превращать в NН2-группы.
Соединения, подпадающие в принципе под формулу I, но содержащие вместо одного или нескольких Н-атомов одну или несколько сольволизуемых групп, могут подвергаться сольволизу и прежде всего гидролизу с получением в результате соединений формулы I.
Кроме того, одно соединение формулы I по известным методам можно превращать в какое-либо другое соединение формулы I.
Соединения формулы I, в которых R1 обозначает остаток, замещенный CONH2, CONHA или CONA2, могут быть получены путем дериватизации соответствующих замещенных соединений формулы I за счет частичного гидролиза. Другая возможность состоит в том, что цианзамещенные соединения формулы I сначала гидролизуют до кислот, которые затем амидируют первичными либо вторичными аминами. Предпочтительно свободную карбоновую кислоту подвергать взаимодействию с амином в условиях синтеза пептидов. Эту реакцию целесообразно проводить предпочтительно в присутствии агента дегидратации, например карбодиимида, такого как дициклогексилкарбодиимид или N-(3-диметиламинопропил)-N-этилкарбодиимид; в этих целях могут использоваться также ангидрид пропанфосфоновой кислоты (ср. Angew. Chem. 92, 129 (1980)), дифенилфосфорилазид или 2-этокси-N-этоксикарбонил-1,2-дигидрохинолин в инертном растворителе, например в галоидированном углеводороде, таком как дихлорметан, в простом эфире, таком как ТГФ или диоксан, в амиде, таком как ДМФ или диметилацетамид, в нитриле, таком как ацетонитрил, при температурах в интервале от приблизительно -10 до +40oС, предпочтительно от 0 до 30oС. Вместо кислоты, соответственно вместо амида в реакции могут использоваться также реакционноспособные производные этих веществ, например, такие, в которых реактивные группы на промежуточной стадии блокированы защитными группами. Кислоты могут использоваться также в форме их активированных эфиров, которые целесообразно образовывать in situ, например, добавлением 1-гидроксибензтриазола либо N-гидроксисукцинимида. Так, в частности, цианзамещенные индольные остатки можно гидролизовать до карбоксииндольных либо карбоксамидоиндольных остатков. Но особенно предпочтительно работать в обратной последовательности, т.е. получать нитрилы за счет отщепления воды, исходя из амидов, например, с помощью трихлорацетилхлорида/Et3N [см. Synthesis (2), 184 (1985)] или РОСl3 (см. Journ. Org. Chem. 26, 1003 (1961)).
Полученное основание формулы I можно переводить с помощью кислоты в соответствующую кислотно-аддитивную соль. Для осуществления этой реакции пригодны кислоты, образующие физиологически приемлемые соли. Так, в частности, можно использовать неорганические кислоты, например серную кислоту, галогенводородные кислоты, такие как хлористоводородная кислота либо бромистоводородная кислота, фосфорные кислоты, такие как ортофосфорная кислота, азотную кислоту, сульфоаминовую кислоту, а также органические кислоты, конкретно алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- либо многооснoвные карбоновые, сульфо- или серные кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, бензойная кислота, салициловая кислота, 2-фенилпропионовая кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- либо этансульфокислота, этандисульфокислота, 2-гидроксиэтансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталинмоно- и -дисульфокислоты, лаурилсерная кислота.
Свободные основания формулы I при необходимости могут высвобождаться из их солей за счет обработки сильными основаниями, такими как гидроксид натрия или калия, карбонат натрия или калия, в тех случаях, когда в молекуле отсутствуют другие кислотные группы. В тех случаях, когда соединения формулы I имеют свободные кислотные группы, за счет обработки основаниями также можно образовывать соли. В качестве таких оснований пригодны гидроксиды щелочных и щелочно-земельных металлов или органические основания в виде первичных, вторичных либо третичных аминов.
Объектом изобретения является применение соединений формулы I и их физиологически приемлемых солей для получения фармацевтических композиций прежде всего нехимическим путем. При этом из них совместно с по меньшей мере одним твердым, жидким и/или полужидким носителем или вспомогательным веществом и необязательно в сочетании с одним либо несколькими другими активными веществами может изготавливаться соответствующая дозированная форма.
Еще одним объектом изобретения являются средства, прежде всего фармацевтические композиции, содержащие в своем составе по меньшей мере одно соединение формулы I и/или одну из его физиологически приемлемых солей. Эти композиции могут применяться в качестве лекарственных средств в медицине и в ветеринарии. В качестве субстанций-носителей в них приемлемы органические или неорганические вещества, пригодные для энтерального (например, орального), парентерального либо местного введения и не вступающие в реакцию с новыми соединениями, например вода, масла растительного происхождения, бензиловые спирты, полиэтиленгликоли, желатин, углеводороды, такие как лактоза или крахмал, стеарат магния, тальк, вазелины. Для энтерального введения могут назначаться прежде всего таблетки, драже, капсулы, сиропы, микстуры, капли или суппозитории, для парентерального введения предназначены растворы, предпочтительно масляные либо водные растворы, далее суспензии, эмульсии или имплантаты, для местного применения могут назначаться мази, кремы или пудра. Новые соединения можно также подвергать лиофилизации и полученные лиофилизаты использовать, например, для изготовления препаратов для инъекций. Указанные композиции можно стерилизовать и/или они могут содержать в своем составе такие вспомогательные вещества, как замасливатели, консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для регуляции осмотического давления, буферные субстанции, красители, вкусовые добавки и/или ароматизаторы. При необходимости в их составе можно предусмотреть несколько других активных веществ, например один или несколько витаминов.
Соединения формулы I и их физиологически приемлемые соли могут применяться в терапевтических целях для лечения человека и животных и для борьбы с болезнями. Они пригодны для лечения заболеваний центральной нервной системы, таких как состояния напряженности, депрессии, состояния страха, шизофрения, нарушения функций желудочно-кишечного тракта, тошнота, замедленная дискинезия, паркинсонизм и/или психозы, и для устранения побочных действий при лечении гипертонии (например, и др., Journ. Med. Chem. 1992, 35, стр.4020-4026 или Iyer и др. , Journ. Chem. Soc. Perkin Trans. II 1973, стр.872-878). Первичные спирты формулы R1-(CH2)m-OH можно получить, например, восстановлением соответствующих карбоновых кислот либо их эфиров. Путем обработки тионилхлоридом, бромистым водородом, трибромидом фосфора или какими-либо подобными галогеносоединениями получают соответствующие галогениды формулы R2-(CH2)m-Hal. Соответствующие сульфонилоксисоединения могут быть получены из спиртов взаимодействием с соответствующими хлорангидридами сульфокислот.
Соединения иода формулы R1-(CH2)m-I можно получить, например, воздействием иодида калия на соответствующие эфиры п-толуолсульфокислоты. Амины формулы 1-(CH2)m-NH2 могут быть получены, например, из галогенидов с помощью фталимидкалия или путем восстановления соответствующих нитрилов.
Взаимодействие соединений формул II и III осуществляют по известным методам, используемым для алкилирования, соответственно ацилирования аминов. Компоненты можно расплавлять совместно в отсутствие растворителя при определенных условиях в трубке либо в автоклаве. Но можно также превращать соединения в присутствии нейтрального растворителя. В качестве растворителей пригодны среди прочих, например, углеводороды, такие как бензол, толуол, ксилол; кетоны, такие как ацетон, бутанон; спирты, такие как метанол, этанол, изопропанол, н-бутанол; простые эфиры, такие как тетрагидрофуран (ТГФ) или диоксан; амиды, такие как диметилформамид (ДМФ) или N-метилпирролидон (N-МП); нитрилы, такие как ацетонитрил, при этом при определенных условиях можно использовать также смеси этих растворителей между собой либо смеси с водой. Целесообразным может оказаться добавление связывающего кислоту агента, например гидроксида, карбоната либо бикарбоната щелочного или щелочно-земельного металла, или какой-либо другой соли слабой кислоты щелочных или щелочно-земельных металлов, предпочтительно калия, натрия или кальция, или добавление органического основания, такого как триэтиламин, диметиланилин, пиридин либо хинолин, или добавление избыточного количества производного пиперазина формулы II. Продолжительность реакции в зависимости от условий ее проведения составляет от нескольких минут до 14 дней, а температура реакции находится в интервале от приблизительно 0 до 150, обычно от 20 до 130oС.
При определенных условиях до осуществления этой реакции необходимо перед процессом алкилирования или ацилирования защищать другие содержащиеся аминогруппы, вводя соответствующие защитные группы. Понятие “аминозащитные группы” общеизвестно и относится к группам, способным защищать аминогруппу от химических превращений, но легко удаляемым по завершении требуемой химической реакции в другом месте молекулы. Поскольку такие защитные группы, равно как и методика их введения и отщепления в принципе известны специалисту в данной области техники из многочисленных литературных источников и учебников, необходимость в более подробных пояснениях отпадает.
Соединения формулы I могут быть получены, кроме того, путем восстановительного аминирования соединений формулы IV соединениями формулы II. Исходные вещества формул IV и II частично известны. Если они не известны, их можно получить с помощью известных методов. Восстановительное аминирование можно осуществлять в присутствии восстановителей, таких, например, как NaBН3CN и NаВH(ОАс)3.
Еще одна возможность получения соединения формулы I состоит в том, что форпродукт, который вместо атомов водорода содержит одну либо несколько восстанавливаемых групп и/или одну либо несколько дополнительных С-С- и/или С-N-связей, обрабатывают восстановителем предпочтительно при температурах в интервале от -80 до +250oС в присутствии по меньшей мере одного инертного растворителя. Восстанавливаемыми (заменяемыми на водород) группами являются в первую очередь кислород в карбонильной группе, гидроксил, арилсульфонилокси (например, п-толуолсульфонилокси), N-бензолсульфонил, N-бензил либо O-бензил.
В принципе соединения, которые содержат только одну либо две или более вышеуказанных групп, соответственно дополнительных связей, можно переводить путем восстановления в соединение формулы I, при этом одновременно могут восстанавливаться заместители в группе I, содержащиеся в исходном соединении. Предпочтительно использовать в этих целях выделяющийся водород или комплексные гидриды металлов, кроме того, можно проводить восстановление по Вольфу-Кишнеру, а также с помощью газообразного водорода при катализе переходными металлами.
Если в качестве восстановителя предусматривается использовать выделяющийся водород, то последний можно образовать, например, за счет обработки металлов слабыми кислотами или основаниями. Так, например, можно использовать смесь цинка с едким щелоком или железа с уксусной кислотой. Приемлемы для использования также натрий или какой-либо другой щелочной металл, растворенные в спирте, таком как этанол, изопропанол, бутанол, амиловый либо изоамиловый спирт или фенол. Кроме того, может использоваться сплав алюминия с никелем в щелочно-водном растворе, необязательно с добавками этанола. Для образования выделяющегося водорода пригодна также амальгама натрия или алюминия в водно-спиртовом либо в водном растворе. Реакцию можно проводить также в гетерогенной фазе, при этом целесообразно использовать водную и бензольную либо толуоловую фазу.
Наряду с указанными особенно предпочтительно использовать в качестве восстановителей комплексные гидриды металлов, такие как LiAlH4, NaBH4, гидрид диизобутилалюминия или NaAl(OCH2CH2OCH3)2H2, а также диборан, при необходимости с добавлением катализаторов, таких как ВF3, А1С13 или LiBr. В качестве растворителей пригодны в указанных целях прежде всего простые эфиры, в частности диэтиловый эфир, ди-н-бутиловый эфир, ТГФ, диоксан, диглимы или 1,2-диметоксиэтан, а также углеводороды, в частности бензол. При восстановлении с помощью NaBН4 предпочтительны в качестве растворителей в первую очередь спирты, такие как метанол или этанол, далее вода, а также водные растворы спиртов. Восстановление по этим методам проводят предпочтительно при температурах в интервале от -80 до +150, прежде всего от приблизительно 0 до приблизительно 100oС.
Кроме того, некоторые реакции по восстановлению можно осуществлять, используя газообразный Н2 при катализе переходными металлами, такими как никель Ренея или Pd. При такой технологии, например, Cl, Br, I, SH, а в определенных случаях и ОН-группы можно заменять на водород. В равной степени можно нитрогруппы путем каталитического гидрирования с помощью Pd/H2 в метаноле превращать в NН2-группы.
Соединения, подпадающие в принципе под формулу I, но содержащие вместо одного или нескольких Н-атомов одну или несколько сольволизуемых групп, могут подвергаться сольволизу и прежде всего гидролизу с получением в результате соединений формулы I.
Кроме того, одно соединение формулы I по известным методам можно превращать в какое-либо другое соединение формулы I.
Соединения формулы I, в которых R1 обозначает остаток, замещенный CONH2, CONHA или CONA2, могут быть получены путем дериватизации соответствующих замещенных соединений формулы I за счет частичного гидролиза. Другая возможность состоит в том, что цианзамещенные соединения формулы I сначала гидролизуют до кислот, которые затем амидируют первичными либо вторичными аминами. Предпочтительно свободную карбоновую кислоту подвергать взаимодействию с амином в условиях синтеза пептидов. Эту реакцию целесообразно проводить предпочтительно в присутствии агента дегидратации, например карбодиимида, такого как дициклогексилкарбодиимид или N-(3-диметиламинопропил)-N-этилкарбодиимид; в этих целях могут использоваться также ангидрид пропанфосфоновой кислоты (ср. Angew. Chem. 92, 129 (1980)), дифенилфосфорилазид или 2-этокси-N-этоксикарбонил-1,2-дигидрохинолин в инертном растворителе, например в галоидированном углеводороде, таком как дихлорметан, в простом эфире, таком как ТГФ или диоксан, в амиде, таком как ДМФ или диметилацетамид, в нитриле, таком как ацетонитрил, при температурах в интервале от приблизительно -10 до +40oС, предпочтительно от 0 до 30oС. Вместо кислоты, соответственно вместо амида в реакции могут использоваться также реакционноспособные производные этих веществ, например, такие, в которых реактивные группы на промежуточной стадии блокированы защитными группами. Кислоты могут использоваться также в форме их активированных эфиров, которые целесообразно образовывать in situ, например, добавлением 1-гидроксибензтриазола либо N-гидроксисукцинимида. Так, в частности, цианзамещенные индольные остатки можно гидролизовать до карбоксииндольных либо карбоксамидоиндольных остатков. Но особенно предпочтительно работать в обратной последовательности, т.е. получать нитрилы за счет отщепления воды, исходя из амидов, например, с помощью трихлорацетилхлорида/Et3N [см. Synthesis (2), 184 (1985)] или РОСl3 (см. Journ. Org. Chem. 26, 1003 (1961)).
Полученное основание формулы I можно переводить с помощью кислоты в соответствующую кислотно-аддитивную соль. Для осуществления этой реакции пригодны кислоты, образующие физиологически приемлемые соли. Так, в частности, можно использовать неорганические кислоты, например серную кислоту, галогенводородные кислоты, такие как хлористоводородная кислота либо бромистоводородная кислота, фосфорные кислоты, такие как ортофосфорная кислота, азотную кислоту, сульфоаминовую кислоту, а также органические кислоты, конкретно алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- либо многооснoвные карбоновые, сульфо- или серные кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, бензойная кислота, салициловая кислота, 2-фенилпропионовая кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- либо этансульфокислота, этандисульфокислота, 2-гидроксиэтансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталинмоно- и -дисульфокислоты, лаурилсерная кислота.
Свободные основания формулы I при необходимости могут высвобождаться из их солей за счет обработки сильными основаниями, такими как гидроксид натрия или калия, карбонат натрия или калия, в тех случаях, когда в молекуле отсутствуют другие кислотные группы. В тех случаях, когда соединения формулы I имеют свободные кислотные группы, за счет обработки основаниями также можно образовывать соли. В качестве таких оснований пригодны гидроксиды щелочных и щелочно-земельных металлов или органические основания в виде первичных, вторичных либо третичных аминов.
Объектом изобретения является применение соединений формулы I и их физиологически приемлемых солей для получения фармацевтических композиций прежде всего нехимическим путем. При этом из них совместно с по меньшей мере одним твердым, жидким и/или полужидким носителем или вспомогательным веществом и необязательно в сочетании с одним либо несколькими другими активными веществами может изготавливаться соответствующая дозированная форма.
Еще одним объектом изобретения являются средства, прежде всего фармацевтические композиции, содержащие в своем составе по меньшей мере одно соединение формулы I и/или одну из его физиологически приемлемых солей. Эти композиции могут применяться в качестве лекарственных средств в медицине и в ветеринарии. В качестве субстанций-носителей в них приемлемы органические или неорганические вещества, пригодные для энтерального (например, орального), парентерального либо местного введения и не вступающие в реакцию с новыми соединениями, например вода, масла растительного происхождения, бензиловые спирты, полиэтиленгликоли, желатин, углеводороды, такие как лактоза или крахмал, стеарат магния, тальк, вазелины. Для энтерального введения могут назначаться прежде всего таблетки, драже, капсулы, сиропы, микстуры, капли или суппозитории, для парентерального введения предназначены растворы, предпочтительно масляные либо водные растворы, далее суспензии, эмульсии или имплантаты, для местного применения могут назначаться мази, кремы или пудра. Новые соединения можно также подвергать лиофилизации и полученные лиофилизаты использовать, например, для изготовления препаратов для инъекций. Указанные композиции можно стерилизовать и/или они могут содержать в своем составе такие вспомогательные вещества, как замасливатели, консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для регуляции осмотического давления, буферные субстанции, красители, вкусовые добавки и/или ароматизаторы. При необходимости в их составе можно предусмотреть несколько других активных веществ, например один или несколько витаминов.
Соединения формулы I и их физиологически приемлемые соли могут применяться в терапевтических целях для лечения человека и животных и для борьбы с болезнями. Они пригодны для лечения заболеваний центральной нервной системы, таких как состояния напряженности, депрессии, состояния страха, шизофрения, нарушения функций желудочно-кишечного тракта, тошнота, замедленная дискинезия, паркинсонизм и/или психозы, и для устранения побочных действий при лечении гипертонии (например,  -метилдопамином). Наряду с этим предлагаемые соединения могут найти применение в эндокринологии и гинекологии, например для терапии акромегалии, гипогонадизма, вторичной аминореи, предменструального синдрома, нежелательной пуэрперальной (послеродовой) лактации, кроме того, для профилактики и терапии расстройств, связанных с сосудами головного мозга (например, мигреней), прежде всего в гериатрии, подобно некоторым эрготалкалоидам.
Особенно предпочтительно они могут применяться в качестве терапевтических средств для борьбы с последствиями инсульта (apoplexia cerebri), в частности апоплексического удара и церебральной ишемии, и для лечения травм головного мозга и спинномозговых травм. Но прежде всего они пригодны для применения в качестве активных веществ в таких лекарственных средствах, как анксиолитики, антидепрессанты, средства, предупреждающие психотические состояния, и/или для положительного воздействия на невроз навязчивых состояний (ОКР), нарушения сна, замедленную дискинезию, расстройства в процессе обучения, возрастные нарушения памяти, нарушения в пищевом поведении, как, например, булимия, и/или половые расстройства.
Предлагаемые в изобретении субстанции назначают при этом, как правило, аналогично известным, коммерчески доступным препаратам (таким, например, как бромокрипин, дигидроэргокорнин) предпочтительно в дозировках от порядка 0,2 до 500 мг, прежде всего от 0,2 до 50 мг на одну унифицированную дозу. Суточная доза составляет предпочтительно от порядка 0,001 до 10 мг/кг веса пациента. Низкие дозировки составляют от порядка 0,2 до 500 мг, предпочтительно от 0,2 до 50 мг на одну унифицированную дозу. Низкие дозировки (приблизительно 0,2-1 мг на одну унифицированную дозу; приблизительно 0,001-0,005 мг/кг веса тела) назначают при этом прежде всего в случае мигреней, тогда как при других показаниях предпочтительны дозировки от 10 до 50 мг на одну унифицированную дозу. Однако назначаемая тому или иному пациенту доза зависит от самых разных факторов, в частности от эффективности применяемого соединения, от возраста пациента, веса тела, общего состояния его здоровья, пола, от особенностей питания, от времени и методики введения препарата, от скорости выделения, комбинации лекарственных средств и степени тяжести соответствующего заболевания, для лечения которого предназначается данная терапия. Предпочтительно оральное введение.
Под используемым в нижеследующих примерах понятием “обычная переработка” имеются в виду следующие операции: при необходимости добавляют воду, при необходимости в зависимости от структурных особенностей конечного продукта устанавливают рН от 2 до 10, экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу сушат над сульфатом натрия, фильтруют, упаривают и очищают посредством хроматографии на силикагеле и/или путем кристаллизации. Значения Rf определяли с помощью тонкослойной хроматографии на силикагеле. Значения М ++1 выявляли посредством FAB-масс-спектрометрии (FAB означает “бомбардировку ускоренными атомами”).
Пример 1.
Растворяют 0,79 г (0,003 моля) 4-(2-оксо-2H-1-бензопиран-4-ил)пиперазина [получаемого, например, взаимодействием N,N-биc(2-хлорэтил)амина с 4-амино-2-оксо-2Н-1-бензопираном] и 0,80 г (0,003 моля) 3-(4-хлорбутил)-5-цианиндола [который может быть получен восстановлением 3-(4-хлорбутаноил)индол-5-карбонитрила] в 100 мл ацетонитрила, затем добавляют 0,50 мл (0,004 моля) триэтиламина и 1,20 мл (0,007 моля) этилдиизопропиламина и перемешивают в течение ночи на паровой бане. После обычной переработки получают 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил]индол-5-карбонитрил, дигидрохлорид, tпл 284-285oС.
Аналогично получают: -метилдопамином). Наряду с этим предлагаемые соединения могут найти применение в эндокринологии и гинекологии, например для терапии акромегалии, гипогонадизма, вторичной аминореи, предменструального синдрома, нежелательной пуэрперальной (послеродовой) лактации, кроме того, для профилактики и терапии расстройств, связанных с сосудами головного мозга (например, мигреней), прежде всего в гериатрии, подобно некоторым эрготалкалоидам.
Особенно предпочтительно они могут применяться в качестве терапевтических средств для борьбы с последствиями инсульта (apoplexia cerebri), в частности апоплексического удара и церебральной ишемии, и для лечения травм головного мозга и спинномозговых травм. Но прежде всего они пригодны для применения в качестве активных веществ в таких лекарственных средствах, как анксиолитики, антидепрессанты, средства, предупреждающие психотические состояния, и/или для положительного воздействия на невроз навязчивых состояний (ОКР), нарушения сна, замедленную дискинезию, расстройства в процессе обучения, возрастные нарушения памяти, нарушения в пищевом поведении, как, например, булимия, и/или половые расстройства.
Предлагаемые в изобретении субстанции назначают при этом, как правило, аналогично известным, коммерчески доступным препаратам (таким, например, как бромокрипин, дигидроэргокорнин) предпочтительно в дозировках от порядка 0,2 до 500 мг, прежде всего от 0,2 до 50 мг на одну унифицированную дозу. Суточная доза составляет предпочтительно от порядка 0,001 до 10 мг/кг веса пациента. Низкие дозировки составляют от порядка 0,2 до 500 мг, предпочтительно от 0,2 до 50 мг на одну унифицированную дозу. Низкие дозировки (приблизительно 0,2-1 мг на одну унифицированную дозу; приблизительно 0,001-0,005 мг/кг веса тела) назначают при этом прежде всего в случае мигреней, тогда как при других показаниях предпочтительны дозировки от 10 до 50 мг на одну унифицированную дозу. Однако назначаемая тому или иному пациенту доза зависит от самых разных факторов, в частности от эффективности применяемого соединения, от возраста пациента, веса тела, общего состояния его здоровья, пола, от особенностей питания, от времени и методики введения препарата, от скорости выделения, комбинации лекарственных средств и степени тяжести соответствующего заболевания, для лечения которого предназначается данная терапия. Предпочтительно оральное введение.
Под используемым в нижеследующих примерах понятием “обычная переработка” имеются в виду следующие операции: при необходимости добавляют воду, при необходимости в зависимости от структурных особенностей конечного продукта устанавливают рН от 2 до 10, экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу сушат над сульфатом натрия, фильтруют, упаривают и очищают посредством хроматографии на силикагеле и/или путем кристаллизации. Значения Rf определяли с помощью тонкослойной хроматографии на силикагеле. Значения М ++1 выявляли посредством FAB-масс-спектрометрии (FAB означает “бомбардировку ускоренными атомами”).
Пример 1.
Растворяют 0,79 г (0,003 моля) 4-(2-оксо-2H-1-бензопиран-4-ил)пиперазина [получаемого, например, взаимодействием N,N-биc(2-хлорэтил)амина с 4-амино-2-оксо-2Н-1-бензопираном] и 0,80 г (0,003 моля) 3-(4-хлорбутил)-5-цианиндола [который может быть получен восстановлением 3-(4-хлорбутаноил)индол-5-карбонитрила] в 100 мл ацетонитрила, затем добавляют 0,50 мл (0,004 моля) триэтиламина и 1,20 мл (0,007 моля) этилдиизопропиламина и перемешивают в течение ночи на паровой бане. После обычной переработки получают 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил]индол-5-карбонитрил, дигидрохлорид, tпл 284-285oС.
Аналогично получают:3-{4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол, 3-{4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}-5-фториндол, 3-{4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}-5-хлориндол, 3-{4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}-5-метоксииндол, 3-(4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил} -5-этоксииндол, метиловый эфир 3-{4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, 3-{4-[4-(2-оксо-2Н-1-бензопирап-4-ил)-1-пиперазинил]бутил}-6-фториндол, 3-{4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}-6-хлориндол, 3-{4-[4-(2-оксо-2Н-1-бензопирап-4-ил)-1-пиперазинил]бутил}-6-метоксииндол, 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил}-6-этоксииндол, метиловый эфир 3-{4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, 3-{4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазипил]бутил}-индол-6-карбонитрил. Пример 2. Смесь из 8,3 г (0,031 моля) 4-(2-оксо-2Н-1-бензопиран-6-ил)пиперазина, гидрохлорида (получение аналогично примеру 1), 7,70 г (0,033 моля) 3-(4-хлорбутил)-5-цианиндола (получение см. пример 1), 6,7 г (0,066 моля) триэтиламина, 11,3 мл (0,066 моля) этилдиизопропиламина и 55 мл 1-метил-2-пирролидона перемешивают в течение ночи при температуре бани 120-130oС. Затем суспензию сливают при перемешивании в 4 л ледяной воды и после продолжительного перемешивания получают кристаллический 3-{4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил} индол-5-карбонитрил с tпл 135-137oС, а в виде гидрохлорида с tпл 282-284oС. Аналогично получают: 3-{4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол, 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил}индол-5-карбонитрил, моногидрохлорид, tпл 287-290oС, 3-{ 4-[4-(2-оксо-2Н-1-бензопирап-6-ил)-1-пиперазинил] бутил} -5-метоксииндол, 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил}-5-этоксииндол, метиловый эфир 3-{4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил} -6-метоксииндол, 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил}-6-этоксииндол, метиловый эфир 3-{4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил}индол-6-карбонитрил. Пример 3. Смесь из 5,10 г (0,017 моля) 4-(5-фториндол-3-ил)бутилового эфира метансульфокислоты [получаемого взаимодействием 4-(5-фториндол-3-ил)бутанола (получаемого восстановлением с помощью гидрида литийалюминия 4-(5-фториндол-3-ил)бутановой кислоты, которая может быть получена по реакции аналогично реакции Яппа-Клингеманна, в ТГФ) с хлорангидридом метансульфокислоты], 4,0 г (0,015 моля) 4-(2-оксо-2Н-1-бензопиран-6-ил)пиперазина, гидрохлорида (получение аналогично примеру 1), 200 мл ацетонитрила и 10,0 мл триэтиламина перемешивают в течение 30 ч на паровой бане, подвергая таким образом компоненты взаимодействию друг с другом. После обычной переработки получают 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил}-5-фториндол, гидрохлорид, tпл 293-295oС. Аналогично получают: 3-{4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}-5-хлориндол, 3-{4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}-6-фториндол, 3-{4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}-6-хлориндол, 3-{ 4-[4-(7-гидрокси-2-оксо-2H-1-бензопиран-6-ил)-1-пиперазинил] бутил} индол, 3-{ 4-[4-(7-гидрокси-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}-5-фториндол, 3-{ 4-[4-(7-гидрокси-2-оксо-2H-1-бензопиран-6-ил)-1-пиперазинил]бутил}-6-фториндол, 3-{ 4-[4-(7-гидрокси-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}-5-хлориндол, 3-{ 4-[4-(7-гидрокси-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}-6-хлориндол. Пример 4. Смесь из 0,0098 моля 4-(5-метоксикарбонилиндол-3-ил)бутилового эфира метансульфокислоты (получение аналогично описанному в примере 3) и 0,0097 моля 4-(2-оксо-2Н-1-бензопиран-6-ил)пиперазина нагревают в ацетонитриле в течение приблизительно 96 ч на паровой бане. Затем реакционную смесь подвергают обычной переработке и очищают. Таким путем получают метиловый эфир 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил} индол-5-карбоновой кислоты. Аналогично получают: метиловый эфир 3-{4-[4-(7-метил-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, метиловый эфир 3-{4-[4-(7-метокси-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-фтор-2-оксо-2H-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-хлор-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-циан-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, метиловый эфир 3-{4-[4-(7-метил-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, метиловый эфир 3-{4-[4-(7-метокси-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-фтор-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-хлор-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-циан-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-5-карбоновой кислоты, метиловый эфир 3-{4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, метиловый эфир 3-{4-[4-(7-метил-2-оксо-2H-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, метиловый эфир 3-{4-[4-(7-метокси-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-фтор-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-хлор-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-циан-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, метиловый эфир 3-{4-[4-(7-метил-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, метиловый эфир 3-{4-[4-(7-метокси-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-фтор-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-хлор-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты, метиловый эфир 3-{ 4-[4-(7-циан-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-6-карбоновой кислоты. Пример 5. 1,8 г метилового эфира 3-{4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил}индол-5-карбоновой кислоты кипятят в течение 30 мин со 100 мл 2 н. КОН в этаноле, после чего проводят обычную переработку и получают в результате 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-5-карбоновую кислоту. Аналогично получают: 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил}индол-6-карбоновую кислоту, 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил}индол-5-карбоновую кислоту, 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил}индол-6-карбоновую кислоту, 3-{ 4-[4-(7-метил-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил} индол-5-карбоновую кислоту, 3-{ 4-[4-(7-метокси-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-5-карбоновую кислоту, 3-{ 4-[4-(7-фтор-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил} индол-5-карбоновую кислоту, 3-{ 4-[4-(7-хлор-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил} индол-5-карбоновую кислоту, 3-{ 4-[4-(7-циан-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил} индол-5-карбоновую кислоту, 3-{ 4-[4-(7-метил-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил} индол-5-карбоновую кислоту, 3-{ 4-[4-(7-метокси-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-5-карбоновую кислоту, 3-{ 4-[4-(7-фтор-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил} индол-5-карбоновую кислоту, 3-{ 4-[4-(7-хлор-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил} индол-5-карбоновую кислоту, 3-{ 4-[4-(7-циан-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил} индол-5-карбоновую кислоту, 3-{ 4-[4-(7-метил-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил} индол-6-карбоновую кислоту, 3-{ 4-[4-(7-метокси-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-6-карбоновую кислоту, 3-{ 4-[4-(7-фтор-2-оксо-2Н-1-бензопиран-6-ил)-1-питаразинил] бутил} индол-6-карбоновую кислоту, 3-{ 4-[4-(7-хлор-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил} индол-6-карбоновую кислоту, 3-{ 4-[4-(7-циан-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил} индол-6-карбоновую кислоту, 3-{ 4-[4-(7-метил-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил} индол-6-карбоновую кислоту, 3-{ 4-[4-(7-метокси-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-6-карбоновую кислоту, 3-{ 4-[4-(7-фтор-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил} индол-6-карбоновую кислоту, 3-{ 4-[4-(7-хлор-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил} индол-6-карбоновую кислоту, 3-{ 4-[4-(7-циан-2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил] бутил} индол-6-карбоновую кислоту. Ниже приведены примеры фармацевтических композиций и технология их приготовления в соответствующих дозированных формах. Пример А: Склянки для инъекционных растворов Раствор из 100 г активного вещества формулы I и 5 г динатрийгидрофосфата в 3 л дважды дистиллированной воды с помощью 2 н. соляной кислоты устанавливают на рН 6,5, стерильно фильтруют, заполняют склянки, лиофилизуют в стерильных условиях и стерильно укупоривают. В каждой склянке содержится 5 мг активного вещества. Пример Б: Суппозитории Смесь из 20 г активного вещества формулы I, 100 г соевого лецитина и 1400 г масла какао расплавляют, разливают в формы и дают застыть. Каждый суппозиторий содержит 20 мг активного вещества. Пример В: Раствор Приготавливают раствор из 1 г активного вещества формулы I, 9,38 г NаH2РО4  2H2О, 28,48 г Na2HPO4 2H2О, 28,48 г Na2HPO4 12H2O и 0,1 г хлорида бензалкония в 940 мл дважды дистиллированной воды. Затем устанавливают на рН 6,8, доводят до объема 1 л и стерилизуют облучением. Этот раствор может применяться в виде глазных капель.
Пример Г: Мазь 12H2O и 0,1 г хлорида бензалкония в 940 мл дважды дистиллированной воды. Затем устанавливают на рН 6,8, доводят до объема 1 л и стерилизуют облучением. Этот раствор может применяться в виде глазных капель.
Пример Г: МазьПри соблюдении асептических условий приготавливают смесь из 500 мг активного вещества формулы I и 99,5 г вазелина. Пример Д: Таблетки Смесь из 1 кг активного вещества формулы I, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния таблетируют по обычной технологии, получая таблетки, каждая из которых содержит 10 мг активного вещества. Пример Е: Драже Аналогично примеру Д прессуют таблетки, которые затем по обычной технологии покрывают оболочкой из сахарозы, картофельного крахмала, талька, траганта и красителя. Пример Ж: Капсулы Из 2 кг активного вещества формулы I по обычной технологии изготавливают капсулы с твердожелатиновым покрытием, каждая из которых содержит 20 мг активного вещества. Пример З: Ампулы Раствор из 1 кг активного вещества формулы I в 60 л дважды дистиллированной воды стерильно фильтруют, разливают в ампулы, в стерильных условиях лиофилизуют и стерильно укупоривают. В каждой ампуле содержится 10 мг активного вещества. Были получены значения IC50 (концентрации в мол/литр) для некоторых характерных представителей ряда соединений формулы I, представленные в таблице. Представленные опытные данные демонстрируют ингибирующие действия в отношении обратного захвата 5-НТ, а также действие как агониста в отношении 5-НТ1А некоторых выбранных соединений, заявленных в изобретении. Тесты осуществлялись в соответствии с методами, описанными ранее в настоящей заявке. Результаты полученных испытаний совершенно четко демонстрируют ценность заявленных соединений в плане возможного их использования, особенно в качестве антидепрессантов и анксиолитиков. Формула изобретения
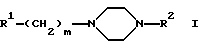 в которой R1 обозначает замещенный радикалами CN или Hal, индол-3-ильный остаток, R2 обозначает незамещенный 2-оксо-2Н-1-бензопиран-6-ил или 2-оксо-2Н-1-бензопиран-4-ил, где Hal обозначает F, Cl, Br или I и m = 4, а также их физиологически приемлемые соли. 2. Соединения по п.1, выбранные из группы, включающей а) 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил}индол-5-карбонитрил, б) 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил] бутил} -5-фториндол, в) 3-{ 4-[4-(2-оксо-2Н-1-бензопиран-4-ил)-1-пиперазинил]бутил}индол-5-карбонитрил, г) 3-{4-[4-(7-гидрокси-2-оксо-2Н-1-бензопиран-6-ил)-1-пиперазинил]бутил} индол-5-карбонитрил, а также их физиологически приемлемые соли. 3. Способ получения производных пиперазина формулы I по п.1 и их солей, заключающийся в том, что соединение формулы II 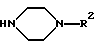 в которой R2 имеет указанные в п.1 значения, подвергают взаимодействию с соединением формулы III R1-(CH2)m-(CO)k-L, в которой R1 имеет указанные в п.1 значения, L обозначает Cl, Br, J, OSO2A, A обозначает алкил, легко нуклеофильно замещаемую уходящую группу, k=0, m=4, с последующим в случае необходимости превращением продукта в одну из солей. 4. Фармацевтическая композиция, ингибирующая действие в отношении обратного захвата 5-НТ, а также обладающая действием как агониста в отношении 5-НТ1А, отличающаяся тем, что она содержит в своем составе по меньшей мере одно соединение общей формулы I и/или одну из его физиологически приемлемых солей. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 30.06.2007
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
