Патент на изобретение №2193034
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АМИНОТИАЗОЛКАРБОКСАМИДА
(57) Реферат: Изобретение относится к способу получения производных 2-аминотиазолкарбоксамида формулы I, в которой R1 представляет C1-5 алкил с прямой или разветвленной цепью, R2 представляет С1-3 алкил, путем взаимодействия соединения формулы II, в которой R3 представляет фенил, который может быть необязательно моно-пентазамещенным независимо хлором, метокси, этокси, фенокси или нитро, с соединением формулы III, в которой Y представляет уходящую группу, в растворителе и в присутствии основания. Соединение формулы II, в которой R1 представляет C1-5 алкил с прямой или разветвленной цепью, R2 представляет C1-3 алкил, R3 представляет фенил, который может быть необязательно моно-пента-замещенным независимо хлором, метокси, этокси, фенокси или нитро, и соединение формулы III, в которой Y представляет хлор или бром. Технический результат – усовершенствование способа получения 2-аминотиазолкарбоксамида. 3 c. и 7 з.п. ф-лы, 1 табл.   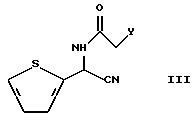
Настоящее изобретение относится к способу получения производного 2-аминотиазолкарбоксамида, представленного следующей формулой (I):  в которой R1 представляет C1-5 алкил с прямой или разветвленной цепью, C1-5 галогеналкил или С3-6 циклоалкил, и R2 представляет С1-3 алкил или C1-3 галогеналкил. Соединения формулы (I) используются в качестве микробицидов при лечении болезней растений, вызываемых Pythiaceae или Peronosporaceae. Соединения формулы (I) уже были описаны в корейской выложенной заявке 94-19960 и в соответствующих иностранных заявках, например патентной заявке США 08/287917, патентной заявке Японии 192529 и патентной заявке ЕР 94112652.6, которые были поданы заявителем настоящей заявки. Кроме того, способ получения производных 2-аминотиазолкарбоксамида, включая соединения формулы (I), использующий 2-аминотиазолкарбоновую кислоту в качестве промежуточного соединения, описан в выложенной корейской заявке 97-24120. Однако недостатком этого способа является то, что он оказывается неэкономичным при промышленном производстве из-за многостадийности получения промежуточного соединения и низкого выхода. Соответственно, заявители провели исследования по усовершенствованию ранее известного способа путем решения вышеупомянутых проблем, и в результате пришли к настоящему изобретению. Настоящее изобретение относится к способу получения производного 2-аминотиазолкарбоксамида, представленного вышеприведенной формулой (I), отличающемуся тем, что соединение иминотиомочевины, представленное следующей формулой (II):  в которой R1 и R2 имеют значения, определенные выше, и R3 представляет фенил, который может быть необязательно моно- – пентазамещенным независимо хлором, метокси, этокси, фенокси или нитро, подвергают реакции с соединением тиофенацетамида, представленным следующей формулой (III):  в которой Y представляет уходящую группу, такую как хлорид, бромид и т. п. Соединение формулы (I) может быть получено путем реакции соединения формулы (II) с соединением формулы (III) в растворителе и в присутствии основания, как описывается схемой реакции I (см. в конце описания). Примеры основания, используемого в вышеописанной реакции, включают органическое основание, такое как триэтиламин, трибутиламин, диизопропилэтиламин, N,N-диметиланилин, пиридин, 4-диметиламинопиридин и т.п., и неорганическое основание, такое как гидроокись натрия, гидроокись калия, карбонат калия, бикарбонат натрия, бикарбонат калия, гидрид натрия, гидрид калия и т. п. Органическое основание является предпочтительным, и более предпочтительным является алкиламин, такой как триэтиламин, трибутиламин, диизопропилэтиламин и т.п. Основание может использоваться в количестве от 1 до 5 эквивалентов, предпочтительно в количестве от 1 до 2 эквивалентов. Вышеописанная реакция может осуществляться при температуре между 20oС и 120oС, предпочтительно между 40oС и 80oС, и требуемое время реакции составляет примерно от 8 до 12 часов. Растворитель включает спирт, такой как метанол, этанол, изопропиловый спирт и т.д.; ароматический углеводород, такой как бензол, толуол, ксилол и т. д. ; простой эфир, такой как диэтиловый эфир, диоксан, 1,2-диметоксиэтан, тетрагидрофуран и т.д.; кетон, такой как ацетон, метилэтилкетон, циклогексанон и т.п.; нитрил, такой как ацетонитрил, пропионитрил и т.д.; галогенированный углеводород, такой как дихлорметан, 1,2-дихлорэтан, хлороформ и т. д.; сложный эфир, такой как метилацетат, этилацетат и т.д.; и полярный растворитель, такой как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.д.; и спирт является предпочтительным. Соединение формулы (II), используемое как исходное вещество в схеме реакции I, является новым и может быть получено в соответствии со схемой реакции II (см. в конце описания). Иначе говоря, соединение формулы (II) может быть получено по способу, отличающемуся тем, что: на стадии 1 амидное соединение, представленное следующей формулой (IV):  в которой R2 и R3 имеют значения, определенные выше, подвергается реакции с галогенирующим агентом в растворителе в присутствии основания с получением имидоилхлоридного соединения, представленного следующей формулой (V):  в которой R2 и R3 имеют значения, определенные выше; на стадии 2 полученное имидоилхлоридное соединение формулы (V) подвергают реакции с тиоцианатным соединением, представленным следующей формулой (VII): MSCN (VII), в которой М представляет щелочной металл, такой как натрий, калий, и т. д., или NH4, по которой хлоридная группа заменяется изотиоцианидной группой с получением имидоилизотиоцианатного соединения, представленного формулой (VI):  где R2 и R3 определены, как описано выше; на стадии 3 полученное имидоилизотиоцианатное соединение формулы (VI) подвергают реакции с первичным аминовым соединением, представленным следующей формулой (VIII): R1-NН2 (VIII), где R1 определен, как описано выше, в присутствии основания. На стадии 1 для получения имидоилхлоридного соединения формулы (V) в качестве галогенирующего агента могут быть использованы тионилхлорид (SОСl2), фосген (COCl2), оксихлорид фосфора (РОС13) и т.п. Галогенирующий агент подходящим образом используется в количестве от 1 до 4 эквивалентов. Эту реакцию проводят при температуре между -20oС и 80oС, предпочтительно между -10oС и 20oС. Время реакции составляет обычно от 2 до 5 часов. В качестве основания может быть использовано органическое основание, такое как пиридин, 4-диметиламинопиридин, триэтиламин, N,N-диметиланилин, трибутиламин и т. п. Предпочтительными являются слабые основания, такие как пиридин. Основание подходящим образом используется в количестве от 1 до 4 эквивалентов. В качестве растворителя может быть использован ароматический углеводород, такой как бензол, толуол, ксилол и т.п.; галогенированный углеводород, такой как дихлорметан, 1,2-дихлорэтан, хлороформ, и т.п.; простой эфир, такой как диэтиловый эфир, диоксан, 1,2-диметоксиэтан, тетрагидрофуран, и т.п. ; кетон, такой как ацетон, метилэтилкетон, циклогексанон и т.п.; нитрил, такой как ацетонитрил, пропионитрил и т.п.; сложный эфир, такой как метилацетат, этилацетат и т.п.; или полярный растворитель, такой как N,N-диметилформамид, N, N-диметилацетамид, диметилсульфоксид и т.п.; и, предпочтительно, галогенированный углеводород, такой как дихлорэтан, хлороформ и т.п. Кроме того, N,N-диметилформамид может быть использован в качестве катализатора. На стадии 2 имидоилизотиоцианатное соединение формулы (VI) получают путем реакции имидоилхлоридного соединения формулы (V), полученного на стадии 1, с тиоцианатным соединением формулы (VII). Тиоцианатное соединение формулы (VII) предпочтительно используют в количестве от 1 до 2 эквивалентов. Температура реакции может быть между -20oС и 50oС, предпочтительно между 0oС и 20oС, и время реакции предпочтительно варьирует обычно от 2 до 5 часов. На стадии 3 иминотиомочевиновое соединение формулы (II) получают из имидоилизотиоцианатного соединения формулы (VI). На данной стадии атом углерода изотиоцианата атакуется аминовым соединением формулы (VIII) в присутствии основания, благодаря чему получается тиомочевиновое соединение формулы (II). Аминовое соединение формулы (VIII) может использоваться в количестве от 1 до 4 эквивалентов, предпочтительно от 2 до 3 эквивалентов. Данная реакция может проводиться при температуре между -20oС и 80oС, предпочтительно между 0oС и 30oС. Время реакции составляет, как правило, от 2 до 4 часов. Вышеописанные способы по настоящему изобретению будут более подробно объяснены нижеследующими примерами. В качестве типичных примеров соединений формулы (II) по настоящему изобретению могут быть упомянуты соединения, которые описаны в таблице (см. в конце описания). Соединение формулы (III), используемое в качестве исходного вещества в схеме реакций (I), также является новым и может быть получено в соответствии со схемой реакций III (см. в конце описания). Иными словами, соединение формулы (III) может быть получено по способу, отличающемуся тем, что на стадии 1 альдегидное соединение, представленное следующей формулой (IX):  превращают в аминонитрильное соединение, представленное следующей формулой (X):  по известному синтезу Стрекера; на стадии 2 полученное аминонитрильное соединение формулы (X) вводят в реакцию с соединением, представленным следующей формулой (XI):  где Y определен, как описано выше, в присутствии основания. На стадии 1 вышеописанной реакции альдегидное соединение формулы (IX) может быть легко превращено в аминонитрильное соединение формулы (X) путем известного синтеза Стрекера, как указано выше. На стадии 2 тиофенацетамидное соединение формулы (III) может быть получено путем реакции аминонитрильного соединения формулы (X) с 1-3 эквивалентами, предпочтительно с 1-1,5 эквивалентами хлорацетилхлорида или бромацетилбромида формулы (XI) в присутствии основания. Данная реакция может осуществляться при температуре между -20oС и 80oС, предпочтительно между 0oС и 20oС. Время реакции подходящим образом составляет от 30 минут до 2 часов. В качестве основания может использоваться органическое основание, такое как пиридин, 4-диметиламинопиридин, триэтиламин, N,N-диметиланилин, трибутиламин, диизопропилэтиламин и т.п., предпочтительно пиридин или 4-диметиламинопиридин. Основание может предпочтительно использоваться в количестве от 1 до 3 эквивалентов. В качестве растворителя может использоваться галогенированный углеводород, такой как дихлорметан, 1,2-дихлорэтан, хлороформ и т.п.; ароматический углеводород, такой как бензол, толуол, ксилол и т.п.; простой эфир, такой как диэтиловый эфир, диоксан, 1,2-диметоксиэтан, тетрагидрофуран и т.п.; кетон, такой как ацетон, метилэтилкетон, циклогексанон и т.п.; нитрил, такой как ацетонитрил, пропионитрил и т.п.; сложный эфир, такой как метилацетат, этилацетат и т.п.; или полярный растворитель, такой как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид и т.п.; и, предпочтительно, галогенированный углеводород или ароматический углеводород. Настоящее изобретение более подробно объясняется с помощью нижеследующих препаративных примеров и примеров. Однако должно быть ясно, что настоящее изобретение никоим образом не ограничивается этими примерами. Препаративный пример 1: Синтез N-фенилпропионамида В реакционный сосуд помещают анилин (279,4 г, 3,0 моль) и дихлорметан (2400 г), реакционный сосуд охлаждают до 0oС и медленно добавляют в него по каплям гидроокись натрия (132,0 г, 3,3 моль), растворенную в воде (660 г). После подтверждения того, что температура сосуда составляет 0oС, в него по каплям в течение 2 часов добавляют пропионилхлорид (291,5 г, 3,2 моль). Затем смесь перемешивают при комнатной температуре (20oС) в течение 2 часов и реакция заканчивается. После завершения реакции слои разделяют и дихлорметан удаляют отгонкой под пониженным давлением, получая коричневое твердое вещество. Твердое вещество перекристаллизовывают из толуола, получая указанное в заголовке соединение (434,7 г, 2,9 моль) с выходом 97%. 1H ЯМР (СDСl3):  7,75 (1Н, с, шир.), 7,52 (2Н,д), 7,29 (2Н, д), 7,08 (1Н, т), 2,37 (2Н, кв.), 1,22 (3Н, т).
Пример 1: Синтез N-этил-N’-(1-фенилиминопропил)мочевины 7,75 (1Н, с, шир.), 7,52 (2Н,д), 7,29 (2Н, д), 7,08 (1Н, т), 2,37 (2Н, кв.), 1,22 (3Н, т).
Пример 1: Синтез N-этил-N’-(1-фенилиминопропил)мочевиныN-фенилпропионамид (149,2 г, 1,0 моль) и пиридин (261,0 г, 3,3 моль) растворяют в дихлорметане (300 г) и смесь охлаждают до 0oС. К ней по каплям в течение двух часов добавляют оксихлорид фосфора (168,7 г, 1,1 моль) и затем смесь перемешивают при комнатной температуре (20oС) в течение 2 часов для получения N-фенилпропионимидохлорида. Впоследствии реагент в течение 2 часов медленно добавляют по каплям в реакционный сосуд, содержащий смесь тиоцианата калия (145,8 г, 1,5 моль) и карбоната калия (318,0 г, 3,0 моль) в ацетоне (1000 мл) при температуре 10oС или ниже и затем смесь перемешивают в течение 1 часа с получением изотиоцианата N-фенилпропионимидоила. В реакционный сосуд в течение 2 часов по каплям добавляют этиламин (128,8 г, 2,0 моль), поддерживая температуру 10oС или ниже, и затем смесь перемешивают в течение 1 часа. После завершения реакции растворитель удаляют отгонкой при пониженном давлении. Продукт экстрагируют толуолом и промывают раствором гидроокиси натрия. Затем толуол удаляют отгонкой под пониженным давлением и остаток перекристаллизовывают из изопропилового спирта, получая указанное в заголовке соединение (157,2 г, 0,7 моль) с выходом 67%. 1H ЯМР (СDСl3):  11,84 (1Н, с, шир.), 8,18 (1Н, с, шир.), 7,32 (2Н, м), 7,12 (1Н, т), 6,79 (2Н, д), 3,69 (2Н, м), 2,23 (2Н, кв.), 1,26 (3Н, т), 1,15 (3Н, т).
Пример 2: Синтез N-(1-(2,4-дихлорфенил)иминопропил)) -N’ -этилтиомочевины 11,84 (1Н, с, шир.), 8,18 (1Н, с, шир.), 7,32 (2Н, м), 7,12 (1Н, т), 6,79 (2Н, д), 3,69 (2Н, м), 2,23 (2Н, кв.), 1,26 (3Н, т), 1,15 (3Н, т).
Пример 2: Синтез N-(1-(2,4-дихлорфенил)иминопропил)) -N’ -этилтиомочевиныN-(2,4-дихлорбензол)пропионамид (21,8 г, 0,1 моль) и пиридин (27,7 г, 0,35 моль) растворяют в дихлорметане (30 г) и смесь охлаждают до 0oС. К ней по каплям в течение двух часов добавляют оксихлорид фосфора (16,9 г, 0,11 моль) и затем смесь перемешивают при комнатной температуре (20oС) в течение 2 часов с получением N-(2,4-дихлорбензол) пропионимидоилхлорида. После этого реагент в течение 2 часов медленно добавляют по каплям в реакционный сосуд, содержащий смесь тиоцианата калия (14,6 г, 0,15 моль) и карбоната калия (31,8 г, 0,3 моль) в ацетоне (100 мл) при температуре 10oС или ниже и затем смесь перемешивают в течение 1 часа с получением изотиоцианата N-(2,6-дихлорбензол)пропионимидохлорида. В реакционный сосуд в течение 2 часов по каплям добавляют этиламин (12,9 г, 0,2 моль), при поддержании температуры 10oС или ниже, и затем смесь перемешивают в течение 1 часа. После завершения реакции по такой же методике, как в примере 1, получают указанное в заголовке соединение (21,9 г, 72 ммоль) с выходом 72%. 1H ЯМР (СDСl3):  11,69 (1Н, с, шир.), 8,65 (1Н, с, шир.), 7,43 (1Н, д), 7,21 (1Н, м), 6,78 (1Н, д), 3,70 (2Н, м), 2,23 (2Н, кв.), 1,27 (3Н, т), 1,14 (3Н, т).
Пример 3: Синтез N-изопропил-N’- (1-фенилиминопропил) тиомочевины 11,69 (1Н, с, шир.), 8,65 (1Н, с, шир.), 7,43 (1Н, д), 7,21 (1Н, м), 6,78 (1Н, д), 3,70 (2Н, м), 2,23 (2Н, кв.), 1,27 (3Н, т), 1,14 (3Н, т).
Пример 3: Синтез N-изопропил-N’- (1-фенилиминопропил) тиомочевиныN-фенилпропионамид (7,46 г, 0,05 моль) и пиридин (13,8 г, 0,18 моль) растворяют в дихлорметане (300 г) и смесь охлаждают до 0oС. К ней по каплям в течение двух часов добавляют оксихлорид фосфора (8,43 г, 0,05 моль) и затем смесь перемешивают при комнатной температуре (20oС) в течение 2 часов с получением N-фенилпропионимидохлорида. Впоследствии реагент в течение 2 часов медленно добавляют по каплям в реакционный сосуд, содержащий смесь тиоцианата калия (7,3 г, 0,08 моль) и карбоната калия (15,9 г, 0,15 моль) в ацетоне (50 мл) при температуре 10oС или ниже и затем смесь перемешивают в течение 1 часа с получением изотиоцианата N-фенилпропионимидоилхлорида. В реакционный сосуд в течение 2 часов по каплям добавляют изопропиламин (5,9 г, 0,1 моль), при поддержании температуры 10oС или ниже, и затем смесь перемешивают в течение 1 часа. После завершения реакции по такой же методике, как в примере 1, получают указанное в заголовке соединение (8,1 г, 0,03 моль) с выходом 65%. 1H ЯМР (СDСl3):  11,80 (1Н, с, шир.), 7,92 (1Н, с, шир.), 7,35 (2Н, м), 7,13 (1Н, т), 6,79 (2Н, д), 4,50 (1Н, м), 2,25 (2Н, кв.), 1,28 (3Н, с), 1,22 (3Н, с), 1,17 (3Н, т).
Пример 4: Синтез 2-хлор-N-( 11,80 (1Н, с, шир.), 7,92 (1Н, с, шир.), 7,35 (2Н, м), 7,13 (1Н, т), 6,79 (2Н, д), 4,50 (1Н, м), 2,25 (2Н, кв.), 1,28 (3Н, с), 1,22 (3Н, с), 1,17 (3Н, т).
Пример 4: Синтез 2-хлор-N-( -циано-2-тенил) ацетамида -циано-2-тенил) ацетамидаГидрохлорид аминотиофен-2-ил-ацетонитрила (17,5 г, 0,1 моль) растворяют в дихлорметане (100 мл) и затем добавляют к нему пиридин (16,6 г, 0,21 моль). Смесь охлаждают до 10oС и затем в течение 1 часа добавляют к ней по каплям хлорацетилхлорид (12,4 г, 0,11 моль). После завершения реакции смесь трижды промывают водой (по 60 мл на каждую промывку), растворитель удаляют отгонкой под пониженным давлением и остаток перекристаллизовывают из толуола, получая указанное в заголовке соединение (19,8 г, 0,09 моль) с выходом 92%. 1H ЯМР (СDСl3):  7,42 (1Н, д), 7,32 (1Н, д), 7,23 (1Н, с, шир.), 7,05 (1Н, т), 6,28 (1Н, д), 4,15 (2Н, с.).
Пример 5: Синтез 2-6ром-N-( 7,42 (1Н, д), 7,32 (1Н, д), 7,23 (1Н, с, шир.), 7,05 (1Н, т), 6,28 (1Н, д), 4,15 (2Н, с.).
Пример 5: Синтез 2-6ром-N-( -циано-2-тенил)ацетамида -циано-2-тенил)ацетамидаГидрохлорид аминотиофен-2-ил-ацетонитрила (8,8 г, 0,05 моль) растворяют в дихлорметане (50 мл) и затем добавляют к нему пиридин (8,7 г, 0,11 моль). Смесь охлаждают до 0oС и затем в течение 1 часа добавляют к ней по каплям бромацетилбромид (10,1 г, 0,05 моль). После завершения реакции по такой же методике, как в примере 4, получают указанное в заголовке соединение (11,4 г, 0,04 моль) с выходом 88%. 1H ЯМР (СDСl3):  7,41 (1Н, м), 7,32 (1Н, м), 7,11 (1Н, д, шир.), 7,05 (1Н, м), 6,25 (1Н, д), 3,94 (2Н, с.).
Пример 6: Синтез N-( 7,41 (1Н, м), 7,32 (1Н, м), 7,11 (1Н, д, шир.), 7,05 (1Н, м), 6,25 (1Н, д), 3,94 (2Н, с.).
Пример 6: Синтез N-( -циано-2-тенил)-4-этил-2- (этиламино) -5-тиазолкарбоксамида -циано-2-тенил)-4-этил-2- (этиламино) -5-тиазолкарбоксамидаСпособ 1 N-этил-N’-(1-фенилиминопропил) тиомочевину (23,5 г, 0,1 моль) и 2-хлор-N-(  -циано-2-тенил)ацетамид (21,4 г, 0,1 моль) растворяют в метаноле (200 мл). Затем в смесь вводят триэтиламин (15,2 г, 0,15 моль) и смесь кипятят с обратным холодильником в течение 8 часов.
После завершения реакции смесь охлаждают и фильтруют. Остаток промывают холодным метанолом и сушат, получая указанное в заголовке соединение (24,0 г, 0,08 моль) с выходом 75%.
Способ 2 -циано-2-тенил)ацетамид (21,4 г, 0,1 моль) растворяют в метаноле (200 мл). Затем в смесь вводят триэтиламин (15,2 г, 0,15 моль) и смесь кипятят с обратным холодильником в течение 8 часов.
После завершения реакции смесь охлаждают и фильтруют. Остаток промывают холодным метанолом и сушат, получая указанное в заголовке соединение (24,0 г, 0,08 моль) с выходом 75%.
Способ 2N-(1-(2,6-дихлорфенил) иминопропил)-N’- этилтиомочевину (31 г, 0,1 моль) и 2-xnop-N-(  -циано-2-тенил)ацетамид (21,4 г, 0,1 моль) растворяют в метаноле (200 мл). Затем в смесь вводят триэтиламин (15,2 г, 0,15 моль) и смесь кипятят с обратным холодильником в течение 8 часов.
После завершения реакции смесь охлаждают с использованием холодного метанола и сушат с получением указанного в заголовке соединения (24,0 г, 0,08 моль) с выходом 75%.
1H ЯМР (СDСl3): -циано-2-тенил)ацетамид (21,4 г, 0,1 моль) растворяют в метаноле (200 мл). Затем в смесь вводят триэтиламин (15,2 г, 0,15 моль) и смесь кипятят с обратным холодильником в течение 8 часов.
После завершения реакции смесь охлаждают с использованием холодного метанола и сушат с получением указанного в заголовке соединения (24,0 г, 0,08 моль) с выходом 75%.
1H ЯМР (СDСl3):  7,38 (1Н, д), 7,33 (1Н, д), 7,04 (1Н, т), 6,43 (1Н, д), 5,94 (1Н, д, шир.), 5,59 (1Н, с, шир.), 3,26 (2Н, кв.), 2,93 (2Н, кв.), 1,26 (6Н, м).
Пример 7: Синтез N-( 7,38 (1Н, д), 7,33 (1Н, д), 7,04 (1Н, т), 6,43 (1Н, д), 5,94 (1Н, д, шир.), 5,59 (1Н, с, шир.), 3,26 (2Н, кв.), 2,93 (2Н, кв.), 1,26 (6Н, м).
Пример 7: Синтез N-( -циано-2-тенил)-2-(этиламино)-4-метил -5-тиазолкарбоксамида -циано-2-тенил)-2-(этиламино)-4-метил -5-тиазолкарбоксамидаN-этил-N’-(1-фенилиминоэтил) тиомочевину (22,1 г, 0,1 моль) и 2-хлор-N-(  -циано-2-тенил) ацетамид (21,4 г, 0,1 моль) растворяют в этаноле (200 мл). Затем в смесь вводят диизопропилэтиламин (15,5 г, 0,12 моль) и смесь перемешивают при температуре 60oС в течение 10 часов.
После завершения реакции растворитель удаляют отгонкой при пониженном давлении, получая коричневое твердое вещество. Твердое вещество перекристаллизовывают из смеси толуола и воды (объемное соотношение 10/1) с получением указанного в заголовке соединения (22,1 г, 0,07 моль) с выходом 72%.
1H ЯМР (СDСl3): -циано-2-тенил) ацетамид (21,4 г, 0,1 моль) растворяют в этаноле (200 мл). Затем в смесь вводят диизопропилэтиламин (15,5 г, 0,12 моль) и смесь перемешивают при температуре 60oС в течение 10 часов.
После завершения реакции растворитель удаляют отгонкой при пониженном давлении, получая коричневое твердое вещество. Твердое вещество перекристаллизовывают из смеси толуола и воды (объемное соотношение 10/1) с получением указанного в заголовке соединения (22,1 г, 0,07 моль) с выходом 72%.
1H ЯМР (СDСl3):  7,36 (1Н, д), 7,30 (1Н, д), 7,04 (1Н, т), 6,10 (1Н, д), 5,99 (1Н, с, шир.), 3,28 (2Н, кв.), 2,53 (2Н, с), 1,30 (3Н, т).
Пример 8: Синтез N-( 7,36 (1Н, д), 7,30 (1Н, д), 7,04 (1Н, т), 6,10 (1Н, д), 5,99 (1Н, с, шир.), 3,28 (2Н, кв.), 2,53 (2Н, с), 1,30 (3Н, т).
Пример 8: Синтез N-( -циано-2-тенил)-4-этил-2-(изопропиламино) -5-тиазолкарбоксамида -циано-2-тенил)-4-этил-2-(изопропиламино) -5-тиазолкарбоксамидаN-изопропил-N’-(1-фенилиминопропил)тиомочевину (2,5 г, 0,01, моль) и 2-бpом-N-(  -циано-2-тенил)ацетамид (2,6 г, 0,01 моль) растворяют в метаноле (20 мл). Затем в смесь вводят триэтиламин (1,5 г, 0,02 моль) и смесь перемешивают при температуре 60oС в течение 7 часов.
После завершения реакции растворитель удаляют отгонкой под пониженным давлением, получая коричневое твердое вещество. Твердое вещество перекристаллизовывают из смешанного растворителя этанол-вода (объемное соотношение 1/1), получая указанное в заголовке соединение (2,0 г, 0,01 моль) с выходом 60%.
1H ЯМР (СDСl3): -циано-2-тенил)ацетамид (2,6 г, 0,01 моль) растворяют в метаноле (20 мл). Затем в смесь вводят триэтиламин (1,5 г, 0,02 моль) и смесь перемешивают при температуре 60oС в течение 7 часов.
После завершения реакции растворитель удаляют отгонкой под пониженным давлением, получая коричневое твердое вещество. Твердое вещество перекристаллизовывают из смешанного растворителя этанол-вода (объемное соотношение 1/1), получая указанное в заголовке соединение (2,0 г, 0,01 моль) с выходом 60%.
1H ЯМР (СDСl3):  7,38 (1Н, д), 7,30 (1Н, д), 7,01 (1Н, т), 6,44 (1Н, д), 6,00 (1Н, д), 5,49 (1Н, с, шир.), 3,61 (1Н, м), 2,91 (2Н, кв.), 1,27 (9Н, м).
Пример 9: Синтез N-этил-N’-(1-(4-феноксифенил)иминопропил)-тиомочевины 7,38 (1Н, д), 7,30 (1Н, д), 7,01 (1Н, т), 6,44 (1Н, д), 6,00 (1Н, д), 5,49 (1Н, с, шир.), 3,61 (1Н, м), 2,91 (2Н, кв.), 1,27 (9Н, м).
Пример 9: Синтез N-этил-N’-(1-(4-феноксифенил)иминопропил)-тиомочевиныN-(4-феноксибензол)пропионамид (120,6 г, 0,5 моль) и пиридин (130,6 г, 1,65 моль) растворяют в дихлорметане (200 г), и смесь охлаждают до 0oС. К смеси по каплям в течение двух часов добавляют оксихлорид фосфора (84,3 г, 0,55 моль), и затем смесь перемешивают при комнатной температуре (20oС) в течение 2 часов с получением N-(4-феноксибензол) пропионимидоилхлорида. Впоследствии реагент медленно добавляют по каплям в реакционный сосуд, содержащий смесь тиоцианата калия (72,9 г, 0,75 моль) и карбоната калия (159,0 г, 1,5 моль) в ацетоне (500 мл), при температуре 10oС или ниже в течение 2 часов и затем смесь перемешивают в течение 1 часа с получением изотиоцианата N-(4-феноксибензол)пропионимидоила. В реакционный сосуд по каплям добавляют этиламин (64,4 г, 1,0 моль), при поддержании температуры 10oС или менее в течение 2 часов, и затем смесь перемешивают в течение 1 часа. После завершения реакции растворитель удаляют отгонкой при пониженном давлении. Продукт экстрагируют толуолом и промывают раствором гидроокиси натрия. Затем толуол удаляют перегонкой при пониженном давлении и остаток перекристаллизовывают из изопропилового спирта с получением указанного в заголовке соединения (98,2 г, 0,3 моль) с выходом 60%. 1H ЯМР (СDСl3):  11,97 (1Н, с.), 8,90 (1H, с), 7,33 (3Н, м), 7,01 (4Н, м), 6,75 (2Н, м), 3,68 (2Н, кв.), 1,25 (3Н, т.), 1,16 (3Н, т).
Пример 10: Синтез N-этил-N’-(1-(4-метоксифекил)иминопропил)-тиомочевины 11,97 (1Н, с.), 8,90 (1H, с), 7,33 (3Н, м), 7,01 (4Н, м), 6,75 (2Н, м), 3,68 (2Н, кв.), 1,25 (3Н, т.), 1,16 (3Н, т).
Пример 10: Синтез N-этил-N’-(1-(4-метоксифекил)иминопропил)-тиомочевиныN-(4-метоксибензол)пропионамид (89,6 г, 0,5 моль) и пиридин (130,6 г, 1,65 моль) растворяют в дихлорметане (200 г), и смесь охлаждают до 0oС. К смеси по каплям в течение двух часов добавляют оксихлорид фосфора (84,3 г, 0,55 моль), и затем смесь перемешивают при комнатной температуре (20oС) в течение 2 часов с получением N-(4-метоксибензол) пропионимидоилхлорида. Впоследствии реагент медленно добавляют по каплям в реакционный сосуд, содержащий смесь тиоцианата калия (72,9 г, 0,75 моль) и карбоната калия (159,0 г, 1,5 моль) в ацетоне (500 мл), при температуре 10oС или менее в течение 2 часов, и смесь перемешивают в течение 1 часа с получением N-(4-метоксибензол)пропионимидоилизотиоцианата. В реакционный сосуд по каплям добавляют этиламин (64,4 г, 1,0 моль) при поддержании температуры 10oС или менее в течение 2 часов, и затем смесь перемешивают в течение 1 часа. После завершения реакции растворитель удаляют перегонкой при пониженном давлении. Продукт экстрагируют толуолом и промывают раствором гидроокиси натрия. Затем толуол удаляют перегонкой при пониженном давлении, и остаток перекристаллизовывают из изопропилового спирта с получением указанного в заголовке соединения (84,9 г, 0,32 моль) с выходом 64%. 1H ЯМР (СDСl3):  11,90 (1Н, с.), 8,12 (1H, с.), 6,87 (2Н, д.), 3,80 (3Н, с.), 3,69 (2Н, кв.), 2,24 (2Н, кв.), 1,26 (3Н, т.), 1,14 (3Н, т).
Пример 11: Синтез N-этил-N’-(1- (4-нитрофенил) иминопропил) -тиомочевины 11,90 (1Н, с.), 8,12 (1H, с.), 6,87 (2Н, д.), 3,80 (3Н, с.), 3,69 (2Н, кв.), 2,24 (2Н, кв.), 1,26 (3Н, т.), 1,14 (3Н, т).
Пример 11: Синтез N-этил-N’-(1- (4-нитрофенил) иминопропил) -тиомочевиныN-(4-ниробензол)пропионамид (19,4 г, 0,1 моль) и пиридин (26,1 г, 0,33 моль) растворяют в дихлорметане (30 г), и смесь охлаждают до 0oС. К смеси по каплям в течение двух часов добавляют оксихлорид фосфора (16,9 г, 0,11 моль), и затем смесь перемешивают при комнатной температуре (20oС) в течение 2 часов с получением N-(4-нитробензол)пропионимидоилхлорида. Впоследствии реагент медленно добавляют по каплям в реакционный сосуд, содержащий смесь тиоцианата калия (14,6 г, 0,15 моль) и карбоната калия (31,8 г, 0,3 моль) в ацетоне (100 мл), при температуре 10oС или менее в течение 2 часов, и смесь перемешивают в течение 1 часа с получением N-(4-нитробензол)пропионимидоилизотиоцианата. В реакционный сосуд по каплям добавляют этиламин (12,9 г, 0,2 моль), при поддержании температуры 10oС или менее в течение 2 часов, и затем смесь перемешивают в течение 1 часа. После завершения реакции растворитель удаляют перегонкой при пониженном давлении. Продукт экстрагируют толуолом и промывают раствором гидроокиси натрия. Затем толуол удаляют перегонкой при пониженном давлении, и остаток перекристаллизовывают из изопропилового спирта с получением указанного в заголовке соединения (17,4г, 0,062 моль) с выходом 62%. 1H ЯМР (СDСl3):  11,20 (1Н, с.), 8,23 (2Н, д.), 7,88 (1Н, с.), 6,92 (2Н, д.), 3,71 (2Н, кв.), 2,22 (2Н, кв.), 1,28 (3Н, т.), 1,17 (3Н, т).
Пример 12: Синтез N-( 11,20 (1Н, с.), 8,23 (2Н, д.), 7,88 (1Н, с.), 6,92 (2Н, д.), 3,71 (2Н, кв.), 2,22 (2Н, кв.), 1,28 (3Н, т.), 1,17 (3Н, т).
Пример 12: Синтез N-( -циано-2-этил)-4-этил-2-(этиламино)-5-тиазолкарбоксамида -циано-2-этил)-4-этил-2-(этиламино)-5-тиазолкарбоксамидаСпособ А) Получение целевого соединения с использованием исходного материала с фенокси группой N-этил-N’-(1-(4-феноксифенил)иминопропил)тиомочевину (32,7 г, 0,1 моль) и 2-хлор-N-(  -циано-2-тенил)ацетамид (21,4 г, 0,1 моль) растворяют в метаноле (200 мл). Затем в смесь вводят триэтиламин (15.2 г, 0.15 моль), и смесь нагревают с обратным холодильником в течение 8 часов. После завершения реакции смесь охлаждают и фильтруют. Остаток промывают холодным метанолом и сушат с получением указанного в заголовке соединения (22,5 г, 0.07 моль) с выходом 70,2%.
Способ В) -циано-2-тенил)ацетамид (21,4 г, 0,1 моль) растворяют в метаноле (200 мл). Затем в смесь вводят триэтиламин (15.2 г, 0.15 моль), и смесь нагревают с обратным холодильником в течение 8 часов. После завершения реакции смесь охлаждают и фильтруют. Остаток промывают холодным метанолом и сушат с получением указанного в заголовке соединения (22,5 г, 0.07 моль) с выходом 70,2%.
Способ В)Получение целевого соединения с использованием исходного материала с метокси группой N-этил-N’-(1-(4-метоксифенил)иминопропил)тиомочевину (26,5 г, 0,1 моль) и 2-хлор-N-(  -циано-2-тенил)ацетамид (21,4 г, 0,1 моль) растворяют в метаноле (200 мл). Затем в смесь вводят триэтиламин (15.2 г, 0.15 моль), и смесь нагревают с обратным холодильником в течение 8 часов. После завершения реакции смесь охлаждают и фильтруют. Остаток промывают холодным метанолом и сушат с получением указанного в заголовке соединения (20,0 г, 0,06 моль) с выходом 62,4%.
Способ С) -циано-2-тенил)ацетамид (21,4 г, 0,1 моль) растворяют в метаноле (200 мл). Затем в смесь вводят триэтиламин (15.2 г, 0.15 моль), и смесь нагревают с обратным холодильником в течение 8 часов. После завершения реакции смесь охлаждают и фильтруют. Остаток промывают холодным метанолом и сушат с получением указанного в заголовке соединения (20,0 г, 0,06 моль) с выходом 62,4%.
Способ С)Получение целевого соединения с использованием исходного материала с нитро группой N-этил-N-(1-(4-нитрофенил)иминопропил)тиомочевину (28,0 г, 0,1 моль) и 2-хлор-N-(  -циано-2-тенил)ацетамид (21,4 г, 0,1 моль) растворяют в метаноле (200 мл). Затем в смесь вводят триэтиламин (15.2 г, 0.15 моль), и смесь нагревают с обратным холодильником в течение 8 часов. После завершения реакции смесь охлаждают и фильтруют. Остаток промывают холодным метанолом и сушат с получением указанного в заголовке соединения (21,5 г, 0.067 моль) с выходом 67,1%. Данные ЯМР целевого соединения -циано-2-тенил)ацетамид (21,4 г, 0,1 моль) растворяют в метаноле (200 мл). Затем в смесь вводят триэтиламин (15.2 г, 0.15 моль), и смесь нагревают с обратным холодильником в течение 8 часов. После завершения реакции смесь охлаждают и фильтруют. Остаток промывают холодным метанолом и сушат с получением указанного в заголовке соединения (21,5 г, 0.067 моль) с выходом 67,1%. Данные ЯМР целевого соединения1H ЯМР (СDСl3):  7,38 (1Н, д.), 7,33 (1H, д.), 7,04 (1Н, т.), 6,43 (1H, д. ), 5,94 (1H, д. шир.), 5,59 (1H, с., шир.), 3,26 (2Н, кв.), 2,93 (2Н, кв. ), 1,26 (6Н, м.).
Как описано выше, производные 2-аминотиазолкарбоксамида формулы (I) могут быть получены с высоким выходом при использовании промежуточных соединений формул (II) и (III) по способу настоящего изобретения. С промышленной точки зрения настоящий способ более экономичен, чем известный, благодаря высоким выходам. 7,38 (1Н, д.), 7,33 (1H, д.), 7,04 (1Н, т.), 6,43 (1H, д. ), 5,94 (1H, д. шир.), 5,59 (1H, с., шир.), 3,26 (2Н, кв.), 2,93 (2Н, кв. ), 1,26 (6Н, м.).
Как описано выше, производные 2-аминотиазолкарбоксамида формулы (I) могут быть получены с высоким выходом при использовании промежуточных соединений формул (II) и (III) по способу настоящего изобретения. С промышленной точки зрения настоящий способ более экономичен, чем известный, благодаря высоким выходам.
Формула изобретения
 в которой R1 представляет C1-5 алкил с прямой или разветвленной цепью; R2 представляет C1-3 алкил; отличающийся тем, что соединение, представленное следующей формулой II:  в которой R1 и R2 имеют значения, определенные выше, и R3 представляет фенил, который может быть необязательно моно-пента-замещенным независимо хлором, метокси, этокси, фенокси или нитро, подвергают реакции с соединением, представленным следующей формулой III:  в которой Y представляет уходящую группу, в растворителе и в присутствии основания. 2. Способ по п. 1, в котором Y представляет хлор или бром. 3. Способ по п. 1, в котором растворитель представляет спирт, выбранный из группы, состоящей из метанола, этанола и изопропилового спирта, ароматический углеводород, выбранный из группы, состоящей из бензола, толуола и ксилола, простой эфир, выбранный из группы, состоящей из диэтилового эфира, диоксана, 1,2-диметоксиэтана и тетрагидрофурана, кетон, выбранный из группы, состоящей из ацетона, метилэтилкетона и циклогексанона, нитрил, выбранный из группы, состоящей из ацетонитрила и пропионитрила, галогенированный углеводород, выбранный из группы, состоящей из дихлорметана, 1,2-дихлор-этана и хлороформа, сложный эфир, выбранный из группы, состоящей из метилацетата и этилацетата, или полярный растворитель, выбранный из группы, состоящей из N, N-диметилформамида, N, N-диметилацетамида и диметилсульфоксида. 4. Способ по п. 3, в котором растворителем является спирт. 5. Способ по п. 1, в котором основание представляет собой органическое основание, выбранное из группы, состоящей из триэтиламина, трибутиламина, диизопропилэтиламина, N, N-диметиланилина, пиридина и 4-диметиламинопиридина или неорганическое основание, выбранное из группы, состоящей из гидроокиси натрия, гидроокиси калия, карбоната калия, бикарбоната натрия, бикарбоната калия, гидрида натрия и гидрида калия. 6. Способ по п. 5, в котором основание представляет собой органическое основание. 7. Способ по п. 1, в котором реакцию проводят при температуре между 20 и 120oС в течение от 8 до 12 ч. 8. Соединение, представленное следующей формулой II:  в которой R представляет C1-5 алкил с прямой или разветвленной цепью; R2 представляет C1-3 алкил; R3 представляет фенил, который может быть необязательно моно-пента-замещенным независимо хлором, метокси, этокси, фенокси или нитро. 9. Соединение по п. 8, в котором любой из R1 и R2 независимо от другого представляет этил. 10. Соединение, представленное следующей формулой III:  в которой Y представляет хлор или бром. РИСУНКИ
PD4A Изменение наименования, фамилии, имени, отчества патентообладателя
(73) Патентообладатель(и):
Адрес для переписки:
Дата публикации: 7.01.2011
PC4A Государственная регистрация договора об отчуждении исключительного права
Дата и номер государственной регистрации договора: 10.02.2011 № РД0076437
Лицо(а), передающее(ие) исключительное право:
(73) Патентообладатель(и):
Адрес для переписки:
Дата публикации: 20.03.2011
|
||||||||||||||||||||||||||
