Патент на изобретение №2192012
|
||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К АНТИГЕНУ РЕОВИРУСНОГО ТЕНОСИНОВИТА КУР
(57) Реферат: Изобретение относится к ветеринарной вирусологии и биотехнологии и может быть использовано для определения специфичных антител к реовирусу теносиновита кур методом иммуноферментного анализа. Способ осуществляется путем получения вируссодержащего материала из штамма “ВНИВИП-ДЕП”, последующую очистку вируссодержащего материала осуществляют методом молекулярно-ситовой хроматографии на макропористом стекле с диаметром пор, соответствующим диаметру вириона очищаемого вируса. Наилучший результат получают при использовании макропористого стекла, модифицированного поливинилпирролидоном (ПВП) с диаметром пор не менее 1200 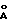 . Далее осуществляют адсорбцию высокоочищенного антигена с концентрацией белка не менее 5-10 мкг/0,1 см3, в качестве конъюгата используют антивидовой иммунопероксидазный конъюгат против lgG кур, а при проведении спектрофотометрического учета результатов в случае определения конечного титра исследуемой пробы по одному разведению 1:100 используют формулу lg титр= 2,19 . Далее осуществляют адсорбцию высокоочищенного антигена с концентрацией белка не менее 5-10 мкг/0,1 см3, в качестве конъюгата используют антивидовой иммунопероксидазный конъюгат против lgG кур, а при проведении спектрофотометрического учета результатов в случае определения конечного титра исследуемой пробы по одному разведению 1:100 используют формулу lg титр= 2,19 (LgS/P)+3,59, где S/P=(S-NKx)/(PKx-NKx), S – значение оптической плотности исследуемой сыворотки, Р – значение оптической плотности положительного контроля, NKx – среднее значение оптической плотности отрицательного контроля, РКх – среднее значение оптической плотности положительного контроля. Способ позволяет повысить чувствительность и специфичность анализа. 3 з.п. ф-лы, 2 табл. (LgS/P)+3,59, где S/P=(S-NKx)/(PKx-NKx), S – значение оптической плотности исследуемой сыворотки, Р – значение оптической плотности положительного контроля, NKx – среднее значение оптической плотности отрицательного контроля, РКх – среднее значение оптической плотности положительного контроля. Способ позволяет повысить чувствительность и специфичность анализа. 3 з.п. ф-лы, 2 табл.
Изобретение относится к ветеринарной вирусологии и биотехнологии и может быть использовано для определения специфических антител к реовирусу теносиновита кур методом иммуноферментного анализа. Теносиновит – контагиозное реовирусное заболевание птицы, зарегистрированное во всех странах мира, имеет подострое, хроническое или латентноперсистирующее течение. Широко распространено среди кур, индеек, гусей и синантропной птицы. Реовирусы птиц антигенно отличны от реовирусов млекопитающих и человека. Серологические и вирусологические исследования установили широкое распространение (90-95%) реовирусной инфекции у кур в Российской Федерации [1]. Поэтому исключительно важное значение и приобретает диагностика данного заболевания, основанная на эпизоотологических, клинических и патологоанатомических данных, результатах лабораторных исследований (выделение вируса и его идентификация в реакции нейтрализации, биопроба) и выявление специфических антител в сыворотке крови птиц методом иммуноферментного анализа. Известен способ получения вакцины против proventriculitis (заболевание птиц) [2] . Способ предусматривает выделение реовируса proventriculitis из содержащей реовирус ткани птицы, пораженной proventriculitis, инокулирование клеточной культуры, способной поддерживать рост и репликацию этих реовирусов, экстракцию вируса из клеточных и внеклеточных компонентов и превращение реовирусов в форму, пригодную для введения домашней птице. Недостатком этого способа получения антигена реовируса кур является низкая концентрация вирусного белка, что не позволяет получить высокоактивный антиген, используемый в иммуноферментном анализе (ИФА). Известен также способ получения иммунопероксидазного конъюгата для выявления антигенов бруцелл, включающий иммунизацию кроликов смесью водорастворимых антигенов Вг. abortus 544, Вг. melitensis 565 и Вг. suis 1330, взятых в равных отношениях, затем выделение специфических иммуноглобулинов из иммунной сыворотки и конъюгацию с пероксидазой хрена [3]. Однако получение иммунопероксидазного конъюгата данным способом не решает задачу выявления специфических антител к реовирусному теносиновиту кур. В основу изобретения поставлена комплексная задача создания способа определения антител к антигену реовирусного теносиновита кур, позволяющего повысить чувствительность и специфичность анализа. Поставленная задача решается тем, что согласно изобретению вируссодержащий материал получают с использованием штамма “ВНИВИП-ДЕП”, очистку полученного вируссодержащего материала осуществляют путем вирусной гельхроматографии на макропористом стекле с диаметром пор, соответствующим диаметру вириона очищаемого вируса. Наилучший результат получают при использовании макропористого стекла, модифицированного поливинилпирролидоном (ПВП) с диаметром пор не менее 1200 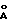 для вирусной гельхроматографии. Далее разведение полученного очищенного антигена теносиновита кур проводят фосфатно-буферным раствором до концентрации 5,0-10,0 мкг/0,1 см3, адсорбцию полученного разведенного антигена проводят на поверхности полистироловых планшет, затем на планшеты наносят исследуемые сыворотки крови кур, детекцию комплекса антиген-антитело осуществляют с использованием антивидового иммунопероксидазного конъюгата против IgG кур. Учет результатов реакции ИФА в исследуемых сыворотках крови проводят либо визуально путем сравнения цветового окрашивания содержимого лунок исследуемой сыворотки с интенсивностью окраски продукта пероксидазной реакции титруемого контроля, либо спектрофотометрически.
Конечный титр исследуемой сыворотки крови определяют по одному разведению 1:100, используя формулу для вирусной гельхроматографии. Далее разведение полученного очищенного антигена теносиновита кур проводят фосфатно-буферным раствором до концентрации 5,0-10,0 мкг/0,1 см3, адсорбцию полученного разведенного антигена проводят на поверхности полистироловых планшет, затем на планшеты наносят исследуемые сыворотки крови кур, детекцию комплекса антиген-антитело осуществляют с использованием антивидового иммунопероксидазного конъюгата против IgG кур. Учет результатов реакции ИФА в исследуемых сыворотках крови проводят либо визуально путем сравнения цветового окрашивания содержимого лунок исследуемой сыворотки с интенсивностью окраски продукта пероксидазной реакции титруемого контроля, либо спектрофотометрически.
Конечный титр исследуемой сыворотки крови определяют по одному разведению 1:100, используя формулуLg титр=2,19 (Lg S/P)+3,59, где S/P=(S-NKх)/(PKх-NKх), где S – значение оптической плотности исследуемой сыворотки; Р – значение оптической плотности положительного контроля; NKх – среднее значение оптической плотности отрицательного контроля; PKх – среднее значение оптической плотности положительного контроля; при этом проба сыворотки при S/P-отношении ниже 0,2 расценивается как отрицательная, а при S/P-отношении, равном или превышающем 0,2, как положительная. Заявляемые свойства способа определяются прежде всего использованием штамма “ВНИВИП-ДЕП”, активность которого составляет 5,5-6,0 Ig ЭИД50. Штамм депонирован в коллекции Всероссийского государственного научно-исследовательского института контроля, стандартизации и сертификации ветеринарных препаратов под номером “ВНИВИП-ДЕП” [4]. Авторами было установлено, что оптимальной дозой антигена реовируса для адсорбции на полистироловом планшете является 5-10 мкг/0,1 см3, поскольку увеличение ее выше 10 мкг/0,1 см3 приводит к многослойной сорбции антигена, вследствие чего снижается чувствительность реакции, а уменьшение ее ниже 5 мкг/0,1 см3 не приводит к получению монослоя на полистироле, что также отрицательно сказывается на результате. Специфический комплекс – антиген-немеченое антитело – выявляют использованием антивидового иммунопероксидазного конъюгата, специфичного к IgG птиц, поскольку это определяется его биологическими свойствами. Способ осуществляют следующим образом. Вирус теносиновита кур штамм “ВНИВИП-ДЕП” хранится во ВГНКИ ветпрепаратов и выдается по требованию биопредприятия не реже 1 раза в год с паспортом, характеризующим свойства штамма. Для получения вируссодержащего материала использовали метод перемежающихся пассажей на развивающихся куриных эмбрионах 9-11-суточного возраста, которые заражали освеженным аттенуированным вакцинным штаммом “ВНИВИП-ДЕП” реовирусного теносиновита кур. Активность эмбрионального вируса теносиновита кур определяли методом титрации на куриных эмбрионах [5]. Биологическая активность вируссодержащей жидкости должна быть не ниже 5,5 Ig ЭИД50. Активный и специфичный антиген вируса теносиновита кур получают путем очистки вируссодержащей эмбриональной жидкости методом молекулярно-ситовой хроматографии на макропористом стекле с диаметром пор 1200 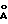 (ВГХ), модифицированном ПВП.
В очищенном препарате вируса количество белка определяют по методу Лоури, и оно, как правило, составляет от 35 до 50 мкг/см3. Далее очищенный препарат вируса разводят 0,01 М фосфатно-буферным раствором с 0,15 М хлоридом натрия (ФБР) рН 7,2-7,4 до конечной концентрации 5-10 мкг/0,1 см3. Это значение является оптимальным параметром для адсорбции очищенного антигена вируса в лунках планшета, поскольку увеличение концентрации антигена свыше 10 мкг/0,1 см3 и уменьшение ее ниже 5 мкг/0,1 см3 снижает чувствительность реакции.
После определения активности и специфичности очищенный антиген вируса теносиновита кур разделяют на две партии (части), одну из которых используют для иммунизации цыплят с целью получения гипериммунной сыворотки крови, а вторую – для адсорбции в лунках планшета для ИФА.
Твердофазный антиген получают посредством сорбции в лунках планшета для ИФА по 0,1 см3, разведенного ФБР в конечной концентрации очищенного антигена в течение 16-18 часов при 2-4oС.
Затем содержимое лунок планшета удаляют резким встряхиванием и трехкратно промывают промывочным буфером следующего состава: фосфатно-буферный раствор (рн 7,2-7,4) 0,01 моль/л; хлорид натрия 0,5 М, твин-20, твин-80 или тритон Х-100 0,1%, после чего лунки планшета подсушивают путем постукивания по фильтровальной бумаге.
Для постановки иммуноферментного анализа используют одно- и восьмиканальные автоматические пипетки со сменными наконечниками разных объемов, термостат с температурой нагрева (37,0 (ВГХ), модифицированном ПВП.
В очищенном препарате вируса количество белка определяют по методу Лоури, и оно, как правило, составляет от 35 до 50 мкг/см3. Далее очищенный препарат вируса разводят 0,01 М фосфатно-буферным раствором с 0,15 М хлоридом натрия (ФБР) рН 7,2-7,4 до конечной концентрации 5-10 мкг/0,1 см3. Это значение является оптимальным параметром для адсорбции очищенного антигена вируса в лунках планшета, поскольку увеличение концентрации антигена свыше 10 мкг/0,1 см3 и уменьшение ее ниже 5 мкг/0,1 см3 снижает чувствительность реакции.
После определения активности и специфичности очищенный антиген вируса теносиновита кур разделяют на две партии (части), одну из которых используют для иммунизации цыплят с целью получения гипериммунной сыворотки крови, а вторую – для адсорбции в лунках планшета для ИФА.
Твердофазный антиген получают посредством сорбции в лунках планшета для ИФА по 0,1 см3, разведенного ФБР в конечной концентрации очищенного антигена в течение 16-18 часов при 2-4oС.
Затем содержимое лунок планшета удаляют резким встряхиванием и трехкратно промывают промывочным буфером следующего состава: фосфатно-буферный раствор (рн 7,2-7,4) 0,01 моль/л; хлорид натрия 0,5 М, твин-20, твин-80 или тритон Х-100 0,1%, после чего лунки планшета подсушивают путем постукивания по фильтровальной бумаге.
Для постановки иммуноферментного анализа используют одно- и восьмиканальные автоматические пипетки со сменными наконечниками разных объемов, термостат с температурой нагрева (37,0 0,5)oС, бытовой холодильник, рН-метр тип 121 или 340, спектрофотометр любой конструкции с вертикальным лучом света при длине волны 450 нм.
Для исследования в лабораторию доставляют по 20-25 проб (0,2-0,3) см3 сывороток крови птиц разных возрастных групп из птицехозяйств, где имеется подозрение на данное заболевание.
Далее поступают следующим образом: готовят иммуноспецифические и неспецифические компоненты и рабочие растворы: 0,5)oС, бытовой холодильник, рН-метр тип 121 или 340, спектрофотометр любой конструкции с вертикальным лучом света при длине волны 450 нм.
Для исследования в лабораторию доставляют по 20-25 проб (0,2-0,3) см3 сывороток крови птиц разных возрастных групп из птицехозяйств, где имеется подозрение на данное заболевание.
Далее поступают следующим образом: готовят иммуноспецифические и неспецифические компоненты и рабочие растворы:Компонент 1 – положительная сыворотка крови кур к реовирусу теносиновита (положительный контроль), разведенная 1:100 0,15 М раствором хлорида натрия с содержанием 1% фетальной сыворотки, лиофилизированная, 1,0 см3 -1 ампула или флакон (К.1.); Компонент 2 – отрицательная сыворотка крови (отрицательный контроль), не содержащая антител к реовирусу теносиновита кур, разведенная 1:100 0,15 М раствором хлорида натрия с содержанием 1% фетальной сыворотки, лиофилизированная, 1.0 см3 – 1 ампула или флакон (К.2.); Компонент 3 – антиген реовируса теносиновита кур, очищенный и адсорбированный по 0,1 см3 в лунках планшета для ИФА – 2 планшета (К.3.); Компонент 4 – антивидовой иммунопероксидазный конъюгат против IgG кур, лиофилизированный 0,2 или 1,0 см3 – 1 ампула (флакон), рабочее разведение 1: 21 (К.4.); Компонент 5 – концентрированный разбавитель – 1,5 М калий-фосфатный буфер рН 7,2-7,4, жидкий, 10 см3 – 1 флакон (К.5.); Компонент 6 – разбавленный детергент твин-20, твин-80 или тритон Х-100, жидкий, 5 см3 – 1 флакон (К.6.); Компонент 7 – 5-аминосалициловая кислота, порошок, 20 мг – 1 флакон или 1 пробирка для микропроб (К.7.); Компонент 8 – гидроперит, таблетка в стандартной упаковке, 0,75 или 1,5 г – 1 шт. (К.8.). Приготовление рабочих растворов: Раствор 1- 0,01 М калий-фосфатный буфер, содержащий 0,5 М раствор хлорида натрия с 0,1% конечной концентрацией детергента (твина-20, твина-80 или тритона Х-100), рН 7,2-7,4. Для его приготовления необходимо растворить содержимое флакона с концентрированным разбавителем (К.5.), содержимое флакона с разбавленным детергентом (К.6.) и 44,0 г хлорида натрия в 1500 см3 дистиллированной воды, проверить рН. При необходимости рН корректируют 0,1н. КОН или HCI. Раствор используют для разведения положительной, отрицательной исследуемых проб сывороток крови кур, антивидового конъюгата и промывания лунок планшетов. Хранят не более 15 суток в бытовом холодильнике при (4-8)oС. Раствор 2 – содержимое ампулы (флакона) с положительной сывороткой крови кур (К. 1. ) растворяют в 1,0 см3 раствора 1, получают разведение положительной сыворотки 1:100, готовят перед использованием. Допускается хранение в морозильной камере бытового холодильника до 15 сут. Раствор 3 – содержимое ампулы (флакона) с отрицательной сывороткой крови кур (К. 2. ) растворяют с 1,0 см3 раствора 1, получают разведение отрицательной сыворотки 1:100, готовят перед использованием. Допускается хранение в морозильной камере бытового холодильника до 15 сут. Раствор 4 – содержимое ампулы с антивидовым конъюгатом (К.4.) растворяют в 21 см3 раствора 1. Готовят перед использованием. Допускается хранение в морозильной камере бытового холодильника до 15 сут. Раствор 5 – 1%-ный раствор NaOH. Готовят растворением 1 г гидроокиси натрия в 99 см3 дистиллированной воды. Хранят не более 15 суток при комнатной температуре 20oС. Раствор 6 – таблетку гидроперита 1,5 г (К.8.) растворяют в 22,5 или 45 см3 дистиллированной воды. Раствор хранят в защищенном от света месте при 4-8oС не более 10 суток. Раствор 7 – содержимое флакона с 5-аминосалициловой кислотой (К.7.) растворяют в 25 см3 горячей дистиллированной воды (70  2)oС при постоянном перемешивании на магнитной мешалке, затем охлаждают до комнатной температуры и доводят рН до 6,0 2)oС при постоянном перемешивании на магнитной мешалке, затем охлаждают до комнатной температуры и доводят рН до 6,0 0,1 с помощью раствора 5. Раствор готовят непосредственно перед использованием, не хранят.
Раствор 8 – для приготовления субстратно-индикаторной смеси к 0,1 см3 раствора 6 добавляют 3,3 см3 холодной (4-8)oС дистиллированной воды, затем к 2 см3 полученного раствора приливают 18 см3 раствора 7. Раствор готовят непосредственно перед использованием, не хранят.
Постановка реакции: 0,1 с помощью раствора 5. Раствор готовят непосредственно перед использованием, не хранят.
Раствор 8 – для приготовления субстратно-индикаторной смеси к 0,1 см3 раствора 6 добавляют 3,3 см3 холодной (4-8)oС дистиллированной воды, затем к 2 см3 полученного раствора приливают 18 см3 раствора 7. Раствор готовят непосредственно перед использованием, не хранят.
Постановка реакции:Образцы исследуемых сывороток разводят 1:100 раствором 1. С этой целью к 1,0 см3 раствора 1 добавляют 0,01 см3 (10 мкл) сыворотки крови птиц. Затем в три лунки (А1, В1, С1) вертикального ряда планшета вносят по 0,1 см3 разведенной отрицательной сыворотки крови (раствор 3) и в следующие три лунки (D1, Е1, F1) вносят по 0,1 см3 разведенной 1:100 положительной сыворотки крови (раствор 2). В лунки G1, HI вносят по 0,1 см3 раствора 1, служащие для контроля конъюгата и субстратно-индикаторной смеси. В остальные лунки рядов B2-12…H2-12 вносят по 0,1 см3 раствора 1, а в лунки горизонтального ряда A2-12 по 0,2 см3 исследуемых проб сывороток крови и проводят раститровку по вертикальным рядам, начиная от разведения 1:100 до 1: 12800. С этой целью из лунок A2-12 отбирают по 0,1 см3 разведенных исследуемых сывороток крови и переносят в лунки B2-12 соответствующего ряда, пипетируют и проводят двукратное разведение переносом по 0,1 см3 в очередную лунку вертикального ряда планшета, удаляя из последних лунок H2-12 по 0,1 см3. Планшет осторожно встряхивают для перемешивания содержимого, закрывают крышкой и переносят в термостат (37,0  0,5 oС) на 30 мин. Затем лунки планшета освобождают от содержимого путем вытряхивания, трехкратно промывают раствором 1 и подсушивают путем постукивания по фильтровальной бумаге.
Готовят раствор 4 и вносят во все лунки планшета по 0,1 см3, затем помещают в термостат (37,0 0,5 oС) на 30 мин. Затем лунки планшета освобождают от содержимого путем вытряхивания, трехкратно промывают раствором 1 и подсушивают путем постукивания по фильтровальной бумаге.
Готовят раствор 4 и вносят во все лунки планшета по 0,1 см3, затем помещают в термостат (37,0 0,5 oС) на 30 мин. После инкубации раствор конъюгата удаляют, лунки трехкратно промывают и подсушивают путем постукивания по фильтровальной бумаге.
Затем готовят растворы 5, 6, 7. Во все лунки планшета вносят по 0,1 см3 раствора 8 – субстратно-индикаторной смеси – и оставляют при комнатной температуре в темном месте на 15-20 мин.
Выявление специфических антител в сыворотках крови кур иммуноферментным методом можно проводить и без раститровки испытуемых сывороток.
В этом случае в три лунки (А1, В1, С1) вертикального ряда планшета вносят по 0,1 см3 разведенной 1:100 отрицательной сыворотки крови (отрицательный контроль), а в следующие три лунки (D1, Е1, F1) вносят по 0,1 см3 разведенной 1: 100 положительной сыворотки (положительный контроль). В лунки G1, Н1 вносят по 0,1 см3 раствора 1, служащие для контроля конъюгата и субстратно-индикаторной смеси. В лунки В2…Н2 вносят по 0,1 см3 раствора 1, а в лунки А2 по 0,2 см 3 положительной сыворотки и проводят раститровку по вертикальному ряду А2-Н2. В остальные лунки рядов А3-12…Н3-12 вносят по 0,1 см3 исследуемых проб сывороток крови кур в разведении 1:100, используя по одной лунке на каждую пробу. Остальные этапы постановки реакции проводят аналогично.
Учет результатов анализа проводят через 15-20 мин визуально – по интенсивности окрашивания содержимого лунок планшета или инструментально – с помощью спектрофотометра с вертикальным лучом света при длине волны 450 нм.
При визуальном способе учета первоначально проводят оценку результатов по контрольным лункам планшета: содержимое лунок с положительной сывороткой (положительный контроль) должно быть интенсивно окрашено в коричневый цвет. Содержимое лунок с отрицательной сывороткой (отрицательный контроль) и контроль конъюгата должно быть бесцветным или иметь бледно-соломенное окрашивание.
При отсутствии необходимости строгого количественного определения содержания специфических антител в исследуемых пробах сывороток крови учет результатов ИФА проводят визуально, сравнением цветового окрашивания содержимого лунок исследуемой сыворотки с интенсивностью окраски продукта пероксидазной реакции титруемого положительного контроля. Интенсивность цветового окрашивания продукта пероксидазной реакции пропорциональна содержанию антител к реовирусу теносиновита кур.
Раститровка проб испытуемых сывороток крови дает возможность количественно оценить концентрацию специфических антител. За титр сыворотки принимается наивысшее ее разведение, при котором еще достаточно четко видна разница цветового окрашивания по сравнению с отрицательной сывороткой крови.
Спектрофотометрический учет результатов ИФА позволяет количественно оценить содержание антител в исследуемых пробах путем измерения значений оптической плотности с одновременной записью результатов реакции с каждой лунки планшета на специальной бумажной ленте или листе бумаги. Различие между средним значением положительного контроля и средним значением отрицательного контроля должно быть более чем 0,10. Наличие или отсутствие антител против реовируса устанавливается сравнением значений оптической плотности тестируемой сыворотки (S) с положительным контролем (Р). Проба сыворотки с S/P-отношением ниже 0,2 должна расцениваться как отрицательная. Если S/P-отношение равно или больше, чем 0,2, то исследуемая проба должна расцениваться как положительная.
При определении конечного титра исследуемой пробы по одному разведению 1:100 используют формулу 0,5 oС) на 30 мин. После инкубации раствор конъюгата удаляют, лунки трехкратно промывают и подсушивают путем постукивания по фильтровальной бумаге.
Затем готовят растворы 5, 6, 7. Во все лунки планшета вносят по 0,1 см3 раствора 8 – субстратно-индикаторной смеси – и оставляют при комнатной температуре в темном месте на 15-20 мин.
Выявление специфических антител в сыворотках крови кур иммуноферментным методом можно проводить и без раститровки испытуемых сывороток.
В этом случае в три лунки (А1, В1, С1) вертикального ряда планшета вносят по 0,1 см3 разведенной 1:100 отрицательной сыворотки крови (отрицательный контроль), а в следующие три лунки (D1, Е1, F1) вносят по 0,1 см3 разведенной 1: 100 положительной сыворотки (положительный контроль). В лунки G1, Н1 вносят по 0,1 см3 раствора 1, служащие для контроля конъюгата и субстратно-индикаторной смеси. В лунки В2…Н2 вносят по 0,1 см3 раствора 1, а в лунки А2 по 0,2 см 3 положительной сыворотки и проводят раститровку по вертикальному ряду А2-Н2. В остальные лунки рядов А3-12…Н3-12 вносят по 0,1 см3 исследуемых проб сывороток крови кур в разведении 1:100, используя по одной лунке на каждую пробу. Остальные этапы постановки реакции проводят аналогично.
Учет результатов анализа проводят через 15-20 мин визуально – по интенсивности окрашивания содержимого лунок планшета или инструментально – с помощью спектрофотометра с вертикальным лучом света при длине волны 450 нм.
При визуальном способе учета первоначально проводят оценку результатов по контрольным лункам планшета: содержимое лунок с положительной сывороткой (положительный контроль) должно быть интенсивно окрашено в коричневый цвет. Содержимое лунок с отрицательной сывороткой (отрицательный контроль) и контроль конъюгата должно быть бесцветным или иметь бледно-соломенное окрашивание.
При отсутствии необходимости строгого количественного определения содержания специфических антител в исследуемых пробах сывороток крови учет результатов ИФА проводят визуально, сравнением цветового окрашивания содержимого лунок исследуемой сыворотки с интенсивностью окраски продукта пероксидазной реакции титруемого положительного контроля. Интенсивность цветового окрашивания продукта пероксидазной реакции пропорциональна содержанию антител к реовирусу теносиновита кур.
Раститровка проб испытуемых сывороток крови дает возможность количественно оценить концентрацию специфических антител. За титр сыворотки принимается наивысшее ее разведение, при котором еще достаточно четко видна разница цветового окрашивания по сравнению с отрицательной сывороткой крови.
Спектрофотометрический учет результатов ИФА позволяет количественно оценить содержание антител в исследуемых пробах путем измерения значений оптической плотности с одновременной записью результатов реакции с каждой лунки планшета на специальной бумажной ленте или листе бумаги. Различие между средним значением положительного контроля и средним значением отрицательного контроля должно быть более чем 0,10. Наличие или отсутствие антител против реовируса устанавливается сравнением значений оптической плотности тестируемой сыворотки (S) с положительным контролем (Р). Проба сыворотки с S/P-отношением ниже 0,2 должна расцениваться как отрицательная. Если S/P-отношение равно или больше, чем 0,2, то исследуемая проба должна расцениваться как положительная.
При определении конечного титра исследуемой пробы по одному разведению 1:100 используют формулуLg титр=2,19 (Lg S/P)+3,59, где S/P=(S-NKх)/(PKх-NKх), где S – значение оптической плотности исследуемой сыворотки; Р – значение оптической плотности положительного контроля; NКх – среднее значение оптической плотности отрицательного контроля; PKх – среднее значение оптической плотности положительного контроля; при этом проба сыворотки при S/Р-отношении ниже 0,2 расценивается как отрицательная, а при S/Р-отношении, равном или превышающем 0,2, как положительная. Обнаружение в сыворотках крови птиц разных возрастных групп, невакцинированных против реовирусного теносиновита, специфических антител в титрах 1:100 и выше у более чем 50% исследуемых проб, дает основание для постановки диагноза на данное заболевание. При этом учитывают эпизоотическую ситуацию в птицехозяйстве, наличие клинических и патологоанатомических признаков заболевания. Для окончательной постановки диагноза на данное заболевание проводят вирусологические исследования по выделению вируса из патологического материала (пораженные суставы, почки, селезенка. печень). Оценкой эффективности поствакцинального иммунитета является выявление в сыворотках крови птиц специфических антител в титрах не ниже чем 1:400 у 80% вакцинированной птицы. Осуществление заявленного способа описано в примерах. Пример 1. Для подтверждения высокой чувствительности и специфичности предлагаемого способа был проведен сравнительный анализ результатов исследования проб сывороток крови кур с помощью реакции нейтрализации и предложенного способа. Сыворотки, исследуемые предложенным способом, подобраны так, что все они проверялись на наличие антител к вирусу теносиновита кур в реакции нейтрализации (РН). Тест нейтрализации является классическим тестом диагностики вирусных заболеваний, в том числе и для диагностики реовирусного теносиновита кур. Результаты сравнительного изучения чувствительности предложенного способа и реакции нейтрализации при выявлении специфических антител к вирусу теносиновита кур представлены в табл.1. Результаты исследования показали, что предлагаемый способ обладает высокой чувствительностью и специфичностью и позволяет выявлять специфические антитела к вирусу теносиеновита кур в сыворотках крови. Корреляции между двумя сравниваемыми тестами не обнаружено. Реакция нейтрализации выявляет только вируснейтрализующие антитела, в то время как предложенный способ выявляет целый комплекс антител: комплементсвязывающие, вируснейтрализующие, преципитирующие и др. Пример 2. Были проведены испытания на активность и специфичность предложенного способа в шифрованном опыте. На испытание были представлены 3 лабораторные опытные серии иммуноспецифических компонентов для выявления антител к вирусу теносиновита кур предложенным способом, изготовленных: серия 1 – 02.02.00 серия 2 – 03.03.00 серия 3 – 05.05.00 – набор для диагностики ССЯ-76 ИФМ, производства ВНИВИП (ТУ 10-07-146-89), изготовленного 06.99; – набор для выявления антител к вирусу инфекционного бронхита кур иммуноферментным способом, производства ВНИВИП (ТУ 10.07.080-93), изготовленного 04.2000; – сыворотки гиперимунные специфические к вирусу теносиновита кур от разных возрастных групп – 15 проб; – положительные сыворотки к вирусу теносиновита кур от экспериментально зараженной птицы различными штаммами вируса; – полевые сыворотки крови кур от птиц разного возраста – 60 проб; – специфические (гетерологичные) сыворотки крови кур к вирусам: гриппа птиц, инфекционного ларинготрахеита. болезни Марека, инфекционной бурсальной болезни. ПМВ-2 – по 3 пробы; – отрицательные сыворотки крови кур к вирусу теносиновита – 10 проб. Для исследований было зашифровано 10 проб сывороток крови кур. Исследуемые сыворотки разводили ФБР 1:100 и вносили в лунки планшета с адсорбированным очищенным антигеном реовируса в объеме 0,1 см3, по 2 лунки на каждую сыворотку. Иммуноферментную реакцию проводили аналогичным образом, как указано ранее. Результаты испытаний представлены в табл.2. Результаты шифрованного опыта показали, что предлагаемый способ выявления специфических антител к реовирусу теносиновита в сыворотках крови кур обладает высокой чувствительностью и специфичностью. Таким образом, заявленный способ определения антител к антигену реовирусного теносиновита кур обладает высокой чувствительностью, специфичностью и эффективностью при выявлении специфических антител в сыворотках крови кур. Способ может быть использован для качественного и количественного выявления специфических антител к вирусу теносиновита кур в сыворотках крови и может быть использован для серологического контроля при эпизоотологическом обследовании птицепоголовья и определения напряженности поствакцинального иммунитета против теносиновита кур. Источники информации 1. Трефилов Б.Б., Никитина Н.В. Реовирусная инфекция птиц. – СПб, Информационный листок N 2-96, ВНИВИП, 1996. 2. ЕР 0101348 А2. Публ. 22.02.84, ИЗР 21, тем. выпуск 13, 1984. 3. SU 1475331 A1 (Волгоградский научно-исследовательский противочумный институт). Публ. 20.05.99. 4. RU 2158304 (Всероссийский научно-исследовательский ветеринарный институт птицеводства). Публ. 27.10.2000 30. 5. Сюрин В.Л. Руководство по ветеринарной вирусологии. – М., 1966. Формула изобретения
lg титр=2,19  (LgS/P)+3,59, (LgS/P)+3,59,где S/P=(S-NKx)/(PKx-NKx), где S – значение оптической плотности исследуемой сыворотки; Р – значение оптической плотности положительного контроля; NKx – среднее значение оптической плотности отрицательного контроля; РKx – среднее значение оптической плотности положительного контроля, при этом проба сыворотки при S/P – отношении ниже 0,2 расценивается как отрицательная, а при S/P – отношении, равном или превышающим 0,2, – как положительная. 4. Способ по п.1, отличающийся тем, что вируссодержащий материал получают методом молекулярно-ситовой хроматографии на макропористом стекле, модифицированном поливинилпирролидоном, с диаметром пор не менее 1200 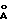 для вирусной гельхроматографии. для вирусной гельхроматографии.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 04.07.2006
Извещение опубликовано: 10.06.2007 БИ: 16/2007
|
||||||||||||||||||||||||||
