Патент на изобретение №2189984
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ БЕНЗОФУРАЗАНА ИЛИ БЕНЗО-2,1,3-ТИАДИАЗОЛА И СПОСОБ ЛЕЧЕНИЯ
(57) Реферат: Изобретение относится к производным бензофуразана или бензо-2,1,3-тиадиазола формулы I, в которой R1 представляет кислород или серу, R2 и R3 независимо выбирают из группы, состоящей из -СR=, М представляет =СR4-, где R4 независимо представляет R, R8 представляет водород, R5 выбирают из группы, состоящей из -СR=CR1-, -CR=CX-, -(СRR1)n-, R7 выбирают из группы, состоящей из -(CRR1)n-, -C(O)-, -CRX-, -CXX1-, R6 выбирают из группы, состоящей из -(CRR1)m-, -C(O)-, -CRX -, -CXX1-, -S- и -O-. Соединения обладают усиливающими АМРА рецепторы свойствами. Эти соединения можно использовать для таких терапевтических целей, как облегчение обучению поведению, и для лечения состояний, таких, как нарушения памяти из-за уменьшения количества или эффективности АМРА рецепторов или синапсов, использующих эти рецепторы. Описан также способ лечения с помощью заявленных соединений. 2 с. и 28 з.п. ф-лы, 3 ил., 1 табл. 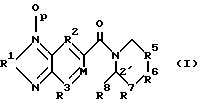
Область изобретения Изобретение относится к профилактике и лечению церебральной недостаточности, включая усиление функционирования рецепторов в синапсах в сетях мозга, ответственных за поведение высшего порядка. Эти сети мозга участвуют в познавательных способностях, связанных с нарушениями памяти, такими, какие наблюдаются при различных формах слабоумия и при нарушениях нейронной активности между различными участками мозга, что предполагается при таких заболеваниях, как шизофрения. Более конкретно, настоящее изобретение относится к соединениям, которые можно использовать для лечения таких состояний и к способам использования этих соединений для такого лечения. Предпосылки изобретения Выделение глутамата у синапсов во многих точках переднего мозга млекопитающих стимулирует два класса постсинаптических рецепторов. Обычно эти классы называют рецепторами АМРА/квисквалата и N-метил-О-аспарагиновой кислоты (NMDA). АМРА/квисквалатные рецепторы опосредуют независимый от напряжения быстрый возбуждающий постсинаптический ток (быстрый EPSC), тогда как NMDA рецепторы создают зависящий от напряжения, медленный возбуждающий ток. Исследования, проведенные на срезах гиппокампа или коры головного мозга, показывают, что АМРА рецептор, опосредующий быстрый EPSC, обычно является доминантной компонентой большинства глута-матергических синапсов. АМРА рецепторы не распределены равномерно по мозгу, но скорее и главным образом ограничены конечным мозгом и мозжечком. Эти рецепторы обнаружены в высоких концентрациях в поверхностных слоях неокортекса, в каждой из основных синаптических зон гиппокампа и в стриарном комплексе, как сообщали Monaghan et al. в Brain Research, 324:160-164 (1984). Исследования на животных и на людях показывают, что эти структуры организуют сложные непрерывные двигательные процессы и предоставляют основу для поведения высшего порядка. Так, АМРА рецепторы опосредуют передачу в те сети мозга, которые отвечают за познавательные активности индивидуума. По этим причинам лекарства, которые усиливают функционирование АМРА рецепторов, могут оказать значительное благоприятное воздействие на интеллектуальные характеристики. Такие лекарства должны также облегчить кодирование памяти. Экспериментальные исследования, такие как те, о которых сообщали Aria and Lynch, Brain Research, 598:173-184 (1992), показывают, что увеличение интенсивности АМРА рецептором опосредствованных синаптических реакций усиливает индуцирование долговременного потенциирования (LTP). LTP стабильно повышает прочность синаптических контактов, которые возникают после повторной физиологической активности такого типа, который, как известно, происходит в мозгу во время обучения. Соединения, которые усиливают функционирование АМРА форм глутаматных рецепторов, облегчают индуцирование LTP и накопление задач обучения, что определено на ряде примеров. См., например. Granger et al., Synapse, 15:326-329 (1993); Staubli et al., PNAS, 91:777-781 (1994); Arai et al., Brain Res. , 638:343-346 (1994); Staubli et al., PNAS, 91:11158-11162 (1994); Shors et al. , Neurosci., 186:153-156 (1995); Larson et al., J. Neurosci., 15:8023-8030 (1995); Grang er et al., Synapse, 22:332-337 (1996); Arai et al., JPET, 278: 627-638 (1996); Lynch et al., Internat. Clin. Psychopharm., 11:13-19 (1996); and Lynch and Rogers, PCT Pubn. N WO 94/02475. Существует значительное количество доказательств, демонстрирующих то, что LTP являются основой памяти. Например, соединения, которые блокируют LTP, нарушают образование памяти у животных, и некоторые лекарства, которые нарушают обучение у людей, препятствуют стабилизации LTP, о чем сообщали Сеrrо и Lynch, Neuroscience, 49:1-6 (1992). Возможный прототип соединения, которое селективно усиливает АМРА рецептор был описан lto et al., J. Physiol., 424:533-543 (1990). Эти авторы обнаружили, что ноотропное лекарство анирацетам (N-анизоил-2-пирролидинон) усиливает токи, опосредствованные АМРА рецепторами мозга, экспрессированными в ооциты Xenopus, не нарушая реакций, вызываемых гамма- аминомасляной кислотой (GABA), каиновой кислотой (КА) или NMDA рецепторами. Было также показано, что инфузия анирацетама в срезы гиппокампа повышает величину быстрых синаптических потенциалов, не изменяя свойств, находящихся в покое мембран. С тех пор было получено подтверждение того, что анирацетам усиливает синаптические реакции в некоторых участках гиппокампа и что он не оказывает влияния на NMDA-рецептором опосредствованные потенциалы. См. например, Staubii et al., Psychobiology, 18:377-381 (1990) и Xiao et al., Hippocampus, 1: 373-380 (1991). Было обнаружено, что анирацетам быстро действует и быстро выводится и его можно использовать повторно без видимых длительных эффектов, что является весьма желательным свойством для лекарств, связанных с поведением. Однако у анирацетама существует несколько недостатков. Периферическое введение анирацетама, по-видимому, не оказывает влияния на рецепторы мозга. Лекарство работает только при высоких концентрациях (примерно 1,0 мМ) и около 80% лекарства превращается в анизоил-GABA после периферического введения человеку (Guenzi and Zanetti, J. Chromatogr., 530:397-406 (1990). Было обнаружено, что этот метаболит, анизоил-GABA, обладает меньшей активностью, нежели анирацетам, Был описан класс соединений, усиливающих АМРА рецепторы, который не демонстрировал характеристик низкой эффективности и нестабильности, присущих анирацетаму (Lynch and Rogers. PCT публикация WO 94/02475). Эти соединения, называемые “AMPAKINES”тм, представляют собой бензамиды, которые включают, например, 1-(1,3-бензодиоксол-5-илкарбонил) пиперидин. Они химически более стабильны, нежели анирацетам, и отличаются повышенной биодоступностью по данным экспериментов, проведенных с помощью позитронной эмиссионной томографии (РЕТ) (см., например, Staubli et al., PNAS, 91:11158-11162 (1994). Как было недавно обнаружено, другой класс ампакинов, бензоксазины, обладает очень высокой активностью в моделях in vitro и in vivo для оценки вероятности достижения улучшения познавательных способностей, как раскрыто в РСТ WO 97/36907 “Бензоксазины для усиления синаптических реакций” Rogers и Lynch. Некоторые, но не все, из этих соединений демонстрируют активность в моделях на крысах в отношении болезни человека – шизофрении (Larson et al., Brain Res., 728:353-356 (1996). Было обнаружено, что некоторые замещенные бензофуразаны и бензотиадиазолы оказываются значительно и неожиданно более эффективными в моделях шизофрении на животных, нежели соединения, о которых сообщалось ранее, и оказываются также более эффективными в плане улучшения познавательных способностей. Эти соединения раскрыты в настоящем изобретении. Краткое содержание изобретения Настоящее изобретение включает, в одном из аспектов соединения, которые представлены и описаны в разделе II последующего подробного описания. Эти соединения эффективно усиливают АМРА рецептором опосредствованные реакции и поэтому полезны для различных целей. Они включают облегчение изучения поведения, зависящего от АМРА рецепторов, лечат состояния, при которых понижено количество или эффективность АМРА рецепторов или синапсов, использующих эти рецепторы, и усиливают активность возбуждающих синапсов для восстановления нарушенного баланса между субучастками мозга. В изобретении предложен способ лечения млекопитающих, страдающих от гипоглутаматергического состояния или от дефицита количества или эффективности возбуждающих синапсов, или количества АМРА рецепторов, такого, при котором нарушается память или другие познавательные функции. Такие состояния могут также быть причиной кортико/стриарного дисбаланса, приводящего к шизофрении или шизофреническому поведению. В соответствии со способом настоящего изобретения пациента лечат эффективным количеством соединения, как раскрыто в разделе II подробного описания, в фармацевтически приемлемом носителе. Как продемонстрировано далее, эти соединения значительно более эффективны, нежели описанные ранее соединения, в плане усиления функций АМРА рецепторов в срезах гиппокампа крыс, в модели шизофрении и депрессии на животных и в плане повышения характеристик познавательных способностей, таких, как поведение в лабиринте с 8 радиальными дорожками. Эти и другие цели и особенности изобретения станут более очевидны после прочтения последующего подробного описания изобретения со ссылками на прилагаемые чертежи. Краткое описание чертежей Фиг. 1 представляет способ получения предпочтительного соединения изобретения; Фиг. 2А-2D представляют способы получения тетрациклических соединений, которые составляют одно из воплощений настоящего изобретения; и Фиг.3 представляет отбор соединений, пригодных для использования в практике способа настоящего изобретения. Подробное описание изобретения I. Определения Приводимые ниже термины имеют следующие значения, если нет других указаний. “Алкил” относится к полностью насыщенному одновалентному радикалу, содержащему углерод и водород, который может быть циклической, разветвленной или неразветвленной цепочкой. Примерами алкильных групп являются метил, этил, н-бутил, н-гептил, изопропил, 2-метилпропил, циклопропил, циклопропилметил, циклобутил, циклопентил, циклопентилэтил и циклогексил. “Арил” относится к замещенному или незамещенному одновалентному ароматическому радикалу, содержащему отдельное кольцо (например, бензол) или несколько конденсированных колец (например, нафтил). Другие примеры включают гетероциклические ароматические кольцевые системы, содержащие в кольце один или более атомов азота, кислорода или серы, такие как имидазол, фурил, пиррол, пиридил и индол. Термин “эффективное количество” относится к количеству выбранного соединения формулы I, которое необходимо для усиления глутаматергической синаптической реакции в результате усиления АМРА рецепторной активности. Необходимое точное количество будет меняться в зависимости от конкретного выбранного соединения, возраста и веса пациента, способа введения и т.д., но его можно легко определить с помощью обычных экспериментов. Термин “фармацевтически приемлемый носитель” относится к носителю или эксципиенту, который не является токсичным для пациента, которому его вводят. Фармацевтически приемлемые эксципиенты подробно описаны T.W. Martin в “Remington’s Pharmaceutical Science”. II. Соединения, усиливающие АМРА рецептор Настоящее изобретение в одном из аспектов направлено на соединения, обладающие свойствами усиливать АМРА рецептор. Эти соединения имеют структурную формулу I, представленную далее 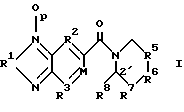 где R1 представляет кислород или серу; R2 и R3 независимо выбирают из группы, состоящей из -N=, -CR- и -СХ=; М представляет =N- или =CR4-, где R4 и R8 независимо представляют R или вместе образуют простой связующий фрагмент, связывающий М с вершиной кольца 2′, причем связующий фрагмент выбирают из группы, состоящей из простой связи, -CRR; -CR=CR’-, -С(О)-, -О-, -S(O)y-, -NR- и -N=; и R5 и R7 независимо выбирают из группы, состоящей из -(CRR’)n-, -C(O)-, -CR=CR’-, -CR=CX-, -CRX-, -CXX’-, -S- и -О-, и R6 выбирают из группы, состоящей из -(CRR’)m-, -С(O)-, -CR=CR’-, -CRX-, -CXX’-, -S- и -О-; где Х и X’ независимо выбирают из -Br, -Cl, -F, -CN, -NO2, -OR, -SR, -NRR’, -C(O)R-, -CO2R или -CONRR’, где две группы R или R’ у одной или разных Х групп могут вместе образовывать кольцо; R и R’ независимо выбирают из (i) водорода, (ii) C1-C6 разветвленного или неразветвленного алкила, который может быть незамещенным или может быть замещен одной или более функциональной группой, выбранной из галогена, нитро, алкокси, гидрокси, алкилтио, амино, кето, альдегида, карбоновой кислоты, сложного эфира карбоновой кислоты или амида карбоновой кислоты, и где две такие алкильные группы у одного атома углерода или у соседних атомов углерода могут вместе образовывать кольцо, и (iii) арила, который может быть незамещенным или может быть замещен одной или более функциональной группой, выбранной из водорода, нитро, алкокси, гидрокси, арилокси, алкилтио, амино, кето, альдегида, карбоновой кислоты, сложного эфира карбоновой кислоты или амида карбоновой кислоты; m и p независимо равны 0 или 1; n и y независимо равны 0, 1 или 2. Предпочтительные группы соединений, охватываемых формулой I, включают те, в которых р=0, те, в которых R2 и R3 представляют -CR=, a M представляет = CR4, особенно те, в которых R4 представляет водород, и те, в которых R4 представляет кислород. Особенно предпочтительной группой является та, в которой соблюдены все указанные определения, и более предпочтительной та, в которой R5 и R7 представляют -(CRR’)n-, a R6 представляет -(CRR’)m-; то есть некоторые производные 5-карбоксамидобензофуразана, содержащие различного размера насыщенные гетероциклические кольца, связанные с карбонильной группой. Предпочтительными соединениями этой группы являются те, в которых R и R’ выбирают из (i) водорода или (ii) алкила, как указано выше. Наиболее предпочтительным соединением этой группы является 1-(бензофуразан-5-илкарбонил) пиперидин, обозначаемый здесь как соединение 2. Предпочтительными также является соответствующее соединение, в котором R1 представляет серу, то есть 1-(бензо-2,1,3-тиадиазол-5-илкарбонил)пиперидин, обозначаемый здесь как соединение 1. Другие примеры соединений, содержащих кольца различного размера (где n=1, a m равно 0 или 2, соответственно), включают 1-(бензофуразан-5-илкарбонил) пирролидин (11) и 1-(бензофуразан-5-илкарбонил) гексаметиленимин (14). Второй предпочтительной группой соединений формулы I являются соединения, в которых р= 0, R4 и R8 оба представляют водород, R6 представляет -(CRR’)m-, R7 представляет -(CRR’)n-, а R5 представляет -CR=CX- или -CR=CR’-, то есть гетероциклическое кольцо содержит двойную связь. Другим предпочтительным классом этой второй группы является такой, в котором m равно 0. Особенно предпочтительными примерами этого класса являются соединения, в которых R1 представляет кислород, n=1, и R и R’ представляют водород, то есть 1-(бензофуразан-5-илкарбонил)-1,2,3,6-тетрагидропиридин, обозначаемый здесь как соединение 3, и 1-(бензофуразан-5-илкарбонил)-1,2,3,6-тетрагидро-4-фторпиридин, обозначаемый здесь как соединение 6. Другим примером соединения, содержащего 5-членное кольцо (оба m и n равны 0), является 1-(бензофуразан-5-илкарбонил)пирролин (12). Третья предпочтительная группа соединений формулы I включает соединения, в которых р=0, R1 представляет кислород, R4 и R8 оба представляют водород, R5 и R7 представляют -(CRR’)n-, a R6 представляет -С(О)-, -CRX-, СХХ’-, -О- или -S-. Другим предпочтительным классом соединений этой третьей группы являются те, в которых R6 представляет -CRX- или -СХХ’-, где R и Х каждый выбирают из групп, определенных ранее, a n=1. Двумя наиболее предпочтительными примерами этого класса являются 1-(бензофуразан-5-илкарбонил)-4′-цианопиперидин (соединение 8) и 1-(бензофуразан-5-илкарбонил)-4′-гидроксипиперидин (соединение 9). Предпочтительными также являются те, в которых Х представляет фтор, а R и R’ представляют водород, то есть, 1-(бензофуразан-5-илкарбонил)-4′-фторпиперидин и 1-(бензофуразан-5-илкарбонил)-4′, 4′-дифторпиперидин, обозначаемые здесь как соединения 4 и 5, соответственно. Другие примеры включают соответствующие 4-метилпиперидин и 4-метоксипиперидин производные (13 и 17, соответственно). Когда любой из R5, R6 и R7 представляет СХХ’, две группы Х и X’ могут образовывать кольцо с одним и тем же или со смежным атомом углерода, как указано выше. Примером может служить 1-(бензофуразан-5-илкарбонил)-1,4-диокса-8-азаспиро[4,5]декан (15). Другим предпочтительным классом этой третьей группы соединений являются те, в которых n=1, R и R’ представляют водород, а R6 представляет кислород или серу. Этот класс включает морфолино- и тиоморфолиноамиды бензофуразана, то есть N-(бензофуразан-5-илкарбонил)морфолин (7) и N-(бензофуразан-5-илкарбонил)тиоморфолин (10). В соединении 16, полученном из 4-пиридинона, R6 представляет -С(О)-. Четвертой предпочтительной группой соединений формулы I являются те, в которых М представляет = CR4-, где R4 и R8 вместе образуют один связующий фрагмент, связывающей М с вершиной кольца 2′. Этот связующий фрагмент выбирают из группы, состоящей из простой связи, -CRR’-, -CR=CR’-, -С(O)-, -О-, -S-, -NR- и -N=. Предпочтительные соединения этой четвертой группы включают те, в которых р=0, те, в которых R1 представляет кислород, и те, в которых R2 и R3 представляют -CR=, где R имеет указанные выше значения. Наиболее предпочтительными соединениями являются те, в которых выполняются все указанные определения; то есть некоторые тетрациклические бензофуразановые амиды, такие как те, которые представлены на фиг.2. Предпочтительная группа этих соединений включает те, в которых связующий фрагмент выбирают из -CRR’-, -О-, -S- и -N=. Предпочтительно, R5 и R7 представляют -(CRR’)n-, а R6 представляет -(CRR’)m-. Более предпочтительно в этом случае n=1, a m=0 или 1, что приводит к 5-членному или 6-членному гетероциклическому кольцу, соответственно, как самое правое конденсированное кольцо. Из предпочтительных связующих фрагментов особенно предпочтительны -CRR’-, кислород, сера и -N=, кислород и имино (-N=), причем наиболее предпочтителен кислород. III. Получение целевых соединений Соединения настоящего изобретения можно получить различными способами, включая обычные химические методики синтеза. Способы получения соединений настоящего изобретения заключается в следующем. Соединения изобретения, в которых R4 и R8 не образуют связующего фрагмента, обычно получают как представлено на фиг.1, активируя карбоксильную группу соответствующим образом замещенной бензойной кислоты или, в другом варианте, никотиновой, пиразинкарбоновой, пиридизинкарбоновой или пиримидинкарбоновой кислоты, с использованием карбонилдиимидазольной или другой активирующей группы, например, тионилхлорид, в безводном растворителе, таком как дихлорметан, хлороформ, тетрагидрофуран или этилацетат. Затем циклический амин подвергают взаимодействию с активированной карбоксильной группой. Циклический амин предпочтительно включает, в соответствии с описанными выше предпочтительными структурами, необязательно замещенное производное пиперидина. Кольцо может также быть ненасыщенным или включать атомы кислорода или серы, причем рассматриваются также более крупные или менее крупные размеры колец. Коммерчески доступен большой выбор таких аминов; в другом варианте их можно получить, используя известные способы синтеза. В примерах 1-20 описывается получение представительных соединений настоящего изобретения, обозначаемых здесь как соединения 1-18, в соответствии с описанными выше способами. Соединения настоящего изобретения, в которых R4 и R8 образуют связующий фрагмент, можно получить в соответствии со способами, представленными на фиг.2А-2D. Хотя в иллюстративных способах получения использованы бензофуразановые ядра, аналогичные способы можно использовать для получения и других соединений изобретения, например, соответствующих бензотиадиазолов и других азотсодержащих гетероароматических систем. Как представлено на фиг.2А, после активации карбоксильной группы соответствующим образом замещенной салициловой кислоты карбонилдиимидазолом в безводном растворителе, таком как дихлорметан, хлороформ, тетрагидрофуран, этилацетат или т. п., следует присоединение подходящего аминоалкилацеталя. Полученный амидацеталь подвергают взаимодействию с сильной кислотой, такой как алкил- или арилсульфоновая кислота, или с трифторуксусной кислотой в низкоосновном растворителе, таком как дихлорметан, для осуществления отщепления ацеталя и циклизации в тетрациклический замещенный бензоксазин, как представлено, в котором связующий фрагмент, образованный R4 и R8, представляет кислород. В альтернативном способе получения, представленном на фиг. 2В, активированный салицилат реагирует с циклическим имином, таким как 1-пирролин или 2,3,4,5-тетрагидропиридин. На фиг. 2С представлена реакция подходящим образом замещенного антранилатного сложного эфира с циклическим галоимином, таким как 2-хлор- или 2-бромимидат, до получения тетрациклического соединения, в котором связующим фрагментом, образованным R4 и R8, является иминогруппа. Эту группу можно затем восстановить, например, каталитическим гидрированием, получая аминосвязующий фрагмент. На фиг. 2D представлена реакция подходящим образом замещенного гомофталевого ангидрида с циклическим имином, таким как 1-пирролин или 2,3,4,5-тетрагидропиридин, с последующим декарбоксилированием с получением тетрациклического соединения, в котором связующими фрагментами, образованными R4 и R8, являются -СН2– или -CRR’- группы (см., например, Cushman et al., J. Org. Chem. , 45:5067-5073 (1980) и Smith et al., J. Heterocyclic Chem., 28:1813-1815 (1991)). IV Способ лечения В соответствии со следующим аспектом настоящего изобретения композиции настоящего изобретения можно использовать для лечения шизофрении или шизофренического поведения у млекопитающих, или для лечения нарушений памяти или других познавательных функций. Такие болезни являются симптомами гипоглутаматергического состояния или недостаточного количества или эффективности возбуждающих синапсов, или количества АМРА рецепторов. Так как лечение субъекта композициями настоящего изобретения повышает активность АМРА рецепторов, такое лечение можно использовать для облегчения выработки навыков поведения, зависящей от АМРА рецепторов. Способ лечения включает введение субъекту в фармацевтически приемлемом носителе эффективного количества соединения формулы 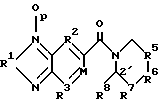 где R1 представляет кислород или серу; R2 и R3 независимо выбирают из группы, состоящей из -N=, -CR= и -СХ=; М представляет =N- или =CR4-, где R4 и R8 независимо представляют R или вместе образуют один связующий фрагмент, связывающей М с вершиной кольца 2′, причем связующий фрагмент выбирают из группы, состоящей из простой связи, -CRR’-, -CR=CR’-, -С (О)-, -О-, -S(O)y-, -NR- и -N=; и R5 и R7 независимо выбирают из группы, состоящей из -(CRR’)n-, -C(O)-, -CR=CR’-, -CR=CX-, -CRX-, -CXX’-, -S- и -О-; и R6 выбирают из группы, состоящей из -(CRR’)m-, -С(О)-, -CR=CR’-, -CRX-, -CXX’-, -S- и -О-; где Х и X’ независимо выбирают из -Br, -Cl, -F, -CN, -NO2, -OR, -SR, -NRR’, -C(O)R-, -CO2R или -CONRR’, где две R и R’ группы у одной или разных Х групп могут, взятые вместе, образовывать кольцо; R и R’ независимо выбирают из (i) водорода, (ii) C1-C6 разветвленного или неразветвленного алкила, который может быть незамещенным или может быть замещен одной или более из функциональных групп, выбранных из галогена, нитро, алкокси, гидрокси, алкилтио, амино, кето, альдегида, карбоновой кислоты, сложного эфира карбоновой кислоты или амида карбоновой кислоты, и где две такие алкильные группы у одного атома углерода или у соседних атомов углерода могут вместе образовывать кольцо, и (iii) арила, который может быть незамещенным или может быть замещен одной или более из функциональных групп, выбранных из водорода, нитро, алкокси, гидрокси, арилокси, алкилтио, амино, кето, альдегида, карбоновой кислоты, сложного эфира карбоновой кислоты или амида карбоновой кислоты; m и р независимо равны 0 или 1; n и y независимо равны 0, 1 или 2. Из соединений, вводимых в соответствии с указанным способом, предпочтительные группы включают те, которые описаны в разделе II выше. Особенно предпочтительны соединения, обозначенные как соединения 1-9, причем наиболее предпочтительны соединения 2, 7, 8 и 9. Как было обнаружено, соединения, вводимые в соответствии со способом настоящего изобретения, более эффективны, нежели описанные ранее соединения, в плане повышения активности АМРА рецепторов, что показано в in vitro и in vivo тестах, описываемых далее. V. Биологическая активность А. Усиление АМРА рецепторной функции Синаптические реакции, опосредствованные АМРА рецепторами, усиливаются в соответствии со способом настоящего изобретения, с использованием описанных здесь соединений. Эти соединения, как продемонстрировано в последующих примерах, оказываются гораздо более эффективными, нежели описанные ранее соединения, в плане усиления АМРА рецепторной функции в срезах гиппокампа крыс. Этот in vitro анализ описан далее и в примере 21 позднее. Поле EPSP (возбуждающий постсинаптический потенциал), записываемый в поле СА1 после стимуляции СА3 аксонов, как известно, опосредован АМРА рецепторами, которые присутствуют в синапсах (Kessler et al., Brain Res., 560: 337-341 (1991)). Лекарства, которые селективно блокируют этот рецептор, селективно блокируют поле EPSP (Muller et al., Science, см. ранее). Анирацетам, который, как было показано, повышает среднее время открытия канала АМРА рецепторов, повышает амплитуду синаптического тока и пролонгирует его длительность (Tang et al., Science, см. ранее). Эти эффекты отражаются на поле EPSP (например, Staubli et al., Psychobiology, ранее; Xiao et al., Hippocampus, ранее; Staubli et al., Hippocampus, 2:4958 (1992)). Аналогичные результаты сообщались для ранее открытых стабильных бензамидных аналогов анирацетама (Lynch and Rogers, PCT WO 94/02475). Для получения данных, представленных в таблице, биполярный нихромовый стимулирующий электрод помещают в дендритный слой (stratum radiatum) гиппокампального субполя СА1 вблизи границы субполя СА3, как описано в примере 21. Импульс тока (0,1 мксек) через стимулирующий электрод активирует популяцию Schaffer-соединительных волокон (SC), которые выходят из нейронов в субразделе СА3 и оканчиваются в синапсах на дендритах СА1 нейронов. Активация этих синапсов заставляет их выделять трансмиттерный глутамат. Глутамат связывается с постсинаптическими АМРА рецепторами, которые затем кратковременно открывают связанные с ними ионные каналы и дают возможность току натрия проникать в постсинаптическую клетку. Этот ток приводит к созданию напряжения во внеклеточном пространстве (поле EPSP), которое записывается регистрирующим электродом с высоким сопротивлением, расположенным в середине stratum radiatum CA1. Интенсивность стимулирующего тока устанавливают такой, чтобы получить половину максимальных значений EPSP (обычно около 1,5-2,0 мВольт). Парные стимулирующие импульсы подают каждые 40 сек с межимпульсными интервалами 200 мксек, как описано далее в примере 21. Срезы гиппокампа поддерживают в регистрирующей камере, в которую непрерывно подают искусственную спинномозговую жидкость (ACSF). В течение 15-30 минутных интервалов перфузионную среду заменяют на среду, содержащую различные концентрации тестируемых соединений. Реакции, зарегистрированные непосредственно до или в конце перфузии лекарства, налагают для расчета процента увеличения EPSP амплитуды. Соединения изобретения 1-9, как представлено на фиг.3 и в таблице далее, а также сравнительное соединение СХ516 (1-(хиноксалин-6-илкарбонил)пиперидин), раскрытый в РСТ WO 94/02475, анализируют в описанной выше физиологической тестовой системе. Результаты в первой колонке таблицы демонстрируют оценку концентрации каждого из тестируемых соединений, которая понадобилась бы для повышения амплитуды поля EPSP до величины, на 10% превышающей базовое значение. 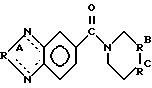 Как свидетельствуют результаты таблицы соединения настоящего изобретения осуществляют дозо-зависимое повышение амплитуды EPSP и оказываются эффективными в концентрациях столь низких, как 3 мкМ. Большинство тестированных соединений оказались одинаково или более эффективными, вплоть до множителя 50 по сравнению со сравнительным соединением СХ516, в повышении АМРА рецепторной функции. Соединения 2, 4 и 6-9 оказались особенно эффективными. Исследования, в которых сравнивали эффекты АМРА модуляторов на моносинаптические (как здесь сообщалось) и полисинаптические реакции, продемонстрировали, что 10% повышение амплитуды моносинаптического поля EPSP усиливает на 300% трисинаптические реакции (Strvio et al., Neuroscience, 74: 1025-1035 (1996)). Кроме того, как было показано, концентрация модулятора, который вызывает эти реакции, существует в плазме, полученной от поведенчески соответствующих доз (Graner et al., Synapse, ранее). Так, 10% повышение амплитуды моносинаптического поля EPSP, как видно из таблицы, по-видимому представляет поведенчески соответствующие концентрации плазмы. В. Поведенческий тест Соединения настоящего изобретение эффективны также при испытании на моделях животных соответствующих заболеваний, таких как шизофрения и депрессия, и в испытаниях на моделях характеристик познавательных способностей, таких как характеристики в лабиринте с 8 радиальными дорожками. Результаты во второй колонке таблицы демонстрируют минимальную эффективную дозу (МЭД= MEDs) для активности в модели крыс с использованием метамфетамина, который, как доказано, применим для оценки эффективности нейролептических лекарств для лечения шизофрении (Larson et al., Brain Res., ранее). Записаны дозы, которые снижают гиперактивность и/или стереотипическую активность, индуцированную острым введением 2 мг/кг метамфетамина крысам, как описано в примере 22. Все тестированные соединения оказались значительно более эффективными, нежели сравнительное соединение, как представлено в таблице, в том, что обеспечили 10-кратное или более снижение дозы, вызывающей эквивалентный эффект. Соединение 2 оказалось равно эффективным при дозе в 100 раз меньшей. Результаты в третьей колонке демонстрируют МЭД для эффективности по улучшению характеристик в задаче с лабиринтом с 8 радиальными дорожками, в котором тестируют улучшение памяти и познавательных способностей (МЕДс). Эта задача была описана ранее (Staubli et al., PNAS, 91:777-781 (1994) и Lynch and Rogers, PCT WO 94/02475). И снова, все тестируемые соединения (2 и 7-9) оказались в этом тесте в несколько раз более эффективными нежели СХ516. В четвертой колонке в таблице представлены МЕД, которые вызывают статистически значимые улучшения в поведении в модели депрессии на животных (МЕДд), как описано Malatynska and Kostowski, Pol. J. Pharmacol., 40, 357-364 (1984). Соединения 2 и 9 были протестированы и снова оказались более эффективными (примерно в 500 раз) по сравнению со сравнительным соединением. VI. Способы введения, дозы и композиции Как указано выше, соединения и способ изобретения повышают АМРА рецептором опосредованные реакции и могут быть использованы для лечения гипоглутаматергических состояний. Их можно также использовать для лечения таких состояний, как нарушения памяти или других познавательных функций, вызванных дефицитом количества или эффективности возбуждающих синапсов, или количества АМРА рецепторов. Их можно также использовать для лечения шизофрении или шизофренического поведения, возникающего из-за кортикально/стриального дисбаланса, и для облегчения изучения поведения, зависящего от АМРА рецепторов. Обычно дозы и способы введения соединений определяют в соответствии с весом и состоянием пациента, в соответствии со стандартной фармацевтической практикой. Уровни используемых доз могут широко меняться и их может легко определить специалист. Обычно используют количества от миллиграмма вплоть до грамма. Композицию можно вводить пациенту различными способами, например, перорально, трансдермально, периневрально или парентерально, т.е. с помощью внутривенных, подкожных, внутрибрюшинных или внутримышечных инъекций. Субъекты, которых можно лечить в соответствии со способом настоящего изобретения, включают людей, домашних животных, лабораторных животных и т.п. Композиции, содержащие соединения настоящего изобретения, могут иметь форму твердых, полутвердых, лиофилизированных порошков или жидких лекарственных форм, например таких как таблетки, капсулы, порошки, композиции с замедленным выделением, растворы, суспензии, эмульсии, суппозитории, кремы, мази, лосьоны, аэрозоли или т.п., предпочтительно в единичных лекарственных формах, подходящих для простого введения точной дозы. Композиции обычно включают традиционный фармацевтический носитель или эксципиент и могут дополнительно включать другие медицинские агенты, носители, адьюванты и т.п. Предпочтительно, чтобы композиция содержала от около 0,5 до 75% по весу соединения или соединений изобретения, причем остальное составляют фармацевтические эксципиенты. Для перорального введения такие эксципиенты включают фармацевтической степени чистоты маннит, лактозу, крахмал, стеарат магния, натрийсахарин, тальк, целлюлозу, глюкозу, желатин, сахарозу, карбонат магния и т.п. При желании композиция может также содержать небольшие количества нетоксичных вспомогательных веществ, таких как смачивающие агенты, эмульгирующие агенты или буферы. Жидкие композиции можно приготовить, растворяя или диспергируя соединения (от около 0,5% до около 20%) и необязательно фармацевтические адьюванты в носителе, таком как, например, водный физиологический раствор, водная декстроза, глицерин или этанол, до образования раствора или суспензии. Для использования в препаратах для перорального введения композицию можно приготовить в виде раствора, суспензии, эмульсии или сиропа, поставляемых либо в форме жидкости, либо в сухом виде, пригодном для растворения в воде или нормальном физиологическом растворе. Если композицию используют в форме твердых препаратов для перорального введения, эти препараты могут быть таблетками, гранулами, порошками, капсулами или т. п. Для композиций в форме таблеток композицию обычно приготавливают с добавками, например эксципиентами, такими как сахарид или целлюлоза, такими связующими, как крахмальная паста или метилцеллюлоза, наполнителями, разрыхлителями и другими добавками, которые обычно используют при изготовлении медицинских препаратов. Композиции для инъекций для парентерального введения обычно содержат соединение в подходящем для внутривенного введения растворе, таком как стерильный физиологический солевой раствор. Композиция может быть также приготовлена в виде суспензии в липиде или фосфолипиде, в липосомной суспензии или в водной эмульсии. Способы получения таких лекарственных форм известны или будут очевидны специалистам; см., например, “Remington’s Pharmaceutical Sciences” (17th Ed. , Mack. Pub. Co, 1985). Композиция, предназначенная для введения, должна содержать количество выбранного соединения в фармацевтически эффективном количестве для осуществления усиления АМРА рецепторных токов у пациента. ПРИМЕРЫ Нижеследующие примеры лишь иллюстрируют изобретение, но никоим образом не ограничивают его. Если нет других указаний, все температуры даны в oС. Все спектры 1H ЯМР получены в растворителе дейтерохлороформе с использованием в качестве внутреннего стандарта тетраметилсилана. Инфракрасные спектры (ИК) записаны с пленок на Fresnel кристалле в режиме ATI Mattson Gemini FTIR. Примечание: Перегонку любых из следующих соединений следует осуществлять крайне осторожно. Опасность выделения газообразных продуктов разложения возрастает с увеличением масштаба реакции. Альтернативный способ очистки с использованием активированного угля описан в примере 2, в способе В далее. ПРИМЕР 1: 1-(Бензо-2,1,3-тиадиазол-5-илкарбонил) пиперидин (1) Триметилалюминий (2М в толуоле; 3,0 мл, 6,0 ммоль) разбавляют в 30 мл дихлорметана, к этому добавляют пиперидин (0,55 г, 6,6 ммоль) и метил бензо-2,1,3-тиадиазол-5-карбоксилат (1,16 г, 6,00 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов и концентрируют до половины объема в роторном испарителе. Добавляют сухой толуол (25 мл) и реакционный раствор нагревают до 80oС в течение 1 часа. Добавляют дополнительно пиперидин (около 0,2 г) и температуру повышают до 100oС в течение 1 часа. Раствору дают остыть до комнатной температуры и перемешивают в течение ночи, после чего реакцию гасят 10% лимонной кислотой и соляной кислотой. Этот раствор разбавляют этилацетатом и последовательно промывают 10% лимонной кислотой, насыщенным раствором вторичного кислого фосфата натрия и насыщенным раствором хлорида натрия, а затем сушат над безводным сульфатом натрия. Этот раствор концентрируют на двуокиси кремния и продукт элюируют смесью гексан/этилацетат (3: 1). В результате очистки перегонкой в круглодонной колбе (kugelrohr) при 180oС и давлении 0,5 мм рт.ст., получают 1-(бензо-2,1,3-тиадиазол-5-илкарбонил)пиперидин (1) (1,29 г, 87%) в виде масла бледно-желтого цвета. ИК: 2920, 2855, 1633, 1478, 1439, 1280, 1223, 1001, 816 и 748 см-1. 1Н ЯМР (500 МГц)  : 8,06 (1Н, д, J=9, 1 Гц); 8,02 (1Н, с); 7,63 (1Н, т, J= 9,0 и 1,5 Гц); 3,77 (2Н, шир. с); 3,40 (2Н, шир. с); 1,72 (4Н, шир. с) и 1,5 млн.д (2Н, шир. с).
ПРИМЕР 2: 1-(Бензофуразан-5-илкарбонил) пиперидин (2) : 8,06 (1Н, д, J=9, 1 Гц); 8,02 (1Н, с); 7,63 (1Н, т, J= 9,0 и 1,5 Гц); 3,77 (2Н, шир. с); 3,40 (2Н, шир. с); 1,72 (4Н, шир. с) и 1,5 млн.д (2Н, шир. с).
ПРИМЕР 2: 1-(Бензофуразан-5-илкарбонил) пиперидин (2)Способ А: Бензофуразан-5-карбоновую кислоту (2,0 г, 12,2 ммоль) суспендируют в 10 мл дихлорметана. Добавляют карбонилдиимидазол (2,0 г, 12,3 ммоль), что приводит к растворению с выделением газа. Полученный желтый раствор перемешивают в течение 40 мин при комнатной температуре, после чего добавляют пиперидин (1,2 г, 14,1 ммоль). Полученный раствор перемешивают в течение ночи и концентрируют на двуокиси кремния. Продукт элюируют смесью гексан/этилацетат (2: 1) и очищают перегонкой в круглодонной колбе (kugelrohr) при 155-170oС и давлении 0,5 мм рт.ст. 1-(Бензофуразан-5-илкарбонил)пиперидин (2) (2,78 г, 99%), вначале представляющий масло бледно-желтого цвета, кристаллизуется при охлаждении. Т. пл. 88,5-90,5oС. ИК: 2938, 2857, 1630, 1519, 1439, 1266, 1223, 996, 881, 816 и 740 см-1 1Н ЯМР (500 МГц)  : 7,90 (1Н, д, J=9, 17 Гц); 7,84 (1Н, с); 7,44 (1Н, дд, J=9,0 и 1,4 Гц); 3,74 (2Н, шир. с); 3,39 (2Н, шир. с); 1,72 (4Н, шир. с) и 1,57 млн.д (2Н, шир. с).
Способ В: : 7,90 (1Н, д, J=9, 17 Гц); 7,84 (1Н, с); 7,44 (1Н, дд, J=9,0 и 1,4 Гц); 3,74 (2Н, шир. с); 3,39 (2Н, шир. с); 1,72 (4Н, шир. с) и 1,57 млн.д (2Н, шир. с).
Способ В:В 5-и литровую колбу загружают этилацетат (2,3 л) и карбонилдиимидазол (500,0 г, 2,48 моль), к этому добавляют 4-хлор-3-нитробензойную кислоту (402,5 г, 2,48 моль) порциями в течение 1 часа. Раствор перемешивают в течение еще 1,5 часов. В течение 2 часов по каплям добавляют пиперидин (222,2 г, 2,60 моль) и полученный раствор перемешивают еще в течение 4 часов. Реакционную смесь промывают последовательно дважды 6 н. НСl раствором (600 мл), дважды насыщенным раствором бикарбоната натрия (250 мл) и, наконец, насыщенным раствором NaCl (250 мл). Органический раствор сушат над безводным сульфатом натрия и фильтруют, а растворитель удаляют в вакууме, получая 646 г (97%) 4-хлор-3-нитробензоил-пиперидина в виде кристаллического твердого вещества желтого цвета с т.пл. 76-77oС. ИК: 1633, 1535 и 1440 см-1. 1Н ЯМР (500 МГц, CDCl3)  : 7,92 (1Н, д, J=1,5 Гц); 7,60 (1Н, д, J=8,1 Гц); 7,56 (1Н, дд, J=8,1 и 1,5 Гц); 3,70 (2Н, шир. с); 3, 35 (2Н, шир. с); 1,0 (4Н, шир. с) и 1,56 млн.д (2Н, шир.с ).
4-Хлор-3-нитробензоилпиперидин (539,2 г, 2,00 моля) растворяют в 2,93 л этиленгликоля в пятилитровой колбе при перемешивании и нагревании до 50oС. К этому раствору порциями в течение 40 мин добавляют азид натрия (137,0 г, 2,10 молей). После завершения добавления температуру повышают до 120oС в течение 2,5 часов и поддерживают эту температуру в течение 3 часов. Раствору дают остыть до 50oС и в это время в течение 5 минут добавляют дополнительно азид натрия (65,2 г, 1,00 моль). Температуру повышают до 120oС в течение 2,5 часов и поддерживают эту температуру в течение 4,5 часов, пока не прекращается выделение газа. Раствору дают остыть до комнатной температуры и в это время смесь разделяют между водой и этилацетатом (1,5 л каждого). Водную фазу экстрагируют трижды этилацетатом (300 мл). Объединенные органические фазы промывают 30 мл воды, дважды насыщенным раствором NaCl (200 мл) и, наконец, сушат над безводным сульфатом натрия. Отфильтрованный раствор упаривают, получая 345,5 г неочищенного 1-(бензофуразан-5-илкарбонил)пиперидина.
Неочищенный (сырой)) 1-(бензофуразан-5-илкарбонил)пиперидин (22 г) растворяют в 200 мл этилацетата при перемешивании. К раствору добавляют активированный уголь (11,0 г) и полученную суспензию нагревают до кипения с обратным холодильником, позволяют остыть до 60oС и, наконец, фильтруют на целите. Оставшийся на фильтре активированный уголь снова суспендируют в 200 мл этилацетат, нагревают до кипения с обратным холодильником и снова фильтруют на целите. Отфильтрованную лепешку дважды промывают этилацетатом (50 мл) и полученный фильтрат концентрируют в роторном испарителе, получая 19,0 г масла, оранжевого цвета, которое отверждается при стоянии. Обесцвеченный продукт промывают 20 мл охлажденного льдом этанола, получая 13,1 г бледно-желтых кристаллов (2) с т. плавления 91,0-93,0oС.
ПРИМЕР 3: 1-(Бензофуроксан-5-илкарбонил) пиперидин (1) : 7,92 (1Н, д, J=1,5 Гц); 7,60 (1Н, д, J=8,1 Гц); 7,56 (1Н, дд, J=8,1 и 1,5 Гц); 3,70 (2Н, шир. с); 3, 35 (2Н, шир. с); 1,0 (4Н, шир. с) и 1,56 млн.д (2Н, шир.с ).
4-Хлор-3-нитробензоилпиперидин (539,2 г, 2,00 моля) растворяют в 2,93 л этиленгликоля в пятилитровой колбе при перемешивании и нагревании до 50oС. К этому раствору порциями в течение 40 мин добавляют азид натрия (137,0 г, 2,10 молей). После завершения добавления температуру повышают до 120oС в течение 2,5 часов и поддерживают эту температуру в течение 3 часов. Раствору дают остыть до 50oС и в это время в течение 5 минут добавляют дополнительно азид натрия (65,2 г, 1,00 моль). Температуру повышают до 120oС в течение 2,5 часов и поддерживают эту температуру в течение 4,5 часов, пока не прекращается выделение газа. Раствору дают остыть до комнатной температуры и в это время смесь разделяют между водой и этилацетатом (1,5 л каждого). Водную фазу экстрагируют трижды этилацетатом (300 мл). Объединенные органические фазы промывают 30 мл воды, дважды насыщенным раствором NaCl (200 мл) и, наконец, сушат над безводным сульфатом натрия. Отфильтрованный раствор упаривают, получая 345,5 г неочищенного 1-(бензофуразан-5-илкарбонил)пиперидина.
Неочищенный (сырой)) 1-(бензофуразан-5-илкарбонил)пиперидин (22 г) растворяют в 200 мл этилацетата при перемешивании. К раствору добавляют активированный уголь (11,0 г) и полученную суспензию нагревают до кипения с обратным холодильником, позволяют остыть до 60oС и, наконец, фильтруют на целите. Оставшийся на фильтре активированный уголь снова суспендируют в 200 мл этилацетат, нагревают до кипения с обратным холодильником и снова фильтруют на целите. Отфильтрованную лепешку дважды промывают этилацетатом (50 мл) и полученный фильтрат концентрируют в роторном испарителе, получая 19,0 г масла, оранжевого цвета, которое отверждается при стоянии. Обесцвеченный продукт промывают 20 мл охлажденного льдом этанола, получая 13,1 г бледно-желтых кристаллов (2) с т. плавления 91,0-93,0oС.
ПРИМЕР 3: 1-(Бензофуроксан-5-илкарбонил) пиперидин (1)Бензофуроксан-5-карбоновую кислоту (1 г, 5,6 ммоль) суспендируют при перемешивании в 15 мл дихлорметана и к этому добавляют карбонилдиимидазол (0,90 г, 5,6 ммоль). Происходит выделение газа и полученный раствор перемешивают в течение 40 мин, причем в это время добавляют при перемешивании пиперидин (0,5 г, 5,9 ммоль). Реакционный раствор концентрируют на двуокиси кремния и полученный продукт элюируют смесью гексан/этилацетат (3:1). В результате перекристаллизации из смеси 2-пропанол/гексан (1:10) получают 1-(бензофуроксан-5-илкарбонил)пиперидин (0,94 г, 69%) в виде твердого вещества желтого цвета с т.пл. 94,5-96,5oС. ИК: 2938, 2855, 1620, 1612, 1528, 1487, 1435, 1257, 1233, 1018, 1000, 852, 811 и 747 см-1. 1Н ЯМР (500 МГц)  : 7,10-7,80 (3Н, шир. с), 3,72 (2Н, шир. с); 3,39 (2Н, шир. с); 1,72 (4Н, шир. с) и 1,54 млн.д (2Н, шир. с).
ПРИМЕР 4: Получение 4-фторпиперидина и 1,2,3,4-тетрагидропиридина : 7,10-7,80 (3Н, шир. с), 3,72 (2Н, шир. с); 3,39 (2Н, шир. с); 1,72 (4Н, шир. с) и 1,54 млн.д (2Н, шир. с).
ПРИМЕР 4: Получение 4-фторпиперидина и 1,2,3,4-тетрагидропиридинаN-Трифторацетил-4-гидроксипиперидин (7, 92 г, 40 ммоль ) суспендируют в 10 мл дихлорметана и охлаждают до -78oС. Добавляют трифторид диметиламиносеры (6,8 г, 42 ммоль) и суспензию оставляют нагреваться до комнатной температуры в течение ночи. Затем реакционную смесь разбавляют 125 мл дихлорметана и промывают насыщенным раствором бикарбоната натрия, что приводит к интенсивному бурлению. Дихлорметановый раствор затем сушат, промывая насыщенным раствором хлорида натрия, а затем обрабатывают безводным сульфатом магния. Растворитель удаляют в вакууме, а полученное масло оранжевого цвета перемешивают с 7,5 М КОН раствором в течение 1 часа при комнатной температуре. Этот продукт экстрагируют эфиром и сушат над безводным сульфатом магния. Раствор фильтруют и эфир удаляют перегонкой при атмосферном давлении. Амины отгоняют при 95oС, в результате получают 0,7 г бесцветного масла, которое состоит из смеси 4-фторпиперидина/1,2,3,6-тетрагидропиридина. ИК: 3317, 3293, 2968, 2955, 2943, 2929, 1451, 1427, 1418, 1377, 1279 и 1023 см-1. ПРИМЕР 5: 1-(Бензофуразан-5-илкарбонил)-1,2,3,6-тетрагидропиридин (3) и 1-(бензофуразан-5-илкарбонил)-4-фторпиперидин (4) Бензофуразан-5-карбоновую кислоту (0,75 г, 4,6 ммоль) суспендируют в 15 мл дихлорметана. К этой суспензии добавляют карбонилдиимидазол (0,75 г, 4,6 ммоль), что вызывает превращение реакционной смеси в желтый цвет по мере выделения газа. Раствор перемешивают в течение 30 минут, после чего добавляют смесь 4-фторпиперидина и 1,2,3,6-тетрагидропиридина (0,7 г, примерно 7 ммоль), полученных как указано в примере 4. Раствор перемешивают в течение 2 часов при комнатной температуре, после чего реакционную смесь концентрируют на двуокиси кремния и продукты элюируют смесью гексан/этилацетат (3:1). Выделяют три компонента 100 мг, 200 мг и 300 мг, соответственно. Соединение, вышедшее вторым, отверждается при стоянии и его идентифицируют как 1-(бензофуразан-5-илкарбонил)-1,2,3,6-тетрагидропиридин, (3) по данным ЯМР. Т. плавления 68,5-70oС. ИК: 1630, 1516, 1438, 1245, 1009, 881, 816, 741 и 629 см-1. 1Н ЯМР (500 МГц)  : 7,92 (1Н, д, J=9,0 Гц); 7,88 (1Н, с); 7,47 (1Н, д, J= 9,0); 5,57-5,95 (2Н, м); 4, 23 (1Н, шир. с); 3,90-3,97 (2Н, м); 3,53 (1Н, шир. с); 2,33 (1Н, шир. с) и 2,22 млн.д (1Н, шир. с).
Компонент, который вышел третьим, перекристаллизовывают из смеси этилацетат/гексан (1:30), получая 200 мг белых кристаллов с т. плавления 124-125,5oС, и его идентифицируют как 1-(бензофуроксан-5-илкарбонил)-4′-фторпиперидин (4) по данным ЯМР.
ИК: 1633, 1439, 1274, 1231, 1034, 923, 881 и 742 см-1.
1Н ЯМР (500 МГц) : 7,92 (1Н, д, J=9,0 Гц); 7,88 (1Н, с); 7,47 (1Н, д, J= 9,0); 5,57-5,95 (2Н, м); 4, 23 (1Н, шир. с); 3,90-3,97 (2Н, м); 3,53 (1Н, шир. с); 2,33 (1Н, шир. с) и 2,22 млн.д (1Н, шир. с).
Компонент, который вышел третьим, перекристаллизовывают из смеси этилацетат/гексан (1:30), получая 200 мг белых кристаллов с т. плавления 124-125,5oС, и его идентифицируют как 1-(бензофуроксан-5-илкарбонил)-4′-фторпиперидин (4) по данным ЯМР.
ИК: 1633, 1439, 1274, 1231, 1034, 923, 881 и 742 см-1.
1Н ЯМР (500 МГц)  : 7,93 (1Н, д, J=9,0 Гц); 7,87 (1Н, с); 7,44 (1Н, д, J= 9,0 Гц); 4,9-5,1 (1Н, м); 4,0-4,2 (1Н, шир. с); 3,5-3,7 (2Н, м); 3,4-3,5 (1Н, шир. с); 1,72-2,1 млн.д (4Н, м).
ПРИМЕР 6: 1-(Бензофуразан-5-илкарбонил)-1,2,3,6-тетрагидропиридин (3) : 7,93 (1Н, д, J=9,0 Гц); 7,87 (1Н, с); 7,44 (1Н, д, J= 9,0 Гц); 4,9-5,1 (1Н, м); 4,0-4,2 (1Н, шир. с); 3,5-3,7 (2Н, м); 3,4-3,5 (1Н, шир. с); 1,72-2,1 млн.д (4Н, м).
ПРИМЕР 6: 1-(Бензофуразан-5-илкарбонил)-1,2,3,6-тетрагидропиридин (3)Альтернативный способ Более прямой способ получения 1-(бензофуразан-5-илкарбонил)-1,2,3,6-тетрагидропиридина (3) был осуществлен по способу примера 2, способу А, см. ранее, исходя из чистого тетрагидропиридина. Неочищенный продукт (выход 94%) очищают с помощью хроматографической обработки на силикагеле (гексан/этилацетат (1: 3)), в результате чего получают с выходом 74% кристаллы бледно-желтого цвета с т. плавления 82-83,5oС. Предположительно другой кристаллический изоморф полученного ранее. ПРИМЕР 7: Получение 4,4-дифторпиперидин/1,2,3,6-тетрагидро-4-фторпиперидина N-Трифторацетил-4-пиперидон (10 г, 52 ммоль) суспендируют в 10 мл дихлорметана. К этой суспензии добавляют диэтиламиносульфуртрифторид (9,1 г, 56,5 ммоль). Реакция вначале протекает медленно, но через несколько минут смесь начинает бурно кипеть. Чтобы уменьшить интенсивность кипения, осуществляют охлаждение. Смесь перемешивают в течение ночи, разбавляют 125 мл дихлорметана и промывают насыщенным раствором бикарбоната натрия, после чего происходит интенсивное образование пузырьков. Затем дихлорметан сушат насыщенным раствором хлорида натрия, а затем безводным сульфатом магния. Растворитель удаляют в вакууме и полученное масло оранжевого цвета перемешивают с 7,5 М КОН раствором в течение 1 часа при комнатной температуре. Продукт экстрагируют эфиром, полученный раствор сушат над безводным сульфатом магния и фильтруют. Эфир отгоняют при атмосферном давлении, а продукт отгоняют при 105-125oС, получая 4,5 г бледно-желтого масла, состоящего из смеси 4,4-дифторпиперидина/1,2,3,6-тетрагидро-4-фторпиперидина. ИК: 2960, 1357, 1265, 1146, 1117, 987, 952, 814 и 792 см-1. ПРИМЕР 8: 1-(Бензофуразан-5-илкарбонил)-4,4-дифторпиперидин (5) и 1-(бензофуразан-5-илкарбонил)-1,2,3,6-тетрагидро-4-фторпиридин (6) Бензофуразан-5-карбоновую кислоту (0,75 г, 4,6 ммоль) активируют в 15 мл дихлорметана карбонилдиимидазолом, по способу примера 4. Смесь 4,4-дифторпиперидина и 1,2,3,6-тетрагидро-4-фторпиридина (0,7 г), полученную по способу примера 7, добавляют к раствору и продукт элюируют смесью гексан/этилацетат (3:1), получая два компонента. Компонент, элюированный первым, перекристаллизовывают из смеси этилацетат/гексан (1:5), получая 480 мг твердого вещества с т.пл. 148-149oС, и его идентифицируют как 1-(бензофуразан-5-илкарбонил)-4,4′-дифторпиперидин (5). ИК: 1642, 1440, 1365, 1266, 1123, 1086, 936, 822, 817, 737 и 607 см-1. 1Н ЯМР (500 МГц)  : 7,96 (1Н, д, J=9, 5 Гц); 7,90 (1Н, с); 7,45 (1Н, т, J= 8,8 и 1,1 Гц); 3,8-4,1 (2Н, шир. с); 3,5-3,7 (2Н, шир. с) и 1,9-2,2 млн.д (4Н, шир. д).
Компонент, элюрованный вторым, перекристаллизовывают из смеси этилацетат/гексан (1: 10), получая 180 мг твердого продукта с т. плавления 102-105oС, и его идентифицируют как 1-(бензофуразан-5-илкарбонил)-1,2,3,6-тетрагидро-4-фторпиридин (6).
ИК: 1639, 1436, 1361, 1241, 1146, 1007, 828, 817, 742 и 605 см-1.
1Н ЯМР (500 МГц) : 7,96 (1Н, д, J=9, 5 Гц); 7,90 (1Н, с); 7,45 (1Н, т, J= 8,8 и 1,1 Гц); 3,8-4,1 (2Н, шир. с); 3,5-3,7 (2Н, шир. с) и 1,9-2,2 млн.д (4Н, шир. д).
Компонент, элюрованный вторым, перекристаллизовывают из смеси этилацетат/гексан (1: 10), получая 180 мг твердого продукта с т. плавления 102-105oС, и его идентифицируют как 1-(бензофуразан-5-илкарбонил)-1,2,3,6-тетрагидро-4-фторпиридин (6).
ИК: 1639, 1436, 1361, 1241, 1146, 1007, 828, 817, 742 и 605 см-1.
1Н ЯМР (500 МГц)  : 7,94 (1Н, д, J=9,0 Гц); 7,90 (1Н, с); 7,46 (1Н, д, J= 9,0 Гц); 5,1-5,4 (1Н, м); 4,3 (1Н, шир. с); 4,0 (2Н, шир. с); 3,65 (1Н, шир. с) и 2,30-2,55 млн. д (2Н, шир. д).
ПРИМЕР 9: 4-(Бензофуразан-5-илкарбонил)морфолин (7) : 7,94 (1Н, д, J=9,0 Гц); 7,90 (1Н, с); 7,46 (1Н, д, J= 9,0 Гц); 5,1-5,4 (1Н, м); 4,3 (1Н, шир. с); 4,0 (2Н, шир. с); 3,65 (1Н, шир. с) и 2,30-2,55 млн. д (2Н, шир. д).
ПРИМЕР 9: 4-(Бензофуразан-5-илкарбонил)морфолин (7)4-(Бензофуразан-5-илкарбонил)морфолин получают по способу примера 2 (способ А), используя морфолин вместо пиперидина. Продукт получают с выходом 65% в виде бледного кристаллического твердого вещества с т. плавления 148-150oС. ИК: 1638, 1522, 1439, 1276, 1108, 1003 и 614 см-1. 1Н ЯМР (500 МГц)  : 7,94 (1Н, д, J=9,2 Гц); 7,88 (1Н, с); 7,45 (1H, д, J=9,2 Гц) и 3,50-3,90 (8Н, м) м.д.
ПРИМЕР 10: 1-(Бензофуразан-5-илкарбонил)-4-цианопиперидин (8) : 7,94 (1Н, д, J=9,2 Гц); 7,88 (1Н, с); 7,45 (1H, д, J=9,2 Гц) и 3,50-3,90 (8Н, м) м.д.
ПРИМЕР 10: 1-(Бензофуразан-5-илкарбонил)-4-цианопиперидин (8)Способ А 1-(Бензофуразан-5-илкарбонил)-4-цианопиперидин получают по способу примера 2 (Способ А), используя 4-цианопиперидин вместо пиперидина. Продукт получают с выходом 74%, с т. плавления 190-192oС после хроматографической очистки на силикагеле, используя в качестве элюента смесь этилацетат/метанол (95:5). ИК: 1675, 1611, 1431, 1261 и 1226 см-1. 1Н ЯМР (500 МГц)  : 7,93 (1Н, д, J=9,2 Гц); 7,88 (1Н, с); 7,46 (1Н, д, J= 9,1); 5,30-5,50 (2Н, м); 4,60-4,70 (1Н, м); 3,75-3,85 (1Н, м); 2,90-3,25 (2Н, м); 2,40-2,50 (1Н, м) и 1,60-2,10 млн.д (4Н, м).
Способ В : 7,93 (1Н, д, J=9,2 Гц); 7,88 (1Н, с); 7,46 (1Н, д, J= 9,1); 5,30-5,50 (2Н, м); 4,60-4,70 (1Н, м); 3,75-3,85 (1Н, м); 2,90-3,25 (2Н, м); 2,40-2,50 (1Н, м) и 1,60-2,10 млн.д (4Н, м).
Способ В1-(Бензофуразан-5-илкарбонил)-4-карбоксамидопиперидин (2,50 г, 9,11 ммоль) растворяют в СНС13 (90 мл) и обрабатывают тионилхлоридом (1,65 г, 13,8 ммоль). Реакционную смесь нагревают до кипения с обратным холодильником в течение 30 минут и в это время раствор становится мутным. Добавляют дополнительно тионилхлорид (1,52 г, 12,8 ммоль) и реакционную смесь нагревают дополнительно 1,5 часа. После того, как раствор охлаждают до комнатной температуры, его разбавляют CH2Cl2, промывают насыщенным раствором бикарбоната натрия и сушат над сульфатом натрия. Продукт концентрируют на силикагеле и элюируют смесью гексан/этилацетат (1:1). Полученное соединение обесцвечивают активированным углем в этилацетате, получая 1-(бензофуразан-5-илкарбонил)-4-цианопиперидин (0,570 г, 24%) (51% в расчете на выделенный исходный материал) в виде масла, которое кристаллизуется при стоянии в виде бледного твердого вещества. Т. плавления 104-107oС. ИК: 2240, 1735, 1633, 1435, 1271 и 1236 см-1. 1Н ЯМР (500 МГц)  : 7,96 (1Н, дд, J=9,0 и 1,2 Гц); 7,88 (1Н, дд, J=1,7 и 0,7 Гц); 7,44 (1Н, дд, J=9,1 и 1,6 Гц); 3,60-4,00 (4Н, м); 2,95-3,05 (1Н, м) и 1,80-2,15 млн.д (4Н, м).
ПРИМЕР 11: 1-(Бензофуразан-5-илкарбонил)-4-гидроксипиперидин (9) : 7,96 (1Н, дд, J=9,0 и 1,2 Гц); 7,88 (1Н, дд, J=1,7 и 0,7 Гц); 7,44 (1Н, дд, J=9,1 и 1,6 Гц); 3,60-4,00 (4Н, м); 2,95-3,05 (1Н, м) и 1,80-2,15 млн.д (4Н, м).
ПРИМЕР 11: 1-(Бензофуразан-5-илкарбонил)-4-гидроксипиперидин (9)1-(Бензофуразан-5-илкарбонил)-4-гидроксипиперидин получают по способу примера 2 (способ А), используя 4-гидроксипиперидин вместо пиперидина. Продукт получают с выходом 45% и т.плавления 132-136oС после хроматографической очистки на силикагеле, используя этилацетат в качестве элюента. ИК: 1614 и 1446 см-1. 1Н ЯМР (200 МГц)  : 7,95 (1Н, д, J=9,3 Гц); 7,86 (1Н, с); 7,44 (1Н, дд, J= 9,2 и 1,3 Гц); 4,0-4,25 (2Н, м); 3,1-4,0 (3Н, м); 1,8-2,1 (2Н, м) и 1,5-1,8 (3Н, м) м.д.
13С ЯМР (125 МГц) : 7,95 (1Н, д, J=9,3 Гц); 7,86 (1Н, с); 7,44 (1Н, дд, J= 9,2 и 1,3 Гц); 4,0-4,25 (2Н, м); 3,1-4,0 (3Н, м); 1,8-2,1 (2Н, м) и 1,5-1,8 (3Н, м) м.д.
13С ЯМР (125 МГц)  : 33,6, 34,5, 39,3, 44,6, 66,5, 114,6, 117,5, 130,6, 139,1, 148,5, 148,6 и 167,5 млн. д.
ПРИМЕР 12: 1-(Бензофуразан-5-илкарбонил)тиоморфолин (10) : 33,6, 34,5, 39,3, 44,6, 66,5, 114,6, 117,5, 130,6, 139,1, 148,5, 148,6 и 167,5 млн. д.
ПРИМЕР 12: 1-(Бензофуразан-5-илкарбонил)тиоморфолин (10)1-(Бензофуразан-5-илкарбонил)тиоморфолин получают по способу примера 2 (способ А), используя тиоморфолин вместо пиперидина. Продукт получают с выходом 58% и т.плавления 144-146oС в виде бледного кристаллического вещества. ИК: 2912, 1632, 1557, 1434, 1292, 1231, 1208, 957, 941, 880, 825, 741 и 616 см-1. 1Н ЯМР (500 МГц)  : 7,94 (1Н, д, J=9,6 Гц); 7,86 (1Н, с); 7,41 (1Н, д, J=9,2 Гц); 4,06 (2Н, шир. с); 3,73 (2Н, шир. с), 2,78 (2Н, шир. с) и 2,62 м. д. (2Н, шир. с).
ПРИМЕР 13: 1-(Бензофуразан-5-илкарбонил)пирролидин (11) : 7,94 (1Н, д, J=9,6 Гц); 7,86 (1Н, с); 7,41 (1Н, д, J=9,2 Гц); 4,06 (2Н, шир. с); 3,73 (2Н, шир. с), 2,78 (2Н, шир. с) и 2,62 м. д. (2Н, шир. с).
ПРИМЕР 13: 1-(Бензофуразан-5-илкарбонил)пирролидин (11)1-(Бензофуразан-5-илкарбонил)пирролидин получают по способу примера 2 (способ А), используя пирролидин вместо пиперидина. Продукт получают с выходом 61% и т.плавления 97,8-99,3oС. ИК: 2957, 2878, 1632, 1619, 1514, 1471, 1432, 1194, 1009, 882, 822, 786 и 742 см-1. 1Н ЯМР (500 МГц)  : 7,96 (1Н, с); 7,91 (1Н, д, J=9,0 Гц); 7,58 (1Н, д, J= 9,5 Гц); 3,69 (2Н, т, J=6,6 Гц); 3,50 (2Н, т, J=6,5 Гц); 2,01 (2Н, кв, J= 6,6 Гц) и 1,96 м.д. (2Н, т, J=6,5 Гц).
ПРИМЕР 14: 1-(Бензофуразан-5-илкарбонил)-3-пирролин (12) : 7,96 (1Н, с); 7,91 (1Н, д, J=9,0 Гц); 7,58 (1Н, д, J= 9,5 Гц); 3,69 (2Н, т, J=6,6 Гц); 3,50 (2Н, т, J=6,5 Гц); 2,01 (2Н, кв, J= 6,6 Гц) и 1,96 м.д. (2Н, т, J=6,5 Гц).
ПРИМЕР 14: 1-(Бензофуразан-5-илкарбонил)-3-пирролин (12)1-(Бензофуразан-5-илкарбонил)-3-пирролин получают по способу примера 2 (способ А), используя 3-пирролин вместо пиперидина. Продукт получают с выходом 65% и т.плавления 117-118oС в виде бледного кристаллического вещества. ИК: 3072, 2862, 1633, 1609, 1562, 1535, 1524, 1471, 1460, 1432, 1408, 1360, 1304, 1192, 1156, 1012, 882, 834, 822, 769, 744, 695 и 684 см-1. 1Н ЯМР (500 МГц)  : 8,00 (1Н, с) 7,93 (1Н, д, J=9,7 Гц); 7,58 (1Н, д, J= 9,3 Гц); 5,97 (1Н, м); 5,80 (1Н, м); 4,50 (2Н, с) и 4,30 млн.д (2Н, с).
ПРИМЕР 15: 1-(Бензофуразан-5-илкарбонил)-4-метилпиперидин (13) : 8,00 (1Н, с) 7,93 (1Н, д, J=9,7 Гц); 7,58 (1Н, д, J= 9,3 Гц); 5,97 (1Н, м); 5,80 (1Н, м); 4,50 (2Н, с) и 4,30 млн.д (2Н, с).
ПРИМЕР 15: 1-(Бензофуразан-5-илкарбонил)-4-метилпиперидин (13)1-(Бензофуразан-5-илкарбонил)-4-метилпиперидин получают по способу примера 2 (способ А), используя 4-метилпиперидин вместо пиперидина. Продукт получают с выходом 67% и т.плавления 86-87oС. ИК: 1633, 1441 и 1239 см-1. 1Н ЯМР (500 МГц)  : 7,92 (1Н, д, J=9,5 Гц); 7,90 (1Н, с); 7,44 (1Н, д, J= 9,0 Гц); 4,50-4,70 (1Н, м); 3,65-3,80 (1Н, м); 3,05-3,15 (1Н, м); 2,80-2,90 (1Н, м); 1,75-1,85 (1Н, м); 1,60-1,75 (2Н, м); 1,20-1,30 (1Н, м); 1,05-1,20 (1Н, м) и 1,00 млн.д (3Н, д, J=6 Гц).
ПРИМЕР 16: 1-(Бензофуразан-5-илкарбонил)гексаметиленимин (14) : 7,92 (1Н, д, J=9,5 Гц); 7,90 (1Н, с); 7,44 (1Н, д, J= 9,0 Гц); 4,50-4,70 (1Н, м); 3,65-3,80 (1Н, м); 3,05-3,15 (1Н, м); 2,80-2,90 (1Н, м); 1,75-1,85 (1Н, м); 1,60-1,75 (2Н, м); 1,20-1,30 (1Н, м); 1,05-1,20 (1Н, м) и 1,00 млн.д (3Н, д, J=6 Гц).
ПРИМЕР 16: 1-(Бензофуразан-5-илкарбонил)гексаметиленимин (14)1-(Бензофуразан-5-илкарбонил)гексаметиленимин получают по способу примера 2 (способ А), используя гексаметиленимин вместо пиперидина. Продукт получают с выходом 67% и т. плавления 86-87oС после хроматографической очистки на силикагеле, используя в качестве элюента смесь гексан/этилацетат (1: 1). ИК: 1631, 1428, 1273 и 743 см-1. 1Н ЯМР (500 МГц)  : 7,91 (1Н, дд, J=8,6, 0,6 Гц); 7,82 (1Н, с); 7,44 (1Н, дд, J= 9,2, 0,8 Гц); 3,72 (2Н, т, J=3,9 Гц); 3,43 (2Н, т, J=3,9 Гц); 1,88 (2Н, т, J=3,9 Гц; и 1,60-1,70 м.д. (6Н, м).
ПРИМЕР 17: 1-(Бензофуразан-5-илкарбонил)-1,4-диокса-8-азаспиро[4,5]декан (15) : 7,91 (1Н, дд, J=8,6, 0,6 Гц); 7,82 (1Н, с); 7,44 (1Н, дд, J= 9,2, 0,8 Гц); 3,72 (2Н, т, J=3,9 Гц); 3,43 (2Н, т, J=3,9 Гц); 1,88 (2Н, т, J=3,9 Гц; и 1,60-1,70 м.д. (6Н, м).
ПРИМЕР 17: 1-(Бензофуразан-5-илкарбонил)-1,4-диокса-8-азаспиро[4,5]декан (15)1-(Бензофуразан-5-илкарбонил)-1,4-диокса-8-азаспиро[4,5] декан получают по способу примера 2 (способ А), используя 1,4-диокса-8-азаспиро[4,5]декан (этиленкеталь 4-пиридона) вместо пиперидина. Продукт получают с выходом 54% и т.плавления 88-90oС. ИК: 1638, 1440, 1268, 1120, 1081 и 742 см-1. 1Н ЯМР (500 МГц)  : 7,91 (1Н, дд, J=9,0 и 1,0 Гц); 7,87 (1Н, дд, J=1,6 и 0,9 Гц); 7,45 (1Н, дд, J=9,2 и 1,2 Гц); 4,00 (4Н, с); 2,80-3,95 (2Н, шир. с); 2,45-2,65 (2Н, шир. с); 1,75-1,90 (2Н, шир. с) и 1,65-1,75 м.д. (2Н, шир. с).
ПРИМЕР 18: 1-(Бензофуразан-5-илкарбонил)-4-пиперидон (16) : 7,91 (1Н, дд, J=9,0 и 1,0 Гц); 7,87 (1Н, дд, J=1,6 и 0,9 Гц); 7,45 (1Н, дд, J=9,2 и 1,2 Гц); 4,00 (4Н, с); 2,80-3,95 (2Н, шир. с); 2,45-2,65 (2Н, шир. с); 1,75-1,90 (2Н, шир. с) и 1,65-1,75 м.д. (2Н, шир. с).
ПРИМЕР 18: 1-(Бензофуразан-5-илкарбонил)-4-пиперидон (16)1-(Бензофуразан-5-илкарбонил)-4-пиперидон получают по способу примера 2 (способ А), используя 4-пиперидон вместо пиперидина. Продукт получают с выходом 30% и т.плавления 136-139oС. ИК: 1715, 1637, 1433, 1270 и 1238 см-1. 1Н ЯМР (500 МГц)  : 7,96 (1Н, дд, J=9,6, 1,0 Гц); 7,94 (1Н, с); 7,49 (1Н, д, J=9,6 Гц); 3,70-4,20 (4Н, с) и 2,30-2,80 м.д. (4Н, шир. с).
ПРИМЕР 19: 1-(Бензофуразан-5-илкарбонил)-4-метоксипиперидин (17) : 7,96 (1Н, дд, J=9,6, 1,0 Гц); 7,94 (1Н, с); 7,49 (1Н, д, J=9,6 Гц); 3,70-4,20 (4Н, с) и 2,30-2,80 м.д. (4Н, шир. с).
ПРИМЕР 19: 1-(Бензофуразан-5-илкарбонил)-4-метоксипиперидин (17)1-(Бензофуразан-5-илкарбонил)-4-метоксипиперидин (840 мг, 3,40 ммоль) растворяют в диметилформамиде (12 мл) и обрабатывают 60% гидридом натрия (150 мг, 3,75 ммоль) в течение 30 минут. Добавляют метилиодид (650 мг, 4,54 ммоль) и через 3 часа при комнатной температуре реакционную смесь обрабатывают еще таким же количеством гидрида натрия и метилиодида, что и раньше, и оставляют выстаиваться на 16 часов. Реакционный раствор разбавляют водой и продукт экстрагируют этилацетатом. Органический раствор промывают водой и насыщенным раствором хлорида натрия и сушат над сульфатом магния. Сырой продукт очищают, обесцвечивая активированным углем в этаноле, дважды обрабатывают хроматографически на силикагеле, элюируя смесью гексан/этилацетат (2: 1) и, наконец, осуществляют перегонку в круглодонной колбе (kugelrohr) при 125-140oС, получая 1-(бензофуразан-5-илкарбонил)-4-метоксипиперидин (269 мг, 30%) в виде бледно-желтого масла. ИК: 1639, 1440, 1274, 1101 и 1089 см-1. 1Н ЯМР (500 МГц)  : 7,91 (1Н, дм, J=9,2 Гц); 7,85 (1Н, т, J=1,1 Гц); 7,43 (1Н, дд, J= 9,2, 1,2 Гц); 3,90-4,05 (1Н, м); 3,55-3,72 (2Н, м); 3,53 (1Н, септ, J= 3,5 Гц); 3,38 (3Н, с); 3,20-3,35 (1Н, м); 1,90-2,02 (2Н, м); 1,65-1,85 (2Н, м) и 1,65 м.д. (1Н, м).
ПРИМЕР 20: 1-(Бензофуразан-5-илкарбонил)декадейтеропиперидин (18) : 7,91 (1Н, дм, J=9,2 Гц); 7,85 (1Н, т, J=1,1 Гц); 7,43 (1Н, дд, J= 9,2, 1,2 Гц); 3,90-4,05 (1Н, м); 3,55-3,72 (2Н, м); 3,53 (1Н, септ, J= 3,5 Гц); 3,38 (3Н, с); 3,20-3,35 (1Н, м); 1,90-2,02 (2Н, м); 1,65-1,85 (2Н, м) и 1,65 м.д. (1Н, м).
ПРИМЕР 20: 1-(Бензофуразан-5-илкарбонил)декадейтеропиперидин (18)Бензофуразан-5-карбоновую кислоту (0,9070 г, 5,526 ммоль) суспендируют в 15 мл метиленхлорида, к этому раствору добавляют карбонилдиимидазол (0,9027 г, 5,567 ммоль). Реакционная смесь становится темной по мере выделения газа. Этот раствор перемешивают в течение 30 минут и в этот момент добавляют пиперидин-d11 (0,5125 г, 5,437 ммоль). Реакционную смесь перемешивают в течение двух часов при комнатной температуре, концентрируют на силикагеле и элюируют смесью гексан/этилацетат (2:1), получая 1-(бензофуразан-5-илкарбонил) декадейтеропиперидин (911,1 мг, 69%) в виде бледного кристаллического твердого вещества с т. плавления 88-89oС. ИК: 2213, 2113, 1624, 1517, 1416, 1233, 1103, 970, 930, 897, 881, 872, 772, 740 и 605 см-1. 1Н ЯМР (500 МГц)  7,91 (1H, д, J=9,8 Гц); 7,84 (1Н, с) и 7,44 м.д. (1Н, дд, J=9,4, 1,4 Гц).
ПРИМЕР 21: In vitro физиологическое тестирование 7,91 (1H, д, J=9,8 Гц); 7,84 (1Н, с) и 7,44 м.д. (1Н, дд, J=9,4, 1,4 Гц).
ПРИМЕР 21: In vitro физиологическое тестированиеФизиологическое действие соединений настоящего изобретения тестируют in vitro с помощью срезов крысиного гиппокампа следующим способом. Возбуждающие реакции (поле EPSP) измеряют в срезах гиппокампов, которые находятся в регистрирующей камере, в которую непрерывно подают искусственную спинномозговую жидкость (ACSF). В течение 15-30 минутных интервалов перфузионную среду заменяют средой, содержащей различные концентрации тестируемых соединений. Реакции, зарегистрированные непосредственно до и в конце перфузии лекарства, налагают для расчета процента повышения EPSP амплитуды. Для проведения этих тестов гиппокамп удаляют у анестезированных двухмесячных крыс штамма Спраг-Доули и приготавливают in vitro срезы (толщиной 400 мкм), которые помещают в камеру с интерфейсом при 35oС, используя обычную методику (см. , например, Dunwiddie and Lynch, J. Physiol., 276:353-367 (1978)). В камеру постоянно подают со скоростью 0,5 мл/мин ACSF, содержащую (в мМ): NaCl 124, КСl 3, КН2РO4 1,25, MgSO4 2,5, CaCl2 3,4, NаНСО3 26, глюкозу 10 и L-аскорбат 2. Биполярный нихромовый стимулирующий электрод помещают в дендритный слой (stratum radiatum) гиппокампального субполя СА1 вблизи границы субполя СА3. Импульс тока (0,1 мксек) через стимулирующий электрод активирует популяцию Schaffer-соединительных волокон (SC), которые выходят из нейронов в подразделе СА3 и оканчиваются в синапсах на дендритах СА1 нейронов. Активация этих синапсов заставляет их выделять трансмиттерный глутамат. Глутамат связывается с постсинаптическими АМРА рецепторами, которые затем кратковременно открывают связанные с ними ионные каналы и дают возможность току натрия проникать в постсинаптическую клетку. Этот ток приводит к созданию напряжения во внеклеточном пространстве (поле EPSP), которое записывается регистрирующим электродом с высоким сопротивлением, расположенным в середине stratum radiatum CA1. Для экспериментов, суммированных в таблице, интенсивность стимулирующего тока устанавливают такой, чтобы получить половину максимальных значений; EPSP (обычно около 1,5-2,0 мВольт). Парные стимулирующие импульсы подают каждые 40 сек с межимпульсными интервалами 200 мксек, см. далее. Поле EPSP второй реакции оцифровывают и анализируют для определения амплитуды. Если реакции оказываются стабильными в течение 15-30 минут (базовая линия), тестовые соединения добавляют в перфузионные линии в течение около 15 минут. Затем перфузию возвращают к регулярной ACSF. Используют стимуляцию парными импульсами, так как стимуляция SC волокон частично активирует интернейроны, которые создают ингибирующий постсинаптический потенциал (IPSP) в пирамидальных клетках CA1. Это сдвигает вперед типичные значения IPSP обычных значений после того, как EPSP достигает своего пика. Это ускоряет реполяризацию и укорачивает фазу затухания EPSP и это может частично маскировать эффекты тестируемых соединений. Одной из связанных с этим особенностей сдвига вперед IPSP является то, что у него нет возможности реактивировать в течение нескольких сотен миллисекунд после стимулирующего импульса. Это явление можно использовать, чтобы с выгодой исключить IPSP, подавая парные импульсы, разделенные 200 миллисекундами, и используя вторую (“праймированную”) реакцию для анализа результатов. Результаты в первой колонке таблицы показывают оценку концентраций каждого из тестированных соединений, которая потребуется для повышения амплитуды поля EPSP до величины на 10% выше базового уровня. Величины в большинстве случаев установлены путем интерполяции, но в других случаях путем экстраполяции из определенных значений. ПРИМЕР 22: Поведенческое тестирование Результаты во второй колонке таблицы демонстрируют минимальную эффективную дозу (МЭД = MEDs) для активности в модели для крыс с использованием метамфетамина, для оценки эффективности нейролептических лекарств для лечения шизофрении (Larson et al., Brain Res., ранее). Записаны дозы, которые снижают гиперактивность и/или стереотипическую активность, индуцированную острым введением 2 мг/кг метамфетамина двухмесячным крысам штамма Спраг-Доули. Активность регистрируют в течение 90 минут, используя два ряда множественных, парных инфракрасных диод-детекторов с тем, чтобы нижний ряд детектировал передвижение, а верхний ряд детектировал поведение хвоста. Данные собирают и хранят в персональном компьютере для последующего анализа. Хотя настоящее изобретение было описано со ссылкой на конкретные методики и воплощения, следует понимать, что, не выходя за рамки объема и сути изобретения, можно осуществить его различные модификации. Формула изобретения
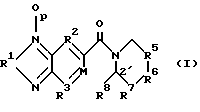 где R1 представляет кислород или серу; R2 и R3 независимо выбирают из группы, состоящей из -N= , -CR= и -СХ= ; М представляет = N- или = CR4-, где R4 и R8 независимо представляют R или вместе образуют один связующий фрагмент, связывающий М с вершиной кольца 2′, причем связующий фрагмент выбирают из группы, состоящей из простой связи, -CRR’-, -CR= CR’-, -С(О)-, -О-, -S(O)y-, -NR- и -N= ; и R5 и R7 независимо выбирают из группы, состоящей из -(CRR’)n-, -C(O)-, -CR= CR’-, -CR= CX-, -CRX-, -CXX’-, -S- и -О-, и R6 выбирают из группы, состоящей из -(CRR’)m-, -C(O)-, -CR= CR’-, -CRX-, -CXX’-, -S- и -О-; где Х и X’ независимо выбирают из -Br, -Cl-, -F, -CN, -NO2, -OR, -SR, -NRR’, -C(O)R-, -CO2R или -CONRR’, где две группы R или R’ у одной группы Х или у двух соседних групп Х могут вместе образовывать кольцо, R и R’ независимо выбирают из (i) водорода, (ii) C1-C6 разветвленного или неразветвленного алкила или С3-С5 циклоалкила, который может быть незамещенным или может быть замещен одной или более функциональной группой, выбранной из галогена, нитро, алкокси, гидрокси, алкилтио, амино, кето, альдегида, карбоновой кислоты, сложного эфира карбоновой кислоты или амида карбоновой кислоты, и где две такие алкильные группы у одного атома углерода или у соседних атомов углерода могут вместе образовывать кольцо, и (iii) арила, который может быть незамещенным или может быть замещен одной или более функциональной группой, выбранной из водорода, нитро, алкокси, гидрокси, арилокси, алкилтио, амино, кето, альдегида, карбоновой кислоты, сложного эфира карбоновой кислоты или амида карбоновой кислоты, m и p независимо равны 0 или 1, n и y независимо равны 0, 1 или 2, где “алкокси” обозначает алкильный эфир, а “алкилтио” обозначает алкильный тиоэфир, где “алкил” содержит от одного до семи атомов углерода; “арил” обозначает замещенный или незамещенный одновалентный ароматический радикал, содержащий одно кольцо или несколько конденсированных колец, включая гетероциклические ароматические кольцевые системы, содержащие один или несколько атомов азота, кислорода или серы в кольце, такие как фенил, нафтил, имидазол, фурил, пиррол, пиридил и индол, и “арилокси” обозначает арильный эфир. 2. Соединение по п. 1, где R и R’ независимо выбирают из (i) водорода, (ii) C1-C6 разветвленного или неразветвленного алкила или С3-С6 циклоалкила, который может быть незамешенным или может быть замещен одной или более функциональной группой, выбранной из водорода, нитро, алкокси, гидрокси, алкилтио, амино, кето, альдегида, карбоновой кислоты, сложного эфира карбоновой кислоты или амида карбоновой кислоты, и где две такие алкильные группы у одного атома углерода или у соседних атомов углерода могут вместе образовывать кольцо. 3. Соединение по п. 1, где R2 и R3 представляют -CR-, a M представляет = CR4-. 4. Соединение по п. 3, где р= 0, R1 представляет кислород, а R4 и R8 представляют водород. 5. Соединение по п. 4, где R5 и R7 представляют -(CRR’)n-, а R6 представляет -(CRR’)m-. 6. Соединение по п. 5, где R и R’ представляют водород, а m= n= 1, причем указанное соединение является 1-(бензофуразан-5-илкарбонил)пиперидином. 7. Соединение по п. 3, где р= 0, R1 представляет серу, R4, R8, R и R’ представляют водород и m= n= 1, причем указанное соединение является 1-(бензо-2,1,3-тиадиазол-5-илкарбонил)пиперидином. 8. Соединение по п. 4, где R5 представляет -CR= CX-, R6 представляет -(CRR’)m-, R7 представляет -(CRR’)n-, а m= 0. 9. Соединение по п. 8, где R и R’ представляют водород. 10. Соединение по п. 9, где Х представляет фтор, а n= 1, причем указанное соединение является 1-(бензофураэан-5-илкарбонил)-4-фтор-1,2,3,6-тетрагидропиридином. 11. Соединение по п. 4, где R5 представляет -CR= CR’-, R6 представляет -(CRR’)m-, R7 представляет -(CRR’)n-, a m= 0. 12. Соединение по п. 11, где R и R’ представляют водород. 13. Соединение по п. 12, где n= 1, причем указанное соединение является 1-(бензофуразан-5-илкарбонил)-1,2,3,6-тетрагидропиридином. 14. Соединение по п. 4, где R5 и R7 представляют -(CRR’)n-, а R6 представляет -С(О)-, -CRX-, СХХ’-, -О- или -S-. 15. Соединение по п. 14, где R6 представляет -СХХ’-, R и R’ представляют водород, n= 1, a X представляет фтор, причем указанное соединение является 1-(бензофуразан-5-илкарбонил)-4′, 4′-дифторпиперидином. 16. Соединение по п. 14, где R6 представляет -CRX’-, R и R’ представляют водород, а n= 1. 17. Соединение по п. 16, где указанное соединение выбирают из 1-(бензофуразан-5-илкарбонил)-4′-фторпиперидина, 1-(бензофуразан-5-илкарбонил)-4′-цианопиперидина и 1-(бензофуразан-5-илкарбонил)-4′-гидроксипиперидина. 18. Соединение по п. 14, где R6 представляет -О-, -S-или -С(О)-, n= 1, a R и R’ представляют водород, причем указанное соединение выбирают из 4-(бензофуразан-5-илкарбонил)морфолина, 4-(бензофуразан-5-илкарбонил)тиоморфолина и 4-(бензофуразан-5-илкарбонил)-4-пиперидона. 19. Соединение по п. 1, где М представляет = CR4-, где R4 и R8 вместе образуют отдельный связующий фрагмент, связывающий М с вершиной кольца 2′, причем этот связующий фрагмент представляет простую связь, -CRR’-, -CR= CR’-, -С(О)-, -О-, -S-, -NR- или -N= . 20. Соединение по п. 19, где R2 и R3 представляют -CR= . 21. Соединение по п. 20, где р= 0, R1 представляет кислород, R5 и R7 представляют -(CRR’)n-, a R6 представляет -(CRR’)m-. 22. Соединение по п. 21, где n= 1. 23. Соединение по п. 21, где связующим фрагментом является -CRR’-, -О-, -S- или -N= . 24. Соединение по п. 23, где связующим фрагментом является -О-. 25. Соединение по любому из пп. 1-24, предназначенные для использования совместно с фармацевтически приемлемым носителем для усиления АМРД рецепторных функций у млекопитающего. 26. Способ лечения расстройств памяти или других познавательных функций, вызванных гипоглутаматергическим состоянием или дефицитом количества или эффективности возбуждающих синапсов, или количества ДМРА рецепторов, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по п. 1. 27. Способ по п. 26 для лечения шизофрении или шизофренического поведения, возникающих из-за кортикал/стриарного дисбаланса, вызванного гипоглутаматергическим состоянием или дефицитом количества или эффективности возбуждающих синапсов или количества ДМРА рецепторов. 28. Соединение по п. 25, используемое для облегчения изучения поведения, зависящего от функционирования АМРА рецепторов. 29. Способ по п. 26, по которому вводят субъекту соединение по любому из пп. 2-18. 30. Способ по п. 26, где указанное соединение выбирают из группы, состоящей из: 1-(бензофуразан-5-илкарбонил)пиперидина, 1-(бензо-2,1,3-тиадиазол-5-илкарбонил)пиперидина, 1-(бензофуразан-5-илкарбонил)-4-фтор-1,2,3,6-тетрагидропиридина, 1-(бензофуразан-5-илкарбонил)-4′-фторпиперидина, 1-(бензофуразан-5-илкарбонил)-4′, 4′-дифторпиперидина, 1-(бензофуразан-5-илкарбонил)-4′-цианопиперидина, 1-(бензофуразан-5-илкарбонил)-4′-гидроксипиперидина, 4-(бензофуразан-5-илкарбонил)морфолина, 4-(бензофуразан-5-илкарбонил)тиоморфолина и 4-(бензофуразан-5-илкарбонил)-4-пиперидона. РИСУНКИ
|
||||||||||||||||||||||||||
