Патент на изобретение №2189982
|
||||||||||||||||||||||||||
(54) АЗОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОТИВОГРИБКОВАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ГРИБКОВОЙ ИНФЕКЦИИ
(57) Реферат: Описываются азольные производные общей формулы (I), где R1 представляет: I) C1-6 алкил, необязательно моно- или дизамещенный заместителями, выбранными из 2-тетрагидрофурила, C1-6 ацилокси, гидрокси, C1-6 алкоксикарбонила, бензилоксикарбонила, карбокси, C1-6 алканоиламино, бензилокси, C1-6 алкокси или 1,3-диоксолан-4-ила, который, в свою очередь, может быть замещен С1-4 алкилом; или II) 1,3-диоксан-5-ил; n равно 0 или 1; R2 представляет водород или C1-6 алкил; Х представляет галоген; Y представляет галоген; Z представляет -СН2-СН2– или -N=CH; R7, когда Z представляет группу -СН2-СН2-, представляет собой 3-4-азотсодержащий 5-членный гетероциклический остаток, необязательно замещенный C1-6 алкилом, который, в свою очередь, замещен C1-6 ацилоксигруппу; когда Z представляет группу -N=CH-, R7 представляет C1-6 алкоксигруппу, замещенную галогеном; противогрибковая фармацевтическая композиция и способ лечения грибковой инфекции. Соединения (I) обладают повышенной растворимостью в воде, проявляют улучшенное внутреннее поглощение, а следовательно, обладают хорошим действием при лечении грибковых заболеваний. 4 с. и 6 з.п.ф-лы, 5 табл., 2 ил. 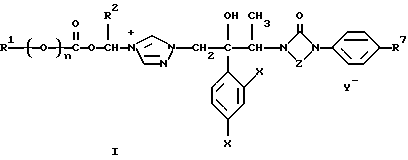
Изобретение относится к новым азольным соединениям, обладающим противогрибковым действием, их получению и применению. Предпосылки создания изобретения К настоящему времени известны различные азольные соединения, обладающие противогрибковым действием. Например, в публикации патента Японии Kokai Hei 6-293740 раскрывается азольное соединение, представленное формулой: 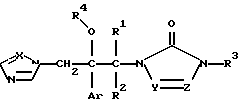 где Аr представляет замещенную фенильную группу; R1 и R2, независимо, представляют атом водорода или низшую алкильную группу, или R1 и R2 могут быть объединены вместе с образованием низшей алкиленовой группы; R3 представляет группу, связанную через атом углерода; R4 представляет атом водорода или ацильную группу; Х представляет атом азота или метиновую группу; и Y и Z, независимо, представляют атом азота или метиновую группу, которая необязательно может быть замещена низшей алкильной группой, или его соль. Публикация патента Японии Kokai Hei 8-104676 раскрывает соединение, представленное формулой: 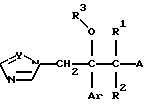 где Ar представляет необязательно замещенный фенил; R1 и R2, будучи одинаковыми или разными, представляют атом водорода или низшую алкильную группу, или R1 и R2 могут быть объединены вместе с образованием низшей алкиленовой группы; R3 представляет атом водорода или ацильную группу; Y представляет атом азота или метиновую группу; и А представляет необязательно замещенную насыщенную циклическую амидную группу, связанную через первый атом азота, и его соли. WO 9625410 A1 (соответствует публикации патента Японии Kokai No. Hei 9-183769) описывает соединение, представленное формулой: 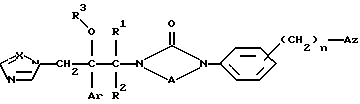 где Ar представляет необязательно замещенную фенильную группу; R1 и R2, одинаковые или различные, представляют атом водорода или низшую алкильную группу, или R1 и R2, могут быть объединены вместе с образованием низшей алкиленовой группы; R3 представляет атом водорода или ацильную группу; Х представляет атом азота или метиновую группу; А представляет Y=Z (Y и Z, одинаковые или разные, представляют атом азота или метиновую группу, необязательно замещенную низшей алкильной группой) или этиленовую группу, необязательно замещенную низшей алкильной группой; n представляет целое число от 0 до 2; и Az представляет необязательно замещенную азолильную группу, или его соль. С другой стороны, в настоящее время известен ряд соединений, относящихся к мягким лекарственным средствам, которые представляют собой производные азола (имидазола, триазола) типа четвертичных солей аммония, гидролизующихся под действием ферментов и/или неферментативно. Например, о четвертичных аммониевых солях производных 1-метилимидазола сообщалось в Journal of Medical Chemistry, Vol.23, page 469, 1980 (противомикробная активность), там же Vol. 23, 566, 1980 (противоопухолевая активность), там же Vol.23, 474, 1980 (антихолинергическая активность) и там же Vol.32, 493, 1989 (активность реактивации ацетилхолинэстеразы), и эти четвертичные соли сами по себе обладают биологической активностью, и одной из их отличительных особенностей является то, что гидролиз их протекает быстро. С другой стороны, о производных азольных соединений типа четвертичных солей аммония в качестве пролекарственного средства сообщалось только в Pharmaceutical Research, Vol.9, page 372, 1992 (противоглаукомное лекарственное средство) и в Entomologia Experimentalis et Aplicata, Vol.44, page 295, 1987 (инсектицид). Кроме того, пример применения в качестве синтетического промежуточного соединения производного имидазола типа четвертичной соли аммония, где используется его способность легко гидролизоваться, описан в Journal of Chemical Society, Perkin I, page 1341, 1979 и в New Journal of Chemistry, Vol.16, page 107, 1992. Более того, ряд производных типа четвертичных солей аммония описан в патентах США 4061722 и 4160099. Однако ранее не были известны ферментативно и/или неферментативно гидролизующиеся производные азольных соединений типа четвертичных солей, обладающие противогрибковой активностью. Обращаясь к азоловым соединениям, обладающим вышеуказанной противогрибковой активностью, следует отметить, что их растворимость в воде для применения в качестве инъекционных препаратов не всегда является достаточной, и трудно сказать, достаточна ли для проявления высокого терапевтического эффекта их всасывание внутри организма. Следовательно, было бы желательно повышение водорастворимости и всасывания внутри организма. Подробное изложение изобретения При данных обстоятельствах авторы настоящего изобретения проводили интенсивные исследования. В результате авторами настоящей заявки установлено, что производное, полученное путем кватернизации атомов азота, содержащихся в lH-имидазол-1-ильной группе или 1Н-1,2,4-триазол-1-ильной группе азольных соединений, обладает повышенной растворимостью в воде и гидролизуется ферментативно и/или неферментативно, давая соединение, имеющее 1Н-имидазол-1-ильную группу или 1H-1,2,4-триазольную группу и обладающее противогрибковой активностью. Таким образом, настоящее изобретение осуществлено на основе этих результатов. А именно, настоящее изобретение относится к кватернизированному азотсодержащему имидазол-1-ильному или 1,2,4-триазол-1-ильному соединению, в котором один из атомов азота, составляющих азольное кольцо, кватернизирован заместителем, способным отщепляться in vivo, и при отщеплении заместителя исходное соединение превращается в противогрибковое азольное соединение; к способу его получения и к фармацевтической композиции, содержащей соединение. Вышеуказанное “кватернизированное азотсодержащее имидазол-1-ильное или 1,2,4-триазол-1-ильное соединение, в котором один из атомов азота, составляющих азольное кольцо, кватернизирован заместителем, способным отщепляться in vivo, и при отщеплении заместителя исходное соединение преобразуется в противогрибковое азольное соединение [далее, иногда, называемое соединением (I)] ” представляет собой соединение, содержащее в молекуле группу имидазол-1-ила или 1,2,4-триазол-1-ила, в которой атом азота кватернизирован за счет наличия заместителя у атома азота в 3-положении имидазол-1-ильной группы и атома азота во 2- или 4-положении 1,2,4-триазол-1-ильной группы, и заместитель гидролизуется in vivo с отщеплением, таким образом соединение превращается в соединение, содержащее группу имидазол-1-ила или группу 1,2,4-триазол-1-ила, не содержащую кватернизированного атома азота и обладающее противогрибковым действием. Примеры такого соединения включают соединение, представленное формулой: 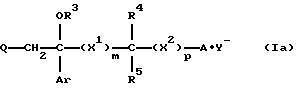 где Q представляет группу имидазол-1-ила или 1,2,4-триазол-1-ила, в которой один из атомов азота, составляющих азольное кольцо, кватернизирован заместителем, способным отщепляться in vivo; Ar представляет необязательно замещенную фенильную группу; А представляет необязательное замещенную углеводородную группу или необязательно замещенную гетероциклическую группу; X1 представляет атом кислорода или метиленовую группу; X2 представляет необязательно окисленный атом серы; тир, соответственно, представляют 0 или 1; Y– представляет анион; и (1) R3, R4 и R5 могут быть одинаковыми или разными и представляют атом водорода или низшую алкильную группу, или (2) R3 представляет атом водорода или низшую алкильную группу, и R4 и R5 объединены друг с другом, представляя низшую алкиленовую группу, или (3) R5 представляет атом водорода или низшую алкильную группу, и R3 и R4 объединены друг с другом, представляя низшую алкиленовую группу, или его соль [далее упоминаемое иногда как соединение (Ia)]. “Заместитель, способный отщепляться in vivo” в “группе имидазол-1-ила или 1,2,4-триазол-1-ила, в которой один из атомов азота, составляющих азольное кольцо, кватернизирован заместителем, способным отщепляться in vivo”, представленный Q, может быть любой группой, которая отщепляется in vivo, и группа, обозначенная Q, включает группы, представленные формулой (II): 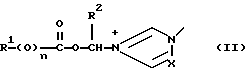 где R1 представляет необязательно замещенную углеводородную группу или гетероциклическую группу; R2 представляет атом водорода или низшую алкильную группу; Х представляет атом азота или метиновую группу; и n представляет 0 или 1. Примеры “углеводородной группы” в “необязательно замещенной углеводородной группе”, представленной R1, включают алифатическую углеводородную группу, ароматическую углеводородную группу и ароматически-алифатическую углеводородную группу. Примеры алифатической углеводородной группы включают алкильную группу, циклоалкильную группу, циклоалкилалкильную группу, алкенильную группу и алкинильную группу. Примеры алкильной группы включают линейную или разветвленную алкильную группу, имеющую от 1 до 20 атомов углерода, такую как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил и т.д., и среди них низшая алкильная группа, имеющая от 1 до 6 атомов углерода (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, и т. д.), является особенно предпочтительной. Примеры циклоалкильной группы включают циклоалкильную группу, имеющую от 3 до 10 атомов углерода, такую как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, адамантил и т. д. , и среди них циклоалкильная группа, имеющая от 3 до 5 атомов углерода (например, циклопропил, циклобутил, циклопентил, циклогексил и т.д.), является особенно предпочтительной. Примеры циклоалкилалкильной группы включают группы, имеющие от 4 до 12 атомов углерода, такие как циклопропилметил, циклопентилметил, циклогексилметил и т.д., и среди них циклоалкилалкильная группа, имеющая от 6 до 8 атомов углерода (например, циклопентилметил, циклогексилметил и т.д.), является особенно предпочтительной. Примеры алкенильной группы включают группы, имеющие от 2 до 4 атомов углерода, такие как винил, пропенил, бутенил и т. д. , и среди них алкенильная группа, имеющая 2-3 атома углерода (например, винил, пропенил), является особенно предпочтительной. Примеры алкинильной группы включают группы, имеющие от 2 до 4 атомов углерода, такие как этинил, пропинил, бутинил и т.д., и среди них алкинильная группа, имеющая 2-3 атома углерода (например, этинил, пропинил), является особенно предпочтительной. Примеры ароматической углеводородной группы включают группы, имеющие от 6 до 14 атомов углерода, такие как фенил, нафтил, бифенилил, антрил, инденил и т. д. , и среди них арильная группа, имеющая от 6 до 10 атомов углерода (например, фенил, нафтил и т.д.) является особенно предпочтительной. Примеры ароматически-алифатической углеводородной группы включают аралкильные группы, имеющие от 7 до 15 атомов углерода, такие как бензил, фенетил, фенилпропил, нафтилметил, инданил, инданилметил, 1,2,3,4-тетрагидронафтил, 1,2,3,4-тетрагидронафтилметил и т. д. , и среди них аралкильная группа, имеющая от 7 до 11 атомов углерода (например, бензил, фенетил, нафтил-метил и т.д.), является особенно предпочтительной. “Гетероциклическая группа” в “необязательно замещенной гетероциклической группе”, представленной R1, является группой, полученной при удалении одного атома водорода, связанного с гетероциклическим кольцом, и такое гетероциклическое кольцо представляет собой 5-8-членное кольцо, содержащее 1 или несколько, предпочтительно от 1 до 4 гетероатомов (например, атом азота (необязательно окисленный), атом кислорода, атом серы и т.д.), или их конденсированное кольцо. Конкретные примеры гетероциклической кольцевой группы включают пирролил, пиразолил, имидазолил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, фурил, тиенил, оксазолил, изоксазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, тиазолил, изотиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, пирролидинил, пиридил, пиридазинил, пиримидинил, пиразинил, пиперидинил, пиперазинил, индолил, пиранил, тиопиранил, диоксинил, диоксолил, хинолил, пиридо[2,3-d]пиримидил, 1,5-, 1,6-, 1,7-, 1,8-, 2,6- или 2,7-нафтиридинил, тиено[2,3-d] пиридил, бензопиранил, тетрагидрофурил, тетрагидропиранил, диоксоланил, диоксанил и тому подобные. Примеры заместителей в “необязательно замещенной углеводородной группе” и “необязательно замещенной гетероциклической группе”, представленных R1, включают гетероциклическую группу, оксогруппу, гидроксигруппу, C1-6 алкоксигруппу, С3-10 циклоалкилоксигруппу, C6-10 арилоксигруппу, C7-19 аралкилоксигруппу, гетероциклическое кольцо-оксигруппу, меркаптогруппу, C1-6 алкилтиогруппу (атом серы может быть окисленным), С3-10 циклоалкилтиогруппу (атом серы может быть окисленным), С6-10 арилтиогруппу (атом серы может быть окисленным), C7-19 аралкилтиогруппу (атом серы может быть окисленным), гетероциклическое кольцо-тиогруппу, гетероциклическое кольцо-сульфинилгруппу, гетероциклическое кольцо-сульфонилгруппу, аминогруппу, моно-C1-6 киламиногруппу, ди-С1-6 алкиламиногруппу, три-С1-6 алкиламмониогруппу, С3-10 циклоалкиламиногруппу, С6-10 ариламиногруппу, C7-19 аралкиламиногруппу, гетероциклическое кольцо-аминогруппу, циклическую аминогруппу, нитрогруппу, атом галогена, цианогруппу, карбоксильную группу, C1-10 алкоксикарбонильную группу, С6-10 арилоксикарбонильную группу, C7-19 аралкилоксикарбонильную группу, С6-10 арилкарбонильную группу, C1-6 алканоилгруппу, С3-5 алкеноилгруппу, С6-10 арилкарбонилоксигруппу, С2-6 алканоилоксигруппу, С3-5 алкеноилоксигруппу, необязательно замещенную карбамоильную группу, необязательно замещенную тиокарбамоильную группу, необязательно замещенную карбамоилоксигруппу, C1-6 алканоиламиногруппу, С6-10 арилкарбониламино группу, C1-10 алкоксикарбоксамидогруппу, С6-10 арилоксикарбоксамидогруппу, C7-19 аралкилоксикарбоксамидогруппу, C1-10 алкоксикарбонилоксигруппу, С6-10 арилоксикарбонилоксигруппу, C7-19 аралкилоксикарбонилоксигруппу, С3-10 циклоалкилоксикарбонилоксигруппу, необязательно замещенную уреидогруппу и т. д., и они могут быть одинаковыми или различными, и может присутствовать от 1 до 4 заместителей. Примеры “C1-6 алкоксигруппы” включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, н-пентилокси, н-гексилокси и т.д.; примеры “С3-10 циклоалкилоксигруппы” включают циклопропилокси, циклогексилокси и т.д.; примеры “С6-10 арилоксигруппы” включают фенокси, нафтилокси и т.д.; примеры “C7-19 аралкилоксигруппы” включают бензилокси, 1-фенилэтилокси, 2-фенилэтилокси, бензгидрилокси и т. д.; примеры “C1-6 алкилтиогруппы (атом серы может быть окисленным) ” включают метилтио, этилтио, н-пропилтио, н-бутилтио, метилсульфинил, метилсульфонил и т.д.; примеры “С3-10 циклоалкилтиогруппы (атом серы может быть окисленным)” включают циклопропилтио, циклогексилтио, циклопентилсульфинил, циклогексилсульфонил и т.д.; примеры “С6-10 арилтиогруппы (атом серы может быть окисленным)” включают фенилтио, нафтилтио, фенилсульфинил, фенилсульфонил и т.д.; примеры “С7-19 аралкилтиогруппы (атом серы может быть окисленным)” включают бензилтио, фенилэтилтио, бензгидрилтио, бензилсульфинил, бензилсульфонил и т.д.; примеры “моно-С1-6 алкиламиногруппы” включают метиламино, этиламино, н-пропиламино, н-бутиламино и т.д.; примеры “ди-С1-6 алкиламиногруппы” включают диметиламино, диэтиламино, метилэтиламино, ди(н-пропил)амино, ди(н-бутил)амино и т.д.; примеры “три-С1-6 алкиламмониогруппы” включают триметиламмонио и т. д.; примеры “С3-10 циклоалкиламиногруппы” включают циклопропиламино, циклопентиламино, циклогексиламино и т.д.; примеры “С6-10 ариламиногруппы” включают анилино, N-метиланилино и т.д.; примеры “C7-19 аралкиламиногруппы” включают бензиламино, 1-фенилэтиламино, 2-фенилэтиламино, бензгидриламино и т.д.; примеры “циклической аминогруппы” включают 1-пирролидинил, пиперидино, 1-пиперазинил, морфолино, тиоморфолино и т.д.; примеры “атома галогена включают фтор, хлор, бром, иод и т.д.; примеры “C1-10 алкоксикарбонильной группы” включают метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, трет-бутоксикарбонил, циклопентилоксикарбонил, циклогексилоксикарбонил, норборнилоксикарбонил и т. д. ; “С6-10 арилоксикарбонильная группа” включает феноксикарбонил, нафтилоксикарбонил и т.д.; примеры “C7-19 аралкилкарбонильной группы” включают бензилоксикарбонил, бензгидрилоксикарбонил и т. д. ; примеры “С6-10 арилкарбонильной группы” включают бензоил, нафтоил, фенилацетил и т.д.; примеры “C1-6 алканоилгруппы” включают формил, ацетил, пропионил, бутирил, валерил, пивалоил и т.д.; примеры “С3-5 алкеноилгруппы” включают акрилоил, кротоноил и т.д.; примеры “С6-10 арилкарбонилоксигруппы” включают бензоилокси, нафтоилокси, фенилацетокси и т.д.; примеры “С2-6 алканоилоксигруппы” включают ацетокси, пропионилокси, бутирилокси, валерилокси, пивалоилокси и т.д.; примеры “С3-5 алкеноилоксигруппы” включают акрилоилокси, кротоноилокси и т. д.; примеры “необязательно замещенной карбамоильной группы” включают карбамоильную группу, которая может быть замещена одним или двумя заместителями, выбранными из C1-4 алкильной группы (например, метил, этил и т.д.), фенильной группы, C1-7 ацильной группы (например, ацетил, пропионил, бензоил и т.д.) и C1-4 алкоксифенильной группы (например, метоксифенил и т.д.) и циклическую аминокарбонильную группу, и ее конкретные примеры включают карбамоил, N-метилкарбамоил, N-этилкарбамоил, N,N-диметилкарбамоил, N,N-диэтилкарбамоил, N-фенилкарбамоил, N-ацетилкарбамоил, N-бензоилкарбамоил, N-(п-метоксифенил)карбамоил, 1-пирролидинилкарбонил, пиперидинокарбонил, 1-пиперазинилкарбонил, морфолинокарбонил и т.д.; примеры “необязательно замещенной тиокарбамоильной группы” включают тиокарбамоильную группу, которая может быть замещена одним или двумя заместителями, выбранными из C1-4 алкильной группы (например, метил, этил и т.д.) и фенильной группы, и ее конкретные примеры включают тиокарбамоил, N-метилтиокарбамоил, N-фенилтиокарбамоил и т.д.; примеры “необязательно замещенной карбамоилоксигруппы” включают карбамоилоксигруппы, которые могут быть замещены одним или двумя заместителями, выбранными из C1-4 алкильной группы (например, метил, этил и т.д.) и фенильной группы, и их конкретные примеры включают карбамоилокси, N-метилкарбамоилокси, N,N-диметилкарбамоилокси, N-этилкарбамоилокси, N-фенилкарбамоилокси и т.д.; примеры “C1-6 алканоиламиногруппы” включают ацетамидо, пропионамидо, бутирамидо, валеламидо, пивальамидо и т.д.; примеры “C6-10 арилкарбониламиногруппы” включают бензамидо, нафтамидо, фталимидо и т.д.; примеры “C1-10 алкоксикарбоксамидогруппы” включают метоксикарбоксамидо (СН3ОСОNН-), этоксикарбоксамидо, трет-бутоксикарбоксамидо и т.д.; примеры “С6-10 арилоксикарбоксамидогруппы” включают феноксикарбоксамидо (C6H5OCONH-) и т.д.; примеры “С7-10 аралкилоксикарбоксамидогруппы” включают бензилоксикарбоксамидо (C6H5CH2OCONH-), бензгидрилоксикарбоксамидо и т.д.; примеры “C1-10 алкоксикарбонилоксигруппы” включают метоксикарбонилокси, этоксикарбонилокси, н-пропоксикарбонилокси, изопропоксикарбонилокси, н-бутоксикарбонилокси, трет-бутоксикарбонилокси, н-пентилоксикарбонилокси, н-гексилдоксикарбонилокси и т. д. ; примеры “С6-10 арилоксикарбонилокси группы” включают феноксикарбонилокси, нафтилоксикарбонилокси и т.д.; примеры “C7-19 аралкилоксикарбонилокси группы” включают бензилоксикарбонилокси, 1-фенилэтилоксикарбонилокси, 2-фенилэтилоксикарбонилокси, бензгидрилоксикарбонилокси и т.д.; примеры “С3-10 циклоалкилоксикарбонилокси группы” включают циклопропилоксикарбонилокси, циклогексилоксикарбонилокси и т.д.; и примеры “необязательно замещенной уреидогруппы” включают иреидогруппу, которая может быть замещены 1-3 заместителями, выбранными из C1-4 алкильной группы (например, метил, этил и т.д.), фенильной группы и т.д., и ее конкретные примеры включают уреидо, 1-метилуреидо, 3-метилуреидо, 3,3-диметилуреидо, 1,3-диметилуреидо, 3-фенилуреидо и т.д. В дополнение к описанному выше в качестве заместителя “необязательно замещенной гетероциклической группы”, представленного R1, используют, например, C1-6 алкильную группу, С3-6 циклоалкильную группу, С4-7 циклоалкилалкильную группу, С2-3 алкенильную группу, С2-3 алкинильную группу, С6-10 арильную группу, С7-11 аралкильную группу и т.д. Примеры “C1-6 алкильной группы” включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и т.д.; примеры “С3-6 циклоалкильной группы” включают циклопропил, циклобутил, циклопентил, циклогексил и т.д.; примеры “С4-7 циклоалкилалкильной группы” включают циклопропилметил, циклопентилметил и т.д.; примеры “С2-3 алкенильной группы” включают винил, пропенил и т.д.; примеры “С2-3 алкинильной группы” включают этинил, пропинил и т. д. ; примеры “С6-10 арильной группы” включают фенил, нафтил и т.д.; и примеры “С7-11 аралкильной группы” включают бензил, фенетил, нафтилметил и т.д. Число этих заместителей в “необязательно замещенной углеводородной группе” и “необязательно замещенной гетероциклической группе”, представленной R1, не ограничено одним заместителем, и заместители могут быть одинаковыми или различными, если имеется несколько (2-4) заместителей. Гетероциклическая группа в заместителе “углеводородной группы” и “гетероциклической группы” и гетероциклическая группа в гетероциклическое кольцо-оксигруппе, гетероциклическое кольцо-тиогруппе, гетероциклическое кольцо-сульфинилгруппе, гетероциклическое кольцо-сульфонилгруппе и гетероциклическое кольцо-аминогруппе, соответственно, представляют собой группу, полученную удалением одного из атомов водорода, связанных с гетероциклическим кольцом, и такое гетероциклическое кольцо представляет собой 5-8-членное кольцо, содержащее от 1 до нескольких, предпочтительно от 1 до 4 гетероатомов (например, атом азота (необязательно окисленный), атом кислорода, атом серы и т.д.), или их конденсированное кольцо. Примеры гетероциклической группы включают пирролил, пиразолил, имидазолил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, фурил, тиенил, оксазолил, изоксазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, тиазолил, изотиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, пирролидинил, пиридил, пиридазинил, пиримидинил, пиразинил, пиперидинил, пиперазинил, индолил, пиранил, тиопиранил, диоксинил, диоксолил, хинолил, пиридо[2,3-d]пиримидил, 1,5-, 1,6-, 1,7-, 1,8-, 2,6- или 2,7-нафтиридинил, тиено[2,3-d]пиридил, бензопиранил, тетрагидрофурил, тетрагидропиранил, диоксоланил, диоксанил и т.д. Эти гетероциклические группы могут быть замещены 1-3 заместителями, выбранными из C1-4 алкильной группы (например, метил, этил и т.д. ), гидроксильной группы, оксогруппы и C1-4 алкоксигруппы (например, метокси, этокси и т.д.). В необязательно замещенной углеводородной группе или гетероциклической группе, представленных R1, в качестве “необязательно замещенной углеводородной группы” предпочтительной является C1-6 алкильная группа (примеры C1-6 алкильной группы включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил и т.д.), которая может быть замещена 1-3 заместителями, выбранными из гидроксила, C1-6 алкоксигруппы, С7-19 аралкилоксигруппы, C1-6 алкилтиогруппы, C1-6 алкилсульфонила, C1-6 алканоиламиногруппы, C1-10 алкоксикарбонильной группы, C7-19 аралкилоксикарбонильной группы, необязательно замещенной карбамоильной группы, C1-10 алкоксикарбоксамидо, С7-10 аралкилоксикарбоксамидо и гетероциклической группы (необязательно замещенной), и конкретные примеры ее включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, метоксиметил, этоксиметил, 1-метоксиэтил, 2-метоксиэтил, 1-этоксиэтил, 2-этоксиэтил, 2-бензилоксиэтил, 3-бензилоксипропил, 1,3-дибензилокси-2-пропил, гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 3-гидроксипропил, 2,3-дигидроксипропил, 1,3-дигидрокси-2-пропил, метилтиометил, метилсульфонилэтил, ацетамидометил, 1-ацетамидоэтил, 2-ацетамидоэтил, метоксикарбонилметил, этоксикарбонилметил, трет-бутоксикарбонилметил, 1-этоксикарбонилэтил, 2-этоксикарбонилэтил, 1-метоксикарбонил-1-метилэтил, 1-этоксикарбонил-1-метилэтил, 1-трет-бутоксикарбонил-1-метилэтил, 1-бензилоксикарбонилэтил, 1-бензилоксикарбонил-1-метилэтил, карбамоилметил, N,N-диметилкарбамоилметил, метоксикарбоксамидометил, этоксикарбоксамидометил, трет-бутоксикарбоксамидометил, бензилоксикарбоксамидометил, 2-этоксикарбоксамидоэтил, 2-фурилметил, 2-тетрагидрофурилметил, 1,3-диоксолан-2-илметил, 1,3-диоксолан-4-илметил, 2-оксо-1,3-диоксолан-4-илметил, 2,2-диметил-1,3-диоксолан-4-илметил, 1,3-диоксан-5-илметил, 1-этоксикарбонил-1-(2,3,4-тригидроксифенил)метил, 1-ацетамидо-2-этоксикарбонил, 1-ацетамидо-3-этоксикарбонилпропил, 2-ацетамидо-2-этоксикарбонилэтил, 3-ацетамидо-3-этоксикарбонилпропил, 1-ацетамидо-2-карбамоилэтил, 1-ацетамидо-3-карбамоилпропил и т.д. В ряду вышеуказанных C1-6 алкильных групп, которые могут быть замещены 1-3 заместителями, наиболее предпочтительные группы представляют собой линейные или разветвленные C1-4 алкильные группы, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил и т.д.; и линейные или разветвленные C1-4 алкильные группы, замещенные гидроксильной группой, C1-6 алкоксигруппой, C1-10 алкоксикарбонильной группой, гетероциклической группой (необязательно замещенной) и т.д., такие как 2-гидроксиэтил, 3-гидроксипропил, 2,3-дигидроксипропил, 1,3-дигидрокси-2-пропил, 2-метоксиэтил, 2-этоксиэтил, 3-бензилоксипропил, этоксикарбонилметил, 1-этоксикарбонилэтил, 1-бензилоксикарбонилэтил, 2-фурилметил, 2-тетрагидрофурилметил, 1,3-диоксолан-4-илметил, 2-оксо-1,3-диоксолан-4-илметил, 2,2-диметил-1,3-диоксолан-4-илметил и т.д. В необязательно замещенной углеводородной группе или гетероциклической группе, представленных R1, в качестве “необязательно замещенной гетероциклической группы” предпочтительной является гетероциклическая группа, замещенная 1-3 заместителями, выбранными из оксогруппы, гидроксильной группы, C1-6 алкильной группы, C1-6 алкоксигруппы и т.д., и конкретные ее примеры включают фурил, тиенил, пиранил, тиопиранил, диоксинил, диоксолил, бензопиранил, тетрагидрофурил, тетрагидропиранил, диоксоланил, диоксанил, метилфурил, гидроксифурил, метилтиенил, метоксифурил, 2-оксо-1,3-диоксолил, 2,2-диметил-1,3-диоксолил, 2-оксо-1,3-диоксоланил, 2,2-диметил-1,3-диоксоланил, 2-оксо-1,3-диоксанил, 2,2-диметил-1,3-диоксанил и т.д. Среди них фурил, тиенил, диоксанил, 2-оксо-1,3-диоксанил, 2,2-диметил-1,3-диоксанил являются особенно предпочтительными. Примеры низшей алкильной группы, представленной R2, включают низшую алкильную группу, имеющую 1-4 атома углерода (например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил и т.д.), и метил является особенно предпочтительным. В качестве R2 особенно предпочтительными являются атом водорода или метил. Х представляет атом азота или метиновую группу, и предпочтительным является атом азота. Примеры необязательно окисленного атома серы, представленного X2, включают тио, сульфинил и сульфонил. m и р соответственно представляют целое число, равное 0 или 1, и предпочтительным является случай, когда оба из них равны 0. Примеры заместителя в “необязательно замещенной фенильной группе”, представленной Аr, включают галоген (например, фтор, хлор, бром, иод и т.д.), галогенированную низшую (C1-4) алкильную группу (например, фторметил, трифторметил, хлорметил, 1-фторэтил, 2-фторэтил, 1,1-дифторэтил, 1,2-дифторэтил и т.д.) и галогенированную низшую (C1-4) алкоксигруппу (например, фторметокси, трифторметокси, хлорметокси, 1-фторэтокси, 2-фторэтокси, 1,1-дифторэтокси, 1,2-дифторэтокси, 1,1,2,2-тетрафторэтокси, 2,2,2-трифторэтокси, 2,2,3,3-тетрафторпропокси, 2,2,3,3,3-пентафторпропокси и т.д.). Предпочтительно заместитель представляет галоген (например, фтор, хлор, бром, иод и т. д.) и наиболее предпочтителен фтор. Число заместителей предпочтительно составляет от 1 до 3, более предпочтительно от 1 до 2. Предпочтительные примеры Аr включают галогенфенильную группу, (галогенированный низший (C1-4) алкил)фенильную группу, (галогенированный низший (C1-4) алкокси) фенильную группу и т.д. Примеры галогенфенильной группы включают 2,4-дифторфенил, 2,4-диихлорфенил, 4-хлорфенил, 4-фторфенил, 2-хлорфенил, 2-фторфенил, 2-фтор-4-хлорфенил, 2-хлор-4-фторфенил, 2,4,6-трифторфенил, 4-бромфенил и т.д. Примеры (галогенированный низший (C1-4) алкил) фенильной группы включают 4-трифторметилфенил и т.д. Примеры (галогенированный низший (C1-4) алкокси) фенильной группы включают 4-трифторметоксифенил, 4-(1,1,2,2-тетрафторэтокси)фенил, 4-(2,2,2-трифтроэтокси)фенил, 4-(2,2,3,3-тетрафторпропокси) фенил, 4- (2,2,3,3,3-пентафторпропокси)фенил и т.д. Особенно предпочтительными примерами Аr является фенильная группа, замещенная 1-2 галогенами, такая как 2,4-дифторфенил, 2,4-дихлорфенил, 4-хлорфенил, 4-фторфенил, 2-хлорфенил, 2-фторфенил, 2-фтор-4-хлорфенил, 2-хлор-4-фторфенил, 4-бромфенил и т.д. Среди них фенильная группа, замещенная 1-2 атомами фтора, такая как 4-фторфенил, 2-фторфенил, 2,4-дифторфенил и т. д. является особенно предпочтительной и наиболее предпочтительны 2-фторфенил и 2,4-дифторфенил. Анион, представленный Y–, является анионом, полученным за счет удаления одного протона от органической кислоты или неорганической кислоты, и примеры органической кислоты включают уксусную кислоту, пропионовую кислоту, метансульфоновую кислоту, бензолсульфоновую кислоту, толуолсульфоновую кислоту, трифторметансульфоновую кислоту, трифторуксусную кислоту и т.д., и примеры неорганической кислоты включают хлористоводородную (соляную) кислоту, серную кислоту, фосфорную кислоту, фтористоводородную кислоту, бромистоводородную кислоту, иодистоводородную кислоту, воду и т.д. В качестве Y– анион, полученный в результате удаления одного протона из неорганической кислоты, является предпочтительным. Среди них анион, полученный в результате удаления одного протона из галогенводородных кислот, таких как хлористоводородная кислота, фтористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота и т.д., является предпочтительным, и анион, полученный за счет удаления одного протона из хлористоводородной кислоты, бромистоводородной кислоты, иодистоводородной кислоты и т.д. является особенно предпочтительным. Y– может быть определен как группа, имеющая отрицательный заряд, и ее предпочтительные примеры включают Сl–, F–, Br–, I–, НSО3 –, HSO4 –, Н2РO4 –, ОН– и т.д. Среди них Сl–, F–, Br–, I– являются предпочтительными и Сl–, Вr– и I– являются особенно предпочтительными. Примеры низшей алкильной группы, представленной R3, R4 и R5, включают линейные или разветвленные алкильные группы, имеющие от 1 до 4 атомов углерода, такие как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил и т.д. Среди них метил является особенно предпочтительным. Когда R3 и R4 или R4 и R5 объединены с образованием низшей алкиленовой группы, примеры низшей алкиленовой группы включают те, которые имеют от 1 до 4 атомов углерода, такие как метилен, этилен, пропилен, бутилен и т.д. Когда R3 и R4 объединены с образованием низшей алкиленовой группы, метилен и этилен являются предпочтительными. Когда R4 и R5 объединены с образованием низшей алкиленовой группы, этилен является предпочтительным. R3 предпочтительно представляет атом водорода. Предпочтительно, R4 и R5 одновременно представляют атомы водорода или метильные группы, или один из них представляет атом водорода, а другой представляет метильную группу. Более предпочтительно, один из R4 и R5 представляет атом водорода, а второй представляет метил. Примеры “необязательно замещенной углеводородной группы” или “необязательно замещенной гетероциклической группы”, представленные А, включают такие же группы, как описанные для R1. Предпочтительно А представляет группу формулы: 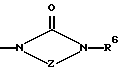 где R6 представляет необязательно замещенную углеводородную группу или ароматическую гетероциклическую группу; и Z представляет необязательно замещенную низшую алкиленовую группу или группу формулы: -D=E-, где D и Е могут быть одинаковыми или различными и представляют атом азота или метиновую группу, которая может быть замещена низшим алкилом)). Примеры углеводородной группы в “необязательно замещенной углеводородной группе”, представленной R6, включают алифатическую углеводородную группу, ароматическую углеводородную группу и ароматически-алифатическую углеводородную группу. Примеры алифатической углеводородной группы включают группы алкила, циклоалкила, алкенила, алкинила и т.д. Примеры алкильных групп включают линейные или разветвленные группы, имеющие от 1 до 12 атомов углерода. Конкретные примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, гептил, октил, нонил, децил, додецил и т.д. Среди них низшие алкильные группы, имеющие от 1 до 4 атомов углерода (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и т.д.), являются особенно предпочтительными. Примеры циклоалкильных групп включают циклоалкильные группы, имеющие от 3 до 8 атомов углерода. Их конкретные примеры включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.д. Среди них циклоалкильная группа, имеющая от 3 до 6 атомов углерода (например, циклопропил, циклобутил, циклопентил, циклогексил и т.д.), является особенно предпочтительной. Примеры алкенильной группы включают алкенильную группу, имеющую от 2 до 4 атомов углерода. Конкретные примеры включают винил, пропенил, бутенил и т.д. Среди них алкенильная группа, имеющая 2-3 атома углерода (например, винил, пропенил и т.д.), является особенно предпочтительной. Примеры алкинильной группы включают алкинильную группу, имеющую от 2 до 4 атомов углерода. Конкретные примеры включают этинил, пропинил, бутинил и т. д. Среди них алкинильная группа, имеющая 2-3 атома углерода (например, этинил, пропинил и т.д.), является особенно предпочтительной. Примеры ароматической углеводородной группы включают арильную группу, имеющую от 6 до 14 атомов углерода. Примеры арильной группы включают фенил, нафтил, бифенилил, антрил, инденил и т.д. Среди них арильная группа, имеющая от 6 до 10 атомов углерода (например, фенил, нафтил и т.д.), является особенно предпочтительной. Примеры ароматически-алифатической углеводородной группы включают арилалкильную группу, имеющую от 7 до 15 атомов углерода. Конкретные примеры включают бензил, фенетил, фенилпропил, нафтилметил, инданил, инданилметил, 1,2,3,4-тетрагидронафтил, 1,2,3,4-тетрагидронафтилметил, бифенилилметил, бензгидрил и т. д. Среди них аралкильная группа, имеющая от 7 до 11 атомов углерода (например, бензил, фенетил, нафтилметил и т.д.), является особенно предпочтительной. Примеры ароматической гетероциклической группы в “ароматической гетероциклической группе, которая может иметь заместитель”, представленной R6, включают ароматическую гетероциклическую группу, содержащую по крайней мере один гетероатом, выбранный из атома азота, атома серы и атома кислорода. Ароматическая гетероциклическая группа может быть сконденсированной с бензольным кольцом или 5- или 6-членным гетероциклическим кольцом. Примеры ароматической гетероциклической группы включают ароматические гетероциклические группы, такие как имидазолил, тиазолил, тетразолил, пиразолил, придил, тиазолил, тиадиазолил, тиенил, фурил, пирролил, пиразинил, пиримидинил, оксазолил, изооксазолил и т.д.; и конденсированные ароматические гетероциклические группы, такие как бензимидазолил, имидазопиримидинил, имидазопиридинил, имидазопиразинил, имидазопиридазинил, бензотиазолил, хинолил, изохинолил, хиназолинил, индолил и т.д. В качестве ароматической гетероциклической группы особенно предпочтительна 5-или 6-членная ароматическая гетероциклическая группа, содержащая от 1 до 3 гетероатомов, выбранных необязательно из атома азота, атома серы и атома кислорода (например, имидазолил, триазолил, тиазолил, тиадиазолил, тиенил, фурил, пиридил, пиримидинил и т.д.). Примеры заместителя в “алифатической ароматической или ароматически-алифатической углеводородной группе, которая может иметь заместитель или ароматической гетероциклической группе, которая может иметь заместитель”, представленных R6, включают гидроксильную группу, необязательно этерифицированную карбоксильную группу (например, карбоксил, алкоксикарбонил, имеющий от 1 до 6 атомов углерода, такой как метоксикарбонил, этоксикарбонил, бутоксикарбонил и т.д.), нитрогруппу, аминогруппу, ациламиногруппу (например, алканоиламино, имеющий от 1 до 10 атомов углерода, такой как ацетиламино, пропиониламино, бутириламино и т.д.), аминогруппу, которая моно- или дизамещена алкильной группой, имеющей от 1 до 10 атомов углерода (например, метиламино, диметиламино, диэтиламино, дибутиламино и т.д.), необязательно замещенную 5-6-членную циклическую аминогруппу (например, пирролидинил, морфолино, пиперидино, пиразолидинил, пергидроазепинил, пиперазинил, 4-бензилпиперазинил, 4-ацетилпиперазинил, 4-(4-трифторметоксифенил)-1-пиперазинил, 4-[4-(1,1,2,2-тетрафторэтокси)фенил] -1-пиперазинил, 4-[4-(2,2,3,3- тетрафторпропокси)фенил]-1-пиперазинил, 4-[4-(2,2,2-трифторэтокси)фенил] -1-пиперазинил, 4-[4-(2,2,3,3,3-пентафторпропокси)фенил] -1-пиперазинил, 4-(4-трифторметилфенил)-4-пиперазинил и т.д.), алкоксигруппу, имеющую от 1 до 6 атомов углерода (например, метокси, этокси, пропокси, бутокси и т.д.), атом галогена (например, фтор, хлор, бром и т. д. ), алкильную группу, имеющую от 1 до 6 атомов углерода (например, метил, пропил, бутил и т. д. ), циклоалкильную группу, имеющую от 3 до 6 атомов углерода (например, циклопропил, циклопентил и т.д.), галогеналкильную группу, имеющую от 1 до 6 атомов углерода (например, трифторметил, дихлорметил, трифторэтил и т.д.), галогеналкоксигруппу, имеющую от 1 до 6 атомов углерода (например, трифторметокси, 1,1,2,2-тетрафторэтокси, 2,2,2-трифторэтокси, 2,2,3,3-тетрафторпропокси, 2,2,3,3,3-пентафторпропокси, 2,2,3,3,4,4,5,5-октафторпентокси, 2-фторэтокси и т.д.), оксогруппу, тиооксогруппу, меркаптогруппу, алкилтиогруппу, имеющую от 1 до 6 атомов углерода (например, метилтио, этилтио, бутилтио и т.д.), алкилсульфонильную группу, имеющую от 1 до 6 атомов углерода (например, метансульфонил, этансульфонил, бутансульфонил и т.д.), алканоильную группу, имеющую от 1 до 10 атомов углерода (например, ацетил, формил, пропионил, бутирил и т. д. ), 5- или 6-членную ароматическую гетероциклическую группу (например, пирролил, пиразолил, имидазолил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, фуразанил, 1,3,4-тиадиазолил, 1,2,3-тиадиазолил, 1,2,5-тиадиазолил, 1,2,4-тиадиазолил, тиенил, фурил, пиридил, пиримидинил, пиридазинил и т.д.) и конденсированную ароматическую гетероциклическую группу (например, бензимидазолил, имидазопиримидинил, имидазопиридинил, имидазопиразинил, имидазопиридазинил, бензотиазолил, хинолил, изохинолил, хиназолил, индолил и т. д. ). Среди них галогеналкоксигруппа, имеющая от 1 до 6 атомов углерода и 5-членная ароматическая гетероциклическая группа являются предпочтительными, и 1,1,2,2-тетрафторэтокси, 2,2,3,3-тетрафторпропокси, пиразолил (например, 1H-пиразол-1-ил), имидазолил (например, 1Н-имидазол-1-ил), 1,2,3-триазолил (например, 1Н-1,2,3-триазол-1-ил, 2Н-1,2,3-триазол-2-ил), 1,2,4-триазолил (например, 1Н-1,2,4-триазол-1-ил), тетразолил (например, 1Н-тетразол-1-ил, 2Н-тетразол-2-ил) являются особенно предпочтительными. Число вышеуказанных заместителей предпочтительно составляет от 1 до 3, более предпочтительно от 1 до 2. Алифатические, ароматические или ароматически-алифатические углеводородные группы, которые могут иметь заместитель, или ароматическая гетероциклическая группа, которая может иметь заместитель, представленные R6, предпочтительно представляют собой ароматическую углеводородную группу, которая может иметь заместитель, более предпочтительно, фенильную группу, имеющую заместитель. Среди них особенно предпочтительными являются фенильная группа, замещенная галогеналкокси группой, имеющей от 1 до 6 атомов углерода (например, 4-(1,1,2,2-тетрафторэтокси)фенил, 4-(2,2,3,3-тетрафторпропокси)фенил) и фенильная группа, замещенная 5-членной ароматической гетероциклической группой [например, 4-(1Н-пиразолил-1-ил)фенил, 4-(1Н-имидазол-1-ил)фенил, 4-(1Н-1,2,3-триазол-1-ил)фенил, 4-(2Н-1,2,3-триазол-2-ил)фенил, 4-(1Н-1,2,4-триазол-1-ил)фенил, 4-(1Н-тетразол-1-ил)фенил, 4-(2Н-тетразол-2-ил)фенил]. Низшая алкиленовая группа в “необязательно замещенной низшей алкиленовой группе”, представленной Z, включает группы, имеющие от 1 до 3 атомов углерода, такие как метилен, этилен, пропилен и т.д. Среди них особенно предпочтительным является этилен. Заместитель в “необязательно замещенной низшей алкиленовой группе” предпочтительно представляет собой линейную или разветвленную алкильную группу, имеющую от 1 до 4 атомов углерода, такую как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и т. д. Среди них метил и этил являются более предпочтительными и особенно предпочтительным является метил. Предпочтительные примеры этиленовой группы, которая может быть замещена низшей алкильной группой, которая представлена Z, включают этилен, 1-метилэтилен, 1,1-диметилэтилен, 1,2-диметилэтилен, 1-этилэтилен, 1,2-диэтилэтилен и т.д. Среди них этилен является особенно предпочтительным. Когда Z представляет D=E, примеры низшей алкильной группы в “метиновой группе, которая может быть замещена низшей алкильной группой”, представленной D или Е, включают линейную или разветвленную алкильную группу, имеющую от 1 до 4 атомов углерода (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и т.д.). Среди них метил является предпочтительным. Предпочтительные примеры метиновой группы, которая может быть замещена низшей алкильной группой, представленной D или Е, включают метин, этилидин (-С(СН3)=), пропилидин (-С(СН2СН3)=), бутилидин (-С(СН2СН2СН3)=) и т.д. Среди них предпочтительными являются метин и этилидин, и особенно предпочтительным является метин. Случай, когда один из D и Е является атомом азота, а другой представляет метин; случай, когда оба D и Е представляют метин; случай, когда оба D и Е являются атомами азота; и случай, когда один из D и Е представляет атом азота, а другой из них является этилидином, являются предпочтительными. Среди них случай, когда один из D и Е представляет атом азота, а другой представляет метин, и случай, когда оба из D и Е представляют метин, являются особенно предпочтительными. Конкретно, Z предпочтительно представляет -N=CH-, -CH=N-, -СН=СН-, -N=N, -N= (C(CH3)-, -С(СН3)=N, -СН2-СН2– и т.д. Среди них N=CH-, -CH=N-, -CH=CH-, -CH2-CH2– и т.д. являются более предпочтительными, a N=CH-, -CH2-CH2– являются наиболее предпочтительными. В качестве группы, представленной формулой: 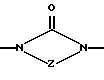 например, такие группы как: 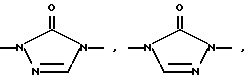 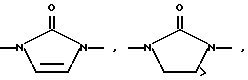 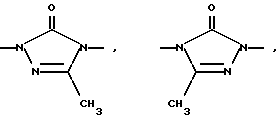 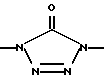 и т.д. являются предпочтительными. Среди них 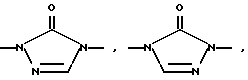 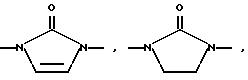 и т. д. являются особенно предпочтительными. Также, когда реакционноспособный атом, такой как атом азота, присутствует в необязательно замещенной углеводородной группе или необязательно замещенной гетероциклической группе, представленной А, группа формулы где каждый символ является таким, как определено выше, может быть связана с этим атомом. Когда соединение (I) имеет в молекуле один или несколько асимметрических атомов углерода, существует два или более стереоизомеров, и стереоизомеры и их смеси также включены в настоящее изобретение. В соединении, представленном общей формулой (Iа), когда Q является группой, представленной формулой (II), А представляет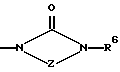 m и р оба равны О, R4 представляет атом водорода, и R5 представляет метильную группу, особенно предпочтительным является оптически активное соединение, в котором оба углерода, с которыми связана необязательно замещенная фенильная группа, представленная Аr, и углерод, к которому присоединен R5, имеют (R) конфигурацию. В формуле (Iа), когда Q является группой, представленной формулой (II), формула (Iа) также может быть выражена формулой: 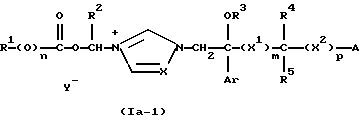 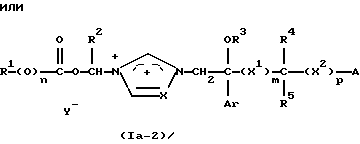 где каждый символ является таким, как определено выше. Соединения по настоящему изобретению могут быть как гидратами, так и негидратами. Соединения по настоящему изобретению превращаются in vivo в соединения, обладающие противогрибковой активностью, представленные формулой: 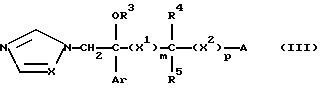 где каждый символ является таким, как определено выше. Конкретные примеры соединений согласно настоящему изобретению показаны в таблицах 1-4, но не ограничены представительными соединениями. Соединения по настоящему изобретению могут быть получены посредством введения группы, которая способна отщепляться in vivo, в противогрибковое соединение, содержащее имидазол-1-ильную группу или 1,2,4-триазол-1-ильную группу. Примеры противогрибкового соединения, имеющего имидазол-1-ильную или 1,2,4-триаэол-1-ильную группу, включают известные азольные гротивогрибковые соединения, такие как миконазол, кетоконазол, флуконазол, интраконазол, саперконазол, клотримазол, D0870, вориконазол, эконазол, изоконазол, сулконазол, бутоконазол, тиоконазол, бифоназол, оксиконазол, терконазол, SSY-726, КР-103, Sch-56592, Sch-51048, UR-9746, MFB-1041, UR-9751, UR-9728, UR-9825, ER-30346, T-8581, BAY-W-9279, фентиконазол, омоконазол, флутримазол, эберконазол, ланоконазол, нетиконазол, сертаконазол, генаконазол кроконазол и т.д., но не ограничены известными противогрибковыми агентами. Соединение (Iа-1) [соединение (Iа), где Q является группой, представленной формулой (II)] может быть получено, например, взаимодействием соединения (III) с соединением, представленным формулой (IV): 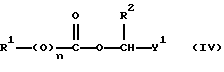 где Y1 представляет атом галогена, а другие символы являются такими, как определено выше, далее упоминаемое, иногда, как соединение (IV) и необязательно с последующим анионным обменом реакционного продукта. Атом галогена, представленный Y1 предпочтительно является хлором, бромом или иодом. Взаимодействие между соединением (III) и соединением (IV) обычно осуществляют в присутствии растворителя, который не ингибирует реакцию, или без него. В качестве не ингибирующего реакцию растворителя, используют, например, кетоны (например, ацетон, 2-бутанон, 2-пентанон и т.д.), сульфоксиды (например, диметилсульфоксид и т.д.), простые эфиры (например, диэтиловый эфир, тетрагидрофуран, диоксан и т.д.), нитрилы (например, ацетонитрил и т. д. ), ароматические углеводороды (например, бензол, толуол, ксилол и т.д.), галогенированные углеводороды (например, дихлорметан, хлороформ, 1,2-дихлорэтан и т. д. ), сложные эфиры (например, этилацетат и т.д.), амиды (например, диметилформамид, ацетамид, диметилацетамид, 1-метил-2-пиролиидинон и т.д.) и мочевины (например, 1,3-диметил-2-имидазолидинон). Эти растворители могут быть использованы по отдельности или в комбинации при подходящем соотношении. Соединение (IV) используют в количестве от 1 до 100 эквивалентов, предпочтительно от 1 до 5 эквивалентов из расчета на соединение (III). Температура реакции не ограничена каким-либо конкретным образом, но обычно она составляет от 0 до 150oС, предпочтительно от примерно 20 до 120oС. Время реакции составляет от нескольких минут до нескольких сотен часов (например от 5 минут до 100 часов и т.д.). Полученное таким образом соединение может, необязательно, быть превращено в соединение (Iа), имеющее желаемый анион (Y–) путем анионного обмена. Анионный обмен может быть осуществлен путем обработки ионообменной смолой анионного типа или солью щелочного металла (например, натрия, калия и т. д. ) органической или неорганической кислоты, описанной выше для Y–, в присутствии воды, смешанного растворителя из воды и органического растворителя (например, ацетона, ацетонитрила, тетрагидрофурана, метанола, этанола и т.д. ) или органического растворителя. Соединение (I) по настоящему изобретению (далее упоминаемое, иногда, как настоящее соединение (I), полученное таким образом, может быть выделено и очищено из реакционной смеси с использованием известных сами по себе способов, таких как экстракция, концентрирование, нейтрализация, фильтрование, перекристаллизация, колоночная хроматография, тонкослойная хроматография и т.д. Когда настоящее соединение (I) имеет один или несколько асимметрических атомов углерода в молекуле, существует два или более стереоизомеров, но эти изомеры могут быть, если желательно, получены по отдельности. Например, когда исходные соединения (III) и (IV) имеют асимметрический атом углерода в молекуле, может быть получен индивидуальный изомер настоящего соединения (Iа) путем осуществления вышеуказанной реакции с использованием такого индивидуального изомера. Кроме того, индивидуальный изомер реакционного соединения (Iа) может быть получен путем осуществления вышеуказанной реакции с использованием индивидуального изомера исходного соединения (III). Также, в том случае, когда продукт представляет собой смесь двух или более видов изомеров, продукт может быть разделен с использованием обычных способов разделения, например, таких способов разделения как различные виды хроматографии и дробная перекристаллизация. Когда исходное соединение (III) настоящего изобретения представляет собой известный сам по себе описанный выше противогрибковый агент, способ получения такого соединения известен, и также известны сами по себе способы получения ряда соединений, полезных в качестве противогрибковых агентов, например, способы, описанные в публикации патента Японии Kokai No.Hei 6-293740, публикации патента Японии Kokai No.Hei 8-104676 и WO-9625410A. Кроме того, способ получения другого исходного соединения (IV) также известен, и соединение может быть получено способом, описанным в Synthesis, page 588 (1971) и Synthetic Communications, Vol.25, page 2739 (1995), или способом, основанным на данном методе. Так как настоящее соединение (I) обладает низкой токсичностью и сильным противогрибковым действием в отношении genus Candida [например, Candida albicans, Candida utilis, Candida glabrata, и т.д.], genus Histoplasma [например, Histoplasma capsulatum и т. д.], genus Aspergillus [например, Aspergillus niger, Aspergillus fumigatus и т. д. ] , genus Cryptococcus [например, Cryptococcus neoformans и т.д.], genus Trichophyton [например, Trichophyton rubrum, Trichophton mentagrophytes и т.д.], genus Microsporum [например, Microsporum gypseum и т.д.], genus Mallassezia [например, Mallassezia furfur и т.д.] и т.д., то оно может использоваться для профилактики и лечения грибковых инфекций [например, кандидоза слизистой оболочки (кандидозный стоматит, ангулярный стоматит, вульвовагинальный кандидоз, кандидозный баланопостит (воспаление кожи головки полового члена) и уретрит), кожного кандидоза (междигитальный кандидоз, интертригинозный кандидоз (кандидоз складок кожи), перианальный кандидоз, бластомикозный кожный экзематоз, кандидоз онихия (грибковое поражение ногтей), кандидоз паронизия (воспаление околоногтевых тканей), кандидоз предсердий, грибковые инфекционные поражения кожи, диффузный поверхностный кандидоз, гранулематозный кандидоз, врожденный кожный кандидоз, candids), хронического кожно-слизистого кандидоза и системного кандидоза (кандидоз дыхательных путей, кандидоз желудочно-кишечного тракта, инфекционный кандидоз, эндокардиальный кандидоз, кандидоз мочевого тракта, кандидоз глаза, кандидоз центральной нервной системы, кандидоз суставов и костей, кандидоз брюшины, кандидоз печени, внутриматочный кандидоз и т.д.) за счет genus Candida; острого легочного гистоплазмоза, хронического легочного гистоплазмоза и диссеминированного (рассеянного) гистоплазмоза и т.д. за счет genus Histoplasma; аспергиллеза дыхательных путей (аллергический аспергиллез, бронхиальный аспергиллез, аспергиллома, легочный аспергиллез (острый инвазивный легочный аспергиллоз, хронический некротический легочный аспергиллез, аспергиллезная эмфиема), диссеминированного аспергиллеза, аспергиллеза центральной нервной системы, аспергиллезного эндокардита, аспергиллезного миокардита, аспергиллезного перикардита, аспергиллезной мицетомы, аспергиллезного отомикоза, аспергиллезной онихии, аспергиллезной паронихии, аспергиллезного кератита, аспергиллезного эндофтальмита, кожного аспергиллеза и назально-орбитального аспергиллеза и т.д. за счет genus Aspergillus; легочного криптококкоза, криптококкоза центральной нервной системы, кожного и кожно-слизистого криптококкоза, костного криптококкоза, криптококкоза лимфатических узлов, диссеминированного криптококкоза и криптококкоза гематопоэтических органов (органы кроветворения) и т.д. за счет genus Cryptococcus; дерматомикоза, парши, кериона Цельса (инфильтративно-нагноительная трихофития), дерматофитии, трихофитии пятнисто-везикулярной, трихофитии экзематозной круговидной, тропического круговидного микоза, трихофитии волдыреобразной, дерматомикоза ногтевого, стригущего лишая и гранулемы трихофитиевой и т.д. за счет genus Trichophyton или genus Microsporum; дерматомикоза разноцветного и т.д. за счет genus Mallassezia] у млекопитающих (например, человека, домашних животных, домашней птицы и т.д.) и также для профилактики или лечения идиопатического дерматита. Более того, соединение (I) по настоящему изобретению может использоваться в качестве сельскохозяйственного противогрибкового агента. Когда настоящее соединение (I) вводят человеку, его можно безопасно вводить перорально или парентерально в виде фармацевтической композиции, так например, пероральное введение (например, порошок, гранула, таблетка, капсула и т. д.), парентеральное введение [например, инъекция, наружный агент (например, назальное введение, подкожное введение и т.д.) и суппозиторий (например, ректальный суппозиторий, вагинальный суппозиторий и т.д.)], по отдельности или в сочетании с подходящим фармацевтически приемлемыми носителями, эксципиентами, разбавителями и т.д. Эти препараты могут быть получены известным сам по себе способом, который обычно используют в процессе производства. Доля настоящего соединения (I) в препаратах изменяется в зависимости от их формы и может колебаться в диапазоне, обычно используемом для противогрибкового агента. Например, это составляет от примерно 10 до 95% по весу в случае вышеуказанного перорального введения и примерно от 0,001 до 95% по весу в случае вышеуказанного парентерального введения. Например, препарат для инъекции может быть получен путем смешивания настоящего соединения (I) с диспергирующими агентами [например, Tween 80 (производимый компанией Atlas Powder, США), НСО 60 (производимый компанией Nikko Chemicals Co. ), карбоксиметилцеллюлоза, альгинат натрия и т.д.], консервантами (например, метилпарабен, пропилпарабен, бензиловый спирт, хлорбутанол и т. д. ) и изотоническими агентами (например, хлорид натрия, глицерин, сорбит, глюкоза и т. д. ) с образованием водного инъекционного раствора, или путем растворения, суспендирования или эмульгирования в растительных маслах (например, оливковом масле, кунжутном масле, арахисовом масле, масле из хлопковых семян, кукурузном масле и т.д.), пропиленгликоле и т.д. с образованием масляной инъекции. Препарат для перорального введения может быть получен путем добавления эксципиентов (например, лактозы, сахарозы, крахмала и т.д.), дизинтеграторов (например, крахмала, карбоната кальция), связующих веществ (например, крахмала, гуммиарабика, карбоксиметилцеллюлозы, поливинилпирролидона, гидроксипропилцеллюлозы и т.д.) и лубрикантов (например, талька, стеарата магния, полиэтиленгликоля 6000 и т.д.) к настоящему соединению (I), подвергая смеси формованию прессованием и, необязательно, маскируя вкус или покрывая внешним слоем с использованием известных сами по себе способов с целью придания свойства высвобождения в кишечнике или свойства замедленного высвобождения. В качестве агента для покрытия, например, могут использоваться гидроксипропилметилцеллюлоза, этилцеллюлоза, гидроксиметилцеллюлоза, гидроксипропилцеллюлоза, полиоксиэтиленгликоль, Tween 80, Pulronic P68, ацетат фталат целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат сукцинат гидроксиметилцеллюлозы, Oidora kid (производимый Rhome Co., Западная Германия, сополимер метакриловой и акриловой кислот) и пигмент (например, оксид титана, оксид железа и т.д.). Соединение (I) по настоящему изобретению может быть использовано в виде твердого, полутвердого или жидкого наружного препарата. Например, твердый наружный препарат может быть получен путем использования самого по себе настоящего соединения (I) или посредством добавления эксципиентов (например, глицерина, маннита, крахмала, микрокристаллической целлюлозы и т.д.), загустителей (например, природных камедей, производных целлюлозы, акрилового полимера и т. д.) и т.д. к настоящему соединению (I) с последующим перемешиванием с образованием порошкообразной композиции. В случае полутвердого наружного препарата предпочтительным является применение водного или маслянистого гелевого агента или мази. В случае жидкого наружного препарата он может быть получен путем образования маслянистой или водной суспензии способом, аналогичным способу, описанному для инъекции. К твердому, полутвердому или водному наружному препаратам могут быть добавлены регуляторы рН (например, угольная кислота, фосфорная кислота, лимонная кислота, соляная кислота, гидроксид натрия и т.д.) и консерванты (например, параоксибензоаты, хлорбутанол, хлорид бензалькония и т.д.). В частности, мазь, содержащая вазелин, ланолин и т.д. в виде основы и примерно от 0,1 до 100 мг настоящего соединения (I) может использоваться для стерилизации или дезинфекции кожи или слизистой оболочки. Настоящее соединение (I) может быть введено в состав масляного или водного твердого, полутвердого или жидкого суппозитория. В случае получения суппозитория примеры масляной основы включают глицерид высшей жирной кислоты [(например, масло какао, витепзоли (производимые Dynamite Nobel Company) и т. д. ], среднюю жирную кислоту [например, мигриолевую кислоту (производимая Dynamite Nobel Company) и т.д.], и растительное масло [например, кунжутное масло, соевое масло, хлопоковое масло]. Примеры водной основы включают полиэтиленгликоли, пропиленгликоли и примеры основы водных гелей включают природные камеди, производное целлюлозы, виниловый полимер, акриловый полимер и т.д. Доза настоящего соединения (I) изменяется в зависимости от инфекционного заболевания и пути введения и т.д. В случае перорального введения взрослым пациентам (вес 50 кг) с целью лечения кандидозов доза составляет примерно от 0,01 до 100 мг/кг/день, предпочтительно примерно от 0,1 до 50 мг/кг/день. Более предпочтительно, доза составляет примерно от 0,5 до 10 мг/кг/день. Два или более соединений по настоящему изобретению могут использоваться при получении препаратов по настоящему изобретению и также соединение по настоящему изобретению может использоваться в сочетании с одним или несколькими соединениями, обладающими противогрибковой активностью, отличающимися от соединений по настоящему изобретению. При использовании настоящего соединения (I) в качестве сельскохозяйственного противогрибкового агента настоящее соединение (I) растворяют или суспендируют в подходящем жидком носителе (например, растворитель) или смешивают, или поглощают подходящим твердым носителем (например, разбавитель, наполнитель и т.д.) и, если необходимо, добавляют эмульгаторы, суспендирующие, разбрызгивающие, агенты, регулирующие осмотическое давление, смачивающие агенты, клеи, стабилизаторы и т. д. для образования эмульсии, гидрата, порошка, гранул и т.д. Эти препараты могут быть получены известными способами. Для борьбы с рисовой гнилью количество используемого соединения (I) по настоящему изобретению предпочтительно составляет от примерно 25 до 150 г, более предпочтительно от примерно 40 до 80 г на ар заливного поля. Соединение по настоящему изобретению может использоваться в сочетании с другими сельскохозяйственными противогрибковыми агентами. В качестве жидкого носителя могут использоваться, например, вода, спирты (например, метиловый спирт, этиловый спирт, н-пропиловый спирт, изопропиловый спирт, этиленгликоль и т.д.), простые эфиры (например, диоксан, тетрагидрофуран и т.д.), алифатические углеводороды (например, керосин, керосиновое масло, топочный мазут и т.д.), ароматические углеводороды (например, бензин, толуол и т.д.). галогенированный углеводород (например, хлористый метилен, хлороформ и т.д.), амиды кислот (например, диметилформамид, диметилацетамид и т.д.), сложные эфиры (например, этилацетат, бутилацетат и т.д.) и нитрилы (например, ацетонитрил, пропионитрил и т.д.), и эти жидкие носители могут использоваться по отдельности или в сочетании в подходящем соотношении. В качестве твердого носителя может использоваться, например, растительная мука (например, соевая мука, табачная мука, пшеничная мука и т.д.), минеральные порошки (например, каолин, бентонит и т.д.), глинозем, порошок серы, активированный уголь и т.д., и эти твердые носители могут использоваться по отдельности или в сочетании в подходящем соотношении. Лучший способ осуществления изобретения Следующие ссылочные примеры, примеры, примеры получения и экспериментальные примеры подробно иллюстрируют настоящее изобретение, но они не предназначены для ограничения объема изобретения. 1Н-ЯМР спектры зарегистрированы на спектрометре типа Varian Gemini 200 (200 МГц) с использованием тетраметилсилана в качестве внешнего стандарта и все значения  приведены в м.д. (миллионных долях). Цифровые значения, описанные в ( ) для смешанного растворителя, представляют собой объемное отношение при смешивании для каждого растворителя. “%” даны по весу, если не указано другого. Соотношение растворителей при хроматографии на силикагеле представлено объемными соотношениями смешиваемых растворителей.
Символы в примерах имеют следующие значения: приведены в м.д. (миллионных долях). Цифровые значения, описанные в ( ) для смешанного растворителя, представляют собой объемное отношение при смешивании для каждого растворителя. “%” даны по весу, если не указано другого. Соотношение растворителей при хроматографии на силикагеле представлено объемными соотношениями смешиваемых растворителей.
Символы в примерах имеют следующие значения:с: синглет; д: дублет; т: триплет, к: квартет, дд, дублет дублетов, тт: триплет триплетов, м: мультиплет, уш.: уширенный, J: константа спин-спинового расщепления. Ссылочный пример 1 Тетрагидрофурфуриловый спирт (19,4 г) растворяли в безводном диэтиловом эфире (500 мл) и, после добавления пиридина (15 г), при охлаждении льдом добавляли по каплям хлорметилхлорформиат (25 г). После перемешивания реакционной смеси при комнатной температуре в течение 17 часов, выпавший осадок гидрохлорида пиридина удаляли фильтрованием и осадок на фильтре промывали диэтиловым эфиром (50 мл  2). Промывные воды и фильтрат объединяли, промывали водой (300 мл 2). Промывные воды и фильтрат объединяли, промывали водой (300 мл  2) и затем сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении, получая (2,3,4,5-тетрагидрофурфурил)хлорметилкарбонат (33,9 г) в виде бесцветного маслянистого продукта.
1Н-ЯМР (СDСl3) 2) и затем сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении, получая (2,3,4,5-тетрагидрофурфурил)хлорметилкарбонат (33,9 г) в виде бесцветного маслянистого продукта.
1Н-ЯМР (СDСl3)  : 1,59-1,73 (1Н, м), 1,83-2,11 (3Н, м), 3,75-3,97 (2Н, м), 4,11-4,34 (3Н, м), 5,74 (2Н, с).
(2,3,4,5-Тетрагидрофурфурил)хлорметилкарбонат (3,4 г) и иодид натрия (10,46 г) добавляли к ацетонитрилу (70 мл) и затем смесь нагревали при 60oС в течение 90 минут. После охлаждения реакционного раствора растворитель отгоняли при пониженном давлении и остаток распределяли между диэтиловым эфиром (70 мл) и насыщенным водным раствором хлорида натрия (50 мл). Органический слой последовательно промывали водным 5%-ным раствором тиосульфата натрия (50 мл), водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл) и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении, получая (2,3,4,5-тетрагидрофурфурил) иодметилкарбонат (4,8 г) в виде бледно-желтого маслянистого продукта.
1Н-ЯМР (СDСl3) : 1,59-1,73 (1Н, м), 1,83-2,11 (3Н, м), 3,75-3,97 (2Н, м), 4,11-4,34 (3Н, м), 5,74 (2Н, с).
(2,3,4,5-Тетрагидрофурфурил)хлорметилкарбонат (3,4 г) и иодид натрия (10,46 г) добавляли к ацетонитрилу (70 мл) и затем смесь нагревали при 60oС в течение 90 минут. После охлаждения реакционного раствора растворитель отгоняли при пониженном давлении и остаток распределяли между диэтиловым эфиром (70 мл) и насыщенным водным раствором хлорида натрия (50 мл). Органический слой последовательно промывали водным 5%-ным раствором тиосульфата натрия (50 мл), водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл) и затем сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении, получая (2,3,4,5-тетрагидрофурфурил) иодметилкарбонат (4,8 г) в виде бледно-желтого маслянистого продукта.
1Н-ЯМР (СDСl3)  : 1,54-1,73 (1Н, м), 1,84-2,11 (3Н, м), 3,73-3,96 (2Н, м), 4,10-4,32 (3Н, м), 5,96 (2Н, с).
Ссылочный пример 2 : 1,54-1,73 (1Н, м), 1,84-2,11 (3Н, м), 3,73-3,96 (2Н, м), 4,10-4,32 (3Н, м), 5,96 (2Н, с).
Ссылочный пример 2Формаль глицерина (14 г) растворяли в безводном эфире (400 мл) и после добавления пиридина (15 г) при -10oС добавляли по каплям раствор хлорметилхлорформиата (25 г) в безводном диэтиловом эфире (50 мл) в течение 10 минут. После перемешивания реакционного раствора при комнатной температуре в течение 20 часов, выпавший осадок гидрохлорида пиридина удаляли фильтрованием. Фильтрат промывали насыщенным водным раствором хлорида натрия (400 мл  2) и затем сушили над безводным сульфатом магния. Остаток, полученный после отгонки растворителя при пониженном давлении, очищали хроматографией на силикагеле (элюент:этилацетат/гексан=1/5 –> этилацетат/гексан=1/3), получая (1,3-диоксан-5-ил)хлорметилкарбонат (1,7 г) в виде бесцветного маслянистого продукта.
1H-ЯМР (CDCl3) 2) и затем сушили над безводным сульфатом магния. Остаток, полученный после отгонки растворителя при пониженном давлении, очищали хроматографией на силикагеле (элюент:этилацетат/гексан=1/5 –> этилацетат/гексан=1/3), получая (1,3-диоксан-5-ил)хлорметилкарбонат (1,7 г) в виде бесцветного маслянистого продукта.
1H-ЯМР (CDCl3)  : 4,05 (4Н, д, J=3,2 Гц), 4,67 (1Н, квинтет, J=3,2 Гц), 4,82 (1H, д, J=6,2 Гц), 4,95 (1H, д, J=6,2 Гц), 5,75 (2Н, с).
Полученное выше соединение (1,7 г) и иодид натрия (5,1 г) добавляли к ацетонитрилу (40 мл) и затем смесь перемешивали при нагревании при 60oС в течение 2 часов. Остаток, полученный после отгонки растворителя из реакционной смеси при пониженном давлении, растворяли в диэтиловом эфире (100 мл). Раствор последовательно промывали водным 5%-ным раствором тиосульфата натрия (50 мл), водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл) и затем сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении, получая (1,3-диоксан-5-ил)исдметилкарбонат (3,2 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (CDCl3) : 4,05 (4Н, д, J=3,2 Гц), 4,67 (1Н, квинтет, J=3,2 Гц), 4,82 (1H, д, J=6,2 Гц), 4,95 (1H, д, J=6,2 Гц), 5,75 (2Н, с).
Полученное выше соединение (1,7 г) и иодид натрия (5,1 г) добавляли к ацетонитрилу (40 мл) и затем смесь перемешивали при нагревании при 60oС в течение 2 часов. Остаток, полученный после отгонки растворителя из реакционной смеси при пониженном давлении, растворяли в диэтиловом эфире (100 мл). Раствор последовательно промывали водным 5%-ным раствором тиосульфата натрия (50 мл), водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл) и затем сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении, получая (1,3-диоксан-5-ил)исдметилкарбонат (3,2 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (CDCl3)  : 4,04 (4Н, д, J=3,0 Гц), 4,66 (1H, квинтет, J=3,0 Гц), 4,81 (1H, д, J=6,2 Гц), 4,95 (1H, д, J=6,2 Гц), 5,97 (2Н, с).
Ссылочный пример 3 : 4,04 (4Н, д, J=3,0 Гц), 4,66 (1H, квинтет, J=3,0 Гц), 4,81 (1H, д, J=6,2 Гц), 4,95 (1H, д, J=6,2 Гц), 5,97 (2Н, с).
Ссылочный пример 3(R)-Глицерин ацетонид (10 г) растворяли в безводном простом эфире [200 мл) и после добавления пиридина (6,6 г) при -10oС добавляли по каплям за 10 минут раствор хлорметил хлорформиата (10,7 г) в безводном диэтиловом эфире (20 мл). После перемешивания реакционной смеси при комнатной температуре в течение 20 часов выпавший осадок хлоргидрата пиридина удаляли фильтрованием. Фильтрат промывали насыщенным водным раствором хлорида натрия (200 мл  2) и затем сушили над безводным сульфатом магния. Остаток, полученный после отгонки растворителя при пониженном давлении очищали хроматографией на силикагеле (элюент: гексан –> этилацетат/гексан= 1/5 –> этилацетат/гексан=3/5), получая [(4S)-2,2-диметил-1,3-диоксолан-4-ил)метилхлорметилкарбонат (17 г) в виде бесцветного маслянистого продукта.
1H-ЯМР (CDCl3) 2) и затем сушили над безводным сульфатом магния. Остаток, полученный после отгонки растворителя при пониженном давлении очищали хроматографией на силикагеле (элюент: гексан –> этилацетат/гексан= 1/5 –> этилацетат/гексан=3/5), получая [(4S)-2,2-диметил-1,3-диоксолан-4-ил)метилхлорметилкарбонат (17 г) в виде бесцветного маслянистого продукта.
1H-ЯМР (CDCl3)  : 1,37 (3Н, с), 1,44 (3Н, с), 3,80 (1Н, дд, J=8,8, 5,8 Гц), 4,07-4,42 (4Н, м), 5,74 (2-Н, с).
Полученное выше соединение (2 г) и иодид натрия (5,3 г) добавляли к ацетонитрилу (40 мл) и затем смесь перемешивали при нагревании при 60oС в течение 2 часов. Остаток, полученный после отгонки растворителя из реакционной смеси при пониженном давлении, растворяли в диэтиловом эфире (50 мл). Раствор последовательно промывали водным 5%-ным раствором тиосульфата натрия (50 мл), водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл) и затем сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении, получая [(4S)-2,2-диметил-1,3-диоксолан-4-ил)метилиодметилкарбонат (2,1 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (СDСl3) : 1,37 (3Н, с), 1,44 (3Н, с), 3,80 (1Н, дд, J=8,8, 5,8 Гц), 4,07-4,42 (4Н, м), 5,74 (2-Н, с).
Полученное выше соединение (2 г) и иодид натрия (5,3 г) добавляли к ацетонитрилу (40 мл) и затем смесь перемешивали при нагревании при 60oС в течение 2 часов. Остаток, полученный после отгонки растворителя из реакционной смеси при пониженном давлении, растворяли в диэтиловом эфире (50 мл). Раствор последовательно промывали водным 5%-ным раствором тиосульфата натрия (50 мл), водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл) и затем сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении, получая [(4S)-2,2-диметил-1,3-диоксолан-4-ил)метилиодметилкарбонат (2,1 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (СDСl3)  : 1,37 (3Н, с), 1,44 (3Н, с), 3,79 (1Н, дд, J=8,0, 5,0 Гц), 4,06-4,41 (4Н, м), 5,96 (2Н, с).
Ссылочный пример 4 : 1,37 (3Н, с), 1,44 (3Н, с), 3,79 (1Н, дд, J=8,0, 5,0 Гц), 4,06-4,41 (4Н, м), 5,96 (2Н, с).
Ссылочный пример 4К раствору бензил 4-гидроксибутаноата (синтезированного способом, описанным Weber et al., J.Med.Chern., 1991, 34, 2692-2701; 5,0 г) в диэтиловом эфире (100 мл) добавляли пиридин (2,3 мл) в атмосфере азота и добавляли по каплям хлорметилхлорформиат (3,7 г) при -10oС. Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь фильтровали через стеклянный фильтр и затем фильтрат последовательно промывали водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над сульфатом магния и затем растворитель отгоняли при пониженном давлении, полученный таким образом остаток подвергали колоночной хроматографии на силикагеле, элюируя смесью ацетон/гексан (1:1 об/об), получая (3-бензилоксикарбонилпролил)хлорметилкарбонат (7,25 г) в виде бесцветного маслянистого продукта. 1H-ЯМР (CDCl3)  : 2,02-2,12 (2Н, м), 2,49 (2Н, т, J=7 Гц), 4,28 (2Н, т, J=6 Гц), 5,13 (2Н, с), 5,71 (2Н, с), 7,36 (5Н, с).
К раствору полученного выше соединения (2,5 г) в ацетонитриле (67 мл) добавляли иодид натрия (5,2 г) в атмосфере азота. Смесь перемешивали при 60oС в течение 8,5 часов. Растворитель отгоняли при пониженном давлении и остаток растворяли в диэтиловом эфире (100 мл). Раствор последовательно промывали 5%-ным водным раствором тиосульфата натрия, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении, получая (3-бензилоксикарбонилпропил)иoдметилкарбонат (2,98 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (СDСl3) : 2,02-2,12 (2Н, м), 2,49 (2Н, т, J=7 Гц), 4,28 (2Н, т, J=6 Гц), 5,13 (2Н, с), 5,71 (2Н, с), 7,36 (5Н, с).
К раствору полученного выше соединения (2,5 г) в ацетонитриле (67 мл) добавляли иодид натрия (5,2 г) в атмосфере азота. Смесь перемешивали при 60oС в течение 8,5 часов. Растворитель отгоняли при пониженном давлении и остаток растворяли в диэтиловом эфире (100 мл). Раствор последовательно промывали 5%-ным водным раствором тиосульфата натрия, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении, получая (3-бензилоксикарбонилпропил)иoдметилкарбонат (2,98 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (СDСl3)  : 2,01-2,08 (2Н, м), 2,49 (2Н, т, J=7 Гц), 4,28 (2Н, т, J=6 Гц), 5,14. (2Н, с), 5,94 (2Н, с), 7,36 (5Н, с).
Ссылочный пример 5 : 2,01-2,08 (2Н, м), 2,49 (2Н, т, J=7 Гц), 4,28 (2Н, т, J=6 Гц), 5,14. (2Н, с), 5,94 (2Н, с), 7,36 (5Н, с).
Ссылочный пример 5К смеси этил (S)-лактата (23,6 г), пиридина (15,8 г) и диэтилового эфира (400 мл) добавляли по каплям раствор хлорметилхлорформиата (25,6 г) в диэтиловом эфире (100 мл) при охлаждении льдом в течение 40 минут. После перемешивания при комнатной температуре в течение 14 часов образовавшийся твердый продукт удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении и остаток растворяли в этилацетате (250 мл). Раствор промывали водой (150 мл  2) и насыщенным водным раствором хлорида натрия (150 мл). После сушки над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [(1S)-1-(этоксикарбонил)этил]хлорметилкарбонат (38,5 г) в виде бесцветной жидкости.
1H-ЯМР (СDСl3) 2) и насыщенным водным раствором хлорида натрия (150 мл). После сушки над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [(1S)-1-(этоксикарбонил)этил]хлорметилкарбонат (38,5 г) в виде бесцветной жидкости.
1H-ЯМР (СDСl3)  : 1,30 (3Н, т, J=7,2 Гц), 1,57 (3Н, д, J=7,0 Гц), 4,25 (2Н, к, J= 7, 2 Гц), 5,07 (1Н, к, J=7,0 Гц), 5,71 (1H, д, J=6,4 Гц), 5.80 (1Н, д, J=6,4 Гц).
Ссылочный пример 6 : 1,30 (3Н, т, J=7,2 Гц), 1,57 (3Н, д, J=7,0 Гц), 4,25 (2Н, к, J= 7, 2 Гц), 5,07 (1Н, к, J=7,0 Гц), 5,71 (1H, д, J=6,4 Гц), 5.80 (1Н, д, J=6,4 Гц).
Ссылочный пример 6К смеси бензил (S)-лактата (30,6 г), пиридина (13,4 г) и диэтилового эфира (300 мл) добавляли по каплям при охлаждении льдом в течение 30 минут раствор хлорметилхлорформиата (21,9 г) в диэтиловом эфире (100 мл). После перемешивания при комнатной температуре в течение 5 часов образовавшийся твердый продукт удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении и остаток растворяли в этилацетате (200 мл). Раствор промывали водой (100 мл  2) и насыщенным водным раствором хлорида натрия (100 мл). После сушки над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [(1S)-1-(бензилоксикарбонил)этил]хлорметилкарбонат (45,0 г) в виде бесцветной жидкости.
1H-ЯМР (CDCl3) 2) и насыщенным водным раствором хлорида натрия (100 мл). После сушки над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [(1S)-1-(бензилоксикарбонил)этил]хлорметилкарбонат (45,0 г) в виде бесцветной жидкости.
1H-ЯМР (CDCl3)  : 1,57 (3Н, д, J=7 Гц), 5,07-5,28 (3Н, м), 5,69 (1Н, д, J=6 Гц), 5,78 (1Н, д, J=6 Гц), 7.36 (5Н, с).
[(1S)-1-(бензилоксикарбонил)этил] хлорметилкарбонат (2,7 г) растворяли в ацетонитриле (4 мл) и добавляли иодид натрия (6,0 г). Смесь перемешивали при 60oС в течение 2 часов в атмосфере аргона. После концентрирования реакционной смеси при пониженном давлении к остатку добавляли диэтиловый эфир (100 мл) и воду (100 мл). Слой диэтилового эфира отделяли и последовательно промывали 5%-ным водным раствором тиосульфата натрия (80 мл), водой (80 мл) и насыщенным водным раствором хлорида натрия (80 мл). После сушки над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [(1S)-1-(бензилоксикарбонил)этил] иодметилкарбонат (3,3 г) в виде бесцветной жидкости.
1H-ЯМР (CDCl3) : 1,57 (3Н, д, J=7 Гц), 5,07-5,28 (3Н, м), 5,69 (1Н, д, J=6 Гц), 5,78 (1Н, д, J=6 Гц), 7.36 (5Н, с).
[(1S)-1-(бензилоксикарбонил)этил] хлорметилкарбонат (2,7 г) растворяли в ацетонитриле (4 мл) и добавляли иодид натрия (6,0 г). Смесь перемешивали при 60oС в течение 2 часов в атмосфере аргона. После концентрирования реакционной смеси при пониженном давлении к остатку добавляли диэтиловый эфир (100 мл) и воду (100 мл). Слой диэтилового эфира отделяли и последовательно промывали 5%-ным водным раствором тиосульфата натрия (80 мл), водой (80 мл) и насыщенным водным раствором хлорида натрия (80 мл). После сушки над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [(1S)-1-(бензилоксикарбонил)этил] иодметилкарбонат (3,3 г) в виде бесцветной жидкости.
1H-ЯМР (CDCl3)  : 1,56 (3Н, д, J=7 Гц), 5,07-5,29 (3Н, м), 5,93 (1Н, д, J=5 Гц), 5,98 (3Н, д, J=5 Гц), 7.37 (5Н, с).
Ссылочный пример 7 : 1,56 (3Н, д, J=7 Гц), 5,07-5,29 (3Н, м), 5,93 (1Н, д, J=5 Гц), 5,98 (3Н, д, J=5 Гц), 7.37 (5Н, с).
Ссылочный пример 7К раствору 3-(бензилокси)пропанола (синтезированного способом, описанным Wei et al., J.Org.Chem., 54, 5768-5774 (1989); 15,1 г) и пиридина (7,18 г) в диэтиловом эфире (150 мл) добавляли по каплям при охлаждении льдом в течение 20 минут раствор хлорметилхлорформиата (11,7 г) в диэтиловом эфире (50 мл). После перемешивания при комнатной температуре в течение 15 часов полученный твердый продукт удаляли фильтрованием и промывали этилацетатом (100 мл). Фильтрат и промывную жидкость объединяли и промывали водой (100 мл  2) и насыщенным водным раствором хлорида натрия (50 мл). После сушки раствора над безводным сульфатом магния растворитель отгоняли при пониженном давлении. Остаток очищали, подвергая его хроматографии на силикагеле (силикагель 200 г, элюент: этилацетат-гексан= 1: 4), получая [3-(бензилокси)пропил]-хлорметилкарбонат (21,0 г) в виде бесцветной жидкости.
1H-ЯМР (CDCl3) 2) и насыщенным водным раствором хлорида натрия (50 мл). После сушки раствора над безводным сульфатом магния растворитель отгоняли при пониженном давлении. Остаток очищали, подвергая его хроматографии на силикагеле (силикагель 200 г, элюент: этилацетат-гексан= 1: 4), получая [3-(бензилокси)пропил]-хлорметилкарбонат (21,0 г) в виде бесцветной жидкости.
1H-ЯМР (CDCl3)  : 2,01 (2Н, квинтет, J=6,2 Гц), 3,57 (2Н, т, J=6,0 Гц), 4,36 (2Н, т, J=6,4 Гц), 4,51 (2Н, с), 5,71 (2Н, с), 7,33 (5Н, с).
[3-(Бензилокси)пропил] хлорметилкарбонат (2,0 г) растворяли в ацетонитриле (3 мл) и добавляли иодид натрия (4,6 г). Смесь перемешивали в атмосфере азота при 60oС в течение 2 часов. Реакционную смесь выливали в воду (100 мл) и экстрагировали этилацетатом (100 мл). Этилацетатный слой промывали 5%-ным водным раствором тиосульфата натрия (50 мл : 2,01 (2Н, квинтет, J=6,2 Гц), 3,57 (2Н, т, J=6,0 Гц), 4,36 (2Н, т, J=6,4 Гц), 4,51 (2Н, с), 5,71 (2Н, с), 7,33 (5Н, с).
[3-(Бензилокси)пропил] хлорметилкарбонат (2,0 г) растворяли в ацетонитриле (3 мл) и добавляли иодид натрия (4,6 г). Смесь перемешивали в атмосфере азота при 60oС в течение 2 часов. Реакционную смесь выливали в воду (100 мл) и экстрагировали этилацетатом (100 мл). Этилацетатный слой промывали 5%-ным водным раствором тиосульфата натрия (50 мл  2), водой (50 мл 2), водой (50 мл  2) и насыщенным водным раствором хлорида натрия (50 мл). После высушивания над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [3-(бензилокси)пропил] иодметилкарбонат (2,5 г) в виде бледно-желтой жидкости.
1H-ЯМР (СDСl3) 2) и насыщенным водным раствором хлорида натрия (50 мл). После высушивания над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [3-(бензилокси)пропил] иодметилкарбонат (2,5 г) в виде бледно-желтой жидкости.
1H-ЯМР (СDСl3)  : 2,00 (2Н, квинтет, J=6,2 Гц), 3,57 (2Н, т, J=6,0 Гц), 4,36 (2Н, т, J=6,4 Гц), 4,51 (2Н, с), 5,94 (2Н, с), 7,34 (5Н, с).
Ссылочный пример 8 : 2,00 (2Н, квинтет, J=6,2 Гц), 3,57 (2Н, т, J=6,0 Гц), 4,36 (2Н, т, J=6,4 Гц), 4,51 (2Н, с), 5,94 (2Н, с), 7,34 (5Н, с).
Ссылочный пример 8К смеси 2-ацетиламиноэтанола (20,0 г), пиридина (15,3 г) и тетрагидрофурана (100 мл) добавляли по каплям при охлаждении льдом в течение 30 минут раствор хлорметилхлорформиата (25,2 г) в тетрагидрофуране (50 мл). После перемешивания при комнатной температуре в течениее 16 часов образовавшийся твердый продукт удаляли фильтрованием и промывали тетрагидрофураном (30 мл). Фильтрат и промывную жидкость объединяли и концентрировали при пониженном давлении. К остатку добавляли этилацетат (300 мл) и воду (100 мл) и органический слой отделяли. Водный слой экстрагировали дважды смесью этилацетата (150 мл) и тетрагирофурана (50 мл). Органические слои объединяли, промывали насыщенным водным раствором хлорида натрия (100 мл) и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Остаток очищали, подвергая его хроматографии на силикагеле (силикагель 240 г, элюент: этилацетат-гексан= 1: 1 –> этилацетат), получая [2-(ацетиламино)этил]хлорметилкарбонат (32,4 г) в виде бесцветного масла. 1H-ЯМР (CDCl3)  : 2,01 (3Н, с), 3,58 (3Н, к, J=6Гц), 4,32 (2Н, т, J=6 Гц), 5,75 (2Н, с), 5,87 (1Н, уш.) : 2,01 (3Н, с), 3,58 (3Н, к, J=6Гц), 4,32 (2Н, т, J=6 Гц), 5,75 (2Н, с), 5,87 (1Н, уш.)[2-(Ацетиламино)этил]хлорметилкарбонат (5,0 г) растворяли в ацетонитриле (15 мл) и добавляли иодид натрия (15,0 г). Смесь перемешивали при 60oС в течение 2 часов в атмосфере аргона. Реакционную смесь выливали в ледяную воду (200 мл) и экстрагировали этилацетатом (200 мл). Экстракт последовательно промывали 5%-ным водным раствором тиосульфата натрия (100 мл  2), водой (100 мл 2), водой (100 мл  2) и насыщенным водным раствором хлорида натрия (50 мл). После высушивания над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [2-(ацетиламино)этил]иодметил-карбонат (3,5 г) в виде желтого масла.
1H-ЯМР (CDCl3) 2) и насыщенным водным раствором хлорида натрия (50 мл). После высушивания над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [2-(ацетиламино)этил]иодметил-карбонат (3,5 г) в виде желтого масла.
1H-ЯМР (CDCl3)  : 2,00 (3Н, с), 3,54 (3Н, к, J=6Гц), 4,28 (2Н, т, J=6 Гц), 5,93 (2Н, с), 6,12 (1Н, уш.) : 2,00 (3Н, с), 3,54 (3Н, к, J=6Гц), 4,28 (2Н, т, J=6 Гц), 5,93 (2Н, с), 6,12 (1Н, уш.)Ссылочный пример 9 К смеси 3-(метокси)пропанола (6,0 г), пиридина (5.3 г) и диэтилового эфира (50 мл) добавляли по каплям в течение 15 минут при охлаждении льдом раствор хлорметилхлорформиата (8,6 г) в диэтиловом эфире (10 мл). После перемешивания при комнатной температуре в течение 16 часов добавляли воду (100 мл) и этилацетат (100 мл) и органический слой отделяли. Органический слой промывали водой (100 мл) и насыщенным водным раствором хлорида натрия (50 мл) и, после высушивания над безводным сульфатом магния, растворитель отгоняли при пониженном давлении. Остаток очищали хроматографией на силикагеле (силикагель 70 г, элюент:этилацетат-гексан=1:2), получая [3-(метокси)пропил] хлорметилкарбонат (11,0 г) в виде бесцветной жидкости. 1H-ЯМР (СОСl3)  : 1,97 (2Н, квинтет, J=6,2 Гц), 3,34 (3Н, с), 3,47 (2Н, т, J=6,2 Гц), 4,33 (2Н, т, J=6,2 Гц), 5,74 (2Н, с).
[3-(Метокси)пропил] хлорметилкарбонат (3,7 г) растворяли в ацетонитриле (12 мл) к добавляли иодид натрия (12,0 г). Смесь перемешивали при 55oС в течение 4 часов в атмосфере аргона. Реакционную смесь выливали в воду (100 мл) и экстрагировали этилацетатом (100 мл). Этилацетатный слой промывали водным 5%-ным раствором тиосульфата натрия (50 мл : 1,97 (2Н, квинтет, J=6,2 Гц), 3,34 (3Н, с), 3,47 (2Н, т, J=6,2 Гц), 4,33 (2Н, т, J=6,2 Гц), 5,74 (2Н, с).
[3-(Метокси)пропил] хлорметилкарбонат (3,7 г) растворяли в ацетонитриле (12 мл) к добавляли иодид натрия (12,0 г). Смесь перемешивали при 55oС в течение 4 часов в атмосфере аргона. Реакционную смесь выливали в воду (100 мл) и экстрагировали этилацетатом (100 мл). Этилацетатный слой промывали водным 5%-ным раствором тиосульфата натрия (50 мл  2), водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл). После высушивания над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [3-(метокси)пропил]иодметилкарбонат (5,0 г) в виде бледно-желтой жидкости.
1H-ЯМР (СDСl3) 2), водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл). После высушивания над безводным сульфатом магния растворитель отгоняли при пониженном давлении, получая [3-(метокси)пропил]иодметилкарбонат (5,0 г) в виде бледно-желтой жидкости.
1H-ЯМР (СDСl3)  : 1,96 (2Н, квинтет, J=6,2 Гц), 3,35 (3Н, с), 3,47 (2Н, т, J=6,2 Гц), 4,33 (2Н, т, J=6,2 Гц), 5,96 (2Н, с).
Пример 1 : 1,96 (2Н, квинтет, J=6,2 Гц), 3,35 (3Н, с), 3,47 (2Н, т, J=6,2 Гц), 4,33 (2Н, т, J=6,2 Гц), 5,96 (2Н, с).
Пример 1Смесь 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -2-имидазолидинона (0,25 г) и хлорметилпивалоата (3,0 г) перемешивали в течение 24 часов при 100oС. После охлаждения смесь разбавляли диэтиловым эфиром (5 мл) и полученный порошок отфильтровывали. Порошок очищали колоночной хроматографией на октадецил-диоксиде кремния (далее кратко называемом ОДК) (элюент:метанол/вода= 3/2), получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[(2,2-диметилпропаноилокси)метил] -1Н-1,2,4-триазолия (Соединение 1, 0,10 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 1,13 (9Н, с), 3,61~4,10 (4Н, м), 4,65~ 4,75 (1Н, м), 4,89 (1Н, д, J=14 Гц), 5,13 (1Н, д, J=14 Гц), 6,17 (2Н, с), 6,74 (1Н, с), 6,91~7,01 (1Н, м), 7,21~7,36 (2Н, м), 7,82~7,93 (4Н, м), 7,95 (1Н, д, J=1,2 Гц), 8,79 (1Н, д, J=1,2 Гц), 9,11 (1Н, с), 10,53 (1H, с).
Пример 2 : 0,97 (3Н, д, J=7 Гц), 1,13 (9Н, с), 3,61~4,10 (4Н, м), 4,65~ 4,75 (1Н, м), 4,89 (1Н, д, J=14 Гц), 5,13 (1Н, д, J=14 Гц), 6,17 (2Н, с), 6,74 (1Н, с), 6,91~7,01 (1Н, м), 7,21~7,36 (2Н, м), 7,82~7,93 (4Н, м), 7,95 (1Н, д, J=1,2 Гц), 8,79 (1Н, д, J=1,2 Гц), 9,11 (1Н, с), 10,53 (1H, с).
Пример 2Смесь 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -2-имидазолидинона (0,5 г) и хлорметилпивалоата (3,1 г) перемешивали в течение 2 часов при 100oС. После охлаждения смесь разбавляли диизопропиловым эфиром (10 мл) и полученный порошок отфильтровывали. Порошок подвергали флэш-хроматографии на силикагеле (элюент: этилацетат –> ацетон –> ацетон/этанол=10/1 –> ацетон/этанол= 5/1), получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[(2,2-диметилпропаноилокси)метил] -1H-1,2,4-триазолия (Соединение 1, 0,34 г) в виде белого порошка. Пример 3 Смесь 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -2-имидазолидинона (0,5 г) и хлорметилпивалоата (4,7 г) перемешивали в течение 5 часов при 100oС. После охлаждения смесь разбавляли диизопропиловым эфиром (10 мл) и полученный порошок отфильтровывали. Порошок подвергали колоночной хроматографии СНР-20Р (элюент: вода –> 5%-ный водный раствор ацетонитрила –> 30%-ный водный раствор ацетонитрила –> 5%-ный водный раствор тетрагидрофурана –> 10%-ный водный раствор тетрагидрофурана –> 20%-ный водный раствор тетрагидрофурана), получая дихлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-[3-(2,2-диметилпропаноилокси)метил-1(1H)-1,2,3-триазолио] фенил]-1-имидазолидинил]бутил]-4-(2,2-диметилпропаноилокси)метил] -1Н-1,2,4-триазолия (Соединение 8, 134 мг) в виде белого порошка и соединение 1 (141 мг) в виде белого порошка. Соединение 8: 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=6,8 Гц), 1,13 (9Н, с), 1,21 (9Н, с), 3,63-3,66 (1H, м), 3,98-4,15 (3Н, м), 4,62-4,78 (1H, м), 4,88 (1H, д, J= 14 Гц), 5,23 (1H, д, J=14 Гц), 6,17 (2Н, с), 6,64 (2Н, с), 6,88 (1H, с), 6,90-7,00 (1H, м), 7,21-7,36 (2Н, м), 7,98 (2Н, д, J=9,8 Гц), 8,05 (2Н, д, J=9,8 Гц), 9,10 (1H, с), 9,34 (1H, д, J=2,0 Гц), 9,68 (1H, д, J=2,0 Гц), 10,64 (1H, с).
Пример 4 : 0,97 (3Н, д, J=6,8 Гц), 1,13 (9Н, с), 1,21 (9Н, с), 3,63-3,66 (1H, м), 3,98-4,15 (3Н, м), 4,62-4,78 (1H, м), 4,88 (1H, д, J= 14 Гц), 5,23 (1H, д, J=14 Гц), 6,17 (2Н, с), 6,64 (2Н, с), 6,88 (1H, с), 6,90-7,00 (1H, м), 7,21-7,36 (2Н, м), 7,98 (2Н, д, J=9,8 Гц), 8,05 (2Н, д, J=9,8 Гц), 9,10 (1H, с), 9,34 (1H, д, J=2,0 Гц), 9,68 (1H, д, J=2,0 Гц), 10,64 (1H, с).
Пример 4К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1H-тетразол-1-ил)фенил] -2-имидазолидинона (0,48 г) и ацетона (10 мл) добавляли хлорметилпивалоат (2,9 мл) и смесь перемешивали при кипении с обратным холодильником. Через 88 часов к смеси добавляли хлорметилпивалоат (1,45 мл). Смесь дополнительно перемешивали в течение 14 часов при кипении с обратным холодильником. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диэтиловый эфир (8 мл) и полученный порошок отфильтровывали. Порошок подвергали ОДК колоночной хроматографии (элюент: метанол/вода= 3/2), получая хлорид 1-[(2R/3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[(2,2-диметилпропаноилокси)метил] -1Н-1,2,4-триазолия (Соединение 2, 0,25 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 1,13 (9Н, с), 3,61~4,09 (4Н, м), 4,65~ 4,75 (1Н, м), 4,88 (1Н, д, J=14 Гц), 5,14 (1Н, д, J=14 Гц), 6,16 (2Н, с), 6,75 (1Н, с), 6, 91~7,01 (1H, м), 7,21~7,37 (2Н, м), 7,90 (4Н, с), 9,10 (1Н, с), 10,07 (1H, с), 10,53 (1H, с).
Пример 5 : 0,97 (3Н, д, J=7 Гц), 1,13 (9Н, с), 3,61~4,09 (4Н, м), 4,65~ 4,75 (1Н, м), 4,88 (1Н, д, J=14 Гц), 5,14 (1Н, д, J=14 Гц), 6,16 (2Н, с), 6,75 (1Н, с), 6, 91~7,01 (1H, м), 7,21~7,37 (2Н, м), 7,90 (4Н, с), 9,10 (1Н, с), 10,07 (1H, с), 10,53 (1H, с).
Пример 5Смесь 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1H-тетразол-1-ил)фенил] -2-имидазолидинона (0,5 г), хлорметилпивалоата (15,7 г) и ацетонитрила (2,4 г) перемешивали в течение 6,5 часов при 100oС. После охлаждения смесь разбавляли диизопропиловым эфиром (10 мл) и полученный порошок отфильтровывали. Порошок подвергали колоночной хроматографии на силикагеле (элюент: этилацетат –> ацетон –> ацетон/этанол= 10/1 –> ацетон/этанол= 5/1), получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил) -2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил]-4-[(2,2-диметилпропаноилокси)метил]-1Н-1,2,4-триазолия (Соединение 2, 0,32 г) в виде белого порошка. Вышеуказанное соединение 2 (0,4 г) кристаллизовали из этилацетата (20 мл), получая белые кристаллы (0,3 г) соединения 2. Т.пл.: 196-197oС (разложение). Элементный анализ: C28H32ClF2N9O4 Вычислено (%): С, 53,21; Н, 5,10; N, 19,94 Найдено (%): С, 53,17; Н, 5,15; N, 19,76 Пример 6 Смесь 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3-[4-(1H-1,2,3-триазол-l-ил)фенил] -2-имидазолидинона (0,3 г) и хлорметилацетата (1,35 г) перемешивали в течение 24 часов при 100oС. Реакционную смесь концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент:метанол/вода=3/2), получая хлорид 4-ацетоксиметил-1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,3-триазол-1-ил)фенил]-1-имидазолидинил]бутил]-1Н-1,2,4-триазолия (Соединение 3, 45 мг) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 2,08 (3Н, с), 3,61~4,08 (4Н, м), 4,65~ 4,75 (1Н, м), 4,86 (1Н, д, J=14 Гц), 5,11 (1Н, д, J=14 Гц), 6,07~ 6,20 (2Н, м), 6,69 (1Н, с), 6,96~7,05 (1Н, м), 7,25-7,36 (2Н, м), 7,82~7,95 (5Н, м), 8,78 (1Н, с), 9,06 (1Н, с), 10,46 (1Н, с).
Пример 7 : 0,97 (3Н, д, J=7 Гц), 2,08 (3Н, с), 3,61~4,08 (4Н, м), 4,65~ 4,75 (1Н, м), 4,86 (1Н, д, J=14 Гц), 5,11 (1Н, д, J=14 Гц), 6,07~ 6,20 (2Н, м), 6,69 (1Н, с), 6,96~7,05 (1Н, м), 7,25-7,36 (2Н, м), 7,82~7,95 (5Н, м), 8,78 (1Н, с), 9,06 (1Н, с), 10,46 (1Н, с).
Пример 7К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -2-имидазолидинона (0,63 г) и ацетонитрила (20 мл) добавляли хлорметилизобутилат (1,71 г) и смесь перемешивали в течение 130 часов при кипении с обратным холодильником. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диизопропиловый эфир (10 мл) и полученный порошок отфильтровывали. Порошок подвергали ОДК колоночной хроматографии (элюент:метанол/вода=3/2) и элюат концентрировали в вакууме. Остаток растворяли в воде (20 мл). Раствор лиофилизовали, получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -1-имидазолидинил] бутил]-4-[(2-метилпропаноилокси)метил] -lH-l,2,4-триазолия (Соединение 4, 0,335 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 1,07 (6Н, д, J=7 Гц), 2,59 (1Н, квинтет, J=7 Гц), 3,60~4,09 (4Н, м), 4,65~4,75 (1Н, м), 4,87 (1Н, д, J= 14 Гц), 5,10 (1Н, д, J=14 Гц), 6,10~6,22 (2Н, м), 6,69 (1Н, с), 6,93~7,02 (1Н, м), 7,23~7,35 (2Н, м), 7,82~7,93 (4Н, м), 7,95 (1Н, с), 8,78 (1Н, с), 9,08 (1Н, с), 10,48 (1Н, с).
Пример 8 : 0,97 (3Н, д, J=7 Гц), 1,07 (6Н, д, J=7 Гц), 2,59 (1Н, квинтет, J=7 Гц), 3,60~4,09 (4Н, м), 4,65~4,75 (1Н, м), 4,87 (1Н, д, J= 14 Гц), 5,10 (1Н, д, J=14 Гц), 6,10~6,22 (2Н, м), 6,69 (1Н, с), 6,93~7,02 (1Н, м), 7,23~7,35 (2Н, м), 7,82~7,93 (4Н, м), 7,95 (1Н, с), 8,78 (1Н, с), 9,08 (1Н, с), 10,48 (1Н, с).
Пример 8К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1H-тетразол-1-ил)фенил] -2-имидазолидикона (0,50 г) и ацетона (20 мл) добавляли хлорметилизобутилат (1,37 г) и смесь перемешивали в течение 50 часов при кипении с обратным холодильником. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диизопропиловый эфир (10 мл) и полученный порошок отфильтровывали. Порошок подвергали ОДК колоночной хроматографии (элюент: метанол/вода=3/2). Элюат концентрировали в вакууме. Остаток растворяли в воде (20 мл). Раствор лиофилизовали, получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил]-4-[(2-метилпропаноилокси)метил] -1Н-1,2,4-триазолия (Соединение 5, 0,15 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 1,07 (6Н, д, J=7 Гц), 2,59 (1Н, квинтет, J=7 Гц), 3,61~4,08 (4Н, м), 4,65~4,75 (1Н, м), 4,87 (1Н, д, J= 14 Гц), 5,11 (1Н, д, J=14 Гц), 6,14~6,22 (2Н, м), 6,69 (1Н, с), 6,92~7,03 (1Н, м), 7,22~7,37 (2Н, м), 7,90 (4Н, с), 9,09 (1Н, с), 10,08 (1Н, с), 10,48 (1Н, с).
Продукт (50 мг) кристаллизовали из насыщенного водного раствора хлорида натрия (1 мл), получая белые порошкоообразные кристаллы соединения 5 (41 мг).
Т.пл.: 217-219oС (разложение).
Элементный анализ: C27H30ClF2N9O4 : 0,97 (3Н, д, J=7 Гц), 1,07 (6Н, д, J=7 Гц), 2,59 (1Н, квинтет, J=7 Гц), 3,61~4,08 (4Н, м), 4,65~4,75 (1Н, м), 4,87 (1Н, д, J= 14 Гц), 5,11 (1Н, д, J=14 Гц), 6,14~6,22 (2Н, м), 6,69 (1Н, с), 6,92~7,03 (1Н, м), 7,22~7,37 (2Н, м), 7,90 (4Н, с), 9,09 (1Н, с), 10,08 (1Н, с), 10,48 (1Н, с).
Продукт (50 мг) кристаллизовали из насыщенного водного раствора хлорида натрия (1 мл), получая белые порошкоообразные кристаллы соединения 5 (41 мг).
Т.пл.: 217-219oС (разложение).
Элементный анализ: C27H30ClF2N9O4 0,5 H2O 0,5 H2OВычислено (%): С, 51,72; Н, 4,98; N, 20,10 Найдено (%):С, 51,79; Н, 4,83; N, 20,04 Пример 9 К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-3-ил)пропил] -3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -2-имидазолидинона (100 мг) и 1-хлорэтил-этилкарбоната (1,0 г) добавляли ацетонитрил (0,5 мл) и смесь перемешивали в течение 60 часов при 85oС. После охлаждения смесь разбавляли диизопропиловым эфиром (4 мл) и полученный порошок отфильтровывали. Порошок подвергали ОДК колоночной хроматографии (элюент: метанол/вода= 3/2). Элюат концентрировали в вакууме. Остаток растворяли в воде (10 мл) и лиофилизовали, получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[1-(этоксикарбонилокси)этил] -1Н-1,2,4-триазолия (Соединение 6, 36 мг) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 1,21, 1,22 (3Н, т, J=7 Гц), 1,80 (3H, д, J=6 Гц), 3,61-4,25 (6Н, м), 4,63~5,09 (3Н, м), 6,67~6,83 (2Н, м), 6,94~ 7,03 (1Н, м), 7,21~7,37 (2Н, м), 7,82~8,05 (5Н, м), 8,79 (1Н, с), 9,22 (0,5Н, с), 9,27 (0,5Н, с), 10,70 (0,5Н, с), 10,80 (0,5Н, с).
Пример 10 : 0,97 (3Н, д, J=7 Гц), 1,21, 1,22 (3Н, т, J=7 Гц), 1,80 (3H, д, J=6 Гц), 3,61-4,25 (6Н, м), 4,63~5,09 (3Н, м), 6,67~6,83 (2Н, м), 6,94~ 7,03 (1Н, м), 7,21~7,37 (2Н, м), 7,82~8,05 (5Н, м), 8,79 (1Н, с), 9,22 (0,5Н, с), 9,27 (0,5Н, с), 10,70 (0,5Н, с), 10,80 (0,5Н, с).
Пример 10К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(lH-тетразол-1-ил)фенил] -2-имидазолидинона (0,61 г) и 1-хлорэтил-этилкарбоната (3,7 г) добавляли ацетонитрил (1 мл) и смесь перемешивали в течение 38 часов при 95oС. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диизопропиловый эфир (10 мл) и полученный порошок отфильтровывали. Порошок подвергали ОДК колоночной хроматографии (элюент: метанол/вода=3/2). Элюат концентрировали в вакууме. Остаток растворяли в воде (10 мл) и лиофилизовали, получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(lH-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[1-(этоксикарбонилокси)этил] -1Н-1,2,4-триазолия (Соединение 7, 90 мг) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 1,21, 1,22 (3Н, т, J=7 Гц), 1,79, 1,80 (3Н, д, J=6 Гц), 3,62~4,23 (6Н, м), 4,65~5,10 (3Н, м), 6,69~6,82 (2К, м), 6,94~7,04 (1Н, м), 7,26~7,38 (2Н, м), 7,90 (4Н, с), 9,23 (0,5Н, с), 9,27 (0,5Н, с), 10,08 (1Н, с), 10,72 (0,5Н, с), 10,82 (0,5Н, с).
Пример 11 : 0,97 (3Н, д, J=7 Гц), 1,21, 1,22 (3Н, т, J=7 Гц), 1,79, 1,80 (3Н, д, J=6 Гц), 3,62~4,23 (6Н, м), 4,65~5,10 (3Н, м), 6,69~6,82 (2К, м), 6,94~7,04 (1Н, м), 7,26~7,38 (2Н, м), 7,90 (4Н, с), 9,23 (0,5Н, с), 9,27 (0,5Н, с), 10,08 (1Н, с), 10,72 (0,5Н, с), 10,82 (0,5Н, с).
Пример 11Смесь 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -2-имидазолидинона (0,5 г), хлорметилизопропилкарбоната (3,2 г) и ацетонитрила (1 мл) перемешивали в течение 25 часов при 100oС. После охлаждения смесь разбавляли диизопропиловым эфиром (10 мл) и полученный порошок отфильтровывали и подвергали колоночной хроматографии на силикагеле (элюент:этилацетат –> ацетон –> ацетон/этанол= 10/1 –> ацетон/этанол=5/1). Растворитель отгоняли при пониженном давлении и остаток кристаллизовали из этилацетата. Кристаллы растворяли в воде (10 мл). Водный раствор лиофилизовали, получая хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[(изопропоксикарбонилокси)метил]-1H-1,2,4-триазолия (Соединение 9, 0,18 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,98 (3Н, д, J= 7 Гц), 1,24 (6Н, д, J=6,4 Гц), 3,52-3,67 (1Н, м), 3,93-4,00 (3Н, м), 4,69 (1Н, к, J=7 Гц), 4,80 (1Н, квинтет, J= 6,4 Гц), 4,88 (1Н, д, J=13,8 Гц), 5,05 (1Н, д, J=13,8 Гц), 6,12 (1Н, д, J= 10,8 Гц), 6,20 (1Н, д, J=10,8 Гц), 6,98-7,03 (1Н, м), 7,23-7,36 (2Н, м), 7,84 (2Н, д, J=8 Гц), 7,91 (2Н, д, J=8 Гц), 7,94 (1Н, д, J=1Гц), 8,77 (1Н, д, J=1 Гц), 9,10 (1H, с), 10,38 (1.Н, с). Полученный выше лиофилизованный продукт соединения 9 (0,05 г) перекристаллизовывали из ацетонитрила (3 мл), получая белые кристаллы (0,01 г) соединения 9.
Элементный анализ: C28H31ClF2N5O5 : 0,98 (3Н, д, J= 7 Гц), 1,24 (6Н, д, J=6,4 Гц), 3,52-3,67 (1Н, м), 3,93-4,00 (3Н, м), 4,69 (1Н, к, J=7 Гц), 4,80 (1Н, квинтет, J= 6,4 Гц), 4,88 (1Н, д, J=13,8 Гц), 5,05 (1Н, д, J=13,8 Гц), 6,12 (1Н, д, J= 10,8 Гц), 6,20 (1Н, д, J=10,8 Гц), 6,98-7,03 (1Н, м), 7,23-7,36 (2Н, м), 7,84 (2Н, д, J=8 Гц), 7,91 (2Н, д, J=8 Гц), 7,94 (1Н, д, J=1Гц), 8,77 (1Н, д, J=1 Гц), 9,10 (1H, с), 10,38 (1.Н, с). Полученный выше лиофилизованный продукт соединения 9 (0,05 г) перекристаллизовывали из ацетонитрила (3 мл), получая белые кристаллы (0,01 г) соединения 9.
Элементный анализ: C28H31ClF2N5O5 H2O H2OВычислено (%): С, 51,65; Н, 5,11; N, 17,21 Найдено (%):С, 51,64; Н, 4,68; N, 17,06 Пример 12 К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -2-имидазолидинона (0,5 г) и ацетонитрила (10 мл) добавляли бромметилацетат (0,1 мл) и смесь перемешивали в течение 24 часов при 50oС. Реакционную смесь очищали флэш-хроматографией на силикагеле (силикагель: 25 г, элюент:этилацетат –> ацетон –> ацетон/этанол=10/1). Остаток очищали кристаллизацией из этанола, получая бромид 4-ацетоксиметил-1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,4-триазол-1-ил)фенил]-1-имидазолидинил]бутил]-1Н-1,2,4-триазолия (Соединение 10, 0,135 г) в виде бесцветных кристаллов. 1H-ЯМР (d6-ДМСО)  : 0,98 (3Н, д, J=7 Гц), 2,08 (3Н, с), 3,62-4,08 (4Н, м), 4,66-4,75 (1Н, м), 4,87 (1Н, д, J=14 Гц), 4,99 (1Н, д, J=14 Гц), 6,07-6,21 (2Н, м), 6,34 (1Н, с), 6,96-7,07 (1Н, м), 7,24 – 7,35 (2Н, м), 7,83-7,94 (5Н, м), 8,80 (1Н, с), 9,09 (1H, с), 10,24 (1Н, с).
Пример 13 : 0,98 (3Н, д, J=7 Гц), 2,08 (3Н, с), 3,62-4,08 (4Н, м), 4,66-4,75 (1Н, м), 4,87 (1Н, д, J=14 Гц), 4,99 (1Н, д, J=14 Гц), 6,07-6,21 (2Н, м), 6,34 (1Н, с), 6,96-7,07 (1Н, м), 7,24 – 7,35 (2Н, м), 7,83-7,94 (5Н, м), 8,80 (1Н, с), 9,09 (1H, с), 10,24 (1Н, с).
Пример 13К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил]-3-[4-(1H-тетразол-1-ил)фенил]-2-имидазолидинона (0,5 г) и ацетонитрила (10 мл) добавляли бромметилацетат (0,2 мл) и смесь перемешивали при 50oС в течение 16 часов. Реакционную смесь очищали флэш-хроматографией на силикагеле (силикагель: 25 г, элюент:этилацетат –> ацетон –> ацетон/этанол= 10/1). Остаток очищали кристаллизацией из этанола, получая бромид 4-ацетоксиметил-1-[ (2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил]бутил]-1Н-1,2,4-триазолия (Соединение 11, 0,39 г) в виде бесцветных кристаллов. 1H-ЯМР (d6-ДМСО)  : 0,99 (3Н, д, J=7 Гц), 2,09 (3Н, с), 3,64-4,08 (4Н, м), 4,68-4,72 (1H, м), 4,86 (1H, д, J=14 Гц), 5,01 (1H, д, J=14 Гц), 6,07-6,21 (2Н, м), 6,35 (1H, с), 7,00-7,09 (1H, м), 7,28 -7,38 (2Н, м), 7,91 (4Н, с), 9,10 (1H, с), 10,08 (1H, с), 10,28 (1H, с).
Пример 14 : 0,99 (3Н, д, J=7 Гц), 2,09 (3Н, с), 3,64-4,08 (4Н, м), 4,68-4,72 (1H, м), 4,86 (1H, д, J=14 Гц), 5,01 (1H, д, J=14 Гц), 6,07-6,21 (2Н, м), 6,35 (1H, с), 7,00-7,09 (1H, м), 7,28 -7,38 (2Н, м), 7,91 (4Н, с), 9,10 (1H, с), 10,08 (1H, с), 10,28 (1H, с).
Пример 14К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил]-3-[4-(lH-тетразол-1-ил)фенил]-2-имидазолидинона (0,5 г) и ацетонитрила (10 мл) добавляли (2,3,4,5-тетрагидрофурфурил)иодметилкарбонат (0,594 г) и смесь перемешивали в течение 15 часов при 50oС. Реакционную смесь подвергали флэш-хроматографии на силикагеле (элюент: этилацетат –> ацетон –> ацетон/этанол=10/1) и фракции, содержащие целевое соединение концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент: метанол/вода= 3/2). Фракцию, содержащую целевое соединение, концентрировали и остаток лиофилизовали, получая иодид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил]-1-имидазолидинил]бутил]-4-[(2,3,4,5-тетрагидрофурфурил)оксикарбонилоксиметил] -1Н-1,2,4-триазолия (Соединение 30, 0,4 г) в виде бесцветного порошка. Продукт растворяли в воде (15 мл) и раствор подвергали действию ионообменной смолы [Dowex 1х8 (Сl– тип)]. Фракцию, содержащую целевое соединение, концентрировали при пониженном давлении и лиофилизозали, получая хлорид 1-[ (2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1H-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[(2,3,4,5-тетрагидрофурфурил)оксикарбонилоксиметил]-1Н-1,2,4-триазолия (Соединение 21, 0,24 г) в виде бесцветного порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 1,52-1,99 (4Н, м), 3,61-4,17 (9Н, м), 4,67-4,82 (1Н, м), 4,86 (1Н, д, J=14 Гц), 5,10 (1Н, д, J=14 Гц), 6,11-6,25 (2Н, м), 6,65 (1Н, с), 6,69-7,06 (1Н, м), 7,28-7,39 (2Н, м), 7,90 (4Н, с), 9,10 (1Н, с), 10,08 (1Н, с), 10,47 (1Н, С).
Пример 15 : 0,97 (3Н, д, J=7 Гц), 1,52-1,99 (4Н, м), 3,61-4,17 (9Н, м), 4,67-4,82 (1Н, м), 4,86 (1Н, д, J=14 Гц), 5,10 (1Н, д, J=14 Гц), 6,11-6,25 (2Н, м), 6,65 (1Н, с), 6,69-7,06 (1Н, м), 7,28-7,39 (2Н, м), 7,90 (4Н, с), 9,10 (1Н, с), 10,08 (1Н, с), 10,47 (1Н, С).
Пример 15Бромид 4-ацетоксиметил-1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -1Н-1,2,4-триазолия (Соединение 11, 0,81 г) подвергали действию ионообменной смолы [Dowex 1х8 (Сl–тип) ] (элюент: вода). Элюат лиофилизовали, получая хлорид 4-ацетоксиметил-1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1H-тетразол-1-ил)фенил] -1-имидазолидинил]бутил]-1Н-1,2,4-триазолия (Соединение 12, 0,61 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 2,08 (3Н, с), 3,62-3,66 (1Н, м), 3,90-4,07 (3Н, м), 4,69 (1Н, к, J=7,4 Гц), 4,85 (1Н, д, J=14,6 Гц), 5,04 (1Н, д, J=14,6 Гц), 6,09 (1Н, д, J=11 Гц), 6,16 (1Н, д, J=11 Гц), 6,55 (1Н, с), 6,98-7,06 (1Н, м), 7,23 -7,38 (2Н, м), 7,90 (4Н, с), 9,06 (1Н, с), 10,06 (1Н, с), 10,34 (1Н, с).
Полученный выше лиофилизованный продукт (1,1 г) соединения 12 перекристаллизовывали из этанола (20 мл), получая соединение 12 в виде белых кристаллов (1 г).
Элементный анализ: C25H26ClF2N9O4 : 0,97 (3Н, д, J=7 Гц), 2,08 (3Н, с), 3,62-3,66 (1Н, м), 3,90-4,07 (3Н, м), 4,69 (1Н, к, J=7,4 Гц), 4,85 (1Н, д, J=14,6 Гц), 5,04 (1Н, д, J=14,6 Гц), 6,09 (1Н, д, J=11 Гц), 6,16 (1Н, д, J=11 Гц), 6,55 (1Н, с), 6,98-7,06 (1Н, м), 7,23 -7,38 (2Н, м), 7,90 (4Н, с), 9,06 (1Н, с), 10,06 (1Н, с), 10,34 (1Н, с).
Полученный выше лиофилизованный продукт (1,1 г) соединения 12 перекристаллизовывали из этанола (20 мл), получая соединение 12 в виде белых кристаллов (1 г).
Элементный анализ: C25H26ClF2N9O4Вычислено (%): С; 50,89, Н; 4,44, N; 21,37, Cl; 6,01 Найдено (%): С; 50,61, Н; 4,38, N; 21,24, Cl; 5,80. Кристаллы (0,63 г) соединения 12 растворяли в воде (10 мл) и раствор оставляли на ночь при 0oС, получая гидрат (0,61 г) соединения 12 в виде белых кристаллов. Элементный анализ: C25H26ClF2N9  H2O H2OВычислено (%): С; 49,39, Н; 4,64, N; 20,73 Найдено (%): С; 49,56, Н, 4,64, N; 20,85. Пример 16 Бромид 4-ацетоксиметил-1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -1Н-1,2,4-триазолия (Соединение 11, 0,5 г) растворяли в тетрагидрофуране (100 мл). К раствору добавляли насыщенный водный раствор (100 мл) хлорида натрия. Смесь встряхивали и органический слой отделяли. Встряхивание с раствором хлорида натрия с последующим отделением органического слоя повторяли пять раз. Органический слой сушили над сульфатом магния и растворитель отгоняли. Остаток перекристаллизовывали из этанола (5 мл), получая хлорид 4-ацетоксиметил-1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил]-1-имидазолидинил]бутил]-1Н-1,2,4-триазолия (Соединение 12, 0,28 г) в виде белых кристаллов. Физико-химические свойства этого продукта были идентичны свойствам кристаллов соединения 12, полученных кристаллизацией из этанола в примере 15. Пример 17 Смесь 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3- (1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(lH-тетразол-1-ил)фенил]-2-имидазолидинона (1 г), иодометилацетата (0,8 г) и ацетонитрила (15 мл) перемешивали в течение 15 часов при 50-55oС. Растворитель отгоняли и остаток растворяли в тетрагидрофуране (100 мл). Раствор промывали один раз насыщенным водным раствором (100 мл) хлорида натрия, содержащим небольшое количество тиосульфата натрия с последующим промыванием в течение четырех раз насыщенным водным раствором (100 мл) хлорида натрия. Органический слой сушили над сульфатом магния и растворитель отгоняли при пониженном давлении. Остаток подвергали хроматографии на силикагеле (элюент:этилацетат –> ацетон –> ацетон/этанол =10/1 –> ацетон/этанол= 5/1). Растворитель отгоняли и остаток кристаллизовали из этанола (10 мл), получая хлорид 4-ацетоксиметил-1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -1Н-1,2,4-триазолия (Соединение 12, 0,44 г) в виде белых кристаллов. Физико-химические свойства этого продукта были идентичны свойствам кристаллов соединения 12, полученных кристаллизацией из этанола в примере 15. Пример 18 Бромид 4-ацетоксиметил-1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -1-имидазолидинил] бутил]-1Н-1,2,4-триазолия (Соединение 10, 0,03 г) подвергали действию ионообменной смолы [Dowex 1х8 (Сl–тип)] (элюент: вода). Элюат лиофилизовали, получая хлорид 4-ацетоксиметил-1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -1-имидазолидинил] бутил] -1Н-1,2,4-триазолия (Соединение 3, 0,02 г) в виде белого порошка. Элементный анализ: C26H27ClF2N8O4  H2O H2OВычислено (%): С; 49,96, Н; 5,00, N; 17,93, Cl; 5,67 Найдено (%): С; 49,98, Н, 4,57, N; 17,95, Cl; 6,04 Пример 19 Смесь 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1H-1,2,4-триазол-1-ил)пропил] -3-[4-(lH-тетразол-1-ил)фенил] -2-имидазолидинона (0,5 г), хлорметилпропил. карбоната (3,2 г) и ацетонитрила (1 мл) перемешивали в течение 12 часов при 100oС. После охлаждения смесь разбавляли диизопропиловым эфиром (10 мл) и полученный порошок отфильтровывали. Порошок подвергали хроматографии на силикагеле (элюент: этилацетат –> ацетон –> ацетон/этанол=10/1 –> ацетон/этанол=5/1). Растворитель отгоняли и остаток подвергали ОДК колоночной хроматографии (элюент:метанол/вода=3/2), получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(lH-тетразол-1-ил)фенил] -1-имидазолидинил] бутил]-4-пропоксикарбонилоксиметил-lH-l,2,4-триазолия (Соединение 19, 0,02 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,88 (3Н, т, J=7,8 Гц), 0,97 (3Н, д, J=7,0 Гц), 1,62 (2Н, тк, J=7,8 Гц), 3,63-3,67 (1Н, м), 3,80-4,05 (3Н, м), 4,09 (2Н, т, J=7,8 Гц), 4,69 (1Н, к, J=7,0 Гц), 4,88 (1Н, д, J=14,4 Гц), 5,05 (1Н, д, J=14,4 Гц), 6,13 (1Н, д, J=10,6 Гц), 6,21 (1Н, д, J=10,6 Гц), 6,52 (1Н, с), 6,94-7,02 (1Н, м), 7,24-7,33 (2Н, м), 7,90 (4Н, с), 9,10 (1Н, с), 10,05 (1Н, с5, 10,39 (1Н, с).
Пример 20 : 0,88 (3Н, т, J=7,8 Гц), 0,97 (3Н, д, J=7,0 Гц), 1,62 (2Н, тк, J=7,8 Гц), 3,63-3,67 (1Н, м), 3,80-4,05 (3Н, м), 4,09 (2Н, т, J=7,8 Гц), 4,69 (1Н, к, J=7,0 Гц), 4,88 (1Н, д, J=14,4 Гц), 5,05 (1Н, д, J=14,4 Гц), 6,13 (1Н, д, J=10,6 Гц), 6,21 (1Н, д, J=10,6 Гц), 6,52 (1Н, с), 6,94-7,02 (1Н, м), 7,24-7,33 (2Н, м), 7,90 (4Н, с), 9,10 (1Н, с), 10,05 (1Н, с5, 10,39 (1Н, с).
Пример 20Смесь 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-кл)пропил] -3-[4-(lH-тетразол-1-ил)фенил]-2-имидазолидинона (1 г), иодметилпропилкарбоната (0,9 г) и ацетонитрила (15 мл) перемешивали в течение 12 часов при 50-55oС. Смесь подвергали хроматографии на силикагеле (элюент: этилацетат/гексан= 5/1 –> этилацетат –> ацетон –> ацетон/этанол= 10/1 –> ацетон/этанол=5/1) и затем ОДК колоночной хроматографии (элюент:метанол/вода= 3/2), получая иодид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил]бутил]-4-пропоксикарбонилоксиметил-lH-l, 2,4-триазолия (Соединение 20, 1 г) в виде бледно-желтого порошка. 1H-ЯМР (d6-ДМСО)  : 0,88 (3Н, т, C=7,2 Гц), 0,98 (3Н, д, J=7,2 Гц), 1,61 (2Н, тк, J=7,2 Гц), 3,50-3,70 (1Н, м), 3,84-4,13 (3Н, м), 4,09 (2Н, т, J=7,2 Гц), 4,68 (1Н, к, J=7,2 Гц), 4,86 (1Н, д, J=13,8 Гц), 4,96 (1Н, д, J=13,8 Гц), 6,12 (1Н, д, J=11 Гц), 6,20 (1Н, д, J=11 Гц), 6,33 (1Н, с), 6,97-7,07 (1Н, м), 7,21-7,38 (2Н, м), 7,90 (4Н, с), 9,11 (1Н, с), 10,05 (1H, с), 10,21 (1Н, с).
Пример 21 : 0,88 (3Н, т, C=7,2 Гц), 0,98 (3Н, д, J=7,2 Гц), 1,61 (2Н, тк, J=7,2 Гц), 3,50-3,70 (1Н, м), 3,84-4,13 (3Н, м), 4,09 (2Н, т, J=7,2 Гц), 4,68 (1Н, к, J=7,2 Гц), 4,86 (1Н, д, J=13,8 Гц), 4,96 (1Н, д, J=13,8 Гц), 6,12 (1Н, д, J=11 Гц), 6,20 (1Н, д, J=11 Гц), 6,33 (1Н, с), 6,97-7,07 (1Н, м), 7,21-7,38 (2Н, м), 7,90 (4Н, с), 9,11 (1Н, с), 10,05 (1H, с), 10,21 (1Н, с).
Пример 21Иодид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил]-4-пропоксикарбонилоксиметил-1H-1,2,4-триазолия (Соединение 20, 0,3 г) растворяли в смеси тетрагидрофуран/этилацетат (3/1) (100 мл) и раствор промывали четыре раза насыщенным водным раствором (50 мл) хлорида натрия. Органический слой сушили над сульфатом натрия и растворитель отгоняли. Остаток кристаллизовали из этанол/ацетон, получая хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил]-4-пропоксикарбонилоксиметил-1H-1,2,4-триазолия (Соединение 19, 0,09 г) в виде белого порошка. Элементный анализ: С27Н30СlF2N9O5  0,5Н2О 0,5Н2ОВычислено (%): С; 50,43, Н; 4,86, N; 19,60, Cl; 5,51 Найдено (%): С; 50,25, Н, 4,71, N; 19,31, Cl; 5,42 Пример 22 К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -2-имидазолидинона (0,80 г) и хлорметил пропаната (4,07 г) добавляли ацетонитрил (1,6 мл) и смесь перемешивали в течение 12 часов при 100oС в атмосфере аргона. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли диизопропиловый эфир (8 мл). Полученный порошок отфильтровывали. Порошок подвергали флэш-хроматографии на силикагеле (элюент:этилацетат –> ацетон –> ацетон/этанол= 9/1 –> 4/1) и фракцию, содержащую целевое соединение концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент:метанол/вода=3/2). Элюат концентрировали в вакууме и остаток растворяли в воде (10 мл). Раствор лиофилизовали, получая хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -1-имидазолидинил]бутил]-4-пропаноилоксиметил-1H-1,2,4-триазолия (Соединение 13, 0,11 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,92-1,12 (6Н, м), 2,25-2,55 (2Н, м), 3,60~4,10 (4Н, м), 4,64~ 4,75 (1Н, м), 4,86 (1Н, д, J=14 Гц), 5,08 (1Н, д, J=14 Гц), 6,09~ 6,21 (2Н, м), 6,64 (1Н, с), 6,96~7,06 (1Н, м), 7,22~7,42 (2Н, м), 7,80~8,02 (5Н, м), 8,80 (1Н, ушир.), 9,07 (1К, с), 10,42 (1Н, с).
Пример 23 : 0,92-1,12 (6Н, м), 2,25-2,55 (2Н, м), 3,60~4,10 (4Н, м), 4,64~ 4,75 (1Н, м), 4,86 (1Н, д, J=14 Гц), 5,08 (1Н, д, J=14 Гц), 6,09~ 6,21 (2Н, м), 6,64 (1Н, с), 6,96~7,06 (1Н, м), 7,22~7,42 (2Н, м), 7,80~8,02 (5Н, м), 8,80 (1Н, ушир.), 9,07 (1К, с), 10,42 (1Н, с).
Пример 23К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1H-тетразол-1-ил)фенил] -2-имидазолидинона (0,80 г) и хлорметилпропаната (4,07 г) добавляли ацетонитрил (1,6 мл) и смесь перемешивали в течение 10 часов при 100oС в атмосфере аргона. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли диизопропиловый эфир (8 мл). Полученный порошок отфильтровывали. Порошок подвергали флэш-хроматографии на силикагеле (элюент:этилацетат –> ацетон –> ацетон/этанол= 9/1 –> 5/1) и фракцию, содержащую целевое соединение, концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент:метанол/вода=3/2). Элюат концентрировали в вакууме и остаток растворяли в воде (10 мл). Раствор лиофилизовали, получая хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1H-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-пропаноилоксиметил-1Н-1,2,4-триазолия (Соединение 14, 0,04 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7,4 Гц), 1,01 (3Н, т, J=7,4 Гц), 2,38 (2Н, к, J=7,4 Гц), 3,61-4,09 (4Н, м), 4,65-4,75 (1Н, м), 4,86 (1Н, д, J=14 Гц), 5,08 (1Н, д, J=14 Гц), 6,11 (1H, д, J=11 Гц), 6,19 (1H, д, J=11 Гц), 6,61 (1Н, с), 6,96-7,06 (1H, м), 7,25-7,49 (2Н, м), 7,90 (4Н, с), 9,07 (1H, с), 10,07 (1H, с), 10,40 (1H, с).
Пример 24 : 0,97 (3Н, д, J=7,4 Гц), 1,01 (3Н, т, J=7,4 Гц), 2,38 (2Н, к, J=7,4 Гц), 3,61-4,09 (4Н, м), 4,65-4,75 (1Н, м), 4,86 (1Н, д, J=14 Гц), 5,08 (1Н, д, J=14 Гц), 6,11 (1H, д, J=11 Гц), 6,19 (1H, д, J=11 Гц), 6,61 (1Н, с), 6,96-7,06 (1H, м), 7,25-7,49 (2Н, м), 7,90 (4Н, с), 9,07 (1H, с), 10,07 (1H, с), 10,40 (1H, с).
Пример 24К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -2-имидазолидинона (0,50 г) и хлорметилэтил карбоната (2,9 г) добавляли ацетонитрил (0,5 мл) и смесь перемешивали в течение 22 часов при 100oС. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диизопропиловый эфир (10 мл) и полученный порошок отфильтровывали. Порошок подвергали флэш-хроматографии на силикагеле (элюент:этилацетат/ацетон=1/1 –> ацетон –> ацетон/этанол=9/1 –> 4/1) и фракцию, содержащую целевое соединение, концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент: метанол/вода=3/2). Элюат концентрировали в вакууме и остаток растворяли в воде (15 мл). Раствор лиофилизовали, получая хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -1-имидазолидинил] бутил] -4-этоксикарбонилоксиметил-1Н-1,2,4-триазолия (Соединение 15, 0,04 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 1,22 (3Н, т, J=7 Гц), 3,60~ 4,08 (4Н, м), 4,18 (2Н, к, J=7 Гц), 4,63~4,73 (1H, м), 4,87 (1H, д, J=14 Гц), 5,10 (1H, д, J=l4 Гц), 6,13 (1H, д, J=11 Гц), 6,21 (1H, д, J=11 Гц), 6,65 (1H, с), 6,96~7,04 (1Н, м), 7,24~7,37 (2Н, м), 7,82~7,95 (5Н, с), 8,78 (1Н, д, J=1 Гц), 9,09 (1Н, с), 10,48 (1Н, с).
Пример 25 : 0,97 (3Н, д, J=7 Гц), 1,22 (3Н, т, J=7 Гц), 3,60~ 4,08 (4Н, м), 4,18 (2Н, к, J=7 Гц), 4,63~4,73 (1H, м), 4,87 (1H, д, J=14 Гц), 5,10 (1H, д, J=l4 Гц), 6,13 (1H, д, J=11 Гц), 6,21 (1H, д, J=11 Гц), 6,65 (1H, с), 6,96~7,04 (1Н, м), 7,24~7,37 (2Н, м), 7,82~7,95 (5Н, с), 8,78 (1Н, д, J=1 Гц), 9,09 (1Н, с), 10,48 (1Н, с).
Пример 25К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1H-тетразол-1-ил)фенил] -2-имидазолидинона (1,31 г) и этилиодметил карбоната (1,25 г) добавляли ацетонитрил (20 мл) и смесь перемешивали в течение 14 часов при 60oС в атмосфере аргона. Реакционную смесь концентрировали при пониженном давлении и остаток подвергали флэш-хроматографии на силикагеле (элюент:этилацетат –> ацетон –> ацетон/этанол= 4/1). Фракцию, содержащую целевое соединение, концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент:метанол/вода= 3/2), получая иодид 1-[(2R,3R)-2-[2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил]-1-имидазолидинил]бутил]-4-этоксикарбонилоксиметил-1Н-1,2,4-триазолия (Соединение 17, 1,1 г) в виде бледно-желтого порошка. 1H-ЯМР (d6-ДМСО)  : 0,99 (3Н, д, J=7 Гц), 1,23 (3Н, т, J=7 Гц), 3,64-4,05 (4Н, м), 4,19 (2Н, к, J=7 Гц), 4,64-4,74 (1Н, м), 4,87 (1Н, д, J=14 Гц), 4,97 (1Н, д, J=14 Гц), 6,13 (1H, д, J=11 Гц), 6,21 (1H, д, J=11 Гц), 6,33 (1H, ушир.), 6,99-7,07 (1H, м), 7,22-7,39 (2Н, м), 7,91 (4Н, с), 9,12 (1H, с), 10,06 (1H, с), 10,23 (1H, с).
Пример 26 : 0,99 (3Н, д, J=7 Гц), 1,23 (3Н, т, J=7 Гц), 3,64-4,05 (4Н, м), 4,19 (2Н, к, J=7 Гц), 4,64-4,74 (1Н, м), 4,87 (1Н, д, J=14 Гц), 4,97 (1Н, д, J=14 Гц), 6,13 (1H, д, J=11 Гц), 6,21 (1H, д, J=11 Гц), 6,33 (1H, ушир.), 6,99-7,07 (1H, м), 7,22-7,39 (2Н, м), 7,91 (4Н, с), 9,12 (1H, с), 10,06 (1H, с), 10,23 (1H, с).
Пример 26Иодид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил]бутил]-4-этоксикарбонилоксиметил-lH-1,2,4-триазолия (Соединение 17, 1,10 г) подвергали ионообменной хроматографии (DOWEX 1х8, Сl– тип, 300 мл) и фракцию, содержащую целевое соединение концентрировали при пониженном давлении. Остаток перекристаллизовывали из этанола, получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-этоксикарбонилоксиметил-1Н-1,2,4-триазолия (Соединение 16, 0,70 г) в виде бесцветных порошкообразных кристаллов. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 1,22 (3Н, т, J=7 Гц), 3,60-4,08 (4Н, м), 4,18 (2Н, к, J=7 Гц), 4,63-4,73 (1Н, м), 4,87 (1Н, д, J=14 Гц), 5,10 (1Н, д, J=14 Гц), 6,13 (1H, д, J=11 Гц), 6,21 (1H, д, J=11 Гц), 6,66 (1H, с), 6,96-7,04 (1H, м), 7,24-7,36 (2Н, м), 7,90 (4Н, c), 9,09 (1H, с), 10,07 (1H, с), 10,48 (1Н, с).
Пример 27 : 0,97 (3Н, д, J=7 Гц), 1,22 (3Н, т, J=7 Гц), 3,60-4,08 (4Н, м), 4,18 (2Н, к, J=7 Гц), 4,63-4,73 (1Н, м), 4,87 (1Н, д, J=14 Гц), 5,10 (1Н, д, J=14 Гц), 6,13 (1H, д, J=11 Гц), 6,21 (1H, д, J=11 Гц), 6,66 (1H, с), 6,96-7,04 (1H, м), 7,24-7,36 (2Н, м), 7,90 (4Н, c), 9,09 (1H, с), 10,07 (1H, с), 10,48 (1Н, с).
Пример 27Смесь 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1H-тетразол-1-ил)фенил] -2-имидазолидинона (0,5 г), хлорметилизопропил карбоната (3,17 г) и ацетонитрила (1 мл) перемешивали в течение 6 часов при 100oС. После охлаждения смесь разбавляли диизопропиловым эфиром (10 мл). Образовавшийся порошок отфильтровывали. Порошок подвергали хроматографии на силикагеле (элюент: этилацетат –> ацетон –> ацетон/этанол=10/1 –> ацетон/этанол=5/1). Растворитель отгоняли и остаток кристаллизовали из этанол/ацетон, получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-(изопропоксикарбонилокси)метил-1H-1,2,4-триазолия (Соединение 18, 110 мг) в виде белых порошкообразных кристаллов. 1H-ЯМР (d6-ДМСО)  : 0,98 (3Н, д, J=7,4 Гц), 1,24 (6Н, д, J=6,2 Гц), 3,62-3,66 (1Н, м), 3,98-4,0 (3Н, м), 4,69 (1Н, к, J=7,4 Гц), 4,80 (1Н, квинтет, J= 6,2 Гц), 4,87 (1Н, д, J=14,4 Гц), 5,04 (1Н, д, J=14,4 Гц), 6,11 (1Н, д, J= 11 Гц), 6,19 (1Н, д, J=11 Гц), 6,51 (1Н, с), 6,96-7,03 (1Н, м), 7,22-7,38 (2Н, м), 7,90 (4Н, с), 9,10 (1Н, с), 10,06 (1Н, с), 10,36 (1Н, с).
Пример 28 : 0,98 (3Н, д, J=7,4 Гц), 1,24 (6Н, д, J=6,2 Гц), 3,62-3,66 (1Н, м), 3,98-4,0 (3Н, м), 4,69 (1Н, к, J=7,4 Гц), 4,80 (1Н, квинтет, J= 6,2 Гц), 4,87 (1Н, д, J=14,4 Гц), 5,04 (1Н, д, J=14,4 Гц), 6,11 (1Н, д, J= 11 Гц), 6,19 (1Н, д, J=11 Гц), 6,51 (1Н, с), 6,96-7,03 (1Н, м), 7,22-7,38 (2Н, м), 7,90 (4Н, с), 9,10 (1Н, с), 10,06 (1Н, с), 10,36 (1Н, с).
Пример 28К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил]-3-[4-(1H-тетразол-1-ил)фенил]-2-имидазолидинона (2,5 г) и (1,3-диоксан-5-ил)иодметилкарбоната (3 г) добавляли ацетонитрил (40 мл) и смесь перемешивали в течение 12 часов при 50-55oС. Смесь подвергали хроматографии на силикагеле (элюент:этилацетат/гексан=1/1 –> этилацетат/гексан= 10/1 –> этилацетат –> ацетон –> ацетон/этанол=5/1), получая иодид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[(1,3-диоксан-5-ил)оксикарбонилоксиметил] -1Н-1,2,4-триазолия (Соединение 31, 4,22 г) в виде желтого порошка. 1H-ЯМР (d6-ДМСО)  : 0,98 (3Н, д, J=7 Гц), 3,55-3,75 (1Н, м), 3,87-4,02 (7Н, м), 4,50-4,58 (1Н, м), 4,67-4,93 (5Н, м), 6,16 (1Н, д, J=11 Гц), 6,24 (1Н, д, J=11 Гц), 6,33 (1Н, с), 6,97-7,07 (1Н, м), 7,21-7,39 (2Н, м), 7,90 (4Н, с), 9,12 (1Н, с), 10,05 (1Н, с), 10,23 (1Н, с).
Пример 29 : 0,98 (3Н, д, J=7 Гц), 3,55-3,75 (1Н, м), 3,87-4,02 (7Н, м), 4,50-4,58 (1Н, м), 4,67-4,93 (5Н, м), 6,16 (1Н, д, J=11 Гц), 6,24 (1Н, д, J=11 Гц), 6,33 (1Н, с), 6,97-7,07 (1Н, м), 7,21-7,39 (2Н, м), 7,90 (4Н, с), 9,12 (1Н, с), 10,05 (1Н, с), 10,23 (1Н, с).
Пример 29Иодид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил]-1-имидазолидинил]бутил]-4-[(1,3-диоксан-5-ил)оксикарбонилоксиметил]-1Н-1,2,4-триазолия (Соединение 31, 1 г) подвергали действию ионообменной смолы [Dowex 1х8 (Сl– тип)] (элюент:вода) и элюат лиофилизовали, получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил]-1-имидазолидинил]бутил]-4-[(1,3-диоксан-5-ил)оксикарбонилоксиметил] -1Н-1,2,4-триазолия (Соединение 22, 0,23 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=6, 6 Гц), 3,63-3,66 (1Н, м), 3,87-4,02 (7Н, м), 4,52-4,59 (1Н, м), 4,60-5,11 (5Н, м), 6,17 (1Н, д, J=11 Гц), 6,25 (1H, д, J=11 Гц), 6,59 (1Н, c), 6,97-7,04 (1H, м), 7,23-7,40 (2Н, м), 7,90 (4Н, с), 9,11 (1H, с), 10,06 (1H, с), 10,44 (1H, с).
Лиофилизованный продукт (0,15 г) полученного выше соединения 22 кристаллизовали из этанола (20 мл), получая белые кристаллы соединения 22 (0,14 г).
Элементный анализ: C28H30ClF2N9O7 : 0,97 (3Н, д, J=6, 6 Гц), 3,63-3,66 (1Н, м), 3,87-4,02 (7Н, м), 4,52-4,59 (1Н, м), 4,60-5,11 (5Н, м), 6,17 (1Н, д, J=11 Гц), 6,25 (1H, д, J=11 Гц), 6,59 (1Н, c), 6,97-7,04 (1H, м), 7,23-7,40 (2Н, м), 7,90 (4Н, с), 9,11 (1H, с), 10,06 (1H, с), 10,44 (1H, с).
Лиофилизованный продукт (0,15 г) полученного выше соединения 22 кристаллизовали из этанола (20 мл), получая белые кристаллы соединения 22 (0,14 г).
Элементный анализ: C28H30ClF2N9O7Вычислено (%): С, 49,60; Н, 4,46; N, 18,59 Найдено (%): С, 49,60; Н, 4,46; N, 18,40 Пример 30 К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1H-тетразол-1-ил)фенил] -2-имидазолидинона (0,50 г) и [(1S)-1-(этоксикарбонил)этил] хлорметилкарбоната (1,09 г) добавляли ацетонитрил (5 мл) и смесь перемешивали в течение 68 часов при 95oС. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диизопропиловый эфир (6 мл) и полученный порошок отфильтровывали. Порошок подвергали флэш-хроматографии на силикагеле (элюент:этилацетат –> этилацетат/ацетон=1/1 –> ацетон –> ацетон/этанол=5/1). Фракцию, содержащую целевое соединение, концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент:метанол/вода=3/2). Элюат концентрировали в вакууме и растворяли в воде (50 мл). Раствор лиофилизовали, получая хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[(1S)-l-этоксикарбонилэтокси] карбонилоксиметил] -1Н-1,2,4-триазолия (Соединение 23, 0,22 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,98 (3Н, д, J=7 Гц), 1,17 (3Н, т, J=7 Гц), 1,43 (3Н, д, J=7 Гц), 3,60-4,08 (4Н, м), 4,14 (2Н, к, J=7 Гц), 4,65-4,75 (1Н, м), 4,86 (1Н, д, J= 14 Гц), 5,02 (1Н, к, J=7 Гц), 5,11 (1Н, д, J=14 Гц), 6,24 (2Н, с), 6,65 (1Н, с), 6,95-7,05 (1H, м), 7,25-7,39 (2Н, м), 7,90 (4Н, с), 9,11 (1Н, с), 10,07 (1H, с), 10,52 (1H, с).
Пример 31 : 0,98 (3Н, д, J=7 Гц), 1,17 (3Н, т, J=7 Гц), 1,43 (3Н, д, J=7 Гц), 3,60-4,08 (4Н, м), 4,14 (2Н, к, J=7 Гц), 4,65-4,75 (1Н, м), 4,86 (1Н, д, J= 14 Гц), 5,02 (1Н, к, J=7 Гц), 5,11 (1Н, д, J=14 Гц), 6,24 (2Н, с), 6,65 (1Н, с), 6,95-7,05 (1H, м), 7,25-7,39 (2Н, м), 7,90 (4Н, с), 9,11 (1Н, с), 10,07 (1H, с), 10,52 (1H, с).
Пример 31К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил]-3-[4-(1Н-тетразол-1-ил)фенил]-2-имидазолидинона (1,0 г) и [(1S)-1-(бензилосикарбонил)этил] иодметилкарбоната (1,53 г) добавляли ацетонитрил (15 мл) и смесь перемешивали в течение 12 часов при 60oС в атмосфере аргона. Реакционную смесь концентрировали при пониженном давлении и остаток подвергали флэш-хроматографии на силикагеле (элюент:этилацетат –> ацетон –> ацетон/этанол= 4/1). Фракцию, содержащую целевое соединение, концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент: метанол/вода= 3/2) и подвергали ионообменной хроматографии (DOWEX 1х8, Сl– тип). Фракцию, содержащую целевое соединение, концентрировали при пониженном давлении, получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(lH-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[[(1S)-l-(бензилоксикарбонилэтокси] карбонилоксиметил] -1H-1,2,4-триазолия (Соединение 24, 0,25 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J= 7 Гц), 1,45 (3Н, д, J=6,6 Гц), 3,60-4,08 (4Н, м), 4,65-4,78 (1Н, м), 4,85 (1Н, д, J=14 Гц), 5,07-5,18 (4Н, м), 6,23 (2Н, с), 6,67 (1Н, с), 6,95-7,04 (1Н, м), 7,24-7,37 (7Н, м), 7,9 (4Н, с), 9,09 (1Н, с), 10,07 (1Н, с), 10,53 (1Н, с).
Пример 32 : 0,97 (3Н, д, J= 7 Гц), 1,45 (3Н, д, J=6,6 Гц), 3,60-4,08 (4Н, м), 4,65-4,78 (1Н, м), 4,85 (1Н, д, J=14 Гц), 5,07-5,18 (4Н, м), 6,23 (2Н, с), 6,67 (1Н, с), 6,95-7,04 (1Н, м), 7,24-7,37 (7Н, м), 7,9 (4Н, с), 9,09 (1Н, с), 10,07 (1Н, с), 10,53 (1Н, с).
Пример 32К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил]-3-[4-(1H-тетразол-1-ил)фенил]-2-имидазолидинона (2,0 г) и 3-(бензилосипропил)иодметилкарбоната (2,9 г) добавляли ацетонитрил (20 мл) и смесь перемешивали в течение 20 часов при 50~55oС в атмосфере аргона. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в смеси этилацетата (100 мл) и тетрагидрофурана (50 мл). К раствору добавляли насыщенный водный раствор хлорида натрия (50 мл) и 5%-ный водный раствор тиосульфата натрия (0,1 мл) и смесь встряхивали. Органический слой промывали насыщенным водным раствором хлорида натрия (50 мл) четыре раза. Органический слой сушили над безводным сульфатом магния и растворитель отгоняли. Остаток подвергали флэш-хроматографии на силикагеле (элюент:этилацетат –> ацетон –> ацетон/этанол=4/1). Фракцию, содержащую целевое соединение, концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент: метанол/вода= 3/2) и затем элюат подвергали ионообменной хроматографии (DOWEX 1х8, Сl– тип). Фракцию, содержащую целевое соединение, концентрировали при пониженном давлении, получая хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[(3-бензилоксипропокси)карбонилоксиметил] -1Н-1,2,4-триазолия (Соединение 25, 0,79 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7,2 Гц), 1,89 (2Н, квинтет, J=6,4 Гц), 3,47 (2Н, т, J=6,2 Гц), 3,60-4,09 (4Н, м), 4,22 (2Н, т, J=6,6 Гц), 4,44 (2Н, с), 4,65-4,75 (1Н, м), 4,86 (1Н, д, J=14 Гц), 5,09 (1Н, д, 14 Гц), 6,12 (1Н, д, J= 11 Гц), 6,20 (1Н, д, J=11 Гц), 6,62 (1Н, с), 6,94-7,04 (1Н, м), 7,24-7,36 (7Н, м), 7,9 (4Н, с), 9,09 (1Н, с), 10,07 (1Н, с), 10,45 (1Н, с).
Пример 33 : 0,97 (3Н, д, J=7,2 Гц), 1,89 (2Н, квинтет, J=6,4 Гц), 3,47 (2Н, т, J=6,2 Гц), 3,60-4,09 (4Н, м), 4,22 (2Н, т, J=6,6 Гц), 4,44 (2Н, с), 4,65-4,75 (1Н, м), 4,86 (1Н, д, J=14 Гц), 5,09 (1Н, д, 14 Гц), 6,12 (1Н, д, J= 11 Гц), 6,20 (1Н, д, J=11 Гц), 6,62 (1Н, с), 6,94-7,04 (1Н, м), 7,24-7,36 (7Н, м), 7,9 (4Н, с), 9,09 (1Н, с), 10,07 (1Н, с), 10,45 (1Н, с).
Пример 33Хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[(3-бензилоксипропокси)карбонилоксиметил] -1Н-1,2,4-триазолия (Соединение 25, 0,66 г) растворяли в метаноле (25 мл) и к раствору добавляли 1 н. соляную кислоту (0,89 мл) и 11% палладий-на-угле (50% влажн., 0,33 г). Смесь перемешивали в течение 1,5 часов при комнатной температуре в атмосфере водорода. Катализатор отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент:метанол/вода=3/2) и перекристаллизовывали из этанола, получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил]-4-[(3-гидроксипропокси)карбонилоксиметил]-1Н-1,2,4-триазолия (Соединение 26, 0,19 г) в виде бесцветных порошкоообразных кристаллов. 1H-ЯМР (d6-ДМСО)  : 0,98 (3Н, д, J=7,2 Гц), 1,74 (2Н, квинтет, J=6 Гц), 3,44 (2Н, дт, J=6, 5 Гц), 3,60-4,10 (4Н, м), 4,20 (2Н, т, J=6 Гц), 4,59 (1Н, т, J=5 Гц), 4,65-4,75 (1Н, м), 4,87 (1Н, д, J=14 Гц), 5,10 (1Н, д,J=14 Гц), 6,13 (1Н, д, J=11 Гц), 6,21 (1Н, д, J=11 Гц), 6,63 (1Н, с), 6,95-7,05 (1Н, м), 7,25-7,37 (2Н, м), 7,89 (4Н, с), 9,09 (1Н, с), 10,06 (1Н, с), 10,48 (1Н, с).
Пример 34 : 0,98 (3Н, д, J=7,2 Гц), 1,74 (2Н, квинтет, J=6 Гц), 3,44 (2Н, дт, J=6, 5 Гц), 3,60-4,10 (4Н, м), 4,20 (2Н, т, J=6 Гц), 4,59 (1Н, т, J=5 Гц), 4,65-4,75 (1Н, м), 4,87 (1Н, д, J=14 Гц), 5,10 (1Н, д,J=14 Гц), 6,13 (1Н, д, J=11 Гц), 6,21 (1Н, д, J=11 Гц), 6,63 (1Н, с), 6,95-7,05 (1Н, м), 7,25-7,37 (2Н, м), 7,89 (4Н, с), 9,09 (1Н, с), 10,06 (1Н, с), 10,48 (1Н, с).
Пример 34Смесь 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил]-3-[4-(1H-тетразол-1-ил)фенил]-2-имидазолидинона (1,6 г) и [(4S)-2,2-диметил-1,3-диоксолан-4-ил] метилиодметилкарбоната (2,1 г) добавляли к ацетонитрилу (20 мл) и смесь перемешивали в течение 15 часов при 55oС. Полученную смесь подвергали хроматографии на силикагеле (элюент:этилацетат –> ацетон –> ацетон/этанол=5/1) и затем элюат подвергали действию ионообменной смолы (Dowex 1х8, Сl–), (элюент: вода). Элюат упаривали в вакууме и остаток подвергали ОДК колоночной хроматографии (элюент: метанол/вода=3/2). Растворитель отгоняли при пониженном давлении и остаток кристаллизовали из этанола, получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил]-4-[[(4S)-2,2-диметил-1,3-диоксолан-4-ил] метилоксикарбонилоксиметил] -1Н-1,2,4-триазолия (Соединение 27, 0,4 г) в виде белых кристаллов. 1H-ЯМР (d6-ДМСО)  : 0,98 (3Н, д, J=7,0 Гц), 1,26 (3Н, с), 1,30 (3Н, с), 3,62-3,72 (2Н, м), 3,97-4,34 (7Н, м), 4,70 (1Н, к, J=7,0 Гц), 4,88 (1Н, д, J= 14 Гц), 5,12 (1Н, д, 14,2 Гц), 6,16 (1Н, д, J=11,0 Гц), 6,24 (1Н, д, J= 11,0 Гц), 6,66 (1Н, с), 6,94-7,03 (1Н, м), 7,21-7,38 (2Н, м), 7,89 (4Н, с), 9,10 (1Н, с), 10,05 (1Н, с), 10,51 (1Н, с).
Пример 35 : 0,98 (3Н, д, J=7,0 Гц), 1,26 (3Н, с), 1,30 (3Н, с), 3,62-3,72 (2Н, м), 3,97-4,34 (7Н, м), 4,70 (1Н, к, J=7,0 Гц), 4,88 (1Н, д, J= 14 Гц), 5,12 (1Н, д, 14,2 Гц), 6,16 (1Н, д, J=11,0 Гц), 6,24 (1Н, д, J= 11,0 Гц), 6,66 (1Н, с), 6,94-7,03 (1Н, м), 7,21-7,38 (2Н, м), 7,89 (4Н, с), 9,10 (1Н, с), 10,05 (1Н, с), 10,51 (1Н, с).
Пример 35Хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[[(4S)-2,2-диметил-1,3-диоксолан-4-ил] метилоксикарбонилоксиметил]-1Н-1,2,4-триазолия (Соединение 27, 0,1 г) растворяли в тетрагидрофуране (1,5 мл) и к раствору добавляли 1 н. раствор соляной кислоты (1,5 мл) при охлаждении льдом. Смесь перемешивали в течение 4 часов при комнатной температуре. Полученную смесь подвергали ОДК колоночной хроматографии (элюент:метанол/вода=3/2), получая хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил]бутил]-4-[[(2S)-2,3-дигидрокси-пропокси]карбонилоксиметил] -1Н-1,2,4-триазолия (Соединение 28, 0,05 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,98 (3Н, д, J=7,0 Гц), 3,26-4,24 (9Н, м), 4,70 (1Н, к, J= 7,0 Гц), 4,86 (1Н, д, J=14,6 Гц), 5,09 (1Н, д, 14,6 Гц), 6,15 (1Н, д, J= 11,0 Гц), 6,22 (1Н, д, J= 11,0 Гц), 6,63 (1Н, с), 6,96-7,06 (1Н, м), 7,23-7,36 (2Н, м), 7,90 (4Н, с), 9,10 (1Н, с), 10,06 (1Н, с), 10,46 (1Н, с).
Пример 36 : 0,98 (3Н, д, J=7,0 Гц), 3,26-4,24 (9Н, м), 4,70 (1Н, к, J= 7,0 Гц), 4,86 (1Н, д, J=14,6 Гц), 5,09 (1Н, д, 14,6 Гц), 6,15 (1Н, д, J= 11,0 Гц), 6,22 (1Н, д, J= 11,0 Гц), 6,63 (1Н, с), 6,96-7,06 (1Н, м), 7,23-7,36 (2Н, м), 7,90 (4Н, с), 9,10 (1Н, с), 10,06 (1Н, с), 10,46 (1Н, с).
Пример 36К раствору 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(lH-тетразол-1-ил)фенил] -2-имидазолидинона (1,0 г) в ацетонитриле (15 мл) добавляли (3-бензилоксикарбонилпропил) иодметилкарбонат (1,0 г) в атмосфере азота и смесь перемешивали в течение 20 часов при 45-50oС. Реакционную смесь концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле (элюент:этилацетат –> ацетон) и фракцию, содержащую целевое соединение, концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент: метанол/вода= 3/2), получая иодид 4-[(3-бензилоксикарбонилпропокси)карбонилоксиметил] -1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -1Н-1,2,4-триазолия (Соединение 32, 1,47 г) в виде желтого порошка. 1H-ЯМР (d6-ДМСО)  : 1,04 (3Н, д, J=7 Гц), 1,83-1,97 (2Н, м), 2,45 (2Н, т, J=7 Гц), 3,57-3,69 (2Н, м), 3,90-4,09 (2Н, м), 4,18 (2Н, т, J=7 Гц), 4,69 (1H, к, J=7 Гц), 4,87 (1Н, д, J=14 Гц), 4,98 (1H, д, J=14 Гц), 5,08 (2Н, с), 6,14 (1H, д, J=11 Гц), 6,22 (1H, д, J=11 Гц), 6,33 (1H, с), 6,99-7,08 (1H, м), 7,23-7,32 (2Н, м), 7,35 (5Н, с), 7,91 (4Н, с), 9,12 (1H, с), 10,07 (1H, с), 10,24 (1H, с).
Пример 37 : 1,04 (3Н, д, J=7 Гц), 1,83-1,97 (2Н, м), 2,45 (2Н, т, J=7 Гц), 3,57-3,69 (2Н, м), 3,90-4,09 (2Н, м), 4,18 (2Н, т, J=7 Гц), 4,69 (1H, к, J=7 Гц), 4,87 (1Н, д, J=14 Гц), 4,98 (1H, д, J=14 Гц), 5,08 (2Н, с), 6,14 (1H, д, J=11 Гц), 6,22 (1H, д, J=11 Гц), 6,33 (1H, с), 6,99-7,08 (1H, м), 7,23-7,32 (2Н, м), 7,35 (5Н, с), 7,91 (4Н, с), 9,12 (1H, с), 10,07 (1H, с), 10,24 (1H, с).
Пример 37Иодид 4-[(3-бензилоксикарбонилпропокси)карбонилоксиметил] -1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил]-1Н-1,2,4-триазолия (Соединение 32, 1,47 г) подвергали ионообменной хроматографии (Dowex 1х8, Сl– тип, 500 мл) и фракцию, содержащую целевой продукт, концентрировали при пониженном давлении, получая хлорид 4-[(3-бензилоксикарбонилпропокси) карбонилоксиметил] -1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил]бутил]-1Н-1,2,4-триазолия (Соединение 29, 893 мг) в виде белого порошка. 1H-ЯМР (d6-ДМСО) d: 1,04 (3Н, д, J=7 Гц), 1,82-1,99 (2Н, м), 2,44 (2Н, т, J=7 Гц), 3,53-3,67 (2Н, м), 3,95-4,03 (2Н, м), 4,17 (2Н, т, J=7 Гц), 4,68 (1H, к, J=7 Гц), 4,87 (1H, д, J=14 Гц), 5,06 (1H, д, J=14 Гц), 5,07 (2Н, с), 6,13 (1H, д, J=11 Гц), 6,21 (1H, д, J=11 Гц), 6,56 (1H, с), 6,95-7,05 (1H, м), 7,23-7,33 (2Н, м), 7,34 (5Н, с), 7,90 (4Н, с), 9,09 (1H, с), 10,07 (1H, с), 10,41 (1H, с). Пример 38 Хлорид 4-[(3-бензилоксикарбонилпропокси) карбонилоксиметил] -1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -1Н-1,2,4-триазолия (Соединение 29, 155 мг) растворяли в метаноле (6 мл). К раствору добавляли 1 н. раствор соляной кислоты (0,2 мл) и 10% палладий-на-угле (50% влажн., 77 мг). Смесь перемешивали в течение 0,5 часов при комнатной температуре в атмосфере водорода. Катализатор отфильтровывали и к фильтрату добавляли дистиллированную воду. Смесь концентрировали при пониженном давлении и концентрированный раствор лиофилизовали, получая хлорид 1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(lH-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-[(3-карбоксипропокси) карбонилоксиметил] -1Н-1,2,4-триазолия (Соединение 33, 122 мг) в виде белого порошка. 1H-ЯМР (d6-ДМСО) d: 0,98 (3Н, д, J=7 Гц), 1,78-1,90 (2Н, м), 2,29 (2Н, т, J=7 Гц), 3,54-3,69 (2Н, м), 3,94-4,04 (2Н, м), 4,16 (2Н, т, J=7 Гц), 4,69 (1Н, к, J=7 Гц), 4,87 (1Н, д, J=14 Гц), 5,06 (1Н, д, J=14 Гц), 6,13 (1Н, д, J= 11 Гц), 6,21 (1Н, д, J=11 Гц), 6,54 (1Н, с), 6,95-7,10 (1Н, м), 7,24-7,37 (2Н, м), 7,90 (4Н, с), 8,31 (1Н, с), 9,09 (1Н, с), 10,06 (1Н, с), 10,34 (1Н, с). Пример 39 Раствор бромметилацетата (2,4 г) и иодида натрия (2,3 г) в ацетонитриле (75 мл) перемешивали в течение 2 часов при 80oС. Реакционную смесь охлаждали до комнатной температуры, полученные кристаллы отфильтровывали и к фильтрату добавляли 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1Н-тетразол-1-ил)фенил]-2-имидазолидин он (5 г). Смесь перемешивали в течение 16 часов при 45oС. Из реакционной смеси отфильтровывали осадок и растворитель отгоняли. Остаток растворяли в тетрагидрофуране (150 мл). Раствор промывали смесью насыщенного водного раствора хлорида натрия (150 мл) и 5%-ного водного раствора тиосульфата натрия (10 мл). Органический слой промывали дважды насыщенным водным раствором хлорида натрия (150 мл). Тетрагидрофурановый слой сушили над безводным сульфатом магния и растворитель отгоняли. К остатку добавляли этанол (50 мл) и растворитель отгоняли. К остатку добавляли ацетон (3 мл) и этанол (1,3 мл) и смесь оставляли на 2 часа при 0oС. К полученному белому твердому продукту добавляли этанол (3 мл). Твердый продукт отфильтровывали и сушили при пониженном давлении. Полученный белый порошок растворяли в смеси тетрагидрофурана (400 мл) и метанола (70 мл). Раствор промывали насыщенным водным раствором хлорида натрия (250 мл) семь раз. Органический слой сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Остаток растворяли в смеси этанола (150 мл) и ацетона (50 мл) и растворитель отгоняли при пониженном давлении. К остатку добавляли этанол (100 мл) и растворитель опять отгоняли при пониженном давлении. К остатку добавляли смесь этанола (150 мл) и ацетона (50 мл). Растворитель отгоняли до объема раствора в 20 мл и раствор оставляли на 2 часа при комнатной температуре. Полученный твердый продукт отфильтровывали, получая хлорид 4-ацетоксиметил-1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил]-1-имидазолидинил] бутил]-1Н-1,2,4-триазолия (Соединение 12, 3,6 г) в виде белых кристаллов. Физико-химические свойства этого продукта были идентичны свойствам кристаллов соединения 12, полученных кристаллизацией из этанола в примере 15. Пример 40 К смеси 1-[(1R, 2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1Н-тетразол-1-ил)фенил] -2-имидазолидинона (2,0 г) и [2-(ацетиламино)этил]иодметилкарбоната (2,9 г) добавляли ацетонитрил (20 мл) и смесь перемешивали в течение 20 часов при 50~55oС в атмосфере аргона. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в смеси этилацетата (100 мл) и тетрагидрофурана (50 мл). К смеси добавляли смесь насыщенного водного раствора хлорида натрия (50 мл) и 5%-ного водного раствора тиосульфата натрия (0,1 мл) и смесь встряхивали. Органический слой промывали 4 раза насыщенным водным раствором хлорида натрия (50 мл). Органический слой сушили над безводным сульфатом магния и растворитель отгоняли. Остаток подвергали флэш-хроматографии на силикагеле (элюент: этилацетат –> ацетон –> ацетон/этанол=4/1). Фракцию, содержащую целевое соединение концентрировали при пониженном давлении. Остаток подвергали ОДК колоночной хроматографии (элюент:метанол/вода=3/2) и элюат подвергали ионообменной хроматографии (Dowex 1х8, Сl– тип). Фракцию, содержащую целевое соединение, концентрировали при пониженном давлении, получая хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил]-1-имидазолидинил]бутил]-4-[(2-ацетиламиноэтокси)карбонилоксиметил] -1Н-1,2,4-триазолия (Соединение 34, 0,5 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 1,77 (3Н, с), 3,30 (2Н, к, J=6 Гц), 3,60-3,72 (1Н, м), 3,92-4,08 (3Н, м), 4,12 (2Н, т, J=6 Гц), 4,65-4,75 (1Н, м), 4,87 (1Н, д, J=14 Гц), 5,10 (1Н, д, J=14 Гц), 6,14 (1Н, д, J=11 Гц), 6,23 (1Н, д, J=11 Гц), 6,63 (1Н, с), 6,95-7,05 (1Н, м), 7,26-7,37 (2Н, м), 7,90 (4Н, с), 8,09 (1Н, т, J=6 Гц), 9,10 (1Н, с), 10,07 (1Н, с), 10,49 (1Н, с).
Пример 41 : 0,97 (3Н, д, J=7 Гц), 1,77 (3Н, с), 3,30 (2Н, к, J=6 Гц), 3,60-3,72 (1Н, м), 3,92-4,08 (3Н, м), 4,12 (2Н, т, J=6 Гц), 4,65-4,75 (1Н, м), 4,87 (1Н, д, J=14 Гц), 5,10 (1Н, д, J=14 Гц), 6,14 (1Н, д, J=11 Гц), 6,23 (1Н, д, J=11 Гц), 6,63 (1Н, с), 6,95-7,05 (1Н, м), 7,26-7,37 (2Н, м), 7,90 (4Н, с), 8,09 (1Н, т, J=6 Гц), 9,10 (1Н, с), 10,07 (1Н, с), 10,49 (1Н, с).
Пример 41К смеси 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил]-3-[4-(1Н-тетразол-1-ил)фенил]-2-имидазолидинона (1,0 г) и [3-(метокси)пропил]иодметилкарбоната (1,1 г) добавляли ацетонитрил (10 мл) и смесь перемешивали в течение 15 часов при 40~50oС в атмосфере аргона. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в смеси ацетонитрила (5 мл) и этилацетата (100 мл). Раствор встряхивали со смесью насыщенного водного раствора хлорида натрия (50 мл) и 5%-ного водного раствора тиосульфата натрия (0,1 мл). Органический слой промывали четыре раза насыщенным водным раствором хлорида натрия (50 мл). Органический слой сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле (элюент: этилацетат –> ацетон –> ацетон/этанол=4/1). Фракцию, содержащую целевое соединение концентрировали при пониженном давлении. Остаток подвергали ионообменной хроматографии (Dowex 1х8, Сl– тип), а затем элюат подвергали ОДК колоночной хроматографии (элюент:метанол/вода=3/2), получая хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(lH-тетразол-1-ил)фенил] -1-имидазолидинил]бутил]-4-[(3-метоксипропокси) карбонилоксиметил] -1Н-1,2,4-триазолия (Соединение 35, 0,80 г) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 0,97 (3Н, д, J=7 Гц), 1,83 (2Н, квинтет, J=6 Гц), 3,20 (3Н, с), 3,35 (2Н, т, J=6 Гц), 3,55-3,70 (1Н, м), 3,90-4,10 (3Н, м), 4,18 (2Н, т, J=6 Гц), 4,64-4,75 (1Н, м), 4,87 (1H, д, J=14 Гц), 5,11 (1Н, д, J= 14 Гц), 6,14 (1H, д, J= 11 Гц), 6,22 (1H, д, J=11 Гц), 6,66 (1H, с), 6,95-7,05 (1H, м), 7,25-7,39 (2Н, м), 7,90 (4Н, с), 9,10 (1H, с), 10,07 (1H, с), 10,48 (1H, с).
Пример 42 : 0,97 (3Н, д, J=7 Гц), 1,83 (2Н, квинтет, J=6 Гц), 3,20 (3Н, с), 3,35 (2Н, т, J=6 Гц), 3,55-3,70 (1Н, м), 3,90-4,10 (3Н, м), 4,18 (2Н, т, J=6 Гц), 4,64-4,75 (1Н, м), 4,87 (1H, д, J=14 Гц), 5,11 (1Н, д, J= 14 Гц), 6,14 (1H, д, J= 11 Гц), 6,22 (1H, д, J=11 Гц), 6,66 (1H, с), 6,95-7,05 (1H, м), 7,25-7,39 (2Н, м), 7,90 (4Н, с), 9,10 (1H, с), 10,07 (1H, с), 10,48 (1H, с).
Пример 42Раствор бромметилацетата (424 мг) и иодида натрия (415 мг) в ацетонитриле (15 мл) перемешивали в течение 2 часов при 80oС. Реакционную смесь охлаждали до комнатной температуры и остаточный бромид натрия отфильтровывали. К фильтрату добавляли 2-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -4-[4-(2,2,3,3-тетрафторпропокси)фенил]-3(2Н, 4Н)-1,2,4-триазолон (1 г) и смесь перемешивали в течение 16 часов при 45oС. Осадок, выпавший из реакционной смеси, отфильтровывали и растворитель отгоняли при пониженном давлении. Остаток растворяли в тетрагидрофуране (30 мл) и промывали смесью насыщенного водного раствора хлорида натрия (30 мл) и 5%-ного водного раствора тиосульфата натрия (2 мл), а затем промывали дважды насыщенным водным раствором хлорида натрия (30 мл). Тетрагидрофурановый слой сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Остаток подвергали хроматографии на силикагеле (элюент:этилацетат –> этилацетат/этанол= 10/1 –> 4/1), а затем подвергали действию ионообменной смолы [Dowex 1×8 (Cl– тип)] (элюент:вода). Фракцию, содержащую целевой продукт, лиофилизовали, получая хлорид 4-ацетоксиметил-1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[4,5-дигидро-5-оксо-4-[4-(2,2,3,3-тетрафторпропокси)фенил]-1Н-1,2,4-триазол-1-ил]бутил-1H-1,2,4-триазолия (Соединение 36, 294 мг) в виде белого порошка. 1H-ЯМР (d6-ДМСО)  : 1,22 (3Н, д, J=7 Гц), 2,08 (3Н, с), 4,66 (2Н, т, J= 14 Гц), 4,85 (1Н, д, J=14 Гц), 4,89 (1Н, к, J=7 Гц), 4,98 (1Н, д, J=14 Гц), 6,09 (1Н, д, J=11 Гц), 6,19 (1Н, д, J=11 Гц), 6,26 (1H, с), 6,69 (1Н, тт, J= 52, 5 Гц), 6,97-7,06 (1H, м), 7,23 (2Н, д, J=9 Гц), 7,25-7,41 (2Н, м), 7,69 (2Н, д, J=9 Гц), 8,58 (1H, с), 9,09 (1H, с), 10,25 (1H, с).
Пример 43 : 1,22 (3Н, д, J=7 Гц), 2,08 (3Н, с), 4,66 (2Н, т, J= 14 Гц), 4,85 (1Н, д, J=14 Гц), 4,89 (1Н, к, J=7 Гц), 4,98 (1Н, д, J=14 Гц), 6,09 (1Н, д, J=11 Гц), 6,19 (1Н, д, J=11 Гц), 6,26 (1H, с), 6,69 (1Н, тт, J= 52, 5 Гц), 6,97-7,06 (1H, м), 7,23 (2Н, д, J=9 Гц), 7,25-7,41 (2Н, м), 7,69 (2Н, д, J=9 Гц), 8,58 (1H, с), 9,09 (1H, с), 10,25 (1H, с).
Пример 43Раствор 1-[(1R,2R)-2-(2,4-дифторфенил)-2-гидрокси-1-метил-3-(1Н-1,2,4-триазол-1-ил)пропил] -3-[4-(1H-тетразол-1-ил)фенил] -2-имидазолидинона (200 мг) и бромметилацетата (77,1 мг) в ацетонитриле (2 мл) перемешивали в течение часов при 80oС в атмосфере аргона. Реакционную смесь разбавляли ацетонитрилом (11 мл) и полученную смесь перемешивали при 80oС до растворения кристаллов, выпавших из смеси в осадок. После охлаждения до комнатной температуры добавляли силикагель (400 мг) и смесь перемешивали в течение 10 минут при комнатной температуре. Силикагель отфильтровывали и промывали смесью ацетонитрила и тетрагидрофурана (1/1, 2 мл  3). Маточный раствор и промывные жидкости объединяли и добавляли насыщенный водный раствор хлорида натрия (10 мл). Полученную смесь перемешивали в течение 30 минут при комнатной температуре и органический слой отделяли. То же самое действие, а именно, добавление насыщенного водного раствора хлорида натрия (10 мл) с последующим перемешиванием в течение 30 минут при комнатной температуре и последующим отделением органического слоя, дополнительно проводили три раза. Органический слой сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Остаток растворяли в тетрагидрофуране (3 мл) и раствор оставляли на 5 часов при комнатной температуре. Выпавший в осадок твердый продукт (179 мг) отфильтровывали и растворяли в смеси метанола и тетрагидрофурана (1/1, 4 мл). Раствор концентрировали при пониженном давлении и остаток растворяли в тетрагидрофуране (2 мл). Раствор оставляли на 5 часов при комнатной температуре. Выпавшие в осадок порошкообразные кристаллы (167 мг) отфильтровывали и растворяли в смеси этанола (6 мл) и ацетона (0,5 мл). Раствор концентрировали при пониженном давлении до объема примерно 2 мл и оставляли на 3 часа при комнатной температуре. Выпавший в осадок твердый продукт отфильтровывали, получая хлорид 4-ацетоксиметил-1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил]-1-имидазолидинил]бутил]-1Н-1,2,4-триазолия (Соединение 12, 126 мг) в виде белых кристаллов. Физико-химические свойства продукта были идентичны свойствам кристаллов соединения 12, полученных при кристаллизации из этанола в примере 15.
Препарат 1 3). Маточный раствор и промывные жидкости объединяли и добавляли насыщенный водный раствор хлорида натрия (10 мл). Полученную смесь перемешивали в течение 30 минут при комнатной температуре и органический слой отделяли. То же самое действие, а именно, добавление насыщенного водного раствора хлорида натрия (10 мл) с последующим перемешиванием в течение 30 минут при комнатной температуре и последующим отделением органического слоя, дополнительно проводили три раза. Органический слой сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Остаток растворяли в тетрагидрофуране (3 мл) и раствор оставляли на 5 часов при комнатной температуре. Выпавший в осадок твердый продукт (179 мг) отфильтровывали и растворяли в смеси метанола и тетрагидрофурана (1/1, 4 мл). Раствор концентрировали при пониженном давлении и остаток растворяли в тетрагидрофуране (2 мл). Раствор оставляли на 5 часов при комнатной температуре. Выпавшие в осадок порошкообразные кристаллы (167 мг) отфильтровывали и растворяли в смеси этанола (6 мл) и ацетона (0,5 мл). Раствор концентрировали при пониженном давлении до объема примерно 2 мл и оставляли на 3 часа при комнатной температуре. Выпавший в осадок твердый продукт отфильтровывали, получая хлорид 4-ацетоксиметил-1-[(2R,3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил]-1-имидазолидинил]бутил]-1Н-1,2,4-триазолия (Соединение 12, 126 мг) в виде белых кристаллов. Физико-химические свойства продукта были идентичны свойствам кристаллов соединения 12, полученных при кристаллизации из этанола в примере 15.
Препарат 1Используя соединение 2, полученное в примере 4, получали раствор для инъекции, содержащий указанные ниже компоненты. Соединение 2, полученное в примере 4 – 100 мг 5%-ный раствор глюкозы для инъекций – 100 мл Препарат 2 Используя соединение 1, полученное в примере 1, смешивали указанные ниже компоненты. Смесь упаковывали в желатиновые капсулы, получая капсулы, каждая из которых содержала соединение 1 в количестве 50 мг, мг: Соединение 1 – 50 Лактоза – 100 Кукурузный крахмал – 40 Стеарат магния – 10 Всего – 200 Препарат 3 Соединение 2, полученное в примере 4, и стеарат магния гранулировали в водном растворе растворимого крахмала. Полученный продукт высушивали и затем смешивали с лактозой и кукурузным крахмалом. Смесь подвергали компрессионному формованию, получая таблетки, содержащие указанные ниже компоненты, мг: Соединение 2, полученное в примере 4 – 50 Лактоза – 65 Кукурузный крахмал – 30 Растворимый крахмал – 35 Стеарат магния – 20 Всего – 200 Эксперимент 1 Способ: самок мышей Crj:CDFl пятинедельного возраста инфицировали внутривенно минимально летальной дозой Candida albicans ТА. Испытуемое соединение растворяли в 5%-ном растворе глюкозы и вводили мышам внутривенно сразу же после инфицирования. Защитное действие соединений выражали в виде 50%-ной эффективной дозы (ED50), рассчитанной с использованием способа Рида и Мюнча (Reed and Muench) по степени выживания на 7-й день после инфицирования. Результат: Защитное действие соединений при экспериментальном инфицировании на мышах показано ниже Соединение – Ed50 (мкмоль/кг) вв. 1 – 2,3 2 – 1,5 Эксперимент 2 Способ: самок мышей Crj:CDF1 пятинедельного возраста инфицировали внутривенно минимально летальной дозой Candida albicans ТА. Испытуемое соединение растворяли в 5%-ном растворе глюкозы и вводили мышам перорально сразу же после инфицирования. Защитное действие соединений выражали в виде 50%-ной эффективной дозы (ED50), рассчитанной с использоваанием способа Рида и Мюнча (Reed and Muench) по степени выживания на 7-й день после инфицирования. Результат: Защитное действие соединений при экспериментальном инфицировании на мышах показано ниже Соединение – Ed50 (мкмоль/кг) п.о. 1 – 2,9 2 – 1,8 Эксперимент 3 Способ: самок мышей Crj:CDF1 пятинедельного возраста инфицировали внутривенно минимально летальной дозой Candida albicans ТА. Испытуемое соединение растворяли в 5%-ном растворе глюкозы и вводили мышам внутривенно (вв.) или перорально (п. о.) в дозе 1,04 мкмоль/кг сразу же после инфицирования. Защитное действие для каждого соединения выражали как число выживших на 7-й день после инфицировакия и число дней жизни для мышей, которые умерли до 7-го дня после инфицирования. Результат: защитное действие соединений при экспериментальном инфицировании на мышах показано в табл.5. В табл.5 включено значение защитного действия для ссылочного соединения, обозначенного цифрой (V). Ссылочное соединение суспендировали в 0,5%-ной карбоксиметилцеллюлозе натрия и вводили мышам перорально в дозе 1,04 мкмоль/кг сразу же после инфицирования. Промышленная применимость Соединения по настоящему изобретению обладают улучшенной растворимостью в воде и могут выгодным образом использоваться для инъекций, и, кроме того, они проявляют улучшенное внутреннее поглощение. Таким образом, можно полагать, что соединения по настоящему изобретению будут обладать хорошим действием при лечении заболевания. Краткое описание чертежей На фиг.1 показан рентгеновский диффракционный спектр (Cu, 40 кВ, 50 мА). Формы I кристаллов (не гидратированные, кристаллизованные из этанола) соединения 12, полученного в примере 15. Поперечная ось (ось абсцисс) показывает угол диффракции (2  ), а на оси ординат показана интенсивность пика.
На фиг.2 показан рентгеновский диффракционный спектр (Сu, 40 кВ, 50 мА). Формы II кристаллов (гидрат, кристаллизованные из воды) соединения 12, полученного в примере 15. Поперечная ось (ось абсцисс) показывает угол диффракции (2 ), а на оси ординат показана интенсивность пика.
На фиг.2 показан рентгеновский диффракционный спектр (Сu, 40 кВ, 50 мА). Формы II кристаллов (гидрат, кристаллизованные из воды) соединения 12, полученного в примере 15. Поперечная ось (ось абсцисс) показывает угол диффракции (2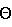 ), а на оси ординат показана интенсивность пика. ), а на оси ординат показана интенсивность пика.
Формула изобретения
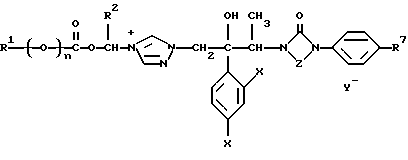 где R1 представляет: I) C1-6 алкил, необязательно моно- или дизамещенный заместителями, выбранными из: 2-тетрагидрофурила; C1-6 ацилокси; гидрокси; C1-6 алкоксикарбонила; бензилоксикарбонила; карбокси; C1-6 алканоиламино; бензилокси; C1-6 алкокси; 1,3-диоксолан-4-ила, который, в свою очередь, может быть замещен C1-4 алкилом; II) 1,3-диоксан-5-ил; n = 0 или 1; R2 представляет водород или C1-6 алкил; Х представляет галоген; Y представляет галоген; Z представляет -CH2-CH2– или -N= CH-; R7, когда Z представляет группу -CH2-CH2-, представляет собой 3-4-азотсодержащий 5-членный гетероциклический остаток, необязательно замещенный C1-6 алкилом, который, в свою очередь, замещен C1-6 ацилоксигруппой; когда Z представляет группу -N= CH-, R7 представляет C1-6 алкоксигруппу, замещенную галогеном. 2. Соединение по п. 1, которое представляет хлорид 4-ацетоксиметил-1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,2-триазол-1-ил)фенил] -1-имидазолидинил] -бутил] -1Н-1,2,4-триазолия. 3. Соединение по п. 1, которое представляет хлорид 4-ацетоксиметил-1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -1Н-1,2,4-триазолия. 4. Соединение по п. 1, которое представляет хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-1,2,3-триазол-1-ил)фенил] -1-имидазолидинил] бутил] -4-этокси-карбонилоксиметил-1H-1,2,4-триазолия. 5. Соединение по п. 1, которое представляет хлорид 1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[2-оксо-3-[4-(1Н-тетразол-1-ил)фенил] -1-имидазолидинил] бутил] -4-этоксикарбонилоксиметил-1H-1,2,4-триазолия. 6. Соединение по п. 1, которое представляет хлорид 4-ацетоксиметил-1-[(2R, 3R)-2-(2,4-дифторфенил)-2-гидрокси-3-[4,5-дигидро-5-оксо-4-[4-(2,2,3,3-тетрафторпропокси)фенил] -1H-1,2,4-триазол-1-ил] бутил] -1Н-1,2,4-триазолия. 7. Соединение по п. 1, проявляющее противогрибковую активность. 8. Противогрибковая фармацевтическая композиция, которая включает соединение по п. 1 и по крайней мере один фармацевтически приемлемый носитель, разбавитель или эксципиент. 9. Способ лечения грибковой инфекции, вызванный Candida albicans ТА, который включает введение пациенту, страдающему от грибковой инфекции, эффективного количества соединения по п. 1, необязательно вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом. 10. Способ получения соединения формулы I 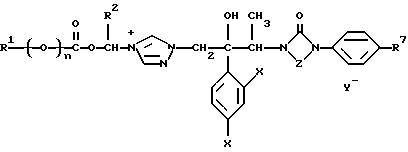 где значения R1, R2, R7, X, Y, Z и n указаны в п. 1, который включает взаимодействие соединения, представленного формулой  каждый символ имеет указанные выше значения, с соединением, представленным формулой 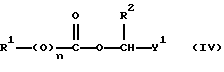 где Y1 представляет атом галогена, а другие символы имеют приведенные выше значения, и полученный продукт, необязательно, подвергают анионному обмену. Приоритет по признакам: 31.03.1997 – по пп. 1-10; 08.07.1997 и 08.12.1997 – уточнение признаков по пп. 1-10 формулы в описании. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 31.03.2004
Извещение опубликовано: 10.05.2005 БИ: 13/2005
|
||||||||||||||||||||||||||
