Патент на изобретение №2189979
|
||||||||||||||||||||||||||
(54) ДИАРИЛМЕТИЛИДЕНФУРАНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ
(57) Реферат: Настоящее изобретение относится к диарилметилиденфурановым производным формулы I, в которой циклы А и В означают независимо фенил, нафтил, производнoе гетероцикла с 5-6 звеньями и с 1-4 гетероатомами, производное насыщенного углеводородного цикла с 3-7 атомами углерода, по меньшей мере, один из заместителей X1, X2, Y1 или Y2 обязательно означает группу -S(O)nR, в которой n – целое число 0, 1 или 2; R – низший алкил с 1 -6 атомами углерода, группу -SO2NH2 и находится в пара-положении, остальные означают независимо атом водорода, атом галогена, низший алкил с 1-6 атомами углерода, трифторметил, низший О-алкил с 1-6 атомами углерода или Х1 и Х2 или Y1 и Y2 означают группу метилендиокси, R1, R2, R3 и R4 означают независимо атом водорода, атом галогена, низший алкил с 1-6 атомами углерода, низший галогеналкил с 1-6 атомами углерода, ароматический радикал, выбираемый из группы, включающей фенил, нафтил, тиенил, фурил или пиридил, или R1, R2 или R3, R4 означают атом кислорода, которые обладают противовоспалительным и болеутоляющими свойствами, а также к способу получения фармацевтической композиции на их основе. Технический результат – новые соединения, используемые в медицине. 3 с. и 8 з.п.ф-лы, 3 табл. 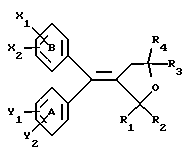
Настоящее изобретение относится к диарилметилиденфурановым производным общей формулы (I) в качестве новых продуктов. Один из путей биотрансформации арахидоновой кислоты – это циклооксигеназа, с ее помощью арахидоновую кислоту превращают в PGG2, затем в PGH. Последние работы по клонированию и секвенированию циклооксигеназы позволили выявить у многих видов и, в частности, у человека, два изофермента СОХ-1 и СОХ-2. Первый из вышеназванных – это конститутивный фермент, экспрессируемый в большинстве тканей, тогда как второй, экспрессируемый в некоторых тканях, таких как головной мозг, индуцируется в большинстве своем рядом веществ, в частности цитокинами и медиаторами, продуцируемыми в процессе развития воспалительных реакций. Каждый из этих ферментов имеет свою определенную роль, и ингибирование СОХ-1 или СОХ-2 будет вызывать неодинаковые последствия. Ингибирование СОХ-1 вызовет уменьшение простагландинов, участвующих в гомеостазе, что может привести к побочным эффектам. Ингибирование СОХ-2 вызовет уменьшение простагландинов, продуцируемых в процессе воспаления. Следовательно, селективное ингибирование СОХ-2 позволит получить хороший толерантный противовоспалительный агент. Рассматриваемые в данном изобретении соединения позволяют получить такое селективное ингибирование. Следовательно, соединения, о которых идет речь, представляют очень большой интерес для фармакологии в связи с тем, что они наделены противовоспалительными и болеутоляющими свойствами, прекрасно переносимыми организмом на уровне желудка. В частности, они будут использоваться при лечении воспалительных процессов и при снятии боли. Например, их можно использовать при лечении артрита, а именно ревматоидного артрита, спондилоартрита, подагрического артрита, остеоартрита, юношеского артрита, аутоиммунных болезней, красной волчанки. Они могут быть использованы также при лечении бронхиальной астмы, дисменорей, тендинитов, бурситов, дерматологических воспалений, таких как псориаз, экзема, ожоги, дерматиты, при лечении желудочно-кишечных заболеваний, болезни Крона, гастритов, язвенных колитов, для профилактики раковых заболеваний, в частности аденокарциномы ободочной кишки, для профилактики нейродегенеративных заболеваний, в частности болезни Альцгеймера, для профилактики внезапных мозговых ударов, эпилепсии и для профилактики преждевременных маточных родов. Болеутоляющие свойства этих соединений позволяют их использовать при всех болевых симптомах, а именно при лечении мускульных, суставных или нервных болей, зубной боли, опоясывающего лишая и мигреней, при лечении ревматических заболеваний, болей ракового происхождения, а также в качестве дополнительного лечения при инфекционных заболеваниях и при лихорадке. Настоящее изобретение относится также к способу получения названных продуктов и их применению в терапии. Некоторые производные описаны в литературе как обладающие селективными ингибирующими свойствами циклооксигеназы-2. Например, можно назвать соединения, описанные в заявках: WO 9500501 A (Merck Frosst Canada Inc.) WO 9415932 A (G.D.Searle et Co.) WO 9608482 A (Merck et Co. Inc.) Большинство соединений, описанных в указанных заявках в качестве селективных ингибиторов циклооксигеназы-2, – это производные гетероциклов с 5 атомами, замещенных двумя ароматическими кольцами, непосредственно связанными с гетероциклом и расположенными на двух углеродах, примыкающих к этому гетероциклу. Заявительница неожиданно обнаружила, что производные, несущие оба ароматических кольца на одном и том же углероде, причем эти ароматические кольца связаны с гетероциклом не непосредственно, а через двойную связь, обладают значительными селективными ингибиторными свойствами циклооксигеназы-2. Эти диарилметилиденфурановые производные отличаются тем, что они отвечают общей формуле (I) 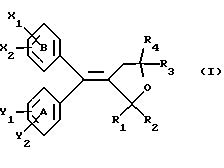 в которой циклы А и В означают независимо: – фенильный радикал – нафтильный радикал, – производное гетероцикла с 5-6 звеньями, включающее один гетероатом, – производное насыщенного углеводородного цикла с 3-7 атомами углерода, – по меньшей мере один из заместителей X1, X2, Y1 или Y2 обязательно означает: – группу -S(O)nR, в которой n – целое число 0, 1 или 2, a R – низший алкил с 1-6 атомами углерода, – группу – SO2NH2; и находится в пара-положении, другие означают независимо – атом водорода, – атом галогена, – низший алкил с 1-6 атомами углерода, – трифторметил, – низший 0-алкил с 1-6 атомами углерода или X1 и X2, или Y1 и Y2 обязательно означают группу метилендиокси, R1, R2, R3 и R4 означают независимо – атом водорода, – атом галогена, – низший алкил с 1-6 атомами углерода, – низший галогеноалкил с 1-6 атомами углерода, – ароматический радикал, выбираемый из группы, содержащей фенил, нафтил, тиенил, фурил или пиридил, или R1, R2 или R3, R4 означают атом кислорода. В описании и формуле изобретения под низшим алкилом подразумевают линейную или разветвленную углеводородную цепь с 1-6 атомами углерода. Низший алкил, например, это метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил, гексил, изогексил. Под галогеном подразумевают атом хлора, брома, йода или фтора. Под насыщенным углеводородным циклом, имеющим от 3 до 7 атомов углерода, подразумевают циклопропан, циклобутан, циклопентан, циклогексан или циклогептан. Под производным гетероцикла подразумевают все ароматические циклы, содержащие в кольце гетероатом: азот, кислород или серу. Среди этих циклов особенно предпочтительны пиридин, фуран, тиофен, а также пиррол, имидазол, пиразол, пиразин, пиримидин, пиридазин, оксазол, окосадиазол, тиазол, тиадиазол. Вышеназванные производные формулы (I) могут представлять собой центры асимметрии и/или могут быть в виде производных цис или транс. Изобретение охватывает смеси рацемические, смеси соединений цис и транс, но также оптически активные продукты, производные цис и производные транс, взятые отдельно. Получение этих чистых продуктов осуществляют согласно известным специалистам методикам, в частности, с помощью хроматографии на хиральных колонках, когда речь идет об оптических изомерах. В некоторых случаях это разделение можно осуществлять путем простой рекристаллизации. Оно может быть выполнено либо на конечном продукте, либо на промежуточном соединении синтеза, причем в этом случае продолжение синтеза будет соответствовать стереохимии молекулы промежуточного соединения. Предпочтительно, производные по изобретению – это производные вышеназванной формулы (I), в которой: Циклы А и В означают независимо радикал: – фенил, – нафтил, – пиридил, – фурил, – тиенил, – циклогексил, по меньшей мере один из заместителей X1, Х2, Y1 или Y2 обязательно означает группу SСН3, SО2СН3 или SO2NH2, другие означают независимо: – атом водорода, – атом галогена, – низший алкил с 1-6 атомами углерода, – трифторметил, – низший O-алкил с 1-6 атомами углерода R1, R2 означают атом кислорода, R3, R4 означают независимо атом водорода или низший алкил с 1-6 атомами углерода. Предпочтительно, в рамках настоящего изобретения используют соединение формулы (I), в которой выполнено по меньшей мере одно из следующих условий: – цикл В означает фенил, – X1 – группа 4-SО2СН3 или группа 4-SO2NH2, – X2 – атом водорода, – цикл А – это фенил или пиридил, – Y1 – атом фтора, атом хлора или метил, – Y2 – атом водорода, атом фтора или атом хлора, – R1,R2 – атом кислорода, – R3 – атом водорода, – R4 – атом водорода. Особенно предпочтительные соединения по изобретению – это производные формулы (Е)-3-[1-(4-фторфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он 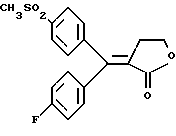 (Z)-3-[1-(4-хлорфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он 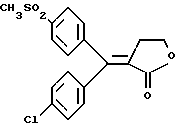 (Z)-3-[1-(3,4-дихлорфенил)-1-(4-метансульфонилфенил)-метилиден] дигидрофуран-2-он, 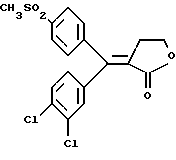 (Z)-3-[1-(6-хлорпиридин-3-ил)-1-(4-метансульфонилфенил) метилиден] дигидрофуран-2-он, 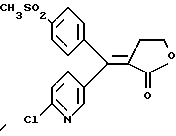 (Z)-4-[(4-хлорфенил)-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамид 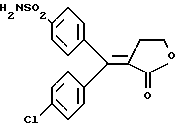 (Z)-4-[(3-фтор-4-метилфенил)-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамид 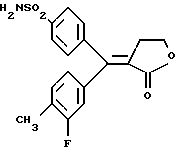 Согласно изобретению соединения формулы (I) могут быть синтезированы следующим образом: С помощью реакции Фриделя-Крафтса хлорангидрида кислоты формулы (II) 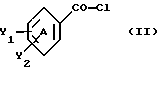 в которой A, Y1 и Y2 определены выше с тиоанизолом, получают кетон формулы (III) 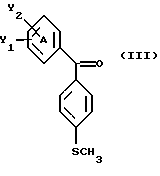 в которой A, Y1 и Y2 имеют вышеназванные значения. Этот кетон может быть получен также с помощью реакции Гриньяра: реакция магнийсодержащего бромароматического производного, которое может быть замещено на пара-метилтиобензонитриле. Обрабатывая этот кетон окислителем, например метахлорпербензойной кислотой, перборатом натрия или перекисью водорода в присутствии каталитического количества солей молибдена, получают производное формулы (IV): 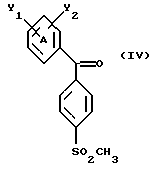 в которой А, Y1 и Y2 имеют вышеназванные значения. Обрабатывая производное формулы (IV) с помощью реакции Реформатского, модифицированной бромбутиролактоном формулы (V) 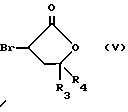 в которой R3 и R4 имеют вышеназванные значения, в присутствии магния и небольшого количества метилиодида, чтобы инициировать реакцию, получают производные формулы (VI): 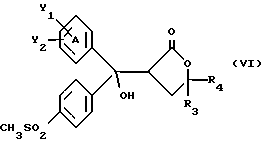 в которой A, Y1, Y2, R3 и R4 имеют вышеназванные значения. Дегидратируя производные формулы (VI) путем нагревания в толуоле, например в присутствии паратолуолсульфоновой кислоты, или путем обработки трифторуксусным ангидридом в трифторуксусной кислоте, получают соединения формулы (I): 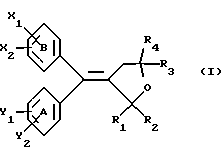 в которой В – это фенильное кольцо, X1 – группа 4-SО2СН3, Х2 – атом водорода, R1, R2 – атом кислорода, a A, Y1, Y2, R3 и R4 имеют вышеназванные значения. Один из вариантов выполнения состоит в том, что продукт формулы (III) обрабатывают либо производным формулы (V) согласно методике, идентичной реакции Реформатского, модифицированной присутствием магния и метилиодида для инициирования реакции, либо лактонами формулы (V’) 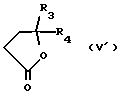 в которой R3 и R4 имеют вышеназванные значения, в присутствии бромида N, N-диэтиламиномагния, полученного путем воздействия N,N-диэтиламина на бромид этилмагния, согласно информационной ссылке: K.Sisido, H.Nozaki, O.Kurihara J.Am. Chem. Soc., 74, 6254 (1952), чтобы получить либо уже дегидратированные соединения формулы (I), либо соединения формулы (VI’) 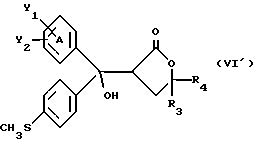 в которой A, Y1, Y2, R3 и R4 имеют вышеназванные значения. Тогда соединения формулы (VI’) дегидратируют с помощью трифторуксусного ангидрида и трифторуксусной кислоты, чтобы получить соединения формулы (I): 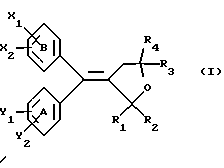 в которой В – фенильное кольцо, X1 – группа 4-SСН3, Х2 – атом водорода, R1, R2 – атом кислорода, a A, Y1, Y2, R3 и R4 имеют вышеназванные значения. Обработка таким образом полученного соединения с помощью метахлорпербензойной кислоты или другого окислителя, например NаВО3, 4Н2О, приведет, в зависимости от использованного количества окислителя, к соединениям формулы (I) 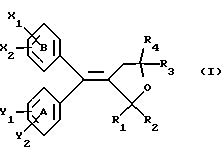 в которой В – фенильное кольцо, X1 – группа 4-SОСН3 для одного эквивалента окислителя или группа 4-SО2СН3 для двух эквивалентов окислителя, Х2 – атом водорода, R1, R2 – атом кислорода, а А, Y1, Y2, R3 и R4 имеют вышеназванные значения. Другой вариант получения соединений формулы (I) состоит в том, что обрабатывают кетон формулы (III) с помощью этилсукцината согласно реакции Штоббе в трет-бутаноле в присутствии трет-бутилата натрия или калия, чтобы получить соединения формулы (VII) 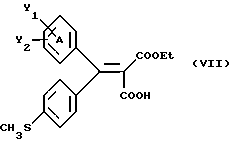 в которой A, Y1 и Y2 имеют вышеназванные значения. Селективное восстановление сложного эфира, например, в боргидриде кальция, полученном in situ из боргидрида калия и хлорида кальция в этаноле, или в диэтилдигидроалюминате натрия в этиловом эфире, приводит после лактонизации полученных оксикислот, к производным формулы (VIII). 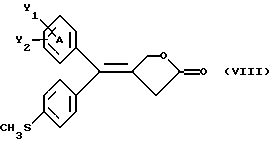 в которой А, Y1 и Y2 имеют вышеназванные значения. Производные формулы (VIII) могут быть оксидированы вышеописанным способом, при этом группа SСН3 превращается в группу SОСН3 или SО2СН3 в зависимости от использованного количества окислителя, чтобы получить соединения формулы (I) 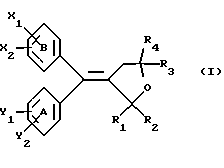 в которой В – фенильное кольцо, X1 – группа 4-SОСН3 или группа 4-SO2СН3, Х2, R1 и R2 – атом водорода, R3, R4 – атом кислорода, a A, Y1, Y2 имеют вышеназванные значения. Восстановление производных формулы (VII) с помощью двойного алюмогидрида лития, например, в тетрагидрофуране приводит к получению диодов формулы (IX) 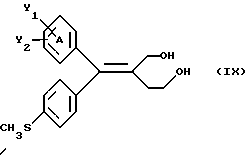 в которой A, Y1, Y2 имеют вышеназванные значения. Дегидратация этих диодов с помощью серной кислоты или путем кипячения толуола с обратным холодильником в присутствии паратолуолсульфоновой кислоты с прибором Дина Старка позволяет получить соединения формулы (I) 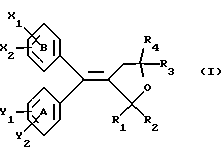 в которой A, Y1 и Y2 имеют вышеназванные значения, В – фенильное кольцо, X1 – группа 4-SСН3, Х2, R1, R2, R3, R4 означают атом водорода. Обработав эти производные окислителем так, как описано выше, получают соответствующие производные, в которых X1 означает группу 4-SОСН3 или группу 4-SO2СН3, в зависимости от использованного количества окислителя. Можно использовать и другие варианты получения соединений формулы I. Реакция кетонов, соединений формулы (IV) с этилсукцинатом согласно реакции Штоббе, проводимая в трет-бутаноле в присутствии трет-бутилата натрия или калия, приводит, например, к получению соединений формулы (X): 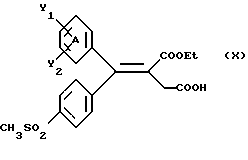 в которой А, Y1 и Y2 имеют вышеназванные значения. В данном случае селективное восстановление кислотной функции с помощью борана или комплексного соединения боран/метилсульфид в тетрагидрофуране или этиловом эфире приводит к получению сложных эфиров, содержащих спиртовую группу формулы (XI): 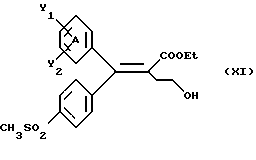 в которой A, Y1 и y2 имеют вышеназванные значения. Эти сложные эфиры, содержащие спиртовую группу формулы (XI), или соответствующие кислоты, содержащие спиртовую группу, полученные путем гидролиза сложного эфира гидроксидом натрия в этаноле при кипячении с обратным холодильником, циклизуют путем нагревания в ароматическом растворителе, таком как толуол, например, в присутствии паратолуолсульфоновой кислоты, чтобы получить соединения формулы (I): 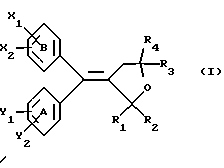 в которой A, Y1, Y2 имеют вышеназванные значения, В – фенильное ядро, X1 – группа 4-SO2СН3, Х2, R3 и R4 означают атом водорода, a R1, R2 – атом кислорода. Соединения формулы (XII), в которой A, Y1, Y2 имеют вышеназванные значения, можно получить согласно реакционной схеме, в которой Ph означает группу фенил, a Z означает радикал МgВr, когда А – это фенил, и радикал Li, когда А – это пиридил. 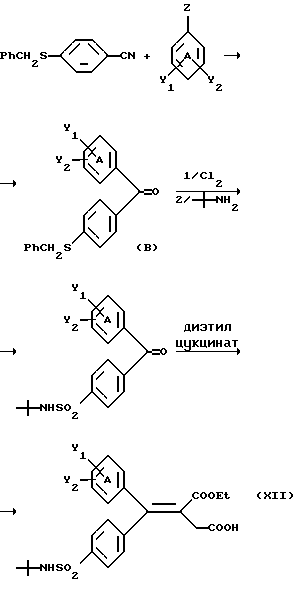 Еще один вариант состоит в получении диарилкетона (В), используемого в предшествующей реакционной схеме, путем воздействия бензилмеркаптана PhCh2SH на фтордиарилкетон в диметилформамиде в присутствии гидрида натрия или карбоната натрия: 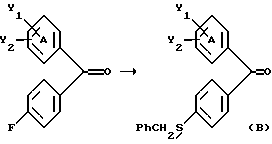 Соединения формулы (XII) обрабатывают как соединения формулы (X), чтобы получить соединения формулы (I): 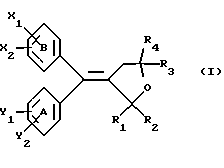 в которой В – фенильное кольцо, X1 – группа 4-SO2NHt-Bu, Х2, R3 и R4 – атом водорода, R1, R2 – атом кислорода, a A, Y1 и Y2 имеют вышеназванные значения. Обрабатывая эти производные сильной кислотой, например концентрированной серной кислотой, трифторуксусной кислотой или путем нагревания в толуоле в присутствии паратолуолсульфоновой кислоты, получают соединения формулы (I), в которой В – фенильное кольцо, X1 – группа 4-SO2NH2, Х2, R3 и R4 – атом водорода, R1, R2 – атом кислорода, а А, Y1 и Y2 имеют вышеназванные значения. Вышеназванные соединения формулы (I) являются ингибиторами циклооксигеназы-2 и обладают хорошей противовоспалительной и болеутоляющей активностью наряду с отличной толерантностью, в частности желудочной. Благодаря таким свойствам они могут применяться в терапии. Поэтому объектом настоящего изобретения в качестве медикаментов являются продукты, определенные вышеназванной формулой (I). Объектом изобретения является также фармацевтическая композиция, отличающаяся тем, что она включает в себя фармацевтически эффективное количество, по меньшей мере, одного указанного выше соединения формулы (I) при необходимости включенного в эксципиент, связующее вещество или фармацевтически приемлемый носитель. Эти композиции могут быть назначены для применения пероральным, ректальным, парентеральным путем, чреcкожным, окулярным, назальным или аурикулярным путем. Они могут быть твердыми или жидкими и могут представлять собой все фармацевтические формы, используемые в настоящее время в медицине, например таблетки простые и дражированные, желатиновые капсулы, гранулы, свечи, препараты для инъекций, чреcкожные системы, примочки для глаз, аэрозоли и спреи и ушные капли. Методы их получения обычны и известны. Активное начало, состоящее из фармацевтически эффективного количества, по меньшей мере, одного указанного выше соединения формулы (I), может быть включено в используемые в этих фармацевтических композициях эксципиенты. Это могут быть тальк, гуммиарабик, лактоза, крахмал, стеарат магния, поливидон, производные целлюлозы, масло какао, полусинтетические триглицериды, водные или неводные связующие, жиры животного или растительного происхождения, гликоли, различные смачивающие вещества, диспергаторы или эмульгаторы, силиконовые гели, некоторые полимеры и сополимеры, консерванты, ароматизаторы и красители. Изобретение рассматривает также фармацевтическую композицию с противовоспалительным и болеутоляющим действием, оказывающую, в частности, благоприятный эффект при лечении воспалительных процессов и боли, отличающуюся тем, что она включает фармацевтически эффективное количество, по меньшей мере, одного соединения указанной формулы (I), введенного в эксципиент, связующее вещество или фармацевтически приемлемый носитель. Согласно способу выполнения, получают фармацевтическую композицию с противовоспалительным и болеутоляющим действием, позволяющим, в частности, благополучно лечить различные воспаления и боли. Согласно одному варианту выполнения получают композицию, сформулированную в виде желатиновых капсул или таблеток с дозировкой от 1 мг до 1000 мг, или в виде препаратов для инъекций с дозировкой от 0,1 мг до 500 мг. Можно также использовать формулирования в виде свечей, мазей, кремов, гелей, аэрозольных препаратов, чрескожных препаратов или пластырей. Изобретение относится также к способу терапевтического лечения млекопитающих, отличающемуся тем, что данному млекопитающему назначают терапевтически эффективное количество, по меньшей мере, одного соединения вышеназванной формулы (I). Согласно одному варианту осуществления этого способа соединение формулы (I), либо одно, либо вместе с фармацевтически приемлемым эксципиентом, формулируют в желатиновых капсулах или в таблетках с дозировкой от 1 мг до 1000 мг для перорального приема, или в виде инжектируемых препаратов с дозировкой от 0,1 мг до 500 мг, или в виде свечей, мазей, кремов, гелей или аэрозолей. Этот способ позволяет, в частности, благополучно лечить воспалительные процессы и боли. При терапевтическом лечении человека и животного соединения формулы (I) могут быть назначены одни или в сочетании с физиологически приемлемым эксципиентом в какой угодно фармацевтической форме, в частности оральным путем в виде желатиновых капсул или таблеток или парентерально в виде растворов для инъекций. Могут быть рассмотрены и другие виды назначения, такие как свечи, мази, кремы, гели и аэрозольные препараты. Из фармакологических испытаний, представленных в конце описания, видно, что при лечении человека с вышеуказанными показаниями соединения согласно изобретению могут быть назначены в виде желатиновых капсул или таблеток с дозировкой от 1 мг до 1000 мг для перорального приема или в виде препаратов для инъекций с дозировкой от 0,1 мг до 500 мг за один или несколько раз в день для взрослого человека весом 60-70 кг для приема парентеральным путем. При лечении животных дневная используемая доза составляет от 0,1 мг до 100 мг на килограмм. Другие характеристики и преимущества изобретения станут более понятны при чтении нижеследующих примеров, которые не ограничивают изобретение, а приведены в качестве иллюстрации. ПРИМЕР 1 4-фтор-4′-метилтиобензофенон Формула (III): А=фенил, Y1=4-F, Y2=H К раствору из 70 г (0,564 моль) тиоанизола и 90,2 г (0,654 моль) 4-фторбензолхлорида в 500 мл дихлорметана добавляют порционно 86,4 г трихлорида алюминия при температуре от 0oС до 5oС. После окончания добавления смесь доводят до комнатной температуры, затем нагревают с обратным холодильником в течение 2 часов. После охлаждения реакционную среду сливают на смесь лед/разбавленная соляная кислота, а органическую фазу декантируют, затем сушат над сульфатом магния и выпаривают в вакууме, чтобы получить осадок, который кристаллизуется в изопропиловом эфире и дает 118 г 4-фтор-4′-метилтиобензофенона с точкой плавления 88oС. ПРИМЕР 2 4-фтор-4′-метансульфонилбензофенон Формула (IV): А= фенил, Y1=4-F, Y2=H К раствору из 25 г (0,1015 моля) 4-фтор-4′-метилтиобензофенона, полученного в примере 1, в 350 мл дихлорметана добавляют порционно 87 г 70%-ного водного раствора 3-хлорпербензойной кислоты при температуре от 0oС до 5oС. Затем смесь перемешивают при 0oС в течение 30 минут, затем доводят до комнатной температуры и перемешивают в течение 2 часов 30 минут. Полученный осадок центрифугируют и промывают в разбавленном растворе гидроокиси натрия, затем растворяют в дихлорметане. Полученную органическую фазу сушат над сульфатом магния и выпаривают в вакууме, чтобы получить масло, которое кристаллизуется в изопропиловом эфире и дает 24,6 г 4-фтор-4′-метансульфонилбензофенона с точкой плавления 136oС. ПРИМЕР 3 3-[1-(4-фторфенил)-1-гидрокси-1-(4-метансульфонилфенил)метил]дигидрофуран-2-он Формула (IV): А=фенил, Y1=4-F, Y2=H, R3=R4=H Стружку магния (3,5 г) покрывают безводным тетрагидрофураном и добавляют несколько капель иодметана. Как только реакция началась, добавляют по каплям смесь из 24,6 г 4-фторо-4′-метансульфонилбензофенона и 8,1 мл  -бром- -бром- -бутирлактона 250 мл безводного тетрагидрофурана, чтобы поддерживать легкий рефлюкс. По окончании добавления реакционную среду охлаждают, затем сливают на смесь лед/10% водный раствор серной кислоты. Органическую фазу экстрагируют в тетрагидрофуране и промывают насыщенным раствором бикарбоната натрия, затем сушат над сульфатом магния. После выпаривания растворителя полученный осадок хроматографируют на силикагеле при элюировании смеси дихлорметан/ацетон (9/1), чтобы получить 7 г 3-[1-(4-фторфенил)-1-гидрокси-1-(4-метансульфонилфенил)метил] дигидрофуран-2-она в виде бежевого аморфного порошка, используемого таким, как есть, в дальнейшем.
ПРИМЕР 4 -бутирлактона 250 мл безводного тетрагидрофурана, чтобы поддерживать легкий рефлюкс. По окончании добавления реакционную среду охлаждают, затем сливают на смесь лед/10% водный раствор серной кислоты. Органическую фазу экстрагируют в тетрагидрофуране и промывают насыщенным раствором бикарбоната натрия, затем сушат над сульфатом магния. После выпаривания растворителя полученный осадок хроматографируют на силикагеле при элюировании смеси дихлорметан/ацетон (9/1), чтобы получить 7 г 3-[1-(4-фторфенил)-1-гидрокси-1-(4-метансульфонилфенил)метил] дигидрофуран-2-она в виде бежевого аморфного порошка, используемого таким, как есть, в дальнейшем.
ПРИМЕР 4(Е)-3-[1-(4-фторфенид)-1-(4-метансульфонил фенил)-метилиден] дигидрофуран-2-он Изомер (Е): Формула (I): А=В=фенил, Y1=4=F, X2=Y2=H, X1=4-SO2CH3, R1, R2=0, R3=R4=H. К раствору из 7 г 3-[1-(4-фторфенил)-1-гидрокси-1-(4-метансульфонилфенил)метил] дигидрофуран-2-она, полученного в примере 3, в 100 мл толуола добавляют несколько мг 4-толуолсульфоновой кислоты и смесь нагревают с обратным холодильником в течение 10 часов с помощью прибора Дина-Старка. Растворитель затем упаривают досуха в вакууме и осадок хроматографируют при элюировании смеси дихлорметан/ацетон (9/1), чтобы получить масло, которое элюируют трет-бутилметилэфиром, чтобы получить 2,9 г (Е)-3-[1-(4-фторфенил)-1- (4-метансульфонилфенил)метилиден] дигидрофуран-2-она (второй элюированный продукт) в виде кристаллов с точкой плавления 187-9oС. Рекуперируют 1,5 г (Z)-3-[1-(4-фторфенил)-1-(4-метансульфонилфенил)метилиден]дигидрофуран-2-она (первый элюированный продукт) в виде кристаллов с точкой плавления 157-158oС. ПРИМЕР 5 4-хдор-4′-метидтиобензофенон Формула (III): А=фенил, Y1=4-Cl, Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 134oС. ПРИМЕР 6 3-[1-(4-(хлорфенил)-1-гидрокси-1-(4-метилтиофенил)метил] -дигидрофуран-2-он Формула (VI’): А=фенил, Y1=4-Cl, Y2=H, R3=R4=Н К 5,9 г магниевой стружки, покрытой безводным тетрагидрофураном, добавляют несколько капель иодметана. Как только реакция начинается, добавляют по капле смесь из 17 г 4-хлор-4′-метилтиобензофенона и 12,6 мл  -бром- -бром- -бутирлактона в 300 мл безводного тетрагидрофурана, чтобы поддерживать легкий рефлюкс. После добавления смесь перемешивают при комнатной температуре в течение 1 часа 30 минут, затем охлаждают в ледяной бане. Затем добавляют насыщенный раствор хлорида аммония и смесь перемешивают, затем декантируют. Органическую фазу сушат над сульфатом магния и выпаривают в вакууме, чтобы получить масляный остаток, который после хроматографии на силикагеле при элюировании дихлорметаном дает 8,5 г 3-[1-(4-хлорфенил)-1-гидрокси-1-(4-метилтиофенил)метил] дигидрофуран-2-она в виде масла, используемого в дальнейшем в неочищенном виде.
ПРИМЕР 7 -бутирлактона в 300 мл безводного тетрагидрофурана, чтобы поддерживать легкий рефлюкс. После добавления смесь перемешивают при комнатной температуре в течение 1 часа 30 минут, затем охлаждают в ледяной бане. Затем добавляют насыщенный раствор хлорида аммония и смесь перемешивают, затем декантируют. Органическую фазу сушат над сульфатом магния и выпаривают в вакууме, чтобы получить масляный остаток, который после хроматографии на силикагеле при элюировании дихлорметаном дает 8,5 г 3-[1-(4-хлорфенил)-1-гидрокси-1-(4-метилтиофенил)метил] дигидрофуран-2-она в виде масла, используемого в дальнейшем в неочищенном виде.
ПРИМЕР 73-[1-(4-хлорфенил)-1-(4-метилтиофенил)мети-лиден]дигидрофуран-2-он Формула (I): А=В=фенил, Y1=4-Cl, Y2=X1=H, Х2=4-SСН3, R1, R2=0, R3=R4=Н К раствору из 8,6 г 3-[ 1-(4-хлорфенил)-1-гидрокси-1-(4-метилтиофенил)метил]дигидрофуран-2-она, полученного в примере 6, в 100 мл дихлорметана 5,2 г трифторуксусного ангидрида и 3,8 мл трифторуксусной кислоты. Смесь перемешивают при комнатной температуре в течение 4 часов, затем разбавляют водой и декантируют. Органическую фазу сушат над сульфатом магния и выпаривают в вакууме, чтобы получить 7,5 г 3-[1-(4-[хлорфенил)-1-(4-метилтиофенил)метилиден] дигидрофуран-2-она в виде масла, используемого таким, как есть, в дальнейшем. ПРИМЕР 8 (Z)-3-[1-(4-хлорфенил)-1-(4-метансульфонилфенил)метилиден]-дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=4=Cl, Y2=X1=H, Х2=4-SС2СН3, R1, R2=0, R3=R4=Н. К раствору из 9,5 г 3-[1-(4-хлорфенил)-1- (4-метилтиофенил)метилиден] дигидрофуран-2-она, полученного в примере 7, в 120 мл уксусной кислоты добавляют 11 г тригидрированного пербората натрия. Смесь нагревают при 40-50oС в течение 5 часов, затем охлаждают. Образованные кристаллы центрифугируют, промывают водой, затем хроматографируют на силикагеле при элюировании смеси дихлорметан/ацетон (99/1), чтобы получить 4,1 г (Z)-3-[1-(4-хлорфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-она в виде кристаллов с точкой плавления 197-199oС. Выделение второго элюированного продукта позволяет получить 2,5 г (Е)-3-[1-(4-хлорфенил)-1-(4-метансульфонилфенил)-метилиден] дигидрофуран-2-она в виде кристаллов с точкой плавления 211-212oС. ПРИМЕР 9 4-фтор-4′-метилтиобензофенон Формула (III): А=фенил, Y1=4-F, Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 76oС. ПРИМЕР 10 4-фтор-4′-метансульфонилбензофенон Формула (IV): А=фенил, Y1=3-F, Y2=H. Получают согласно способу примера 2. Кристаллы с точкой плавления 106oС. ПРИМЕР 11 3-этоксикарбонил-4-(3-фторфенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=3-F, Y2=H К раствору 15,7 г (0,140 моля) трет-бутилата калия в 100 мл трет-бутанола добавляют порционно 35,5 г (0,1275 моля) 4-фтор-4′-метансульфонилбензофенона, полученного в примере 10. Смесь перемешивают и быстро по каплям добавляют 32 мл (0,191 моля) этилсукцината. Затем смесь нагревают с обратным холодильником в течение 30 минут, охлаждают и добавляют в нее воду и 1N соляную кислоту, чтобы получить рН, равный 1, затем экстрагируют в трет-бутилметилэфире. Органическую фазу обрабатывают 2% раствором гидроксида калия и смесь декантируют. Водную фазу подкисляют 1N соляной кислотой, затем экстрагируют в трет-бутилметилэфире. Органическую фазу сушат над сульфатом магния и выпаривают в вакууме, чтобы получить 39,2 г 3-этоксикарбонил-4-(3-фторфенил)-4-(4-метансульфонилфенил)-3-бутеновой кислоты в виде густого масла, используемого в таком виде в дальнейшем. ПРИМЕР 12 3-(3-фторфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=3-F, Y2=H. К раствору из 31,5 г (0,0775 моля) 3-этоксикарбонил-4-(3-фторфенил)-4-(4-метансульфонилфенил)-3-бутеновой кислоты, полученной в примере 11, в 90 мл безводного тетрагидрофурана добавляют по капле 15,5 мл (0,155 моля) комплекса боран/метилсульфид. Смесь перемешивают при комнатной температуре в течение 8 часов и добавляют по капле 23,5 мл метанола. Смесь упаривают досуха в вакууме, осадок обрабатывают этилацетатом, затем обрабатывают водным раствором из 7,6 г карбоната калия. Органическую фазу декантируют, затем сушат над сульфатом магния и упаривают досуха в вакууме, чтобы получить 29,3 г 3-(3-фторфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноата в виде вязкого масла, используемого в таком виде в дальнейшем. ПРИМЕР 13 (Z)-3-[1-(3-фторфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-F, X2=Y2=H, X1=4-SO2CH3, R1, R2=0, R3=R4=Н К раствору из 29,3 г 3-(3-фторфенил)-3-(4-метансульфонилфенил) -2-(2-гидроксиэтил)-2-этилпропеноата, полученного в примере 12, в 50 мл этанола, добавляют 3,3 г гидроксида натрия в растворе в 10 мл воды и смесь нагревают с обратным холодильником в течение 2 часов. После упаривания досуха осадок обрабатывают в воде и подкисляют 1N соляной кислотой, затем экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния и выпаривают в вакууме, чтобы получить маслянистый осадок. Масло растворяют в 150 мл толуола и добавляют 10 мг паратолуолсульфоновой кислоты. Смесь нагревают с обратным холодильником, и образованную воду удаляют с помощью прибора Дина Старка. После охлаждения смесь промывают водой, органическую фазу сушат над сульфатом магния, выпаривают в вакууме, а осадок хроматографируют на двуокиси кремния при элюировании трет-бутилметилэфира, чтобы получить 4 г (Z)-3-[1-(3-фторфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-она (второй элюированный продукт) в виде кристаллов с температурой плавления 153-154oС. ПРИМЕР 14 3,4-дихдор-4′-метилтиобензофенон Формула (III): А=фенил, Y1=3-Cl, Y2=4-Cl. Получают согласно способу примера 1. Кристаллы с точкой плавления 100oС. ПРИМЕР 15 3,4 -дихлор-4′-метансульфонилбензофенон Формула (IV): А= фенил, Y1=3-Cl, Y2=4-Cl. Получают согласно способу примера 2. Кристаллы с точкой плавления 158oС. ПРИМЕР 16 3-этоксикарбонил-4-(3,4-дихлорфенил)-4- (4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=3-Cl, Y2=4-C1. Получают согласно способу примера 11. Масло, используемое такое, как есть в дальнейшем. ПРИМЕР 17 3-(3,4-дихлорфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=3-Cl, Y2=4-С1 Получают согласно способу примера 12. Масло, используемое в таком виде в дальнейшем. ПРИМЕР 18 (Z)-3-[1-(3,4-дихлорфенил)-1-(4-метансульфонилфенил) метилиден]дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-Cl, Y2=4-Cl, X2=H, X1=4-SO2CH3, R1, R2=0, R3=R4=H. Получают согласно способу примера 13. Хроматографируют при элюировании смеси дихлорметан/ацетон (99/1), первый элюированный продукт. Кристаллы с точкой плавления 195-197oС. Во время хроматографии выделение второго элюированного продукта позволяет получить изомер (Е)-3-[1-(3,4-дихлорфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он в виде кристаллов с точкой плавления 163-164oС. ПРИМЕР 19 4-хлор-4′-метилтиобензофенон Формула (III): А=фенил, Y1=3-Cl, Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 70oС. ПРИМЕР 20 4-хлор- 4′-метансульфонилбензофенон Формула (IV): А=фенил, Y1=3-Cl, Y2=H Получают согласно способу примера 2. Кристаллы с точкой плавления 140oС. ПРИМЕР 21 3-этоксикарбонил-4-(3-хлорфенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=3-Cl, Y2=H. Получают согласно способу примера 11. Масло, используемое в таком виде в дальнейшем. ПРИМЕР 22 3-(3-хлорфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=3-Cl, Y2=H Получают согласно способу примера 12. Масло, используемое в таком виде в дальнейшем. ПРИМЕР 23 (Z)-3-[1-(3-хлорфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-Cl, X2=Y2=H, Х1-4-SО2СН3, R1, R2=0, R3=R4=H. Получают согласно способу примера 13. Хроматографируют при элюировании смеси дихлорметан/ацетон (99/1), первый элюированный продукт. Кристаллы с точкой плавления 147-149oС. Выделение второго элюированного продукта во время хроматографии позволяет получить соединение (Е)-3-[1-(3-хлорфе-нил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он в виде кристаллов с точкой плавления 170-172oС. ПРИМЕР 24 4-метилтиобензофенон Формула (III): А=фенил, Y1=Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 84oС. ПРИМЕР 25 4-метансульфонилбензофенон Формула (IV): А=фенил, Y1=Y2=H Получают согласно способу примера 2. Кристаллы с точкой плавления 150oС. ПРИМЕР 26 3-этоксикарбонил-4-фенил-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X ): А=фенил, Y1=Y2=H. Получают согласно способу примера 11. Масло, используемое в таком виде в дальнейшем. ПРИМЕР 27 3-фенил-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=Y2=H. Получают согласно способу примера 12. Масло, используемое такое, как есть в дальнейшем. ПРИМЕР 28 (Е)-3-[1-фенил-1-(4-метансульфонилфенил)метилиден]-дигидрофуран-2-он Изомер (Е): формула (I): А=В=фенил, Y1=Y2=H, Х2=Н, X1=4-SO2CH3, R1, R2= 0, R3=R4=H. Получают согласно способу примера 13. Хроматографируют на силикагеле при элюировании смеси дихлорметан/ацетон (99/1), первый элюированный продукт. Кристаллы с точкой плавления 135-137oС. Выделение второго элюированного продукта позволяет получить изомер (Z)-3-[1-фенил-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он в виде кристаллов с точкой плавления 206-208oС. ПРИМЕР 29 5,5-диметил-3-[1-(4-фторфенил)-1-гидрокси-1-(4-метилтиофенил)метил] дигидрофуран-2-он Формула (VI’): А=фенил, Y1=4-F, Y2=H, R3=R4=СН3 К суспензии из 2,4 г магниевой стружки в безводном этиловом эфире добавляют по каплям 7,5 мл бромметана. После добавления смесь охлаждают до 0oС и 10,5 мл N,N-диэтиламина добавляют по каплям. Реакционную среду перемешивают в течение часа при комнатной температуре, затем 15 минут нагревают с обратным холодильником и охлаждают в ледяной бане из льда и хлорида натрия. Добавляют по капле раствор 12,3 г 4-фтор-4′-метилтиобензофенона, полученного в примере 1, и 5,7 г 4,4-диметилбутиролактона в 50 мл безводного тетрагидрофурана, поддерживая температуру от 0oС до 5oС. Затем смесь кипятят с обратным холодильником в течение 2 часов, охлаждают и обрабатывают с помощью 100 мл 10%-го раствора серной кислоты. После экстрагирования этиловым эфиром органическую фазу сушат над сульфатом магния и выпаривают в вакууме, чтобы получить 4,8 г 5,5-диметил-3-[1-(4-фторфенил)-1-гидрокси-1-(4-метилтиофенил)метил]дигидрофуран-2-она в виде кристаллов с точкой плавления 185oС. ПРИМЕР 30 5,5-диметил-3-[1-(4-фторфенил)-1-(4-метилтиофенил)метилиден] дигидрофуран-2-он Изомер (Е): Формула (I): А=В=фенил, Y1=4-F, Y2=X2=H, X1=4-SCH3, R1R2=0, R3=R4=СН3. Изомер (Z): Формула (I): А=В=фенил, X1=4-F, X2=Y2=H, Y1=4-SCH3, R1, R2= 0, R3=R4=СН3. Получают согласно способу примера 4 от производного примера 29. Оба изомера расщепляют путем фракционной кристаллизации в смеси изопропиловый эфир/пентан: (Е)-5,5-диметил-3-[1-(4-фторфенил)-1- (4-метилтиофенил)метилиден] дигидрофуран-2-он, точка плавления 98oС. (Z)-5,5-диметил-3-[1-(4-фторфенил)-1-(4-метилтиофенил)-метилиден] дигидрофуран-2-он, точка плавления 160oС. ПРИМЕР 31 (Е)-5,5-диметил-3-[1-(4-фторфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он Изомер (Е): Формула (I): А=В=фенил, Y1=4-F, X2=Y2=H, X1=4-SO2CH3, R1, R2=0, R3=R4=СН3. К раствору 2 г (Е)-5,5-диметил-3-[1-(4-фторфенил)-1-(4-метилтиофенил)метилиден]дигидрофуран-2-она, полученного в примере 30, в 15 мл уксусной кислоты добавляют 1,9 г тригидрированного пербората натрия. Смесь нагревают в течение 3 часов при 45oС, образованные кристаллы центрифугируют при нагревании и хроматографируют на силикагеле при элюировании смеси дихлорметан/ацетон (9/1), чтобы получить 1,2 г (Е)-5,5-диметил-3-[1-(4-фторфенил)-1-(4-метансульфонилфенил) метилиден] дигидрофуран-2-она в виде кристаллов с точкой плавления 175oС. ПРИМЕР 32 5-этил-3-[1-(4-фторфенил)-1-гидрокси-1-(4-метилтиофенил)-метил]дигидрофуран-2-он Формула (VI’): А=фенил, Y1=4-F, Y2=H, R3=C2Н5, R4=H. Получают согласно способу примера 29 от  -капролактона.
Кристаллы с точкой плавления 150oС.
ПРИМЕР 33 -капролактона.
Кристаллы с точкой плавления 150oС.
ПРИМЕР 335-этил-3-[1-(4-фторфенил)-1-(4-метилтиофенил)метилиден] -дигидрофуран-2-он Изомер (Е): Формула (I): А=В=фенил, Y1=4-F, X2=Y2=H, X1=4-SCH3, R1, R2= 0, R3=C2H5, R4=H. Изомер (Z): Формула (I): А=В=фенил, X1=4-F, X2=Y2=H, Y1=4-SCH3, R1, R2= 0, R3=C2H5, R4=H. Получают согласно способу примера 4 от производного примера 29. Смесь из двух изомеров (Е) и (Z) используют как таковую в дальнейшем. ПРИМЕР 34 (Е)-5-этил-3-[1-(4-фторфенил)-1-(4-метансульфонилфенил)метилиден]дигидрофуран-2-он Изомер (Е): Формула (I): А=В=фенил, Y1=4-F, X2=Y2=H, X1=4-SO2CH3, R1, R2=0, R3=C2H5, R4=H. Получают согласно способу примера 31. Изомер (Е)-5-этил-3-[1-(4-фторфенил)-1-(4-метансульфонилфенил)метилиден]дигидрофуран-2-он очищают хроматографически на силикагеле при элюировании смеси дихлорметан/ацетон (99/1) и получают в виде кристаллов с точкой плавления 134-136oС (первый элюированный продукт). Выделение второго элюированного продукта во время хроматографии позволяет получить (Z)-5-этил-3-[1-(4-фторфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он в виде кристаллов с точкой плавления 176-177oС. ПРИМЕР 35 5-метил-3-[1-(4-хлорфенил)-1-гидрокси-1-(4-метилтиофенил)-метил]дигидрофуран-2-он Формула (VI’): А=фенил, Y1=3-Cl, Y2=Н, R3=СН2, R4=H. Получают согласно способу примера 6 из 3-хлор-4′-метилтиобензофенона и  -бром- -бром- -валеролактона.
Аморфный порошок, используемый в дальнейшем.
ПРИМЕР 36 -валеролактона.
Аморфный порошок, используемый в дальнейшем.
ПРИМЕР 365-метил-3-[1-(3-хлорфенил)-1-(4-метилтиофенил)метилиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-Cl, X2=Y2=H, X1=4-SCH3, R1, R2= 0, R3=СН3, R4=H. Изомер (Е): Формула (I): А=В=фенил, X1=3-Cl, X2=Y2=H, X1=4-SCH3, R1, R2= 0, R3=СН3, R4=H. Получают согласно способу примера 4 из производного примера 35. Смесь из двух изомеров используют в дальнейшем в виде масла. ПРИМЕР 37 (Z)-5-метил-3-[1-(3-хлорфенил)-1-(4-метансульфонилфенил)метил]дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-Cl, X2=Y2=H, Х1=4-SO2СН3, R1, R2=0, R3=СН3, R4=H. Получают согласно способу примера 31. Изомер (Z)-5-метил-3-[1-(3-хлорфенил)-1-(4-метансульфонилфенил)метил] дигидрофуран-2-он очищают хроматографически на силикагеле при элюировании смеси дихлорметан/ацетон (99/1) в виде аморфного порошка (первый элюированный продукт). Выделение второго элюированного продукта позволяет получить изомер (Е)-5-метил-3-[1-(3-хлорфенил)-1- (4-метансульфонилфенил)метил] дигидрофуран-2-он в виде кристаллов с точкой плавления 164-165oС. ПРИМЕР 38 2-хлор-5-(4-метилтиобензоил)пиридин Формула (III): А=3-пиридил, Y1=6-Cl, Y2=Н. Получают согласно способу примера 2. Кристаллы с точкой плавления 150oС. ПРИМЕР 39 2-хлор-5-(4-метансульфонилбензоил)пиридин Формула (IV): А=3-пиридил, Y1=6-Cl, Y2=H. Раствор 34,6 г 2-хлор-5-(4-метилтиобензоил)пиридина, полученного в примере 38, и 42 г тригидрированного пербората натрия в 250 мл уксусной кислоты нагревают в течение 4 часов при 45oС. Образованные кристаллы центрифугируют при нагревании, затем промывают водой и высушивают, чтобы получить 32,6 г 2-хлор-5-(4-метансульфонилбензоил)пиридина в виде кристаллов с точкой плавления 170oС. ПРИМЕР 40 4-(6-хлорпиридин-3-ил)-3-этоксикарбонил-4- (4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=3-пиридил, Y1=6-Cl, Y2=H. Получают согласно способу примера 11 из производного примера 39. Твердое аморфное вещество, используемое в таком виде в дальнейшем. ПРИМЕР 41 3-(6-хлорпиридин-3-ил)-2-(2-гидроксиэтил)-3- (4-метансульфонилфенил)-2-этилпропеноат Формула (XI): А=3-пиридил, Y1=6-Cl, Y2=Н. Получают согласно способу примера 12 из производного примера 40. Твердое аморфное вещество, используемое как таковое в дальнейшем. ПРИМЕР 42 (Z)-3-[1-(6-хлорпиридин-3-ил)-1-(4-метансульфонилфенил)-метилиден]дигидрофуран-2-он Изомер (Z): Формула (I): А=3-пиридил, В=фенил, Y1=6-Cl, X2=Y2=H, X1=4-SO2CH3, R1, R2=0, R3=R4=Н. Получают согласно способу примера 13 из производного примера 41. Изомер (Z) получают хроматографически при элюировании смеси дихлорметан/ацетон (5/1), а затем путем кристалллизации в смеси ацетон/этиловый эфир в виде кристаллов с точкой плавления 172-174oС. Изомер (Е)-3-[1-(6-хлорпиридин-3-ил)-1- (4-метансульфонилфенил)метилиден] дигидрофуран-2-он получают в чистом виде с помощью кристаллизации в ацетоне, перед хроматографией сырой смеси двух изомеров, в виде кристаллов с точкой плавления 198-199oС. ПРИМЕР 43 3-этоксикарбонил-4-(4-фторфенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=4-F, Y2=H. Получают согласно способу примера 11 из 4-фтор-4′-метансульфонилбензофенона, полученного в примере 2. Масло, используемое в таком же виде для дальнейшего. ПРИМЕР 44 4-[1-(4-фторфенил)-1-(4-метансульфонилфенил)метилиден]-дигидрофуран-2-oн Формула (I): А=В=фенил, Х1=4-SО2СН3, X2=Y2=H, Y1=4-F, R1, R2=H, R3, R4= 0. К раствору 3-этоксикарбонил-4-(4-фторфенил)-4- (4-метансульфонил)-3-бутеновой кислоты, полученной в примере 43, в 500 мл этанола добавляют 13,6 порошка безводного хлорида кальция. Смесь перемешивают при комнатной температуре и добавляют по капле 7,5 г раствора борогидрида натрия в смеси, состоящей из 1,5 г гидроксида калия, 10 мл воды и 10 мл этанола, охлаждая в ледяной бане. Через 4 часа при комнатной температуре реакционную среду охлаждают до 0oС и добавляют по капле раствор 6N-соляной кислоты. После экстрагирования дихлорметаном органическую фазу сушат над сульфатом магния, выпаривают в вакууме и осадок кристаллизуют в изопропиловом эфире. Полученные кристаллы рекристаллизуют в метаноле, чтобы получить 5 г 4-[1-(4-фторфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-она в виде смеси (50/50) двух изомеров (Е) и (Z), кристаллов с точкой плавления 160-164oС. ПРИМЕР 45 3-метил-4′-метилтиобензофенон Формула (III): А=фенил, Y1=3-CH3, Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 46-47o. ПРИМЕР 46 3-метил-4′-метансульфонилбензофенон Формула (IV): А=фенил, Y1=3-CH3, Y2=H. Получают согласно способу примера 2. Кристаллы с точкой плавления 150oС. ПРИМЕР 47 3-этоксикарбонил-4-(3-метилфенил)-4-(4-метансульфонилфенил)3-бутеновая кислота Формула (X): А=фенил, Y1=3-СН3, Y2=H. Получают согласно способу примера 11 из производного примера 46. Масло, используемое в том же виде для дальнейшего. ПРИМЕР 48 3-(3-метилфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=3=CH3, Y2=H. Получают согласно способу примера 12 из производного примера 47. Масло, такое какое есть, для использования в дальнейшем. ПРИМЕР 49 Изомер (Z)-3-[1-(3-метилфенил)-1-(4-метансульфонилфенил)метилиден]дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-CH3, Х2=Y2=Н, X1=4-SO2CH3, R1, R2=0, R3=R4=Н. Получают согласно способу примера 13 из производного примера 48. Очищают хроматографией на силикагеле при элюировании смеси дихлорметан/ацетон (99/1), первый элюированный продукт в виде кристаллов с точкой плавления 166oС. ПРИМЕР 50 3,4-дифтор-4′-метилтиобензофенон Формула (III): А=фенил, Y1=3-F, Y2=4-F. Получают согласно способу примера 1 из производного примера 50. Кристаллы с точкой плавления 96oС. ПРИМЕР 51 3,4-дифтор-4′-метансульфонилбензофенон Формула (IV): А=фенил, Y1=3-F, Y2=4-F. Получают согласно способу примера 1 из производного примера 50. Кристаллы с точкой плавления 120oС. ПРИМЕР 52 3-этоксикарбонил-4-(3,4-дифторфенил)-4-(метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=3-F, Y2=4-F. Получают согласно способу примера 11 из производного примера 51. Масло в полученном виде используется в дальнейшем. ПРИМЕР 53 3-(3,4-дифторфенил)-3-(4-метансульфонилфенил-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=3-F, Y2=4-F. Получают согласно способу примера 12 из производного примера 52. Полученное масло используют в дальнейшем. ПРИМЕР 54 (Z)-3-[1-(3,4-дифторфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-F, Y2=4-F, X2=SO2CH3, X2=H, R1, R2=0, R3=R4=H. Получают согласно способу примера 13 из производного примера 53. Очищают хроматографически на силикагеле при элюировании смеси дихлорметан/ацетон (99/1), первый элюированный продукт, кристаллы с точкой плавления 148oС. ПРИМЕР 55 4-бензилтиобензонитрил Смесь из 37,2 г бензилмеркаптана, 36,3 г 4-фторбензонитрила и 42 г карбоната калия в 700 мл 2-бутанона кипятят с обратным холодильником в течение 7 часов. Растворитель выпаривают в вакууме, осадок обрабатывают водой и петролейным эфиром. Образованные кристаллы центрифугируют, промывают водой и петролейным эфиром, чтобы получить 46 г 4-бензилтиобензонитрила в виде кристаллов с точкой плавления 85oС. ПРИМЕР 56 4-бензилтио-4′-фторбензофенон К суспензии 9,6 г магниевой стружки в 20 мл безводного этилового эфира добавляют по капле раствор 44 мл 4-бром-1-фторбензола в 300 мл безводного этилового эфира. После добавления смесь перемешивают несколько минут при комнатной температуре и добавляют по каплям раствор 46 г 4-бензилтиобензонитрила, полученного в примере 55, в 400 мл безводного тетрагидрофурана. Этиловый эфир дистиллируют и смесь кипятят с обратным холодильником в течение 3 часов, затем охлаждают льдом. Добавляют по капле 400 мл раствора 6N соляной кислоты и смесь кипятят с обратным холодильником в течение 6 часов. После добавления воды и дихлорметана органическую фазу декантируют и сушат над сульфатом магния, затем выпаривают в вакууме. Осадок кристаллизуют в изопропиловом эфире, чтобы получить 48 г 4-бензилтио-4′-фторбензофенона в виде кристаллов с точкой плавления 96oС. ПРИМЕР 57 4-трет-бутиламиносульфонил-4′-фторбензофенон В растворе 43 г 4-бензилтио-4′-фторбензофенона, полученного в примере 56, в 300 мл охлажденной до 0oС уксусной кислоты барботируют хлор до насыщения (36 г). Затем смесь перемешивают 2 часа при комнатной температуре, выливают в ледяную воду и экстрагируют дихлорметаном. Органическую фазу промывают водой, сушат над сульфатом магния и выпаривают в вакууме, чтобы получить 47 г масла, которое растворяют в 100 мл 1,2-дихлорэтана. Этот раствор добавляют по капле к раствору 50 мл трет-бутиламина в 300 мл 1,2-дихлорметана. Смесь нагревают в течение одного часа до 80oС, охлаждают и промывают водой, а затем разбавленной соляной кислотой. Органическую фазу сушат над сульфатом магния и выпаривают в вакууме. Осадок кристаллизуют в этиловом эфире, чтобы получить 25 г 4-трет- бутиламиносульфонил-4′-фторбензофенона в виде кристаллов с точкой плавления 160oС. ПРИМЕР 58 3-этоксикарбонил-4-(4-трет-бутиламиносульфонилфенил) -4-(4-фторфенил)-3-бутеновая кислота Формула (XII): А=фенил, Y1=4-F, Y2=H. Получают согласно способу примера 11 из производного в примере 57 при использовании 2 эквивалентов трет-бутилата калия, аморфный порошок, используемый в дальнейшем. ПРИМЕР 59 3-(4-трет-бутиламиносудьфонилфенил)-3-(4-фторфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Получают согласно способу примера 12 из производного примера 58. Полученное масло обрабатывают этиловым эфиром и образованные кристаллы сушат, чтобы получить чистый изомер (Z)-3-(4-трет-бутиламиносульфонилфенил)-3-(4-фторфенил)-2- (2-гидроксиэтил)-2-этилпропеноат в виде кристаллов с точкой плавления 152oС. Фильтрат выпаривают в вакууме, чтобы получить масляный осадок, соответствующий изомеру (Е)-3- (4-трет-бутиламиносульфонилфенил)-3-(4-фторфенил)-2-(2-гидроксиэтил)-2-этилпропеноат, используемый в дальнейшем как таковой. ПРИМЕР 60 (Е)-4-[(4-фторфенил)-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамид Изомер (Е): Формула (I): А=В=фенил, Y1=4-F, Y2=X2=H, X1=4-SO2NH2, R1, R2=0, R3=R4=H. (Е)-3-(4-трет-бутиламиносульфонилфенил)-3-(4-фторфенил)-2-(2-гидроксиэтил)-2-этилпропеноат (10 г), полученный в примере 59, растворяют в 20 мл этанола и добавляют 2 г гидроксида натрия в растворе в 10 мл воды. Смесь нагревают с обратным холодильником в течение 2 часов. После упаривания досуха осадок обрабатывают водой и подкисляют 1N соляной кислотой, затем экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния, затем выпаривают в вакууме. Осадок добавляют порционно к 500 мл концентрированной серной кислоты. Смесь перемешивают 15 минут при комнатной температуре, затем выливают в ледяную воду, образованные кристаллы центрифугируют и промывают этиловым эфиром, затем обрабатывают в 100 мл теплого ацетона. К полученному раствору добавляют 50 мл этилового эфира и образованные кристаллы центрифугируют и высушивают, чтобы получить 6 г (Е)-4-[(4-фторфенил)-(2-оксодигидрофуран-3-илиден)метил]бензолсульфонамида в виде кристаллов с точкой плавления 202oС. ПРИМЕР 61 (Z)-4-[(4-фторфенил)-(2-оксодигидрофуран-3-илиден)метил] -бензолсульфонамид Изомер (Z): Формула (I): А=В=фенил, X1=4-F, X2=Y2=H, Y1=4-SO2NH2, R1, R2=0, R3=R4=Н. Получают согласно способу примера 60 из изомера (Z), полученного в примере 59. Кристаллы с точкой плавления 222oС. ПРИМЕР 62 4-хлор-4′-метансульфонилбензофенон Формула (IV): А=фенил, Y1=4-Cl, Y2=H. Получают согласно способу примера 39 из производного примера 5. Кристаллы с точкой плавления 176oС. ПРИМЕР 63 (Z)-3-этоксикарбонил-4-(4-хлорфенил)-4-(4-метансульфонил)-3-бутеновая кислота Формула (X): А=фенил, Y1=4-Cl, Y2=H. К суспензии 20 г 4-хлор-4′-метансульфонилбензофенона, полученного в примере 62, в 100 мл трет-бутанола добавляют за один раз 1,2 г трет-бутилата натрия при комнатной температуре. Суспензию нагревают до 40oС и в течение 10 минут добавляют раствор из 16,9 мл этилсукцината в 20 мл трет-бутанола. В течение 30 минут поддерживают температуру до 55oС, затем ее снижают до 35-40oС; добавляют 140 мл холодной воды и смесь перемешивают в течение 30 минут. Раствор фильтруют и кристаллы промывают водой. Водно-спиртовую фазу промывают два раза с помощью 75 мл толуола, затем подкисляют концентрированной соляной кислотой. Кристаллы центрифугируют, промывают водой и сушат в вакууме, чтобы получить 20,2 г (Z)-3-этоксикарбонил-4-(4-хлорфенил)-4-(4-метансульфонил)-3-бутеновой кислоты, чистота ВЭЖХ: 81,6%, 12,1% изомера (Е). Рекристаллизация в 2-пропаноле позволяет получить 14 г (Z)-3-этоксикарбонил-4-(4-хлорфенил)-4-(4-метансульфонил)бутеновой кислоты с чистотой ВЭЖХ: 96,1%, содержащей 0,7% изомера (Е), в виде кристаллов с точкой плавления 183oС. ПРИМЕР 64 (Z)-3-(4-хлорфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=4-Cl, Y2=H. К раствору 350 г (Z)-3-этоксикарбонил-4-(4-хлорфенил)-4-(4-метансульфонилфенил)-3-бутеновой кислоты, полученной в примере 63, в 1,5 л тетрагидрофурана добавляют по капле и при интенсивном перемешивании 120 мл комплекса боран/метилсульфид. После добавления раствор перемешивают в течение 2,5 часов при комнатной температуре. Избыток борана гидролизуют с помощью 100 мл метанола и 100 мл воды. После выпаривания в вакууме растворителя осадок перемешивают с водой, фильтруют, промывают водой, чтобы получить (Z)-3-(4-хлорфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат в виде влажных кристаллов, используемых как таковые на следующей стадии. Путем просушивания этих кристаллов и рекристаллизации в 2-пропаноле получают (Z)-3-(4-хлорфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат в виде кристаллов с чистотой ВЭЖХ 98,3% и точкой плавления 128oС. ПРИМЕР 65 (Z)-3-[1-(4-хлорфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он Формула (I): А=В=фенил, Y1=4-Cl, X2=Y2=H, X1=4-SO2CH3, R1, R2=0, R3=R4= H. Влажный продукт примера 64 нагревают с обратным холодильником в 1,5 л толуола в присутствии 1 г 4-толуолсульфоновой кислоты. Воду и этанол удаляют с помощью прибора Дина Старка, затем приблизительно 1 л толуола выпаривают. После возвращения к комнатной температуре образованные кристаллы центрифугируют и промывают в минимальном количестве 2-бутанона, затем высушивают, чтобы получить 261,5 г (Z)-3-[1-(4-хлорфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-она в виде кристаллов с точкой плавления 188-190oС. ПРИМЕР 66 3,5-дихлор-4′-метилтилбензофенон Формула (III): А=фенил, Y1=3-Cl, Y2=5-Cl. Получают согласно способу примера 1. Кристаллы с точкой плавления 108oС. ПРИМЕР 67 3,5-дихлор-4′-метансульфонилбензофенон Формула (IV): А=фенил, Y1=3-Cl, Y2=5-Cl. Получают согласно способу примера 39. Кристаллы с точкой плавления 200oС. ПРИМЕР 68 (Z)-3-этоксикарбонил-4-(3,5-дихлорфенил)-4- (4-метансульфонилфенил)-3-бутеновая кислота Изомер (Z): Формула (X): А=фенил, Y1=3-Cl, Y2=5-Cl. Получают согласно способу примера 11. Кристаллы с точкой плавления 180oС. ПРИМЕР 69 (Z)-3-(3,5-дихлорфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Изомер (Z): Формула (XI): А=фенил, Y1=3-Cl, Y2=5-Cl. Получают согласно способу примера 12. Масло, такое какое есть, используется в дальнейшем. ПРИМЕР 70 (Z)-3-[1-(3,5-дихлорфенил)-1-(4-метансульфонилфенил)-метидиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-Cl, Y2=5-Cl, X1=4-SO2CH3, Х2=Н, R1, R2=0, R3=R4=Н. Получают согласно способу примера 65. Кристаллы с точкой плавления 114oС. ПРИМЕР 71 2,4-дифтор-4′-метилтиобензофенон Формула (III): А=фенил, Y1=2-F, Y2=4-F. Получают согласно способу примера 1. Кристаллы с точкой плавления 98oС. ПРИМЕР 72 2,4-дифтор-4′-метансульфонилбензофенон Формула (IV): А=фенил, Y1=2-F, Y2=4-F. Получают согласно способу примера 39. Кристаллы с точкой плавления 160oС. ПРИМЕР 73 3-этоксикарбонил-4-(2,4-дифторфенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=2-F, Y2=4-F. Получают согласно способу примера 11. Масло, используемое как таковое в дальнейшем. ПРИМЕР 74 3-(2,4-дифторфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=2-F, Y2=4-F. Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 75 (Z)-3-[1-(2,4-дифторфенил)-1-(4-метансульфонилфенил)-метилиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=2-F, Y2=4-F, X1=4-SO2СН3, Х2=Н, R1, R2=0, R3=R4=Н. Получают согласно способу примера 65, очищают хроматографически при элюировании смеси дихлорметан/ацетон (10/0,3). Кристаллы с точкой плавления 140oС. ПРИМЕР 76 3,5-дифтор-4’метилтиобензофенон Формула (III): А=фенил, Y1=3-F, Y2=5-F. Получают согласно способу примера 1. Кристаллы с точкой плавления 90oС. ПРИМЕР 77 3,5-дифтор-4′-метансульфонилбензофенон Формула (IV): А=фенил, Y1=3-F, Y2=5-F. Получают согласно способу примера 39. Кристаллы с точкой плавления 152oС. ПРИМЕР 78 3-этоксикарбонил-4-(3,5-дифторфенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=3-F, Y2=5-F. Получают согласно способу примера 11. Масло, используемое как таковое в дальнейшем. ПРИМЕР 79 3-(3,5-дифторфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=3-F, Y2=5-F. Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 80 (Z)-3-[1-(3,5-дифторфенил)-3-(4-метансульфонилфенил)-метилиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-F, Y2=5-F, X1=4-SO2СН3, X2=Н, R1, R2=0, R3=R4=Н. Получают согласно способу примера 65, очищают хроматографически при элюировании смеси дихлорметан/ацетон (10/0,3). Кристаллы с точкой плавления 162oС. ПРИМЕР 81 4-метил-4′-метилтиобензофенон Формула (III): А=фенил, Y1=4-CH3, Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 96oС. ПРИМЕР 82 4-мeтил-4′-мeтaнcyльфoнилбeнзoфeнoн Формула (IV): А=фенил, Y1=4-CH3, Y2=H. Получают согласно способу примера 39. Кристаллы с точкой плавления 180oС. ПРИМЕР 83 3-этоксикарбонил-4-(4-метилфенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=4-CH3, Y2=H. Получают согласно способу примера 11. Масло, используемое как таковое в дальнейшем. ПРИМЕР 84 3-(4-метилфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=4-CH3, Y2=H. Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 85 [Е)-3-[1-(4-метилфенил)-3-(4-метансульфонилфенил)метилиден]дигидрофуран-2-он Изомер (Е): Формула (I): А=В=фенил, Y1=4-CH3, Y2=H, X1=4-SO2CH3, X2=H, R1, R2=0, R3=R4=Н. Получают согласно способу примера 65, очищают хроматографически при элюировании смеси дихлорметан/ацетон (10/0,3). Кристаллы с точкой плавления 222oС. ПРИМЕР 86 3-бром-4′-метилтиобензофенон Формула (III): А=фенил, Y1=3-Br, Y2=Н. Получают согласно способу примера 1. Кристаллы с точкой плавления 90oС. ПРИМЕР 87 3-бром-4′-метансульфонилбензофенон Формула (IV): А=фенил, Y1=3-Br, Y2=H. Получают согласно способу примера 39. Кристаллы с точкой плавления 170oС. ПРИМЕР 88 3-этоксикарбонил-4-(3-бромфенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=3-Br, Y2=H. Получают согласно способу примера 11. Масло, используемое как таковое в дальнейшем. ПРИМЕР 89 3-(3-бромфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=3-Br, Y2=Н. Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 90 (Z)-3-[1-(3-бромфенил)-3-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-Br, Y2=H, X1=4-SO2СН3, Х2=Н, R1, R2=0, R3=R4=Н. Получают согласно способу примера 65, очищают хроматографией при элюировании смеси дихлорметан/ацетон (10/0,3). Кристаллы с точкой плавления 162oС. ПРИМЕР 91 3-хлор-4-фтор-4′-метилтиобензофенон Формула (III): А=фенил, Y1=3-Cl, Y2=4-F. Получают согласно способу примера 1. Кристаллы с точкой плавления 116oС. ПРИМЕР 92 3-хлор-4-фтор-4′-метансульфонилбензофенон Формула (IV): А=фенил, H1=3-Cl, Y2=4-F. Получают согласно способу примера 39. Кристаллы с точкой плавления 146oС. ПРИМЕР 93 3-этоксикарбонил-4-(3-хлор-4-фторфенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=3-Cl, Y2=4-F. Получают согласно способу примера 11. Масло, используемое как таковое в дальнейшем. ПРИМЕР 94 3-(3-хлор-4-фторфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=3-Cl, Y2=4-F. Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 95 (Z)-3-[1-(3-хлор-4-фторфенил)-1-(4-метансульфонилфенил)метилиден]дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-Cl, Y2=4-F, X1=4-SO2CH3, Х2=Н, R1, R2=0, R3=R4=Н. Получают согласно способу примера 65, очищают хроматографией при элюировании смеси дихлорметан/ацетон (10/0,3). Кристаллы с точкой плавления 123oС. ПРИМЕР 96 4-бром-4′-метилтиобензофенон Формула (III): А=фенил, Y1=4-Br, Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 148oС. ПРИМЕР 97 4-бром-4′-метансульфонилбензофенон Формула (IV): А=фенил, Y1=4-Br, Y2=H. Получают согласно способу примера 39. Кристаллы с точкой плавления 188oС. ПРИМЕР 98 3-этоксикарбонил-4-(4-бромфенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=4-Br, Y2=H. Получают согласно способу примера 11. Масло, используемое как таковое в дальнейшем. ПРИМЕР 99 3-(4-бромфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=4-Br, Y2=H. Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 100 (Z)-3-[1-(4-бромфенил)-1- (4-метансульфонилфенилметилиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=4-Br, Y2=Н, X2=4-SO2CH3, Х2=Н, R1, R2=0, R3=R4=H. Получают согласно способу примера 65, очищают хроматографией при элюировании смеси дихлорметан/ацетон (10/0,3). Кристаллы с точкой плавления 204oС. ПРИМЕР 101 2-(4-метилтиобензоил)фуран Формула (III): А=2-фурил, Y1=Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 86oС. ПРИМЕР 102 2-(4-метансульфонилбензоил)фуран Формула (IV): А=2-фурил, Y1=Y2=H. Получают согласно способу примера 39. Кристаллы с точкой плавления 112oС. ПРИМЕР 103 3-этоксикарбонил-4-(фуран-2-ил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=2-фурил, Y1=Y2=H. Получают согласно способу примера 11. Масло, используемое как таковое в дальнейшем. ПРИМЕР 104 3-(фуран-2-ил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=2=фурил, Y1=Y2=H. Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 105 (Z)-3-[1-(фуран-2-ил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=2-фурил, В=фенил, Y1=Y2=H, X1=4-SO2CH3, X2=H, R1, R2=0, R3=R4=Н. Получают согласно способу примера 65, очищают хроматографией при элюировании смеси дихлорметан/ацетон (10/0,3). Кристаллы с точкой плавления 170oС. ПРИМЕР 106 (4-метилтиобензоил)циклогексан Формула (III): А=циклогексил, Y1=Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 110oС. ПРИМЕР 107 (4-метансульфонилбензоил)циклогексан Формула (IV): А=циклогексил, Y1=Y2=H. Получают согласно способу примера 39. Кристаллы с точкой плавления 116oС. ПРИМЕР 108 3-этоксикарбонил-4-циклогексил-4-(4-метансульфонилфенил)3-бутеновая кислота Формула (X): А=циклогексил, Y1=Y2=H. Получают согласно способу примера 11. Масло, используемое как таковое в дальнейшем. ПРИМЕР 109 3-циклогексил-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=циклогексил, Y1=Y2=H. Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 110 (Z)-3-[1-циклогексил-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=циклогексил, В=фенил, Y1=Y2=H, X1=4-SO2CH3, X2=H, R1, R2=0, R3=R4=Н. Получают согласно способу примера 65. Кристаллы с точкой плавления 148oС. ПРИМЕР 111 3-фтор-4-метил-4′-метилтиобензофенон Формула (III): А=фенил, Y1=3-F, Y2=4-СН3. К суспензии из 6,4 г магниевой стружки в 5 мл безводного этилового эфира добавляют по капле раствор 50 г 4-бром-2-фтортолуола в 150 мл безводного этилового эфира. После добавления смесь перемешивают в течение 30 минут, затем добавляют раствор 4-метилтиобензонитрила в 200 мл безводного тетрагидрофурана. Этиловый эфир дистиллируют и смесь нагревают с обратным холодильником в течение 4 часов. После возвращения к комнатной температуре добавляют по капле 300 мл 6N соляной кислоты. Затем смесь нагревают с обратным холодильником в течение 6 часов, охлаждают при комнатной температуре и экстрагируют изопропиловым эфиром. Органическую фазу сушат над сульфатом магния, затем упаривают досуха. Осадок кристаллизуют в этиловом эфире, чтобы получить 25 г 3-фтор-4-метил-4′-метилтиобензофенона в виде кристаллов с точкой плавления 94oС. ПРИМЕР 112 3-фтор-4-метил-4′-метансульфонилбензофенон Формула (IV): А=фенил, Y1=3-F, Y2=4-СН3. Получают согласно способу примера 39. Кристаллы с точкой плавления 170oС. ПРИМЕР 113 (Z)-3-этоксикарбонил-4-(3-фтор-4-метилфенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=3-F, Y2=4-СН3. Получают согласно способу примера 11, очищают, обрабатывая неочищенную смесь двух изомеров (Е) и (Z) с помощью 1 эквивалента D-(+)-  -метилбензиламина в 5 объемах этилацетата. Образованные кристаллы удаляют (соль -изомера (Е)) и фильтрат подкисляют разбавленной соляной кислотой, декантируют и выпаривают в вакууме, чтобы получить масло, соответствующее изомеру (Z), содержащему менее 5% изомера (Е).
ПРИМЕР 114 -метилбензиламина в 5 объемах этилацетата. Образованные кристаллы удаляют (соль -изомера (Е)) и фильтрат подкисляют разбавленной соляной кислотой, декантируют и выпаривают в вакууме, чтобы получить масло, соответствующее изомеру (Z), содержащему менее 5% изомера (Е).
ПРИМЕР 114(Z)-3-(3-фтор-4-метилфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=3-F, Y2=4-СН3. Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 115 (Z)-3-[1-(3-фтор-4-метилфенил)-1-(4-метансульфонилфенил] метилиден] дигидрофуран-2-он Изомер (Z): Формула (I): А=В=фенил, Y1=3-F, Y2=4-СН3, X1=4-SO2CH3, Х2=Н, R1, R2=0, R3=R4=Н. Получают согласно способу примера 65. Кристаллы с точкой плавления 169-170oС. ПРИМЕР 116 4-тpифтopмeтил-4′-мeтилтиoбeнзoфeнoн Формула (III): А=фенил, Y1=4-CF, Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 139oС. ПРИМЕР 117 4-тpифтopмeтил-4′-мeтaнcyльфoнилбeнзoфeнoн Формула (IV): А=фенил, Y1=4-CF3, Y2=H. Получают согласно способу примера 39. Кристаллы с точкой плавления 138oС. ПРИМЕР 118 3-этоксикарбонил-4-(4-трифторметилфенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=4-CF3, Y2=H. Получают согласно способу примера 11. Масло, используемое как таковое в дальнейшем. ПРИМЕР 119 3-(4-трифторметилфенил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенид, Y1=4-CF3, Y2=H. Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 120 (Е)-3-[1-(4-трифторметилфенил)-1-(4-метансульфонил)метилиден] дигидрофуран-2-он Изомер (Е): Формула (I): A=B=фенил, Y1=4-CF3, Y2=H, X2=4-SO2CH3, Х2=Н, R1, R2=0, R3=R4=H. Получают согласно способу примера 65, очищают хроматографией при элюировании смеси дихлорметан/ацетон (10/0,3). Кристаллы с точкой плавления 188-189oС. ПРИМЕР 121 4-бeнзилтиo-4′-xлopбeнзoфeнoн Получают согласно примеру 56 из 4-бромхлорбензола и 4-бензилтиобензонитрила, полученного в примере 55. Кристаллы с точкой плавления 134oС. ПРИМЕР 122 4-трет-бутиламиносульфонил-4′-хлорбензофенон Получают согласно примеру 57. Кристаллы с точкой плавления 163oС. ПРИМЕР 123 3-этоксикарбонил-4-(4-трет-бутиламиносульфонилфенил )-4-(4-хлорфенил)-3-бутеновая кислота Формула (XII): А=фенил, Y1=4-Cl, Y2=H. Получают согласно способу примера 58. Масло, используемое как таковое в дальнейшем. ПРИМЕР 124 (Z)-3-(4-трет-бутиламиносульфонилфенил)-3-(4-хлорфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Получают согласно способу примера 12. Полученное масло обрабатывают этиловым эфиром и образованные кристаллы центрифугируют (изомер Е). Фильтрат концентрируют в вакууме, а осадок, обработанный в петролейном эфире, кристаллизуют, чтобы получить изомер (Z) в виде кристаллов с точкой плавления 120oС. ПРИМЕР 125 (Z)-4-[(4-хлорфенил)-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамид Формула (I): А=В=фенил, Y1=4-Cl, Y2=H, X1=4-SO2NH2, X2=H, R1, R2=0, R3= R4=H. Раствор 10 г (Z)-3-(4-трет-бутиламиносульфонилфенил)-3-(4-хлорфенил)-2-(2-гидроксиэтил)-2-этилпропеноата, полученного в примере 124, в 80 мл трифторуксусной кислоты нагревают с обратным холодильником в течение 15 часов. После выпаривания растворителя в вакууме осадок обрабатывают дихлорметаном. Органическую фазу, промывают водой, затем сушат над сульфатом магния и выпаривают в вакууме, чтобы получить масло, которое кристаллизуется в смеси ацетон/изопропиловый эфир, и получают 3,9 г (Z)-4-[(4-хлорфенил)-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамида в виде кристаллов с точкой плавления 187-189oС. ПРИМЕР 126 4-бензилтио-3′-фтор-4′-метилбензофенон Получают согласно примеру 56 из 4-бром-2-фтортолуол. Кристаллы с точкой плавления 122oС. ПРИМЕР 127 4-трет-бутил аминосульфонил-3-фтор-4′-метилбензофенон Получают согласно примеру 57. Кристаллы с точкой плавления 132oС. ПРИМЕР 128 (Z)-3-этоксикарбонил-4-(4-трет-бутиламиносульфонилфенил)-4-(3-фтор-4-метилфенил)-3-бутеновая кислота Формула (XII): А=фенил, Y1=3-F, Y2=4-СН3. Получают согласно способу примера 58. Полученное масло обрабатывают трет-бутилэтиловым эфиром и образованные кристаллы центрифугируют, чтобы получить изомер (Е) с точкой плавления 96oС. Фильтрат концентрируют в вакууме, чтобы получить изомер (Z) в виде масла, используемого как таковое в дальнейшем. ПРИМЕР 129 (Z)-3-(4-трет-бутиламиносульфонилфенил)-3-(3-фтор-4-метилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Получают согласно примеру 12 из изомера (Z) кислоты примера 128. Масло, используемое как таковое в дальнейшем. ПРИМЕР 130 (Z)-4-[(3-фтор-4-метилфенил)-2-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамид Формула (I): А=В=фенил, Y1=3-F, Y2=4-CH3, X1=4-SO2NH2, Х2=H, R1, R2=0, R3=R4=H. Получают согласно примеру 125. Кристаллы с точкой плавления 170-172oС. ПРИМЕР 131 3-бензилтио-4′-фтор-3′-метилбензофенон Получают согласно примеру 56 из 5-бром-2-фтортолуола. Кристаллы с точкой плавления 123oС. ПРИМЕР 132 4-тpeт-бyтилaминocyльфoнил-4′-фтop-3′-мeтилбeнзoфeнoн Получают согласно примеру 57. Кристаллы с точкой плавления 108oС. ПРИМЕР 133 (Z)-3-этоксикарбонил-4-(4-трет-бутиламиносульфонилфенил)-4-(4-фтор-3-метилфенил)-3-бутеновая кислота Формула (XII): А=фенил, Y1=3-CH3, Y2=4-F. Получают согласно способу примера 58, при этом полученное масло обрабатывают трет-бутилэтиловым эфиром и образованные кристаллы удаляют (изомер (Е)). Фильтрат выпаривают в вакууме, чтобы получить изомер (Z) в виде масла, используемого как таковое в дальнейшем. ПРИМЕР 134 (Z)-3-(4-трет-бутиламиносульфонилфенил)-3-(4-фтор-3-метилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Получают согласно примеру 12. Кристаллы с точкой плавления 128oС. ПРИМЕР 135 (Z)-4-[(4-фтор-4-метилфенил)-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамид Формула (I): А=В=фенил, Y1=3-CH3, Y2=4-F, X1=4-SO2NH2, X2=H, R1, R2=0, R3=R4=Н. Получают согласно примеру 125. Кристаллы с точкой плавления 228-229oС. ПРИМЕР 136 (Е)-3-(4-трет-бутиламиносульфонилфенил)-3-(3-фтор-4-метилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Получают согласно примеру 12 из изомера (Е) кислоты примера 128. Масло, используемое как таковое в дальнейшем. ПРИМЕР 137 (Е)-3-(4-трет-бутиламиносульфонилфенил)-3-(3-фтор-4-метилфенил)-2-(2-гидроксиэтил)-3-пропеновая кислота Раствор из 16 г (Е)-3-(4-трет-бутиламиносульфонилфенил)-3-(3-фтор-4-метилфенил)-2-(2-гидроксиэтил)-2-этилпропеноата, полученного в примере 136, в 50 мл этанола, содержащего 3 г гидроксида натрия и 5 мл воды, нагревают с обратным холодильником в течение 2 часов. Смесь концентрируют в вакууме, обрабатывают водой, промывают этиловым эфиром, затем подкисляют разбавленной соляной кислотой и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния, затем упаривают досуха в вакууме, чтобы получить осадок, который кристаллизуется в изопропиловом эфире, и получают 7,6 г (Е)-3-(4-трет-бутиламиносульфонилфенил)-3-(3-фтор-4-метилфенил)-2-(2-гидроксиэтил)-3-пропеновой кислоты в виде кристаллов с точкой плавления 160oС. ПРИМЕР 138 (Е)-2-[1-(4-трет-бутиламиносульфонилфенил)-1-(3-фтор-4-метилфенил)метилиден]бутан-1,4-диол К раствору 7,8 г (Е)-3-(4-трет-бутиламиносульфонилфенил)-3-(3-фтор-4-метилфенил)-2-(2-гидроксиэтил)-3-пропеновой кислоты, полученной в примере 137, в 50 мл безводного тетрагидрофурана, добавляют по капле 5 мл комплекса боран/метилсульфид. Смесь перемешивают 6 часов при комнатной температуре, затем добавляют по капле 10 мл метанола. Смесь концентрируют в вакууме, обрабатывают водным раствором карбоната калия и экстрагируют этиловым спиртом. Органическую фазу сушат над сульфатом магния и выпаривают в вакууме, чтобы получить 6,3 г (Е)-2-[1-(4-трет-бутиламиносульфонилфенил)-1-(3-фтор-4-метилфенил)метилиден] бутан-1,4-диола в виде кристаллов с точкой плавления 106oС. ПРИМЕР 139 (Е)-4-[(3-фтор-4-метилфенил)-(тетрагидрофуран-3-илиден)метил] бензолсульфонамид Формула (I): А=В=фенил, X1=3-F, Х2=4-СН3, Y1=4-SO2NH2, Y2=H, R1=R2=R3= R4=H. Раствор из 6,3 г (Е)-2-[1-(4-трет-бутиламиносульфонилфенил)-1-(3-фтор-4-метилфенил)метилиден] бутан-1,4-диола, полученного в примере 138, в 75 мл трифторуксусной кислоты нагревают с обратным холодильником в течение 10 часов. Растворитель концентрируют в вакууме и осадок обрабатывают разбавленным раствором гидроксида натрия, промывают дихлорметаном, затем подкисляют разбавленной соляной кислотой и экстрагируют дихлорметаном. Органические фазы соединяют и сушат над сульфатом магния, затем выпаривают в вакууме. Осадок разбавляют трет-бутилметил эфиром, чтобы получить 4 г (Е)-4-[(3-фтор-4-метилфенил)тетрагидрофуран-3-илиден)метил] бензолсульфонамида в виде кристаллов с точкой плавления 174-176oС. ПРИМЕР 140 4-бeнзилтиo-3′-xлop-4′-фтopбeнзoфeнoн Получают согласно примеру 56 из 4-бром-2-хлорфторбензола. Кристаллы с точкой плавления 102oС. ПРИМЕР 141 4-трет-бутил аминосульфонил-3′-хдор-4′-фторбензофенон Получают согласно примеру 57. Кристаллы с точкой плавления 108oС. ПРИМЕР 142 3-этоксикарбонил-4-(4-трет-бутиламиносульфонилфенил)-4-(3-хлор-4-фторфенил)-3-бутеновая кислота Формула (XII): А=фенил, Y1=3-Cl, Y2=4-F. Получают согласно способу примера 58. Масло, используемое как таковое в дальнейшем. ПРИМЕР 143 (Z)-4-[(3-хлор-4-фторфенил)-(2-оксодигидрофуран-3-илиден)метил]бензолсудьфонамид Формула (I): А= В=фенил, Y1=3-Cl, Y2=4-F, X1=4-SO2NH2, Х2=Н, R1, R2=0, R3=R4=Н. К раствору из 17 г 3-этоксикарбонил-4- (4-трет-бутиламиносульфонилфенил)-4-(3-хлор-4-фторфенил)-3-бутеновой кислоты, полученной в примере 142, в 150 мл тетрагидрофурана добавляют по капле 7 мл комплекса боран/метилсульфид. Смесь перемешивают 6 часов при комнатной температуре, затем добавляют по капле 30 мл этанола. После добавления водного раствора карбоната калия смесь экстрагируют дихлорметаном. Органическую фазу сушат и выпаривают в вакууме. Осадок (13,8 г) обрабатывают в 30 мл этанола, содержащего раствор 3 г гидроксида натрия в 10 мл воды, и смесь нагревают до 70oС в течение 3 часов. Растворители концентрируют в вакууме, а осадок обрабатывают водой; водную фазу промывают этиловым эфиром, подкисляют соляной кислотой и экстрагируют дихлорметаном, сушат над сульфатом магния и выпаривают в вакууме. Осадок обрабатывают этиловым эфиром и полученные кристаллы центрифугируют, чтобы получить 3 г (Е)-3-(4-трет-бутиламиносульфонилфенил)-3-(3-фтор-4-хлорфенил)-2-(2-гидроксиэтил)-3-пропеновой кислоты (точка плавления 180oС). Фильтрат концентрируют в вакууме, а осадок обрабатывают в 60 мл трифторуксусной кислоты. Смесь нагревают с обратным холодильником в течение 17 часов, затем концентрируют в вакууме. Осадок обрабатывают разбавленным раствором гидроксида натрия и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния, затем выпаривают в вакууме, чтобы получить 2 г (Z)-4-[(3-хлор-4-фторфенил)-(2-оксодигидрофуран-3-илиден)метил]бензола сульфонамида в виде кристаллов с точкой плавления 244-246oС. ПРИМЕР 144 4-бензилтио-3′-фтор-4′-метоксибензофенон Получают согласно примеру 56 из 4-бром-2-фторанизола. Кристаллы с точкой плавления 125oС. ПРИМЕР 145 4-тpeт-бyтилaминocyльфoнил-3′-фтop-4′-мeтoкcибeнзoфeнoн Получают согласно примеру 57. Кристаллы с точкой плавления 136oС. ПРИМЕР 146 (Z)-3-этоксикарбонил-4-(4-трет-бутиламиносульфонилфенил)-4-(3-фтор-4-метоксифенил)-3-бутеновая кислота Формула (XII): А=фенил, Y1=3-F, Y2=4-OMe. Получают согласно способу примера 58, полученное масло обрабатывают трет-бутилметиловым эфиром, чтобы получить изомер (Z) в виде аморфных кристаллов, используемых как таковых в дальнейшем. ПРИМЕР 147 (Z)-3-(4-трет-бутиламиносульфонилфенил)-3-(3-фтор-4-метоксифенил)-2-(2-гидроксиэтил)-2-этилпропеноат Получают согласно примеру 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 148 (Z)-4-[(3-фтор-4-метоксифенил)-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамид Формула (I): А=В=фенил, Y1=3-F, Y2=4-ОМе, X1=4-SO2NH2, Х2=Н, R1, R2=0, R3=R4=Н. Получают согласно примеру 125. Кристаллы с точкой плавления 149-150oС. ПРИМЕР 149 3-(4-фторбензоил)пиридин К суспензии 140 г хлоргидрата хлорида никотиновой кислоты в 500 мл фторбензола, охлажденной до 0oС, добавляют порционно 280 г хлорида алюминия. Смесь кипятят с обратным холодильником 6 часов, затем охлаждают и сливают на лед. После добавления гидроксида натрия до рН 8 смесь экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния, затем выпаривают в вакууме. Осадок кристаллизуют в смеси пентан/изопропиловый эфир, чтобы получить 108,5 г 3-(4-фторбензоил)пиридина в виде кристаллов с точкой плавления 91oС. ПРИМЕР 150 3-(4-бензилтиобензоил)пиридин К раствору 43 г бензилмеркаптана в 500 мл N,N-диметилформамида добавляют 14 г 60%-го водного раствора гидрида натрия. Смесь перемешивают 20 минут при комнатной температуре и добавляют 70 г 3-(4-фторбензоил)пиридина, полученного в примере 149. Смесь нагревают в течение 8 часов до 80oС, затем концентрируют в вакууме, а осадок обрабатывают водой. Образованные кристаллы центрифугируют, растворяют в дихлорметане, раствор сушат над сульфатом магния и концентрируют в вакууме. Осадок кристаллизуют в смеси пентан/изопропиловый эфир и получают 81 г 3-(4-бензилтиобензоил)пиридина в виде кристаллов с точкой плавления 102oС. ПРИМЕР 151 3-(4-трет-бутиламиносульфонилбензоил)пиридин Получают согласно примеру 57. Кристаллы с точкой плавления 179oС. ПРИМЕР 152 (Z)-3-этоксикарбонил-4-(4-трет-бутиламиносульфонилфенил)-4-(3-пиридил)-3-бутеновая кислота Формула (XII): А=3-пиридил, Y1=Y2=H. Получают согласно способу примера 58, при этом полученное масло обрабатывают теплым этилацетатом и образованные кристаллы центрифугируют (изомер (Е) с точкой плавления 209oС). Фильтрат выпаривают, и осадок, обработанный пентаном, кристаллизуют, чтобы получить изомер (Z) в виде кристаллов с точкой плавления 209oС. ПРИМЕР 153 (Z)-3-(4-трет-бутиламиносульфонилфенил)-3-(3-пиридил)-2-(2-гидроксиэтил)-2-этилпропеноат Получают согласно примеру 12. Аморфные кристаллы, используемые как таковые в дальнейшем. ПРИМЕР 154 (Z)-[(3-пиридил)-(2-оксодигидрофуран-3-илиден)метил]бензолсульфонамид Формула (I): А=3-пиридил, В=фенил, X1=4-SO2NH2, X2=H, Y1=Y2=H, R1, R2=0, R3=R4=Н. Получают согласно примеру 125. Кристаллы с точкой плавления 219-220oС. ПРИМЕР 155 3-хлор-4-метокси-4′-метилтиобензофенон Формула (III); А=фенил, Y1=3-Cl, Y2=4-OMe. Получают согласно способу примера 1. Кристаллы с точкой плавления 110oС. ПРИМЕР 156 3-хлор-4-метокси-4′-метансульфонилебнзофенон Формула (IV): А=фенил, Y1=3-Cl, Y2=4-ОМе. Получают согласно способу примера 39. Кристаллы с точкой плавления 164oС. ПРИМЕР 157 (Z)-3-этоксикарбонил-4-(3-хлор-4-метоксифенил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=фенил, Y1=3-Cl, Y2=4-OMe. Получают согласно способу примера 11, причем полученное масло обрабатывают эфиром и образованные кристаллы центрифугируют, чтобы получить изомер (Z) в виде кристаллов с точкой плавления 179oС. ПРИМЕР 158 (Z)-3-(3-хлор-4-метоксифенил)-3-(4-метансульфонилфенил)-2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=фенил, Y1=3-Cl, Y2=4-OMe. Получают согласно способу примера 12. Кристаллы с точкой плавления 102oС. ПРИМЕР 159 [Z)-3-[1-(3-хлор-4-метоксифенил] -1-(4-метансульфонилфенил)-метилиден] дигидрофуран-2-он Формула (I): А=В=фенил, Y1=3-Cl, Y2=4-OMe. X1=4-SO2CH3, X2=H, R1, R2=0, R3=R4=H. Получают согласно способу примера 65. Кристаллы с точкой плавления 177oС. ПРИМЕР 160 2-(4-метилтиобензоил)тиофен Формула (III): А=2-тиенил, Y1=Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 60oС. ПРИМЕР 161 2-(4-метансульфонилбензоил)тиофен Формула (IV): А=2-тиенил, Y1=Y2=H. Получают согласно способу примера 39. Кристаллы с точкой плавления 140oС. ПРИМЕР 162 (Е)-3-этоксикарбонил-4-(4-метансульфонилфенил)-4-(2-тиенил)3-бутеновая кислота Формула (X): А=2-тиенил, Y1=Y2=H. Получают согласно способу примера 11. Кристаллы с точкой плавления 120oС. ПРИМЕР 163 (Е)-3-(4-метансульфонилфенил)-3-(2-тиенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=2-тиенил, Y1=Y2=H. Получают согласно способу примера 12. Кристаллы с точкой плавления 116oС. ПРИМЕР 164 (Е)-3-[1-(4-метансульфонилфенил)-1-(2-тиенил)метилиден]дигидрофуран-2-он Формула (I): А=2-тиенил, В-фенил, Y1=Y2=H. X1=4-SO2CH3, X2=H, R1, R2=0; R3=R4=H. Получают согласно способу примера 65. Кристаллы с точкой плавления 246oС. ПРИМЕР 165 4-(2-нафтоил)метилтиобензол Формула (III): А=2-нафтил, Y1=Y2=H. Получают согласно способу примера 1. Кристаллы с точкой плавления 98oС. ПРИМЕР 166 4-(2-нафтоил)метансудьфонилбензол Формула (IV): А=2-нафтил, Y1=Y2=H. Получают согласно способу примера 39. Кристаллы с точкой плавления 150oС. ПРИМЕР 167 3-этоксикарбонил-4-(2-нафтил)-4-(4-метансульфонилфенил)-3-бутеновая кислота Формула (X): А=2-нафтил, Y1=Y2=H. Получают согласно способу примера 11. Масло, используемое как таковое в дальнейшем. ПРИМЕР 168 3-(2-нафтил)-3-(4-метансульфонилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Формула (XI): А=нафтил, Y1=Y2=H. Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 169 (Z)-3-[1-(2-нафтил)-1-(4-метансульфонилфенил)метилиден]дигидрофуран-2-он Формула (I): А=2-нафтил, В=фенил, Y1=Y2=H. X1=4-SO2CH3, X2=H, R1, R2=0, R3=R4=H. Получают согласно способу примера 65, очищают хроматогафией при элюировании смеси дихлорметан/ацетон (10/0,3). Кристаллы с точкой плавления 244oC. ПРИМЕР 170 3, 5-дихлор-4′-фторбензофенон Смесь 50 г хлорида 3,5-дихлорбензоила и 150 мл фторбензола охлаждают до 0oС и добавляют порциями 65 г трихлорида алюминия. Смесь перемешивают при комнатной температуре в течение 2 часов, затем в течение 4 часов кипятят с обратным холодильником. После охлаждения смесь сливают на смесь лед/разбавленная соляная кислота и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния и упаривают досуха, чтобы получить 59 г 3,5-дихлор-4′-фторбензофенона в виде кристаллов с точкой плавления 65oС. ПРИМЕР 171 3,5-дихлор-4′-бензилтиобензофенон Получают согласно способу примера 150 из 3, 5-дихлор-4′-фторбензофенона, полученного в примере 170. Кристаллы с точкой плавления 80oС. ПРИМЕР 172 4-трет-бутиламиносульфонил-3′,5′-дихлорбензофенон Получают согласно примеру 57 из 3,5-дихлор-4′- бензилтиобензофенона, полученного в примере 171. Кристаллы с точкой плавления 144oС. ПРИМЕР 173 3-этоксикарбонил-4-(4-трет-бутиламиносульфонилфенил)-4-(3,5-дихлорфенил)-3-бутеновая кислота Формула (XII): А=фенил, Y1=3-Cl, Y2=5-С1. Получают согласно способу примера 58. Масло, используемое как таковое в дальнейшем. ПРИМЕР 174 3-(4-трет-бутиламиносульфонилфенил)-3-(3,5-дихлорфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 175 (Z)-4-[(3,5-дихлорфенил)-2-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамид Изомер (Z): Формула (I): А=В=фенил, Y1=3-Cl, Y2=5-Cl, X1=4-SO2NH2, X2=H, R1, R2=0, R3=R4=H. Получают согласно способу примера 65. Полученные кристаллы хроматографируют на силикагеле при элюировании смеси дихлорметан/ацетон (9/1), чтобы после рекристаллизации в уксусной кислоте получить (Z)-4-[(3,5-дихлорфенил)-(2-оксодигидрофуран-3-илиден) метил] бензолсульфонамид в виде кристаллов с точкой плавления 217oС. ПРИМЕР 176 3-хлор-4′-фторбензофенон Получают согласно способу примера 170. Кристаллы с точкой плавления 76oС. ПРИМЕР 177 3-хлор-4′-бензилтиобензофенон Получают согласно способу примера 150 из 3-хлор-4′-фторбензофенона, полученного в примере 176. Кристаллы с точкой плавления 90oС. ПРИМЕР 178 4-трет-бутиламиносульфонил-3′-хлорбензофенон Получают согласно примеру 57 из 3′-хлор-4′- бензилтиобензофенона, полученного в примере 177. Кристаллы с точкой плавления 128oС. ПРИМЕР 179 3-этоксикарбонил-4-(4-трет-бутиламиносульфонилфенил)-4′(3-хлорфенил)-3-бутеновая кислота Формула (XII): А=фенил, Y1=3-Cl, Y2=H. Получают согласно способу примера 58. Масло, используемое как таковое в дальнейшем. ПРИМЕР 180 3-(4-трет-бутиламиносульфонилфенил)-3-(3-хлорфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 181 (Z)-4-[(3-хлорфенил)-(2-оксодигидрофуран-3-илиден)метил] бензолсудьфонамид Изомер (Z): Формула (I): А=В=фенил, Y1=3-Cl, Y2=H, X1=4-SO2NH2, X2=H, R1, R2=0, R3=R4=H. Получают согласно способу примера 65, очищают хроматографически на силикагеле при элюировании смеси дихлорметан/ацетон (10/1). Кристаллы с точкой плавления 178oС. ПРИМЕР 182 4-фтор-3′-метилбензофенон Получают согласно способу примера 170. Кристаллы с точкой плавления 50oС. ПРИМЕР 183 4-бeнзилтиo-3′-мeтилбeнзoфeнoн Получают согласно способу примера 150 из 4-фтор-3′- метилбензофенона, полученного в примере 182. Кристаллы с точкой плавления 98oС. ПРИМЕР 184 4-трет-бутиламиносульфонил-3′-метилбензофенон Получают согласно примеру 57 из 4-бензилтио-3′- метилбензофенона, полученного в примере 183. Кристаллы с точкой плавления 116oС. ПРИМЕР 185 3-этоксикарбонил-4-(4-трет-бутиламиносульфонилфенил)-4-(3-метилфенил)-3-бутеновая кислота Формула (XII): А=фенил, Y1=3-CH3, Y2=H. Получают согласно способу примера 58. Масло, используемое как таковое в дальнейшем. ПРИМЕР 186 3-(4-трет-бутиламиносульфонилфенил)-3-(3-метилфенил)-2-(2-гидроксиэтил)-2-этилпропеноат Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 187 (Z)-4-[(3-метилфенил)-(2-оксодигидрофуран-3-идиден)метил]бензолсульфонамид Изомер (Z): Формула (I): А=В=фенил, Y1=3-СН3, Y2=H, X1=4-SO2NH2, X2=H, R1, R2=0, R3=R4=H. Получают согласно способу примера 65. Полученное масло хроматографируют на силикагеле при элюировании смеси дихлорметан/ацетон (10/1), чтобы получить (Z)-4-[(3-метилфенил)-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамид в виде кристаллов с точкой плавления 166oС. ПРИМЕР 188 3-хлор-4-метокси-4′-бензилтиобензофенон Получают согласно способу примера 56 из 2-хлор-4-броманизола. Кристаллы с точкой плавления 115oС. ПРИМЕР 189 4-трет-бутиламиносульфонил-3′-хлор-4′-метоксибензофенон Получают согласно примеру 57 из 3-хлор-4-метокси-4′-бензилтиобензофенон. Кристаллы с точкой плавления 120oС. ПРИМЕР 190 3-этоксикарбонил-4-(4-трет-бутиламиносульфонилфенил)-4-(3-хлор-4-метоксифенил)-3-бутеновая кислота Формула (XII): А=фенил, Y1=3-Cl, Y2=OMe. Получают согласно способу примера 58. Масло, используемое как таковое в дальнейшем. ПРИМЕР 191 3-(4-трет-бутиламиносульфонилфенил)-3-(3-хлор-4-метоксифенил)-2-(2-гидроксиэтил)-2-этилпропеноат Получают согласно способу примера 12. Масло, используемое как таковое в дальнейшем. ПРИМЕР 192 (Z)-4-[3-хлор-4-метоксифенил)-(2-оксодигидрофуран-3- илиден)метил] бензолсульфонамид и (Е)-4-[(3-хлор-4-метоксифенил)-(2-оксодигидрофуран-3-илиден)метил]бензолсульфонамид Формула (I): А=В=фенил, Y1=3-Cl, Y2=4-OMe, X1=4-SO2NH2, Х2=Н, R1, R2=0, R3=R4=H. Получают согласно способу примера 65. Полученное масло хроматографируют на силикагеле при элюировании смеси дихлорметан/ацетон (10/1), чтобы получить смесь (Е) и (Z)-4-[(3-хлор-4-метоксифенил)-(2-оксодигидрофуран-3-илиден)метил]бензолсульфонамида в виде аморфных кристаллов. Фармакология Противовоспалительное действие соединений примеров определяли на модели каррагенового отека, а болеутоляющую активность на модели каолинового артрита. МЕТОДЫ Противовоспалительное действие Противовоспалительное действие определяли у крысы в тексте на каррагеновый отек. Продукт вводили перорально из расчета 2,5 мл/100 г (n=6 животных на дозу) через 2 часа 30 минут после перегрузки жидкостью пероральным путем (2,5 мл/100 г), через час после введения продукта вызывали отек путем подошвенной подкожной инъекции 2%-ного водного раствора каррагена. Результаты выражены в таблице 1 в виде DI50 дозы в мг/кг, приводящей к 50%-ному уменьшению объема отека, подсчитанному путем линейной регрессии с учетом максимального объема отека для каждого тестируемого продукта. Болеутоляющее действие Болеутоляющее действие определялось у крыс в тесте на каолиновый артрит. Через 30 минут после внутримышечного введения 10%-ной водной суспензии каолина продукт вводили перорально из расчета 1 мл/100 г (n=10 животных на дозу). Результаты выражены в виде DE50 дозы в мг/кг, приводящей к 50%-ному уменьшению максимальных размеров, полученных в контроле, подсчитанному с помощью линейной регрессии. Ингибирование ферментативной активности циклооксигеназы-1 и циклооксигеназы-2. Изучаемую молекулу предварительно инкубировали в течение 10 минут при 25oС с 2 ед циклооксигеназы-1 (очищенный фермент семенного пузырька барана) или с 1 ед циклооксигеназы-2 (очищенный фермент плаценты овцы). Арахидоновую кислоту (6 мкМ для циклооксигеназы-1 и 4 мкМ для циклооксигеназы-2) добавляли в реакционную среду и инкубировали в течение 5 минут при 25oС. В конце времени инкубации ферментативную реакцию останавливали путем добавления 1N HC1 и полученную PGE2 дозировали с помощью EIA. Результаты выражены в таблице 2 в виде CI50, концентрация в нМ соответствует 50%-ному ингибированию максимальной ферментативной активности на циклооксигеназу-1 и на циклооксигеназу-2 (n=1-4) определения. Толерантность Желудочная толерантность Желудочную толерантность изучали у крыс Шарль Ривер штамма CD весом 110-150 г. Животные находились на водной диете 24 часа перед введением продукта или одного только наполнителя пероральным путем из расчета 1 мл/100 г (n= 6 животных на дозу). Через шесть часов после введения животных забивали, вынимали желудки и вскрывали их по большой кривизне. Число макроскопически идентифицированных геморрагических точек и борозд на желудок позволяет установить индекс язвообразования (0:нет поражения, 1:1-2 поражения, 2: 3-4 поражения, 3:5-8 поражений, 4:9-16 поражений, 5: более 17 поражений) и вычислить 50%-ную язвообразующую дозу (см. таблицу 3, где DU50=дозa, выраженная в мг/кг, вызывающая 4-5 поражений). Токсикология Первые выполненные тесты на токсичность показывают, что продукты примеров не оказывают никакого вредного действия при введении доз до 300 мг/кг (дозы вводились крысам перорально). Формула изобретения
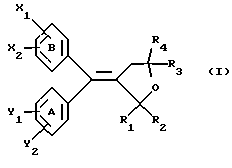 в которой циклы А и В означают независимо фенил, нафтил, производное гетероцикла с 5-6 звеньями, включающего один гетероатом, производное насыщенного углеводородного цикла с 3-7 атомами углерода; по меньшей мере один из заместителей 1, X2, Y1 или Y2 обязательно означает группу -S(O)nR, в которой n – целое число 0, 1 или 2, R – низший алкил с 1-6 атомами углерода, группу -SO2NH2 и находится в пара-положении; остальные означают независимо атом водорода, атом галогена, низший алкил с 1-6 атомами углерода, трифторметил, низший O-алкил с 1-6 атомами углерода или X1 и Х2, или Y1 и Y2 обязательно означают группу метилендиокси; R1, R2, R3 и R4 означают независимо атом водорода, атом галогена, низший алкил с 1-6 атомами углерода, низший галогеналкил с 1-6 атомами углерода, ароматический радикал, выбираемый из группы, включающей фенил, нафтил, тиенил, фурил или пиридил, или R1, R2 или R3, R4 означают атом кислорода. 2. Производные формулы (I) по п. 1, отличающиеся тем, что циклы А и В независимо означают фенил, нафтил, пиридил, фурил, тиенил, циклогексил; по меньшей мере, один из заместителей X1, X2, Y1 или Y2 обязательно означает группу -SСН3, -SО2СН3 или -SO2NH2; другие означают независимо атом водорода, атом галогена, низший алкил с 1-6 атомами углерода, трифторметил, О-низший алкил с 1-6 атомами углерода; R1, R2 означают атом кислорода; R3, R4 означают независимо атом водорода или низший алкил с 1-6 атомами углерода. 3. Производные по п. 1 или 2, отличающиеся тем, что цикл В означает фенил. 4. Производные по п. 1 или 2, отличающиеся тем, что цикл А означает фенил или пиридил. 5. Производные по одному из пп. 1-4, отличающиеся тем, что 1 означает группу 4-SО2СН3 или группу 4-SO2NH2 и X2 означает атом водорода. 6. Производные по одному из пп. 1-5, отличающиеся тем, что 1 означает атом фтора, атом хлора или радикал метил и Y2 означает атом водорода, атом фтора или атом хлора. 7. Производные по одному из пп. 1-6, отличающиеся тем, что 1, R2 означают атом кислорода, а R3 и R4 означают каждый атом водорода. 8. Производные по п. 1, отличающиеся тем, что их выбирают из соединений формулы (E)-3-[1-(4-фторфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он 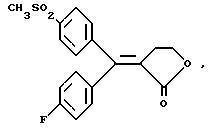 (Z)-3-[1-(4-хлорфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он 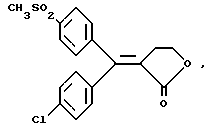 (Z)-3-[1-(3,4-дихлорфенил)-1-(4-метансульфонилфенил)метилиден] дигидрофуран-2-он 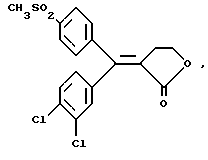 (Z)-3-[1-(6-хлорпиридин-3-ил)-1-(4-метансульфонилфенил)-метилиден] дигидрофуран-2-он 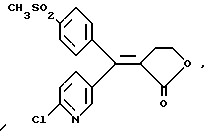 (Z)-4-[4-хлорфенил)-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамид 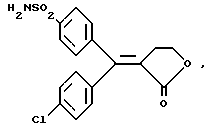 (Z)-4-[(3-фтор-4-метилфенил)-(2-оксодигидрофуран-3-илиден)метил] бензолсульфонамид 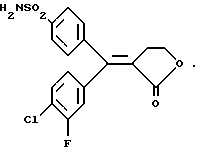 9. Способ получения соединений формулы (I) по одному из пп. 1-8, отличающийся тем, что он включает реакцию взаимодействия кетона формулы 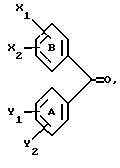 в которой А, В, X1, X2, Y1 и Y2 имеют значения, указанные в п. 1, с алкилсукцинатом формулы 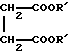 в которой R’ – низший алкил с 1-6 атомами углерода, оптимально – этил, согласно условиям реакции конденсации Стобба, в присутствии алкоголята, в частности, трет-бутилата натрия или калия, или гидрида, например гидрида натрия, в спиртовом растворителе, таком, как трет-бутанол, или ароматическом растворителе, таком, как толуол, причем выбор агента конденсации и растворителя позволяют ориентировать реакцию на определенный тип изомера, чтобы получить производные сложных эфиров, содержащие кислотную группу формулы 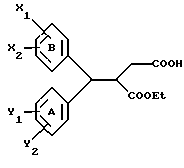 в которой А, В, X1, X2, Y1 и Y2 имеют значения, указанные в п. 1; селективное восстановление кислотной группы вышеназванных производных сложных эфиров, содержащих кислотную группу, например, путем воздействия борана на тетрагидрофуран, чтобы получить сложные эфиры, содержащие спиртовую группу формулы 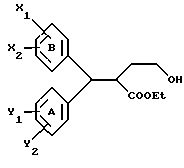 в которой А, В, X1, Х2, Y1 и Y2 имеют значения, указанные в п. 1; затем циклизацию этих сложных эфиров, содержащих спиртовую группу путем нагревания, например в толуоле, в присутствии паратолуолсульфоновой кислоты. 10. Фармацевтическая композиция с противовоспалительным и болеутоляющим действием, отличающаяся тем, что она содержит фармацевтически эффективное количество соединения формулы (1) по одному из пп. 1-8, при необходимости введенное в фармацевтически приемлемый эксципиент, связующее или носитель. 11. Фармацевтическая композиция по п. 10, отличающаяся тем, что она находится в форме желатиновых капсул или таблеток, содержащих дозу 1 – 1000 мг, или в форме препарата для инъекций, содержащего дозу 0,1 – 500 мг. Приоритет по признакам: 04.04.1996 – циклы А и В – одновременно обозначают фенил; 26.06.1996 – циклы А и В одновременно обозначают производное гетероцикла с 6 звеньями и 1 гетероатомом. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 04.04.2004
Извещение опубликовано: 10.05.2005 БИ: 13/2005
|
||||||||||||||||||||||||||
