Патент на изобретение №2189043
|
||||||||||||||||||||||||||
(54) ГРАФИТОВЫЕ НАНОТРУБКИ В ЛЮМИНЕСЦЕНТНЫХ АНАЛИЗАХ И СПОСОБЫ ПРОВЕДЕНИЯ ТАКИХ АНАЛИЗОВ
(57) Реферат: Изобретение относится к области анализа. Графитовые нанотрубки, которые включают трубчатые фуллерены и фибриллы, которые функциализованы химическим замещением, используются в качестве твердых носителей в анализах на основе электрогенерируемой хемилюминесценции. Эти графитовые нанотрубки химически модифицированы биомолекулами с функциональными группами перед использованием в анализе. Связывание электрохемилюминесцентых комплексов рутения с нанотрубками, модифицированными биомолекулами с функциональными группами, позволяет детектировать молекулы, в том числе нуклеиновые кислоты, антигены, ферменты и субстраты ферментов, с применением многочисленных форм выполнения анализа. Технический результат – получение высокой эмиссии света. 6 с. и 5 з.п.ф-лы, 13 ил., 7 табл. Эта заявка является частичным продолжением находящейся в процессе одновременного рассмотрения заявки Massey et al. Serial No.08/346832, поданной 30 ноября 1994 года, которая является продолжением заявки Serial No. 08/158193, поданной 24 ноября 1993 года, которая является продолжением заявки Serial No.07/652427, поданной 6 февраля 1991 года и частичным продолжением заявки Serial No.07/539389, поданной 18 июня 1990 года, которая является продолжением заявки Serial No.7/266882, в настоящее время отклоненной, с названием “Электрохемилюминесцентные анализы”, поданной 3 ноября 1988 года. Эта заявка является также частичным продолжением находящейся в процессе одновременного рассмотрения заявки Fischer et al. Serial No.08/352400 с названием “Функционализованные нанотрубки”, поданной 8 декабря 1994 года. Содержание этих заявок включено здесь в виде ссылки. Область изобретения Данная заявка относится в общем к способам и устройству для проведения анализов связывания, более конкретно к таким, которые измеряют присутствие представляющего интерес аналита путем измерения люминесценции, испускаемой одним или несколькими мечеными компонентами тест-системы. Более конкретно, данное изобретение относится к точным воспроизводимым правильным гомогенным или гетерогенным анализам специфического связывания улучшенной чувствительности, в которых люминесцентный компонент концентрируется в тест-композиции и собирается на системе детектирования перед индуцированием его для электрохемилюминесценции. Предшествующий уровень техники Были разработаны многочисленные способы и системы для детектирования и количественного определения представляющих интерес аналитов в биохимических и биологических материалах. Способы и системы, которые способны измерять следовые количества микроорганизмов, фармацевтических веществ, гормонов, вирусов, антител, нуклеиновых кислот и белков, представляют большую ценность для исследователей и клиницистов. Была исследована очень существенная часть области, основанной на хорошо известных реакциях связывания, например на реакциях антиген-антитело, на способах гибридизации нуклеиновых кислот и системах белок-лиганд. Высокая степень специфичности во многих биохимических и биологических системах связывания привела к разработке многих способов анализа и систем, ценных в исследовательской работе и диагностике. Как правило, существование представляющего интерес аналита детектируется присутствием или отсутствием наблюдаемой “метки”, присоединенной к одному или нескольким связывающимся материалам. Особый интерес представляют метки, которые можно заставить люминесцировать посредством фотохимических, химических и электрохимических средств. “Фотолюминесценция” представляет собой процесс, посредством которого материал индуцируется для люминесценции при поглощении им электромагнитного излучения. Флуоресценция и фосфоресценция представляют собой типы фотолюминесценции. “Хемилюминесцентные” процессы вызывают создание люминесцентных частиц путем химического переноса энергии. “Электрохемилюминесценция” вызывает создание люминесцентных частиц электрохимически. Были созданы хемилюминесцентные способы анализа, в которых пробу, содержащую представляющий интерес аналит, смешивают с реагентом, меченным хемилюминесцентной меткой. Эту реакционноспособную смесь инкубируют и некоторая часть меченого реагента связывается с аналитом. После инкубирования связанную и несвязанную фракции этой смеси разделяют и концентрацию метки в любой фракции или в обеих фракциях можно определить хемилюминесцентными способами. Уровень хемилюминесценции, определенной в одной или обеих фракциях, указывает количество представляющего интерес аналита в биологической пробе. Электрохемилюминесцентные (ECL) способы анализа являются усовершенствованием хемилюминесцентных способов. Они обеспечивают чувствительное и точное измерение присутствия и концентрации представляющего интерес аналита. В таких способах инкубируемая проба экспонируется в присутствии вольтамперометрического рабочего электрода для индукции люминесценции. В подходящем химическом окружении такая электрохемилюминесценция запускается напряжением, подведенным на рабочий электрод, в определенное время и определенным образом. Свет, продуцируемый меткой, измеряется и указывает присутствие или количество аналита. Для более полного описания таких ECL-способов дается ссылка на опубликованную РСТ заявку US 85/01253 (WО 86/02734), опубликованную РСТ заявку US 87/00987 и опубликованную РСТ заявку US 88/03947. Описания этих заявок включены в качестве ссылки. Электрохемилюминесцентные анализы желательно проводить без необходимости стадии разделения во время процедуры анализа и так, чтобы максимизировать модулирование сигнала при различных концентрациях аналита, с целью выполнения точных и чувствительных измерений. Среди известных способов анализов без стадии разделения имеются способы, которые используют материал из микрочастиц, суспендируемый в анализируемой пробе (тест-пробе), для связывания одного или нескольких компонентов связывания этого анализа. В US Application Serial No. 539389 (РСТ published application US 89/04919) описаны чувствительные способы анализа специфического связывания, основанные на явлении люминесценции, в которых инертный, состоящий из микрочастиц материал специфически связывается с одним из партнеров связывания тест-системы. Эти анализы могут проводиться в гетерогенной (с одной или несколькими стадиями) постановке анализа и могут быть использованы наиболее выгодно в гомогенной (без разделения) постановке анализа. US 89/04919 относится к композиции для анализа, основанного на реакции связывания, для измерения явления люминесценции, причем эта композиция включает в себя множество суспендированных частиц, имеющих поверхность, способную связывать компонент анализируемой смеси. В другом аспекте, он относится к системе для детектирования или количественного определения представляющего интерес аналита в пробе, причем эта система способна проводить тест-способы с использованием тест-композиций данного изобретения. Эта система включает в себя средства для индуцирования меченого соединения в тест-среде для люминесценции и средства для измерения люминесценции для обнаружения представляющего интерес аналита в пробе. Было обнаружено, что связывание того компонента тест-системы, с которым была соединена электрохемилюминесцентная часть молекулы, с суспендированным, состоящим из микрочастиц материалом сильно модулирует интенсивность люминесцентного сигнала, генерируемого электрохемилюминесцентной частью молекулы, соединенной с этим компонентом, обеспечивая средство для мониторинга реакции специфического связывания этой тест-системы. Было обнаружено, что суспендированные частицы оказывают небольшое влияние или вообще не влияют на интенсивность люминесцентного сигнала, генерируемого элктрохемилюминесцентной частью молекулы, соединенной с компонентом системы, который остается не связанным с суспендированным, состоящим из микрочастиц материалом. Таким образом, US 89/04919 относится к способам обнаружения представляющего интерес аналита в пробе, причем способ включает стадии (1) образования композиции, включающей (а) пробу, в которой предполагают присутствие представляющего интерес аналита, (b) вещество, подвергаемое анализу, выбранное из группы, состоящей из (i) представляющего интерес аналита или аналога представляющего интерес аналита, (ii) партнера связывания представляющего интерес аналита или его упомянутого аналога и (iii) реакционноспособного компонента, способного к связыванию с (i) или (ii), причем одно из этих веществ связано с соединением-меткой, имеющим химическую часть молекулы, способную индуцироваться для люминесценции, и (с) множество суспендированных частиц, способных специфически связываться с аналитом и/или веществом, определенным в (b) (i), (ii) или (iii); (2) инкубирование этой композиции с образованием комплекса, который включает частицу и упомянутое соединение-метку; (3) индуцирование соединения-метки для люминесценции; и (4) измерение люминесценции, испускаемой этой композицией, для обнаружения присутствия представляющего интерес аналита в пробе. Эти же способы могут быть использованы для определения количества аналита в пробе путем сравнения люминесценции тест-композиции с люминесценцией композиции, содержащей известное количество аналита. Аналоги представляющего интерес аналита, которые могут быть природными или синтетическими, являются соединениями, которые имеют связывающие свойства, сравнимые со свойствами аналита, но включают также соединения с более высокой или с более низкой способностью связывания. Партнеры связывания, пригодные для использования в данном изобретении, хорошо известны. Примерами их являются антитела, ферменты, нуклеиновые кислоты, лектины, кофакторы и рецепторы. Реакционноспособные компоненты, способные связываться с аналитом или его аналогом и/или их партнером связывания, могут быть вторым антителом или белком, таким как Протеин А или Протеин G, или могут быть авидином или биотином или другим компонентом, о котором известно в данной области, что он вступает в реакции связывания. Предпочтительно, люминесценция возникает из электрохемилюминесценции (ECL), индуцированной экспонированием меченого соединения, связанного или не связанного с партнерами специфического связывания, в присутствии вольтамперометрического рабочего электрода. ECL-реакционноспособная смесь регулируемо запускается для эмиссии света напряжением, подведенным на рабочий электрод, в определенное время и определенным образом с генерированием света. Хотя эмиссия видимого света является выгодным свойством, композиция или система может испускать другие типы электромагнитного излучения, такие как инфракрасный или ультрафиолетовый свет, рентгеновское излучение, микроволны и т. д. Использование терминов “электрохемилюминесценция”, “электрохемилюминесцентный”, “люминесценция”, “люминесцентный” и “люминесцировать” включает испускание света или других форм электромагнитного излучения. Способы, описанные в US 89/04919, делают возможным обнаружение и количественное определение чрезвычайно малых количеств аналитов в разнообразных анализах, проводимых в исследовательских и клинических условиях. Однако потребности исследователей и клиницистов заставляют понижать пороги детектирования анализов, проводимых такими способами, для увеличения чувствительности этих анализов и для увеличения скорости выполнения этих анализов. В данной области известны разнообразные способы для увеличения сигнала от меченых частиц путем концентрирования их перед проведением стадии измерения. Например, в US Patent No.4652333 частицы, меченные флуоресцентной, фосфоресцентной или атомной флуоресцентной метками, концентрируются микрофильтрацией перед проведением стадии измерения. Также известно в данной области концентрирование меченых иммунохимических частиц перед стадией измерения, например, притягиванием чувствительных в магнитном отношении меченых частиц к поверхности сосуда для измерения. В US Patents No.4731337, 4777145 и 4115535, например, такие частицы притягиваются к стенке сосуда и затем освещаются для возбуждения флуорофорной эмиссии света. В US Patent No.4945045 частицы концентрируются на магнитном электроде. На электроде имеет место электрохимическая реакция, облегчаемая меченым химическим медиатором. Реакция иммунохимического связывания изменяет эффективность этого медиатора, приводя к модифицированному сигналу в случае, когда имеет место связывание. Без связывания каким-либо конкретным механистическим объяснением поверхностного возбуждения, например, электрохемилюминесценции, считается, что метка на твердофазном комплексе должна быть окислена на электроде. Это требует, чтобы электрон переместился от метки к электроду. Считается, что электрон производит “перескок” посредством явления, известного как туннельный переход (туннельное прохождение электронов), в котором электрон проходит через пространство (участок, где его потенциальная энергия является очень высокой, например раствор) без необходимости проходить “через” барьер потенциальной энергии. Он может совершать туннельный переход (проникать через потенциальный барьер) и, следовательно, перемещаться от одной молекулы к другой или от одной молекулы к электроду без дополнительного подведения энергии. Однако это явление туннельного перехода может действовать только для очень коротких расстояний. Вероятность туннельного перехода падает экспоненциально по мере увеличения расстояния между двумя частицами. Вероятность явления туннельного перехода, происходящего между двумя частицами, является вполне высокой, если расстояние меньше 25 ангстрем (2,5 нм), но довольно низким, если расстояние больше. Расстояние 25 ангстрем является обязательным правилом (“правилом большого пальца” (rule-of-thumb)), используемым специалистами в данной области, но не является абсолютным ограничением. Таким образом, можно ожидать, что только ECL-метки с 25 ангстрем от поверхности электрода участвуют в ECL-процессе. Зона частицы, которая находится в пределах 25 ангстрем от поверхности электрода, как правило, крайне мала. В соответствии с этим нельзя было бы ожидать, что ECL от поверхности частицы можно было бы измерить до какой-либо значимой степени. Кроме того, свет, производимый ECL-процессом, должен проходить через эту частицу, чтобы попасть к фотоумножителю. Поскольку эти частицы по существу непрозрачны (их концентрированная суспензия является черной), нельзя было бы ожидать, даже если значительные количества света могли бы продуцироваться ECL, что свет мог бы проходить через частицу и быть измерен фотоумножителем. С 1970-х годов графитовые нанотрубки и фибриллы были идентифицированы в качестве материалов, представляющих интерес для многих применений. Субмикронные графитовые фибриллы иногда называют выращенными в парах углеродными волокнами. Углеродные фибриллы представляют собой червеобразные углеродные отложения, имеющие диаметры менее 1,0 микрон, предпочтительно менее 0,5 микрон и даже более предпочтительно менее 0,2 микрон. Они существуют в разнообразных формах и были получены каталитическим разложением различных содержащих углерод газов на металлических поверхностях. Такие червеобразные углеродные отложения наблюдали почти со времени появления электронной микроскопии. Хороший ранний обзор и ссылки можно найти в Baker and Harris, Chemistry and Physics of Carbon, Walker and Thrower ed., Vol. 14, 1978, p. 83, включенной в качестве ссылки. См. также Rodriguez N. J. Mater. Research. Vol. 8, р. 3233 (1993), включенную в качестве ссылки. В 1976 году Endo et al. (см. Obelin A. and Endo M. J. of Crystal Growth. , Vol. 32 (1976), pp. 335-349, включ. в качестве ссылки) выяснили основной механизм, по которому происходит рост таких углеродных фибрилл. Было обнаружено, что они происходят из частицы металлического катализатора, который в присутствии содержащего углеводород газа становится пересыщенным по углероду. Экструдируется цилиндрический графитовый сердечник, который немедленно, согласно Endo et al., становится покрытым наружным слоем пиролитически отлагающегося графита. Эти фибриллы с пиролитическим покрытием, как правило, имеют диаметры более 0,1 микрон, более типично 0,2-0,5 микрон. В 1983 году Tennent, US Patent No.4663230, включ. в качестве ссылки, удалось вырастить цилиндрические графитовые сердечники, незагрязненные пиролитическим углеродом. Таким образом, изобретение Tennent обеспечило доступность фибрилл меньшего диаметра, как правило, 35-700 ангстрем (0,0035-0,07 микрон), и упорядоченной, “как бы выращенной” графитовой поверхности. Фибриллярные углеродные материалы менее совершенной структуры, но без наружного слоя пиролитического углерода также были выращены. Фибриллы, волокна “buckytubes” и нановолокна отличаются от непрерывных углеродных волокон, промышленно доступных в качестве материалов армировки. В противоположность фибриллам, которые имеют желательно большие, но неизбежно конечные относительные длинные, непрерывные углеродные волокна имеют относительные длины (L/D, длина/диаметр) по меньшей мере 104 и часто 106 или более. Диаметр непрерывных волокон также гораздо больше, чем диаметр фибрилл, будучи всегда >1,0 микрон и, как правило, 5-7 микрон. Непрерывные углеродные волокна производят пиролизом органических предшественников-волокон, обычно гидратцеллюлозного волокна, полиакрилонитрила (PAN) и смолы. Таким образом, они могут содержать гетероатомы в их структурах. Графитовая природа “как бы изготовленных” непрерывных углеродных волокон вариирует, но они могут быть подвергнуты последующей стадии графитизации. Различия в степени графитизации, ориентации и кристалличности графитовых поверхностей, если они присутствуют, потенциальное присутствие гетероатомов и даже абсолютное различие в диаметре субстрата делает опыт работы с непрерывными волокнами малоперспективным для химии нановолокон. Tennent, US Patent No.4663230 описывает углеродные фибриллы, которые не имеют непрерывного термического углеродного покрытия и имеют множественные графитовые наружные слои, которые по существу параллельны оси фибриллы. Как таковые, они могут быть охарактеризованы как имеющие с-оси, оси, которые являются перпендикулярными касательным изогнутых слоев графита, по существу перпендикулярными их цилиндрическим осям. Как правило, они имеют диаметры не более 0,1 микрон и отношения длины к диаметру по меньшей мере 5. Желательно, чтобы они были по существу свободны от непрерывного термического углеродного покрытия, т.е. пиролитически отлагающегося углерода, происходящего вследствие термического разрушения подаваемого газа, используемого для их изготовления. Tennent et al., US Patent No.5171560, включ. в качестве ссылки, описывает углеродные фибриллы, не содержащие термического покрытия и имеющие графитовые слои, по существу параллельные осям фибрилл, так что проекция этих слоев на оси фибрилл простирается на расстояние по меньшей мере двух диаметров фибрилл. Как правило, такие фибриллы являются по существу цилиндрическими, графитовыми нанотрубками по существу постоянного диаметра и содержат цилиндрические графитовые слои, с-оси которых по существу перпендикулярны их цилиндрической оси. Они практически не имеют пиролитически отложенного углерода, имеют диаметр менее 0,1 микрон и отношение длины к диаметру более 5. Эти фибриллы являются фибриллами первостепенного интереса в данном изобретении. Дальнейшие детали относительно образования агрегатов углеродных фибрилл могут быть найдены в описании Snyder et al., US Patent Application Serial No. 149573, поданной 28 января 1988 года, и PCN Application No. US 89/00322, поданной 28 января 1989 года (“Углеродные фибриллы”) WO 89/07163, и Моу et al., U.S. Patent Application Serial No.413837, поданной 28 сентября 1989 года, и PCN Application No. US 90/05498, поданной 27 сентября 1990 (“Агрегаты фибрилл и способ их приготовления”), WO 91/05089, все переуступленные правопреемнику, являющемуся также правопреемником данного изобретения, и включенные в качестве ссылки. Моу et al. , USSN 07/887307, filed May 22, 1992, включ. в качестве ссылки, описывает фибриллы, приготовленные в виде агрегатов, имеющих различные макроскопические морфологии (как определено сканирующим электронным микроскопом), в которых они произвольно запутаны друг с другом с образованием запутанных шариков или фибрилл, напоминающих гнезда птиц (“BN”, bird nests); или в виде агрегатов, состоящих из пучков прямых, слегка изогнутых или загнутых углеродных фибрилл, имеющих по существу одну и ту же относительную ориентацию и имеющих вид, например, расчесанной пряжи (“CY”, combed yarn), продольная ось каждой фибриллы (несмотря на индивидуальные изгибы или загибы) простирается в том же самом направлении, что и направление окружающих фибрилл в пучках; или в виде агрегатов, состоящих из прямых или слегка согнутых или загнутых фибрилл, которые рыхло спутаны друг с другом с образованием структуры “открытой сетки” (“ON”, open net). В структурах открытой сетки степень спутанности фибрилл является большей, чем в агрегатах типа расчесанной пряжи (в которых отдельные фибриллы имеют по существу одну и ту же относительную ориентацию), но меньшей, чем в случае типа птичьих гнезд. CY- и ON-агрегаты более легко диспергируются, чем BN, что делает их применимыми в изготовлении композиционного материала, где желательны однородные свойства по всей структуре. Когда проекция графитовых слоев на ось фибриллы простирается на расстояние, меньшее чем два диаметра фибриллы, углеродные плоскости графитового нановолокна, в поперечном сечении, имеют вид скелета селедки. Они названы фибриллами рыбьего скелета. Geus, US Patent No.4855091, включ. в качестве ссылки, обеспечивает процедуру для приготовления фибрилл рыбьего скелета, практически не содержащих пиролитического покрытия. Эти фибриллы применимы также в практике данного изобретения. Углеродные нанотрубки с морфологией, сходной с каталитически выращенными фибриллами, описанными выше, были выращены в высокотемпературной угольной дуге (Iijima, Nature, 354 56, 1991). Сейчас, как правило, признается (Weaver, Science, 265, 1994), что эти выращенные в угольной дуге нановолокна имеют ту же самую морфологию, что и более ранние каталитически выращенные фибриллы Tennent. Выращенные в угольной дуге углеродные нановолокна также применимы в данном изобретении. Цели изобретения Таким образом, целью данного изобретения является обеспечение люминесцентных анализов с применением частиц, имеющих высокую площадь поверхности, для иммобилизации необходимых для проведения анализа веществ для получения выгодно высокой эмиссии света. Другой целью данного изобретения является обеспечение композиций и тестов с использованием графитовых нанотрубок (фибрилл), которые могут быть помечены соединениями, способными индуцироваться для люминесценции. Следующей целью является обеспечение функционализованных фибрилл для использования в таких анализах. Описание изобретения Определение терминов Термины “ECL-частица”, “металлсодержащая ECL-частица”, “метка”, “соединение-метка” и “вещество-метка” используются взаимозаменяемо. Этот термин находится в объеме данного изобретения для частиц, называемых “ECL-частица”, “металлсодержащая ECL-частица”, “металлоорганическая”, “хелат металла”, “хелат переходного металла”, “хелат редкоземельного металла”, “соединение-метка”, “вещество-метка” и “метка”, которые должны быть связаны с молекулами, такими как аналит или его аналог, партнер связывания аналита или его аналога, и, далее, с партнерами связывания такого вышеупомянутого партнера связывания или с реакционноспособным компонентом, способным связываться с аналитом, его аналогом или партнером связывания, упомянутыми выше. Вышеупомянутые частицы могут быть также связаны с комбинацией одного или нескольких партнеров связывания и/или одного или нескольких реакционноспособных компонентов. Кроме того, вышеупомянутые частицы могут быть также связаны с аналитом или его аналогом, связанными с партнером связывания, реакционноспособным компонентом или комбинацией одного или нескольких партнеров связывания и/или одного или нескольких реакционноспособных компонентов. Этот термин употребляется также в объеме данного изобретения для множества вышеупомянутых частиц, которые должны быть связаны непосредственно или через другие молекулы, как рассмотрено выше, с аналитом или его аналогом. Для краткости эти лиганды называются веществами, (необходимыми) для проведения анализа (assay-performance-substances). Термины детектирование и количественное определение называются “измерением”, причем понятно, что количественное определение может требовать приготовления эталонных композиций и калибрований. Термины сбор и концентрирование комплекса могут использоваться взаимозаменяемо для описания концентрирования комплекса внутри тест-композиции и сбора комплекса, например, на поверхности электрода. Краткое описание рисунков Фиг.1 изображает схематический рисунок ячейки для проведения основанного на микрочастицах неразделительного и разделительного анализов данного изобретения. Фиг. 2 – упрощенная диаграмма устройства для регуляции напряжения для использования с ячейкой Фиг.1. Фиг. 3 – схематическое изображение, показывающее специфические сайты ферментативного гидролиза на Ru(bpy)3 2+-меченых пептидных фибриллах. Фиг. 4 – схематическое изображение анализа ДНК-зонда с использованием фибрилл с авидином. Фиг. 5 – схематическое изображение схемы реакций для получения бифункциональных фибрилл путем присоединения N  -(трет-бутоксикарбонил)-L-лизина.
Фиг. 6 – схематическое изображение схемы реакций для синтеза основанной на ECL, бифункциональной биосенсорной фибриллы.
Фиг. 7 – схематическое изображение бифункциональной, основанной на ECL биосенсорной фибриллы.
Фиг. 8 – схематическое изображение реакции, катализируемой D-глюкозо-6-фосфатдегидрогеназой.
Фиг. 9 – диаграмма, показывающая ECL-детектирование глюкозо-6-фосфатдегидрогеназы с использованием удерживаемого фибриллой основанного на ECL биосенсора.
Фиг. 10 – схематическое изображение ECL-биосенсора на основе алкогольдегидрогеназы (ADH).
Фиг.11 – схематическое изображение биосенсора на основе ADH, иммобилизованного на гранулах Dynal M450 (слева) и иммобилизованного на алкилированных фибриллах (справа).
Фиг. 12 – диаграмма, показывающая ECL-детектирование этанола с использованием ферментного биосенсора, иммобилизованного на гранулах и фибриллах.
Фиг. 13 – график, показывающий анализ связывания Ru(bpy)3 2+ с карбокси-фибриллами и PEG-модифицированными фибриллами, полученными двумя различными способами.
Краткое описание изобретения -(трет-бутоксикарбонил)-L-лизина.
Фиг. 6 – схематическое изображение схемы реакций для синтеза основанной на ECL, бифункциональной биосенсорной фибриллы.
Фиг. 7 – схематическое изображение бифункциональной, основанной на ECL биосенсорной фибриллы.
Фиг. 8 – схематическое изображение реакции, катализируемой D-глюкозо-6-фосфатдегидрогеназой.
Фиг. 9 – диаграмма, показывающая ECL-детектирование глюкозо-6-фосфатдегидрогеназы с использованием удерживаемого фибриллой основанного на ECL биосенсора.
Фиг. 10 – схематическое изображение ECL-биосенсора на основе алкогольдегидрогеназы (ADH).
Фиг.11 – схематическое изображение биосенсора на основе ADH, иммобилизованного на гранулах Dynal M450 (слева) и иммобилизованного на алкилированных фибриллах (справа).
Фиг. 12 – диаграмма, показывающая ECL-детектирование этанола с использованием ферментного биосенсора, иммобилизованного на гранулах и фибриллах.
Фиг. 13 – график, показывающий анализ связывания Ru(bpy)3 2+ с карбокси-фибриллами и PEG-модифицированными фибриллами, полученными двумя различными способами.
Краткое описание изобретенияВ самом широком воплощении данное изобретение представляет собой нанотрубку, к которой присоединен компонент, соединенный с соединением-меткой, способным индуцироваться с возникновением люминесценции. В частности, упомянутая нанотрубка представляет собой графитовую нанотрубку, а люминесценция представляет собой электрохемилюминесценцию. В одном варианте упомянутый компонент представляет собой ферментный биосенсор. Данное изобретение относится также к композиции для детектирования представляющего интерес аналита, присутствующего в пробе, причем эта композиция содержит: (i) графитовую нанотрубку, имеющую функциональную группу, и (ii) вещество для проведения анализа, связанное с этой функциональной группой, причем это вещество для проведения анализа способно связываться, прямо или опосредованно, с аналитом. В одном варианте вещество для проведения анализа, будучи связанным с указанной функциональной группой, в свою очередь, связано с аналитом. Кроме того, композиция содержит второе вещество для проведения анализа, связанное с аналитом, причем второе вещество для проведения анализа соединено с соединением-меткой, способным индуцироваться с возникновением люминесценции. Вещество для проведения анализа содержит по меньшей мере одно вещество, выбранное из группы, включающей: (i) добавленный представляющий интерес аналит или добавленный аналог этого аналита; (ii) партнер связывания упомянутого аналита или партнер связывания упомянутого аналога и (iii) реакционноспособный компонент, способный связываться с (i) или (ii). Одно из упомянутых веществ (i), (ii) или (iii) соединено с соединением-меткой, имеющим химическую часть молекулы, способную индуцироваться для люминесценции. В общих чертах, эти частицы представляют собой функционализованные фибриллы, т.е. фибриллы, поверхность которых была подвергнута реакции или контактированию с одним или несколькими веществами для обеспечения на ней активных сайтов для химического замещения или физической адсорбции различных химических частиц. McCarthy et al., US Patent Application Serial No.351967, filed May 15, 1989, включ. в качестве ссылки, описывает процессы для окисления поверхности углеродных фибрилл, которые предусматривают контактирование этих фибрилл с окислителем, который включает серную кислоту (Н2SO4) и хлорат калия (КСlO3), при условиях реакции (например, времени, температуре и давлении), достаточных для окисления поверхности фибриллы. Фибриллы, окисленные в соответствии с процессами McCarthy et al., являются неоднородно окисленными, т.е. атомы углерода замещены смесью карбоксильных, альдегидных, кетоновых, фенольных и других карбонильных групп. Фибриллы также окислялись неоднородно обработкой азотной кислотой. International Application PCN/US 94/10168 описывает образование окисленных фибрилл, содержащих смесь функциональных групп. Hoogenvaad M. S. et al. (“Metal Catalysts supported on Novel Carbon Support”, Presented at Sixth International Conference on Scientific Basis for the Preparation of Heterogeneous Catalysts, Brussels, Belgium, September 1994) также нашел выгодным при приготовлении удерживаемых на фибриллах благородных металлов предварительное окисление поверхности фибрилл азотной кислотой. Такая предобработка кислотой является стандартной стадией в приготовлении удерживаемых на углеродных носителях катализаторов – благородных металлов, где, при условии обычных источников такого углерода, она служит настолько же для очистки поверхности от нежелательных материалов, насколько для функционализации ее. В опубликованной работе McCarthy and Bening (Polymer Preprints ACS Div. of Polymer Chem. 30(1), 420 (1990)) приготовили производные окисленных фибрилл для демонстрации того, что эта поверхность содержала множество окисленных групп. Соединения, которые они приготовили, фенилгидразоны, галогенароматические сложные эфиры, соли таллия и т.д., были выбраны из-за их аналитической применимости, вследствие, например, их яркой окраски или проявления некоторых сильных и легко индентифицируемых и дифференцируемых сигналов. Эти частицы являются предпочтительно функционализованными фибриллами, которые в общем имеют формулу 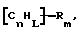 где n обозначает целое число, L обозначает число менее 0,1n, m обозначает число менее 0,5n, каждый из R является одним и тем же и выбран из SО3Н, СООН, NH2, ОН, СНО, CN, COCl, галогенида, COSH, SH, COOR’, SR’, SiR’3, 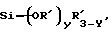 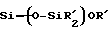 , R”, Li, AIR’2, Hg-X, TlX2 и Mg-X, , R”, Li, AIR’2, Hg-X, TlX2 и Mg-X,Y обозначает целое число, равное или меньшее 3, R’ обозначает алкил, арил, циклоалкил или аралкил, R” обозначает фторалкил, фторарил, фторциклоалкил, фтораралкил или циклоарил, Х обозначает галогенид и Z обозначает карбоксилат или трифторацетат. Атомы углерода Сn представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки по существу постоянного диаметра. Нанотрубки включают трубки, имеющие отношение длины к диаметру более 5 и диаметр менее 0,5 микрон, предпочтительно менее 0,1 микрон. Нанотрубки могут быть также практически цилиндрическими графитовыми нанотрубками, которые по существу не содержат пиролитически отложенного углерода, более предпочтительно нанотрубками, характеризующимися тем, что они имеют проекцию графитовых слоев на ось фибриллы, которая простирается на расстояние по меньшей мере двух диаметров фибриллы, и/или нанотрубками, имеющими цилиндрические графитовые слои, с-оси которых по существу перпендикулярны их цилиндрической оси. Эти композиции являются однородными в том смысле, что каждый из R является одним и тем же. Эти частицы включают также неоднородно замещенные нанотрубки. Они включают композиции формулы 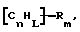 где n, L, m, R и сама нанотрубка аналогичны описанным выше при условии, что каждый из R не содержит кислород или, если каждый из R является кислородсодержащей группой, СООН не присутствует. Функционализованные нанотрубки, имеющие формулу 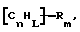 где n, L, m, R и R’ имеют указанные выше значения и атомы углерода являются поверхностными атомами углерода фибриллы типа рыбного скелета, имеющими отношение длины к диаметру более 5, также включены в качестве частиц в данное изобретение. Они могут быть однородно или неоднородно замещенными. Предпочтительно, эти нанотрубки не имеют термического покрытия и имеют диаметры менее 0,5 микрон. В изобретение также включены в качестве частиц функционализованные нанотрубки, имеющие формулу 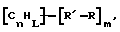 где n, L, m, R’ и R имеют указанные выше значения. Атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки по существу постоянного диаметра. Эти нанотрубки имеют отношение длины к диаметру более 5 и диаметр менее 0,5 микрон, предпочтительно менее 0,1 микрон. Эти нанотрубки могут быть нанотрубками, которые по существу не содержат пиролитически отложенного углерода. Более предпочтительно, эти нанотрубки являются нанотрубками, которые имеют проекцию графитовых слоев на оси фибрилл, которая простирается на расстояние по меньшей мере двух диаметров фибриллы, и/или нанотрубками, имеющими цилиндрические графитовые слои, с-оси которых по существу перпендикулярны их цилиндрической оси. Как в однородно, так и в неоднородно замещенных нанотрубках реагируют поверхностные атомы Сn. Большинство атомов углерода в поверхностном слое графитовой фибриллы, как в графите, являются углеродами базисной плоскости. Углероды базисной плоскости относительно инертны к химической атаке. В дефектных местах, где, например, графитовая плоскость не простирается полностью вокруг фибриллы, имеются атомы углерода, аналогичные краевым атомам углерода графитовой плоскости (см. Urry, Elementary Equilibrium Chemistry of Carbon, Wiley, New York, 1989 в отношении обсуждения краевых углеродов и углеродов базисной плоскости). В дефектных местах могут быть обнажены краевые углероды или углероды базисной плоскости нижних, внутренних слоев нанотрубки. Термин поверхностный углерод включает все углероды, базисной плоскости и краевые, самого верхнего слоя нанотрубки, а также углероды как базисной плоскости, так и/или краевые, более нижних слоев, которые могут быть обнажены в дефектных местах самого верхнего слоя. Краевые углероды являются реакционноспособными и должны содержать какой-либо гетероатом или группу в соответствии с валентностью углерода. Замещенные нанотрубки, описанные выше, могут быть выгодно функционализованы дополнительно. Такие композиции включают композиции формулы 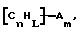 где углероды являются поверхностными углеродами нанотрубки, n, L и m имеют указанные выше значения, А выбран из OY, NHY, 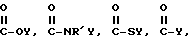 -СR’2-OY, N=Y или С=Y, Y обозначает подходящую функциональную группу белка, пептида, фермента, антитела, нуклеотида, олигонуклеотида, антигена или субстрата фермента, ингибитора фермента или аналога переходного состояния субстрата фермента или выбран из R’-OH, R’-NH2, R’SH, R’CHO, R’CN, R’X, R’SiR’3, 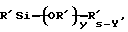 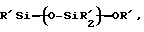 R’-R”, R’-N-CO, R’-R”, R’-N-CO, 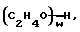 (C3H6O)-wН, (C3H6O)-wН, 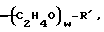 (С3Н6О)w-R’ и R’, (С3Н6О)w-R’ и R’,w обозначает целое число более 1 и менее 200. Атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки по существу постоянного диаметра. Эти нанотрубки включают нанотрубки, имеющие отношение длины к диаметру более 5 и диаметр менее 0,5 микрон, предпочтительно менее 0,1 микрон. Нанотрубки могут быть также по существу цилиндрическими графитовыми нанотрубками, которые по существу не содержат пиролитически отложенного углерода. Более предпочтительно, они характеризуются тем, что они имеют проекцию графитовых слоев на оси фибрилл, которая простирается на расстояние по меньшей мере двух диаметров фибриллы, и/или они состоят из цилиндрических графитовых слоев, с-оси которых по существу перпендикулярны их цилиндрическим осям. Предпочтительно, эти нанотрубки не содержат термического покрытия и имеют диаметры менее 0,5 микрон. Функциональные нанотрубки структуры 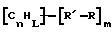 могут быть также функционализованы с образованием композиций, имеющих формулу 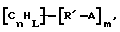 где n, L, m, R’ и А имеют указанные выше значения. Атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки по существу постоянного диаметра. Эти нанотрубки включают нанотрубки, имеющие отношение длины к диаметру более 5 и диаметр менее 0,5 микрон, предпочтительно менее 0,1 микрон. Нанотрубки могут быть также по существу цилиндрическими графитовыми нанотрубками, которые по существу не содержат пиролитически отложенного углерода. Более предпочтительно, они характеризуются тем, что они имеют проекцию графитовых слоев на оси фибрилл, которая простирается на расстояние по меньшей мере двух диаметров фибриллы, и/или имеют цилиндрические графитовые слои, с-оси которых по существу перпендикулярны их цилиндрической оси. Предпочтительно, эти нанотрубки не имеют термического покрытия и имеют диаметры менее 0,5 микрон. Частицы данного изобретения включают также нанотрубки, на которых адсорбированы определенные циклические соединения. Они включают композиции формулы 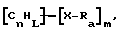 где n обозначает целое число, L обозначает число менее 0,1n, m является меньше 0,5n, а равно 0 или обозначает число менее 10, Х является полициклической ароматической, полигетероциклической ароматической или металлополигетероциклической ароматической частью молекулы и R имеет указанное выше значение. Атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки по существу постоянного диаметра. Эти нанотрубки включают нанотрубки, имеющие отношение длины к диаметру более 5 и диаметр менее 0,5 микрон, предпочтительно менее 0,1 микрон. Нанотрубки могут быть также по существу цилиндрическими графитовыми нанотрубками, которые по существу не содержат пиролитически отложенного углерода, и более предпочтительно нанотрубками, характеризующимися тем, что они имеют проекцию графитовых слоев на оси фибрилл, которая простирается на расстояние по меньшей мере двух диаметров фибриллы, и/или нанотрубками, имеющими цилиндрические графитовые слои, с-оси которых по существу перпендикулярны их цилиндрическим осям. Предпочтительно, эти нанотрубки не имеют термического покрытия и имеют диаметры менее 0,5 микрон. Предпочтительные циклические соединения представляют собой плоские макроциклы, описанные на стр.76 Cotton and Wilkinson, Advanced Organic Chemistry. Более предпочтительными циклическими соединениями для адсорбции являются порфирины и фталоцианины. Адсорбированные циклические соединения могут быть функционализованы. Такие композиции включают соединения формулы 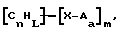 где m, n, L, а, Х и А имеют описанные выше значения и атомы углерода являются поверхностными атомами углерода по существу цилиндрической графитовой нанотрубки, как описано выше. Углеродные фибриллы, функционализованные, как описано выше, могут быть включены в матрикс. Предпочтительно, матрикс представляет собой органический полимер (например, термореактивная смола, такая как эпокси-, бисмалеимидная, полиамидная или полиэфирная смола; термопластичная смола; реакционная, полученная литьем под давлением смола, или эластомер, такой как природный каучук, бутадиенстирольный каучук или цис-1,4-полибутадиен); неорганический полимер (например, полимерный неорганический оксид, такой как стекло), металл (например, свинец или медь) или керамический материал (например, клей Портланда). Без связывания с конкретной теорией функционализованные фибриллы лучше диспергируются в полимерных системах, поскольку свойства их модифицированной поверхности более совместимы с полимером или поскольку модифицированные функциональные группы (в частности, гидроксильные или аминогруппы) связываются непосредственно с полимером при концевых группах. Таким путем полимерные системы, такие как поликарбонаты, полиуретаны, полиэфиры или полиамиды/имиды связываются непосредственно с фибриллами, что позволяет фибриллам легче диспергироваться с улучшенным сцеплением. Функционализованные группы вводят на поверхность углеродных фибрилл путем контактирования углеродных фибрилл с сильным окислителем в течение периода времени, достаточного для окисления поверхности этих фибрилл, и дополнительного контактирования этих фибрилл с реагентом, пригодным для присоединения функциональной группы к окисленной поверхности. Предпочтительно, окислитель состоит из раствора хлората щелочного металла в сильной кислоте. В других вариантах хлорат щелочного металла представляет собой хлорат натрия или хлорат калия. В предпочтительных вариантах в качестве сильной кислоты используют серную кислоту. Периоды времени, достаточные для окисления, составляют от ~0,5 часа до ~24 часов. Сетку углеродных фибрилл получают контактированием углеродных фибрилл с окислителем в течение периода времени, достаточного для окисления поверхности углеродных фибрилл, контактированием поверхностно-окисленных фибрилл с реагентом, пригодным для присоединения функциональной группы к поверхности углеродных фибрилл, и дополнительным контактированием поверхностно-функционализованных фибрилл со сшивающим агентом, эффективным для образования сетки углеродных фибрилл. Предпочтительным сшивающим агентом является полиол, полиамин или поликарбоновая кислота. Функционализованные фибриллы могут быть также в форме жестких сеток фибрилл. Хорошо диспергированная, трехмерная сетка функционализованных кислотой фибрилл может, например, быть стабилизирована сшиванием кислотных групп (межфибрилльных) с полиолами или полиаминами с образованием жесткой сетки. Фибрилльные частицы включают также трехмерные сетки, образованные связанными функционализованными фибриллами данного изобретения. Эти комплексы включают по меньшей мере две функционализованные фибриллы, связанные одним или несколькими линкерами, содержащими прямую связь или химическую часть молекулы. Эти сетки содержат пористую среду с удивительно однородными порами эквивалентного размера. Хотя промежутки между этими фибриллами являются неправильными как по размеру, так и по форме, их можно считать порами и характеризовать при помощи способов, применяемых для характеристики пористых сред. Размер промежутков в таких сетках может регулироваться концентрацией и уровнем диспергирования фибрилл и концентрацией и длинами цепей сшивающих агентов. Комплекс, включающий эти частицы, может быть собран, например, на поверхности электрода, где он возбуждается и индуцируется для электрохемилюминесценции подведением напряжения на электрод. Хотя данное изобретение проводится предпочтительно сбором комплекса в зоне измерения, т. е. на поверхности, при которой его заставляют люминесцировать, изобретение также включает в себя способы, в которых комплекс собирают в зоне измерения и после этого к этой зоне подводят средства или предпринимают иные стадии для индуцирования и измерения люминесценции. Сбор комплекса можно проводить несколькими различными способами, в том числе гравитационным осаждением, фильтрованием, центрифугированием и магнитным притяжением чувствительных к магниту частиц, которые образуют часть комплекса. Некоторые варианты описаны более подробно ниже. Данное изобретение относится также к способу проведения анализа связывания для представляющего интерес аналита, присутствующего в пробе, предусматривающему следующие стадии: (а) образование композиции, содержащей (i) указанную пробу, (ii) вещество для проведения анализа, которое содержит компонент, соединенный с соединением-меткой, способным индуцироваться для люминесценции, и (iii) множество функционализованных графитовых нанотрубок, связанных с веществом для проведения анализа; (b) инкубирование этой композиции с образованием комплекса, который включает в себя функционализованную графитовую нанотрубку и соединение-метку; (c) сбор этого комплекса в зоне измерения; (d) индуцирование соединения-метки в указанном комплексе для люминесценции поверхностным селективным возбуждением и (e) измерение испускаемой люминесценции для измерения присутствия представляющего интерес аналита в пробе. В частности, вышеупомянутый комплекс собирают на поверхности средства для индуцирования люминесценции и измерения этой люминесценции. Этот способ выгодно основан на измерении электрохемилюминесценции, при котором комплекс собирают при поверхности электрода. Данное изобретение относится также к способу проведения анализа связывания для представляющего интерес аналита, присутствующего в пробе, основанному на измерении электрохемилюминесценции на поверхности электрода, предусматривающему следующие стадии: (а) образование композиции, содержащей (i) указанную пробу, (ii) вещество для проведения анализа, которое содержит компонент, соединенный с соединением-меткой, способным индуцироваться для электрохемилюминесценции, и (iii) множество функционализованных графитовых нанотрубок, связанных с веществом для проведения анализа; (b) инкубирование этой композиции с образованием комплекса, который включает в себя функционализованную графитовую нанотрубку и соединение-метку; (c) сбор этого комплекса; (d) приведение этого комплекса в контакт с поверхностью электрода и индуцирование соединения-метки в этом комплексе для люминесценции путем подведения напряжения на электрод и (е) измерение испускаемой люминесценции на поверхности электрода для измерения присутствия представляющего интерес аналита в пробе. Кроме того, данное изобретение относится к способу проведения анализа связывания для представляющего интерес аналита, основанному на измерении электрохемилюминесценции на поверхности электрода, предусматривающему следующие стадии: (а) образование композиции, содержащей (i) указанную пробу, (ii) вещество для проведения анализа, которое содержит компонент, соединенный с соединением-меткой, способным индуцироваться для электрохемилюминесценции, и (iii) множество магниточувствительных суспендированных функционализованных графитовых нанотрубок, связанных с веществом для проведения анализа; (b) инкубирование этой композиции с образованием комплекса, который включает в себя функционализованную графитовую нанотрубку и соединение-метку; (c) сбор этого комплекса путем наложения магнитного поля на графитовые нанотрубки; (d) приведение этого комплекса в контакт с поверхностью электрода и индуцирование соединения-метки в этом комплексе к люминесценции путем подведения напряжения на электрод и (e) измерение испускаемой люминесценции при поверхности электрода для измерения присутствия представляющего интерес аналита в пробе. Наложение магнитного поля заставляет комплекс собираться около поверхности электрода. Кроме того, данное изобретение относится к композиции для использования в качестве реагента в основанном на микрочастицах анализе связывания, содержащей функционализованные графитовые нанотрубки и по меньшей мере один другой компонент, выбранный из группы, включающей: (a) электролит; (b) соединение-метку, содержащее ECL-частицу; (c) представляющий интерес аналит или аналог представляющего интерес аналита; (d) партнер связывания представляющего интерес аналита или его аналога; (e) реакционноспособный компонент, способный реагировать с (с) или (d); (f) восстановитель и (g) усилитель электрохемилюминесцентной реакции, при условии, что никакие два компонента, содержащиеся в любой композиции реагентов, не реагируют друг с другом во время хранения таким образом, что ухудшается их функция в предполагаемом анализе. Этот реагент может содержать чувствительные к магнитному полю графитовые нанотрубки. Данное изобретение относится также к тест-реагенту для анализа, основанного на реакции связывания, и для измерения явления электрохемилюминесценции, содержащему: (a) электролит; (b) множество магниточувствительных функционализованных графитовых нанотрубок, имеющих поверхность, связанную с веществом для проведения анализа, и (с) вещество-метку, имеющее связывающие свойства, причем это вещество-метка включает в себя химическую часть молекулы, имеющую электрохемилюминесцентные свойства. Данное изобретение относится, кроме того, к способу проведения анализа для представляющего интерес аналита, присутствующего в пробе, предусматривающему следующие стадии: (а) образование композиции, содержащей (i) эту пробу и (ii) функционализованную графитовую нанотрубку, соединенную с тест-компонентом, связанным с соединением-меткой, способным индуцироваться для люминесценции, причем указанный компонент представляет собой субстрат представляющего интерес аналита; (b) инкубирование указанной композиции при условиях, позволяющих аналиту расщеплять упомянутый компонент; (c) отделение функционализованной графитовой нанотрубки от композиции; (d) индуцирование соединения-метки для люминесценции и (e) измерение испускаемой люминесценции для измерения присутствия представляющего интерес аналита в пробе. Хотя могут проводиться серийные (периодические) анализы, непрерывные или полу-непрерывные анализы могут проводиться в проточных ячейках. В проточной ячейке твердая фаза остается в измерительной ячейке, тогда как раствор протекает через нее и выходит из ячейки. Если твердая фаза (например, частицы) является более плотной, чем вода, т. е. имеет большую плотность, чем плотность воды (более 1,0 г/мл), то действие силы тяжести на частицы заставляет их падать на дно ячейки. Ячейка может быть сконструирована таким образом, что большая часть пробы содержится в ячейке в колоночном компартменте над рабочим электродом системы ECL. Должно быть обеспечено достаточное время задержки в ячейке, чтобы частицы могли осесть на поверхности электрода перед индуцированием ECL. В другом варианте данного изобретения тест-композиция, содержащая суспендированные фибриллы, имеющие плотность, большую, чем баланс тест-композиции, может быть подвергнута центрифугированию для удаления частиц к зоне измерения, где они затем приводятся в контакт, например, с электродом, для индуцирования электрохемилюминесценции или приводятся непосредственно в контакт с электродом на стадии центрифугирования. В этом варианте измерительная ячейка снабжена средством для быстрого вращения пробы и ограждения пробы. Центробежная сила заставляет фибриллы в пробе перемещаться кнаружи от оси вращения ограждения пробы и собираться на наружной поверхности ограждения пробы. Наружные поверхности такого ограждения пробы могут составлять рабочий электрод измерительной ECL-системы. В третьем варианте фибриллы могут быть удалены фильтрованием из тест-композиции. В этом варианте частицы не должны иметь плотность, большую, чем общая плотность (баланс) тест-композиции. Фибриллы отделяют от раствора и концентрируют протягиванием раствора через фильтр, например, при помощи откачивания и сбора частиц на поверхности фильтра. Эта поверхность фильтра покрыта, например, тонкой металлической пленкой, которая служит в качестве рабочего электрода в системе ECL-детектирования. В другом варианте суспендированные фибриллы являются чувствительными к магниту, например они могут быть парамагнитными или ферромагнитными, и они собираются в измерительной зоне или предпочтительно непосредственно на поверхности электрода наложением магнитного поля на частицы. Измерительная ячейка снабжена магнитом. Магнитное поле этого магнита прилагает к частицам силу, когда они находятся в ячейке для периодического измерения или когда они протекают через проточную ячейку, заставляя их отделяться от массы раствора на поверхность ячейки, которая находится в теснейшей близости к магниту. Если магнит помещен в правильной ориентации и в тесной близости относительно рабочего электрода ECL-системы детектирования, то частицы будут концентрироваться на поверхности рабочего электрода. Несколько различных гетерогенных и гомогенных форм проведения для анализов связывания могут выполняться с использованием описанных выше способов для сбора и концентрирования комплекса на поверхности электрода. В гетерогенном анализе связывания комплекс отделяют от композиции перед измерением люминесценции из метки. В гомогенных анализах не разделяют связанные (с твердой фазой) и несвязанные меченые реагенты. В гомогенном анализе, когда комплекс сконцентрирован на поверхности рабочего электрода, измеряемый сигнал от метки является гораздо большим, чем он был бы в отсутствие стадии сбора. В противоположность этому, сигнал от не находящихся в комплексе меченых реагентов не изменяется. Следовательно, несмотря на присутствие некомплексированных меченых реагентов в измерительной ячейке, сигнал от собранного комплекса является более сильным, чем в анализе без сбора комплекса. В результате процедуры сбора порог детектирования для анализа связывания является значительно улучшенным. В предпочтительном варианте данного изобретения в процедуру гомогенного анализа связывания включена стадия разделения in situ. После накачивания тест-композиции, т.е. пробы, вещества для проведения анализа и частиц, в измерительную ячейку и улавливания комплекса на рабочем электроде через эту ячейку накачивают вторую жидкость, которая не содержит метки или меченых реагентов, проводя тем самым промывку in situ или отделение комплекса от несвязанных компонентов тест-композиции. Эта процедура анализа представляет собой технически гетерогенный анализ связывания. Однако возможность проводить разделение внутри измерительной ячейки является выгодной вследствие того, что она не требует дополнительного разделительного устройства, и эта процедура, как правило, является более быстрой, чем способы внешнего разделения. Гетерогенные анализы связывания проводят с применением данного изобретения путем смешивания компонентов тест-композиции и оставлением их для реагирования в течение заранее определенного периода времени. Затем тест-композицию подвергают стадии разделения, в которой раствор отделяют от частиц. Затем измеряют электрохемилюминесценцию либо из комплекса, либо из раствора. Измерение ECL из комплекса после стадии концентрирования позволяет измерять аналит с лучшей точностью и с более низким порогом детектирования, чем это возможно без концентрирования. Характерные примеры В одном характерном варианте данного изобретения функционализованная фибрилла дополнительно реагирует с авидином (веществом для проведения анализа) для подготовки фибриллы для использования в ECL-анализе. Затем модифицированная таким образом фибрилла реагирует с биотинилированным олигонуклеотидом (веществом для проведения анализа) с образованием комплекса фибрилла-авидин-биотин-олигонуклеотид для использования в анализе с ДНК-зондом. Этот комплекс может быть использован в качестве зонда для олигонуклеотидного, представляющего интерес аналита, который комплементарен этому зонду, в сэндвич-анализе в присутствии второго олигонуклеотида, комплементарного представляющему интерес аналиту, меченного ECL-частью молекулы. Подробное описание изобретения Данное изобретение, а также его другие цели и признаки будут более ясно и полно понятны из следующего описания некоторых предпочтительных вариантов. Данное изобретение широко применимо для представляющих интерес аналитов, которые способны вступать в реакции связывания. Эти реакции включают, например, взаимодействия антиген-антитело, лиганд-рецептор, взаимодействия ДНК и РНК и другие известные реакции. Данное изобретение относится к различным способам и тестам для качественного и количественного детектирования присутствия таких представляющих интерес аналитов во многокомпонентной пробе. Пробы Проба, которая может содержать представляющий интерес аналит, которая может быть в форме твердого вещества, эмульсии, суспензии, жидкости или газа, может быть получена, например, из клеток и происходящих из клеток продуктов, воды, пищевых продуктов, крови, сыворотки, волос, пота, мочи, фекалий, ткани, слюны, масел, органических растворителей или воздуха. Проба может дополнительно содержать, например, воду, ацетонитрил, диметилсульфоксид, диметилформамид, н-метилпирролидон или спирты или их смеси. Аналиты Типичными представляющими интерес аналитами являются целая клетка или поверхностный антиген, субклеточная частица, вирус, прион, вироид, антитело, антиген, гаптен, жирная кислота, нуклеиновая кислота, белок, липопротеин, полисахарид, липополисахарид, гликопротеин, пептид, полипептид, клеточный метаболит, гормон, фармакологический агент, синтетическая органическая молекула, металлоорганическая молекула, транквилизатор, барбитурат, алкалоид, стероид, витамин, аминокислота, сахар, лектин, рекомбинантный или выделенный белок, биотин, авидин, стрептавидин или неорганическая молекула, присутствующая в пробе. Как правило, представляющий интерес аналит присутствует в концентрации 10-3 М или менее, например в такой низкой концентрации, как 10-12 М или ниже. Вещество для проведения анализа Вещество для проведения анализа, которое объединяют с пробой, содержащей представляющий интерес аналит, содержит по меньшей мере одно вещество, выбранное из группы, включающей (i) добавленный представляющий интерес аналит или его аналог, описанные выше, (ii) партнер связывания представляющего интерес аналита или его аналога и (iii) реакционноспособный компонент, описанный выше, способный связываться с (i) или (ii), причем одно из указанных веществ соединено с соединением или частью молекулы, например с ECL-частью, способной индуцироваться для люминесценции. Меченое вещество может быть целой клеткой или поверхностным антигеном, субклеточной частицей, вирусом, прионом, вироидом, антителом, антигеном, гаптеном, липидом, жирной кислотой, нуклеиновой кислотой, полисахаридом, белком, липопротеином, липополисахаридом, гликопротеином, пептидом, полипептидом, клеточным метаболитом, гормоном, фармакологическим агентом, транквилизатором, барбитуратом, алкалоидом, стероидом, витамином, аминокислотой, сахаром, небиологическим полимером (предпочтительно растворимым), лектином, рекомбинантным или выделенным белком, синтетической органической молекулой, металлоорганической молекулой, неорганической молекулой, биотином, авидином или стрептавидином. В одном варианте этот реагент представляет собой электрохемилюминесцентную часть молекулы, конъюгированную с антителом, антигеном, нуклеиновой кислотой, гаптеном, небольшой нуклеотидной последовательностью, олигомером, лигандом, ферментом или биотином, авидином, стрептавидином, Протеином А, Протеином G или их комплексами, или другим вторичным партнером связывания, способным связываться с первичным партнером связывания через белковые взаимодействия. Аналоги представляющего интерес аналита, которые могут быть природными или синтетическими, представляют собой, как правило, соединения, которые имеют связывающие свойства, сравнимые со свойствами аналита, но могут также быть соединениями с более высокой или с более низкой связывающей способностью. Реакционноспособными компонентами, способными связываться с аналитом или его аналогом и/или с его партнером связывания, через которые ECL-частица может быть соединена с аналитом, являются вторичное антитело или белок, такой как Протеин А или Протеин G, или авидин, или биотин, или другой компонент, о котором известно в данной области, что он может вступать в реакции связывания. Метки Предпочтительными ECL-частицами являются хелаты металлов. Металлом такого хелата является любой металл, при котором хелат металла будет люминесцировать при электрохимических условиях, которые налагаются на рассматриваемую реакционную систему. Металлом таких хелатов металлов является, например, металл переходного ряда (такой как переходный металл d-блока) или редкоземельный металл. Металл предпочтительно представляет собой рутений, осмий, рений, иридий, родий, платину, индий, палладий, молибден, технеций, медь, хром или вольфрам. Особенно предпочтительны рутений и осмий. Лиганды, которые связаны с металлом в таких хелатах, являются обычно гетероциклическими или органическими по их природе и играют роль в определении того, является ли данный хелат растворимым в водной среде или в органической или иной неводной среде. Эти лиганды могут быть полидентатными и могут быть замещенными. Полидентатные лиганды включают ароматические и алифатические лиганды. Подходящие ароматические лиганды включают ароматические гетероциклические лиганды. Предпочтительными ароматическими гетероциклическими лигандами являются азотсодержащие, такие как, например, бипиридил, бипиразил, терпиридил и фенантролил. Подходящие заместители включают, например, алкил, замещенный алкил, арил, замещенный арил, аралкил, замещенный аралкил, карбоксилат, карбоксальдегид, карбоксамид, циано, амино, гидрокси, имино, гидроксикарбонил, аминокарбонил, амидин, гуанидин, уреидо, серусодержащие группы, фосфорсодержащие группы и карбоксилатный эфир N-гидроксисукцинимида. Хелат может иметь один или несколько монодентатных лигандов, большое разнообразие которых известно в данной области. Пригодные монодентатные лиганды включают, например, моноксид углерода, цианиды, изоцианиды, галогениды и алифатические, ароматические и гетероциклические фосфины, амины, стильбены и арсины. Примерами пригодных хелатов являются бис[(4,4′-карбоксиметокси)-2,2′-бипиридин] -2-[3-(4-метил-2,2′-бипиридин-4-ил)пропил] -1,3-диоксалан-рутений (II); бис(2,2′-бипиридин)[4-(бутан-1-аль)-4′-метил-2,2′-бипиридин] -рутений (II); бис(2,2′-бипиридин)[4-(4′-метил-2,2′-бипиридин-4′-ил)масляная кислота] -рутений (II); трис(2,2′-бипиридин)-рутений (II); (2,2′-бипиридин)[бис-бис(1,2-дифенилфосфино)этилен] -2-[3-(4-метил-2,2′-бипиридин-4′-ил)пропил]-1,3-диоксолан-осмий (II); бис-(2,2′-бипиридин)[4-(4′-метил-2,2′-бипиридин)бутиламин] -рутений (II); бис(2,2′-бипиридин)[1-бром-4-(4′-метил-2,2′-бипиридин-4-ил)бутан] -рутений (II); бис(2,2′-бипиридин)малеимидогексановая кислота, 4-метил-2,2′-бипиридин-4′-бутиламид-рутений (II). Другие ECL-частицы описаны в РСТ published application US 87/00987 и РСТ published application 88/0394. Функция ECL-частиц заключается в испускании электромагнитного излучения как результата введения в реакционную систему электрохимической энергии. Для того чтобы выполнять это, они должны быть способны стимулироваться до возбужденного энергетического состояния и также быть способны испускать электромагнитное излучение, такое как фотон света, при выходе из этого возбужденного состояния. Хотя и не желая быть связанными теоретическим анализом механизма участия ECL-частицы в электрохемилюминесцентной реакции, мы считаем, что она окисляется введением электрохимической энергии в реакционную систему и затем, через взаимодействие с восстановителем, присутствующим в этой системе, переходит в возбужденное состояние. Это состояние является относительно нестабильным, и хелат металла быстро опускается до более стабильного состояния. При этом хелат выдает электромагнитное излучение, такое как фотон света, которое является детектируемым. Количество хелата металла или другой металлсодержащей ECL-частицы, включенной в систему в соответствии с данным изобретением, будет меняться от системы к системе. Как правило, используемое количество такой частицы является количеством, которое эффективно для получения эмиссии детектируемой и, если желательно, измеряемой количественно, электромагнитной энергии из вышеупомянутой композиции или системы. Детектирование и/или количественное определение представляющего интерес аналита обычно выполняют из сравнения люминесценции из пробы, содержащей представляющий интерес аналит и ECL-частицу, с люминесценцией, испускаемой калибровочным стандартом, содержащим известные количества представляющего интерес аналита и ECL-частицы. Это предполагает гомогенную форму проведения анализа. В гетерогенном режиме перед анализом ECL проводят разделение, обсуждаемое ранее. Как должно быть понятно специалисту с обычной квалификацией в данной области, идентичность и количество металлсодержащей ECL-частицы будет меняться от одной системы к другой в зависимости от преобладающих условий. Пригодная металл-содержащая ECL-частица и достаточное количество ее для получения желаемого результата могут быть определены эмпирически специалистами с обычной квалификацией в данной области на основании этих объяснений без чрезмерного экспериментирования. Графитовые нанотрубки Нанотрубки могут использоваться в качестве твердого носителя для аналитических применений в разнообразных геометриях, в том числе в диспергированном виде, в виде агрегатов, в виде матов или пленок, присоединенных к большим носителям, в том числе гранулам, или в смеси с другим материалом с использованием в виде композиционного материала, например в пористой колонке. Нанотрубки состоят первично из химически модифицируемого графитового углерода. Они обычно имеют диаметры не более 0,1 мкм и отношения диаметра к длине по меньшей мере 5. Как правило, они имеют диаметры 0,01 мкм и длины 1-10 мкм. Функционализованные нанотрубки Предпочтительны функционализованные фибриллы, т.е. фибриллы, поверхности которых однородно или неоднородно модифицированы таким образом, что они имеют связанную с ними функциональную химическую часть молекулы. Поверхности фибрилл могут быть функционализованы реакцией с окисляющими или другими химическими средами. Поверхности фибрилл могут быть однородно модифицированы либо химической реакцией, либо физической адсорбцией частиц, которые сами обладают химической активностью. Поверхности фибрилл могут быть модифицированы, например, окислением и могут быть дополнительно модифицированы реакцией с другими функциональными группами. Поверхности фибрилл могут быть модифицированы спектром функциональных групп таким образом, что фибриллы могут химически реагировать или физически связываться с химическими группами во множестве субстратов, включающих связывающие компоненты в электрохемилюминесцентных анализах. Комплексные структуры фибрилл могут быть получены путем соединения функциональных групп на фибриллах друг с другом рядом способов химии линкеров. Способы химической модификации поверхностей фибрилл и способы физической адсорбции частиц на поверхностях фибрилл описаны, так что в каждом случае можно получить функциональную частицу, связанную с поверхностью фибриллы. Функционализованные нанотрубки, связанные с веществами для проведения анализа Функционализованные фибриллы могут взаимодействовать с различными биомолекулами для подготовки их для использования в ECL-анализах. Различные вещества для проведения реакции, например антитела, рецепторы или другие связывающие частицы, могут взаимодействовать с функционализованными фибриллами для подготовки их для использования в ECL-анализах. Частицы Графитовые нанотрубки могут быть ковалентно или нековалентно присоединены к более крупным твердым фазам, таким как частицы. Эти частицы предпочтительно включают материал из микрочастиц, имеющих диаметр 0,05 мкм – 200 мкм, предпочтительно 0,1 мкм – 100 мкм, наиболее предпочтительно 0,5 мкм – 10 мкм, и поверхностный компонент, способный связываться с аналитом, и/или одно или несколько других веществ, определенных в подпараграфах (b) (i), (b) (ii) или (b) (iii) выше. Например, материал микрочастиц может быть сшитым крахмалом, декстранами, целлюлозой, белками, органическими полимерами, стирольным сополимером, таким как сополимер стирола и бутадиена, сополимер акрилонитрила, бутадиена и стирола, винилацетилакрилатный сополимер или сополимер винилхлорида и акрилата, инертные неорганические частицы, диоксид хрома, оксиды железа, диоксид кремния, смеси диоксида кремния и белковый материал или их смеси. Желательно суспендирование этих частиц в ECL-системе. Тест-среды Для функционирования системы, в которой электрод вводит электрохимическую энергию, необходимо обеспечить электролит, в который погружают электрод и который содержит ECL-частицу. Электролит представляет собой фазу, через которую заряд переносится ионами. Как правило, электролит находится в жидкой фазе и является раствором одной или нескольких солей или других молекул в воде, органической жидкости или смеси органических жидкостей или смесью воды и одной или нескольких органических жидкостей. Однако другие формы электролита также применимы в некоторых вариантах данного изобретения. Например, электролит может быть дисперсией одного или нескольких веществ в жидкости (например, в жидкости, парах или сверхкритической жидкости ) или может быть раствором одного или нескольких веществ в твердом веществе, парах или сверхкритической жидкости. Предпочтительно электролит является раствором соли в воде. Соль может быть предпочтительно солью натрия или солью калия, но включение других катионов также выгодно в некоторых вариантах, если этот катион не препятствует последовательности электролюминесцентного взаимодействия. Анион соли может быть, например, фосфатом, но применение других анионов также допустимо в некоторых вариантах данного изобретения – опять-таки, если выбранный анион не препятствует последовательности электрохемилюминесцентного взаимодействия. Композиция может быть также неводной. Хотя сверхкритические жидкости могут быть выгодно использованы в некоторых случаях, более типично использование электролита, содержащего органическую жидкость в неводной композиции. Подобно водному электролиту неводный электролит также представляет собой фазу, через которую заряд переносится ионами. Обычно это означает, что соль растворена в органической жидкой среде. Примером подходящих органических жидкостей являются ацетонитрил, диметилсульфоксид (ДМСО), диметилформамид (ДМФ), метанол, этанол и смеси двух или более из вышеуказанных веществ. В качестве иллюстрации можно привести соли тетраалкиламмония, такие как тетрафторборат тетрабутиламмония, растворимые в органических жидкостях, которые могут быть использованы с ними для образования неводных электролитов. Электролит, в некоторых вариантах данного изобретения, является забуференной системой. Часто удобны фосфатные буферы. Примерами являются водный раствор фосфата натрия/хлорида натрия и водный раствор фосфата натрия/фторида натрия. Другие тест-компоненты Как описано в РСТ published application US 89/04859 commonly assigned, озаглавленной Electrochemiluminescent Reaction Utilizing Amine-Derived Reductant (Электрохемилюминесцентная реакция с использованием произведенного из амина восстановителя), описание которой включено в качестве ссылки, желательно включать восстановитель, обычно амин или аминную часть молекулы (большей молекулы), который может окисляться и самопроизвольно разрушаться с превращением его в высоковосстанавливающие частицы. Считается, что амин или аминная часть молекулы также окисляется электрохимической энергией, вводимой в реакционную систему. Амин или аминная часть молекулы теряет один электрон и затем депротонируется и сама реаранжируется в сильный восстановитель. Этот восстановитель взаимодействует с окисленной металлсодержащей ECL-частицей и переводит ее в возбужденное состояние, рассмотренное выше. Для выполнения их роли амин или аминная часть молекулы предпочтительно имеет радикал центрального углерода с электроном, который может отдаваться от такого углерода, и альфа-углерод, который может затем действовать в качестве донора протона во время депротонирования для образования восстановителя. Полученный из амина восстановитель обеспечивает необходимый стимул для превращения металлсодержащей ECL-частицы в ее возбужденное состояние, из которого испускается детектируемое электромагнитное излучение. Широкое разнообразие аминов и соответствующих аминных частей молекул может быть использовано в практике данного изобретения. Обычно амин или аминную часть молекулы выбирают в соответствии с рН системы, которая должна быть электрохемилюминсцентно анализирована. Другим важным фактором является то, что амин или аминная часть молекулы должны быть совместимы со средой, в которой они должны функционировать во время анализа, т. е. совместимы с водной или неводной средой, которые могут использоваться в том или ином случае. Еще одним принимаемым во внимание фактором является то, что выбранные амин или аминная часть должны образовать при преобладающих условиях произведенный из амина восстановитель, который является достаточно сильным для восстановления окисленной металлсодержащей ECL-частицы в этой системе. Амины (или соответствующие части молекул, произведенные из них), которые удобно использовать в данном изобретении, являются алифатическими аминами, такими как первичный, вторичный и третичный алкиламины, алкильные группы которых имеют один-три атома углерода, а также замещенными алифатическими аминами. Трипропиламин представляет собой особенно предпочтительный амин, который приводит, образно говоря, к эмиссии электромагнитного излучения особенно высокой интенсивности, что усиливает чувствительность и точность детектирования и количественного определения в вариантах, в которых его используют. Также пригодны диамины, такие как гидразин, и полиамины, такие как поли(этиленимин). Примерами других аминов, пригодных для использования на практике данного изобретения, являются триэтаноламин, триэтиламин, 1,4-диазабицикло-(2.2.2)-октан, 1-пиперидинэтанол, 1,4-пиперазин-бис(этансульфоновая кислота), триизопропиламин и поли(этиленимин). Как правило, металлсодержащая ECL-частица, используемая в данном изобретении, является лимитирующим реакцию компонентом. Поэтому обычно амин или аминную часть молекулы обеспечивают в стехиометрическом избытке относительно нее. Например, амин или аминную часть молекулы используют в концентрации 50-150 мМ. Для применения при рН ~7 часто предпочтительна концентрация 100 мМ. В некоторых вариантах верхний порог концентрации амина или аминной части молекулы определяют максимальной растворимостью амина или аминной части молекулы в среде, в которой его используют, например, в воде. В общем, количество используемых амина или аминной части молекулы такое, которое является достаточным для осуществления превращения окисленной металлсодержащей ECL-частицы в ее возбужденное состояние, в котором происходит люминесценция. Специалисты с обычной квалификацией в данной области, на основании данного описания, смогут определить эмпирически количество амина или аминной части молекулы, которое удобно использовать для конкретной анализируемой системы, без чрезмерного экспериментирования. Как описано в переуступленной РСТ published application US 89/04915, озаглавленной Enhanced Electrochemiluminescent Reaction (Усиленная электрохемилюминесцентная реакция), содержание которой включено в качестве ссылки, анализы данного изобретения желательно проводить в присутствии усилителя, обычно соединения формулы 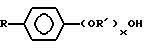 где R обозначает водород или CnHn2+1, R’ обозначает СnН2n, х равно 0-70 и n равно 1-20. В частности, n равно 1-4. Характерным примером является вещество, коммерчески доступное под названием Тритон Х-100 формулы 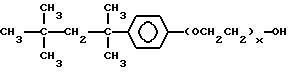 где х равно 9-10, и вещество, доступное коммерчески под названием Тритон N-401 (NPE-40), формулы 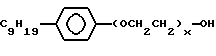 где х равно 40. Усилитель обычно используют в количестве, достаточном для того, чтобы в его присутствии имело место желательное увеличение эмиссии электромагнитного излучения. Как правило, это количество равно 0,01%-5,0%, более конкретно 0,1-1,0% (об/об). Материал этой заявки включен в качестве ссылки. ECL-частицу, включенную в соответствии с данным изобретением, индуцируют для эмиссии электромагнитного излучения стимуляцией ее для переведения в возбужденное состояние. Это выполняют экспонированием системы, в которую включена ECL-частица, электрохимической энергии. Напряжение, при котором происходит окисление ECL-частицы и частиц, образующих сильный восстановитель, зависит от их точных химических структур, а также от таких факторов, как рН системы и характер электрода, используемого для введения электрохимической энергии. Специалистам с обычной квалификацией в данной области хорошо известно, как определить оптимальный потенциал и длину испускаемой волны электрохемилюминесцентной системы. Некоторые предпочтительные способы стимулирования ECL-системы описаны в обычно переуступленной РСТ published application US 89/01814, содержание которой включено в качестве ссылки. Устройство для измерения электрохемилюминесценции Устройство для проведения анализов данного изобретения описано на Фиг.1 и 2. Фиг. 1 описывает предпочтительное ECL-устройство, но способы данного изобретения не ограничиваются применением устройства 10, и могут быть также использованы в других типах ECL-устройств, которые включают рабочий электрод или другую запускающую поверхность для обеспечения электрохимической энергии для запуска электрохемилюминесценции ECL-частицы. Хотя способы данного изобретения можно проводить в статическом или проточном режиме, устройство 10 включает в себя проточную ячейку, которая обеспечивает явные преимущества для многих типов проб, в том числе для проб для анализа связывания. Дальнейшие детали устройства для проведения ECL-анализов данного изобретения описаны в commonly assigned published РСТ applications US 89/04854 и US 90/01370. Устройство 10 включает в себя электрохимическую ячейку 12, измерительное/детектирующее свет устройство 14, которое предпочтительно может быть фотоэлектронным умножителем (ФЭУ), фотодиод, прибор на зарядовых связях, фотографическую пленку или эмульсию или т.п. и насос 16, который предпочтительно является перистальтическим насосом, для обеспечения транспортировки жидкости к ячейке 12, через нее и из нее. Альтернативно, можно использовать насос позитивного вытеснения. Механизм заслонки 18 помещен между ячейкой 12 и ФЭУ 14 и он действует регулируемо для открывания лишь настолько, чтобы экспонировать ФЭУ 14 относительно ячейки 12 во время периодов измерения ECL. Механизм заслонки может быть закрытым, например, во время режима поддержания. В устройство 10 также включен, но не показан на Фиг.1, светонепроницаемый корпус, предназначенный для установления в нем различных компонентов и для загораживания ФЭУ 14 от какого-либо наружного света во время измерений ECL. Сама ячейка 12 включает первый крепежный блок 20, через который проходит входная трубка 22 и выходная трубка 24, которые предпочтительно могут быть изготовлены из нержавеющей стали. Крепежный блок 20 имеет первую, наружную поверхность 26 и вторую, внутреннюю поверхность 28, определяющие одну сторону содержащего пробу объема 30 ячейки 12, в котором ячейка 12 держит очищающие и/или кондиционирующие, и/или измерительные растворы во время соответствующих операций устройства 10. Входная и выходная трубки 22, 24 проходят через крепежный блок 20 от наружной поверхности 26 к внутренней поверхности 28 и открываются в удерживающий пробу объем 30. Второй крепежный блок 32, предпочтительно изготовленный из нержавеющей стали, также имеет первую, наружную поверхность 34 и вторую, внутреннюю поверхность 36. Второй крепежный блок 32 отделен от первого крепежного блока 20 круговой прокладкой 38, предпочтительно изготовленной из Тефлона или другого незагрязняемого материала. Таким образом, наружная поверхность 34 крепежного блока 30 определяет часть второй стороны содержащего пробу объема 30. Прокладка 38 имеет наружную часть 40 и центральное отверстие 42, внутренний край 44 которого определяет боковую стенку содержащего пробу объема 30. Наружная часть 40 заделывает герметически внутреннюю поверхность 28 первого крепежного блока 20 с наружной поверхностью 34 второго крепежного блока 32 для предотвращения выхода какого-либо раствора из содержащего пробу объема 30 между двумя поверхностями 28, 34. Крепежный блок 32 дополнительно имеет центральное отверстие 46, в которое герметично подогнано окно 48 для определения остальной части второй стороны содержащего пробу объема 30 в виде продолжения наружной поверхности 34. Окно 48 образовано из материала, который по существу является прозрачным при длине волны электрохемилюминесцентного света, испускаемого ECL-частицей. Окно 48, следовательно, предпочтительно изготовлено из стекла, пластика, кварца и т.п. Входная трубка 22 пересекает содержащий пробу объем 30 при его первом конце 50 смежно с прокладкой 38, а выходная трубка 24 пересекает содержащий пробу объем 30 при его втором конце 52 смежно с прокладкой 38. Таким образом комбинация входной трубки 22, содержащего пробу объема 30 и выходной трубки 24 обеспечивает непрерывный проточный путь для узкого, по существу ламинарного потока раствора к ячейке 12, через нее и из нее. На внутренней поверхности 28 первого крепежного блока 20 установлена система рабочего электрода 54, которая, в иллюстрируемом варианте, включает первый и второй рабочие электроды 56 и 58. В других вариантах может быть выгодно обеспечен единственный рабочий электрод или только электрод 56 может быть рабочим электродом. Именно на рабочих электродах 56, 58 могут иметь место рассматриваемые электрохимические и ECL реакции. Рабочие электроды 56, 58 представляют собой твердые вольтамперометрические электроды и, следовательно, могут быть изготовлены из платины, золота или других металлов, которые эффективны для этой цели. Проволочные соединения 60, 62, соединенные с рабочими электродами 56, 58 соответственно, проходят через первый крепежный блок 20. Выводы 60, 62 оба соединены с первой клеммой 64 “рабочего электрода” регулятора напряжения 66, показанного на Фиг.2. Регулятор напряжения 66 предпочтительно работает как регулятор (стабилизатор) напряжения для подачи сигналов напряжения к рабочим электродам 56, 58 и необязательно для измерения тока, текущего из него, во время измерения ECL. Альтернативно, соединения 60, 62 могут быть присоединены к отдельным клеммам регулятора напряжения 66 для отдельной операции. Стабилизирующая работа регулятора напряжения 66 выполняется далее через противоэлектрод 68 и, необязательно, но предпочтительно, электрод сравнения 70. В иллюстрируемом варианте крепежный блок 32 изготовлен из нержавеющей стали и противоэлектрод 68 состоит из открытых поверхностей 72, 74 крепежного блока 32. Противоэлектрод 72, 74 и рабочие электроды 56, 58 обеспечивают интерфейс для наложения потенциала на раствор в содержащем пробу объеме 30, который снабжает энергией химические реакции и запускает электрохемилюминесценцию в пробе и/или обеспечивает энергию для очистки и кондиционирования поверхностей ячейки 12. Противоэлектрод 72, 74 соединен проволочным соединением 76 со вторым, “противоэлектродным” зажимом 78 регулятора напряжения 66. Электрод сравнения 70 обеспечивает эталонное (опорное) напряжение, с которым сравнивается напряжение, подаваемое рабочими электродами 56, 58, например +1,2 вольта, против напряжения электрода сравнения. Электрод сравнения 70 предпочтительно помещен в выходной трубке 24 в положении 80 на расстоянии от ячейки 12 и соединен через проволочное соединение 82 с третьим зажимом 84 “электрода сравнения” регулятора напряжения 66. В режиме трех электродов ток не идет через электрод сравнения 70. Электрод сравнения 70 может использоваться в трехэлектродном режиме работы для обеспечения уравновешенного (poised), известного и стабильного напряжения и, следовательно, предпочтительно сконструирован из серебра/хлорида серебра (Ag/AgCl) или представляет собой насыщенный каломельный электрод (НКЭ). Регулятор напряжения 66 может работать в двухэлектродном режиме действия с использованием только рабочего электрода 56 и электрода 58 в качестве противоэлектрода/электрода сравнения. В этом двухэлектродном режиме эксплуатации противоэлектрод/электрод сравнения 58 электрически соединен с клеммами регулятора напряжения 78 и 84 на регуляторе напряжения 66. В этом случае регулятор напряжения 66 работает по существу как батарея. Регулятор напряжения 66 подает сигналы напряжения к рабочему электроду и противоэлектроду 56 и 58 и необязательно измеряет ток, идущий через соответствующие электроды. Электрод сравнения 70 может альтернативно быть так называемым электродом “квази-сравнения”, сконструированным из платины, золота, нержавеющей стали или другого материала, который обеспечивает менее стабильное напряжение, но все еще измеряемое относительно находящегося в контакте раствора. В обоих режимах, в двухэлектродном и трехэлектродном, электрод сравнения 70 или 58 служит для обеспечения опорного сигнала, против которого измеряется напряжение, прилагаемое к рабочим электродам 56. Опорный сигнал уравновешенного напряжения в настоящее время считается более удобным. Регулятор напряжения 66 в его стабилизирующем режиме регулирует разные электроды обеспечением известного напряжения на рабочих электродах 56, 58 относительно электрода сравнения 70, с измерением тока, идущего между рабочими электродами 56, 58 и противоэлектродом 72, 74. Стабилизаторы для этой цели хорошо известны и внутренняя конструкция регулятора напряжения 66 может, следовательно, соответствовать любому из общепринятых, коммерчески доступных стабилизаторов, которые производят вышеуказанные функции и таким образом не являются сами по себе частью данного изобретения. Действительно, устройство 10 может быть сконструировано альтернативно без регулятора внутреннего напряжения 66 и может быть приспособлено таким образом, чтобы быть соединенным с наружным стабилизатором, который регулируется отдельно для обеспечения требуемых сигналов напряжения к электродам 56, 58, 72, 74 и 70. Эти сигналы напряжения, прилагаемые особым образом, как описано ниже, обеспечивают воспроизводимые первоначальные условия для поверхностей рабочих электродов 56, 58 и предпочтительно для поверхностей ячейки 12 в целом, что является признаком, значительно способствующим улучшению точности в измерениях ECL. Насос 16 предпочтительно помещен при выходной трубке 24 для “втягивания” раствора из объема с пробой в направлении стрелки А во входную трубку 22. Этот раствор будет течь через входную трубку, содержащий пробу объем 30 и выходную трубку 24 мимо электрода сравнения 70 и из трубки в направлении стрелки В. Альтернативно, насос 16 может быть помещен при входной трубке 22 для “вталкивания” раствора через устройство 10. Альтернативно, тот же самый путь потока через входную трубку 22, содержащий пробу объем 30 и выходную трубку 24 используют для всех растворов и жидкостей, которые проходят через ячейку 12, посредством чего каждая жидкость выполняет гидродинамическое очищающее действие, выгоняя предшествующую жидкость из ячейки 12. Насос 16 может регулироваться для временной приостановки его действия для удерживания конкретного раствора в ячейке 12 в течение любого периода времени. Проточная конструкция устройства 10 позволяет рабочим электродам находиться при приложенном вариабельном напряжении или удерживаться непрерывно при предэксплутационном потенциале при непрерывном контактировании с одним или несколькими растворами, без доступа воздуха к рабочим электродам 56, 58 (или противоэлектроду и электроду сравнения 72, 74, 70). Экспонирование с воздухом, которое размыкает цепь к электроду сравнения 70, делает возможными произвольные флуктуации напряжения, которые нарушают воспроизводимость поверхностных условий на рабочих электродах 56, 58. Проточная конструкция делает возможным быстрое чередование между стадиями приведения в исходное положение, в которых система электродов 54 очищается и кондиционируется, и стадиями измерения, в которых одна или несколько измерительных форм сигнала или разверток запускают (инициируют) ECL. Данное изобретение относится также к композициям реагентов. В широком смысле, композиции реагентов могут быть любым одним из компонентов тест-систем данного изобретения, т.е. (а) электролитом, (b) соединением-меткой, содержащим ECL-часть молекулы, (с) функционализованными фибриллами, с которыми связано вещество для проведения анализа, необязательно связанными с частицами, в том числе чувствительными в магнитном отношении частицами, (d) представляющим интерес аналитом или аналогом представляющего интерес аналита, (е) партнером связывания представляющего интерес аналита или его аналога, (f) химически активным компонентом, способным взаимодействовать с (d) или (е), (g) восстановителем или (h) усилителем реакции электрохемилюминесценции. Реагенты могут быть объединены друг с другом для удобства использования, т.е. могут быть приготовлены двухкомпонентные, трехкомпонентные и многокомпонентные (с большим числом компонентов) смеси, при условии, что эти компоненты не являются реакционноспособными во время хранения так, что они ухудшают их функцию в предполагаемом анализе. Желательно, чтобы эти реагенты были в виде двухкомпонентных или многокомпонентных смесей, которые содержат частицы, а также один или несколько других компонентов. Данное изобретение относится также к наборам. Наборы могут включать в себя сосуды, содержащие один или несколько компонентов (а)-(h), приведенных выше, или эти наборы могут содержать сосуды, содержащие одну или несколько композиций реагентов, описанных выше, содержащих смеси этих компонентов, все для использования в способах и системах анализа данного изобретения. СПОСОБЫ ФУНКЦИОНАЛИЗАЦИИ ФИБРИЛЛ Функционализованные фибриллы данного изобретения могут быть непосредственно получены сульфонированием, электрофильным присоединением к деоксигенированным поверхностям фибрилл или металлированием. При использовании выращенных в угольной дуге нанофибрилл они могут нуждаться в интенсивной очистке перед функционализацией. Ebbesen et al. (Nature 367 519 (1994)) дает процедуру для такой очистки. Предпочтительно, углеродные фибриллы обрабатывают перед контактированием их с функционализирующим агентом. Такая обработка может включать диспергирование фибрилл в растворителе. В некоторых случаях углеродные фибриллы могут быть затем отфильтрованы и высушены перед дальнейшим контактом. 1. СУЛЬФОНИРОВАНИЕ Предшествующие способы описаны в March J. Р., Advanced Organic Chemistry, 3rd Ed. Wiley, New York 1985; House H., Modern Synthetic Reactions, 2nd Ed., Benjamin/Cummings, Menlo Park, CA 1972. Активированные С-Н (в том числе ароматические С-Н) связи могут быть сульфонированы при помощи дымящей серной кислоты (олеума), которая представляет собой раствор концентрированной серной кислоты, содержащей до 20% SО3. Общепринятым способом является способ сульфонирования via жидкой фазы при Т~80oС с применением олеума; однако активированные С-Н-связи могут быть также сульфонированы с применением SО3 в инертных апротонных растворителях или SО3 в паровой фазе. Реакция представляет собой: -С-H+SO3–>-C-SO3H Сверхреакция приводит к образованию сульфонов в соответствии с реакцией: 2-C-H+SO3–>-C-SO2-C-+H2O Получение А Активация связей С-Н с применением серной кислоты Реакции проводили в газовой фазе и в растворе без какого-либо значимого различия в результатах. Реакцию в газовой фазе проводили в горизонтальном кварцевом трубчатом реакторе, нагреваемом печью Линдберга. Многогорлую колбу, содержащую 20% SO3 в концентрированной Н2SO4, снабженную трубками входа/выхода, использовали в качестве источника SО3. Взвешенную пробу фибрилл (BN и СС) в фарфоровой лодочке помещали в однодюймовую трубку, снабженную впускным отверстием для газа; выпускное отверстие соединяли с барботерным улавливателем концентрированной H2SO4. Аргон продували через реактор в течение 20 минут для удаления всего воздуха и пробу нагревали до 300oС в течение 1 часа для удаления оставшейся влаги. После высушивания температуру доводили до температуры реакции в атмосфере аргона. Когда желательная температура стабилизировалась, источник SО3 соединяли с реакторной трубкой и ток аргона использовали для внесения паров SО3 в кварцевый трубчатый реактор. Реакцию проводили в течение желательного периода времени при желательной температуре, после чего реактор охлаждали при продувании аргоном. Затем фибриллы сушили при 90oС при вакууме 5″ рт. ст. с получением прироста сухого веса. Содержание сульфоновой кислоты (-SО3Н) определяли реакцией с 0,100 н. NaOH и обратным титрованием 0,100 н. НСl с применением рН 6,0 в качестве конечной точки. Реакцию в жидкой фазе проводили в концентрированной серной кислоте, содержащей 20% SO3, в многогорлой колбе на 100 мл, снабженной термометром/терморегулятором и магнитной мешалкой. Суспензию фибрилл в концентрированной H2SO4 (50) помещали в колбу. Раствор олеума (20 мл) предварительно нагревали до -60oС перед добавлением в реактор. После реакции кислую суспензию выливали на раздробленный лед и разбавляли немедленно 1 л деионизованной (ДИ) воды. Твердые вещества отфильтровывали и промывали интенсивно ДИ-водой до тех пор, пока рН эффлюента не переставал изменяться. Фибриллы сушили при 100oС при вакууме 5″ рт. ст. Вследствие потерь при переносе для фильтрования точные увеличения в весе нельзя было получить. Результаты представлены в Таблице I. Не было значимого различия в содержании сульфоновой кислоты при реакции в паровой фазе или в жидкой фазе. Наблюдали температурный эффект. Более высокая температура реакции (паровая фаза) дает более высокие количества сульфонов. В 118-61В, увеличение веса 4,2% согласовалось с содержанием сульфоновой кислоты (теоретическое содержание было 0,51 мэкв/г). Опыты 60А и 61А имели слишком высокое увеличение в весе, чтобы относить его только к содержанию сульфоновой кислоты. Поэтому было сделано предположение, что были образованы также приемлемые количества сульфонов. 2. Присоединения к не содержащим оксидов поверхностям фибрилл Предшествующие способы описаны в Urry G., Elementary Equilibrium Chemistry of Carbon, Wiley, New York, 1989. Поверхностные углероды в фибриллах ведут себя подобно графиту, т.е. они размещены гексагональными слоями, содержащими как углероды базисной плоскости, так и краевые углероды. В то время как углероды базисной плоскости относительно инертны к химической атаке, краевые углероды являются реакционноспособными и должны содержать какой-либо гетероатом или группу в соответствии с валентностью углерода. Фибриллы также имеют дефектные сайты поверхности, которые являются в основном краевыми углеродами и содержат гетероатомы или группы. Наиболее обычными гетероатомами, присоединенными к углеродам поверхности, являются водород, преобладающий газообразный компонент во время изготовления; кислород, вследствие его высокой реакционной способности и вследствие того, что его следов очень трудно избежать; Н2O, которая всегда присутствует благодаря катализатору. Пиролиз при 1000oС в вакууме будет деоксигенировать эту поверхность в комплексной реакции с невыясненным механизмом, но с известной стехиометрией. Продуктами являются СО и СО2 в соотношении 2: 1. Полученная поверхность фибриллы содержит радикалы в размещении C1-C4, которые очень реакционноспособны в отношении активированных олефинов. Эта поверхность является стабильной в вакууме или в присутствии инертного газа, но сохраняет ее высокую химическую активность, пока она экспонируется с реакционноспособным газом. Таким образом, фибриллы могут быть пиролизованы при 1000oС в вакууме или в инертной атмосфере, охлаждены при тех же самых условиях и могут взаимодействовать с подходящей молекулой при более низкой температуре с образованием стабильной функциональной группы. Типичными примерами являются: 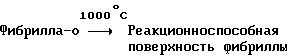 (RFS)+2CO+CO2 затем: 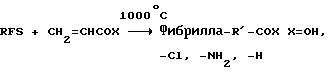 RFS+Малеиновый ангидрид–>Фибрилла-R'(СООН)2 RFS+Цианоген–>Фибрилла-CN RFS+СН2=СН-СН2Х–>Фибрилла R’СН2Х, Х=-NН2, -ОН, -галоген RFS+Н2О–>Фибрилла=О (хиноидальная) RFS+СН2=СНСНО–>Фибрилла-R’СНО (альдегидная) RFS+СН2=CH-CN–>Фибрилла-R’ CN, где R’ обозначает углеводородный радикал (алкил, циклоалкил и т. д.) Получение В Получение функционализованньхх фибрилл реакцией акриловой кислоты с не содержащими оксидов поверхностями фибрилл Один грамм фибрилл BN в фарфоровой лодочке помещают в горизонтальную однодюймовую кварцевую трубку, снабженную термопарой, и помещают в трубчатую печь Линдберга. Концы снабжены входным/выходным отверстиями для газа. Трубку продувают сухим деоксигенированным аргоном в течение 10 минут, после чего температуру печи повышают до 300oС и поддерживают в течение 30 минут. После этого при непрерывном токе аргона температуру повышают с приращениями в 100 до 1000oС и поддерживают на этом уровне в течение 16 часов. В конце этого периода времени трубку охлаждают до комнатной температуры при пропускании аргона. Затем ток аргона шунтируют для прохождения через многогорлую колбу, содержащую неразбавленную очищенную акриловую кислоту при 50oС и снабженную входным/выходным отверстиями для газа. Ток паров акриловой кислоты/аргона продолжают при комнатной температуре в течение 6 часов. В конце этого периода времени оставшуюся непрореагировавшую акриловую кислоту удаляют, сначала выдуванием аргоном, затем сушкой в вакууме при 100oС при вакууме <5″ рт. ст. Содержание карбоновой кислоты определяют реакцией с избытком 0,100 н. NaOH и обратным титрованием 0,100 н. НС1 до конечной точки при рН 7,5. Получение С Получение функционализованных фибрилл реакцией акриловой кислоты с не содержащими оксидов поверхностями фибрилл Процедуру повторяют аналогично вышеописанной процедуре за исключением того, что пиролиз и охлаждение проводят при вакууме 10-4 торр. Очищенные пары акриловой кислоты разбавляют аргоном, как в предыдущей процедуре. Получение D Получение функционализованных фибрилл реакцией малеиновой кислоты с не содержащими оксидов поверхностями фибрилл Процедуру повторяют, как в Получении В, за исключением того, что реагентом при комнатной температуре является очищенный малеиновый ангидрид (MAN), который подают в реактор путем прохождения газа аргона через баню с расплавленным MAN при 80oС. Получение Е Получение функционализованных фибрилл реакцией акрилоилхлорида с не содержащими оксидов поверхностями фибрилл Процедуру повторяют, как в Получении В, за исключением того, что реагентом при комнатной температуре является очищенный акрилоилхлорид, который подают в реактор путем прохождения аргона над неразбавленным акрилхлоридом при 25oС. Содержание галогенангидрида определяют реакцией с избытком 0,100 н. NaOH и обратным титрованием 0,100 н. НСl. Пиролиз фибрилл в вакууме деоксигенирует поверхность фибрилл. В аппарате TGA пиролиз при 1000oС либо в вакууме, либо в токе очищенного Аr дает среднюю потерю веса 3% для трех проб фибрилл BN. Анализ газовой хроматографией обнаружил только СО и СО2 в соотношении ~2:1 соответственно. Полученная поверхность является очень реакционноспособной, и активированные олефины, такие как акриловая кислота, акрилоилхлорид, акриламид, акролеин, малеиновый ангидрид, аллиламин, аллиловый спирт или аллилгалогениды будут реагировать даже при комнатной температуре с образованием чистых продуктов, содержащих только функциональную группу, связанную с активированным олефином. Таким образом, поверхности, содержащие только карбоновые кислоты, доступны с применением реакции с акриловой кислотой или малеиновым ангидридом; поверхности только с галогенангидридом с применением реакции с акрилоилхлоридом; только с альдегидом из акролеина; только с гидроксилом из аллилового спирта; только с амином из аллиламина и только с галогенидом из аллилгалогенида. МЕТАЛЛИРОВАНИЕ Известные способы представлены в March, Advanced Organic Chemistry, 3rd ed., p. 545. Ароматические связи С-Н могут быть металлированы разнообразными металлоорганическими реагентами с образованием связей углерод-металл (С-М). М обычно представляет собой Li, Be, Mg, Al или Тl; однако могут быть также использованы другие металлы. Самой простой реакцией является простое замещение водорода в активированных ароматических соединениях: 1. Фибрилла-Н+R-Li–>Фибрилла-Li+RH Эта реакция может требовать дополнительно сильного основания, такого как трет-бутоксид калия или хелатирующие диамины. Необходимы апротонные растворители (парафины, бензол). 2. Фибрилла-Н+АlR3–>Фибрилла-АlR2+RH 3. Фибрилла-Н+Тl(ТFА)3–>Фибрилла-Тl(TFA)2+HTFA TFA=трифторацетат HTFA=трифторуксусная кислота Металлированные производные являются примерами первичных один раз функционализованных фибрилл. Однако они могут взаимодействовать дополнительно с образованием других первичных один раз функционализованных фибрилл. Некоторые реакции могут проводиться последовательно в одном и том же аппарате без выделения промежуточных продуктов. 4. Фибрилла-М+O2–>Фибрилла-ОН+МО, М=Li, Al 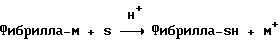 Фибрилла-М+Х2–>Фибрилла-Х+MX, Х=галоген 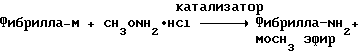 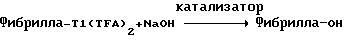 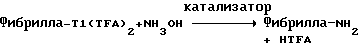 Фибрилла-Тl(ТFA)2 + вод. KCN–>Фибрилла-CN+TlTFA+KTFA Фибрилла-CN+Н2–>Фибрилла-СН2-NН2 Получение F Получение фибриллы-Li Один грамм фибрилл СС помещают в фарфоровую лодочку и вставляют в однодюймовый кварцевый трубчатый реактор, который закрывают в трубчатой печи Линдберга. Концы трубки снабжены входным/выходным отверстиями для газа. При непрерывном токе Н2 фибриллы нагревают до 700oС в течение 2 часов для превращения любых оксигенатов поверхности в связи С-Н. Затем реактор охлаждают до комнатной температуры при прохождении Н2. Гидрированные фибриллы переносят сухим деоксигенированным гептаном (с LiAlH4) в однолитровую многогорлую круглодонную колбу, снабженную системой продувания очищенным аргоном, для удаления всего воздуха и поддержания инертной атмосферы, холодильником, магнитной мешалкой и резиновой перегородкой, через которую жидкости могут подаваться при помощи шприца. В атмосфере аргона шприцом добавляют 2% раствор, содержащий бутиллитий в гептане и суспензию перемешивают при осторожном нагревании с обратным холодильником в течение 4 часов. В конце этого периода времени фибриллы отделяют гравитационным фильтрованием в атмосфере аргона в боксе с перчатками и промывают несколько раз на фильтре сухим деоксигенированным гептаном. Фибриллы переносят в круглодонную колбу на 50 мл, снабженную запорным краном и сушат при вакууме 10-4 торр при 50o С. Концентрацию лития определяют реакцией пробы фибрилл с избытком 0,100 н. НСl в ДИ-воде и обратным титрованием 0,100 н. NaOH до конечной точки при рН 5,0. Получение G Получение фибриллы-Тl(TFA)2 Один грамм фибрилл СС гидрируют, как в Получении Е, и загружают в многогорлую колбу с HTFA, которую дегазируют повторяющимся продуванием сухим аргоном. В колбу через резиновую перегородку добавляют 5% раствор 5 ммоль Tl(TFA)2 в HTFA и суспензию перемешивают при осторожном нагревании с обратным холодильником в течение 6 часов. После реакции фибриллы собирают и сушат, как в Получении А. Получение Н Получение фибриллы-ОН (оксигенированного производного, содержащего только функциональную группу ОН) Полграмма литированных фибрилл, полученных в Получении F, переносят сухим деоксигенированным гептаном в перчаточном боксе с атмосферой аргона в одногорлую колбу на 50 мл, снабженную запорным краном и стержнем для магнитной мешалки. Колбу вынимают из перчаточного бокса и перемешивают на магнитной мешалке. Затем запорный кран открывают для доступа воздуха и суспензию перемешивают в течение 24 часов. В конце этого периода времени фибриллы отделяют фильтрованием, промывают водным МеОН и сушат при 50oС в вакууме 5″ рт. ст. Концентрацию ОН-групп определяют реакцией со стандартизованным раствором уксусного ангидрида в диоксане (0,252 М) при 80oС для превращения ОН-групп в ацетатные эфиры с высвобождением 1 эквивалента уксусной кислоты на 1 моль прореагировавшего ангидрида. Общее содержание кислоты, свободной уксусной кислоты и непрореагировавшего уксусного ангидрида, определяют титрованием 0,100 н. NaOH до конечной точки при рН 7,5. Получение I Получение фибриллы-NH2 Один грамм таллированных фибрилл получают, как в Получении G. Эти фибриллы суспендируют в диоксане и добавляют 0,5 г трифенилфосфина, растворенного в диоксане. Суспензию перемешивают при 50oС в течение нескольких минут, после чего добавляют при 50oС газообразный аммиак в течение 30 минут. Затем фибриллы отделяют фильтрованием, промывают в диоксане, затем в ДИ-воде и сушат при 80oС при вакууме 5″ рт. ст. Концентрацию амина определяют реакцией с избытком уксусного ангидрида и обратным титрованием свободной уксусной кислоты и непрореагировавшего ангидрида 0,100 н. NaOH. 4. ПРОИЗВОДНЫЕ ПОЛИЦИКЛИЧЕСКИХ АРОМАТИЧЕСКИХ, ПОЛИГЕТЕРОЦИКЛИЧЕСКИХ АРОМАТИЧЕСКИХ И ПЛОСКИХ МАКРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ Графитовые поверхности фибрилл делают возможной физическую адсорбцию ароматических соединений. Притяжение происходит через Вандерваальсовы силы. Эти силы являются значительными между многокольцевыми гетероциклическими ароматическими соединениями и углеродами базисной плоскости графитовых поверхностей. Десорбция может происходить при условиях, в которых возможна конкурентная поверхностная адсорбция, или когда адсорбат обладает высокой растворимостью. Получение J Адсорбция порфиринов и фталоцианинов на фибриллы Предпочтительными соединениями для физической адсорбции на фибриллах являются производные порфиринов или фталоцианинов, которые, как известно, сильно адсорбируются на графитовой или углеродной саже. Некоторые соединения являются доступными, например тетракарбоновая кислота-порфирин, кобальт(II)-фталоцианин или дилитийфталоцианин. Два последние могут быть превращены в производные в форме карбоновой кислоты. Загрузочная способность порфиринов или фталоцианинов может быть определена обесцвечиванием растворов при их добавлении с приращениями. Глубокие цвета растворов (темно-розовый для тетракарбоновой кислоты-порфирина в МеОН, темный сине-зеленый для Со(II)- или дилитийфталоцианина в ацетоне или пиридине) отбрасываются, так как эти молекулы удаляются адсорбцией на черную поверхность фибрилл. Загрузочные способности оценивали по этому способу и наличие этих производных рассчитывали из их приблизительных измерений (~140 кв. ангстрем). Для средней площади поверхности для фибрилл 250 м2/г максимальная загрузка будет ~0,3 ммоль/г. Тетракарбоновую кислоту-порфирин анализировали титрованием. Целостность адсорбции испытывали высвобождением красителя в водных системах при температуре окружающей среды и повышенных температурах. Суспензии фибрилл сначала смешивали (в смесителе Уоринга) и перемешивали во время загрузки. Часть суспензий обрабатывали ультразвуком, после того как краска больше не выделялась, но безуспешно. После загрузки, Опыты 169-11, -12, -14 и -19-1 (см. Таблицу II), промывали в том же самом растворителе для удаления окклюдированного пигмента. Все давали непрерывный слабый оттенок в промывном эффлюенте, так что было трудно точно определить точку насыщения. Опыты 168-18 и -19-2 использовали рассчитанные количества пигмента для загрузки и промывались лишь очень слабо после загрузки. Тетракарбоновая кислота-порфирин (из ацетона) и Со-фталоцианин (из пиридина) загружались на фибриллы для дальнейшей характеристики (Опыты 169-18 и -12-2 соответственно). Анализы тетракарбоновой кислоты-порфирина Добавление избытка основания (рН 11-12) вызвало немедленное розовое окрашивание в титрующейся суспензии. Хотя это не мешало фильтрованию, это показало, что при высоком рН порфирин десорбируется. Концентрацию карбоновой кислоты определяли обратным титрованием избытка NaOH с рН 7,5 в качестве конечной точки. Титрование давало загрузку 1,10 мэкв/г кислоты, что эквивалентно 0,275 мэкв/г порфирина. Анализ кобальт- или дилитий-фталоцианина Концентрации этих адсорбатов оценивали только на основании экспериментов с обесцвечиванием. Точку, в которой сине-зеленый оттенок не выцветал после 30 минут, брали как точку насыщения. Ряд замещенных полициклических ароматических или полигетероциклических ароматических соединений адсорбировали на поверхностях фибрилл. Для адгезии число ароматических колец должно было быть большим чем два, на кольца/боковую функциональную группу. Таким образом, замещенные антрацены, фенантрены и т. д. , содержащие три конденсированных кольца, или полифункциональные производные, содержащие четыре или более конденсированных колец, могут быть использованы вместо производных порфирина или фталоцианина. Подобно этому могут быть использованы замещенные ароматические гетероциклы, такие как хинолины, или множественно замещенные гетероароматические соединения, содержащие четыре или более колец. Таблица II суммирует результаты экспериментов по определению загрузки для трех производных порфирина/фталоцианина. 5. ОКИСЛЕНИЕ ХЛОРАТОМ ИЛИ АЗОТНОЙ КИСЛОТОЙ Литература по окислению графита сильными окислителями, такими как хлорат калия в концентрированной серной кислоте или азотная кислота, включает R. N. Smith, Quarterly Review 13, 287 (1959); M. J. D. Chem. Rev., 60, 267 (1960)). Как правило, атакуются краевые углероды (в том числе дефектные сайты) с образованием смесей карбоновых кислот, фенолов и других оксигенированных групп. Этот механизм является сложным, включающим радикальные реакции. Получение К Получение функционализованных карбоновой кислотой фибрилл с применением хлората Пробу фибрилл СС суспендировали в концентрированной H2SO4 смешиванием шпателем и затем переносили в реакционную колбу, снабженную входным/выходным отверстиями для газа и верхней мешалкой. При перемешивании и при медленном токе аргона загрузку NaClO3 добавляли порциями при комнатной температуре на протяжении опыта. Пары хлора образовывались во время всего хода опыта и выносились из реактора в улавливатель с водным раствором NaOH. В конце опыта суспензию фибрилл выливали на раздробленный лед и фильтровали в вакууме. Фильтровальный осадок переносили затем в камеру Сокслета и промывали в экстракторе Сокслета ДИ-водой со сменой свежей воды каждые несколько часов. Промывание продолжали до тех пор, пока проба фибрилл при добавлении к свежей ДИ-воде не переставала изменять рН воды. Затем фибриллы отделяли фильтрованием и сушили при 100oС при вакууме 5″ рт. ст. в течение ночи. Содержание карбоновой кислоты определяли реакцией пробы с избытком 0,100 н. NaOH и обратным титрованием 0,100 н. НСl до конечной точки рН 7,5. Результаты представлены в Таблице III. Получение L Получение функционализованных карбоновой кислотой фибрилл с применением азотной кислоты Взвешенную пробу фибрилл суспендировали с азотной кислотой подходящей концентрации в многогорлой индентированной реакционной колбе со связанным дном, снабженной верхней мешалкой и водным холодильником. При постоянном перемешивании температуру доводили до нужного уровня и реакцию проводили в течение указанного времени. Коричневый дым выделялся вскоре после превышения температуры 70oС независимо от концентрации кислоты. После реакции суспензию выливали на раздробленный лед и разбавляли ДИ-водой. Суспензию фильтровали и избыток кислоты удаляли промыванием в экстракторе Сокслета с заменой воды в резервуаре свежей водой каждые несколько часов, пока суспендированная проба не переставала изменять рН ДИ-воды. Фибриллы сушили при 100oС при вакууме 5″ рт. ст. в течение ночи. Взвешенную порцию фибрилл подвергали взаимодействию со стандартным 0,100 н. NaOH и содержание карбоновой кислоты определяли обратным титрованием с применением XPS. Диспергируемость в воде испытывали при 0,1 мас. % смешиванием в смесителе Уоринга при высокой скорости в течение 2 минут. Результаты суммированы в Таблице IV. 6. ВТОРИЧНЫЕ ПРОИЗВОДНЫЕ ФУНКЦИОНАЛИЗОВАННЫХ ФИБРИЛЛ Функционализованные карбоновой кислотой фибриллы Число вторичных производных, которые могут быть получены только из карбоновой кислоты, является по существу неограниченным. Спирты или амины легко связываются с кислотой с образованием стабильных эфиров или амидов. Если спирт или амин является частью ди- или полифункциональной молекулы, то связь через О- или NH- оставляет другие функциональности в виде боковых групп. Типичные примеры вторичных реагентов представлены в Таблице А. Эти реакции могут проводиться с применением любых способов, разработанных для этерификации или аминирования карбоновых кислот со спиртами или аминами. Из них использовали способы Н. A. Staab, Angew. Chem. Internal. Edit. , (1), 351 (1962), с применением N,N’-карбонилдиимидазола (CDI) в качестве ацилирующего агента для эфиров или амидов и G. W. Anderson et al., J. Amer. Chem. Soc., 86, 1839 (1964), с применением N-гидроксисукцинимида (NHS) для активации карбоновых кислот для амидирования. Получение М Получение вторичных производных функционализованных фибрилл N,N’-Карбонилдиимидазол Для этой процедуры необходимы чистые, сухие апротонные растворители (например, толуол или диоксан). Стехиометрические количества реагентов являются достаточными. Для эфиров карбоновую кислоту подвергают взаимодействию в инертной атмосфере (аргон) в толуоле со стехиометрическим количеством CDI, растворенным в толуоле, при комнатной температуре в течение 2 часов. Во время этого времени выделяется СО2. После двух часов добавляют спирт вместе с каталитическими количествами этоксида Na и реакцию продолжают при 80oС в течение 4 часов. Для нормальных спиртов выходы являются количественными. Реакции представляют собой: 1. R-COOH+Im-CO-Im–>R-CO-Im+HIm+СО2 Im=имидазолид, НIm=имидазол  Амидирование аминов происходит без катализа при комнатной температуре. Первая стадия в этой процедуре является той же самой. После выделения СО2 добавляют стехиометрическое количество амина при комнатной температуре и реакцию проводят в течение 1-2 часов. Реакция является количественной. Реакция представляет собой: 3. R-CO-Im+R’-NH2–>R-CO-NHR+HIm N-Гидроксисукцинимид Активация карбоновых кислот для аминирования первичными аминами происходит через N-гидроксисукцинамиловый эфир; карбодиимид используют для связывания воды, выделяющейся в виде замещенной мочевины. Затем NHS-эфир превращают при комнатной температуре в амид реакцией с первичным амином. Реакции представляют собой: 1. R-СООН+NHS+CDI–>R-CONHS+замещ. мочевина 2. R-CNHS+R’-NH2–>R-СО-NHR’ Силилирование Триалкилсилилхлориды или триалкилсиланолы взаимодействуют непосредственно с кислотным Н в соответствии с: R-СООН+Cl-SiR’3–>R-СО-SiR’3+НСl Небольшие количества диаза-1,1,1-бициклооктана (DABCO) используют в качестве катализатора. Подходящими растворителями являются диоксан и толуол. Получение N Получение эфир/спиртовых производных иэ функционализованных карбоновой кислотой фибрилл Функционализованные карбоновой кислотой фибриллы получали, как в Получении К. Содержание карбоновой кислоты было 0,75 мэкв/г. Фибриллы взаимодействовали со стехиометрическим количеством CDI в инертной атмосфере с толуолом в качестве растворителя при комнатной температуре до тех пор, пока не прекращалось выделение СО2. После этого суспензия взаимодействовала при 80oС с 10-кратным молярным избытком полиэтиленгликоля (MB 600) и небольшим количеством NaOEt в качестве катализатора. После двух часов реакции фибриллы отделяли фильтрованием, промывали толуолом и сушили при 100oС. Получение О Получение амид/аминных производных из функционализованных карбоновой кислотой фибрилл (177-041-1) 0,242 г окисленных хлоратом фибрилл (0,62 мэкв/г) суспендировали в 20 мл безводного диоксана с перемешиванием в круглодонной колбе на 100 мл с пробкой из серума. Добавляли 20-кратный молярный избыток N-гидроксисукцинимида (0,299 г) и давали ему раствориться. Затем добавляли 20-кратный избыток 1-этил-3-(3-диметиламинопропил)карбодиимида (EDAC) (0,510 г) и перемешивание продолжали в течение 2 часов при комнатной температуре. В конце этого периода перемешивание останавливали и супернатант отсасывали, твердые вещества промывали безводным диоксаном и МеОН и фильтровали на полисульфоновой мембране 0,45 микрон. Твердые вещества промывали дополнительным количеством МеОН на фильтровальной мембране и сушили в вакууме, пока не переставали наблюдать дальнейшее уменьшения веса. Выход NHS-активированных окисленных фибрилл был 100% в расчете на 6% наблюдаемое увеличение веса. К 10 мл 0,2 М NaHCO3-буфера добавляли 100 мкл этилендиамина (en). Добавляли эквивалентный объем уксусной кислоты (НОАс) для поддержания рН около 8. NHS-активированные окисленные фибриллы (0,310 г) добавляли при интенсивном перемешивании и проводили реакцию в течение 1 часа. Добавляли дополнительно 300 мкл en и 300 мкл НОАс в течение дополнительных 10 минут. Раствор фильтровали на полисульфоновой мембране 0,45 микрон и промывали последовательно NaHCO3-буфером, 1% НСl, ДИ-водой и EtOH. Твердые вещества сушили в вакууме в течение ночи. HCl-соль обратно превращали в свободный амин реакцией с NaOH (177-046-1) для последующего анализа и реакций. Проводили ESCA (ЭСХА) для определения количества N, присутствующего на аминированных фибриллах (GF/NH2). Анализ ESCA 177-046-1 показал 0,90 ат.% N (177-059). Для дальнейшей оценки того, сколько из этого N присутствует как на доступных, так и на реакционноспособных аминогруппах, получали производное реакцией в газовой фазе с пентафторбензальдегидом для образования связей соответствующего основания Шиффа с доступными первичными аминогруппами. Анализ ESCA все еще показывал 0,91 ат.% N, как и ожидалось, и 1,68 ат. % F. Это соответствует 0,34 ат.% N, присутствующего в качестве реакционноспособного первичного амина на аминированной фибрилле (5F на молекулу пентафторбензальдегида). Уровень 0,45 ат.% мог ожидаться при предположении полной реакции со свободными концами каждого N. Наблюдаемый уровень свидетельствует об очень высоком выходе из реакции N с NHS-активированной фибриллой и подтверждает реакционную способность доступных свободных аминных групп. При уровне 0,34 ат.% N, присутствующего в виде свободного амина, рассчитанном из данных ESCA, должно было бы быть почти полное покрытие фибрилл свободными аминными группами, позволяющее связывание других материалов. Получение Р Получение силильного производного из функционализованных карбоновой кислотой фибрилл Функционализованные кислотой фибриллы, полученные, как в Получении К, суспендировали в диоксане в инертной атмосфере. При перемешивании добавляли стехиометрическое количество хлортриэтилсилана и реакцию проводили в течение 0,5 часа, после чего добавляли несколько капель 5% раствора DABCO в диоксане. Система реагировала еще в течение 1 часа, после чего фибриллы собирали фильтрованием и промывали в диоксане. Фибриллы сушили при 100oС в вакууме 5″ рт. ст. в течение ночи. Таблица V суммирует получения вторичных производных. Продукты анализировали ESCA на содержание на поверхности С, О, N, Si и F. Получение Q Получение силильных производных из функционализованных карбоновой кислотой фибрилл Функционализованные кислотой фибриллы, полученные, как в Получении К, суспендировали в диоксане в инертной атмосфере. При перемешивании добавляли стехиометрическое количество хлортриэтилсилана и реакцию проводили в течение 0,5 часа, после чего добавляли несколько капель 5% раствора DABCO в диоксане. Система реагировала еще в течение 1 часа, после чего фибриллы собирали фильтрованием и промывали в диоксане. Фибриллы сушили при 100oС в вакууме 5″ рт. ст. в течение ночи. Таблица VI суммирует получения вторичных производных. Продукты анализировали ESCA. Анализ подтвердил включение желательных боковых групп. Продукты анализировали ESCA на содержание на поверхности С, О, N, Si и F. Функционализованные сульфоновой кислотой фибриллы Арилсульфоновые кислоты, подобные полученным в Получении А, могут дополнительно взаимодействовать с образованием вторичных производных. Сульфоновые кислоты могут быть восстановлены до меркаптанов при помощи LiAlH4 или комбинации трифенилфосфина и иода (March, J. Р., р. 1107). Они могут быть превращены в сульфонатные эфиры реакцией с диалкиловыми эфирами, т. е.: Фибрилла-SO3Н+R-О-R–>Фибрилла-SO2ОR+ROH Фибриллы, функционализованные электрофильным присоединением к не содержащим кислорода поверхностям фибрилл или металлированием Первичные продукты, полученные присоединением активированных электрофилов к не содержащим кислорода поверхностям фибрилл, имеют боковые группы -СООН, -СОСl, -CN, -CH2NH2, -СН2ОН, -СН2-галоген или НС=О. Они могут быть превращены во вторичные производные следующим образом: Фибрилла-СООН–>см. выше. Фибрилла-СОСl(хлорангидрид)+HO-R-Y–>F-COO-R-Y (Sec. 4/5) Фибрилла-COCl+NH2-R-Y–>F-CONH-R-Y Фибрилла-CN+H2–>F-CH2-NH2 Фибрилла-СН2NН2+HOOC-R-Y–>F-CH2NHCO-R-Y Фибрилла-СН2NН2+O=CR-R’Y–>F-CH2N=CR-R’-Y Фибрилла-СН2ОН+O(COR-Y)2–>F-CH2OCOR-Y Фибрилла-СН2ОН+HOOC-R-Y–>F-CH2OCROR-Y Фибрилла-СН2-галоген+Y––>F-CH2-Y+X–Y–=NCO–, -OR– Фибрилла-С=О+H2N-R-Y–>F-C=N-R-Y Фибриллы, функционализованные адсорбцией полициклических или полигетероциклических ароматических или плоских макроциклических соединений Дилитий-фталоцианин. Как правило, два иона Li+ вытесняют из группы фиалоцианина (Рс) в большинстве случаев комплексами металлов (в частности, многовалентных). Таким образом, замещение ионов Li+ ионом металла, связанным с нелабильными лигандами, является способом помещения стабильных функциональных групп на поверхности фибрилл. Комплексы почти всех металлов переходного ряда будут вытеснять Li+ из Рс с образованием стабильного нелабильного хелата. Задачей является связывание этого металла с подходящим лигандом. Кобальт (II)-фталоцианин Комплексы кобальта (II) являются особенно подходящими для этого. Ион Со++ может замещать два иона Li+ с образованием очень стабильного хелата. Ион Со++ может затем быть координирован с лигандом, таким как никотиновая кислота, которая содержит кольцо пиридина с боковой карбоксильной группой и которая, как известно, связывается предпочтительно с группой пиридина. В присутствии избытка никотиновой кислоты Co(II)Pc может электрохимически окисляться до Co(III)Pc с образованием нелабильного комплекса с пиридиновой частью никотиновой кислоты. Таким образом, свободная карбоксильная группа никотиновой кислоты прочно присоединяется к поверхности фибриллы. Другими подходящими лигандами являются аминопиридины или этилендиамин (боковая группа NН2), меркаптопиридин (SH) или другие полифункциональные лиганды, содержащие любую из амино- или пиридильной части молекулы на одном конце и любую желательную функциональную группу на другом конце. 7. ТРЕХМЕРНЫЕ СТРУКТУРЫ Окисленные фибриллы более легко диспергируются в водных средах, чем неокисленные фибриллы. Стабильные, пористые 3-мерные структуры с мезо- и макропорами (порами >2 нм) очень применимы в качестве катализаторов или хроматографических носителей. Поскольку фибриллы могут быть диспергированы на индивидуализированной основе, хорошо диспергированная проба, которая стабилизирована поперечными (мостиковыми) связями, позволяет сконструировать такой носитель. Функционализованные фибриллы являются идеальными для такого применения, так как они легко диспергируются в водных и полярных средах и функциональность обеспечивает точки поперечных связей. Кроме того, функциональная группа обеспечивает точки для несения каталитических или хроматографических сайтов. Конечным результатом является жесткая, 3-мерная структура с ее доступной общей площадью поверхности с функциональными сайтами, которые могут служить носителем для активного агента. Типичные применения этих носителей в катализе включают их использование в качестве высокопористого носителя для металлических пропитанных катализаторов, например катализаторов гидрирования из драгоценных металлов. Кроме того, способность анкерных молекулярных катализаторов связываться с носителем через функциональную группу в сочетании с высокой пористостью этой структуры позволяет проводить гомогенные реакции по типу гетерогенных. Такой привязанный молекулярный катализатор по существу болтается в непрерывной жидкой фазе, подобно гомогенному реактору, в котором он может использовать преимущества в селективности и скоростях, которыми отличаются гомогенные реакции. Однако, поскольку он привязан к твердому носителю, он может быть легко отделен и извлечен с получением активного, во многих случаях очень дорогостоящего катализатора. Эти стабильные, жесткие структуры позволяют проводить до сих пор бывшие очень трудными реакции, такие как асимметричные синтезы или аффинную хроматографию путем присоединение подходящего энантиомерного катализатора или селективного субстрата к такому носителю. Получение производных через Metallo-Pc или металл-порфириновые комплексы также позволяет восстановить лиганд, связанный с ионом металла, и, кроме того, любую молекулу, которая связана с этим лигандом, через вторичные производные. Например, в случае, когда 3-мерной структурой функционализованных фибрилл является электрод или часть электрода и функционализация произошла в результате адсорбции Со(II)Рс, электрохимическое окисление Со(II) до Со(III) в присутствии никотиновой кислоты будет производить нелабильный Со(III)-пиридильный комплекс с карбоновой кислотой в качестве боковой группы. Присоединение подходящего антигена, антитела, каталитического антитела или другого сайт-специфического улавливающего агента сделает возможным селективное разделение молекул (аффинную хроматографию), которое в ином случае очень трудно получить. После промывания электрода для удаления прилипшего материала комплекс Со(III), содержащий целевую молекулу, может быть электрохимически восстановлен извлечением лабильного комплекса Со(II). Затем лиганд на Со(II), содержащий целевую молекулу, может быть извлечен mass action-замещением лабильного лиганда Со(II) с разделением и извлечением тем самым молекул, которые иным образом очень трудно или дорого разделить и извлечь (например, хиральных лекарственных средств). Другим примером 3-мерных структур являются фибрилльно-керамические композиционные материалы. Получение R Получение состоящих из оксид алюмикия-фибрилл композиционных материалов (185-02-01) Один грамм окисленных азотной кислотой фибрилл (185-01-02) хорошо диспергировали в 100 мл деионизованной воды при помощи дезинтегратора U/S (ультразвукового). Суспензию фибрилл нагревали до 90oС и медленно добавляли раствор 0,04 моль трибутоксида алюминия в 20 мл пропанола. Нагревание с обратным холодильником продолжали в течение 4 часов, после чего холодильник удаляли для отгонки спирта. После 30 минут холодильник помещали обратно и суспензию нагревали с обратным холодильником при 100oС в течение ночи. Получали черный коллоидный раствор однородного вида. Этот коллоидный раствор охлаждали до комнатной температуры и после одной недели образовался черный гель с гладкой поверхностью. Гель нагревали при 300oС на воздухе в течение 12 часов. Оксид алюминия-фибрилльный композиционный материал испытывали сканирующей электронной микроскопией (SEM). Микрофотографии треснутых поверхностей обнаружили гомогенное диспергирование фибрилл в геле. Получение S Получение состоящих из диоксид кремния-фибрилл композиционных материалов (173-85-03) Два грамма окисленных азотной кислотой фибрилл (173-83-03) хорошо диспергировали в 200 мл этанола при помощи обработки ультразвуком. К суспензии медленно добавляли раствор 0,1 моль тетраэтоксисилана, растворенного в 50 мл этанола, при комнатной температуре с последующим добавлением 3 мл концентрированной НСl. Смесь нагревали до 85oС и поддерживали при этой температуре, пока объем не уменьшался до 100 мл. Смесь охлаждали и оставляли стоять, пока он не образовал черный твердый гель. Этот гель нагревали при 300oС на воздухе. Состоящие из диоксид кремния-фибрилл композиционные материалы испытывали при помощи SEM. Микрофотографии растреснутых поверхностей обнаружили гомогенное диспергирование фибрилл в этом геле. Могут быть приготовлены подобные препараты с другими керамиками, такими как диоксид циркония, диоксид титана, оксиды редкоземельных металлов, а также третичные оксиды. Как проиллюстрировано предшествующим описанием и примерами, данное изобретение имеет приложение в приготовлении большого разнообразия функционализованных нанотрубок. Термины и выражения, которые использовались, применялись в качестве терминов описания, а не ограничений, и не предполагается использование таких терминов или выражений для исключения каких-либо эквивалентов признаков, показанных и описанных в виде их частей, с признанием, что возможны многочисленные модификации в объеме данного изобретения. ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ИЗОБРЕТЕНИЯ Хотя в анализах данного изобретения может быть использован широкий диапазон нанотрубок, как правило, эти нанотрубки имеют плотность от 1,0 до 5,0 г/мл и предпочтительно имеют плотность от 1,1 до 2 г/мл. Выбор оптимальной плотности находится в объеме квалификации в данной области, причем скорость осаждения в анализах с гравитационным осаждением выбирается на основании скорости анализа и желания создать однородный слой комплекса на поверхности электрода. Могут также применяться нанотрубки с широким диапазоном средних диаметров. Могут использоваться частицы, имеющие средний диаметр от 0,001 до 100 мкм и предпочтительно частицы имеют средний диаметр от 0,01 до 10 мкм. Длина нанотрубок по меньшей мере в 5 раз превышает диаметр. Могут также использоваться широкие пределы концентрации частиц в тест-композициях. Например, концентрация может находиться в диапазоне от 1  10-9 до 1 10-9 до 1 10-2 г/мл до предпочтительно от 1 10-2 г/мл до предпочтительно от 1 10-8 до 1 10-8 до 1 10-3 г/мл. Желательно, чтобы плотность частиц, их размер и их концентрация были выбраны таким образом, чтобы частицы осаждались при скорости по меньшей мере 0,5 мм/мин, и предпочтительно при большей скорости.
При проведении данного изобретения в режиме фильтрования желательно, чтобы фильтрующее средство имело размер пор, измеряемый как средний диаметр, от 0, 01 до 90% среднего диаметра частиц и предпочтительно от 10 до 90% этого диаметра.
Нанотрубки могут быть парамагнитными или ферромагнитными и могут быть покрыты различными материалами, с которыми связываются связывающие соединения таким образом, чтобы такую магнитную частицу можно было использовать в анализах. Желательно, чтобы магнитные нанотрубки, используемые в данном изобретении, имели чувствительность по меньшей мере 0,001 cgs-единиц и более желательно чувствительность по меньшей мере 0,01 cgs-единиц. Магнитные нанотрубки могут иметь широкий диапазон плотностей, т.е. от существенно меньшей, чем плотность воды, 0,01 до 5 г/мл и предпочтительно от 0,5 до 2 г/мл. Размеры частиц могут быть в пределах от 0,001 до 100 мкм и предпочтительно от 0,01 до 10 мкм. Концентрация этих частиц может быть в диапазоне в общем от 1 10-3 г/мл. Желательно, чтобы плотность частиц, их размер и их концентрация были выбраны таким образом, чтобы частицы осаждались при скорости по меньшей мере 0,5 мм/мин, и предпочтительно при большей скорости.
При проведении данного изобретения в режиме фильтрования желательно, чтобы фильтрующее средство имело размер пор, измеряемый как средний диаметр, от 0, 01 до 90% среднего диаметра частиц и предпочтительно от 10 до 90% этого диаметра.
Нанотрубки могут быть парамагнитными или ферромагнитными и могут быть покрыты различными материалами, с которыми связываются связывающие соединения таким образом, чтобы такую магнитную частицу можно было использовать в анализах. Желательно, чтобы магнитные нанотрубки, используемые в данном изобретении, имели чувствительность по меньшей мере 0,001 cgs-единиц и более желательно чувствительность по меньшей мере 0,01 cgs-единиц. Магнитные нанотрубки могут иметь широкий диапазон плотностей, т.е. от существенно меньшей, чем плотность воды, 0,01 до 5 г/мл и предпочтительно от 0,5 до 2 г/мл. Размеры частиц могут быть в пределах от 0,001 до 100 мкм и предпочтительно от 0,01 до 10 мкм. Концентрация этих частиц может быть в диапазоне в общем от 1 10-9 до 1 10-9 до 1 10-2 г/мл и предпочтительно от 1 10-2 г/мл и предпочтительно от 1 10-8 до 1 10-8 до 1 10-3 г/мл.
Желательно, чтобы магнитные нанотрубки, которые используются, имели низкую остаточную намагниченность, как описано, например, в ЕР 0180384, так чтобы после удаления магнитного поля нанотрубки размагничивались и могли быть удалены из тест-ячейки. Желательно, чтобы плотность, концентрация и размер магнитных нанотрубок были выбраны таким образом, чтобы время осаждения было по меньшей мере 0,5 мм/мин, и, более желательно, выше этой скорости. При эксплуатации магнитной ячейки часто желательно удалять магнит от поверхности электрода перед индуцированием электрохемилюминесценции, чтобы не мешать работе фотоэлектронного умножителя.
Анализы 10-3 г/мл.
Желательно, чтобы магнитные нанотрубки, которые используются, имели низкую остаточную намагниченность, как описано, например, в ЕР 0180384, так чтобы после удаления магнитного поля нанотрубки размагничивались и могли быть удалены из тест-ячейки. Желательно, чтобы плотность, концентрация и размер магнитных нанотрубок были выбраны таким образом, чтобы время осаждения было по меньшей мере 0,5 мм/мин, и, более желательно, выше этой скорости. При эксплуатации магнитной ячейки часто желательно удалять магнит от поверхности электрода перед индуцированием электрохемилюминесценции, чтобы не мешать работе фотоэлектронного умножителя.
АнализыС использованием способов данного изобретения можно проводить разнообразные анализы. Анализ может выполняться при помощи функционализованных углеродных нанотрубок. Такой анализ включал ECL-детектирование гидролитических ферментов с применением углеродных нанотрубок (фибрилл). Углеродные нанотрубки (фибриллы) были химически модифицированы субстратами гидролитических ферментов. На конце субстрата, наиболее удаленном от фибриллы, присоединяли производное Ru(bру)3 2+. Основная структура твердой фазы была следующей: фибрилла-субстрат (разрезаемая связь)-Ru(bpy)3 2+. Если присутствует фермент, который расщепляет разрезаемую связь, Ru(bpy)3 2+-конец субстрата высвобождается в раствор под действием этого фермента. После смешивания и инкубирования этих фибрилл с таким ферментом, фибриллы удаляют из раствора (фильтрованием или центрифугированием). Измеряют ECL оставшегося раствора. Если фермент присутствует, Ru(bpy)3 2+ – конец субстрата будет присутствовать в растворе и будет испускать свет. Таким образом, присутствие специфического фермента приводит к эмиссии света из фазы раствора смеси. Этот анализ является новым ECL-анализом на протеазы, поскольку в нем не участвуют антитела (он не является иммуноанализом). Таким образом, он имеет преимущество, заключающееся в том, что он является скорее анализом на активность фермента, чем анализом на присутствие фермента (фермент может быть неактивным в этом случае). Кроме того, этот анализ использует фибриллы в качестве твердого носителя. Фибриллы являются предпочтительными вследствие их большой площади поверхности и легкости в присоединении биомолекул, таких как субстраты ферментов. Кроме того, функционализованные фибриллы могут быть образованы в виде проточной мембраны (мата). Ферментная смесь могла бы быстро протекать через эту мембрану с высвобождением Ru(bpy)3 2+ и делать анализ быстрым и удобным. Был выполнен анализ с ДНК-зондом с применением фибрилл и ECL. Углеродные нанотрубки (фибриллы) использовали в качестве твердого носителя в анализе с ДНК-зондом в качестве разделительных сред для отделения аналита от смесей комплексов, которые могут включать в себя биологические жидкости и добавленные реагенты. Фибриллы были модифицированы авидином (или стрептавидином) либо путем ковалентного присоединения (через NHS-эфир), либо адсорбцией на алкил-фибриллах. Биотинилированную одноцепочечную ДНК (ssDNA) (“аналит”) связывали с авидин-фибриллами и детектировали по ECL комплементарный одноцепочечный олигонуклеотид, который был помечен Ru(bpy)3 2+. Одна форма выполнения для детектирования природного (небиотинилированного) ДНК-фрагмента представляет собой конкурентную форму выполнения, где Ru(bpy)3 2+ – меченый олиго может связываться либо с природной ДНК, либо с введенной биотинилированной ДНК. Таким образом, чем больше аналита, который присутствует (небиотинилированной ДНК), тем меньше меченого олиго остается для связывания с биотинилированной ДНК, которая при улавливании на авидин-фибриллах дает сигнал ECL. Таким образом, впервые углеродные нанотрубки были использованы в анализе ДНК. Способ имеет следующие преимущества: (1) углеродные нанотрубки имеют очень высокую площадь поверхности, что означает, что необходимо меньше твердого носителя, чем в случае других твердых носителей; (2) фибриллы являются электропроводимыми, что является привлекательным свойством для твердого носителя в ECL-приложениях, в которых твердый носитель находится на электроде. Вследствие электропроводимости большая площадь поверхности находится в электрохимическом контакте, чем с другими носителями, которые не являются электропроводимыми. Был бы выгодным также иммуноанализ на основе ECL с применением иммобилизованных антител на углеродных нанотрубках (фибриллах). Фибриллы с антителами могли бы использоваться в ECL-приложениях в форме конкурентного иммуноанализа (где имеется конкуренция между аналитом и Ru(bpy)3 2+-меченным аналитом за связывание с несущими антитела фибриллами) или в форме сэндвич-анализа (где Ru(bру)3 2+ – меченное вторичное антитело связывается с комплексом фибрилла с антителом-аналит). В обоих случаях эмиссия света ECL сигнализирует о присутствии или отсутствии представляющего интерес аналита. Антитело может быть иммобилизовано на фибриллах несколькими различными способами, ковалентным или нековалентным путем. Для нековалентной иммобилизации антитело адсорбируют на немодифицированных фибриллах или на фибриллах, модифицированных для усиления характеристик адсорбции. Такие модифицированные фибриллы имеют гидрофобные придатки (алкильные цепи или фенилалкильные цепи). Ковалентная иммобилизация антител на фибриллах может быть достигнута тремя различными способами: NHS-эфирной активацией карбоксилированных фибрилл, восстановительным аминированием углеводных групп антител и с использованием сульфгидрил/малеимидо-фибрилл, реагирующих с восстановленными или малеимидо-модифицированными антителами. Иммобилизация антител на углеродных фибриллах является выгодной. Фибриллы с антителами имеют ряд уникальных свойств по сравнению с другими твердыми носителями для антител. Эти преимущества включают в себя высокую площадь поверхности на вес, электропроводимость (в частности, в ECL-приложениях) и химическую и физическую стабильность. Углеродные нанотрубки были использованы в качестве биосенсоров на основе ECL. Готовили бифункциональные фибриллы, где производное ферментного кофактора НАД+ присоединяли к одной функциональной группе, а производное Ru(bpy)3 2+ присоединяли к другой функциональной группе (СООН). Биосенсорные фибриллы смешивали с раствором, который содержал аналит (дегидрогеназу, в этом случае глюкозо-6-фосфатдегидрогеназу, G6PDH), и добавляли субстрат дегидрогеназы (в этом случае глюкозо-6-фосфат). После периода времени, достаточного для реакции фермента с его субстратом и превращения НАД+ – групп на фибриллах в НАДН, измеряли ECL фибрилл в устройстве для определения ECL. Изменение в свойствах ECL биосенсорных фибрилл указывало на присутствие фермента глюкозо-6-фосфатдегидрогеназы. Были обнаружены следующие преимущества. (1) Тесная близость кореагентов НАД+ и Ru(bpy)3 2+ приводит к внутримолекулярной ECL-реакции, которая более эффективна, чем межмолекулярные ECL-реакции. (2) ECL-активные реагенты (кореагенты НАД+ и Ru(bpy)3 2+) иммобилизованы на фибриллах, что позволяет им осаждаться на электроде или притягиваться магнитом к ECL-электроду, что приводит к усиленной эмиссии света. (3) Фибриллы имеют чрезвычайно высокую площадь поверхности, так что большие количества кореагентов (НАД+ и Ru(bру)3 2+ могут быть иммобилизованы, с теоретическим усилением выхода света во время детектирования дегидрогеназ. (4) Фибриллы являются электропроводимыми – когда биосенсоры достигают электрода, большая часть их площади поверхности, которая не была в фактическом контакте с электродом, может получить напряжение и участвовать в реакциях ECL. (5) Биосенсор предназначен для детектирования дегидрогеназ, которые используют в качестве кофактора НАД+ или НАДН. Существует много таких ферментов и они могли бы детектироваться с использованием данного изобретения. Углеродные фибриллы использовали в качестве твердого носителя для ферментного биосенсора. Поскольку ферментный биосенсор является водорастворимым, он может использоваться только один раз, если он не иммобилизован (иммобилизация позволяет извлекать его из раствора аналита). US Application Serial No.08/467712 обсуждает и притязает на иммобилизацию на твердом носителе и на (твердом) электроде. Данное изобретение демонстрирует использование углеродных фибрилл в качестве твердого носителя. Ферментный биосенсор может быть присоединен к фибриллам при помощи адсорбции. Фибриллы могут быть либо немодифицированными фибриллами, либо, предпочтительно, химически модифицированными фибриллами. Химической модификацией фибрилл является предпочтительно алкилирование. Адсорбцию этого биосенсора проводят инкубированием с перемешиванием ферментного биосенсора и алкилированных фибрилл. Фибриллы в качестве твердого носителя являются новыми и привлекательными по следующим причинам: (1) они имеют высокую площадь поверхности иммобилизации, приводящую к потенциально высокой эмиссии света, (2) белки, такие как этот биосенсор, могут быть легко адсорбированы без ковалентной химии, (3) фибриллы являются электропроводимыми, что может усиливать ECL при контакте с электродом, (4) сами фибриллы могут быть изготовлены в виде электродов и в этом случае сам электрод является носителем биосенсора. Магниточувствительные частицы применимы в качестве устройств для разделений. Разделения, например, специфического аналита от комплексной смеси, применимы в производстве диагностических средств, где аналит может присутствовать в комплексной смеси, такой как кровь. Поскольку комплексная смесь может мешать анализу аналита, желательно связывать аналит с твердой поверхностью, так чтобы комплексная смесь могла вымываться из аналита, что позволило бы его определение. Если желательный аналит может специфически связываться с магниточувствительной частицей, эта частица может быть удержана магнитом, что позволяет вымывание комплексной смеси из аналита, который затем может быть определен. Поскольку фибриллы являются частицами, которые могут специфически и эффективно связывать биомолекулы, магниточувствительные фибриллы выгодно используют в качестве устройств для твердофазного разделения, в частности в ECL-анализах. Фибриллы были сделаны магниточувствительными проведением обработок, таких как химические реакции или смена растворителя, в котором они суспендированы (например, воды на ДМФ). Обсуждается, что такие манипуляции вызывают изменения в физической агрегации множеств фибрилл. Поскольку фибриллы имеют некоторое количество (приблизительно 0,5% по весу) железа в них, они способны, при агрегации, становиться по существу магниточувствительными. Проводили некоторые обработки, которые увеличивают магниточувствительность фибрилл. Постулируется, что эти обработки вызывают изменения в агрегации фибрилл, которые, в свою очередь, заставляют их эффективно притягиваться к магниту. Магниточувствительные фибриллы имеют по меньшей мере два уникальных преимущества. Во-первых, они имеют очень высокую площадь поверхности на вес. Следовательно, должно быть использовано меньшее количество фибрилл (по сравнению, например, с гранулами Dynal) для достижения одного и того же результата. Во-вторых, фибриллы являются электропроводимыми. Таким образом, они имеют преимущество в таких применениях, как ECL, где магниточувствительные частицы удерживаются на электроде. Таким образом, будучи электропроводимыми, они фактически становятся частью электрода, усиливая эффективность эмиссии света. ПРИМЕРЫ (1) Оборудование Использовали проточное устройство с применением трех электродов, изображенное на Фиг.1 и 2. Рабочий электрод – Au disk, диаметр 3 мм. Противоэлектрод – Au disk, диаметр 3 мм. Электрод сравнения – Аg/АgСl. Тефлоновая прокладка (толщиной 0,15″). Фронтальная плоскость из плексигласа. Входная трубка = 0,042″ из пропилена. Скорости отсасывания: вариабельные от 0,01 до 5 мл/мин. Стабилизатор: управляемый микропроцессором. Люменометр с применением электронного фотоумножителя. ФЭУ Hamamatsu R374 (чувствительная к красному свету трубка с низким коэффициентом усиления); напряжение ФЭУ, вариабельное от 0 до 1400 В. (2) Цикл измерения ECL (режим трехэлектродной ячейки) Цикл измерения ECL состоит из трех стадий: (1) предварительное кондиционирование, (2) измерение и (3) очистка. Стадия предварительного кондиционирования включает наложение волны треугольника напряжений от 0,0 В до +2,2 В, до -1,0 В, до +0,6 В при 2,0 В/сек. Стадия измерения включает наложение треугольной формы кривой напряжения от +0,6 В до +2,8 В, до +2,0 В при 1,0 В/сек. Стадия очистки включает наложение прямоугольного колебания напряжения от +0,0 В до +3,0 В, до -0,5 В, до 0,0 В. Все напряжения даны относительно электрода сравнения Аg/АgСl. ПРИМЕР 1 Синтез фибрилл с пептидом с рутениевой меткой Этот пример показывает синтез реагента для детектирования фермента в ECL-анализаторе. Синтез фибрилл с пептидом с рутениевой меткой. Тетрапептид Fmoc-Gly-Lys-Lys(N  -CBZ)-Phe-Gly-COOH синтезировали общепринятыми способами в фазе раствора и этот пептид подвергали реакции с вариантом Ru(bрy)3 2+ в виде производного первичного амина (IGEN, Inc., Gaithersburg, MD) (73 мг, 0,078 ммоль), EDC (17,8 мг, 0,093 ммоль) использовали в качестве активирующего реагента и НОВТ (12,58 мг, 0,093 ммоль) в качестве катализатора. Продукт Fmoc-Gly-Lys(N -CBZ)-Phe-Gly-COOH синтезировали общепринятыми способами в фазе раствора и этот пептид подвергали реакции с вариантом Ru(bрy)3 2+ в виде производного первичного амина (IGEN, Inc., Gaithersburg, MD) (73 мг, 0,078 ммоль), EDC (17,8 мг, 0,093 ммоль) использовали в качестве активирующего реагента и НОВТ (12,58 мг, 0,093 ммоль) в качестве катализатора. Продукт Fmoc-Gly-Lys(N -CBZ)-Phe-Gly-CO-NH-Tag (170 мг, 0,223 ммоль) освобождали от защитных групп пиперидином (96 мл) и метиленхлоридом (1,1 мл). Структуру этого соединения тетрапептида-Ru(bру)3 2+ подтверждали 1Н-ЯМР. К раствору тетрапептида-Ru(bру)2 2+ (5 мг, 0,003 ммоль) в метиленхлориде (2 мл) добавляли карбоксилированные фибриллы (54 мг). Затем добавляли EDC (5,8 мг, 0,03 ммоль) и HOBt (4 мг, 0,03 ммоль). Реакционную смесь перемешивали в течение ночи. Фибриллы интенсивно промывали водой, метанолом, ацетонитрилом и метиленхлоридом. Полученные фибриллы обрабатывали триметилсилилиодидом (TMSI, 1 мл) в ацетонитриле (4 мл) в течение 3 часов при 40oС. Конечные полученные фибриллы интенсивно промывали водой, метанолом, ацетонитрилом, стандартным тест-буфером ECL IGEN (IGEN, Inc., Gaithersburg, MD) и метиленхлоридом.
ПРИМЕР 2 -CBZ)-Phe-Gly-CO-NH-Tag (170 мг, 0,223 ммоль) освобождали от защитных групп пиперидином (96 мл) и метиленхлоридом (1,1 мл). Структуру этого соединения тетрапептида-Ru(bру)3 2+ подтверждали 1Н-ЯМР. К раствору тетрапептида-Ru(bру)2 2+ (5 мг, 0,003 ммоль) в метиленхлориде (2 мл) добавляли карбоксилированные фибриллы (54 мг). Затем добавляли EDC (5,8 мг, 0,03 ммоль) и HOBt (4 мг, 0,03 ммоль). Реакционную смесь перемешивали в течение ночи. Фибриллы интенсивно промывали водой, метанолом, ацетонитрилом и метиленхлоридом. Полученные фибриллы обрабатывали триметилсилилиодидом (TMSI, 1 мл) в ацетонитриле (4 мл) в течение 3 часов при 40oС. Конечные полученные фибриллы интенсивно промывали водой, метанолом, ацетонитрилом, стандартным тест-буфером ECL IGEN (IGEN, Inc., Gaithersburg, MD) и метиленхлоридом.
ПРИМЕР 2ECL-анализ активности трипсина и химотрипсина с применением фибрилл, связанных с Ru(bру)3 2+-меченым пептидом Ru(bpy)3 2+ – меченый тетрапептид (NH2-Gly-Lys-Phe-Gly-Ru(bpy)3 2+) конъюгировали с карбоксилированными фибриллами, как описано в Примере 1. Фибриллы с Ru(bру)3 2+-меченым пептидом (RPF) использовали для детектирования активности гидролитических ферментов трипсина и химотрипсина. Вкратце, RPF добавляли к водному раствору, содержащему один из ферментов или оба фермента. Поскольку пептид был сконструирован таким образом, что он должен содержать специфические сайты расщепления как для трипсина, так и для химотрипсина (Фиг. 3), и поскольку фибриллы являются твердым веществом, действие этих ферментов должно было высвобождать либо Phe-Gly-Ru(bpy)3 2+ (трипсин), либо Gly-Ru(bpy)3 2+ (химотрипсин) в раствор. После подходящего периода инкубирования, достаточного для расщепления этими ферментами твердофазного пептида, водный раствор отделяли от фибрилл стандартными способами, такими как центрифугирование, фильтрование или удаление фибрилл магнитом. Затем высвобожденные в водный раствор Phe-Gly-Ru(bpy)3 2+ или Gly-Ru (bpy)3 2+ детектировали при помощи ECL. Хотя здесь описаны анализы трипсина и химотрипсина, другие гидролитические ферменты могли бы детектироваться с использованием фибрилл, конъюгированных с подходящим Ru(bpy)3 2+-меченым ферментным субстратом. Такие ферменты (и модифицированные фибриллы) включают: нуклеазы (с использованием фибрилл, конъюгированных с Ru(bpy)3 2+-меченой РНК, одноцепочечной ДНК или двухцепочечной ДНК), гликозидазы (с использованием фибрилл, конъюгированных с Ru(bpy)3 2+-мечеными сахарами, олигосахаридами или полисахаридами) или липазы (с использованием фибрилл, конъюгированных с Ru(bpy)3 2+ мечеными липидами). ПРИМЕР 3 ECL-детектирование трипсина с использованием фибрилл К 2,97 мл суспензий RPF (фибриллы-Gly-Lys-Phe-Gly-Ru(bру)3 2+) (2,2 мг/мл) в стандартном тест-буфере ECL (IGEN, Inc., Gaithersburg, MD) добавляли либо 30 мкл 58,9 мкМ трипсина (конечная концентрация = 0,59 мкМ) в 1 мМ НС1, либо 30 мкл 1 мМ НС1. Затем две эти суспензии вращали при комнатной температуре. Периодически вращение останавливали, суспензию быстро центрифугировали и измеряли ECL водного супернатанта. ECL-результаты после 30 минут инкубирования показали, что ECL-отношение проб (ECL с трипсином/ECL без трипсина) было 1,29. После 44 часов ECL-отношение было 2,05. Эти результаты показали, что трипсин мог быть детектирован по его способности гидролитически высвобождать электрохемилюминесцентную рутениевую метку из фибрилл. ПРИМЕР 4 ECL-детектирование химотрипсина с использованием фибрилл К 2,97 мл суспензий RPF (фибриллы-Gly-Lys-Phe-Gly-Ru(bру)3 2+) (0,15 мг/мл) в стандартном тест-буфере ECL (IGEN, Inc., Gaithersburg, MD) добавляли либо 30 мкл 34,2 мкМ химотрипсина (конечная концентрация = 0,34 мкМ) в 1 мМ НСl, либо 30 мкл 1 мМ НСl. Затем эти суспензии вращали при комнатной температуре. Периодически вращение останавливали, суспензию быстро центрифугировали и измеряли ECL водного супернатанта. ECL-результаты показали, что исходно (время = 0) ECL-отношение проб (ECL с химотрипсином/ECL без химотрипсина) было 1,06. После 30 минут инкубирования это отношение повышалось до 1,25 и после 23 часов инкубирования это отношение повышалось до 1,85. Эти результаты показали, что активность химотрипсина могла быть детектирована по способности этого фермента высвобождать электрохемилюминесцентную рутениевую метку, Ru(bpy)3 2+, из фибрилльного твердого носителя. ПРИМЕР 5 Ковалентное присоединение белков к фибриллам через NHS-эфир Для демонстрации того, что белок может быть ковалентно связан с фибриллами через NHS-эфир, стрептавидин, авидин и трипсин присоединяли к фибриллам следующим образом. 0,5 мг соединенных с NHS-эфиром фибрилл промывали 5 мМ натрий-фосфатным буфером (рН = 7,1) и супернатант выбрасывали. 200 мкл раствора стрептавидина (1,5 мг в том же самом буфере) добавляли к этим фибриллам и смесь вращали при комнатной температуре в течение 5,5 часов. Затем фибриллы промывали 1 мл следующих буферов в последовательности: 5мМ натрий-фосфатный буфер (рН = 7,1), PBS (ЗФР) (0,1 М фосфат натрия, 0,15 М NaCl, рН = 7,4), ORIGEN тест-буфер (IGEN, Inc., Gaithersburg, MD) и PBS. Стрептавидиновые фибриллы хранили в PBS-буфере для последующего использования. 2,25 мг соединенных с NHS-эфиром фибрилл обрабатывали ультразвуком в 500 мкл 5 мМ натрий-фосфатного буфера (рН = 7,1) в течение 40 минут и супернатант выбрасывали. Фибриллы суспендировали в 500 мкл 5 мМ натрий-фосфатного буфера (рН =7,1) и 300 мкл раствора авидина, приготовленного в том же самом буфере, содержащего 2 мг авидина (Sigma, А-9390). Эту смесь вращали при комнатной температуре еще в течение одного часа. Фибриллы промывали 1 мл 5 мМ натрий-фосфатного буфера (рН = 7,1) четыре раза и PBS-буфером дважды. Авидиновые фибриллы суспендировали в 200 мкл PBS-буфера для хранения. Трипсин-фибриллы готовили смешиванием 1,1 мг NHS-эфирных фибрилл (обработанных, как в случае авидиновых фибрилл) и 200 мкл 1,06 мМ раствора трипсина, приготовленного в 5 мМ натрий-фосфатном буфере (рН = 7,1), и вращением при комнатной температуре в течение 6,5 часов. Затем трипсин-фибриллы промывали 1 мл 5 мМ натрий-фосфатного буфера (рН = 7,1) три раза и суспендировали в 400 мкл того же самого буфера для хранения. ПРИМЕР 6 Анализ с ДНК-зондом с применением ECL-анализатора Для элиминации неспецифического связывания аналита на связанных со стрептавидином (или авидином) фибриллах в ECL-анализе эти фибриллы блокировали 4 мг/мл раствора БСА (бычьего сывороточного альбумина) в течение 6 часов при комнатной температуре и в течение ночи при 4oС. Анализ с ДНК-зондом изображен на Фиг.4. Эксперимент начинали промыванием 115 мкг блокированных БСА авидиновых фибрилл и стрептавидиновых фибрилл (из Примера 5) дважды 5 мМ натрий-фосфатным буфером (рН = 7,1). Брали аликвоты каждых фибрилл в две пробирки с ~57 мкг в 100 мкл того же самого буфера. Одну пробирку (стрепт)авидиновых фибрилл смешивали с 4 мкл 4 нМ биотинилированной ДНК (70 нуклеотидов), которая была связана с меченным рутениевой меткой олигомером. В другую пробирку добавляли только 4 мкл меченного рутениевой меткой олигомера (в той же концентрации, что и в пробе биотинилированной ДНК) для контрольного анализа. Реакционные смеси инкубировали при комнатной температуре в течение 15 минут и промывали 7 раз 300 мкл ORIGEN тест-буфера (IGEN, Inc., Gaithersburg, MD). Затем эти фибриллы суспендировали в 600 мкл ORIGEN тест-буфера и брали аликвоты в две пробирки для измерения ECL в двух повторностях с применением гравитационного улавливания фибрилл. Результат этого ECL-анализа суммирован следующим образом: Проба – ECL-счет Авидиновые фибриллы (контроль) – 161 Авидиновые фибриллы (ДНК-зонд) – 2212 Стрептавидиновые фибриллы (контроль) – 885 Стрептавидиновые фибриллы (ДНК-зонд) – 4248 Такой же анализ авидиновых фибрилл проводили также с применением магнитного улавливания фибрилл. Экспериментальная процедура была той же самой, за исключением промывания после связывания ДНК с фибриллами. Пробу промывали в ECL-анализаторе с применением запрограммированных стадий. ECL-счет был 3835 для варианта авидиновые фибриллы (ДНК-зонд) и 205 для контроля. Авидин, адсорбированный на С8-фибриллах, также испытывали в анализе с ДНК-зондом с применением магнитного улавливания этих фибрилл, как описано выше. ECL-счет был 15792 для варианта авидиновые фибриллы (ДНК-зонд) против 205 для контроля. ПРИМЕР 7 Ковалентная иммобилизация антител на углеродных нанотрубках Целью этого примера была иммобилизация антител на поверхностях карбоновых нанотрубок. Такие модифицированные антителами нанотрубки могут быть использованы в различных применениях, в том числе в детектировании при помощи иммуноанализа специфических аналитов и биоспецифических аффинных разделениях. Иммуноанализы можно было бы проводить с применением модифицированных антителами нанотрубок в качестве твердого носителя. Использование твердого носителя позволяет проводить стадии промывания, если твердый носитель либо фиксирован, либо иным образом отделен от фазы раствора (например, фильтрованием, центрифугированием или магнитными силами). Использование стадий промывания позволило бы использовать модифицированные антителами нанотрубки во многих типах основанных на электрохемилюминесценции иммуноанализов. Модифицированные антителами нанотрубки могли бы использоваться в качестве замен общепринятых магнитных гранул или в качестве суспендируемого носителя, который можно собирать фильтрованием, или в качестве перманентно-фиксированного иона-носителя одноразового патрона. Фибрилла-антитело-связывание между первичным амином и карбоксильными группами Образование NHS-эфирных фибрилл Суспензию 148,4 мг углеродных фибрилл (Hyperion Catalisis International, Cambridge, MA) в смеси СН2Сl2/диоксан смешивали с 239 мг N-гидроксисукцинимида (NHS) и 399 мг EDC и реакции давали протекать в течение 4 часов. Выход полученных модифицированных NHS-эфиром фибрилл (NHS-фибрилл) был 214,7 мг. Образование модифицированных антителами фибрилл NHS-эфирные фибриллы (84,5 мг) предобрабатывали 1,0 мл буфера для связывания (0,2 М NaHCO3, pH 8,1), затем суспендировали в 1 мл другого буфера для связывания (0,1 М фосфат натрия, 0,5 М NaCl, pH 7,5). Моноклональное антитело (антитело против глюкозооксидазы) (1,5 мг в 2,0 мл буфера для связывания) добавляли к этим фибриллам и суспензию вращали в течение 1 часа, чтобы позволить NHS-фибриллам прореагировать с антителом (первично с боковыми цепями лизина этого антитела). Полученные фибриллы фильтровали и несколько раз промывали буфером для связывания. Связывание глюкозооксидазы с модифицированными антителами фибриллами Непокрытые антителами сайты на модифицированных антителами фибриллах блокировали вращением в течение 10 минут с 1% БСА, растворенным в забуференном фосфатом солевом растворе (ЗФР), pH 6,0. Глюкозооксидазу растворяли в растворе БСА и этот раствор смешивали с фибриллами в течение 1,5 часа. Наконец, фибриллы промывали фосфатным буфером с нейтральным pH, пока не переставали наблюдать элюцию белка при помощи спектрофотометрического мониторинга эффлюентов при 280 нм. Детектирование антитела на модифицированных антителами фибриллах Функциональные молекулы антител на фибриллах определяли количественно по каталитической активности связанного антигена, глюкозооксидазы. Глюкозооксидазную активность определяли спектрофотометрически добавлением пробы фермента (либо свободного фермента, либо фермента, специфически связанного с модифицированными антителами фибриллами) в кювету, содержащую 0,1 М фосфат натрия (рН 6,0), 20 мкМ глюкозу, 183 нМ пероксидазу хрена и 30 мкМ 2,2′-азино-бис(3-этилбензтиазолин)-6-сульфоновую кислоту (АВТС). Активность глюкозооксидазы измеряли спектрофотометрическим определением скорости увеличения поглощения при 414 нм при 25oС (образование зеленой окраски). Количественное определение связанного фермента показало, что имелось 1,52 мкмоля функционального антитела на грамм фибрилл. Фибрилла-антитело-связывание между первичным амином и углеводными группами Образование амино-фибрилл Суспензию NHS-фибрилл (214,7 мг) в свежеприготовленном 0,2 М NaHCO3, рН 8,1, смешивали с 1,2-диаминоэтаном (100 мкл) при комнатной температуре. Суспензию перемешивали в течение приблизительно 5 часов. Затем смесь фильтровали с отсасыванием в воронке Бюхнера и промывали водой (3  10 мл) и метанолом (3 10 мл) и метанолом (3 10 мл) и сушили в вакууме в течение ночи. Выход амино-фибрилл был 144 мг. Нингидриновый тест показал, что диаминоэтан (неконъюгированный) все еще был на этих фибриллах. Фибриллы ресуспендировали в воде и обрабатывали ультразвуком в течение 90 минут. Нингидриновый тест показал, что фибриллы были достаточны свободными от нековалентно связанного амина.
Образование модифицированных антителами фибрилл 10 мл) и сушили в вакууме в течение ночи. Выход амино-фибрилл был 144 мг. Нингидриновый тест показал, что диаминоэтан (неконъюгированный) все еще был на этих фибриллах. Фибриллы ресуспендировали в воде и обрабатывали ультразвуком в течение 90 минут. Нингидриновый тест показал, что фибриллы были достаточны свободными от нековалентно связанного амина.
Образование модифицированных антителами фибриллNAP-5-колонку уравновешивали 100 мМ ацетатом, рН 5,5, и добавляли моноклональное антитело (антитело против глюкозооксидазы, 1,5 мг в 300 мкл буфера) и элюировали буфером (1 мл). Этому раствору давали реагировать с 50 мкл 20 мМ NaIO4 (конечная концентрация NaIO4 1 мМ) при комнатной температуре в течение 2 часов. Реакцию останавливали добавлением предварительно уравновешенного NAP-10 (0,15 М КН2РО4, рН 6,0) и элюировали тем же самым буфером. Элюент собирали в 10-миллилитровую трубку, содержащую амино-фибриллы, и суспензии давали реагировать в течение 2-3 часов. Затем фибриллы промывали реакционным буфером и хранили в 5 мл КН2РО4, рН 5,5. Обнаружение антител на модифицированных антителами фибриллах Функциональные молекулы антител на фибриллах определяли количественно по каталитической активности связанного антигена, глюкозооксидазы, как описано выше. Количественное определение связанного фермента показало, что имелось 0,36 мкмоля функциональных антител на грамм фибрилл. Фибрилла-антитело-связывание между малеимидом (имидом малеиновой кислоты) и сульфгидрильными группами 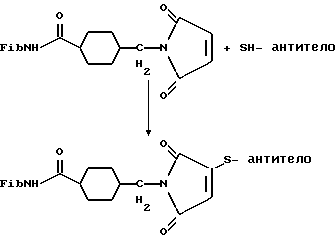 Восстановление мышиных моноклональных антител К раствору антител (24,7 мг, в 2,9 мл) добавляли дитиотреитол (ДТТ, 25 мг, 0,16 ммоль) и смесь инкубировали в течение 1 часа при комнатной температуре. Восстановленные антитела очищали с применением одноразовой гель-фильтрационной колонки PD-10 (Pharmacia). Ковалентное связывание антитела и малеимид-фибрилл Малеимид-фибриллы (0,18 мг) и простые фибриллы (0,15 мг) обрабатывали ультразвуком в течение 15 минут при комнатной температуре и инкубировали в течение 30 минут при 40oС. Затем эти фибриллы центрифугировали и супернатант удаляли. Затем фибриллы инкубировали с восстановленными антителами (12,4 мг) в натрий-фосфатном буфере (0,1 М, рН 7,2, 1,1 мл) в течение 4 часов при комнатной температуре. Количественное определение антител на модифицированных антителами фибриллах (антитела-фибриллах) при помощи меченных пероксидазой хрена (HRP) козьих антител против мышиных антител Модифицированные мышиными антителами фибриллы прединкубировали с 0,1% PEG в натрий-фосфатном буфере (0,1 М, рН 7,5, 1 мл) в течение 30 минут при 40oС. Затем их центрифугировали и супернатант удаляли. Мышиные антитела-фибриллы инкубировали с HRP-меченными козьими антителами против мышиных антител (0,01 мг) в натрий-фосфатном буфере (0,1 М, рН 7,5, 500 мл), содержащем 0,1% PEG, в течение 2 часов при комнатной температуре. Затем фибриллы промывали пять раз 0,1% PEG в натрий-фосфатном буфере (0,1 М, рН 7,5, 1 мл). Количество связанной HRP определяли спектрофотометрическим измерением каталитической активности связанного фермента. Ферментативная реакция показана ниже: 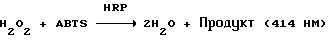 Эти результаты показали, что плотность мышиных антител на этих фибриллах была 1,84 мг антител на грамм фибрилл, а плотность мышиных антител на простых (контрольных) фибриллах была 0,48 мг антител на грамм фибрилл (уровень неспецифического связывания был ~26%). ПРИМЕР 8 Получение бифункциональных фибрилл путем присоединения лизина Синтез бензилового эфира N  -CBZ-L-лизина -CBZ-L-лизинаПоследовательность реакций показана на Фиг.5. N  -(трет-бутоксикарбонил)-L-лизин (2 г, 8,12 ммоль) растворяли в метаноле (40 мл) и воде (40 мл) и рН доводили до 8 триэтиламином. К этой смеси добавляли раствор N-(бензилоксикарбонилокси)сукцинимида в диоксане (2,4 г, 9,7 ммоль) в 20 мл) и рН поддерживали при 8-9 триэтиламином. Реакционную смесь перемешивали в течение ночи. Растворитель удаляли роторным испарением с получением неочищенногоN -(трет-бутоксикарбонил)-L-лизин (2 г, 8,12 ммоль) растворяли в метаноле (40 мл) и воде (40 мл) и рН доводили до 8 триэтиламином. К этой смеси добавляли раствор N-(бензилоксикарбонилокси)сукцинимида в диоксане (2,4 г, 9,7 ммоль) в 20 мл) и рН поддерживали при 8-9 триэтиламином. Реакционную смесь перемешивали в течение ночи. Растворитель удаляли роторным испарением с получением неочищенногоN -CBZ-N -CBZ-N -(трет-бутоксикарбонил)-L-лизина.N -(трет-бутоксикарбонил)-L-лизина.N -(трет-бутоксикарбонил)-L-лизин обрабатывали 0,2 М карбонатом кальция (4 мл) и водный слой удаляли с получением белого твердого вещества. Твердое вещество ресуспендировали в N, N-диметилформамиде (40 мл) и бензилбромиде (1,16 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь обрабатывали этилацетатом и водой и органический слой сушили над сульфатом магния. Растворитель удаляли с получением неочищенного бензилового эфира N -(трет-бутоксикарбонил)-L-лизин обрабатывали 0,2 М карбонатом кальция (4 мл) и водный слой удаляли с получением белого твердого вещества. Твердое вещество ресуспендировали в N, N-диметилформамиде (40 мл) и бензилбромиде (1,16 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь обрабатывали этилацетатом и водой и органический слой сушили над сульфатом магния. Растворитель удаляли с получением неочищенного бензилового эфира N -CBZ-N -CBZ-N -(трет-бутоксикарбонил)-L-лизина, который очищали хроматографией на силикагеле с применением 25% гексана в этилацетате в качестве растворителя. К бензиловому эфиру N -(трет-бутоксикарбонил)-L-лизина, который очищали хроматографией на силикагеле с применением 25% гексана в этилацетате в качестве растворителя. К бензиловому эфиру N -CBZ-N -CBZ-N -(трет-бутоксикарбонил)-L-лизина (1 г, 2,2 ммоль) в метиленхлориде (10 мл) добавляли трифторуксусную кислоту при 0oС. Реакционную смесь перемешивали в течение 10 минут при 0oС, затем перемешивали еще в течение 2,5 часа при комнатной температуре. Растворитель удаляли с получением неочищенного продукта.
Чистый бензиловый эфир -(трет-бутоксикарбонил)-L-лизина (1 г, 2,2 ммоль) в метиленхлориде (10 мл) добавляли трифторуксусную кислоту при 0oС. Реакционную смесь перемешивали в течение 10 минут при 0oС, затем перемешивали еще в течение 2,5 часа при комнатной температуре. Растворитель удаляли с получением неочищенного продукта.
Чистый бензиловый эфир   -CBZ-L-лизина получали хроматографией на силикагеле.
Синтез модифицированных бензиловым эфиром N -CBZ-L-лизина получали хроматографией на силикагеле.
Синтез модифицированных бензиловым эфиром N -CBZ-L-лизина фибрилл -CBZ-L-лизина фибриллК суспензии карбоксил-фибрилл (300 мг) в метиленхлориде (18 мл) добавляли раствор бензилового эфира N  -CBZ-L-лизина (148 мг, 0,32 ммоль) в 20 мл метиленхлорида и 176 мкл триэтиламина. Затем добавляли НОВТ (43,3 мг, 0,32 ммоль) и TDC (61,3 мг, 0,32 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре с получением неочищенного продукта. Полученные фибриллы интенсивно промывали метанолом, метиленхлоридом и водой, затем сушили в вакууме.
Синтез бифункциональных фибрилл Fib-Lys(COOH)NH2 -CBZ-L-лизина (148 мг, 0,32 ммоль) в 20 мл метиленхлорида и 176 мкл триэтиламина. Затем добавляли НОВТ (43,3 мг, 0,32 ммоль) и TDC (61,3 мг, 0,32 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре с получением неочищенного продукта. Полученные фибриллы интенсивно промывали метанолом, метиленхлоридом и водой, затем сушили в вакууме.
Синтез бифункциональных фибрилл Fib-Lys(COOH)NH2К модифицированным бензиловым эфиром N  -CBZ-L-лизина фибриллам (113 мг) в метаноле (4 мл) добавляли гидроксид натрия (1 н., 4 мл) и реакционную смесь перемешивали в течение ночи. Продукт, N -CBZ-L-лизина фибриллам (113 мг) в метаноле (4 мл) добавляли гидроксид натрия (1 н., 4 мл) и реакционную смесь перемешивали в течение ночи. Продукт, N -CBZ-L-лизин-фибриллы, интенсивно промывали водой и метанолом и эти фибриллы сушили под вакуумом. К суспензии N -CBZ-L-лизин-фибриллы, интенсивно промывали водой и метанолом и эти фибриллы сушили под вакуумом. К суспензии N -CBZ-L-лизин-фибрилл (50 мг) в ацетонитриле (4 мл) добавляли триметилсилилиодид (1 мл). Смесь перемешивали в течение 3 часов при 40oС. Конечные бифункциональные фибриллы интенсивно промывали водой, метанолом, 0,5 н. гидроксидом натрия, ацетонитрилом и метиленхлоридом. Аминокислотный анализ показал 0,3 мкмолей лизина на грамм фибрилл.
Гидроксил- и карбоксил- (или амино-) бифункциональные фибриллы могут быть приготовлены способом, аналогичным описанному здесь, с применением серина, треонина или тирозина. Тиолированные и карбоксил- (или амино-) бифункциональные фибриллы могут быть приготовлены с применением цистеина. Карбоксил- и амино-бифункциональные фибриллы могут быть приготовлены с применением аспарагиновой или глутаминовой кислоты.
ПРИМЕР 9 -CBZ-L-лизин-фибрилл (50 мг) в ацетонитриле (4 мл) добавляли триметилсилилиодид (1 мл). Смесь перемешивали в течение 3 часов при 40oС. Конечные бифункциональные фибриллы интенсивно промывали водой, метанолом, 0,5 н. гидроксидом натрия, ацетонитрилом и метиленхлоридом. Аминокислотный анализ показал 0,3 мкмолей лизина на грамм фибрилл.
Гидроксил- и карбоксил- (или амино-) бифункциональные фибриллы могут быть приготовлены способом, аналогичным описанному здесь, с применением серина, треонина или тирозина. Тиолированные и карбоксил- (или амино-) бифункциональные фибриллы могут быть приготовлены с применением цистеина. Карбоксил- и амино-бифункциональные фибриллы могут быть приготовлены с применением аспарагиновой или глутаминовой кислоты.
ПРИМЕР 9Углеродные нанотрубки в качестве биосенсоров на основе ECL К суспензии бифункциональных фибрилл (113 мг) в метиленхлориде (8 мл) добавляли 4-диметиламинопиридин (DMAP, 19,5 мг, 0,16 ммоль) и 1,3-дициклогексилкарбодиимид (DCC, 33 мг, 0,16 ммоль) (Фиг.6). Смесь перемешивали в течение 5 минут, затем добавляли 4-метил-4′-(8-гидроксиоктил)-2,2′-бипиридин (47 мг, 0,16 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Фибриллы полученного продукта интенсивно промывали последовательно ДМФ, 50% диоксаном в воде, метанолом и водой. Эти фибриллы суспендировали в смеси этанола (4 мл) и воды (4 мл) и добавляли дигидрат цис-дихлорбис(2,2′-дипиридин)рутения (45,2 мг, 0,087 ммоль). Смесь нагревали с обратным холодильником в течение 5,5 часов при 110oС. Модифицированные рутениевым комплексом фибриллы интенсивно промывали водой, стандартным ECL-тест-буфером (IGEN, Inc., Gaithersburg, MD), толуолом, 50% диоксаном в воде, затем последовательно нагревали с обратным холодильником в ацетонитриле, этиленгликоле и метаноле. Модифицированные рутениевым комплексом фибриллы подвергали реакции с TMSI (4 мл) в ацетонитриле (4 мл) в течение 4 часов при 40oС для удаления защитной группы CBZ, затем промывали метанолом, водой и гидроксидом натрия (1 н. ). Конечный продукт сушили в вакууме. Затем эти фибриллы суспендировали в метиленхлориде (5 мл) и добавляли триэтиламин (5 капель). К суспензии добавляли янтарный ангидрид (40 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре и продукт промывали метиленхлоридом, метанолом и водой, затем сушили в вакууме. Модифицированные карбоновой кислотой/рутениевым комплексом фибриллы ресуспендировали в диоксане (5 мл), затем добавляли N-гидроксисукцинимид (100 мг) и TDC (167 мг). Реакционную смесь перемешивали в течение 4 часов при комнатной температуре. Полученные модифицированные NHS-эфиром/рутениевым комплексом фибриллы промывали диоксаном и метанолом. Модифицированные NHS-эфиром/рутениевым комплексом фибриллы ресуспендировали в диоксане (2 мл) и добавляли раствор аналога НАД в бикарбонате натрия (75 мл в 2 мл 0,2 М NаНСО3, рН 8,6). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем фибриллы интенсивно промывали водой, бикарбонатом натрия (0,2 М) и метанолом, затем сушили под вакуумом с получением биосенсорных фибрилл. ПРИМЕР 10 Применение углеродных нанотрубок в качестве биосенсоров на основе ECL Биосенсор на основе ECL получали химической модификацией фибрилл. Модифицированные фибриллы получали с использованием NН2/СООН-бифункциональных фибрилл (Пример 8). К одной функциональной группе (NH2) присоединяли НAД+-аналог, а к другой функциональной группе (СООН) присоединяли производное Ru(bpy)3 2+. Структура биосенсорных фибрилл показана на Фиг.7. Был сконструирован биосенсор для облегчения детектирования дегидрогеназных ферментов, которые акцептируют НАД (Ф)+/НАД (Ф) Н в качестве кофактора, и субстратов дегидрогеназных ферментов, которые акцептируют НАД (Ф)+/НАД (Ф) Н в качестве кофактора. Известно (Е. Jameison et al., Analitical Chemistry, in press), что НАД (Ф)+ и НАД (Ф) Н обладают очень разными способностями усиливать Ru(bру)3 2+-ECL. Поэтому активность дегидрогеназы может быть детектирована по ее способности восстанавливать/окислять НАД (Ф)+/НАД (Ф) Н, которая наблюдается по различиям в способности НАД (Ф)+ и НАД (Ф) Н индуцировать электрохемилюминесценцию Ru(bpy)3 2+ (Фиг.8). Подобным образом, поскольку действие дегидрогеназ на их субстраты стехиометрически сопровождается превращением НАД (Ф)+ в НАД (Ф) Н или НАД (Ф) Н в НАД (Ф)+, присутствие их субстратов может также детектироваться по электрохемилюминесценции. Для использования несомого фибриллой биосенсора на основе ECL этот биосенсор смешивают с водным раствором, содержащим дегидрогеназу и неизвестное количество субстрата дегидрогеназы (субстрат является аналитом), или с водным раствором, содержащим субстрат дегидрогеназы и неизвестное количество дегидрогеназы (дегидрогеназа является аналитом). После подходящего времени инкубирования, достаточного для того, чтобы произошла ферментативная реакция и НАД (Ф)+ или НАД (Ф) Н иммобилизовались на фибриллах будучи восстановленными или окисленными, фибриллы втягивают в ECL-устройство и измеряют ECL фибрилл. Измерение ECL проводят в буфере, который не содержит обычных концентраций трипропиламина (так как НАД (Ф)+/НАД (Ф) Н являются заменами трипропиламина в данном изобретении). Привлекательными признаками этого основанного на ECL биосенсора являются: тесная близость НАД (Ф)+/НАД (Ф) Н и Ru(bpy)3 2+ на одной и той же бифункциональной группе на фибриллах, которая усиливает эффективность переноса электрона в электрохимическом механизме ECL (внутримолекулярный перенос электрона является более эффективным, чем межмолекулярный перенос электрона); оба ECL-активных реагента, НАД (Ф)+/НАД (Ф) Н и Ru(bpy)3 2+, находятся на фибриллах, которые могут удерживаться под действием сил магнитного поля на электроде устройства ECL, что будет увеличивать эмиссию света; фибриллы имеют чрезвычайно высокие площади поверхности, которые позволяют иммобилизацию высокой плотности (на вес) НАД (Ф)+/HАД (Ф) Н и Ru(bpy)3 2+, которая сделает возможной эмиссию большего количества света; этот биосенсор является многосторонним, в том смысле, что он может детектировать многие различные аналиты (любую дегидрогеназу, которая акцептирует НАД (Ф)+ или НАД (Ф) Н в качестве кофактора, или субстраты этих ферментов). ПРИМЕР 11 Детектирование глюкозо-6-фосфатдегидрогеназы (G6PDH) при помощи удерживаемого фибриллами биосенсора на основе ECL Фибриллы, модифицированные как аналогом НАД+, так и аналогом Ru(bpy)3 2+, ковалентно связанными с бифункциональным аддуктом (ECL-биосенсорными фибриллами), использовали для детектирования фермента глюкозо-6-фосфатдегидрогеназы. ECL-биосенсорные фибриллы (860 мкг/мл) смешивали с забуференным раствором с нейтральным рН, содержащим приблизительно 50 мкМ глюкозо-6-фосфат. В одну пробирку добавляли G6PDH до концентрации 3,6 мкМ. Во вторую пробирку добавляли деионизованную воду. Сразу же измеряли ECL этих фибрилл. Фиг.9 показывает, что при времени 0 ECL фибрилл с (DH+) и без (DH-) G6PDH было на сходном уровне. ECL-фон, получаемый из тест-буфера (без фибрилл), также показан (А. В.). После 42 часов инкубирования (вращения при комнатной температуре) извлекали еще фибриллы и снова измеряли ECL. Как показано на Фиг. 9, ECL тест-буфера (А. В.) и фибрилл в отсутствие G6PDH (DH-) была одинакова с ECL, наблюдаемой при времени 0. Однако ECL пробы, содержащей G6PDH (DH+), была значительно ниже, чем при времени 0. Эти результаты показывают, что активность G6PDH могла быть детектирована с применением удерживаемых фибриллами ECL-биосенсоров. Отдельные исследования с конкретным НАД+-аналогом, использованным здесь (неиммобилизованным), и Ru(bpy)3 2+ (неиммобилизованным) в отсутствие фибрилл подтвердили, что восстановленный (НАДН) вариант НАД+-аналога является менее эффективным, чем окисленный (НАД+) вариант при индуцировании электрохемилюминесценции Ru(bpy)3 2+. ПРИМЕР 12 Применение углеродных нанотрубок в качестве носителя для ферментного биосенсора на основе ECL Получали ферментный биосенсор, содержащий дегидрогеназный фермент, с которым был конъюгирован как аналог никотинадениндинуклеотида (НАД+) (кофактора фермента), так и аналог рутений (II)-трис-бипиридина (Ru(bpy)3 2+). НАД+ – аналог привязывают таким образом, что он может связываться в сайте связывания кофактора фермента и вести себя, как в природном состоянии, в связанном виде (т.е. он может быть восстановлен ферментом в соответствии с обычным химическим механизмом в присутствии природного субстрата этого фермента). Кроме того, аналог Ru(bpy)3 2+ привязывают таким образом, что он может вступать в физический контакт с НАД+ (Фиг.10). В ECL-устройстве, таком как IGEN Origen  Analyser ((IGEN, Inc., Gaithersburg, MD), НАД+ и его восстановленная форма, НАДН, усиливают электрохемилюминесценцию Ru(bpy)3 2+ в различной степени.
Таким образом, на основе выхода света можно определить, присутствует в растворе НАД+, НАДН или какая-либо смесь этих двух компонентов (F. Jameison et al., Analitical Chemistry, in press). Таким образом, этот биосенсор использует различия между эффективностями ECL-реакций Ru(bpy)3 2+для детектирования степени восстановления НАД+ и, следовательно, присутствия субстрата фермента. В качестве примера, алкогольдегидрогеназа катализирует реакцию, показанную ниже: Analyser ((IGEN, Inc., Gaithersburg, MD), НАД+ и его восстановленная форма, НАДН, усиливают электрохемилюминесценцию Ru(bpy)3 2+ в различной степени.
Таким образом, на основе выхода света можно определить, присутствует в растворе НАД+, НАДН или какая-либо смесь этих двух компонентов (F. Jameison et al., Analitical Chemistry, in press). Таким образом, этот биосенсор использует различия между эффективностями ECL-реакций Ru(bpy)3 2+для детектирования степени восстановления НАД+ и, следовательно, присутствия субстрата фермента. В качестве примера, алкогольдегидрогеназа катализирует реакцию, показанную ниже:этанол (восстановленный)+НАД+(окисленный)–>(ацетальдегид (окисленный)+НАДН (восстановленный). ECL-биосенсор на основе алкогольдегидрогеназы может превращать этанол в ацетальдегид, одновременно превращая НАД+ в НАДН. Поскольку свойства ECL Ru(bpy)3 2+, иммобилизованного на этом биосенсоре, зависят от того, иммобилизован НАД+ или НАДН, ECL этого ферментного биосенсора может сообщать о присутствии этанола. Привлекательным признаком этого биосенсора является то, что, поскольку во время реакции ECL НАДН-форма кофактора повторно окисляется до НАД+-формы, одна молекула биосенсора может повторно использоваться для детектирования множественных молекул аналита. Поскольку этот биосенсор основан на растворимом ферменте (дегидрогеназе) и аналит (например, этанол) является также растворимым, было бы выгодно иммобилизовать этот биосенсор таким образом, чтобы он мог быть использован повторяющимся образом для анализа различных содержащих аналит проб без вымывания вместе с отработанным раствором аналита. Такую иммобилизацию проводят с ECL-биосенсором на основе алкогольдегидрогеназы (ADH) (показанную схематически на Фиг.10). Фиг.11 показывает иммобилизацию биосенсора на основе ADH на гранулах Dynal M450 (Lake Success, NY) (слева) и иммобилизацию на алкил-фибриллах (справа). Ни одна диаграмма не нарисована в одном масштабе, так что молекулы биосенсора в действительности гораздо меньше по сравнению с размером твердых носителей. Алкил-фибриллы получали реакцией окисленных фибрил (несущих группы СООН) с 1-аминооктаном. В обоих случаях (гранулы и фибриллы) ферментный биосенсор был иммобилизован нековалентной адсорбцией в забуференном водном растворе. Этанол детектировали с применением иммобилизованных как на гранулах, так и на фибриллах ECL-биосенсоров на основе ADH. Количество ферментного биосенсора, адсорбированного на гранулах или фибриллах, определяли измерением количества остающегося (неадсорбированного) белка в растворе по УФ-поглощению при 280 нм (поглощение при 280 нм указывает количество белка в растворе). Эти результаты показали, что 0,308 мг ADH-биосенсора связывалось на 1 мг фибрилл, тогда как 0,015 мг ADH-биосенсора связывалось на 1 мг гранул. Таким образом, на единицу веса твердого носителя адсорбционная способность фибрилл превосходила адсорбционную способность гранул Dynal. ECL-определение этанола проводили смешиванием гранул с адсорбированным ADH-биосенсором (0,50-1,25 мг) или фибрилл (0,04-0,10 мг) с раствором, содержащим 0,1 М натрий-фосфатный буфер (рН 7,2), 12 мМ семикарбазид. Некоторые пробы содержали также 0,5 мМ аналита, этанола. Твердые носители, покрытые биосенсором, втягивали в IGEN Origen  Analyzer (IGEN, Inc., Gaithersburg, MD) и измеряли ECL. Результаты одного из таких экспериментов показаны на Фиг. 12. Как с гранулами, так и с фибриллами, ECL-сигнал ферментного биосенсора уменьшался в присутствии этанола. Этот результат согласуется с результатами, полученными в исследованиях, проведенных на растворах (с использованием неиммобилизованных НАД+/НАДФ и неиммобилизованного Ru(bpy)3 2+), действия окисленного/восстановленного состояния этого НАД+-аналога на электрохемилюминесценцию Ru(bpy)3 2+. Эти результаты показали, что фибриллы могут быть использованы в качестве носителя для ферментов в ECL и, в частности, в качестве носителя для ECL-биосенсоров на основе фермента. Следует отметить, что результаты, наблюдаемые с фибриллами, были сходны с результатами, наблюдаемыми с гранулами Dynal, даже при использовании в 20 раз меньшего количества фибрилл.
ПРИМЕР 13 Analyzer (IGEN, Inc., Gaithersburg, MD) и измеряли ECL. Результаты одного из таких экспериментов показаны на Фиг. 12. Как с гранулами, так и с фибриллами, ECL-сигнал ферментного биосенсора уменьшался в присутствии этанола. Этот результат согласуется с результатами, полученными в исследованиях, проведенных на растворах (с использованием неиммобилизованных НАД+/НАДФ и неиммобилизованного Ru(bpy)3 2+), действия окисленного/восстановленного состояния этого НАД+-аналога на электрохемилюминесценцию Ru(bpy)3 2+. Эти результаты показали, что фибриллы могут быть использованы в качестве носителя для ферментов в ECL и, в частности, в качестве носителя для ECL-биосенсоров на основе фермента. Следует отметить, что результаты, наблюдаемые с фибриллами, были сходны с результатами, наблюдаемыми с гранулами Dynal, даже при использовании в 20 раз меньшего количества фибрилл.
ПРИМЕР 13Биотинилированные фибриллы и бифункциональные биотинилированные алкил-фибриллы Было обнаружено, что поверхности фибрилл могут быть биотинилированными или как алкилированными, так и биотинилированными. Затем фибриллы, содержащие такие модификации, могут связывать любые конъюгированные со стрептавидином вещества, такие как стрептавидиновые гранулы и связанные со стрептавидином ферменты. Фибриллы предоставляют большие преимущества, чем твердые носители, вследствие их высокой площади поверхности. Гранулы, которые могут быть сделаны сильно магнитными, очень применимы в разделительных анализах. Биотинилированные фибриллы, описанные здесь, объединяют преимущества как фибрилл, так и гранул. Биотинилированные алкил-фибриллы являются расширением той же самой идеи, но обнаруживают дополнительное свойство адсорбции белков алкил-фибрилл. Покрытые стрептавидином и биотином фибриллы могут быть использованы в диагностике и могут быть использованы в качестве улавливающих агентов для электрохемилюминесцентных анализов. Новым признаком данного изобретения является сочетание двух твердых носителей на одной фибрилле с образованием бифункциональной фибриллы. Кроме того, описанный способ увеличивает площадь поверхности для гранул и значительно увеличивает намагниченность фибрилл. Получение биотинилированных фибрилл Биотинилированные фибриллы получали смешиванием 2,4 мг амино-фибрилл, полученных в основном, как описано в Получении О, и 9 мг биотина с длинной NHS-эфирной цепью в буфере 0,2 М NаНСО3 при рН 8,15. Эту смесь вращали при комнатной температуре в течение 4 часов и промывали тем же самым буфером дважды. Получение биотинилированных алкил-фибрилл Биотинилированные алкил-фибриллы получали в двухстадийной реакции. Во-первых, смешивали 4,25 мг бифункциональных фибрилл (содержащих как амино, так и карбоксил) и 25 мг биотина с длинной NHS-эфирной цепью. Фибриллы промывали и сушили в вакууме. Вторую реакцию проводили путем смешивания 4 мг биотинилированных бифункциональных фибрилл с 11мг EDC (1-этил-3-(3-диметиламинопропил)карбодиимида), 7,5 мг DMAP (4-диметиламинопиридина) и 10 мкл NН2(СН2)7СН3 в 0,5 мл ДМФ. Смесь перемешивали при комнатной температуре в течение ночи. Конечные биотинилированные алкил-фибриллы промывали CH2Cl2, MeOH и дН2О. ПРИМЕР 14 Биотинилированные фибриллы в качестве твердого носителя в ECL-анализах Биотинилированные фибриллы могут использоваться в ECL-анализах, включающих формы проведения анализов, которые требуют взаимодействий стрептавидин-биотин или авидин-биотин. Биотинилированные фибриллы могли бы быть дополнительно дериватизованы стрептавидином. Биотин, ковалентно связанный с фибриллами (см. Пример 13), мог бы образовать сильные нековалентные связывающие взаимодействия со стрептавидином. Поскольку стрептавидин представляет собой тетрамерный белок с четырьмя равноценными сайтами связывания, стрептавидин, связанный с биотинилированными фибриллами, мог бы почти наверняка иметь незанятые сайты связывания, с которыми могли бы связываться дополнительные биотинилированные реагенты. Таким образом, биотинилированные фибриллы могли бы быть превращены в покрытые стрептавидином фибриллы. Имеется ряд аналитических тестов, которые могли бы выполняться с такими фибрилла-биотин-стрептавидиновыми (FBS) носителями. Например, биотинилированное антитело против аналита могло бы улавливаться на FBS-носителе (либо перед образованием комплекса антитела с аналитом, либо после этого). Анализы с использованием биотинилированных антител против аналитов хорошо разработаны. Такие анализы включают конкурентные анализы, в которых представляющий интерес аналит конкурирует с введенным Ru(bpy)3 2+ -меченым аналитом за связывание с антителом против аналита. Свободный (несвязанный) аналит и свободный (несвязанный) Ru(bpy)3 2+ -меченый аналит можно вымыть из иммобилизованных фибриллой антител. Стадия промывания зависит от фибрилл, физически отделенных от фазы раствора общепринятыми способами, включающими центрифугирование, фильтрование или притягивание к магниту. Кроме конкурентного анализа, иммуноанализ типа сэндвич-иммуноанализа мог бы проводиться на FBS-носителях. Сэндвич-иммуноанализы хорошо известны в области диагностики в целом и в ECL-детектировании, в частности. Такие анализы включают связывание аналита одновременно с двумя антителами; первым “первичным” антителом, которое прикреплено на твердом носителе, например, будучи меченым биотином, и “вторичным” антителом, которое не прикреплено к твердой поверхности, но помечено репортерной группой, такой как Ru(bpy)3 2+, в ECL-приложениях. Такой сэндвич-анализ мог бы проводиться с использованием фибрилл в качестве твердого захватывающего носителя, посредством которого фибриллы улавливаются, как описано в предшествующем параграфе. Следовательно, в таком анализе, фибриллы могли бы иметь ковалентно связанный с ними биотин, который мог бы связываться со стрептавидином, который, в свою очередь, связан с биотинилированным первичным антителом, которое могло бы связываться с аналитом (если он присутствует), который мог бы быть связан с Ru(bpy)3 2+ – меченным вторичным антителом. Аналогично, анализы с ДНК-зондом могли бы проводиться с использованием FBS-носителей. Биотинилированная одноцепочечная ДНК может быть связана с FBS-носителями и может происходить конкурентная гибридизация между комплементарными одноцепочечными молекулами ДНК (аналитом) и комплементарными Ru(bpy)3 2+ -мечеными олигонуклеотидами. Другой тип биотинилированных фибрилл, биотинилированные алкил-фибриллы, могут использоваться в иммуноанализах и анализах с ДНК-зондами. Как описано в Примере 13, биотинилированные фибриллы могут быть модифицированы ковалентным присоединением биотина к одному типу функциональной группы, а цепи алкила к другому типу функциональной группы. Полученные алкилированные биотинилированные фибриллы могут быть использованы в специфической ассоциации как со стептавидином, так и с авидином (через биотин), а также для адсорбции белков (через алкильные цепи). Алкил-фибриллы могли бы использоваться в соединении с другими твердыми носителями, такими как покрытые стрептавидином магнитные гранулы, в том числе магнитные гранулы Dynal. Одним из преимуществ фибрилл над такими гранулами является то, что они имеют гораздо большую площадь поверхности (на единицу веса). Следовательно, если фибриллы могли бы быть присоединены к наружной поверхности магнитных гранул, это существенно улучшило бы площадь поверхности и, следовательно, связывающую емкость этих гранул. Предполагается, что алкилированные, биотинилированные фибриллы могли бы смешиваться с покрытыми стрептавидином гранулами, приводя к высоким афинным взаимодействиям стрептоавидина (гранула)-биотина (фибрилла) и, следовательно, получению покрытых фибриллами гранул с чрезвычайно высокой площадью поверхности. Поскольку алкил-фибриллы могут связывать белки посредством адсорбции, покрытые этими фибриллами гранулы могли бы образовать дальнейшие производные с адсорбированными белками, в том числе со стрептавидином и антителами. Как описано выше, покрытые стрептавидином или антителами фибриллы могут использоваться в иммуноанализах и анализах с ДНК-зондами. Таким образом, покрытые фибриллами гранулы могли бы улучшить свойства этих гранул значительным увеличением площади их поверхности, так что будет требоваться меньшее количество гранул в конкретном анализе для получения того же самого результата. ПРИМЕР 15 Магнито-чувствительные углеродные нанотрубки Фибриллы могут обладать магнитными свойствами. Степень, до которой фибриллы могут быть сделаны магнитными или немагнитными, регулируется количеством катализатора, который находится в фибрилле в результате процесса образования фибриллы. Такие процессы описаны в US Patents 4663230, 5165909 и 5171560. Магнитное свойство фибрилл наблюдали после функционализации фибрилл, т. е. алкилированных фибрилл, связанных с белком фибрилл и т.д. Фибриллы после некоторых реакций (например, алкилирования) мигрируют заметно быстрее к магниту, чем перед такой реакцией. Одна из гипотез этого явления заключается в том, что может происходить какой-то тип агрегации или сольватации во время процесса реакции. Однако истинный механизм в настоящее время остается невыясненным. ПРИМЕР 16 Снижение неспецифического связывания Ru(bpy)3 2+ c модифицированными ПЭГ фибриллами Исходные дисперсии окисленных хлоратом фибрилл, фибрилл, модифицированных ПЭГ с применением бензоилпероксида, и фибрилл, модифицированных ПЭГ NHS-эфирным связыванием, получали при 1,0 мг/мл в 50 мМ калий-фосфатном буфере, рН 7,0 с обработкой ультразвуком. 2 мл 10-кратных серийных разведении каждой из них помещали в каждую из 5 полипропиленовых пробирок. 50 мкл исходного раствора Ru(bpy)3 2+ (приблизительно 10 мкМ) в том же самом буфере добавляли в каждую пробирку и в 3 пробирки слепого контроля (буфер). Также готовили три пробирки с буфером без Ru(bpy)3 2+. Все пробирки перемешивали на вортексе и давали им инкубироваться в течение ночи. Все пробирки центрифугировали для отделения фибрилл и аликвоты 0,1 мл супернатанта переносили в новые пробирки и разбавляли 1,0 мл Origen  тест-буфера (IGEN, Inc., Gaithersburg, MD) и анализировали на Ru(bpy)3 2+ по ECL с использованием Magnalyzer тест-буфера (IGEN, Inc., Gaithersburg, MD) и анализировали на Ru(bpy)3 2+ по ECL с использованием Magnalyzer (IGEN, Inc., Gaithersburg, MD). Уровень Ru(bpy)3 2+, остающегося в супернатанте, был непрямой мерой количества, которое было неспецифически связано с фибриллами (Фиг.13). Для обоих модифицированных ПЭГ материалов фибрилл по существу весь Ru(bpy)3 2+, оставшийся в супернатанте фибрилл, составлял количество до 0,1 мг/мл. Имелось 20-30% уменьшение Ru(bpy)3 2+ в супернатанте при 0,1 мг/мл этих фибрилл. В противоложность этому, в случае окисленных хлоратом фибрилл почти не имелось Ru(bpy)3 2+, остающегося в супернатанте при 1,0 мг/мл, и было 20-30% уменьшение Ru(bpy)3 2+ в супернатанте при 0,1 мг/мл этих фибрилл без ПЭГ-модификации. (IGEN, Inc., Gaithersburg, MD). Уровень Ru(bpy)3 2+, остающегося в супернатанте, был непрямой мерой количества, которое было неспецифически связано с фибриллами (Фиг.13). Для обоих модифицированных ПЭГ материалов фибрилл по существу весь Ru(bpy)3 2+, оставшийся в супернатанте фибрилл, составлял количество до 0,1 мг/мл. Имелось 20-30% уменьшение Ru(bpy)3 2+ в супернатанте при 0,1 мг/мл этих фибрилл. В противоложность этому, в случае окисленных хлоратом фибрилл почти не имелось Ru(bpy)3 2+, остающегося в супернатанте при 1,0 мг/мл, и было 20-30% уменьшение Ru(bpy)3 2+ в супернатанте при 0,1 мг/мл этих фибрилл без ПЭГ-модификации.
Формула изобретения
РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 13.12.2007 № РД0030188
Извещение опубликовано: 7.01.2008 БИ: 03/2008
|
||||||||||||||||||||||||||
