Патент на изобретение №2186070
|
||||||||||||||||||||||||||
(54) МОНОСУЛЬФАТ АЗАПЕПТИДНОГО ПРОИЗВОДНОГО И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ ВИЧ-ПРОТЕАЗУ
(57) Реферат: Описано новое соединение общей формулы I 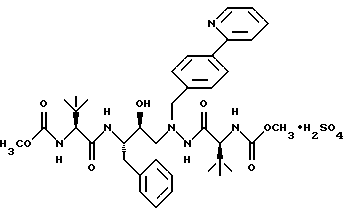 представляющее собой кристаллическую соль моносульфат азапептидного производного, проявляющее высокую скорость растворимости в воде, значительно улучшенную пероральную биодоступность при введении животным по сравнению со свободным основанием. Описана фармацевтическая композиция, включающая в качестве активного начала соединение формулы I. 2 с.п.ф-лы, 5 ил. ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ 1. Область, к которой относится изобретение Изобретение предлагает новую кристаллическую соль – моносульфат азапептидного ингибитора ВИЧ-протеазы формулы 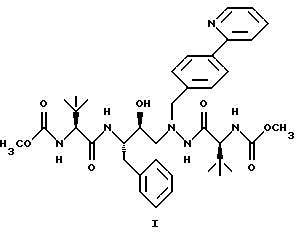 которая проявляет неожиданно улучшенные свойства – растворимость в воде/растворение – по сравнению с другими солями и значительно улучшенную биодоступность при пероральном приеме животными по сравнению со свободным основанием. Таким образом, моносульфат применим для фармацевтических лекарственных форм вышеуказанного ингибитора протеазы, особенно для пероральных лекарственных форм. 2. Уровень техники Опубликованная РСТ патентная заявка WO 97/40029 раскрывает ряд азапептидных ингибиторов ВИЧ-протеазы, которые, как сообщают, обладают высокой ингибирующей активностью в отношении вируса ВИЧ. Одно из веществ, включенных в объем WO 97/40029, представляет собой соединение, имеющее структурную формулу 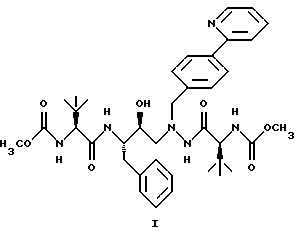 и химическое название диметиловый эфир [3S-(3R*,8’R*,9’R*,12R*)]-3,12-бис(1,1-диметилэтил)-8-гидрокси-4,11-диоксо-9-(фенилметил)-6-[[4-(2-пиридинил)-фенилметил] -2,5,6,10,13-пентаазатетрадекандиовой кислоты и оценивается как возможный ингибитор второго поколения ВИЧ-протеазы. WO 97/40029 описывает азапептидные производные, такие как соединение I, в форме оснований, а также различные формацевтически приемлемые соли присоединения. Хотя ряд органических и неорганических кислот упомянут в качестве возможного солеобразующего агента, включая серную кислоту, там нет упоминания моносульфата, который представляет собой предмет данного изобретения. СУЩНОСТЬ ИЗОБРЕТЕНИЯ Данное изобретение предоставляет соль – моносульфат соединения I, имеющий следующую формулу 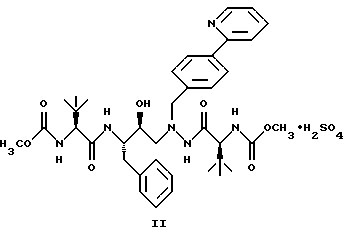 ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Изобретение иллюстрируется графиками, показывающими: Фиг. 1 – зависимость растворимости солей, получающихся при присоединении кислот, от величины рН. Фиг.IIа – физическую стабильность моносульфата. Фиг.IIв – физическую стабильность гидрохлорида. Фиг.IIс – физическую стабильность метасульфоната Фиг.IId- физическую стабильность сульфата. Соединение I, раскрытое выше, представляет собой слабое органическое основание с растворимостью в воде менее 1 мкг/мл при 24  3oС. Кристаллическое свободное основание в виде суспензии в воде или масле обладает малой биодоступностью при пероральном введении животным, возможно, из-за своей чрезвычайно низкой растворимости в этих носителях.
Для разработки фармацевтических рецептур, в частности пероральных лекарственных форм, активный ингредиент должен иметь достаточную биодоступность при пероральном введении. Так как соединение I в виде свободного основания не обладает такой биодоступностью, авторами настоящего изобретения исследовались соли присоединения кислот. Ряд обычно применяемых солей, получающихся при присоединении кислот, такие, например, как гидрохлорид, бензолсульфонат, метансульфонат, п-толуолсульфонат, фосфат, нитрат, 1,2-этандисульфонат, изэтионат и сульфат, оценивались, помимо моносульфата по данному изобретению. Все эти соли в кристаллической форме проявляют пониженную растворимость в воде (1-3 мг/мл или менее при 24 3oС. Кристаллическое свободное основание в виде суспензии в воде или масле обладает малой биодоступностью при пероральном введении животным, возможно, из-за своей чрезвычайно низкой растворимости в этих носителях.
Для разработки фармацевтических рецептур, в частности пероральных лекарственных форм, активный ингредиент должен иметь достаточную биодоступность при пероральном введении. Так как соединение I в виде свободного основания не обладает такой биодоступностью, авторами настоящего изобретения исследовались соли присоединения кислот. Ряд обычно применяемых солей, получающихся при присоединении кислот, такие, например, как гидрохлорид, бензолсульфонат, метансульфонат, п-толуолсульфонат, фосфат, нитрат, 1,2-этандисульфонат, изэтионат и сульфат, оценивались, помимо моносульфата по данному изобретению. Все эти соли в кристаллической форме проявляют пониженную растворимость в воде (1-3 мг/мл или менее при 24 3oС) по сравнению с моносульфатом, растворимость которого в тех же условиях составляет примерно 4-5 мг/мл.
В твердом состоянии наблюдались превращения, когда соли присоединения других упомянутых кислот суспендировали в воде, возможно, вследствие их диссоциации с образованием свободного основания. В большинстве случаев эти превращения сопровождались образованием геля. В отличие от других вышеупомянутых кислот дополнительный протон моносульфата препятствует превращению в свободное основание, которое, как сказано выше, очень плохо растворимо в воде и обладает слабой биодоступностью при пероральном введении. Необычная растворимость моносульфата в воде подробно представлена далее.
В целом, превращение солей в неионизированную форму и наоборот может быть объяснено на основе теории растворимости в зависимости от рН. Растворимость свободного основания в воде определяли как функцию рН при 24 3oС) по сравнению с моносульфатом, растворимость которого в тех же условиях составляет примерно 4-5 мг/мл.
В твердом состоянии наблюдались превращения, когда соли присоединения других упомянутых кислот суспендировали в воде, возможно, вследствие их диссоциации с образованием свободного основания. В большинстве случаев эти превращения сопровождались образованием геля. В отличие от других вышеупомянутых кислот дополнительный протон моносульфата препятствует превращению в свободное основание, которое, как сказано выше, очень плохо растворимо в воде и обладает слабой биодоступностью при пероральном введении. Необычная растворимость моносульфата в воде подробно представлена далее.
В целом, превращение солей в неионизированную форму и наоборот может быть объяснено на основе теории растворимости в зависимости от рН. Растворимость свободного основания в воде определяли как функцию рН при 24 3oС и она показана ниже на фиг.1. рН, при котором соединение имеет наибольшую растворимость, обозначается рНmax и, как найдено, равно примерно 1,2. В литературе сообщалось, что в случае слабоосновного соединения при рН>pHmax равновесная твердая фаза водной суспензии соединения представляет собой свободное основание. При рН 3oС и она показана ниже на фиг.1. рН, при котором соединение имеет наибольшую растворимость, обозначается рНmax и, как найдено, равно примерно 1,2. В литературе сообщалось, что в случае слабоосновного соединения при рН>pHmax равновесная твердая фаза водной суспензии соединения представляет собой свободное основание. При рН 3oС в течение, по меньшей мере, 24 часов. рН суспензии после установления равновесия был 2,1 3oС в течение, по меньшей мере, 24 часов. рН суспензии после установления равновесия был 2,1 0,1, что выше, чем рНmax. Нерастворенные твердые частицы этих суспензий отделяли, сушили на воздухе и идентифицировали. Термическим и элементным анализом нерастворенные твердые вещества из этих соединений были идентифицированы как свободное основание. Такой результат ожидали исходя из кривой рН-растворимости, показанной на вышеприведенном графике (фиг.1), и из литературных данных.
Когда избыток моносульфата достигал равновесного состояния в воде, в твердой фазе, находящейся в равновесии с раствором, происходило изменение. Однако нерастворенная твердая фаза после уравновешивания не была свободным основанием, хотя рН (1,9 0,1, что выше, чем рНmax. Нерастворенные твердые частицы этих суспензий отделяли, сушили на воздухе и идентифицировали. Термическим и элементным анализом нерастворенные твердые вещества из этих соединений были идентифицированы как свободное основание. Такой результат ожидали исходя из кривой рН-растворимости, показанной на вышеприведенном графике (фиг.1), и из литературных данных.
Когда избыток моносульфата достигал равновесного состояния в воде, в твердой фазе, находящейся в равновесии с раствором, происходило изменение. Однако нерастворенная твердая фаза после уравновешивания не была свободным основанием, хотя рН (1,9 0,2) суспензии был выше pHmax и сравним с рН суспензий описанных выше солей – метансульфоната и гидрохлорида. Твердую фазу после, по меньшей мере, 24 часов уравновешивания идентифицировали элементным анализом как гидратированная форма 2:1 соли свободного основания и серной кислоты (называемой сульфатом). Такое поведение моносульфата является неожиданным исходя из теории зависимости рН-растворимости.
Когда, в свою очередь, избыток сульфата уравновешивали в воде, в твердой уравновешенной с раствором фазе происходило изменение. Нерастворенные частицы суспезии отделяли, сушили на воздухе и идентифицировали. Термический и элементный анализ этой нерастворенной твердой фазы был аналогичен анализу свободного основания, хотя превращение сульфата в свободное состояние было не таким однозначным, как в случае метансульфоната и гидрохлорида. С фармацевтической точки зрения склонность солей к превращению в свободное состояние в водной среде не является желательным из-за низкой биодоступности свободного основания при пероральном введении. Следовательно, моносульфат, вследствие своего уникального поведения в водном растворе, дает неожиданное преимущество.
Свойство растворимости моносульфата в воде также было неожиданным, если принимать во внимание взаимодействие свободного основания I и серной кислоты в воде. Например, растворимость свободного основания в воде составляет менее 1 мг/мл при рН ~ 1,8, достигнутом с помощью серной кислоты, по сравнению с растворимостью – 4-5 мг/мл – моносульфата в воде при сравнимом значении рН. Если исходить из теории рН-растворимости, следовало бы ожидать, что свободное основание и соль должны иметь сходную растворимость при данном значении рН.
Повышенные свойства растворимость/растворение моносульфата приводят к повышенной пероральной биодоступности у животных по сравнению со свободным основанием. Было обнаружено, что абсолютная пероральная биодоступность моносульфата равна примерно 20% у собак при введении “несформулированного” твердого вещества (не в виде состава) в желатиновой капсуле. По сравнению с этим кристаллическое свободное основание имеет минимальную пероральную биодоступность у собак.
Помимо оптимальной растворимости другим желательным свойством лекарственных форм солей является физическая стабильность. Термин “физическая стабильность” показывает на способность соли сохранять свою кристаллическую структуру (включая, если таковые есть, кристаллизационные растворители) в условиях хранения/нагрузок. Заметные изменения физической природы соли, как показано термическими методами, такими как дифференциальная сканирующая калориметрия, нежелательны. Соль – моносульфат – показала прекрасную физическую стабильность при хранении при 40oС/75% относительной влажности (RH) в течение 9 месяцев, как показано ниже на Фиг. IIа. Дифференциальная сканирующая калориметрия не выявила заметных изменений термических свойств напряженного образца (образца под нагрузкой) соли – моносульфата – по сравнению с образцом без нагрузки (хранение при 2-8oС в закрытой упаковке). С другой стороны, метансульфонат, гидрохлорид и сульфат продемонстрировали значительные изменения термических свойств при хранении при 40oС/75% RH в течение всего двух недель, как показано на Фиг.IIb, c и d. Хотя различие физической стабильности солей не является необычным, склонность конкретной соли образовывать сольваты (или кристаллические модификации) и ее способность удерживать кристаллизационный растворитель (физическая стабильность кристаллических модификаций) в условиях хранения/нагрузки нельзя предсказать заранее.
Моносульфат можно получать реакцией раствора свободного основания соединения I с серной кислотой в растворителях, таких, например, как ацетонитрил, изопропанол, этанол или ацетон, и затем выделять полученную таким образом соль – моносульфат.
Из-за своей высокой биодоступности, также как и высокой степени кристалличности и высокой стабильности, соль-моносульфат пригодна для получения лечебных форм соединения I для перорального введения. Следующие далее примеры иллюстрируют получение отдельных рецептур для перорального введения.
Соль-моносульфат и ее рецептуры применяют, как описано в WO 97/40029 для лечения заболеваний, вызванных вирусами, особенно ретровирусами, например, такими, как вирус ВИЧ.
ОПИСАНИЕ КОНКРЕТНЫХ ВАРИАНТОВ 0,2) суспензии был выше pHmax и сравним с рН суспензий описанных выше солей – метансульфоната и гидрохлорида. Твердую фазу после, по меньшей мере, 24 часов уравновешивания идентифицировали элементным анализом как гидратированная форма 2:1 соли свободного основания и серной кислоты (называемой сульфатом). Такое поведение моносульфата является неожиданным исходя из теории зависимости рН-растворимости.
Когда, в свою очередь, избыток сульфата уравновешивали в воде, в твердой уравновешенной с раствором фазе происходило изменение. Нерастворенные частицы суспезии отделяли, сушили на воздухе и идентифицировали. Термический и элементный анализ этой нерастворенной твердой фазы был аналогичен анализу свободного основания, хотя превращение сульфата в свободное состояние было не таким однозначным, как в случае метансульфоната и гидрохлорида. С фармацевтической точки зрения склонность солей к превращению в свободное состояние в водной среде не является желательным из-за низкой биодоступности свободного основания при пероральном введении. Следовательно, моносульфат, вследствие своего уникального поведения в водном растворе, дает неожиданное преимущество.
Свойство растворимости моносульфата в воде также было неожиданным, если принимать во внимание взаимодействие свободного основания I и серной кислоты в воде. Например, растворимость свободного основания в воде составляет менее 1 мг/мл при рН ~ 1,8, достигнутом с помощью серной кислоты, по сравнению с растворимостью – 4-5 мг/мл – моносульфата в воде при сравнимом значении рН. Если исходить из теории рН-растворимости, следовало бы ожидать, что свободное основание и соль должны иметь сходную растворимость при данном значении рН.
Повышенные свойства растворимость/растворение моносульфата приводят к повышенной пероральной биодоступности у животных по сравнению со свободным основанием. Было обнаружено, что абсолютная пероральная биодоступность моносульфата равна примерно 20% у собак при введении “несформулированного” твердого вещества (не в виде состава) в желатиновой капсуле. По сравнению с этим кристаллическое свободное основание имеет минимальную пероральную биодоступность у собак.
Помимо оптимальной растворимости другим желательным свойством лекарственных форм солей является физическая стабильность. Термин “физическая стабильность” показывает на способность соли сохранять свою кристаллическую структуру (включая, если таковые есть, кристаллизационные растворители) в условиях хранения/нагрузок. Заметные изменения физической природы соли, как показано термическими методами, такими как дифференциальная сканирующая калориметрия, нежелательны. Соль – моносульфат – показала прекрасную физическую стабильность при хранении при 40oС/75% относительной влажности (RH) в течение 9 месяцев, как показано ниже на Фиг. IIа. Дифференциальная сканирующая калориметрия не выявила заметных изменений термических свойств напряженного образца (образца под нагрузкой) соли – моносульфата – по сравнению с образцом без нагрузки (хранение при 2-8oС в закрытой упаковке). С другой стороны, метансульфонат, гидрохлорид и сульфат продемонстрировали значительные изменения термических свойств при хранении при 40oС/75% RH в течение всего двух недель, как показано на Фиг.IIb, c и d. Хотя различие физической стабильности солей не является необычным, склонность конкретной соли образовывать сольваты (или кристаллические модификации) и ее способность удерживать кристаллизационный растворитель (физическая стабильность кристаллических модификаций) в условиях хранения/нагрузки нельзя предсказать заранее.
Моносульфат можно получать реакцией раствора свободного основания соединения I с серной кислотой в растворителях, таких, например, как ацетонитрил, изопропанол, этанол или ацетон, и затем выделять полученную таким образом соль – моносульфат.
Из-за своей высокой биодоступности, также как и высокой степени кристалличности и высокой стабильности, соль-моносульфат пригодна для получения лечебных форм соединения I для перорального введения. Следующие далее примеры иллюстрируют получение отдельных рецептур для перорального введения.
Соль-моносульфат и ее рецептуры применяют, как описано в WO 97/40029 для лечения заболеваний, вызванных вирусами, особенно ретровирусами, например, такими, как вирус ВИЧ.
ОПИСАНИЕ КОНКРЕТНЫХ ВАРИАНТОВПример 1 Приготовление соли – моносульфата из этанола В трехгорлую круглодонную колбу, снабженную высокой мешалкой и капельной воронкой, добавляют при перемешивании 15,013 г (0,0213 моль) свободного основания соединения I и 113 мл этанола пробы 200. К этой суспензии добавляют по каплям в течение 90 секунд 1,28 мл концентрированной серной кислоты. После добавления серной кислоты получают раствор прозрачного янтарного цвета. Раствор отфильтровывают через фильтр тонкой очистки 1 Ватман и промывают 5 мл этанола пробы 200. К раствору добавляют 58 мл гептана и 37,5 мг (0,25 вес. %) кристаллической затравки соединения формулы II и затем дополнительно 55 мл гептана. Полученную смесь перемешивают в течение 6 часов при 300 об/мин. Полученную кристаллическую суспензию фильтруют и промывают 50 мл смеси этанол/гептан (1:1) и сушат в вакууме при 60oС в течение ночи с получением 15,11 г требуемой кристаллической моносульфатной соли (выход 88,4 мол. %), имеющей вышеприведенную формулу II. Характеристические свойства моносульфатной соли Элементный анализ. Вычислено для С38Н52N6О  1,0 Н2SО4,%: С 56,84; Н 6,78; N 10,37; S 3,99.
Найдено,%: С 56,72; Н 6,65; N 10,41; S 3,83.
Т. пл. 195oС.
Н20=0,28% (KF).
Пример 2 1,0 Н2SО4,%: С 56,84; Н 6,78; N 10,37; S 3,99.
Найдено,%: С 56,72; Н 6,65; N 10,41; S 3,83.
Т. пл. 195oС.
Н20=0,28% (KF).
Пример 2Приготовление соли – моносульфата из ацетона 5М H2S04 (8,52 мл, 42,6 мМ) добавляют по каплям к суспензии свободного основания соединения формулы I (30,0 г, 42,6 мМ) в ацетоне (213 мл), перемешиваемой с помощью механической мешалки и помещенной в масляную баню с температурой 50oС. Почти немедленно получают прозрачный раствор. К раствору добавляют затравку кристаллов свободного основания соединения формулы II. Через две минуты образуется осадок, который становится пастой. Смесь перемешивают в течение одного часа при 50oС, 30 минут при 25oС и в течение 2 часов при 0oС. Раствор отфильтровывают и первый фильтрат используют для того, чтобы перенести оставшийся в колбе материал в воронку для фильтрования. Продукт промывают ацетоном, затем гептаном и сушат в вакууме в течение ночи с получением 31,48 г (исправленный выход 92%) моносульфатной соли формулы II1, т.пл. 198-199oС с разл. Элементный анализ. Вычислено для С38Н52N6О7  1,0 Н2SO4 1,0 Н2SO4 0,2 Н2О,%: С 56,59; Н 6,80; N 10,42; S 3,98; Н2О 0,45.
Найдено,%: С 56,66; Н 6,78; N 10,50; S 4,20; H2O 0,45 (KF).
Пример 3 0,2 Н2О,%: С 56,59; Н 6,80; N 10,42; S 3,98; Н2О 0,45.
Найдено,%: С 56,66; Н 6,78; N 10,50; S 4,20; H2O 0,45 (KF).
Пример 3Приготовление соли – моносульфата из изопропанола Водную серную кислоту (5,0 М, 0,20 мл, 1 мМ) добавляют к суспензии свободного основания соединения формулы I (0,704 г, 1 мМ) в изопропаноле (4,0 мл), охлажденной на ледяной бане. Ледяную баню удаляют и смесь перемешивают при комнатной температуре. Суспензия растворяется в течение 15 минут. К раствору добавляют затравку кристаллов, как в вышеописанных Примерах 1 или 2, и перемешивают в течение 5 часов. Твердый осадок отфильтровывают и первый фильтрат используют для того, чтобы перенести оставшийся в колбе материал в воронку для фильтрования. Продукт промывают гептаном и сушат в вакууме в течение ночи с получением 0,752 г кристаллической моносульфатной соли формулы II, выход 90%, т.пл. 160-190oС с разл. Элементный анализ. Вычислено для С38Н52N6О7  1,0 H2SO4 1,0 H2SO4 2,0 Н2О,%: С 54,40; Н 6,97; N 10,02; S 3,82; Н2О 4,29.
Найдено,%: С 54,25; Н 6,73; N 10,02; S 3,67; Н20 4,53 (KF).
Рентгенограмма кристаллов, полученных из изопропанола, отлична от рентгенограммы кристаллов, полученных из ацетонитрила, этанола-гептана или ацетона. В настоящее время их называют кристаллами Типа II. Кристаллы Типа I, по-видимому, являются безводным/десольватированным кристаллическим веществом, тогда как кристаллы Типа II представляют собой гидратированную, гигроскопическую кристаллическую форму.
Пример 4 2,0 Н2О,%: С 54,40; Н 6,97; N 10,02; S 3,82; Н2О 4,29.
Найдено,%: С 54,25; Н 6,73; N 10,02; S 3,67; Н20 4,53 (KF).
Рентгенограмма кристаллов, полученных из изопропанола, отлична от рентгенограммы кристаллов, полученных из ацетонитрила, этанола-гептана или ацетона. В настоящее время их называют кристаллами Типа II. Кристаллы Типа I, по-видимому, являются безводным/десольватированным кристаллическим веществом, тогда как кристаллы Типа II представляют собой гидратированную, гигроскопическую кристаллическую форму.
Пример 4Приготовление капсулированных рецептур соли – моносульфата А. Капсулы (50 и 200 мг эквивалента свободного основания) Капсулы предназначены для перорального приема, при этом капсула представляет собой твердую желатиновую непрозрачную капсулу серого цвета размера 0, содержащую моносульфат формулы II, рецептура которого представляет собой совокупность увлажненных гранул с лактозой, кросповидоном и стеаратом магния. В. Капсулы (100 мг эквивалента свободного основания) Капсулы предназначены для перорального приема, при этом капсула представляет собой твердую желатиновую непрозрачную капсулу серого цвета размера 0, содержащую моносульфат формулы II, взвешенный в Gelucire 44/14. Gelucire 44/14 представляет собой ненасыщенный полигликолизированный глицерид, состоящий из моно-, ди- и триглицеридов и моно- и диэфиров жирных кислот и полиэтиленгликоля. Капсулы готовят, расплавляя Gelucire 44/14 при 45-70oС с последующим добавлением соли – моносульфата при перемешивании. Расплавленную смесь заливают в твердые желатиновые капсулы, дают охладиться и затвердеть. Формула изобретения
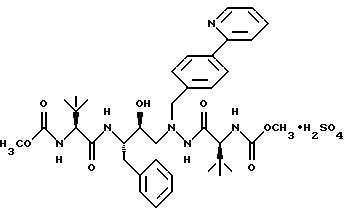 2. Фармацевтическая композиция, ингибирующая ВИЧ-протеазу, содержащая соединение по п. 1 и фармацевтически приемлемый носитель. РИСУНКИ
|
||||||||||||||||||||||||||
