Патент на изобретение №2186066
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ 5-АРИЛ-3-(8-АЗАБИЦИКЛО[3.2.1]ОКТ-3-ИЛ)-1,3,4-ОКСАДИАЗОЛ-2(3H)-ОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
(57) Реферат: Настоящее изобретение относится к производным 5-арил-3-(8-азабицикло[3.2.1] окт-3-ил)-1,3,4-оксадиазол-2(3Н)-она общей формулы I, в которой R1 представляет собой алкильную или циклоалкилметильную группу, Х1 представляет собой атом водорода или галогена, или алкоксильную группу, или альтернативно OR1 и Х1 вместе представляют собой -ОСН2О-, -О(СН2)2-, -О(СН2)3-, -О(СН2)2О- или -О(СН2)3О- – группу, Х2 представляет собой атом водорода или аминогруппу, Х3 представляет собой атом водорода или галогена, R2 представляет собой атом водорода, возможно замещенную алкильную группу, возможно замещенную фенилалкильную группу или группу -(СН2)nCO-Z, в которой n равно числу 1 – 6, Z представляет собой 1-пиперидильную группу. Описаны также способ их получения, фармацевтическая композиция и лекарственное средство. Соединения можно применять для лечения и профилактики расстройств центральной нервной системы, желудочно-кишечного тракта. 4 с. и 3 з.п. ф-лы, 2 табл. 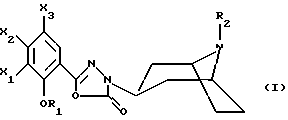
Настоящее изобретение относится к соединениям, соответствующим общей формуле (I) 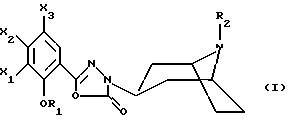 в которой R1 представляет собой (С1-С4)алкильную или (С3-7)циклоалкилметильную группу, X1 представляет собой атом водорода или галогена, или (С1-С4)алкоксильную группу, или альтернативно OR1 и X1 вместе представляют собой группу формулы -ОСН2O-, -O(СН2)2-, -O(СН2)3-, -О(CH2)2O- или -O(СН2)3О-, Х2 представляет собой атом водорода или аминогруппу, Х3 представляет собой атом водорода или галогена и R2 представляет собой атом водорода, (С1-С6)алкильную группу, фенил(С1-С4)алкильную группу или группу общей формулы -(СН2)nСО-Z, в которой n равно числу от 1 до 6, и Z представляет собой 1-пиперидильную или 4-(диметиламино)-1 -пиперидильную группу. Когда R2 представляет собой алкильную группу, такой группой предпочтительно является бутильная группа. Когда R2 представляет собой фенил(С1-С3)алкильную группу, такой группой предпочтительно является 2-фенилэтильная группа. Когда R2 представляет собой группу общей формулы -(СН2)nСО-Z, такой группой предпочтительно является 4-[4-(диметиламино)-1-пиперидил]-4-оксобутильная группа, 5-[4-(диметиламино)-1-пиперидил]-4-оксопентильная группа или 6-[4-(диметиламино)-1-пиперидил]-6-оксогексильная группа. Соединения по изобретению могут существовать в форме свободных оснований или фармацевтически приемлемых солей присоединения кислоты. Из-за тропанового кольца они могут быть также в форме эндо- или экзо-изомеров. Более того, некоторые заместители R2 могут содержать асимметрический атом углерода; поэтому данные соединения могут существовать в виде различных чистых или смешанных геометрических и/или оптических изомерных форм. Известны (патентная заявка ЕР-0554794) N-(8-азабицикло[3.2.1]окт-3-ил)бензамиды, которые имеют структуру почти такую же, как у соединений по изобретению, и которые обладают сродством к рецепторам 5-НТ3 и 5-НТ4. Согласно изобретению соединения общей формулы (I) могут быть получены способом, показанным на следующей схеме: 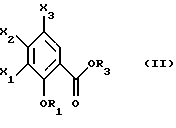 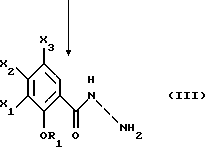 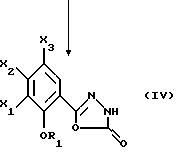 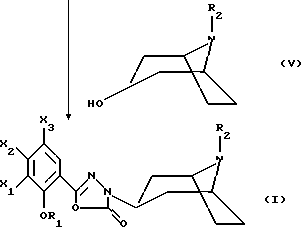 Сложный эфир общей формулы (II), в которой R1, X1, Х2 и Х3 являются такими, как определено выше, а R3 представляет собой метильную или этильную группу, подвергают взаимодействию с гидразингидратом в отсутствие растворителя или в полярном протонном растворителе, например этаноле, с получением гидразида общей формулы (III), который подвергают циклизации в оксадиазол общей формулы (IV) либо при помощи фосгена в апротонном растворителе, например диоксане, либо при помощи фенилхлорформиата в апротонном растворителе, например толуоле. Затем оксадиазол общей формулы (IV) подвергают взаимодействию с тропанолом общей формулы (V), в которой R2 является таким, как определено в отношении общей формулы (I), но иным чем атом водорода, или альтернативно представляет собой (1,1-диметилэтокси)карбонильную защитную группу, в присутствии трифенилфосфина или этилазодикарбоксилата в апротонном растворителе, например тетрагидрофуране, после чего, если необходимо, с атома азота тропанового кольца при помощи трифторуксусной кислоты снимают защиту с получением соединения общей формулы (I), в которой R2 представляет собой атом водорода, и, если требуется, полученное соединение подвергают взаимодействию с производным общей формулы R2-X, в которой Х представляет собой уходящую группу, например атом галогена или метансульфонатную или пара-толуолсульфонатную группу, а R2 является таким, как определено в отношении общей формулы (I), но иным чем атом водорода, в присутствии триэтиламина в апротонном растворителе, например ацетонитриле. Исходные сложные эфиры общей формулы (II) и/или соответствующие кислоты описаны, в частности, в патентных заявках ЕР-0231139, ЕР-0234872, WO-84/03281, WO-93/16072 и WO-94/19344. Тропанолы общей формулы (V) известны или могут быть получены любыми известными способами. 8-[(1,1-Диметилэтокси)карбонил]-8-азабицикло[3.2.1] октан-3-ол может быть получен способом, описанным в Drug Metabolism and Disposition, 1992, 20 (4), 596-602. Следующие далее примеры иллюстрируют в деталях получение нескольких соединений по изобретению. Элементные микроанализы и ИК- и ЯМР-спектры подтверждают структуры полученных соединений. Номера указанных в заголовках соединений, приведенные в круглых скобках, соответствуют номерам в табл. 1, приведенной позднее. Пример 1 (Соединение 1) 5-(4-Амино-5-хлор-2-метоксифенил)-3-(8-метил-8-азабицикло[3.2.1] окт-3-ил)-1,3,4-оксадиазол-2(ЗН)-он 1.1. Гидразид 4-амино-5-хлор-2-метоксибензойной кислоты 51,5 г (0,239 моль) метилового эфира 4-амино-5-хлор-2-метоксибензойной кислоты, суспендированного в 460 мл этанола, загружают в реактор емкостью 1 л. За период времени 15 минут добавляют 119 г (2,39 моль) гидразингидрата и эту смесь нагревают с обратным холодильником в течение 15 часов. Смесь охлаждают, используя ледяную баню, осадок отфильтровывают, промывают этанолом и сушат при пониженном давлении при 80oС в течение 2 часов 30 минут. Таким образом получают 47,5 г продукта. Температура плавления 211oС. 1.2. Фенилметиловый эфир [2-хлор-5-метокси-4-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)фенил]карбаминовой кислоты 461 мл (0,875 моль) 1,93 М раствора фосгена в толуоле за период времени 1 час при комнатной температуре и перемешивании с использованием магнитной мешалки по каплям добавляют к суспензии 37,7 г (0,175 моль) гидразида 4-амино-5-хлор-2-метоксибензойной кислоты в 1200 мл диоксана в реакторе емкостью 3 л. Эту смесь перемешивают при комнатной температуре в течение ночи, а затем нагревают при 80oС в течение 1 часа. Избыток фосгена удаляют пропусканием потока аргона при этой температуре в течение 2 часов. Затем добавляют 72 мл (0,7 моль) бензилового спирта и продолжают нагревание в течение 1 ч при 100oС. Смесь охлаждают и концентрируют при пониженном давлении, остаток растирают в порошок с изопропиловым эфиром. Полученное твердое вещество отфильтровывают и сушат. Таким образом получают 60,3 г продукта. Температура плавления 214oС. 1.3. Гидрохлорид фенилметилового эфира [2-хлор-4-[4-(8-метил-8-азабицикло[3.2.1] окт-3-ил)-5-оксо-4,5-дигидро- 1,3,4-оксадиазол-2-ил] -5-метоксифенил]карбаминовой кислоты 1 г (2,66 ммоль) фенилметилового эфира [2-хлор-5-метокси-4-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)фенил] карбаминовой кислоты, 0,47 г (3,33 ммоль) эндо-8-метил-8-азабицикло[3.2.1]октан-3-ола и 1,05 г (4 ммоль) трифенилфосфина, растворенного в 15 мл тетрагидрофурана, загружают в трехгорлую круглодонную колбу емкостью 50 мл, смесь охлаждают до 0oС, добавляют 0,63 мл, т.е. 0,70 г (4 ммоль) этилазодикарбоксилата и эту смесь перемешивают при 40oС в течение 3 часов 30 минут. Растворитель выпаривают при пониженном давлении, остаток переносят в 15 мл смеси диэтилового эфира и диизопропилового эфира и твердое вещество собирают фильтрованием. После промывки и сушки получают 1,6 г твердого вещества. Гидрохлорид этого твердого вещества получают традиционным способом и растирают в порошок с ацетоном и перекристаллизовывают из этанола. Получают 2,22 г соли. 1.4. 5-(4-Амино-5-хлор-2-метоксифенил)-3-(8-метил-8-азабицикло[3.2.1] окт-3-ил)-1,3,4-оксадиазол-2(3Н)-он 0,94 г (1,76 ммоль) гидрохлорида фенилметилового эфира [2-хлор-4-[4-(8-метил-8-азабицикло[3.2.1] окт-3-ил)-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил] -5-метоксифенил] карбаминовой кислоты загружают в трехгорлую круглодонную колбу, содержащую 17 мл уксусной кислоты, добавляют 3,12 мл 33%-ной бромоводородной кислоты в уксусной кислоте (т.е. 7 эквивалентов бромоводородной кислоты) и эту среду перемешивают в течение 24 часов. Добавляют 20 мл диэтилового эфира, твердое вещество собирают фильтрованием, промывают диэтиловым эфиром и переносят в воду. Добавляют водный раствор аммиака до щелочного рН и получают очень тонкий осадок, который собирают фильтрованием. После сушки выделяют 0,45 г соединения. Температура плавления 208oС. Пример 2 (Соединение 3) Гидрохлорид 5-(8-амино-7-хлор-2,3-дигидро-1,4-бензодиоксин-5-ил)-3-(8-азабицикло[3.2.1]окт-3-ил)-1,3,4-оксадиазол-2(3Н)-она 2.1. Фенилметиловый эфир [6-хлор-8-[4-[8-[(1,1-диметилэтокси)карбонил] -8-азабицикло[3.2.1] окт-3-ил] -5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил] -2,3-дигидро-1,4-бензодиоксин-5-ил]карбаминовой кислоты 7,1 г (0,030 моль) фенилметилового эфира эндо-8-[(1,1-диметилэтокси)карбонил]-8-азабицикло[3.2.1]октан-3-ола, 10 г (0,025 моль)фенилметилового эфира [6-хлор-8-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)-2,3-дигидро-1,4-бензодиоксин-5-ил]карбаминовой кислоты (полученного из соответствующего метилбензоата согласно способу, описанному в стадиях 1.1 и 1.2), 8,44 г (0,032 моль) трифенилфосфина, 5,6 г (0,032 моль) этилазодикарбоксилата и 400 мл сухого тетрагидрофурана загружают в круглодонную колбу и эту смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают при пониженном давлении, остаток очищают хроматографией на силикагеле, элюируя смесью этилацетата и гептана (50/50), и получают 13,0 г соединения. Температура плавления 210oС. 2.2. Фенилметиловый эфир [6-хлор-8-[4-(8-азабицикло[3.2.1]окт-3-ил)-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил] -2,3-дигидро-1,4-бензодиоксин-5-ил] карбаминовой кислоты 13,75 г (0,022 моль) фенилметилового эфира [6-хлор-8-[4-[8-[(1,1-диметилэтокси)карбонил] -8-азабицикло[3.2.1]окт-3-ил]-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил] -2,3-дигидро-1,4-бензодиоксин-5-ил] карбаминовой кислоты, растворенного в 150 мл хлороформа, загружают в трехгорлую круглодонную колбу емкостью 500 мл, медленно, за 20 минут, добавляют 17,05 мл (0,221 моль) трифторуксусной кислоты и эту смесь перемешивают в течение 19 часов. Добавляют дополнительное количество трифторуксусной кислоты (17,05 мл; 0,221 моль) и смесь перемешивают в течение 5 часов. Смесь концентрируют, и остаток кристаллизуют из 300 мл диэтилового эфира. Твердое вещество переносят в 100 мл воды, добавляют 3 мл 30%-ного раствора гидроксида натрия. Эту смесь экстрагируют хлороформом и упаривают. Остаток растирают в порошок с диизопропиловым эфиром. Получают 7,88 г соединения. Температура плавления 140oС. 2.3. Гидрохлорид 5-(8-амино-7-хлор-2,3-дигидро-1,4-бензодиоксин-5-ил)-3-(8-азабицикло[3.2.1]окт-3-ил)-1,3,4-оксадиазол-2(3Н)-она Получают суспензию 0,88 г (1,72 ммоль) фенилметилового эфира [6-хлор-8-[4-(8-азабицикло[3.2.1]окт-3-ил]-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил] -2,3-дигидро-1,4-бензодиоксин-5-ил] карбаминовой кислоты в 10 мл уксусной кислоты, добавляют 2,2 мл 33%-ной бромоводородной кислоты в уксусной кислоте и эту смесь перемешивают в течение ночи. К смеси добавляют диэтиловый эфир, осадок собирают фильтрованием, промывают диэтиловым эфиром и переносят в воду, раствор промывают этилацетатом, добавляют 0,5 мл 30%-ного водного раствора гидроксида натрия, смесь четыре раза экстрагируют хлороформом, органическую фазу промывают водой, сушат над сульфатом натрия, фильтруют и выпаривают растворитель. Остаток растирают в порошок с диэтиловым эфиром, фильтруют, переносят в этанол, который нагревают с обратным холодильником, и обрабатывают раствором хлороводорода в этаноле. Окончательно получают 0,61 г гидрохлорида. Температура плавления 210oС. Пример 3 (Соединение 5) Гидробромид 5-(8-амино-7-хлор-2,3-дигидро-1,4-бензодиоксин-5-ил)-3-(8-бутил-8-азабицикло[3.2.1]окт-3-ил)-1,3,4-оксадиазол-2(3Н)-она 3.1. Фенилметиловый эфир [6-хлор-8-[4-(8-бутил-8-азабицикло[3.2.1]окт-3-ил)-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил1-2,3-дигидро-1,4-бензодиоксин-5-ил]карбаминовой кислоты 1,54 г (3 ммоль) фенилметилового эфира [6-хлор-8-[4-(8-азабицикло[3.2.1] окт-3-ил)-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил] -2,3-дигидро-1,4-бензодиоксин-5-ил]карбаминовой кислоты и 1,2 г (12 ммоль) триэтиламина, растворенного в 20 мл ацетонитрила, загружают в 100-миллилитровую трехгорлую круглодонную колбу, добавляют 0,82 г (6 ммоль) 1-бромбутана и смесь нагревают при 60oС в течение 20 часов. Растворитель выпаривают, остаток переносят в воду и экстрагируют этилацетатом, органическую фазу промывают водой и сушат, растворитель выпаривают при пониженном давлении, а остаток очищают хроматографией на силикагеле, элюируя смесью хлороформа, метанола и водного раствора аммиака (95/5/0,5). Получают 1,25 г соединения. Температура плавления 142oС. 3.2. Гидробромид 5-(8-амино-7-хлор-2,3-дигидро-1,4-бензодиоксин-5-ил)-3-(8-бутил-8-азабицикло[3.2.1]окт-3-ил)-1,3,4-оксадиазол-2(3Н)-она 1,2 г (2,11 ммоль) фенилметилового эфира [6-хлор-8-[4-(8-бутил-8-азабицикло[3.2.1] окт-3-ил)-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил] -2,3-дигидро-1,4-бензодиоксин-5-ил]карбаминовой кислоты, 12 мл уксусной кислоты и 3 мл 33%-ного раствора бромоводородной кислоты в уксусной кислоте загружают в круглодонную колбу на 50 мл и полученный раствор перемешивают при комнатной температуре в течение 18 часов. Добавляют диэтиловый эфир и твердое вещество собирают фильтрованием, промывая диэтиловым эфиром, и кристаллизуют из 2-пропанола. Получают 0,92 г гидробромида, который растирают в порошок с этанолом и окончательно получают 0,79 г чистого соединения. Температура плавления >260oС. Пример 4 (Соединение 4) 5-(8-Амино-7-хлор-2,3-дигидро-1,4-бензодиоксин-5-ил)-3-[8-(2-фенилэтил)-8-азабицикло[3.2.1]окт-3-ил]-1,3,4-оксадиазол-2(3Н)-он 4.1. Фенилметиловый эфир [6-хлор-8-[4-[8-(2-фенилэтил)-8-азабицикло[3.2.1] окт-3-ил] -5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил]-2,3-дигидро-1,4-бензодиоксин-5-ил]карбаминовой кислоты 1,33 г (2,6 ммоль) фенилметилового эфира [6-хлор-8-[4-(8-азабицикло[3.2.1] окт-3-ил)-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил] -2,3-дигидро-1,4-бензодиоксин-5-ил]карбаминовой кислоты, 1,05 г (10,4 ммоль) триэтиламина и 0,96 г (5,2 ммоль) (2-бромэтил)бензола, растворенного в 20 млацетонитрила, загружают в трехгорлую круглодонную колбу емкостью 100 мл и эту смесь нагревают при 60oС в течение 18 часов. Добавляют дополнительное количество (2-бромэтил)бензола (0,48 г; 2,6 ммоль) и продолжают нагревание в течение 5 часов. Растворитель выпаривают при пониженном давлении, остаток переносят в воду и экстрагируют хлороформом, органическую фазу промывают водой и сушат, растворитель выпаривают при пониженном давлении, а остаток очищают хроматографией на колонке с силикагелем, элюируя смесью хлороформа, метанола и водного раствора аммиака (99/1/0,1), Получают 1,28 г продукта, кристаллизация которого из диизопропилового эфира приводит к получению 1,18 г чистого соединения. Температура плавления 118oС. 4.2. 5-(8-Амино-7-хлор-2,3-дигидро-1,4-бензодиоксин-5-ил)-3-[8-(2-фенилэтил)-8-азабицикло[3.2.1]окт-3-ил]-1,3,4-оксадиазол-2(3Н)-он 1,18 г (1,91 ммоль) фенилметилового эфира [6-хлор-8-[4-[8-(2-фенилэтил)-8-азабицикло[3.2.1] окт-3-ил]-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил] -2,3-дигидро-1,4-бензодиоксин-5-ил] карбаминовой кислоты, 12 мл уксусной кислоты и 2,95 мл бромоводородной кислоты, растворенной в уксусной кислоте, загружают в круглодонную колбу емкостью 50 мл, и раствор перемешивают при комнатной температуре в течение 18 часов. Добавляют диэтиловый эфир, осадок собирают фильтрованием, промывая диэтиловым эфиром. Полученный таким образом неочищенный гидробромид переносят в 13 мл воды и 20 мл хлороформа, добавляют 0,5 мл 30%-ного раствора гидроксида натрия, смесь экстрагируют хлороформом, растворитель выпаривают при пониженном давлении и остаток растирают в порошок с диизопропиловым эфиром. Получают 0,703 г чистого соединения в форме свободного основания. Температура плавления 227oС. Пример 5 (Соединение 7) Гидрохлорид 3-(8-азабицикло[3.2.1] окт-3-ил)-5-(6-хлор-3,4-дигидро-2Н-1-бензопиран-8-ил)-1,3,4-оксадиазол-2(3Н)-она 2,83 г (11,2 ммоль) 5-(6-хлор-3,4-дигидро-2Н-1-бензопиран-8-ил)-1,3,4-оксадиазол-2(3Н)-она (полученного из соответствующего метилбензоата согласно способу, описанному в стадиях 1.1 и 1.2), 2,54 г (11,2 ммоль) эндо-8-(1,1-диметилэтоксикарбонил)-8-азабицикло[3.2.1]октан-3-ола и 4,11 г (15,68 ммоль) трифенилфосфина загружают в 100 мл тетрагидрофурана, смесь охлаждают до 0oС в атмосфере аргона, добавляют 3,0 мл этилазодикарбоксилата и эту смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают при пониженном давлении, остаток переносят в 100 мл дихлорметана, добавляют 17,3 мл трифторуксусной кислоты и эту смесь перемешивают в течение 12 часов. Смесь концентрируют до сухого состояния, остаток переносят в 1 н. соляную кислоту, эту смесь промывают диэтиловым эфиром, а затем этилацетатом, к водной фазе добавляют карбонат калия и эту смесь экстрагируют хлороформом. Водную фазу промывают и сушат, растворитель выпаривают при пониженном давлении, остаток переносят в 1 эквивалент раствора хлороводорода в этаноле, смесь концентрируют до сухого состояния и остаток перекристаллизовывают из смеси воды и 2-пропанола (9/1). После фильтрования и сушки получают 1,8 г соединения. Температура плавления 254oС. Пример 6 (Соединение 9) Гидрохлорид 3-(8-бутил-8-азабицикло[3.2.1] окт-3-ил)-5-(6-хлор-3,4-дигидро-2Н-1-бензопиран-8-ил)-1,3,4-оксадиазол-2(3Н)-она Смесь 0,96 г (2,38 ммоль) гидрохлорида 3-(8-азабицикло[3.2.1]окт-3-ил)-5-(6-хлор-3,4-дигидро-2Н-1-бензопиран-8-ил)-1,3,4-оксадиазол-2(3Н)-она, 0,28 мл, т.е. 0,36 г (2,62 ммоль), бромбутана, 0,72 г (5,24 ммоль) карбоната калия и 40 мл ацетонитрила нагревают при 60oС в течение 24 часов. Растворитель выпаривают при пониженном давлении, остаток переносят в воду и экстрагируют хлороформом, водную фазу промывают и сушат, растворитель выпаривают при пониженном давлении и остаток очищают хроматографией на колонке с диоксидом кремния, элюируя дихлорметаном. Основание переносят в 1 эквивалент раствора хлороводорода в этаноле, раствор концентрируют и соль перекристаллизовывают из 2-пропанола, фильтруют и сушат. Получают 0,38 г соединения. Температура плавления 242oС. Пример 7 (Соединение 10) Гидрохлорид 3-(8-азабицикло[3.2.1] окт-3-ил)-5-(5-хлор-2,3-дигидробензофуран-7-ил)-1,3,4-оксадиазол-2(3Н)-она 3,58 г (15 ммоль) 5-(5-хлор-2,3-дигидробензофуран-7-ил)-1,3,4-оксадиазол-2(3Н)-она (полученного из соответствующего метилбензоата согласно способу, описанному в стадиях 1.1 и 1.2), 3,41 г (15 ммоль) эндо-8-(1,1-диметилэтоксикарбонил)-8-азабицикло[3.2.1] октан-3-ола и 5,51 г (21 ммоль) трифенилфосфина загружают в 120 мл тетрагидрофурана, смесь охлаждают до 0oС в атмосфере аргона, добавляют 4,0 мл, т.е. 4,44 г, (25,5 ммоль), этилазодикарбоксилата и эту смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают при пониженном давлении, остаток переносят в 150 мл дихлорметана, добавляют 23,1 мл трифторуксусной кислоты и эту смесь перемешивают в течение 12 часов. Смесь концентрируют до сухого состояния, остаток переносят в 1 н. соляную кислоту, смесь промывают диэтиловым эфиром, а затем этилацетатом, к водной фазе добавляют карбонат калия до рН 10 и смесь экстрагируют хлороформом. Органическую фазу промывают и сушат, растворитель выпаривают при пониженном давлении, остаток переносят в 1 эквивалент раствора хлороводорода в этаноле, смесь концентрируют до сухого состояния и остаток перекристаллизовывают из смеси 2-пропанола и воды (49/1). После фильтрования и сушки получают 1,7 г соединения. Температура плавления >260oС. Пример 8 (Соединение 11) Гидрохлорид 3-[8-(2-фенилэтил)-8-азабицикло[3.2.1]окт-3-ил]-5-(5-хлор-2,3-дигидробензофуран-7-ил)-1,3,4-оксадиазол-2(3Н)-она Смесь 0,80 г (2,08 ммоль) гидрохлорида 3-(8-азабицикло[3.2.1]окт-3-ил)-5-(5-хлор-2,3-дигидробензофуран-7-ил)-1,3,4-оксадиазол-2(3Н)-она, 0,31 мл, т. е. 0,43 г (2,29 ммоль), (2-бромэтил)бензола, 0,63 г (4,58 ммоль) карбоната калия и 30 мл ацетонитрила нагревают при 60oС в течение 24 часов. Растворитель выпаривают при пониженном давлении, остаток переносят в воду и экстрагируют хлороформом, органическую фазу промывают и сушат, растворитель выпаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем, элюируя смесью дихлорметана и этанола (98/2) Основание переносят в 1 эквивалент раствора хлороводорода в этаноле, раствор концентрируют и соль перекристаллизовывают из этанола, фильтруют и сушат. Получают 0,84 г соединения. Температура плавления 266oС. Пример 9 (Соединение 15) Гидробромид 5-(4-амино-5-хлор-2-метоксифенил)-3-(8-азабицикло[3.2.1]окт-3-ил)-1,3,4-оксадиазол-2(3Н)-она 9.1 Фенилметиловый эфир [2-хлор-4-[4-(8-азабицикло[3.2.1]окт-3-ил)-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил]-5-метоксифенил]карбаминовой кислоты 5,78 г (15 ммоль) фенилметилового эфира [2-хлор-5-метокси-4,5-дигидро-1,3,4-оксадиазол-2-ил)фенил] карбаминовой кислоты, 6,0 г (23 ммоль) трифенилфосфина и 3,5 г (15 ммоль) 8-[(1,1-диметилэтокси)карбонил]-8-азабицикло[3.2.1] октан-3-ола, растворенного в 50 мл тетрагидрофурана, загружают в трехгорлую круглодонную колбу емкостью 100 мл, раствор охлаждают до 0oС и по каплям добавляют 3,64 мл этилового эфира азадикарбоновой кислоты. Смесь оставляют нагреваться до 20oС и перемешивают в течение 3 часов Растворитель выпаривают при пониженном давлении, остаток переносят в 50 мл дихлорметана, при 0oС добавляют 25 мл трифторуксусной кислоты и полученный раствор перемешивают при комнатной температуре в течение 4 часов. Растворитель выпаривают при пониженном давлении, добавляют 50 мл воды и 100 мл диэтилового эфира и осадок собирают фильтрованием, промывают диэтиловым эфиром и сушат. Получают 5,0 г белого твердого вещества. Температура плавления 156-157oС. 9.2. Гидробромид 5-(4-амино-5-хлор-2-метоксифенил)-3-(8-азабицикло[3.2.1]окт-3-ил)-1,3,4-оксадиазол-2(3Н)-она 5,0 г (10,6 ммоль) фенилметилового эфира [2-хлор-4-[4-(8-азабицикло[3.2.1]окт-3-ил)-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил]-5-метоксифенил] карбаминовой кислоты, растворенного в 10 мл 33%-ной бромоводородной кислоты в уксусной кислоте, помещают в круглодонную колбу емкостью 25 мл и смесь перемешивают при комнатной температуре в течение 24 часов. Добавляют диэтиловый эфир, осадок собирают фильтрованием и несколько раз промывают эфиром. Получают 4,2 г соединения. Температура плавления 235-237oC. Пример 10 (Соединение 13) (-)-Бистартрат 5-{ 4-амино-5-хлор-2-метоксифенил)-3-[8-[1-[5-[4-(диметиламино)пиперидин-1-ил] -5-оксопентил] -8-азабицикло[3.2.1]окт-3-ил]-1,3,4-оксадиазол-2(3Н)-она 0,5 г (1,16 ммоль) гидробромида 5-(4-амино-5-хлор-2-мет6ксифенил)-3-(8-азабицикло[3.2.1] окт-3-ил)-1,3,4-оксадиазол-2(3Н)-она, 0,286 г (1,16 ммоль) 1-(5-хлор-1-оксопентил)-N,N-диметилпиперидин-4-амина и 0,484 мл (3,48 ммоль) триэтиламина, растворенного в 10 мл N,N-диметилформамида, загружают в трехгорлую круглодонную колбу емкостью 25 мл и смесь нагревают с обратным холодильником в течение 18 часов. Растворитель выпаривают при пониженном давлении, добавляют воду и смесь экстрагируют дихлорметаном. Растворитель выпаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем, элюируя сначала смесью дихлорметана и метанола (90/10), а затем смесью дихлорметана, метанола и водного раствора аммиака (80/20/2).Получают масло, которое обрабатывают двумя эквивалентами винной кислоты, и окончательно получают 0,35 г белого твердого вещества. Температура плавления 198-201oС. Табл. 1 иллюстрирует химические структуры и физические свойства некоторых соединений по изобретению. Испытания, которым подвергали соединения по изобретению, демонстрируют значимость этих соединений как терапевтически активных веществ. Так, соединения по изобретению исследовали в отношении их сродства к рецепторам 5-НТ4 в полосатом теле морской свинки в соответствии с известным (Grossman et al., Br. J. Pharmacol., 1993, 109, 618-624) способом. Морских свинок (Hartley, Charles River, France) весом от 300 до 400 г умерщвляют, удаляют их головной мозг и полосатые тела иссекают и замораживают при -80oС. В день эксперимента ткань размораживают до 4oС в 33 объемах буферного раствора HEPES-NaOH (50 мМ, рН 7,4 при 20oС), смесь гомогенизируют с использованием гомогенизатора  гомогенат центрифугируют при 48000 х g в течение 10 минут, осадок отделяют и ресуспендируют, суспензию повторно центрифугируют таким же способом и конечный осадок ресуспендируют в буферном растворе HEPES-NaOH в соотношении 30 мг ткани на 1 мл. 100 мкл этой мембранной суспензии инкубируют при 0oС в течение 120 минут в присутствии [3Н] GR 113808 (лиганд, описанный в упомянутой статье, специфическая активность 80-85 Кюри/ммоль) в конечном объеме буферного раствора HEPES-NaOH (1 мл, 50 мМ, рН 7,4), в присутствии или в отсутствие испытуемого соединения. Инкубирование прекращают фильтрованием через фильтр Whatman GF/B, предварительно обработанный 0,1%-ным полиэтиленимином, каждую пробирку ополаскивают 4 мл буферного раствора при 0oС, проводят дополнительное фильтрование и жидкой сцинтиграфией измеряют радиоактивность, оставшуюся на фильтре.
Неспецифическое связывание определяют в присутствии 30 мкМ серотонина. Специфическое связывание представляет собой 90% от общей радиоактивности, полученной на фильтре.
Для каждой концентрации испытуемого соединения определяют процент ингибирования специфического связывания [3Н] GR 113808, а впоследствии ИК50, концентрацию испытуемого соединения, которая ингибирует связывание на 50%.
Величины ИK50 наиболее активных соединений находятся между 1,3 и 340 нМ.
Соединения по изобретению также исследовали в отношении их агонистического или антагонистического действия на рецепторы 5-НТ4 в пищеводе крысы в соответствии с описанным способом (Baxter et al., Naunyn. Schmied. Arch. Pharmacol., 1991, 343-439).
Используют крыс-самцов Sprague-Dawley весом от 300 до 450 г. Быстро удаляют фрагмент концевой части пищевода (приблизительно 1,5 см), удаляют мышечный слой и продольно вскрывают внутреннюю мышечную слизистую оболочку, заключают в изолированный контейнер, содержащий Krebs-Henseleit раствор при 32oС, оксигенированный потоком карбогена (95% 02 и 5% С02), и связывают с изометрическим преобразователем при базальном напряжении 0,5 г. Сокращение ткани индуцируют добавлением 0,5 мкМ карбахола, а после стабилизации сокращения (15 минут) на препарат воздействуют серотонином (1 мкМ) с целью количественного определения максимальной релаксации. Ткань промывают,и через 20 минут добавляют дополнительное количество 0,5 мкМ карбахола и на препарат воздействуют испытуемым соединением, увеличивая кумулятивные концентрации от 0,1 до 1 мкМ. Соединения, которые индуцируют релаксацию, рассматривают в качестве 5-НТ4 агонистов.
Для соединений, которые не индуцируют релаксацию, на препарат воздействуют серотонином, увеличивая кумулятивные концентрации от 0,1 нМ до концентрации, которая индуцирует максимальную релаксацию, а затем кривую релаксации, обусловленную серотонином, в присутствии испытуемого соединения, сравнивают со стандартной кривой, определенной в отсутствие указанного соединения. Если его присутствие индуцирует сдвиг кривой вправо, то испытуемое соединение рассматривают в качестве 5-НТ4 антагониста.
Результаты этих двух биологических испытаний показывают, что соединения по изобретению являются сильными лигандами серотонинергических рецепторов 5-НТ4 типа и что они действуют на эти рецепторы либо как агонисты, либо как антагонисты.
В заключение соединения по изобретению исследовали in vitro в отношении их сродства к гистаминергическим рецепторам Н3 мозга крысы, в сущности известным (Korte A. et al., Biochem. Phys. Res. Commun., 1990, 160, 979-986 и West R. E. et al., Mol. Pharmacol., 1990, 38, 610-613) способом.
Крыс-самцов Sprague Dawley (OFA, Iffa Credo, France) весом от 250 до 300 г умерщвляют и удаляют их головной мозг. Ткани гомогенизируют с использованием гомогенизатора PolytronTM (режим 7 в течение 20 секунд) в 20 объемах буферного раствора Tris-HCI (50 мМ, рН 7,4 при 22oС). Гомогенат центрифугируют при 1000 х g в течение 10 минут, а затем повторно центрифугируют надосадочную жидкость при 45000 х g в течение 20 минут при 4oС. Затем осадок промывают при помощи ресуспендирования в буферном растворе, гомогенизирования и центрифугирования его. Конечный осадок ресуспендируют в буферном растворе в соотношении 100 мг исходной ткани на 1 мл, а затем делят на 11 мл аликвотные фракции, которые замораживают при -80oС. В день эксперимента мембранную суспензию (100 мкл, от 300 до 400 мг белков) инкубируют при 30oС в течение 60 минут в присутствии 0,5 нМ [3Н] N гомогенат центрифугируют при 48000 х g в течение 10 минут, осадок отделяют и ресуспендируют, суспензию повторно центрифугируют таким же способом и конечный осадок ресуспендируют в буферном растворе HEPES-NaOH в соотношении 30 мг ткани на 1 мл. 100 мкл этой мембранной суспензии инкубируют при 0oС в течение 120 минут в присутствии [3Н] GR 113808 (лиганд, описанный в упомянутой статье, специфическая активность 80-85 Кюри/ммоль) в конечном объеме буферного раствора HEPES-NaOH (1 мл, 50 мМ, рН 7,4), в присутствии или в отсутствие испытуемого соединения. Инкубирование прекращают фильтрованием через фильтр Whatman GF/B, предварительно обработанный 0,1%-ным полиэтиленимином, каждую пробирку ополаскивают 4 мл буферного раствора при 0oС, проводят дополнительное фильтрование и жидкой сцинтиграфией измеряют радиоактивность, оставшуюся на фильтре.
Неспецифическое связывание определяют в присутствии 30 мкМ серотонина. Специфическое связывание представляет собой 90% от общей радиоактивности, полученной на фильтре.
Для каждой концентрации испытуемого соединения определяют процент ингибирования специфического связывания [3Н] GR 113808, а впоследствии ИК50, концентрацию испытуемого соединения, которая ингибирует связывание на 50%.
Величины ИK50 наиболее активных соединений находятся между 1,3 и 340 нМ.
Соединения по изобретению также исследовали в отношении их агонистического или антагонистического действия на рецепторы 5-НТ4 в пищеводе крысы в соответствии с описанным способом (Baxter et al., Naunyn. Schmied. Arch. Pharmacol., 1991, 343-439).
Используют крыс-самцов Sprague-Dawley весом от 300 до 450 г. Быстро удаляют фрагмент концевой части пищевода (приблизительно 1,5 см), удаляют мышечный слой и продольно вскрывают внутреннюю мышечную слизистую оболочку, заключают в изолированный контейнер, содержащий Krebs-Henseleit раствор при 32oС, оксигенированный потоком карбогена (95% 02 и 5% С02), и связывают с изометрическим преобразователем при базальном напряжении 0,5 г. Сокращение ткани индуцируют добавлением 0,5 мкМ карбахола, а после стабилизации сокращения (15 минут) на препарат воздействуют серотонином (1 мкМ) с целью количественного определения максимальной релаксации. Ткань промывают,и через 20 минут добавляют дополнительное количество 0,5 мкМ карбахола и на препарат воздействуют испытуемым соединением, увеличивая кумулятивные концентрации от 0,1 до 1 мкМ. Соединения, которые индуцируют релаксацию, рассматривают в качестве 5-НТ4 агонистов.
Для соединений, которые не индуцируют релаксацию, на препарат воздействуют серотонином, увеличивая кумулятивные концентрации от 0,1 нМ до концентрации, которая индуцирует максимальную релаксацию, а затем кривую релаксации, обусловленную серотонином, в присутствии испытуемого соединения, сравнивают со стандартной кривой, определенной в отсутствие указанного соединения. Если его присутствие индуцирует сдвиг кривой вправо, то испытуемое соединение рассматривают в качестве 5-НТ4 антагониста.
Результаты этих двух биологических испытаний показывают, что соединения по изобретению являются сильными лигандами серотонинергических рецепторов 5-НТ4 типа и что они действуют на эти рецепторы либо как агонисты, либо как антагонисты.
В заключение соединения по изобретению исследовали in vitro в отношении их сродства к гистаминергическим рецепторам Н3 мозга крысы, в сущности известным (Korte A. et al., Biochem. Phys. Res. Commun., 1990, 160, 979-986 и West R. E. et al., Mol. Pharmacol., 1990, 38, 610-613) способом.
Крыс-самцов Sprague Dawley (OFA, Iffa Credo, France) весом от 250 до 300 г умерщвляют и удаляют их головной мозг. Ткани гомогенизируют с использованием гомогенизатора PolytronTM (режим 7 в течение 20 секунд) в 20 объемах буферного раствора Tris-HCI (50 мМ, рН 7,4 при 22oС). Гомогенат центрифугируют при 1000 х g в течение 10 минут, а затем повторно центрифугируют надосадочную жидкость при 45000 х g в течение 20 минут при 4oС. Затем осадок промывают при помощи ресуспендирования в буферном растворе, гомогенизирования и центрифугирования его. Конечный осадок ресуспендируют в буферном растворе в соотношении 100 мг исходной ткани на 1 мл, а затем делят на 11 мл аликвотные фракции, которые замораживают при -80oС. В день эксперимента мембранную суспензию (100 мкл, от 300 до 400 мг белков) инкубируют при 30oС в течение 60 минут в присутствии 0,5 нМ [3Н] N -метилгистамина (специфичная активность от 75 до 80 Кюри/ммоль, New England Nuclear, Du Pont de Nemours, Boston, USA) в конечном объеме буферного раствора Tris-HCI (500 мкл), в присутствии или в отсутствие испытуемого соединения. Инкубирование прекращают фильтрованием через фильтры Whatman GF/B, предварительно обработанные полиэтиленимином (0,4%). Каждую реакционную пробирку три раза ополаскивают 4 мл холодного (0oС) буферного раствора Tris-HCI. Фильтры сушат в печи при 120oС в течение 5 минут. Радиоактивность, оставшуюся на фильтрах, определяют жидкой сцинтиграфией. Неспецифическое связывание определяют в присутствии 10 мкМ тиоперамида (N-циклогексил-4-(1Н-имидазол-4-ил)пиперидин-1-карботиоамида).
Для каждой концентрации испытуемого соединения рассчитывают процентное ингибирование специфического связывания [3Н] N -метилгистамина (специфичная активность от 75 до 80 Кюри/ммоль, New England Nuclear, Du Pont de Nemours, Boston, USA) в конечном объеме буферного раствора Tris-HCI (500 мкл), в присутствии или в отсутствие испытуемого соединения. Инкубирование прекращают фильтрованием через фильтры Whatman GF/B, предварительно обработанные полиэтиленимином (0,4%). Каждую реакционную пробирку три раза ополаскивают 4 мл холодного (0oС) буферного раствора Tris-HCI. Фильтры сушат в печи при 120oС в течение 5 минут. Радиоактивность, оставшуюся на фильтрах, определяют жидкой сцинтиграфией. Неспецифическое связывание определяют в присутствии 10 мкМ тиоперамида (N-циклогексил-4-(1Н-имидазол-4-ил)пиперидин-1-карботиоамида).
Для каждой концентрации испытуемого соединения рассчитывают процентное ингибирование специфического связывания [3Н] N -метилгистамина, после которого определяют концентрацию соединения ИК50, которая ингибирует связывание на 50%.
Соединения по изобретению, которые являются наиболее активными в этом испытании, имеют величину ИК50 приблизительно 35 нМ.
Результаты разных биологических испытаний, проведенных на соединениях по изобретению, показывают, что соединения являются лигандами рецепторов 5-НТ4 и/или Н3.
Эти результаты указывают на то, что соединения можно применять для лечения и профилактики расстройств, в которые вовлекаются рецепторы 5-НТ4 и/или Н3, в особенности в отношении центральной нервной системы, желудочно-кишечной системы, нижнего отдела мочевыделительной системы или сердечно-сосудистой системы.
Что касается центральной нервной системы, то эти расстройства и болезни включают в себя, главным образом, неврологические и психиатрические расстройства, такие как когнитивные расстройства, психозы, компульсивное и обсессивное поведение и состояния депрессии и тревоги. Когнитивные расстройства включают в себя, например, дефицит памяти и внимания, состояния деменции (старческие деменции, такие как болезнь Альцгеймера, или деменции, связанные с возрастом), цереброваскулярную недостаточность и болезнь Паркинсона. Психозы включают в себя, например, паранойю, шизофрению, манию и аутизм. Компульсивное и обсессивное поведение включает в себя, например, расстройства, связанные с едой, такие как булимия или потеря аппетита. Состояния депрессии и тревоги включают в себя, например, тревогу, связанную с ожиданием (перед хирургической операцией, перед лечением зубов и т.д.), и тревогу, вызванную алкогольной или наркотической зависимостью или абстиненцией. Наконец, также можно упомянуть манию, эпилепсию, нарушения сна, сезонные аффективные расстройства и мигрень.
Что касается желудочно-кишечной системы, то эти расстройства и болезни включают в себя прямые и косвенные расстройства гастроподвижности пищевода, желудка или кишечника, тошноту, специфические заболевания, такие как диспепсия, язвы, гастроэзофагеальный рефлюкс, метеоризм, синдром раздраженной толстой кишки, интестинальные секреторные расстройства, диарея, например, вызванная холерой или карциноидным синдромом, и расстройства, которые могут быть связаны или не связаны с загрязнением атмосферы, такие как астма, ринит и затруднения дыхания.
Что касается нижнего отдела мочевыделительной системы, то эти расстройства и болезни главным образом включают в себя недержание мочи, дизурию и задержку мочи.
Что касается сердечно-сосудистой системы, то эти расстройства и болезни главным образом включают в себя патологии, связанные, прямо или косвенно, с сердечной аритмией, гипертонией, ишемией, инфарктом миокарда или нестабильной стенокардией, проблемы реокклюзии после восстановления проходимости сосудов, например после фибринолитической или тромболитической терапии, ангиопластики или операции на сердце. Кроме того, расстройством, которое можно лечить при помощи соединений по изобретению, является глаукома.
Соединения по изобретению могут быть представлены во всех формах композиций, подходящих для энтерального или парентерального введения, таких как таблетки, таблетки, покрытые сахаром, желатиновые капсулы, облатки, питьевые или инъекционные суспензии или растворы, такие как сиропы, или ампулы и т.д. , объединенные с подходящими эксципиентами и дозированные для суточного введения от 0,001 до 20 мг/кг.
Данные по биологической активности приведены в табл. 2. -метилгистамина, после которого определяют концентрацию соединения ИК50, которая ингибирует связывание на 50%.
Соединения по изобретению, которые являются наиболее активными в этом испытании, имеют величину ИК50 приблизительно 35 нМ.
Результаты разных биологических испытаний, проведенных на соединениях по изобретению, показывают, что соединения являются лигандами рецепторов 5-НТ4 и/или Н3.
Эти результаты указывают на то, что соединения можно применять для лечения и профилактики расстройств, в которые вовлекаются рецепторы 5-НТ4 и/или Н3, в особенности в отношении центральной нервной системы, желудочно-кишечной системы, нижнего отдела мочевыделительной системы или сердечно-сосудистой системы.
Что касается центральной нервной системы, то эти расстройства и болезни включают в себя, главным образом, неврологические и психиатрические расстройства, такие как когнитивные расстройства, психозы, компульсивное и обсессивное поведение и состояния депрессии и тревоги. Когнитивные расстройства включают в себя, например, дефицит памяти и внимания, состояния деменции (старческие деменции, такие как болезнь Альцгеймера, или деменции, связанные с возрастом), цереброваскулярную недостаточность и болезнь Паркинсона. Психозы включают в себя, например, паранойю, шизофрению, манию и аутизм. Компульсивное и обсессивное поведение включает в себя, например, расстройства, связанные с едой, такие как булимия или потеря аппетита. Состояния депрессии и тревоги включают в себя, например, тревогу, связанную с ожиданием (перед хирургической операцией, перед лечением зубов и т.д.), и тревогу, вызванную алкогольной или наркотической зависимостью или абстиненцией. Наконец, также можно упомянуть манию, эпилепсию, нарушения сна, сезонные аффективные расстройства и мигрень.
Что касается желудочно-кишечной системы, то эти расстройства и болезни включают в себя прямые и косвенные расстройства гастроподвижности пищевода, желудка или кишечника, тошноту, специфические заболевания, такие как диспепсия, язвы, гастроэзофагеальный рефлюкс, метеоризм, синдром раздраженной толстой кишки, интестинальные секреторные расстройства, диарея, например, вызванная холерой или карциноидным синдромом, и расстройства, которые могут быть связаны или не связаны с загрязнением атмосферы, такие как астма, ринит и затруднения дыхания.
Что касается нижнего отдела мочевыделительной системы, то эти расстройства и болезни главным образом включают в себя недержание мочи, дизурию и задержку мочи.
Что касается сердечно-сосудистой системы, то эти расстройства и болезни главным образом включают в себя патологии, связанные, прямо или косвенно, с сердечной аритмией, гипертонией, ишемией, инфарктом миокарда или нестабильной стенокардией, проблемы реокклюзии после восстановления проходимости сосудов, например после фибринолитической или тромболитической терапии, ангиопластики или операции на сердце. Кроме того, расстройством, которое можно лечить при помощи соединений по изобретению, является глаукома.
Соединения по изобретению могут быть представлены во всех формах композиций, подходящих для энтерального или парентерального введения, таких как таблетки, таблетки, покрытые сахаром, желатиновые капсулы, облатки, питьевые или инъекционные суспензии или растворы, такие как сиропы, или ампулы и т.д. , объединенные с подходящими эксципиентами и дозированные для суточного введения от 0,001 до 20 мг/кг.
Данные по биологической активности приведены в табл. 2.
Формула изобретения
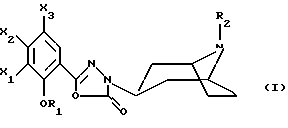 в которой R1 представляет собой (С1-С4) алкильную или (С3-С7) циклоалкилметильную группу; Х1 представляет собой атом водорода или галогена, или (С1-С4) алкоксильную группу, или альтернативно OR1 и Х1 вместе представляют собой группу формулы -ОСН2О-, -О(СН2)2-, -О(СН2)3-, -О(СН2)2О или -О(СН2)3О-; Х2 представляет собой атом водорода или аминогруппу; Х3 представляет собой атом водорода или галогена; R2 представляет собой атом водорода, (С1-С6) алкильную группу, фенил (С1-С4) алкильную группу или группу общей формулы -(СН2)nCO-Z, в которой n равно 1 – 6, Z представляет собой 1-пиперидильную или 4-(диметиламино)-1-пиперидильную группу, в форме свободного основания или фармацевтически приемлемой соли присоединения кислоты. 2. Соединение по п. 1, отличающееся тем, что R2 представляет собой бутильную группу. 3. Соединение по п. 1, отличающееся тем, что R2 представляет собой 2-фенилэтильную группу. 4. Соединение по п. 1, отличающееся тем, что R2 представляет собой 4-[4-(диметиламино)-1-пиперидил] -4-оксобутильную, 5-[4-(диметиламино)-1-пиперидил] -5-оксопентильную или 6-[4-(диметиламино)-1-пиперидил] -6-оксогексильную группу. 5. Способ получения соединений по п. 1, отличающийся тем, что сложный эфир общей формулы (II) 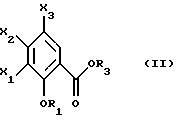 в которой R1, X1, X2 и Х3 являются такими, как определено в п. 1, а R3 представляет собой метильную или этильную группу, подвергают взаимодействию с гидразингидратом с получением гидразида общей формулы (III) 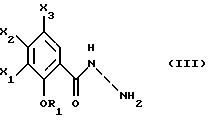 который подвергают циклизации в оксадиазол общей формулы (IV) 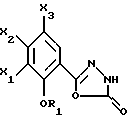 либо при помощи фосгена, либо при помощи фенилхлорформиата, после чего оксадиазол общей формулы (IV) подвергают взаимодействию с тропанолом общей формулы (V) 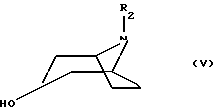 в которой R2 является таким, как определено в отношении общей формулы (I), но иным, чем атом водорода, или альтернативно представляет собой (1,1-диметилэтокси)карбонильную защитную группу, в присутствии трифенилфосфина или этилазодикарбоксилата, после чего, если необходимо, с атома азота тропанового кольца при помощи трифторуксусной кислоты снимают защиту с получением соединения общей формулы (I), в которой R2 представляет собой атом водорода и, если требуется, полученное соединение подвергают взаимодействию с производным общей формулы R2-X, в которой Х представляет собой уходящую группу, а R2 является таким, как определено в отношении общей формулы (I), но иным, чем атом водорода. 6. Лекарственное средство, проявляющее свойство лигандов рецепторов 5-НТ4 и/или Н3, отличающееся тем, что оно состоит из соединения по одному из пп. 1-4. 7. Фармацевтическая композиция, проявляющая свойство лигандов рецепторов 5-НТ4 и/или Н3, отличающаяся тем, что она содержит соединение по одному из пп. 1-4 в сочетании с эксципиентом. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 16.04.2004
Извещение опубликовано: 7.08.2005 БИ: 24/2005
|
||||||||||||||||||||||||||
