Патент на изобретение №2184735
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ СПИРОПИПЕРИДИНА, ЛЕКАРСТВЕННОЕ СРЕДСТВО, СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ
(57) Реферат: Изобретение относится к новым производным спиропиперидина общей формулы (I), где R1 представляет фенильную группу, которая может быть необязательно замещена 1-3 заместителями, выбранными из атомов галогена, низших алкильных групп, галогеннизших алкильных групп, низших алкоксигрупп, низших алкоксикарбонильных групп, гидроксильных групп, низших алифатических ациламиногрупп, цианогрупп, или 5- или 6-членную гетероциклическую группу, содержащую 1-3 атома кислорода, серы и/или азота, которая может быть необязательно конденсирована с фенильной группой; R2 представляет фенильную группу, которая замещена 1-3 атомами фтора или хлора; А представляет карбонильную группу; В представляет простую связь; D представляет атом кислорода или серы; Е представляет C1-4алкеленовую группу; 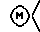 представляет группу формулы (II), где G представляет С5-8алкановое кольцо, которое замещено гидроксильной группой; Ar представляет фенильное кольцо; n представляет целое число 1 или 2, или их фармакологически приемлемые соли. Лекарственное средство, обладающее антагоническим действием по отношению к NK1, NK2 и NK3 рецепторам, содержащее в качестве эффективного ингредиента соединение формулы I или его фармакологически приемлемую соль и эксципиент. Предлагаемые соединения могут использоваться для лечения или профилактики заболевания, которое лечится или предупреждается средствами, обладающими антагонистическим действием по отношению к NK1, NK2 и NK3 рецепторам, путем введения теплокровному животному эффективного количества соединения формулы 1 или его фармакологически приемлемую соль. Технический результат – новые производные спиропиперидина. 3 с. и 9 з. п.ф-лы, 3 табл. представляет группу формулы (II), где G представляет С5-8алкановое кольцо, которое замещено гидроксильной группой; Ar представляет фенильное кольцо; n представляет целое число 1 или 2, или их фармакологически приемлемые соли. Лекарственное средство, обладающее антагоническим действием по отношению к NK1, NK2 и NK3 рецепторам, содержащее в качестве эффективного ингредиента соединение формулы I или его фармакологически приемлемую соль и эксципиент. Предлагаемые соединения могут использоваться для лечения или профилактики заболевания, которое лечится или предупреждается средствами, обладающими антагонистическим действием по отношению к NK1, NK2 и NK3 рецепторам, путем введения теплокровному животному эффективного количества соединения формулы 1 или его фармакологически приемлемую соль. Технический результат – новые производные спиропиперидина. 3 с. и 9 з. п.ф-лы, 3 табл.
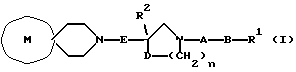 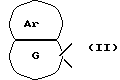
[Область техники] Изобретение относится к новым производным спиропиперидина, которые проявляют антагонистическое действие по отношению к рецепторам тахикинина (NK1, NK2 и NК3). [Уровень техники] Как известно, NK1 рецепторы, NK2 рецепторы и NК3 рецепторы действуют как рецепторы тахикинина. Известен ряд соединений, проявляющих антагонистическое действие по отношению к одному из этих рецепторов. Недавно соединения, которые тормозят столько же подтипов, сколько возможно среди этих трех подтипов, привлекли пристальное внимание для использования в способах для профилактики или лечения болезней, вызванных тахикинином. Исследуются соединения, проявляющие антагонистическое действие по отношению как к NK1, так и NK2 рецепторам. Например, соединение А, показанное ниже, раскрыто в ЕР-776893 в качестве соединения, обладающего антагонистической активностью по отношению как к NK1, так и NK2 рецепторам. Однако не сообщается, что это соединение проявляет антагонистическую активность по отношению к NK3 рецептору. 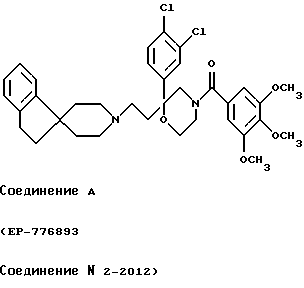 [Сущность изобретения] Настоящее изобретение относится к: (1) соединению, представленному формулой (I), или его фармакологически приемлемой соли, сложному эфиру или другому производному 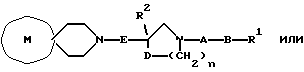 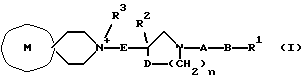 { где R1 и R2 являются одинаковыми или различными и каждый представляет арильную группу, гетероарильную группу, арильную группу, замещенную от 1 до 3 группами, выбранными из Замещающей Группы А, или гетероарильную группу, замещенную от 1 до 3 группами, выбранными из Замещающей Группы А, А представляет метиленовую группу, карбонильную группу или сульфонильную группу, В представляет одинарную связь, С1-4алкиленовую группу или С2-4алкениленовую группу, D представляет атом кислорода или атом серы, Е представляет С1-4алкиленовую группу или С2-4алкениленовую группу,  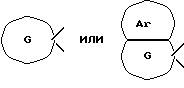 где G представляет С5-8циклоалкеновый цикл, С5-8циклоалкановый цикл, замещенный 1 или 2 группами, выбранными из Замещающей Группы В, или циклоалкеновый цикл, замещенный 1 или 2 группами, выбранными из Замещающей Группы В, Аr представляет арильный цикл, гетероарильный цикл, арильный цикл, замещенный от 1 до 3 группами, выбранными из Замещающей Группы А, или гетероарильный цикл, замещенный от 1 до 3 группами, выбранными из Замещающей Группы А, R3 представляет низшую алкильную группу, и n представляет целое число от 1 до 3; при условии, что G не включает группу, замещенную только оксогруппой}; [Замещающая Группа А] атомы галогена, низшие алкильные группы, галогеннизшие алкильные группы, низшие алкоксигруппы, низшие алкоксикарбонильные группы, карбоксильные группы, гидроксильные группы, низшие алифатические ацильные группы, низшие алифатические ациламиногруппы, аминогруппы и цианогруппы; [Замещающая Группа В] оксогруппы, гидроксильные группы, карбоксильные группы или тиольные группы; и, в качестве заместителей атома азота, низшие алкильные, арильные, аралкильные, низшие алифатические ацильные и низшие алкансульфонильные группы, каждая из которых может быть замещена группой, выбранной из Замещающей Группы А. Среди них предпочтительными соединениями являются: (2) соединения, где R1 представляет арильную группу, гетероарильную группу или арильную группу, замещенную от 1 до 3 группами, выбранными из Замещающей Группы А, (3) соединения, где R1 представляет арильную группу или арильную группу, замещенную от 1 до 3 группами, выбранными из Замещающей Группы А1, определенной ниже, (4) соединения, где R2 представляет арильную группу или арильную группу, замещенную от 1 до 3 группами, выбранными из Замещающей Группы А, (5) соединения, где R2 представляет арильную группу, замещенную, по крайней мере, одной группой, выбранной из Замещающей Группы А, (6) соединения, где А представляет карбонильную группу, (7) соединения, где В представляет простую связь, (8) соединения, где D представляет атом кислорода, (9) соединения, где Е представляет С1-4алкиленовую группу, (10) соединения, где Е представляет С2-3алкиленовую группу, (11) соединения, где 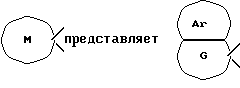 (12) соединения, где G представляет циклопентановый или циклопентеновый цикл, замещенный одной или двумя группами, выбранными из Замещающей Группы В, (13) соединения, где G представляет циклопентановый или циклопентеновый цикл, замещенный гидроксигруппой, (14) соединения, где п представляет 1 или 2, и (15) соединения, где п представляет 2; и их фармакологически приемлемые соли, сложные эфиры или другие производные. [Замещающая Группа А1] низшие алкильные группы, галогеннизшие алкильные группы и низшие алкоксигруппы. Из вышеописанных соединений, соединения, которые включают комбинацию факторов, выбранных из восьми групп, состоящих из (2) и (3); (4) и (5); (6); (7); (8); (9) и (10); от (11) по (13); и (14) и (15) являются также предпочтительными. (16) Более предпочтительными соединениями являются: 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(2-гидрокси)индан-1,4′-пиперидин], 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(3-гидрокси)индан-1,4′-пиперидин], 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(1Н-инден-1,4′-пиперидин], 1-{2-[(2R)-(3,4-дихлорфенил)-4-(3,5-диметоксибензоил)морфолин-2-ил]этил} спиро[(2-гидрокси)индан-1,4′-пиперидин], 1-{2-[(2R)-(3,4-дихлорфенил)-4-(3,5-диметоксибензоил)морфолин-2-ил]этил} спиро[(3-гидрокси)индан-1,4′-пиперидин], и 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(1Н-инден-1,4′-пиперидин], и их фармакологически приемлемые соли, сложные эфиры и другие производные. (17) Наиболее предпочтительными являются соединения: 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(2-гидрокси)индан-1,4′-пиперидин] и 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(3-гидрокси)индан-1,4′-пиперидин], и их фармакологически приемлемые соли, сложные эфиры и другие производные. Новое лекарственное средство настоящего изобретения включает в качестве эффективного ингредиента соединение, выбранное из любого одного из соединений, описанных выше в (1)-(17), или его фармакологически приемлемую соль, сложный эфир или другое производное и может применяться особенно в качестве профилактического средства или лекарства от астмы и/или бронхита, ринита, аллергии и недержания мочи. В формуле (I) примеры “арильной группы” в определениях R1 и R2, арильная группа “n арильной группы, замещенной от 1 до 3 группами, выбранными из Замещающей Группы А” в определениях 1 и R2, и “арильная группа” “арильной группы, которая может быть замещена группой, выбранной из Замещающей Группы А” в определении “Замещающей группы В”, включают С5-8ароматические углеводородные группы, такие как фенил, инденил, нафтил, фенантренил и антраценил, из которых фенильные группы являются предпочтительными. В данном случае вышеописанная “арильная группа” может образовывать конденсированное ядро с С3-10циклоалкильной группой, и примеры таких групп включают 5-инданильные группы. “Гетероарильная группа” в определениях R1 и R2 и “гетероарильная группа” “гетероарильной группы, замещенной от 1 до 3 группами, выбранными из Замещающей Группы А” в определениях R1 и R2, означает 5-7-членную ароматическую гетероциклическую группу, содержащую от 1 до 3 атомов серы, атомов кислорода и/или атомов азота. Примеры включают группы фурила, тиенила, пирролила, пиразолила, имидазолила, оксазолила, изоксазолила, тиазолила, изотиазолила, 1,2,3-оксадиазолила, триазолила, тетразолила, тиадиазолила, пиридила, пиридазинила, пиримидинила и пиразинила. Среди таких 5-7-членных ароматических гетероциклических групп наиболее предпочтительными являются группы, каждая из которых содержит по крайней мере один атом азота и кроме него дополнительно может содержать атом кислорода или атом серы. Примеры включают группы пирролила, пиразолила, имидазолила, оксазолила, изоксазолила, тиазолила, изотиазолила, 1,2,3-оксадиазолила, триазолила, тетразолила, тиадиазолила, пиридила, пиридазинила, пиримидинила и пиразинила, из которых более предпочтительными группами являются группы пиридила, имидазолила, оксазолила, пиразинила и тиазолила. Кроме того, вышеописанная “гетероарильная группа” может образовывать конденсированное ядро с другой циклической группой. Примеры таких групп включают индолил, бензофурил, бензотиенил, бензоксазолил, бензоимидазолил, изохинолил, хинолил и хиноксалил. Примеры “низшей алкильной группы” в определении R3, [Замещающая Группа А] и [Замещающая Группа А’] и “низшей алкильной группы” “низшей алкильной группы, которая может быть замещена группой, выбранной из Замещающей Группы А”, в определении [Замещающая Группа В] включают в C1-6алкильные группы с линейной или разветвленной цепью, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, 2-метилбутил, неопентил, 1-этилпропил, н-гексил, изогексил, 4-метилпентил, 3-метилпентил, 2-метилпентил, 1-метилпентил, 3,3-диметилбутил, 2,2-диметилбутил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил и 2-этилбутил, среди которых С1-4алкильные группы с линейной или разветвленной цепью являются предпочтительными. Примеры “С1-4алкиленовой группы” в определениях В и Е включают C1-4алкиленовые группы с линейной или разветвленной цепью, такие как метилен, метилметилен, этилен, пропилен, триметилен, тетраметилен, 1-метилтриметилен, 2-метилтриметилен и 3-метилтриметилен. Относительно В предпочтительными являются C1-3алкиленовые группы с линейной или разветвленной цепью. Относительно Е предпочтительными являются C1-3алкиленовые группы с линейной или разветвленной цепью, из которых более предпочтительными являются этиленовая и триметиленовая группы, а этиленовая группа является наиболее предпочтительной. Примеры “С2-4алкениленовой группы” в определениях В и Е включают С2-4алкениленовые группы с линейной или разветвленной цепью, такие как этенилен, 2-пропенилен, 1-метил-2-пропенилен, 2-метил-2-пропенилен, 2-этил-2-пропенилен и 2-бутенилен, из которых этениленовая, 2-пропениленовая и 3-бутениленовая группы являются предпочтительными, а группы этенилена и 2-пропенилена более предпочтительны. Примеры “С5-8циклоалкенового цикла” и “С5-8циклоалкенового цикла”, “С5-8циклоалкенового цикла, замещенного 1 или 2 группами, выбранными из Замещающей Группы В” в определении G, включают циклопентеновый, циклогексеновый, циклогептеновый и циклооктеновый циклы, из которых “С5-6циклоалкеновый цикл” является предпочтительным, а циклопентеновые циклы являются более предпочтительными. Примеры “С5-8циклоалканового цикла” “С5-8циклоалканового цикла, замещенного 1 или 2 группами, выбранными из Замещающей Группы В”, представляющие G, включают циклопентановый, циклогексановый, циклогептановый и циклооктановый циклы, из которых “С5-6циклоалкановый цикл” является предпочтительным, а циклопентановые циклы являются более предпочтительными. Примеры “арильного цикла” и “арильного цикла” “арильного цикла, замещенного от 1 до 3 группами, выбранными из Замещающей Группы А” в определении Аr, включают С6-14ароматические углеводородные циклы, такие как бензольный, инденовый, нафталиновый, фенантреновый и антраценовый циклы, из которых бензольные циклы являются предпочтительными. “Гетероарильный цикл” и “гетероарильный цикл” “гетероарильного цикла, замещенного от 1 до 3 группами, выбранными из Замещающей группы А”, каждый в определении Аr, обозначают 5-7-членный ароматический гетероцикл, содержащий от 1 до 3 атомов серы, атомов кислорода или/и атомов азота. Примеры включают такие циклы, как фуран, тиофен, пиррол, азепин, пиразол, имидазол, оксазол, изоксазол, тиазол, изотиазол, 1,2,3-оксадиазол, триазол, тетразол, тиадиазол, пиран, пиридин, пиридазин, пиримидин и пиразин. Среди этих 5-7-членных ароматических гетероциклов предпочтительными являются циклы, которые содержат по крайней мере, один атом азота и которые могут также содержать еще атом кислорода или атом серы, и примеры включают такие циклы, как пиррол, азепин, пиразол, имидазол, оксазол, изоксазол, тиазол, изотиазол, 1,2,3-оксадиазол, триазол, тетразол, тиадиазол, пиридин, пиридазин, пиримидин и пиразин, из которых более предпочтительными являются циклы пиридина, имидазола, оксазола, пиразина и тиазола. Соответственно, примеры группы, представленные следующей формулой: 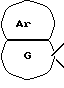 включают 2-гидроксииндан-1,1-диил (в частности, 2S-гидроксииндан-1,1-диил), 3-гидроксииндан-1,1-диил, 2,3-дигидроксииндан-1,1-диил и инден-1,1-диил. “Атомы галогена” в определении [Замещающая Группа А] включают атомы фтора, хлора, брома и иода, из которых атомы фтора и хлора являются предпочтительными. “Галогеннизшие алкильные группы” в определении [Замещающая Группа А] и [Замещающая Группа А’] обозначает группы, в которых вышеописанный “атом галогена” присоединен к “низшей алкильной группе”. Примеры включают трифторметил, трихлорметил, дифторметил, дихлорметиль, дибромметил, фторметил, 2,2,2-трихлорэтил, 2,2,2-трифторэтил, 2-бромэтил, 2-хлорэтил, 2-фторэтил и 2,2-дибромэтил, из которых трифторметил, 2-бромэтил, 2-хлорэтил и 2-фторэтил являются предпочтительными. “Низшие алкоксигруппы” в определениях [Замещающая Группа А] и [Замещающая Группа А’] и “низшие алкоксигруппы” “низшей алкоксикарбонильной группы” в определении [Замещающая Группа А] означают группу, в которой вышеописанная “низшая алкильная группа” присоединена к атому кислорода. Примеры включают C1-6алкоксигруппы с линейной или разветвленной цепью, такие как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентокси, изопентокси, 2-метилбутокси, неопентокси, н-гексоилокси, 4-метилпентокси, 3-метилпентокси, 2-метилпентокси, 3,3-диметилбутокси, 2,2-диметилбутокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси и 2,3-диметилбутокси, из которых С1-4алкоксигруппы с линейной или разветвленной цепью являются предпочтительными. Каждая из “низших алифатических ацильных групп”, “низших алифатических ацильных групп”, “низших алифатических ациламиногрупп” в определении [Замещающая Группа А] обозначает С2-7алифатические ацильные группы. Примеры включают формильную, ацетильную, пропионильную, бутирильную, изобутирильную, пентаноильную, пивалоильную, валерильную и изовалерильную группы, из которых ацетильная и пропионильная группы являются предпочтительными. R1 является, предпочтительно, арильной группой, гетероарильной группой или арильной группой, замещенной 1-3 группами, выбранными из Замещающей Группы А; более предпочтительно является арильной группой или арильной группой, замещенной 1-3 группами, выбранными из Замещающей Группы А; еще более предпочтительно является арильной группой, замещенной 1-3 группами, выбранными из Замещающей Группы А’; и самое предпочтительное является арильной группой, замещенной 1-3 низшими алкоксигруппами. R2 является предпочтительно арильной группой, замещенной от 1 до 3 группами, выбранными из Замещающей Группы А; более предпочтительно является арильной группой, замещенной 1-3 группами, выбранными из Замещающей Группы А; еще более предпочтительно является арильной группой, замещенной 1-3 атомами галогена; и, что самое предпочтительное, является фенильной группой, замещенной 1-3 атомами галогена. Следующая формула предпочтительно представляет группу, в которой атом углерода, соседний с атомом углерода, образующим спиросвязь между группой G и пиперидиновым кольцом, и соседний с ним атом углерода составляют часть циклической группы Аr, а также часть циклической группы G 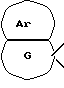 Так как соединения (I) настоящего изобретения могут образовывать соль, “их фармакологически приемлемые соли” представляют такую соль. Предпочтительные примеры солей, включающие соединения (I) изобретения и кислоту, включают соли неорганических кислот, такие как соли галогенводородной кислоты (например, гидрофторид, гидрохлорид, гидробромид, гидроиодид и т.д.), нитраты, перхлораты, сульфаты, фосфаты и подобные; соли органических кислот, такие как низшие алкансульфонаты (например, метансульфонат, трифторметансульфонат, этансульфонат и т.д.), арилсульфонаты (например, бензолсульфонат, п-толуолсульфонат и т.д.), соли уксусной кислоты, малоновой кислоты, фумарат, сукцинат, цитрат, тартрат, оксалат, малеат и подобные; и соли аминокислот, такие как глициновые соли, лизиновые соли, аргининовые соли, орнитиновые соли, глутамат, аспартат и подобные; из которых более предпочтительны соли галогенводородной кислоты и соли органической кислоты, еще более предпочтительны соли галогенводородной кислоты, а гидрохлорид является самым предпочтительным. С другой стороны, предпочтительные примеры соли, образуемой соединением (I) изобретения и основанием, включают соли металла, например соли щелочных металлов, такие как соли калия, соли натрия и соли лития, соли щелочноземельных металлов, такие как соли кальция и соли магния, соли алюминия и соли железа; соли амина, например неорганические соли, такие как соли аммония, и органические соли, такие как трет-октиламиновые соли, дибензиламиновые соли, морфолиновые соли, глюкозаминовые соли, соли сложного фенилглициналкилового эфира, соли этилендиамина, соли N-метилглюкамина, соли гуанидина, соли диэтиламина, соли триэтиламина, соли дициклогексиламина, соли N,N-дибензилэтилендиамина, соли хлоропрокаина, соли прокаина, соли диэтаноламина, соли N-бензилфенэтиламина, соли пиперазина, соли тетраэтиаммония и соли трис(гидроксиметил)аминометана; соли аминокислот, такие как соли глицина, лизина, аргинина, орнитина, глутаминовой кислоты и соли аспарагиновой кислоты. Так как соединения (I) данного изобретения могут превращаться в соответствующие четвертичные соли путем модификации атома азота пиперидиновой группы в молекуле с группой R3, соли между таким катионосодержащим соединением и анионом (здесь нет особых ограничений на анион, при условии, что он служит в качестве аниона, а примеры включают анионы галогена, такие как хлорид анион и иодид анион) также охватываются настоящим изобретением. Кроме того, соединения (I) настоящего изобретения абсорбируют воду и содержат эту абсорбированную воду, добавленную к ним, или становятся гидратами, когда их оставляют стоять на воздухе. Такие соли также охватываются настоящим изобретением. “Сложный эфир или другое его производное” означает соединение, в котором функциональная группа (например, гидроксигруппа, карбоксигруппа или аминогруппа) видоизменена защитной или ей подобной группой, и которая может превращаться в соединение (I) настоящего изобретения после введения его в живой организм. Является ли соединение таким производным, может быть установлено путем введения его экспериментальному животному, такому как крыса или мышь, внутривенно, исследования жидкости организма животного после введения и обнаружения исходного соединения или его фармацевтически приемлемой соли. Так как соединения (I) данного изобретения могут превращаться в соответствующие сложные эфиры, то “сложные эфиры” и означает такие эфиры. Примеры сложных эфиров включают “эфиры гидроксильной группы” и “эфиры карбоксильной группы”. Это означает сложный эфир, в котором эфирный остаток является “традиционной защитной группой”, или “защитную группу, которая может быть удалена in vivo биологическим способом, таким как гидролиз”. “Традиционная защитная группа” означает защитную группу, которая может быть удалена химическим способом, таким как гидрогенолиз, гидролиз, электролиз или фотолиз. Предпочтительные примеры “традиционной защитной группы” для “сложного эфира гидроксильной группы” включают вышеописанные “низшие алифатические ацильные группы”; вышеописанные “ароматические ацильные группы”; “тетрагидропиранильную или тетрагидротиопиранильную группы”, такие как тетрагидропиранил-2-ил, 3-бром-тетрагидропиранил-2-ил, 4-метокситетрагидропиранил-4-ил, тетрагидротиопиранил-2-ил и 4-метокситетрагидротиоопиранил-4-ил; “тетрагидрофуранильную или тетрагидротиофуранильную группы”, такие как тетрагидрофуран-2-ил и тетрагидротиофуран-2-ил; “силильные группы”, например, три(низший алкил)силильные группы, такие как триметилсилил, триэтилсилил, изопропилдиметилсилил, трет-бутилсилил, метилдиизопропилсилил, метил-ди-трет-бутилсилил и триизопропилсилил и три(низший алкил) силильные группы, замещенные 1 или 2 арильными группами, такие как дифенилметилсилил, дифенилбутилсилил, дифенилизопропилсилил и фенилдиизопропилсилил; “алкоксиметильные группы”, например низшие алкоксиметильные группы, такие как метоксиметил, 1,1-диметил-1-метоксиметил, этоксиметил, пропоксиметил, изопропоксиметил, бутоксиметил и трет-бутоксиметил, низшие алкоксиметильные группы, замещенные низшими алкоксигруппами, такие как 2-метоксиэтоксиметильные группы и (галоген низший алкокси)метильные группы, такие как 2,2,2-трихлорэтоксиметил и бис(2-хлорэтокси)метил; “замещенные этильные группы”, например этильные группы, замещенные низшей алкоксигруппой, такие как 1-этоксиэтил и 1-(изопропокси)этил и галогенированные этильные группы, такие как 2,2,2-трихлорэтильные группы; “аралкильные группы”, например низшие алкильные группы, замещенные 1-3 арильными группами, такие как бензил,  -нафтилметил, -нафтилметил,  -нафтилметил, дифенилметил, трифенилметил, -нафтилметил, дифенилметил, трифенилметил,  -нафтилдифенилметил и 9-антрилметильная группа, и низшие алкильные группы, каждая из которых замещена от 1 до 3 арильными группами, имеющими арил, замещенный низшей алкильной, галоген(низшей алкильной), низшей алкокси, нитро, галоген или цианогруппой, такие как 4-метилбензил, 2,4,6-триметилбензил, 3,4,5-триметилбензил, 3,5-ди(трифторметил)бензил, 4-метоксибензил, 4-метоксифенилдифенилметил, 2-нитробензил, 4-нитробензил, 4-хлорбензил, 4-бромбензил и 4-цианобензил; и вышеописанные “низшие алкоксикарбонильные группы”.
Предпочтительные примеры “традиционной защитной группы” для сложного эфира карбоксильной группы включают вышеописанные “низшие алкильные группы”; низшие алкенильные группы, такие как этенил, 1-пропенил, 2-пропенил, 1-метил-2-пропенил, 1-метил-1-пропенил, 2-метил-1-пропенил, 2-метил-2-пропенил, 2-этил-2-пропенил, 1-бутенил, 2-бутенил, 1-метил-2-бутенил, 1-метил-1-бутенил, 3-метил-2-бутенил, 1-этил-2-бутенил, 3-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 1-этил-3-бутенил, 1-пентенил, 2-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 4-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил и 5-гексенил; низшие алкинильные группы, такие как этинил, 2-пропинил, 1-метил-2-пропинил, 2-бутинил, 1-метил-2-бутинил, 1-этил-2-бутинил, 3-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 1-этил-3-бутинил, 2-пентинил, 1-метил-2-пентинил, 3-пентинил, 1-метил-3-пентинил, 2-метил-3-пентинил, 4-пентинил, 1-метил-4-пентинил, 2-метил-4-пентинил, 2-гексинил, 3-гексинил, 4-гексинил и 5-гексинил; вышеописанные “галогеннизшие алкильные группы”; гидрокси “низшие алкильные группы”, такие как 2-гидроксиэтил, 2,3-дигидроксипропил, 3-гидроксипропил, 3,4-дигидроксибутил и 4-гидроксибутил; “низшие алифатические ацильные” – “низшие алкильные группы”, такие как ацетилметильные группы; вышеописанные “аралкильные группы” и вышеописанные “силильные группы”.
“Защитные группы, которые могут быть расщеплены in vivo биологическим способом, таким как гидролиз” означают защитную группу, которая удаляется in vivo биологическим способом, таким как гидролиз, и образует свободную кислоту или ее соль. Является ли сложный эфир таким производным, может быть установлено при внутривенном введении этого эфира экспериментальному животному, такому как крыса или мышь, исследовании жидкости организма такого животного после введения и обнаружении исходного соединения или его фармакологически приемлемой соли.
Предпочтительные примеры “защитных групп, которые могут быть удалены in vivo биологическим способом, таким как гидролиз” для “сложного эфира гидроксильной группы” включают 1-(ацилокси) “низшие алкильные группы”, например 1-(“низший алифатический ацил”окси), “низшие алкильные группы”, такие как формилоксиметил, ацетоксиметил, диметиламиноацетоксиметил, пропионилоксиметил, бутирилоксиметил, пивалоилоксиметил, валерилоксиметил, изовалерилоксиметил, гексаноилоксиметил, 1-формилоксиэтил, 1-ацетоксиэтил, 1-пропионилоксиэтил, 1-бутирилоксиэтил, 1-пивалоилоксиэтил, 1-валерилоксиэтил, 1-изовалерилоксиэтил, 1-гексаноилоксиэтил, 1-формилоксипропил, 1-ацетоксипропил, 1-пропионилоксипропил, 1-бутирилоксипропил, 1-пивалоилоксипропил, 1-валерилоксипропил, 1-изовалерилоксипропил, 1-гексаноилоксипропил, 1-ацетоксибутил, 1-пропионилоксибутил, 1-бутирилоксибутил, 1-пивалоилоксибутил, 1-ацетоксипентил, 1-пропионилоксипентил, 1-бутирилоксипентил, 1-пивалоилоксипентил и 1-пивалоилоксигексил, 1-(“циклоалкил”карбонилокси) “низкие алкильные группы”, такие как циклопентилкарбонилоксиметил, циклогексилкарбонилоксиметил, 1-циклопентилкарбонилоксиэтил, 1-циклогексилкарбонилоксиэтил, 1-циклопентилкарбонилоксипропил, 1-циклогексилкарбонилоксипропил, 1-циклопентилкарбонилоксибутил и 1-циклогексилкарбонилоксибутил, и 1-(“ароматический ацил”окси) “низшие алкильные группы”, такие как бензоилоксиметильные группы; (низшие алкоксикарбонилокси)алкильные группы, такие как метоксикарбонилоксиметил, этоксикарбонилоксиметил, пропоксикарбонилоксиметил, изопропоксикарбонилоксиметил, бутоксикарбонилоксиметил, изобутоксикарбонилоксиметил, пентилоксикарбонилоксиметил, гексилоксикарбонилоксиметил, циклогексилоксикарбонилоксиметил, циклогексилоксикарбонилокси(циклогексил)метил, 1-(метоксикарбонилокси)этил, 1-(этоксикарбонилокси)этил, 1-(пропоксикарбонилокси)этил, 1-(изопропоксикарбонилокси)этил, 1-(бутоксикарбонилокси)этил, 1-(изобутоксикарбонилокси)этил, 1-трет-бутоксикарбонилокси)этил, 1-пентилоксикарбонилокси)этил, 1-(гексилоксикарбонилокси)этил, 1-(циклопентилоксикарбонилокси)этил, 1-(циклопентилоксикарбонилокси)пропил, 1-циклогексилоксикарбонилокси)пропил, 1-(циклопентилоксикарбонилокси)бутил, 1-(циклогексилоксикарбонилокси)этил, 1-(этоксикарбонилокси)пропил, 2-(метоксикарбонилокси)этил, 2-этоксикарбонилокси)этил, 2-(пропоксикарбонилокси)этил, 2-(изопропоксикарбонилокси)этил, 2-(бутоксикарбонилокси)этил, 2-(изобутоксикарбонилокси)этил, 2- (пентилоксикарбонилокси)этил, 2-(гексилоксикарбонилокси)этил, 1-метоксикарбонилокси)пропил, 1-(этоксикарбонилокси)пропил, 1-(пропоксикарбонилокси)пропил, 1-(изопропоксикарбонилокси)пропил, 1-(бутоксикарбонилокси)пропил, 1-(изобутоксикарбонилокси)пропил, 1-(пентилоксикарбонилокси)пропил, 1-(гексилоксикарбонилокси)пропил, 1-метоксикарбонилокси)бутил, 1-(этоксикарбонилокси)бутил, 1-(пропоксикарбонилокси)бутил, 1-(изопропоксикарбонилокси)бутил, 1-(бутоксикарбонилокси)бутил, 1-(изобутоксикарбонилокси)бутил, 1-(метоксикарбонилокси)пентил, 1-(этоксикарбонилокси)пентил, 1-(метоксикарбонилокси)гексил и 1-(этоксикарбонилокси)гексил; и оксодиоксоленилметильные группы, такие как (5-фенил-2-оксо-1,3-диоксолен-4-ил)метил, [5-(4-метилфенил)-2-оксо-1,3-диоксолен-4-ил] метил, [5-(4-метоксифенил)-2-оксо-1,3-диоксолен-4-ил] метил, [5-(4-фторфенил)-2-оксо-1,3-диоксолен-4-ил] метил, [5-(4-хлорфенил)-2-оксо-1,3-диоксолен-4-ил] метил, (2-оксо-1,3-диоксолен-4-ил)метил, (5-метил-2-оксо-1,3-диоксолен-4-ил)метил, (5-этил-2-оксо-1,3-диоксолен-4-ил)метил, (5-пропил-2-оксо-1,3-диоксолен-4-ил)метил, (5-изопропил-2-оксо-1,3-диоксолен-4-ил)метил и (5-бутил-2-оксо-1,3-диоксолен-4-ил)метил; “фталидильные группы”, такие как фталидил, диметилфталидил и диметоксифталидил; вышеописанные “низшие алифатические ацильные группы”, вышеописанные “ароматические ацильные группы”; “соль полуэфирного остатка янтарной кислоты”; “остатки фосфатной соли”; “сложный эфир – образующие остатки, подобные аминокислотам”; карбамоильные группы; карбамоильные группы, замещенные 1 или 2 низшими алкильными группами; и “1-(ацилокси)алкилкарбонильные группы”, такие как пивалоилоксиметилоксикарбонил, из которых “карбонилоксиалкильные группы” являются предпочтительными.
Предпочтительные примеры “защитной группы, которая может быть удалена in vivo биологическим способом, таким как гидролиз” для “сложного эфира карбоксигруппы” включает “алкоксинизшие алкильные группы”, например (низший алкокси)(низшие алкильные) группы, такие как метоксиэтил, 1-этоксиэтил, 1-метил-1-метоксиэтил, 1-(изопропокси)этил, 2-метоксиэтил, 2-этоксиэтил, 1,1-диметил-1-метоксиэтил, этоксиметил, н-пропоксиметил, изопропоксиметил, н-бутоксиметил и трет-бутоксиметил, (низший алкокси)низшие алкильные группы, замещенные низшим алкокси, такие как 2-метоксиэтоксиметил, “арил”окси”низшие алкильные группы”, такие как феноксиметильные группы, и (галогенированный низший алкокси) (низшие алкильные группы, такие как 2,2,2-трихлорэтоксиметил и бис(2-хлорэтокси)метильные группы; “”низший алкокси”карбонил <<низшие алкильные группы>>>>, такие как метоксикарбонилметильные группы; <<циано>>низшие алкильные группы>>>>, такие как цианометил и 2-цианоэтил; <<<<низший алкил>>тиометильные группы>>, такие как метилтиометил и этилтиометил; “”арил”тиометильные группы”, такие как фенилтиометил и нафтилтиометил; “низший алкил”сульфонил “низшие алкильные группы”, которые могут быть замещены галогеном”, такие как 2-метансульфонилэтил и 2-трифторметансульфонилэтильные группы; “”арил”сульфонил “низшие алкильные группы””, такие как 2-бензилсульфонилэтил и 2-толуолсульфонилэтил; вышеописанные “1-(ацилокси) “низшие алкильные группы””; вышеописанные “фталидильные группы”; вышеописанные “арильные группы”; вышеописанные “низшие алкильные группы”; “карбоксиалкильные группы”, такие как карбоксиметил; и “амидообразующие остатки аминокислот”, такие как фенилаланин.
Когда соединения (I) настоящего изобретения содержат амино и/или карбоксильную группу, они могут превращаться в производные, отличающиеся от вышеописанных “фармакологически приемлемых солей” и “их сложных эфиров”. “Другие производные” означают такие производные. Примеры таких производных включают производные амида.
Соединения (I) настоящего изобретения содержат асимметрический атом углерода в своей молекуле, и стереоизомеры, чей асимметрический атом имеет R- или S- конфигурацию, присутствуют. Стереоизомеры и их смесь в любом отношении также включены в настоящее изобретение.
[Варианты осуществления изобретения] -нафтилдифенилметил и 9-антрилметильная группа, и низшие алкильные группы, каждая из которых замещена от 1 до 3 арильными группами, имеющими арил, замещенный низшей алкильной, галоген(низшей алкильной), низшей алкокси, нитро, галоген или цианогруппой, такие как 4-метилбензил, 2,4,6-триметилбензил, 3,4,5-триметилбензил, 3,5-ди(трифторметил)бензил, 4-метоксибензил, 4-метоксифенилдифенилметил, 2-нитробензил, 4-нитробензил, 4-хлорбензил, 4-бромбензил и 4-цианобензил; и вышеописанные “низшие алкоксикарбонильные группы”.
Предпочтительные примеры “традиционной защитной группы” для сложного эфира карбоксильной группы включают вышеописанные “низшие алкильные группы”; низшие алкенильные группы, такие как этенил, 1-пропенил, 2-пропенил, 1-метил-2-пропенил, 1-метил-1-пропенил, 2-метил-1-пропенил, 2-метил-2-пропенил, 2-этил-2-пропенил, 1-бутенил, 2-бутенил, 1-метил-2-бутенил, 1-метил-1-бутенил, 3-метил-2-бутенил, 1-этил-2-бутенил, 3-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 1-этил-3-бутенил, 1-пентенил, 2-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 4-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил и 5-гексенил; низшие алкинильные группы, такие как этинил, 2-пропинил, 1-метил-2-пропинил, 2-бутинил, 1-метил-2-бутинил, 1-этил-2-бутинил, 3-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 1-этил-3-бутинил, 2-пентинил, 1-метил-2-пентинил, 3-пентинил, 1-метил-3-пентинил, 2-метил-3-пентинил, 4-пентинил, 1-метил-4-пентинил, 2-метил-4-пентинил, 2-гексинил, 3-гексинил, 4-гексинил и 5-гексинил; вышеописанные “галогеннизшие алкильные группы”; гидрокси “низшие алкильные группы”, такие как 2-гидроксиэтил, 2,3-дигидроксипропил, 3-гидроксипропил, 3,4-дигидроксибутил и 4-гидроксибутил; “низшие алифатические ацильные” – “низшие алкильные группы”, такие как ацетилметильные группы; вышеописанные “аралкильные группы” и вышеописанные “силильные группы”.
“Защитные группы, которые могут быть расщеплены in vivo биологическим способом, таким как гидролиз” означают защитную группу, которая удаляется in vivo биологическим способом, таким как гидролиз, и образует свободную кислоту или ее соль. Является ли сложный эфир таким производным, может быть установлено при внутривенном введении этого эфира экспериментальному животному, такому как крыса или мышь, исследовании жидкости организма такого животного после введения и обнаружении исходного соединения или его фармакологически приемлемой соли.
Предпочтительные примеры “защитных групп, которые могут быть удалены in vivo биологическим способом, таким как гидролиз” для “сложного эфира гидроксильной группы” включают 1-(ацилокси) “низшие алкильные группы”, например 1-(“низший алифатический ацил”окси), “низшие алкильные группы”, такие как формилоксиметил, ацетоксиметил, диметиламиноацетоксиметил, пропионилоксиметил, бутирилоксиметил, пивалоилоксиметил, валерилоксиметил, изовалерилоксиметил, гексаноилоксиметил, 1-формилоксиэтил, 1-ацетоксиэтил, 1-пропионилоксиэтил, 1-бутирилоксиэтил, 1-пивалоилоксиэтил, 1-валерилоксиэтил, 1-изовалерилоксиэтил, 1-гексаноилоксиэтил, 1-формилоксипропил, 1-ацетоксипропил, 1-пропионилоксипропил, 1-бутирилоксипропил, 1-пивалоилоксипропил, 1-валерилоксипропил, 1-изовалерилоксипропил, 1-гексаноилоксипропил, 1-ацетоксибутил, 1-пропионилоксибутил, 1-бутирилоксибутил, 1-пивалоилоксибутил, 1-ацетоксипентил, 1-пропионилоксипентил, 1-бутирилоксипентил, 1-пивалоилоксипентил и 1-пивалоилоксигексил, 1-(“циклоалкил”карбонилокси) “низкие алкильные группы”, такие как циклопентилкарбонилоксиметил, циклогексилкарбонилоксиметил, 1-циклопентилкарбонилоксиэтил, 1-циклогексилкарбонилоксиэтил, 1-циклопентилкарбонилоксипропил, 1-циклогексилкарбонилоксипропил, 1-циклопентилкарбонилоксибутил и 1-циклогексилкарбонилоксибутил, и 1-(“ароматический ацил”окси) “низшие алкильные группы”, такие как бензоилоксиметильные группы; (низшие алкоксикарбонилокси)алкильные группы, такие как метоксикарбонилоксиметил, этоксикарбонилоксиметил, пропоксикарбонилоксиметил, изопропоксикарбонилоксиметил, бутоксикарбонилоксиметил, изобутоксикарбонилоксиметил, пентилоксикарбонилоксиметил, гексилоксикарбонилоксиметил, циклогексилоксикарбонилоксиметил, циклогексилоксикарбонилокси(циклогексил)метил, 1-(метоксикарбонилокси)этил, 1-(этоксикарбонилокси)этил, 1-(пропоксикарбонилокси)этил, 1-(изопропоксикарбонилокси)этил, 1-(бутоксикарбонилокси)этил, 1-(изобутоксикарбонилокси)этил, 1-трет-бутоксикарбонилокси)этил, 1-пентилоксикарбонилокси)этил, 1-(гексилоксикарбонилокси)этил, 1-(циклопентилоксикарбонилокси)этил, 1-(циклопентилоксикарбонилокси)пропил, 1-циклогексилоксикарбонилокси)пропил, 1-(циклопентилоксикарбонилокси)бутил, 1-(циклогексилоксикарбонилокси)этил, 1-(этоксикарбонилокси)пропил, 2-(метоксикарбонилокси)этил, 2-этоксикарбонилокси)этил, 2-(пропоксикарбонилокси)этил, 2-(изопропоксикарбонилокси)этил, 2-(бутоксикарбонилокси)этил, 2-(изобутоксикарбонилокси)этил, 2- (пентилоксикарбонилокси)этил, 2-(гексилоксикарбонилокси)этил, 1-метоксикарбонилокси)пропил, 1-(этоксикарбонилокси)пропил, 1-(пропоксикарбонилокси)пропил, 1-(изопропоксикарбонилокси)пропил, 1-(бутоксикарбонилокси)пропил, 1-(изобутоксикарбонилокси)пропил, 1-(пентилоксикарбонилокси)пропил, 1-(гексилоксикарбонилокси)пропил, 1-метоксикарбонилокси)бутил, 1-(этоксикарбонилокси)бутил, 1-(пропоксикарбонилокси)бутил, 1-(изопропоксикарбонилокси)бутил, 1-(бутоксикарбонилокси)бутил, 1-(изобутоксикарбонилокси)бутил, 1-(метоксикарбонилокси)пентил, 1-(этоксикарбонилокси)пентил, 1-(метоксикарбонилокси)гексил и 1-(этоксикарбонилокси)гексил; и оксодиоксоленилметильные группы, такие как (5-фенил-2-оксо-1,3-диоксолен-4-ил)метил, [5-(4-метилфенил)-2-оксо-1,3-диоксолен-4-ил] метил, [5-(4-метоксифенил)-2-оксо-1,3-диоксолен-4-ил] метил, [5-(4-фторфенил)-2-оксо-1,3-диоксолен-4-ил] метил, [5-(4-хлорфенил)-2-оксо-1,3-диоксолен-4-ил] метил, (2-оксо-1,3-диоксолен-4-ил)метил, (5-метил-2-оксо-1,3-диоксолен-4-ил)метил, (5-этил-2-оксо-1,3-диоксолен-4-ил)метил, (5-пропил-2-оксо-1,3-диоксолен-4-ил)метил, (5-изопропил-2-оксо-1,3-диоксолен-4-ил)метил и (5-бутил-2-оксо-1,3-диоксолен-4-ил)метил; “фталидильные группы”, такие как фталидил, диметилфталидил и диметоксифталидил; вышеописанные “низшие алифатические ацильные группы”, вышеописанные “ароматические ацильные группы”; “соль полуэфирного остатка янтарной кислоты”; “остатки фосфатной соли”; “сложный эфир – образующие остатки, подобные аминокислотам”; карбамоильные группы; карбамоильные группы, замещенные 1 или 2 низшими алкильными группами; и “1-(ацилокси)алкилкарбонильные группы”, такие как пивалоилоксиметилоксикарбонил, из которых “карбонилоксиалкильные группы” являются предпочтительными.
Предпочтительные примеры “защитной группы, которая может быть удалена in vivo биологическим способом, таким как гидролиз” для “сложного эфира карбоксигруппы” включает “алкоксинизшие алкильные группы”, например (низший алкокси)(низшие алкильные) группы, такие как метоксиэтил, 1-этоксиэтил, 1-метил-1-метоксиэтил, 1-(изопропокси)этил, 2-метоксиэтил, 2-этоксиэтил, 1,1-диметил-1-метоксиэтил, этоксиметил, н-пропоксиметил, изопропоксиметил, н-бутоксиметил и трет-бутоксиметил, (низший алкокси)низшие алкильные группы, замещенные низшим алкокси, такие как 2-метоксиэтоксиметил, “арил”окси”низшие алкильные группы”, такие как феноксиметильные группы, и (галогенированный низший алкокси) (низшие алкильные группы, такие как 2,2,2-трихлорэтоксиметил и бис(2-хлорэтокси)метильные группы; “”низший алкокси”карбонил <<низшие алкильные группы>>>>, такие как метоксикарбонилметильные группы; <<циано>>низшие алкильные группы>>>>, такие как цианометил и 2-цианоэтил; <<<<низший алкил>>тиометильные группы>>, такие как метилтиометил и этилтиометил; “”арил”тиометильные группы”, такие как фенилтиометил и нафтилтиометил; “низший алкил”сульфонил “низшие алкильные группы”, которые могут быть замещены галогеном”, такие как 2-метансульфонилэтил и 2-трифторметансульфонилэтильные группы; “”арил”сульфонил “низшие алкильные группы””, такие как 2-бензилсульфонилэтил и 2-толуолсульфонилэтил; вышеописанные “1-(ацилокси) “низшие алкильные группы””; вышеописанные “фталидильные группы”; вышеописанные “арильные группы”; вышеописанные “низшие алкильные группы”; “карбоксиалкильные группы”, такие как карбоксиметил; и “амидообразующие остатки аминокислот”, такие как фенилаланин.
Когда соединения (I) настоящего изобретения содержат амино и/или карбоксильную группу, они могут превращаться в производные, отличающиеся от вышеописанных “фармакологически приемлемых солей” и “их сложных эфиров”. “Другие производные” означают такие производные. Примеры таких производных включают производные амида.
Соединения (I) настоящего изобретения содержат асимметрический атом углерода в своей молекуле, и стереоизомеры, чей асимметрический атом имеет R- или S- конфигурацию, присутствуют. Стереоизомеры и их смесь в любом отношении также включены в настоящее изобретение.
[Варианты осуществления изобретения]Производные спиропиперидина настоящего изобретения могут быть получены нижеописанным способом. [Способ А] 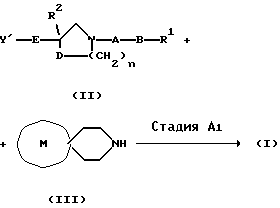 В вышеприведенной схеме реакции, R1, R2, А, В, D, Е, М и n принимают те же самые вышеописанные значения. Y’ может быть любой группой, способной к удалению, как нуклеофильный остаток, и особо не ограничена. Предпочтительные примеры таких групп включают атомы галогена, такие как хлор, бром и иод; тригалометоксигруппы, такие как трихлорметокси; низший алкансульфонилоксигруппы, такие как метансульфонилокси- и этансульфонилоксигруппы; (галогено низший алкил)сульфонилоксигруппы, такие как трифторметансульфонилокси и пентафторэтансульфонилоксигруппы; и арилсульфонилоксигруппы, такие как бензолсульфоилокси-, п-толуолсульфонилокси- и п-нитрофенилсульфонилоксигруппы, из которых атомы галогена и низшие алкансульфонилоксигруппы являются еще более предпочтительными. Стадия А1 является стадией получения соединения (I) настоящего изобретения взаимодействием соединения (II) с соединением (III) в растворителе в присутствии основания. На природу используемого растворителя нет особых ограничений, при условии, что он не оказывает неблагоприятного воздействия на реакцию и способен, по крайней мере, в некоторой степени растворять исходные материалы. Предпочтительные примеры включают алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; нитросоединения, такие как нитроэтан и нитробензол; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и гексаметилфосфотриамид; и сульфоксиды, такие как диметилсульфоксид и сульфолан, из которых предпочтительными являются амиды, простые эфиры и нитрилы, а амиды являются самими предпочтительными. На природу используемого основания нет особых ограничений, при условии, что основание используется в обычных реакциях. Предпочтительные примеры включают сочетания иодида металла (например, иодида калия) и неорганического основания, такого как карбонат щелочного металла (например, карбонат натрия, карбонат калия или карбонат лития), гидрокарбонат щелочного металла (например, гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития), гидрид щелочного металла (например, гидрид лития, гидрид натрия или гидрид калия), гидроксид щелочного металла (например, гидроксид натрия, гидроксид калия, гидроксид бария или гидроксид лития) или фторид щелочного металла (например, фторид натрия или фторид калия); или органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N, N-диметиламино)пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N, N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) и 1,8-диазабицикло[5.4.0] ундек-7-ен (DBU), из которых более предпочтительной является комбинация иодида металла и неорганического основания, а наиболее предпочтительным является сочетание иодида металла и гидрокарбоната щелочного металла. Пределы температуры реакции составляют от 0 до 150oС, от 20 до 120oС. Хотя время реакции зависит, главным образом, от температуры и природы сырья, реагентов реакции и растворителя, которые используются, оно обычно находится в пределах от 30 минут до 48 часов, от 1 до 12 часов. Соединение формулы (I), где углеродный атом, который является кольцевым атомом группы G и который не является соседним с пиперидиновым циклом и имеет гидроксильную группу, может быть получено восстановлением соответствующего производного кетона, который получен в соответствии с вышеописанным методом А. На природу используемого растворителя нет особых ограничений, при условии, что он не оказывает неблагоприятного воздействия на реакцию и способен, по крайней мере, в некоторой степени растворять исходные материалы. Предпочтительные примеры включают спирты, такие как метанол или этанол; галогенированные углеводороды, такие как хлористый метилен, хлороформ, четыреххлористый углерод, дихлорэтан, хлорбензол и дихлорбензол; и простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, из которых предпочтительными являются спирты, а этанол – наиболее предпочтителен. На природу используемого восстановительного агента нет особых ограничений, при условии, что он обычно используется в качестве восстанавливающего агента. Предпочтительные примеры включают гидридные реагенты, такие как боргидриды щелочного металла (например, боргидрид натрия или боргидрид лития), соединения гидрида алюминия (например, алюмогидрид лития или триэтоксиалюмогидрид лития), теллурогидрид натрия, и органические алюмогидридные восстановительные агенты [например, диизобутилалюмогидрид или ди(метоксиэтокси)алюмодигидрид натрия] , из которых наиболее предпочтительными являются боргидриды щелочного металла и органические алюмогидридные восстановительные агенты, самыми предпочтительными являются боргидриды щелочного металла. Пределы температуры реакции составляют от -78 до 50oС, от -20 до 20oС. Время реакции зависит, главным образом, от температуры и природы сырья, реагентов реакции и растворителя, которые используются. Обычно оно находится в пределах от 5 минут до 24 часов, от 10 минут до 2 часов. После завершения соответствующих реакций соединения, полученные соответствующими реакциями, можно выделить из реакционной смеси обычным способом. Например, реакционную смесь соответственно нейтрализуют и, после удаления фильтрацией нерастворимого вещества, если таковое есть, добавляют несмешивающийся с водой органический растворитель (например, этилацетат). После промывания водой и подобным ей, органический слой, содержащий желаемое соединение, отделяют и сушат над безводным сульфатом магния и ему подобным. Затем растворитель отгоняют с получением целевого соединения. Полученное целевое соединение, при желании, выделяют и очищают обычными способами, такими как кристаллизация и переосаждение, или способами, которые обычно используются для выделения и очистки органических соединений, например адсорбционной колоночной хроматографией с использованием носителя, такого как силикагель, алюмо- или магнийсиликагель, флоризил; способом с использованием синтетических адсорбентов, например разделительной колоночной хроматографией с использованием Сефадекса LH-20 (произведенного Pharmacia Co. ), Амберлита XAD-11 (произведенного Rohm & Haas Co.), Diaion HP-20 (произведенного Mitsubishi Kasei Co., Ltd.); способом с использованием ионообменной хроматографии; или жидкостной хроматографией с нормальной/обращенной фазой (высокоэффективной жидкостной хроматографией, использующей силикагель или алкилированный силикагель; или в сочетании с использованием подходящего растворителя. В данном случае сырье является коммерчески доступным или может быть легко получено известными способами. Например, соединение формулы (II) можно получить способом, раскрытым в ЕР-776893, и ему подобным, в то время как соединение формулы (III) можно получить способом, хорошо известным из уровня техники (см., например, патент US 5578593) и ему подобным. Новые производные спиропиридина настоящего изобретения обладают превосходным антагонизмом против тахикинина, превосходной антагонистической активностью против NK1, NK2 и NК3 рецепторов, превосходной пероральной абсорбцией и меньшей токсичностью, что делает их полезными в качестве лекарственного средства. Примеры заболеваний, для которых это лекарственное средство полезно в качестве профилактического или терапевтического средства, включают такие заболевания центральной нервной системы, как тревога, депрессия, психоз и шизофрения; синдром апноэ во сне; нейродегенеративные болезни, такие как слабоумие, вызванное СПИДом, старческое слабоумие, болезнь Альцгеймера, синдром Дауна, демиелинизация, атрофический латеральный склероз, невропатия, периферическая невропатия и невралгия; респираторные заболевания, такие как хроническая абструктивная болезнь легких, бронхит, пневмония, бронхостеноз, астма и кашель; воспалительные болезни, такие как воспаление пищеварительного тракта (IBD), псориаз, фиброз, эпифазный остеомиелит, остеоартрит и ревматоидный артрит; аллергические заболевания, такие как ринит и экзема; заболевание повышенной чувствительности, такое как повышенная чувствительность к винограду; офтальмологические заболевания, такие как конъюктивит, весенний конъюктивит, весенний катар верхних дыхательных путей, разрушение гематоофтальмического барьера в случае различных воспалительных заболеваний глаза, повышение внутриглазного давления и миоз; заболевания кожи, такие как контактный дерматит, атопический дерматит, крапивница и другие экзематоидные дерматиты; пагубная привычка, такая как алкогольная зависимость; соматические заболевания, вызванные стрессом; дистрофия симпатического рефлекса, такой как кистевой и плечевой синдром; дистимия; нежелательная иммунная реакция, включающая отторжение трансплантата, заболевание, связанное с иммунным потенциалом, включающее красную волчанку и подавление иммунитета; дигестивные заболевания, включающие заболевания, вызванные нарушениями в нервах, регулирующих органы, колит, неспецифический язвенный колит и болезнь Крона, рвота, включая рвоту, вызванную вредным действием рентгеновского излучения и химиотерапией, ядами, токсинами, беременностью, расстройством вестибулярного аппарата, постоперационным страданием, желудочно-кишечной окклюзией, пониженным перемещением по желудочно-кишечному тракту, висцеральной болью, мигренью, повышением внутриартериального давления, внутричерепного давления или введением различных лекарств; функциональные заболевания мочевого пузыря, такие как цистит или недержание мочи; зозинофилия, вызванная коллагеновыми болезнями, склеродермия или инфекция Fasciola hepatica (печеночная двуустка); заболевания, вызванные патологическим кроветоком, обусловленным расширением или сужением кровеносных сосудов, такие как стенокардия, мигрень и болезнь Рейно; и заболевания болевого ноцирецептора, такие как мигрень, цефалгия и одонталгия. Соединения (I) настоящего изобретения могут быть введены перорально, например, в виде таблеток, капсул, гранул, порошков или сиропов или введены парентерально, например, в виде инъекционных препаратов или суппозиториев. Такие препараты можно получить, по существу, известным способом, используя добавки, такие как эксципиенты [например, производные сахара, такие как лактоза, сахароза, глюкоза, маннит или сорбит; производные крахмала, такие как кукурузный крахмал, картофельный крахмал,  -крахмал, декстрин или карбоксиметиловый крахмал; производные целлюлозы, такие как кристаллическая целлюлоза, малозамещенная гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, кальцийкарбоксиметилцеллюлоза или внутренне поперечно-связанный натрийкарбоксиметилцеллюлоза; аравийная камедь; декстрин; органические эксципиенты, такие как поллулан; кремневые производные, такие как легкая безводная кремневая кислота, синтетический алюмосиликат или магнийалюминат метасиликат; фосфаты, такие как фосфат кальция; карбонаты, такие как карбонат кальция; неорганические эксципиенты, такие как сульфаты (например, сульфат кальция)]; смазки [например, стеараты металла, такие как стеариновая кислота, стеарат кальция и стеарат магния; тальк; коллоидная двуокись кремния; воски, такие как пчелиный воск и спермасет; борная кислота; адипиновая кислота;, сульфаты, такие как сульфат натрия; гликоль; фумаровая кислота; бензоат натрия; DL-лейцин; натриевые соли жирных кислот; лаурилсульфаты, такие как лаурилсульфат натрия и лаурилсульфат магния; кремниевые кислоты, такие как безводная кремниевая кислота и гидрат силиката; и вышеупомянутые производные крахмала] ; связующие вещества [например, поливинилпирролидон, макрогол или те же самые соединения, что и вышеназванные эксципиенты; дезинтеграторы, например те же самые соединения, как вышеуказанные эксципиенты и химически модифицированные крахмалцеллюлозы, такие как кроскармеллоза натрия, натрийкарбоксметиловый крахмал и поперечно-сшитый поливинилпирролидон] ; стабилизаторы [например, пара-оксибензоаты, такие как метил-пара-аминобензойная кислота (метилпарабен) и пропил-пара-аминобензойная кислота (пропилпарабен); спирты, такие как хлорбутанол, бензиловый спирт и фенилэтиловый спирт; бензалконидхлорид; фенолы, такие как фенол и крезол; тримекозол; дегидроуксусная кислота; и сорбиновая кислота]; модификаторы лекарственных веществ [например, обычно используемые подсластители, кислые агенты или ароматизаторы]; и разбавители согласно известным способам.
Доза изменяется в зависимости от тяжести болезни, возраста, способа введения и тому подобное. Например, в случае перорального введения, благоприятно, если соединение настоящего изобретения вводится от одного до нескольких раз в день в дозе от 0,01 мг/кг веса тела (0,1 мг/кг веса тела, предпочтительный предел нижний) до 100 мг/кг веса тела (50 мг/кг веса тела, предпочтительный предел верхний) в зависимости от тяжести болезни. В случае внутривенного введения благоприятно, если соединение настоящего изобретения вводится от одного до нескольких раз в день в дозе от 0,01 мг/кг веса тела (0,05 мг/кг веса тела, предпочтительный предел нижний) до 100 мг/кг веса тела (50 мг/кг веса тела, предпочтительный предел верхний) в зависимости от тяжести болезни.
[Наилучшие варианты осуществления изобретения] -крахмал, декстрин или карбоксиметиловый крахмал; производные целлюлозы, такие как кристаллическая целлюлоза, малозамещенная гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, кальцийкарбоксиметилцеллюлоза или внутренне поперечно-связанный натрийкарбоксиметилцеллюлоза; аравийная камедь; декстрин; органические эксципиенты, такие как поллулан; кремневые производные, такие как легкая безводная кремневая кислота, синтетический алюмосиликат или магнийалюминат метасиликат; фосфаты, такие как фосфат кальция; карбонаты, такие как карбонат кальция; неорганические эксципиенты, такие как сульфаты (например, сульфат кальция)]; смазки [например, стеараты металла, такие как стеариновая кислота, стеарат кальция и стеарат магния; тальк; коллоидная двуокись кремния; воски, такие как пчелиный воск и спермасет; борная кислота; адипиновая кислота;, сульфаты, такие как сульфат натрия; гликоль; фумаровая кислота; бензоат натрия; DL-лейцин; натриевые соли жирных кислот; лаурилсульфаты, такие как лаурилсульфат натрия и лаурилсульфат магния; кремниевые кислоты, такие как безводная кремниевая кислота и гидрат силиката; и вышеупомянутые производные крахмала] ; связующие вещества [например, поливинилпирролидон, макрогол или те же самые соединения, что и вышеназванные эксципиенты; дезинтеграторы, например те же самые соединения, как вышеуказанные эксципиенты и химически модифицированные крахмалцеллюлозы, такие как кроскармеллоза натрия, натрийкарбоксметиловый крахмал и поперечно-сшитый поливинилпирролидон] ; стабилизаторы [например, пара-оксибензоаты, такие как метил-пара-аминобензойная кислота (метилпарабен) и пропил-пара-аминобензойная кислота (пропилпарабен); спирты, такие как хлорбутанол, бензиловый спирт и фенилэтиловый спирт; бензалконидхлорид; фенолы, такие как фенол и крезол; тримекозол; дегидроуксусная кислота; и сорбиновая кислота]; модификаторы лекарственных веществ [например, обычно используемые подсластители, кислые агенты или ароматизаторы]; и разбавители согласно известным способам.
Доза изменяется в зависимости от тяжести болезни, возраста, способа введения и тому подобное. Например, в случае перорального введения, благоприятно, если соединение настоящего изобретения вводится от одного до нескольких раз в день в дозе от 0,01 мг/кг веса тела (0,1 мг/кг веса тела, предпочтительный предел нижний) до 100 мг/кг веса тела (50 мг/кг веса тела, предпочтительный предел верхний) в зависимости от тяжести болезни. В случае внутривенного введения благоприятно, если соединение настоящего изобретения вводится от одного до нескольких раз в день в дозе от 0,01 мг/кг веса тела (0,05 мг/кг веса тела, предпочтительный предел нижний) до 100 мг/кг веса тела (50 мг/кг веса тела, предпочтительный предел верхний) в зависимости от тяжести болезни.
[Наилучшие варианты осуществления изобретения]Далее настоящее изобретение будет описано с дополнительными подробностями с приведением примеров, примеров композиций и примеров испытаний. Однако не следует воспринимать их для ограничения объема настоящего изобретения. [Примеры] [Пример 1] 1-{ 2-[(2R)-(3,4-Дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(2-гидрокси)индан-1,4′-пиперидин] (Нижеописанное соединение 138) В 4 мл безводного диметилформамида суспендируют 200 мг (0,37 ммоль) 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этанол метансульфоната, 96 мг (0,40 ммоль) спиро[(2-гидрокси)индан-1,4′-пиперидин]гидрохлорида, полученного в Ссылочном примере 3, 92 мг (1,10 ммоль) бикарбоната натрия и 91 мг (0,55 ммоль) иодида калия, с последующим нагреванием при 80oС в течение 8 ч в атмосфере азота. В реакционную смесь добавляют воду и полученную смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния. Растворитель отгоняют под вакуумом. Остаток очищают тонкослойной хроматографией на силикагеле (растворитель; метиленхлорид: метанол = 10:1) с получением 175 мг (73%) указанного в заглавии соединения в виде белых кристаллов. [  ]D+11,8 ]D+11,8 (с=0,56, хлороформ).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13) (с=0,56, хлороформ).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13)  , мд: 7,16-7,67(7Н, м), 6,52 (2Н, с), 4,40 (1Н, с), 3,85 (9Н, с), 3,37-4,04 (6Н, м), 3,27(1Н, дд, J= 16,7, 5,3 Гц), 2,82 (1Н, д, J=16,7 Гц), 2,62-2,88 (2Н, м), 1,49-2,40 (10Н, м).
ИК-абсорбционный спектр , мд: 7,16-7,67(7Н, м), 6,52 (2Н, с), 4,40 (1Н, с), 3,85 (9Н, с), 3,37-4,04 (6Н, м), 3,27(1Н, дд, J= 16,7, 5,3 Гц), 2,82 (1Н, д, J=16,7 Гц), 2,62-2,88 (2Н, м), 1,49-2,40 (10Н, м).
ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):3432, 2934, 1634, 1584 Масс-спектрометрический анализ (FAB) м/е: 655 (M+H)+. Элементный анализ (%, основанный на С35Н40N2O6Сl2  0.5Н2O) 0.5Н2O)Вычислено: С 63,25, Н 6,22, N 4,21, Cl 10,67. Найдено: С 63,24, Н 6,37, N 4,14, Cl 10,41. [Пример 2] 1-{ 2-[(2R)-(3,4-Дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(3-гидрокси)индан-1,4′-пиперидин] (Нижеописанное соединение 106) [Пример 2а] 1-{ 2-[(2R)-(3,4-Дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(3-гидрокси)индан-1,4′-пиперидин] В 4 мл безводного диметилформамида суспензируют 200 мг (0,37 ммоль) 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этанолметансульфоната, 95 мг (0,40 ммоль) спиро[(3-гидрокси)индан-1,4′-пиперидин] гидрохлорида, полученного в Ссылочном примере 5, 92 мг (1,10 ммоль) бикарбоната натрия и 91 мг (0,55 ммоль) иодида калия, с последующим нагреванием при 80oС в течение 8 ч в атмосфере азота. В реакционную смесь добавляют воду и полученную смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния. Растворитель отгоняют под вакуумом. Остаток очищают тонкослойной хроматографией на силикагеле (растворитель; метиленхлорид: метанол = 10:1), с получением 167 мг (70%) указанного в заглавии соединения в виде белых кристаллов. [  ]D+11,8 ]D+11,8 (с=0,53, хлороформ).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13) (с=0,53, хлороформ).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13)  , мд: 7,29-7,78 (7Н, м), 6,49 (2Н, с), 3,85 (9Н, с), 3,30-3,92 (6Н, м), 2,74-2,96 (2Н, м), 2,52 (2Н, с), 1,93-2,30 (8Н, м), 1,47-1,50 (2Н, м).
ИК-абсорбционный спектр , мд: 7,29-7,78 (7Н, м), 6,49 (2Н, с), 3,85 (9Н, с), 3,30-3,92 (6Н, м), 2,74-2,96 (2Н, м), 2,52 (2Н, с), 1,93-2,30 (8Н, м), 1,47-1,50 (2Н, м).
ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):3416, 2933, 1714, 1637, 1603. Масс-спектрометрический анализ (FAB) м/е: 653 (М+Н)+. Элементный анализ (%, основанный на C35H38N2O6Cl2  O,5H2O) O,5H2O)Вычислено: С 63,44, Н 5,93, N 4,22, Cl 10,70. Найдено: С 63,63, Н 6,20, N 4,11, Cl 10,26. [Пример 2б] 1-{ 2-[(2R)-(3,4-Дихлорфенил)-4-(3,4,5-триметоксибензо-ил)морфолин-2-ил] этил}спиро[(3-гидрокси)индан-1,4′-пиперидин] В 1 мл этанола растворяют 24 мг (0,62 ммоль) боргидрида натрия. К полученному раствору добавляют раствор 1-{2[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил]этил}спиро[(3-инданон)-1,4′-пиперидина] (100 мг (0,16 ммоль)), полученного в Примере 2а, в этаноле (1 мл) при охлаждении льдом с последующим перемешиванием в течение 2 ч в атмосфере азота. В реакционную смесь добавляют воду и полученную смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния. Растворитель отгоняют под вакуумом. Остаток очищают тонкослойной хроматографией на силикагеле (растворитель; метиленхлорид: метанол= 10: 1) с получением 80 мг (78%) указанного в заглавии соединения в виде белых кристаллов. [  ]D+8,3 ]D+8,3 (с=0,52, хлороформ).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13) (с=0,52, хлороформ).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13)  , мд: 7,19-7,69 (7Н, м), 6,50 (2Н, с), 5,23 (1Н, т, J=5,9 Гц), 3,85 (9Н, с), 3,41-4,02 (6Н, м), 2,78-2,89 (2Н, м), 1,37-2,45 (12Н, м).
ИК-абсорбционный спектр , мд: 7,19-7,69 (7Н, м), 6,50 (2Н, с), 5,23 (1Н, т, J=5,9 Гц), 3,85 (9Н, с), 3,41-4,02 (6Н, м), 2,78-2,89 (2Н, м), 1,37-2,45 (12Н, м).
ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):3424, 2928, 1634, 1584. Масс-спектрометрический анализ (EI) м/е: 654 (М)+. Элементный анализ (%, основанный на C35H40N2O6Cl2  0,5H2O) 0,5H2O)Вычислено: С 63,25, Н 6,22, N 4,21, Cl 10,67. Найдено: С 63,24, Н 6,35, N 4,05, Cl 10,22. [Пример 3] 1-{ 2-[(2R)-(3,4-Дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[((2S)-гидрокси)индан-1,4′-пиперидин] (Нижеописанное соединение 138) В 6 мл диметилацетамида суспендируют 300 мг (0,547 ммоль) 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этанолметансульфоната, 144 мг (0,602 ммоль) спиро[((2S)-гидрокси)индан-1,4′-пиперидин] гидрохлорида, полученного в Ссылочном примере 7, 138 мг (1,64 ммоль) бикарбоната натрия и 136 мг (0,821 ммоль) иодида натрия, с последующим нагреванием при 80oС в течение 8 ч. В реакционную смесь добавляют воду и полученную смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором NaCl и сушат над безводным сульфатом магния. Растворитель отгоняют под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (силикагель; 15 г, элюент; гексан:этилацетат = 1:1 –> 1:3, метиленхлорид: метанол = 50:1 –> 20:1), с получением 297 мг (83%) 1-{2[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил} спиро[((2S)-гидрокси)индан-1,4′-пиперидина] в виде белых кристаллов. Температура плавления: 121oС. 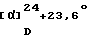 (с=0,96, хлороформ).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13) (с=0,96, хлороформ).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13)  , мд: 7,67-7,16 (7Н, м), 6,52 (2Н, шир. с), 4,40 (1Н, шир. с), 3,85 (9Н, с), 4,04-3,37 (6Н, м), 3,27 (1Н, дд, J=16,7 Гц, 5,3 Гц), 2,82(1Н, д, J=16,7 Гц), 2,88-2,62 (2Н, м), 2,40-1,49 (10Н, м).
ИК-абсорбционный спектр , мд: 7,67-7,16 (7Н, м), 6,52 (2Н, шир. с), 4,40 (1Н, шир. с), 3,85 (9Н, с), 4,04-3,37 (6Н, м), 3,27 (1Н, дд, J=16,7 Гц, 5,3 Гц), 2,82(1Н, д, J=16,7 Гц), 2,88-2,62 (2Н, м), 2,40-1,49 (10Н, м).
ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):3427, 2933, 1634, 1584, 1465, 1428, 1415, 1330, 1237, 1128. Масс-спектрометрический анализ (FAB) м/е: 655 (М+Н)+. Элементный анализ (%, основанный на С35Н40С12N2O6  Н2O) Н2O)Вычислено: С 62,41, Н 6,29, N 4,16, Cl 10,53. Найдено: С 62,33, Н 6,27, N 3,90, Cl 10,49. [Пример 4] 1-{ 2-[(2R)-(3,4-Дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил} спиро[((2S)-гидрокси) индан-1,4′-пиперидин] (Нижеописанное соединение 138 гидрохлорид). В 3,0 мл этанола растворяют 297 мг (0,453 ммоль) 1-{2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил} спиро[((2S)-гидрокси)индан-1,4′-пиперидина), полученного в Примере 3. К полученному раствору при охлаждении льдом прибавляют 0,57 мл 4 N раствора хлористого водорода в 1,4-диоксане, с последующим перемешиванием в течение 30 мин. Затем растворитель упаривают при уменьшенном давлении, остаток промывают эфиром с получением 304 мг (выход:97%) 1-{2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил} спиро[((2S)-гидрокси)индан-1,4′-пиперидин] гидрохлорида в виде белых кристаллов. Температура плавления: 169oС. 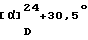 (с=1,0, метанол).
Спектр ядерно-магнитного резонанса (400 МГц, DMCO-d6) (с=1,0, метанол).
Спектр ядерно-магнитного резонанса (400 МГц, DMCO-d6)  , мд: 10,78 (1Н, м), 7,88-7,32 (3Н, м), 7,27-7,06 (4Н, м), 6,76-6,61 (2Н, м), 4,93-4,92 (1H, м), 4,39-4,38 (1Н, м), 3,81 (6Н, с), 3,70 (3Н, с), 4,22-2,58 (15Н, м), 2,41-1,18 (4Н, м), 1,69-1,48 (1H, м).
ИК-абсорбционный спектр , мд: 10,78 (1Н, м), 7,88-7,32 (3Н, м), 7,27-7,06 (4Н, м), 6,76-6,61 (2Н, м), 4,93-4,92 (1H, м), 4,39-4,38 (1Н, м), 3,81 (6Н, с), 3,70 (3Н, с), 4,22-2,58 (15Н, м), 2,41-1,18 (4Н, м), 1,69-1,48 (1H, м).
ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):3360, 2937, 2561, 1635, 1584, 1464, 1427, 1330, 1237, 1127. Масс-спектрометрический анализ (FAB) м/е: 655 ([М+Н]+) свободная форма). Элементный анализ (%, основанный на C35H40Cl2N2O6  1/2Н2О) 1/2Н2О)Вычислено: С 59,96, Н 5,89, N 4,00, Cl 15,17. Найдено: С 59,94, Н 5,81, N 3,94, Cl 15,22. Соединения, которые будут описаны ниже, были синтезированы подобным способом, который описан в вышеизложенных примерах. 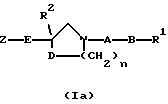 В данном случае в нижеописанной таблице, “Ас” обозначает ацетильную группу, “Me” обозначает метильную группу, “Ph” обозначает фенил, “iPr” обозначает изопропил и каждый заместитель (в таблице обозначенный как “зам”) обозначает группу, представленную в табл.А. В табл. 1-3 соединения, обозначенные как Соединения 1-192 и Соединения 321-384, являются предпочтительными, из которых соединения, обозначенные как Соединения 97-192, являются более предпочтительными, а соединения, обозначенные как Соединения 101-106, 133-138 и 165-179, являются еще более предпочтительными. Самыми предпочтительными являются соединения: 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(2-гидрокси)индан-1,4′-пиперидин], 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(3-гидрокси)индан-1,4′-пиперидин], 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[1Н-инден-1,4′-пиперидин], 1-{2-[(2R)-(3,4-дихлорфенил)-4-(3,5-диметоксибензоил)морфолин-2-ил]этил} спиро[(2-гидрокси)1Н-индан-1,4′-пиперидин], 1-{2-[(2R)-(3,4-дихлорфенил)-4-(3,5-диметоксибензоил)морфолин-2-ил]этил} спиро[(3-гидрокси)1Н-индан-1,4′-пиперидин] и 1-{2-[(2R)-(3,4-дихлорфенил)-4-(3,5-диметоксибензоил)морфолин-2-ил]этил} спиро[1Н-инден-1,4′-пиперидин], особенно предпочтительными соединениями являются: 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(2-гидрокси)индан-1,4′-пиперидин] и 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил] этил}спиро[(3-гидрокси)индан-1,4′-пиперидин]. [Ссылочные примеры] Настоящее изобретение далее будет описано со ссылкой на Ссылочные примеры. [Ссылочный пример 1] N-трет-Бутоксикарбонил-спиро(1Н-инден-1,4′-пиперидин) В 60 мл безводного тетрагидрофурана растворяют 11,6 г (0,10 моль) индена, с последующим прикапыванием 200 мл (0,20 моль) бис-три-метилсилиламида лития (1,0 М раствор тетрагидрофурана) в течение одного часа при охлаждении льдом. После 30-минутного перемешивания к реакционной смеси прикапывают 50 мл тетрагидрофуранового раствора 24,2 г (0,10 моль) N-трет-бутоксикарбонил-бис(2-хлорэтил)амина в течение 20 мин. Полученную смесь затем перемешивают 2 часа при охлаждении льдом. Реакционную смесь упаривают под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (элюент; н-гексан: этилацетат = 97:3) с получением 21,3 г (89%) озаглавленного соединения в виде белых кристаллов. Спектр ядерно-магнитного резонанса (400 МГц, CDCl3)  , мд: , мд:7,21-7,41 (4Н, м), 6,85 (1Н, д, J=5,7 Гц), 6,79 (1Н, д, J=5,7 Гц), 4,11-4,28 (2Н, м), 3,07-3,23(2Н, м), 2,01 (2Н, дт, J=12,8, 4,5 Гц), 1,51 (9Н, с), 1,47-1,50 (2Н, м). ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):2965, 1680, 1425, 1365, 1245, 1165. Масс-спектрометрический анализ (EI) м/е: 285(M)+. [Ссылочный пример 2] N-трет-Бутоксикарбонил-спиро[(2-гидрокси)индан-1,4′-пиперидин] и N-трет-бутоксикарбонил-спиро[(3-гидрокси)индан-1,4′-пиперидин] В 100 мл безводного тетрагидрофурана растворяют 10,0 г (35,0 ммоль) N-трет-бутоксикарбонил-спиро(1Н-инден-1,4′-пиперидина), полученного, как описано в Ссылочном примере 1, с последующим прикапыванием 52,5 мл (52,5 ммоль) тетрагидрофуранборанового комплекса (1,0 М тетрагидрофурановый раствор) в течение 1,5 ч при охлаждении льдом. Полученную смесь перемешивают 30 мин при охлаждении льдом и затем 4 ч при комнатной температуре. При охлаждении льдом в реакционную смесь добавляют этанол. Затем перемешивают 5 мин и в реакционную смесь прикапывают 13 мл 6 N водного раствора гидроксида натрия в течение 20 мин. Затем прикапывают 13,0 мл 30%-ного водного раствора перекиси водорода за 25 мин, с последующим перемешиванием 20 мин при охлаждении льдом и 3 ч при комнатной температуре. Реакционную смесь выливают в воду, затем экстрагируют этилацетатом. Органический слой промывают насыщенным раствором NaCl и сушат над безводным сульфатом натрия. Затем растворитель отгоняют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент; н-гексан:этилацетат = 7:30-60:40), получают 5,83 г (55%) N-трет-бутоксикарбонил-спиро[(2-гидрокси)индан-1,4′-пиперидина] в виде неполярного вещества и 4,20 г (40%) N-трет-бутоксикарбонил-спиро[(3-гидрокси)индан-1,4′-пиперидина] в виде полярного вещества, каждый в виде белых кристаллов. N-трет-Бутоксикарбонил-спиро[(2-гидрокси)индан-1,4′-пиперидин] Спектр ядерно-магнитного резонанса (400 МГц, CDCl3)  , мд: , мд:7,20-7,29 (4Н, м), 4,48-4,52 (1H, м), 3,96 (2Н, шир. с), 3,32 (1Н, дд, J=16,7, 5,3 Гц), 3,24 (2Н, м), 2,86 (1Н, дд, J=16,7, 1,0 Гц), 2,02-2,06 (1H, м), 1,84 (1Н, м), 1,52-1,65 (3Н, м), 1,49 (9Н, с). ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):3620, 2980, 2935, 1680, 1430, 1365. Масс-спектрометрический анализ (EI) м/е: 303 (М)+. N-трет-Бутоксикарбонил-спиро[(3-гидрокси)индан-1,4′-пиперидин] Спектр ядерно-магнитного резонанса (400 МГц, CDCl3)  , мд: , мд:7,42 (1Н, д, J=7,0 Гц), 7,26-7,36 (2Н, м), 7,23 (1Н, д, J=7,0 Гц), 5,29 (1Н, д, J= 7,2 Гц), 4,12 (2Н, м), 2,95 (1Н, м), 2,53 (1Н, кв, J=6,9 Гц), 1,9-1,98 (2Н, м), 1,72-1,80 (2Н, м), 1,61-1,67 (1H, м), 1,49 (9Н, с), 1,38-1,42 (1H, м). ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):3605, 2980, 2935, 1680, 1430, 1365. Масс спектрометрический анализ (EI) м/е: 303 (M)+. [Ссылочный пример 3] Спиро[(2-гидрокси)индан-1,4′-пиперидин]гидрохлорид В 10 мл этанола растворяют 2,51 г (8,27 ммоль) N-трет-бутоксикарбонил-спиро[(2-гидрокси)индан-1,4′-пиперидина] , полученного, как описано в Ссылочном примере 2, затем добавляют 10,0 мл (40,0 ммоль) 4 N раствора хлористоводородной кислоты в диоксане в течение 5 мин при охлаждении льдом. После этого реакционную смесь перемешивают 30 мин при охлаждении льдом и 4 ч при комнатной температуре. Растворитель отгоняют в вакууме из реакционной смеси. Остаток перекристаллизовывают из смеси метанол/диэтиловый эфир, получают 1,64 г (83%) указанного в заглавии соединения в виде белых кристаллов. Температура плавления: 250-251oС. Спектр ядерно-магнитного резонанса (400 МГц, DMCO-d6)  , мд: , мд:8,99 (2Н, м), 7,13-7,22 (4Н, м), 5,19 (1Н, с), 4,38 (1Н, с), 3,13-3,26 (5Н, м), 2,77 (1Н, дд, J=16,5, 3,2Гц), 2,07 (1Н, д, J=14,0 Гц), 1,82-1,99 (2Н, м), 1,60 (д, J=14,0 Гц). ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):3390, 2973, 2826, 1598. Масс спектрометрический анализ (EI) м/е: 203(М)+ (свободная форма). [Ссылочный пример 4] N-трет-Бутоксикарбонил-спиро[(3-инданон)-1,4′-пиперидин] В 40 мл хлористого метилена растворяют 2,00 г (6,59 ммоль) N-трет-бутоксикарбонил-спиро[(3-гидрокси)индан-1,4′-пиперидина] , полученного, как описано в Ссылочном примере 2. К полученному раствору добавляют 12,0 г порошкообразных молекулярных сит 4 ангстрема и 2,84 г (13,2 ммоль) хлорхромата пиридиния при охлаждении льдом и последующим 30-минутным перемешиванием. Далее смесь перемешивают 2 ч при комнатной температуре. Затем добавляют 80 мл диэтилового эфира к реакционной смеси, полученную смесь фильтруют через Цеолит. Фильтрат концентрируют в вакууме. Остаток очищают колоночной хроматографией (элюент; н-гексан: этилацетат = 75:25), получают 1,98 г (99%) указанного в заглавии соединения в виде белых кристаллов. Спектр ядерно-магнитного резонанса (400 МГц, СDС13)  , мд: , мд:7,75 (1Н, д, J=8,0 Гц), 7,65 (1Н, дд, J=8,0, 8,0 Гц), 7,49 (1Н, д, J=8,0 Гц), 7,42 (1Н, дд, J=8,0, 8,0 Гц), 4,23 (2Н, шир. с), 2,86 (2Н, м), 2,64 (2Н, с), 1,99 (2Н, дт, J=13,2, 4,4 Гц), 1,50-1,53 (11Н, м). ИК-абсорбционный спектр  макс, см-1 (CHCl3): макс, см-1 (CHCl3):2980, 2940, 1710, 1685, 1430. Масс спектрометрический анализ (EI) м/е: 301(М)+. [Ссылочный пример 5] Спиро [(3-инданон)-1,4′-пиперидин]гидрохлорид В 20 мл этанола растворяют 1,94 г (6,50 ммоль) N-трет-бутоксикарбонил-спиро[(3-инданон)-1,4′-пиперидина] , полученного, как описано в Ссылочном примере 4, затем прикапывают 17,0 мл (65,0 ммоль) 4 N раствор хлористого водорода в диоксане в течение 5 мин при охлаждении льдом. После этого реакционную смесь перемешивают 30 мин при охлаждении льдом и 2 ч при комнатной температуре. Растворитель отгоняют в вакууме из реакционной смеси, а остаток перекристаллизовывают из смеси метанол/диэтиловый эфир, получают 1,46 г (94%) указанного в заглавии соединения в виде белых кристаллов. Температура плавления: 227-228oС. Спектр ядерно-магнитного резонанса (400 МГц, DMCO-d6)  , мд: , мд:9,07 (2Н, шир. с), 7,78 (1Н, дд, J=7,8, 7,8 Гц), 7,65 (1Н, J=7,8 Гц), 7,59 (1Н, д, J= 7,8 Гц), 7,50 (1Н, дд, J=7,8, 7,8 Гц), 3,34-3,37 (2Н, м), 2,99-3,37 (2Н, м), 2,76 (2Н, м), 2,27 (2Н, дт, J=13,8, 4,1 Гц), 1,64-1,68 (2Н, м). ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):3030, 2703, 2500, 1690, 1610, 1470. Масс спектрометрический анализ (EI) м/е: 201(М)+ (свободная форма). [Ссылочный пример 6] N-трет-Бутоксикарбонил-спиро[((2S)-гидрокси)индан-1,4′-пипeридин] К 0,42 мл (0,42 ммоль) 1,0 М толуольного раствора (R)-2-метил-СВS-оксазаборолидина со скоростью 1,0 мл/мин добавляют (8,3 мл) тетрагидрофуранового раствора 2,5 г (8,30 ммоль) N-трет-бутоксикарбонил-спиро[(2-инданон)-1,4′-пиперидина] и 4,2 мл 1 М тетрагидрофуранового раствора боран-тетрагидрофуранового комплекса. Полученную смесь перемешивают 1 час при комнатной температуре, затем добавляют воду при охлаждении льдом. После экстракции реакционной смеси этилацетатом, органический слой промывают насыщенным раствором NaCl и сушат над безводным сульфатом натрия. Затем растворитель упаривают под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (элюент; гексан:этилацетат = 1:1), получают 2,51 г (выход: 100%, оптическая чистота: 89% ее) N-третбутоксикарбонил-спиро[((2S)-гидрокси)индан-1,4′-пиперидин] в виде белых кристаллов. Полученные кристаллы растворяют в 5,0 мл этилацетата при нагревании на водяной бане. Добавляют 150 мл гексана и полученную смесь оставляют стоять, получают 1,9 г белых кристаллов. Снова повторяют ту же самую процедуру и получают 1,52 г (выход: 61%, оптическая чистота: 199%ее) N-трет-бутоксикарбонил-спиро[((2S)-гидрокси)индан-1,4′-пиперидина] в виде белых кристаллов. В данном случае оптическая чистота соединения, указанного в заголовке, определена высокоэффективной жидкостной хроматографией (ВЭЖХ) нитробензоильного производного озаглавленного соединения, которое было получено, как описано в Ссылочном примере 8. Температура плавления: 106oС. 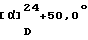 (с=1,0, метанол).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13) (с=1,0, метанол).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13)  , мд: , мд:7,28-7,18 (4Н, м), 4,50 (1Н, дд, J=4,9,1,9 Гц), 4,07-3,83 (2Н, м), 3,32 (1Н, дд, J=16,7 Гц, 4,9 Гц), 3,30-3,12 (2Н, м), 2,86 (1Н, дд, J=16,7 Гц, 1,9 Гц), 2,08-1,99 (1Н, м), 1,89-1,78 (1Н, м), 1,49 (9Н, с), 1,64-1,42 (2Н, м). ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):3349, 2934, 1698, 1425, 1367, 1168, 1162. Масс-спектрометрический анализ (FAB) м/е: 304 (М+Н)+. Элементный анализ (%, основанный на C18H25NO3) Вычислено: С 71,26, Н 8,31, N 4,62. Найдено: С 70,99, Н 8,24, N 4,68. [Ссылочный пример 7] Спиро[((2S)-гидрокси)индан-1,4′-пиперидин]гидрохлорид В 12,4 мл этанола растворяют 1,5 г (4,95 ммоль) N-трет-бутоксикарбонил-спиро[((2S)-гидрокси)индан-1,4′-пиперидина] , полученного, как описано в Ссылочном примере 6. К полученному раствору добавляют 6,2 мл 4 N раствора хлористого водорода в 1,4-диоксане при охлаждении льдом, с последующим 5-часовым перемешиванием при комнатной температуре. Растворитель отгоняют в вакууме из реакционной смеси. Остаток промывают эфиром, получают 1,1 г (выход: 93%) спиро[((2S)-гидрокси) индан-1,4′-пиперидин] гидрохлорид в виде белых кристаллов. Температура плавления: 247oС. 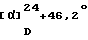 (с=0,50, метанол).
Спектр ядерно-магнитного резонанса (400 МГц/ ДМСО-d6) (с=0,50, метанол).
Спектр ядерно-магнитного резонанса (400 МГц/ ДМСО-d6)  , мд: , мд:8,98(2Н, м), 7,22-7,17 (4Н, м), 5,20 (1Н, д, J=5,0 Гц), 4,40-4,37 (1Н, м), 3,26-3,13 (5Н, м), 2,77 (1Н, дд, J=16,5, 3,2 Гц), 2,07 (1Н, д, J=14,0 Гц), 1,99-1,82 (2Н, м), 1,60 (1Н, д, J=14,0 Гц). ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):3413, 3269, 2937, 1607, 1431, 1074, 765. Масс-спектрометрический анализ (ЕI) м/е: 203 (М)+ (свободная форма). Элементный анализ (%, основанный на С13H17NO  HCl) HCl)Вычислено: С 65,13, Н 7,57, N 5,84, Cl 14,79. Найдено: С 64,89, Н 7,48, N 5,82, Cl 15,01. [Ссылочный пример 8] N-трет-Бутоксикарбонил-спиро[(2S)-(4-нитробензоилокси)индан-1,4′-пиперидин] N-трет-Бутоксикарбонил-спиро[((2S)-гидрокси)индан-1,4′-пиперидин, 30,3 мг (0,1 ммоль), полученный, как описано в Ссылочном примере 6, растворяют в 2,0 мл хлористого метилена. К полученному раствору добавляют 0,042 мл (0,3 ммоль) триэтиламина, 1,2 мг (0,01 ммоль) 4-диметиламинопиридина и 28 мг (0,15 ммоль) 4-нитробензоил хлорида, перемешивают при комнатной температуре 3 часа. Растворитель упаривают из реакционной смеси под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (элюент; н-гексан:этилацетат = 2:1), получают 42 мг (выход: 93%, оптическая чистота: 100% ее) N-трет-бутоксикарбонил-спиро[((2S)-(4-нитробензоилокси)индан-1,4′-пиперидина] в виде белых кристаллов. Оптическую чистоту соединения определяют ВЭЖХ-анализом. Температура плавления: 75,6oС. 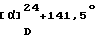 (с=1,18, хлороформ).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13) (с=1,18, хлороформ).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13)  , мд: 8,25 (2Н, д, J= 8,9 Гц), 8,11 (2Н, д, J=8, 9 Гц), 7,34-7,17 (4Н, м), 5,83 (1Н, д, J=5,3 Гц), 4,11-3,84(2Н, м), 3,52 (1Н, дд, J=17,4 Гц, 5,3 Гц), 3,32-3,13 (1Н, м), 3,04 (1Н, д, J= 17,4 Гц), 3,02-2,92 (1Н, м), 2,16-1,97 (2Н, м), 1,73-1,58 (2Н, м), 1,47 (9Н, с).
ИК-абсорбционный спектр , мд: 8,25 (2Н, д, J= 8,9 Гц), 8,11 (2Н, д, J=8, 9 Гц), 7,34-7,17 (4Н, м), 5,83 (1Н, д, J=5,3 Гц), 4,11-3,84(2Н, м), 3,52 (1Н, дд, J=17,4 Гц, 5,3 Гц), 3,32-3,13 (1Н, м), 3,04 (1Н, д, J= 17,4 Гц), 3,02-2,92 (1Н, м), 2,16-1,97 (2Н, м), 1,73-1,58 (2Н, м), 1,47 (9Н, с).
ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):2975, 1723, 1695, 1530, 1279, 1167. Масс-спектрометрический анализ (FAB) м/е: 452 [(М+Н)+]. Элементный анализ (%, основанный на C25H28N2O6) Вычислено: С 66,36, Н 6,24, N 6,19, О 21,21. Найдено: С 66,33, Н 6,37, N 5,95. ВЭЖХ-анализ Колонка: Chiral Cel AD (производство Daicel Chemical Industris, Ltd., внутренний диаметр 4,6 мм, длина 250 мм) Элюент: гексан:2-пропанол = 50:50. Скорость течения: 0,5 мл/мин. Температура: 40oС. Обнаружение: 254 нм. Время удерживания: 17,1 мин. [Ссылочный пример 9] N-трет-Бутоксикарбонил-спиро[((2R)-гидрокси)индан-1,4′-пиперидин Используя процедуру, аналогичную описанной в Ссылочном примере 6, из 0,5 г (1,66 ммоль) N-трет-бутоксикарбонил-спиро[(2-инданон)-1,4′-пиперидина с использованием 0,083 мл (0,083 ммоль) 1,0 М толуольного раствора (S)-2-метил-СDS-оксазаборазина получают 215 мг (выход: 43%, оптическая чистота: 100% ее) N-трет-бутоксикарбонил-спиро[((2R)-гидрокси)индан-1,4′-пиперидина в виде белых кристаллов. (Оптическую чистоту вышеуказанного соединения определяют высокоэффективной жидкостной хроматографией (ВЭЖХ) нитро-бензоильного производного озаглавленного соединения, которое было получено, как описано в Ссылочном примере 10). Температура плавления, спектр ядерно-магнитного резонанса, ИК-абсорбционный спектр, спектрометрический анализ целевого соединения совпадают с (S)-формой того же соединения, полученного в Ссылочном примере 6. 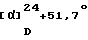 (с=1,0, метанол).
Элементный анализ (%, основанный на C18H25NO3) (с=1,0, метанол).
Элементный анализ (%, основанный на C18H25NO3)Вычислено: С 71,26, Н 8,31, N 4,62. Найдено: С 71,09, Н 8,25, N 4,68. [Ссылочный пример 10] N-трет-Бутоксикарбонил-спиро[((2R)-(4-нитробензоилокси)индан-1,4′-пиперидин Используя процедуру, аналогичную описанной в Ссылочном примере 9, из 30,3 мг (0,1 ммоль) N-трет-бутоксикарбонил-спиро[(2R)-гидрокси)индан-1,4′-пиперидина] получают 43 мг (выход: 95%, оптическая чистота: 100% ее) N-трет-бутоксикарбонил-спиро[(2R)-(4-нитробензоилокси)индан-1,4′-пиперидина] в виде белых кристаллов. Оптическую чистоту соединения определяют ВЭЖХ-анализом. Температура плавления, спектр ядерно-магнитного резонанса, ИК-абсорбционный спектр, масс-спектрометрический анализ целевого соединения совпадают с (S)-формой того же соединения, полученного в Ссылочном примере 8. 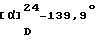 (с=0,76, хлороформ).
Элементный анализ (%, основанный на С25Н28N2О6 (с=0,76, хлороформ).
Элементный анализ (%, основанный на С25Н28N2О6 1/4Н2O) 1/4Н2O)Вычислено: С 65,70, Н 6,29, N 6,13. Найдено: С 65,97, Н 6,38, N 6,01. ВЭЖХ-анализ Колонка: Chiral Cel AD (производство Daicel Chemical Industris, Ltd., внутренний диаметр 4,6 мм, длина 250 мм) Элюент: гексан:2-пропанол = 50:50. Скорость течения: 0,5 мл/мин. Температура: 40oС. Обнаружение: 254 нм. Время удерживания: 10,1 мин. [Ссылочный пример 11] N-трет-Бутоксикарбонил-спиро[((2R, 3S)-эпокси)индан-1,4′-пиперидин] В 2,0 мл метиленхлорида растворяют N-трет-Бутоксикарбонил-спиро[1Н-индан-1,4′-пиперидин] , 100 мг (0,35 ммоль). К полученному раствору добавляют 11,4 мг (0,018 ммоль) (S,S) (+)-N,N’-бис(3,5-ди-трет-бутилсалицилиден)-1,2-циклогександиаминомарганца (III) хлорида, а затем 19 мг (0,11 ммоль) 4-фенилпиридин-N-оксида. Полученную смесь перемешивают 10 мин. Затем к смеси добавляют 1,1 мл (0,7 ммоль) 1,0 М водного раствора гипохлорита натрия и полученную смесь перемешивают 2 часа. К реакционной смеси добавляют воду и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором NaCl, а затем сушат безводным сульфатом натрия. Растворитель экстракта упаривают в вакууме. Остаток подвергают препаративной тонкослойной хроматографии (растворитель, гексан: этилацетат = 2:1), получают 53,6 мг (выход: 51%, оптическая чистота: 91% ее) N-трет-бутоксикарбонил-спиро[((2R, 3S)-эпокси)индан-1,4′-пипепидин] в виде белых кристаллов. Оптическую чистоту соединения определяют ВЭЖХ-анализом. Температура плавления: 149oС. 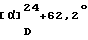 (с=1, метанол, 99% ее).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13) (с=1, метанол, 99% ее).
Спектр ядерно-магнитного резонанса (400 МГц, СDС13)  , мд: 7,49 (1Н, д, J= 7,3 Гц), 7,32-7,15 (3Н, м), 4,28 (1Н, д, J=2,9 Гц), 4,11 (1Н, д, J=2,9 Гц), 4,30-4,03(2Н, м), 3,15 (2Н, шир. т, J=12,0 Гц), 1,95-1,74 (3Н, м), 1,51 (9Н, с), 1,58-1,50 (1H, м).
ИК-абсорбционный спектр , мд: 7,49 (1Н, д, J= 7,3 Гц), 7,32-7,15 (3Н, м), 4,28 (1Н, д, J=2,9 Гц), 4,11 (1Н, д, J=2,9 Гц), 4,30-4,03(2Н, м), 3,15 (2Н, шир. т, J=12,0 Гц), 1,95-1,74 (3Н, м), 1,51 (9Н, с), 1,58-1,50 (1H, м).
ИК-абсорбционный спектр  макс, см-1 (KBr): макс, см-1 (KBr):2949, 1679, 1424, 1365, 1244, 1168, 765. Масс-спектрометрический анализ (ЕI) м/е: 301 (M+ свободная форма). Элементный анализ (%, основанный на C18H23NO3) Вычислено: С 71,74, Н 7,69, N 4,65. Найдено: С 71,62, Н 7,67, N 4,59. ВЭЖХ-анализ Колонка: Chiral Cel AD (производство Daicel Chemical Industris, Ltd., внутренний диаметр 4,6 мм, длина 250 мм). Элюент: гексан:2-пропанол = 80:20. Скорость течения: 0,5 мл/мин. Температура: 40oС. Обнаружение: 210 нм. Время удерживания: 13,2 мин. [Ссылочный пример 12] N-трет-Бутоксикарбонил-спиро[((2R,3S)-гидрокси)индан-1,4′-пиперидин] В 5,0 мл 1,4-диоксана растворяют 125 мг (0,415 ммоль) N-трет-бутоксикарбонил-спиро[((2R, 3S)-эпокси)индан-1,4′-пиперидин] . К полученному раствору добавляют 151 мг (2,49 ммоль) формиата аммония и 10 мг 5% палладия-на-угле и перемешивают при 80oС 1 час. К реакционной смеси дополнительно добавляют 120 мг формиата аммония и 10 мг 5% палладия-на-угле и перемешивают 1 час. Затем реакционную смесь оставляют при комнатной температуре и отфильтровывают. Растворитель фильтрата упаривают под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (элюент; гексан:этилацетат = 3:1), получают 118 мг (выход: 94%) N-трет-бутоксикарбонилспиро[(2S) -гидрокси)индан-1,4′-пиперидин] в виде белых кристаллов. Все физические данные озаглавленного соединения совпадают с указанными для соединения Ссылочного примера 6. [Ссылочный пример 13] N-трет-Бутоксикарбонил-спиро[((2R, 3S)-эпокси)индан-1,4′-пиперидин] Используя 100 мг (0,35 ммоль) N-трет-бутоксикарбонил-спиро[1Н-инден-1,4′-пиперидина] и 11,4 мг (0,018 ммоль) (R,R) (-)-N,N’-бис(3,5-ди-трет-бутилсалицилиден)-1,2-циклогександиамино-марганца (III) аналогично способу, описанному в Ссылочном примере 11, получают 52,4 мг (выход: 50%, оптическая чистота 87% ее) N-трет-бутоксикарбонил-спиро[((2S, 3R)-эпокси)индан-1,4′-пиперидина] в виде белых кристаллов. Оптическую чистоту соединения определяют ВЭЖХ-анализом. Температура плавления, спектр ядерно-магнитного резонанса, ИК-абсорбционный спектр, масс-спектрометрический анализ целевого соединения совпадают с (2R, 3S)-формой того же соединения, полученного в Ссылочном примере 11. 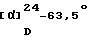 (с=0,50, метанол, 99% ее).
Элементный анализ (%, основанный на С18Н23NO3 (с=0,50, метанол, 99% ее).
Элементный анализ (%, основанный на С18Н23NO3 1/3Н2O) 1/3Н2O)Вычислено: С 70,33, Н 7,76, N 4,56. Найдено: С 72,22, Н 7,79, N 4,53. ВЭЖХ-анализ Колонка: Chiral Cel AD (производство Daicel Chemical Industris, Ltd., внутренний диаметр 4,6 мм, длина 250 мм). Элюент; гексан:2-пропанол = 80:20 Скорость течения: 0,5 мл/мин. Температура: 40oС. Обнаружение: 210 нм. Время удерживания: 10,9 мин. [Пример композиции] Фармацевтическая композиция, содержащая соединение (I) настоящего изобретения или сложный эфир или другое его производное в качестве активного ингредиента, получают следующим образом: [Пример композиции 1] Порошок Порошок получают смешиванием соединения Примера 1 (5 г), лактозы (893 г) и кукурузного крахмала в смесителе. [Пример композиции 2] Гранулы Получение гранул: к смеси соединения Примера 2 (5 г), лактозы (865 г) и малозамещенного гидроксипропилцеллюлозы (100 г) добавляют 300 г 10%-ного водного раствора гидроксипропилцеллюлозы, смешивают в общую массу эту смесь, гранулируют пластифицированную массу в экструзивном грануляторе с последующей сушкой гранулированного продукта. [Пример композиции 3] Капсулы Капсулы получают смешиванием соединения Примера 3 (5 г), лактозы (115 г), кукурузного крахмала (58 г) и стеарата магния (2 г) в V-образном смесителе с последующим наполнением полученной смесью порциями по 180 мг капсул 3. [Пример композиции 4] Таблетки Таблетки получают смешиванием соединения Примера 4 (5 г), лактозы (90 г), кукурузного крахмала (34 г), кристаллической целлюлозы (20 г) и стеарата магния (1 г) в смесителе и последующим таблетированием полученной смеси в таблетирующей машине. [Пример испытаний] [Пример испытаний 1] Анализ связывания NK1рецептора (а) Приготовление образцов неочищенных легочных мембран Образцы неочищенных легочных мембран готовят из легкого самца морской свинки Harty. А именно: умерщвляют обескровливанием из абдоминальной аорты под хлороформной анестезией с последующим немедленным иссечением легкого и ткани дыхательного тракта. После перфузии иссеченного легкого буфером (1) (50 мМ Трис-HCl, рН 7,4), легкое разрезают на тонкие ломтики и затем гомогенизируют в буфере (2) (буфер (1), содержащий 120 мМ хлорида натрия и 5 мМ хлорида калия) с помощью Polytron’a. Тканевую массу удаляют из гомогената, пропуская через нейлоновую сетку (50 нм), и отделяют центрифугированием (30000хg, 30 мин, 4oС). Осадок ресуспендируют при охлаждении льдом в буфере (3) (буфер (1), содержащий 10 мМ EDTA и 300 мМ хлористого калия) и оставляют спокойно стоять 60 мин при 4oС, полученную суспензию центрифугируют и промывают дважды (30000хg, 15 мин, 4oС). Неочищенные образцы мембраны хранят при -80oС до момента использования. (б) Анализ связывания рецептора 250 мкл раствора образца неочищенных мембран добавляют к 250 мкл смешанного раствора тестируемого лекарства и [3Н]-вещества Р (конечная концентрация: 1 нМ) (50 мМ Трис-HCl, рН 7,4, 6 мМ хлористого марганца, 800 мкг/мл BSA, 8 мкг/мл гемостатина, 8 мкг/мл леапептина, 80 мкг/мл бацитрацина и 20 мкг/мл фосфограмидона) и инкубируют 30 мин при комнатной температуре. После реакции компонент мембран выделяют на GF/B стеклянном фильтре (Whatman), используя автоматическую фильтрационную систему (Brandel). В данном случае стеклянный фильтр предварительно обрабатывают около 4 ч 0,1%-ным раствором полиэтилендиамина для сведения к минимуму неспецифического связывания. Фильтрат, содержащий компонент мембран, переносят в минипластиковую пробирку, содержащую 4 мл Picoflow и измеряют радиоактивность жидкостным сцинцилляционным счетчиком (Beckman, LCS3500). [Пример испытаний 2] Анализ связывания NK2рецептора (а) Приготовление образцов неочищенных мембран подвздошной кишки Неочищенные образцы мембран готовят из подвздошной кишки самца морской свинки Hartly. А именно: умерщвляют обескровливанием из абдоминальной аорты под хлороформной анестезией с последующим немедленным иссечением подвздошной кишки. Иссеченную подвздошную кишку отделяют от составляющих, секретов и эпителия соскабливанием предметным стеклом. Затем разрезают на тонкие фазы в буфере (1) (950 мМ Трис-HCl, рН 7,4) и гомогенизируют в буфере (2) (буфер (1), содержащий 120 мМ хлорида натрия и 5 мМ хлорида калия) с помощью Политрона. Тканевую массу удаляют из гомогената, пропуская через нейлоновую сетку (50 мкм) и отделяя центрифугированием (30000хg, 30 мин, 4oС). Осадок ресуспендируют при охлаждении льдом в буфере (3) (буфер (1), содержащий 10 мМ EDTA и 300 мМ хлористого калия) и оставляют спокойно стоять 60 мин при 4oС, полученную суспензию центрифугируют и промывают дважды (30000хg, 15 мин, 4oС). Неочищенные образцы мембран хранят при -80oС до момента использования. (б) Анализ связывания рецептора 250 мкл раствора неочищенного образца мембран добавляют к 250 мкл смешанного раствора тестируемого лекарства и [3Н]-SR-48968 (Amercham, конечная концентрация: 1 нМ) (50 мМ Трис-HCl, рН 7,4, 6 мМ хлористого марганца, 800 мкг/мл BSA, 8 мкг/мл гемостатина, 8 мкг/мл леапептина, 80 мкг/мл бацитрацина и 20 мкг/мл фосфорамидона) и инкубируют 30 минут при комнатной температуре. После реакции компонент мембран выделяют на GF/B стеклянном фильтре (Whatman), используя автоматическую фильтрационную систему. В данном случае стеклянный фильтр предварительно обрабатывают около 4 часов 0,1%-ным раствором полиэтилендиамина для сведения к минимуму неспецифического связывания. Фильтрат, содержащий компонент мембран, переносят в минипластиковую пробирку, содержащую 4 мл Picoflow, и измеряют радиоактивность жидкостным сцинтилляционным счетчиком (Beckman, LSC3500). [Эксперимент 3] Ингибирующий эффект на повышенную проницаемость сосудов. Ингибирующий эффект на повышенную проницаемость сосудов, индуцируемую антагонистом NK1 рецептора – веществом Р (SP), оценивают, основываясь на измерении количества просочившегося пигмента, полученного с использованием обычных морских свинок (самец морской свинки Hartley весом около 400 г). Повышенная проницаемость сосудов была вызвана последовательным введением пигмента (Evans blue: 20 мг/кг) морским свинкам, анестезированным пентобарбиталом (25 мг/кг, внутрибрюшинно), с последующим немедленным внутривенным введением SP (1 мкг/кг). Через 15 минут морских свинок умерщвляют при анестезии хлороформом и измеряют количество пигмента, просочившееся в основные области дыхательного тракта, методом Харада (J.Pharm. Pharmacol, 23, 218, (1971)). Тестируемое соединение суспендируют в 0,5%-ной суспензии трагаканта и полученную суспензию вводят перорально за 1 час до введения SP. Ингибирующий эффект установлен по количеству просочившегося пигмента в морских свинках, которым вводилось тестируемое соединение. [Пример испытаний 4] Ингибирующий эффект на сокращение дыхательного тракта. Ингибирующий эффект тестируемого лекарственного средства на сокращение дыхательного тракта, вызванное нейрокинином A (NKA), который является агонистом NK2 рецептора, оценивают, основываясь на внутреннем давлении дыхательного тракта обычных морских свинок (самцы морской свинки Hartley весом около 500 г) в соответствии с модифицированным способом Konzet-Roessler (Naunyn-Schmiedebergs Arch. Exp. Pathol. Pharmakol. 195, 71 (1940)). А именно: после имплантации канюли дыхательного тракта морским свинкам, анестезированным пентобарбиталом (30 мг/кг, внутрибрюшинно), и введения галламина (20 мг/кг, внутривенно) животных немедленно подвергают дыханию при положительном давлении 8 мл/кг и 60 циклов/минуту (Ugo-Basile, 7025). Внутреннее давление дыхательного тракта во время искусственного дыхания усиливали посредством преобразователя давления (Nippon Danco, 200T), введенного в канюлю бокового бронха дыхательного тракта, полученную (Nippon Denco, AP-601G), и регистрировали с помощью прибора (Nippon Denco WT-685G). Для снижения сокращения дыхательного тракта через 5 минут после предварительной обработки атропином (1 мг/кг, внутривенно) и пропанололом (1 мг/кг, внутривенно) вводят 4 мкг/кг NKA, внутривенно. Затем в течение 10 минут измеряют внутреннее давление дыхательного тракта. Тестируемое соединение готовят способом, аналогичным описанному в Примере испытаний 3, и вводят перорально за один час до индукции NKA. Ингибирующую активность определяют сравнением площади внутреннего давления дыхательного тракта группы животных, которой вводили тестируемое соединение, и контрольной группой. [Пример испытания 5] Анализ связывания NK3 рецептора. (а) Приготовление образцов неочищенных мембран мозга. Образцы неочищенных мембран мозга готовят из мозга самца морской свинки Hartley. Конкретно, животных умерщвляют обескровливанием из абдоминальной аорты под анестезией хлороформом. После перфузии буфером (1) (50 мМ Трис-HCl, рН 7,4) из правого желудочка немедленно энуклеируют мозг. Иссеченный мозг гомогенизируют буфером (2) (буфер (1), содержащий 120 мМ хлорида натрия и 5 мМ хлорида калия) с использованием Polytron’а. Тканевую массу удаляют из гомогената, пропуская через найлоновую сетку (50 мкм), и отделяют центрифугированием (30000хg, 30 мин, 4oС). Осадок (компонент мембран) ресуспендируют при охлаждении льдом в буфере (3) (буфер (1), содержащий 10 мМ EDTA и 300 мМ хлористого калия) и оставляют спокойно стоять 60 мин при 4oС, полученную суспензию центрифугируют и дважды промывают (30000хg, 15 мин, 4oС). Для приготовления неочищенного образца мембран компонент мембран суспендируют в буфере (1). Его хранят при -80oС до момента использования в анализе связывания рецептора. (б) Анализ связывания рецептора. Пробирку, используемую в реакции, предварительно обрабатывают буфером (1), содержащим 5 мг/кг бычьего сывороточного альбумина (BSA). К 100 мкл буфера (1), содержащего… [3H]-сенктида, 6 мМ хлорида марганца, 800 мкг/мл BSA, 8 мкг/мл гемостатина, 8 мкг/мл леапептина, 80 мкг/мл бацитрацина и 20 мкг/мл фосфорамидона, добавляют 150 мкг буфера (1), содержащего 400 мкг/мл BSA и тестируемое соединение. Для того чтобы начать реакцию, к полученной смеси добавляют 250 мкг/мл неочищенного образца мембран (концентрацию протеина доводят до 1 мг/мл) (в то же время конечная концентрация [3H]-сенктида в реакционной среде составляет 2,5 нМ). После инкубации при комнатной температуре в течение 60 мин компонент мембран выделяют на GF/B стеклянном фильтре (Whatman), используя автоматическую фильтрационную систему (Brandel), который предварительно обрабатывают 0,1%-ным раствором полиэтиленимина в течение более чем 4 часов, с последующим трехразовым промыванием 5 мл охлажденного льдом буфера (4) (5 мМ трис-хлористоводородная кислота, содержащего 400 мкг/мл BSA и 0,01% додецилсульфата натрия, рН 7,4). Фильтрат, содержащий компонент мембран, переносят в минипластиковую пробирку, содержащую 4 мл Picoflow и измеряют радиоактивность жидкостным сцинцилляционным счетчиком (Aloka, LCS 3500). Для того чтобы определить радиоактивность, обусловленную неспецифическим связыванием [3Н] -сенктида (связывание с сайтами, отличными от рецептора, например, фильтром), эксперимент проводят с избыточным количеством сенктида (конечная концентрация: 10 мкМ) и измеряют радиоактивность. Отношение ингибирования сенктид-рецепторного связывания, обусловленное тестируемым соединением, вычисляют с помощью следующего уравнения: Отношение ингибирования (%)=[1-(С-А)/(В-А)]  100 100А: радиоактивность, обусловленная неспецифическим связыванием В: радиоактивность в испытании без добавления тестируемого соединения С: радиоактивность в испытании с добавлением тестируемого соединения Соединения настоящего изобретения, проявляющие антагонизм против всех NK1, NK2 и НК3 рецепторов, по антагонистической активности превосходят Соединение А. Промышленная применимость. Так как производные спиропиперидина по данному изобретению проявляют превосходную антагонистическую активность в отношении NK1, NK2 и NК3 рецепторов, имеют более низкую токсичность и превосходную фармакокинетику, они могут найти применение в качестве лекарственного средства, особенно для профилактики или лечения астмы и/или бронхита, ринита, аллергии или недержания мочи. Формула изобретения
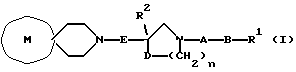 где R1 представляет фенильную группу, которая может быть необязательно замещена 1-3 заместителями, выбранными из атомов галогена, низших алкильных групп, определенных ниже, галоген- низших алкильных групп, определенных ниже, низших алкоксигрупп, определенных ниже, низших алкоксикарбонильных групп, включающих карбонильные группы, замещенные низшей алкоксигруппой, определенной ниже, гидроксильных групп, низших алифатических ациламиногрупп, включающих аминогруппы, замещенные низшей алифатической ацильной группой, определенной ниже, и цианогрупп, или 5- или 6-членную гетероциклическую группу, содержащую от 1 до 3 атомов кислорода, серы и/или азота, которая может быть необязательно конденсирована с фенильной группой; R2 представляет фенильную группу, которая замещена 1-3 атомами фтора или хлора; А представляет карбонильную группу; В представляет простую связь; D представляет атом кислорода или серы; Е представляет С1-4 алкиленовую группу;  где G представляет С5-8 циклоалкановое кольцо, которое замещено гидроксильной группой; Аr представляет фенильное кольцо; и n представляет целое число 1 или 2; или их фармакологически приемлемые соли; низшие алкильные группы, указанные выше, представляют прямые или разветвленные (С1-6) алкильные группы; галогеннизшие алкильные группы, указанные выше, представляют низшие алкильные группы, определенные выше, которые замещены 1 или более атомами галогена; низшие алкоксигруппы, указанные выше, представляют низшие алкильные группы, определенные выше, присоединенные к атому кислорода; низшая алифатическая ацильная часть низших алифатических ациламиногрупп, указанных выше, представляет С2-7 алифатическую ацильную группу. 2. Соединение по п. 1, где R1 представляет фенильную группу, необязательно замещенную 1-3 группами, выбранными из низших алкильных групп, галоген- низших алкильных групп и низших алкоксигрупп, как они определены в п. 1, или его фармакологически приемлемая соль. 3. Соединение по п. 1 или 2, где D представляет атом кислорода, или его фармакологически приемлемая соль. 4. Соединение по любому из пп. 1-3, где Е представляет С2-3 алкиленовую группу, или его фармакологически приемлемая соль. 5. Соединение по любому из пп. 1-4, где G представляет циклопентановое кольцо, замещенное гидроксильной группой, или его фармакологически приемлемая соль. 6. Соединение по любому из пп. 1-5, где n = 2, или его фармакологически приемлемая соль. 7. Соединение по п. 1, где R1 представляет фенильную группу, необязательно замещенную 1-3 группами, выбранными из низших алкильных групп, галоген- низших алкильных групп и низших алкоксигрупп, как они определены в п. 1; R2, А и В имеют значения, определенные в п. 1; D представляет атом кислорода; Е представляет С2-3 алкиленовую группу; 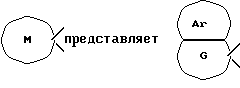 где G представляет циклопентановое кольцо, замещенное гидроксильной группой; и n = 2; или его фармакологически приемлемая соль. 8. Соединение по п. 1, выбранное из группы, включающей следующие соединения: 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил) морфолин-2-ил] этил} спиро [(2-гидрокси)индан-1,4′-пиперидин] , 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил) морфолин-2-ил] этил} спиро [(3-гидрокси)индан-1,4′-пиперидин] , 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,5-диметоксибензоил)морфолин-2-ил] этил} спиро [(2-гидрокси)индан-1,4′-пиперидин] , 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,5-диметоксибензоил)морфолин-2-ил] этил} спиро [(3-гидрокси)индан-1,4′-пиперидин] , или их фармакологически приемлемые соли. 9. Соединение по п. 1, выбранное из группы, включающей следующие соединения: 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил) морфолин-2-ил] этил} спиро [(2-гидрокси)индан-1,4′-пиперидин] , 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил) морфолин-2-ил] этил} спиро [(3-гидрокси)индан-1,4′-пиперидин] , или их фармакологически приемлемые соли. 10. Соединение по любому из пп. 1-9 или его фармакологически приемлемая соль в качестве активного ингредиента лекарственного средства для профилактики или лечения заболевания, которое лечится или предупреждается средствами, обладающими антагонистическим действием по отношению к NK1, NK2 и NK3 рецепторам. 11. Лекарственное средство, обладающее антагонистическим действием по отношению к NK1, NK2 и NK3 рецепторам, содержащее фармакологически эффективный ингредиент и эксципиент, отличающееся тем, что в качестве фармакологически эффективного ингредиента содержит соединение по любому из пп. 1-9 или его фармакологически приемлемую соль. 12. Способ профилактики или лечения заболевания, которое лечится или предупреждается средствами, обладающими антагонистическим действием по отношению к NK1, NK2 и NK3 рецепторам, включающий введение теплокровному животному эффективного количества профилактического или терапевтического средства, где указанное средство представляет соединение по любому из пп. 1-9 или его фармакологически приемлемую соль. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 23.01.2009
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
