Патент на изобретение №2184732
|
||||||||||||||||||||||||||
(54) 5,5-ДИЗАМЕЩЕННЫЕ-2-МЕТИЛ-9,9-ДИОКСО-9-ТИАБИЦИКЛО[4.3.0]НОНАНЫ
(57) Реферат: Изобретение относится к химии гетероциклических соединений серы и касается тиабициклических производных формулы I, обладающих антидепрессивной активностью, где R= H, Na, Me, CH2=CHCH2, CH2Ph или CH3CH2CH2CH2, X=CONH2; NH2  HCl; NHBoc; CH2NH2 или C(OEt)2NH2 HCl; NHBoc; CH2NH2 или C(OEt)2NH2 HCl. Соединения малотоксичны, обладают в ряде специфических тестов более выраженным и стабильным действием по сравнению с эталонными антидепрессантами, могут быть получены из доступного и недорогого сырья. 1 з.п. ф-лы, 3 табл. HCl. Соединения малотоксичны, обладают в ряде специфических тестов более выраженным и стабильным действием по сравнению с эталонными антидепрессантами, могут быть получены из доступного и недорогого сырья. 1 з.п. ф-лы, 3 табл.
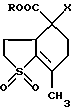
Изобретение относится к химии гетероциклических соединений серы и касается тиабициклических производных, обладающих фармакологической активностью. Современный блок психотропных препаратов, применяемых для лечения психически больных, включает широкий набор антидепрессантов, относящихся по структуре к различным химическим соединениям, с разным механизмом действия (избирательные и неизбирательные ингибиторы МАО, блокаторы “обратного захвата” нейромедиаторов и др.) со стимулирующим или седативным эффектом. Тем не менее ведется активный поиск новых соединений, обладающих антидепрессивной активностью, в том числе в ряду различных бициклический соединений. Аналогами по строению указанных соединений являются циклические сульфоны, обладающие высокой противовоспалительной активностью (тип II) [Патент США 5.147.893], а также противовоспалительной и противоязвенной активностью (III) [АС СССР 1018390, БИ 8, 1994]. Отмечается избирательность действия ряда сульфонов по отношению к ЦОГ1 и ЦОГ2 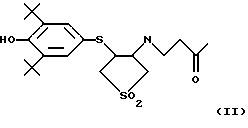 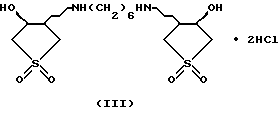 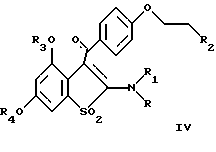 Известно производное тиенонафтохинона (V), отнесенное к группе нейролептиков [Толстикова Т.Г., Шульц Э.Э., Попов В.Г., Лазарева Д.Н., Давыдова В.А., Толстиков Г.А. Гидрированные производные нафто- и антрахинона – перспективные психотропные средства. Доклады АН СССР, 1991, т. 320, 1, с. 242-245] 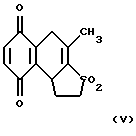 Наиболее распространены в медицинской практике Амитриптилин и Импрамин из группы трициклических антидепрессантов [Машковский М.Д. Лекарства XX века. М. : Новая волна. 1998. С. 112-114]. Они достаточно эффективны при лечении депрессивных состояний различной этиологии. Однако они обладают рядом побочных эффектов: головная боль, сонливость, тремор, сухость во рту, тахикардия. Большая часть осложнений (например, синусовая тахикардия, запоры, сухость во рту, нарушение аккомадации) связаны с холинолитическими свойствами трициклических антидепрессантов. Рост количества больных с депрессивными состояниями и появление высокорезистентных случаев заболеваний определяют актуальность поиска новых соединений, обладающих большей эффективностью и меньшей токсичностью. Задачей изобретения является получение новых соединений в ряду тиацикланов, обладающих фармакологической, в частности, антидепрессивной активностью и низкой токсичностью, расширение арсенала таких средств. Поставленная задача достигается 5,5-дизамещенным-2-метил-9,9-диоксо-9-тиабицикло  [4.3.0]нонанам, общей формулы (I) [4.3.0]нонанам, общей формулы (I)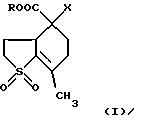 где R=Н, Na, Me, CH2=CHCH2, СН2Рh или СН3СН2СH2СH2 Х=CONH2; NH2  НСl; NHBoc; CH2NH2 или C(OEt)2NH2 НСl; NHBoc; CH2NH2 или C(OEt)2NH2 НСl; НСl;проявляющими фармакологическую активность, в частности, антидепрессивную. Предпочтительны соединения формулы (I), выбранные из следующих: Ia: R= H, Х=CONH2-5-аминокарбонил-5-карбокси-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонан; Ib: R=Me, X=CONH2-5-аминокарбонил-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонан; Ic: R= Н, Х= NH2HCl-5-амино-5-карбокси-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонан; Id: R= H, Х= NHBoc-5-амино-5-карбокси-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонан; Ie: R= Me, Х=NHBoc-5-ВОС-Амино-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонан; If: R=Me, X=CH2NH2-5-аминометил-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонан; Ig: R= Me, X= C(OEt)2NH2HCl-5-диметиламинометил-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонан; Ih: R= Na, X=CONH2-5-аминокарбонил-5-карбокси-2-метил-9,9-диоксо-9-тиабицикло [4.3.0]нонан; Ii: R= CH2=CHCH2, X=CONH2-5-аминокарбонил-5-карбоксиаллил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонан; Ij: R= CH2Ph, X=CONH2-5-аминокарбонил-5-карбоксибензил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонан; Ik_R=CH3CH2CH2CH2,X=CONH2-5-аминокарбонил-5-карбоксибутил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонан. Изобретение иллюстрируется следующими примерами. 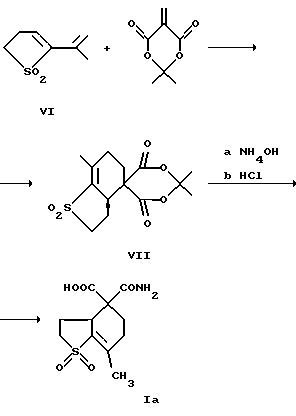 Выход продукта (I) составляет 78%. Эфир (Ib) получали с количественным выходом при обработке диазометаном в эфирном растворе. Перегруппировка Гофмана соединения (Iа) в обычных условиях приводит к амину Iс, выделенному в виде гидрохлорида с выходом 79%. Амины (Iс), а также продукт гофмановской перегруппировки эфира (Ib) без выделения переводили в бутоксикарбонильные производные (Id,e) с выходом 85-87%. При обработке (Iа) избытком бромистого аллила в присутствии четвертичной аммонийной соли (C4H9)3N+Br и 5% водного раствора едкого натра в смеси ДМСО-ацетон при комнатной температуре получали аллиловый эфир (Ii) с выходом 75%. Обработкой (Iа) действием избытка хлористого бензила или бромистого бутила в среде диметилсульфоксида в присутствии порошка гидроокиси калия получали соответствующие бензиловый или бутиловый эфиры (Ij, Ik) с выходом 76 или 79% соответственно. Пример 1. Синтез 5-аминокарбонил-5-карбокси-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонана (Iа). К раствору 1,44 г (0,015 молей) кислоты Мельдрума в 20 мл ацетонитрила добавили 0,01 г пролина и 2 мл 40%-ного раствора формалина. Смесь перемешивали 5 мин, затем порциями в течение 20 мин добавили 1,58 г (0,01 моля) 2-изопропенил-2-тиолен-1,1-диоксида (VI). Реакционную массу перемешивали 2 ч при комнатной температуре, затем выливали в ледяную воду (20 мл). Образовавшийся осадок отфильтровывали, промывали водой, высушивали на воздухе. Получили 2,92 г (93%) 1,1′,4,6-тетраоксо-2,2,7′-триметил-2′,3′,3а’,4′,5′,6′-гексагидроспиро[1,3-диоксан-4,4′-бензотиофена] (VII). Т. пл. 193-195oС (из воды). ИК-спектр, см-1: 1090, 1140, 1300, 1330 (SO2), 1720, 1765 (С=О). Спектр ПМР [CDCl3,  , м.д, J, , м.д, J, 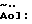 1.70 с (3Н, СН3), 1.73 с (3Н, СН3), 1.81 м (1Н, Н5′, Jгем15.8), 2.12 д (3Н, СН3 при С7′, J 2.0), 2.16 м (1Н, H6′), 2.21 д. д.д (1Н, Н3′, J 12,5, 6.8 и 3.5), 2.34 м (2Н, Н2 ‘,6’), 2.42 д.д (1Н, Н3a’, J 4.2 и 6.8), 2.92 д.д.д (1H, H5′, J 15.8, 4.6 и 3.8), 3.15 д.д (1Н, H3′, J 14.0 и 5.5), 3.51 м (1H, Н2′, Jгем16.8). Спектр ЯМР 13С (CDCl3, 1.70 с (3Н, СН3), 1.73 с (3Н, СН3), 1.81 м (1Н, Н5′, Jгем15.8), 2.12 д (3Н, СН3 при С7′, J 2.0), 2.16 м (1Н, H6′), 2.21 д. д.д (1Н, Н3′, J 12,5, 6.8 и 3.5), 2.34 м (2Н, Н2 ‘,6’), 2.42 д.д (1Н, Н3a’, J 4.2 и 6.8), 2.92 д.д.д (1H, H5′, J 15.8, 4.6 и 3.8), 3.15 д.д (1Н, H3′, J 14.0 и 5.5), 3.51 м (1H, Н2′, Jгем16.8). Спектр ЯМР 13С (CDCl3,  C, м.д.): 17.85 к (СН3 при С-7′), 22.16 т (С-3′), 28.84 к, 29.14 к (СН3 при С-4), 29.80 т (С-5′), 30.94 т (С-6′), 42.96 д (С-3а’), 50.18 т (С-2′), 50.67 с (С-4′), 105.27 с (С-4), 130.92 с (С-1а’), 140.83 с (С-7′), 164.15 с, 169.22 с (С= О). Найдено, %: С 54.0; Н 5.9; S 10.0. C14H12O6S. Вычислено, %: С 53.5; Н 5.8; S 10.2.
б) К перемешиваемому раствору 3.08 г (0.01 моля) соединения (VII) в 200 мл тетрагидрофурана добавили по каплям при 20oС 70 мл раствора гидроксида аммония. Реакционную массу выдерживали при комнатной температуре в течение 3 ч, растворитель отгоняли в вакууме (температура не выше 40oС), остаток подкисляли соляной кислотой (1: 1) до рН ~2, образовавшийся осадок перекристаллизовали из водного метанола (1:1). Получили 2.13 г (78%) соединения (I). Т. пл. 135-138oС. ИК-спектр, см-1: 920, 990, 1100, 1140, 1260, 1320, 1520, 1580, 1640, 1680, 1710, 1740, 1280, 3320. Спектр ПМР [СD3OD, C, м.д.): 17.85 к (СН3 при С-7′), 22.16 т (С-3′), 28.84 к, 29.14 к (СН3 при С-4), 29.80 т (С-5′), 30.94 т (С-6′), 42.96 д (С-3а’), 50.18 т (С-2′), 50.67 с (С-4′), 105.27 с (С-4), 130.92 с (С-1а’), 140.83 с (С-7′), 164.15 с, 169.22 с (С= О). Найдено, %: С 54.0; Н 5.9; S 10.0. C14H12O6S. Вычислено, %: С 53.5; Н 5.8; S 10.2.
б) К перемешиваемому раствору 3.08 г (0.01 моля) соединения (VII) в 200 мл тетрагидрофурана добавили по каплям при 20oС 70 мл раствора гидроксида аммония. Реакционную массу выдерживали при комнатной температуре в течение 3 ч, растворитель отгоняли в вакууме (температура не выше 40oС), остаток подкисляли соляной кислотой (1: 1) до рН ~2, образовавшийся осадок перекристаллизовали из водного метанола (1:1). Получили 2.13 г (78%) соединения (I). Т. пл. 135-138oС. ИК-спектр, см-1: 920, 990, 1100, 1140, 1260, 1320, 1520, 1580, 1640, 1680, 1710, 1740, 1280, 3320. Спектр ПМР [СD3OD,  , м.д, J, , м.д, J,  2.17 д (3Н, CH3 при С2, J 2.0), 2.18 м (1Н, Н3), 2.27 д.д.д (1Н, Н7, J 12,5, 6.8 и 3.5), 2.34 м (2Н, H4,8), 2.58 д.д (1Н, H6, J 5.5 и 3.8), 3.02 д. д. д (1H, Н4, J 14.6, 5.2 и 3.5), 3.15 д.д.д (1Н, H7, J 14.2, 5.6 и 3.5), 3.51 м (1Н, Н8, Jгем16.8). Найдено, %: С 48.5; Н 5.7; N 5.5; S 11.8. C11H15NO5S. Вычислено, %: С 48.4; Н 5.5; N 5.1; S 11.7.
Пример 2. Синтез 5-аминокарбонил-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ib). К раствору 1.36 г (5 ммоль) соединения (Iа) в 200 мл эфира добавили 15 мл эфирного раствора диазометана (из 10 ммоль нитрозометилмочевины по методике [Кост A.Н.,Общий практикум по органической химии, М. , Мир, 1965, с. 532]) до появления устойчивой желтой окраски. Оставили па ночь при комнатной температуре. Растворитель упарили, остаток растворили в этилацетате, по охлаждении отфильтровали 1.38 г (97%) метилового эфира (Ib). Т. пл. 108-110oС. ИК-спектр, см-1: 920, 995, 1110, 1140, 1260, 1300, 1322, 1600, 1640, 1710, 1730. Спектр ПМР [CDCl3, 2.17 д (3Н, CH3 при С2, J 2.0), 2.18 м (1Н, Н3), 2.27 д.д.д (1Н, Н7, J 12,5, 6.8 и 3.5), 2.34 м (2Н, H4,8), 2.58 д.д (1Н, H6, J 5.5 и 3.8), 3.02 д. д. д (1H, Н4, J 14.6, 5.2 и 3.5), 3.15 д.д.д (1Н, H7, J 14.2, 5.6 и 3.5), 3.51 м (1Н, Н8, Jгем16.8). Найдено, %: С 48.5; Н 5.7; N 5.5; S 11.8. C11H15NO5S. Вычислено, %: С 48.4; Н 5.5; N 5.1; S 11.7.
Пример 2. Синтез 5-аминокарбонил-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ib). К раствору 1.36 г (5 ммоль) соединения (Iа) в 200 мл эфира добавили 15 мл эфирного раствора диазометана (из 10 ммоль нитрозометилмочевины по методике [Кост A.Н.,Общий практикум по органической химии, М. , Мир, 1965, с. 532]) до появления устойчивой желтой окраски. Оставили па ночь при комнатной температуре. Растворитель упарили, остаток растворили в этилацетате, по охлаждении отфильтровали 1.38 г (97%) метилового эфира (Ib). Т. пл. 108-110oС. ИК-спектр, см-1: 920, 995, 1110, 1140, 1260, 1300, 1322, 1600, 1640, 1710, 1730. Спектр ПМР [CDCl3,  , м.д, J, Гц]: 2.20 д (3Н, СН3 при С2, J 2.0), 2.28 м (1H, H3), 2.36 д.д.д (1H, H7, J 12,5, 6.8 и 3.5), 2.50 м (3Н, Н4,6,8), 3.08 м (2Н, Н3,4), 3.18 д.д.д (1Н, Н7, J 12.5, 5.6 и 3.5), 3.51 м (1Н, Н8, Jгeмl6.8), 3.62 с (ОСН3), 7.38 с (2Н, NH2). Найдено, %: С 50.5; Н 5.7; N 5.0; S 11.1. C12H17NO5S. Вычислено, %: С 50.2; Н 5.9; N 4.9; S 11,2.
Пример 3. Синтез гидрохлорида 5-амино-5-карбокси-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонана (Iс). К раствору, состоящему из 6 мл 10%-ного NaOH и 10 ммоль 3.5 М раствора гипохлорита натрия, при 0-3oС порциями добавили 1.36 г (5 ммоль) соединения (Iа). Перемешивание продолжали до исчезновения исходного амида (контроль по ТСХ). Реакционную массу нейтрализовали, продукт извлекли хлороформом, растворитель выпарили, остаток растворили в 5 мл эфира и обработали 1 М раствором хлористого водорода в метаноле (до рН 2). Через 30 мин отфильтровали 1.03 г (73%) гидрохлорида аминокислоты (Iс). Т. пл. 88-94oС. ИК-спектр, см-1: 920, 995, 1120, 1310, 1710, 1730, 3355. Спектр ПМР [СD3ОD, , м.д, J, Гц]: 2.20 д (3Н, СН3 при С2, J 2.0), 2.28 м (1H, H3), 2.36 д.д.д (1H, H7, J 12,5, 6.8 и 3.5), 2.50 м (3Н, Н4,6,8), 3.08 м (2Н, Н3,4), 3.18 д.д.д (1Н, Н7, J 12.5, 5.6 и 3.5), 3.51 м (1Н, Н8, Jгeмl6.8), 3.62 с (ОСН3), 7.38 с (2Н, NH2). Найдено, %: С 50.5; Н 5.7; N 5.0; S 11.1. C12H17NO5S. Вычислено, %: С 50.2; Н 5.9; N 4.9; S 11,2.
Пример 3. Синтез гидрохлорида 5-амино-5-карбокси-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонана (Iс). К раствору, состоящему из 6 мл 10%-ного NaOH и 10 ммоль 3.5 М раствора гипохлорита натрия, при 0-3oС порциями добавили 1.36 г (5 ммоль) соединения (Iа). Перемешивание продолжали до исчезновения исходного амида (контроль по ТСХ). Реакционную массу нейтрализовали, продукт извлекли хлороформом, растворитель выпарили, остаток растворили в 5 мл эфира и обработали 1 М раствором хлористого водорода в метаноле (до рН 2). Через 30 мин отфильтровали 1.03 г (73%) гидрохлорида аминокислоты (Iс). Т. пл. 88-94oС. ИК-спектр, см-1: 920, 995, 1120, 1310, 1710, 1730, 3355. Спектр ПМР [СD3ОD,  , м. д, J, Гц]: 2.16 д (3Н, СН3 при С2, J 2.0), 2.20 м (1Н, H3), 2.32 д.д.д (1Н, Н7, J 12,5, 6.8 и 3.5), 2.48 м (3Н, Н4,6,8), 3.08 д.д.д (1Н, Н4, J 14.6, 5.2 и 3.5), 3.28 м (2Н, Н3,7), 3.51 м (3Н, Н8, Jгем16.8 и 2Н, NH2). Найдено, %: С 42.5; Н 5.7; Сl 12.2; N 5.0; S 11.2. C10H16NClO4S. Вычислено, %: С 42.3; Н 5.7; Cl 12.6; N 5.0; S 11.4.
Пример 4. Синтез 5-амино-5-карбокси-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонан a (Id). К раствору, состоящему из 6 мл 10%-ного NaOH и 10 ммоль 3.5 М гипохлорита натрия, при 0-3oС порциями добавили 1.36 г (5 ммоль) соединения (Iа). Перемешивание продолжали до исчезновения исходного амида (по ТСХ). К реакционной массе постепенно прибавляли 0.01 моля ди-трет-бутилдикарбоната в 5 мл пропанола и перемешивали 15 ч при комнатной температуре. Реакционную смесь упарили на половину объема, остаток экстрагировали петролейным эфиром. Водный слой охлаждали до 0oС, подкисляли 2 N соляной кислотой до рН 2. Продукт экстрагировали из кислого раствора этилацетатом, сушили сульфатом магния, отгоняли растворитель и остаток растирали с петролейным эфиром. Осадок перекристаллизовывали из диэтилового эфира. Получили 1.53 г (85%) соединения (Id). Т. пл. 118-120oС. ИК-спектр, см-1: 720, 1000, 1120, 1260, 1300, 1325, 1600, 1659, 1710, 1730. Спектр ПМР [СD3ОD, , м. д, J, Гц]: 2.16 д (3Н, СН3 при С2, J 2.0), 2.20 м (1Н, H3), 2.32 д.д.д (1Н, Н7, J 12,5, 6.8 и 3.5), 2.48 м (3Н, Н4,6,8), 3.08 д.д.д (1Н, Н4, J 14.6, 5.2 и 3.5), 3.28 м (2Н, Н3,7), 3.51 м (3Н, Н8, Jгем16.8 и 2Н, NH2). Найдено, %: С 42.5; Н 5.7; Сl 12.2; N 5.0; S 11.2. C10H16NClO4S. Вычислено, %: С 42.3; Н 5.7; Cl 12.6; N 5.0; S 11.4.
Пример 4. Синтез 5-амино-5-карбокси-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонан a (Id). К раствору, состоящему из 6 мл 10%-ного NaOH и 10 ммоль 3.5 М гипохлорита натрия, при 0-3oС порциями добавили 1.36 г (5 ммоль) соединения (Iа). Перемешивание продолжали до исчезновения исходного амида (по ТСХ). К реакционной массе постепенно прибавляли 0.01 моля ди-трет-бутилдикарбоната в 5 мл пропанола и перемешивали 15 ч при комнатной температуре. Реакционную смесь упарили на половину объема, остаток экстрагировали петролейным эфиром. Водный слой охлаждали до 0oС, подкисляли 2 N соляной кислотой до рН 2. Продукт экстрагировали из кислого раствора этилацетатом, сушили сульфатом магния, отгоняли растворитель и остаток растирали с петролейным эфиром. Осадок перекристаллизовывали из диэтилового эфира. Получили 1.53 г (85%) соединения (Id). Т. пл. 118-120oС. ИК-спектр, см-1: 720, 1000, 1120, 1260, 1300, 1325, 1600, 1659, 1710, 1730. Спектр ПМР [СD3ОD,  , м.д, J, Гц]: 1,40 с (9Н, 3-СН3), 2.16 д (3Н, СН3 при С2, J 2.0), 2.18 м (1Н, Н3), 2.26 д. д. д (1Н, H7, J 12,5, 6.8 и 3.5), 2.50 м (3Н, Н4,6,8), 3.07 д.д.д (1Н, Н4, J 14.5, 5.0 и 3.2), 3.12 м (1H, H3), 3.29 д.д.д (1Н, Н7, J 13.2, 5.6 и 3.1), 3.51 м (1H, H8, Jгем16.5), 5.25 м (2Н, NH, ОН). Найдено, %: С 54.5; Н 6.4; N 4.0; S 8.6. С15H23NO7S. Вычислено, %: С 54.2; Н 6.4; N 3.9; S 8.9.
Пример 5. Синтез 5-ВОС-Амино-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонана (Iе). К раствору, состоящему из 6 мл 10%-ного NaOH и 10 моля 3.5 М гипохлорита натрия, при 0-3oС порциями добавили 1.39 г (5 ммоль) соединения (Ib). Перемешивание продолжали до исчезновения исходного амида (по ТСХ). К реакционной массе постепенно прибавляли 10 ммоль ди-трет-бутилдикарбоната в 5 мл пропанола и перемешивали 15 ч при комнатной температуре. Реакционную смесь упарили на половину объема, остаток экстрагировали петролейным эфиром. Водный слой охлаждали до 0oС, подкисляли 2 N соляной кислотой до рН 2. Продукт экстрагировали из кислого раствора этилацетатом, сушили сульфатом магния, отгоняли растворитель и остаток растирали с петролейным эфиром, аморфный осадок отфильтровали и перекристаллизовывали из диэтилового эфира. Получили 1.59 г (87%) соединения (Iе). Т. пл. 99-102oС. ИК-спектр, см-1: 1015, 1085, 1120, 1280, 1305, 1355, 1635, 1665, 1715, 3330. Спектр ПМР [CDCl3, , м.д, J, Гц]: 1,40 с (9Н, 3-СН3), 2.16 д (3Н, СН3 при С2, J 2.0), 2.18 м (1Н, Н3), 2.26 д. д. д (1Н, H7, J 12,5, 6.8 и 3.5), 2.50 м (3Н, Н4,6,8), 3.07 д.д.д (1Н, Н4, J 14.5, 5.0 и 3.2), 3.12 м (1H, H3), 3.29 д.д.д (1Н, Н7, J 13.2, 5.6 и 3.1), 3.51 м (1H, H8, Jгем16.5), 5.25 м (2Н, NH, ОН). Найдено, %: С 54.5; Н 6.4; N 4.0; S 8.6. С15H23NO7S. Вычислено, %: С 54.2; Н 6.4; N 3.9; S 8.9.
Пример 5. Синтез 5-ВОС-Амино-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонана (Iе). К раствору, состоящему из 6 мл 10%-ного NaOH и 10 моля 3.5 М гипохлорита натрия, при 0-3oС порциями добавили 1.39 г (5 ммоль) соединения (Ib). Перемешивание продолжали до исчезновения исходного амида (по ТСХ). К реакционной массе постепенно прибавляли 10 ммоль ди-трет-бутилдикарбоната в 5 мл пропанола и перемешивали 15 ч при комнатной температуре. Реакционную смесь упарили на половину объема, остаток экстрагировали петролейным эфиром. Водный слой охлаждали до 0oС, подкисляли 2 N соляной кислотой до рН 2. Продукт экстрагировали из кислого раствора этилацетатом, сушили сульфатом магния, отгоняли растворитель и остаток растирали с петролейным эфиром, аморфный осадок отфильтровали и перекристаллизовывали из диэтилового эфира. Получили 1.59 г (87%) соединения (Iе). Т. пл. 99-102oС. ИК-спектр, см-1: 1015, 1085, 1120, 1280, 1305, 1355, 1635, 1665, 1715, 3330. Спектр ПМР [CDCl3,  , м.д, J, Гц]: 1.48 с (9Н, 3-СН3), 2.16 д (3Н, СН3 при С2, J 2.0), 2.18 м (1Н, Н3), 2.26 д.д.д (1H, Н7, J 12,5, 6.8 и 3.5), 2.40 м (2Н, Н4,8), 2.58 д.д (1Н, H6, J 5.5 и 3.8), 3.02 д.д.д (1H, Н4, J 14.6, 5.2 и 3.5), 3.18 м (2Н, Н3,7), 3.51 м (1H, Н8, Jгем16.8) 3.62 с (ОСН3), 6.38 уш. с (1Н, NH), 10.42 с (ОН). Найдено, %: С 51.5; H 6.4; N 4.0; S 8.7. C16H25NO7S. Вычислено, %: С 51.2; Н 6.7; N 3.7; S 8.8.
Пример 6. Синтез 5-аминометил-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонана (If). К суспензии 0.28 г (8 ммоль) алюмогидрида лития в 10 мл безводного тетрагидрофурана при перемешивании в атмосфере аргона медленно прикапывали раствор 1.39 г (5 ммоль) соединения (Ib) в 10 мл тетрагидрофурана и затем кипятили 2 ч с обратным холодильником. По охлаждении прикапывали 0.5 мл воды, затем 0.8 мл 10% водного КОН (для разложения избытка алюмогидрида лития). Выпавший гидроксид алюминия отфильтровывали, дважды кипятили по 30 мин с 20 мл тетрагидрофурана, объединенный фильтрат промывали насыщенным раствором хлористого натрия, водой и высушивали над сульфатом натрия. Растворитель упаривали, остаток (1.3 г) растворяли в 50 мл хлороформа и перкалировали через 5 г окиси алюминия (по Брокману II степени). Растворитель упаривали, остаток растворили в эфире. По охлаждении отфильтровали 1.08 г (78%) соединения (If). Т. пл. 68-72oС. ИК-спектр, см-1: 950, 1110, 1120, 1305, 1620, 1720, 3360. Спектр ПМР [CDC13, , м.д, J, Гц]: 1.48 с (9Н, 3-СН3), 2.16 д (3Н, СН3 при С2, J 2.0), 2.18 м (1Н, Н3), 2.26 д.д.д (1H, Н7, J 12,5, 6.8 и 3.5), 2.40 м (2Н, Н4,8), 2.58 д.д (1Н, H6, J 5.5 и 3.8), 3.02 д.д.д (1H, Н4, J 14.6, 5.2 и 3.5), 3.18 м (2Н, Н3,7), 3.51 м (1H, Н8, Jгем16.8) 3.62 с (ОСН3), 6.38 уш. с (1Н, NH), 10.42 с (ОН). Найдено, %: С 51.5; H 6.4; N 4.0; S 8.7. C16H25NO7S. Вычислено, %: С 51.2; Н 6.7; N 3.7; S 8.8.
Пример 6. Синтез 5-аминометил-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0]нонана (If). К суспензии 0.28 г (8 ммоль) алюмогидрида лития в 10 мл безводного тетрагидрофурана при перемешивании в атмосфере аргона медленно прикапывали раствор 1.39 г (5 ммоль) соединения (Ib) в 10 мл тетрагидрофурана и затем кипятили 2 ч с обратным холодильником. По охлаждении прикапывали 0.5 мл воды, затем 0.8 мл 10% водного КОН (для разложения избытка алюмогидрида лития). Выпавший гидроксид алюминия отфильтровывали, дважды кипятили по 30 мин с 20 мл тетрагидрофурана, объединенный фильтрат промывали насыщенным раствором хлористого натрия, водой и высушивали над сульфатом натрия. Растворитель упаривали, остаток (1.3 г) растворяли в 50 мл хлороформа и перкалировали через 5 г окиси алюминия (по Брокману II степени). Растворитель упаривали, остаток растворили в эфире. По охлаждении отфильтровали 1.08 г (78%) соединения (If). Т. пл. 68-72oС. ИК-спектр, см-1: 950, 1110, 1120, 1305, 1620, 1720, 3360. Спектр ПМР [CDC13,  , м.д, J, Гц]: 2.20 д (3Н, СН3 при С2, J 2.0), 2.28 м (2Н, H3,7), 2.40 м (2Н, Н4,8), 2.58 д.д (1Н, Н6, J 5.5 и 3.8), 3.02 д.д.д (1H, H4, J 14.6, 5.2 и 3.5), 3.48 м (4Н, Н3,7 и NH2), 3.51 м (1Н, Н8, Jгем16.8), 3.62 с (3H, ОСH3), 3.72 с (2Н, СН2). Найдено, %: С 52.5; Н 6.8; N 5.0; S 11.7. C12H19NO4S. Вычислено, %: С 52.8; Н 7.0; N 5.1; S 11.7.
Пример 7. Синтез гидрохлорида 5-диметиламинометил-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ig). Смешивали при охлаждении (5-10oС) 1.38 г (5 ммоль) соединения (If), 2.3 g (5 ммоль) муравьиной кислоты и 2.2 мл 30%-ного раствора формальдегида (2.2 ммоль), смесь кипятили 5 ч, затем прибавили 1.5 мл концентрированной соляной кислоты (разогрев), выпарили досуха в вакууме, остаток растирали в 20 мл эфира. Образовавшийся осадок отфильтровали, промыли этилацетатом, получили 1.38 г (81%) соединения Ig. Т. пл. 108-111oС. ИК-спектр, см-1: 950, 1105, 1040, 1100, 1300, 1420, 1600, 1720, 1320. Спектр ПМР [(CD3)2SO, , м.д, J, Гц]: 2.20 д (3Н, СН3 при С2, J 2.0), 2.28 м (2Н, H3,7), 2.40 м (2Н, Н4,8), 2.58 д.д (1Н, Н6, J 5.5 и 3.8), 3.02 д.д.д (1H, H4, J 14.6, 5.2 и 3.5), 3.48 м (4Н, Н3,7 и NH2), 3.51 м (1Н, Н8, Jгем16.8), 3.62 с (3H, ОСH3), 3.72 с (2Н, СН2). Найдено, %: С 52.5; Н 6.8; N 5.0; S 11.7. C12H19NO4S. Вычислено, %: С 52.8; Н 7.0; N 5.1; S 11.7.
Пример 7. Синтез гидрохлорида 5-диметиламинометил-5-метоксикарбонил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ig). Смешивали при охлаждении (5-10oС) 1.38 г (5 ммоль) соединения (If), 2.3 g (5 ммоль) муравьиной кислоты и 2.2 мл 30%-ного раствора формальдегида (2.2 ммоль), смесь кипятили 5 ч, затем прибавили 1.5 мл концентрированной соляной кислоты (разогрев), выпарили досуха в вакууме, остаток растирали в 20 мл эфира. Образовавшийся осадок отфильтровали, промыли этилацетатом, получили 1.38 г (81%) соединения Ig. Т. пл. 108-111oС. ИК-спектр, см-1: 950, 1105, 1040, 1100, 1300, 1420, 1600, 1720, 1320. Спектр ПМР [(CD3)2SO,  , м.д, J, Гц]: 2.18 д (3Н, СН3 при С2, J 2.0), 2.18 м (1H, Н3), 2.26 д.д.д (1Н, Н7, J 12,5, 6.8 и 3.5). 2.35 с (6Н, 2-СН3), 2.59 м (4H, H3,4,6,8), 3.12 д.д.д (1H, Н4, J 14.6, 5.2 и 3.5), 3.23 д. д.д (1H, H7, J 14.2, 5.6 и 3.5), 3.30 м (1Н, Н8, Jгем16.8), 3.65 с (ОСН3) 5.24 у.с. (NH2). Найдено, %: С 49.5; Н 7.1; Сl 10.6; N 4.2, S 9.7. С14H24NClO4S. Вычислено, %: С 49.7; H 7.1; Сl 10.8; N 4.1; S 9.5.
Пример 8. Получение натриевой соли 5-аминокарбонил-5-карбокси-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ih). а) К раствору 0.27 г (1.0 ммоль) соединения (Iа) в 10 мл ацетона (о.с.ч) прибавили раствор 0.16 г (1.5 ммоль) в 3 мл воды (рН 7.5). Желтый осадок соли отфильтровали, промыли ацетоном, спиртом до нейтральной реакции и высушили сначала на воздухе, а затем в вакууме при 50oС. Получили 0.23 г (75%) порошка соединения (Ih). Т.пл. 55-60oС. ИК-спектр, см-1: 720, 1005, 1110, 1300, 1660, 1640, 1750. Найдено, %: С 42.9; H 4.8; N 4.8; S 10.5; Na 7.8. C11H14NO5SNa. Вычислено, %: С 43.3; Н 4.6; N 4.6; S 10.5; Na 7.5.
Пример 9. Синтез 5-аминокарбонил-5-карбоксиаллил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ii). К раствору 0.82 г (3 ммоль) соединения (Ia) в 60 мл хлористого метилена прибавили 22 мл 24% водного раствора NaOH, 0.05 г тетрабутиламмония бромистого и 0.5 мл (5 ммоль) бромистого аллила. Через 10 мин прибавили 20 мл ацетона и 25 мл этанола. Смесь перемешивали при комнатной температуре 24 ч. разбавили 50 мл воды и экстрагировали хлористым метиленом, органическую фазу последовательно промыли водой, 5%-ным раствором соляной кислоты, водой, сушили сульфатом магния, растворитель выпаривали в вакууме. Получили 0.9 г сырого продукта, который растирали в аморфный порошок в ацетоне с гексаном. Выделили 0.73 г (75%) соединения (Ii). Т.пл. 136-138oС. ИК-спектр, см-1: 750, 825, 1050, 1120, 1310, 1320, 1610, 1660, 1720. Спектр ПМР [CD3OD, , м.д, J, Гц]: 2.18 д (3Н, СН3 при С2, J 2.0), 2.18 м (1H, Н3), 2.26 д.д.д (1Н, Н7, J 12,5, 6.8 и 3.5). 2.35 с (6Н, 2-СН3), 2.59 м (4H, H3,4,6,8), 3.12 д.д.д (1H, Н4, J 14.6, 5.2 и 3.5), 3.23 д. д.д (1H, H7, J 14.2, 5.6 и 3.5), 3.30 м (1Н, Н8, Jгем16.8), 3.65 с (ОСН3) 5.24 у.с. (NH2). Найдено, %: С 49.5; Н 7.1; Сl 10.6; N 4.2, S 9.7. С14H24NClO4S. Вычислено, %: С 49.7; H 7.1; Сl 10.8; N 4.1; S 9.5.
Пример 8. Получение натриевой соли 5-аминокарбонил-5-карбокси-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ih). а) К раствору 0.27 г (1.0 ммоль) соединения (Iа) в 10 мл ацетона (о.с.ч) прибавили раствор 0.16 г (1.5 ммоль) в 3 мл воды (рН 7.5). Желтый осадок соли отфильтровали, промыли ацетоном, спиртом до нейтральной реакции и высушили сначала на воздухе, а затем в вакууме при 50oС. Получили 0.23 г (75%) порошка соединения (Ih). Т.пл. 55-60oС. ИК-спектр, см-1: 720, 1005, 1110, 1300, 1660, 1640, 1750. Найдено, %: С 42.9; H 4.8; N 4.8; S 10.5; Na 7.8. C11H14NO5SNa. Вычислено, %: С 43.3; Н 4.6; N 4.6; S 10.5; Na 7.5.
Пример 9. Синтез 5-аминокарбонил-5-карбоксиаллил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ii). К раствору 0.82 г (3 ммоль) соединения (Ia) в 60 мл хлористого метилена прибавили 22 мл 24% водного раствора NaOH, 0.05 г тетрабутиламмония бромистого и 0.5 мл (5 ммоль) бромистого аллила. Через 10 мин прибавили 20 мл ацетона и 25 мл этанола. Смесь перемешивали при комнатной температуре 24 ч. разбавили 50 мл воды и экстрагировали хлористым метиленом, органическую фазу последовательно промыли водой, 5%-ным раствором соляной кислоты, водой, сушили сульфатом магния, растворитель выпаривали в вакууме. Получили 0.9 г сырого продукта, который растирали в аморфный порошок в ацетоне с гексаном. Выделили 0.73 г (75%) соединения (Ii). Т.пл. 136-138oС. ИК-спектр, см-1: 750, 825, 1050, 1120, 1310, 1320, 1610, 1660, 1720. Спектр ПМР [CD3OD,  , м.д, J, Гц]: 2.12 д (3Н, СН3 при С2, J 2.0). 2.20 м (1Н, Н3), 2.28 д. д.д (1H, Н7, J 12,5, 6.8 и 3.5), 2.40 м (2Н, Н4,8 и 2Н, СН2), 2.52 д. д (1Н, Н6, J 5.5 и 3.8), 3.12 д.д.д (1Н, Н4, J 14.6, 5.2 и 3.5), 3.26 м (2Н, Н3,7), 3.58 м (1Н, Н8, Jгем16.8), 5.20 м (NH2), 5.62 у.с. (1Н, СН= ), 5.99 м (2Н, СН2). Найдено, %: С 50.5; Н 5.8; N 4.4; S 9.7. C14H19NO5S. Вычислено, %: С 50.8; Н 5.9; N 4.3; S 9.9.
Пример 10. Синтез 5-аминокарбонил-5-карбоксибензил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ij). К раствору 0.82 г (3 ммоль) соединения (Iа) в 30 мл ДМСО при 0 – +5oС прибавили 1 г порошка КОН и по каплям 0.9 мл (7.5 ммоль) бромистого бензила. Реакционную массу перемешивали при комнатной температуре 20 ч, разбавили 130 мл воды, осадок отфильтровали, промыли последовательно водой, эфиром и высушили. Получили 1.0 г сырого продукта, который хроматографировали на колонке с силикагелем (элюент – хлороформ:этанол:вода). Смесью 100:15:1 вымыли 0.85 г (76%) гомогенного эфира (Ij), который растерли в аморфный порошок в эфире. Т. пл. 106-109oС. ИК-спектр, см-1: 720, 790, 825, 1110, 1260, 1310, 1522, 1600, 1680, 1710. Спектр ПМР [CD3OD, , м.д, J, Гц]: 2.12 д (3Н, СН3 при С2, J 2.0). 2.20 м (1Н, Н3), 2.28 д. д.д (1H, Н7, J 12,5, 6.8 и 3.5), 2.40 м (2Н, Н4,8 и 2Н, СН2), 2.52 д. д (1Н, Н6, J 5.5 и 3.8), 3.12 д.д.д (1Н, Н4, J 14.6, 5.2 и 3.5), 3.26 м (2Н, Н3,7), 3.58 м (1Н, Н8, Jгем16.8), 5.20 м (NH2), 5.62 у.с. (1Н, СН= ), 5.99 м (2Н, СН2). Найдено, %: С 50.5; Н 5.8; N 4.4; S 9.7. C14H19NO5S. Вычислено, %: С 50.8; Н 5.9; N 4.3; S 9.9.
Пример 10. Синтез 5-аминокарбонил-5-карбоксибензил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ij). К раствору 0.82 г (3 ммоль) соединения (Iа) в 30 мл ДМСО при 0 – +5oС прибавили 1 г порошка КОН и по каплям 0.9 мл (7.5 ммоль) бромистого бензила. Реакционную массу перемешивали при комнатной температуре 20 ч, разбавили 130 мл воды, осадок отфильтровали, промыли последовательно водой, эфиром и высушили. Получили 1.0 г сырого продукта, который хроматографировали на колонке с силикагелем (элюент – хлороформ:этанол:вода). Смесью 100:15:1 вымыли 0.85 г (76%) гомогенного эфира (Ij), который растерли в аморфный порошок в эфире. Т. пл. 106-109oС. ИК-спектр, см-1: 720, 790, 825, 1110, 1260, 1310, 1522, 1600, 1680, 1710. Спектр ПМР [CD3OD,  , м. д, J, Гц] : 2.18 д (3Н, СН3 при С2, J 2.0), 2.18 м (2Н, Н3,7), 2.40 м (2Н, Н4,8), 2.58 д. д (1Н, Н6, J 5.5 и 3.8), 3.02 д.д.д (1Н, Н4, J 14.6, 5.2 и 3.5), 3.18 д.д.д (1Н, Н7, J 14.2, 5.6 и 3.5), 3.51 м (2Н, Н3,8) 3.60 с (2Н, СН2), 5.20 у.с. (NH2), 7.30 м (5Н, Ph-H). Найдено, %: С 57.7; Н 5.8; N 3.4; S 8.7. C18H21NO5S. Вычислено, %: С 57.8; Н 5.6; N 3.8; S 8.6.
Пример 11. Синтез 5-аминокарбонил-5-карбоксибутил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ik). К раствору 0.82 г (3 ммоль) соединения (Iа) в 30 мл ДМСО при 0 – +5oС прибавили 2 г порошка КОН и по каплям 1.0 мл (10 ммоль) хлористого бутила. Смесь перемешивали при комнатной температуре 20 ч, вылили на 100 г льда, подкислили лимонной кислотой до рН 4 и проэкстрагировали хлористым метиленом (100 мл х 2). Экстракт последовательно промыли водой, 1 N раствором аммиака, водой, сушили сульфатом магния и упарили в вакууме. Получили 1.0 г сырого продукта, который хроматографировали па колонке с силикагелем (элюент хлороформ:этанол). Смесью 20:1 вымыли 0.87 г (79%) гомогенного эфира (Ik), который растерли в аморфный порошок в эфире. Т. пл. 108-110oC. ИК-спектр, см-1: 920, 995, 1110, 1140, 1260, 1300, 1322, 1600, 1640, 1710, 1730. Спектр ПМР [CD3OD, , м. д, J, Гц] : 2.18 д (3Н, СН3 при С2, J 2.0), 2.18 м (2Н, Н3,7), 2.40 м (2Н, Н4,8), 2.58 д. д (1Н, Н6, J 5.5 и 3.8), 3.02 д.д.д (1Н, Н4, J 14.6, 5.2 и 3.5), 3.18 д.д.д (1Н, Н7, J 14.2, 5.6 и 3.5), 3.51 м (2Н, Н3,8) 3.60 с (2Н, СН2), 5.20 у.с. (NH2), 7.30 м (5Н, Ph-H). Найдено, %: С 57.7; Н 5.8; N 3.4; S 8.7. C18H21NO5S. Вычислено, %: С 57.8; Н 5.6; N 3.8; S 8.6.
Пример 11. Синтез 5-аминокарбонил-5-карбоксибутил-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонана (Ik). К раствору 0.82 г (3 ммоль) соединения (Iа) в 30 мл ДМСО при 0 – +5oС прибавили 2 г порошка КОН и по каплям 1.0 мл (10 ммоль) хлористого бутила. Смесь перемешивали при комнатной температуре 20 ч, вылили на 100 г льда, подкислили лимонной кислотой до рН 4 и проэкстрагировали хлористым метиленом (100 мл х 2). Экстракт последовательно промыли водой, 1 N раствором аммиака, водой, сушили сульфатом магния и упарили в вакууме. Получили 1.0 г сырого продукта, который хроматографировали па колонке с силикагелем (элюент хлороформ:этанол). Смесью 20:1 вымыли 0.87 г (79%) гомогенного эфира (Ik), который растерли в аморфный порошок в эфире. Т. пл. 108-110oC. ИК-спектр, см-1: 920, 995, 1110, 1140, 1260, 1300, 1322, 1600, 1640, 1710, 1730. Спектр ПМР [CD3OD,  , м.д, J, Гц]: 1.22 т (3Н, СН3, J 7.0), 2.16 д (3Н, СН3 при С2, J 2.0), 2.18 м (1Н, Н3), 2.28 д.д.д (1Н, Н7, J 12,5, 6.8 и 3.5), 2.50 м (3Н, Н4,6,8 и 4Н, 2-СН2), 3.12 д.д.д (1Н, Н4, J 14.6, 5.2 и 3.5), 3.22-3.42 м (2H, Н3,7 и 2H, СH2), 3.54 м (1H, H8, Jгем16.8) 5.22 у. с. (NН2). Найдено. %: С 58.5; Н 7.2; N 4.6; S 10.7. С15Н23NO5S. Вычислено, %: С 58.2; Н 7.4; N 4.5; S 10.4.
Все синтезированные соединения были испытаны на наличие у них фармакологической активности.
Для исследования вещества суспендировали в воде с добавлением Твина-40 и вводили per os через зонд, в контрольных группах вводили дистиллированную воду с добавлением того же Твина-40.
В качестве эталонных препаратов сравнения использовали известные и широко применяемые трициклические антидепрессанты Амитриптилин и Имипрамин.
Для всех синтезированных соединений была определена острая токсичность.
Острая токсичность определялась на белых беспородных мышах обоего пола. Результаты исследования приведены в табл.1.
Из данных табл.1 видно, что описываемые соединения менее токсичны, чем известные антидепрессанты.
Все синтезированные соединения были исследованы на наличие у них антидепрессивной активности. Применялись стандартные методики для скрининга психотропных средств: тест “открытого поля”, влияние на температуру тела, влияние на каталепсию, вызванную галоперидолом и др. Наиболее четко проявлялась эффективность изучаемых соединений в поведенческом тесте по Порсолоту. Антидепрессивная активность соед. Iа была исследована в этом тесте в широком диапазоне зон.
Для иллюстрации изобретения приведены примеры исследования активности соед. Iа.
Влияние исследуемых соединений и эталонных антидепрессантов на продолжительность иммобилизации мышей в тесте Порсолота
Следует отметить, что в данных тестах действие изучаемых веществ было даже более выраженным и стабильным по сравнению с таковым эталонных антидепрессантов: если амитриптилин в обоих тестах более или менее значимо проявлял специфическую активность в дозах 10-30 мг/кг, то у имипрамина нам не удалось ее выявить даже при увеличении его дозы до 50 мг/кг. Кроме того, по-видимому, механизм, лежащий в основе наблюдаемого эффекта исследуемых соединений, отличен от такового у амитриптилина и имипрамина, поскольку отчетливого влияния комбинации этих средств с соед. Iа на время иммобилизации в тесте Порсолота не выявлено.
Влияние Препарата Iа на ареколиновый тремор , м.д, J, Гц]: 1.22 т (3Н, СН3, J 7.0), 2.16 д (3Н, СН3 при С2, J 2.0), 2.18 м (1Н, Н3), 2.28 д.д.д (1Н, Н7, J 12,5, 6.8 и 3.5), 2.50 м (3Н, Н4,6,8 и 4Н, 2-СН2), 3.12 д.д.д (1Н, Н4, J 14.6, 5.2 и 3.5), 3.22-3.42 м (2H, Н3,7 и 2H, СH2), 3.54 м (1H, H8, Jгем16.8) 5.22 у. с. (NН2). Найдено. %: С 58.5; Н 7.2; N 4.6; S 10.7. С15Н23NO5S. Вычислено, %: С 58.2; Н 7.4; N 4.5; S 10.4.
Все синтезированные соединения были испытаны на наличие у них фармакологической активности.
Для исследования вещества суспендировали в воде с добавлением Твина-40 и вводили per os через зонд, в контрольных группах вводили дистиллированную воду с добавлением того же Твина-40.
В качестве эталонных препаратов сравнения использовали известные и широко применяемые трициклические антидепрессанты Амитриптилин и Имипрамин.
Для всех синтезированных соединений была определена острая токсичность.
Острая токсичность определялась на белых беспородных мышах обоего пола. Результаты исследования приведены в табл.1.
Из данных табл.1 видно, что описываемые соединения менее токсичны, чем известные антидепрессанты.
Все синтезированные соединения были исследованы на наличие у них антидепрессивной активности. Применялись стандартные методики для скрининга психотропных средств: тест “открытого поля”, влияние на температуру тела, влияние на каталепсию, вызванную галоперидолом и др. Наиболее четко проявлялась эффективность изучаемых соединений в поведенческом тесте по Порсолоту. Антидепрессивная активность соед. Iа была исследована в этом тесте в широком диапазоне зон.
Для иллюстрации изобретения приведены примеры исследования активности соед. Iа.
Влияние исследуемых соединений и эталонных антидепрессантов на продолжительность иммобилизации мышей в тесте Порсолота
Следует отметить, что в данных тестах действие изучаемых веществ было даже более выраженным и стабильным по сравнению с таковым эталонных антидепрессантов: если амитриптилин в обоих тестах более или менее значимо проявлял специфическую активность в дозах 10-30 мг/кг, то у имипрамина нам не удалось ее выявить даже при увеличении его дозы до 50 мг/кг. Кроме того, по-видимому, механизм, лежащий в основе наблюдаемого эффекта исследуемых соединений, отличен от такового у амитриптилина и имипрамина, поскольку отчетливого влияния комбинации этих средств с соед. Iа на время иммобилизации в тесте Порсолота не выявлено.
Влияние Препарата Iа на ареколиновый треморДля оценки центрального холинолитического действия соединений использовали тест взаимодействия с ареколином, оценивая показатель латентного периода появления тремора и его продолжительность. Ареколин (25 мг/кг, в/б) вводили через 90 минут после Препаратов. В контрольной группе у всех животных уже в течение первых 1,5 минут развивался интенсивный тремор, который длился 5-7 минут. Этому эффекту холиномиметика отчетливо противодействовал амитриптилин. Уже в дозе 10 мг/кг он удлинял латентный период развития тремора и сокращал его продолжительность, а в дозе 30 мг/кг у части животных полностью блокировал его появление (табл. 3). Холинолитический эффект имипрамина был значительно менее выражен: в дозах 30 и 50 мг/кг удалось зарегистрировать лишь более или менее выраженное удлинение латентного периода развития тремора. У соед. Iа только в меньшей из доз (50 мг/кг) отмечена пролонгация эффекта ареколина. Исследуемый препарат не вызывает холинолитического действия при взаимодействии с холиномиметиком. Таким образом, заявляемые соединения обладают в эксперименте стабильной и выраженной антидепрессивной активностью и, в отличии от стандартных трициклических антидепрессантов, не вызывают холинолитического действия при взаимодействии с холиномиметиком, обладая при этом токсичностью в несколько раз меньшей, чем у упомянутых антидепрессантов. Кроме того, достоинством изобретения является возможность получения соединений из доступного недорого сырья – сульфолена (Безменова Т.Э. Химия тиолен-1,1-диоксидов. Киев: Наукова Думка. 1981. 292 с.), малоновой кислоты и ацетона. Формула изобретения
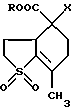 где R= H, Me, Na, CH2Ph, CH2= CHCH2 или CH3CH2CH2CH2, X= CONH2; NH2  HCl; NHBoc; CH2NH2; C(OEt)2NH2 HCl; NHBoc; CH2NH2; C(OEt)2NH2  HCl.
2. 5,5-Дизамещенные-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонаны по п. 1, обладающие антидепрессивной активностью. HCl.
2. 5,5-Дизамещенные-2-метил-9,9-диоксо-9-тиабицикло[4.3.0] нонаны по п. 1, обладающие антидепрессивной активностью.
РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 27.12.2004 № 20621
Извещение опубликовано: 20.02.2005 БИ: 05/2005
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 27.04.2008
Извещение опубликовано: 20.06.2010 БИ: 17/2010
|
||||||||||||||||||||||||||
