Патент на изобретение №2183643
|
||||||||||||||||||||||||||
(54) ПЕПТИД, ОБЛАДАЮЩИЙ БИОЦИДНОЙ АКТИВНОСТЬЮ
(57) Реферат: Изобретение относится к новым пептидам общей формулы 1 H-a-Lys-b-Trp-Lys-c- Pro-d-Lys-Pro-Trp-e-Arg-NH2, где а = -Ile- или -Lys-; b= -Pro – или -Lys-; с, d = -Lys- или -Trp-; е=Arg или Ala, обладающий биоцидной активностью, которые сочетают более высокую по сравнению с индолицидином биоцидную активность с отсутствием повреждающего воздействия на клетки крови. 4 табл. Изобретение относится к области биотехнологии, а именно к новым пептидным структурам, обладающим биоцидными, в частности антибактериальными свойствами. Механизм уничтожения клеток микроорганизмов такими пептидами связан со способностью этих соединений образовывать при взаимодействии с двойным слоем липидной мембраны клеток амфипатичные спирали, для которых характерны катион обогащенные и гидрофобные участки, что приводит к лизису клетки. Наиболее близким к заявляемому решению по структуре и свойствам являлся пептид индолицидин общей формулы (1): (1) H-Ile-Leu-Pro-Trp-Lys-Trp-Pro-Trp-Trp-Pro-Trp-Arg-Arg-NH2 Недостатком индолицидина является наличие высокой гемолитической активности. Задачей, стоящей перед авторами при создании настоящего изобретения, являлась разработка более эффективных и безопасных пептидов, лишенных побочного цитотоксического эффекта в отношении эритроцитов крови, то есть не обладающих гемолитической активностью. Было найдено, что стоящая перед авторами задача решается путем создания пептида общей формулы (2): (2) H-a-Lys-b-Trp-Lys-c-Pro-d-Lys-Pro-Trp-e-Arg-NH2, где а = -Ile- или -Lys-; b = -Pro- или -Lys -; c, d = -Lys- или -Тrр-; e = -Arg- или -Ala-. Лучшие результаты были получены при использовании пептидов (3-7) (3) H-Ile-Lys-Pro-Trp-Lys-Lys-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2, (4) H-Ile-Lys-Pro-Trp-Lys-Trp-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2, (5) H-Ile-Lys-Pro-Trp-Lys-Trp-Pro-Trp-Lys-Pro-Trp-Ala-Arg-NH2, (6) H-Lys-Lys-Pro-Trp-Lys-Trp-Pro-Lys-Lys-Pro-Trp-Arg-Arg-NH2, (7) H-Ile-Lys-Lys-Trp-Lys-Lys-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2. Для временной защиты  -аминогрупп используют трет.-бутилоксикарбонильную защитную группировку. Индольные кольца триптофана блокируют формильной группой, гуаногруппы аргинина – нитрогруппами, -аминогрупп используют трет.-бутилоксикарбонильную защитную группировку. Индольные кольца триптофана блокируют формильной группой, гуаногруппы аргинина – нитрогруппами,  Полноту протекания реакции контролируют нингидриновым тестом. Отщепление от смолы и удаление защитных групп проводят в два этапа. На первом этапе, непосредственно на полимере с помощью пиперидина удаляют формильные группы, на втором этапе – фтористым водородом в присутствии анизола производят окончательное деблокирование и отщепление пептида от смолы.
Очистку синтезированных пептидов проводят с помощью высокоэффективной жидкостной хроматографии высокого давления (ВЖХ) на обращенной фазе.
Чистота полученных при этом препаратов была более 95%. Все они имели удовлетворительный аминокислотный анализ и были индивидуальны по данным аналитической ВЭЖХ.
Промышленная применимость изобретения иллюстрируется следующими примерами.
Пример 1. Синтез пептида H-Ile-Lys-Pro-Trp-Lys-Lys-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2 (3)
Полноту протекания реакции контролируют нингидриновым тестом. Отщепление от смолы и удаление защитных групп проводят в два этапа. На первом этапе, непосредственно на полимере с помощью пиперидина удаляют формильные группы, на втором этапе – фтористым водородом в присутствии анизола производят окончательное деблокирование и отщепление пептида от смолы.
Очистку синтезированных пептидов проводят с помощью высокоэффективной жидкостной хроматографии высокого давления (ВЖХ) на обращенной фазе.
Чистота полученных при этом препаратов была более 95%. Все они имели удовлетворительный аминокислотный анализ и были индивидуальны по данным аналитической ВЭЖХ.
Промышленная применимость изобретения иллюстрируется следующими примерами.
Пример 1. Синтез пептида H-Ile-Lys-Pro-Trp-Lys-Lys-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2 (3)Для синтеза пептида загружали в реакционный сосуд 0.2 г. N  -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -нитро-аргинин-метил-бензгидриламинополимера в 10 мл диметилформамида. Содержание аргинина 1,0 ммол/г полимера. Пептидную цепь далее наращивали с С-конца по программе, приведенной в табл. 1.
Если нингидриновый тест положителен, повторяли конденсацию, начиная с п. 7.
Для синтеза пептида (3) к исходному N -нитро-аргинин-метил-бензгидриламинополимера в 10 мл диметилформамида. Содержание аргинина 1,0 ммол/г полимера. Пептидную цепь далее наращивали с С-конца по программе, приведенной в табл. 1.
Если нингидриновый тест положителен, повторяли конденсацию, начиная с п. 7.
Для синтеза пептида (3) к исходному N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -нитро-L-аргинин-метилбензгидриламинополимеру по программе, приведенной в табл. 1, последовательно присоединяли N -нитро-L-аргинин-метилбензгидриламинополимеру по программе, приведенной в табл. 1, последовательно присоединяли N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -нитро-L-аргинин, N -нитро-L-аргинин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N -хлорбензилоксикарбонил-L-лизин, N -трет-бутил-оксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутил-оксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N -хлорбензилоксикарбонил-L-лизин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N -хлорбензилоксикарбонил-L-лизин, N -трет-бутил-оксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутил-оксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
По завершении синтеза пептидил-полимер высушивали в вакуум-эксикаторе над пятиокисью фосфора и 0,2 г пептидил-полимера деблокировали по программе, приведенной в табл. 2.
Лиофилизат подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19 -хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
По завершении синтеза пептидил-полимер высушивали в вакуум-эксикаторе над пятиокисью фосфора и 0,2 г пептидил-полимера деблокировали по программе, приведенной в табл. 2.
Лиофилизат подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19 300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте. Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 2. Синтез пептида H-Ile-Lys-Pro-Trp-Lys-Trp-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2 (4) 300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте. Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 2. Синтез пептида H-Ile-Lys-Pro-Trp-Lys-Trp-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2 (4)Синтез, деблокирование, очистка и характеристика пептида (4) осуществляли теми же способами, что и пептида (3) по примеру 1, за исключением того, что для его получения к исходному N  -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -нитро-аргинин-метилбензгидриламино-полимеру по программе, приведенной в таблице 1, последовательно присоединяли N -нитро-аргинин-метилбензгидриламино-полимеру по программе, приведенной в таблице 1, последовательно присоединяли N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -нитро-L-аргинин, N -нитро-L-аргинин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N -хлорбензилоксикарбонил-L-лизин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N -хлорбензилоксикарбонил-L-лизин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19 -хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19 300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 3. Синтез пептида H-Ile-Lys-Pro-Trp-Lys-Trp-Pro-Trp-Lys-Pro-Trp-Ala-Arg-NH2 (5) 300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 3. Синтез пептида H-Ile-Lys-Pro-Trp-Lys-Trp-Pro-Trp-Lys-Pro-Trp-Ala-Arg-NH2 (5)Синтез, деблокирование, очистка и характеристика пептида (5) осуществляются теми же способами, что и пептида (3) по примеру 1, за исключением того, что для его получения к исходному N  -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -нитро-L-аргинин-метилбензгидриламинополимеру по программе, приведенной в табл. 1, последовательно присоединяли N-трет-бутилоксикарбонил-L-аланин, N -нитро-L-аргинин-метилбензгидриламинополимеру по программе, приведенной в табл. 1, последовательно присоединяли N-трет-бутилоксикарбонил-L-аланин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил -трет-бутилоксикарбонил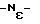 хлорбензилоксикарбонил-L-лизин, N хлорбензилоксикарбонил-L-лизин, N -трет-бутилокси-карбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилокси-карбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин,N -хлорбензилоксикарбонил-L-лизин,N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19 -хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19 300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 4. Синтез пептида H-Lys-Lys-Pro-Trp-Lys-Trp-Pro-Lys-Lys-Pro-Trp-Arg-Arg-NH2= (6) 300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 4. Синтез пептида H-Lys-Lys-Pro-Trp-Lys-Trp-Pro-Lys-Lys-Pro-Trp-Arg-Arg-NH2= (6)Синтез, деблокирование, очистка и характеристика пептида (6) осуществляются теми же способами, что и пептида (3) по примеру 1, за исключением того, что для его получения к исходному N  -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -нитро-L-аргинин-метилбензгидриламино-полимеру по программе, приведенной в табл. 1, последовательно присоединяли N -нитро-L-аргинин-метилбензгидриламино-полимеру по программе, приведенной в табл. 1, последовательно присоединяли N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -нитрo-L-аргинин, N -нитрo-L-аргинин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N -хлорбензилоксикарбонил-L-лизин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N-трет-бутилоксикарбонил-L-пролин, N -хлорбензилоксикарбонил-L-лизин, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N -хлорбензилоксикарбонил-L-лизин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин и N -хлорбензилоксикарбонил-L-лизин и N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19 -хлорбензилоксикарбонил-L-лизин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19 300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 5. Синтез пептида H-Ile-Lys-Lys-Trp-Lys-Lys-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2 (7) 300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 5. Синтез пептида H-Ile-Lys-Lys-Trp-Lys-Lys-Pro-Trp-Lys-Pro-Trp-Arg-Arg-NH2 (7)Синтез, деблокирование, очистка и характеристика пептида (7) осуществляются теми же способами, что и пептида (3) по примеру 1, за исключением того, что для его получения к исходному N  -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -нитро-L-аргинин-метилбензгидриламинополимеру по программе, приведенной в табл. 1, последовательно присоединяли N -нитро-L-аргинин-метилбензгидриламинополимеру по программе, приведенной в табл. 1, последовательно присоединяли N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -нитро-L-аргинин, N -нитро-L-аргинин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N -хлорбензилоксикарбонил-L-лизин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, N-трет-бутилоксикарбонил-L-пролин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N -хлорбензилоксикарбонил-L-лизин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N -хлорбензилоксикарбонил-L-лизин, N -трет-бутилоксикарбонил-Nin-формил-L-триптофан, -трет-бутилоксикарбонил-Nin-формил-L-триптофан, 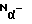 трет-бутилоксикарбонил-N трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин, N -хлорбензилоксикарбонил-L-лизин, N -трет-бутилоксикарбонил-N -трет-бутилоксикарбонил-N -хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19 -хлорбензилоксикарбонил-L-лизин и N-трет-бутилоксикарбонил-L-изолейцин.
Полученный в результате деблокирования по программе, приведенной в табл. 2, лиофильно высушенный пептид подвергали очистке обращенно-фазовой хроматографией на колонке С 18 Nova Pack 19 300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 6. Влияние синтезированных пептидов на рост микроорганизмов.
Культуры клеток, выращенные на твердой питательной среде, выдерживали сутки в холодильнике при +6oС. Перед измерением клетки снимали петлей в жидкую среду LB и доводили концентрацию до 5 300 в градиенте 0-70% ацетонитрила в 0,1% трифторуксусной кислоте.
Содержание основного вещества, по данным оптической плотности, не менее 95%. Аминокислотный состав пептида соответствует теоретическому.
Пример 6. Влияние синтезированных пептидов на рост микроорганизмов.
Культуры клеток, выращенные на твердой питательной среде, выдерживали сутки в холодильнике при +6oС. Перед измерением клетки снимали петлей в жидкую среду LB и доводили концентрацию до 5 106 -107 клеток/мл. В стерильные планшеты “Costar” для клеточных культур (96 ячеек) вносили по 50 мкл раствора пептида в воде (концентрация 200 мкг/мл) и по 100 мкл суспензии клеток в среде LB, и проводили далее разбавление с шагом 2. Инкубировали планшеты в течение 16 часов при 37oС, встряхивали планшеты при комнатной температуре в течение 20-30 минут для взвешивания клеток и снимали показатели оптической плотности на ридере для планшет при длине волны 490 нм.
Считали средний контроль (без пептида) и оценивали % подавления роста микроорганизма по сравнению с контролем.
Результаты испытаний приведены в табл. 3.
Пример 7. Гемолитическая активность пептидов.
Эритроциты человека (кровь берется на гепарин) отмывали 3 раза верональным буфером (VBS) и разводили до концентрации 0,5% (об.) в VBS. Образцы пептидов разводили в концентрации 200 мкг/мл в VBS, при этом начальная концентрация пептида в ячейке составляла 100 мкг.
Раствор пептида вносили в ячейки стерильной планшеты для клеточных культур фирмы “Costar”, начиная с концентрации 100 мкг препарата и 50 мкг эритроцитов человека в ячейку. Проводили раститровывание с шагом 2. Планшеты инкубировали 1 час при 37oС, центрифугировали, отбирали супернатант и проводили скрининг оптической плотности при 415 нм.
В качестве контроля использовали: К1 – VBS без пептида; К2 – VBS с 1% тритоном Х-100. Полученные показатели гемолиза обрабатывали по формуле: 106 -107 клеток/мл. В стерильные планшеты “Costar” для клеточных культур (96 ячеек) вносили по 50 мкл раствора пептида в воде (концентрация 200 мкг/мл) и по 100 мкл суспензии клеток в среде LB, и проводили далее разбавление с шагом 2. Инкубировали планшеты в течение 16 часов при 37oС, встряхивали планшеты при комнатной температуре в течение 20-30 минут для взвешивания клеток и снимали показатели оптической плотности на ридере для планшет при длине волны 490 нм.
Считали средний контроль (без пептида) и оценивали % подавления роста микроорганизма по сравнению с контролем.
Результаты испытаний приведены в табл. 3.
Пример 7. Гемолитическая активность пептидов.
Эритроциты человека (кровь берется на гепарин) отмывали 3 раза верональным буфером (VBS) и разводили до концентрации 0,5% (об.) в VBS. Образцы пептидов разводили в концентрации 200 мкг/мл в VBS, при этом начальная концентрация пептида в ячейке составляла 100 мкг.
Раствор пептида вносили в ячейки стерильной планшеты для клеточных культур фирмы “Costar”, начиная с концентрации 100 мкг препарата и 50 мкг эритроцитов человека в ячейку. Проводили раститровывание с шагом 2. Планшеты инкубировали 1 час при 37oС, центрифугировали, отбирали супернатант и проводили скрининг оптической плотности при 415 нм.
В качестве контроля использовали: К1 – VBS без пептида; К2 – VBS с 1% тритоном Х-100. Полученные показатели гемолиза обрабатывали по формуле: Результаты испытаний приведены в табл. 4. Полученные данные свидетельствуют, что пептиды заявляемой структуры сочетают более высокую по сравнению с индолицидином биоцидную активность с отсутствием повреждающего воздействия на клетки крови. Проведенные испытания пептидов при внутреннем введении в дозе до 1,5 мг/кг путем инъекции соединения в физиологическом растворе в хвостовую вену белых беспородных мышей показали отсутствие токсичности для всех предлагаемых пептидов. Формула изобретения
H-a-Lys-b-Trp-Lys-c-Pro-d-Lys-Pro-Trp-e-Arg-NH2, где а = -Ile- или -Lys-; b = -Pro- или -Lys-; с, d = -Lys- или -Trp-; е = Arg или Ala, обладающий биоцидной активностью. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 19.12.2008
Извещение опубликовано: 7.12.2010 БИ: 36/2010
NF4A Восстановление действия патента СССР или патента Российской Федерации на изобретение
Дата, с которой действие патента восстановлено: 27.12.2010
Извещение опубликовано: 7.12.2010 БИ: 36/2010
PD4A Изменение наименования, фамилии, имени, отчества патентообладателя
(73) Патентообладатель(и):
Дата публикации: 10.05.2011
|
||||||||||||||||||||||||||
