Патент на изобретение №2183214
|
||||||||||||||||||||||||||
(54) ПРИРОДНЫЙ И РЕКОМБИНАНТНЫЙ ИНГИБИТОРЫ ТРОМБИНА, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ
(57) Реферат: Изобретение относится к области биотехнологии и биохимии и может быть использовано в медицине. Из слюны клопа Triatoma pallidipennis выделен белок с молекулярной массой (18000  3000) Да и значением рI 4,5-5,2, обладающий свойствами ингибитора тромбина. С помощью олигонуклеотидного зонда, синтезированного с учетом результатов определения N-концевой последовательности аминокислот выделенного природного белка, получены фрагменты ДНК, кодирующие его предшественника и активную форму. Указанные фрагменты ДНК включены в вектор экспрессии, который использован для трансформации штамма Е.соli. Путем культивирования полученного рекомбинантного штамма осуществлена экспрессия рекомбинантного аналога ингибитора тромбина из слюны клопа. После очистки хроматографическими методами обе формы (природная и рекомбинантная) полипептида, а также их смесь могут быть применены в качестве лекарственного средства при лечении тромбозов, нестабильной стенокардии, артериосклероза и т.п. как непосредственно, так и в составе фармкомпозиции. 3 ил., 2 табл. 3000) Да и значением рI 4,5-5,2, обладающий свойствами ингибитора тромбина. С помощью олигонуклеотидного зонда, синтезированного с учетом результатов определения N-концевой последовательности аминокислот выделенного природного белка, получены фрагменты ДНК, кодирующие его предшественника и активную форму. Указанные фрагменты ДНК включены в вектор экспрессии, который использован для трансформации штамма Е.соli. Путем культивирования полученного рекомбинантного штамма осуществлена экспрессия рекомбинантного аналога ингибитора тромбина из слюны клопа. После очистки хроматографическими методами обе формы (природная и рекомбинантная) полипептида, а также их смесь могут быть применены в качестве лекарственного средства при лечении тромбозов, нестабильной стенокардии, артериосклероза и т.п. как непосредственно, так и в составе фармкомпозиции. 3 ил., 2 табл.
Изобретение относится к протеинам, ингибиторам тромбина из слюны кровососущих у млекопитающих. Тромбин выполняет ключевую функцию при образовании тромба в кровеносных сосудах. Он катализирует расщепление фибриногена до фибрина. Он приводит к образованию сгустков крови. Далее, он индуцирует агрегацию тромбоцитов. Фермент принимает участие в патогенезе различных заболеваний, как, например, артериальный или венозный тромбоз или атериосклероз. Поэтому применение ингибитора тромбина должно приводить к успеху при лечении тромбозов. До сих пор самыми важными известными ингибиторами тромбина являются антитромбин III-гепарин и гирудин. Антитромбин III представляет собой находящийся в плазме протеин с молекулярным весом 58 кд (килодальтонов) Антитромбин III сначала связывается с гепарином, который представляет собой полисахарид. Затем комплекс антитромбин III-гепарин связывается с тромбином и ингибирует этот тромбин. Образуется очень стабильный комплекс из тромбина с антитромбином III и антитромбин III расщепляется тромбином. Наряду с тромбином антитромбин III также ингибирует другие серинпротеазы, как, например, фактор Ха (Pratt, C. W. и Church, G.C. (1991) “Fntithrombin: Structure and Function”, Seminars in Hematology 28: 3-9). Из пиявки Hirudo medicinalis выделяют протеин гирудин. Он имеет молекулярный вес примерно 7 кд и связывается за счет ионного взаимодействия с тромбином. Он специфичен для тромбина (Johnson, P.H., и др. (1989) “Biochemistry and Genetic engineering of hirudin”, Seminars in Thrombosis and Hemostasis 15:302-315). Наряду с вышеупомянутыми ингибиторами тромбина, которые относятся к уровню техники, необходимы другие ингибиторы, которые обладают другим механизмом действия или повышенной активностью. Изобретение предлагает природные или синтетические получаемые протеины, которые являются ингибиторами тромбина и выделяются из слюны насекомых, сосущих кровь млекопитающих. Согласно изобретению предпочтительны протеины, которые выделяют из хищного клона Тriatoma pallidipennis. Предлагаемые согласно изобретению протеины могут быть природного происхождения. Протеины получают тем, что очищают слюну. Также можно выделять протеины из слюнных желез или отбирать синтезирующие протеин клетки из слюнной железы и культивировать. Продуцированные этой культурой клеток надосадочные жидкости собирают и обрабатывают. Надосадочную жидкость культуры клеток очищают и предлагаемые согласно изобретению протеины выделяют и обогащают. Все стадии обогащения, выделения и очистки составляют часть изобретения. Предпочтительны стадии обогащения, выделения и очистки, при которых предлагаемые согласно изобретению протеины можно применять для фармацевтических целей. Так, достигают очисток 50% ингибитора тромбина, в расчете на весь протеин, предпочтительно 85%, более предпочтительно 95% и чаще всего предпочтительно 99% ингибитора тромбина, в расчете на весь протеин. Изобретение охватывает не только протеины, которые выделяют Тriatoma pallidipennis, но и также протеины, которые могут синтезироваться другими видами насекомых. Так, наряду с протеинами, которые выделяются Тriatoma pallidipennis и которые относятся к группе самых предпочтительных, предпочтительны другие протеины, которые происходят из Тriatoma infestans, Тriatoma dimidiata, Тriatoma maculata, Rhodnius prolixus, Panstrongylus megistus и Panstrongylus infestans. Также можно предлагаемые согласно изобретению протеины получать синтетическим путем. К такому пути получения относится синтез протеина согласно J. M.SEWART И J.D.YOUNG, San Franzisco, 1969, и J.MEIENHOFER, Hormonal Proteing and Peptides, т. 2, с. 46, Academic Press (New York) 1973, и E.SCHODER и К. LUBKE, The Peptides, т. 1, Academic Press (New York), 1965. К синтетически получаемым протеинам также причисляют рекомбинантные протеины, которые получают известными способами. В зависимости от организма-хозяина предлагаемые согласно изобретению протеины могут быть гликозилированы или, если они синтезируются в прокариотах, негликозилированы. Ингибиторную функцию устанавливают в различных тест-системах. В примерах 2-4 описываются обычные способы испытаний. Предлагаемые согласно изобретению протеины определяют в слюне насекомых, которые сосут кровь млекопитающих. Эти протеины обычно синтезируются клетками слюнных желез. Поэтому протеины могут выделяться из слюны. Предлагаемые согласно изобретению протеины не ограничиваются этим способом получения и выделения. Напротив, вместе с ними охватываются все синтетически получаемые, предлагаемые согласно изобретению ингибиторы тромбина, которые обнаруживаются в слюне и которые можно выделять из нее. N-концевые последовательности зрелого протеина Изобретение охватывает далее природный или синтетическим путем получаемый протеин, который является ингибитором тромбина и выделяется из слюны насекомых, которые сосут кровь млекопитающих, предпочтительно из Тriatoma pallidipennis. а) причем протеин в качестве активного протеина содержит следующую N-концевую последовательность: Ala-Glu-Gly-Asp-Asp-Cys-Ser-Leu-Glu-Lus-Ala-Met-Gly-Asp-Phe-Lys-Pro-Glu-Glu-Phe-Phe… или б) причем протеин в качестве активного протеина обладает аллельными модификациями указанной выше в п. а) N-концевой аминокислотной последовательности, причем одна или две аминокислоты N-концевой аминокислотной последовательности замещены, подвергнуты делеции или инсерции, при этом существенно не оказывается влияние на активность активного протеина, или в) причем протеин в качестве активного протеина имеет посттрансляционные модифицикации N-концевых последовательностей п.п. а) и б), которые не влияют в значительной степени на активность активного протеина. Последовательности зрелых протеинов Изобретение охватывает далее протеин, который является ингибитором тромбина и г) который в качестве активного зрелого протеина включает одну из следующих последовательностей: I) последовательность, идентифицированную как 1 (последовательность Протокола 1); II) последовательность, идентифицированную как 2 (последовательность Протокола 2); III последовательность, идентифицированную как 3 (последовательность Протокола 3); и IV) последовательность, идентифицированную как 4 (последовательность Протокола 4); или д) который в качестве активного зрелого протеина содержит аллельные модификации одной из указанный выше в п. г) аминокислотных последовательностей, причем по крайней мере одна аминокислота аминокислотной последовательности замещена, подвергнута делеции или инсерции, при этом в значительной степени не оказывается влияние на активность активного протеина; или е) который в качестве активного зрелого протеина включает посттрансляционные модификации одной из последовательностей п.п. г) и д), которые существенно не влияют на активность активного протеина. Все аллельные модификации, которые включают замещения, делеции и/или инсерции вплоть до 30 аминокислот, относятся к группе предлагаемых согласно изобретению протеинов. Предпочтительны делеции, замещения и/или инсерции вплоть до 20 аминокислот, более предпочтительно вплоть до 10 аминокислот, более всего предпочтительны делеции, замещения и/или инсерции одной, двух, трех, четырех, пяти, шести, семи, восьми или девяти аминокислот. Последовательности зрелых протеинов с сигнальной последовательностью Дальнейшая форма осуществления предлагаемых согласно изобретению протеинов заключается в протеине, который состоит из сигнальной последовательности и зрелого, предлагаемого согласно изобретению протеина; ж) причем протеин имеет одну из следующих последовательностей: I) последовательность, идентифицированную как 5 (последовательность Протокола 5), II) последовательность, идентифицированную как 6 (последовательность Протокола 6), III) последовательность, идентифицированную как 7 (последовательность Протокола 7), и IV) последовательность, идентифицированную как 8 (последовательность Протокола 8). или з) причем протеин включает аллельные модификации одной из указанных выше в п. ж) аминокислотных последовательностей, причем по крайней мере одна аминокислота аминокислотной последовательности замещена, подвергнута делеции или инсерции, не влияя при этом существенно на активность зрелого активного протеина; или и) причем протеин включает посттрансляционные модификации одной из последовательностей п. п. ж) и з), которые существенно не влияют на активность активного зрелого протеина. Все аллельные модификации, которые охватывают замещения, делеции и/или инсерции вплоть до 32-х аминокислот, относятся к группе предлагаемых согласно изобретению протеинов. Предпочтительны делеции, замещения и/или инсерции вплоть до 21 аминокислоты, более предпочтительно вплоть до 11 аминокислот, более всего предпочтительны делеции, замещения и/или инсерции одной, двух, трех, четырех, пяти, шести, семи, восьми или девяти аминокислот. Более всего предпочтительны предлагаемые согласно изобретению протеины, которые представляют собой рекомбинантные протеины. При этом протеины могут быть гликозилированы. Предлагаемые согласно изобретению протеины включают зрелые протеины и соответствующие протеины-предшественники, которые образуются из сигнальной последовательности и последовательности зрелого протеина. При этом сигнальная последовательность предшествует последовательности зрелого протеина. Зрелый протеин начинается с указанной выше N-концевой последовательности п. а) Сигнальная последовательность необходима для осуществления эндоплазматического ретикулюма. кДHК или ДНК, кодирующая предлагаемые согласно изобретению протеины Изобретение охватывает далее также кДНК или ДНК, которая кодирует зрелый ингибитор тромбина, аа) причем кДНК или ДНК кодирует одну из следующих аминокислотных последовательностей: I) последовательность, идентифицированная как 1 (последовательность Протокола 1), II) последовательность, идентифицированная как 2 (последовательность Протокола 2), III) последовательность, идентифицированная как 3 (последовательность Протокола 3), и IV) последовательность, идентифицированная как 4 (последовательность Протокола 4); или бб) причем кДНК или ДНК кодирует аллельные модификации одной из аминокислотных последовательностей п. аа), причем по крайней мере одна аминокислота аминокислотной последовательности замещена, подвергнута делеции или инсерции, существенно не влияя при этом на активность активного протеина. Аллельные модификации определяются выше в пункте “Последовательности зрелых протеинов”. Далее, изобретение охватывает кДНК или ДНК, которая кодирует ингибитор тромбина, вв) причем кДНК или ДНК содержит одну из следующих нуклеотидных последовательностей: I) Последовательность, идентифицированная как 9 (последовательность Протокола 9), II) последовательность, идентифицированная как 10 (последовательность Протокола 10), III) последовательность, идентифицированная как 11 (последовательность Протокола 12); или гг) причем кДНК или ДНК включает аллельную модификацию одной из нуклеотидных последовательностей п. вв), причем по крайней мере один нуклеотид замещен, подвергнут делеции или инсерции, не влияя при этом существенно на активность протеина, который кодируется аллельной модификацией нуклеотидной последовательности п. вв). Все ДНК-конструкции также относятся к перечисленным, предлагаемым согласно изобретению последовательностям, если обмениваются такие нуклеотиды, которые на основании дегенерированного кода кодируют ту же самую аминокислоту. Обмен такого рода нуклеотидов очевиден, и соответствующие аминокислоты известны из любой книги по биохимии (R.Nnippers, 1982, 3-е издание, Moleculare Genetik, изд. George Thieme). Все аллельные модификации, которые приводят к изменению аминокислотной последовательности, относятся к изобретению, причем эти модификации охватывают замещения, делеции и/или инсерции вплоть до 30 аминокислот. Предпочтительны делеции, замещения и/или инсерции вплоть до 20 аминокислот, более предпочтительно вплоть до 10 аминокислот, более всего предпочтительны делеции, замещения и/или инсерции одной, двух, трех, четырех, пяти, шести, семи, восьми или девяти аминокислот. Далее, изобретение охватывает также генетический материал, который содержит, наряду с кодирующей, зрелый протеин последовательности, также сигнальную последовательность. Эта сигнальная последовательность находится в кДНК-банке; возможны также другие сигнальные последовательности, которые позволяют осуществлять экспрессию и секрецию протеина. Таким образом, изобретение охватывает кДНК или ДНК, которая кодирует ингибитор тромбина с сигнальной последовательностью, дд) причем кДНК или ДНК содержит одну из следующих нуклеотидных последовательностей: I) последовательность, идентифицированная как 13 (последовательность Протокола 13), II) последовательность, идентифицированная как 14 (последовательность Протокола 14), III) последовательность, идентифицированная как 15 (последовательность Протокола 15), и IV) последовательность, идентифицированная как 16 (последовательность Протокола 16); или ее) причем кДНК или ДНК включает аллельную модификацию одной из нуклеотидных последовательностей и дд), причем по крайней мере один нуклеотид замещен, подвергнут делеции или инсерции, существенно не влияя при этом на активность зрелого протеина, который кодируется, включая свою сигнальную последовательность, аллельной модификацией нуклеотидной последовательности п. дд). Аллельные модификации определяются выше в п. гг). Если указывается активность протеина, для того, чтобы установить, относится ли аллельная модификация к группе протеинов согласно изобретению, то всегда нужно измерять зрелый протеин, также если указана сигнальная последовательность. Если нужно указать сигнальную последовательность, то всегда нужно измерять функцию протеина, который получается после удаления сигнальной последовательности. Далее, изобретение охватывает связывающие молекулы (например, пептиды или их производные), одноцепочечные протеины (Signale Ghain Proteins), антитела или фрагменты антител, домены которых специфически распознают на зрелом, предлагаемом согласно изобретению протеине. Если имеет очищенный, предлагаемый согласно изобретению протеин, то специалисту из него можно легко получить моноклональные антитела. При этом применяют известный метод Келера и Мильштайна и его дальнейшие осуществляемые варианты. При этом, в частности, согласно традиционному методу, мышь иммунизируют многократно с помощью очищенного протеина, отбирают клетки селезенки и соединяют с пригодными опухолевыми клетками. Гибриды затем селекционируют. Протеины согласно изобретению можно выделять из слюны хищных клопов Triatoma pallidipennis. Очистку осуществляют путем гель-фильтрации и последующей аффинной хроматографии на тромбинсефарозе (см. пример 1). Протеины содержат вышеописанные аминокислотные последовательности. Они имеют молекулярную массу примерно 18000  3000 Да (см. пример 6). Изоэлектрическая точка находится в области рН 4,5-5,2, когда применяют описанный в примере 8 метод.
Протеины согласно изобретению подавляют действие тромбина при свертывании крови и при активировании тромбоцитов и в амидолитическом тесте. Тест-системы описываются в примерах 2, 3, 4 и 9. Протеины подавляют свертывание (крови) в концентрации 8 нмоль/л при концентрации тромбина 1,27 нмоль/л. Они ингибируют индуцируемую тромбином агрегацию тромбоцитов до 100% при концентрации 15 нг/мл. Эта концентрация соответствует, при используемой концентрации тромбина 0,06 IU/мл=0,812 пмоль/мл (IU= международная единица), молярному соотношению тромбина к протеину согласно изобретению, равному примерно 1: 1. Напротив, протеины согласно изобретению в амидолитическом тесте подавляют активность тромбина при соотношении тромбина к протеину согласно изобретению, равном 1,87, примерно только на 50%. Протеины согласно изобретению в концентрации 35 нмоль/л удлиняют тромбиновое время (1 IU/мл) в 5 раз.
Протеины согласно изобретению специфичны для тромбина. Другие серинпротеазы (например, фактор Ха или трипсин) также при 40-кратном избытке по достоверным сведениям не ингибируются (см. пример 7).
Векторы с ДНК согласно изобретению 3000 Да (см. пример 6). Изоэлектрическая точка находится в области рН 4,5-5,2, когда применяют описанный в примере 8 метод.
Протеины согласно изобретению подавляют действие тромбина при свертывании крови и при активировании тромбоцитов и в амидолитическом тесте. Тест-системы описываются в примерах 2, 3, 4 и 9. Протеины подавляют свертывание (крови) в концентрации 8 нмоль/л при концентрации тромбина 1,27 нмоль/л. Они ингибируют индуцируемую тромбином агрегацию тромбоцитов до 100% при концентрации 15 нг/мл. Эта концентрация соответствует, при используемой концентрации тромбина 0,06 IU/мл=0,812 пмоль/мл (IU= международная единица), молярному соотношению тромбина к протеину согласно изобретению, равному примерно 1: 1. Напротив, протеины согласно изобретению в амидолитическом тесте подавляют активность тромбина при соотношении тромбина к протеину согласно изобретению, равном 1,87, примерно только на 50%. Протеины согласно изобретению в концентрации 35 нмоль/л удлиняют тромбиновое время (1 IU/мл) в 5 раз.
Протеины согласно изобретению специфичны для тромбина. Другие серинпротеазы (например, фактор Ха или трипсин) также при 40-кратном избытке по достоверным сведениям не ингибируются (см. пример 7).
Векторы с ДНК согласно изобретениюДругой частью изобретения является вектор, который содержит предлагаемую согласно изобретению кДНК или дНК, далее пригодный промотор и в случае необходимости пригодный энхансер. Также может быть еще включена сигнальная последовательность. Векторы подробно описываются в европейских публикациях ЕР – 0480651, ЕР – 0462632 и ЕР – 01731777 Другая форма осуществления изобретения заключается в эукариотной или прокариотной клетке-хозяине, которая трансформирована с помощью предлагаемого в изобретении вектора. Аллельные модификации Самые большие делеции, инсерции и замещения не вызывают, по-видимому, никакого существенного изменения в характеристике протеина согласно изобретению. Так как трудно заранее указать точный эффект замещения, делеции или инсерции, то нужно сравнивать функцию измененного протеина с функцией протеина согласно изобретению. Используемые для этой цели методы указываются, например, в примерах 2-4 и 9. В качестве стандарта служит протеин согласно последовательности, идентичной 1  4, а также протеин, который очищают согласно примеру 1, и также способ очистки примера 1 для сравнительного протеина.
Генетический код дегенерирован, что означает, что наибольшая часть аминокислот кодируется более чем одним кодоном из трех нуклеотидов. Поэтому некоторые аллельные модификации в области нуклеотидов не приводят к изменению аминокислотной последовательности. Поэтому, вероятно, аллельные модификации происходят в области ДНК и могут сказываться вторично на аминокислотной последовательности.
кДНК- или ДНК-последовательности, которые кодируют протеины согласно изобретению, можно модифицировать традиционными способами, чтобы получить варианты предлагаемых в изобретении протеинов, которые по существу обладают такой же активностью, как и описанные и охарактеризованные протеины изобретения. При этом активность измеряют так, как описывается в примерах 2-4 и 9.
Аминокислоты можно замещать, как указано в таблице 1, существенно не влияя при этом на функцию протеина. В каждом отдельном случае благодаря тесту на активность нужно решать, какое влияние изменение оказывает на функцию протеина.
Функции или иммунологическая идентичность существенно изменяются, когда выбираются заместители, которые при замещении менее консервативны, чем указанные в таблице 1 аминокислоты. Такого рода значительные изменения могут достигаться за счет замещений с помощью аминокислот, которые более различаются по своей структуре и по функциональным группам. Значительные изменения имеют следствием то, что изменяется трехмерная структура и/или, например, осуществляется влияние на складчатую или геликоидальную структуру. Также в случае изменений нужно принимать во внимание взаимодействия зарядов и гидрофобных цепей.
Мутации определяются гомологией (подобием) в отношении вторых, взятых для сравнения протеинов. Выражение “гомология” охватывает подобные аминокислоты (например, см. таблицу 1) и пропуски в последовательностях аминокислот (гомология = подобие). Предлагаемые согласно изобретению протеины имеют аминокислотные последовательности, которые обладают гомологией по крайней мере с 80%, предпочтительно 90%, более предпочтительно 95% и предпочтительнее всего 98% предлагаемых согласно изобретению структур, которые определяются последовательностями п. п. г) или ж) (последовательности, идентичные 1-8) и которые далее получаются после очистки согласно примеру 1.
Как упоминалось выше, изобретение охватывает также модификации ДНК или кДНК. Эти модифицированные последовательности гибридизируют в строгих условиях с помощью ДНК-последовательностей, которые кодируют предлагаемые согласно изобретению протеины (см. последовательности в п.п. аа), вв) и дд)). кДНК- или ДНК- последовательности содержат нуклеотидные последовательности, которые обладают идентичностью, включая короткие (до 15 нуклеотидов) делеции и инсерции, по крайней мере на 70%, предпочтительно 82%, более предпочтительно 90% и предпочтительнее всего на 95% с предлагаемыми согласно изобретению кДНК- или ДНК-последовательностями (см. п. аа) и дд), вв)). Идентичность, включая короткие делеции и инсерции (до 15 нуклеотидов), можно определять путем гибридизации, которая описана Р.KNIPPERS, Molekulare Genetik, 1982, 3-e изд. Georg Thime, Stuttgart – New York.
Посттрансляционные модификации 4, а также протеин, который очищают согласно примеру 1, и также способ очистки примера 1 для сравнительного протеина.
Генетический код дегенерирован, что означает, что наибольшая часть аминокислот кодируется более чем одним кодоном из трех нуклеотидов. Поэтому некоторые аллельные модификации в области нуклеотидов не приводят к изменению аминокислотной последовательности. Поэтому, вероятно, аллельные модификации происходят в области ДНК и могут сказываться вторично на аминокислотной последовательности.
кДНК- или ДНК-последовательности, которые кодируют протеины согласно изобретению, можно модифицировать традиционными способами, чтобы получить варианты предлагаемых в изобретении протеинов, которые по существу обладают такой же активностью, как и описанные и охарактеризованные протеины изобретения. При этом активность измеряют так, как описывается в примерах 2-4 и 9.
Аминокислоты можно замещать, как указано в таблице 1, существенно не влияя при этом на функцию протеина. В каждом отдельном случае благодаря тесту на активность нужно решать, какое влияние изменение оказывает на функцию протеина.
Функции или иммунологическая идентичность существенно изменяются, когда выбираются заместители, которые при замещении менее консервативны, чем указанные в таблице 1 аминокислоты. Такого рода значительные изменения могут достигаться за счет замещений с помощью аминокислот, которые более различаются по своей структуре и по функциональным группам. Значительные изменения имеют следствием то, что изменяется трехмерная структура и/или, например, осуществляется влияние на складчатую или геликоидальную структуру. Также в случае изменений нужно принимать во внимание взаимодействия зарядов и гидрофобных цепей.
Мутации определяются гомологией (подобием) в отношении вторых, взятых для сравнения протеинов. Выражение “гомология” охватывает подобные аминокислоты (например, см. таблицу 1) и пропуски в последовательностях аминокислот (гомология = подобие). Предлагаемые согласно изобретению протеины имеют аминокислотные последовательности, которые обладают гомологией по крайней мере с 80%, предпочтительно 90%, более предпочтительно 95% и предпочтительнее всего 98% предлагаемых согласно изобретению структур, которые определяются последовательностями п. п. г) или ж) (последовательности, идентичные 1-8) и которые далее получаются после очистки согласно примеру 1.
Как упоминалось выше, изобретение охватывает также модификации ДНК или кДНК. Эти модифицированные последовательности гибридизируют в строгих условиях с помощью ДНК-последовательностей, которые кодируют предлагаемые согласно изобретению протеины (см. последовательности в п.п. аа), вв) и дд)). кДНК- или ДНК- последовательности содержат нуклеотидные последовательности, которые обладают идентичностью, включая короткие (до 15 нуклеотидов) делеции и инсерции, по крайней мере на 70%, предпочтительно 82%, более предпочтительно 90% и предпочтительнее всего на 95% с предлагаемыми согласно изобретению кДНК- или ДНК-последовательностями (см. п. аа) и дд), вв)). Идентичность, включая короткие делеции и инсерции (до 15 нуклеотидов), можно определять путем гибридизации, которая описана Р.KNIPPERS, Molekulare Genetik, 1982, 3-e изд. Georg Thime, Stuttgart – New York.
Посттрансляционные модификацииПод вышеупомянутыми посттрансляционными модификациями понимают изменения, которые появляются во время или после трансляции. К ним относятся гликозилирование, образование дисульфидных мостиков, химические модификации аминокислот, как, например, сульфатирование, которое описано в связи с гирудином (J. W.FENTON (1989) “Thrombin Interactions with Hirudin”, Seminars un Thrombosis and Hemostasis, 15; 265-268). Гликозилирование представляет собой существенную функцию эндоплазматического ретикулюма и/или Golgi-аппарата. Последовательность и разветвление олигосахаридов образуются в эндоплазматическом ретикулюме и изменяются в Golgi-аппарате. Олигосахариды могут представлять собой N-соединенные олигосахариды (соединенные за счет аспарагина) или О-соединенные олигосахариды (серин-, треонин- или гидроксилизин-связанные). Форма гликозилирования зависит от продуцирующего типа клеток и от рода, от которого происходит соответствующий тип клеток. На масштаб и род гликозилирования можно влиять за счет веществ, которые описываются в европейской публикации ЕР – 0222313. Варьирование гликозилирования может изменять функцию протеина. Протеины зачастую образуют ковалентные связи в цепях. Эти дисульфидные мостики получаются между двумя цистеинами. При этом протеин специфически складывается. Дисульфидные мостики стабилизируют трехмерную структуру протеинов. Далее, аминокислоты можно изменять так, как описывается в международной публикации ВОИС 91/10684. Протеин также может быть сульфатирован. Это изменение описано в связи с гирудином. Выделение и получение предлагаемых согласно изобретению протеинов Изобретение далее охватывает способ получения предлагаемых в изобретении протеинов, включающий следующие стадии: культивирование клетки-хозяина, которая трансформирована с помощью вектора, который содержит предлагаемую согласно изобретению кДНК или ДНК; и выделение и очистка протеина или протеинов. Протеины предпочтительно очищают согласно примеру 1. Однако также возможны другие методы выделения и очистки: Methods of Enzymology, т. 182: Guide to Protein Purification, изд. Murray P.DEUTSCHER, Academic Press, 1990; Protein Purification Application-A Practical Approach, изд. E.L.V.НАRRIS и S. ANGEL, IRL-Press 1990; Protein Purification, Prunciples and Practice Ropect SCOPES, Springer Verlag 1982; и Protein Purification, Principles, High Pesolution Methods and Applications, изд. H. – C.JANSON И L.RYDEN, VCH publishers, 1989. Изобретение также охватывает способ очистки предлагаемых согласно изобретению протеинов, причем протеины выделяют, очищают по крайней мере при использовании одной колонки и затем концентрируют. Предпочтительны колоночная хроматография или адсорбционная хроматография. Сверх того, изобретение относится к способу очистки протеинов согласно изобретению, причем способ состоит из следующих стадий: Нанесение слюны на “Superose 12 НR-колонку” и элюирование и новое нанесение на СН-активированную Sephorose колонку, в которой предварительно связан тромбин, и элюирование. Очистка описывается подробно в примере 1. Применение в качестве лекарственного средства Протеины согласно изобретению обладают фармакологическими воздействиями и поэтому применимы в качестве фармацевтических биологически активных веществ. Изобретение охватывает также лекарственное средство, которое содержит один из предлагаемых согласно изобретению протеинов или их смесь. Далее, к изобретению относится фармацевтическая композиция, которая содержит один из предлагаемых согласно изобретению протеинов или смесь предлагаемых согласно изобретению протеинов, в присутствии фармацевтически совместимых и приемлемых соединений и носителей. Изобретение также охватывает фармацевтическую композицию, которая содержит один из фармацевтических активных, предлагаемых согласно изобретению протеинов или их смесь и фармацевтически приемлемую соль или фармацевтически приемлемый носитель. В особенности, предлагаемые согласно изобретению протеины, согласно Протоколам расшифровки последовательностей 1-4, обладают ингибирующим воздействием на активность тромбина. Ингибирование активности тромбина можно обнаружить в тесте на свертывание (см. пример 2), в тесте на агрегацию тромбоцитов (см. пример 3), в амидолитическом тексте (см. пример 4) и путем измерения тромбинового времени (см. пример 9). Предпочтительной тест-системой является измерение тромбинового времени. Предлагаемые согласно изобретению протеины обнаруживают удлинение тромбинового времени при концентрациях 10-66 нмоль/л (концентрация тромбина 1 IU/мл). При концентрации 58 нмоль/л происходит 9-кратное удлинение. Более высокие концентрации применимы без нарушения тест-системы. Таким образом, предлагаемые согласно изобретению протеины применимы в концентрациях 10-200 нмоль/л. Результаты испытаний согласно этому тесту ин витро показывают, что предлагаемые согласно изобретению протеины можно применять в качестве лекарственного средства или для медицинской обработки. Эти результаты испытаний можно переносить с тест-системы ин витро на систему ин виво, так как в случае теста на свертывание речь идет о принятом порядке испытания (М.TALBOT (1989) “Biology of Recombinant Hirudin, A New Prospect in the Treatment of Thombosis” Seminars in Thrombosis and Hemostasis 15: 293-301). Протеины изобретения поэтому могут служить для лечения и предохранения от тромбозов, нестабильной ангины или артериосклероза, или для предохранения от повторной закупорки сосудов после РТСА/РТА (ангиопластия с баллонным катетером), или для предотвращения свертывания крови при гемодиализе. Протеины изобретения можно использовать в качестве антитромботического и/или антиартериосклеротического лекарственного средства в случае млекопитающих, в особенности людей, для лечения тромботических и/или артериосклеротических недугов. Они могут наступать при дергающей боли за счет артериосклеротических агрегаций (тромбоцитов), при разрушении ткани эндотелия, как, например, при сепсисе, в случае трансплантатов или при нестабильной ангине. Они также могут применяться для того, чтобы избежать новой закупорки после лечения миокардиальных инфарктов и/или при фибринолизе или ангиопластии. При этом протеин изобретения можно вводить до, при и/или после введения катетера. Изобретение далее включает: (I) применение одного из предлагаемых согласно изобретению протеинов или их смеси для приготовления лекарственного средства с целью лечения тромбозов, нестабильной ангины или артериосклероза, или для предохранения от повторной закупорки сосудов после РТСА/РТА, или для предотвращения свертывания крови при гемодиализе; (II) способ лечения тромбозов, нестабильной ангины или артериосклероза для предохранения от повторной закупорки сосудов после РТСА/РТА или тромбозов или для предотвращения свертывания крови в случае гемодиализа, причем способ включает введение количества протеина, согласно изобретению, которое подавляет заболевание, и причем количество протеина вводится пациенту, которому необходимо такое лекарственное средство; (III) фармацевтическую композицию для лечения тромбозов, нестабильной ангины или артериосклерозов, или для предохранения от повторной закупорки сосудов после РТСА/РТА или тромболиза, или для предотвращения свертывания крови при гемодиализе, причем эта композиция включает один из предлагаемых согласно изобретению протеинов или их смесь и по крайней мере один фармацевтически приемлемый носитель и добавку. Для терапевтического воздействия пригодны различные дозы. Они зависят, например, от используемого протеина, хозяина, вида введения и рода и тяжести излечиваемых состояний. В общем, однако, удовлетворительных результатов в случае животных нужно ожидать тогда, когда суточные дозы составляют величины в пределах 2-2000 мкг на кг веса тела. В случае более крупных млекопитающих, например людей, рекомендуемая суточная доза составляет 2-2000 мкг на кг веса тела, когда применяют очищенный согласно примеру 1 протеин. Например, эту дозу целесообразнее вводить в виде частичных доз вплоть до четырехкратно в день. Суточные дозы в случае кратковременного лечения острых тромбов могут составляет 20-2000 мкг на 1 кг веса тела, т.е. быть выше, чем дозы при хроническом лечении, равные 2-200 мкг на 1 кг веса тела. Также удовлетворительных результатов нужно ожидать тогда, когда протеин изобретения вводится подкожно. Предпочтительна целевая инъекция в часть организма, в которой образовались тромбы. Предлагаемые согласно изобретению протеины можно вводить любым обычным путем, в особенности в форме инъекцируемых растворов или суспензий. Настоящее изобретение относится к фармацевтическим композициям, которые включают один из предлагаемых согласно изобретению протеинов или их смесь и по крайней мере один фармацевтически приемлемый носитель или добавку. Такие композиции можно приготовлять известными способами. При этом нужно указать на Remington’s Pharmacentical Science, 15-тое изд. Mack Publishing Company, East Pennsylvania (1980). Результаты испытаний поясняются, руководствуясь фиг. 1-3, которые, в частности, показывают следующее. Фиг. 1: удлинение тромбинового времени при добавке предлагаемого согласно изобретению протеина из Тriatoma pallidipennis. Фиг. 2: Ингибирование активности тромбина в амидолитическом тесте (Triatoma = ингибитор тромбина из Triatoma pallidipennis). Фиг. 3: Ингибирование активности тромбина в тесте на свертывание. Пример 1 Получение слюны Triatoma pallidipennis и очистка протеина изобретения Хищных клопов возбуждают путем механической стимуляции их пробазидия для выделения их слюны. Слюну улавливают на стеклянной пластине и собирают с помощью силиконизированной, снимающей (вытягивающей) пипетки Пастера. Слюну подвергают сушке вымораживанием и растворяют в дистиллированной воде в концентрации 2,5 мг/мл 2 мл этого раствора подвергают гель-фильтрации через колонку с “Superose 12 HR 16/50” (Pharmacia) в 10 ммоль/л Трис-НСl, рН 7,4, 0,0001% “Pluronic F 68”. Активные в тесте на свертывание (см. пример 2) фракции объединяют и наносят на СН-активированную Сефарозу (Pharmacia) с которой по данным изготовителя связан предварительно тромбин. Протеин согласно изобретению связывается в этой снабженной тромбином колонке. Колонку промывают сначала Tyrode-буфером (без сывороточного альбумина), затем элюируют сначала с помощью 10 ммоль/л ацетата натрия, рН 4,5 и затем с помощью 10 ммоль/л глицина, рН 2,5. В элюатах устанавливают рН 7. 10 ммоль/л глицинового элюата содержат очищенный протеин изобретения. Он активен в тесте на свертывание (см. пример 2), в тесте на агрегацию тромбоцитов (см. пример 3), в амидолитическом тесте (см. пример 4) и удлиняет тромбиновое время (см. пример 9). Препарат не содержит никаких определяемых в SDS-гель-электрофорезе примесей. Пример 2 Ингибирование активности тромбина в тесте на свертывание На пластину для микротитрования, которая покрыта альбумином сыворотки крови крупного рогатого скота (0,1% в 0,1 моль/л NaHCO3, рН 9,5), пипеткой наносят 80 мкл 20 ммоль/л НЕРЕS, рН 7,4; 0,15 ммоль/л NaCl; 20 мкл 20 ммоль/л СаСl2; 100 мкл разбавленного раствора протеина согласно изобретению (5-50 нг) и 20 мкл тромбина (0,03 IU=0,03 международных единиц). После инкубации в течение 2 мин при 37oС добавляют 100 мкл фибриногена (5 мг/мл) и инкубируют в течение 40 мин при 37oС. Затем измеряют поглощение при 405 нм. 45 нг (= 8 нмоль/л) очищенного протеина согласно изобретению полностью подавляют расщепление фибриногена. При таких же условиях теста гирудин показывает такую же активность (полное подавление с помощью 8 нмоль/л) (см. фиг. 3). Пример 3 Ингибирование активности тромбина в тесте с агрегацией тромбоцитов 500 мкл отфильтрованных тромбоцитов (300000 /мл) вместе с протеином настоящего изобретения (5-100 нг/мл) инкубируют в течение 1 мин при 37oС. Затем индуцируют агрегацию с помощью тромбина (0,06 IU/мл) и регистрируют агрегацию в агрегометре. Измерения с очищенным протеином согласно изобретению показывают, что при концентрации 16 нг/мл агрегация подавляется на 100%. Пример 4 Ингибирование активности тромбина в амидолитическом тесте На пластине для микротитрования 80 мкл 100 ммоль/л Трис-НСl, рН 7,4, 150 ммоль/л NaCl и 0,03 IU (1,35 нмоль/л)тромбина и 100 мкл разбавленного раствора протеина изобретения (32-630 нг) инкубируют в течение 10 мин при 37oС и затем смешивают со 100 мкл (50 нмоль) субстрата S2238 (Кabi Vitrum). После инкубации в течение 30 мин при 37oС измеряют поглощение при 405 нм. 630 нг (117 нмоль/л) подавляют активность тромбина примерно на 50%. Гирудин в концентрации 6 нмоль/л подавляет активность тромбина до 85% (см. фиг. 2). Пример 5 Определение N-концевой аминокислотной последовательности Очищенный протеин согласно изобретению секвенируют в автоматическом анализаторе аминокислотной последовательности (Applied Biosystems, Inc.) по инструкции изготовителя. Последовательность аминокислот 1-21 (от N-конца) представляет собой: Аla-Glu-Gly-Asp-Asp-Cys-Ser-Leu-Glu-Lys-Ala-Met-Asp-Phe-? -Pro-Glu-Glu-Phe-Phe. “?” обозначает, что с полной гарантией не идентифицируется. В случае этой аминокислоты с некоторой вероятностью речь идет о лизине. Пример 6 SDS-Гель-электрофорез и определение молекулярного веса Протеин согласно изобретению в восстановленном (восстановление с помощью Дитиотреита) и в невосстановленном состоянии вместе с маркерами молекулярного веса (набор для калибровки при электрофорезе фирмы Pharmacia), как фосфорилаза “в” (94 кд), альбумин (97 кд), овальбумин (43 кд), Сarbonic (содержащая четырехвалентный углерод)ангидраза (30 кд), трипсиновый ингибитор (20,1 кд) и лактальбумин (14,4 кд), наносят на 12,5%-ный SDS полиакриламидный гель и после электрофореза согласно Laemmli (1970, Nature, 227, 680-685) окрашивают с помощью Coomassie brilliant blue. В восстановленном состоянии протеин согласно изобретению во время электрофореза только незначительно мигрирует выше трипсина. Это соответствует молекулярной массе примерно 21000 Да. В невосстановленном состоянии протеин согласно изобретению мигрирует между трипсиновым ингибитором и лактальбумином, что соответствует молекулярной массе примерно 18000 Да. Пример 7 Протеин согласно изобретению не ингибирует серин-протеазы – фактор Ха и трипсин Активность фактора Ха и трипсина измеряют с помощью следующего теста. К 80 мкл 50 ммоль/л Трис-HСl, рН 8,0, 227 ммоль/л NaCl для определения фактора Ха добавляют 0,004 IU (0,653 пмоль) фактора Ха (American Diagnoctica) и 0,5 мкг (25 пмоль) протеина согласно изобретению, а для определения трипсина добавляют 0,004 IU (0,019 пмоль) трипсина (Sigma) и 0,016 мкг (0,817 пмоль) протеина согласно изобретению и инкубируют 2 мин при 37oС. После добавки 0,05 мкмоль субстрата S2222 (Kabi Vitrum) инкубируют 20 мин при 37oС и затем измеряют поглощение при 405 нм. Поглощение этих смесей точно такой же величины, как и смесей без протеина согласно изобретению, т.е. протеин не ингибирует активность ни фактора Ха, ни трипсина. Пример 8 Изоэлектрическая фокусировка Протеин согласно изобретению наносят на гель для изоэлектрической фокусировки в области рН 3-9 (Pharmacia) и фокусируют вместе со стандартными протеинами (калибровочный набор, рН 3-10, Pharmacia). Место фокусировки протеина согласно изобретению находится между таковым соевого трипсинового ингибитора (I.P.=4,55) и таковым  -лактоглобулина А (I.P.=5,2).
Пример 9 -лактоглобулина А (I.P.=5,2).
Пример 9Удлинение тромбинового времени Тромбиновое время является мерой активности экзогенного тромбина, который добавляется к тест-плазме. К 0,1 мл плазмы добавляют 50 мкл раствора протеина согласно изобретению в различных разбавлениях (6-58 нмоль) и 50 мкл диэтилбарбитурат-ацетатного буфера с рН 7,6 и инкубируют 1 мин при 37oС. После добавки 0,1 мл раствора тромбина (3 IU/мл) измеряют время наступления свертывания (Biomatic 2000-коагулятор фирмы Sarstedt). Протеин согласно изобретению, который находится в концентрации 35 нмоль/л, удлиняет время свертывания по сравнению с контрольной смесью в 5 раз (см. фиг. 1). Пример 10 Определение внутренних аминокислотных последовательностей после расщепления с помощью Lys C Очищенный протеин по изобретению (59 мкг) восстанавливают с помощью 10% 2-меркаптоэтанола (2 ч при комнатной температуре и в атмосфере азота) и затем вводят во взаимодействие с 4-винилпиридином (2 ч при комнатной температуре и в атмосфере азота). После диализа против 25 ммоль/л Трис-НСl, рН 8,5; 1 ммоль/л ЭДТК, пробу смешивают с 1 мкг Lys C (Boehringer Mannheim) и инкубируют 6 ч при 37oС. Эту смесь после расщепления наносят на Supersper RP-18,4 мкм, находящийся в колонке размером 250 х 4 мм) Mz-analesen-technik, Mainz) и элюируют с помощью градиента 0,1% ТFA в Н2О-0,08% TFA в 70% ацетонитрила (ВЭЖХ фирмы ВОТЕРС). Регистрируют поглощение при 280 нм и при 214 нм и элюат фракционируют. Фракции, которые соответствуют пику поглощения, выпаривают досуха и обрабатывают 30 мкл Н2О. Отдельные фракции секвенируют на автоматическом анализаторе аминокислотной последовательности (Applied Biosystems Inc.) по инструкциям изготовителя. При этом получаются следующие последовательности (начало, смотря по обстоятельствам, от N-конца; “?” обозначает, что однозначно не идентифицировано): 1. Аla-Met-Gly-Asp-Phe-Lys-Pro-Glu-Glu-Phe-Phe-? -Gly-Thr-Arg(?)-Try-Leu-Ala (Определение аминокислоты Arg под сомнением); 2. Gly-Phe-Thr-Gln-Ile-val-Glu-Ile-Gly-Tyr-Acn-Lys-; 3. Asn-Gly-Glu-Gln-Tyr-Ser-Phe-Lys-. Пример 11 Молекулярное клонирование предлагаемой согласно изобретению кДНК Если последовательность N-конца протеина согласно изобретению известна, то можно определить соответствующую нуклеотидную последовательность (см. ВОИС 90/0786). аа) Приготовление специфических проб в случае РCR Для того чтобы определить кДНК согласно изобретению, сначала синтезируют праймер (затравка, стартовая часть), который производится от вышеопределенной при деструкции по Эдману аминокислотной последовательности. Синтезированные олигонуклеотидные последовательности праймера используют для того, чтобы амплифицировать с помощью PCR (Polymerase Chain Reaction = реакция цепи полимеразы) фрагмент предлагаемой согласно изобретению кДНК (см. патент США 4800159). Два олигонуклеотидных праймера получают тем, что нуклеотидную последовательность выводят из частично определенной выше аминокислотной последовательности N-концевого сайта полного, предлагаемого согласно изобретению протеина и одного из его фрагментов. При этом применяют следующие аминокислотные последовательности (см. в конце описания). Матрица (template) состоит из кДНК, которая происходит от поли-А+-РНК, которая предварительно выделена из слюнных желез Triatoma pallidipennis (SAMBROCK и др. : Мolekular Cloning (глава 7, с. 18-22, Cold Spring Harbor Laboratory Press, 1989). Матричная стартовая часть (смысловой праймер): 5′-GC1 GA (A/G) GGI GA (C-T) GA(C/T) TG(C/T) TCI CTI GA (A/G) AA(A/G) GCI ATG GGI GA(C/T) TT-3′ Нематричная стартовая часть (антисмысловой праймер): 5′-TT(G/A)TT (G/A)TA ICC (G/A)AT (T/C)TC IAC (G/A)AT (T/C)TG IGT (G/A)AA-3 A = дезоксиаденозин, С = дезоксицитидин, G =дезоксигуанозин. T = дезокситимидин, и I = дезоксиинозин. PCR состоит из 40 циклов. Один цикл выглядит следующим образом: а) 2 мин денатурирования при 94oС, б) 90 с гибридизации при 52oС и в) 2 мин удлинения при 72oС. Полученный вышеописанным способом продукт PCR- размножения образует на геле агарозы полосу. Ее отделяют от геля агарозы, который имеет низкую температуру плавления, и переносят прямо в PCR-плазмиду (стартовый ген) и субклонируют. Способ соответствует описанию из Протокола изготовителя (рСR – Script TM SK(+) Cloning набор фирмы Stratagen). ДНК-Последовательность подвергнутого инсерции продукта соответствует последовательности PSR-продукта и определяется так, как описано SANGER и др. Proc. Natl. Acad. Sci. USA (1977) 74, 5463-5467. бб) Способ селекции кДНК-банка и выделение предлагаемого согласно изобретению кДНК-клона Примерно 400000 первичных клонов из банка кДНК из слюнных желез Triatoma pallidipennis (кДНК-библиотека) переносят нейлоновые мембраны (Pall Biosupport East Hills, NY, USA) и подвергают скринингу, как предписывает изготовитель. При этом применяют маркированный образец, который получают с помощью вышеописанного метода PCR-размножения. Способ селекции осуществляют дважды, следуя от превращения ДНК-фага в ДНК-плазмиду и проводя определение последовательности вставки (встроенной ДНК) этой плазмиды. Благодаря этому устанавливают четыре кДНК-последовательности, которые представлены в виде последовательностей, идентичных таковым 13-16, причем лишь отсутствуют (триплеты) Triplika для аминокислот (-17)  (-9) при Ti 28 и Ti 45 и (триплет) Rriplika для амикислоты – 18 при Ti 12.
Каждую из обеих нитей выделенной ДНК секвенируют. Производимая от кодирующей ДНК аминокислотная последовательность полностью совпадает с аминокислотной последовательностью, которая найдена ранее с помощью деструкции по Эдману предлагаемого согласно изобретению очищенного протеина.
Самый длинный кДНК-клон (Ti 12) начинается с нуклеотидов TG, которые соответствуют неполному стартовому кодону для метионина. Это становится очевидным, когда принимают во внимание следующий изолированный клон (Ti 5), который найден в случае способа селекционирования с 600000 фагами того же самого кДНК-банка, применяемого при селекционировании Ti 12, Ti 28 и Ti 45.
Четыре кДНК-последовательности предлагаемого в изобретении протеина селекционируют, идентифицируют и секвенируют согласно вышеописанным методам. Лишь положения 9 имеют различия в полученной аминокислотной последовательности. Различия перечисляются в таблице 2.
Идентичность и подобие четырех зрелых протеинов согласно изобретению составляет примерно 95-98%, в зависимости от того, какой выбирается сравнительный партнер.
Пример 12 (-9) при Ti 28 и Ti 45 и (триплет) Rriplika для амикислоты – 18 при Ti 12.
Каждую из обеих нитей выделенной ДНК секвенируют. Производимая от кодирующей ДНК аминокислотная последовательность полностью совпадает с аминокислотной последовательностью, которая найдена ранее с помощью деструкции по Эдману предлагаемого согласно изобретению очищенного протеина.
Самый длинный кДНК-клон (Ti 12) начинается с нуклеотидов TG, которые соответствуют неполному стартовому кодону для метионина. Это становится очевидным, когда принимают во внимание следующий изолированный клон (Ti 5), который найден в случае способа селекционирования с 600000 фагами того же самого кДНК-банка, применяемого при селекционировании Ti 12, Ti 28 и Ti 45.
Четыре кДНК-последовательности предлагаемого в изобретении протеина селекционируют, идентифицируют и секвенируют согласно вышеописанным методам. Лишь положения 9 имеют различия в полученной аминокислотной последовательности. Различия перечисляются в таблице 2.
Идентичность и подобие четырех зрелых протеинов согласно изобретению составляет примерно 95-98%, в зависимости от того, какой выбирается сравнительный партнер.
Пример 12Получение кодирующей протеин согласно изобретению плазмиды и экспрессия и очистка полученного в Е.соli протеина Если известны ДНК-последовательности, то пригодные промоторы и в случае необходимости пригодные энхансеры могут связываться с соответствующими последовательностями ДНК, так что тогда образуется пригодный вектор. (М. WIRTH, L. SCHUMACHER И H.HAUSER в Protein Glycosylation, Gellular Biotechnical and Analytical Aspects (изд. H.S.CONRAAT), т. 15, 49-52, VCH publishers, Weinheim 1991); также J.KRATZSCHMAR И ДР. (1992), Gene, 116, 281-284. Экспрессия такого вектора возможна в эукариттах (например, Baby Hamster Kidney Cells). Далее, ДНК-последовательности могут встраиваться в пригодные прокариотные векторы для экспрессии в штаммах Е.соli. а) Получение плазмиды (I) Предварительные сведения Конструкцию для экспрессии предлагаемого согласно изобретению рекомбинантного протеина в прокариотах получают тем, что используют имеющуюся в продаже плазмиду рКК233-2, которая содержит IPTG-индуцируемый trc-промотор. Пригодный для экспрессии вектор охватывает эту плазмиду рКК233-2, в которую вставлены как кодирующая последовательность предлагаемого и согласно изобретению протеина, так и сигнальная последовательность. Сигнальная последовательность представляет собой модифицированную сигнальную последовательность, которая сводится к выделенному Е.coli протеину – циклофилину “а”. Сигнальная последовательность и кодирующая ДНК используются по направлению вниз от промотора, благодаря чему образуется рКК/срh (T.HAYANO (1991), Biochemistry 30, 3041-3048). Кодирующие последовательности предлагаемого согласно изобретению протеина вставляются в плазмиду экспрессии, и таким образом полученная конструкция (рКК/cph-протеин) используется для трансформации компонентных Е.сoli jM 105 – клеток. (II) Конструирование плазмиды рКК/срh Применяется следующая пара частично перекрывающихся внахлестку и дополнительных олигодезоксинуклеотидов, чтобы копировать кодирующую ДНК для сигнальной последовательности циклофилина “а”. При этом модифицируется соответствующий С-конец циклофилиновой последовательности, чтобы образовать оптимальное место расщепления для бактериальной сигнальной пептидазы. Модификация состоит в том, что последние семь (триплетов) Тriplika С-конца обмениваются на Тriplika, которые кодируют следующую аминокислотную последовательность: Phe-Ser-Ala-Ser-Ala-Leu-Ala (R. E.DALBEY и G.von HEIJNE (1992), TIBS, 17, 474-478). Смысловая олигонуклеотидная последовательность (Sense oligo): 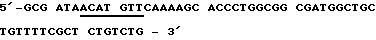 Антисмысловая олигонуклеотидная последовательность (Antisens oligo) 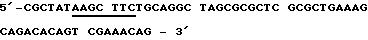 После присоединения стартовой последовательности и последующего дополнения дочерних участков при применении Таg полимеразы ДНК-фрагменты расщепляют с помощью Af/III и Hind III. Места расщепления подчеркнуты. Затем субклонируется ДНК-фрагмент между Ncol- и HindIII – сайтами плазмиды рКК233-2. NneI – сайт, который вместе с HindIII – сайтом облегчает дальнейшее субклонирование кДНК-участков, выделен подчеркиванием. (II) Конструирование плазмиды с помощью предлагаемого в изобретении протеина Применяют следующую пару стартовой последовательности (праймер), чтобы размножать кодирующую последовательность для зрелого протеина согласно изобретению (Ti28= последовательность, идентифицированную как 2). При этом NheI и Hind III – сайты разреза, которые подчеркнуты, необходимы для вставки в плазмиду рКК/срh. Смысловая олигонуклеотидная последовательность (Sense oligo) 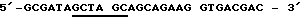 Анисмысловая олигонуклеотидная последовательность (Antisens oligo) 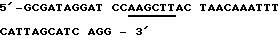 Осуществляют десять циклов, состоящих из: 2 мин при 94oС, 2 мин при 30oС и 2,5 мин при 72oС, для PCR (Polymerase Chain Reaktion) = реакция цепи полимеразы), причем используют 2 мкг матричной нити (Тemplate). Размножившуюся ДНК выделяют с низкоплавящегося геля агарозы, расщепляют с помощью NheI и HindIII и переводят в плазмиду рКК/срh, которую предварительно расщепляют с помощью тех же самых рестрикционных эндонуклеаз. Таким образом, полученную конструкцию исследуют с помощью полного секвенирования кодирующей ДНК и фланкирующей кодирующую ДНК ДНК. (III) Трансформация Е.соli Клетки Е.coli J.M 105 трансформируют при применении способа с СаС12. При этом используют 1 мкг рКК/срh ДНК, которая кодирует протеин согласно изобретению. б) Очистка и характеристика полученного с помощью Е.соli протеина согласно изобретению Культуру трансформированных клеток Е.coli смешивают с IPTG (1 ммоль/л) и инкубируют в течение 6 ч при 37oС. (IPTG = изопропил-  -D-тиогалоктозид). Клетки отделяют путем центрифугирования и подвергают осмотическому “шоку” (обработка сахарозой и затем водой). Таким образом полученная фракция периплазмы ингибирует активность тромбина в тесте на свертывание (см. пример 2). Фракция с ингибирующей активностью очищается путем ионообменной хроматографии на DE-52- целлюлозе и тромбинной аффинной хроматографии (см. пример 1).
Очищенная фракция имеет такую же ингибирующую активность, как и протеин слюны. Она имеет идентичное поведение в SDS-полиакриламидоэлектрофорезе (см. пример 6). Далее, по N- концевой аминокислотной последовательности она совпадает со зрелым протеином слюны. 50811AWOM I XXOO + P 25.11.93.2 -D-тиогалоктозид). Клетки отделяют путем центрифугирования и подвергают осмотическому “шоку” (обработка сахарозой и затем водой). Таким образом полученная фракция периплазмы ингибирует активность тромбина в тесте на свертывание (см. пример 2). Фракция с ингибирующей активностью очищается путем ионообменной хроматографии на DE-52- целлюлозе и тромбинной аффинной хроматографии (см. пример 1).
Очищенная фракция имеет такую же ингибирующую активность, как и протеин слюны. Она имеет идентичное поведение в SDS-полиакриламидоэлектрофорезе (см. пример 6). Далее, по N- концевой аминокислотной последовательности она совпадает со зрелым протеином слюны. 50811AWOM I XXOO + P 25.11.93.2
Формула изобретения
 3000)Да и значением рН в изоэлектрической точке 4,5-5,2.
2. Рекомбинантный зрелый протеин, обладающий свойствами ингибитора тромбина и имеющий выведенную аминокислотную последовательность 1, или 2, или 3, или 4, с молекулярной массой и значением рН в изоэлектрической точке природного протеина по п.1.
3. Фрагмент ДНК, кодирующий зрелый протеин, обладающий свойствами ингибитора тромбина, с нуклеотидной последовательностью 9, или 10, или 11, или 12.
4. Фрагмент ДНК, кодирующий предшественник зрелого протеина по п.2, с нуклеотидной последовательностью 13, или 14, или 15, или 16.
5. Вектор pKK/cph для экспрессии протеина, содержащий фрагмент ДНК, кодирующий сигнальную последовательность, модифицированную на С-конце циклофильной последовательности так, что последний седьмой остаток С-конца заменен последовательностью Phe-Ser-Ala-Ser-Ala-Leu-Ala, и фрагмент ДНК по п.3, субклонированный между Nco I- и Hind III – сайтами плазмиды рКК 233-2.
6. Рекомбинантный штамм Escherichia coli JM 105, трансформированный вектором экспрессии pKK/cph – продуцент протеина, обладающего свойствами ингибитора тромбина.
7. Способ получения зрелого протеина, обладающего свойствами ингибитора тромбина, предусматривающий культивирование штамма – продуцента E.coli, трансформированного вектором экспрессии, содержащим кодирующий названный протеин фрагмент ДНК, выделение и очистку протеина, отличающийся тем, что вектор экспрессии содержит фрагмент ДНК по п.3.
8. Способ выделения и очистки ингибитора тромбина, полученного в E.coli, отличающийся тем, что а) культуру трансформированных E.coli бактерий смешивают с изопропил- 3000)Да и значением рН в изоэлектрической точке 4,5-5,2.
2. Рекомбинантный зрелый протеин, обладающий свойствами ингибитора тромбина и имеющий выведенную аминокислотную последовательность 1, или 2, или 3, или 4, с молекулярной массой и значением рН в изоэлектрической точке природного протеина по п.1.
3. Фрагмент ДНК, кодирующий зрелый протеин, обладающий свойствами ингибитора тромбина, с нуклеотидной последовательностью 9, или 10, или 11, или 12.
4. Фрагмент ДНК, кодирующий предшественник зрелого протеина по п.2, с нуклеотидной последовательностью 13, или 14, или 15, или 16.
5. Вектор pKK/cph для экспрессии протеина, содержащий фрагмент ДНК, кодирующий сигнальную последовательность, модифицированную на С-конце циклофильной последовательности так, что последний седьмой остаток С-конца заменен последовательностью Phe-Ser-Ala-Ser-Ala-Leu-Ala, и фрагмент ДНК по п.3, субклонированный между Nco I- и Hind III – сайтами плазмиды рКК 233-2.
6. Рекомбинантный штамм Escherichia coli JM 105, трансформированный вектором экспрессии pKK/cph – продуцент протеина, обладающего свойствами ингибитора тромбина.
7. Способ получения зрелого протеина, обладающего свойствами ингибитора тромбина, предусматривающий культивирование штамма – продуцента E.coli, трансформированного вектором экспрессии, содержащим кодирующий названный протеин фрагмент ДНК, выделение и очистку протеина, отличающийся тем, что вектор экспрессии содержит фрагмент ДНК по п.3.
8. Способ выделения и очистки ингибитора тромбина, полученного в E.coli, отличающийся тем, что а) культуру трансформированных E.coli бактерий смешивают с изопропил- -Д-тиогалактозидом, б) бактериальные клетки отделяют центрифугированием и подвергают осмотическому шоку и затем в) полученную фракцию периплазмы очищают путем ионообменной хроматографии на целлюлозе DE-52 и тромбинной афинной хроматографии.
9. Способ выделения и очистки ингибитора тромбина из слюны Triatoma pallidipennis, отличающийся тем, что а) возбуждают клопов (Triatoma pallidipennis) путем механической стимуляции их пробазидия для выделения их слюны, б) улавливают слюну на стеклянной пластине и собирают пипеткой Пастера, в) собранную слюну сушат вымораживанием и растворяют в дистиллированной воде в концентрации 2,5 мг/мл, г) 2 мл этого раствора фильтруют на гель-фильтрующей колонке, д) активные на свертываемость фракции объединяют и наносят на СН-активированную колонку, предварительно обработанную тромбином, е) колонку промывают Tyrode-буфером и затем элюируют сначала буфером (10 ммоль/л ацетата Na, pH 4,5) и затем 10 ммоль/л глицина, ж) полученный элюат, содержащий ингибитор в глициновой фракции, нейтрализуют до pH 7.
10. Лекарственное средство, ингибирующее тромбин, отличающееся тем, что представляет собой один из протеинов по п.1 или 2 или их смесь.
11. Фармацевтическая композиция, ингибирующая тромбин, отличающаяся тем, что содержит один из протеинов по п.1 или 2 или их смесь в присутствии фармацевтически совместимых и приемлемых добавок и носителей.
12. Способ получения лекарственного средства, ингибирующего тромбин, для лечения тромбозов, или нестабильной стенокардии, или артериосклероза или для предохранения от повторной закупорки сосудов после ангиопластии с баллонным катетером, или для предотвращения свертывания крови при гемодиализе, отличающийся тем, что один из протеинов по пп.1 и 2 или их смесь применяют в количестве 2-2000 мкг на 1 кг веса тела.
Приоритет по пунктам: -Д-тиогалактозидом, б) бактериальные клетки отделяют центрифугированием и подвергают осмотическому шоку и затем в) полученную фракцию периплазмы очищают путем ионообменной хроматографии на целлюлозе DE-52 и тромбинной афинной хроматографии.
9. Способ выделения и очистки ингибитора тромбина из слюны Triatoma pallidipennis, отличающийся тем, что а) возбуждают клопов (Triatoma pallidipennis) путем механической стимуляции их пробазидия для выделения их слюны, б) улавливают слюну на стеклянной пластине и собирают пипеткой Пастера, в) собранную слюну сушат вымораживанием и растворяют в дистиллированной воде в концентрации 2,5 мг/мл, г) 2 мл этого раствора фильтруют на гель-фильтрующей колонке, д) активные на свертываемость фракции объединяют и наносят на СН-активированную колонку, предварительно обработанную тромбином, е) колонку промывают Tyrode-буфером и затем элюируют сначала буфером (10 ммоль/л ацетата Na, pH 4,5) и затем 10 ммоль/л глицина, ж) полученный элюат, содержащий ингибитор в глициновой фракции, нейтрализуют до pH 7.
10. Лекарственное средство, ингибирующее тромбин, отличающееся тем, что представляет собой один из протеинов по п.1 или 2 или их смесь.
11. Фармацевтическая композиция, ингибирующая тромбин, отличающаяся тем, что содержит один из протеинов по п.1 или 2 или их смесь в присутствии фармацевтически совместимых и приемлемых добавок и носителей.
12. Способ получения лекарственного средства, ингибирующего тромбин, для лечения тромбозов, или нестабильной стенокардии, или артериосклероза или для предохранения от повторной закупорки сосудов после ангиопластии с баллонным катетером, или для предотвращения свертывания крови при гемодиализе, отличающийся тем, что один из протеинов по пп.1 и 2 или их смесь применяют в количестве 2-2000 мкг на 1 кг веса тела.
Приоритет по пунктам:04.12.1992 по пп.7-9 и 12; 12.02.1993 по пп.1 и 2; 17.08.1993 по пп.3 и 4; 25.11.1993 по пп.5, 6, 10 и 11. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 04.12.2005
Извещение опубликовано: 20.12.2007 БИ: 35/2007
|
||||||||||||||||||||||||||
