Патент на изобретение №2183213
|
||||||||||||||||||||||||||
(54) МОДИФИЦИРОВАННЫЕ НУКЛЕОЗИД-5′-ТРИФОСФАТЫ КАК АНТИВИРУСНЫЕ АГЕНТЫ
(57) Реферат: Описываются новые модифицированные нуклеозид-5′-трифосфаты общей формулы: R”’-P(= O)OH-CXX”-P(= O)OH-O-P(= O)OH-CH2-A-B, где В=тимин, аденин, урацил или 5-этилурацил; А имеет формулу (I), R’=Н или N3, R”=H или R и R”’ вместе образуют двойную связь; Z=O или СН2; R”’=Ph, OAlkyl, Oph, NHPh; X’= X”= Br, F; или Х’=H, a X”=Br. Новые соединения являются антивирусными агентами, в частности, они способны ингибировать репродукцию вируса иммунодефицита человека в культуре лимфоцитов человека. 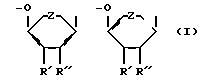 3 табл. Изобретение относится к области молекулярной биологии и вирусологии, а точнее к новым соединениям, модифицированным по P-  , ,  , ,  и сахарному остаткам нуклеозид-5′-трифосфатам D- и L-рядов.
Новые соединения являются терминаторными субстратами обратной транскриптазы вируса иммунодефицита человека (ВИЧ) и ингибиторами репродукции ВИЧ в культуре лимфоцитов человека, а также обладают способностью предохранять от инфицирования здоровые клетки. Кроме того, заявленные соединения являются специфическими ингибиторами вируса гепатита В в культуре гепатоцитов человека, вирусов группы герпеса в различных клеточных культурах, а также обратных транскриптаз ретровирусов, гепаднавирусов и ДНК-полимераз вирусов группы герпеса.
В настоящее время известны различные соединения, подавляющие репродукцию вируса иммунодефицита человека. Наиболее эффективным из известных соединений является 3′-азидо-3′-дезокситимидин (AZT), находящий применение в медицинской практике (Mitsuya H. et al., Proc. Nat. Acad. Sci. USA, 1985, 82, 7096-7100; Mitsuya H. , Broder S. , Proc. Nat. Acad. Sci. USA, 1986, 83, 1911-1915). Молекулярный механизм действия указанного соединения включает диффузию его внутрь клетки, инфицированной ВИЧ. Далее он подвергается трифосфорилированию и специфично блокирует синтез ДНК, катализируемый обратной транскриптазой ВИЧ. Аналогичным образом действуют другие противовирусные нуклеозиды, применяемые в медицинской практике для лечения СПИД: 2′,3′-дидезоксицитидин (Mitsuya H., Broder S., Proc. Natl. Acad. Sci. USA, 1986, 83, 1911-1915), 2′, 3′-дидезоксиинозин (там же), 2′,3′-дидезокси-2′,3′-дидегидротимидин (Herdewijn P. et al., J. Med. Chem., 1987, 30, 1270-1278; Baba M. et al., Biochem. Biophys. Res. Commun., 1987, 142, 128-134) и 2′,3′-дидезокси-3′-тиотимидин (Soudeyns H. et al., Antimicrob. Agents Chemother., 1991, 35, 1386-1390). Однако фосфорилирование модифицированных нуклеозидов клеточными ферментами происходит значительно менее эффективно, чем природных нуклеозидов. Процесс превращения нуклеозида в организме человека в соответствующий 5′-трифосфат занимает около 1,5-2 часов. За это время проникший в клетки вирус успевает в форме провирусной ДНК интегрировать в геном человека. Использование в качестве лекарственных препаратов нуклеозид-5′-трифосфатов с немодифицированной трифосфатной частью невозможно из-за их низкой стабильности к действию ферментов гидролиза и вследствие этого низкой способности проникать внутрь клетки. Таким образом, применяемые препараты, даже если они приняты в момент инфицирования, не могут предохранить от заражения ВИЧ. В качестве противовирусного препарата было предложено использовать производные 3′-азидо-3′-дезокситимидина, содержащие модифицированную фосфатную группу в 5′-положении, а именно Н-фосфонат AZT (Н.Б. Тарусова, и др., Мол. Биол. , 1989, 23, 6, 1716-1724; Патент США 5043437). Однако было показано, что в организме это соединение в основном подвергается дефосфорилированию, превращаясь в AZT (Кузнецова Е.В. и др., Мол. Биол., 1995, 29, 2, 415-420).
В основу изобретения положена задача создания новых нуклеозид-5′-трифосфатов, которые устойчивы к действию ферментов дефосфорилирования, способны проникать внутрь клетки и обладают избирательной активностью в подавлении биосинтеза ДНК, катализируемого обратной транскриптазой ВИЧ.
Задача решена тем, что согласно изобретению заявляются новые соединения – P- и сахарному остаткам нуклеозид-5′-трифосфатам D- и L-рядов.
Новые соединения являются терминаторными субстратами обратной транскриптазы вируса иммунодефицита человека (ВИЧ) и ингибиторами репродукции ВИЧ в культуре лимфоцитов человека, а также обладают способностью предохранять от инфицирования здоровые клетки. Кроме того, заявленные соединения являются специфическими ингибиторами вируса гепатита В в культуре гепатоцитов человека, вирусов группы герпеса в различных клеточных культурах, а также обратных транскриптаз ретровирусов, гепаднавирусов и ДНК-полимераз вирусов группы герпеса.
В настоящее время известны различные соединения, подавляющие репродукцию вируса иммунодефицита человека. Наиболее эффективным из известных соединений является 3′-азидо-3′-дезокситимидин (AZT), находящий применение в медицинской практике (Mitsuya H. et al., Proc. Nat. Acad. Sci. USA, 1985, 82, 7096-7100; Mitsuya H. , Broder S. , Proc. Nat. Acad. Sci. USA, 1986, 83, 1911-1915). Молекулярный механизм действия указанного соединения включает диффузию его внутрь клетки, инфицированной ВИЧ. Далее он подвергается трифосфорилированию и специфично блокирует синтез ДНК, катализируемый обратной транскриптазой ВИЧ. Аналогичным образом действуют другие противовирусные нуклеозиды, применяемые в медицинской практике для лечения СПИД: 2′,3′-дидезоксицитидин (Mitsuya H., Broder S., Proc. Natl. Acad. Sci. USA, 1986, 83, 1911-1915), 2′, 3′-дидезоксиинозин (там же), 2′,3′-дидезокси-2′,3′-дидегидротимидин (Herdewijn P. et al., J. Med. Chem., 1987, 30, 1270-1278; Baba M. et al., Biochem. Biophys. Res. Commun., 1987, 142, 128-134) и 2′,3′-дидезокси-3′-тиотимидин (Soudeyns H. et al., Antimicrob. Agents Chemother., 1991, 35, 1386-1390). Однако фосфорилирование модифицированных нуклеозидов клеточными ферментами происходит значительно менее эффективно, чем природных нуклеозидов. Процесс превращения нуклеозида в организме человека в соответствующий 5′-трифосфат занимает около 1,5-2 часов. За это время проникший в клетки вирус успевает в форме провирусной ДНК интегрировать в геном человека. Использование в качестве лекарственных препаратов нуклеозид-5′-трифосфатов с немодифицированной трифосфатной частью невозможно из-за их низкой стабильности к действию ферментов гидролиза и вследствие этого низкой способности проникать внутрь клетки. Таким образом, применяемые препараты, даже если они приняты в момент инфицирования, не могут предохранить от заражения ВИЧ. В качестве противовирусного препарата было предложено использовать производные 3′-азидо-3′-дезокситимидина, содержащие модифицированную фосфатную группу в 5′-положении, а именно Н-фосфонат AZT (Н.Б. Тарусова, и др., Мол. Биол. , 1989, 23, 6, 1716-1724; Патент США 5043437). Однако было показано, что в организме это соединение в основном подвергается дефосфорилированию, превращаясь в AZT (Кузнецова Е.В. и др., Мол. Биол., 1995, 29, 2, 415-420).
В основу изобретения положена задача создания новых нуклеозид-5′-трифосфатов, которые устойчивы к действию ферментов дефосфорилирования, способны проникать внутрь клетки и обладают избирательной активностью в подавлении биосинтеза ДНК, катализируемого обратной транскриптазой ВИЧ.
Задача решена тем, что согласно изобретению заявляются новые соединения – P- , ,  , ,  модифицированные 2′-дезоксинуклеозид-5′-трифосфаты, общей формулы: модифицированные 2′-дезоксинуклеозид-5′-трифосфаты, общей формулы: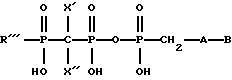 где В=тимин, аденин, урацил или 5-этилурацил 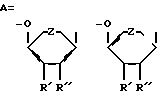 R’=H или N3; R”=Н или R’ и R” вместе образуют двойную связь; Z=O или СН2; R”’=Ph, OAlkyl, OPh, NHPh; X’=X”=Br, F или X’=H, a X”=Br. Новые соединения получают путем активации соответствующим образом модифицированного мононуклеотида с помощью N,N’-карбонилдиимидазола и последующей его конденсации с модифицированным трифосфтатом. Структура заявленных соединений подтверждена методами УФ-, ЯМР- и массспектрометрии. Пример 1. 5′-(  -Фениламидо- -Фениламидо- , ,  -дибромметилендифосфонил- -дибромметилендифосфонил- -фосфонилметил)-5′-дезоксиметил-3′-азидо-3′-дезокситимидин. (Соединение I, В=Thy, R’=N3, R”=H, Z=O, R”’=NHPh, X’=X”=Br).
К раствору 0,5 ммоль 3′-азидо-2′,3′-дидезокси-4′-нортимидин-4′-норфосфоната в 10 мл ДМФА прибавляют 162 мг (1 ммоль) N,N’-карбонилдиимдазола, перемешивают 2 часа при 20oС, приливают 1 мл метанола, оставляют на 30 мин и упаривают досуха, к остатку прибавляют 1 ммоль -фосфонилметил)-5′-дезоксиметил-3′-азидо-3′-дезокситимидин. (Соединение I, В=Thy, R’=N3, R”=H, Z=O, R”’=NHPh, X’=X”=Br).
К раствору 0,5 ммоль 3′-азидо-2′,3′-дидезокси-4′-нортимидин-4′-норфосфоната в 10 мл ДМФА прибавляют 162 мг (1 ммоль) N,N’-карбонилдиимдазола, перемешивают 2 часа при 20oС, приливают 1 мл метанола, оставляют на 30 мин и упаривают досуха, к остатку прибавляют 1 ммоль  -фениламида дибромметилендифосфоната бистрибутиламмониевой соли, перемешивают 3 час, а при 20oС, приливают 200 мл воды и наносят на колонку (20 -фениламида дибромметилендифосфоната бистрибутиламмониевой соли, перемешивают 3 час, а при 20oС, приливают 200 мл воды и наносят на колонку (20 2,5 см) с Toyopeari DEAE (НСО3 –). Элюцию проводят линейным градиентом буфера NH4HCO3, рН 7,5 (0->0,4 М, общий объем 600 мл) с УФ-контролем. Фракции с веществом лиофилизуют, остаток растворяют в 1 мл воды и наносят на колонку (20 2,5 см) с Toyopeari DEAE (НСО3 –). Элюцию проводят линейным градиентом буфера NH4HCO3, рН 7,5 (0->0,4 М, общий объем 600 мл) с УФ-контролем. Фракции с веществом лиофилизуют, остаток растворяют в 1 мл воды и наносят на колонку (20 1,5 см) с LichroPrep RP18. Элюцию проводят водой с УФ-контролем. Раствор, содержащий вещество, лиофилизуют, выход 0,26 ммоль, 52%. УФ-спектр (вода) 1,5 см) с LichroPrep RP18. Элюцию проводят водой с УФ-контролем. Раствор, содержащий вещество, лиофилизуют, выход 0,26 ммоль, 52%. УФ-спектр (вода)  max266 nm ( max266 nm ( 9600), 1H-ЯМР-спектр (D2O, 9600), 1H-ЯМР-спектр (D2O,  , м. д.): 7.64 m (2Н, Ph), 7.32 m (3H, arom), 7.60 s (1H, H-6); 6.30 m (1H, Н-1′); 5.52 s (1-H, H-4′); 4.46 m (1-H, H-3′); 3.64 d (2H, jСH, P=8.5 Гц, , м. д.): 7.64 m (2Н, Ph), 7.32 m (3H, arom), 7.60 s (1H, H-6); 6.30 m (1H, Н-1′); 5.52 s (1-H, H-4′); 4.46 m (1-H, H-3′); 3.64 d (2H, jСH, P=8.5 Гц, 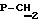 ); 2,44 m (1H, H-2′); 1.92 s (3H, СН3-Thy); 1.86 d (3H, JH,P’=17.9Гц, СН3РО); 31P ЯМР спектр (D2O, d, м.д.):9,58 д ( ); 2,44 m (1H, H-2′); 1.92 s (3H, СН3-Thy); 1.86 d (3H, JH,P’=17.9Гц, СН3РО); 31P ЯМР спектр (D2O, d, м.д.):9,58 д ( -P, J -P, J – – = 33,0 Гц), 8.16 д ( = 33,0 Гц), 8.16 д ( -P, J -P, J – – = 13,85 Гц), 0,10 м ( = 13,85 Гц), 0,10 м ( -P) FAB-масс, m/z: 735 (М++Н), 752 (М++Н+NН3) -P) FAB-масс, m/z: 735 (М++Н), 752 (М++Н+NН3)Пример2.5′-(  -Метил- -Метил- , ,  -дибромметилендифосфонил- -дибромметилендифосфонил- -фосфонилметил)-5′-дезоксиметил-3′-азидо-3′-дезокситимидин. (Соединение 2, B=Thy, R’=N3, R”=H, Z=O, R”’=OMe, X’=X”=Br).
Синтез проводят по методике примера 1 исходя из 5′-фосфонилметил-5′-дезоксиметил-3′-азидо-3′-дезокситимидина и бис(трибутиламмонийной) соли метилового эфира дибромметилендифосфоновой кислоты. Выход 0,34 ммоль, 68%. УФ-спектр (вода) -фосфонилметил)-5′-дезоксиметил-3′-азидо-3′-дезокситимидин. (Соединение 2, B=Thy, R’=N3, R”=H, Z=O, R”’=OMe, X’=X”=Br).
Синтез проводят по методике примера 1 исходя из 5′-фосфонилметил-5′-дезоксиметил-3′-азидо-3′-дезокситимидина и бис(трибутиламмонийной) соли метилового эфира дибромметилендифосфоновой кислоты. Выход 0,34 ммоль, 68%. УФ-спектр (вода)  max268 nm ( max268 nm ( 9600), 1H -ЯМР-спектр (D2O, 9600), 1H -ЯМР-спектр (D2O,  , м.д.): 7.60 м (1H, H-6); 6.30 м (1H, Н-1′); 5.60 м (1-H, H-4′); 4.38 м (1H, H-3′); 3.64 д (2H, JCH, P= 8.5 Hz, , м.д.): 7.60 м (1H, H-6); 6.30 м (1H, Н-1′); 5.60 м (1-H, H-4′); 4.38 м (1H, H-3′); 3.64 д (2H, JCH, P= 8.5 Hz, 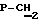 ); 3.36 (3H, ОМе); 2.39 м (1H, H-3′); 1.92 с (3H, Me), . 31P ЯМР спектр (D2O, ); 3.36 (3H, ОМе); 2.39 м (1H, H-3′); 1.92 с (3H, Me), . 31P ЯМР спектр (D2O,  , м.д.): 10,87 д ( , м.д.): 10,87 д ( -P, J -P, J – – = 35,0 Гц), 8,46 д ( = 35,0 Гц), 8,46 д ( -P, J -P, J – – = 14,95 Гц), -0,12 м ( = 14,95 Гц), -0,12 м ( -P). FAB-масс, m/z: 679 (М++1).
Пример3.5′-( -P). FAB-масс, m/z: 679 (М++1).
Пример3.5′-( -Фенил- -Фенил- , ,  -дибромметилендифосфонил- -дибромметилендифосфонил- -фосфонилметил)-5′-дезоксиметил-3′-азидо-3′-дезокситимидин (Соединение 3, B=Thy, R’=H, R”=H, Z= O, R”’=OPh, X’=X”=Br).
Синтез проводят по методике примера 1 исходя из 5′-фосфонилметил-5′-дезоксиметил-3′-азидо-3′-дезокситимидина и бис(трибутиламмонийной) соли фенилового эфира дибромметилендифосфоновой кислоты. Выход 0.34 ммоль, 68%. УФ-спектр (вода) -фосфонилметил)-5′-дезоксиметил-3′-азидо-3′-дезокситимидин (Соединение 3, B=Thy, R’=H, R”=H, Z= O, R”’=OPh, X’=X”=Br).
Синтез проводят по методике примера 1 исходя из 5′-фосфонилметил-5′-дезоксиметил-3′-азидо-3′-дезокситимидина и бис(трибутиламмонийной) соли фенилового эфира дибромметилендифосфоновой кислоты. Выход 0.34 ммоль, 68%. УФ-спектр (вода)  max268 nm ( max268 nm ( 9600), 1H-ЯМР-спектр (D2O, 9600), 1H-ЯМР-спектр (D2O,  , м.д.): 7.68 m (2H, Ph), 7.32 m (3H, Ph), 7.60 с (1Н, Н-6); 6.30 м (1H, Н-1′); 5.46 м (1-H, H-4′); 4.60 м (1-H, Н-3′); 3.91 д (2H, JCH,P=8,5 Гц, , м.д.): 7.68 m (2H, Ph), 7.32 m (3H, Ph), 7.60 с (1Н, Н-6); 6.30 м (1H, Н-1′); 5.46 м (1-H, H-4′); 4.60 м (1-H, Н-3′); 3.91 д (2H, JCH,P=8,5 Гц, 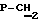 ); 2.28 м (1H, Н-2′); 1.94 с (3H, СН3). 31P ЯМР спектр (D2O, ); 2.28 м (1H, Н-2′); 1.94 с (3H, СН3). 31P ЯМР спектр (D2O,  , м.д.): 11,67 д ( , м.д.): 11,67 д ( -P, J -P, J – – = 33,56 Гц), 8,43 д ( = 33,56 Гц), 8,43 д ( -P, J -P, J – – = 14,08 Гц), 0,05 м ( = 14,08 Гц), 0,05 м ( -P) FAB-масс, m/z: 741 (М++Н), 758 (M++H+NH3).
Пример4.5′-( -P) FAB-масс, m/z: 741 (М++Н), 758 (M++H+NH3).
Пример4.5′-( -Фенил- -Фенил- , ,  -дибромметилендифосфонил- -дибромметилендифосфонил- -фосфонилметил)-5′-дезоксиметил-3′-азидо-2′, 3′-дидезоксиуридин (Соединение 4, B=Ura, R’=N3, R”= H, Z=O, R”’=OPh, X’=X”=Br).
Синтез проводят по методике примера 1 исходя из 5′-фосфонилметил-5′-дезоксиметил-3′-азидо-2′, 3′-дидезоксиуридина и бис(трибутиламмонийной) соли фенилового эфира дибромметилендифосфоновой кислоты. Выход 0.34 ммоль, 68%. УФ-спектр (вода) -фосфонилметил)-5′-дезоксиметил-3′-азидо-2′, 3′-дидезоксиуридин (Соединение 4, B=Ura, R’=N3, R”= H, Z=O, R”’=OPh, X’=X”=Br).
Синтез проводят по методике примера 1 исходя из 5′-фосфонилметил-5′-дезоксиметил-3′-азидо-2′, 3′-дидезоксиуридина и бис(трибутиламмонийной) соли фенилового эфира дибромметилендифосфоновой кислоты. Выход 0.34 ммоль, 68%. УФ-спектр (вода)  max268 nm ( max268 nm ( 9600), 1H-ЯМР-спектр (D2O, 9600), 1H-ЯМР-спектр (D2O,  , м.д.): 7.60 д (1H, J= 8 Гц, Н-6); 7.68 м (2H, arom); 7.32 м (3H, Ph); 6.22 м (1H, Н-1′); 5.80 д (1H, J=8 Гц, Н-5); 5.28 м (1H, H-4′); 4.50 м (1-H, Н-3′); 3.64 д (2H, jCH,P= 8.5 Гц, , м.д.): 7.60 д (1H, J= 8 Гц, Н-6); 7.68 м (2H, arom); 7.32 м (3H, Ph); 6.22 м (1H, Н-1′); 5.80 д (1H, J=8 Гц, Н-5); 5.28 м (1H, H-4′); 4.50 м (1-H, Н-3′); 3.64 д (2H, jCH,P= 8.5 Гц, 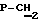 ); 2.22 м (1H, Н-2′);. 31Р ЯМР спектр (D2O, ); 2.22 м (1H, Н-2′);. 31Р ЯМР спектр (D2O,  , м.д.): 9,24 д ( , м.д.): 9,24 д ( -P, J -P, J – – = 30,19 Гц), 8,86 д ( = 30,19 Гц), 8,86 д ( -P, J -P, J – – = 13,87 Гц), 0,23 м ( = 13,87 Гц), 0,23 м ( -P) FAB-масс, m/z: 728 (M++H).
Пример5.5′-( -P) FAB-масс, m/z: 728 (M++H).
Пример5.5′-( -Фенил- -Фенил- , ,  -дибромметилендифосфонил- -дибромметилендифосфонил- -фосфонилметил)-5′-дезоксиметил-3′-азидо-2′,3′-дидезокси-5-этилуридин (Соединение 5, В=5-этилурацил, R’=N3, R”=H, Z=O, R”’=OPh, X’=X”=Br).
Синтез проводят по методике примера 1 исходя из 5′-фосфонилметил-5′-дезоксиметил-3′-азидо-2′, 3′-дидезокси-5-этилиуридина и бис-(трибутил-аммонийной) соли фенилового эфира дибромметилендифосфоновой кислоты. Выход 38%. УФ-спектр (вода) -фосфонилметил)-5′-дезоксиметил-3′-азидо-2′,3′-дидезокси-5-этилуридин (Соединение 5, В=5-этилурацил, R’=N3, R”=H, Z=O, R”’=OPh, X’=X”=Br).
Синтез проводят по методике примера 1 исходя из 5′-фосфонилметил-5′-дезоксиметил-3′-азидо-2′, 3′-дидезокси-5-этилиуридина и бис-(трибутил-аммонийной) соли фенилового эфира дибромметилендифосфоновой кислоты. Выход 38%. УФ-спектр (вода)  max272 nm ( max272 nm ( 12400). 1H-ЯМР-спектр (D2O, 12400). 1H-ЯМР-спектр (D2O,  , м.д.): 7.72 д (1Н, J=7.5 Гц, Н-6); 7.68 м (2Н, arom), 7.32 м (3Н, Ph), 6.23 м (1Н, Н-1′); 5.68 д (1Н, J=7.5 Гц, Н-5); 5.50 м (1-Н, Н-4′) 4.46 м (1-Н, Н-3′); 2,55 м (2Н, СH2-СН3), 2.42 м (1Н, Н-2′), 1.37 м (3Н, СН2-СH3). 31P ЯМР спектр (D2O, , м.д.): 7.72 д (1Н, J=7.5 Гц, Н-6); 7.68 м (2Н, arom), 7.32 м (3Н, Ph), 6.23 м (1Н, Н-1′); 5.68 д (1Н, J=7.5 Гц, Н-5); 5.50 м (1-Н, Н-4′) 4.46 м (1-Н, Н-3′); 2,55 м (2Н, СH2-СН3), 2.42 м (1Н, Н-2′), 1.37 м (3Н, СН2-СH3). 31P ЯМР спектр (D2O,  , м.д.): 12,34 д ( , м.д.): 12,34 д ( -P, J -P, J – – = 36,5 Гц), 9,13 д ( = 36,5 Гц), 9,13 д ( -P, J -P, J – – = 14,15 Гц), 0,05 м ( = 14,15 Гц), 0,05 м ( -P) FAB-масс, m/z: 749 (М++Н).
Пример6.5′-( -P) FAB-масс, m/z: 749 (М++Н).
Пример6.5′-( -Фенил- -Фенил- , ,  -дибромметилендифосфонил- -дибромметилендифосфонил- -фосфонилметил)-5′-дезоксиметил-2′, 3′-дидезоксиаденозин (Соединение 6, B= Ade, R’=R”=H, Z=O, R”’=PhO, X’=X”=Br).
Синтез проводят по методике примера 1 исходя из N-защищенного 5′-фосфонилметил-5′-дезоксиметил-2′, 3′-дидезоксиаденозина и бис(трибутилам-монийной) соли фенилового эфира дибромметилендифосфоновой кислоты. Выход 0,32 ммол, 64%. УФ-спектр (вода) -фосфонилметил)-5′-дезоксиметил-2′, 3′-дидезоксиаденозин (Соединение 6, B= Ade, R’=R”=H, Z=O, R”’=PhO, X’=X”=Br).
Синтез проводят по методике примера 1 исходя из N-защищенного 5′-фосфонилметил-5′-дезоксиметил-2′, 3′-дидезоксиаденозина и бис(трибутилам-монийной) соли фенилового эфира дибромметилендифосфоновой кислоты. Выход 0,32 ммол, 64%. УФ-спектр (вода)  max260 nm ( max260 nm ( 15000), 1Н-ЯМР-спектр (D2O, 15000), 1Н-ЯМР-спектр (D2O,  , м.д.): 8.30 с (1Н, Н-2); 8.09 с (1Н, Н-8); 7.68 m (2Н, arom), 7.32 m (3Н, Ph), 6.33 м (1Н, Н-1′); 5,36 м (1Н, Н-4′); 3.56 д (2Н, J=9,0 Гц, CH2-P), 2,6-2,3 (4Н, Н-3′, Н-2′). 31Р ЯМР спектр (D2О, , м.д.): 8.30 с (1Н, Н-2); 8.09 с (1Н, Н-8); 7.68 m (2Н, arom), 7.32 m (3Н, Ph), 6.33 м (1Н, Н-1′); 5,36 м (1Н, Н-4′); 3.56 д (2Н, J=9,0 Гц, CH2-P), 2,6-2,3 (4Н, Н-3′, Н-2′). 31Р ЯМР спектр (D2О,  , м.д.): 11,82 д ( , м.д.): 11,82 д ( -P, J -P, J – – = 34,5 Гц), 8.59 д ( = 34,5 Гц), 8.59 д ( -P, J -P, J – – = 13,90 Гц), -0.11 м ( = 13,90 Гц), -0.11 м ( -P) FAB-масс, m/z: 707 (М++Н), 724 (M++H+NH3).
Пример7.5′-( -P) FAB-масс, m/z: 707 (М++Н), 724 (M++H+NH3).
Пример7.5′-( -Фенил- -Фенил- , ,  -дифторметилендифосфонил- -дифторметилендифосфонил- -фосфонилметил)-5′-дезоксиметил-2′,3′-дидезокситимидин (Соединение 7, B=Thy, R’=R”=H, Z=O, R”’= PhO, X’=X”=F).
Синтез проводят по методике примера 1 исходя из 5′-фосфонилметил-5′-дезоксиметил-2′, 3′-дидезокситимидина и бис(трибутиламмонийной) соли фенилового эфира дифторметилендифосфоновой кислоты. Выход 0,16 ммол, 32%. УФ-спектр (вода) -фосфонилметил)-5′-дезоксиметил-2′,3′-дидезокситимидин (Соединение 7, B=Thy, R’=R”=H, Z=O, R”’= PhO, X’=X”=F).
Синтез проводят по методике примера 1 исходя из 5′-фосфонилметил-5′-дезоксиметил-2′, 3′-дидезокситимидина и бис(трибутиламмонийной) соли фенилового эфира дифторметилендифосфоновой кислоты. Выход 0,16 ммол, 32%. УФ-спектр (вода)  max268 nm ( max268 nm ( 9600). 1H-ЯМР-спектр (D2O, 9600). 1H-ЯМР-спектр (D2O,  , м.д.): 7.62 м (2Н, arom), 7.56 м (1Н, Н-6), , м.д.): 7.62 м (2Н, arom), 7.56 м (1Н, Н-6),7.32 м (3Н, Ph), 6.04 т (1Н, J=6.5 Гц, Н-1′); 6.24 м (1-Н, Н-1′); 5.18 м (1H, Н-4′); 3.64 д (2Н, J=9,0 Гц, CH2-P), 2.6-2.2 м (4Н, Н-3′, Н-2′); 1.98 с (3Н, 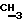 ). 31P ЯМР спектр (D2O, ). 31P ЯМР спектр (D2O,  , м.д.): 12,08 д ( , м.д.): 12,08 д ( -P, J -P, J – – = 34,5 Гц), 6,26 д ( = 34,5 Гц), 6,26 д ( -P, J -P, J – – = 13,86 Гц), -1,81 м ( = 13,86 Гц), -1,81 м ( -P). FAB-масс, m/z: 572 (М++Н), 589 (M++H+NH3).
Пример 8. 2′,3′-Дидезокси-4′-нор-4′-( -P). FAB-масс, m/z: 572 (М++Н), 589 (M++H+NH3).
Пример 8. 2′,3′-Дидезокси-4′-нор-4′-( -фенил -фенил , ,  -дибромметилендифосфонил- -дибромметилендифосфонил- -фосфонилметил-L-карбоаденозин (Соединение 8, B=Ade, R’=R”=H, Z=CH2, R”’=Ph, X’=X”=Br).
Синтез проводят по методике примера 1. Выход 0,33 ммоль, 66%. УФ-спектр (вода) -фосфонилметил-L-карбоаденозин (Соединение 8, B=Ade, R’=R”=H, Z=CH2, R”’=Ph, X’=X”=Br).
Синтез проводят по методике примера 1. Выход 0,33 ммоль, 66%. УФ-спектр (вода)  max268 nm ( max268 nm ( 14600), 1H ЯМР-спектр (D2O, 14600), 1H ЯМР-спектр (D2O,  , м.д.): 8.59 с (1Н, Н-2); 8.30 с (1Н, Н-8); 7.82 м (2Н, arom), 7.32 m (3Н, Ph), 4.95 т (1Н, J=6.5 Гц, Н-1′); 3.58 д (2Н, J=8,5 Гц, СН2-Р), 2.8-2.5 м (3Н, Н-3′, H-5 , м.д.): 8.59 с (1Н, Н-2); 8.30 с (1Н, Н-8); 7.82 м (2Н, arom), 7.32 m (3Н, Ph), 4.95 т (1Н, J=6.5 Гц, Н-1′); 3.58 д (2Н, J=8,5 Гц, СН2-Р), 2.8-2.5 м (3Н, Н-3′, H-5  ); 2.3-2.1 м (2Н, Н-2′); 1.92 м (1Н, H-5 ); 2.3-2.1 м (2Н, Н-2′); 1.92 м (1Н, H-5  ). 31Р-ЯМР-спектр (D2O, ). 31Р-ЯМР-спектр (D2O,  , м.д.): 11.82 д ( , м.д.): 11.82 д ( -P, J -P, J – – = 32,25 Гц); 0.26 м ( = 32,25 Гц); 0.26 м ( -P, Гц); 7.80 д ( -P, Гц); 7.80 д ( -P, J -P, J – – = 15,18 Гц). FAB-масс, m/z: 576 (М++Н).
Пример9.4′-( = 15,18 Гц). FAB-масс, m/z: 576 (М++Н).
Пример9.4′-( -Фенил- -Фенил- , ,  -дибромметилендифосфонил- -дибромметилендифосфонил- -метиленфосфонил)-2′,3′-дидезокси-2′,3′-дидегидро-4′-нор-L-карбоаденозин (Соединение 9, B=Ade, R’ и R” образуют двойную связь, Z=CH2, R”’=OPh, X’=X”=Br).
Синтез проводят по методике, аналогичной методике примера 1, исходя из 2′,3′-дидезокси-2′,3′-дидегидро-4′-нор-L-карбоаденозин-4′– -метиленфосфонил)-2′,3′-дидезокси-2′,3′-дидегидро-4′-нор-L-карбоаденозин (Соединение 9, B=Ade, R’ и R” образуют двойную связь, Z=CH2, R”’=OPh, X’=X”=Br).
Синтез проводят по методике, аналогичной методике примера 1, исходя из 2′,3′-дидезокси-2′,3′-дидегидро-4′-нор-L-карбоаденозин-4′– –метиленфосфоната и дибромметилендифосфоната бис(трибутиламмониевой) соли. Выход 58%.
УФ-спектр (вода) –метиленфосфоната и дибромметилендифосфоната бис(трибутиламмониевой) соли. Выход 58%.
УФ-спектр (вода)  max262 nm ( max262 nm ( 14200). 1H ЯМР-спектр (D2O, 14200). 1H ЯМР-спектр (D2O,  , м.д.): 8.18 с (1Н, Н-2); 8.16 с (1Н, Н-8); 7.68 м (2Н, Ph), 7.32 м (3Н, Ph), 6.13 м (1-Н, Н-3′); 5.92 м (1Н, Н-2′); 5.39 м (1Н, Н-1′); 4.66 с (1Н, Н-4′); 3.61 д (2Н, J=9,0 Гц, СН2-Р), 2.92 м(1Н, H-5 , м.д.): 8.18 с (1Н, Н-2); 8.16 с (1Н, Н-8); 7.68 м (2Н, Ph), 7.32 м (3Н, Ph), 6.13 м (1-Н, Н-3′); 5.92 м (1Н, Н-2′); 5.39 м (1Н, Н-1′); 4.66 с (1Н, Н-4′); 3.61 д (2Н, J=9,0 Гц, СН2-Р), 2.92 м(1Н, H-5  ); 1.96 м (1Н, H-5 ); 1.96 м (1Н, H-5  ). 31P ЯМР-спектр (D2O, ). 31P ЯМР-спектр (D2O,  , м. д. ): 11.6 д ( , м. д. ): 11.6 д ( -P, J -P, J – – = 35,10 Гц); 0.29 м ( = 35,10 Гц); 0.29 м ( -P); 10.7 д ( -P); 10.7 д ( -P, J -P, J – – = 16,3 Гц), FAB-масс, m/z: 582 (М++Н).
Пример 10. 2′,3′-Дидезокси-2′,3′-дидегидро-4′-( = 16,3 Гц), FAB-масс, m/z: 582 (М++Н).
Пример 10. 2′,3′-Дидезокси-2′,3′-дидегидро-4′-( -фениламино- -фениламино- , ,  -дифтор-метилендифосфонил- -дифтор-метилендифосфонил- -метиленфосфонил)-4′-норкарбоаденозин (Соединение 10, B= Ade, R’ и R” образуют двойную связь, Z=CH2, R”’=NHPh, X’=X”=F).
Синтез проводят по методике, аналогичной примеру 1, исходя из 2′,3′-дидезокси-2′,3′-дидегидро-4′-норкарбоаденозин-4′- -метиленфосфонил)-4′-норкарбоаденозин (Соединение 10, B= Ade, R’ и R” образуют двойную связь, Z=CH2, R”’=NHPh, X’=X”=F).
Синтез проводят по методике, аналогичной примеру 1, исходя из 2′,3′-дидезокси-2′,3′-дидегидро-4′-норкарбоаденозин-4′- -метиленфосфоната и дифторметилендифофоната бистрибутиламмониевой соли. Выход 26%.
УФ-спектр (вода) -метиленфосфоната и дифторметилендифофоната бистрибутиламмониевой соли. Выход 26%.
УФ-спектр (вода)  max260 nm ( max260 nm ( 14100). 1H ЯМР-спектр (D2O, 14100). 1H ЯМР-спектр (D2O,  , м.д.): 8.18 с (1Н, Н-2); 8.16 с (1H, Н-8); 7.68 м (2Н, Ph), 7.32 м (3Н, Ph), 6.24 м (1-Н, Н-3′); 5.99 m (1Н, Н-2′); 5.46 м (1Н, Н-1′); 4.66 с (1Н, Н-4′); 3.74 д (2Н, JCH,P=8.5 Гц, , м.д.): 8.18 с (1Н, Н-2); 8.16 с (1H, Н-8); 7.68 м (2Н, Ph), 7.32 м (3Н, Ph), 6.24 м (1-Н, Н-3′); 5.99 m (1Н, Н-2′); 5.46 м (1Н, Н-1′); 4.66 с (1Н, Н-4′); 3.74 д (2Н, JCH,P=8.5 Гц, 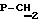 ), 2.86 i (1H, H-5 ), 2.86 i (1H, H-5  ); 1.90 м (1H, H-5 ); 1.90 м (1H, H-5  ). 31P-ЯMP-cпeктp (D2O, ). 31P-ЯMP-cпeктp (D2O,  , м.д.): 12,97 д ( , м.д.): 12,97 д ( -P, J -P, J – – = 33,5 Гц), 6,80 д ( = 33,5 Гц), 6,80 д ( -P, J -P, J – – = 13,32 Гц), -0,71 м ( = 13,32 Гц), -0,71 м ( -P) FAB-масс, т/z: 598 (М++Н).
Пример11.2′,3′-Дидeзoкcи-4′( -P) FAB-масс, т/z: 598 (М++Н).
Пример11.2′,3′-Дидeзoкcи-4′( -фeнил- -фeнил- , ,  -бpoммeтилeндифocфoнил- -бpoммeтилeндифocфoнил- -мeтилeн-фосфонил)-4′-нортимидин (Соединение 11, B=Thy, R’=R”=H, Z=O, R”’=PhO, X’= H, X”=Br).
Синтез проводят по аналогичной примеру 1 методике из 2′,3′-дидезокси-4′-нортимидин-4′- -мeтилeн-фосфонил)-4′-нортимидин (Соединение 11, B=Thy, R’=R”=H, Z=O, R”’=PhO, X’= H, X”=Br).
Синтез проводят по аналогичной примеру 1 методике из 2′,3′-дидезокси-4′-нортимидин-4′- -метиленфосфоната и бис(трибутил-аммонийной) соли фенилфосфонилбромметиленфосфоната. Выход 0,16 ммол, 32%. УФ-спектр (вода) -метиленфосфоната и бис(трибутил-аммонийной) соли фенилфосфонилбромметиленфосфоната. Выход 0,16 ммол, 32%. УФ-спектр (вода)  max268 нм ( max268 нм ( 9600), 1H-ЯМР-спектр (D2O, 9600), 1H-ЯМР-спектр (D2O,  , м.д.): 7.68 м (2Н, аrom), 7.32 м (3Н, Ph), 7.14 с (1H, Н-6); 6.14 т (1H, J=6.5 Гц, Н-1′); 5.56 м (1H, Н-4′); 3.57 д (2Н, jCH,P=8.5 Гц, , м.д.): 7.68 м (2Н, аrom), 7.32 м (3Н, Ph), 7.14 с (1H, Н-6); 6.14 т (1H, J=6.5 Гц, Н-1′); 5.56 м (1H, Н-4′); 3.57 д (2Н, jCH,P=8.5 Гц, 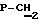 ); 2.7-2.2 м (4Н, Н-2′, Н-3′); 1.95 с (3Н, ); 2.7-2.2 м (4Н, Н-2′, Н-3′); 1.95 с (3Н, 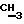 ). 31P-ЯMP-cпeктp (D2O, ). 31P-ЯMP-cпeктp (D2O,  , м.д.): 11,84 д ( , м.д.): 11,84 д ( -P, J -P, J – – = 35,0 Гц), 9,13 д ( = 35,0 Гц), 9,13 д ( -P, J -P, J – – = 13,55 Гц), 0,05 м ( = 13,55 Гц), 0,05 м ( -P). FAB-масс, m/z: 644 (М++Н), 661 (M++H+NH3).
Изучение ингибирования биосинтеза ДНК заявляемыми соединениями при катализе реакции ДНК-полимеразами проводили с использованием обратной транскриптазы ВИЧ [К. Ф. 2.7.7.49], а также концевой дезоксинуклеотидилтрансферазы из тимуса теленка [К.Ф. 2.7.7.31] (“Amersham”), ДНК-полимеразы -P). FAB-масс, m/z: 644 (М++Н), 661 (M++H+NH3).
Изучение ингибирования биосинтеза ДНК заявляемыми соединениями при катализе реакции ДНК-полимеразами проводили с использованием обратной транскриптазы ВИЧ [К. Ф. 2.7.7.49], а также концевой дезоксинуклеотидилтрансферазы из тимуса теленка [К.Ф. 2.7.7.31] (“Amersham”), ДНК-полимеразы  , ,  и и  из плаценты человека. Одноцепочечную ДНК фага М13тр10 выделяли из культуральной жидкости реципиентного штамма Е. coli K12XL1. Для ДНК-полимераз из плаценты человека. Одноцепочечную ДНК фага М13тр10 выделяли из культуральной жидкости реципиентного штамма Е. coli K12XL1. Для ДНК-полимераз  , ,  , ,  и обратной транскриптазы ВИЧ использовали одноцепочечную ДНК фага М13mp10 в качестве матрицы и в качестве праймера синтетический 2′-дезокситетрадекануклеотид (структура рабочей части комплекса показана на фиг. 1). Для концевой дезоксинуклеотидилтрансферазы использовали тот же праймер, но без матрицы.
Праймерный тетрадекануклеотид метили по 5′-положению с помощью и обратной транскриптазы ВИЧ использовали одноцепочечную ДНК фага М13mp10 в качестве матрицы и в качестве праймера синтетический 2′-дезокситетрадекануклеотид (структура рабочей части комплекса показана на фиг. 1). Для концевой дезоксинуклеотидилтрансферазы использовали тот же праймер, но без матрицы.
Праймерный тетрадекануклеотид метили по 5′-положению с помощью 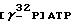 (уд. акт. 1500 Ки/ммоль, “Радиоизотоп”) при катализе полинуклеотидкиназой фага Т4 (“Amersham”).
Условия реакции выбирали в зависимости от свойств соответствующей ДНК-полимеразы (обратной транскриптазы).
Одноцепочечную ДНК фага М13тр10 (0,5 мкМ) гибридизовали с праймером, меченым 32P до 5′-концу (0,75 мкМ) в следующих буферах: 10 мМ Трис-НСl (рН 8,2), 5 мМ MgCl2, 40 мМ КСl, 1 мМ дитиотреитол (в случае обратной транскриптазы), 100 мМ какодилат натрия (рН 7,2), 10 мМ MgCl2, 1 мМ CaCl2 и 1 мМ дитиотреитол (в случае концевой дезоксинуклеотидилтрансферазы), 10 мМ Трис-НСl (рН 7,4), 6 мМ MgCl2 и 0,4 мМ дитиотреит (в случае ДНК-полимераз а и е), 10 мМ Трис-НСl (рН 8,5), 6 мМ MgCl2 и 0,4 мМ дитиотреитол (в случае ДНК-полимеразы (уд. акт. 1500 Ки/ммоль, “Радиоизотоп”) при катализе полинуклеотидкиназой фага Т4 (“Amersham”).
Условия реакции выбирали в зависимости от свойств соответствующей ДНК-полимеразы (обратной транскриптазы).
Одноцепочечную ДНК фага М13тр10 (0,5 мкМ) гибридизовали с праймером, меченым 32P до 5′-концу (0,75 мкМ) в следующих буферах: 10 мМ Трис-НСl (рН 8,2), 5 мМ MgCl2, 40 мМ КСl, 1 мМ дитиотреитол (в случае обратной транскриптазы), 100 мМ какодилат натрия (рН 7,2), 10 мМ MgCl2, 1 мМ CaCl2 и 1 мМ дитиотреитол (в случае концевой дезоксинуклеотидилтрансферазы), 10 мМ Трис-НСl (рН 7,4), 6 мМ MgCl2 и 0,4 мМ дитиотреит (в случае ДНК-полимераз а и е), 10 мМ Трис-НСl (рН 8,5), 6 мМ MgCl2 и 0,4 мМ дитиотреитол (в случае ДНК-полимеразы  ).
Исследование ингибиторных свойств соединений в бесклеточной системе с индивидуальным ферментом проводили в 6 мкл инкубационой смеси, содержащей 0,01 мкМ меченого праймер-матричного комплекса (фиг.1), исследуемое соединение, соответствующие природные 2′-дезоксинуклеозид-5′-трифосфаты и фермент (1 ед. акт. ДНК-полимераз ).
Исследование ингибиторных свойств соединений в бесклеточной системе с индивидуальным ферментом проводили в 6 мкл инкубационой смеси, содержащей 0,01 мкМ меченого праймер-матричного комплекса (фиг.1), исследуемое соединение, соответствующие природные 2′-дезоксинуклеозид-5′-трифосфаты и фермент (1 ед. акт. ДНК-полимераз  , ,  и и  , 2 единицы активности обратной транскриптазы или 3 ед. акт. концевой дезоксинуклеотидилтрансферазы) в соответствующем буфере (см. выше). Реакцию начинали добавлением фермента и проводили в течение 20 мин при 37oС. Для остановки реакции добавляли 3 мкл деионизованного формамида, содержащего 20 мкМ EDTA, 0,1%-ный бромфеноловый синий и 0,1%-ный ксиленцианол. Продукты реакции разделяли электрофорезом в 20%-ном денатурирующем ПААГ. Полученные гели подвергали радиоавтографии, используя рентгеновскую пленку Kodak XRP-5. Просчитывали радиоактивность соответствующих полос на геле и определяли концентрацию ингибитора, дающую 50% ингибирование элонгации цепи. Далее рассчитывалось соотношение этой концентрации к концентрации природного субстрата. Для сравнения использовали 3′-азидо-2′, 3′-дидезокситимидин-5′-трифосфат (AZTTP). Результаты приведены в таблице 1.
Как видно из табл. 1, все соединения обладают высокой активностью в подавлении синтеза ДНК при катализе обратной транскриптазой ВИЧ, но не влияют на синтез ДНК при катализе ДНК-полимеразами человека даже при концентрациях в 25-100 раз более высоких. Они несколько превосходят в этом отношении хорошо известный ингибитор этого фермента AZTTP.
Определение противовирусной активности проводили на клетках фибробластов мыши, инфицированных вирусным конструктом, содержащим обратную транскриптазу вируса лейкемии мышей Молони (Mo-MLV) (Шевелев Л.Я. др., Мол.биол., 1995, 29, N 5, 1114-1123).
Фибробласты крысы линии Ratl рассеивали на 4-луночные плашки Libro (Flow) 1:10. Через 2 суток клетки заражали вирусом pSG1, собранным со свежего монослоя клеток упаковщиков РАЗ17 и разведенным свежей средой в соотношении 1:10. Исследуемые соединения в 10-кратных серийных разведениях добавляли в культуральную среду в момент заражения. Через 1 сутки среду меняли на свежую и еще через 1 сутки фиксировали, окрашивали Xgal и подсчитывали количество колоний, окрашенных в голубой цвет и, следовательно, экспрессирующих , 2 единицы активности обратной транскриптазы или 3 ед. акт. концевой дезоксинуклеотидилтрансферазы) в соответствующем буфере (см. выше). Реакцию начинали добавлением фермента и проводили в течение 20 мин при 37oС. Для остановки реакции добавляли 3 мкл деионизованного формамида, содержащего 20 мкМ EDTA, 0,1%-ный бромфеноловый синий и 0,1%-ный ксиленцианол. Продукты реакции разделяли электрофорезом в 20%-ном денатурирующем ПААГ. Полученные гели подвергали радиоавтографии, используя рентгеновскую пленку Kodak XRP-5. Просчитывали радиоактивность соответствующих полос на геле и определяли концентрацию ингибитора, дающую 50% ингибирование элонгации цепи. Далее рассчитывалось соотношение этой концентрации к концентрации природного субстрата. Для сравнения использовали 3′-азидо-2′, 3′-дидезокситимидин-5′-трифосфат (AZTTP). Результаты приведены в таблице 1.
Как видно из табл. 1, все соединения обладают высокой активностью в подавлении синтеза ДНК при катализе обратной транскриптазой ВИЧ, но не влияют на синтез ДНК при катализе ДНК-полимеразами человека даже при концентрациях в 25-100 раз более высоких. Они несколько превосходят в этом отношении хорошо известный ингибитор этого фермента AZTTP.
Определение противовирусной активности проводили на клетках фибробластов мыши, инфицированных вирусным конструктом, содержащим обратную транскриптазу вируса лейкемии мышей Молони (Mo-MLV) (Шевелев Л.Я. др., Мол.биол., 1995, 29, N 5, 1114-1123).
Фибробласты крысы линии Ratl рассеивали на 4-луночные плашки Libro (Flow) 1:10. Через 2 суток клетки заражали вирусом pSG1, собранным со свежего монослоя клеток упаковщиков РАЗ17 и разведенным свежей средой в соотношении 1:10. Исследуемые соединения в 10-кратных серийных разведениях добавляли в культуральную среду в момент заражения. Через 1 сутки среду меняли на свежую и еще через 1 сутки фиксировали, окрашивали Xgal и подсчитывали количество колоний, окрашенных в голубой цвет и, следовательно, экспрессирующих  -галактозидазу E. coli, кодируемую вирусом pSG1 (Шевелев Л.Я. др., Мол. биол. , 1995, 29, N 5, 1114-1123). Результаты выражали в % зараженных клеток в присутствии исследуемого соединения по отношению к контролю в отсутствие этого соединения. Каждая точка является средней из 3 параллельных измерений в 2 независимых экспериментах. Стандартные отклонения не превышают 20%. Для сравнения использовали азидотимидин (AZT).
В таблице 2 показаны результаты подавления вируса, выраженные в концентрациях исследуемого соединения, подавляющих вирус на 50 и 90%.
Как видно из таблицы 2, антивирусная активность всех соединений соизмерима с таковой для азидотимидина (AZT) -галактозидазу E. coli, кодируемую вирусом pSG1 (Шевелев Л.Я. др., Мол. биол. , 1995, 29, N 5, 1114-1123). Результаты выражали в % зараженных клеток в присутствии исследуемого соединения по отношению к контролю в отсутствие этого соединения. Каждая точка является средней из 3 параллельных измерений в 2 независимых экспериментах. Стандартные отклонения не превышают 20%. Для сравнения использовали азидотимидин (AZT).
В таблице 2 показаны результаты подавления вируса, выраженные в концентрациях исследуемого соединения, подавляющих вирус на 50 и 90%.
Как видно из таблицы 2, антивирусная активность всех соединений соизмерима с таковой для азидотимидина (AZT)Скорость дефосфорилирования синтезированных соединений в сыворотке крови человека определяли, добавляя по 2,5 мкл 10 мМ растворов всех синтезированных соединений к 47,5 мкл 100% фетальной сыворотки человека. Растворы инкубировали при 37oС и через 2,5, 5, 10, 20, 30, 40, 60, мин, 2, 3, 4, 5, 8, 12, час, 2, 4, 7, и 14 суток, прибавляли по 50 мкл воды и 230 мкл метанола, встряхивали и оставляли на 30 мин при -20oС. Образцы центрифугировали 10 мин при 12000 об/мин, супернатанты концентрировали до 100 мкл и анализировали ВЭЖХ на колонке Nucleosil 120C18 (4  150 мм, 5 мкм) линейным градиентом метанола от 0 до 35% в 0,05 М КН2РO4-буфере за 25 мин, скорость потока 0,5 мл/мин. Для сравнения использовали 3′-азидо-2′,3′-дидезокситимидин-5′-фосфат и природные субстраты dTTP и dATP.
В таблице 3 представлены данные по скорости гидролиза заявляемых соединений в неразбавленной плазме крови человека, характеризующие их стабильность в этих условиях. Кроме того, даны времена удерживания соединений на твердой фазе при ВЭЖХ, что отражает степень их гидрофобности.
Из таблицы 3 видно, что время гидролиза половинного количества соединений 1-8 примерно в 2000 раз больше, чем для природных субстратов dTTP и dATP, а также AZTTP. При этом их гидрофобность, пропорциональная времени удерживания при ТСХ, значительно увеличивается, что облегчает их диффузию в клетки. 150 мм, 5 мкм) линейным градиентом метанола от 0 до 35% в 0,05 М КН2РO4-буфере за 25 мин, скорость потока 0,5 мл/мин. Для сравнения использовали 3′-азидо-2′,3′-дидезокситимидин-5′-фосфат и природные субстраты dTTP и dATP.
В таблице 3 представлены данные по скорости гидролиза заявляемых соединений в неразбавленной плазме крови человека, характеризующие их стабильность в этих условиях. Кроме того, даны времена удерживания соединений на твердой фазе при ВЭЖХ, что отражает степень их гидрофобности.
Из таблицы 3 видно, что время гидролиза половинного количества соединений 1-8 примерно в 2000 раз больше, чем для природных субстратов dTTP и dATP, а также AZTTP. При этом их гидрофобность, пропорциональная времени удерживания при ТСХ, значительно увеличивается, что облегчает их диффузию в клетки.
Формула изобретения
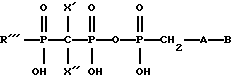 где В=тимин, аденин, урацил или 5-этилурацил; 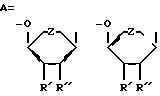 R’ – Н или N3; R” – Н или R’ и R” вместе образуют двойную связь; Z – O или CH2; R”’=Ph, OАlkyl, OPh, NHPh; X’=X”=Br, F; или Х’=H, a X”=Br как антивирусные агенты. РИСУНКИ
|
||||||||||||||||||||||||||
