Патент на изобретение №2182902
|
||||||||||||||||||||||||||
(54) ИНДЕНОИЛГУАНИДИН, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО
(57) Реферат: Изобретение относится к инденоилгуанидину формулы I, способу его получения, лекарственному средству на его основе. Соединения являются полезными для лечения сердечной аритмии. Кроме того, они используются в качестве кардиопротекторных агентов для млекопитающих. Также описан способ получения соединений. 3 с. и 3 з.п.ф-лы, 7 табл. 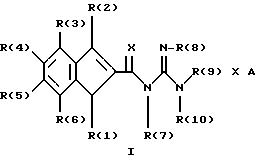
Изобретение относится к инденоилгуанидинам, к способу их получения, к их применению в качестве лекарственных средств, к их применению в качестве диагностирующих агентов и к содержащим их лекарственным средствам. Более конкретно, настоящее изобретение относится к инденоилгуанидинам, имеющим общую формулу I: 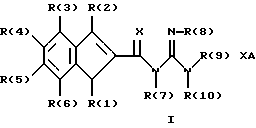 где R(1) и R(2) отдельно или вместе являются водородом, алкилом, содержащим 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода; циклоалкилом, содержащим 3, 4, 5 или 6 атомов углерода, O-алкилом, содержащим 1, 2, 3 или 4 атома углерода, O-С(= O) алкилом, содержащим 1, 2, 3 или 4 атома углерода, СmН2m-NR(12)R(13), где R (12) и R(13) независимо друг от друга являются водородом или алкилом, содержащим 1, 2, 3 или 4 атома углерода, m равно нулю, 2, 3 или 4; NH-C(=O)-NH2, С(=O)-O-алкилом, имеющим 1, 2, 3 или 4 атома углерода, С(= O)-NН2, С(= O)-NН-алкилом, содержащим 1, 2, 3 или 4 атома углерода, С(=O)-N(алкилом)2, имеющим 1, 2, 3 или 4 атома углерода в каждой из алкильных групп, алкенилом, содержащим 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода, алкинилом, содержащим 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода, алкиларилом, содержащим 1, 2, 3 или 4 атомов углерода в алкильной группе, алкениларилом, содержащим 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода в алкенильной группе, алкиниларилом, содержащим 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода в алкинильной группе, С1-С4-алкилзамещенным арилом, C1-С4-алкилгетероарилом, С1-С4-алкенилгетероарилом, аминоалкиларилом, содержащим 1, 2, 3 или 4 атомов углерода в алкильной группе, замещенным арилом, гетероарилом или замещенным гетероарилом; R(3), R(4), R(5) и R(6) отдельно или вместе являются водородом, алкилом, содержащим 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода, O-алкилом, имеющим 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода, галогенами (такими как F, Cl, Вr, I), ОН, арилом, замещенным арилом, гетероарилом, замещенным гетероарилом, O-низшим алкилом, O-арилом, O-низшим алкиларилом, O-замещенным арилом, O-низшим алкилзамещенным арилом, O-С(=O)-С1-С4-алкиларилом, O-С(= O)-NН-С1-С4-алкилом, O-С(= O)N(С1-С4-алкилом)2, NO2, СN, СF3, NН2, NН-С(= O)-С1-С4-алкилом, NН-С(=O)-NН2, СООН, C(=O)-O-C1-C4-алкилом, С(=O)-NН2, С(= O)-NH-C1-C4-алкилом, С(= O)-N(С1-С4-алкилом)2, С1-С4-СООН, С1-С4-алкил-С(= O)-O-С1-С4-алкилом, SO3H, SO2-алкилом, SO2-алкиларилом, SO2-N-(алкилом)2, SO2-N(алкил) (алкиларилом), С(= O)-R(11), С1-С10-алкил-C(= O)-R(11), С2-С10-алкенил-С(= O)-R(11), С2-С10-алкинил-С(= O)-R(11), NH-C(= O)-C1-C10-алкил-С(=O)-R(11), O-С1-С11-алкил-С(=O)-R(11), R (11) является C1-C4-алкилом, С1-С4-алкинилом, арилзамещенным арилом, NН2, NH-C1-C4-алкилом, N-(С1-С4-алкилом)2, SO3H, SO2-алкилом, SO2-алкиларилом, SO2-N-(алкилом)2, SO2-N(алкил) (алкиларилом); Х является О, S или NH; R (7), R (8), R (9) и R (10) отдельно или вместе являются водородом, алкилом, циклоалкилом, арилом, алкиларилом или R (8) и R (9) вместе могут быть частью 5-, 6- или 7-членного гетероциклического кольца; А отсутствует или является нетоксичной органической или минеральной кислотой. Типичными кислотами являются хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, метансульфоновая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, уксусная кислота, молочная кислота, салициловая кислота, бензойная кислота, никотиновая кислота, фталевая кислота, стеариновая кислота, олеиновая кислота и щавелевая кислота. Во всем описании, если нет других указаний, следующие термины должны иметь следующие значения. “Алкил” означает насыщенный алифатический углеводород, который может быть либо с прямой, либо с разветвленной цепью. Предпочтительные алкильные группы имеют не более 12 атомов углерода и могут быть метилом, этилом и структурными изомерами пропила, бутила, пентила, гексила, гептила, октила, нонила, децила, ундецила и додецила. “Низший алкил” означает алкильную группу, как указано выше, имеющую 1-6 атомов углерода. Примерами низших алкильных групп являются метил, этил, н-пропил, изопропил, бутил, втор.-бутил, трет.-бутил, н-пентил, изопентил и неопентил. “Циклоалкил” означает алифатическую моноциклическую насыщенную карбоциклическую группу. Предпочтительные группы имеют около 3-6 атомов углерода, и типичные группы включают циклопропил, циклопентил и циклогексил. “Алкенил” означает ненасыщенный алифатический углеводород. Предпочтительные группы имеют не более 12 атомов углерода. Типичные группы включают любые структурные и геометрические изомеры этенила, пропенила, бутенила, пентенила, гексенила, гептенила, октенила, ноненила, деценила, ундеценила и додеценила или бутадиенила, пентадиенила и т.п. “Низший алкенил” означает алкенил с около 2-6 атомами углерода. Предпочтительные группы включают этенил, пропенил, бутенил, изобутенил и все структурные и геометрические их изомеры. “Алкинил” означает ненасыщенный алифатический углеводород. Предпочтительные группы имеют не более чем около 12 атомов углерода и содержат одну или более тройных связей, включая любые структурные изомеры этинила, пропинила, бутинила, пентинила, гексинила, гептинила, октинила, нонинила, децинила, ундецинила, додецинила и т.п. “Низший алкинил” означает алкинил с около 2-6 атомами углерода. Предпочтительные группы включают структурные изомеры пропинила, бутинила и пентинила. “Арил” означает фенил и замещенный фенил. “Замещенный фенил” означает фенильную группу, в которой один или более атомов водорода замещены одинаковыми или различными заместителями, включая галоген, низший алкил, низший алкенил, низший алкинил, галоиднизший алкил, нитро, амино, ациламино, гидроксил, карбоксил, низший алкокси, арил низший алкокси, ацилокси, низший алканоил, циано, амидо, низший алкиламино, низший алкоксиамино, аралкиламино или низший алкилсульфонил. “Аралкил” означает алкильную группу, в которой один или несколько атомов водорода замещены арильной группой. Предпочтительными группами являются фенилалкил и замещенный фенилалкил. “Фенилалкил” означает алкильную группу, замещенную фенильной группой. “Замещенный фенилалкил” означает фенилалкильную группу, в которой один или несколько фенильных водородов замещены как указано выше в отношении замещенного фенила. “Замещенный фенилалкенил” означает фенилалкенильную группу, в которой фенильная группа замещена как указано выше в отношении замещенного фенила. “Гетероциклическое кольцо” или “гетероцикл” означает 3-, 5-, 6- или 7-членный цикл, имеющий 1-3 гетероатома, которые могут быть азотом, кислородом или серой, включая пиррол, пирролидин, пиридон, гептаметилениминил, пиразол, пиридил, пиримидил, пиразолил, имидазолил, изоксазолил, фурил, тиенил, оксазолил, тиазолил, пиперидил, морфолинил, оксазолидинил, тиазолидинил, пиразолидинил, имидазолидинил, пиперазинил, тиаморфолинил, азепинил и этилениминил. “Замещенный гетероцикл” означает гетероцикл, в котором один или несколько водородов у кольцевых углеродов замещены заместителями как указано выше в отношении замещенного фенила. Термин “галоид” или “галоген” включает все четыре галогена, а именно фтор, хлор, бром и йод. Галоидалкилы, галоидфенил и галоидзамещенные пиридильные группы имеют более одного галоидного заместителя, которые могут быть одинаковыми или различными, такие как трифторметил, 1-хлор-2-бромэтил, хлорфенил и 4-хлорпиридил. “Ацил” означает органический карбонильный радикал низшей алкановой кислоты. Предпочтительные ацильные группы представляют собой алканоильные группы, такие как ацетил и пропионил. “Ароил” означает ароматический кислотный радикал, такой как бензоил, толуоил. “Низший алканоил” означает ацильный радикал низшей алкановой кислоты, такой как ацетил, пропионил, бутирил, валерил, стеароил и т.п. “Алкокси” означает алкоксигруппу и включает оксиалкильные группы. Предпочтительными низшими алкоксигруппами являются метокси, этокси, н-пропокси и изопропокси, изобутокси, н-бутокси и трет.бутокси. Нетоксичные органические и минеральные кислоты А, образующие соли присоединения, являются, например, хлористоводородной кислотой, бромистоводородй кислотой, серной кислотой, азотной кислотой, фосфорной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, уксусной кислотой, молочной кислотой, салициловой кислотой, бензойной кислотой, никотиновой кислотой, фталевой кислотой, стеариновой кислотой, олеиновой кислотой и щавелевой кислотой. Предпочтительными соединениями изобретения являются соединения формулы II: 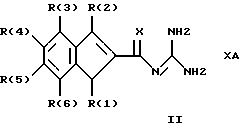 где R (1) является водородом, С1-С4-алкилом, NR (12) R (13), где R (12) и R (13), независимо друг от друга, являются водородом или алкилом, имеющим 1, 2, 3 или 4 атома углерода; С1-С4-алкил-NН2, арил-алкил-NН2, O-алкилом, С(=O)-NН(низшим алкилом), С(=O)-N (низшим алкилом)2, С(=O)-O-низшим алкилом, замещенным алкилом, арилом, замещенным арилом; R (2) является водородом, С1-С4-алкилом, С1-С4-алкил-NH2, арил-алкил-NH2, замещенным алкилом, арилом, замещенным арилом; R (3), R (4), R (5) и R (6) отдельно или вместе являются F, Cl, Вr, I, ОН, O-низшим алкилом, O-арилом, O-низшим алкил-арилом, O-замещенным арилом, O-низшим алкилзамещенным арилом, СООН, С(=O)-O-низшим алкилом, CN, CF3, NH2, NH-низшим алкилом, N(низшим алкилом)2, O-низший алкил-NН2, О-низший алкил-NН(низшим алкилом), O-низший алкил-N (низшим алкилом)2, SO2 – низшим алкилом, SO3H, SO2-NH2, SO2-NН-низшим алкилом, SO2-N-(низшим алкилом)2, гетероарилом, замещенным гетероарилом, предпочтительными группами для гетероарила являются пиридил, тиенил, фурил, хинил и изохинил; предпочтительными заместителями для замещенного гетероарила являются F, Сl, Вr, I, ОН, NН2, O-низший алкил, O-низший алкиларил, СООН, С(=O)-O-низший алкил, CN, NН-низший алкил, N(низший алкил)2, SО3Н, SO2-NН2, SO2-NН-низший алкил, SO2-N(низший алкил)2; Х является O, S или NH, но предпочтительно Х является О. Соединения по настоящему изобретению могут содержать асимметричные центры, изобретение относится к соединениям как S, так и R конфигурации. Соединения могут существовать как оптические изомеры, рацематы и их смеси. Типичные примеры соединений по настоящему изобретению приведены в табл. 1, 2 и 3. 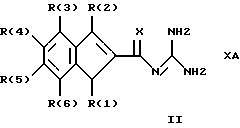 где R (1) и R (3) являются H, R (2) является СН3, Х является О в формуле II. Соединения формулы I являются замещенными ацилгуанидинами. Наиболее ярким представителем ацилгуанидином является пиразиновое производное амилорида, которое используется в терапии в качестве калийсохраняющего диуретика. В литературе описаны многочисленные другие соединения амилоридного типа, такие как, например, диметиламилорид или этилизопропиламилорид. Более того, были описаны исследования, в которых отмечаются противоаритмические свойства амилорида [Circulation, 79? 1257-1263 (1989)]. Однако его широкому применению как противоаритмического агента препятствует тот факт, что его действие является слабым и сопровождается противогипертензивным и сальуретическим действием, а эти побочные эффекты являются нежелательными при лечении расстройств сердечного ритма. Указания на противоаритмические свойства амилорида также были получены в экспериментах на изолированном сердце животных. [Eur. Heart. I. 9. {supplement I}: 167 (1983) (book of abstracts)]. Так, например, было обнаружено на сердцах крыс, что амилоридом можно полностью подавить искусственно вызванную вентрикулярную фибрилляцию. На этой модели вышеупомянутое производное амилорида этилизопропиламилорид является даже более мощным, чем амилорид. Бензоилгуанидины, обладающие противоаритмическими свойствами, описаны в Европейской заявке на патент 416499, выложенной для открытого ознакомления. В патенте США 3780027 описаны ацилгуанидины, которые значительно отличаются от соединений формулы I согласно изобретению, описанных здесь, тем, что они являются тризамещенными бензоилгуанидинами, которые происходят по своей схеме замещения из коммерчески доступных диуретиков, таких как буметанид и фуросемид, и имеют аминогруппу, которая является существенной для мягкого сальдиуретического действия, в положении 2 или 3 по отношению к карбонилгуанидиновой группе. Для этих соединений указывалась соответственно мощная сальдиуретическая активность. В Circulation 79, 1257-1263 описаны противоаритмические свойства амилорида – молекулы, содержащей ацилгуанидиновый фрагмент. В патентах США 37802, 734904 и 4544670 также описаны ацилгуанидины. Они относятся к ацилгуанидинам, у которых гетероциклический /Circulation/ или фенильный /патенты США/ остаток присоединен к ацилгуанидиновому фрагменту. В настоящем изобретении гетероциклический или ароматический остаток отделен от ацилгуанидинового фрагмента этиленовой связью в транс-геометрии в форме пятичленного карбоциклического кольца. Было обнаружено, что эти соединения обладают очень хорошими противоаритмическими свойствами. Эти соединения обладают значительным преимуществом по сравнению с обычно доступными противоаритмическими лекарственными средствами и используются как кардиопротекторные соединения для лечения инфаркта, а также для лечения стенокардии. Неожиданно оказалось, что соединения согласно изобретению не имеют нежелательных вредных сальдиуретических свойств, но обладают очень хорошими противоаритмическими свойствами, так что они могут быть использованы для лечения сердечных заболеваний, таких как симптомы кислородной недостаточности. Благодаря их фармакологическим свойствам они прекрасно подходят в качестве противоаритмических лекарственных средств, имеющих кардиопротекторную компоненту для профилактики инфаркта и лечения инфаркта и для лечения стенокардии, где они также профилактически ингибируют или сильно снижают патофизиологические процессы при развитии ишемически вызванного поражения, в частности инициации ишемически вызванной сердечной аритмии. Благодаря их защитному действию против гипоксической и ишемической ситуации соединения формулы I согласно изобретению в результате ингибирования механизма Nа+/Н+ клеточного обмена могут быть использованы в качестве лекарственных средств для лечения любого острого или хронического поражения, вызванного ишемией или заболеваниями, таким образом индуцированными первично или вторично. Это относится к их применению в качестве лекарственных средств для хирургического вмешательства, например трансплантации органов, где соединения могут быть использованы как для защиты органов донора и в процессе удаления, для защиты удаленных органов, например, во время обработки или хранения их в физиологических жидких растворах, так и во время пересадки в организм реципиента. Соединения также являются ценными лекарственными средствами, которые обладают защитным действием при проведении ангиопластических хирургических вмешательств, например, на сердце, а также на периферических сосудах. В соответствии с их защитным действием против ишемически вызванного поражения соединения также пригодны в качестве лекарственных средств для лечения ишемии нервной системы, в частности ЦНС, где они пригодны, например, для лечения апоплексии или отека мозга. Кроме того, соединения формулы I также пригодны для лечения различных шоков, таких как, например, аллергический, кардиогенный, гиповолемический и бактериальный шок. Соединения формулы I согласно изобретению, кроме того, отличаются мощным ингибирующим действием на пролиферацию клеток, например пролиферацию фибробластных клеток и пролиферацию клеток гладкой сосудистой мышцы. Следовательно, соединения формулы I являются, вероятно, ценными лекарствами при заболеваниях, в которых первично или вторично вызвана пролиферация клеток, и, следовательно, они могут быть использованы в качестве противосклеротических средств и в качестве агентов, препятствующих диабетическим осложнениям, раковым заболеваниям, фибротическим заболеваниям, таким как легочный фиброз, фиброз печени или фиброз почек, и гипертрофии и гиперплазии органов, в частности гиперплазии простаты или гипертрофии простаты. Соединения согласно изобретению являются эффективными ингибиторами клеточного антипорта натрий/протон (Nа+/Н+ обмен), который при многочисленных заболеваниях (эссенциальная гипертония, атеросклероз, диабет и т.п.) также увеличивается в тех клетках, которые легко доступны для измерений, таких как, например, в эритроцитах, тромбоцитах и лейкоцитах. Следовательно, соединения согласно изобретению пригодны в качестве замечательного и простого научного инструмента, например, при их применении в качестве диагностического агента для определения и дифференциации некоторых форм гипертонии, но также атеросклероза, диабета, пролиферативных заболеваний и т.п. Следовательно, соединения формулы I пригодны для превентивной терапии для профилактики источника высокого кровяного давления, например эссенциальной гипертонии. Настоящее изобретение также относится к способу получения соединений формулы I. Получение соединений изобретения иллюстрируется, но не ограничивается получением типичных соединений по изобретению. Синтез соединений формулы I, где R (2) = другой, чем Н, осуществляют через промежуточный продукт формулы III: 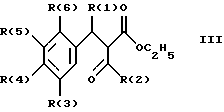 который, в свою очередь, получают известными для специалистов способами. Один из этих способов заключается в генерировании аниона на активированном метилене с помощью NаН/ТГФ с последующим алкилированием с использованием замещенных бензилбромидов. Соединения формулы III превращают в 3-замещенные инден-2-карбоновые кислоты формулы IV путем обработки концентрированной серной кислотой при комнатной температуре в течение 10-12 часов с последующей обработкой водой. Синтез соединений формулы I, где R (2) = Н, осуществляют через промежуточный продукт V: 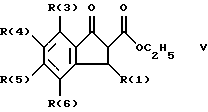 который, в свою очередь, получают известными для специалистов способами синтеза. Один из этих способов заключается в генерировании аниона на активированном метилене, соседним с карбоксильной группой, используя бутиллитий, с последующим ацилированием с использованием этилхлорформата. Альтернативно, тот же самый продукт может быть получен с использованием способа енаминового ацилирования карбонильных соединений. Соединения формулы V превращают в инден-2-карбоновые кислоты формулы IV: 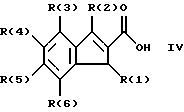 путем восстановления карбонильной группы боргидридом натрия с последующей дегидратацией, катализируемой кислотой /n-толуолсульфоновая кислота/ в сухом бензоле. Значения R (1), R (2), R (3), R (4), B (5) и R (6) в формулах III, IV и в формуле VI 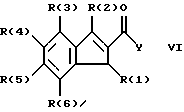 являются такими же, как определено выше для формулы I. В формуле V R (1), R (3), R (4), R (5) и R (6) имеют те же значения, что были определены для формулы I. Изобретение также относится к способу получения соединений формулы I, который заключается во взаимодействии соединений формулы VI со свободным гуанидином или с соединением формулы VII: 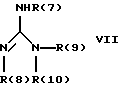 в которой R (7), R (8), R (9) и R (10) имеют значения, указанные ранее для формулы I, а Y является отщепляемой группой, которая может быть легко замещена нуклеофилом. Активированные производные кислоты формулы VI, в которой Y является алкоксигруппой, предпочтительно метоксигруппой, активированной феноксигруппой, фенилтио, метилтио, 2-пиридилтиогруппой или азотистым гетероциклом, таким как имидазолил, могут быть получены из хлорангидрида кислоты (формула VI: Y = С1), который, в свою очередь может быть получен из кислоты формулы IV обработкой тионилхлоридом. Могут быть использованы другие методы активирования сложных эфиров, которые известны в области пептидов для активации кислоты при реакциях связывания. Имидазолиды формулы VI, Y = имидазолиды, также могут быть получены из соединения формулы IV обработкой его 1,1-карбонилдиимидазолом [C.Staab. Andew. Chem. Int Eng. End. 351-367 /1962/]. Соединение формулы VI (Y=С1) при обработке соединения формулы VII в условиях реакции Шоттен-Баума также дает соединение формулы I. Может быть получен другой смешанный ангидрид формулы VI, такой как при взаимодействии с ClCOOEt, тозилхлоридом, триэтилфосфорилхлоридом, в присутствии триэтиламина или любого другого основания в инертном растворителе. Активация СООН-группы в соединениях формулы IV также может быть достигнута c DСС. Другие способы получения активированных производных карбоновых кислот типа формулы VI приведены с указанием на литературный источник в J. March, Advanced Organic Chemistry, 3 rd Edition (John Wiley and Son, 1985), с. 350. Реакция связывания соединений формул VI и VII может быть проведена различными путями в протонных или апротонных полярных растворителях, но предпочтительны инертные органические растворители. В этой связи метанол, ТГФ, ДМФ, N-метилпирролидон, ГМФА и т.п. при температуре между комнатной и температурой кипения этих растворителей особенно пригодны для взаимодействия соединения формулы VI (Y=ОМе) с гуанидином. Взаимодействие соединений формулы VI с солью свободного гуанидина удобно проводить в инертных апротонных растворителях, таких как ТГФ, диметоксиэтин, ДМФ или диоксан. В случае, когда соединение формулы IV непосредственно обрабатывают карбонилдиимидазолом для активации карбоксильной группы, используют апротонные полярные растворители, такие как ДМФ, диметоксиэтин, с последующим прибавлением соединения формулы VII. Соединения формулы I могут быть преобразованы в фармакологически приемлемые соли присоединения кислот с примерами солей, как описано ранее в этом описании. Активные соединения по настоящему изобретению могут быть введены перорально, парентерально, внутривенно, ректально или путем ингаляции, предпочтительный путь введения зависит от конкретных клинических требований по заболеванию. В этой связи соединения формулы I также могут быть использованы сами по себе или вместе с вспомогательными лекарственными средствами как в ветеринарии, так и при лечении людей. Какие вспомогательные лекарственные средства пригодны для желаемой фармацевтической рецептуры, определяет специалист на основании своего опыта. Могут быть использованы в дополнение к растворителям гелеобразующие агенты, основы суппозиториев, вспомогательные компоненты для таблеток и другие носители активного соединения, антиоксиданты, диспергаторы, эмульгаторы, противовспенивающие агенты, корректоры вкуса, консерванты, солюбилизаторы или красители. В форме для перорального использования активные соединения смешивают с добавками, пригодными для этой цели, такими как наполнители, стабилизаторы или инертные разбавители, и готовят обычными методами формы, пригодные для введения, такие как таблетки, таблетки с покрытием, твердые желатиновые капсулы, водные, спиртовые или масляные растворы. Инертными носителями, которые могут быть использованы, являются гуммиарабик, магнезия, карбонат магния, фосфат калия, лактоза, глюкоза или крахмал, в частности кукурузный крахмал. В этом случае препарат может быть как в виде сухих, так и в виде влажных гранул. Подходящими масляными наполнителями или растворителями являются, например, растительные или животные масла, такие как подсолнечное масло или жир тресковой печени. Для подкожного или внутривенного введения активные соединения при желании вместе с обычно используемыми для этой цели веществами, такими как солюбилизаторы, эмульгаторы или другие вспомогательные вещества, вводят в раствор, суспензию или эмульсию. Возможными растворителями являются, например, вода, физиологический солевой раствор или спирты, например этанол, пропанол, глицерин, а также растворы сахаров, такие как растворы глюкозы или маннита, или, альтернативно, смеси вышеупомянутых различных растворителей. Фармацевтическими препаратами, пригодными для введения в виде аэрозолей или спреев, являются, например, растворы, суспензии или эмульсии активного соединения формулы I в фармацевтически приемлемом растворителе, таком как, в частности, этанол или вода, или в смеси таких растворителей. Если требуется, состав также может содержать другие фармацевтическре вспомогательные вещества, такие как поверхностно-активные вещества, эмульгаторы и стабилизаторы, а также газ-пропелент. Такой препарат обычно содержит активное соединение при концентрации порядка 0,1-10, в частности, примерно 0,3-3 мас.%. Дозировка вводимого активного соединения формулы I и частота введения зависят от мощности и длительности действия использованных соединений, а, кроме того, также от природы и тяжести заболевания, которое лечат, и от пола, возраста, массы и индивидуальной восприимчивости млекопитающего, подлежащего лечению. В среднем дневная доза соединения формулы I для пациента массой 75 кг составляет, по крайней мере, 0,001 мг, предпочтительно от 0,01 мг до не более 10 мг, предпочтительно не более 1,0 мг на кг массы. При остром начале болезни, например сразу после перенесенного сердечного инфаркта, также могут быть необходимы еще более высокая и, более того, более частая дозировки, например до 4 индивидуальных доз в день. В частности, при внутривенном введении, например, пациенту с инфарктом в отделении интенсивной терапии может быть необходимо до 100 мг в день. Экспериментальная часть Описывается синтез типичных представителей, 3-метилиден-2-оилгуанидин-монохлорида (соединение 1 формулы I таблицы 1) и инден-2-оилгуанидин-метансульфоновой кислоты (соединение 13 формулы I таблицы 2), другие соединения также были синтезированы, используя ту или иную последовательность. А. Синтез соединения 1 таблицы 1: а. Синтез соединений формулы III Дважды промывают гексаном /2  50 мл/ 13,8 г /0,6 моля/ NаН и суспендируют в 250 мл свежеперегнанного ТГФ. Затем осторожно добавляют по каплям 75 мл /избыток/ этилацетата, в то время как приемную колбу охлаждают до -10oС. По окончании прибавления смесь перемешивают 2 часа при -10oС и 30 минут при комнатной температуре. Прибавляют по каплям при комнатной температуре к вышеуказанному раствору 51,0 г /0,3 моля/ бензилбромида. Реакционную смесь перемешивают всю ночь при комнатной температуре. Реакцию заканчивают на следующий день, выливая в ледяную воду, доводят до нейтрального рН и экстрагируют эфиром/этилацетатом. Объединенные эфир/этилацетатные экстракты промывают рассолом и сушат над сульфатом натрия. После удаления растворителя путем осторожной вакуумной отгонки получают этилбензилацетоацетат, т. кип. 276oС.
ИК-спектр /чистый/, см-1: 290-3050, 1690-1760 /широкая/, 1655.
ЯМР-спектр /CDCl3/ 50 мл/ 13,8 г /0,6 моля/ NаН и суспендируют в 250 мл свежеперегнанного ТГФ. Затем осторожно добавляют по каплям 75 мл /избыток/ этилацетата, в то время как приемную колбу охлаждают до -10oС. По окончании прибавления смесь перемешивают 2 часа при -10oС и 30 минут при комнатной температуре. Прибавляют по каплям при комнатной температуре к вышеуказанному раствору 51,0 г /0,3 моля/ бензилбромида. Реакционную смесь перемешивают всю ночь при комнатной температуре. Реакцию заканчивают на следующий день, выливая в ледяную воду, доводят до нейтрального рН и экстрагируют эфиром/этилацетатом. Объединенные эфир/этилацетатные экстракты промывают рассолом и сушат над сульфатом натрия. После удаления растворителя путем осторожной вакуумной отгонки получают этилбензилацетоацетат, т. кип. 276oС.
ИК-спектр /чистый/, см-1: 290-3050, 1690-1760 /широкая/, 1655.
ЯМР-спектр /CDCl3/  : 1,25 /т, 3Н, СН2СН3/, 2,25 /с, 3Н, COCH3/, 3,20 /д, 2Н, бензильный СН2/, 3,8 /т, 1Н, СОСНСО/, 4,20 /к, 2Н, ОСН2СН3/, 7,15-7,35 /м, 5Н, Аr-Н/.
б. Синтез соединений формулы IV : 1,25 /т, 3Н, СН2СН3/, 2,25 /с, 3Н, COCH3/, 3,20 /д, 2Н, бензильный СН2/, 3,8 /т, 1Н, СОСНСО/, 4,20 /к, 2Н, ОСН2СН3/, 7,15-7,35 /м, 5Н, Аr-Н/.
б. Синтез соединений формулы IVПрибавляют 37 г этилбензилацетоацетата к смеси 360 г 98%-ной серной кислоты и 15 г воды, охлажденной до -2oС, в течение 45 минут при интенсивном перемешивании. Раствор теперь темно-красновато-коричневый перемешивают при oС в течение 2 часов, а затем всю ночь при 15-20oС, затем его выливают в лед с водой /2,0 л/. Эту смесь нагревают до 50-60oС для коагуляции шлама, а затем фильтруют и обрабатывают. 3-метилиден-2-карбоновую кислоту очищают хроматографией на колонке с последующей перекристаллизацией, т.пл. 200oС. ИК-спектр /KBr/, см-1: 2900-3100 /широкая/, 1640-1680, 1600. ЯМР-спектр /CDCl3/  : 2,45 /с, 3Н, CH3/, 3,55 /с, 2Н, СН2/, 7,20-7,40 /м, 4Н, Аr-Н/.
Анализ: : 2,45 /с, 3Н, CH3/, 3,55 /с, 2Н, СН2/, 7,20-7,40 /м, 4Н, Аr-Н/.
Анализ:Вычислено для С11Н10O2: С 76,99; Н 5,79% Найдено: С 76,43; Н 5,86% в. Синтез соединений формулы I Кипятят с обратным холодильником 1,0 г 3-метилен-2-карбоновой кислоты и 5 мл тионилхлорида в течение 4 часов. Осторожное удаление растворителя путем отгонки при пониженном давлении дает 3-метилиден-2-оилхлорид. Прибавляют по каплям растворенный в ТГФ хлорангидрид кислоты в смесь гуанидина и гидроксида натрия при комнатной температуре в течение 10 минут и перемешивают 1 час. Реакцию заканчивают обычным путем и очищают продукт хроматографией на колонке. Получают 3-метилиден-2-оилгуанидин-моногидрохлорид при растворении свободного основания в метаноле с последующим добавлением эфирного НСl до рН 2,0 и перемешиванием. Соль осаждается при охлаждении на ледяной бане. Белый кристаллический порошок, т. пл. 250-251oС. ИК-спектр /KBr/, см-1: 3100-3350 /широкая/, 1690, 1655. ЯМР-спектр /CDCl3/  : 2,45 /с, 3Н, CH3/, 4,0 /с, 2Н, СН2/, 7,4-7,7 /м, 4Н, Аr-Н/, 8,4 /шир. с, 2Н, NН2, обмениваемый с D2О/.
Анализ: : 2,45 /с, 3Н, CH3/, 4,0 /с, 2Н, СН2/, 7,4-7,7 /м, 4Н, Аr-Н/, 8,4 /шир. с, 2Н, NН2, обмениваемый с D2О/.
Анализ:Вычислено для С12Н16O2N2Сl: С 53,42, Н 5,90, N 15,57, Cl 13,16% Найдено: С 53,12, Н 5,42, N 15,94, Cl 13,68% Б. Синтез соединения 13 в таблице 2: г. Синтез соединений формулы V Растворяют 1,5 г /11,36 ммоля/ 1-инданона в сухом ТГФ в трехгорлой колбе, снабженной подводом азота, перегородкой и предохранительной трубкой. Колбу охлаждают до -20oС в течение 10 минут. Затем прибавляют 11,37 мл /12,48 ммоля/ бутиллития по каплям через перегородку, используя шприц. Реакционную смесь оставляют при -20oС на 45 минут, а затем прибавляют по каплям 1,08 мл /10 ммолей/ этилхлорформата, используя шприц. Реакционную смесь перемешивают при -20oС в течение 30 минут и медленно доводят до комнатной температуры примерно за 1 час. Реакционную смесь обрабатывают, выпаривая ТГФ, и хроматографируют продукт, получают 2-карбэтокси-1-инданон. ЯМР-спектр /СDСl3/  : 1,25 /т, 3Н, OCH2CH3/, 3,45 /д, 2Н, бензильный СН2/, 3,65 /т, 1Н, СОСНСО/, 4,2 /к, 2Н, ОСН2СН3/, 7,4-7,5 /м, 4Н, Аr-Н/.
д. Синтез соединений формулы IV : 1,25 /т, 3Н, OCH2CH3/, 3,45 /д, 2Н, бензильный СН2/, 3,65 /т, 1Н, СОСНСО/, 4,2 /к, 2Н, ОСН2СН3/, 7,4-7,5 /м, 4Н, Аr-Н/.
д. Синтез соединений формулы IVРастворяют 2-карбэтокси-1-инданон в сухом метаноле при комнатной температуре, при которой прибавляют тремя порциями боргидрид натрия, продолжая перемешивать реакционную смесь. Затем реакционную смесь перемешивают 30 минут, после чего отфильтровывают твердый продукт и фильтрат выпаривают досуха. Остаток растворяют в бензоле, к нему прибавляют каталитическое количество п-толуолсульфоновой кислоты и перемешивают реакционную смесь в течение часа. Отфильтровывают п-толуолсульфоновую кислоту и концентрируют фильтрат, получая этил-инден-2-карбоксилат. Этил-инден-2-карбоксилат растворяют в метаноле и прибавляют 1,0 эквивалент водного раствора гидроксида натрия и перемешивают реакционную смесь всю ночь. На следующий день реакцию заканчивают, выпаривая метанол, затем разбавляют остаток водой, доводят до нейтрального рН и отфильтровывают инден-2-карбоновую кислоту. ЯМР-спектр /СDСl3/  : 3,75 /с, 2Н, бензильный СН2/, 7,4-7,5 /м, 4Н, Аr-Н/, 7,95 /с, 1Н, олефиновый Н/.
е. Синтез соединений формулы I : 3,75 /с, 2Н, бензильный СН2/, 7,4-7,5 /м, 4Н, Аr-Н/, 7,95 /с, 1Н, олефиновый Н/.
е. Синтез соединений формулы IРаботают по методике, описанной ранее в экспериментальной части А-в для получения соединения 1, получают соединение 13 в таблице 2 из инден-2-карбоновой кислоты. Инден-2-оилгуанидин-метансульфоновую кислоту получают при растворении свободного основания в этилацетате при комнатной температуре с последующим добавлением 1 экв. метансульфоновой кислоты. Соль осаждается при охлаждении на ледяной бане. Желтый кристаллический порошок, т.пл. 164-165oС. ЯМР-спектр /СDСl3/  : 3,75 /с, 2Н, бензильный СН2/, 7,4-7,7 /м, 4Н, Аr-Н/, 8,05 /с, 1Н, олефиновый Н/, 8,35 и 11,09 /шир. с, NН и NН2, обмениваемые с D2О/.
Фармакологические методы оценки противоаритмического и кардиопротекторного действия.
Ингибирование обмена натрий/протон в эритроцитах кролика.
Белых кроликов новозеландской породы кормили кормом с 2% холестерина в течение шести недель перед отбором крови для определения обменной Nа+/Н+ активности в эритроцитах. Гиперхолестеринемия была установлена по увеличению обменной активности в эритроцитах кролика (Scholz et al., 1990, Arteriosklerose – Neue Aspekte aus Zellbiologie und Moleculargenetik, Epidemiologie und Klinik; Assmann G. et al., Eds. Braunschweig, Wiesbaden, Vieweg, 296-302). Образцы крови отбирают из ушной вены и определяют гематокрит. Примерно 200 мкл крови инкубируют при 37oС в течение часа с гиперосмолярным сахарозным буфером, содержащим 0,1 мМ Quabain в присутствии или в отсутствии испытуемого образца. После периода инкубации реакцию прекращают добавлением 5 мл охлажденного на льду раствора МgСl2, содержащего 0,1 мМ Quabain. Эритроциты три раза промывают 5 мл раствора МgСl2. Их гемолизуют при добавлении 4 мл дистиллированной воды и определяют содержание натрия в гемолизате с помощью пламя-фотометра. Активность испытуемого соединения определяют по его способности снижать содержание натрия в эритроцитах и она выражается как ИК50 (табл. 4), которая представляет собой концентрацию, необходимую для снижения концентрации натрия в эритроцитах на 50%.
Аритмия, вызванная реперфузией, на изолированном сердце крысы. Взрослых крыс Чарльз Фостер, самцов, /250-300 г/ умерщвляют оглушив и спустив кровь. Быстро извлекают сердца и проводят перфузию по методу Лангендорфа. В среду перфузии добавляют различные концентрации испытуемого соединения. После 20 минут равновесия лигатируют левую переднюю нисходящую /LAD/ коронарную артерию. Через 15 минут лигатуру удаляют, и в следующие 30 минут допускается реперфузия. Во время реперфузии контролируют период ECG. Длительность вентрикулярной фибрилляции /VFD/ является основным параметром оценки. Противоаритмическая активность оценивается как концентрация испытуемого соединения, требующаяся, чтобы вызвать 50 %-ное снижение VFD (табл.5).
Аритмия, вызванная ишемией, у анастеризованных крыс.
Самцов крыс Чарльз Фостер /220-260 г/ анестеризуют пентобарбитоном натрия. Животным делают искусственное дыхание. Давление крови регистрируют через каротидную /сонную/ артерию. Осуществляют торакотомию, чтобы раскрыть сердце. Идентифицируют левую переднюю нисходящую /LАD/ коронарную артерию. Испытуемое соединение вводят или орально за 10 минут до анастезии /за 40 минут до лигатуры LАD артерии/, или внутривенно /за 5 минут до лигатуры LАD артерии/. Пероральное введение и внутривенное введение приведены в табл.6. Регистрируют полученную в результате аритмию в течение периода 15 минут лигатуры и анализируют в соответствии с Конвенцией Ламбета /Walker M. J. A. et al. , 1988, Cardiovascular Research, 22, 447-455/. Противоаритмическое действие испытуемого соединения выражается как ингибирующая доза, зависимая от длительности вентрикулярной тахикардии /VT/ и вентрикулярной фибрилляции /VF/.
Инфаркт миокарда у анастеризованной крысы.
Крыс готовят как в предыдущих экспериментах. Соединения вводят внутривенно за 5 минут до лигатуры. Эксперимент состоит из 1 часа лигатуры с последующим 1 часом перфузии. Инфаркт миокарда оценивают методом двойного окрашивания, используя Голубой Эванса и 2,3,5-трифенилтетразолий для идентификации площади риска и зоны инфаркта соответственно. Степень инфаркта выражается как процент площади /зоны/ риска. /Simpson et al., 1987, Circulation Research, 60, 666-673/. Защита против инфаркта представлена в табл.7.0 : 3,75 /с, 2Н, бензильный СН2/, 7,4-7,7 /м, 4Н, Аr-Н/, 8,05 /с, 1Н, олефиновый Н/, 8,35 и 11,09 /шир. с, NН и NН2, обмениваемые с D2О/.
Фармакологические методы оценки противоаритмического и кардиопротекторного действия.
Ингибирование обмена натрий/протон в эритроцитах кролика.
Белых кроликов новозеландской породы кормили кормом с 2% холестерина в течение шести недель перед отбором крови для определения обменной Nа+/Н+ активности в эритроцитах. Гиперхолестеринемия была установлена по увеличению обменной активности в эритроцитах кролика (Scholz et al., 1990, Arteriosklerose – Neue Aspekte aus Zellbiologie und Moleculargenetik, Epidemiologie und Klinik; Assmann G. et al., Eds. Braunschweig, Wiesbaden, Vieweg, 296-302). Образцы крови отбирают из ушной вены и определяют гематокрит. Примерно 200 мкл крови инкубируют при 37oС в течение часа с гиперосмолярным сахарозным буфером, содержащим 0,1 мМ Quabain в присутствии или в отсутствии испытуемого образца. После периода инкубации реакцию прекращают добавлением 5 мл охлажденного на льду раствора МgСl2, содержащего 0,1 мМ Quabain. Эритроциты три раза промывают 5 мл раствора МgСl2. Их гемолизуют при добавлении 4 мл дистиллированной воды и определяют содержание натрия в гемолизате с помощью пламя-фотометра. Активность испытуемого соединения определяют по его способности снижать содержание натрия в эритроцитах и она выражается как ИК50 (табл. 4), которая представляет собой концентрацию, необходимую для снижения концентрации натрия в эритроцитах на 50%.
Аритмия, вызванная реперфузией, на изолированном сердце крысы. Взрослых крыс Чарльз Фостер, самцов, /250-300 г/ умерщвляют оглушив и спустив кровь. Быстро извлекают сердца и проводят перфузию по методу Лангендорфа. В среду перфузии добавляют различные концентрации испытуемого соединения. После 20 минут равновесия лигатируют левую переднюю нисходящую /LAD/ коронарную артерию. Через 15 минут лигатуру удаляют, и в следующие 30 минут допускается реперфузия. Во время реперфузии контролируют период ECG. Длительность вентрикулярной фибрилляции /VFD/ является основным параметром оценки. Противоаритмическая активность оценивается как концентрация испытуемого соединения, требующаяся, чтобы вызвать 50 %-ное снижение VFD (табл.5).
Аритмия, вызванная ишемией, у анастеризованных крыс.
Самцов крыс Чарльз Фостер /220-260 г/ анестеризуют пентобарбитоном натрия. Животным делают искусственное дыхание. Давление крови регистрируют через каротидную /сонную/ артерию. Осуществляют торакотомию, чтобы раскрыть сердце. Идентифицируют левую переднюю нисходящую /LАD/ коронарную артерию. Испытуемое соединение вводят или орально за 10 минут до анастезии /за 40 минут до лигатуры LАD артерии/, или внутривенно /за 5 минут до лигатуры LАD артерии/. Пероральное введение и внутривенное введение приведены в табл.6. Регистрируют полученную в результате аритмию в течение периода 15 минут лигатуры и анализируют в соответствии с Конвенцией Ламбета /Walker M. J. A. et al. , 1988, Cardiovascular Research, 22, 447-455/. Противоаритмическое действие испытуемого соединения выражается как ингибирующая доза, зависимая от длительности вентрикулярной тахикардии /VT/ и вентрикулярной фибрилляции /VF/.
Инфаркт миокарда у анастеризованной крысы.
Крыс готовят как в предыдущих экспериментах. Соединения вводят внутривенно за 5 минут до лигатуры. Эксперимент состоит из 1 часа лигатуры с последующим 1 часом перфузии. Инфаркт миокарда оценивают методом двойного окрашивания, используя Голубой Эванса и 2,3,5-трифенилтетразолий для идентификации площади риска и зоны инфаркта соответственно. Степень инфаркта выражается как процент площади /зоны/ риска. /Simpson et al., 1987, Circulation Research, 60, 666-673/. Защита против инфаркта представлена в табл.7.0
Формула изобретения
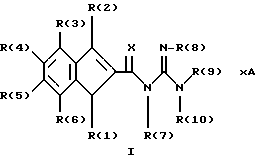 где R(1) и R(2) независимо друг от друга обозначают водород, C1-С10-алкил или O-C1-С10-алкил; R(3), R(4), R(5) и R(6) независимо друг от друга обозначают водород, С1-С4-алкил или галоген, такой как F, Сl, Вr или I; Х обозначает О; R(7), R(8), R(9) и R(10) независимо друг от друга обозначают водород; А отсутствует или обозначает нетоксичную органическую или минеральную кислоту. 2. Соединение по п. 1 формулы II 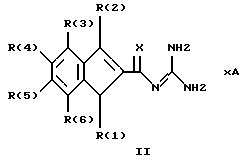 где R(1) обозначает водород, С1-С4-алкил или O-С1-С4-алкил; R(2) обозначает водород или С1-С4-алкил; R(3), R(4), R(5) и R(6) независимо друг от друга обозначают F, Сl, Вr или I. 3. Соединение по п. 1, обладающее противоаритмической активностью, предназначенное для получения лекарственного средства для лечения аритмии сердца. 4. Соединение по п. 1, обладающее кардиопротекторной активностью, предназначенное для получения лекарственного средства для лечения или профилактики инфаркта сердца. 5. Способ получения соединения формулы I по п. 1, заключающийся в том, что соединение формулы VI 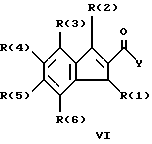 где R(1), R(2), R(3), R(4), R(5) и R(6) имеют значения, указанные в п. 1, и Y обозначает удаляемую группу, выбранную из метокси, фенокси, фенилтио, метилтио, 2-пиридилтио, 1-имидазолила, хлора, подвергают взаимодействию с гуанидином формулы VII 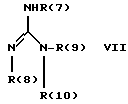 где R(7), R(8), R(9) и R(10) имеют значения, указанные в п. 1, и, если необходимо, преобразуют далее в фармацевтически приемлемую соль. 6. Лекарственное средство, обладающее противоаритмической и кардиопротекторной активностью, отличающееся тем, что включает эффективное количество соединения формулы I по п. 1 или 2 и фармацевтически приемлемый носитель и/или разбавитель. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 18.04.2004
Извещение опубликовано: 10.05.2005 БИ: 13/2005
|
||||||||||||||||||||||||||
