Патент на изобретение №2182002
|
||||||||||||||||||||||||||
(54) КОМПОЗИЦИЯ С ФИКСИРОВАННОЙ ДОЗОЙ ИНГИБИТОРА АНГИОТЕНЗИН-ПРЕВРАЩАЮЩЕГО ФЕРМЕНТА И АНТАГОНИСТА КАЛЬЦИЕВЫХ КАНАЛОВ, СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ И ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ
(57) Реферат: Композиция включает дозу (а) эналаприла или его фармацевтически приемлемой соли и другую дозу (b) нитрендипина или его фармацевтически приемлемой соли и вводится в форме галенового препарата разовой дозой. Способ получения композиции включает: а) растворение малеата эналаприла в воде с неорганической солью; b) смешивание микронизированного нитрендипина с фракцией разрыхляющих наполнителей, увлажняющих агентом, фрагментарным разбавляющим агентом, склеивающим агентом и пластичным разбавляющим агентом, предварительно просеянными; с) гранулирование продуктов, гомогенизированных в секции (b), раствором, полученным на стадии (a); d) высушивание гранулированной массы; е) введение смазывающего агента и оставшейся фракции разрыхляющих наполнителей и гомогенизации откалиброванного гранулята; f) прессование гранулята. Изобретение позволяет снизить побочные эффекты и упростить режим введения. 3 с. и 7 з.п.ф-лы, 8 табл., 3 ил. Область изобретения Настоящее изобретение относится к сочетанию ингибитора ангиотензин-превращающего фермента (ингибитора АПФ), эналаприла, и ингибитора кальциевых каналов (ИКК), нитрендипина, с фиксированной дозой к способу изготовления фармацевтической композиции, которая включает указанное сочетание (ассоциацию) с фиксированной дозой, и к ее применению для лечения заболеваний сердечно-сосудистой системы, в частности артериальной гипертензии. Композиции настоящего изобретения представлены в форме твердых разовых доз с фиксированными количествами эналаприла и нитрендипина таким образом, что разовое введение один раз в день обеспечивает эффект в течение 24 часов после приема указанной дозы. Фармацевтические препараты настоящего изобретения обладают терапевтическим эффектом при лечении гипертензии и других заболеваний сердечно-сосудистой системы, при котором количества активных ингредиентов, эналаприла и нитрендипина, меньше обычных терапевтических доз каждого из этих лекарственных средств, вводимых по отдельности. Эти препараты настоящего изобретения имеют менее выраженные дозозависимые побочные эффекты по сравнению с теми же эффектами, которые возникают при введении более высоких доз каждого из активных ингредиентов в отдельности, для достижения такого же терапевтического эффекта. Фармацевтические композиции настоящего изобретения упрощают режим введения лекарственных препаратов и являются более приемлемыми для пациента. Предпосылки к созданию изобретения В мире среди врачей существует общее мнение по поводу начальной терапии слабой и умеренной гипертензии (АГТ – артериальная гипертензия). Мероприятия, связанные со здоровым образом жизни и диетическими ограничениями, являются неизбежным первым этапом при лечении пациента, страдающего гипертензией. Если с помощью этих мер достаточный контроль за цифрами кровяного давления не достигается, должно начинаться лекарственное лечение. Способы лекарственного лечения, которые рекомендуются в качестве первого выбора, в течение последних лет изменялись. Первоначально это были диуретики типа тиадиазида, к которым добавляли впоследствии  -блокаторы, и эта практика в настоящее время распространяется на другие группы лекарственных препаратов, такие как ингибиторы АПФ, антагонисты кальциевых каналов и -блокаторы, и эта практика в настоящее время распространяется на другие группы лекарственных препаратов, такие как ингибиторы АПФ, антагонисты кальциевых каналов и  1-блокаторы. Все вышеуказанные фармакологические группы обладают сходной эффективностью в отношении контроля цифр кровяного давления и признаны в качестве альтернативных лекарственных средств первого выбора.
Монолекарственная терапия остается в настоящее время обязательной практикой в качестве первого этапа лекарственного лечения АГТ. В случае если начальная терапия оказывается неэффективной, различные группы экспертов рассматривают несколько возможностей. Удовлетворительной реакцией на лечение в основном считается поддержание цифр артериального давления ниже 140/90 мм рт. ст. Если эта цель не достигается после 1-3 месяцев лечения, рассматриваются различные возможности продолжения лечения, которые будучи в основном сходными, имеют некоторые различия в зависимости от организации, которая их предлагает.
Если начальная терапия неэффективна, ВОЗ рекомендует замену первоначального препарата на другой, принадлежащий к другой группе лекарственных средств. Если же наблюдается частичная эффективность, представляется предпочтительным добавление второго препарата из другой группы лекарственных средств в малых дозах, а не повышение дозы первого препарата.
Несмотря на бесспорные преимущества в отношении показателей заболеваемости и смертности, которые обеспечивает лечение АГТ, его результаты не всегда являются столь обнадеживающими, как ожидается, и пациент продолжает подвергаться повышенному риску развития осложнений со стороны сердечно-сосудистой системы по сравнению с пациентами, имеющими нормальное артериальное давление. Одним из факторов, которые вносят свой вклад в относительную неудачу антигипертензивной терапии, является отсутствие или недостаточно оптимальный контроль у многих пациентов, страдающих артериальной гипертензией, в результате побочных реакций, связанных с применением высоких доз антигипертензивных лекарственных средств и недостаточном соблюдением схемы лекарственного лечения пациентами из-за сложности терапии несколькими лекарственными препаратами.
Помимо этого 35-50% пациентов, страдающих артериальной гипертензией, не реагируют удовлетворительным образом на первоначальную монотерапию (Medical Research Council Working Party. Trial of treatment of mild hypertension: principal results. Br.Med.J., 1985; 291:97-104 and Moser M. The fifth report on the Joint National Committee on detection, evaluation and treatment of high blood pressure: a critique. Primary Cardiol., 1993; 16:66-73). Одной из причин такой высокой степени неэффективности при лечении АГТ является то, что происходит активация регуляторных механизмов противодействия, которые частично ограничивают антигипертензивный эффект. Когда любая из систем, регулирующих артериальное давление, модифицируется, наблюдается компенсаторная реакция со стороны других факторов, препятствующая указанному контролю. Каждая фармакологическая группа действует более избирательно на один из этих механизмов, поэтому одним из главных требований, предъявляемых к комбинированному лечению, является одновременное воздействие на более чем один фактор, вызывающий артериальную гипертензию.
Комбинации (сочетания) антигипертензивных препаратов с фиксированной дозой, таким образом, преследуют тройную цель: повышение эффективности благодаря одновременному воздействию на более чем один механизм, регулирующий кровяное давление; улучшение переносимости лечения благодаря тому, что лекарственные препараты применяются в более низких дозах по сравнению с дозами каждого из компонентов при раздельном применении и улучшение адекватного выполнения пациентами схемы лекарственного лечения благодаря снижению необходимого количества приемов лекарственных препаратов.
Таким образом, существует заинтересованность в разработке ассоциаций ингибитора АПФ и АКК путем поиска синергитического действия по снижению кровяного давления, снижению побочных эффектов, присущих АКК, и улучшению адекватного выполнения пациентами схемы лекарственного лечения благодаря тому, что препараты вводятся в виде единичной дозы.
Механизм, посредством которого осуществляется потенцирование действия обоих активных ингредиентов, является комплексным. АКК вызывают отрицательный баланс натрия, стимулирующего ренин-ангиотензиновую систему, которая, в свою очередь, блокируется ингибиторами АПФ. Помимо этого введение ингибиторов АПФ повышает тонус блуждающего нерва, который будет устранять симпатическую активацию и тахикардию, вызываемую АКК, принадлежащими к группе дигидропиридинов.
Выбор эналаприла в качестве ингибитора АПФ в сочетании настоящего изобретения был сделан на основании того факта, что он снижает кровяное давление при истинной гипертензии и гипертензии реноваскулярного происхождения всех степеней тяжести. Он по меньшей мере столь же эффективен, что и другие ингибиторы АПФ и другие антигипертензивные лекарства из других фармакологических групп, таких как диуретики, 1-блокаторы. Все вышеуказанные фармакологические группы обладают сходной эффективностью в отношении контроля цифр кровяного давления и признаны в качестве альтернативных лекарственных средств первого выбора.
Монолекарственная терапия остается в настоящее время обязательной практикой в качестве первого этапа лекарственного лечения АГТ. В случае если начальная терапия оказывается неэффективной, различные группы экспертов рассматривают несколько возможностей. Удовлетворительной реакцией на лечение в основном считается поддержание цифр артериального давления ниже 140/90 мм рт. ст. Если эта цель не достигается после 1-3 месяцев лечения, рассматриваются различные возможности продолжения лечения, которые будучи в основном сходными, имеют некоторые различия в зависимости от организации, которая их предлагает.
Если начальная терапия неэффективна, ВОЗ рекомендует замену первоначального препарата на другой, принадлежащий к другой группе лекарственных средств. Если же наблюдается частичная эффективность, представляется предпочтительным добавление второго препарата из другой группы лекарственных средств в малых дозах, а не повышение дозы первого препарата.
Несмотря на бесспорные преимущества в отношении показателей заболеваемости и смертности, которые обеспечивает лечение АГТ, его результаты не всегда являются столь обнадеживающими, как ожидается, и пациент продолжает подвергаться повышенному риску развития осложнений со стороны сердечно-сосудистой системы по сравнению с пациентами, имеющими нормальное артериальное давление. Одним из факторов, которые вносят свой вклад в относительную неудачу антигипертензивной терапии, является отсутствие или недостаточно оптимальный контроль у многих пациентов, страдающих артериальной гипертензией, в результате побочных реакций, связанных с применением высоких доз антигипертензивных лекарственных средств и недостаточном соблюдением схемы лекарственного лечения пациентами из-за сложности терапии несколькими лекарственными препаратами.
Помимо этого 35-50% пациентов, страдающих артериальной гипертензией, не реагируют удовлетворительным образом на первоначальную монотерапию (Medical Research Council Working Party. Trial of treatment of mild hypertension: principal results. Br.Med.J., 1985; 291:97-104 and Moser M. The fifth report on the Joint National Committee on detection, evaluation and treatment of high blood pressure: a critique. Primary Cardiol., 1993; 16:66-73). Одной из причин такой высокой степени неэффективности при лечении АГТ является то, что происходит активация регуляторных механизмов противодействия, которые частично ограничивают антигипертензивный эффект. Когда любая из систем, регулирующих артериальное давление, модифицируется, наблюдается компенсаторная реакция со стороны других факторов, препятствующая указанному контролю. Каждая фармакологическая группа действует более избирательно на один из этих механизмов, поэтому одним из главных требований, предъявляемых к комбинированному лечению, является одновременное воздействие на более чем один фактор, вызывающий артериальную гипертензию.
Комбинации (сочетания) антигипертензивных препаратов с фиксированной дозой, таким образом, преследуют тройную цель: повышение эффективности благодаря одновременному воздействию на более чем один механизм, регулирующий кровяное давление; улучшение переносимости лечения благодаря тому, что лекарственные препараты применяются в более низких дозах по сравнению с дозами каждого из компонентов при раздельном применении и улучшение адекватного выполнения пациентами схемы лекарственного лечения благодаря снижению необходимого количества приемов лекарственных препаратов.
Таким образом, существует заинтересованность в разработке ассоциаций ингибитора АПФ и АКК путем поиска синергитического действия по снижению кровяного давления, снижению побочных эффектов, присущих АКК, и улучшению адекватного выполнения пациентами схемы лекарственного лечения благодаря тому, что препараты вводятся в виде единичной дозы.
Механизм, посредством которого осуществляется потенцирование действия обоих активных ингредиентов, является комплексным. АКК вызывают отрицательный баланс натрия, стимулирующего ренин-ангиотензиновую систему, которая, в свою очередь, блокируется ингибиторами АПФ. Помимо этого введение ингибиторов АПФ повышает тонус блуждающего нерва, который будет устранять симпатическую активацию и тахикардию, вызываемую АКК, принадлежащими к группе дигидропиридинов.
Выбор эналаприла в качестве ингибитора АПФ в сочетании настоящего изобретения был сделан на основании того факта, что он снижает кровяное давление при истинной гипертензии и гипертензии реноваскулярного происхождения всех степеней тяжести. Он по меньшей мере столь же эффективен, что и другие ингибиторы АПФ и другие антигипертензивные лекарства из других фармакологических групп, таких как диуретики,  -блокаторы, АКК и -блокаторы, АКК и  1-блокаторы. Его эффективность и безопасность были показаны в многочисленных сравнительных клинических испытаниях, и он в последние несколько лет доступен во многих странах мира. Обычный диапазон доз составляет от 5 до 40 мг один раз в день. Обычная первоначальная доза при слабой артериальной гипертензии составляет 10 мг один раз в день и 20 мг один раз в день – при остальных степенях тяжести артериальной гипертензии. Обычная поддерживающая доза составляет 20 мг один раз в день, которую можно увеличить максимально до 40 мг один раз в день в зависимости от индивидуальных потребностей каждого пациента. Для пациентов, которые обычно не реагируют на монотерапию, можно добавить другой лекарственный препарат из отличающейся фармакологической группы с целью обеспечения дополнительной реакции на лечение.
Ингибиторы АПФ также улучшают коэффициент выживаемости пациентов, страдающих застойной сердечной недостаточностью, и могут предотвратить или задержать развитие дилятации левого желудочка сердца и сердечной недостаточности у пациентов с симптоматической и асимптоматической левожелудочковой дисфункцией. Гемодинамические изменения, связанные как с неотложным, так и долгосрочным лечением эналаприлом пациентов с застойной сердечной недостаточностью, включают снижение: системного сосудистого сопротивления (от 20 до 45%), снижение среднего артериального давления (от 7 до 15%), снижение легочного капиллярного давления (от 25 до 50%) и повышение частоты сердечных сокращений (от 25 до 30%). Коэффициенты смертности и заболеваемости после долгосрочного лечения (свыше одного года) улучшаются приблизительно на 15% у пациентов с легкой и умеренной сердечной недостаточностью (исследование SOLVD N.Eng.J.Med., 1987; 316:1429-1435) и приблизительно на 30% у пациентов с тяжелой сердечной недостаточностью (исследование CONSENSUS, N.Eng.J.Med., 1991; 325:293-302). Дозы эналаприла, рекомендованные для этой цели, составляют первоначально 2,5 мг в день с повышением до 10-20 мг в день в зависимости от клинической реакции.
Диабетическая нефропатия является клиническим синдромом, который характеризуется постоянной протеинурией, прогрессирующим снижением скорости клубочковой фильтрации и повышением артериального давления. Этим изменениям предшествует “немой” период различной длительности, во время которого у пациентов, страдающих диабетом, отмечается лишь постоянная микроальбуминурия. Наличие микроальбуминурии является важным признаком, поскольку было показано, что она является прогностическим фактором клинического развития диабетической нефропатии. У пациентов с нормальным давлением и инсулиннезависимым диабетом или с сахарным диабетом, сопровождающимся гипертензией, которая контролируется нифедипином, добавление к терапии 5 мг в день эналаприла значительно уменьшает микроальбуминурию, на 40-50% в течение 48 месяцев. При мониторинге продолжительностью до 5 лет эналаприл стабилизирует микроальбуминурию у пациентов с нормальным кровяным давлением, страдающих инсулиннезависимым диабетом, лучше, чем плацебо.
Выбор нитрендипина в качестве АКК в сочетании (ассоциации) настоящего изобретения был сделан на основании того факта, что он обладает, главным образом, свойством расширять периферические сосуды, что индуцирует продолжительное снижение систолического и диастолического кровяного давления. В различных клинических испытаниях было сделано наблюдение, что нитрендипин снижает кровяное давление у пациентов со слабой и умеренной гипертензией и что этот эффект поддерживается при долгосрочном введении. В сравнительных испытаниях с диуретиками, 1-блокаторы. Его эффективность и безопасность были показаны в многочисленных сравнительных клинических испытаниях, и он в последние несколько лет доступен во многих странах мира. Обычный диапазон доз составляет от 5 до 40 мг один раз в день. Обычная первоначальная доза при слабой артериальной гипертензии составляет 10 мг один раз в день и 20 мг один раз в день – при остальных степенях тяжести артериальной гипертензии. Обычная поддерживающая доза составляет 20 мг один раз в день, которую можно увеличить максимально до 40 мг один раз в день в зависимости от индивидуальных потребностей каждого пациента. Для пациентов, которые обычно не реагируют на монотерапию, можно добавить другой лекарственный препарат из отличающейся фармакологической группы с целью обеспечения дополнительной реакции на лечение.
Ингибиторы АПФ также улучшают коэффициент выживаемости пациентов, страдающих застойной сердечной недостаточностью, и могут предотвратить или задержать развитие дилятации левого желудочка сердца и сердечной недостаточности у пациентов с симптоматической и асимптоматической левожелудочковой дисфункцией. Гемодинамические изменения, связанные как с неотложным, так и долгосрочным лечением эналаприлом пациентов с застойной сердечной недостаточностью, включают снижение: системного сосудистого сопротивления (от 20 до 45%), снижение среднего артериального давления (от 7 до 15%), снижение легочного капиллярного давления (от 25 до 50%) и повышение частоты сердечных сокращений (от 25 до 30%). Коэффициенты смертности и заболеваемости после долгосрочного лечения (свыше одного года) улучшаются приблизительно на 15% у пациентов с легкой и умеренной сердечной недостаточностью (исследование SOLVD N.Eng.J.Med., 1987; 316:1429-1435) и приблизительно на 30% у пациентов с тяжелой сердечной недостаточностью (исследование CONSENSUS, N.Eng.J.Med., 1991; 325:293-302). Дозы эналаприла, рекомендованные для этой цели, составляют первоначально 2,5 мг в день с повышением до 10-20 мг в день в зависимости от клинической реакции.
Диабетическая нефропатия является клиническим синдромом, который характеризуется постоянной протеинурией, прогрессирующим снижением скорости клубочковой фильтрации и повышением артериального давления. Этим изменениям предшествует “немой” период различной длительности, во время которого у пациентов, страдающих диабетом, отмечается лишь постоянная микроальбуминурия. Наличие микроальбуминурии является важным признаком, поскольку было показано, что она является прогностическим фактором клинического развития диабетической нефропатии. У пациентов с нормальным давлением и инсулиннезависимым диабетом или с сахарным диабетом, сопровождающимся гипертензией, которая контролируется нифедипином, добавление к терапии 5 мг в день эналаприла значительно уменьшает микроальбуминурию, на 40-50% в течение 48 месяцев. При мониторинге продолжительностью до 5 лет эналаприл стабилизирует микроальбуминурию у пациентов с нормальным кровяным давлением, страдающих инсулиннезависимым диабетом, лучше, чем плацебо.
Выбор нитрендипина в качестве АКК в сочетании (ассоциации) настоящего изобретения был сделан на основании того факта, что он обладает, главным образом, свойством расширять периферические сосуды, что индуцирует продолжительное снижение систолического и диастолического кровяного давления. В различных клинических испытаниях было сделано наблюдение, что нитрендипин снижает кровяное давление у пациентов со слабой и умеренной гипертензией и что этот эффект поддерживается при долгосрочном введении. В сравнительных испытаниях с диуретиками,  -блокаторами и другими АКК было показано, что нитрендипин обладает такой же эффективностью в отношении контроля мягкой (слабой) и умеренной артериальной гипертензии. Нитрендипин в течение последних нескольких лет коммерчески доступен во многих странах мира. Обычная первоначальная доза для пациентов с мягкой и умеренной артериальной гипертензией составляет от 5 до 20 мг один раз в день. В зависимости от реакции дозу можно довести до пределов от 5 до 20 мг один раз или дважды в день независимо от того, проводится ли монотерапия или комбинированная терапия с диуретиком или -блокаторами и другими АКК было показано, что нитрендипин обладает такой же эффективностью в отношении контроля мягкой (слабой) и умеренной артериальной гипертензии. Нитрендипин в течение последних нескольких лет коммерчески доступен во многих странах мира. Обычная первоначальная доза для пациентов с мягкой и умеренной артериальной гипертензией составляет от 5 до 20 мг один раз в день. В зависимости от реакции дозу можно довести до пределов от 5 до 20 мг один раз или дважды в день независимо от того, проводится ли монотерапия или комбинированная терапия с диуретиком или  -блокатором.
Было изучено несколько сочетаний (ассоциаций) ингибиторов АПФ и АКК: цилазаприл и нитрендипин (Nakanishi and col., Curr.Ther.Res., 1992; 52:514 – 523), каптоприл и нитрендипин (Gennari and col., Cardiovasc. Drug Ther., 1989; 3:319-325), эналаприл и фелодипин (Morgan and col.. Kidney International, 1992; 41 (suppl.36):S78-S81). На основании этих и других исследований, проводившихся с сочетаниями ингибиторов АПФ и АКК, можно сделать вывод о том, что комбинированное лечение является более эффективным и лучше переносится по сравнению с монотерапией каждым из этих лекарств в отдельности.
Также описаны различные ассоциации ингибиторов АПФ и АКК дигидропиридинового типа для лечения артериальной гипер-тенэии у ряда пациентов, например в ЕР 488059, ЕР 180785, ЕР 265685, WO 9607400, ЕР 272177.
Тем не менее необходимо принимать во внимание, что первостепенным требованием, которое должно учитываться при разработке сочетания (ассоциации) с фиксированной дозой, является совместимость обоих компонентов с точки зрения фармакокинетики и фармакодинамики.
Описание изобретения -блокатором.
Было изучено несколько сочетаний (ассоциаций) ингибиторов АПФ и АКК: цилазаприл и нитрендипин (Nakanishi and col., Curr.Ther.Res., 1992; 52:514 – 523), каптоприл и нитрендипин (Gennari and col., Cardiovasc. Drug Ther., 1989; 3:319-325), эналаприл и фелодипин (Morgan and col.. Kidney International, 1992; 41 (suppl.36):S78-S81). На основании этих и других исследований, проводившихся с сочетаниями ингибиторов АПФ и АКК, можно сделать вывод о том, что комбинированное лечение является более эффективным и лучше переносится по сравнению с монотерапией каждым из этих лекарств в отдельности.
Также описаны различные ассоциации ингибиторов АПФ и АКК дигидропиридинового типа для лечения артериальной гипер-тенэии у ряда пациентов, например в ЕР 488059, ЕР 180785, ЕР 265685, WO 9607400, ЕР 272177.
Тем не менее необходимо принимать во внимание, что первостепенным требованием, которое должно учитываться при разработке сочетания (ассоциации) с фиксированной дозой, является совместимость обоих компонентов с точки зрения фармакокинетики и фармакодинамики.
Описание изобретенияПринимая во внимание вышеизложенные предпосылки, в настоящем изобретении было разработано сочетание (ассоциация) ингибитора ангиотензин-превращающего фермента (ингибитора АПФ) – эналаприла, и антагониста кальциевых каналов (АКК) – нитрендипина, с фиксированной дозой, в которой эти лекарственные средства при введении по отдельности широко продемонстрировали свою эффективность и безопасность при лечении артериальной гипертензии и других сердечно-сосудистых заболеваний. Помимо этого эналаприл и нитрендипин принадлежат к разным фармакологическим группам лекарств, обладающих антигипертензивным действием, и поэтому их объединенное введение позволяет воздействовать на более чем один из механизмов, регулирующих кровяное давление. Настоящее изобретение относится также к новой фармацевтической композиции и способу ее изготовления для перорального введения, а также к ее применению для лечения артериальной гипертензии и других заболеваний сердечно-сосудистой системы. Эта фармацевтическая композиция состоит из лекарственной формы единичных доз, которые содержат фиксированные количества эналаприла и нитрендипина. Молекула, соответствующая эналаприлу (формула I) имеет три хиральных центра и, следовательно, может существовать в восьми различных энантиомерных формах. Энантиомер, известный под названием эналаприл и применяемый в настоящем изобретении, представляет собой 1-(N-((S)-1-этоксикарбонил-3-фенилпропил)-L-аланил)-L-пролин. Можно применять соли эналаприла, такие как соли с органическими и неорганическими кислотами (малеат, гидрохлорат и т.д. ) и соли с основаниями (соли натрия, калия, магния). 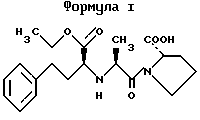 Нитрендипин (формула II) имеет один хиральный центр и, следовательно, может быть представлен в двух энантиомерных формах. Тем не менее коммерческий продукт представляет собой рацемическую смесь двух изомеров этилового и метилового эфира 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридиндикарбоновой кислоты. Можно использовать соли нитрендипина с органическими и неорганическими кислотами. 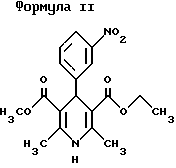 Известна нестабильность малеата эналаприла и низкая растворимость нитрендипина. По этой причине был разработан специальный способ, составляющий цель настоящего изобретения, для изготовления галеновой формы (композиции), которой достигается хорошая стабильность эналаприла в форме натриевой соли и хорошая растворимость нитрендипина, обеспечивающая быстрое высвобождение композиции эналаприл-нитрендипин. Способ изготовления композиции заключается, с одной стороны, в изготовлении раствора для грануляции путем растворения малеата эналаприла и бикарбоната натрия в достаточном количестве воды. С другой стороны, оставшиеся компоненты перемешиваются за исключением группы (фракции) разрыхлителей (крахмала, микрокристаллической целлюлозы) и смазывающего агента (стеарата магния). Указанную смесь гранулируют с помощью вышеупомянутого раствора. После высушивания гранулята получают массу с высокогидрофильным окружением, которая вследствие действия увлажняющего агента (лаурилсульфата натрия) способствует растворению нитрендипина. Склеивающий и увлажняющий агенты (поливинилпирролидон и лаурилсульфат натрия) могут как вариант включаться в гранулирующий раствор. Таким образом, получают гранулят, который после высушивания до остаточной влажности менее 1,5%, калибровки и добавления оставшихся эксципиентов можно прессовать на стандартном оборудовании для получения стабильных таблеток с быстрым высвобождением обоих активных ингредиентов. Диапазон доз эналаприла в единичных дозированных лекарственных формах сочетания с фиксированной дозой находится в пределах между 2,5 и 20 мг, предпочтительно между 10 и 20 мг. Диапазон доз нитрендипина находится в пределах между 5 и 20 мг, предпочтительно между 5 и 10 мг. Эта форма однократного введения дозы облегчает режим приема лекарства и улучшает прием пациентом лечения. Примеры 1 и 2 ниже описывают две различные фармацевтические композиции сочетания эналаприла и нитрендипина, являющиеся целью настоящего изобретения, как и способ их получения. Пример 3 описывает результаты изучения растворения эналаприла и нитрендипина в составах, полученных в примерах 1 и 2. Пример 4 описывает фармакологическое действие сочетания эналаприла и нитрендипина на двух экспериментальных моделях: а) на крысах с экспериментальной гипертензией и b) на собаках породы бигль с нормальным кровяным давлением. Пример 5 описывает фармакокинетическую совместимость, а пример 6 – эффективность фармацевтических композиций настоящего изобретения в сравнительных клинических испытаниях между эналаприлом, нитрендипином и твердой лекарственной формой сочетания эналаприла и нитрендипина с фиксированной дозой (по изобретению). ПРИМЕР 1. Этот пример описывает количественный состав предпочтительной композиции сочетания по настоящему изобретению и способ ее получения. Количественный состав, мг: Малеат эналаприла – 10,00 Измельченный до микронного уровня нитрендипин – 10,00 Бикарбонат натрия – 5,00 Кукурузный крахмал – 65,50 Лаурилсульфат натрия – 2,00 Моногидрат лактозы – 170,00 Поливинилпирролидон – 8,00 Микрокристаллическая целлюлоза – 33,00 Стеарат магния – 1,15 Способ изготовления a) – растворить в достаточном количестве деминерализованной воды малеат эналаприла и соответствующее количество бикарбоната натрия. b) – смешать нитрендипин с 80% кукурузного крахмала, лаурилсульфатом натрия, моногидратом лактозы, поливинилпир-ролидоном и 20% микрокристаллической целлюлозы, предварительно их просеяв. c) – используя высокоскоростное оборудование для гранулирования, гранулировать продукты, гомогенизированные на стадии 2, с раствором, полученным на стадии 1. d) – высушить гранулированную массу на оборудовании с псевдоожиженным слоем до остаточной влажности менее 1,5%. e) – откалибровать сухой гранулят. Добавить оставшиеся 20% кукурузного крахмала и оставшиеся 80% микрокристаллической целлюлозы и стеарат магния, предварительно просеянные, и гомогенизировать с откалиброванным гранулятом. f) – прессовать на обычном прессе. Прилагаемые таблицы 1 и 2 показывают результаты изучения стабильности эналаприла и нитрендипина в этой композиции в зависимости от времени. Для этой цели количественно определяли образование продуктов распада: диацетопиперазина и эналаприловой кислоты в случае эналаприла и пиридинового производного в случае нитрендипина. ПРИМЕР 2. Этот пример описывает другую предпочтительную композицию сочетания эналаприла и нитрендипина и способ ее изготовления. Количественный состав, мг: Малеат эналаприла – 20,00 Микронизированный нитрендипин (измельченный до микронного уровня) – 5,00 Бикарбонат натрия – 10,00 Кукурузный крахмал – 40,00 Лаурилсульфат натрия – 7,50 Моногидрат лактозы – 116,75 Поливинилпирролидон – 11,20 Микрокристаллическая целлюлоза – 80,00 Стеарат магния – 2,20 Способ изготовления а) – растворить в достаточном количестве деминерализованной воды малеат эналаприла и соответствующее количество бикарбоната натрия. b) – смешать нитрендипин с 90% кукурузного крахмала, лаурилсульфатом натрия, моногидратом лактозы, поливинилпир-ролидоном и 20% микрокристаллической целлюлозы, предварительно просеянными. c) – используя высокоскоростное оборудование для гранулирования, гранулировать продукты, гомогенизированные на стадии 2, с раствором, полученным на стадии 1. d) – высушить гранулированную массу на оборудовании с псевдоожиженным слоем до остаточной влажности менее 1,5%. e) – откалибровать сухой гранулят. Добавить оставшиеся 10% кукурузного крахмала и оставшиеся 80% микрокристаллической целлюлозы и стеарат магния, предварительно просеянные, и гомогенизировать с от калиброванным гранулятом. f) – прессовать на обычном прессе. Прилагаемые таблицы 3 и 4 показывают результаты изучения стабильности двух активных ингредиентов, эналаприла и нитрендипина, в композиции этого примера в зависимости от времени. ПРИМЕР 3. Изучение растворения in vitro выполнялись на 6 таблетках, изготовленных из каждой из композиций, описанных в примерах 1 и 2. Средние результаты, полученные для эланаприла и нитрендипина, описаны в табл. 5 и 6. Приведенные в табл. 5 и 6 результаты показаны на фиг.1 и 2, изображающие аккумулятивные профили растворения эналаприла и нитрендипина in vitro для 6 испытанных таблеток из композиций примеров 1 и 2. ПРИМЕР 4. Фармакологический эффект сочетания эналаприла и нитрендипина настоящего изобретения оценивали на двух экспериментальных моделях: а) Антигипертензивная активность у крыс с экспериментальной гипертензией, полученной с помощью структуры аорты. Антигипертензивная активность ассоциации эналаприла и нитрендипина исследовали в сравнении с каждым из компонентов по отдельности на экспериментальной модели гипертензии, полученной с помощью структуры аорты, у крыс. Измерение артериального давления осуществлялось у животных, находившихся в сознании. Испытуемые дозы были следующими: – малеат эналаприла 1 мг/кг (перорально) – нитрендипин 3 мг/кг (перорально) – малеат эналаприла и нитрендипин 1 и 3 мг/кг (перорально) – малеат эналаприла и нитрендипин 0,5 и 1,5 мг/кг (перорально) Контрольная группа получала носитель (1% карбоксиметилцеллюлоза в дистиллированной воде), объем вводившегося раствора составлял 10 мг/кг (перорально). Полученные данные представлены в таблице 7 и на фиг.3. Пероральное введение малеата эланаприла (1 мг/кг) выявило умеренный антигипертензивный эффект, который продолжался до 6 часов после введения. Пероральное введение нитрендипина (3 мг/кг) оказывало весьма выраженный антигипертензивный эффект, хотя и не очень продолжительный, с возвращением к исходным показателям через 4 часа после введения. Комбинированное введение малеата эналаприла (1 мг/кг перорально) и нитрендипина (3 мг/кг перорально) вызывало более выраженный антигипертензивный эффект по сравнению с эналаприлом, введенным отдельно (1 мг/кг перорально). Испытание дозировок малеата эналаприла и нитрендипина ниже тех, которые первоначально использовались с ассоциации (0,5 и 1,5 мг/кг перорально), оказывало антигипертензивный эффект, эквивалентный таковому ассоциации малеата эналаприла и нитрендипина (1 и 3 мг/кг перорально), с пролонгированием антигипертензивного эффекта, полученным при лечении отдельными препаратами, из чего можно сделать вывод о том, что эта ассоциация обладает синергитическим действием. b) Гипотензивная активность на собаках породы бигль с нормальным артериальным давлением. Проводилось исследование по изучению гипотензивного эффекта ассоциации эналаприла и нитрендипина (1:1) на собаках породы бигль, с физиологическими данными, полученными из 26-недельного исследования хронической токсичности; малеат эналаприла и нитрендипин (1:1) вводили в форме капсул в дозах 1 и 1; 3 и 3 и 6 и 6 мг/кг в день, перорально, в течение 26 недель. В течение всего периода лечения фиксировали систолическое и диастолическое артериальное давление и вычисляли средние значения спустя 1, 4, 13 и 26 недель лечения при основных условиях. В каждом из этих периодов артериальное давление фиксировали до введения и через 4 и 8 часов после введения. Полученные результаты представлены в таблице 8. Пероральное введение малеата эналаприла и нитрендипина (1:1) в течение 26 недель в дозах 1 и 1; 3 и 3; и 6 и 6 мг/кг в день обнаружило поддающийся оценке гипотензивный эффект непосредственно с 1-й же недели лечения. Максимальный эффект проявлялся спустя 4 часа после введения и продолжался еще 8 часов после введения. Этот гипотензивный эффект усиливался в течение периода лечения; наименьшее артериальное давление наблюдалось к 13 неделе. Таким образом, это исследование показало отчетливый фармакологический эффект ассоциации малеата эналаприла и нитрендипина (1:1) в дозах 1 и 1; 3 и 3; и 6 и 6 мг/кг в день, перорально. ПРИМЕР 5. Было проведено исследование по фармакокинетическому взаимодействию после введения единичной дозы 20 мг эналаприла, 20 мг нитрендипина и по 20 мг эналаприла и нитрендипина в качестве активных ингредиентов в ассоциации с фиксированной дозой на 24 здоровых добровольцах (10 мужчин и 14 женщин). Для этой цели было организовано рандомизированное, открытое и перекрестное клиническое испытание с использованием Латинского квадрата 3х3, со свободным периодом 15 дней между каждым из периодов лечения. В каждом периоде лечения от каждого участника брали 16 образцов крови, начиная от исходного момента и до +96 часов после введения, и определяли концентрации эналаприлата и нитрендипина в плазме крови. Эти данные использовали как основу для вычисления фармакокинетических параметров, определяющих биодоступность по величине (ППКобес конеч ность) и по скорости (Смах, Смах/ППКобес конеч ностьи Тмах), и проводили статистический анализ (однофакторный дисперсионный анализ) для оценки статистической значимости разницы между средними значениями каждого из этих параметров. Этот анализ не выявил статистически значимой разницы между изолированным пероральным приемом нитрендипина или эналаприна и комбинированным пероральным приемом ассоциации с фиксированной дозой. Относительная биодоступность (ППКобес конеч ность) эналаприлата после комбинированного перорального приема по отношению к изолированному пероральному приему составила 1,12. Относительная биодоступность (ППКобес конеч ность) нитрендипина после комбинированного перорального приема по отношению к изолированному пероральному приему составила 0,91. Таким образом, можно сделать вывод о том, что не существует клинически значимого фармакокинетического взаимодействия – нитрендипина и эналаприла после введения однократной дозы по 20 мг каждого из активных ингредиентов по отдельности или в ассоциации с фиксированной дозой, содержащейся в фармацевтических композициях настоящего изобретения. ПРИМЕР 6. Было выполнено открытое клиническое испытание с контролем плацебо на пациентах-мужчинах с мягкой и умеренной АГТ, определявшейся как величина систолического кровяного давления (СКД) между 165 и 144 мм рт.ст. и как величина диастолического кровяного давления (ДКД) между 95 и 105 мм рт.ст., измерявшаяся в положении лежа после 5-минутного отдыха. После 2 недель приема плацебо пациенты, удовлетворявшие критериям мягкой и умеренной АГТ, получали лечение 5 мг нитрендипина один раз в день (9 пациентов) или 5 мг эналаприла один раз в день (11 пациентов) в течение 2 недель, к концу которых пациенты, которые не реагировали на лечение (ДКД <90 мм рт.ст.), получали комбинированное лечение ассоциацией с фиксированной дозой 5 мг нитрендипина и 5 мг эналаприла один раз в день, в течение еще 2 недель. Лечение только одним препаратом нормализовало кровяное давление у 3 пациентов (15%) у 2 – леченных эналаприлом и 1 – леченного нитрендипином. Комбинированное лечение ассоциацией нормализовало кровяное давление у 14 пациентов (82%). Среднее снижение величин СКД и ДКД по отношению к концу периода плацебо составляло 5 мм рт. ст. /2 мм рт.ст после периода лечения одним препаратом (незначимая разница) и 24 мм рт.ст./16 мм рт.ст. после периода комбинированного лечения ассоциацией с фиксированной дозой (р <0,001). Таким образом, можно сделать вывод о том, что комбинированное введение нитрендипина и эналаприла в ассоциации с фиксированной дозой обеспечивает эффективный контроль мягкой и умеренной АГТ у большинства пациентов в дозах, которые при введении в форме лекарственной монотерапии, не имеют клинически значимого эффекта при лечении АГТ. Формула изобретения
РИСУНКИ
RH4A – Выдача дубликата патента Российской Федерации на изобретение
Дата выдачи дубликата: 24.08.2004
Наименование лица, которому выдан дубликат:
Извещение опубликовано: 27.09.2004 БИ: 27/2004
PD4A – Изменение наименования обладателя патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Извещение опубликовано: 27.10.2004 БИ: 30/2004
TK4A – Поправки к публикациям сведений об изобретениях в бюллетенях “Изобретения (заявки и патенты)” и “Изобретения. Полезные модели”
Страница: 576
Напечатано: (73) ЛАБОРАТОРЬОС С.А. (ES)
Следует читать: (73) ЛАБОРАТОРЬОС ВИТА С.А. (ES)
Номер и год публикации бюллетеня: 30-2004
Код раздела: PD4A
Извещение опубликовано: 20.12.2004 БИ: 35/2004
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 04.04.2006 № РД0007963
Извещение опубликовано: 10.06.2006 БИ: 16/2006
|
||||||||||||||||||||||||||
