Патент на изобретение №2181736
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОЗАМЕЩЕННЫХ ФТАЛОЦИАНИНОВ
(57) Реферат: Предложен способ получения сульфозамещенных фталоцианинов, которые находят широкое применение в различных областях техники. Способ состоит в сульфировании незамещенных фталоцианинов хлорсульфоновой кислотой в высококипящих инертных растворителях при 180-210oС и мольном соотношении исходного фталоцианина и хлорсульфоновой кислоты 1:2-8. В процессе сульфирования образуются сульфокислоты фталоцианинов, преимущественное содержание сульфогрупп в которых в зависимости от природы центрального атома металла и количества используемой хлорсульфоновой кислоты может изменяться от одной до четырех. Выделение целевых продуктов осуществляют в виде свободных кислот либо их натриевых солей. Способ обеспечивает получение сульфозамещенных фталоцианинов высокой степени чистоты и с выходами до 92%. Изобретение относится к химии и химической технологии, а более конкретно к синтезу сульфозамещенных фталоцианинов. Сульфозамещенные фталоцианины имеют широкое и разнообразное применение в различных областях техники, например в качестве активных красителей в текстильной промышленности, катализаторов различных химических процессов, в том числе процессов сероочистки нефтяных продуктов, а также находят в последнее время применение в медицине в качестве фотосенсибилизаторов для фотодинамической терапии (ФДТ) злокачественных опухолей и других патологических новообразований. Наиболее распространенным и удобным методом получения сульфозамещенных фталоцианинов (Рсs) является сульфирование уже готовых макроциклических соединений (Рс). В качестве сульфирующего агента, как правило, используют олеум различной концентрации или хлорсульфоновую кислоту (ХСК). Реакцию сульфирования при этом ведут в растворе сульфирующего агента, используя его значительный избыток по отношению к исходному Рс (20-30 моль на моль Рс), при этом в зависимости от природы центрального атома, а также от условий проведения реакции – температуры, времени реакции, природы сульфирующего агента, а в случае использования олеума и от концентрации последнего – можно получить Рсs с преимущественным содержанием сульфогрупп в макрокольце от одной до четырех (F.Н. Моsеr аnd А.L. Тhоmаs, Тhе Рhthalocyanines, СRC Рrеss, Воса Rаton, F1а., 1983, т. II, стр. 20-21). Наряду с неоспоримыми достоинствами вышеизложенный метод сульфирования обладает двумя существенными недостатками. Во-первых, сульфирование проводится в присутствии большого избытка олеума или ХСК, использующихся не только как сульфирующие агенты, но и как растворители, в результате чего на стадии выделения сульфопроизводных Рс образуется большое количество кислых отходов. Во-вторых, этот метод мало пригоден для сульфирования неустойчивых в кислой среде (в частности, в серной кислоте) фталоцианинов, какими являются безметальный фталоцианин (РсН2) и его цинковый (РсZn) и ряд других комплексов. Задачей предлагаемого изобретения была разработка способа, который бы позволил исключить вышеизложенные недостатки и получать Рсs с достаточно высоким выходом. Для решения этой задачи был предложен способ получения Рсs, в котором сульфирование осуществляют ХСК при соотношении исходного Рс:ХСК = 1: 2-8, а процесс проводят в высококипящих инертных растворителях при 180-210oС. При соотношении Рс: ХСК менее 1:2 не достигается необходимая степень сульфирования, так же как и при осуществлении процесса при температуре ниже 180oС. Проведение процесса при температуре выше 210oС или при соотношении более 1:8 не технологично. Было показано, что при нагревании Рс с эквимолекулярными или близкими к эквимолекулярным количествами ХСК (мольное соотношение Рс и ХСК 1:2-8) в высококипящих инертных растворителях (o-дихлорбензол, трихлорбензол и т.п.) образуются сульфокислоты Рс, преимущественное содержание сульфогрупп в которых в зависимости от природы центрального атома металла и количества используемой хлорсульфоновой кислоты может изменяться от одной до четырех. Выделение целевых продуктов осуществляется в виде свободных кислот 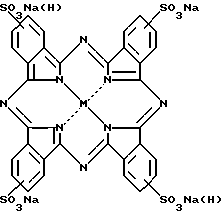 M=HH или металл, либо их натриевых солей с выходами до 92%. Пример 1. Динатривая соль дисульфокислоты безметального фталоцианина. К суспензии 6.15 г (0.012 моль) безметального фталоцианина в 45 мл трихлорбензола добавляют при перемешивании 2.79 г (1.6 мл, 0.024 моль) хлорсульфоновой кислоты, смесь нагревают до 200oС, выдерживают при этой температуре 2 ч, охлаждают до 100oС, осадок отфильтровывают горячим, промывают последовательно толуолом, ацетоном, 5%-ной соляной кислотой, сушат в вакууме, получают 8.5 г технической сульфокислоты безметального фталоцианина. Технический комплекс растворяют в водном 0.5% растворе NаОН, отделяют на центрифуге от нерастворимых примесей, после чего подкисляют разбавленной соляной кислотой. Выпавший осадок отфильтровывают, промывают 5%-ным водным раствором NаСl до нейтральной реакции, после чего промывают 80%-ным водным этанолом до отсутствия ионов хлора в промывных водах, а затем абсолютным горячим спиртом, сушат, получают 8.04 г (93%) динатриевой соли дисульфокислоты безметального фталоцианина. После дополнительной очистки комплекса переосаждением из воды этанолом получают 7.5 г (87%) динатриевой соли дисульфокислоты безметального фталоцианина. Найдено, %: N 14.99; S 9.53. С32Н16Na2N8O6S2. Вычислено, %: N 15.59; S 8.92. Согласно данным хроматографического анализа продуктов гидролиза полученный комплекс содержит 2 сульфогруппы.  макс, нм (lg макс, нм (lg ) в диметилсульфоксиде: 696 (5.06), 663 (5.04), 645, 602. ) в диметилсульфоксиде: 696 (5.06), 663 (5.04), 645, 602.  макс, нм (lg макс, нм (lg ) в буфере рН 6.86: 610 шир. (4,45).
Пример 2. Тринатривая соль трисульфокислоты безметального фталоцианита. К суспензии 2.05 г (0.004 моль) безметального фталоцианина в 15 мл перегнанного трихлорбензола добавляют при интенсивном перемешивании 0.93 г (0.53 мл, 0.008 моль) хлорсульфоновой кислоты, смесь нагревают до 200oС, выдерживают при этой температуре 1 ч, после чего охлаждают до 100oС, добавляют еще 0.93 г (0.53 мл, 0.008 моль) хлорсульфоновой кислоты (всего 4 моль на один моль РсН2), нагревают и выдерживают при 195-200oС еще 1.5 ч. После охлаждения реакционной массы до 100oС осадок отфильтровывают горячим, промывают последовательно толуолом, ацетоном, сушат на воздухе, получают 3.17 г технической сульфокислоты безметального фталоцианина. Технический комплекс растворяют в водном 0.5%-ном растворе NаОН, отделяют на центрифуге от нерастворимых примесей, после чего подкисляют 10%-ной соляной кислотой и высаливают добавлением NаСl. Выпавший осадок отфильтровывают, промывают 10%-ным водным раствором NаСl до нейтральной реакции, а затем 70%-ным водным изопропанолом до отсутствия ионов хлора в промывных водах, а затем абсолютным горячим этанолом, сушат, получают 2.13 г (65%) тринатриевой соли сульфокислоты безметального фталоцианина. После дополнительной очистки комплекса переосаждением из воды изопропанолом получают 1.9 г (58%) тринатриевой соли трисульфокислоты безметального фталоцианина. ) в буфере рН 6.86: 610 шир. (4,45).
Пример 2. Тринатривая соль трисульфокислоты безметального фталоцианита. К суспензии 2.05 г (0.004 моль) безметального фталоцианина в 15 мл перегнанного трихлорбензола добавляют при интенсивном перемешивании 0.93 г (0.53 мл, 0.008 моль) хлорсульфоновой кислоты, смесь нагревают до 200oС, выдерживают при этой температуре 1 ч, после чего охлаждают до 100oС, добавляют еще 0.93 г (0.53 мл, 0.008 моль) хлорсульфоновой кислоты (всего 4 моль на один моль РсН2), нагревают и выдерживают при 195-200oС еще 1.5 ч. После охлаждения реакционной массы до 100oС осадок отфильтровывают горячим, промывают последовательно толуолом, ацетоном, сушат на воздухе, получают 3.17 г технической сульфокислоты безметального фталоцианина. Технический комплекс растворяют в водном 0.5%-ном растворе NаОН, отделяют на центрифуге от нерастворимых примесей, после чего подкисляют 10%-ной соляной кислотой и высаливают добавлением NаСl. Выпавший осадок отфильтровывают, промывают 10%-ным водным раствором NаСl до нейтральной реакции, а затем 70%-ным водным изопропанолом до отсутствия ионов хлора в промывных водах, а затем абсолютным горячим этанолом, сушат, получают 2.13 г (65%) тринатриевой соли сульфокислоты безметального фталоцианина. После дополнительной очистки комплекса переосаждением из воды изопропанолом получают 1.9 г (58%) тринатриевой соли трисульфокислоты безметального фталоцианина.  макс, нм (lg макс, нм (lg ) в диметилсульфоксиде: 694 (1.01), 665 (1.01), 634, 606.
Пример 3. Тринатривая соль трисульфокислоты безметального фталоцианита. К суспензии 5.14 г (0.01 моль) безметального фталоцианина в 25 мл трихлорбензола добавляют при перемешивании 4.64 г (2.75 мл, 0.04 моль) хлорсульфоновой кислоты, смесь нагревают до 200oС, выдерживают при этой температуре 2 ч, охлаждают, осадок отфильтровывают, промывают бензолом, после чего экстрагируют в аппарате Сокслета ацетоном 8 ч, сушат, получают 6.8 г технической сульфокислоты безметального фталоцианина. Выделение и очистку комплекса проводят аналогично примеру 2, получают 3.15 г (38%) тринатриевой соли трисульфокислоты безметального фталоцианина. Найдено, %: С 46.13; Н 2.65; N 12.83; S 11.88. С32Н15N8Nа3O9S3. Вычислено, %: С 46.83; Н 1.84; N 13.65; S 11.72. Согласно данным хроматографического анализа продуктов гидролиза полученный Рс содержит 3.5 сульфогруппы.
Пример 4. Тетранатривая соль тетрасульфокислоты безметального фталоцианита. К суспензии 2.05 г (0.004 моль) безметального фталоцианина в 15 мл перегнанного трихлорбензола добавляют при интенсивном перемешивании 0.93 г (0.53 мл, 0.008 моль) хлорсульфоновой кислоты, смесь нагревают до 180oС, выдерживают при этой температуре 40 мин. Реакционную смесь охлаждают до 100oС, добавляют 0.93 г (0.53 мл, 0.008 моль) хлорсульфоновой кислоты, нагревают и выдерживают при 190-200oС еще 40 мин, после чего опять охлаждают до 100oС, добавляют еще 0.93 г (0.53 мл, 0.008 моль) хлорсульфоновой кислоты (всего 6 моль на один моль РсН2), нагревают и выдерживают при 195-200oС еще 1 час. После окончания всех выдержек реакционную массу охлаждают до 100oС, осадок отфильтровывают горячим, промывают горячим толуом и ацетоном, сушат на воздухе. Техническую сульфокислоту растворяют в 0.5%-ной водной NаОН, отфильтровывают от нерастворимых примесей и высаливают добавлением NаС1. Выпавший осадок отфильтровывают, промывают насыщенным водным раствором NаСl до нейтральной реакции, а затем ацетоном и 70%-ным водным изопропанолом до отсутствия солей в промывных водах, сушат, получают 1.1 г (30%) тетранатриевой соли тетрасульфокислоты безметального фталоцианина. Найдено, %: С 42.12; Н 2.90; N 11.30; S 11.53. С32Н14N8Nа4O12S4. Вычислено, %: С 41.65; Н 1.53; N 12.14; S 13.90. ) в диметилсульфоксиде: 694 (1.01), 665 (1.01), 634, 606.
Пример 3. Тринатривая соль трисульфокислоты безметального фталоцианита. К суспензии 5.14 г (0.01 моль) безметального фталоцианина в 25 мл трихлорбензола добавляют при перемешивании 4.64 г (2.75 мл, 0.04 моль) хлорсульфоновой кислоты, смесь нагревают до 200oС, выдерживают при этой температуре 2 ч, охлаждают, осадок отфильтровывают, промывают бензолом, после чего экстрагируют в аппарате Сокслета ацетоном 8 ч, сушат, получают 6.8 г технической сульфокислоты безметального фталоцианина. Выделение и очистку комплекса проводят аналогично примеру 2, получают 3.15 г (38%) тринатриевой соли трисульфокислоты безметального фталоцианина. Найдено, %: С 46.13; Н 2.65; N 12.83; S 11.88. С32Н15N8Nа3O9S3. Вычислено, %: С 46.83; Н 1.84; N 13.65; S 11.72. Согласно данным хроматографического анализа продуктов гидролиза полученный Рс содержит 3.5 сульфогруппы.
Пример 4. Тетранатривая соль тетрасульфокислоты безметального фталоцианита. К суспензии 2.05 г (0.004 моль) безметального фталоцианина в 15 мл перегнанного трихлорбензола добавляют при интенсивном перемешивании 0.93 г (0.53 мл, 0.008 моль) хлорсульфоновой кислоты, смесь нагревают до 180oС, выдерживают при этой температуре 40 мин. Реакционную смесь охлаждают до 100oС, добавляют 0.93 г (0.53 мл, 0.008 моль) хлорсульфоновой кислоты, нагревают и выдерживают при 190-200oС еще 40 мин, после чего опять охлаждают до 100oС, добавляют еще 0.93 г (0.53 мл, 0.008 моль) хлорсульфоновой кислоты (всего 6 моль на один моль РсН2), нагревают и выдерживают при 195-200oС еще 1 час. После окончания всех выдержек реакционную массу охлаждают до 100oС, осадок отфильтровывают горячим, промывают горячим толуом и ацетоном, сушат на воздухе. Техническую сульфокислоту растворяют в 0.5%-ной водной NаОН, отфильтровывают от нерастворимых примесей и высаливают добавлением NаС1. Выпавший осадок отфильтровывают, промывают насыщенным водным раствором NаСl до нейтральной реакции, а затем ацетоном и 70%-ным водным изопропанолом до отсутствия солей в промывных водах, сушат, получают 1.1 г (30%) тетранатриевой соли тетрасульфокислоты безметального фталоцианина. Найдено, %: С 42.12; Н 2.90; N 11.30; S 11.53. С32Н14N8Nа4O12S4. Вычислено, %: С 41.65; Н 1.53; N 12.14; S 13.90.  макс, нм (lg макс, нм (lg ) в диметилсульфоксиде: 695 (4.96), 666 (4.94), 634, 606.
Пример 5. Дисульфокислота фталоцианина цинка. К суспензии 11.54 г (0.02 моль) фталоцианина цинка в 70 мл трихлорбензола добавляют при перемешивании 4.64 г (2.62 мл, 0.04 моль) хлорсульфоновой кислоты, смесь нагревают до 210oС, выдерживают при этой температуре 2 ч, охлаждают, осадок отфильтровывают, промывают бензолом, после чего экстрагируют в аппарате Сокслета ацетоном в течение 8 ч, сушат, получают 14.96 г технической сульфокислоты фталоцианина цинка. Для очистки технический продукт растворяют в 800 мл 1%-ного водного раствора NaОН, отфильтровывают от нерастворимых примесей, маточник подкисляют конц. НСl, выпавший осадок отфильтровывают и промывают водой до появления светло-голубой окраски фильтрата (рН 2-3), сушат в вакууме и после экстракции в аппарате Сокслета ацетоном в течение 10 ч получают 13.46 г (91%) дисульфокислоты фталоцианина цинка. Найдено, %: S 8.24. С32Н16N8O6S2Zn. Вычислено, %: S 8.86.
Согласно данным хроматографического анализа продуктов гидролиза полученный Рс содержит 2 сульфогруппы. Для получения натриевой соли сульфокислоту суспендируют в дистиллированной воде и добавляют при перемешивании 0.5%-ный водный раствор NаОН доводя рН раствора до 8.3, после чего растворитель упаривают, а остаток промывают этанолом. ) в диметилсульфоксиде: 695 (4.96), 666 (4.94), 634, 606.
Пример 5. Дисульфокислота фталоцианина цинка. К суспензии 11.54 г (0.02 моль) фталоцианина цинка в 70 мл трихлорбензола добавляют при перемешивании 4.64 г (2.62 мл, 0.04 моль) хлорсульфоновой кислоты, смесь нагревают до 210oС, выдерживают при этой температуре 2 ч, охлаждают, осадок отфильтровывают, промывают бензолом, после чего экстрагируют в аппарате Сокслета ацетоном в течение 8 ч, сушат, получают 14.96 г технической сульфокислоты фталоцианина цинка. Для очистки технический продукт растворяют в 800 мл 1%-ного водного раствора NaОН, отфильтровывают от нерастворимых примесей, маточник подкисляют конц. НСl, выпавший осадок отфильтровывают и промывают водой до появления светло-голубой окраски фильтрата (рН 2-3), сушат в вакууме и после экстракции в аппарате Сокслета ацетоном в течение 10 ч получают 13.46 г (91%) дисульфокислоты фталоцианина цинка. Найдено, %: S 8.24. С32Н16N8O6S2Zn. Вычислено, %: S 8.86.
Согласно данным хроматографического анализа продуктов гидролиза полученный Рс содержит 2 сульфогруппы. Для получения натриевой соли сульфокислоту суспендируют в дистиллированной воде и добавляют при перемешивании 0.5%-ный водный раствор NаОН доводя рН раствора до 8.3, после чего растворитель упаривают, а остаток промывают этанолом.  макс, нм (lg макс, нм (lg ) в диметилформамиде: 671 (5.33).
Пример 6. Трисульфокислота фталоцианина цинка. К суспензии 2.0 г (0.0035 моль) фталоцианина цинка в 12 мл перегнанного трихлорбензола добавляют при интенсивном перемешивании 0.81 г (0.46 мл, 0.007 моль) хлорсульфоновой кислоты, смесь нагревают до 205-210oС, выдерживают при этой температуре 1 ч, после чего охлаждают до 100oС, добавляют еще 0.81 г (0.46 мл, 0.007 моль) хлорсульфоновой кислоты (всего 4 моль на один моль РсZn), нагревают и выдерживают при 205-210oС еще 1.5 ч. Выделение и очистку комплекса проводят аналогично примеру 4, получают 1.87 г (65%) трисульфокислоты фталоцианина цинка. Найдено, %: S 11.18. С32Н16N8O9S3Zn. Вычислено, %: S 11.76. Согласно данным хроматографического анализа продуктов гидролиза полученный Рс содержит 2.9 сульфогруппы. Натриевую соль трисульфокислоты фталоцианина цинка получают аналогично примеру 2. ) в диметилформамиде: 671 (5.33).
Пример 6. Трисульфокислота фталоцианина цинка. К суспензии 2.0 г (0.0035 моль) фталоцианина цинка в 12 мл перегнанного трихлорбензола добавляют при интенсивном перемешивании 0.81 г (0.46 мл, 0.007 моль) хлорсульфоновой кислоты, смесь нагревают до 205-210oС, выдерживают при этой температуре 1 ч, после чего охлаждают до 100oС, добавляют еще 0.81 г (0.46 мл, 0.007 моль) хлорсульфоновой кислоты (всего 4 моль на один моль РсZn), нагревают и выдерживают при 205-210oС еще 1.5 ч. Выделение и очистку комплекса проводят аналогично примеру 4, получают 1.87 г (65%) трисульфокислоты фталоцианина цинка. Найдено, %: S 11.18. С32Н16N8O9S3Zn. Вычислено, %: S 11.76. Согласно данным хроматографического анализа продуктов гидролиза полученный Рс содержит 2.9 сульфогруппы. Натриевую соль трисульфокислоты фталоцианина цинка получают аналогично примеру 2.  макс, нм (lg макс, нм (lg ) в диметилформамиде: 672 (5.23).
Пример 7. Тринатриевая соль трисульфокислоты фталоцианина цинка. К суспензии 5.77 г (0.01 моль) фталоцианина цинка в 25 мл трихлорбензола добавляют при перемешивании 4.64 г (2.62 мл, 0.04 моль) хлорсульфоновой кислоты, смесь нагревают до 210oС, выдерживают при этой температуре 3 ч, охлаждают, осадок отфильтровывают, промывают бензолом, после чего экстрагируют в аппарате Сокслета ацетоном 5 ч, сушат, получают 5.4 г технической сульфокислоты фталоцианина цинка. Для очистки технический продукт растворяют в 250 мл 1%-ного водного раствора NаОН, отфильтровывают от нерастворимых примесей, в маточник добавляют 20 г NаСl и подкисляют конц. НСl до рН 1. После полного растворения NаСl выпавший осадок натриевой соли сульфокислоты фталоцианина цинка отфильтровывают, промывают водным солевым раствором до рН 6, этанолом, сушат. После повторного переосаждения с последующей промывкой 80%-ным водным этанолом и экстракцией в аппарате Сокслета этанолом получают 2.7 г (34.5%) тринатриевой соли трисульфокислоты фталоцианина цинка. Найдено, %: С 42.96; Н 2.5; N 12.60; S 11.18. С32Н13Na3N8O9S3Zn. Вычислено, %: С 43.42; Н 1.59; N 12.66; S 10.87. Согласно данным хроматографического анализа продуктов гидролиза полученный Рс содержит 2.9 сульфогруппы. ) в диметилформамиде: 672 (5.23).
Пример 7. Тринатриевая соль трисульфокислоты фталоцианина цинка. К суспензии 5.77 г (0.01 моль) фталоцианина цинка в 25 мл трихлорбензола добавляют при перемешивании 4.64 г (2.62 мл, 0.04 моль) хлорсульфоновой кислоты, смесь нагревают до 210oС, выдерживают при этой температуре 3 ч, охлаждают, осадок отфильтровывают, промывают бензолом, после чего экстрагируют в аппарате Сокслета ацетоном 5 ч, сушат, получают 5.4 г технической сульфокислоты фталоцианина цинка. Для очистки технический продукт растворяют в 250 мл 1%-ного водного раствора NаОН, отфильтровывают от нерастворимых примесей, в маточник добавляют 20 г NаСl и подкисляют конц. НСl до рН 1. После полного растворения NаСl выпавший осадок натриевой соли сульфокислоты фталоцианина цинка отфильтровывают, промывают водным солевым раствором до рН 6, этанолом, сушат. После повторного переосаждения с последующей промывкой 80%-ным водным этанолом и экстракцией в аппарате Сокслета этанолом получают 2.7 г (34.5%) тринатриевой соли трисульфокислоты фталоцианина цинка. Найдено, %: С 42.96; Н 2.5; N 12.60; S 11.18. С32Н13Na3N8O9S3Zn. Вычислено, %: С 43.42; Н 1.59; N 12.66; S 10.87. Согласно данным хроматографического анализа продуктов гидролиза полученный Рс содержит 2.9 сульфогруппы.  макс, нм (lg макс, нм (lg ) в диметилформамиде: 672 (5.23).
Пример 8. Дисульфокислота фталоцианина меди. К суспензии 3.0 г (0.0052 моль) фталоцианина меди в 15 мл трихлорбензола добавляют при перемешивании 2.42 г (1.4 мл, 0.021 моль) хлорсульфоновой кислоты, смесь нагревают до 190oС и выдерживают при 190-200oС в течение 2 ч. Реакционную массу охлаждают до 100oС, осадок отфильтровывают и промывают последовательно толуолом, метанолом, ацетоном, сушат, получают 4.05 г технической сульфокислоты фталоцианина меди. Для очистки технический продукт растворяют в 1%-ном водном растворе NаОН, отфильтровывают от нерастворимых примесей, маточник подкисляют конц. НСl, выпавший осадок отфильтровывают и промывают последовательно 5%-ным раствором НСl, ацетоном, этанолом, сушат, получают 3.6 г (89%) дисульфокислоты фталоцианина меди. Найдено, %: С 50.83; Н 2.45; N 13.87; S 10.19. С32Н16СuN8O7.5S2.5. Вычислено, %: С 49.15; Н 2.08; N 14.44; S 10.33. ) в диметилформамиде: 672 (5.23).
Пример 8. Дисульфокислота фталоцианина меди. К суспензии 3.0 г (0.0052 моль) фталоцианина меди в 15 мл трихлорбензола добавляют при перемешивании 2.42 г (1.4 мл, 0.021 моль) хлорсульфоновой кислоты, смесь нагревают до 190oС и выдерживают при 190-200oС в течение 2 ч. Реакционную массу охлаждают до 100oС, осадок отфильтровывают и промывают последовательно толуолом, метанолом, ацетоном, сушат, получают 4.05 г технической сульфокислоты фталоцианина меди. Для очистки технический продукт растворяют в 1%-ном водном растворе NаОН, отфильтровывают от нерастворимых примесей, маточник подкисляют конц. НСl, выпавший осадок отфильтровывают и промывают последовательно 5%-ным раствором НСl, ацетоном, этанолом, сушат, получают 3.6 г (89%) дисульфокислоты фталоцианина меди. Найдено, %: С 50.83; Н 2.45; N 13.87; S 10.19. С32Н16СuN8O7.5S2.5. Вычислено, %: С 49.15; Н 2.08; N 14.44; S 10.33.  макс, нм (lg макс, нм (lg ) в диметилсульфоксиде: 674 (5.23).
Пример 9. Трисульфокислота фталоцианина палладия. К суспензии 1.55 г (0.0025 моль) фталоцианина палладия в 5 мл трихлорбензола добавляют при интенсивном перемешивании 1.17 г (0.66 мл, 0.01 моль) хлорсульфоновой кислоты, смесь нагревают до 190oС и выдерживают при этой температуре 2 ч. Выделение и очистку комплекса проводят аналогично примеру 8, получают 1.41 г (66%) трисульфокислоты фталоцианина палладия. Найдено, %: N 12.51; S 10.62. С32Н16N8O9РdS3. Вычислено, %: N 13.04; S 11.20. Согласно данным хроматографического анализа продуктов гидролиза полученный Рс содержит 3.2 сульфогруппы. ) в диметилсульфоксиде: 674 (5.23).
Пример 9. Трисульфокислота фталоцианина палладия. К суспензии 1.55 г (0.0025 моль) фталоцианина палладия в 5 мл трихлорбензола добавляют при интенсивном перемешивании 1.17 г (0.66 мл, 0.01 моль) хлорсульфоновой кислоты, смесь нагревают до 190oС и выдерживают при этой температуре 2 ч. Выделение и очистку комплекса проводят аналогично примеру 8, получают 1.41 г (66%) трисульфокислоты фталоцианина палладия. Найдено, %: N 12.51; S 10.62. С32Н16N8O9РdS3. Вычислено, %: N 13.04; S 11.20. Согласно данным хроматографического анализа продуктов гидролиза полученный Рс содержит 3.2 сульфогруппы.  макс, нм (lg макс, нм (lg ) в диметилсульфоксиде: 663 (5.20).
Пример 10. Сульфокислота фталоцианина родия хлорида. К суспензии 1.8 г (0.0028 моль) фталоцианина родия хлорида в 7 мл трихлорбензола добавляют при перемешивании 0.64 г (0.36 мл, 0.006 моль) хлорсульфоновой кислоты, смесь нагревают до 200oС и выдерживают при этой температуре в течение 2 ч. Реакционную массу охлаждают до 100oС, осадок отфильтровывают, промывают толуолом, сушат, получают 2.25 г технической сульфокислоты фталоцианина родия хлорида. Для очистки технический продукт растворяют в 1%-ном водном растворе NаОН, отфильтровывают от непрореагировавшего PcRhCl, маточник подкисляют конц. НСl, выпавший осадок отфильтровывают, промывают 5%-ным раствором НСl, сушат и после экстракции при нагревании с дихлорбензолом органических примесей получают 0.88 г (40% в расчете на загруженный PcRhCl, или 59% с учетом непрореагировавшего PcRhCl) сульфокислоты фталоцианина родия хлорида. Найдено, %: S 5.49. С32Н16СlN8O3RhS. Вычислено, %: S 4.39 ) в диметилсульфоксиде: 663 (5.20).
Пример 10. Сульфокислота фталоцианина родия хлорида. К суспензии 1.8 г (0.0028 моль) фталоцианина родия хлорида в 7 мл трихлорбензола добавляют при перемешивании 0.64 г (0.36 мл, 0.006 моль) хлорсульфоновой кислоты, смесь нагревают до 200oС и выдерживают при этой температуре в течение 2 ч. Реакционную массу охлаждают до 100oС, осадок отфильтровывают, промывают толуолом, сушат, получают 2.25 г технической сульфокислоты фталоцианина родия хлорида. Для очистки технический продукт растворяют в 1%-ном водном растворе NаОН, отфильтровывают от непрореагировавшего PcRhCl, маточник подкисляют конц. НСl, выпавший осадок отфильтровывают, промывают 5%-ным раствором НСl, сушат и после экстракции при нагревании с дихлорбензолом органических примесей получают 0.88 г (40% в расчете на загруженный PcRhCl, или 59% с учетом непрореагировавшего PcRhCl) сульфокислоты фталоцианина родия хлорида. Найдено, %: S 5.49. С32Н16СlN8O3RhS. Вычислено, %: S 4.39  макс, нм в диметилсульфоксиде: 654.
Пример 11. Дисульфокислота фталоцианина родия хлорида. К суспензии 3.6 г (0.0056 моль) фталоцианина родия хлорида в 15 мл трихлорбензола добавляют при перемешивании 2.21 г (1.25 мл, 0.019 моль) хлорсульфоновой кислоты, смесь нагревают до 200oС и выдерживают при этой температуре в течение 2 ч. Выделение и очистку комплекса проводят аналогично примеру 11, получают 3.4 г (75%) дисульфокислоты фталоцианина родия хлорида. Найдено, %: S 7.23. С32Н16СlN8O6RhS2. Вычислено, %: S 7.91. макс, нм в диметилсульфоксиде: 654.
Пример 11. Дисульфокислота фталоцианина родия хлорида. К суспензии 3.6 г (0.0056 моль) фталоцианина родия хлорида в 15 мл трихлорбензола добавляют при перемешивании 2.21 г (1.25 мл, 0.019 моль) хлорсульфоновой кислоты, смесь нагревают до 200oС и выдерживают при этой температуре в течение 2 ч. Выделение и очистку комплекса проводят аналогично примеру 11, получают 3.4 г (75%) дисульфокислоты фталоцианина родия хлорида. Найдено, %: S 7.23. С32Н16СlN8O6RhS2. Вычислено, %: S 7.91.  макс, нм в диметилсульфоксиде: 657.
Пример 12. Трисульфокислота фталоцианина родия хлорида. К суспензии 0.8 г (0.0012 моль) фталоцианина родия хлорида в 5 мл трихлорбензола добавляют при перемешивании 1.15 г (0.65 мл, 0.01 моль) хлорсульфоновой кислоты, смесь нагревают до 200oС и выдерживают при этой температуре в течение 2 ч. Выделение и очистку комплекса проводят аналогично примеру 11, получают 0.69 г (60%) трисульфокислоты фталоцианина родия хлорида. Найдено, %: S 10.32. С32Н16СlN8O9RhS3. Вычислено, %: S 10.79. макс, нм в диметилсульфоксиде: 657.
Пример 12. Трисульфокислота фталоцианина родия хлорида. К суспензии 0.8 г (0.0012 моль) фталоцианина родия хлорида в 5 мл трихлорбензола добавляют при перемешивании 1.15 г (0.65 мл, 0.01 моль) хлорсульфоновой кислоты, смесь нагревают до 200oС и выдерживают при этой температуре в течение 2 ч. Выделение и очистку комплекса проводят аналогично примеру 11, получают 0.69 г (60%) трисульфокислоты фталоцианина родия хлорида. Найдено, %: S 10.32. С32Н16СlN8O9RhS3. Вычислено, %: S 10.79.  макс, нм в диметилсульфоксиде: 659.
Таким образом, предлагаемый способ обеспечивает получение сульфозамещенных фталоцианинов высокой степени чистоты и одновременно позволяет сократить количество кислых стоков. макс, нм в диметилсульфоксиде: 659.
Таким образом, предлагаемый способ обеспечивает получение сульфозамещенных фталоцианинов высокой степени чистоты и одновременно позволяет сократить количество кислых стоков.
Формула изобретения
|
||||||||||||||||||||||||||
