Патент на изобретение №2181729
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ МУРАМОВОЙ КИСЛОТЫ
(57) Реферат: Изобретение относится к соединениям формулы (1), где Х – С1-С20-алкил, за исключением Х – бутил, гептил или гексадецил, или С3-С9-циклоалкил, незамещенный или замещенный С1-С3-алкилом, или адамантил, незамещенный или замещенный С1-С3-алкилом, или С6-С12-арил, незамещенный или замещенный одним или тремя С1-С3-алкилами. Соединения обладают высокой иммуномодулирующей активностью и высокой биологической доступностью. 2 табл. 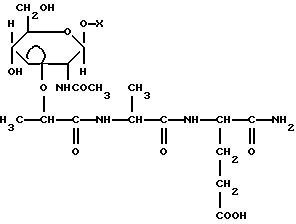
Изобретение относится к новым производным мурамовой кислоты, которые могут найти применение в народном хозяйстве, в частности в медицине. Известно, что мурамилдипептид способен активировать основные звенья иммунитета, в частности, противоопухолевого ответа. Однако, обладая высокой гидрофильностью, он быстро выводится из организма и является высоко пирогенным. Известно и другое производное мурамовой кислоты –  -гептилгликозид-N-ацетилмурамил-L-аланил-D-изоглутамин ( -гептилгликозид-N-ацетилмурамил-L-аланил-D-изоглутамин ( Указанное амфифильное соединение активирует основные звенья иммунитета и стимулирует противоопухолевый иммунный ответ, эффективнее немодифицированного МДП.
Недостатком этого производного является его сравнительно невысокая иммуномодулирующая активность.
Задача изобретения – создание новых производных мурамовой кислоты, обладающих более высокой иммуномодулирующей активностью и большей биологической доступностью при разных формах введения.
Указанная задача решается производными мурамовой кислоты общей формулы
Указанное амфифильное соединение активирует основные звенья иммунитета и стимулирует противоопухолевый иммунный ответ, эффективнее немодифицированного МДП.
Недостатком этого производного является его сравнительно невысокая иммуномодулирующая активность.
Задача изобретения – создание новых производных мурамовой кислоты, обладающих более высокой иммуномодулирующей активностью и большей биологической доступностью при разных формах введения.
Указанная задача решается производными мурамовой кислоты общей формулы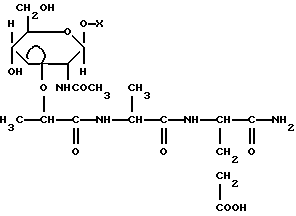 где Х – C1-С20-алкил, за исключением Х – гептил или гексадецил, или С3-С9-циклоалкил, незамещенный или замещенный C1-С3-алкилом, или адамантил, незамещенный или замещенный C1-С3-алкилом, или С6-C12-арил, незамещенный или замещенный одним или тремя C1-С3-алкилами. Указанные соединения могут быть получены, в частности, последовательным гликозилированием спиртов или фенолов в присутствии соответственно иодида ртути или гидроксида натрия и тетраалкиламмоний хлорида, деацетилированием метанолом в присутствии каталитического количества метилата натрия, изопропилиденированием 2,2-диметоксипропаном, алкилированием S-2-бромпропановой кислотой в присутствии гидрида натрия, конденсацией с трифторацетатом бензилового эфира L-аланил-D-изоглутамина N-оксисукцинимидным методом, кислотным гидролизом изопропилиденовой группы и каталитического гидрогенолиза бензилового эфира. Нижеследующие примеры иллюстрируют синтез соединений по изобретению и их биологическую активность. Общие методики синтеза Гликозилирование в присутствии Hgl2. К раствору 2-ацетамидо-3,4,6-три-0-ацетил-2-дезокси-  -0-глюкопиранозилхлорида (1) в сухом дихлорэтане (25 мл/г) добавили 1,16 экв. иодида ртути (II) и 1 экв. спирта. Реакционную смесь перемешивали в присутствии молекулярных сит 0,3 нм до исчезновения гликозил-донора (контроль ТСХ в системе хлороформ – бензол – этанол, 10:1:1). Молекулярные сита и катализатор отфильтровали, фильтрат разбавили хлороформом, промыли раствором тиосульфата натрия и водой. Органический слой отделили, осушили безводным Na2SO4 и упарили. Остаток очищали кристаллизацией или колоночной хроматографией.
Дезацетилирование -0-глюкопиранозилхлорида (1) в сухом дихлорэтане (25 мл/г) добавили 1,16 экв. иодида ртути (II) и 1 экв. спирта. Реакционную смесь перемешивали в присутствии молекулярных сит 0,3 нм до исчезновения гликозил-донора (контроль ТСХ в системе хлороформ – бензол – этанол, 10:1:1). Молекулярные сита и катализатор отфильтровали, фильтрат разбавили хлороформом, промыли раствором тиосульфата натрия и водой. Органический слой отделили, осушили безводным Na2SO4 и упарили. Остаток очищали кристаллизацией или колоночной хроматографией.
ДезацетилированиеК раствору ацетата в сухом метаноле (10 мл/г) добавили 0,01-0,05 экв. 0,1 н. раствора метилата натрия в метаноле, выдержали 12-24 ч. Раствор нейтрализовали катионитом КУ-2 (Н+), смолу промыли метанолом и фильтрат упарили. Изопропилиденирование К раствору триола в диоксане или тетрагидрофуране (50 мл/г) при нагревании до 60oС, добавили 3 экв. 2,2-диметоксипропана и 10-20 мг сухой TsOH. Через 1 ч (контроль ТСХ в системе хлороформ – этанол, 15:1) реакционную смесь нейтрализовали пиридином и упарили. Остаток растворили в 50 мл хлороформа, промыли водой (3  25 мл). Органический слой высушили безводным Na2SO4 и упарили досуха. Изопропилиденовое производное очищали колоночной хроматографией (элюент: хлороформ –> хлороформ – этанол, 20:1).
Получение мурамовых кислот 25 мл). Органический слой высушили безводным Na2SO4 и упарили досуха. Изопропилиденовое производное очищали колоночной хроматографией (элюент: хлороформ –> хлороформ – этанол, 20:1).
Получение мурамовых кислотК раствору сахарида со свободной С-3-ОН группой в сухом диоксане (20 мл/г) при перемешивании порциями добавили 4 экв. гидрида натрия. Реакционную смесь нагрели до 95oС, выдержали при этой температуре 1 ч и после охлаждения до 65oС прилили 1,5 экв. S-2-бромпропановой кислоты и выдержали при 65oС еще 3 ч. После охлаждения избыток гидрида натрия разложили этанолом, смесь концентрировали и вылили в холодную воду. Раствор подкислили 2 н. серной кислотой до рН 2-3 и экстрагировали мурамовую кислоту хлороформом. Экстракт высушили безводным Na2SO4 и упарили. Конденсация N-оксисукцинимидным методом К раствору кислоты в сухом диоксане или ТГФ (10-20 мл/г) при перемешивании добавили 1,1 экв. N-гидроксисукцинимида (HOSu) и 1,1 экв. N,N’-дициклогексилкарбодиимида (DCC). Через 3-5 ч отфильтровали осадок дициклогексилмочевины, промыли его растворителем. К фильтрату добавили 1 экв. трифторацетата бензилового эфира L-аланил-D-изоглутамина и триэтиламин до рН 8. По окончании реакции продукт отделили фильтрованием. Гидролиз изопропилиденовых производных Изопропилиденовые производные растворили при нагревании на кипящей водяной бане в 80% уксусной кислоте (10 мл/г) и выдержали при этой температуре 20 мин (контроль ТСХ в системе хлороформ – этанол, 5:1). Раствор упарили досуха, остаток очистили колоночной хроматографией (элюент: хлороформ хлороформ –> этанол, 10:1). Гидрогенолиз бензильных защит Вещество растворили в этаноле, ТГФ или их смеси (50-100 мл/г) и подвергли гидрогенолизу над 10% Pd/C (1:5 к веществу) при комнатной температуре. Время реакции составляло 2-5 ч. По окончании реакции (контроль ТСХ в системе бутанол-1 – уксусная кислота – вода, 3:1:1) катализатор отфильтровали, промыли растворителем, фильтрат упарили. Остаток затерли в эфире. Примеры синтеза производных мурамовой кислоты Пример 1. 0-(Гексил-2-ацетамидо-2-дезокси-  -D-глюкопиранозид-3-ил)-D-лактоил-L-аланил-D-изоглутамин (2).
Гексанол-1 (0,30 мл, 2,36 ммоль) гликозилировали 0,86 г (2,36 ммоль) хлорида 1 и после кристаллизации из эфира получили 0,45 г (45%) гексил-2-ацетамидо-3,4,6-три-0-ацетил-2-дезокси-р-0-глюкопиранозида (2а). Аналитический образец перекристаллизовали из смеси эфир – гексан; т. пл. 125-127oС, [ -D-глюкопиранозид-3-ил)-D-лактоил-L-аланил-D-изоглутамин (2).
Гексанол-1 (0,30 мл, 2,36 ммоль) гликозилировали 0,86 г (2,36 ммоль) хлорида 1 и после кристаллизации из эфира получили 0,45 г (45%) гексил-2-ацетамидо-3,4,6-три-0-ацетил-2-дезокси-р-0-глюкопиранозида (2а). Аналитический образец перекристаллизовали из смеси эфир – гексан; т. пл. 125-127oС, [ ]54б-17 ]54б-17 (с 1,0; хлороформ). ‘Н-ЯМР (300 МГц, С2НСl3): 0,88 т (с 1,0; хлороформ). ‘Н-ЯМР (300 МГц, С2НСl3): 0,88 т 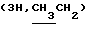 , 1,28 м и 1,57 м ([СН2]n), 1,95с, 2,02с, 2,03с, 2,08с (12Н, NAc и 3 ОАс), 3,47 дт и 3,85 дт (2Н, С-1-ОСН3, Jгем 9,5 Гц), 3,70 ддд (1Н, Н-5, J5,6а 2,5 Гц, J5.6b 5 Гц), 3,83 ддд (1Н, Н-2, J2,3 10 Гц), 4,13 дд и 4,28 дд (2Н, Н-6a, Н-6b, J6а,6b 12 Гц), 4,69 д (1Н, Н-1, J1,2 8,5 Гц), 5,07 дд (1Н, Н-4, J4,5 9,5 Гц), 5,32 дд (1Н, Н-3, J3,4 9,5 Гц), 5,63 д (1Н, NH, J2,NH 8,5 Гц).
1,54 г (3,57 ммоль) ацетата 2а дезацетилировали и получили 1,0 г (92%) гексил-2-ацетамидо-2- дезокси- , 1,28 м и 1,57 м ([СН2]n), 1,95с, 2,02с, 2,03с, 2,08с (12Н, NAc и 3 ОАс), 3,47 дт и 3,85 дт (2Н, С-1-ОСН3, Jгем 9,5 Гц), 3,70 ддд (1Н, Н-5, J5,6а 2,5 Гц, J5.6b 5 Гц), 3,83 ддд (1Н, Н-2, J2,3 10 Гц), 4,13 дд и 4,28 дд (2Н, Н-6a, Н-6b, J6а,6b 12 Гц), 4,69 д (1Н, Н-1, J1,2 8,5 Гц), 5,07 дд (1Н, Н-4, J4,5 9,5 Гц), 5,32 дд (1Н, Н-3, J3,4 9,5 Гц), 5,63 д (1Н, NH, J2,NH 8,5 Гц).
1,54 г (3,57 ммоль) ацетата 2а дезацетилировали и получили 1,0 г (92%) гексил-2-ацетамидо-2- дезокси- -D- глюкопиранозида (2б), которое изопропилиденировали и получили 0,61 г (54%) гексил-2-ацетамидо- 2-дезокси-4,6-0-изопропилиден -D- глюкопиранозида (2б), которое изопропилиденировали и получили 0,61 г (54%) гексил-2-ацетамидо- 2-дезокси-4,6-0-изопропилиден – D-глюкопиранозида (2в); стеклообразный продукт, [ – D-глюкопиранозида (2в); стеклообразный продукт, [ ]54б-88 ]54б-88 (с 1,0; хлороформ).
Алкилированием 485 мг (1,41 ммоль) соединения 2в 5-2-бромпропановой кислотой синтезировали 0,57 г (97%) гексил-2-ацетамидо-2-дезокси-4,6-0-изопропилиден-3-0-(D-1-карбоксиэтил)- (с 1,0; хлороформ).
Алкилированием 485 мг (1,41 ммоль) соединения 2в 5-2-бромпропановой кислотой синтезировали 0,57 г (97%) гексил-2-ацетамидо-2-дезокси-4,6-0-изопропилиден-3-0-(D-1-карбоксиэтил)- -D-глюкопиранозида (2г), которые конденсировали с трифторацетатом бензилового эфира L-аланил-D-изоглутамина. В гликопептидном 2д производном гидролизовали изопропилиденовую защиту и получили 0,48 г (55%) бензилового эфира 0-(гексил-2-ацетамидо-2- дезокси- -D-глюкопиранозида (2г), которые конденсировали с трифторацетатом бензилового эфира L-аланил-D-изоглутамина. В гликопептидном 2д производном гидролизовали изопропилиденовую защиту и получили 0,48 г (55%) бензилового эфира 0-(гексил-2-ацетамидо-2- дезокси- -D-глюкопиранозид-3-ил) -D-лактоил-L-аланил-D- изоглутамина (2е), аморфный порошок, [ -D-глюкопиранозид-3-ил) -D-лактоил-L-аланил-D- изоглутамина (2е), аморфный порошок, [ ]54б-2 ]54б-2 (с 1,0; этанол). ‘Н-ЯМР (300 МГц, DMSO-d6): 0,85 т (с 1,0; этанол). ‘Н-ЯМР (300 МГц, DMSO-d6): 0,85 т  – 1,22 м – 1,22 м 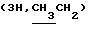 1,24 м и 1,43 м ([СН2]n), 1,75с (3Н, NAc), 1,77 м и 2,01 м (2Н, 1,24 м и 1,43 м ([СН2]n), 1,75с (3Н, NAc), 1,77 м и 2,01 м (2Н, 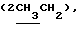 -СН2-Glu), 2,35 т (2Н, -СН2-Glu), 2,35 т (2Н,  –CH2-Glu), 4,10 ддд (1Н, CH-Glu), 4,18 дк (1Н, CH-Ala), 4,22 к –CH2-Glu), 4,10 ддд (1Н, CH-Glu), 4,18 дк (1Н, CH-Ala), 4,22 к  – 4,35 д (1Н, H-1, J1.2 8 Гц), 4,61 т (1Н, С-6-ОН), 5,04с (2Н, COOCH2Ph), 5,28а (1Н, С-4-ОН), 7,13с и 7,29с (2Н, CONH2-Glu), 7,36 м (5Н, Ph), 7,39 д, 7,80 д и 8,13 д (3Н, 3 NH).
В 250 мг (0,38 ммоль) соединения 2е удалили гидрогенолизом бензиловый эфир. Добавлением эфира высадили 170 мг (78%) аморфного гликопептида 2; [ – 4,35 д (1Н, H-1, J1.2 8 Гц), 4,61 т (1Н, С-6-ОН), 5,04с (2Н, COOCH2Ph), 5,28а (1Н, С-4-ОН), 7,13с и 7,29с (2Н, CONH2-Glu), 7,36 м (5Н, Ph), 7,39 д, 7,80 д и 8,13 д (3Н, 3 NH).
В 250 мг (0,38 ммоль) соединения 2е удалили гидрогенолизом бензиловый эфир. Добавлением эфира высадили 170 мг (78%) аморфного гликопептида 2; [ ]54б+5 ]54б+5 (с 0,83; этанол).
Пример 2. 0-(Октил-2-ацетамидо-2-дезокси- (с 0,83; этанол).
Пример 2. 0-(Октил-2-ацетамидо-2-дезокси- -D-глюкопиранозид-3-ил) -D-лактоил-L-аланил-D-изоглутамин (3).
Октанол-1 (0,40 мл, 3,28 ммоль) гликозилировали 1,0 г (2,73 ммоль) хлорида 1 и после очистки колоночной хроматографией (элюент: бензол –> бензол – этанол, 50:1) получили 0,95 г (76%) октил-2-ацетамидо-3,4,6-три-0-ацетил- 2-дезокси- -D-глюкопиранозид-3-ил) -D-лактоил-L-аланил-D-изоглутамин (3).
Октанол-1 (0,40 мл, 3,28 ммоль) гликозилировали 1,0 г (2,73 ммоль) хлорида 1 и после очистки колоночной хроматографией (элюент: бензол –> бензол – этанол, 50:1) получили 0,95 г (76%) октил-2-ацетамидо-3,4,6-три-0-ацетил- 2-дезокси- -D-глюкопиранозида (3а). Аналитический образец перекристаллизовали из смеси эфир – гексан; т. пл. 103-105oС, [ -D-глюкопиранозида (3а). Аналитический образец перекристаллизовали из смеси эфир – гексан; т. пл. 103-105oС, [ ]54б-31 ]54б-31 (с 1,0; хлороформ). ‘Н-ЯМР (300 МГц, С2НСl3): 0,88т (с 1,0; хлороформ). ‘Н-ЯМР (300 МГц, С2НСl3): 0,88т 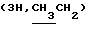 1,26 м и 1,56 м ([СН2]n), 1,95с, 2,02с, 2,03с, 2,08с (12Н, NAc и 3 ОАс), 3,47 дт и 3,86 дт (2Н, С-1-ОСН, Jгем 9,5 Гц), 3,84 ддд (1Н, Н-2, J2.3 10 Гц), 3,69 м (1-Н, H-5, J5,6a 2 Гц, J5.6b 4,5 Гц), 4,13 дд и 4,27 дд (2Н, Н-6а, H-6b, J6а, 6b 12 Гц), 4,69д (1Н, H-1, J1.2 8,5 Гц), 5,07 дд (1Н,H-4 J4.5 9,5 Гц), 5,32 дд (1Н, Н-3, J3.4 9,5 Гц), 5,49д (1Н, NH, J2,NH 8.5 Гц).
Дезацетилированием 2,5 г (5,45 ммоль) ацетата 3а получили 1,80 г (99%) октил-2-ацетамидо-2-дезокси- 1,26 м и 1,56 м ([СН2]n), 1,95с, 2,02с, 2,03с, 2,08с (12Н, NAc и 3 ОАс), 3,47 дт и 3,86 дт (2Н, С-1-ОСН, Jгем 9,5 Гц), 3,84 ддд (1Н, Н-2, J2.3 10 Гц), 3,69 м (1-Н, H-5, J5,6a 2 Гц, J5.6b 4,5 Гц), 4,13 дд и 4,27 дд (2Н, Н-6а, H-6b, J6а, 6b 12 Гц), 4,69д (1Н, H-1, J1.2 8,5 Гц), 5,07 дд (1Н,H-4 J4.5 9,5 Гц), 5,32 дд (1Н, Н-3, J3.4 9,5 Гц), 5,49д (1Н, NH, J2,NH 8.5 Гц).
Дезацетилированием 2,5 г (5,45 ммоль) ацетата 3а получили 1,80 г (99%) октил-2-ацетамидо-2-дезокси- -D- глюкопиранозида (3б), изопропилиденирование 1,65 г (4,95 ммоль) триола 3б дало 1,55 г (84%) аморфного октил-2-ацетамидо-2-дезокси-4,6-0-изопропилиден- -D- глюкопиранозида (3б), изопропилиденирование 1,65 г (4,95 ммоль) триола 3б дало 1,55 г (84%) аморфного октил-2-ацетамидо-2-дезокси-4,6-0-изопропилиден- -D-глюкопиранозида (3в); [ -D-глюкопиранозида (3в); [ ]54б-71 ]54б-71 (с 1,0; хлороформ).
Алкилированием 2,2 г (5,9 ммоль) соединения 3в S-2-бромпропановой кислотой синтезировали 2,4 г (92%) октил-2-ацетамидо-2-дезокси-4,6-0-изопропилиден-3-0-(D-1-карбоксиэтил)- (с 1,0; хлороформ).
Алкилированием 2,2 г (5,9 ммоль) соединения 3в S-2-бромпропановой кислотой синтезировали 2,4 г (92%) октил-2-ацетамидо-2-дезокси-4,6-0-изопропилиден-3-0-(D-1-карбоксиэтил)- -0-глюкопиранозида (3 г). Мурамовую кислоту 3г (2,0 г, 4,49 ммоль) конденсировали с трифторацетатом бензилового эфира L-аланил-D-изоглутамина. Выход гликопептидного производного 3д составил 2,0 г (61%). В 1,0 г (1,36 ммоль) соединения 3д гидролизовали изопропилиденовую защиту и получили 0,72 г (76%) бензилового эфира О-(октил-2-ацетамидо-2-дезокси- -0-глюкопиранозида (3 г). Мурамовую кислоту 3г (2,0 г, 4,49 ммоль) конденсировали с трифторацетатом бензилового эфира L-аланил-D-изоглутамина. Выход гликопептидного производного 3д составил 2,0 г (61%). В 1,0 г (1,36 ммоль) соединения 3д гидролизовали изопропилиденовую защиту и получили 0,72 г (76%) бензилового эфира О-(октил-2-ацетамидо-2-дезокси- -D-глюкопиранозид-3-ил) -D-лактоил-L-аланил-D-изоглутамина (3е); [ -D-глюкопиранозид-3-ил) -D-лактоил-L-аланил-D-изоглутамина (3е); [ ]54б-2 ]54б-2 (с 1,0; этанол). ‘Н-ЯМР (300 МГц, DMSO-d6): 0,86т (с 1,0; этанол). ‘Н-ЯМР (300 МГц, DMSO-d6): 0,86т 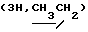 1,24 м и 1,44 м 1,24 м и 1,44 м 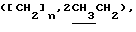 1,75с (3Н, NAc), 1,71 м и 1,94 м (2Н, 1,75с (3Н, NAc), 1,71 м и 1,94 м (2Н,  -CH2-Glu), 2,20 т (2Н, -CH2-Glu), 2,20 т (2Н,  -CH2-Glu), 3,69ддд (1Н, CH-Glu), 4,12дк (1Н, CH-Ala), 4,22к -CH2-Glu), 3,69ддд (1Н, CH-Glu), 4,12дк (1Н, CH-Ala), 4,22к 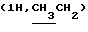 4,25д (1Н, H-1, J1.2 8 Гц), 4,57т (1Н, С-6-ОН), 5,02с (2Н, COOCH2Ph), 5,25а (1Н, С-4-ОН), 7,09с и 7,33с (2Н, CONH2-Glu), 7,36 м (5Н, Ph), 7.39д, 7,80д и 8,09д (3Н, 3 NH).
В соединении 3е (350 мг, 0,51 ммоль) подвергли гидрогенолизу бензиловый эфир. Добавлением эфира высадили 290 мг (95%) аморфного гликопептида 3 [ 4,25д (1Н, H-1, J1.2 8 Гц), 4,57т (1Н, С-6-ОН), 5,02с (2Н, COOCH2Ph), 5,25а (1Н, С-4-ОН), 7,09с и 7,33с (2Н, CONH2-Glu), 7,36 м (5Н, Ph), 7.39д, 7,80д и 8,09д (3Н, 3 NH).
В соединении 3е (350 мг, 0,51 ммоль) подвергли гидрогенолизу бензиловый эфир. Добавлением эфира высадили 290 мг (95%) аморфного гликопептида 3 [ ]54б+12 ]54б+12 (с 0,93, этанол).
Пример 3. 0-(Циклогексил-2-ацетамидо-2-дезокси- (с 0,93, этанол).
Пример 3. 0-(Циклогексил-2-ацетамидо-2-дезокси- -D-глюкопиранозид-3-ил)-D-лактоил-L-аланил-D-изоглутамин (4).
Гликозилирование 1,42 мл (13,7 ммоль) циклогексанола 5,0 г (13,7 ммоль) хлорида 1 дало после перекристаллизации из эфира 3,97 г (68%) циклогексил-2-ацетамидо -3,4,6-три-0-ацетил-2-дезокси- -D-глюкопиранозид-3-ил)-D-лактоил-L-аланил-D-изоглутамин (4).
Гликозилирование 1,42 мл (13,7 ммоль) циклогексанола 5,0 г (13,7 ммоль) хлорида 1 дало после перекристаллизации из эфира 3,97 г (68%) циклогексил-2-ацетамидо -3,4,6-три-0-ацетил-2-дезокси- -D- глюкопиранозида (4а), т. пл. 178oС, [ -D- глюкопиранозида (4а), т. пл. 178oС, [ ]54б-18 ]54б-18 (с 0,77; хлороформ), ‘Н-ЯМР (200 МГц, С2НС13): 0,15 м, 1,61 м ([СН2] n), 1,83с, 1,91с, 1,92с, 1,97с (12Н, NAc и 3 ОАс), 3,55 (1Н, С-1-ОСН), 3,56 м (1Н, Н-2, J2.3 10,5 Гц), 3,59 м (1-Н, H-5, J5.6a 2,5 Гц, J5.6b 4,5 Гц), 3,99дд и 4,16дд (2Н, Н-6а, Н-6b, J6а,6b 12 Гц), 4,76д (1Н, Н-1, J1,2 8,5 Гц), 4,93дд (1Н, Н-4, J4.5 9,5 Гц), 5,29дд (1Н, Н-3, J3,4 9,5 Гц), 5,48д (1Н, NH, J2.NH 8,5 Гц).
Дезацетилированием 2,8 г (6,5 ммоль) перацетата 4а получили 1,9 г (96%) циклогексил-2-ацетамидо-2-дезокси- (с 0,77; хлороформ), ‘Н-ЯМР (200 МГц, С2НС13): 0,15 м, 1,61 м ([СН2] n), 1,83с, 1,91с, 1,92с, 1,97с (12Н, NAc и 3 ОАс), 3,55 (1Н, С-1-ОСН), 3,56 м (1Н, Н-2, J2.3 10,5 Гц), 3,59 м (1-Н, H-5, J5.6a 2,5 Гц, J5.6b 4,5 Гц), 3,99дд и 4,16дд (2Н, Н-6а, Н-6b, J6а,6b 12 Гц), 4,76д (1Н, Н-1, J1,2 8,5 Гц), 4,93дд (1Н, Н-4, J4.5 9,5 Гц), 5,29дд (1Н, Н-3, J3,4 9,5 Гц), 5,48д (1Н, NH, J2.NH 8,5 Гц).
Дезацетилированием 2,8 г (6,5 ммоль) перацетата 4а получили 1,9 г (96%) циклогексил-2-ацетамидо-2-дезокси- -D-глюкопиранозида (4б). Изопропилиденирование 830 мг (2,74 ммоль) триола 4б дало 765 мг (81%) циклогексил-2-ацетамидо-2-дезокси- 4,6-0-изопропилиден- -D-глюкопиранозида (4б). Изопропилиденирование 830 мг (2,74 ммоль) триола 4б дало 765 мг (81%) циклогексил-2-ацетамидо-2-дезокси- 4,6-0-изопропилиден- -D- глюкопиранозида (4в), стеклообразный продукт, [ -D- глюкопиранозида (4в), стеклообразный продукт, [ ]54б-69 ]54б-69 (с 1,0, хлороформ).
Алкилирование 0,75 г (2,19 ммоль) соединения 4в S-2-бромпропановой кислотой привело к 0,85 г (94%) циклогексил-2-ацетамидо-2-дезокси-4,6-0-изопропилиден-3-0-(D-1-карбоксиэтил)- (с 1,0, хлороформ).
Алкилирование 0,75 г (2,19 ммоль) соединения 4в S-2-бромпропановой кислотой привело к 0,85 г (94%) циклогексил-2-ацетамидо-2-дезокси-4,6-0-изопропилиден-3-0-(D-1-карбоксиэтил)- -D- глюкопиранозида (4г). 250 мг (0,53 ммоль) кислоты 4 г конденсировали с трифторацетатом бензилового эфира L-аланил-D-изоглутамина. В защищенном гликопептиде 4д удалили изопропилиденовую защиту и получили 635 мг (48%) бензилового эфира 0-(циклогексил-2-ацетамидо-2-дезокси- -D- глюкопиранозида (4г). 250 мг (0,53 ммоль) кислоты 4 г конденсировали с трифторацетатом бензилового эфира L-аланил-D-изоглутамина. В защищенном гликопептиде 4д удалили изопропилиденовую защиту и получили 635 мг (48%) бензилового эфира 0-(циклогексил-2-ацетамидо-2-дезокси- -D-глюкопиранозид-3-ил)-D-лактоил-L-аланил-D-изоглутамина (4е); аморфный белый порошок, [ -D-глюкопиранозид-3-ил)-D-лактоил-L-аланил-D-изоглутамина (4е); аморфный белый порошок, [ ]54б+6 ]54б+6 (с 1,0; этанол). ‘Н-ЯМР (300 МГц, DMSO-d6): 1,23 м, 1,41 м и 1,60 м (с 1,0; этанол). ‘Н-ЯМР (300 МГц, DMSO-d6): 1,23 м, 1,41 м и 1,60 м 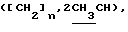 1,74с (3Н, NAc), 1,77 м и 2,01 м (2Н, 1,74с (3Н, NAc), 1,77 м и 2,01 м (2Н,  -СН2-Glu), 2,35 т (2Н, -СН2-Glu), 2,35 т (2Н,  -CH2-Glu), 4,09ддд (1Н, CH-Glu), 4,17дк (1Н, CH-Ala), 4,23к -CH2-Glu), 4,09ддд (1Н, CH-Glu), 4,17дк (1Н, CH-Ala), 4,23к 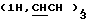 4,37д (1Н, H-1, J1.2 8 Гц), 4,56т (1Н, С-6-ОН), 5,07с 4,37д (1Н, H-1, J1.2 8 Гц), 4,56т (1Н, С-6-ОН), 5,07с 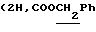 5,24д (1Н, С-4-ОH), 7,12с и 7,32с (2Н, CONH2-Glu), 7,35 м (5Н, Ph), 7,41д, 7,77д и 8,12д (3Н, 3 NH).
Каталитический гидрогенолиз 325 мг (0,49 ммоль) бензилового эфира 4е привел к 265 мг (92%) гликопептида 4; аморфный порошок, [ 5,24д (1Н, С-4-ОH), 7,12с и 7,32с (2Н, CONH2-Glu), 7,35 м (5Н, Ph), 7,41д, 7,77д и 8,12д (3Н, 3 NH).
Каталитический гидрогенолиз 325 мг (0,49 ммоль) бензилового эфира 4е привел к 265 мг (92%) гликопептида 4; аморфный порошок, [ ]54б+6 ]54б+6 (с 0,67; этанол).
Пример 4. 0-[(Адамантил-1-метил)-2-ацетамидо-2-дезокси- (с 0,67; этанол).
Пример 4. 0-[(Адамантил-1-метил)-2-ацетамидо-2-дезокси- -D-глюкопиранозид-3-ил]-D-лактоил-L-аланил-D-изоглутамин (5) -D-глюкопиранозид-3-ил]-D-лактоил-L-аланил-D-изоглутамин (5)230 мг (1,37 ммоль) адамантил-1-метанола гликозилировали 500 мг (1,37 ммоль) хлорида 1 и после очистки колоночной хроматографией (элюент: бензол –> бензол – этанол, 25:1) получили 270 мг (41%) (адамантил-1-метил)-2-ацетамидо-3,4,6-три-0-ацетил-2-дезокси  -D-глюкопиранозида (5а); т. пл. 136-138oС, [ -D-глюкопиранозида (5а); т. пл. 136-138oС, [ ]54б-30 ]54б-30 (с 0,77; хлороформ). ‘Н-ЯМР (200 МГц, С2НСl3): 1,43 м, 1,61 м (СН2 и СН), 1,89с, 1,96с, 1,97с, 2,03с (12Н, NAc и 3 ОАс), 2,90д и 3,45д (2Н, C-1-OCH2, Jгем 10), 3,86ддд (1Н, Н-2, J2.3 10,5 Гц), 3.60ддд (1-Н, Н-5, J5.6а 2,5 Гц, J5.6b 4,5 Гц), 4,06дд и 4,21дд (2Н, Н-6а, H-6b, J6a,6b 12 Гц), 4,48д (1Н, Н-1, J1.2 8,5 Гц), 5,06дд (1Н, Н-4, J4,5 9,5 Гц), 5,18дд (1Н, Н-3, J3,4 9,5 Гц), 5,58д (1Н, NH, J2,NH 8,5 Гц).
Дезацетилирование 1,0 г (2,02 ммоль) ацетата 5а дало 0,71 г (95%) (адамантил-1-метил)-2-ацетамидо -2-дезокси-р-0- глюкопиранозида (5б). Изопропилиденировали 0,61 г (1,66 ммоль) вещества 5б и выделили 416 мг (62%) (адамантил-1-метил)-2-ацетамидо-2-дезокси-4,6-0-изопропилиден – (с 0,77; хлороформ). ‘Н-ЯМР (200 МГц, С2НСl3): 1,43 м, 1,61 м (СН2 и СН), 1,89с, 1,96с, 1,97с, 2,03с (12Н, NAc и 3 ОАс), 2,90д и 3,45д (2Н, C-1-OCH2, Jгем 10), 3,86ддд (1Н, Н-2, J2.3 10,5 Гц), 3.60ддд (1-Н, Н-5, J5.6а 2,5 Гц, J5.6b 4,5 Гц), 4,06дд и 4,21дд (2Н, Н-6а, H-6b, J6a,6b 12 Гц), 4,48д (1Н, Н-1, J1.2 8,5 Гц), 5,06дд (1Н, Н-4, J4,5 9,5 Гц), 5,18дд (1Н, Н-3, J3,4 9,5 Гц), 5,58д (1Н, NH, J2,NH 8,5 Гц).
Дезацетилирование 1,0 г (2,02 ммоль) ацетата 5а дало 0,71 г (95%) (адамантил-1-метил)-2-ацетамидо -2-дезокси-р-0- глюкопиранозида (5б). Изопропилиденировали 0,61 г (1,66 ммоль) вещества 5б и выделили 416 мг (62%) (адамантил-1-метил)-2-ацетамидо-2-дезокси-4,6-0-изопропилиден – -D-глюкопиранозида (5в), т. пл. 172-174oС, [ -D-глюкопиранозида (5в), т. пл. 172-174oС, [ ]54б-56 ]54б-56 (с 1,0; хлороформ).
Алкилированием 415 мг (1,02 ммоль) соединения 5в 5-2-бромпропионовой кислотой синтезировали 470 мг (96%) (адамантил-1-метил)-2-ацетамидо-2-дезокси- 4,6-0-изопропилиден-3-0-(D-1-карбоксиэтил)- (с 1,0; хлороформ).
Алкилированием 415 мг (1,02 ммоль) соединения 5в 5-2-бромпропионовой кислотой синтезировали 470 мг (96%) (адамантил-1-метил)-2-ацетамидо-2-дезокси- 4,6-0-изопропилиден-3-0-(D-1-карбоксиэтил)- – D-глюкопиранозида (5 г). 470 мг (0,98 ммоль) кислоты 5г конденсировали трифторацетатом бензилового эфира L-аланил-D-изоглутамина и выделили 510 мг (68%) бензилового эфира 0-[(адамантил-1-метил)-2-ацетамидо- 2-дезокси-4,6-0- изопропилиден- – D-глюкопиранозида (5 г). 470 мг (0,98 ммоль) кислоты 5г конденсировали трифторацетатом бензилового эфира L-аланил-D-изоглутамина и выделили 510 мг (68%) бензилового эфира 0-[(адамантил-1-метил)-2-ацетамидо- 2-дезокси-4,6-0- изопропилиден- -D- глюкопиранозид-3-ил] -D-лактоил-L-аланил- D-изоглутамина (5д). ‘Н-ЯМР (300 МГц, DMSO-d6): 1,20д и 1,25д -D- глюкопиранозид-3-ил] -D-лактоил-L-аланил- D-изоглутамина (5д). ‘Н-ЯМР (300 МГц, DMSO-d6): 1,20д и 1,25д 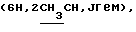 1,32с и 1,46с (6Н, Ме2С), 1,43 м и 1,61 м (СН2 и СН), 1,78с (3Н, NAc), 1,90м и 2,00м (2Н, 1,32с и 1,46с (6Н, Ме2С), 1,43 м и 1,61 м (СН2 и СН), 1,78с (3Н, NAc), 1,90м и 2,00м (2Н,  -CH2-Glu), 2,35т (2Н, -CH2-Glu), 2,35т (2Н,  -СН2-Glu), 2,91д и 3.30д (2Н, C-1-ОСН2, Jгем 10), 4,00ддд (1Н, CH-Glu), 4,19дк (1Н, CH-Ala), 4,24к -СН2-Glu), 2,91д и 3.30д (2Н, C-1-ОСН2, Jгем 10), 4,00ддд (1Н, CH-Glu), 4,19дк (1Н, CH-Ala), 4,24к 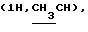 4,32д (1Н, Н-1, J1.2 8), 5,08с 4,32д (1Н, Н-1, J1.2 8), 5,08с 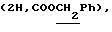 7,13с и 7,32с (2Н, CONH2), 7,36 м (5Н, Ph), 7,29д, 7,91 д и 8,15д (3Н, 3 NH). В производном 5д (280 мг, 0,36 ммоль) кислотным гидролизом удалили изопропилиденовую защиту и получили 250 мг (95%) бензилового эфира 0-[(адамантил-1-метил)-2-ацетамидо-2-дезокси- 7,13с и 7,32с (2Н, CONH2), 7,36 м (5Н, Ph), 7,29д, 7,91 д и 8,15д (3Н, 3 NH). В производном 5д (280 мг, 0,36 ммоль) кислотным гидролизом удалили изопропилиденовую защиту и получили 250 мг (95%) бензилового эфира 0-[(адамантил-1-метил)-2-ацетамидо-2-дезокси- -D -глюкопиранозид-3-ил] -D-лактоил- L-аланил-D-изоглутамин (5е); т. пл. 133-135oС, [ -D -глюкопиранозид-3-ил] -D-лактоил- L-аланил-D-изоглутамин (5е); т. пл. 133-135oС, [ ]54б+4 ]54б+4 (с 1,0; этанол).
Каталитический гидрогенолиз 250 мг (0,34 ммоль) бензилового эфира 5е привел к 190 мг (85%) гликопептида 5, аморфный порошок.
Пример 5. 0-(Фенил-2-ацетамидо-2-дезокси- (с 1,0; этанол).
Каталитический гидрогенолиз 250 мг (0,34 ммоль) бензилового эфира 5е привел к 190 мг (85%) гликопептида 5, аморфный порошок.
Пример 5. 0-(Фенил-2-ацетамидо-2-дезокси- -D-глюкопиранозид-3-ил)-D-лактоил-L-аланил-D-изоглутамин (6).
Реакционную смесь, состоящую из 1,0 г хлорида 7, 0,52 г (5,48 ммоль) фенола, 0,52 г (2,29 ммоль) тетраэтилбензиламмонийхлорида, 3,5 мл (4,38 ммоль) 1,25 н. раствора NaOH и 10 мл хлороформа, интенсивно перемешивали при комнатной температуре до исчезновения гликозил-донора (контроль ТСХ в системе хлороформ – этанол, 10:1). Смесь разбавили 10 мл воды и 10 мл хлороформа. Органический слой отделили, промыли 1 н. NaOH (2 -D-глюкопиранозид-3-ил)-D-лактоил-L-аланил-D-изоглутамин (6).
Реакционную смесь, состоящую из 1,0 г хлорида 7, 0,52 г (5,48 ммоль) фенола, 0,52 г (2,29 ммоль) тетраэтилбензиламмонийхлорида, 3,5 мл (4,38 ммоль) 1,25 н. раствора NaOH и 10 мл хлороформа, интенсивно перемешивали при комнатной температуре до исчезновения гликозил-донора (контроль ТСХ в системе хлороформ – этанол, 10:1). Смесь разбавили 10 мл воды и 10 мл хлороформа. Органический слой отделили, промыли 1 н. NaOH (2 5 мл) и водой (10 мл). Хлороформный экстракт осушили безводным Na2SO4 и упарили. Остаток перекристаллизовали из изопропилового спирта и получили 0,76 г (66%) фенил-2-ацетамидо-3,4,6-три-0-ацетил-2-дезокси- 5 мл) и водой (10 мл). Хлороформный экстракт осушили безводным Na2SO4 и упарили. Остаток перекристаллизовали из изопропилового спирта и получили 0,76 г (66%) фенил-2-ацетамидо-3,4,6-три-0-ацетил-2-дезокси- -D -глюкопиранозида (6а), т. пл. 205-206oС, [ -D -глюкопиранозида (6а), т. пл. 205-206oС, [ ]54б-13 ]54б-13 (с 0,95, хлороформ). ‘Н-ЯМР (300 МГц, С2НСl3): 1,95с, 2,05с, 2,06с, 2,08с (12Н, NAc и 3 ОАс), 3,88ддд (1-Н, Н-5, J5.6a,2,5 Гц, J5.6b 5 Гц), 4,14ддд (1Н, Н-2, J2.3 10,5 Гц), 4,18дд и 4,29дд (2Н, Н-6а, Н-6b, J6a,6b 12 Гц), 5,15д (1Н, Н-4, J4,5 9,5 Гц), 5,28дд (1Н, Н-1, J1.2 8,5 Гц), 5,42дд (1Н, Н-3, J3.4 9,5 Гц), 5,58д (1Н, NH, J2.NH 9 Гц), 7,01 м и 7,28 м (5Н, СНаром).
0,76 г (1,8 ммоль) ацетата 6а растворили в кипящем сухом метаноле, охладили до -40oС и добавили 0,5 мл 0,1 н. раствора метилата натрия в метаноле. Выпавший при стоянии осадок отфильтровали, промыли холодным метанолом. Выход фенил-2-ацетамидо-2-дезокси- (с 0,95, хлороформ). ‘Н-ЯМР (300 МГц, С2НСl3): 1,95с, 2,05с, 2,06с, 2,08с (12Н, NAc и 3 ОАс), 3,88ддд (1-Н, Н-5, J5.6a,2,5 Гц, J5.6b 5 Гц), 4,14ддд (1Н, Н-2, J2.3 10,5 Гц), 4,18дд и 4,29дд (2Н, Н-6а, Н-6b, J6a,6b 12 Гц), 5,15д (1Н, Н-4, J4,5 9,5 Гц), 5,28дд (1Н, Н-1, J1.2 8,5 Гц), 5,42дд (1Н, Н-3, J3.4 9,5 Гц), 5,58д (1Н, NH, J2.NH 9 Гц), 7,01 м и 7,28 м (5Н, СНаром).
0,76 г (1,8 ммоль) ацетата 6а растворили в кипящем сухом метаноле, охладили до -40oС и добавили 0,5 мл 0,1 н. раствора метилата натрия в метаноле. Выпавший при стоянии осадок отфильтровали, промыли холодным метанолом. Выход фенил-2-ацетамидо-2-дезокси- -D-глюкопиранозида (6б) – 0,47 г (87%). Изопропилиденированием 0,47 г (1,57 ммоль) вещества 6б получили 0,47 г (89%) фенил-2-ацетамидо-2-дезокси-4,6-0-изопропилиден- -D-глюкопиранозида (6б) – 0,47 г (87%). Изопропилиденированием 0,47 г (1,57 ммоль) вещества 6б получили 0,47 г (89%) фенил-2-ацетамидо-2-дезокси-4,6-0-изопропилиден- -/ D-глюкопиранозида (6в); т. пл. 153-154oС, [ -/ D-глюкопиранозида (6в); т. пл. 153-154oС, [ ]54б+55 ]54б+55 (с 0,8; хлороформ – метанол, 3:1).
0,45 г (1,36 ммоль) соединения 6в алкилировали S-2-бромпропионовой кислоты и добавлением эфира выделили 0,42 г (76%) фенил-2-ацетамидо-2-дезокси-4,6-0- (с 0,8; хлороформ – метанол, 3:1).
0,45 г (1,36 ммоль) соединения 6в алкилировали S-2-бромпропионовой кислоты и добавлением эфира выделили 0,42 г (76%) фенил-2-ацетамидо-2-дезокси-4,6-0-изопропилиден-3-0-(D-1-карбоксиэтил)-  -D-глюкопиранозида (6 г). ‘Н-ЯМР (300 МГц, DMSO-d6). 1,24д -D-глюкопиранозида (6 г). ‘Н-ЯМР (300 МГц, DMSO-d6). 1,24д 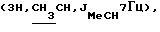 1,33с и 1,48с (6Н, Ме2С), 1,80с (3Н, NAc), 4,19к 1,33с и 1,48с (6Н, Ме2С), 1,80с (3Н, NAc), 4,19к  5,25д (1H, Н-1, J1.2 6 Гц), 6,97 м и 7,29 м (5Н, СНаром.), 7,84д (1Н, NH, J2.NH 6 Гц), 12,48ус (1Н, СООН). Конденсацией 270 мг (0,66 ммоль) кислоты 6г с трифторацетатом бензилового эфира L-аланил-D-изоглутамина синтезировали 270 мг (59%) гликопептида 6д. Кислотный гидролиз изопропилиденовой защиты в производном 6д (190 мг, 0,27 ммоль) дал 179 мг (100%) бензилового эфира 0-(фенил-2-ацетамидо-2-дезокси- 5,25д (1H, Н-1, J1.2 6 Гц), 6,97 м и 7,29 м (5Н, СНаром.), 7,84д (1Н, NH, J2.NH 6 Гц), 12,48ус (1Н, СООН). Конденсацией 270 мг (0,66 ммоль) кислоты 6г с трифторацетатом бензилового эфира L-аланил-D-изоглутамина синтезировали 270 мг (59%) гликопептида 6д. Кислотный гидролиз изопропилиденовой защиты в производном 6д (190 мг, 0,27 ммоль) дал 179 мг (100%) бензилового эфира 0-(фенил-2-ацетамидо-2-дезокси- -D-глюкопиранозид-3-ил)-D-лактоил-L-аланил-D-изоглутамина (6е), т. пл. 212-213oС (с разл.), [ -D-глюкопиранозид-3-ил)-D-лактоил-L-аланил-D-изоглутамина (6е), т. пл. 212-213oС (с разл.), [ ]54б+25 ]54б+25 (с 0,67; этанол). ‘Н-ЯМР (300 МГц, DMSO-d6): 1,25д и 1,27д (6H,2CH3CH,JMe,CH7Гц), 1,78с (3Н, NAc), 1,80 м и 2,02 м (2Н, (с 0,67; этанол). ‘Н-ЯМР (300 МГц, DMSO-d6): 1,25д и 1,27д (6H,2CH3CH,JMe,CH7Гц), 1,78с (3Н, NAc), 1,80 м и 2,02 м (2Н,  -CH2-Glu), 2,36т (2Н, -CH2-Glu), 2,36т (2Н,  -CH2-Glu), 3,90ддд (1Н, CH-Glu), 4,18дк (1Н, CH-Ala), 4,26к -CH2-Glu), 3,90ддд (1Н, CH-Glu), 4,18дк (1Н, CH-Ala), 4,26к  4,69ус (1Н, С-6-ОН), 4,95д (1Н, Н-1, J1.2 8,5 Гц), 5,08с 4,69ус (1Н, С-6-ОН), 4,95д (1Н, Н-1, J1.2 8,5 Гц), 5,08с 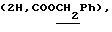 5,40ус (1Н, С-4-ОН), 6,98м (3Н) и 7,30м (2Н) (5Н, Наром), 7,13с и 7,32с (2Н, CONH2), 7,36м (5Н, Ph), 7,47д, 7,91д и 8,14д (3Н, 3 NH).
Бензиловый эфир 6е (180 мг, 0,27 ммоль) подвергли каталитическому гидрогенолизу. Выход гликопептида 6 – 130 мг (84%); аморфный порошок.
Примеры исследования биологических свойств производных мурамовой кислоты.
Исследована биологическая активность производных мурамовой кислоты в модельных тест-системах in vitro и in vivo. Продемонстировано, что вышеописанные соединения в большинстве тест-систем превышают по активности немодифицированный МДП и его известные гликозидные аналоги. Более того, в модельных тест-системах in vivo оригинальные производные МДП проявляли терапевтическое действие по стимуляции противоопухолевого иммунного ответа и усилению неспецифической резистетности к инфекционным заболеваниям в гораздо более низких концентрациях, чем немодицированный МДП. Последняя закономерность наблюдалась и при внутрибрюшинном, и при внутривенном, и при пероральном введении препаратов, что говорит о высокой биодоступности оригинальных производных мурамовой кислоты при вышеописанных путях введения в организм.
Ниже приведены два примера сравнительного изучения иммуномодулирующей активности производных мурамовой кислоты в модельных тест-ситемах in vitro. 5,40ус (1Н, С-4-ОН), 6,98м (3Н) и 7,30м (2Н) (5Н, Наром), 7,13с и 7,32с (2Н, CONH2), 7,36м (5Н, Ph), 7,47д, 7,91д и 8,14д (3Н, 3 NH).
Бензиловый эфир 6е (180 мг, 0,27 ммоль) подвергли каталитическому гидрогенолизу. Выход гликопептида 6 – 130 мг (84%); аморфный порошок.
Примеры исследования биологических свойств производных мурамовой кислоты.
Исследована биологическая активность производных мурамовой кислоты в модельных тест-системах in vitro и in vivo. Продемонстировано, что вышеописанные соединения в большинстве тест-систем превышают по активности немодифицированный МДП и его известные гликозидные аналоги. Более того, в модельных тест-системах in vivo оригинальные производные МДП проявляли терапевтическое действие по стимуляции противоопухолевого иммунного ответа и усилению неспецифической резистетности к инфекционным заболеваниям в гораздо более низких концентрациях, чем немодицированный МДП. Последняя закономерность наблюдалась и при внутрибрюшинном, и при внутривенном, и при пероральном введении препаратов, что говорит о высокой биодоступности оригинальных производных мурамовой кислоты при вышеописанных путях введения в организм.
Ниже приведены два примера сравнительного изучения иммуномодулирующей активности производных мурамовой кислоты в модельных тест-ситемах in vitro.
Формула изобретения
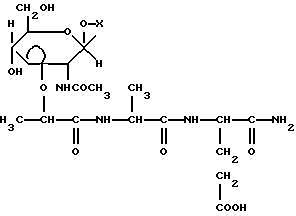 где Х – С1-С20-алкил, за исключением Х – бутил, гептил или гексадецил, или С3-С9-циклоалкил, незамещенный или замещенный С1-С3-алкилом, или адамантил, незамещенный или замещенный С1-С3-алкилом, или С6-С12-арил, незамещенный или замещенный одним или тремя С1-С3-алкилами. РИСУНКИ
|
||||||||||||||||||||||||||
