Патент на изобретение №2181718
|
||||||||||||||||||||||||||
(54) АРИЛАМИДЫ N-(3′-ХЛОРБУТЕН-2′-ИЛ)АНТРАНИЛОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНУЮ АКТИВНОСТЬ
(57) Реферат: Изобретение относится к новым биологически активным ариламидам N-(3′-хлорбутен-2′-ил)антраниловой кислоты формулы (1), где R – 2-CH3, 3-CH3, которые обладают противовоспалительной активностью и благодаря этому могут найти применение в качестве основы новых лекарственных средств. 1 табл. 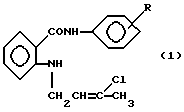
Заявляемые соединения относятся к области органической химии, к классу ароматических аминокислот, а именно новым биологически активным ариламидам N-(3′-хлорбутен-2′-ил)антраниловой кислоты, которые могут найти применение в качестве основы новых лекарственных средств, следующей формулы: 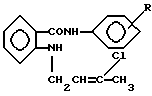 где R – 2-CH3 (1), 3-CH3 (2) Ближайшим структурным аналогом заявляемых соединений является 4-броманилид N-аллил-N-адамантоил-1′)антраниловой кислоты, проявляющий противовоспалительную и анальгетическую активность [патент RU 2030394 на изобретение: “4-броманилид N-аллил-N-(адамантоил-1′)антраниловой кислоты, проявляющий противовоспалительную и анальгетическую активность”]. 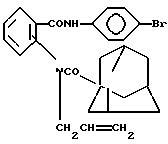 В лечебной практике применяется противовоспалительное средство ортофен [Машковский М. Д. Лекарственные средства (пособие по фармакотерапии для врачей), М. : Медицина, Т. 1., С. 172, 1997], который взят нами в качестве эталона сравнения. Целью предлагаемого изобретения является получение новых ариламидов N-(3′-xлopбyтeн-2′-ил)aнтpaнилoвoй кислоты (1 и 2), обладающих противовоспалительным действием. Поставленная цель достигается путем синтеза ариламидов N-(3′-хлорбутен-2′-ил)антраниловой кислоты на основе метилового эфира N-(3′-xлopбyтeн-2′-ил)aнтpaнилoвoй кислоты, который был использован в магнезиламинной реакции: 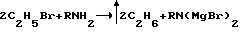 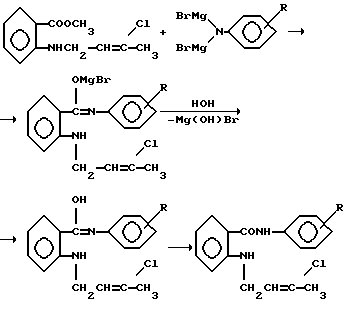 где R – 2-CH3 (1), 3-CH3 (2). Пример получения ортотолуидида N-(3-хлорбутен-2-ил)антраниловой кислоты (1). К EtMgBr, полученному из 16,3 г (0,15 моль) EtBr, 3,6 г (0,15 моль) Mg в 30 мл абсолютного эфира, приливают 7,0 г (0,075 моль) ортотолуидина в 20 мл абсолютного эфира, нагревают на водяной бане 30 мин, затем по каплям приливают раствор из 12,0 г (0,05 моль) метилового эфира N-(3′-хлорбутен-2′-ил)антраниловой кислоты и 20 мл абсолютного эфира, вновь нагревают 30 мин. После завершения реакции магнийорганическое соединение разлагают 10% СН3СООН. Эфирный слой отделяют, а водный экстрагируют 3х40 мл эфира. Из эфирных вытяжек отгоняют растворитель с водяным паром. Кристаллы с Т. пл. 110-112oC. Выход 68%. Найдено, %: N 8,60; C1 11,00; вычислено, %: N 8,89; Cl 11,26. ИК-спектр,  max,см-1: 3360, 3200 (NH), 1630 (С=О), 1580, 1520, 1470 (Аг). ПМР-спектр. ДМСО, max,см-1: 3360, 3200 (NH), 1630 (С=О), 1580, 1520, 1470 (Аг). ПМР-спектр. ДМСО,  , м.д.: 1,8 с (6Н, 2СН3,); 4,31 д (2Н, СН2); 5,58 т (Н, СН); 6,9-8,1 м (9H, Ar+NH).
Пример получения метатолуидида N-(3-хлорбутен-2-ил)антраниловой кислоты (2).
К EtMgBr, полученному из 16,3 г (0,15 моль) EtBr, 3,6 г (0,15 моль) Mg в 30 мл абсолютного эфира, приливают 7,0 г (0,075 моль) метато-луидина в 20 мл абсолютного эфира, нагревают на водяной бане 30 мин, затем по каплям приливают раствор из 12,0 г (0,05 моль) метилового эфира N-(3′-xлopбyтeн-2′-ил)aнтpaнилoвoй кислоты и 15 мл абсолютного эфира и вновь нагревают 30 мин. После завершения реакции магнийорганическое соединение разлагают 10% СН3СООН. Эфирный слой отделяют, а водный экстрагируют 3х40 мл эфира. Из эфирных вытяжек отгоняют растворитель с водяным паром. Кристаллы с Т.пл. 94-96oС. Выход 52%. Найдено, %: N 8,64; Cl 11,50; вычислено, %: N 8,89; C1 11,26. ИК-спектр, , м.д.: 1,8 с (6Н, 2СН3,); 4,31 д (2Н, СН2); 5,58 т (Н, СН); 6,9-8,1 м (9H, Ar+NH).
Пример получения метатолуидида N-(3-хлорбутен-2-ил)антраниловой кислоты (2).
К EtMgBr, полученному из 16,3 г (0,15 моль) EtBr, 3,6 г (0,15 моль) Mg в 30 мл абсолютного эфира, приливают 7,0 г (0,075 моль) метато-луидина в 20 мл абсолютного эфира, нагревают на водяной бане 30 мин, затем по каплям приливают раствор из 12,0 г (0,05 моль) метилового эфира N-(3′-xлopбyтeн-2′-ил)aнтpaнилoвoй кислоты и 15 мл абсолютного эфира и вновь нагревают 30 мин. После завершения реакции магнийорганическое соединение разлагают 10% СН3СООН. Эфирный слой отделяют, а водный экстрагируют 3х40 мл эфира. Из эфирных вытяжек отгоняют растворитель с водяным паром. Кристаллы с Т.пл. 94-96oС. Выход 52%. Найдено, %: N 8,64; Cl 11,50; вычислено, %: N 8,89; C1 11,26. ИК-спектр,  max, см-1: 3230 (NH), 1680 (С=О), 1640, 1590, 1500 (Аг). ПМР-спектр, ДМСО, max, см-1: 3230 (NH), 1680 (С=О), 1640, 1590, 1500 (Аг). ПМР-спектр, ДМСО,  , м. д.: 2,1 д (6Н, СН3); 3,86 д (2Н, СН2); 5,43 м (Н, СН); 6,33-7,46 м (8Н, Аг); 7,66 (H,NH).
Заявляемые соединения представляют собой кристаллические вещества с желтоватым оттенком, нерастворимые в воде, растворимые в диметилформамиде и диметилсульфоксиде.
Исследование острой токсичности и противовоспалительной активности проводили на кафедре фармакологии Пермской фармацевтической академии. Была определена острая токсичность (ЛД50) соединений на белых мышах массой 16-20 г при однократном внутрибрюшинном введении в 2%-ной крахмальной слизи. Каждой паре мышей вводили одну дозу в порядке возрастания. Гибель животных регистрировали в течение 1 суток. ЛД50 вычисляли экспресс-методом при Р=0,05 [Прозоровский В. Б. Практическое пособие по ускоренному определению среднеэффективных доз и концентраций биологически активных веществ. С.-Петербург: НПП-Наука, 1992].
Противовоспалительное действие соединений изучали в соответствии с методическими указаниями по экспериментальному изучению нестероидных противовоспалительных фармакологических веществ, одобренных фармакологическим комитетом МЗ СССР (протокол 22 от 11.11.82). Опыты проведены на беспородных белых крысах массой 150-220 г на модели острого воспалительного отека, вызванного субплантарным введением в заднюю лапу крысы 0,1 мл 1% раствора каррагенина. О противовоспалительном действии судили по торможению отека стопы в процентах к контролю. Объем стопы измеряли онкометрически [Салямон Р.С. Лекарственная регуляция воспалительного процесса. Л., 1958. – С. 11-43]. В качестве препарата сравнения использовали ортофен. Исследуемые соединения (50 мг/кг) и ортофен (10 мг/кг) вводили внутрибрюшинно за 1 час до введения каррагенина. Оценку противовоспалительного действия проводили через 4 ч после введения флогогенного агента. Результаты опытов обработаны статистически с вычислением критериев достоверности при P , м. д.: 2,1 д (6Н, СН3); 3,86 д (2Н, СН2); 5,43 м (Н, СН); 6,33-7,46 м (8Н, Аг); 7,66 (H,NH).
Заявляемые соединения представляют собой кристаллические вещества с желтоватым оттенком, нерастворимые в воде, растворимые в диметилформамиде и диметилсульфоксиде.
Исследование острой токсичности и противовоспалительной активности проводили на кафедре фармакологии Пермской фармацевтической академии. Была определена острая токсичность (ЛД50) соединений на белых мышах массой 16-20 г при однократном внутрибрюшинном введении в 2%-ной крахмальной слизи. Каждой паре мышей вводили одну дозу в порядке возрастания. Гибель животных регистрировали в течение 1 суток. ЛД50 вычисляли экспресс-методом при Р=0,05 [Прозоровский В. Б. Практическое пособие по ускоренному определению среднеэффективных доз и концентраций биологически активных веществ. С.-Петербург: НПП-Наука, 1992].
Противовоспалительное действие соединений изучали в соответствии с методическими указаниями по экспериментальному изучению нестероидных противовоспалительных фармакологических веществ, одобренных фармакологическим комитетом МЗ СССР (протокол 22 от 11.11.82). Опыты проведены на беспородных белых крысах массой 150-220 г на модели острого воспалительного отека, вызванного субплантарным введением в заднюю лапу крысы 0,1 мл 1% раствора каррагенина. О противовоспалительном действии судили по торможению отека стопы в процентах к контролю. Объем стопы измеряли онкометрически [Салямон Р.С. Лекарственная регуляция воспалительного процесса. Л., 1958. – С. 11-43]. В качестве препарата сравнения использовали ортофен. Исследуемые соединения (50 мг/кг) и ортофен (10 мг/кг) вводили внутрибрюшинно за 1 час до введения каррагенина. Оценку противовоспалительного действия проводили через 4 ч после введения флогогенного агента. Результаты опытов обработаны статистически с вычислением критериев достоверности при P 0,05. Данные исследования представлены в таблице.
Из данных таблицы видно, что заявляемые соединения совершенно безвредны (ЛД50 соответствует >4000 мг/кг), соединения обладают в 54 раза меньшей токсичностью в сравнении с ортофеном и в 1,6 раза в сравнении с аналогом по структуре. По противовоспалительной активности заявляемые соединения (50 мг/кг) равны ортофену (10 мг/кг) и структурному аналогу. Условная широта фармакологического действия (УШФД) у заявляемых соединений в 10,8 раз больше УШФД ортофена и в 1,6 раза аналога по структуре.
Заявляемые соединения перспективны как вещества, проявляющие противовоспалительное действие, близкое по активности аналогу по структуре и эталону сравнения по действию – ортофену, но имеют преимущества по токсичности и УШФД в сравнении с ними.
Таким образом, предлагаемые соединения могут найти применение в медицине в качестве основы для создания новых противовоспалительных лекарственных средств. 0,05. Данные исследования представлены в таблице.
Из данных таблицы видно, что заявляемые соединения совершенно безвредны (ЛД50 соответствует >4000 мг/кг), соединения обладают в 54 раза меньшей токсичностью в сравнении с ортофеном и в 1,6 раза в сравнении с аналогом по структуре. По противовоспалительной активности заявляемые соединения (50 мг/кг) равны ортофену (10 мг/кг) и структурному аналогу. Условная широта фармакологического действия (УШФД) у заявляемых соединений в 10,8 раз больше УШФД ортофена и в 1,6 раза аналога по структуре.
Заявляемые соединения перспективны как вещества, проявляющие противовоспалительное действие, близкое по активности аналогу по структуре и эталону сравнения по действию – ортофену, но имеют преимущества по токсичности и УШФД в сравнении с ними.
Таким образом, предлагаемые соединения могут найти применение в медицине в качестве основы для создания новых противовоспалительных лекарственных средств.
Формула изобретения
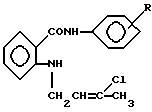 где R – 2-CH3 (1), 3-CH3 (2) проявляющие противовоспалительную активность. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 27.07.2003
Извещение опубликовано: 27.09.2004 БИ: 27/2004
|
||||||||||||||||||||||||||
