Патент на изобретение №2181590
|
||||||||||||||||||||||||||
(54) ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИРБЕСАРТАН
(57) Реферат: Изобретение относится к области медицины. Фармацевтические композиции содержат ирбесартан, наполнитель, связующее, дезинтегратор, антиадгезив, смазывающее и поверхностно-активное вещество. Предложена также таблетированная форма композиции. Композиции имеют более высокое содержание активного вещества и легко таблетируются. 2 с. и 10 з.п. ф-лы, 7 табл. Изобретение относится к фармацевтическим композициям, содержащим ирбесартан, предпочтительно к композициям в форме таблеток. Данное изобретение относится также к таблеткам, полученным из этих композиций. Ирбесартан, 2-н-бутил-4-спироциклопентан-1- [(2′-(тетразол-5-ил) бифенил-4-ил) метил] -2-имидазолин-5-он является сильным антагонистом длительного действия рецептора ангиотензина II и особенно полезен в лечении сердечно-сосудистых заболеваний, таких как гипертензия и сердечная недостаточность. Ирбесартан имеет следующее строение: 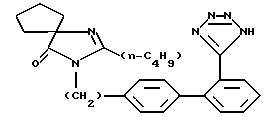 и впервые описывается в патенте США 5270317 авторов Bernhart et al. Ирбесартан может вводиться в дозированных формах, содержащих большое количество активного ингредиента (например, 75-300 мг). Но некоторые физические свойства этого лекарства обуславливают невозможность создания композиций, пригодных для получения таблеток с содержанием большого количества активного агента и одновременно достаточно небольшого размера для удобного проглатывания. Например, ирбесартан представляет собой рыхлый материал с относительно небольшой насыпной плотностью и насыпным весом. Это затрудняет введение большого количества лекарства в небольшую по размеру таблетку, однородную по плотности, твердости и другим, желательным для таблетки, свойствам. Кроме того, ирбесартан обладает некоторыми нежелательными характеристиками текучести, например, является липким и может налипать на поверхности, например, на поверхности форм для таблетирования и поверхности штампов, вызывая проблемы при формовании таблеток, особенно на высокоскоростном прессе. Ирбесартан плохо растворим в воде, что также является проблемой, так как для сохранения небольшой массы таблетки в нее следует вводить только ограниченное количество компонентов, способствующих смачиванию, дезинтеграции и, в конечном счете, быстрому и полному выделению лекарственного средства. Следовательно, существует необходимость получения фармацевтических композиций, содержащих ирбесартан, обладающих хорошими свойствами для формования таблеток и содержащих такое количество наполнителей, при котором можно получать небольшие легко проглатываемые таблетки с высоким содержанием активного ингредиента. Данное изобретение, по крайней мере в его предпочтительной форме, относится к формацевтическим композициям, содержащим ирбесартан, которые (1) обладают минимальной массой дополнительных наполнителей, что позволяет получать небольшие легко проглатываемые таблетки с повышенным количеством принимаемого пациентом вещества и более удобные для приема, (2) обладают превосходными свойствами для формования таблеток и (3) обеспечивают получение таблеток с прекрасной смачиваемостью, дезинтеграцией и, в конечном итоге, быстрым и полным выделением лекарственного средства. В частности, данное изобретение относится к фармацевтическим композициям, которые особенно подходят для получения таблеток, содержащих от приблизительно 20 до приблизительно 70 вес.% ирбесартана или его фармацевтически приемлемых солей, и фармацевтически приемлемые наполнители, отличающимся тем, что таблетки, полученные из указанной композиции, обладают такой способностью к растворению, при которой приблизительно 80% или более, предпочтительно 85% или более, ирбесартана или его солей, содержащихся в указанной таблетке, растворяется в течение 30 минут. Предпочтительные композиции, содержащие ирбесартан, включают (из расчета на общий вес, принятый за 100%): а) от приблизительно 20 до приблизительно 70% (предпочтительно приблизительно 50%) ирбесартана, (b) от приблизительно 1 до приблизительно 70% наполнителя, (с) от приблизительно 2 до приблизительно 20% связующего вещества, (d) от приблизительно 1 до приблизительно 10% дезинтегрирующего вещества, (е) от приблизительно 0,1 до приблизительно 5% антиадгезива, (f) от приблизительно 0,2 до приблизительно 5% смазки и (g) от приблизительно 0,2 до приблизительно 6% поверхностно-активного вещества и, необязательно, (h) приблизительно до 2% (предпочтительно от приблизительно 0,1 до приблизительно 1%) красящего вещества. Представленные композиции могут содержать до приблизительно 70 вес. %/вес.% ирбесартана и при этом могут применяться в воспроизводимом крупномасштабном способе промышленного получения таблеток. Данные композиции могут, например, прессоваться на высокоскоростном оборудовании (особенно, на высокоскоростном прессе) для получения таблеток, однородных по весу и составу и обладающих желательными физическими свойствами, в том числе изысканным внешним видом, низкой хрупкостью и небольшим временем дезинтеграции. Таблетки, полученные из данных композиций, могут выделять активный(-е) компонент(-ы) быстрым и воспроизводимым образом. Если не указано другого значения, термин ирбесартан в данном описании относится также к фармацевтически приемлемым солям ирбесартана. Далее изобретение описывается более подробно. Компоненты, использованные в композиции данного изобретения, должны быть фармацевтически приемлемыми, в частности, указанными в Национальном перечне (National Formylary, NF) или Фармакопее США (United States Pharmacopeia, USP). Термин “способность к растворению” таблетки, использованный в описании в отношении ирбесартана, означает вес ирбесартана, выраженный в % от принятого за 100% общего веса ирбесартана, включенного в таблетку, который растворяется в течение 30 минут при следующих условиях: используемая таблетка имеет общий вес от 150 до 600 мг, применяется USP Apparatus 2, в котором таблетка помещается в 1000 мл 0,1 н. соляной кислоты при 31oС, скорость перемешивания жидкости составляет 50 об/мин и определение количества растворенного ирбесартана (в частности, с использованием УФ излучения с длиной волны 244 нм) проводят через 30 минут. (Если нужно, ход растворения можно также контролировать в различных точках временного интервала). В качестве “наполнителя” в композиции данного изобретения может применяться одно или более соединений, способных обеспечить массу для получения таблетки нужной массы. Желательно применять наполнитель в количестве, близком к нижнему пределу интервала веса наполнителя. Предпочтительными наполнителями являются неорганические фосфаты, такие как двухосновный фосфат кальция, сахара, такие как лактоза водная или лактоза безводная; и целлюлоза или производные целлюлозы, такие как микрокристаллическая целлюлоза. В качестве “связующего вещества” в композиции данного изобретения может применяться одно или несколько соединений, способных облегчать гранулирование ирбесартана в более плотные и большего размера и/или более свободно-текучие частицы. Предпочтительными связующими веществами являются альгиновая кислота (как более предпочтительно примененная в количестве 2-5 вес.%) или альгинат натрия (наиболее предпочтительно примененный в количестве 2-3 вес. %); целлюлоза или производные целлюлозы, такие как натриевая карбоксиметилцеллюлоза (наиболее предпочтительно примененная в количестве 2-6 вес.%), этилцеллюлоза (наиболее предпочтительно примененная в количестве 2-3 вес.%) гидроксиэтилцеллюлоза (наиболее предпочтительно примененная в количестве 2-5%), гидроксипропилцеллюлоза (наиболее предпочтительно примененная в количестве 2-6 вес.%), гидроксипропилметилцеллюлоза (наиболее предпочтительно примененная в количестве 2-5 вес.%) или метилцеллюлоза (наиболее предпочтительно примененная в количестве 2-6 вес.%); желатин (наиболее предпочтительно примененный в количестве 2-10 вес.%); повидон (поливинилпирролидон, т.е. гомополимер 1-этил-2-пирролидинона) (например, повидон К-30), (наиболее предпочтительно примененный в количестве 2-20 вес.%) или крахмал (наиболее предпочтительно примененный в количестве 5-20 вес.%) или преджелатинированный крахмал (наиболее предпочтительно примененный в количестве 2-20, например 5-20 вес.%). В качестве “дезинтегрирующего вещества” в композиции данного изобретения может применяться одно или более соединений, способных облегчать диспергирование таблетки, полученной из композиции, при контакте таблетки с водной средой. Предпочтительными связующими веществами являются альгиновая кислота (наиболее предпочтительно примененная в количестве 2-5 вес.%) или альгинат натрия (наиболее предпочтительно примененный в количестве 2,5-10 вес.%); целлюлоза или производные целлюлозы, такие как натрийкарбоксиметилцеллюлоза (наиболее предпочтительно примененная в количестве 2-6 вес.%), микрокристаллическая целлюлоза (наиболее предпочтительно примененная в количестве 5-15 вес. %), порошкообразная целлюлоза (наиболее предпочтительно примененная в количестве 5-15 вес.%) или натрийкроскармелоза (сшитый полимер натрийкарбоксиметилцеллюлозы) (наиболее предпочтительно примененная в количестве 2-5 вес.%), кросповидон (сшитый гомополимер N-винил-2-пирролидинона, т.е. сшитый 1-этенил-2-пирролидинон) (наиболее предпочтительно примененный в количестве 2-5 вес.%), предварительно желатинированный крахмал (наиболее предпочтительно примененный в количестве 5-10 вес.%), натрийкрахмалгликолят (наиболее предпочтительно примененный в количестве 2-8 вес.%) или крахмал (наиболее предпочтительно примененный в количестве 3-15 вес.%). В качестве “антиадгезива” в композиции данного изобретения может применяться одно или более соединений, способных уменьшить возможность налипания композиции, например, устраняя адгезию на металлические поверхности. Предпочтительными антиадгезивами являются кремнийсодержащие соединения, такие как диоксид кремния (наиболее предпочтительно примененный в количестве 0,25-5% (например, 0,5-2 или 2,5-3,0 вес.%), трисиликат магния (наиболее предпочтительно примененный в количестве 0,5-2 вес.%) или тальк (наиболее предпочтительно примененный в количестве 1-5 вес.%). В качестве “смазки” в композиции данного изобретения может применяться одно или более соединений, способных устранить проблемы, связанные с формованием таблеток, такие как высвобождение из формовочного аппарата изготовленных из композиции таблеток, устранение налипания на поверхность верхнего или нижнего пресса для формования таблеток. Предпочтительными смазками являются жирные кислоты или производные жирных кислот, такие как стеарат кальция (наиболее предпочтительно примененный в количестве 0,5-2 вес.%), глицеринмоностеарат (наиболее предпочтительно примененный в количестве 0,5-2 вес.%), глицерилпальмитостеарат (наиболее предпочтительно примененный в количестве 0,5-2 вес.%), стеарат магния (наиболее предпочтительно примененный в количестве 1-2 вес.%), натрийлаурилсульфат (наиболее предпочтительно примененный в количестве 1-2 вес.%), натрийстеарилфумарат (наиболее предпочтительно примененный в количестве 0,5-2 вес.%), стеарат цинка (наиболее предпочтительно примененный в количестве 0,5-1,5 вес.%) или стеариновая кислота (наиболее предпочтительно примененная в количестве 1-3 вес.%); гидрированное растительное масло (наиболее предпочтительно примененное в количестве 1-5 вес.%); полиалкиленгликоли, такие как полиэтиленгликоль (наиболее предпочтительно примененный в количестве 1-5 вес.%), натрийбензоат (наиболее предпочтительно примененный в количестве 2-5 вес.%); или тальк (наиболее предпочтительно примененный в количестве 1-5 вес.%). В качестве “поверхностно-активного вещества” в композиции данного изобретения могут применяться одно или более соединений, способных улучшить смачивание таблеток и/или повышать растворимость. Предпочтительными поверхностно-активными веществами являются натрийлаурилсульфат (наиболее предпочтительно примененный в количестве 0,2-6 вес.%) и поли(оксиэтилен), поли(оксипропилен)-блок-сополимеры, такие как полоксамеры, особенно полоксамер 188 (наиболее предпочтительно примененный в количестве 1-6 вес.%). В качестве “красящего вещества” (или “красителя”) в композиции данного изобретения может применяться одно или более соединений, которые придают нужную окраску таблетке, полученной из композиции. Добавление красящего вещества может применяться, например, для того, чтобы можно было легко отличить таблетки с различным содержанием действующего вещества. Предпочтительными красящими веществами являются оксиды железа, которые имеют универсальную применимость. Как видно из приведенного выше описания, одно и то же вещество может выполнять две или более функций. Вычисление весового процента предпочтительно проводят исходя из основной функции соединения в данной композиции. Данные композиции предпочтительно состоят, по существу, из указанных выше компонентов. Предпочтительные композиции Предпочтительные композиции данного изобретения содержат один или более компонентов, перечисленных ниже, в количестве, заключенном в указанной области концентраций, вес. %: ирбесартан 20-60 (например, от 25 до 60), более предпочтительно 30-60, наиболее предпочтительно 30-50, особенно 50%; наполнитель 1-70, наиболее предпочтительно 1-60, особенно 1-40%; связующее вещество 5-20, наиболее предпочтительно 5-15%; дезинтегрирующее вещество 4-8, наиболее предпочтительно приблизительно 5%; антиадгезив 0,25-5,0% (например, 2,5-3,0%); смазка 0,5-1,5, наиболее предпочтительно приблизительно 1% и поверхностно-активное вещество 1-3, наиболее предпочтительно приблизительно 3%. В приведенных далее таблицах представлены предпочтительные композиции данного изобретения, из которых получают таблетки особенно высокого качества с прекрасными характеристиками. В таблице А представлены предпочтительные композиции, содержащие ирбесартан. В приведенных в таблице А композициях сочетание стеарата магния и диоксида кремния обеспечивает прекрасный смазывающий эффект при сведении до минимума любого ухудшения способности таблетки к растворению; соотношение кроскармелозы в композиции, образующей внутренние гранулы с активным лекарственным средством, и в так называемой внегранульной композиции (композиция, в которую вносят гранулы с активным лекарственным средством), является оптимальным (например 1:1), полоксамерное поверхностно-активное вещество улучшает водную грануляцию ирбесартана (который является гидрофобным), облегчает выталкивание таблеток после прессования и ускоряет растворение активного ингредиента – ирбесартана. Композиция, приведенная в таблице А, предпочтительно содержит также от 0,08 до 0,12% красного оксида железа и от 0,08 до 0,12 вес.% желтого оксида железа в качестве красящих веществ. Способы изготовления Таблетки могут быть получены из композиций данного изобретения любым подходящим способом получения таблеток. Предпочтительно таблетки получают из композиций данного изобретения с помощью мокрого гранулирования. Один из таких способов включает следующие стадии: а) получение “внутригранульной” композиции (композиции гранул, содержащих активное лекарственное(ые) средство(а)): i) смешение ирбесартана, части наполнителя (предпочтительно от приблизительно 5 до приблизительно 80 вес.% общего количества наполнителя), части дезинтегрирующего вещества (предпочтительно от приблизительно 50 до приблизительно 80 вес.% общего количества дезинтегрирующего вещества), связующего вещества и, необязательно, части антиадгезива (предпочтительно от приблизительно 50 до приблизительно 80 вес.% общего веса антиадгезива) для получения порошкообразной смеси и, необязательно, рассев смеси (например, размол для измельчения агрегатов); ii) повторное смешение смеси; iii) гранулирование смеси с грануляционной жидкой средой, предпочтительно с водой и/или водным раствором поверхностно-активного вещества, с получением гранул (например, используя высокоскоростной смеситель/гранулятор); iv) сушка гранул (например, в печи или предпочтительно в сушилке с псевдоожиженным слоем) и v) рассев высушенных гранул (например, измельчением или просеиванием через сито); b) получение смеси гранул определенного размера, полученных на стадии (а) (v), с “внегранульной” композицией (композицией, в которую вносят гранулы, полученные на стадии (а) (v)): i) смешение остальной части наполнителя, остальной части дезинтегрирующего вещества, антиадгезива или остальной части антиадгезива и, необязательно, красящего вещества (причем один или более из этих компонентов предварительно могут быть смешаны, и размер их частиц доведен до нужного значения (например, помолом для измельчения агрегатов) и повторно смешаны), с гранулами определенного размера, полученными на стадии (а)(v) с получением гранульной смеси; ii) смешение смазки с гранульной смесью с) прессование смеси, полученной на стадии (b) (ii) для получения таблеток (например, с использованием пресса для формования таблеток). Твердые исходные материалы данных композиций предпочтительно перед применением просеивают через сито. Весовое отношение воды (предпочтительно, очищенной воды (USP) или воды для инъекции (USP)), к твердым материалам, примененным на стадии (a) (iii), предпочтительно находится в области от приблизительно 0,25 до приблизительно 0,6:1. Таблетки можно обрабатывать или покрывать оболочкой в соответствии с известными способами. Таблетки, полученные из композиций данного изобретения, предпочтительно содержат (на таблетку) от приблизительно 25 до приблизительно 300 мг ирбесартана, наиболее предпочтительно от приблизительно 75 до 300 мг ирберсартана. Общий вес полученных таблеток предпочтительно составляет от приблизительно 50 до приблизительно 600 мг. Композиции данного изобретения могут использоваться также для получения гранулированных препаратов, гранул для дисперсии или капсул, последние, например, наполняют порошком или указанным выше гранулированным препаратом или гранулами. Способы, которые применяются для получения таких композиций, хорошо известны квалифицированным специалистам и могут применяться для приготовления этих лекарственных форм. Композиции и таблетки данного изобретения могут использоваться для лечения или профилактики заболеваний, таких как описанные в патенте США 5270317, который включен в качестве ссылки в данное изобретение. Такие заболевания включают сердечно-сосудистые заболевания, например, гипертензию или сердечную недостаточность, венозную недостаточность, а также глаукому, диабетическую ретинопатию, почечную недостаточность и различные расстройства центральной нервной системы. Данные композиции или таблетки предпочтительно вводятся перорально в эффективном количестве млекопитающему (в частности человеку), которому необходимо лечение или профилактика вышеуказанных заболеваний. Для человека предпочтительные дозы составляют от приблизительно 75 мг до приблизительно 300 мг ирбесартана и могут вводиться, например, 1-2 раза в день. Приведенные далее примеры иллюстрируют предпочтительные воплощения изобретения без ограничения области данного изобретения. Пример 1 Получение таблеток, содержащих ирбесартан Из композиции, согласно изобретению, представленной в таблице 1, получают таблетки трех видов с различным содержанием ирбесартана: (1) таблетки с содержанием ирбесартана 75 мг/табл. при общем весе каждой таблетки 150 мг; (2) таблетки с содержанием ирбесартана 150 мг/табл. при общем весе каждой таблетки 300 мг и (3) таблетки с содержанием ирбесартана 300 мг/табл. при общем весе каждой таблетки 600 мг. Способом мокрого гранулирования из композиции, приведенной в таблице 1, по описанной ниже методике получают таблетки. В этом способе общее количество воды, которая применяется при получении таблеток, составляет до 50% от общего веса твердых веществ. Ирбесартан, лактозу, прежелатинированный крахмал и часть (1/2) натрийкроскармелозы смешивают в смесителе. Полученную порошкообразную смесь пропускают через оборудование для рассева (мельницу или осциллятор) для получения смеси с частицами определенного размера и смешивают в смесителе. Полоксамер 188 растворяют в воде (очищенной, USP, или в воде для инъекций, USP) (вес которой составляет 25% от общего веса твердых веществ) и используют в мокром гранулировании (с дополнительным добавлением воды, в количестве, которое составляет до 25% общего веса твердых веществ) порошкообразной смеси. Полученные гранулы сушат (в сушилке на поддоне или в сушилке с псевдоожиженным слоем) до тех пор, пока потеря веса при сушке не составит 2% или менее. Высушенные гранулы пропускают через сито или измельчают для получения гранул определенного размера (1-3 мм). Гранулы нужного размера смешивают с диоксидом кремния, микрокристаллической целлюлозой и оставшимся количеством натрийкроскармелозы в смесителе. Полученную смесь смешивают со стеаратом магния. Прессованием полученной смеси на соответствующем оборудовании получают таблетки трех видов с различным содержанием действующего вещества. Составы полученных таблеток приведены в таблице 2. Пример 2 Получение таблеток, содержащих ирбесартан: альтернативная композиция Способом, аналогичным описанному в примере 1, получают таблетки, состав которых представлен в таблице 3. Пример 3 Получение таблеток, содержащих ирбесартан Из композиции, представленной в таблице 4, получают таблетки трех видов с различным содержанием ирбесартана: (1) содержание ирбесартана составляет 75 мг на таблетку при общем весе каждой таблетки 150 мг; (2) содержание ирбесартана составляет 150 мг на таблетку при общем весе каждой таблетки 300 мг и (3) содержание ирбесартана составляет 300 мг при общем весе каждой таблетки 600 мг. Способом мокрого гранулирования из вышеуказанной композиции получают таблетки следующим образом. В этом способе общее количество воды составляет до 50 вес.% от общего веса твердых материалов. В смесителе смешивают ирбесартан, лактозу, прежелатинированный крахмал, часть (1/2) натрийкроскармелозы и часть (приблизительно 73%) диоксида кремния. Полученную порошкообразную смесь измельчают (в мельнице или осцилляторе) и снова смешивают в миксере. Полоксамер 188 растворяют в воде (очищенная, USP, или вода для инъекций, USP, вес которой составляет 25% общего веса твердых материалов) и используют в мокром гранулировании (с дополнительным добавлением воды в количестве до 25% общего веса твердых материалов) порошкообразной смеси. Полученные гранулы сушат (в сушилке на поддоне или в сушилке с псевдоожиженным слоем) до тех пор, пока потеря веса при сушке не будет составлять 2% или менее. Высушенные гранулы пропускают через сито или измельчают до получения подходящего размера гранул (1-3 мм). Гранулы строго определенного размера смешивают с оставшимся количеством диоксида кремния, микрокристаллической целлюлозы и оставшимся количеством натрийкроскармелозы в смесителе. Полученную смесь затем смешивают со стеаратом магния. Прессованием полученной смеси на оборудовании для таблетирования получают таблетки трех составов, композиции которых приведены в таблице 5. Таблетки, содержащие ирбесартан или его фармацевтически приемлемую соль и полученные согласно способу данного изобретения смешением внутригранульной композиции, в которой гранулы содержат антиадгезив (предпочтительно, диоксид кремния), могут растворяться более быстро и/или более полно и, таким образом, могут проявлять улучшенную способность к растворению. Пример 4 Получение таблеток, содержащих ирбесартан; альтернативная композиция По методике примера 3 получают таблетки, композиция которых представлена в таблице 6. Формула изобретения
РИСУНКИ
PD4A – Изменение наименования обладателя патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Извещение опубликовано: 7.01.2006 БИ: 03/2006
|
||||||||||||||||||||||||||
