Патент на изобретение №2179036
|
||||||||||||||||||||||||||
(54) СОСТАВЫ ЭСТРАМУСТИНА С УЛУЧШЕННЫМИ ФАРМАЦЕВТИЧЕСКИМИ СВОЙСТВАМИ
(57) Реферат: Изобретение относится к фармацевтической композиции, содержащей производное эстрамустина и циклодекстрин, в частности, для получения лекарственного средства, пригодного для перорального введения производного эстрамустина пациенту, страдающему от опухоли. Средство обладает более высокой биодоступностью. 2 с. и 10 з. п. ф-лы, 23 табл. Изобретение относится к фармацевтическим композициям, содержащим производное эстрамустина и циклодекстрин. Циклодекстрины [здесь и ниже ЦД (CD)] – хорошо известные олигосахариды, состоящие из D-глюкозных остатков, имеющие структуру с цилиндрической пустотой, способную включать различные гостевые молекулы. В самом деле, одно из самых интересных свойств ЦД заключается в их особенности образовывать включения или комплексы. Это взаимодействие сильно зависит от гидрофобности молекулы гостя, пространственного затруднения между лекарственным средством и ЦД и размера ЦД полости. Так или иначе, этот тип комплексообразования придает новые физико-химические свойства лекарственным средствам, и его интенсивно используют в фармацевтической области для улучшения растворимости и стабильности активных лекарственных веществ [O. Bekers et al. , Drug Dev. Ind. Pharm. , 17, 1503 (1991); J. Szejtli, Pharm. Tech. Int. , Febrary 1991, 15] и, как следствие, их характеристик растворения и биодоступности. Более обычно, комплексообразование лекарственное средство – ЦД используют для улучшения биодоступности активных молекул, имеющих очень низкую растворимость в воде, но хорошую скорость абсорбции (всасывания) через биологические мембраны [D. Duchene et al. , STP Pharma, 323 (1985)] . Указанные комплексы включения обычно получают в жидкой среде, и затем после высушивания их получают в форме порошка. Пригодны различные способы получения твердых соединений включения, такие как смешение [K. Uekama et al. Int. J. Pharm. , 10, 1 (1982)] , соосаждение [K. Uekama et al. Int. J. Pharm. , 16, 327 (1983)] , сушка распылением [H. P. R. Bootsma et al. , Int. J. Pharm. , 51, 213 (1989)] , сушка замораживанием [P. Chiesi et al. , Патент США 4603123, 29 июля (1986)] . В некоторых случаях образование комплекса в твердой фазе является термодинамически самопроизвольным и включение обычно может быть достигнуто путем растирания [C. Torricelli et al. Int. J. Pharm. , 71, 19 (1991)] . Нами неожиданно обнаружено, что характеристики биодоступности некоторых лекарственных средств могут быть еще улучшены с помощью ЦД также для молекул с высокой растворимостью в воде, что теоретически не требует какого-либо конкретного подхода, в частности предназначенного для улучшения их растворимости или их скорости растворения из терапевтической лекарственной формы. Данное изобретение относится к фармацевтической композиции, содержащей производное эстрамустина и циклодекстрин. Производными эстрамустина в соответствии с изобретением являются, например, соединения формулы (I) 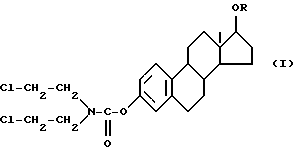 где R обозначает 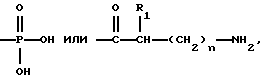 где R1 представляет C1-C4 алкил и n = 0, 1 или 2, и фармацевтически приемлемые соли. Особенно предпочтительными производными эстрамустина являются соединения формулы (I), где R обозначает 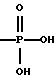 т. е. Эстрамустин-17-фосфат, и его натриевая соль, т. е. Эстрамустин-17-динатрий фосфат; или где R обозначает 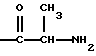 т. е. Эстрамустин-17-L-аланинат, или его метансульфонатная соль, т. е. Эстрамустин-17-L-аланинат метансульфонат. Эстрамустин-17-фосфат динатриевая соль (Патент Великобритании 1016959) является лекарственным средством, используемым при опухоли простаты, наиболее широко при лечении пациентов, которых нельзя далее лечить гормонами, и пациентов с плохим прогнозом. Лекарственное средство применяется для всех пациентов, у которых болезнь распространилась через метастатические опухоли. По мере того как опухоль уменьшается, боль, вызываемая опухолью, также ослабевает. Несмотря на эффективность при лечении и способность к всасыванию через желудочно-кишечную стенку, Эстрамустин-17-фосфат динатриевая соль имеет сильные ограничения при пероральном введении вследствие его взаимодействия с пищей и питьем; необходимо вводить лекарственный препарат натощак для того, чтобы избежать повторного осаждения лекарственного препарата, которое вызывается катионами и, в частности, ионами кальция [P. O. Gunnarsson et al. , Europ. J. Clin. Pharm. , 38, 189 (1990)] . Этот факт существенно понижает биодоступность лекарственного средства и вызывает побочные эффекты в желудочно-кишечном тракте. Эстрамустин-17-L-аланинат (патентная заявка EP 351561) имеет те же самые терапевтические показания, что и Эстрамустин-17-фосфат динатриевая соль, и ему присущ тот же самый недостаток, связанный с переосаждением, но вызываемым анионами, такими как ионы хлора. Данное изобретение, главным образом, относится к использованию любого ЦД, природного (  -ЦД, -ЦД,  -ЦД и -ЦД и  -ЦД), синтетического или полусинтетического (как, например, гидроксипропил- -ЦД), синтетического или полусинтетического (как, например, гидроксипропил- -ЦД или диметил- -ЦД или диметил- -ЦД) или дегидратированного [A. Martini et al. , Патент США 5126333, 30 июня (1992)] .
В частности, предпочтительными циклодекстринами являются -ЦД) или дегидратированного [A. Martini et al. , Патент США 5126333, 30 июня (1992)] .
В частности, предпочтительными циклодекстринами являются  -циклодекстрин, гидроксипропил- -циклодекстрин, гидроксипропил- -циклодекстрин и -циклодекстрин и  -циклодекстрин.
Авторами неожиданно было обнаружено, что, когда циклодекстрины смешивают с Эстрамустин-17-фосфат динатриевой солью, растворимость лекарственного средства сама по себе существенно не изменяется, но эффекты повторного осаждения лекарственного средства, вызываемого катионами, совсем незначительны, поскольку циклодекстрины способны загородить участок взаимодействия Эстрамустин-17-фосфата с кальцием или другими катионами.
Образование комплекса в растворе между лекарственным средством и соответствующим циклодекстрином может предотвратить повторное осаждение свободного лекарственного средства или соли лекарственного средства в физиологических условиях.
Это явление может иметь большое преимущество при введении лекарственного средства, делая его биодоступность более высокой независимо от условий пустого/непустого желудка.
Циклодекстрины неожиданно оказались способными не только предотвращать повторное осаждение Эстрамустин-17-фосфата в присутствии катионов, но, кроме того, позволять поступать в раствор лекарственному средству, когда, например, ионы кальция присутствуют в среде растворения, и повторно растворять уже обрадованный осадок Эстрамустин-17-фосфата с кальцием.
Показано, что циклодекстрины взаимодействуют с Эстрамустин-17-L-аланинатом, предотвращая повторное осаждение различными видами анионов.
Кроме того, необходимо обратить внимание на то, что для этого применения нет необходимости получать комплекс между лекарственным средством и циклодекстрином в твердом состоянии, а достаточно ввести простую физическую смесь из двух химических компонентов.
Соотношение между лекарственным средством и циклодекстрином может варьироваться, например, от 1: 0,5 до 1: 10 (молярное отношение). Предпочтительное молярное соотношение составляет от 1: 1 до 1: 4. Подходящий диапазон составляет от 1: 1 до 1: 2.
Фармацевтический состав, содержащий композицию изобретения лекарственное средство – циклодекстрин, которая входит в объем изобретения, может быть получен следующими известными и обычными способами. Предлагаемая система лекарственное средство – циклодекстрин может быть использована для получения твердого, полутвердого или жидкого составов для пероральных лекарственных форм, например таблеток, твердых или мягких желатиновых капсул, саше и т. д. , с добавлением или без добавления одного или более наполнителей, обычно используемых для фармацевтических составов. Могут присутствовать фармацевтически приемлемые носители или разбавители.
Доза зависит от возраста, веса, состояний пациента и пути введения. Например, доза, предназначенная для перорального введения людям, составляет от 50 до 1500 мг ежедневно.
Данное изобретение относится также к фармацевтической композиции, указанной выше, для использования в способе лечения человека или животного с помощью терапии, в частности для лечения опухоли.
Данное изобретение также относится к применению циклодекстрина при получении лекарственного препарата, пригодного для перорального введения производного острамустина пациенту, причем указанный лекарственный препарат содержит производное эстрамустина и циклодекстрин, и к применению циклодекстрина при получении лекарственного препарата для лечения опухоли, причем лекарственный препарат содержит производное эстрамустина и циклодестрин.
Композиция по настоящему изобретению может быть использована в способе лечения или предотвращения опухоли, который включает введение субъекту, страдающему от нее или предрасположенному к ней, эффективного количества композиции.
Следующие примеры представлены только с целью лучшей иллюстрации данного изобретения, но их не следует рассматривать как ограничивающие объем изобретения.
Пример 1. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему 640 мкг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS), добавляют соответствующие количества хлорида кальция, для того чтобы достигнуть молярное отношение лекарственное средство: соль в интервале от 1: 0 до 1: 1. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты приведены в Таблице 1.
Пример 2. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) и различные количества циклодекстринов: -циклодекстрин.
Авторами неожиданно было обнаружено, что, когда циклодекстрины смешивают с Эстрамустин-17-фосфат динатриевой солью, растворимость лекарственного средства сама по себе существенно не изменяется, но эффекты повторного осаждения лекарственного средства, вызываемого катионами, совсем незначительны, поскольку циклодекстрины способны загородить участок взаимодействия Эстрамустин-17-фосфата с кальцием или другими катионами.
Образование комплекса в растворе между лекарственным средством и соответствующим циклодекстрином может предотвратить повторное осаждение свободного лекарственного средства или соли лекарственного средства в физиологических условиях.
Это явление может иметь большое преимущество при введении лекарственного средства, делая его биодоступность более высокой независимо от условий пустого/непустого желудка.
Циклодекстрины неожиданно оказались способными не только предотвращать повторное осаждение Эстрамустин-17-фосфата в присутствии катионов, но, кроме того, позволять поступать в раствор лекарственному средству, когда, например, ионы кальция присутствуют в среде растворения, и повторно растворять уже обрадованный осадок Эстрамустин-17-фосфата с кальцием.
Показано, что циклодекстрины взаимодействуют с Эстрамустин-17-L-аланинатом, предотвращая повторное осаждение различными видами анионов.
Кроме того, необходимо обратить внимание на то, что для этого применения нет необходимости получать комплекс между лекарственным средством и циклодекстрином в твердом состоянии, а достаточно ввести простую физическую смесь из двух химических компонентов.
Соотношение между лекарственным средством и циклодекстрином может варьироваться, например, от 1: 0,5 до 1: 10 (молярное отношение). Предпочтительное молярное соотношение составляет от 1: 1 до 1: 4. Подходящий диапазон составляет от 1: 1 до 1: 2.
Фармацевтический состав, содержащий композицию изобретения лекарственное средство – циклодекстрин, которая входит в объем изобретения, может быть получен следующими известными и обычными способами. Предлагаемая система лекарственное средство – циклодекстрин может быть использована для получения твердого, полутвердого или жидкого составов для пероральных лекарственных форм, например таблеток, твердых или мягких желатиновых капсул, саше и т. д. , с добавлением или без добавления одного или более наполнителей, обычно используемых для фармацевтических составов. Могут присутствовать фармацевтически приемлемые носители или разбавители.
Доза зависит от возраста, веса, состояний пациента и пути введения. Например, доза, предназначенная для перорального введения людям, составляет от 50 до 1500 мг ежедневно.
Данное изобретение относится также к фармацевтической композиции, указанной выше, для использования в способе лечения человека или животного с помощью терапии, в частности для лечения опухоли.
Данное изобретение также относится к применению циклодекстрина при получении лекарственного препарата, пригодного для перорального введения производного острамустина пациенту, причем указанный лекарственный препарат содержит производное эстрамустина и циклодекстрин, и к применению циклодекстрина при получении лекарственного препарата для лечения опухоли, причем лекарственный препарат содержит производное эстрамустина и циклодестрин.
Композиция по настоящему изобретению может быть использована в способе лечения или предотвращения опухоли, который включает введение субъекту, страдающему от нее или предрасположенному к ней, эффективного количества композиции.
Следующие примеры представлены только с целью лучшей иллюстрации данного изобретения, но их не следует рассматривать как ограничивающие объем изобретения.
Пример 1. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему 640 мкг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS), добавляют соответствующие количества хлорида кальция, для того чтобы достигнуть молярное отношение лекарственное средство: соль в интервале от 1: 0 до 1: 1. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты приведены в Таблице 1.
Пример 2. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) и различные количества циклодекстринов:  -циклодекстрин ( -циклодекстрин ( -ЦД), 2-гидроксипропил- -ЦД), 2-гидроксипропил- -циклодекстрин (ГП- -циклодекстрин (ГП- -ЦД) или -ЦД) или  -циклодекстрин ( -циклодекстрин ( -ЦД), добавляют соответствующие количества хлорида кальция, для того чтобы молярное отношение лекарственное средство: соль было 1: 1. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 2a, 2b и 2c.
Пример 3. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) и различные количества циклодекстринов: -ЦД), добавляют соответствующие количества хлорида кальция, для того чтобы молярное отношение лекарственное средство: соль было 1: 1. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 2a, 2b и 2c.
Пример 3. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) и различные количества циклодекстринов:  -циклодекстрин ( -циклодекстрин ( -ЦД), 2-гидроксипропил- -ЦД), 2-гидроксипропил- -циклодекстрин (ГП- -циклодекстрин (ГП- -ЦД) или -ЦД) или  -циклодекстрин ( -циклодекстрин ( -ЦД), добавляют соответствующие количества хлорида кальция, для того чтобы получить молярное отношение лекарственное средство: соль 1: 2. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 3a, 3b и 3c.
Пример 4. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) различные количества циклодекстринов: -ЦД), добавляют соответствующие количества хлорида кальция, для того чтобы получить молярное отношение лекарственное средство: соль 1: 2. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 3a, 3b и 3c.
Пример 4. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) различные количества циклодекстринов:  -циклодекстрин ( -циклодекстрин ( -ЦД) или 2-гидроксипропил- -ЦД) или 2-гидроксипропил- -циклодекстрин (ГП- -циклодекстрин (ГП- -ЦД) или -ЦД) или  -циклодекстрин ( -циклодекстрин ( -ЦД), добавляют соответствующие количества хлорида кальция, для того чтобы получить молярное отношение лекарственное средство: соль 1: 4. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 4a, 4b и 4c.
Пример 5. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) и 1 моль хлорида кальция на моль ЭФС, добавляют различные количества циклодекстринов: -ЦД), добавляют соответствующие количества хлорида кальция, для того чтобы получить молярное отношение лекарственное средство: соль 1: 4. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 4a, 4b и 4c.
Пример 5. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) и 1 моль хлорида кальция на моль ЭФС, добавляют различные количества циклодекстринов:  -циклодекстрин ( -циклодекстрин ( -ЦД), 2-гидроксипропил- -ЦД), 2-гидроксипропил- -циклодекстрин (ГП- -циклодекстрин (ГП- -ЦД) или -ЦД) или  -циклодекстрин ( -циклодекстрин ( -ЦД), для того чтобы получить молярные отношения лекарственное средство: соль от 1: 0 до 1: 4, для оценки солюбилизирующих свойств циклодекстринов в растворении предварительно образованного осадка ЭФС с кальцием. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 5a, 5b и 5c.
Пример 6. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) и 2 моль хлорида кальция на моль ЭФС, добавляют различные количества циклодекстринов: -ЦД), для того чтобы получить молярные отношения лекарственное средство: соль от 1: 0 до 1: 4, для оценки солюбилизирующих свойств циклодекстринов в растворении предварительно образованного осадка ЭФС с кальцием. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 5a, 5b и 5c.
Пример 6. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) и 2 моль хлорида кальция на моль ЭФС, добавляют различные количества циклодекстринов:  -циклодекстрин ( -циклодекстрин ( -ЦД), 2-гидроксипропил- -ЦД), 2-гидроксипропил- -циклодекстрин (ГП- -циклодекстрин (ГП- -ЦД) или -ЦД) или  -циклодекстрин ( -циклодекстрин ( -ЦД), для того чтобы молярные отношения лекарственное средство: соль было от 1: 0 до 1: 4, для оценки солюбилизирующих свойств циклодекстринов в растворении предварительно образованного осадка ЭФС с кальцием. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 6a, 6 и 6c.
Пример 7. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) и 4 моль хлорида кальция на моль ЭФС, добавляют различные количества циклодекстринов: -ЦД), для того чтобы молярные отношения лекарственное средство: соль было от 1: 0 до 1: 4, для оценки солюбилизирующих свойств циклодекстринов в растворении предварительно образованного осадка ЭФС с кальцием. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 6a, 6 и 6c.
Пример 7. К раствору HCl/KCl буфера (I = 0,1) с pH 3,1, содержащему около 1 мг/мл Эстрамустин-17-фосфат динатриевой соли (ЭФС, EPS) и 4 моль хлорида кальция на моль ЭФС, добавляют различные количества циклодекстринов:  -циклодекстрин ( -циклодекстрин ( -ЦД), 2-гидроксипропил- -ЦД), 2-гидроксипропил- -циклодекстрин (ГП- -циклодекстрин (ГП- -ЦД) или -ЦД) или  -циклодекстрин ( -циклодекстрин ( -ЦД), для того чтобы молярные отношения лекарственное средство: соль было от 1: 0 до 1: 4, для оценки солюбилизирующих свойств циклодекстринов в растворении предварительно образованного осадка ЭФС с кальцием. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 7a, 7b и 7c.
Пример 8. Тест на скорость растворения проводили, сравнивая характеристики уже продаваемого, свободного циклодекстрина, состава Эстрамустин-17-фосфат динатриевой соли, и состава, содержащего Эстрамустин-17-фосфат динатриевая соль: гидроксипропил- -ЦД), для того чтобы молярные отношения лекарственное средство: соль было от 1: 0 до 1: 4, для оценки солюбилизирующих свойств циклодекстринов в растворении предварительно образованного осадка ЭФС с кальцием. Образцы фильтруют и количество Эстрамустин-17-фосфат динатриевой соли в растворе анализируют с помощью УФ-спектроскопии.
Результаты представлены в Таблицах 7a, 7b и 7c.
Пример 8. Тест на скорость растворения проводили, сравнивая характеристики уже продаваемого, свободного циклодекстрина, состава Эстрамустин-17-фосфат динатриевой соли, и состава, содержащего Эстрамустин-17-фосфат динатриевая соль: гидроксипропил- -циклодекстрин (ЭФС/ГП- -циклодекстрин (ЭФС/ГП- -ЦД) в молярном соотношении 1: 2. Условия соответствовали тесту на скорость растворения USP XII N 1 (способ корзины) в погруженных состояниях, 37oC, 100 об. /мин, HCl/KCl буфер pH 3,1 (I = 0,1) с 1 моль хлорида кальция в среде растворения на моль лекарственного средства.
Результаты показаны в Таблице 8.
Пример 9. Тест на скорость растворения проводили, сравнивая характеристики различных составов Эстрамустин-17-фосфат динатриевой соли (ЭФС), содержащих различные циклодекстрины: -ЦД) в молярном соотношении 1: 2. Условия соответствовали тесту на скорость растворения USP XII N 1 (способ корзины) в погруженных состояниях, 37oC, 100 об. /мин, HCl/KCl буфер pH 3,1 (I = 0,1) с 1 моль хлорида кальция в среде растворения на моль лекарственного средства.
Результаты показаны в Таблице 8.
Пример 9. Тест на скорость растворения проводили, сравнивая характеристики различных составов Эстрамустин-17-фосфат динатриевой соли (ЭФС), содержащих различные циклодекстрины:  -циклодекстрин ( -циклодекстрин ( -ЦД), 2-гидроксипропип- -ЦД), 2-гидроксипропип- -циклодекстрин (ГП- -циклодекстрин (ГП- -ЦД), -ЦД),  -циклодекстрин ( -циклодекстрин ( -ЦД) или дегидратированный -ЦД) или дегидратированный  -циклодекстрин (де- -циклодекстрин (де- -ЦД) в молярном отношении 1: 2 с лекарственным средством. Условия соответствовали тесту на скорость растворения USP XII N 1 (способ корзины) в погруженных состояниях, 37oC, 100 об. /мин, HCl/KCl буфер pH 3,1 (I = 0,1) с 1 моль хлорида кальция в среде растворения на моль лекарственного средства.
Результаты показаны в Таблице 9.
Пример 10. Тест на скорость растворения проводили, сравнивая характеристики различных составов Эстрамустин-17-фосфат динатриевой соли (ЭФС), содержащих различные циклодекстрины: -ЦД) в молярном отношении 1: 2 с лекарственным средством. Условия соответствовали тесту на скорость растворения USP XII N 1 (способ корзины) в погруженных состояниях, 37oC, 100 об. /мин, HCl/KCl буфер pH 3,1 (I = 0,1) с 1 моль хлорида кальция в среде растворения на моль лекарственного средства.
Результаты показаны в Таблице 9.
Пример 10. Тест на скорость растворения проводили, сравнивая характеристики различных составов Эстрамустин-17-фосфат динатриевой соли (ЭФС), содержащих различные циклодекстрины:  -циклодекстрин ( -циклодекстрин ( -ЦД) или 2-гидроксипропил- -ЦД) или 2-гидроксипропил- -циклодекстрин (ГП- -циклодекстрин (ГП- -ЦД), в 1: 2 молярном отношении с лекарственным средством. Условия соответствовали тесту на скорость растворения USP XII N 1 (способ корзины) в погруженных состояниях, 37oC, 100 об. /мин, HCl/KCl буфер pH 6,8 (I = 0,1) с 1 моль хлорида кальция в среде растворения на моль лекарственного средства.
Результаты показаны в Таблице 10.
Пример 11. Тест на скорость растворения проводили, сравнивая характеристики различных составов Эстрамустин-17-фосфат динатриевой соли (ЭФС), содержащих различные циклодекстрины: -ЦД), в 1: 2 молярном отношении с лекарственным средством. Условия соответствовали тесту на скорость растворения USP XII N 1 (способ корзины) в погруженных состояниях, 37oC, 100 об. /мин, HCl/KCl буфер pH 6,8 (I = 0,1) с 1 моль хлорида кальция в среде растворения на моль лекарственного средства.
Результаты показаны в Таблице 10.
Пример 11. Тест на скорость растворения проводили, сравнивая характеристики различных составов Эстрамустин-17-фосфат динатриевой соли (ЭФС), содержащих различные циклодекстрины:  -циклодекстрин ( -циклодекстрин ( -ЦД) или 2-гидроксипропил- -ЦД) или 2-гидроксипропил- -циклодекстрин (ГП- -циклодекстрин (ГП- -ЦД), в 1: 2 молярном отношении с лекарственным средством. Условия соответствовали тесту на скорость растворения USP XII N 1 (способ корзины) в погруженных состояниях, 37oC, 100 об. /мин, HCl/KCl буфер pH 3,1 (I = 0,1) с 5 моль хлорида кальция в среде растворения на моль лекарственного средства.
Результаты показаны в Таблице 11. -ЦД), в 1: 2 молярном отношении с лекарственным средством. Условия соответствовали тесту на скорость растворения USP XII N 1 (способ корзины) в погруженных состояниях, 37oC, 100 об. /мин, HCl/KCl буфер pH 3,1 (I = 0,1) с 5 моль хлорида кальция в среде растворения на моль лекарственного средства.
Результаты показаны в Таблице 11.
Формула изобретения
 -циклодекстрин, -циклодекстрин,  -циклодекстрин, -циклодекстрин,  -циклодекстрин, частично этерифицированный -циклодекстрин, частично этерифицированный  -циклодекстрин или диметил- -циклодекстрин или диметил- -циклодекстрин.
5. Фармацевтическая композиция по п. 4, где циклодекстрином является -циклодекстрин.
5. Фармацевтическая композиция по п. 4, где циклодекстрином является  -циклодекстрин.
6. Фармацевтическая композиция по п. 4, где циклодекстрином является гидроксипропил- -циклодекстрин.
6. Фармацевтическая композиция по п. 4, где циклодекстрином является гидроксипропил- -циклодекстрин.
7. Фармацевтическая композиция по п. 4, где циклодекстрином является -циклодекстрин.
7. Фармацевтическая композиция по п. 4, где циклодекстрином является  -циклодекстрин.
8. Фармацевтическая композиция по п. 4, где циклодекстрином является дегидрированный циклодекстрин.
9. Фармацевтическая композиция по любому из пп. 1-8, где молярное отношение производного эстрамустина к циклодекстрину составляет от 1: 0,5 до 1: 10.
10. Фармацевтическая композиция по любому из пп. 1-9, характеризующаяся тем, что она предназначена для лечения опухолей.
11. Применение циклодекстрина в качестве ингибитора осаждения производного эстрамустина в желудочно-кишечном тракте при получении лекарственного препарата, содержащего производное эстрамустина, предназначенного для перорального введения пациенту, в котором циклодекстрин и производное эстрамустина находятся в виде комплекса или физической смеси.
12. Применение циклодекстрина по п. 12, где указанный препарат используется для лечения опухоли. -циклодекстрин.
8. Фармацевтическая композиция по п. 4, где циклодекстрином является дегидрированный циклодекстрин.
9. Фармацевтическая композиция по любому из пп. 1-8, где молярное отношение производного эстрамустина к циклодекстрину составляет от 1: 0,5 до 1: 10.
10. Фармацевтическая композиция по любому из пп. 1-9, характеризующаяся тем, что она предназначена для лечения опухолей.
11. Применение циклодекстрина в качестве ингибитора осаждения производного эстрамустина в желудочно-кишечном тракте при получении лекарственного препарата, содержащего производное эстрамустина, предназначенного для перорального введения пациенту, в котором циклодекстрин и производное эстрамустина находятся в виде комплекса или физической смеси.
12. Применение циклодекстрина по п. 12, где указанный препарат используется для лечения опухоли.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 02.09.2006
Извещение опубликовано: 20.12.2007 БИ: 35/2007
|
||||||||||||||||||||||||||
