Патент на изобретение №2178807
|
||||||||||||||||||||||||||
(54) ВЫДЕЛЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК, ВЕКТОР, СПОСОБ ПОЛУЧЕНИЯ ГОМОГЕННОГО БЕЛКА gp350, ГОМОГЕННЫЙ БЕЛОК gp350, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЕВV-СВЯЗАННОГО ЗАБОЛЕВАНИЯ ИЛИ СОСТОЯНИЯ
(57) Реферат: Предложена выделенная ДНК, кодирующая белок gp350. Белок gp350 используется в фармацевтической композиции для лечения EBV-связанного заболевания или состояния. Выделенная ДНК входит в состав вектора, который вводят в клетку-хозяин, где происходит экспрессия белка gp350. ДНК в составе вектора исключает продуцирование белка gp220 и продуцирует только gp350. 6 с. и 2 з. п. ф-лы, 5 ил. , 3 табл. Вирус Эпштейна-Барра (Epstein-Barr= EBV), член группы герпесвирусов, вызывает у людей инфекционный мононуклеоз. Это заболевание поражает более чем 90% населения. Аналитики здравоохранения оценивают потери, связанные с этим заболеванием в Соединенных Штатах, в 100 миллионов долларов ежегодно. Этот вирус распространяется преимущественно капельным путем со слюной индивидуумов, распространяющих этот вирус. Дети, инфицированные EBV, в большинстве случаев асимптотичны или у них очень слабые симптомы, тогда как у подростков или у взрослых при инфицировании развиваются типичные инфекционные мононуклеозы, характеризующиеся лихорадкой, фарингитами и аденопатией. У людей, которые были инфицированы, анти-EBV антитела сохраняются в течение всей остальной жизни, и поэтому они имеют иммунитет к последующим инфекциям. В настоящее время не существует коммерчески доступных EBV вакцин. Помимо своих инфекционных характеристик, было показано, что EBV трансформирует лимфоциты в быстро делящиеся клетки, и поэтому косвенным образом связан с различными лимфомами, включая лимфому Burkitts или оральную волосистую лейкоплакию. EBV были также обнаружены в образцах тканей от индивидуумов с назофарингеальными опухолями. По всему миру насчитывается порядка 80000 случаев рака носоглотки, и он превалирует у этнических китайцев. Разработка живой, ослабленной вакцины для EBV была и остается серьезной проблемой. Из-за потенциального онкогенного характера, связанного с EBV, исследователи возражали против использования подходов, связанных с живыми вакцинами. Это изобретение позволяет преодолеть проблемы, связанные с живыми вакцинами, за счет создания способов и композиций для субъединичных вакцин, которые не требуют использования потенциально онкогенных живых вирусов. Субъединичная вакцина представляет собой один или более из антигенных протеинов из вируса, которые вызовут иммунную реакцию и выработают иммунитет. Два из наиболее важных антигенных EBV протеинов являются гликопротеинами gр350/300 и gр220/200, которые образуют часть оболочки вирусной мембраны и позволяют вирусным частицам связываться с мишеневыми клетками человека и проникать в них за счет взаимодействия с протеином клеточных мембран, CD21. См. Nemerow, J. Virology 61: 1416 (1987). Они были давно отмечены как кандидаты для субъединичных вакцин, но трудности в получении антигенно активного протеина, выделенного из природных источников, и низкие выходы гликопротеинов при получении их из рекомбинантных источников затруднят и попытки исследователей и разработку вакцин. В литературе указано, что эти протеины имеют различные интервалы молекулярных весов (350 или 300 килодальтон /кД/ для одного из протеинов и 220 или 200 килодальтон для другого протеина). Здесь протеин gр350 или 300 именуется как gр350, а протеин 220 или 200 здесь обозначается как протеин gр220. В целом оба эти протеина здесь обозначают как gр350/220 протеин (протеины). Альтернативно сплайсированный, отдельный ген кодирует gр350/220 протеины и приводит к созданию gр350 и gр220 мРНК транскриптов; причем неизвестны природные варианты сайтов сплайсинга гена gр350/200. Генные продукты двух продуктов экспрессии представляют собой gр350 и gр220 протеины. Открытая считывающая рамка для gр350/220 ДНК последовательности составляет 2721 пару оснований (bр). Вся считывающая рамка кодирует 907 аминокислот gр350. См. патент США 4707358, выданный Kieff (1987). Сплайсированный вариант считывающей рамки охватывает 2130 оснований и транслирует в gр220 протеин последовательность 710 аминокислот. Теоритический молекулярный вес gр350 протеина и gр220 протеина составляет 95 кД и 70 кД, соответственно. Измеренные молекулярные веса экспрессированных gр350 протеина и gр220 протеина варьируются, но составляют примерно 350 килодальтон и 220 килодальтон, соответственно. Интенсивное гликозилирование протеинов ответственно за различия между предсказанным и реальным молекулярными весами. В каждой из отдельных клеток оба протеина, gр350 и gр220, продуцируются в молярном отношении от около 6: 1 до 1: 1. Так, например, в клетках В95-8, которые устойчиво инфицированы EBV, это отношение, по-видимому, варьируется, но иногда достигает значений 6: 1. См. Miller, Proc. Natl. Acad. Sci 69: 383 (1972). Аналогично, рекомбинантное получение этих гликопротеинов поэтому обычно приводит к смеси gр350 и gр220 протеинов. До сих пор gр350/220 протеины экспрессировали в клетки крысиного гипофиза, в клетки яичников китайского хомяка VERO, почек африканской зеленой обезьяны, а также в дрожжевые клетки. См. Whang, J. Virol. 61: 1796 (1982), Motz, Gene 44: 353 (1986) и Emini Virology 166: 387 (1988). Система экспрессии вируса бычьей папилломы была использована для получения gр350/220 протеинов в мышиных фибробластных клетках. См. Madej, Vaccine 10: 777 (1992). Лабораторные и вакцинные штаммы вакцинного вируса также были использованы для экспрессии gр350/220 протеинов. Модифицированные рекомбинантные варианты EBV gp350/220 ДНК и протеин известны специалистам. Более конкретно, были сконструированы рекомбинантные усеченные конструкции gp350/220 гена, не содержащие соединяющих с мембраной последовательностей. Такие конструкции все еще продуцируют смесь двух gр350 и gр220, но делеция участка связывания с мембраной допускает секрецию протеина. См. Finerty, J. Gen. Virology 73: 449 (1992) и Madej J. Vaccine 10: 777 (1992). Кроме того, были также получены различные рекомбинантно полученные рестрикционные фрагменты и протеины слияния, содержащие различные gp350/220 последовательности, и они были экспрессированы в E. coli. См. ЕР патентную публикацию 0173254, опубликованную 24 июля 1991 г. Соответственно, исследования EBV, касающиеся gр350/220, до настоящего времени были сфокусированы на получении эффективной экспрессии нативной gр350/220 последовательности или на модифицированой последовательности, не содержащей трансмембранного домена, что приводило к получению смеси двух альтернативно сплайсированных вариантов нативного, или не содержащего трансмембранного домена протеина, или на получении последовательностей эпитопного фрагмента в  -галактозидазных протеинах слияния.
Известны частично очищенные препараты gр350/220. См. Finerty, J. Gen. Virology 73: 449 (1992) (рекомбинантно получены, частично очищены). Что касается нативного gp350/220 протеина, то в большинстве случаев процесс очистки протеинов приводит к инактивированию антигенности протеина, что делает неприемлемым его использование в субъединичной вакцине. Однако, высокой степени очистки препараты антигенно активного gp350 протеина из нативных (т. е. не рекомбинантных) источников, все-таки были получены, как сообщалось в литературе. См. David, J. Immunol Methods 108: 231 (1988). Кроме того, вирус рекомбинантной вакцины, экспрессирующий gp350/220 протеин, был использован для вакцинации хлопчатникового тамарина против индуцированной EBV лимфомы. См. J. Med. Virology 25: 189 (1988), Mackett, EMBO J. 4: 3229 (1985) и Mackett, VACCINES 86, рр 293 (Lerner RA, Chanock RM, Brown F Eds 1986, Cold Spring Harbor Laboratory). Однако, до сих пор не была сконструирована вирусная gp350/220 ДНК последовательность с тем, чтобы обеспечить экспрессию отдельно одного или другого сплайсированного варианта гена, что обеспечило бы продуцирование чистого gp350 или gр220 протеина. Не были также сконструированы рекомбинантные или мутантные вирусы, которые экспрессировали бы тот или иной из gp350 и gр220 протеинов.
Обычно сплайсинговые сайты облегчают процессинг пре-мРНК молекул в мРНК. В вирусе полиомы сайты сплайсинга необходимы для эффективного накопления последующих мРНК. Изменение 3′ и 5′ сплайсинговых сайтов в транскриптах вируса полиомы снижает или полностью блокирует накопление мРНК. См. Treisman Nature 292: 595 (1981). В вирусе SV40 иссекаемые интроны облегчают транспорт мРНК из ядер и мРНК стабилизацию в ядрах, и так как эти интрон/эксон соединяющие последовательности облегчают связывание мелких ядер, RNP частиц, считают, что пресплайсированная мРНК может оказаться не в состоянии нужным образом включаться в схему процессинга. Было показано, что точечные мутации по сайгам сплайсинга эксон/интрон уменьшают расщепление эксон/интрон и могут нарушить пре-мРНК процессинг, ядерный транспорт и стабильность. См. Ryu, J. Virology 63: 4386 (1989) и Gross, Nature 286: 634 (1980). Поэтому до настоящего изобретения влияние модификации сайтов сплайсинга на функциональную экспрессию и антигенную активность протеинов, кодируемых EBV gp350/220 последовательностью, было совершенно неизвестно и непредсказуемо.
Дополнительная известная по данному вопросу литература включает следующее. EBV биология и заболевание в общем плане приведены в обзоре Straus, Annal of Int. Med. 118: 45 (1993). Описание EBV BLLFI открытой считывающей рамки приведено у Baer, Nature 310: 207 (1984). Описание ДНК и аминокислотных последовательностей gp350/220 вируса Эпштейн-Барра приведены в статье Beisel, J. Virology 54: 665 (1985) и Biggin, EMBO J. 3: 1083 (1984) и в патентах США 4707358, выданных Kieff et. al (1987). Сравнение ДНК последовательностей, кодирующих gp350/220 в вирусах Эпштейн-Барра типов А и В, раскрыто у Lee, Virology 195: 578 (1993). Моноклональные антитела, которые демонстрируют нейтрализующую активность против gp350/220 гликопротеина EBV, раскрыты у Thorley-Lawson, Proc. Natl. Acad. Sci. 77: 5307 (1980). И, наконец, сайты сплайсинга для консенсусных последовательностей для донорных и акцепторных сайтов сплайсинга раскрыты у Mount, Nucleic Acids Res 10: 459 (1982).
В одном аспекте настоящего изобретения предложены нон-сплайсинговые варианты EBV gp350/220 ДНК последовательности. ДНК последовательности настоящего изобретения могут включать выделенную ДНК последовательность, которая кодирует экспрессию гомогенного gp350 протеина. ДНК последовательность, кодирующая gp350 протеин, характеризуется как последовательность, содержащая идентичную или практически идентичную нуклеотидной последовательности на фиг. 1, где нативные нуклеотидные последовательности донорных и акцепторных сайтов сплайсинга заменены на ненативные нуклеотиды и их фрагменты. ДНК последовательность может включать 5′ и 3′ некодирующие последовательности, фланкирующие кодирующую последовательность, и далее включать аминотерминальную сигнальную последовательность. Фиг. 1 иллюстрирует некодирующие последовательности и указывает конец предполагаемой сигнальной последовательности звездочкой. Однако, очевидно, что ДНК последовательности настоящего изобретения могут не содержать некоторые или все из этих фланкирующих последовательностей или сигнальных последовательностей. ДНК последовательности нон-сплайсинговых вариантов настоящего изобретения получают за счет введения мутаций в представленную на фиг. 1 ДНК последовательность в донорных и акцепторных сплайсинговых сайтах гена, кодирующего gp350/220/. Это исключает продуцирование gp220 протеина, так что продуцируется только gp350 протеин.
Соответственно, другой аспект изобретения включает гомогенные gp350 протеины и способы получения протеинов за счет экспрессии нон-сплайсинговых вариантов EBV gp350/220 ДНК последовательности в клетках соответствующих прокариотных или эукариотных хозяев. Что касается терминов, используемых в отношении gp350 протеинов, гомогенность означает полное или практически полное отсутствие gp220 протеина. Мы отмечаем, что гомогенный gp350 протеин, рекомбинантно полученный в клетках млекопитающих или насекомых, насколько нам известно, никогда не упоминался до сих пор в научной литературе.
В еще одном аспекте предложены гомогенные gp350 протеины, содержащие дополнительные делеции, в секретируемом продукте. Такие делеции включают либо удаление трансмембранного участка, либо удаление трансмембранного участка и остального С-конца gp350. Такие дополнительно модифицированные ДНК последовательности и кодируемые ими протеины составляют еще один аспект изобретения.
Предложена также рекомбинантная ДНК молекула, содержащая векторную ДНК и ДНК последовательность, кодирующую гомогенный gp350 протеин. ДНК молекула обеспечивает gp350 последовательность, оперативно связанную с подходящей регуляторной последовательностью, способной управлять репликацией и экспрессией гомогенного gp350 в клетках выбранного хозяина. Клетки хозяина, трансформированные такими ДНК молекулами, для использования при экспрессии рекомбинантных гомогенных gp350, также предоставлены в этом изобретении.
ДНК молекулы и трансформированные клетки хозяев в настоящем изобретении используют в другом аспекте изобретения, в новом способе получения рекомбинантного гомогенного gp350 протеина или его фрагментов. В этом способе клеточную линию, трансформированную ДНК последовательностью, кодирующей гомогенный gp350 протеин или его фрагмент (или описанную выше рекомбинантную молекулу ДНК), оперативно связанную с подходящей регуляторной или контролирующей экспрессию последовательностью, способной контролировать экспрессию протеина, культивируют в соответствующих условиях, обеспечивающих экспрессию рекомбинантной ДНК. Затем экспрессированные протеины собирают из клеток хозяина или культуральной среды с помощью обычных средств. В качестве клеток хозяина в этом способе можно использовать ряд известных клеток; в настоящее время предпочтительны клетки млекопитающих и клетки насекомых.
ДНК последовательности и протеины настоящего изобретения можно использовать при получении терапевтических и иммуногенных соединений, содержащих EBV антигенные детерминанты. Такие соединения находят применение в субъединичных вакцинах для профилактики, лечения и предотвращения таких заболеваний, связанных с EBV, как мононуклеоз, лимфома Буркетта и карцинома носоглотки. Соответственно, в еще одном аспекте настоящего изобретения представлены такие терапевтические и/или иммуногенные фармацевтические композиции для предотвращения и лечения таких связанных с EBV состояний и заболеваний у человека, как инфекционный мононуклеоз, лимфома Буркетта и карцинома носоглотки. Такие терапевтические и/или иммуногенные фармацевтические композиции включают иммуногенно индуцирующее эффективное количество одного или более из гомогенных gp350 протеинов настоящего изобретения в смеси с фармацевтически приемлемым носителем, таким, как гидроксид алюминия, физиологический раствор или фосфатный буферированный физиологический раствор, как это известно специалистам. Под “иммуногенно индуцирующим” подразумевают количество, которого достаточно для стимулирования у млекопитающего продуцирования антител к EBV. В другом варианте, активный ингредиент можно вводить в форме содержащих липосомы агрегатов. Для профилактического применения такие фармацевтические композиции могут быть выполнены в форме субъединичных вакцин для введения людям. Пациентов можно вакцинировать дозой, достаточной для стимулирования образования у пациента антител; и повторно вакцинировать спустя шесть месяцев или год.
В следующем аспекте изобретения предложен способ лечения связанных с EBV заболеваний и состояний за счет введения пациенту, в частности человеку, иммуногенно индуцирующего терапевтически эффективного количества гомогенного gp350 протеина в подходящем фармацевтическом носителе. Еще одним способом изобретения является способ стимуляции иммунной реакции против EBV за счет введения пациенту иммуногенно индуцирующего эффективного количества гомогенного gp350 протеина в подходящем фармацевтическом носителе.
Фиг. 1 иллюстрирует ДНК и аминокислотную последовательность gp350/220 (из Beisel, J. Virology 54: 665 (1985)). Указаны донорные и акцепторные сплайсинговые сайты. Трансмембранный участок обозначен горизонтальными стрелками, а звездочкой (*) отмечен конец предположительной сигнальной последовательности. Нумерация нуклеотидов представлена слева; нумерация аминокислот – справа.
Фиг. 2 иллюстрирует конструирование gp350 делеции и сайт-направленных мутантов. Плазмидные карты, обозначенные как pMDTM и pMSTOP, представляют примеры нон-сплайсинговых вариантов gp350/220 настоящего изобретения. На фиг. 2А линейная модель gp350 протеина представлена примерно в масштабе с кодирующим клоном, BLLF1 (изображен внизу). На протеине указаны N-терминальная сигнальная последовательность (SS) и трансмембранный домен (ТМ), а на диаграмме гена изображены важные рестрикционные сайты. gp350 ген был клонирован в два сегмента, HindIII/BfaI BLSH1 фрагмент и BanI/HindIII BLSH2 фрагмент. SCYT создают, используя полимеразную цепную реакцию, начиная с указанного участка BLLF1. Фиг. 2В иллюстрирует схему клонирования для pDTM, pSTOP, pMDTM и pMSTOP (плазмиды не в масштабе). Подробности схемы клонирования приведены в примерах 1 и 2. На плазмидных картах отмечены соответствующие рестрикционные сайты, используемые векторы клонирования и gp350 генные фрагменты. Мутации сайтов сплайсинга в pMDTM и pMSTOP отмечены звездочками.
Фиг. 3 иллюстрирует результаты иммуноосаждения гомогенного gp350 протеина из pMDTM клонов в анализе SDS-PAGE. Позитивные контрольные клетки (GH3 -галактозидазных протеинах слияния.
Известны частично очищенные препараты gр350/220. См. Finerty, J. Gen. Virology 73: 449 (1992) (рекомбинантно получены, частично очищены). Что касается нативного gp350/220 протеина, то в большинстве случаев процесс очистки протеинов приводит к инактивированию антигенности протеина, что делает неприемлемым его использование в субъединичной вакцине. Однако, высокой степени очистки препараты антигенно активного gp350 протеина из нативных (т. е. не рекомбинантных) источников, все-таки были получены, как сообщалось в литературе. См. David, J. Immunol Methods 108: 231 (1988). Кроме того, вирус рекомбинантной вакцины, экспрессирующий gp350/220 протеин, был использован для вакцинации хлопчатникового тамарина против индуцированной EBV лимфомы. См. J. Med. Virology 25: 189 (1988), Mackett, EMBO J. 4: 3229 (1985) и Mackett, VACCINES 86, рр 293 (Lerner RA, Chanock RM, Brown F Eds 1986, Cold Spring Harbor Laboratory). Однако, до сих пор не была сконструирована вирусная gp350/220 ДНК последовательность с тем, чтобы обеспечить экспрессию отдельно одного или другого сплайсированного варианта гена, что обеспечило бы продуцирование чистого gp350 или gр220 протеина. Не были также сконструированы рекомбинантные или мутантные вирусы, которые экспрессировали бы тот или иной из gp350 и gр220 протеинов.
Обычно сплайсинговые сайты облегчают процессинг пре-мРНК молекул в мРНК. В вирусе полиомы сайты сплайсинга необходимы для эффективного накопления последующих мРНК. Изменение 3′ и 5′ сплайсинговых сайтов в транскриптах вируса полиомы снижает или полностью блокирует накопление мРНК. См. Treisman Nature 292: 595 (1981). В вирусе SV40 иссекаемые интроны облегчают транспорт мРНК из ядер и мРНК стабилизацию в ядрах, и так как эти интрон/эксон соединяющие последовательности облегчают связывание мелких ядер, RNP частиц, считают, что пресплайсированная мРНК может оказаться не в состоянии нужным образом включаться в схему процессинга. Было показано, что точечные мутации по сайгам сплайсинга эксон/интрон уменьшают расщепление эксон/интрон и могут нарушить пре-мРНК процессинг, ядерный транспорт и стабильность. См. Ryu, J. Virology 63: 4386 (1989) и Gross, Nature 286: 634 (1980). Поэтому до настоящего изобретения влияние модификации сайтов сплайсинга на функциональную экспрессию и антигенную активность протеинов, кодируемых EBV gp350/220 последовательностью, было совершенно неизвестно и непредсказуемо.
Дополнительная известная по данному вопросу литература включает следующее. EBV биология и заболевание в общем плане приведены в обзоре Straus, Annal of Int. Med. 118: 45 (1993). Описание EBV BLLFI открытой считывающей рамки приведено у Baer, Nature 310: 207 (1984). Описание ДНК и аминокислотных последовательностей gp350/220 вируса Эпштейн-Барра приведены в статье Beisel, J. Virology 54: 665 (1985) и Biggin, EMBO J. 3: 1083 (1984) и в патентах США 4707358, выданных Kieff et. al (1987). Сравнение ДНК последовательностей, кодирующих gp350/220 в вирусах Эпштейн-Барра типов А и В, раскрыто у Lee, Virology 195: 578 (1993). Моноклональные антитела, которые демонстрируют нейтрализующую активность против gp350/220 гликопротеина EBV, раскрыты у Thorley-Lawson, Proc. Natl. Acad. Sci. 77: 5307 (1980). И, наконец, сайты сплайсинга для консенсусных последовательностей для донорных и акцепторных сайтов сплайсинга раскрыты у Mount, Nucleic Acids Res 10: 459 (1982).
В одном аспекте настоящего изобретения предложены нон-сплайсинговые варианты EBV gp350/220 ДНК последовательности. ДНК последовательности настоящего изобретения могут включать выделенную ДНК последовательность, которая кодирует экспрессию гомогенного gp350 протеина. ДНК последовательность, кодирующая gp350 протеин, характеризуется как последовательность, содержащая идентичную или практически идентичную нуклеотидной последовательности на фиг. 1, где нативные нуклеотидные последовательности донорных и акцепторных сайтов сплайсинга заменены на ненативные нуклеотиды и их фрагменты. ДНК последовательность может включать 5′ и 3′ некодирующие последовательности, фланкирующие кодирующую последовательность, и далее включать аминотерминальную сигнальную последовательность. Фиг. 1 иллюстрирует некодирующие последовательности и указывает конец предполагаемой сигнальной последовательности звездочкой. Однако, очевидно, что ДНК последовательности настоящего изобретения могут не содержать некоторые или все из этих фланкирующих последовательностей или сигнальных последовательностей. ДНК последовательности нон-сплайсинговых вариантов настоящего изобретения получают за счет введения мутаций в представленную на фиг. 1 ДНК последовательность в донорных и акцепторных сплайсинговых сайтах гена, кодирующего gp350/220/. Это исключает продуцирование gp220 протеина, так что продуцируется только gp350 протеин.
Соответственно, другой аспект изобретения включает гомогенные gp350 протеины и способы получения протеинов за счет экспрессии нон-сплайсинговых вариантов EBV gp350/220 ДНК последовательности в клетках соответствующих прокариотных или эукариотных хозяев. Что касается терминов, используемых в отношении gp350 протеинов, гомогенность означает полное или практически полное отсутствие gp220 протеина. Мы отмечаем, что гомогенный gp350 протеин, рекомбинантно полученный в клетках млекопитающих или насекомых, насколько нам известно, никогда не упоминался до сих пор в научной литературе.
В еще одном аспекте предложены гомогенные gp350 протеины, содержащие дополнительные делеции, в секретируемом продукте. Такие делеции включают либо удаление трансмембранного участка, либо удаление трансмембранного участка и остального С-конца gp350. Такие дополнительно модифицированные ДНК последовательности и кодируемые ими протеины составляют еще один аспект изобретения.
Предложена также рекомбинантная ДНК молекула, содержащая векторную ДНК и ДНК последовательность, кодирующую гомогенный gp350 протеин. ДНК молекула обеспечивает gp350 последовательность, оперативно связанную с подходящей регуляторной последовательностью, способной управлять репликацией и экспрессией гомогенного gp350 в клетках выбранного хозяина. Клетки хозяина, трансформированные такими ДНК молекулами, для использования при экспрессии рекомбинантных гомогенных gp350, также предоставлены в этом изобретении.
ДНК молекулы и трансформированные клетки хозяев в настоящем изобретении используют в другом аспекте изобретения, в новом способе получения рекомбинантного гомогенного gp350 протеина или его фрагментов. В этом способе клеточную линию, трансформированную ДНК последовательностью, кодирующей гомогенный gp350 протеин или его фрагмент (или описанную выше рекомбинантную молекулу ДНК), оперативно связанную с подходящей регуляторной или контролирующей экспрессию последовательностью, способной контролировать экспрессию протеина, культивируют в соответствующих условиях, обеспечивающих экспрессию рекомбинантной ДНК. Затем экспрессированные протеины собирают из клеток хозяина или культуральной среды с помощью обычных средств. В качестве клеток хозяина в этом способе можно использовать ряд известных клеток; в настоящее время предпочтительны клетки млекопитающих и клетки насекомых.
ДНК последовательности и протеины настоящего изобретения можно использовать при получении терапевтических и иммуногенных соединений, содержащих EBV антигенные детерминанты. Такие соединения находят применение в субъединичных вакцинах для профилактики, лечения и предотвращения таких заболеваний, связанных с EBV, как мононуклеоз, лимфома Буркетта и карцинома носоглотки. Соответственно, в еще одном аспекте настоящего изобретения представлены такие терапевтические и/или иммуногенные фармацевтические композиции для предотвращения и лечения таких связанных с EBV состояний и заболеваний у человека, как инфекционный мононуклеоз, лимфома Буркетта и карцинома носоглотки. Такие терапевтические и/или иммуногенные фармацевтические композиции включают иммуногенно индуцирующее эффективное количество одного или более из гомогенных gp350 протеинов настоящего изобретения в смеси с фармацевтически приемлемым носителем, таким, как гидроксид алюминия, физиологический раствор или фосфатный буферированный физиологический раствор, как это известно специалистам. Под “иммуногенно индуцирующим” подразумевают количество, которого достаточно для стимулирования у млекопитающего продуцирования антител к EBV. В другом варианте, активный ингредиент можно вводить в форме содержащих липосомы агрегатов. Для профилактического применения такие фармацевтические композиции могут быть выполнены в форме субъединичных вакцин для введения людям. Пациентов можно вакцинировать дозой, достаточной для стимулирования образования у пациента антител; и повторно вакцинировать спустя шесть месяцев или год.
В следующем аспекте изобретения предложен способ лечения связанных с EBV заболеваний и состояний за счет введения пациенту, в частности человеку, иммуногенно индуцирующего терапевтически эффективного количества гомогенного gp350 протеина в подходящем фармацевтическом носителе. Еще одним способом изобретения является способ стимуляции иммунной реакции против EBV за счет введения пациенту иммуногенно индуцирующего эффективного количества гомогенного gp350 протеина в подходящем фармацевтическом носителе.
Фиг. 1 иллюстрирует ДНК и аминокислотную последовательность gp350/220 (из Beisel, J. Virology 54: 665 (1985)). Указаны донорные и акцепторные сплайсинговые сайты. Трансмембранный участок обозначен горизонтальными стрелками, а звездочкой (*) отмечен конец предположительной сигнальной последовательности. Нумерация нуклеотидов представлена слева; нумерация аминокислот – справа.
Фиг. 2 иллюстрирует конструирование gp350 делеции и сайт-направленных мутантов. Плазмидные карты, обозначенные как pMDTM и pMSTOP, представляют примеры нон-сплайсинговых вариантов gp350/220 настоящего изобретения. На фиг. 2А линейная модель gp350 протеина представлена примерно в масштабе с кодирующим клоном, BLLF1 (изображен внизу). На протеине указаны N-терминальная сигнальная последовательность (SS) и трансмембранный домен (ТМ), а на диаграмме гена изображены важные рестрикционные сайты. gp350 ген был клонирован в два сегмента, HindIII/BfaI BLSH1 фрагмент и BanI/HindIII BLSH2 фрагмент. SCYT создают, используя полимеразную цепную реакцию, начиная с указанного участка BLLF1. Фиг. 2В иллюстрирует схему клонирования для pDTM, pSTOP, pMDTM и pMSTOP (плазмиды не в масштабе). Подробности схемы клонирования приведены в примерах 1 и 2. На плазмидных картах отмечены соответствующие рестрикционные сайты, используемые векторы клонирования и gp350 генные фрагменты. Мутации сайтов сплайсинга в pMDTM и pMSTOP отмечены звездочками.
Фиг. 3 иллюстрирует результаты иммуноосаждения гомогенного gp350 протеина из pMDTM клонов в анализе SDS-PAGE. Позитивные контрольные клетки (GH3 19), секретирующие усеченную форму gp350/220 протеина, негативные контрольные клетки (рЕЕ14) и некоторые pMDTM клоны метаболически помечены 35S метионином в течение 5,5 часа; гомогенный gp350 протеин был иммуноосажден из надосадочных жидкостей тканевых культур. Для каждого типа клеток образцы надосадочных жидкостей тканевых культур (S) и осажденные gp350/220 (Iр) обрабатывали электрофоретически на 5% SDS-PAGE (электрофорез в полиакриламидном геле). Слева представлены маркеры молекулярных весов.
Фиг. 4 представляет результаты Норзернблоттинга протеина из pMDTM клонов, экспрессированных в СНО клетках, как указано в примерах 3, 4.
Раскрыты композиции и способы, включающие клонированные EBV ДНК последовательности, кодирующие нон-сплайсинговые варианты gp350 протеина. Как было указано, такие нон-сплайсинговые варианты здесь обозначаются как гомогенные gp350 протеины. Обычно, если gp350/220 ген экспрессируется в клетках млекопитающих, вырабатываются два генных продукта, gp350 и gp220, за счет РНК сплайсинга гена. Настоящее изобретение дает возможность получать только один генный продукт, gp350. Настоящее изобретение включает удаление нескольких или всех РНК сплайсинговых сайтовых сигналов в gp350 гене и экспрессию гена в клетки подходящего хозяина. Мутации gp350/220 гена вводят для предотвращения продуцирования 220 кД версии протеина, когда gp350/220 экспрессируют в клетках млекопитающих. В результате получают мРНК транскрипты, кодирующие только gp350. Исключение gp220 экспрессии за счет использования gp350/220 нон-сплайсингового варианта gp350/220 гена приводит к усиленному продуцированию gp350 по сравнению с gp220. Продуцирование gp220 не существенно для продуцирования эффективно анти-EBV вакцины, так как gp350 содержит все потенциально антигенные сайты, находящиеся на gp220.
Поэтому в одном аспекте настоящее изобретение обеспечивает ДНК последовательность, кодирующую полипептидную последовательность, практически такую же, что и gp350, за исключением того, что кодон донорного сплайсингового сайта, кодирующий аминокислоту 501, и кодон акцепторного сплайсингового сайта, кодирующий аминокислоту 698, были модифицированы за счет замены нативных нуклеотидов ненативными нуклеотидами. Предпочтительно, нативные нуклеотиды заменять ненативными нуклеотидами таким образом, чтобы аминокислотные последовательности оставались такими же. Так например, нативные нуклеотиды AAGT в донорном сплайсинговом сайте (нуклеотиды 1500-1504) и нативные нуклеотиды А и Т, фланкирующие GG акцепторный сплайсинговый сайт (нуклеотиды 2091 и 2094), заменяют нуклеотидами GTCA и Т и А, соответственно. Соответственно, в результате такой замены в донорном сайте глутамин в положении аминокислоты 500 и серин в положении 501 остаются теми же. Аналогично, в результате модификации в акцепторном сайте треонин в положении аминокислоты 697 и глицин в положении 698 остаются теми же.
Аналогично, замещения отличаются от тех, которые были приведены в качестве примера, могут быть легко осуществлены специалистами, как более подробно указано далее.
Поэтому в одном из аспектов настоящее изобретение включает гомогенные gp350 протеины. Гомогенные gp350 протеины отличаются далее тем, что имеют аминокислотную последовательность, практически такую же, что представлена на фиг. 1, с аминокислоты 1 до 907, с аминокислоты 1 до 862 или с аминокислоты 1 до 907, исключая аминокислоты 863-881, причем каждая может содержать или не содержать N-терминальную сигнальную последовательность из 18 аминокислот. Кроме того, предложены аналоги гомогенных gp350 протеинов и они включают мутанты, в которых существуют вариации в аминокислотных последовательностях, которые сохраняют агтигенную активность, и, предпочтительно, гомологичны на, по крайней мере, 80%, более предпочтительно 90% и еще более предпочтительно на 95% с соответствующим участком гомогенных gp350 протеинов. Примеры включают протеины и полипептиды с небольшими аминокислотными вариациями в аминокислотной последовательности, представленной на фиг. 1; в частности, с заменами консервативных аминокислот. Консервативными заменами являются те, которые имеют место внутри семейства аминокислот, которые родственны по своим боковым цепям. Генетически кодиируемые аминокислоты обычно делятся на 4 семейства: (1) кислотные = аспартат, глутамат; (2) основные = лизин, аргинин, гистидин; (3) неполярные = аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан и (4) незаряженные полярные = глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Так например, разумно предположить, что отдельная замена лейцина или аналогичное консервативное замещение аминокислот структурно родственными аминокислотами не окажет значительного влияния на антигенную активность или функциональность.
Настоящее изобретение предлагает преимущество более простого выделения gp350. Так как gp350 и gp220 отличаются сходными биохимическими свойствами, gp220 часто выделяется совместно с gp350 при очистке препаратов. Клеточная экспрессия только нон-сплайсингового варианта gp350/220 гена упрощает выделение протеина. Это снижает стоимость получения gp350. Настоящее изобретение также делает более простым получение биохимических характеристик исходного материала для выделения gp350. Благодаря наличию только одного вида анализ содержания протеина и анализ аминокислотной последовательности можно осуществлять без учета присутствия второго вида.
Настоящее изобретение дополнительно предлагает преимущество усиленного продуцирования gp350 протеина. Предотвращение сплайсинга gp350 гена смещает продуцирование клеткой двух продуктов (gp350 и gp220) на продуцирование только gp350. В некоторых клетках, как было оценено, концентрации gp220 составляют 30-100% от gp350 концентрации. При исключении сплайсинга гена продуцирование gp350 повышается за счет отсутствия продуцирования gp220.
ДНК последовательность gp350/220 гена описана Beisel, J. Virology 54: 665 (1985) и Biggin, EMBO J. 3: 1083 (1984) и представлена на фиг. 1. Ген представляет считывающую рамку из 2721 оснований, кодирующую 907 аминокислот и определяющий продукт первичной трансляции около 95 кД. Различие между предсказанным и реальным значениями связано с интенсивным гликозилированием протеина. 591 основание (кодируют 197 аминокислот) удалены в результате сплайсинга для исключения продуцирования gp220. Кажущийся молекулярный вес gp350/220 генного продукта может также меняться в зависимости от типа используемой измерительной системы, утилизации сайтов гликозилирования и различных типов клеток, различий в посттрансляционном процессинге или селективной генной мутации. Измеряемые величины варьируются для продуктов различных вариантов нон-сплайсинговых сайтов gp350/220 гена, но термин “гомогенный gp350 протеин или протеины” охватывает генные продукты нон-сплайсинговых вариантов, необязательно содержащих дополнительные делеции или мутации, такие, как С-терминальные делеции и/или трансмембранные модификации, также описываемые здесь. Термин “gp220 протеин” относится к альтернативно сплайсированному gp350/220 продукту с молекулярным весом примерно 220 кД. Сайты сплайсинга в gp350/220 генном продукте были определены за счет сравнения gp350/220 гена с консенсусными донорными и акцепторными сплайсинговыми последовательностями, основанными на других генах, преимущественно из эукариотных организмов. Консенсусные последовательности, выявленные Mount, Nucleic Acids Res. 10: 459 (1982) при изучении сайтов сплайсинга в других генах, имеют вид: 19), секретирующие усеченную форму gp350/220 протеина, негативные контрольные клетки (рЕЕ14) и некоторые pMDTM клоны метаболически помечены 35S метионином в течение 5,5 часа; гомогенный gp350 протеин был иммуноосажден из надосадочных жидкостей тканевых культур. Для каждого типа клеток образцы надосадочных жидкостей тканевых культур (S) и осажденные gp350/220 (Iр) обрабатывали электрофоретически на 5% SDS-PAGE (электрофорез в полиакриламидном геле). Слева представлены маркеры молекулярных весов.
Фиг. 4 представляет результаты Норзернблоттинга протеина из pMDTM клонов, экспрессированных в СНО клетках, как указано в примерах 3, 4.
Раскрыты композиции и способы, включающие клонированные EBV ДНК последовательности, кодирующие нон-сплайсинговые варианты gp350 протеина. Как было указано, такие нон-сплайсинговые варианты здесь обозначаются как гомогенные gp350 протеины. Обычно, если gp350/220 ген экспрессируется в клетках млекопитающих, вырабатываются два генных продукта, gp350 и gp220, за счет РНК сплайсинга гена. Настоящее изобретение дает возможность получать только один генный продукт, gp350. Настоящее изобретение включает удаление нескольких или всех РНК сплайсинговых сайтовых сигналов в gp350 гене и экспрессию гена в клетки подходящего хозяина. Мутации gp350/220 гена вводят для предотвращения продуцирования 220 кД версии протеина, когда gp350/220 экспрессируют в клетках млекопитающих. В результате получают мРНК транскрипты, кодирующие только gp350. Исключение gp220 экспрессии за счет использования gp350/220 нон-сплайсингового варианта gp350/220 гена приводит к усиленному продуцированию gp350 по сравнению с gp220. Продуцирование gp220 не существенно для продуцирования эффективно анти-EBV вакцины, так как gp350 содержит все потенциально антигенные сайты, находящиеся на gp220.
Поэтому в одном аспекте настоящее изобретение обеспечивает ДНК последовательность, кодирующую полипептидную последовательность, практически такую же, что и gp350, за исключением того, что кодон донорного сплайсингового сайта, кодирующий аминокислоту 501, и кодон акцепторного сплайсингового сайта, кодирующий аминокислоту 698, были модифицированы за счет замены нативных нуклеотидов ненативными нуклеотидами. Предпочтительно, нативные нуклеотиды заменять ненативными нуклеотидами таким образом, чтобы аминокислотные последовательности оставались такими же. Так например, нативные нуклеотиды AAGT в донорном сплайсинговом сайте (нуклеотиды 1500-1504) и нативные нуклеотиды А и Т, фланкирующие GG акцепторный сплайсинговый сайт (нуклеотиды 2091 и 2094), заменяют нуклеотидами GTCA и Т и А, соответственно. Соответственно, в результате такой замены в донорном сайте глутамин в положении аминокислоты 500 и серин в положении 501 остаются теми же. Аналогично, в результате модификации в акцепторном сайте треонин в положении аминокислоты 697 и глицин в положении 698 остаются теми же.
Аналогично, замещения отличаются от тех, которые были приведены в качестве примера, могут быть легко осуществлены специалистами, как более подробно указано далее.
Поэтому в одном из аспектов настоящее изобретение включает гомогенные gp350 протеины. Гомогенные gp350 протеины отличаются далее тем, что имеют аминокислотную последовательность, практически такую же, что представлена на фиг. 1, с аминокислоты 1 до 907, с аминокислоты 1 до 862 или с аминокислоты 1 до 907, исключая аминокислоты 863-881, причем каждая может содержать или не содержать N-терминальную сигнальную последовательность из 18 аминокислот. Кроме того, предложены аналоги гомогенных gp350 протеинов и они включают мутанты, в которых существуют вариации в аминокислотных последовательностях, которые сохраняют агтигенную активность, и, предпочтительно, гомологичны на, по крайней мере, 80%, более предпочтительно 90% и еще более предпочтительно на 95% с соответствующим участком гомогенных gp350 протеинов. Примеры включают протеины и полипептиды с небольшими аминокислотными вариациями в аминокислотной последовательности, представленной на фиг. 1; в частности, с заменами консервативных аминокислот. Консервативными заменами являются те, которые имеют место внутри семейства аминокислот, которые родственны по своим боковым цепям. Генетически кодиируемые аминокислоты обычно делятся на 4 семейства: (1) кислотные = аспартат, глутамат; (2) основные = лизин, аргинин, гистидин; (3) неполярные = аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан и (4) незаряженные полярные = глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Так например, разумно предположить, что отдельная замена лейцина или аналогичное консервативное замещение аминокислот структурно родственными аминокислотами не окажет значительного влияния на антигенную активность или функциональность.
Настоящее изобретение предлагает преимущество более простого выделения gp350. Так как gp350 и gp220 отличаются сходными биохимическими свойствами, gp220 часто выделяется совместно с gp350 при очистке препаратов. Клеточная экспрессия только нон-сплайсингового варианта gp350/220 гена упрощает выделение протеина. Это снижает стоимость получения gp350. Настоящее изобретение также делает более простым получение биохимических характеристик исходного материала для выделения gp350. Благодаря наличию только одного вида анализ содержания протеина и анализ аминокислотной последовательности можно осуществлять без учета присутствия второго вида.
Настоящее изобретение дополнительно предлагает преимущество усиленного продуцирования gp350 протеина. Предотвращение сплайсинга gp350 гена смещает продуцирование клеткой двух продуктов (gp350 и gp220) на продуцирование только gp350. В некоторых клетках, как было оценено, концентрации gp220 составляют 30-100% от gp350 концентрации. При исключении сплайсинга гена продуцирование gp350 повышается за счет отсутствия продуцирования gp220.
ДНК последовательность gp350/220 гена описана Beisel, J. Virology 54: 665 (1985) и Biggin, EMBO J. 3: 1083 (1984) и представлена на фиг. 1. Ген представляет считывающую рамку из 2721 оснований, кодирующую 907 аминокислот и определяющий продукт первичной трансляции около 95 кД. Различие между предсказанным и реальным значениями связано с интенсивным гликозилированием протеина. 591 основание (кодируют 197 аминокислот) удалены в результате сплайсинга для исключения продуцирования gp220. Кажущийся молекулярный вес gp350/220 генного продукта может также меняться в зависимости от типа используемой измерительной системы, утилизации сайтов гликозилирования и различных типов клеток, различий в посттрансляционном процессинге или селективной генной мутации. Измеряемые величины варьируются для продуктов различных вариантов нон-сплайсинговых сайтов gp350/220 гена, но термин “гомогенный gp350 протеин или протеины” охватывает генные продукты нон-сплайсинговых вариантов, необязательно содержащих дополнительные делеции или мутации, такие, как С-терминальные делеции и/или трансмембранные модификации, также описываемые здесь. Термин “gp220 протеин” относится к альтернативно сплайсированному gp350/220 продукту с молекулярным весом примерно 220 кД. Сайты сплайсинга в gp350/220 генном продукте были определены за счет сравнения gp350/220 гена с консенсусными донорными и акцепторными сплайсинговыми последовательностями, основанными на других генах, преимущественно из эукариотных организмов. Консенсусные последовательности, выявленные Mount, Nucleic Acids Res. 10: 459 (1982) при изучении сайтов сплайсинга в других генах, имеют вид: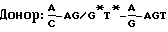 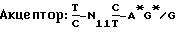 Звездочки у оснований сверху обозначают основания, которые появляются в 100% всех сайтов сплайсинга (высоко консервативны). Положения с двумя основаниями или одним основанием представляют консервативные положения. Знак / указывает реальный сайт сплайсинга. В gp350/220 гене донорный сайт сплайсинга расположен после нуклеотида 1051, а акцепторный сайт сплайсинга после нуклеотида 2092, как видно из ДНК последовательности (Biggin EMBO J. 3: 1083 (1984)) гена gp350/220. (Используемая здесь нумерация и нумерация на фиг. 1 соответствует нумерации у Biggin). Сайт сплайсинга расположен в соответствующем участке гена в штамме EBV типа В (донорный сплайсинговый сайт после A1501 и акцепторный сплайсинговый сайт после G2029). Настоящее изобретение охватывает композиции, полученные с использованием сайтов сплайсинга либо А, либо В штаммов или других EBV штаммов для получения отдельного вида мРНК из gp350/220 гена. ДНК последовательность типа А из вируса из штамма В95-8 была использована в примерах, хотя в той же степени можно использовать ДНК последовательность штамма типа В, так как транслированные генные продукты штаммов типа А и В идентичны. В В штамме отсутствуют аминокислоты 507-520 и 570-576. Штамм типа А используют благодаря тому, что он содержит все возможные gp350 антигенные сайты. В другом варианте можно использовать EBV gp350/220, содержащий штамм-специфические последовательности в соответствии с имеющимися здесь указаниями, что будут продуцироваться EBV штамм-специфические гомогенные gp350 протеины, обладающие иммуногенными свойствами, специфичными для конкретного штамма, и поэтому пригодные для использования в иммуногенных и/или терапевтических композициях для предотвращения или лечения заболеваний, связанных со штамм-специфическими EBV. В таблице 1 представлены дикого типа нуклеотидные и аминокислотные последовательности для донорного и акцепторного сайтов сплайсинга. Чтобы предотвратить РНК сплайсинг gp350/220 гена, в последовательность нуклеиновых кислот gp350/220 гена вводят мутации для замены соответствующих пар оснований сайта сплайсинга РНК. Для придания нефункциональности сайту сплайсинга, предпочтительно, по крайней мере, одно из оснований, выбранных из двух высоко консервативных оснований, ограничивающих донорный сайт или акцепторный сайт, следует заменить неконсервативными основаниями, более предпочтительно, по крайней мере, два высоко консервативных основания следует мутировать в неконсервативные основания. Другие консервативные основания, на расстоянии более двух оснований от сайта сплайсинга, также можно заменить неконсервативными основаниями сайта сплайсинга для дальнейшего ухудшения распознавания сайта сплайсинга. Как донорный, так и акцепторный сайты можно изменить, чтобы нарушить механизм сплайсинга. Предпочтительно, чтобы как донор, так и акцептор содержали, по крайней мере, по одному изменению в каждом, в одном из четырех высоко консервативных положений оснований сайта сплайсинга, и более предпочтительно, по крайней мере, по два изменения в двух из четырех высоко консервативных положений оснований сайта сплайсинга. Если один из сайтов сплайсинга не может быть подвергнут мутации из-за желания сохранить дикого типа аминокислотную последовательность, тогда предпочтительно вводить, по крайней мере, две мутации в другой сайт сплайсинга. Мутации по gp350/220 сайтам сплайсинга могут вводить изменения в аминокислотную последовательность экспрессируемого впоследствии gp350 протеина. Предпочтительно, чтобы такие изменения были бы замещениями консервативных аминокислот. Консервативные замещения в аминокислотной последовательности, в противоположность неконсервативным изменениям в аминокислотной последовательности, помогут сохранить антигенные сайты. Изменения консервативных амнокислот можно осуществлять до тех пор, пока изменение основания (или изменения оснований) не приведут к подходящим изменениям в инвариантных донорных/акцепторных основаниях. Так например, Gly может заменить Ser501 в донорном сплайсинговом сайте, используя любой Gly-специфический кодон, отличный от GGU (использование GGU сохраняет G нуклеотид и не приведет к желательной замене GT в сигнале сплайсинга). Аналогично, в акцепторном сплайсинговом сайте замена Gly698 на А1а будет консервативным изменением, но так как все А1а кодоны начинаются с высоко консервативного G нуклеотида, это не может привести к нужной замене. Хотя пролин также может быть изменением консервативной аминокислоты, пролин не следует использовать для замены дикого типа аминокислоты, так как это приведет к модификации третичной структуры протеина, и за счет этого замаскирует один или более из gp350 антигенных сайтов. В таблице 1 представлены приемлемые консервативные аминокислотные замещения в дикого типа последовательностях. Внизу таблицы 1 представлен пример мутации с консервативными изменениями аминокислот. Хотя один из аспектов настоящего изобретения включает неспецифический вариант gр350/220, могут оказаться желательными и дополнительные мутации gр350/220 кодирующей последовательности. Для получения растворимых гомогенных gр350/220 протеинов (“растворимые протеины” либо свободны в растворе, либо ассоциированы с мембраной, но не интегрированы с мембраной), например, чтобы избежать проблем клеточной токсичности, возникающей при экспрессии полной длины gр350 в качестве интегрального мембранного протеина, соединяющий с мембраной участок (известный также как трансмембранный участок) gр350 модифицируют за счет делеции всей или части его кодирующей ДНК последовательности. Соединяющий с мембраной участок gр350/220 включает аминокислоты 861 (метионин) до 881 (аланин). См. Beisel, J. Virology 54: 665 (1985). Предпочтительно, чтобы, по крайней мере, 8 аминокислот трансмембранного участка были подвергнуты делеции, более предпочтительно, чтобы были подвергнуты делеции 12 аминокислот, и наиболее предпочтительно, чтобы были подвергнуты делеции от 12 до 18 аминокислот. Соответственно, в другом аспекте в настоящем изобретении предложены нон-сплайсинговые варианты gp350/220 ДНК и/или gp350 гомогенные протеины, которые дополнительно содержат, по крайней мере, одну делецию в трансмембранном участке gp350/220 ДНК и/или gp350 гомогенном протеине, что приводит к экспрессии растворимого гомогенного gp350 протеина. Помимо делеции всего или части трансмембранного домена нон-сплайсингового gp350/220 варианта, можно также подвергнуть делеции целиком или частично, как здесь описано, С-терминальную последовательность, следующую после трансмембранного домена, включающую аминокислоты 881-907, в соответствии с настоящим изобретением. Таким образом, в еще одном аспекте настоящее изобретение включает нон-сплайсинговые варианты gp350/220 ДНК и/или гомогенный протеин, дополнительно модифицированные за счет делеции всей или части кодирующей ДНК, и/или аминокислотной последовательности, содержащей трансмембранный участок gp350/220 и даже дополнительно модифицированной за счет делеции остальной С-терминальной ДНК и/или аминокислотной последовательности gp350/220. Соответственно, другой аспект настоящего изобретения включает нон-сплайсинговые варианты ДНК последовательностей, кодирующих гомогенные gp350 протеины настоящего изобретения. Такие ДНК последовательности включают ДНК последовательность, представленную на фиг. 1, кодирующую аминокислоты 1-907, и далее включают нуклеотидные замещения, о которых шла речь, для удаления донорных и акцепторных саитов сплайсинга. Такие ДНК последовательности необязательно включают усеченные ДНК последовательности, в которых нуклеотиды, кодирующие целиком или часть трансмембранного домена и С-конца, включающие аминокислоты 861-907, подвергаются делеции, и варианты делеции, в которых нуклеотиды, кодирующие целиком или часть трансмембранного домена, включающего аминокислоты 861-881, подвергаются делеции. ДНК последовательности настоящего изобретения, кодирующие гомогенные gp350 протеины, могут также включать ДНК, способные к гибридизации в условиях соответствующей жесткости, или которые могут быть способны к гибридизации в таких условиях, но без разрушения генетического кода, для выделения ДНК последовательности, представленной на фиг. 1. Соответственно, ДНК последовательности настоящего изобретения могут содержать модификации в некодирующих последовательностях, сигнальные последовательности или кодирующие последовательности, на основе аллельных вариантов или преднамеренных модификаций. Эти нон-сплайсинговые варианты gp350/220 ДНК последовательностей, как здесь раскрыто, можно сконструировать, используя хорошо известные специалистам способы. Модифицированные ДНК последовательности настоящего изобретения можно экспрессировать рекомбинантно, используя известные способы для получения гомогенных gp350 протеинов настоящего изобретения. Такие рекомбинантные протеины можно выделить и включить в фармацевтические композиции для профилактического лечения и предотвращения заболеваний, связанных с EBV. Нон-сплайсинговые варианты gp350/220 ДНК настоящего изобретения можно экспрессировать рекомбинантно в различные типы клеток, используя соответствующие системы контроля за экспрессией, которые известны специалистам. Подходящие клетки, известные и доступные специалистам, включают (но не ограничиваются ими) такие дрожжевые клетки, как Saccharomyces cerevisiae, такие бактериальные клетки, как E. coli и Bacillus subtilis, и такие клетки млекопитающих, как GH3, СНО, NSO, MDCK и С-127 клетки. Векторы, которые используют с этими типами клеток, выбирают на основе их совместимости с типом клеток и используемой системой векторного контроля. Клетки и векторы, которые обеспечивают экспрессию секретированных продуктов gp350/220 гена, являются предпочтительными. Так например, E. coli трансформируют, используя производные pBR322, которая была модифицирована с использованием обычной методики так, чтобы она содержала ДНК последовательности для экспрессии целевого протеина, в этом случае нон-сплайсинговые вариантные последовательности EBV gp350, содержащие или не содержащие последовательности, кодирующие С-концы и/или участок, соединяющий с мембраной. pBR322 содержит гены устойчивости к ампициллину и тетрациклину, которые можно использовать в качестве маркеров. См. Bolivar, Gene 2: 95 (1977). Обычно используемые последовательности контроля экспрессии, то есть промоторы для инициирования транскрипции и необязательно оператор или энхансер, включают бета-лактамазную и lac промоторные системы (см. Chang, Nature 198: 1056 (1977)), триптофановую промоторную систему (см. Goeddel, Nucleic Acids Res. 8: 4057 (1980)) и лямбда-производный PL промотор и N-генный рибосомный сайт связывания (см. Shimatake, Nature 292: 128 (1981)). Однако, можно использовать любую доступную промоторную систему или систему контроля за экспрессией, если только она совместима с клетками прокариотного хозяина. Другие примеры клеток хозяев, плазмид и векторов экспрессии раскрыты в патенте США, выданном Itakura (1982) под 4356270, 4431739, выданном Riggs (1984) и 440859, выданном Rutter (1984). В качестве клеток-хозяев можно также использовать клетки насекомых, используя экспрессию клеток насекомых. В случае экспрессии в клетках насекомых, обычно компоненты системы экспрессии включают вектор переноса, обычно бактериальную плазмиду, которая содержит и фрагмент бакуловирусного генома, и удобный рестрикционный сайт для встраивания гетерологичных генов или генов, которые нужно экспрессировать; дикого типа бакуловирусы с последовательностью, гомологичной бакуловирус-специфичному фрагменту в векторе переноса (это позволяет обеспечить гомологичную рекомбинацию гетерологичного гена в бакуловирусный геном); и соответствующие клетки насекомого-хозяина и ростовую среду. В настоящее время наиболее часто используемым вектором переноса для встраивания чужеродных генов в AcNPV является рАс373. Было также сконструировано множество других векторов известных специалистам. Они включают, например, pVL985 (который изменяет полиэдриновый стартовый кодон с ATG на АТТ и который вводит BamHI сайт клонирования на 32 пары оснований в прямом направлении от АТТ; см. Luckow and Summers, Virology 17: 31 (1989). Плазмида обычно содержит также полиэдриновый сигнал полиаденилирования (Miller et. al (1988) Ann. Rev. Microbiol. , 42: 177) и прокариотный ген устойчивости к ампициллину (аmр) и источник репликации для отбора и размножения в E. coli. Бакуловирусные векторы переноса обычно содержат бакуловирусный промотор. Бакуловирусный промотор представляет собой любую ДНК последовательность, способную связывать бакуловирусную РНК полимеразу и инициировать в прямом направлении (5′ до 3′) транскрипцию кодирующей последовательности (то есть структурного гена) в мРНК. Промотор должен содержать участок инициирования транскрипции, который обычно расположен проксимально по отношению к 5′ концу кодирующей последовательности. Этот участок инициирования транскрипции обычно включает сайт связывания с РНК полимеразой и сайт инициирования транскрипции. Бакуловирусный вектор переноса может также содержать второй домен, называемый энхансером, который, если присутствует, обычно расположен дистально по отношению к структурному гену. Экспрессия может быть либо регулируемой, либо конструктивной. Для технологии экспрессии в клетках насекомых см. ЕР патентную публикацию 155476. В качестве клеток-хозяев можно также использовать дрожжи, например, Saccharomyces cervisiae. Можно при этом использовать различные штаммы. Аналогично, известны плазмидные векторы, пригодные для экспрессии в дрожжи также, как промоторы и системы контроля за экспрессией. См. , например, Myanohara, Proc. Natl. Acad. Sci, 80: 1 (1983) (PH05 промотор), ЕР патентную публикацию 012873 (лидерные последовательности), Kurtz, Mol. Cell. Biol. 6: 142 (1986), Ito, J. Bacteriol. 153: 163 (1983) и Hinnen, Proc. Natl. Acad. Sci. 75: 1929 (1979) (процедуры трансформации и подходящие векторы). Естественно, можно использовать эукариотные клетки из многоклеточных организмов в качестве клеток-хозяев для экспрессии генов, кодирующих протеины и полипептиды, представляющие интерес. Подходящие клеточные линии хозяев включают VERO и HeLa клетки, клетки яичника китайского хомяка (СНО). Векторы экспрессии, совместимые с такими клетками, также доступны и обычно включают промоторы и последовательности контроля за экспрессией, такие, как например, ранние и поздние промоторы из SV40 (см. Fiers, Nature 273: 113 (1978)) и промоторы из вируса полиомы, аденовируса 2, вируса бычьей папилломы или вируса птичьей саркомы. Примеры клеток-хозяев, промоторов, селектируемых маркеров и методики также раскрыты в патентах США: 5122469, выданном Mather (1992), 4399216, выданном Axel (1983), 4634665, выданном Axel (1987), 4713339, выданном Levinson (1987), 4656134, выданном Ringold (1987), 4822736, выданном Kellems (1989) и 4874702, выданном Fiers (1989). Трансформацию подходящих клеток-хозяев осуществляют, используя стандартные методики, соответствующие конкретным клеткам, такие, как CaCl2 обработка для прокариотов, как указано в статье Cohen Proc. Natl. Acad. Sci 69: 2110 (1972) и СаРО4 осаждение для клеток млекопитающих, как раскрыто у Graham, Virology 52: 546 (1978). Трансформацию дрожжей можно осуществить, как описано у Hsiao, Proc. Natl. Acad. Sci 76: 3829 (1979) или как описано у Klebe, Gene 25: 333 (1983). Конструирование подходящих векторов, содержащих нон-сплайсинговые варианты gp350 последовательности (с дополнительными модификациями (или без них), раскрытыми здесь и приводящими к делеции С-конца и/или связывающего с мембраной участка), осуществляют, используя обычные методики лигирования и рестрикции, хорошо теперь известные специалистам. Сайт-специфическое ДНК расщепление осуществляют, обрабатывая подходящим рестрикционным энзимом (энзимами) в стандартных условиях, в частности в тех, которые обычно указываются изготовителями рестрикционных энзимов. Для разделения по размерам расщепленных фрагментов можно использовать электрофорез на полиакриламидном или агарозном геле, используя стандартные методики, и затуплять концы фрагментов, за счет обработки фрагментом Кленова Е. соli полимеразы 1 в присутствии четырех деоксинуклеотидных трифосфатов. Обработка S1 нуклеазой гидролизует любые одноцепочечные участки. Синтетические олигонуклеотиды можно получить, используя, например, диэтилфосфоамидитный способ, известный специалистам. См. патент США 4415732 (1983). Лигирование можно осуществить, используя Т4 ДНК лигазу в стандартных условиях и температурах, и правильность лигирования подтвердить трансформируя E. coli или COS клетки лигирующей смесью. Удачные трансформанты отбирают по устойчивости к ампициллину, тетрациклину или другим антибиотикам, или используя другие известные специалистам маркеры. Такие рекомбинантные ДНК методики полностью раскрыты в соответствующей литературе. См. : Sambrook, MOLECULAR CLONING: A LABORATORY MANUAL, 2D ED, (1989); DNA CLONING, Vol 1 and 11 (DN Glover ed 1985); OLIGONUCLEOTIDE SYNTHESIS (MG Gait ed 1984); NUCLEIC ACID HYBRIDIZATION (BD Hames ed 1984); TRANSCRIPTION AND TRANSLATION (BD Hames 1984); ANIMAL CELL CULTURE (RI Freshney ed 1986); B. Perbal, A PRACTICAL GUIDE TO MOLECULAR CLONING (1984); GENE TRANSFER VECTORS FOR MAMMALIAN CELLS (JH Miller ed 1987 Cold Spring Harbor Laboratory); Scopes PROTEIN PURIFICATION: PRINCIPLES AND PRACTICE, 2nd ed, (1987 Springer-Verlag NY) and HANDBOOK OF EXPERIMENTAL IMMUNOLOGY Vols 1-1V (DM Weired 1986). Все указанные публикации включены сюда со ссылками. Соответственно, в следующем аспекте изобретение включает векторы, содержащие нон-сплайсинговые варианты gp350/220 ДНК последовательностей и клетки-хозяев, и далее включает способ получения нон-сплайсингового варианта gр350/220 протеина за счет культивирования клеток указанного хозяина, содержащих вектор, который несет нон-сплайсинговый вариант gp350/220 ДНК последовательности, оперативно связанный с последовательностью, контролирующей экспрессию в условиях культивирования, которые обеспечивают экспрессию гомогенного gp350 протеина. Экспрессированный гомогенный gp350 выделяют из клеток и составляющих культуральной среды, используя такие обычные методики очистки гликопротеинов, как ультрафильтрацию, электрофорез в свободном потоке, гель-фильтрационную хроматографию, афинную хроматографию, SDS-PAGE, дифференциальное NH4SO4 осаждение, лектиновые колонки, ионообменные колонки и гидрофобные колонки (но не ограничиваясь ими! ), хорошо известные специалистам. Небольшие количества препаратов gp350 наиболее легко выделять, используя SDS-PAGE или лектиновые афинные колонки и такие небольшие количества препаратов для использования в экспериментах по вакцинации, или экспериментах по иммунной реакции наиболее легко очищать, используя жидкостную хроматографию. Для крупномасштабного производства коммерчески значимых количеств gp350 для использования в вакцинных композициях предпочтительны сочетания ультрафильтрации, гель-фильтрации, ионного обмена и хроматографии гидрофобных взаимодействий. Очищенные гомогенные gp350 протеины настоящего изобретения можно использовать в терапевтических и/или иммуногенных композициях для предотвращения и лечения состояний, связанных с EBV, и таких заболеваний, как инфекционный мононуклеоз, лимфома Burkett и карцинома носоглотки. Такие фармацевтические композиции включают иммуногенно-индуцирующее количество одного или более из гомогенных gp350 протеинов настоящего изобретения в смеси с фармацевтически приемлемым носителем, например, такой системой, представляющей адьювант/антиген, как квасцы. Можно использовать и такие другие системы, представляющие адьювант/антиген, как MF59 (Chiron Corp), QS-21 (Cambridge Biotech Corp), 3-DMPL (3-Деацил-монофосфорил липид A 3-Deacyl-Monophosphoryl Lipid A) (Ribi-Immunо-Chem Research, Inc. ), клинической степени чистоты адьювант Фреунда (IFA), фузогенные липосомы, водорастворимые полимеры или Iscoms (иммуностимулирующие комплексы). Другие примеры фармацевтически приемлемых носителей или растворов включают гидроксид алюминия, физиологический раствор или фосфатный буферированный физиологический раствор. Эти композиции можно вводить системно, предпочтительно, подкожно или внутримышечно в форме приемлемых растворов для подкожного или внутримышечного введения. Инокуляцию можно также осуществить за счет нанесения царапин на поверхность или за счет инокуляции в полости тела. Приготовление таких растворов обладающих за счет подбора рН изотоничностью, стабильностью и т. д. , известно специалистам. Дозовый режим определяют лечащие врачи с учетом таких факторов, как физическое состояние, вес, пол, питание, серьезность состояния, время введения и других клинических факторов, которые могут повлиять на эффект лекарства. Примеры доз составляют интервал от около 1 мкг до около 1000 мкг протеина. В практике способа лечения настоящего изобретения иммунологически-индуцирующее эффективное количество гомогенного gp350 протеина вводят пациенту, нуждающемуся в терапевтическом или профилактическом лечении. Иммуногенно-индуцирующее эффективное количество композиции настоящего изобретения составляет величину в интервале от около 1 мкг до около 1 мг на вводимую дозу. Количество вводимых доз может варьироваться в зависимости от вышеуказанных факторов. Далее изобретение описывается в следующих примерах без ограничения его объема. Пример 1 Делеция gp350/220 трансмембранного участка и трансмембранного участка до С-конца для создания pDTM и pSTOP Ген gp350/220 из EBV В95-8штамма (Miller et. al, 1972) доступен в BamHI библиотеке, как открытая считывающая рамка под названием BLLF1 (Baer, Nature, 310: 207, 1984). Для создания нужной конструкции (см. представленную на фиг. 2В диаграмму) gp350/220 ген клонируют в две части: 1) BLSH1, 2.3kb HindIII/BfaI 3′ фрагмент и 2) BLSH2, 337bp BanI/ HindIII 5′ фрагмент (фиг. 2А). Эти фрагменты клонируют в Staging векторы с тем, чтобы можно было осуществить делеции С-терминальных цитоплазмических и/или трансмембрано-кодирующих доменов. Так как BfaI сайт находится у 5′ конца участка, кодирующего gp350 трансмембранный (ТМ) домен, его используют для конструирования делеций ТМ домена и делеции ТМ домена совместно с делециями прилегающего С-конца. Используя BfaI, оказывается возможным осуществлять делеции, оставляя только две аминокислоты ТМ участка (таблица 2). 1. Конструирование pDTM из pSTGl и pSTG3. Плазмида pDTM состоит из последовательности gp350/220 нуклеиновых кислот, в которой отсутствует весь ТМ кодирующий участок. Эту конструкцию создают, используя два Staging вектора pSTGl и pSTG3. PCR продукт из 450 bp, SYCT, который вводит BfaI сайт в 3′ конец ТМ участка, получают, используя BLLF1 клона мишеневую последовательность (фиг. 2). В качестве PCR праймеров используют следующее (см. праймер 1 и праймер 2 в конце описания). BfaI сайт праймера 1 используют для клонирования BfaI/ XmaI фрагмента SCYT в pSTGl. Праймер 2 соответствует участку вне gр350/220 открытой считывающей рамки с 3′ стороны гена. SCYT PCR фрагмент вырезают за счет BfaI и XmaI для получения фрагмента в 136 пар оснований, который клонируют в pMT11 вектор (Spaete and Mocarski, 1985) наряду со вторым фрагментом, BLSH1 HindIII/BfaI фрагментом, для создания pSTGl. Секвенирование по BfaI сайту показывает, что был делетирован весь ТМ аминокислотный кодирующий участок за исключением аминов кислот Met и Leu (см. табл. 2). Третий BLLF1 фрагмент, BLSH2, клонируют в pMT11 для создания pSTG3. BanI/XbaI олигонуклеотидный линкер из 16 пар оснований вне gр350/220 гена, кодирующей последовательности, используют для клонирования BLSH2 BanI/HindIII фрагмента в pSTG3. 2,4 HindIII/XmaI pSTGl фрагмент клонируют в рЕЕ14 вектор (Celltech, England) вместе с 0,3 XbaI/HindIII pSTG3 фрагментом для завершения pDTM конструкции. 2. Конструирование pSTOP, используя векторы pSTG2 и pSTG3. Плазмида pSTOP содержит gp350/220 ген, в котором отсутствует ТМ участок и С-терминальный цитоплазмический участок, соседствующий с ТМ участком. Для создания этой конструкции создают BfaI/EcoRI олигонуклеотидный линкер из 16 пар оснований со стоп кодонами (подчеркнуты) в трех рамках, следующих за BfaI липким концом, как показано далее: 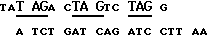 5′ свисающий конец (ТА) верхней последовательности является липким концом для BfaI рестрикционного сайта, а 5′ свисающий конец (ТТАА) нижней последовательности является EcoRI липким концом. Этот 16bр линкер используют для клонирования фрагмента BLSH1 HindIII/BfaI в рМТ11, для создания pSTG2. 2,3 kb pSTG2 HindIII/EcoRI фрагмент и pSTG3 0,3 kb XbaI/HindIII фрагмент клонируют в рЕЕ14 для создания pSTOP. 3. Сравнение дикого типа, pDTM и pSTOP последовательностей на ТМ участке. Олигонуклеотидная последовательность и транслированная аминокислотная последовательность дикого типа, pSTOP и pDTM 3′ концы gp350 ДНК и аминокислотные последовательности представлены далее в таблице 2. Стрелками указаны начало и конец дикого типа трансмембранного домена (ТМ). Только две аминокислоты из трансмембранного домена сохраняются в pDTM и pSTOP Mets861 и Leu862 (см. также фиг. 1). Следует отметить, что стоп кодон следует непосредственно за Leu862 в pSTOP. В pDTM прежнее положение делетированного мембранного участка отмечено как “ТM”. (В таблице 2 указаны нативные аминокислоты). Пример 2 Удаление gp350/220 гена донорного и акцепторного сплайсинговых сайтов для создания pMDTM и pMSTOP. Для получения гомогенного продуцирования gр350 протеина заменяют высоко консервативные и консервативные основания сплайсингового сайта gр350/220 гена. Четыре основания заменяют в донорном сплайсинговом сайте, включая высоко консервативную GT пару, которая находится в 100% всех сплайсинговых сайтов. Два консервативных основания донорного сайта, AА, заменяют на GT. Два высоко консервативных (инвариантных) основания донорного сплайсингового сайта заменяют с GT на СА. У акцепторного сплайсингового сайта, только высоко консервативные основания сплайсингового сайта заменяют для сохранения аминокислотной последовательности. Вторые консервативные основания акцепторного сплайсингового сайта заменяют, как указано в таблице 3. В таблице 3 суммированы изменения оснований в донорном и акцепторном сплайсинговых сайтах gp350/220 гена. Изменения оснований за счет мутагенеза на основе олигонуклеотидов отмечены в мутантных последовательностях звездочками. Реальные сайты сплайсинга указаны стрелками, и представлены кодируемые аминокислоты. Ни одна из этих аминокислотных последовательностей не изменяется в результате нуклеотидных замещений. Нуклеотидные замещения в дикого типа gp350/220 ДНК последовательностях донорного сплайсингового сайта и акцепторного сплайсингового сайта осуществляют, используя мутагенез, опосредствованный олигонуклеотидами. Для осуществления мутаций используют модифицированный фаговый вектор М13ТАС по способу Zoller, M. E. and Smith, M. (1983) Methods of Enzymol. 100: 468. BamHI/XhoI фрагменты gр350/220 нуклеотидной последовательности клонируют в полилинкер плазмиды М13ТАС, используя Аsр718 и BamHI рестрикционные сайты на полилинкере, объединенном с 19 bp олигонуклеотидным линкером, содержащим Asp718 и XhoI липкие концы. Для мутагенеза используют M13DTM и M13STOP примера 1 (фиг. 2В). Для использования в мутагенезе создают два 42-мерных олигонуклеотида, РrДонор1 и РrАкцептор1. Каждый из них конструируют таким образом, чтобы он был комплементарен gp350/220 генным последовательностям центрированно либо по донорному, либо по акцепторному сайтам. Единственным участком олигонуклеотидов, которые не были комплементарны gр350/220 гену, были основания, представляющие целевые мутации. Олигонуклеотиды после мутагенеза имеют следующий вид (см. в конце описания олигонуклеотиды после мутагенеза). Последовательность олигонуклеотидов после мутагенеза помечена как “праймер”, тогда как ДНК последовательность, связывающая сплайсинговые сайты gр350/220 гена, помечена как “EBV”. Основания, которые изменены в результате мутагенеза, отмечены звездочками. Штриховая линия указывает положение сплайсинга. Олигонуклеотидные РrДонор1 и РrАкцептор1 гидролизуют до получения одноцепочечных клонов M13-DTM и M13-STOP. Голоэнзим Т4ДНК полимеразы используют для получения двухцепочечной ДНК и этой двухцепочечной ДНК трансформируют E. coli. Используя вектор М13ТАС, любой из клонов, который содержит целевую мутацию, можно идентифицировать по изменению цвета с белого на синий в присутствии Х-gal и изотиопропилгалактата. Синие бляшки отбирают и выращивают, и ДНК последовательности за соединениями сплайсинга используют для окончательной идентификации мутантных клонов, помеченных как M13-MDTM и M13-MSTOP. После идентификации клонов, содержащих целевые мутации, фрагменты BamHI/XhoI вырезают из M13-MDTM и M13-MSTOP и лигируют обратно в pDTM и pSTOP основные цепи для создания конструкций pMDTM и pMSTOP, соответственно. Эти конструкции переносят в СНО клетки для экспрессии нон-сплайсинговых вариантов gp350/220 ДНК последовательностей, как указано в примере 3. Пример 3 Экспрессия gp350 в СНО клетки. 1. Трансфекция gp350/220 генной конструкции. Один из способов получения с высокими выходами гомогенного gp350 протеина настоящего изобретения из клеток млекопитающих включает конструирование клеток, содержащих множественные копии гетерологичной gp350 последовательности. Гетерологичная ДНК последовательность оперативно связана с амплифицируемым маркером, в этом примере геном глутаминсинтетазы, для которого клетки можно амплифицировать, используя метионинсульфоксимин. Векторы pMDTM и pMSTOP, полученные в примере 2, трансфектируют в СНО клетки, как будет указано далее по способу Crockett, Bio/Technology 8: 662 (1990) и как указано в Celltech Instruction Manual для системы амплификации гена глутаминсинтетазы (1992). СНО-К1 клетки (АТСС CCR61) поддерживают в не содержащей глутамина ЕМЕМ (Eagles минимальная поддерживающая среда), дополненной 10% сывороткой плода теленка, 100 ед/мл пенициллина, 100 мг/мл стрептомицина, MEM (модифицированная среда Eaglets) несущественными аминокислотами, и 1 мМ пируватом натрия (все получены от JRH Biosciences). Среду дополняют также 60 мг/мл глутаминовой кислоты, 60 мг/мл аспарагина, 7 мг/мл аденозина, 7 мг/мл гуанозина, 7 мг/мл цитидина, 7 мг/мл уридина и 2,4 мг/мл тимидина (все от Сигмы). Этот препарат среды используют для трансфекции (причем, в случае отклонений от этого рецепта имеют место указания). За день до трансфекции 10-см чашки засевают 3х106 СНО-К1 клетками. В день трансфекции клетки промывают 10 мл среды, не содержащей сыворотки (для каждой чашки). Плазмидную ДНК (из pMDTM и pMSTOP плазмид) вносят за счет СаРО4 осаждения, используя обычные методики. 10 мкг осадка каждой плазмидной ДНК инкубируют с СНО-К1 клетками плюс 2 мл не содержащей сыворотки среды при 37oС в течение 4,5 часа. Осуществляют тройной эксперимент для каждой из четырех плазмидных трансфекций. Затем клетки встряхивают в течение 1,5 минут с 15% глицерином в физиологическом растворе, буферированном HEPES. После промывания не содержащей сыворотки средой, ее заменяют на содержащую сыворотку среду, и клетки инкубируют в течение 24 часов. На следующий день эту среду заменяют на среду, содержащую 10% диализованную бычью сыворотку (JRH Biosciences) и амплифицируют, добавляя 25 мкМ метионинсульфоксимина (Сигма). Среду, содержащую метионинсульфоксимин, обновляют каждые 3-5 дней до тех пор, пока амплифицированные клоны не оказываются достаточно большими для того, чтобы их можно было собрать, то есть примерно спустя 13-14 дней. Клоны собирают, соскребая колонии с чашек стерильным устройством для пипеттирования на 200 мкл, и переносят в одну из ячеек пластины с 96 ячейками в среду без метионинсульфоксимина. Через 1-2 дня эту среду заменяют на среду с добавлением 25 мкМ метионинсульфоксимина. Спустя 4 дня собирают надосадочные жидкости и анализируют на содержание целевых протеинов в ELISA анализе. СНО клетки также трансфектируют рЕЕ14 контрольным вектором отдельно (который не содержит EBV последовательностей) и 24 клона СНО-рЕЕ14 также собирают и переносят на пластины для контролей. (Контрольные клоны идентифицируют на основании выживания в метионинсульфоксимине). 2. ELISA анализ. После трансфекции 241 клон CHO-pMDTM и 158 клонов СНО-pMSTOP собирают и выращивают. Надосадочные жидкости этих клонов тестируют на предмет получения gp350 протеина. 96-ячеичные пластины покрывают афинно-очищенными кроличьими анти-gp350/220 антителами (антитела MDP1, подарок от Andrew-Morgan), разбавленными 1: 2000 в 50 мМ натрийборатном буфере, рН 9. Пластины инкубируют в течение 3-4 часов и трижды промывают PBS + 0,05% Твин 20, используя Nunc Immune Washer. После того, как блоты высушивают, пластины блокируют, инкубируя с 2% BSA в PBS + 0,01% Thimerosal при 37oС в течение получаса, и снова промывают. Надосадочные жидкости с трансфектированных клеток и контрольных клеток помещают в ячейки и инкубируют в течение 2 часов при 37oС. Затем пластины инкубируют с определенным ранее антителом, мышиным моноклональным антителом против gp350/220 (антитело С65221М; Biodesign International) при 1 мг/мл разбавлении в PBS промывочном буфере при 37oС в течение 1 часа. После промывки пластины инкубируют с вторым антителом, фрагментами козьего F(ab)2, коньюгированными с пероксидазой хрена, направленными против мышиных иммуноглобулинов (адсорбированный Ig человека; Biosource International), 0,7 мкг/мл в PBS + 0,05% BSA и 0,01% Thimerosal при 37oС в течение 1 часа. Пластины промывают и проявляют, используя ABTS (Pierce Chemicals), растворенный в Stable Peroxide Substrate Buffer (Pierce Chemicals) в течение 0,5 часа при комнатной температуре. Реакцию останавливают 1% SDS и пластины считывают на 405 и 650 нм, используя считывающее устройство Molecular Devices Vmax ELISA. 24 pMDTM и 18 pMSTOP колоний были тестированы как положительные в отношении секретиро-вания gp350. Колонии, которые давали наиболее интенсивные ELISA сигналы, перенесли на пластины с 24 ячейками для размножения и дополнительного анализа за счет Вестернблоттинга и анализа радиоиммуноосаждения. 3. Вестернблоттинг и анализ радиоиммуноосаждения. В начальном скринировании надосадочные жидкости тканевых культур из pMDTM трансфекций анализируют на активность в Вестернблоттинге. Надосадочные жидкости СНО клеток очищают на 5% SDS-PAGE гелях, переносят на нитроцеллюлозу после ночи и зондируют анти-gp350 антителами. Семь pMDTM клонов оказываются позитивными для gp350 в Вестернблоттинг-анализе. pMDTM клоны, которые оказываются положительными в Вестернблоттинге, далее тестируют с помощью радиоиммуноосаждения на предмет присутствия gp220. Выбранные трансформированные pMDTM клетки, рЕЕ14 контрольные и GH3  19 контрольные клетки (описанные далее) выращивают в течение ночи в пластинах с 6 ячейками так, чтобы они были примерно на три четверти конфлюэнтны на день эксперимента. Каждая ячейка содержит приблизительно 5 19 контрольные клетки (описанные далее) выращивают в течение ночи в пластинах с 6 ячейками так, чтобы они были примерно на три четверти конфлюэнтны на день эксперимента. Каждая ячейка содержит приблизительно 5 106 клеток. Для введения метки среду из каждой ячейки удаляют и заменяют 0,7 мл MEM, не содержащей метионина (10% сыворотки плода теленка) + 100 мкКюри 35S-метиони-на. Клетки инкубируют в течение 5,5 часа при 37oС, а затем обрабатывают в микроцентрифуге при скорости 4000 об/мин в течение 5 минут. Гомогенный gp350 протеин в надосадочной жидкости иммуноосаждают, добавляя 10 мкл Sepharose-Protein A (Сигма) в 50% суспензии и 20 мкл моноклональных анти-gp350/220 (антитела С65221М, 100 мкг/мл, Biodesign International) в течение ночи при встряхивании при 4oС. Затем смесь осаждают при 2000 об/мин 2 минуты при комнатной температуре в микроцентрифуге, промывают четыре раза небольшими объемами буферированного фосфатом физиологического раствора. После последней промывки всю жидкость удаляют из осадка и заменяют 50 мкл протеинового гель-образцового буфера. Образцы, содержащие осажденный иммунокомплекс, кипятят в течение 5 минут и обрабатывают на 5% SDS-PAGE. Иммуноосадки сравнивают с образцами геля надосадочных жидкостей тканевых культур, смешанных 1: 1 с протеиновым образцовым буфером. Гель высушивают и авторадиографируют на Hyperfilm 106 клеток. Для введения метки среду из каждой ячейки удаляют и заменяют 0,7 мл MEM, не содержащей метионина (10% сыворотки плода теленка) + 100 мкКюри 35S-метиони-на. Клетки инкубируют в течение 5,5 часа при 37oС, а затем обрабатывают в микроцентрифуге при скорости 4000 об/мин в течение 5 минут. Гомогенный gp350 протеин в надосадочной жидкости иммуноосаждают, добавляя 10 мкл Sepharose-Protein A (Сигма) в 50% суспензии и 20 мкл моноклональных анти-gp350/220 (антитела С65221М, 100 мкг/мл, Biodesign International) в течение ночи при встряхивании при 4oС. Затем смесь осаждают при 2000 об/мин 2 минуты при комнатной температуре в микроцентрифуге, промывают четыре раза небольшими объемами буферированного фосфатом физиологического раствора. После последней промывки всю жидкость удаляют из осадка и заменяют 50 мкл протеинового гель-образцового буфера. Образцы, содержащие осажденный иммунокомплекс, кипятят в течение 5 минут и обрабатывают на 5% SDS-PAGE. Иммуноосадки сравнивают с образцами геля надосадочных жидкостей тканевых культур, смешанных 1: 1 с протеиновым образцовым буфером. Гель высушивают и авторадиографируют на Hyperfilm  -Max (Amersham).
На фиг. 3 представлены результаты авторадиографического исследования результатов SDS-PAGE анализа радиоиммуноосажден-ных образцов. В качестве контроля используют клеточную линию GH3 -Max (Amersham).
На фиг. 3 представлены результаты авторадиографического исследования результатов SDS-PAGE анализа радиоиммуноосажден-ных образцов. В качестве контроля используют клеточную линию GH3 19 (подарок Elliot Keiff; Whang et al. , 1987).
Клетки GH3 19 (подарок Elliot Keiff; Whang et al. , 1987).
Клетки GH3 19 секретируют усеченную форму протеина gp350/220, не содержащую трансмембранного и С-терминального цитоплазмического домена. Для негативного контроля клетки СНО трансфектируют только одним вектором рЕЕ14 и селектируют с помощью метионинсульфоксимина параллельно с pMDTM трансфекцией. На фиг. 3 надосадочные жидкости (“S”) представлены в нечетных полосах, чередующихся с иммуноосажденными (“Iр”), представленными в четных полосах. В контрольной полосе 2, осаждение из GH3 19 секретируют усеченную форму протеина gp350/220, не содержащую трансмембранного и С-терминального цитоплазмического домена. Для негативного контроля клетки СНО трансфектируют только одним вектором рЕЕ14 и селектируют с помощью метионинсульфоксимина параллельно с pMDTM трансфекцией. На фиг. 3 надосадочные жидкости (“S”) представлены в нечетных полосах, чередующихся с иммуноосажденными (“Iр”), представленными в четных полосах. В контрольной полосе 2, осаждение из GH3 19 контрольных клеток приводит к получению двух интенсивных протеиновых полос на примерно 220 и 350 кД, что демонстрирует продуцирование усеченных сплайсинговых вариантов gp350 и gp220 протеинов в соотношении около 1: 1. Как и ожидалось, эти иммуноосажденные полосы концентрированы по сравнению с надосадочными жидкостями радиомеченых тканевых культур (не подвергавшиеся иммуноосаждению образцы) в полосе 1. Кроме того, как и ожидалось, не наблюдается полос в негативном контроле (полоса 4), так как вектор рЕЕ14 не содержит ни одной из gp350/220 конструкций.
SDS-PAGE анализ иммуноосаждений из надосадочных жидкостей pMDTM клонов в полосах 6, 8 и 10 приводит к появлению отдельной интенсивной полосы примерно на 350 кД, аналогичной более высокомолекулярным образцам в GH3 19 контрольных клеток приводит к получению двух интенсивных протеиновых полос на примерно 220 и 350 кД, что демонстрирует продуцирование усеченных сплайсинговых вариантов gp350 и gp220 протеинов в соотношении около 1: 1. Как и ожидалось, эти иммуноосажденные полосы концентрированы по сравнению с надосадочными жидкостями радиомеченых тканевых культур (не подвергавшиеся иммуноосаждению образцы) в полосе 1. Кроме того, как и ожидалось, не наблюдается полос в негативном контроле (полоса 4), так как вектор рЕЕ14 не содержит ни одной из gp350/220 конструкций.
SDS-PAGE анализ иммуноосаждений из надосадочных жидкостей pMDTM клонов в полосах 6, 8 и 10 приводит к появлению отдельной интенсивной полосы примерно на 350 кД, аналогичной более высокомолекулярным образцам в GH3 19 контрольной полосе 2.
Однако, в противоположность GH3 19 контрольной полосе 2.
Однако, в противоположность GH3 19 контрольной полосе дополнительная интенсивная полоса примерно на 220 кД отсутствует в полосах 6, 8 и 10, хотя в полосе 8 наблюдается очень слабая полоска, смещенная в область несколько более низких молекулярных весов. Это может представлять продукт разложения, совместно осажденный клеточный продукт или незначительное количество gp220 протеина, образующегося из-за неправильной трансляции или актов мутаций, которые возвращают исключенные донорный и акцепторный сплайсинговые сайты в нативный нуклеотид или аминокислотные последовательности. Интенсивные отдельные полосы на примерно 350 кД были обнаружены в пяти других тестированных MDTM репликатах (данные не представлены).
Непохоже, что полное отсутствие полосы на 220 кД в полосах 6 и 10 связано с неэффективным осаждением из MDTM надосадочных жидкостей, так как в 35S-меченой GH3 19 контрольной полосе дополнительная интенсивная полоса примерно на 220 кД отсутствует в полосах 6, 8 и 10, хотя в полосе 8 наблюдается очень слабая полоска, смещенная в область несколько более низких молекулярных весов. Это может представлять продукт разложения, совместно осажденный клеточный продукт или незначительное количество gp220 протеина, образующегося из-за неправильной трансляции или актов мутаций, которые возвращают исключенные донорный и акцепторный сплайсинговые сайты в нативный нуклеотид или аминокислотные последовательности. Интенсивные отдельные полосы на примерно 350 кД были обнаружены в пяти других тестированных MDTM репликатах (данные не представлены).
Непохоже, что полное отсутствие полосы на 220 кД в полосах 6 и 10 связано с неэффективным осаждением из MDTM надосадочных жидкостей, так как в 35S-меченой GH3 19 контрольной полосе (2) полоса на 220 кД отчетливо визуализируется. Кроме того, дополнительный анализ с использованием pDTM конструкций примера 1, которые содержат дикого типа сайты сплайсинга, приводит к получению двух интенсивных полос на 350 и 220 кД. Поэтому, эти результаты демонстрируют тот факт, что делеция сайтов сплайсинга приводит к продуцированию gp350 протеина без одновременного продуцирования gp220 протеина.
Этот гомогенный gp350 протеин, экспрессированный в СНО клеточные линии, или в другие клеточные линии млекопитающих, можно получить в еще более крупных масштабах, и гомогенный gp350 протеин можно выделить и очистить от кондиционной среды из клеточной линии, используя способы, известные специалистам, включая такие методики, как лектин-афинная хроматография, ВЭЖХ с обращенной фазой, скоростная ВЭЖХ, гель-фильтрация и т. д. . См. David, J. Immunо Methods 108: 231 (1988) и Madej, Vaccine 10: 777 (1992).
4. Нозернблоттинг pMDTM протеина.
В этом эксперименте с помощью Нозернблоттинга показано, что клетки MDTM-1 продуцируют gp350 РНК, но не gp220 РНК, подтверждая, тем самым, на другом уровне, что мутации сплайсингового сайта предотвращают продуцирование gp220.
ДНК зонды, комплементарные gp350, были получены из pDTM, см. пример 1. Матрицу зонда gp350/220, ХР464, выделяют в виде 464 bp XhoI/PstI pDTM фрагмента. ХР464 распознает как gp350, так и gp220. Для получения gp350-специфического зонда AN537, pDTM разрезают за счет NcoI и NdeI, выделяют два перекрывающихся фрагмента 580 bp, и полученную смесь разрезают XmnI для исключения одного примесного фрагмента, и за счет AluI до получения 537 bp AluI/NdeI фрагмента внутри gp350/220 сплайсингового сайта. AN537 специфичен для участка, сплайсированного из gp220 и, таким образом, специфичного для gp350 месседжа. ДНК зонды метят 32P-dCTP ник-трансляцией (Amersham), используя ДНК фрагменты ХР464 и AN537.
Целую клеточную РНК получают практически в соответствии со способом Chomczyunski and Sacchi, Anal. Biochem. , 162: 156-59 (1987). Среду из двух Т-250 склянок каждой СНО-рЕЕ14 (в качестве негативной контрольной линии, см. пример 1), СНО-MDTM и CHO-DTM-7 клеток, 90% конфлюэнтных, отсасывают и клетки подвергают лизису и соскабливают в денатурирующий буфер (10 мл гуанидинтиоцианата, 25 мМ цитрата натрия, рН 7,05 саркозила, 100 мМ 2-меркаптоэтанола). Каждые 10 мл лизата дополняют 1 мл 2М ацетата натрия, рН 4, 10 мл насыщенного фенола, рН 4,5 и 2 мл смеси хлороформ/изоаминоловый спирт; полученный лизат инкубируют на льду 15 минут, вращают при 10000 g в течение 20 минут при 4oС и верхнюю водную фазу удаляют. РНК осаждают из водной фазы, добавляя один объем изопропанола при 20oС в течение 1 часа; осаждают при 4oС, снова суспендируют в денатурирующем буфере и снова осаждают. РНК осадок промывают 1X в 70% этаноле, сушат в Speed-Vac и снова суспендируют в DEPC-обработанной воде.
DTM-7 и MDTM-1 полные клеточные РНК денатурируют при 65oС в течение 15 минут в 15% формамиде и 6% формальдегиде, обрабатывают на 1% агароза/6,6% формальдегидных гелях и переносят на нитроцеллюлозу за счет капиллярных взаимодействий, затем зондируют мечеными ХР464 и AN537. ДНК зоны денатурируют за счет кипячения в течение 5 минут, гибридизуют в 5Х SSPE при 65%С в течение ночи и нитроцеллюлозу промывают в условиях высокой жесткости. Авторадиографию осуществляют, используя Bio-Rad фосфоимеджер.
Нозернблоттинг полных клеточных РНК из CHO-MDTM клеток демонстрирует эффективность сплайсинговых мутаций по предотвращению продуцирования gp220-специфических РНК. gp350-специфический зонд, AN537, связан только с одним из видов РНК в MDTM-1 и DTM-7 клетках (фиг. 4, полосы 1 и 2), как и ожидалось для gр-350-специфического зонда. Зонд ХР464, который специфичен как для gp350, так и для gp220 РНК, распознает два вида в DTM-7 и отдельную более высокомолекулярную полосу в MDTM-1 (фиг. 4, полосы 4 и 3), как и ожидалось, если сплайсинговые мутации предотвращают продуцирование gp220 месседжа в MDTM-1. Даже если MDTM-1 полосы перегружены для gp350-специфической РНК, не наблюдается видимой gp220 РНК. Причина для различий в кажущейся подвижности gp350 месседжа в MDTM-1 по сравнению с DTM-7 полосой неизвестна. Виды MDTM-1 перегружены по сравнению с DTM-7, что может повлиять на миграцию в геле. Кроме того, gp350 месседж выходит вблизи к интенсивной рибосомной РНК полосе на геле, что может нарушить кажущийся молекулярный вес. В любом случае наличие отдельных видов, комплементарных gp350 ДНК последовательностям, дает возможность предположить, что этот сигнал представляет gp350 мРНК. Таким образом, мутации в донорном и акцепторном сайтах сплайсинга эффективны для предотвращения продуцирования gp220 мРНК по данным Нозернблоттинга. Этот результат в дальнейшем подтвержден за счет радиоиммуноосаждения, используя моноклональные антитела, специфичные для gp350/220, а также за счет Вестернблоттинга MDTM-1 и DTM-7 надосадочных жидкостей.
Пример 4 19 контрольной полосе (2) полоса на 220 кД отчетливо визуализируется. Кроме того, дополнительный анализ с использованием pDTM конструкций примера 1, которые содержат дикого типа сайты сплайсинга, приводит к получению двух интенсивных полос на 350 и 220 кД. Поэтому, эти результаты демонстрируют тот факт, что делеция сайтов сплайсинга приводит к продуцированию gp350 протеина без одновременного продуцирования gp220 протеина.
Этот гомогенный gp350 протеин, экспрессированный в СНО клеточные линии, или в другие клеточные линии млекопитающих, можно получить в еще более крупных масштабах, и гомогенный gp350 протеин можно выделить и очистить от кондиционной среды из клеточной линии, используя способы, известные специалистам, включая такие методики, как лектин-афинная хроматография, ВЭЖХ с обращенной фазой, скоростная ВЭЖХ, гель-фильтрация и т. д. . См. David, J. Immunо Methods 108: 231 (1988) и Madej, Vaccine 10: 777 (1992).
4. Нозернблоттинг pMDTM протеина.
В этом эксперименте с помощью Нозернблоттинга показано, что клетки MDTM-1 продуцируют gp350 РНК, но не gp220 РНК, подтверждая, тем самым, на другом уровне, что мутации сплайсингового сайта предотвращают продуцирование gp220.
ДНК зонды, комплементарные gp350, были получены из pDTM, см. пример 1. Матрицу зонда gp350/220, ХР464, выделяют в виде 464 bp XhoI/PstI pDTM фрагмента. ХР464 распознает как gp350, так и gp220. Для получения gp350-специфического зонда AN537, pDTM разрезают за счет NcoI и NdeI, выделяют два перекрывающихся фрагмента 580 bp, и полученную смесь разрезают XmnI для исключения одного примесного фрагмента, и за счет AluI до получения 537 bp AluI/NdeI фрагмента внутри gp350/220 сплайсингового сайта. AN537 специфичен для участка, сплайсированного из gp220 и, таким образом, специфичного для gp350 месседжа. ДНК зонды метят 32P-dCTP ник-трансляцией (Amersham), используя ДНК фрагменты ХР464 и AN537.
Целую клеточную РНК получают практически в соответствии со способом Chomczyunski and Sacchi, Anal. Biochem. , 162: 156-59 (1987). Среду из двух Т-250 склянок каждой СНО-рЕЕ14 (в качестве негативной контрольной линии, см. пример 1), СНО-MDTM и CHO-DTM-7 клеток, 90% конфлюэнтных, отсасывают и клетки подвергают лизису и соскабливают в денатурирующий буфер (10 мл гуанидинтиоцианата, 25 мМ цитрата натрия, рН 7,05 саркозила, 100 мМ 2-меркаптоэтанола). Каждые 10 мл лизата дополняют 1 мл 2М ацетата натрия, рН 4, 10 мл насыщенного фенола, рН 4,5 и 2 мл смеси хлороформ/изоаминоловый спирт; полученный лизат инкубируют на льду 15 минут, вращают при 10000 g в течение 20 минут при 4oС и верхнюю водную фазу удаляют. РНК осаждают из водной фазы, добавляя один объем изопропанола при 20oС в течение 1 часа; осаждают при 4oС, снова суспендируют в денатурирующем буфере и снова осаждают. РНК осадок промывают 1X в 70% этаноле, сушат в Speed-Vac и снова суспендируют в DEPC-обработанной воде.
DTM-7 и MDTM-1 полные клеточные РНК денатурируют при 65oС в течение 15 минут в 15% формамиде и 6% формальдегиде, обрабатывают на 1% агароза/6,6% формальдегидных гелях и переносят на нитроцеллюлозу за счет капиллярных взаимодействий, затем зондируют мечеными ХР464 и AN537. ДНК зоны денатурируют за счет кипячения в течение 5 минут, гибридизуют в 5Х SSPE при 65%С в течение ночи и нитроцеллюлозу промывают в условиях высокой жесткости. Авторадиографию осуществляют, используя Bio-Rad фосфоимеджер.
Нозернблоттинг полных клеточных РНК из CHO-MDTM клеток демонстрирует эффективность сплайсинговых мутаций по предотвращению продуцирования gp220-специфических РНК. gp350-специфический зонд, AN537, связан только с одним из видов РНК в MDTM-1 и DTM-7 клетках (фиг. 4, полосы 1 и 2), как и ожидалось для gр-350-специфического зонда. Зонд ХР464, который специфичен как для gp350, так и для gp220 РНК, распознает два вида в DTM-7 и отдельную более высокомолекулярную полосу в MDTM-1 (фиг. 4, полосы 4 и 3), как и ожидалось, если сплайсинговые мутации предотвращают продуцирование gp220 месседжа в MDTM-1. Даже если MDTM-1 полосы перегружены для gp350-специфической РНК, не наблюдается видимой gp220 РНК. Причина для различий в кажущейся подвижности gp350 месседжа в MDTM-1 по сравнению с DTM-7 полосой неизвестна. Виды MDTM-1 перегружены по сравнению с DTM-7, что может повлиять на миграцию в геле. Кроме того, gp350 месседж выходит вблизи к интенсивной рибосомной РНК полосе на геле, что может нарушить кажущийся молекулярный вес. В любом случае наличие отдельных видов, комплементарных gp350 ДНК последовательностям, дает возможность предположить, что этот сигнал представляет gp350 мРНК. Таким образом, мутации в донорном и акцепторном сайтах сплайсинга эффективны для предотвращения продуцирования gp220 мРНК по данным Нозернблоттинга. Этот результат в дальнейшем подтвержден за счет радиоиммуноосаждения, используя моноклональные антитела, специфичные для gp350/220, а также за счет Вестернблоттинга MDTM-1 и DTM-7 надосадочных жидкостей.
Пример 4Тестирование гомогенных gp350 протеинов на иммуногенную активность. Очищенные гомогенные gp350 протеины вводят в соответствующие носители для введения и вводят мышам следующим образом. 2х адьювант-носитель концентрат приготавливают, смешивая Pluronic L121 и сквалан в 0,4% (объем/объем) Твин 80 в буферированном фосфатом физиологическом растворе с (Thr1) MDP в соответствии со способом David, J. Immunol. Methods 108: 231 (1988) и Allison, J. Immunol. Methods 95: 157 (1986). Состав для введения приготавливают, добавляя равные объемы протеина и адьюванта-носителя в день введения. Содержание протеина должно быть в интервале от 5 мкг до 50 мкг на дозу. Мышей штамма BALB/c иммунизуют тремя по 0,1 мл внутримышечными инъекциями в 0, 21 и 42 день. Кровь от пре-иммунизованных последовательно на 10 день после каждой инъекции отбирают из ретроорбитального синуса. Уровни антител в сыворотке определяют в анализе ELISA по способу примера 3. EBV нейтрализующие антитела в сыворотке подсчитывают по их способности ингибировать трансформацию лимфоцитов крови спинного мозга плода у EBV ин витро по способу Moss, J. Virol. 17: 233 (1972) и De Schryver, Int. J. Cancer 13: 353 (1974). Соответственно Новозеландским белым кроликам инокулируют внутримышечно пять доз протеина, эмульгированного в указанном ранее адьюванте в 0, 21, 42, 63 и 84 дни. Дозы должны быть в интервале от около 5 мкг до 50 мкг на инокуляцию. Сыворотку получают через две недели после последней дозы и тестируют по титрам антител к антигену, для перекрестно-реактивного антитела к вирусному gp350/220 из В95-8 клеток и для ин витро EBV-нейтрализующей активности по способам Emini, Virology 166: 387 (1988). Так как способности EBV gp350/220 протеина индуцировать защитный иммунитет против EBV инфекции на модели животных уже были установлены, см. Epstein, Clin. Exp. Immunol 63: 485 (1986), ожидаются аналогичные позитивные результаты от введения композиции гомогенного gp350 протеина. Раскрытия всех приводимых здесь публикаций включены сюда по ссылкам. Подробное описание приведено только для большей ясности и понимания и никоим образом не является ограничивающим объем изобретения, в который входят все модификации, которые будут очевидны специалистам. Формула изобретения
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 14.04.2009
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
