Патент на изобретение №2178293
|
||||||||||||||||||||||||||
(54) ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЦИКЛОСПОРИН, СПОСОБ ПОЛУЧЕНИЯ МЯГКИХ ЖЕЛАТИНОВЫХ КАПСУЛ
(57) Реферат: Изобретение относится к фармакологии. Сущность изобретения составляет новая гомогенная, не содержащая спирта, легко текучая, осветленная и прозрачная фармацевтическая композиция, содержащая циклоспорин. Количество циклоспорина легко отмеряется в широком диапазоне температур от 15 до 45oС. Композиция включает циклоспорин в гидрофильной среде-носителе, которая включает пропиленгликоль, продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола, такой как сложные эфиры полиэтиленгликоля 6, и абрикосового масла, например Лабрафил М 1944, и полиоксиэтиленсодержащие гидрогенизированные касторовые масла, такие как Кремофор RH 40, и глицеринтриацетат или триацетин. Изобретение включает также способ получения мягких желатиновых капсул для этой композиции. Технический результат изобретения – расширение арсенала лекарственных форм циклоспорина. 2 с. и 6 з. п. ф-лы, 2 табл. Изобретение относится к новой гомогенной, не содержащей спирта, свободно текучей, осветленной и прозрачной фармацевтической композиции, включающей в качестве активного ингредиента циклоспорин. Новая композиция характеризуется повышенной биологической доступностью в случае приготовления средства в солюбилизированной системе, а также тем, что может производиться в традиционном коммерческом варианте. Предпосылки создания изобретения Циклоспорины представляют собой класс структурно различающихся, циклических, поли-N-метилированных эндекапептидов, обладающих обычно фармакологической, в частности иммуносупрессивной и противовоспалительной и/или противопаразитарной активностью. Первый из выделенных циклоспоринов относился к натуральному метаболиту грибов циклоспорину (Cyclosporin или Ciclosporin), известному так же как циклоспорин А, и коммерчески доступному под различными торговыми названиями. Циклоспорин представляет собой циклоспорин формулы А 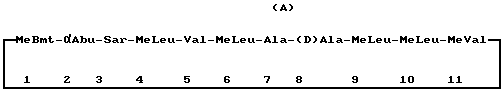 где MeBmt обозначает N-метил-(4R)-4-бут-2Е-ен-1-ил-4-метил- (L) треониловый остаток формулы В 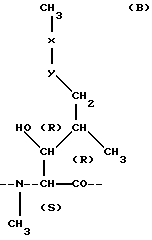 в которой -x-y- обозначает -CH= CH–(транс). До настоящего времени основной областью в исследовании циклоспорина было изучение его как иммуносупрессора, в частности с точки зрения применения его реципиентами при трансплантации органов, например трансплантатов сердца, легкого, комбинированного сердца-легкого, печени, почки, поджелудочной железы, костного мозга, кожи и роговицы и в том числе трансплантатов аллогенных органов. В этой области применение циклоспорина достигло больших успехов. В то же самое время применение циклоспорина в случае различных аутоиммунных заболеваний и воспалительных состояний с этиологией, включающей аутоиммунный компонент, таких как артрит (например, ревматоидный артрит, прогрессирующий хронический артрит и деформирующий артрит) и ревматизм, было также весьма интенсивным и в литературе широко представлены соответствующие отчеты и сообщения о результатах, полученных in vitro, на животных моделях и в клинических испытаниях. Конкретные аутоиммунные заболевания, в отношении которых проводится терапия циклоспорином, включают аутоиммунные гематологические нарушения (включая, например, гемолитическую анемию, апластическую анемию, эритроцитарную анемию и идиопатическую тромбоцитопению), системную красную волчанку, множественное воспаление хрящей, склеродерму, гранулематоз Вегенера, дерматомиозит, активный хронический гепатит, тяжелую псевдопаралитическую миастению, псориаз, синдром Стивенса-Джонсона, идиопатический спру, аутоиммунное воспалительное заболевание кишечника (в том числе язвенный колит и болезнь Крона), эндокринную офтальмопатию, болезнь Грейвса, саркоидоз, множественный склероз, первичный билиарный цирроз печени, ювенильный диабет (сахарный диабет типа I), увеит (передней камеры глаза и задней камеры глаза), сухой кератоконъюнктивит и весенний кератоконъюнктивит, интерстициальный фиброз легкого, псориатический артрит и гломерулонефрит (при наличии нефротического синдрома или в его отсутствие, т. е. включая идиопатический нефротический синдром или нефропатию с минимальными патологическими изменениями). Другие области исследования связаны с возможностью применения препарата в качестве противопаразитарного, в частности противопротозойного агента, в том числе с возможностью использования для лечения таких заболеваний, как малярия, кокцидиомикоз и шистосомоз, и совсем недавно стали исследовать возможность его использования в качестве агента, пригодного для реверсирования или нейтрализации устойчивости опухоли к антинеопластическим средствам и др. В литературе имеются сообщения с подробным описанием натуральных и полусинтетических циклоспоринов, их классификацией, номенклатурой и др. [Traber et al. , Helv. Chim. Acta, 60, 1247-1255 (1977); Traber et al. , Helv. Chim. Acta (65 no. 162, 1655-1667 (1982); Kobel et al. , Europ. J. Applied Microbiology and Biotechnology 14, 273-240 (1982); and von Wartburg et al. , Progress in Allergy, 38, 28-45 (1986); Патенты США NN 4 108 985, 4 210 581 и 4 220 641; публикации Европейских патентов NN 0 034 567 и 0 056 782; публикация международного патента N WO 86/02080; Wenger 1. , Transp. Proc. 15, Suppi. 1; 2230 (1983); Wenger 2, Angew. Chem. Int. Ed. , 24, 77 (1985); и Wenger 3, Progress in Chemistry of Organic Natural Products 50, 123 (1986)] . Среди всех циклоспоринов только для циклоспорина А (известного так же, как Cyclosporin или Ciclosporin) была установлена возможность использования при трансплантации органов и лечении аутоиммунных заболеваний. Несмотря на то, что до настоящего времени циклоспорин использовался наиболее широко из всех имеющихся в медицине супрессорных агентов, он имеет недостаток, связанный с его низкой биологической доступностью. Пероральные лекарственные формы, появившиеся в последнее время на рынке (например, с использованием этанола, оливкового масла в качестве среды-носителя, в сочетании с Лабрафилом в качестве поверхностно-активного вещества (патент США N 4388307)), представляют собой неприятные на вкус галеновы формы. Уровень биологической доступности, достигаемый при использовании таких лекарственных форм, низкий, при этом отмечаются широкие различия как между разными индивидуумами, так и для одного индивидуума. Такие лекарственные формы позволяют достичь среднего значения абсолютной биологической доступности примерно в 30%. Сообщения о вариациях в биологической доступности между субъектами варьируют от нескольких процентов у некоторых пациентов до таких значений, как 90% и более у других. Кроме того, могут наблюдаться заметные изменения в биологической доступности у одного и того же индивидуума с течением времени. Для проведения эффективной терапии в крови должен поддерживаться уровень циклоспорина в определенном диапазоне. Требуемый диапазон варьирует в зависимости от клинического состояния больного. В связи с низкой или варьирующей биологической доступностью дневные дозировки, нужные для достижения желательного уровня в крови, будут значительно варьировать для разных лекарственных форм циклоспорина, и нужен сопутствующий мониторинг достигаемого в крови уровня. Это вносит дополнительную стоимость в проводимое лечение. Для улучшения биологической доступности был предпринят ряд попыток по совершенствованию в этом направлении препаратов циклоспорина. В патенте США N 4 388 307 был предложен метод приготовления растворов для питья, содержащих циклоспорин, с использованием в качестве основы Лабрафила (Labrafil), Миглиола (Miglyol) этанола, кукурузного/оливкового масла. Однако такие препараты имели недостаток, связанный с тем, что они могли быть представлены только в виде жидкости, пригодной для разбавления питьевой водой/другой жидкостью перед употреблением, поскольку в ином случае было трудно отмерять точную дозу. Уровень биологической доступности, достигаемый при использовании таких систем, очень низкий и демонстрирует широкие вариации между индивидуумами, разными типами больных и даже для каждого отдельного индивидуума в разное время проведения курса рассматриваемой терапии. Патент Han Gua (патент Китая N 94191895.5) раскрывает препарат, включающий активное соединение циклоспорин, сахарный эфир жирной кислоты и разбавляющий носитель, обладающий хорошей биологической доступностью. Однако этот препарат имеет недостаток, заключающийся в том, что разбавитель разлагается вследствие гигроскопичности сахарного эфира и стабильность в таком случае не соответствует требуемым стандартам (см. также Pharmaceutical Research, Volume 6, N 11, 1989, P958, “Solid Surfactant Solution of Active Ingedients in Sugar Ester” and International Journal of Pharmaceutics, Vol. 92, 1993. P197″, Application of sucrose laurate a new pharmaceutical excipient, in Peroral formulation of Cyclosporin A”). Патент Китая N 94191895, эквивалентный документу ЕР 0702562, описывает мощную дозировку циклоспорина, обладающую сравнительно высокой стабильностью и до некоторой степени хорошей биологической доступностью в сравнении с более ранними композициями. В этом документе описывается адсорбция циклоспорина А с соответствующими растворителями на адсорбенте вместе с неионным гидрофильным поверхностно-активным веществом. Конечный продукт не содержит растворитель, поскольку его выпаривают в процессе производства. Таким образом, указанный продукт не имеет недостатка, связанного со сроком годности, а значит, и с проблемой стабильности в связи с выпариванием растворителя. В технике хорошо известны различные пригодные для фармацевтических целей поверхностно-активные вещества, полигидроспирты и растворители. В качестве адсорбента используют коллоидный диоксид кремния. Уровень в крови, достигаемый при использовании такого продукта, сравним со стандартными препаратами, приведенными в патенте США N 4 388 307, но при этом он имеет значительно улучшенную биологическую доступность. Однако при сравнении с микроэмульсионными композициями эти препараты не демонстрируют преимуществ, поскольку лекарственное средство адсорбируется на твердой поверхности и необходим дополнительный процесс растворения для достижения биологической доступности. Действие лаурината сахарозы на всасывание циклоспорина в желудочно-кишечном тракте также описано в литературе (Lerk-РС; Sucker-Н, International Journal of Pharmaceutics; 1993; 92 (May 3); 197-202). Оценка лекарственных форм, содержащих лауринат сахарозы, показала усиление всасывания циклоспорина in vitro при использовании нормальной эпителиальной ткани и некротических участков ткани Пейера из морских свинок. По сравнению с коммерчески доступными препаратами растворов для питья поглощение было увеличено в 10 раз. Избыточное количество поверхностно-активного вещества снижает всасывание лекарственного средства. Однако даже несмотря на большой избыток лаурината сахарозы, всасывание питьевого раствора все еще сохраняется на высоком уровне. Было показано, что холевая кислота также повышает всасывание в 5-6 раз. Сравнение всасывания в случае нормальной эпителиальной ткани и некротической ткани Пейера показало, что поглощение методом эндоцитоза не вносит значительный вклад в общий процесс всасывания циклоспорина. Из предварительных испытаний по составлению композиций был сделан вывод, что твердую лекарственную форму циклоспорина можно изготавливать с использованием в качестве наполнителя лаурината сахарозы. Имеется сообщение (Abdallakh-HY; Mayersohn-M, Pharmaceutical Research, 1991, 8 (Apr. ), 518-522) о приготовлении нескольких композиций циклоспорина, которые затем изучали in vitro и на модели собак. Композиция в виде таблеток была отобрана для сравнения с коммерческим масляным раствором, помещенным в мягкую капсулу, в рамках рандомизированного перекрестного испытания на собаках. При исследовании внутривенной дозы препарата было показано, что его абсолютная биологическая доступность составляет 46+11,1 и 45+9,9%; для капсул и таблеток соответственно. Величина максимальной концентрации, время, нужное для достижения максимальной концентрации, и среднее значение времени поглощения не различаются значительно между двумя исследованными композициями. Был сделан вывод, что таблеточная композиция эквивалентна при использовании на модели собак коммерческой дозированной форме, расфасованной в мягкие желатиновые капсулы. В патенте США N 5051402 показано, что циклоспорину может быть придана большая растворимость при сопутствующем введении  -циклодекстрина в режиме раздельного введения, но обязательно одновременно или, что предпочтительно, в виде смеси.
В патенте N 4990337 описана композиция, включающая циклоспорин в смеси по меньшей мере с одним или более моно- или диглицеридом С6-С10 жирной кислоты в количестве, достаточном для растворения циклоспорина. Полученный раствор можно затем легко эмульгировать в воде или в водосодержащей жидкости.
В патенте США N 4693362 описана лиофильно высушенная липосомальная смесь, содержащая циклоспорин. Это изобретение относится к лиофильно высушенной потенцированной липосомальной смеси, включающей амфифатический липид и циклоспорин или его производное, для использования его по методу липосомальной доставки циклоспорина в клетки. Раскрывается также метод, применяемый для получения лиофильно высушенной смеси. При восстановлении для получения липосом в водной среде практически весь имевшийся в лиофильно высушенной смеси циклоспорин оказывается инкапсулированным в липосомы.
Другие варианты улучшения галеновых форм эмульсии циклоспорина, которые имеются на достигнутом уровне техники, относятся к использованию производных токоферола (ЕР 0724452), сложного эфира токоферилполиэтиленгликоля и карбоновой кислоты (ЕР 0712631), диметилизосорбида (ЕР 0711550), ЕР 0650721), простого или сложного алкиленового полиэфира (WO 9423733), эмульсионных композиций (ЕР 0694308), олеилэфира ангидроманнита, лактоглицерида, цитроглицеридов (ЕР 656212), фосфатидилэтаноламина (ЕР 0651995), используемых в качестве поверхностно-активных веществ, стабилизаторов и др.
Три патентных заявки, а именно заявки на европейский патент NN 94110184.2, 95117171.9 и PCT/ЕР 95/04187 описывают использование диметилизосорбида в качестве дополнительного поверхностно-активного вещества или гидрофильной фазы в сочетании с другими ингредиентами с целью усиления поглощения циклоспорина. Одна из наиболее значительных попыток улучшить биологическую доступность циклоспорина в виде лекарственной формы описана в патенте США N 5 342 625. Этот документ описывает использование предварительно приготовленного концентрата микроэмульсии, представляющего собой систему из трех фаз: (1) компонента гидрофильной фазы; (2) компонента липофильной фазы; и (3) поверхностно-активного вещества. Такая композиция включает спирт в качестве обязательного ингредиента и при разведении водой она дает микроэмульсию масла в воде со средним размером частиц менее 1000 -циклодекстрина в режиме раздельного введения, но обязательно одновременно или, что предпочтительно, в виде смеси.
В патенте N 4990337 описана композиция, включающая циклоспорин в смеси по меньшей мере с одним или более моно- или диглицеридом С6-С10 жирной кислоты в количестве, достаточном для растворения циклоспорина. Полученный раствор можно затем легко эмульгировать в воде или в водосодержащей жидкости.
В патенте США N 4693362 описана лиофильно высушенная липосомальная смесь, содержащая циклоспорин. Это изобретение относится к лиофильно высушенной потенцированной липосомальной смеси, включающей амфифатический липид и циклоспорин или его производное, для использования его по методу липосомальной доставки циклоспорина в клетки. Раскрывается также метод, применяемый для получения лиофильно высушенной смеси. При восстановлении для получения липосом в водной среде практически весь имевшийся в лиофильно высушенной смеси циклоспорин оказывается инкапсулированным в липосомы.
Другие варианты улучшения галеновых форм эмульсии циклоспорина, которые имеются на достигнутом уровне техники, относятся к использованию производных токоферола (ЕР 0724452), сложного эфира токоферилполиэтиленгликоля и карбоновой кислоты (ЕР 0712631), диметилизосорбида (ЕР 0711550), ЕР 0650721), простого или сложного алкиленового полиэфира (WO 9423733), эмульсионных композиций (ЕР 0694308), олеилэфира ангидроманнита, лактоглицерида, цитроглицеридов (ЕР 656212), фосфатидилэтаноламина (ЕР 0651995), используемых в качестве поверхностно-активных веществ, стабилизаторов и др.
Три патентных заявки, а именно заявки на европейский патент NN 94110184.2, 95117171.9 и PCT/ЕР 95/04187 описывают использование диметилизосорбида в качестве дополнительного поверхностно-активного вещества или гидрофильной фазы в сочетании с другими ингредиентами с целью усиления поглощения циклоспорина. Одна из наиболее значительных попыток улучшить биологическую доступность циклоспорина в виде лекарственной формы описана в патенте США N 5 342 625. Этот документ описывает использование предварительно приготовленного концентрата микроэмульсии, представляющего собой систему из трех фаз: (1) компонента гидрофильной фазы; (2) компонента липофильной фазы; и (3) поверхностно-активного вещества. Такая композиция включает спирт в качестве обязательного ингредиента и при разведении водой она дает микроэмульсию масла в воде со средним размером частиц менее 1000  Такое увеличение площади поверхности приводит к повышению биологической доступности циклоспорина в сравнении с традиционными дозированными формами. Сравнение биологической доступности микроэмульсионной дозированной формы (композиция 1, описанная в патенте США N 5 342 625) с традиционной лекарственной формой на этанол-масляной основе (композиция описана в патенте США N 5 342 625) и описанной в патенте США N 4 388 307 более ранней композицией проводилось на здоровых волонтерах и результаты исследования приведены в патенте США N 5 342 625. Уровень биологической доступности для композиции 1 составлял 149,0% Такое увеличение площади поверхности приводит к повышению биологической доступности циклоспорина в сравнении с традиционными дозированными формами. Сравнение биологической доступности микроэмульсионной дозированной формы (композиция 1, описанная в патенте США N 5 342 625) с традиционной лекарственной формой на этанол-масляной основе (композиция описана в патенте США N 5 342 625) и описанной в патенте США N 4 388 307 более ранней композицией проводилось на здоровых волонтерах и результаты исследования приведены в патенте США N 5 342 625. Уровень биологической доступности для композиции 1 составлял 149,0%  48) в сравнении с композицией X (для которой значение биологической доступности было принято за 100%). Средние уровни AUC (зависимости концентрации от времени) для композиции I были на 40% выше соответствующих значений для композиции X, но все еще имелись большие вариации, составлявшие до 20%.
Спирт, как это становится очевидным при изучении продуктов, доступных на рынке, представляет собой обязательный элемент композиции (Сандимун [Патент США N 4 388 307] и Неорал [Патент США N 5 342 625] ); оба приведенных препарата содержат спирт. Такие композиции имеют серьезный недостаток, связанный с нестабильностью вследствие испарения низкокипящего растворителя, такого как спирт. Это особенно справедливо для случаев использования продуктов в домашних условиях, где невозможно точно контролировать строгие температурные условия. Хотя для защиты продуктов применяется очень дорогая и сложная технология (например, упаковки из формованного алюминия/алюминиевого блистера), проблема нестабильности препарата полностью еще не разрешена. Проблемы стабильности становятся очевидными при ознакомлении с требованиями, указанными на этикетках или вкладышах для таких коммерческих продуктов, как Сандимун (Sandimun) и Неорал (Neoral), применяемых в виде раствора для питья и капсул и на которых приведены очень строгие требования по условиям хранения и употребления. Ряд примеров таких строгих требований приведен ниже.
1. Требование хранить продукт при температуре ниже 30oC, тогда как замораживание запрещено. Это значит, что пациент, использующий продукт в тропическом климате, нуждается в условиях домашнего кондиционирования воздуха. Это не только ограничивающий фактор, относящийся к употреблению продукта, он может сделать невозможным его использование, поскольку в развивающихся странах не для каждого человека, использующего продукт, может быть достижимо соблюдение требования по хранению его в условиях кондиционирования воздуха. Иногда такие факторы, как длительная неисправность в электрической сети или механические или электрические неполадки в системе кондиционирования воздуха, могут привести к проблемам стабильности таких продуктов, которые в таких случаях могут стать нестабильными.
2. Во вкладышах в упаковках с питьевыми растворами Сандимуном и Неоралом имеется заявление о том, что “раствор Сандимуна Неорала должен быть использован в течение 2 месяцев после вскрытия и храниться при температуре от 15 до 30oC, предпочтительно не ниже 20oC в течение длительного периода времени, поскольку он содержит масляные компоненты натурального происхождения, которые имеют тенденцию затвердевать при низких температурах. Образование массы студнеобразной консистенции может происходить при температуре ниже 20oC и является обратимым в случае повышения температуры до 30oC. Могут наблюдаться небольшие хлопья или легкий осадок. Эти явления не влияют на эффективность и безопасность продукта и на точность дозировки продукта пипеткой”, что указывает на существование проблем, связанных с нестабильностью препарата.
В патенте США N 5 639 724 раскрываются фармацевтические композиции, включающие циклоспорин, продукт переэтерификации натурального растительного масла и глицерина, пример которого приведен под названием МАИЗИН (MAISIN) (продукт переэтерификации кукурузного масла и глицерина) и который является необходимым элементом композиции. Для создания такой композиции необходимо, чтобы циклоспорин был смешан с продуктом переэтерификации растительного масла и глицерина. Такая композиция не совсем подходит для изготовления раствора для питья, поскольку происходит образование студнеобразных комочков, так как продукт переэтерификации при комнатной температуре представляет собой студнеобразное вещество. В такой композиции предпочтительно также использование спирта. Такие композиции сравнимы по уровню биологической доступности с более ранними и несколькими худшими по этому показателю композициями, основанными на патенте США N 4 388 307, и не сравнимы по уровню биологической доступности с композициями, поступившими на рынок в последнее время (НЕОРАЛ) (NEORAL), определенными в патенте США N 5 342 625.
Получение эмульсий, так же как и микроэмульсий, создает особые технологические проблемы, связанные с термодинамической нестабильностью. Такие проблемы могут быть частично решены за счет введения продукта в предварительно приготовленную концентрированную микроэмульсионную форму, где микроэмульгирование осуществляется только in vivo. Однако такие системы могут представлять проблемы, связанные с широкими вариациями, существующими в желудочно-кишечном тракте пациента.
Любой специалист со средним уровнем знаний в данной области, пытающийся приготовить композицию без использования спирта и без тщательных и обширных экспериментов по изучению воздействия добавляемых к циклоспорину химических веществ, получит композиции, которые характеризуются очень высокой вязкостью и имеют тенденцию затвердевать в условиях нормальной комнатной температуры. Такие композиции нежелательны не только в связи с физической нестабильностью, но также из-за того, что они не могут быть изготовлены в виде жидкостей, дозирование которых может быть точно осуществлено при нормальных условиях.
Основным принимаемым в рассмотрении аспектом является точность отмеряемой дозы циклоспорина, что является существенным фактором в связи с узкими терапевтическими рамками препарата, заключающиеся в том, что ниже порогового значения происходит отторжение органа, а выше определенного значения это лекарственное средство вызывает тяжелые токсические реакции.
Ни в одном из упомянутых выше изобретений не приводятся способы растворения циклоспорина А (который является водонерастворимым гидрофобным средством) в гидрофильной среде. Это выглядит малоправдоподобным, и любой специалист в данной области не может себе представить препарат в форме, иной, чем эмульсия и/или микроэмульсия.
Все более ранние подходы к повышению биологической доступности циклоспорина были направлены на получение лекарственного средства в эмульгированной форме (патент США N 4 388 307) или за счет существенного повышения площади поверхности при превращении препарата в микроэмульсию (патент США N 5 342 625).
МАИЗИН является жирным материалом, который получается не только при объединении с циклоспорином, но даже при сочетании с Лабрафилом вместе с циклоспорином.
В рамках описания патента США N 5 639 724 был раскрыт Лабрафил как предпочтительный ингредиент, который следует добавлять в композицию циклоспорина и МАИЗИНА для получения раствора для питья. Однако этот патент не рассматривает проблему образования хлопьеподобных веществ в присутствии МАИЗИНА даже при добавлении в композицию Лабрафила.
Наша попытка состояла в том, чтобы так воздействовать на раствор циклоспорина в гидрофильном окружении с использованием мицеллярной концепции организации поверхностно-активного вещества и дополнительного поверхностно-активного вещества, чтобы такие композиции были, по существу, свободны от жирного материала и вследствие этого от дефектов, привносимых такими жирными материалами. Наша композиция при разведении водной или водной средой удерживала липофильный циклоспорин в солюбилизированном состоянии. В связи с этим удалось получить лекарственное средство с воспроизводимой биологической доступностью в терапевтических концентрациях.
Оказалось, что удобнее всего готовить композиции циклоспорина таким образом, чтобы лекарственное средство превращалось в солюбилизированную систему при разведении in vivo. Композиция по настоящему изобретению при пероральном введении в виде раствора для питья или мягких желатиновых капсул разбавляется жидкостями желудочно-кишечного тракта с образованием мицеллярных растворов, так что гидрофильная часть поверхностно-активного вещества и дополнительного поверхностно-активного вещества ориентирована в гидрофильное окружение жидкостей желудочно- кишечного тракта, а молекулы лекарственного средства захватываются гидрофобными частями мицелл поверхностно-активного вещества. Такие мицеллярные солюбилизированные системы при контакте со слизистой желудочно-кишечного тракта высвобождают лекарственное средство, что ведет к всасыванию, повышая таким образом его биологическую доступность и делая ее менее вариабельной.
Вполне определенно, что такие системы становятся более однородными и обладают большей биологической доступностью, чем микроэмульсии, из которых лекарственное средство распределяется в липофильной фазе для последующего всасывания.
Кроме того, авторы изобретения провели детальное изучение типа продуктов, получаемых с применением технологии, основанной на микроэмульсионных системах.
Имеющийся на рынке коммерческий продукт представлен двумя типами пероральных лекарственных форм.
Один тип средств представлен концентратами раствора для перорального применения, разбавляемый перед употреблением в начале лечения. Такие лекарственные формы позволяют достичь большей гибкости в дозировках с целью применения оптимальных терапевтических концентраций, предписываемых врачами.
Второй тип дозированных форм представляет собой стандартные дозированные формы, например капсулы, обычно мягкие желатиновые капсулы. Этот тип лекарственных форм используется для длительной терапии при осуществлении корректировки дозы.
Авторы изобретения смогли при проведении тщательных экспериментов и при соответствующей теоретической проработке изобрести композицию, в которой может быть растворено гидрофобное лекарственное средство, подобное циклоспорину, в гидрофильной среде при тщательном выборе гидрофильной среды, поверхностно-активных веществ и способа добавления, так что гидрофобное средство может быть растворено в массе молекул поверхностно-активного вещества, организованных таким образом, что их гидрофильные части ориентированы наружу, т. е. к гидрофильной среде, приводя к образованию композиций из прозрачных стабильных растворов. Такие продукты при контакте с биологическими жидкостями приводят к полной солюбилизации циклоспорина на молекулярном уровне, увеличивая в связи с этим площадь поверхности циклоспорина, так что такие разбавленные растворы характеризуются высокой биологической доступностью. Такие композиции не образуют эмульсии при разбавлении.
В другом варианте реализации изобретения раскрывается усовершенствованный способ получения мягких желатиновых капсул, содержащих циклоспорин в качестве активного ингредиента в составе “среды-носителя”, включающей пропиленгликоль, продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола, такой как сложный эфир полиэтиленгликоля 6 и абрикосового масла, такой как Лабрафил М 1944, полиоксиэтиленсодержащие гидрогенизированные касторовые масла, например Кремофор RH 40 (Cremophor RH 40) и глицеринтриацетат или триацетин, в котором ингредиенты присутствуют в следующих диапазонах: 48) в сравнении с композицией X (для которой значение биологической доступности было принято за 100%). Средние уровни AUC (зависимости концентрации от времени) для композиции I были на 40% выше соответствующих значений для композиции X, но все еще имелись большие вариации, составлявшие до 20%.
Спирт, как это становится очевидным при изучении продуктов, доступных на рынке, представляет собой обязательный элемент композиции (Сандимун [Патент США N 4 388 307] и Неорал [Патент США N 5 342 625] ); оба приведенных препарата содержат спирт. Такие композиции имеют серьезный недостаток, связанный с нестабильностью вследствие испарения низкокипящего растворителя, такого как спирт. Это особенно справедливо для случаев использования продуктов в домашних условиях, где невозможно точно контролировать строгие температурные условия. Хотя для защиты продуктов применяется очень дорогая и сложная технология (например, упаковки из формованного алюминия/алюминиевого блистера), проблема нестабильности препарата полностью еще не разрешена. Проблемы стабильности становятся очевидными при ознакомлении с требованиями, указанными на этикетках или вкладышах для таких коммерческих продуктов, как Сандимун (Sandimun) и Неорал (Neoral), применяемых в виде раствора для питья и капсул и на которых приведены очень строгие требования по условиям хранения и употребления. Ряд примеров таких строгих требований приведен ниже.
1. Требование хранить продукт при температуре ниже 30oC, тогда как замораживание запрещено. Это значит, что пациент, использующий продукт в тропическом климате, нуждается в условиях домашнего кондиционирования воздуха. Это не только ограничивающий фактор, относящийся к употреблению продукта, он может сделать невозможным его использование, поскольку в развивающихся странах не для каждого человека, использующего продукт, может быть достижимо соблюдение требования по хранению его в условиях кондиционирования воздуха. Иногда такие факторы, как длительная неисправность в электрической сети или механические или электрические неполадки в системе кондиционирования воздуха, могут привести к проблемам стабильности таких продуктов, которые в таких случаях могут стать нестабильными.
2. Во вкладышах в упаковках с питьевыми растворами Сандимуном и Неоралом имеется заявление о том, что “раствор Сандимуна Неорала должен быть использован в течение 2 месяцев после вскрытия и храниться при температуре от 15 до 30oC, предпочтительно не ниже 20oC в течение длительного периода времени, поскольку он содержит масляные компоненты натурального происхождения, которые имеют тенденцию затвердевать при низких температурах. Образование массы студнеобразной консистенции может происходить при температуре ниже 20oC и является обратимым в случае повышения температуры до 30oC. Могут наблюдаться небольшие хлопья или легкий осадок. Эти явления не влияют на эффективность и безопасность продукта и на точность дозировки продукта пипеткой”, что указывает на существование проблем, связанных с нестабильностью препарата.
В патенте США N 5 639 724 раскрываются фармацевтические композиции, включающие циклоспорин, продукт переэтерификации натурального растительного масла и глицерина, пример которого приведен под названием МАИЗИН (MAISIN) (продукт переэтерификации кукурузного масла и глицерина) и который является необходимым элементом композиции. Для создания такой композиции необходимо, чтобы циклоспорин был смешан с продуктом переэтерификации растительного масла и глицерина. Такая композиция не совсем подходит для изготовления раствора для питья, поскольку происходит образование студнеобразных комочков, так как продукт переэтерификации при комнатной температуре представляет собой студнеобразное вещество. В такой композиции предпочтительно также использование спирта. Такие композиции сравнимы по уровню биологической доступности с более ранними и несколькими худшими по этому показателю композициями, основанными на патенте США N 4 388 307, и не сравнимы по уровню биологической доступности с композициями, поступившими на рынок в последнее время (НЕОРАЛ) (NEORAL), определенными в патенте США N 5 342 625.
Получение эмульсий, так же как и микроэмульсий, создает особые технологические проблемы, связанные с термодинамической нестабильностью. Такие проблемы могут быть частично решены за счет введения продукта в предварительно приготовленную концентрированную микроэмульсионную форму, где микроэмульгирование осуществляется только in vivo. Однако такие системы могут представлять проблемы, связанные с широкими вариациями, существующими в желудочно-кишечном тракте пациента.
Любой специалист со средним уровнем знаний в данной области, пытающийся приготовить композицию без использования спирта и без тщательных и обширных экспериментов по изучению воздействия добавляемых к циклоспорину химических веществ, получит композиции, которые характеризуются очень высокой вязкостью и имеют тенденцию затвердевать в условиях нормальной комнатной температуры. Такие композиции нежелательны не только в связи с физической нестабильностью, но также из-за того, что они не могут быть изготовлены в виде жидкостей, дозирование которых может быть точно осуществлено при нормальных условиях.
Основным принимаемым в рассмотрении аспектом является точность отмеряемой дозы циклоспорина, что является существенным фактором в связи с узкими терапевтическими рамками препарата, заключающиеся в том, что ниже порогового значения происходит отторжение органа, а выше определенного значения это лекарственное средство вызывает тяжелые токсические реакции.
Ни в одном из упомянутых выше изобретений не приводятся способы растворения циклоспорина А (который является водонерастворимым гидрофобным средством) в гидрофильной среде. Это выглядит малоправдоподобным, и любой специалист в данной области не может себе представить препарат в форме, иной, чем эмульсия и/или микроэмульсия.
Все более ранние подходы к повышению биологической доступности циклоспорина были направлены на получение лекарственного средства в эмульгированной форме (патент США N 4 388 307) или за счет существенного повышения площади поверхности при превращении препарата в микроэмульсию (патент США N 5 342 625).
МАИЗИН является жирным материалом, который получается не только при объединении с циклоспорином, но даже при сочетании с Лабрафилом вместе с циклоспорином.
В рамках описания патента США N 5 639 724 был раскрыт Лабрафил как предпочтительный ингредиент, который следует добавлять в композицию циклоспорина и МАИЗИНА для получения раствора для питья. Однако этот патент не рассматривает проблему образования хлопьеподобных веществ в присутствии МАИЗИНА даже при добавлении в композицию Лабрафила.
Наша попытка состояла в том, чтобы так воздействовать на раствор циклоспорина в гидрофильном окружении с использованием мицеллярной концепции организации поверхностно-активного вещества и дополнительного поверхностно-активного вещества, чтобы такие композиции были, по существу, свободны от жирного материала и вследствие этого от дефектов, привносимых такими жирными материалами. Наша композиция при разведении водной или водной средой удерживала липофильный циклоспорин в солюбилизированном состоянии. В связи с этим удалось получить лекарственное средство с воспроизводимой биологической доступностью в терапевтических концентрациях.
Оказалось, что удобнее всего готовить композиции циклоспорина таким образом, чтобы лекарственное средство превращалось в солюбилизированную систему при разведении in vivo. Композиция по настоящему изобретению при пероральном введении в виде раствора для питья или мягких желатиновых капсул разбавляется жидкостями желудочно-кишечного тракта с образованием мицеллярных растворов, так что гидрофильная часть поверхностно-активного вещества и дополнительного поверхностно-активного вещества ориентирована в гидрофильное окружение жидкостей желудочно- кишечного тракта, а молекулы лекарственного средства захватываются гидрофобными частями мицелл поверхностно-активного вещества. Такие мицеллярные солюбилизированные системы при контакте со слизистой желудочно-кишечного тракта высвобождают лекарственное средство, что ведет к всасыванию, повышая таким образом его биологическую доступность и делая ее менее вариабельной.
Вполне определенно, что такие системы становятся более однородными и обладают большей биологической доступностью, чем микроэмульсии, из которых лекарственное средство распределяется в липофильной фазе для последующего всасывания.
Кроме того, авторы изобретения провели детальное изучение типа продуктов, получаемых с применением технологии, основанной на микроэмульсионных системах.
Имеющийся на рынке коммерческий продукт представлен двумя типами пероральных лекарственных форм.
Один тип средств представлен концентратами раствора для перорального применения, разбавляемый перед употреблением в начале лечения. Такие лекарственные формы позволяют достичь большей гибкости в дозировках с целью применения оптимальных терапевтических концентраций, предписываемых врачами.
Второй тип дозированных форм представляет собой стандартные дозированные формы, например капсулы, обычно мягкие желатиновые капсулы. Этот тип лекарственных форм используется для длительной терапии при осуществлении корректировки дозы.
Авторы изобретения смогли при проведении тщательных экспериментов и при соответствующей теоретической проработке изобрести композицию, в которой может быть растворено гидрофобное лекарственное средство, подобное циклоспорину, в гидрофильной среде при тщательном выборе гидрофильной среды, поверхностно-активных веществ и способа добавления, так что гидрофобное средство может быть растворено в массе молекул поверхностно-активного вещества, организованных таким образом, что их гидрофильные части ориентированы наружу, т. е. к гидрофильной среде, приводя к образованию композиций из прозрачных стабильных растворов. Такие продукты при контакте с биологическими жидкостями приводят к полной солюбилизации циклоспорина на молекулярном уровне, увеличивая в связи с этим площадь поверхности циклоспорина, так что такие разбавленные растворы характеризуются высокой биологической доступностью. Такие композиции не образуют эмульсии при разбавлении.
В другом варианте реализации изобретения раскрывается усовершенствованный способ получения мягких желатиновых капсул, содержащих циклоспорин в качестве активного ингредиента в составе “среды-носителя”, включающей пропиленгликоль, продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола, такой как сложный эфир полиэтиленгликоля 6 и абрикосового масла, такой как Лабрафил М 1944, полиоксиэтиленсодержащие гидрогенизированные касторовые масла, например Кремофор RH 40 (Cremophor RH 40) и глицеринтриацетат или триацетин, в котором ингредиенты присутствуют в следующих диапазонах:Циклоспорин – 1-25% (вес. /вес. ) Пропиленгликоль – 10-50% (вес. /вес. ) Продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола – 5-30% (вес. /вес. ) Полиоксиэтиленсодержащие гидрогенизированные касторовые масла – 30-60% (вес. /вес. ) Триацетин – 0,1-30% (вес. /вес. ) Получение таких лекарственных форм, как мягкие желатиновые капсулы, создает уникальные технологические проблемы, связанные с тем, что растворы, которые должны быть инкапсулированы, представляют собой заранее приготовленный микроэмульсионный концентрат. Им свойственна тенденция терять вес в связи с миграцией материала со свободными гидроксильными группами в оболочку капсулы, вызывая таким образом осаждение лекарственного средства в связи с потерей растворителя. В настоящем изобретении эта проблема решается за счет добавления к указанной композиции по настоящему изобретению, по существу, 10-25% избытка “среды-носителя”, компенсируя таким образом потерю веса, связанную с миграцией. В то же самое время количество пластификатора в оболочке снижают на количество, эквивалентное избытку среды-носителя, добавленного в капсулу. Термин “основа” или “среда-носитель” означает в контексте настоящего описания все, что добавляется к композиции, за исключением лекарственного средства. Композиция вводится в капсульную оболочку с применением традиционных процедур, описанных в стандартных руководствах. (“The theory and practice of Industrial Pharmacy” by Leon Lachman et al. Third edition, LEA AND FEBIGER, USA). Мягкие желатиновые капсулы обладают вполне определенным преимуществом, связанным с легкостью работы с ними и употребления в сравнении с пероральными растворами. Такие пероральные формы занимают очень большой сегмент коммерческого рынка. Настоящее изобретение относится к композициям циклоспорина, отличающимся тем, что лекарственное средство находится в солюбилизированных системах, состоящих из мицелл поверхностно-активного вещества, при этом оно соответствующим образом стабилизировано в специфичной гидрофильной фазе. Краткое описание сущности изобретения В соответствии с настоящим изобретением описывается гомогенная, по существу, свободная от спирта прозрачная композиция циклоспорина, которая является прозрачной, стабильной, текучей и легко отмеряемой в широком диапазоне температур от 15 до 45oC и которая содержит циклоспорин в гидрофильной среде-носителе, включающей пропиленгликоль, продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола, полиоксиэтиленсодержащие гидрогенизированные касторовые масла и глицеринтриацетат или триацетин, в которой ингредиенты представлены в следующем диапазоне: Циклоспорин – 1-25% (вес. /вес. ) Пропиленгликоль – 10-50% (вес. /вес. ) Продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола – 5-30% (вес. /вес. ) Полиоксиэтиленсодержащие гидрогенизированные касторовые масла – 30-60% (вес. /вес. ) Триацетин – 0,1-30% (вес. /вес. ) Предпочтительно ингредиенты в настоящих композициях представлены в следующем диапазоне: Циклоспорин – 5-15% (вес. /вес. ) Пропиленгликоль – 15-45% (вес. /вес. ) Продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола – 7-20% (вес. /вес. ) Полиоксиэтиленсодержащие гидрогенизированные касторовые масла – 35-55% (вес. /вес. ) Триацетин – 1-10% (вес. /вес. ) Более предпочтительно композиция по настоящему изобретению включает ингредиенты в следующем диапазоне: Циклоспорин – 8-12% (вес. /вес. ) Пропиленгликоль – 20-40% (вес. /вес. ) Продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола – 10-15% (вес. /вес. ) Полиоксиэтиленсодержащие гидрогенизированные касторовые масла – 40-50% (вес. /вес. ) Триацетин – 2-5% (вес. /вес. ) Подробное описание изобретения Системы по настоящему изобретению представляют собой однофазные системы в отличие от эмульсий/микроэмульсий, в которых липофильная фаза обязательно эмульгирована или микроэмульгирована с использованием поверхностно-активного вещества. В контексте настоящего изобретения выражение “однофазная” относится к фазе, в которой лекарственное средство солюбилизировано в гидрофильной фазе с использованием подходящего (их) поверхностно-активного (ых) вещества/дополнительного (ых) поверхностно-активного (ых) вещества. Композиции по настоящему изобретению, по существу, не содержат этанол. Использование таких композиций наиболее выгодно в условиях тропических стран в связи с отсутствием C1-5 алканолов, таких как этанол, которые более подвержены испарению. Такие композиции по настоящему изобретению, которые представляют собой солюбилизированные системы и, по существу, не содержат C1-5 алканолов, таких как этанол, имеют отчетливые преимущества перед теми композициями, которые описаны в патенте США N 5 342 652, с точки зрения их производства и распространения в тропических странах. В соответствии с настоящим изобретением описывается гомогенная, по существу, свободная от спирта прозрачная композиция циклоспорина, которая является прозрачной, стабильной, текучей и легко отмеряемой в широком диапазоне температур от 15 до 45oC и которая содержит циклоспорин в гидрофильной среде-носителе, включающей пропиленгликоль, продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола, полиоксиэтиленсодержащие гидрогенизированные касторовые масла и глицеринтриацетат или триацетин, в которой ингредиенты представлены в следующем диапазоне: Циклоспорин – 1-25% (вес. /вес. ) Пропиленгликоль – 10-50% (вес. /вес. ) Продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола – 5-30% (вес. /вес. ) Полиоксиэтиленсодержащие гидрогенизированные касторовые масла – 30-60% (вес. /вес. ) Триацетин – 0,1-30% (вес. /вес. ) Предпочтительно такие композиции включают также олеиновую кислоту. Олеиновая кислота может содержаться в диапазоне 0-10% (объем/объем). Предпочтительно продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола представляет собой сложные эфиры полиэтиленгликоля 6 и абрикосового масла. Более предпочтительно сложный эфир полиэтиленгликоля 6 и абрикосового масла представляет собой Лабрафил М 1944. Предпочтительно полиоксиэтиленсодержащее гидрогенизированное касторовое масло представляет собой полиоксиэтилен 40 – гидрогенизированное касторовое масло. Особенно хорошо подходит продукт, продаваемый под торговым названием Кремофор RH (Cremophor RH 40). Предпочтительно ингредиенты в настоящих композициях представлены в следующем диапазоне: Циклоспорин – 5-15% (вес. /вес. ) Пропиленгликоль – 15-45% (вес. /вес. ) Продукт переэтерификации триглицерида натурального растительного масла триглицеридом и полиалкиленполиола – 7-20% (вес. /вес. ) Полиоксиэтиленсодержащие гидрогенизированные касторовые масла – 35-55% (вес. /вес. ) Триацетин – 1-10% (вес. /вес. ) Более предпочтительно композиция по настоящему изобретению включает ингредиенты в следующем диапазоне: Циклоспорин – 8-12% (вес. /вес. ) Пропиленгликоль – 20-40% (вес. /вес. ) Продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола – 10-15% (вес. /вес. ) Полиоксиэтиленсодержащие гидрогенизированные касторовые масла – 40-50% (вес. /вес. ) Триацетин – 2-5% (вес. /вес. ) Очень малые количества антиоксидантов, обычно в диапазоне от 0,005% до 0,01%, могут входить как часть одного из ингредиентов композиции. Количество ингредиентов композиции, раскрытой выше, составляет 100%. Композиция готовится так, чтобы дальше ее можно было разбавить с целью получения раствора для питья или ввести в мягкие желатиновые капсулы. Термин “легко отмеряемая” используется в связи с необходимостью учитывать характерные свойства циклоспорина. Это лекарственное средство требует точного отмеривания дозы в связи с его узким терапевтическим индексом. Большинство упаковок раствора для питья снабжены пипеткой или шприцем для точного отмеривания дозы. Гарантируется, что раствор является достаточно негустой жидкостью, чтобы позволить легко отмерять нужную дозу, а не полутвердой массой и не должен содержать каких-либо хлопьев, различных студнеобразных образований и других осадков, которые могут отрицательно сказаться на гомогенности раствора и привести к ошибке в отмеривании дозы. Композиция по настоящему изобретению обладает всеми желательными характеристиками и в этой связи легко отмеряется, соответствуя тому требованию к препарату, которое относится к отмериванию дозы. Несколько композиций по настоящему изобретению, содержащих ингредиенты в разных диапазонах, были использованы для коммерческих исследований и для испытаний по определению сроков годности, при этом авторы изобретения получили хорошие результаты, что дает основание рассматривать настоящие композиции как удобные для производства и стабильные в течение длительного периода времени, что было получено при изучении стабильности экспресс-методом. Кроме того, при исследовании на здоровых волонтерах было показано, что композиция (и) по настоящему изобретению обладает (ют) превосходной биологической доступностью циклоспорина и биологически эквивалентна коммерческим продуктам. Сравнительные результаты объединены в таблицах I и II. Далее изобретение будет описано со ссылкой на соответствующие примеры, которые никоим образом не должны рассматриваться как ограничивающие область настоящего изобретения: ПРИМЕР 1 (достигнутый уровень техники) Компонент – Количество а) циклоспорин – 100 мг (прибл. = 10,5%) b) маизин – 550 мг (прибл. = 57,8%) с) лабрафил М2125 – 300 мг (прибл = 33,5%) ВСЕГО – 950 мг Полученная смесь представляет собой полутвердую массу при комнатной температуре, которая пригодна только для приготовления мягких желатиновых капсул. ПРИМЕР 2 (достигнутый уровень техники) Компонент – Количество а) циклоспорин – 100 мг (прибл. = 10,5%) b) мизин – 490 мг (прибл. = 52%) с) лабрафил М2125 – 300 мг (прибл. = 31,5%) d) кремофор RH40 – 60 мг (прибл. = 6,3%) ВСЕГО – 950 мг Полученная смесь представляет собой полутвердую массу при комнатной температуре, которая пригодна только для приготовления мягких желатиновых капсул. ПРИМЕР 3 (уровень техники) Компонент – Количество а) циклоспорин – 100 мг (прибл. = 10,5%) b) маизин – 850 мг (прибл. = 52%) Всего – 950 мг Полученная смесь представляет собой полутвердую массу при комнатной температуре, которая пригодна только для приготовления мягких желатиновых капсул. ПРИМЕР 4 (уровень техники) Компонент – Количество а) циклоспорин – 100 мг b) пропиленгликоль – 200 мг с) кремофор RH40 – 350 мг d) лабрафил М1944 – 200 мг е) маизин – 150 мг ВСЕГО – 1000 мг Полученная смесь представляет собой прозрачную гомогенную жидкость при температурах от 25 до 30oC, но при температурах ниже 20oC в ней выпадают студнеобразные хлопья. ПРИМЕР 5 Компонент – Количество а) циклоспорин – 200 мг b) пропиленгликоль – 240 мг с) кремофор RH40 – 430 мг d) лабрафил М1944 – 110 мг е) триацетин – 20 мг Всего – 1000 мг Указанная композиция дает прозрачный гомогенный раствор, который остается прозрачным и стабильным при температурах от 15 до 45oC без образования студнеобразных хлопьев. В этой связи указанная композиция пригодна для приготовления на ее основе раствора для питья или мягких желатиновых капсул. Пропиленгликоль смешивают с Кремофором RH40 и нагревают до температуры от 55 до 60oC. Циклоспорин растворяют в полученной смеси. К указанной массе добавляют Лабрафил М1944 и все перемешивают. Затем к общей массе полученной смеси добавляют триацетин и снова перемешивают. Полученную смесь фильтруют. ПРИМЕР 6 Компонент – Количество а) циклоспорин – 200 мг b) пропиленгликоль – 257 мг с) кремофор RH40 – 425 мг d) лабрафил М1944 – 100 мг е) триацетин – 18 мг ВСЕГО – 1000 мг Указанная композиция дает прозрачный гомогенный раствор, который остается прозрачным и стабильным при температурах от 15 до 45oC без образования студнеобразных хлопьев. В этой связи указанная композиция пригодна для приготовления на ее основе раствора для питья или мягких желатиновых капсул. Пропиленгликоль смешивают с Кремофором RH40 и нагревают до температуры от 55 до 60oC. Циклоспорин растворяют в полученной смеси. К указанной массе добавляют Лабрафил М1944 и все перемешивают. Затем к общей массе полученной смеси добавляют триацетин и снова перемешивают. Полученную смесь фильтруют. ПРИМЕР 7 Компонент – Количество а) циклоспорин – 150 мг b) пропиленгликоль – 260 мг с) кремофор RH40 – 460 мг d) лабрафил М1944 – 110 мг d) триацетин – 20 мг Всего – 1000 мг Указанная композиция дает прозрачный гомогенный раствор, который остается прозрачным и стабильным при температурах от 15 до 45oC без образования студнеобразных хлопьев. В этой связи указанная композиция пригодна для приготовления на ее основе раствора для питья или мягких желатиновых капсул. Пропиленгликоль смешивают с Кремофором RH40 и нагревают до температуры от 55 до 60oC. Циклоспорин растворяют в полученной смеси. К указанной массе добавляют Лабрафил М1944 и все перемешивают. Затем к общей массе полученной смеси добавляют триацетин и снова перемешивают. Полученную смесь фильтруют. ПРИМЕР 8 Компонент – Количество а) циклоспорин – 50 мг b) пропиленгликоль – 350 мг с) кремофор RH40 – 420 мг d) лабрафил M1944 – 110 мг е) триацетин – 20 мг f) олеиновая кислота – 50 мг Всего – 1000 мг Указанная композиция дает прозрачный гомогенный раствор, который остается прозрачным и стабильным при температурах от 15 до 45oC без образования студнеобразных хлопьев. В этой связи указанная композиция пригодна для приготовления на ее основе раствора для питья или мягких желатиновых капсул. Пропиленгликоль смешивают с Кремофором RH40 и нагревают до температуры от 55 до 60oC. Циклоспорин растворяют в полученной смеси. К указанной массе добавляют Лабрафил М1944 и олеиновую кислоту и все перемешивают. Затем к общей массе полученной смеси добавляют триацетин и снова перемешивают. Полученную смесь фильтруют. ПРИМЕР 9 Компонент – Количество а) циклоспорин – 10 мг b) пропиленгликоль – 400 мг с) кремофор RH40 – 420 мг d) лабрафил M1944 – 20 мг е) триацетин – 20 мг ВСЕГО – 1000 мг Указанная композиция дает прозрачный гомогенный раствор, который остается прозрачным и стабильным при температурах от 15 до 45oC без образования студнеобразных хлопьев. В этой связи указанная композиция пригодна для приготовления на ее основе раствора для питья или мягких желатиновых капсул. Пропиленгликоль нагревают до температуры от 55 до 60oC и растворяют в нем циклоспорин. К указанной массе добавляют Кремофор RH40 и все перемешивают. После этого ко всей массе добавляют Лабрафил М1944. Затем к общей массе полученной смеси добавляют триацетин и все перемешивают. Полученную смесь фильтруют. ПРИМЕР 10 Компонент – Количество а) циклоспорин – 100 мг b) пропиленгликоль – 240 мг с) кремофор RH40 – 480 мг d) лабрафил М1944 – 160 мг е) триацетин – 20 мг ВСЕГО – 1000 мг Пропиленгликоль смешивают с Кремофором RH40 и нагревают до температуры от 55 до 60oC. Циклоспорин растворяют в полученной смеси. К указанной массе добавляют Лабрафил М1944 и все перемешивают. Затем к общей массе полученной смеси добавляют триацетин и снова перемешивают. Полученную смесь фильтруют. ПРИМЕР 11 Способ получения мягких желатиновых капсул циклоспорина Композиции на достигнутом уровне техники имеют недостаток, связанный с миграцией среды-носителя, включающей растворители со свободными -ОН группами, в особенности этанол, в оболочку, что приводит к осаждению лекарственного средства в капсулах. Если удалить спирт, это также приводит к осаждению лекарственного средства. Для решения этой проблемы мы использовали свое открытие, связанное с тем, что в композиции по настоящему изобретению увеличение количества среды-носителя композиции ядра примерно на 20% во время инкапсулирования и снижение количества пластификатора (сорбита и глицерина) в композиции оболочки капсулы на 20% приводит к получению мягких желатиновых капсул, которые при хранении сохраняют равновесное состояние и остаются стабильными в течение всего срока годности; примеры таких композиций приведены ниже: Размер партии: 100.000 капсул Композиция ядра: а) циклоспорин – 5 кг b) среда-носитель* – 55 кг * содержит среду-носитель с 20% избытком. Композиция среды-носителя: I) Пропиленгликоль – 10,8 кг II) Кремофор RH40 – 24,9 кг III) Лабрафил М1944 – 18,1 кг IV) Триацетин – 1,2 кг Композиция оболочки капсулы: I) Желатин – 50 мг II) Сорбит – 8 кг III) Глицерин – 8 кг IV) Метилпарабен – 240 кг V) Пропилпарабен – 140 кг VI) Вода – 45 кг VII) Краситель – 400 г Формула изобретения
Циклоспорин – 1-25 Пропиленгликоль – 10-50 Продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола – 5-30 Полиоксиэтиленсодержащие гидрогенизированные касторовые масла – 30-60 Триацетин – 0,1-30 2. Композиция по п. 1, отличающаяся тем, что содержит ингредиенты в следующем соотношении, вес. %: Циклоспорин – 5-15 Пропиленгликоль – 15-45 Продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола – 7-20 Полиоксиэтиленсодержащие гидрогенизированные касторовые масла – 35-55 Триацетин – 1-10 3. Композиция по п. 1, отличающаяся тем, что содержит в следующем соотношении, вес. %: Циклоспорин – 8-12 Пропиленгликоль – 20-40 Продукт переэтерификации триглицерида натурального растительного масла и полиалкиленполиола – 10-15 Полиоксиэтиленсодержащие гидрогенизированные касторовые масла – 40-50 Триацетин – 2-5 4. Композиция по п. 1, отличающаяся тем, что разбавление водной средой приводит к образованию раствора циклоспорина. 5. Композиция по п. 1, отличающаяся тем, что представлена в виде раствора для питья. 6. Композиция по п. 1, отличающаяся тем, что дополнительно включает также олеиновую кислоту. 7. Композиция по п. 6, отличающаяся тем, что олеиновая кислота присутствует в ней в диапазоне 0-10% (вес. /вес. ). 8. Способ получения мягких желатиновых капсул для композиции, охарактеризованной в п. 1, включающий добавление к указанной композиции по существу 10-25% избытка среды-носителя и снижение по существу на 10-25% содержания полиолов, таких, как сорбит и глицерин, которые применяются как пластификаторы, в оболочке капсулы. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 19.08.2009
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
