Патент на изобретение №2177317
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ ХИНОЛИНА ДЛЯ КОРРЕКЦИИ СИСТЕМЫ ГЕМОСТАЗА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СРЕДСТВО ДЛЯ КОРРЕКЦИИ ГЕМОСТАЗА
(57) Реферат: Изобретение относится к области медицины и касается средства для коррекции гемостаза. Изобретение заключается в том, что предлагаются производные хинолина, фармацевтическая композиция и их применение. Изобретение обеспечивает выраженную биологическую активность, а одно из них на уровне гирудина – одного из наиболее активных и дорогих импортных лекарственных средств. Оригинальность (качество) средств заключается в том, что коагуляционная и антикоагуляционная активность этих веществ связана с их влиянием на функционирование системы тромбин-тромбиновый рецептор. 3 с. и 1 з.п. ф-лы, 2 табл. Изобретение относится к медицине, а именно к области фармакологии и клинической биохимии. Представленные вещества относятся к группе триггерных модуляторов свертывающей системы. Предполагается использование патентуемых веществ в следующих областях: Регуляция системы гемостаза, изучение закономерностей его функционирования. Лечение тромботических и протромботических состояний, в которых играет роль коагуляционный каскад (таких как венозный тромбоз, легочная эмболия, инфаркт миокарда и др.). Использование в качестве аддьювантов при лечебной тромбининдуцированной окклюзии. Контроль клеточного роста в экспериментальной онкологии и при терапии новообразований. В течение последнего времени усилия специалистов ведущих научных центров и биотехнологических фирм мира (“Maganin Pharmaceutical Inc.,” “Genzyme Molecular Oncology”, “Aeterna” and all) направлены на поиск новых и модификацию уже известных препаратов, активных в отношении процессов, происходящих в свертывающей и антисвертывающей системе человека. Актуальность этого поиска не только не ослабевает, но и увеличивается в связи с обнаружившейся в последние годы корреляцией процессов метастазирования опухолей и степенью функционирования свертывающей системы. Тромбоциты чувствительны ко многим триггерным (запускающим) веществам. Эндогенная регуляция биологических эффектов тромбина строго регламентирована. Она реализуется на различных уровнях: от экспрессии отдельных белковых компонентов и их последующей активации в ходе каскадных взаимодействий между отдельными факторами свертывания до включения специфических рецепторов тромбина и процессов передачи сигнала. Максимальное влияние оказывают вещества, имеющие возможность одновременного воздействия на различных ступенях. К триггерным веществам относятся коллаген, тромбоксан А2, ТХА, аденозиндифосфат (ADP), адреналин, 5-гидрокситриптамин, тромбин или фактор агрегации тромбоцитов (PAF) и др., причем указанные вещества могут действовать как на уровне обмена Ca2+ или с-АМР, так и на уровне тромбинового рецептора. Эффективными для дальнейшего использования оказываются вещества, полученные как в результате химического синтеза (пептиды, производные индола, имидазола, пиридина), так и выделенные из натуральных источников (растения, беспозвоночные, рыбы, опухолевые клетки) [см. Евр.пат. N 483667, 643072, 593963. Пат. США N 6020334, 4579862, 4752573, 4798830, 3975384, 3975524, 5407946, 448256, 5371091, 5583146, 5741789, 5741792. Пат. ФРГ N 2503961, 2912414, 3420314]. Изобретательская задача – расширить количественно и дополнить качественно список аналогичных биологически активных веществ. Изобретательская задача решается тем, что предлагается фармацевтическая композиция для коррекции системы гемостаза, содержащая приемлемый наполнитель и действующее начало, отличающаяся тем, что в качестве последнего она содержит производное хинолина, выбранное из группы: 6-нитро-2-(1-пиперазинил)-хинолин, 6-нитро-2-тиоморфолинохинолин, 2-тиоморфолинохинолин,  -тиоморфолинохинальдин, 2-метил-6-метокси-4-тиоморфолинохинолин, 2-фенил-4-(3-этоксикарбонил- 4,5,6,7-тетрагидробензо[в] тиенил)амидохинолин, фталоил-1,1-бис(1,2,3,4-тетрагидрохинолин), 1-(5-бромфуроил-2)-1,2,3,4-тетрагидрохинолин.
Часть из предлагаемых соединений (1-5) известна, она была синтезипрована заявителем ранее по разработанной им технологии и входит в его коллекцию биологически активных соединений в качестве психотропных средств [1-2]. Ввиду этого эти известные производные хинолина предлагаются в качестве средства для коррекции гемостаза.
Вещества (6-8) синтезированы впервые. Они описываются общей структурной формулой R1-R-R2, когда 1) R – хинолин, тогда R1 – 2-фенил; R2 – 4-(3-этоксикарбонил-4,5,6,7-тетрагидробензо[в] тиенил), когда 2) R – 1,2,3,4-тетрагидрохинолин, тогда R1 – 1-фталоил или 1-(бромфуроил-2); R2 – H.
Вещества (1-3, 7, 8) обладают выраженной антикоагуляционной активностью, а вещество (2) обладает активностью, приближающейся к активности гирудина – наиболее эффективного и дорогостоящего импортного средства.
Вещества (4-6) вызывают агрегацию тромбоцитов в присутствии тромбина, причем средний радиус агрегатов существенно ниже, чем при использовании только одного тромбина. Эта характеристика агрегации тромбоцитов может оказаться полезной при использовании предлагаемых веществ при тромбининдуцированной окклюзии, создаваемой в лечебных целях. Кроме того, было установлено, что вещество 1 достоверно ингибирует запуск внутреннего пути свертывания крови (т.е. происходящего не в результате травмы сосуда, а при внутренних провоцирующих обстоятельствах) и снижает ферментативную активность тромбина.
Ниже приведены примеры, в которых описаны способы получения предлагаемых веществ, а также данные, подтверждающие заявленную активность и механизм действия.
Пример 1.
Получение 6-нитро-2-(1-пиперазинил)-хинолина, (1) [1].
Смесь 4.50 г (2.16 -тиоморфолинохинальдин, 2-метил-6-метокси-4-тиоморфолинохинолин, 2-фенил-4-(3-этоксикарбонил- 4,5,6,7-тетрагидробензо[в] тиенил)амидохинолин, фталоил-1,1-бис(1,2,3,4-тетрагидрохинолин), 1-(5-бромфуроил-2)-1,2,3,4-тетрагидрохинолин.
Часть из предлагаемых соединений (1-5) известна, она была синтезипрована заявителем ранее по разработанной им технологии и входит в его коллекцию биологически активных соединений в качестве психотропных средств [1-2]. Ввиду этого эти известные производные хинолина предлагаются в качестве средства для коррекции гемостаза.
Вещества (6-8) синтезированы впервые. Они описываются общей структурной формулой R1-R-R2, когда 1) R – хинолин, тогда R1 – 2-фенил; R2 – 4-(3-этоксикарбонил-4,5,6,7-тетрагидробензо[в] тиенил), когда 2) R – 1,2,3,4-тетрагидрохинолин, тогда R1 – 1-фталоил или 1-(бромфуроил-2); R2 – H.
Вещества (1-3, 7, 8) обладают выраженной антикоагуляционной активностью, а вещество (2) обладает активностью, приближающейся к активности гирудина – наиболее эффективного и дорогостоящего импортного средства.
Вещества (4-6) вызывают агрегацию тромбоцитов в присутствии тромбина, причем средний радиус агрегатов существенно ниже, чем при использовании только одного тромбина. Эта характеристика агрегации тромбоцитов может оказаться полезной при использовании предлагаемых веществ при тромбининдуцированной окклюзии, создаваемой в лечебных целях. Кроме того, было установлено, что вещество 1 достоверно ингибирует запуск внутреннего пути свертывания крови (т.е. происходящего не в результате травмы сосуда, а при внутренних провоцирующих обстоятельствах) и снижает ферментативную активность тромбина.
Ниже приведены примеры, в которых описаны способы получения предлагаемых веществ, а также данные, подтверждающие заявленную активность и механизм действия.
Пример 1.
Получение 6-нитро-2-(1-пиперазинил)-хинолина, (1) [1].
Смесь 4.50 г (2.16 10-2 моль) 6-нитро-2-хлорхинолина и 5.58 г (6.48 10-2 моль) 6-нитро-2-хлорхинолина и 5.58 г (6.48 10-2 моль) пиперазина в 15 мл о-дихлорбензола нагревали 4.5 ч при 110oC под аргоном. Смесь охлаждали до комнатной температуры и фильтровали. Осадок растворяли в 100 мл 1 н. раствора HCl и фильтровали. Фильтрат подщелачивали 2 н. раствором NaOH и выпавший осадок отфильтровали, промывали водой до нейтрального pH. Вещество сушили в вакууме над КОН. Выход желтого кристаллического соединения (1) 4.56 г (81%). Т.пл. 193-194oC. RF 0.69 (хлороформ-метанол = 7:3 v/v; Al2O3). Масс-спектр (m/z): 258 [М]+.
Реакцию осуществляли по схеме 1. 10-2 моль) пиперазина в 15 мл о-дихлорбензола нагревали 4.5 ч при 110oC под аргоном. Смесь охлаждали до комнатной температуры и фильтровали. Осадок растворяли в 100 мл 1 н. раствора HCl и фильтровали. Фильтрат подщелачивали 2 н. раствором NaOH и выпавший осадок отфильтровали, промывали водой до нейтрального pH. Вещество сушили в вакууме над КОН. Выход желтого кристаллического соединения (1) 4.56 г (81%). Т.пл. 193-194oC. RF 0.69 (хлороформ-метанол = 7:3 v/v; Al2O3). Масс-спектр (m/z): 258 [М]+.
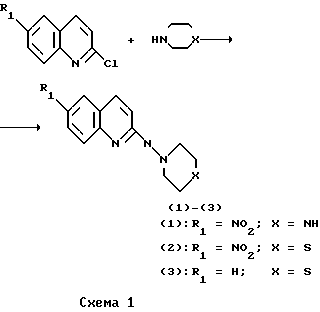
Реакцию осуществляли по схеме 1.
 Пример 2. Получение 6-нитро-2-тиоморфолинохинолина (2) [2]. Суспензию смеси 4.50 г (2.16  10-2 моль) 6-нитро-2-хлорхинолина и 6.00 мл (5.97 10-2 моль) 6-нитро-2-хлорхинолина и 6.00 мл (5.97 10-2 моль) тиоморфолина в 15 мл о-дихлорбензола нагревали при 110oC и перемешивании под аргоном в течение 4,5 ч. После охлаждения смесь фильтровали, осадок промывали по (30 мл х2): бензолом, гексаном, водой и эфиром. Сушили на воздухе и в вакууме над P2O5. Для полученного соединения RF 0.41 (толуол; Al2O3). Выход ярко-желтого кристаллического продукта (2) 5.01 г (84%). Т.пл. 205-207oC. ИК-спектр ( 10-2 моль) тиоморфолина в 15 мл о-дихлорбензола нагревали при 110oC и перемешивании под аргоном в течение 4,5 ч. После охлаждения смесь фильтровали, осадок промывали по (30 мл х2): бензолом, гексаном, водой и эфиром. Сушили на воздухе и в вакууме над P2O5. Для полученного соединения RF 0.41 (толуол; Al2O3). Выход ярко-желтого кристаллического продукта (2) 5.01 г (84%). Т.пл. 205-207oC. ИК-спектр ( max, см-1): 3100-2900, 1617, 1521, 1323, 1485, 1221, 1122, 744. Масс-спектр (m/z): 275 [M]+. Найдено, %: C 56.58; H 4.81; N 15.31. C13H13N3O2S. Вычислено, %: C 56.71; H 4.76; N 15.26.
Реакцию осуществляли по схеме 1.
Пример 3.
Получение 2-тиоморфолинохинолина (3) (2].
Смесь 1.64 г (1.00 max, см-1): 3100-2900, 1617, 1521, 1323, 1485, 1221, 1122, 744. Масс-спектр (m/z): 275 [M]+. Найдено, %: C 56.58; H 4.81; N 15.31. C13H13N3O2S. Вычислено, %: C 56.71; H 4.76; N 15.26.
Реакцию осуществляли по схеме 1.
Пример 3.
Получение 2-тиоморфолинохинолина (3) (2].
Смесь 1.64 г (1.00 10-2 моль) 2-хлорхинолина и 2.68 мл (2.66 10-2 моль) 2-хлорхинолина и 2.68 мл (2.66 10-2 моль) тиоморфолина в 10 мл сухого толуола кипятили в атмосфере аргона 8 ч и при комнатной температуре встряхивали с 30 мл 10% раствора соляной кислоты. Водный слой отделяли, промывали серным эфиром (20 мл х 3) и подщелачивали 30% раствором NaOH до pH 10-2 моль) тиоморфолина в 10 мл сухого толуола кипятили в атмосфере аргона 8 ч и при комнатной температуре встряхивали с 30 мл 10% раствора соляной кислоты. Водный слой отделяли, промывали серным эфиром (20 мл х 3) и подщелачивали 30% раствором NaOH до pH  9. Проводили экстракцию эфиром (20 мл х 4). Экстракт сушили Na2SO4, фильтровали и упаривали с 10 г Al2O3 для очистки на колонке (1.5 х 20 см), уравновешенной гексаном.
Элюент-бензол. Фракции с продуктом (3) собирали и упаривали в вакууме. Получено 1.24 г (54%) белого кристаллического вещества (3). Т.пл. 76-78oC, RF 0.27 (бензол-гексан = 1:1 v/v; Al2O3). Для исходного соединения (20) RF 0.47 (в тех же условиях). ИК-спектр ( 9. Проводили экстракцию эфиром (20 мл х 4). Экстракт сушили Na2SO4, фильтровали и упаривали с 10 г Al2O3 для очистки на колонке (1.5 х 20 см), уравновешенной гексаном.
Элюент-бензол. Фракции с продуктом (3) собирали и упаривали в вакууме. Получено 1.24 г (54%) белого кристаллического вещества (3). Т.пл. 76-78oC, RF 0.27 (бензол-гексан = 1:1 v/v; Al2O3). Для исходного соединения (20) RF 0.47 (в тех же условиях). ИК-спектр ( max, см-1): 3100-2850, 1607, 1525, 745. Масс-спектр (m/z): 230 [М] +. Найдено, %: C 67.58; H 6.20; N 12.16. C13H14N2S. Вычислено, %: C 67.79; H 6.13; N 12.16.
Реакцию осуществляли по схеме 1 max, см-1): 3100-2850, 1607, 1525, 745. Масс-спектр (m/z): 230 [М] +. Найдено, %: C 67.58; H 6.20; N 12.16. C13H14N2S. Вычислено, %: C 67.79; H 6.13; N 12.16.
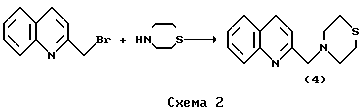
Реакцию осуществляли по схеме 1Пример 4. Получение  -тиоморфолинохинальдина (4) [2].
Смесь 1.14 г (5.20 -тиоморфолинохинальдина (4) [2].
Смесь 1.14 г (5.20 10-3) 10-3)  -бромхинальдина и 1.36 мл (1.36 -бромхинальдина и 1.36 мл (1.36 10-2 моль) тиоморфолина в 12 мл сухого толуола нагревали при 110oC в течение 6 ч в атмосфере аргона. Реакционную массу охлаждали и обрабатывали 40 мл 5% соляной кислоты. Водный слой отделяли, промывали бензолом (10 мл х 2) и подщелачивали 20% раствором NaOH до pH 9-10. Смесь экстрагировали хлороформом (10 мл х 2). Экстракт промывали водой (10 мл х 2) и сушили Na2SO4. Остаток, после отгонки растворителя, хроматографировали на колонке (2.5 х 42 см) с силикагелем, уравновешенной четыреххлористым углеродом. Элюент – хлороформ. Собирали и упаривали в вакууме фракцию с RF 0.16 (хлороформ; силикагель). Выход вязкого маслообразного продукта (4) 0.96 г (77%). ИК-спектр ( 10-2 моль) тиоморфолина в 12 мл сухого толуола нагревали при 110oC в течение 6 ч в атмосфере аргона. Реакционную массу охлаждали и обрабатывали 40 мл 5% соляной кислоты. Водный слой отделяли, промывали бензолом (10 мл х 2) и подщелачивали 20% раствором NaOH до pH 9-10. Смесь экстрагировали хлороформом (10 мл х 2). Экстракт промывали водой (10 мл х 2) и сушили Na2SO4. Остаток, после отгонки растворителя, хроматографировали на колонке (2.5 х 42 см) с силикагелем, уравновешенной четыреххлористым углеродом. Элюент – хлороформ. Собирали и упаривали в вакууме фракцию с RF 0.16 (хлороформ; силикагель). Выход вязкого маслообразного продукта (4) 0.96 г (77%). ИК-спектр ( max, см-1): 3060-2840, 1617, 1602, 1503, 1224, 1125, 741. Масс-спектр (m/z): 244 [М]+. Найдено, % C 69.02; H 6.68; N 11.39. C14H16N2S. Вычислено, %: C 68.81; H 6.60; N 11.46. Реакцию осуществляли по схеме 2. max, см-1): 3060-2840, 1617, 1602, 1503, 1224, 1125, 741. Масс-спектр (m/z): 244 [М]+. Найдено, % C 69.02; H 6.68; N 11.39. C14H16N2S. Вычислено, %: C 68.81; H 6.60; N 11.46. Реакцию осуществляли по схеме 2.
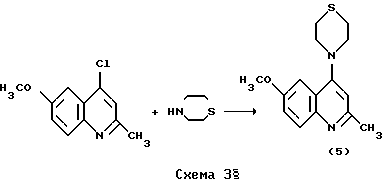
 Пример 5. Получение 2-метил-6-метокси-4-тиоморфолинохинолина (5) 12]. Смесь 2.08 г (1.00  10-2 моль) 2-метил-4-хлор-6-метоксихинолина и 2.52 мл (2.50 10-2 моль) 2-метил-4-хлор-6-метоксихинолина и 2.52 мл (2.50 10-2 моль) тиоморфолина в 20 мл сухого о-ксилола нагревали при 125-130oC в атмосфере аргона в течение 7 ч. Реакционную массу охлаждали до комнатной температуры и добавляли при перемешивании 40 мл 5% соляной кислоты. Водный слой отделяли, промывали бензолом (10 мл х 2) и подщелачивали 10% раствором NaOH до pH 9-10. Выпавший осадок отфильтровывали, промывали водой и сушили в вакууме над P2O5. Продукт реакции (5) перекристаллизовывали из смеси бензол-этанол. Выход 2.06 г (75%). Т.пл. 116-117oC. ИК-спектр ( 10-2 моль) тиоморфолина в 20 мл сухого о-ксилола нагревали при 125-130oC в атмосфере аргона в течение 7 ч. Реакционную массу охлаждали до комнатной температуры и добавляли при перемешивании 40 мл 5% соляной кислоты. Водный слой отделяли, промывали бензолом (10 мл х 2) и подщелачивали 10% раствором NaOH до pH 9-10. Выпавший осадок отфильтровывали, промывали водой и сушили в вакууме над P2O5. Продукт реакции (5) перекристаллизовывали из смеси бензол-этанол. Выход 2.06 г (75%). Т.пл. 116-117oC. ИК-спектр ( max, см-1) : 3050-2800, 1589, 1477, 1277, 1207, 1220, 1030, 720. Масс-спектр (m/z): 275 [М]+. Найдено, %: C 65.78; H 6.58; N 10.17. C15H18N2OS. Вычислено, %: C 65.66; H 6.61; N 10.21.
Реакцию осуществляли по схеме 3. max, см-1) : 3050-2800, 1589, 1477, 1277, 1207, 1220, 1030, 720. Масс-спектр (m/z): 275 [М]+. Найдено, %: C 65.78; H 6.58; N 10.17. C15H18N2OS. Вычислено, %: C 65.66; H 6.61; N 10.21.
Реакцию осуществляли по схеме 3.
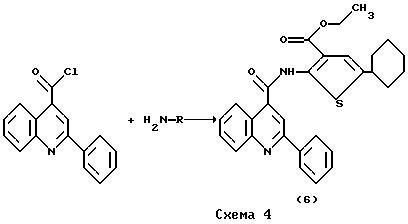
 Пример 6. Получение 2-фенил-4-(3-этоксикарбонил-4,5,6,7-тетрагидробензо[b] тиенил)амидохинолина (6). К раствору соответствующего хинолина в 5 мл пиридина и 10 мл 1,4-диоксина добавляли при перемешивании и охлаждении (15oC) в течение 30 мин раствор ангидрида в 20 мл 1,4-диоксана. Реакционную массу кипятили 1 ч, охлаждали и выливали в 500 мл воды. Выпавший осадок отфильтровывали, промывали водой (2 х 50 мл), 25 мл аммиачной воды (25%) и перекристаллизовывали. Из 2.68 г (1.00  10-2 моль) хлорангидрида цинхоиновой кислоты и 2.24 г (9.94 10-2 моль) хлорангидрида цинхоиновой кислоты и 2.24 г (9.94 10-3 моль) 2-амино-3-карбэтокситетрагидробензо[b] тиофена после перекристаллизации из 1,4-диоксана получали 2.56 г (56%) продукта. Т.пл. 164-165oC. Найдено, %: C 69.83; H 5.27; N 6.12. C27H24N2O3S. Вычислено, %: C 71.03; H 5.30; N 6.14. Реакцию осуществляли по схеме 4. 10-3 моль) 2-амино-3-карбэтокситетрагидробензо[b] тиофена после перекристаллизации из 1,4-диоксана получали 2.56 г (56%) продукта. Т.пл. 164-165oC. Найдено, %: C 69.83; H 5.27; N 6.12. C27H24N2O3S. Вычислено, %: C 71.03; H 5.30; N 6.14. Реакцию осуществляли по схеме 4.
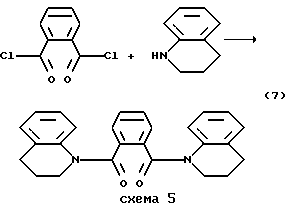
 Пример 7. Получение фталоил-1,1-бис(1,2,3,4-тетрагидрохинолина) (7). Соединение (7) получено в условиях синтеза (6) из 2.04 г (1.00  10-2 моль) дихлорангидрида фталевой кислоты и 1.33 г (9,99 10-2 моль) дихлорангидрида фталевой кислоты и 1.33 г (9,99 10-3 моль) 1,2,3,4-тетрагидрохинолина, после перекристаллизации из ацетона получили 3.25 г (82%) продукта (7). Т.пл. 175-176oC. Найдено, %: C 78.76; H 6.10; N 7.07. C26H24N2O2. Вычислено, %: C 78.76; H 6.10; N.7.07. Реакцию осуществляли по схеме 5. 10-3 моль) 1,2,3,4-тетрагидрохинолина, после перекристаллизации из ацетона получили 3.25 г (82%) продукта (7). Т.пл. 175-176oC. Найдено, %: C 78.76; H 6.10; N 7.07. C26H24N2O2. Вычислено, %: C 78.76; H 6.10; N.7.07. Реакцию осуществляли по схеме 5.
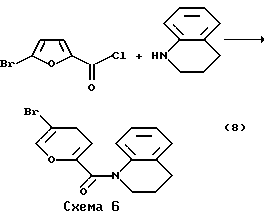
 Пример 8. Получение 1-(5-бромфуроил-2)-1,2,3,4-тетрагидрохинолина (8). Соединение (8) получено в условиях синтеза (6) из 1.94 г (9.26  10-3 моль) хлорангидрида 5-бромфуран-2-карбоновой кислоты и 1.33 г (9.99 10-3 моль) хлорангидрида 5-бромфуран-2-карбоновой кислоты и 1.33 г (9.99 10-3 моль) тетрагидрохинолина, после перекристаллизации из смеси ацетон-метанол получили 2.32 г (80%) продукта (8). Т.пл. 101oC. ИК-спектр, ( 10-3 моль) тетрагидрохинолина, после перекристаллизации из смеси ацетон-метанол получили 2.32 г (80%) продукта (8). Т.пл. 101oC. ИК-спектр, ( max, см-1): 1700 (C = О). Найдено, %: 57.96; H 4.31, N 4.96. C14H12BrNO2. Вычислено, %: C 54.92; H 3.95; N 4.58. Реакцию осуществляли на схеме 6. max, см-1): 1700 (C = О). Найдено, %: 57.96; H 4.31, N 4.96. C14H12BrNO2. Вычислено, %: C 54.92; H 3.95; N 4.58. Реакцию осуществляли на схеме 6.
 Пример 9. Биологические испытания веществ. Определение агрегационной и противоагрегационной активности веществ проводилось по методике Борна/О’Браена [3], основанной на явлении увеличения светопропускания образца при индуцированном образовании агрегатов, регистрируемого турбидиметрическим методом. Действующая концентрация субстанций равнялась 10 мкМ. Для сравнения со стандартом приведены данные испытания гирудина, фирма “Sigma” в концентрации 5 ЕД/мл. Агрегация индуцировалась тромбином в концентрации 5 ЕД/мл. Результаты эксперимента с наиболее активными соединениями приведены в табл. 1. В качестве параметров агрегации использовались: ингибирование агрегации (%), показатель агрегации (условные единицы), максимальный средний радиус агрегатов (относительные единицы). Из результатов таблицы видно, что вещества (под порядковыми номерами 1, 2, 3, 7, 8) обладают выраженной фармацевтической активностью, а вещество 2 – на уровне гирудина. Вещества (4, 5, 6) вызывают обратный эффект, обладают противоположной фармацевтической активностью, при этом размер агрегатов почти в 2 раза меньше, чем при использовании только одного тромбина. Для выяснения механизма активации системы гемостаза было изучено действие патентуемых веществ на тромбининдуцированную пролифирацию клеток BSMC. В экспериментах по методу Мосманн [4] на культурах клеток MCF-7, HeLa, BSMC было обнаружено отсутствие выраженного токсического эффекта субстанций (IC50 200 м.М); данные сведены в табл. 2. Как видно из табл. 2 испытанные вещества (1-4, 8) оказывают влияние на индуцированную тромбином пролифирацию гладкомышечных клеток, из чего можно заключить, что коагуляционная и антикоагуляционная активность этих веществ связана с их влиянием на функционирование тромбиновых рецепторов. Все средства показывают выраженную биологическую активность, а одно из них на уровне гирудина – одного из наиболее активных и дорогих импортных лекарственных средств. Оригинальность (качество) средств заключается в том, что достоверно установлено, что коагуляционная и антикоагуляционная активность этих веществ связана с их влиянием на функционирование системы тромбин-тромбиновый рецептор. Литература Формула изобретения
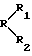 где R – хинолин, R1 – 2-фенил, R2 – 4-(3-этоксикарбонил-4,5,6,7-тетрагидробензо[в]тиенил, где R – 1,2,3,4-тетрагидрохинолин, R1 – 1-фталоил или 1-(5-бромфуроил-2), R2 – Н. 2. Фармацевтическая композиция для коррекции системы гемостаза, содержащая приемлемый наполнитель и действующее начало, отличающаяся тем, что в качестве последнего она содержит производное хинолина, выбранное из группы: 6-нитро-2-(1-пиперазинил)-хинолин, 6-нитро-2-тиоморфолинохинолин, 2-тиоморфолинохинолин,  -тиоморфолинохинальдин, 2-метил-6-метокси-4-тиоморфолинохинолин, 2-фенил-4-(3-этоксикарбонил-4,5,6,7-тетрагидробензо[в]тиенил)амидохинолин, фталоил-1,1-бис(1,2,3,4-тетрагидрохинолин), 1-(5-бромфуроил-2)-1,2,3,4-тетрагидрохинолин.
3. Фармацевтическая композиция по п.2, отличающаяся тем, что она содержит действующее начало в концентрации 1 мг/л (10 мкМ).
4. Применение производных хинолина, выбранных из группы 6-нитро-2-(1-пиперазинил)-хинолин, 6-нитро-2-тиоморфолинохинолин, 2-тиоморфолинохинолин, -тиоморфолинохинальдин, 2-метил-6-метокси-4-тиоморфолинохинолин, 2-фенил-4-(3-этоксикарбонил-4,5,6,7-тетрагидробензо[в]тиенил)амидохинолин, фталоил-1,1-бис(1,2,3,4-тетрагидрохинолин), 1-(5-бромфуроил-2)-1,2,3,4-тетрагидрохинолин.
3. Фармацевтическая композиция по п.2, отличающаяся тем, что она содержит действующее начало в концентрации 1 мг/л (10 мкМ).
4. Применение производных хинолина, выбранных из группы 6-нитро-2-(1-пиперазинил)-хинолин, 6-нитро-2-тиоморфолинохинолин, 2-тиоморфолинохинолин,  -тиоморфолинохинальдин, 2-метил-6-метокси-4-тиоморфолинохинолин в качестве средства для коррекции гемостаза. -тиоморфолинохинальдин, 2-метил-6-метокси-4-тиоморфолинохинолин в качестве средства для коррекции гемостаза.
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 25.10.2002
Номер и год публикации бюллетеня: 13-2004
Извещение опубликовано: 10.05.2004
|
||||||||||||||||||||||||||
