Патент на изобретение №2177191
|
||||||||||||||||||||||||||
(54) СПОСОБ ИЗГОТОВЛЕНИЯ СВИНЦОВО-КИСЛОТНОГО АККУМУЛЯТОРА
(57) Реферат: Изобретение относится к электротехнике, а в частности к производству свинцовых аккумуляторов. В предложенном способе положительные и отрицательные пластины намазывают электродной пастой, приготовленной из окисленного свинцового порошка и раствора серной кислоты. В отличие от существующих технических решений пластины перед сушкой пропитывают некоторое время в растворе гидроксида щелочного металла. Высушенные электродные пластины формируют в сернокислом электролите в формировочных баках или в готовых аккумуляторных батареях. Техническим результатом является обеспечение возможности формирования электродных пластин аккумулятора без газовыделения. При этом время формирования и затраты электрической энергии сокращаются в 1,5-2 раза. Активный материал пластин обоих знаков получается более качественным, без вздутий на отрицательных пластинах и без сульфатных пятен на положительных и не выкрашивается при изготовлении и эксплуатации. 6 ил. Изобретение относится к электротехнической промышленности и может быть использовано в производстве свинцово-кислотных аккумуляторов. В настоящее время свинцовые аккумуляторы изготовляют, используя порошковую технологию, которая осуществляется различными способами. Одним из них является способ, заявленный 31.05.88 г JP 88.134226 в Японии. Активный материал положительного электрода, изготовленного по этому способу, характеризуется высокой пористостью более 60% и преимущественным содержанием тетрагональной модификации двуокиси свинца  -PbO2, содержание которой колеблется от 50 до 80 процентов. Сущность его заключается в совокупности следующих действий. Токоведущую основу пластины заполняют оксидом свинца PbO, погружают в раствор пироксодисульфата аммония. В результате происходит превращение PbO в ромбическую модификацию -PbO2, содержание которой колеблется от 50 до 80 процентов. Сущность его заключается в совокупности следующих действий. Токоведущую основу пластины заполняют оксидом свинца PbO, погружают в раствор пироксодисульфата аммония. В результате происходит превращение PbO в ромбическую модификацию  -PbO2. Затем пластину погружают в раствор серной кислоты H2SO4, и непрореагирующая окись PbO превращается в сульфат свинца. После проводят обжиг пластины, в результате которого образуется моносульфат свинца. В процессе последующего формирования происходит превращение сульфата свинца в -PbO2. Затем пластину погружают в раствор серной кислоты H2SO4, и непрореагирующая окись PbO превращается в сульфат свинца. После проводят обжиг пластины, в результате которого образуется моносульфат свинца. В процессе последующего формирования происходит превращение сульфата свинца в  -PbO2 и моносульфата в -PbO2 и моносульфата в  -PbO2 и -PbO2 и  -PbO2.
Наиболее близким к предлагаемому по технической сущности и достигаемому результату является известный способ изготовления свинцового аккумулятора, при котором положительные и отрицательные пластины намазывают электродной пастой, приготовленной из окисленного свинцового порошка и раствора серной кислоты, сушат, после чего формируют в растворе серной кислоты в формировочных баках или готовых аккумуляторных батареях. При этом аккумуляторы, отформированные батарейно, отправляются к потребителю в залитом состоянии, а из пластин, отформированных в баках и высушенных, собирают аккумуляторы в сухозаряженном исполнении (Дасоян М.А. и др. Производство электрических аккумуляторов. Учеб. пособие. Изд. 3-е, перераб. и доп. М., “Высшая школа”, 1977).
Самым существенным недостатком этих способов являются чрезмерные затраты электрической энергии при формировании. И удлинение формировочного процесса, сильный разогрев электролита и обильное газовыделение, так называемый кислотный туман, наносящий ущерб здоровью обслуживающего персонала, оборудованию и строительным конструкциям. Кроме того, в результате газовыделения на отрицательных электродных пластинах наблюдаются вздутия, а активная масса положительных пластин получается рыхлой, слабосвязанной с токоотводом, что приводит к выкрашиванию при изготовлении и оплыванию при эксплуатации активного материала.
Причина проявления этих недостатков обосновывается следующими соображениями.
Вмазанная в токоотводы электродная паста имеет неоднородный состав и различную кислотность. На участках с щелочным характером пасты при формировании происходит гидролиз PbO + H2O —> Pb2+ + 2OH– с последующим участием, полученных ионов в электрохимических процессах. Кислотные же участки подвергаются в основном дальнейшей сульфатации, в результате чего образуются сульфатные пятна. Поэтому электродные пластины формируются крайне неравномерно – очагами. Для обеспечения равномерности процесса по всей поверхности пластины предварительно перед формированием выдерживают в электролите, тем самым экранируя их сульфатной пленкой. Истинная поверхность, которая может участвовать в основном процессе, становится слишком малой, электроды сильно поляризуются. И газовыделение на положительной пластине начинается практически сразу же после включения электрического тока, так как при этом реализуется потенциал выделения кислорода. В начале скорость процесса -PbO2.
Наиболее близким к предлагаемому по технической сущности и достигаемому результату является известный способ изготовления свинцового аккумулятора, при котором положительные и отрицательные пластины намазывают электродной пастой, приготовленной из окисленного свинцового порошка и раствора серной кислоты, сушат, после чего формируют в растворе серной кислоты в формировочных баках или готовых аккумуляторных батареях. При этом аккумуляторы, отформированные батарейно, отправляются к потребителю в залитом состоянии, а из пластин, отформированных в баках и высушенных, собирают аккумуляторы в сухозаряженном исполнении (Дасоян М.А. и др. Производство электрических аккумуляторов. Учеб. пособие. Изд. 3-е, перераб. и доп. М., “Высшая школа”, 1977).
Самым существенным недостатком этих способов являются чрезмерные затраты электрической энергии при формировании. И удлинение формировочного процесса, сильный разогрев электролита и обильное газовыделение, так называемый кислотный туман, наносящий ущерб здоровью обслуживающего персонала, оборудованию и строительным конструкциям. Кроме того, в результате газовыделения на отрицательных электродных пластинах наблюдаются вздутия, а активная масса положительных пластин получается рыхлой, слабосвязанной с токоотводом, что приводит к выкрашиванию при изготовлении и оплыванию при эксплуатации активного материала.
Причина проявления этих недостатков обосновывается следующими соображениями.
Вмазанная в токоотводы электродная паста имеет неоднородный состав и различную кислотность. На участках с щелочным характером пасты при формировании происходит гидролиз PbO + H2O —> Pb2+ + 2OH– с последующим участием, полученных ионов в электрохимических процессах. Кислотные же участки подвергаются в основном дальнейшей сульфатации, в результате чего образуются сульфатные пятна. Поэтому электродные пластины формируются крайне неравномерно – очагами. Для обеспечения равномерности процесса по всей поверхности пластины предварительно перед формированием выдерживают в электролите, тем самым экранируя их сульфатной пленкой. Истинная поверхность, которая может участвовать в основном процессе, становится слишком малой, электроды сильно поляризуются. И газовыделение на положительной пластине начинается практически сразу же после включения электрического тока, так как при этом реализуется потенциал выделения кислорода. В начале скорость процесса 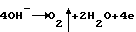 мала, так как активно протекает основной электрохимический процесс образования двуокиси свинца Pb2+–> Pb4+—> PbO2. По мере истощения в зоне реакции запасов ионов Pb2+ скорость побочного процесса возрастает, и коэффициент использования тока падает. Во многом расход ионов Pb2+ связан не с основным процессом, а с химическим взаимодействием Pb2++SO4 2-—>PbSO4, потому как сульфат-ионы движутся во время электродной реализации от отрицательной к положительной пластине, и концентрация их у первой в 1,4 раза выше, чем у последней. Сквозные сульфатные пятна трудно поддаются формированию, и выход по току положительной пластины обычно не превышает 80 процентов.
Из-за высокого перенапряжения выделения водорода при всех возможных реакциях, происходящих на формируемой отрицательной пластине, газ не выделяется. В данном случае электрод получается со стопроцентным выходом по току. Но двадцатипроцентная разница в готовности положительного и отрицательного электродов при дальнейшем совместном формировании вынуждает смещать в отрицательную сторону потенциал полностью сформированной отрицательной пластины до тех пор, пока не начнет выделяться водород. Разность потенциалов на разноименных пластинах достигает величины 2,6-2,8 В. Газовыделение увеличивается в 100-150 раз по сравнению с первоначальной стадией. Почти весь ток при этом расходуется на разложение воды на кислород и водород мала, так как активно протекает основной электрохимический процесс образования двуокиси свинца Pb2+–> Pb4+—> PbO2. По мере истощения в зоне реакции запасов ионов Pb2+ скорость побочного процесса возрастает, и коэффициент использования тока падает. Во многом расход ионов Pb2+ связан не с основным процессом, а с химическим взаимодействием Pb2++SO4 2-—>PbSO4, потому как сульфат-ионы движутся во время электродной реализации от отрицательной к положительной пластине, и концентрация их у первой в 1,4 раза выше, чем у последней. Сквозные сульфатные пятна трудно поддаются формированию, и выход по току положительной пластины обычно не превышает 80 процентов.
Из-за высокого перенапряжения выделения водорода при всех возможных реакциях, происходящих на формируемой отрицательной пластине, газ не выделяется. В данном случае электрод получается со стопроцентным выходом по току. Но двадцатипроцентная разница в готовности положительного и отрицательного электродов при дальнейшем совместном формировании вынуждает смещать в отрицательную сторону потенциал полностью сформированной отрицательной пластины до тех пор, пока не начнет выделяться водород. Разность потенциалов на разноименных пластинах достигает величины 2,6-2,8 В. Газовыделение увеличивается в 100-150 раз по сравнению с первоначальной стадией. Почти весь ток при этом расходуется на разложение воды на кислород и водород 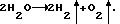 В итоге такой технологии формирования выход по энергии не превышает 50%, а время формирования практически удваивается, структура активного материала пластин обоих знаков проигрывает в качестве материалам, полученным без газовыделения.
Заявляемое изобретение направлено на устранение вышеперечисленных недостатков. Задача решается следующим образом. Положительные и отрицательные пластины намазывают электродной пастой, приготовленной в специальном смесителе из окисленного свинцового порошка и раствора серной кислоты.
В отличие от прототипа и других способов свеженамазанные электродные пластины пропитывают в растворе гидроксида щелочного металла (NaOH или КОН). Затем сушат в электрическом или газовом сушиле и досушивают при комнатной температуре. После чего пластины формируют в сернокислом электролите в формировочных баках или готовых аккумуляторных батареях.
Целесообразность применения щелочных растворов для пропитки электродных пластин трактуется нижеизложенным текстом.
При пропитке электродной пасты пластин гидроокисью щелочного металла сульфат-ионы образуют растворимые соли Na2SO4 или K2SO4. А ионы свинца соединяются с гидроксил-ионами, образуя на поверхности пластин гидроксид свинца Pb(OH)2. Такие пластины не имеют на своей поверхности кислотных участков.
Поэтому гидролиз происходит по всей поверхности. Из-за присутствия в электродной пасте значительного количества гидроксида свинца Pb(OH)2 приэлектродный слой электролита в начальный период формирования имеет водородный показатель pH > 7; потенциалы обоих электродов смещаются в отрицательную сторону. На положительной пластине в щелочной среде идет интенсивное образование двуокиси свинца обеих модификаций В итоге такой технологии формирования выход по энергии не превышает 50%, а время формирования практически удваивается, структура активного материала пластин обоих знаков проигрывает в качестве материалам, полученным без газовыделения.
Заявляемое изобретение направлено на устранение вышеперечисленных недостатков. Задача решается следующим образом. Положительные и отрицательные пластины намазывают электродной пастой, приготовленной в специальном смесителе из окисленного свинцового порошка и раствора серной кислоты.
В отличие от прототипа и других способов свеженамазанные электродные пластины пропитывают в растворе гидроксида щелочного металла (NaOH или КОН). Затем сушат в электрическом или газовом сушиле и досушивают при комнатной температуре. После чего пластины формируют в сернокислом электролите в формировочных баках или готовых аккумуляторных батареях.
Целесообразность применения щелочных растворов для пропитки электродных пластин трактуется нижеизложенным текстом.
При пропитке электродной пасты пластин гидроокисью щелочного металла сульфат-ионы образуют растворимые соли Na2SO4 или K2SO4. А ионы свинца соединяются с гидроксил-ионами, образуя на поверхности пластин гидроксид свинца Pb(OH)2. Такие пластины не имеют на своей поверхности кислотных участков.
Поэтому гидролиз происходит по всей поверхности. Из-за присутствия в электродной пасте значительного количества гидроксида свинца Pb(OH)2 приэлектродный слой электролита в начальный период формирования имеет водородный показатель pH > 7; потенциалы обоих электродов смещаются в отрицательную сторону. На положительной пластине в щелочной среде идет интенсивное образование двуокиси свинца обеих модификаций  -PbO2, -PbO2,  -PbO2 по реакциям Pb2+—>PbO2 и 3PbO -PbO2 по реакциям Pb2+—>PbO2 и 3PbO PbSO4 PbSO4 H2O—>PbO2, а также образование промежуточных окислов непосредственно из трехосновного сульфата свинца 3PbO H2O—>PbO2, а также образование промежуточных окислов непосредственно из трехосновного сульфата свинца 3PbO  PbSO4 PbSO4  H2O —> Pb2O3, 3PbO H2O —> Pb2O3, 3PbO  PbSO4 PbSO4  H2O —> Pb3O4. В результате этого полученные компоненты образуют в пластине своеобразный каркас, хорошо проводящий электрический ток, и поляризация по всей поверхности происходит равномерно. На отрицательной пластине, напротив, имеющие место в кислой среде реакции PbO —>Pb, 3PbO H2O —> Pb3O4. В результате этого полученные компоненты образуют в пластине своеобразный каркас, хорошо проводящий электрический ток, и поляризация по всей поверхности происходит равномерно. На отрицательной пластине, напротив, имеющие место в кислой среде реакции PbO —>Pb, 3PbO  PbSO4 PbSO4  H2O —> Pb в данном случае отсутствуют, а процесс восстановления свинца идет из ионов, находящихся в растворе Pb2+ + 2e —> Pb. Замена на отрицательной пластине реагирующих по очереди исходных компонентов электродной пасты PbO и 3PbO H2O —> Pb в данном случае отсутствуют, а процесс восстановления свинца идет из ионов, находящихся в растворе Pb2+ + 2e —> Pb. Замена на отрицательной пластине реагирующих по очереди исходных компонентов электродной пасты PbO и 3PbO  PbSO4 PbSO4  H2O на ионы, полученные путем гидролиза и растворения гидроксида свинца в серной кислоте, также обеспечивает равномерное формирование и отрицательной пластины.
В отличие от малорастворимой соли PbSO4 гидроксид свинца Pb(OH)2 прекрасно растворяется в серной кислоте, так как гидроксил-ион, посылаемый щелочью в раствор, образует с ионом водорода кислоты малодиссоциированную воду Pb(OH)2 + 2H+ —> Pb2+ + 2H2O. Вследствие этого гидроокись будет растворяться до тех пор, пока произведение концентраций ее ионов снова не сделается равным произведению растворимости. Процесс идет до конца. Раствор оказывается пересыщенным ионами свинца Pb2+, которые интенсивно вступают в электрохимическое взаимодействие. Процесс растворения гидроокиси свинца происходит самопроизвольно, что, естественно, приводит к снижению потенциалов поляризуемых электродов. Исключительное значение представляет снижение перенапряжения образования PbO2 на диоксидно-свинцовом электроде. Если потенциал формируемой положительной пластины во время всего цикла будет меньше потенциала точки нулевого заряда, величина которого для PbO2 в зависимости от концентрации раствора H2SO4 лежит в пределах от 1,7 В для крепких и 1,9 В для сильно разбавленных растворов по водородной шкале, то поверхность электрода будет иметь отрицательный заряд по отношению к ионам ОН–. Тем самым гидроксил-ионы не смогут адсорбироваться и разряжаться на этой поверхности, то есть процесс H2O на ионы, полученные путем гидролиза и растворения гидроксида свинца в серной кислоте, также обеспечивает равномерное формирование и отрицательной пластины.
В отличие от малорастворимой соли PbSO4 гидроксид свинца Pb(OH)2 прекрасно растворяется в серной кислоте, так как гидроксил-ион, посылаемый щелочью в раствор, образует с ионом водорода кислоты малодиссоциированную воду Pb(OH)2 + 2H+ —> Pb2+ + 2H2O. Вследствие этого гидроокись будет растворяться до тех пор, пока произведение концентраций ее ионов снова не сделается равным произведению растворимости. Процесс идет до конца. Раствор оказывается пересыщенным ионами свинца Pb2+, которые интенсивно вступают в электрохимическое взаимодействие. Процесс растворения гидроокиси свинца происходит самопроизвольно, что, естественно, приводит к снижению потенциалов поляризуемых электродов. Исключительное значение представляет снижение перенапряжения образования PbO2 на диоксидно-свинцовом электроде. Если потенциал формируемой положительной пластины во время всего цикла будет меньше потенциала точки нулевого заряда, величина которого для PbO2 в зависимости от концентрации раствора H2SO4 лежит в пределах от 1,7 В для крепких и 1,9 В для сильно разбавленных растворов по водородной шкале, то поверхность электрода будет иметь отрицательный заряд по отношению к ионам ОН–. Тем самым гидроксил-ионы не смогут адсорбироваться и разряжаться на этой поверхности, то есть процесс 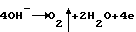 станет невозможным, что приведет к стопроцентному выходу по току положительной пластины.
Величину изменения перенапряжения на каждом из электродов определим, рассмотрев термодинамику формировочного процесса, в частности, найдя приращения свободной энергии Гиббса, полученные в результате взаимодействия гидроксида свинца с серной кислотой в процессе формирования.
Согласно теории двойной сульфатации в свинцовом аккумуляторе на электродах во время заряда происходят следующие реакции: станет невозможным, что приведет к стопроцентному выходу по току положительной пластины.
Величину изменения перенапряжения на каждом из электродов определим, рассмотрев термодинамику формировочного процесса, в частности, найдя приращения свободной энергии Гиббса, полученные в результате взаимодействия гидроксида свинца с серной кислотой в процессе формирования.
Согласно теории двойной сульфатации в свинцовом аккумуляторе на электродах во время заряда происходят следующие реакции:на отрицательном свинцово-сульфатном PbSO4 + H+ + 2e —> Pb + H2O, на положительном свинцово-диоксидном PbSO4 + 2H2O —> PbO2 + HSO4 – + 3H+ + 2e. И суммарная, определяющая основной зарядный процесс 2PbSO4 + 2H2O —> Pb + PbO2 + 2H2SO4. Наличие гидроокиси свинца в электродной пасте усложняет процессы ионизации на этих электродах. Потому что исходным веществом при получении продуктов Pb и PbO2 вместо PbSO4 становится Pb(OH)2. При постоянном давлении и температуре P, T= const. Свободная энергия Гиббса не зависит от формы пути. Поэтому переход от Pb(OH)2 к PbO2 и от Pb(OH)2 к Pb осуществим по соответствующим схемам: 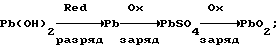 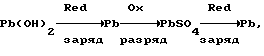 которым соответствуют уравнения в полной форме: на положительном электроде 1. Pb +2H2O —> Pb(OH)2 +2H+ + 2e; 2. Pb + HSO4 – —> PbSO4 + H+ + 2e; 3. PbSO4 + 2H2O —> PbO2 + HSO4 – + 3H+ + 2e и на отрицательном 1. Pb(OH)2 + 2H+ + 2e —> Pb + 2H2O; 2. PbSO4 + H+ + 2e —> Pb + HSO4 –; 3. PbSO4 + H+ + 2e —> Pb + HSO4 –. Если просуммировать первые три уравнения, отражающих анодный процесс, с тремя другими катодного процесса, получим уравнение основного зарядного процесса. Далее осуществим процесс на электродах раздельно. Для этого при формировании положительного электрода в качестве катода используем свинцово-диоксидный электрод, а в качестве анода во втором случае свинцово-сульфатный электрод. То есть проведем электролиз в электрохимических ячейках (+) Pb(OH)2 |H2SO4| PbO2 (-); (-) Pb(OH)2 |H2SO4| Pb (+). При электролизе в этих ячейках будут протекать реакции: в первой 1. Pb + 2H2O —> Pb(OH)2 + 2H+ + 2e; 2. Pb + HSO4 – —> PbSO4 + H+ + 2e; 3. PbSO4 + 2H2O —> PbO2 + HSO4 – + 3H+ + 2e; 4. PbO2 + HSO4 – + 3H+ + 2e —> PbSO4 + 2H2O; во второй 1. Pb(OH)2 + 2H+ + 2e —> Pb + 2H2O; 2. PbSO4 + H+ + 2e —> Pb + HSO4 –; 3. PbSO4 + H+ + 2e —> Pb + HSO4 –; 4. Pb + HSO4 – —> PbSO4 + H+ + 2e. Суммирование уравнений, происходящих в каждой ячейке, показывает, что приращение свободной энергии Гиббса, связанное с применением Pb(OH)2, определяется первыми двумя уравнениями и имеет разное по знаку, но одно и то же абсолютное значение. Нетрудно также видеть, что если соединить последовательно данные электрохимические ячейки, то напряжение этой системы будет равным нулю. Естественно, равным нулю будет и ток. А это означает, что, измерив непосредственно напряжение на каждом из элементов, определим электродвижущие силы (ЭДС), то есть по существу измерим величину перенапряжений на формируемых положительном и отрицательном электродах. Так, например, ЭДС каждой из ячеек, составленных из свеженамазанных пластин попарно со свинцово- диоксидным и свинцово-сульфатным электродами, соединенных последовательно в одномолярном растворе H2SO4 m=1 и комнатной температуре, составляет 0,1 В в первой и -0,1 В во второй. Такой же результат получается при теоретическом определении ЭДС. Для чего уравнения первой ячейки просуммируем в таком порядке: первое с четвертым, второе с третьим. 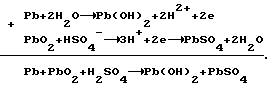 Сумму третьего и второго: 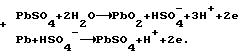 представим в виде разности 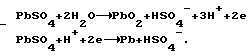 Так как сумма последних уравнений представляет собой зарядный процесс свинцового аккумулятора и совпадает с зарядным уравнением системы последовательно соединенных элементов (+)PbO2|H2SO4)H2(-); (+)H2|H2SO4|Pb(-), составленных попарно из водородного электрода со свинцово-диоксидным и свинцово-сульфатным, то разность этих уравнений, очевидно, равна разности зарядных уравнений указанных элементов 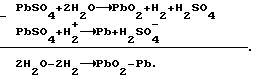 Итак, сумма третьего и второго уравнений эквивалентна уравнению 2H2O – 2H2 —> PbO2 – Pb. Сложив его с суммой первого и четвертого, получим 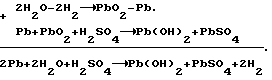 Определим изменение свободной энергии Гиббса по этому уравнению, используя стандартные значения термодинамических характеристик 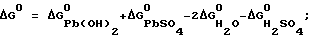  G0 = -100,6 – 193,89 + 2(56,69) + 177,34 = -3,77 ккал/моль.
Так как максимальная работа A процесса равна взятому с обратным знаком изменению свободной энергии G0 = -100,6 – 193,89 + 2(56,69) + 177,34 = -3,77 ккал/моль.
Так как максимальная работа A процесса равна взятому с обратным знаком изменению свободной энергииA=zFEo =-AGo, где Eo – стандартная ЭДС, F – константа Фарадея, Z – число электронов, участвующих в реакции. Тогда Eo = 3,77/(2  23,06) = 0,0817 В.
ЭДС первой ячейки в сернокислом растворе с концентрацией m=1: 23,06) = 0,0817 В.
ЭДС первой ячейки в сернокислом растворе с концентрацией m=1: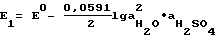 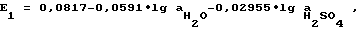 активность воды и серной кислоты в данном растворе равны приблизительно 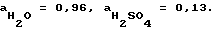 E1 = 0,0817 + 0,0010 + 0,0262 = 0,1089 и E2 = -0,1089. Совпадение теоретических и экспериментальных значений ЭДС подтверждает ключевую роль Pb(OH)2 в снижении перенапряжения на положительном и повышении на отрицательном формируемых электродах. Сравнительные замеры потенциалов пропитанных в щелочи с непропитанными пластинами под током во время формирования показывают, что разница в 0,1 В сохраняется в течение всего процесса, в то же время химический анализ свеженамазанных пластин, в которых обнаружено следующее процентное содержание соединений PbO – 86%, PbSO4 – 13% для обычных и PbO – 86%, PbSO4 – 8% для пропитанных щелочью электродов показывает, что Pb(OH)2 в электродной пасте не превышает пяти процентов. Но данное количество позволяет сохранить процесс гидролиза электродной пасты в течение всего формировочного цикла. При химическом взаимодействии обычных пластин PbO + H2SO4 —> PbSO4 + H2O, предшествующему электрохимическому процессу, на каждом электроде образуется по одной молекуле H2O, которые превращаются при электролизе в две молекулы кислоты 2PbSO4 + 2H2O —> Pb + PbO2 + 2H2SO4. Электроды, обработанные щелочью, взаимодействуют с кислотой по реакции Pb(OH)2 + H2SO4 —> PbSO4 + 2H2O, то есть на каждом электроде образуется по две молекуле воды. В итоге на каждом электроде остается по молекуле для гидролиза PbO + H2O —> Pb(OH)2. В пользу того, что во втором случае химическое взаимодействие происходит по схеме PbO —> Pb(OH)2 —> PbSO4 указывает равенство концентраций электролита до и после формирования. Таким образом, используя при изготовлении аккумулятора гидроксид натрия или калия, можно весь формировочный процесс провести без сульфатации электродов по уравнениям Pb2+ —> Pb и Pb2+ —> PbO2, которые выгодно отличаются от процессов PbSO4 —> Pb и PbSO4 —> PbO2, сопровождающих обычно заключительную часть формирования, что позволяет сэкономить значительную часть времени и электроэнергии. Положительные электроды при этом способе изготовления имеют более низкий равновесный потенциал, а стало быть, более высокую окисленность. Для пояснения текста приводятся следующие графические материалы: Фиг. 1 представлена графиками потенциалостатического формирования контрольной 1 и опытной 2 положительных пластин в координатах плотность тока – время. На фиг. 2 изображены графики зависимости потенциала положительной пластины контрольной 1 и опытной 2 от времени формирования. Графики на фиг. 3 устанавливают зависимость между напряжением и временем формирования в зависимости от различного сочетания опытных и контрольных пластин. Кривые на фиг. 4 в сочетании с осями координат (напряжение – время) дают сопоставительный анализ затрат электрической энергии при старом и новом способах формирования. Фиг. 5 представляет собой таблицу, в которую сведены результаты формирования и разряда серийных 1, 2 и опытной 3 аккумуляторных батарей. На фиг. 6 представлены разрядные кривые соответствующих батарей. Сущность предлагаемого изобретения поясняется примерами конкретного осуществления способа. Все приведенные примеры и другие опытно-испытательные работы проведены на Тюменском аккумуляторном заводе. В качестве объекта исследования использовали двойные электродные пластины: положительные 2СТП-4, 2СТП-5 и отрицательные 2СТО-3, 2СТО-5 на серийных унифицированных токоотводах толщиной 1,6 мм; 1,4 мм с односторонней геометрической поверхностью 3,8 дм2 и 3,6 дм2 соответственно. Сравнительные результаты, характеризующие отличие предлагаемого способа от прототипа, оформлены в виде графиков. В приведенных ниже примерах опытные и контрольные пластины обоих знаков намазывают по серийной технологии электродной пастой, приготовленной смешиванием рецептурных количеств окисленного свинцового порошка и раствора серной кислоты. Затем опытные пластины подвергают дальнейшей пропитке (обработке) в гидроксиде щелочного металла. В первых двух примерах пластины подвергали пропитке перед сушкой в соответствии с формулой изобретения. В третьем примере пропитывали блоки с высушенными пластинами, что не менее эффективно, но затруднено технологически. Пример 1. Пастированные положительные пластины 2СТП-5 окунанием обрабатывали в 15-процентном растворе КОН в течение 15 минут, затем подвергали сушке, пропуская через электрическое сушило, и двое суток досушивали на воздухе при комнатной температуре. Пластины, изготовленные описанным способом, и контрольные из той же партии формировали в сернокислом растворе плотностью d = 1,07 г/см3 в избытке электролита совместно с отрицательными, изготовленными серийно. При этом контрольные пластины предварительно перед подключением источника питания в течение одного часа выдерживали в электролите. Формирование велось до исчезновения сульфатных пятен. На фиг. 1 изображена зависимость плотности тока на видимую поверхность пластины 3,6 дм2 от времени при потенциалостатическом формировании. Потенциал положительной пластины  o составлял o составлял  o = 2,3 В по кадмию. Корректировка тока времени формирования при пропускании тока 5 А на одностороннюю поверхность пластины. В начальный момент перенапрежение на контрольной пластине слишком велико из-за сульфатной пленки, экранирующей поверхность пластины, электродный процесс идет лишь на токоотводе. На опытной пластине перенапряжение, напротив, имеет отрицательное значение, то есть ниже потенциала равновесия PbSO4 = PbO2, что объясняется щелочным характером приэлектролитного слоя пластины. В последующие часы формирования вплоть до окончания перенапряжение электродного процесса опытной пластины значительно ниже и разница по отношению к контрольной составляет от 0,1 до 0,01 В.
Пример 2.
Свеженамазанные положительные пластины 2СТП-4 и отрицательные 2СТО-3 обрабатывались в 22-процентном растворе NaOH в течение 5 минут и сушились по серийной технологии, как в первом примере. Затем формировались в растворе H2SO4 в формировочных баках, соединенных последовательно в группу. В первом баке были установлены контрольные необработанные щелочью разноименные пластины. Во втором пластины обоих знаков были опытными, обработанными в растворе NaOH. В третьем опытные положительные формировались с серийными отрицательными и в четвертом баке наоборот завешены обычные положительные и опытные отрицательные. Через группу пропускался формировочный ток из расчета 4,8 ампера на одностороннюю поверхность пластины 3,8 дм2 или 1,26 А/дм2. На пластинах каждого бака во время всего формировочного процесса производились замеры напряжения, по результатам которых построены графики на фиг. 3. Номера кривых соответствуют номерам баков. Из графика видно, что в промежутке от 1 часа до 7 часов кривая 3 расположена ниже, а кривая 4 выше кривых 1 и 2 на одну и ту же величину, обусловленную растворением Pb(OH)2 на электродах. Кривые 1 и 2 сливаются, так как обе пластины во втором баке обработаны щелочью; и на какую величину перенапряжение на положительной пластине выше, на такую же величину на отрицательной ниже. В итоге разность потенциалов на пластинах второго бака остается равной напряжению пластин первого бака. Второй и третий бак выходят значительно раньше в связи с тем, что обработанные положительные пластины формируются равномерно без сульфатных пятен. На фиг. 4 заштрихованная площадь представляет собой энергию, которую можно сэкономить, если обработать положительную пластину гидроксидом щелочного металла. Здесь кривая 1 соответствует напряжению серийных пластин, а вторая – напряжению опытных положительных в комплекте с обычными отрицательными. Ток формирования 4,8 А на положительную пластину.
Пример 3.
Со сборочного конвейера было снято 3 аккумуляторные батареи 6СТ-55ПМА. Из одной из них были вынуты аккумуляторные блоки и на 15 минут опущены в моноблок с 15-процентным раствором NaOH. После пропитки блоки высушили сжатым воздухом. Затем поместили в батарею и произвели сварку всех батарей на конвейере, залили электролитом плотностью 1,23 г/см3. Первую батарею поставили на формирование через 2 часа после заливки электролита, вторую – через 4 часа, а третью с обработанными блоками пластин – без предварительной выдержки. Формирование велось по обычной схеме до постоянства плотности электролита и напряжения в течение 2 часов. Первые две батареи формировались по режиму: 6 А – 4 ч, 7,5 А – 10 ч, 6 А – 16 ч, 3 А – 12 ч, а третья по режиму 20 А – 0,5 ч, 10 А – 6 ч, 5 А – 10 ч, 3 А – 4 ч.
На первых двух батареях плотность выросла до 1,28 г/см3, а в третьей осталась прежней 1,23 г/см3. Ее скорректировали до 1,28 г/см3 и все батареи поставили на испытание по 20-часовому режиму разряда. Зарядно-разрядные характеристики сведены в таблицу на фиг. 5. На фиг. 6 построены разрядные кривые этих батарей. Номера кривых соответствуют номерам батарей. Кривая 3 оказалась несколько выше других, что связано, очевидно, с более низким потенциалом отрицательных пластин. При этом при формировании третьей батареи было затрачено приблизительно в два раза меньше времени и энергии.
Таким образом, теоретические и опытные данные подтверждают преимущество этого способа над прототипом. o = 2,3 В по кадмию. Корректировка тока времени формирования при пропускании тока 5 А на одностороннюю поверхность пластины. В начальный момент перенапрежение на контрольной пластине слишком велико из-за сульфатной пленки, экранирующей поверхность пластины, электродный процесс идет лишь на токоотводе. На опытной пластине перенапряжение, напротив, имеет отрицательное значение, то есть ниже потенциала равновесия PbSO4 = PbO2, что объясняется щелочным характером приэлектролитного слоя пластины. В последующие часы формирования вплоть до окончания перенапряжение электродного процесса опытной пластины значительно ниже и разница по отношению к контрольной составляет от 0,1 до 0,01 В.
Пример 2.
Свеженамазанные положительные пластины 2СТП-4 и отрицательные 2СТО-3 обрабатывались в 22-процентном растворе NaOH в течение 5 минут и сушились по серийной технологии, как в первом примере. Затем формировались в растворе H2SO4 в формировочных баках, соединенных последовательно в группу. В первом баке были установлены контрольные необработанные щелочью разноименные пластины. Во втором пластины обоих знаков были опытными, обработанными в растворе NaOH. В третьем опытные положительные формировались с серийными отрицательными и в четвертом баке наоборот завешены обычные положительные и опытные отрицательные. Через группу пропускался формировочный ток из расчета 4,8 ампера на одностороннюю поверхность пластины 3,8 дм2 или 1,26 А/дм2. На пластинах каждого бака во время всего формировочного процесса производились замеры напряжения, по результатам которых построены графики на фиг. 3. Номера кривых соответствуют номерам баков. Из графика видно, что в промежутке от 1 часа до 7 часов кривая 3 расположена ниже, а кривая 4 выше кривых 1 и 2 на одну и ту же величину, обусловленную растворением Pb(OH)2 на электродах. Кривые 1 и 2 сливаются, так как обе пластины во втором баке обработаны щелочью; и на какую величину перенапряжение на положительной пластине выше, на такую же величину на отрицательной ниже. В итоге разность потенциалов на пластинах второго бака остается равной напряжению пластин первого бака. Второй и третий бак выходят значительно раньше в связи с тем, что обработанные положительные пластины формируются равномерно без сульфатных пятен. На фиг. 4 заштрихованная площадь представляет собой энергию, которую можно сэкономить, если обработать положительную пластину гидроксидом щелочного металла. Здесь кривая 1 соответствует напряжению серийных пластин, а вторая – напряжению опытных положительных в комплекте с обычными отрицательными. Ток формирования 4,8 А на положительную пластину.
Пример 3.
Со сборочного конвейера было снято 3 аккумуляторные батареи 6СТ-55ПМА. Из одной из них были вынуты аккумуляторные блоки и на 15 минут опущены в моноблок с 15-процентным раствором NaOH. После пропитки блоки высушили сжатым воздухом. Затем поместили в батарею и произвели сварку всех батарей на конвейере, залили электролитом плотностью 1,23 г/см3. Первую батарею поставили на формирование через 2 часа после заливки электролита, вторую – через 4 часа, а третью с обработанными блоками пластин – без предварительной выдержки. Формирование велось по обычной схеме до постоянства плотности электролита и напряжения в течение 2 часов. Первые две батареи формировались по режиму: 6 А – 4 ч, 7,5 А – 10 ч, 6 А – 16 ч, 3 А – 12 ч, а третья по режиму 20 А – 0,5 ч, 10 А – 6 ч, 5 А – 10 ч, 3 А – 4 ч.
На первых двух батареях плотность выросла до 1,28 г/см3, а в третьей осталась прежней 1,23 г/см3. Ее скорректировали до 1,28 г/см3 и все батареи поставили на испытание по 20-часовому режиму разряда. Зарядно-разрядные характеристики сведены в таблицу на фиг. 5. На фиг. 6 построены разрядные кривые этих батарей. Номера кривых соответствуют номерам батарей. Кривая 3 оказалась несколько выше других, что связано, очевидно, с более низким потенциалом отрицательных пластин. При этом при формировании третьей батареи было затрачено приблизительно в два раза меньше времени и энергии.
Таким образом, теоретические и опытные данные подтверждают преимущество этого способа над прототипом.
Формула изобретения
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 17.02.2006
Извещение опубликовано: 20.02.2007 БИ: 05/2007
|
||||||||||||||||||||||||||
