Патент на изобретение №2177004
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ 5-МЕТИЛ-3-(5-НИТРОФУРИЛАКРИЛИДЕН)-ФУРАН-2-ОНА
(57) Реферат: Описывается способ получения нового соединения 5-метил-3-(5-нитрофурилакрилиден)-фуран-2-она, которое в настоящее время изучают в качестве ветеринарного препарата для лечения желудочно-кишечных и респираторных болезней бактериальной этиологии телят и поросят. Способ состоит в том, что промышленное сырье – левулиновую кислоту подвергают конденсации однореактивным синтезом с уксусным ангидридом при температуре 130-132oС и затем с 5-нитрофурилакролеином при 38-40oС с последующим выделением конечного продукта из 50%-ного раствора этилового спирта. Технический результат – получение простым способом нового соединения с ценными свойствами. 1 табл. Изобретение относится к химии азагетероциклических соединений, а именно к способу получения 5-метил-3-(5-нитрофурилакрилиден)-фуран-2-она (фуракрона) формулы: 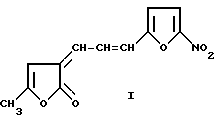 Фуракрон в настоящее время изучается в качестве ветеринарного препарата для лечения желудочно-кишечных и респираторных болезней бактериальной этиологии телят и поросят в Воронежском НИИ патологии, фaрмaкoлoгии и терапии (Шахов А. Г., Скогорева А.Н. Сборник научных трудов “Экологические проблемы патологии, фармакологии и терапии животных”, Воронеж, 1977. С.161-162). Вещество 5-метил-3-(5-нитрофурилакрилиден)-фуран-2-он (I) и способ его получения в литературе не описаны. Известна работа (М.М. АВД Alla, E.A.Soliman, A.A.Hamed, M.W.Osman, Rev. Roumaine de Chimie, 25, 11-12, 1549, 15, 1980), в которой описана циклизация  -3,4-дихлорбензолпропионовой кислоты с ароматическими альдегидами в 3,5-арилидензамещенные 3Н-фураноны по схеме 1 (см. в конце описания).
Конденсация осуществляется в присутствии уксусного ангидрида и ацетата натрия. Температура реакции конкретно не приводится, дано указание на “раскаленную плиту”. Выделение конечного продукта проводят через ряд стадий и далее из бензола. Реакция осложняется побочным образованием димерных структур.
Соединения II отличаются от заявляемого соединения I характером заместителей в 3-м и 5-м положениях лактонного цикла, условиями проведения и выделения конечного продукта: высокая температура, выливают промежуточный продукт в воду, кристаллы перекристаллизовывают из бензола. Выход соединений II с Аr = фурил составляет 65%.
Известны 3-фурфурилидензамещеные-5-метил-3Н-фуран-2-оны (III), полученные на основе 5Н-фуранов. Способ получения осуществляется в присутствии катализатора – пиперидина. В результате реакции двойная связь лактонного цикла перемещается в 3Н-положение. Реакцию осуществляют через окисление 5-метилфурфурола перекисью водорода в присутствии катализаторов соединений селена или вольфрама (см. схему 2 в конце описания).
Способ получения соединений III, близких по структуре к заявляемому, трудоемок, технологически сложен, включает стадии окисления 5-метилфурфурола с использованием катализаторов (соединений селена, вольфрама, пиперидина). (В кн. : Химия и технология фурановых соединений. Краснодар. 1982, с.27-30. Коклюгина Т.Я. Бадовская Л.А., Левитин Б.Н.).
Известен способ получения 5-алкил-3-арилиден-3Н-фуран-2-онов по схеме 3 (см. в конце описания).
(Седавкина В.А., Морозова Н.А., Егоров А.Е., Остроумов И.Г. Химия гетероциклических соединений. 1987., 4, с.451-454).
Синтез соединений IV основан на конденсации -3,4-дихлорбензолпропионовой кислоты с ароматическими альдегидами в 3,5-арилидензамещенные 3Н-фураноны по схеме 1 (см. в конце описания).
Конденсация осуществляется в присутствии уксусного ангидрида и ацетата натрия. Температура реакции конкретно не приводится, дано указание на “раскаленную плиту”. Выделение конечного продукта проводят через ряд стадий и далее из бензола. Реакция осложняется побочным образованием димерных структур.
Соединения II отличаются от заявляемого соединения I характером заместителей в 3-м и 5-м положениях лактонного цикла, условиями проведения и выделения конечного продукта: высокая температура, выливают промежуточный продукт в воду, кристаллы перекристаллизовывают из бензола. Выход соединений II с Аr = фурил составляет 65%.
Известны 3-фурфурилидензамещеные-5-метил-3Н-фуран-2-оны (III), полученные на основе 5Н-фуранов. Способ получения осуществляется в присутствии катализатора – пиперидина. В результате реакции двойная связь лактонного цикла перемещается в 3Н-положение. Реакцию осуществляют через окисление 5-метилфурфурола перекисью водорода в присутствии катализаторов соединений селена или вольфрама (см. схему 2 в конце описания).
Способ получения соединений III, близких по структуре к заявляемому, трудоемок, технологически сложен, включает стадии окисления 5-метилфурфурола с использованием катализаторов (соединений селена, вольфрама, пиперидина). (В кн. : Химия и технология фурановых соединений. Краснодар. 1982, с.27-30. Коклюгина Т.Я. Бадовская Л.А., Левитин Б.Н.).
Известен способ получения 5-алкил-3-арилиден-3Н-фуран-2-онов по схеме 3 (см. в конце описания).
(Седавкина В.А., Морозова Н.А., Егоров А.Е., Остроумов И.Г. Химия гетероциклических соединений. 1987., 4, с.451-454).
Синтез соединений IV основан на конденсации  -кетокарбоновых кислот ( -кетокарбоновых кислот ( -кетогептановой, -кетогептановой,  -кетооктановой) с бензальдегидом, диметиламинобензальдегидом, фурфуролом в присутствии уксусного ангидрида и ацетата натрия. Температура реакции 140oС, выделение конечного продукта осуществляют из эфира, выход составляет 34-47%. -кетооктановой) с бензальдегидом, диметиламинобензальдегидом, фурфуролом в присутствии уксусного ангидрида и ацетата натрия. Температура реакции 140oС, выделение конечного продукта осуществляют из эфира, выход составляет 34-47%.  -Кетокарбоновые кислоты являются продуктом тонкого органического синтеза, синтез их включает следующие стадии: -Кетокарбоновые кислоты являются продуктом тонкого органического синтеза, синтез их включает следующие стадии:I стадия. Получение алкил-  -фурил- карбинола по реакции магнийорганического синтеза фурфурола с алкилбромидом в среде абсолютного эфира (см. схему 4 в конце описания).
II стадия. Расщепление фуранового цикла в алкил- -фурил- карбинола по реакции магнийорганического синтеза фурфурола с алкилбромидом в среде абсолютного эфира (см. схему 4 в конце описания).
II стадия. Расщепление фуранового цикла в алкил- -фурилкарбиноле 0,4%-ным раствором НCI-газа в абсолютном этиловом спирте до этилового эфира -фурилкарбиноле 0,4%-ным раствором НCI-газа в абсолютном этиловом спирте до этилового эфира  -кетокарбоновой кислоты (см. схему 5 в конце описания).
III стадия. Щелочный гидролиз этилового эфира -кетокарбоновой кислоты (см. схему 5 в конце описания).
III стадия. Щелочный гидролиз этилового эфира  -кетокарбоновой кислоты до -кетокарбоновой кислоты до  -кетокарбоновой кислоты (см. схему 6 в конце описания).
IV стадия. Взаимодействие -кетокарбоновой кислоты (см. схему 6 в конце описания).
IV стадия. Взаимодействие  -кетокарбоновой кислоты с бензальдегидом, диметиламинобензальдегидом, фурфуролом при температуре 80-140oС в присутствии плавленого ацетата натрия и уксусного ангидрида (см. схему 7 в конце описания.).
Выделение соединений IV осуществляют экстракцией из реакционной смеси эфиром и последующим удалением эфира.
Недостатками способа являются: -кетокарбоновой кислоты с бензальдегидом, диметиламинобензальдегидом, фурфуролом при температуре 80-140oС в присутствии плавленого ацетата натрия и уксусного ангидрида (см. схему 7 в конце описания.).
Выделение соединений IV осуществляют экстракцией из реакционной смеси эфиром и последующим удалением эфира.
Недостатками способа являются:1. Соединения IV – продукт тонкого органического синтеза и получение их в производстве невозможно, т.к. метод синтеза соединений IV на основе фурфурола находит применение лишь в лабораторном синтезе в связи с тем, что включает в себя Mg-органический синтез  -кетокарбоновых кислот.
2. Получение соединений IV на стадии 1 и на стадии IV проводят с использованием серного эфира – взрывоопасного органического растворителя, с которым работа в производстве затруднена.
3. Низкий выход целевого продукта, не превышает 47%.
Задачей изобретения является разработка способа получения 5-метил-3-(5-нитрофурилакрилиден)-фуран-2-она (фуракрона) (I) на основе доступного промышленного сырья и создание препаратов для применения в ветеринарной практике.
Поставленная задача решается тем, что в способе получения 5-метил-3-(5-нитрофурилакрилиден)-фуран-2-она согласно изобретению промышленное сырье – левулиновую кислоту подвергают конденсации однореактивным синтезом с уксусным ангидридом при температуре 130-132oС и затем с 5-нитрофурилакролеином при 38-40oС с последующим выделением конечного продукта из 50%-ного раствора этилового спирта.
Левулиновая кислота является побочным продуктом гидролиза древесины.
Использование промышленного сырья позволяет получать конечный продукт более упрощенным способом, чем известным для близкого по структуре вещества, исключая стадии 1, 2, 3 синтеза соединения IV. Образование соединения I достигается однореактивным синтезом (без выделения промежуточно образующегося 5-метил-3Н-фуран-2-она) левулиновой кислоты с 5-нитрофурилакролеином по схеме 8 (см. в конце описания).
Изменены условия реакции по сравнению с известным способом получения вещества IV на стадии 4 и условия выделения конечного продукта. Конкретно, первоначально осуществляют взаимодействие левулиновой кислоты с уксусным ангидридом при температуре 130-132oС, т.к. при этой температуре в реакционной смеси ускоряется процесс образования лактонного цикла (А) по схеме 9 (см. в конце описания.).
Далее лактон (А) вступает в реакцию кротоновой конденсации в присутствии ацетата натрия с образованием соединения I.
Выделение целевого продукта осуществляют не экстрагированием эфиром, а обработкой реакционной смеси 50%-ным этиловым спиртом и отделением соединения 1 в виде кристаллического продукта.
Выход соединения I составляет 58-62%, что превышает выход соединения IV в аналоге.
Таким образом, предложенный способ получения фуракрона обладает следующими преимуществами по сравнению с аналогом: -кетокарбоновых кислот.
2. Получение соединений IV на стадии 1 и на стадии IV проводят с использованием серного эфира – взрывоопасного органического растворителя, с которым работа в производстве затруднена.
3. Низкий выход целевого продукта, не превышает 47%.
Задачей изобретения является разработка способа получения 5-метил-3-(5-нитрофурилакрилиден)-фуран-2-она (фуракрона) (I) на основе доступного промышленного сырья и создание препаратов для применения в ветеринарной практике.
Поставленная задача решается тем, что в способе получения 5-метил-3-(5-нитрофурилакрилиден)-фуран-2-она согласно изобретению промышленное сырье – левулиновую кислоту подвергают конденсации однореактивным синтезом с уксусным ангидридом при температуре 130-132oС и затем с 5-нитрофурилакролеином при 38-40oС с последующим выделением конечного продукта из 50%-ного раствора этилового спирта.
Левулиновая кислота является побочным продуктом гидролиза древесины.
Использование промышленного сырья позволяет получать конечный продукт более упрощенным способом, чем известным для близкого по структуре вещества, исключая стадии 1, 2, 3 синтеза соединения IV. Образование соединения I достигается однореактивным синтезом (без выделения промежуточно образующегося 5-метил-3Н-фуран-2-она) левулиновой кислоты с 5-нитрофурилакролеином по схеме 8 (см. в конце описания).
Изменены условия реакции по сравнению с известным способом получения вещества IV на стадии 4 и условия выделения конечного продукта. Конкретно, первоначально осуществляют взаимодействие левулиновой кислоты с уксусным ангидридом при температуре 130-132oС, т.к. при этой температуре в реакционной смеси ускоряется процесс образования лактонного цикла (А) по схеме 9 (см. в конце описания.).
Далее лактон (А) вступает в реакцию кротоновой конденсации в присутствии ацетата натрия с образованием соединения I.
Выделение целевого продукта осуществляют не экстрагированием эфиром, а обработкой реакционной смеси 50%-ным этиловым спиртом и отделением соединения 1 в виде кристаллического продукта.
Выход соединения I составляет 58-62%, что превышает выход соединения IV в аналоге.
Таким образом, предложенный способ получения фуракрона обладает следующими преимуществами по сравнению с аналогом:– соединение I – новое химическое соединение в ряду азагетероциклических ненасыщенных лактонов; – используется доступное промышленное сырье; – исключается использование взрывоопасного эфира; – упрощается способ получения азагетероциклических ненасыщенных лактонов за счет изменения условий реакции; – упрощен способ очистки целевого продукта; – повышается выход целевого продукта. Изобретение иллюстрируется примером конкретного выполнения. Пример. 50 г (0,43 моля) левулиновой кислоты и 87,7 г (0,86 моля) уксусного ангидрида нагревают при температуре 130oС при перемешивании в течение 1 часа (лактон А). Реакционную смесь охлаждают до температуры 40oС и прибавляют 60,12 г (0,36 моля) 5-нитрофурилакролеина (НФА) и 29,5 г (0,36 моля) ацетата натрия, нагревают в течение 2 часов при температуре 38-40oС. Охлаждают реакционную смесь до комнатной температуры и прибавляют 50%-ный этиловый спирт. Образовавшийся продукт отфильтровывают, промывают 50%-ным этиловым спиртом, сушат на воздухе, получают 62 г (58%) 5-метил-3-(5-нитрофурилакрилиден)-фуран-2-она (фуракрона), т.пл. 135-137oС. Найдено, %: С 58,91; Н 3,98; N 6,18. C12H9N05 Вычислено, %: С 58,30; Н 3,64; N 5,67. ИК-спектр, см-1: 1774 (  лактон), 1612, 1636 (полиен), 3144-3125 ( лактон), 1612, 1636 (полиен), 3144-3125 ( С-Н фурана), 1565, 1500 ( С-Н фурана), 1565, 1500 ( С-С фурана), 1536 ( С-С фурана), 1536 ( asNO2), 1360 ( asNO2), 1360 ( sNO2).
ПМР-спектр, sNO2).
ПМР-спектр,  м. д. : 2,20 (3Н синглет), 6,17 (1Н синглет), 6,59-7,34 (ациклич. фрагмент, фуран).
Таким образом, наиболее оптимальными условиями получения фуракрона являются: в стадии получения лактона А температуры 130-132oС и время 1 час; в стадии реакции конденсации температура – 38-40oС и время реакции 2 часа. м. д. : 2,20 (3Н синглет), 6,17 (1Н синглет), 6,59-7,34 (ациклич. фрагмент, фуран).
Таким образом, наиболее оптимальными условиями получения фуракрона являются: в стадии получения лактона А температуры 130-132oС и время 1 час; в стадии реакции конденсации температура – 38-40oС и время реакции 2 часа.
Формула изобретения
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 07.01.2004
Извещение опубликовано: 10.03.2005 БИ: 07/2005
|
||||||||||||||||||||||||||
