Патент на изобретение №2177002
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ГЕРБИЦИДНЫХ СУЛЬФОНИЛМОЧЕВИН И N-(ПИРИМИДИНИЛ- ИЛИ ТРИАЗИНИЛ)-КАРБАМАТОВ В КАЧЕСТВЕ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ
(57) Реферат: Изобретение относится к новому способу получения сульфонилмочевин формулы I, обладающих гербицидным действием, и N-(пиримидинил- или триазинил)карбаматов формулы IV, в качестве промежуточных продуктов. Способ получения сульфонилмочевин формулы I A-SO2-NH-CO-NR-B, в которой Ar означает незамещенный или замещенный фенил, В означает остаток пиримидин-2-ила или 1,3,5-триазинил-2-ила, которые могут быть замещены, R означает водород, C1-5-алкил, C1-5-галоалкил, C1-5-алкокси, C1-5-галоалкокси, А означает незамещенный или замещенный фенил, или их солей, заключается в том, что соединение формулы (II) H-NR-B с помощью основания М+Base–, которое представляет собой алкоголят щелочного металла, где М+ означает эквивалент катиона щелочного металла, Base– эквивалент аниона остатка алкоголята, in situ переводят в соответствующую соль формулы (II-S) М+ –NR-B и полученную реакционную смесь подвергают взаимодействию с диарилкарбонатом формулы (III) (Ar-O)2СО с получением Ar-О-CO-NR-B (IV), при этом символы Ar, В, R в формулах (II), (II-S), (III) и (IV) имеют значения, указанные выше, и полученную реакционную смесь подвергают взаимодействию с сульфонамидом формулы (V) A-SO2-NH2, где А имеет вышеуказанное значение, и затем выделяют соединение формулы I или его соль. Взаимодействие карбамата формулы IV с сульфонамидом формулы V проводят при температуре от -40oС до 180oС. Способ позволяет упростить процесс за счет исключения таких реактивов, как гидриды щелочных металлов, и снизить затраты на технику безопасности, а также позволяет получать продукты в промышленных масштабах. 2 с. и 6 з.п. ф-лы. Изобретение относится к способу получения карбаматов, которые пригодны для получения действующих как гербициды сульфонилмочевин формулы (I): A-SO2-NH-CO-NR-B, (I) в которой A означает органический остаток, который при необходимости содержит гетероатомы, например, алифатический, ароматический или гетероароматический остаток, незамещенный или замещенный и непосредственно или через дивалентную группу связан с гетероатомами по SO2-группе в формуле (I), B означает остаток пиримидин-2-ила или 1,3,5-триазин-2-ила, который является незамещенным или замещенным, и R означает водород, C1-C5-алкил, C1-C5-галоалкил, C1-C5-алкокси или C1-C5-галоалкокси. Соединения формулы (I), как правило, известны и могут использоваться в качестве защитных средств растений с гербицидным действием. Сравните, например, WO 92/00304, DE-A1-4236902, WO 89/10921, EP-A1-301784, EP-A1-187489. Известные способы получения этого класса соединений часто обладают недостатками. Например, многие из известных способов протекают с низким выходом продукта, в особенности, если требуется получить труднорастворимые гетероциклические амины. Другие способы являются многостадийными, что нежелательно, или требуют использования частично ядовитых соединений (как например, фосген) или опасных реагентов (как например, гидриды щелочных металлов), так что с точки зрения техники безопасности, при производстве в большом масштабе должны быть приняты особые меры. По одному из этих, в принципе известных способов, получают гербициды сульфонилмочевины путем взаимодействия сульфонамидов A-SO2-NH2 и карбаматов Ar-O-CO-NR-B, причем Ar означает ароматический остаток, а A, B и R имеют указанные в формуле (I) значения (сравни, например, названные патентные публикации). Если рассматривать получение карбаматов, то этот вариант в большинстве случаев обладает недостатками, поскольку следует использовать сильные основания, с которыми трудно работать. Например, “карбаматный” способ получения сульфонилмочевинных гербицидов, известный из EP-A-562576, требует больших затрат на технику безопасности, поскольку в нем используется в качестве основания гидрид натрия. Был найден новый способ получения карбаматов и – при использовании карбаматов – способ, согласно которому с высокой эффективностью можно получать соединения формулы (I) путем взаимодействия легко доступных исходных материалов. По сравнению с уровнем техники из EP-A-562576 преимущество новых способов согласно изобретению состоит, например, в том, что можно избежать использования реактивов, таких как гидриды щелочных металлов, и способами можно надежно пользоваться в больших промышленных масштабах с дорогостоящими затратами. Предметом изобретения является способ получения карбамата формулы (IV), Ar-O-CO-NR-B, (IV) в котором Ar представляет собой незамещенный или замещенный арил, предпочтительно фенил, B представляет собой остаток пиримидин-2-ила или 1,3,5-триазин-2-ила, который является незамещенным или замещенным, а R означает водород, C1-C5-алкил, C1-C5-галоалкил, C1-C5-алкокси или C1-C5-галоалкокси, отличающийся тем, что соединение формулы (II), H-NR-B, (II) с помощью основания M  Base Base , которое представляет собой алкоголят щелочного металла, где M , которое представляет собой алкоголят щелочного металла, где M означает эквивалент катиона щелочного металла, а Base означает эквивалент катиона щелочного металла, а Base означает эквивалент аниона остатка алкоголята, in situ переводят в соответствующую соль формулы (II-S) означает эквивалент аниона остатка алкоголята, in situ переводят в соответствующую соль формулы (II-S)M   NR-B, (II-S) NR-B, (II-S)полученную реакционную смесь подвергают взаимодействию с диарилкарбонатом формулы (III), (Ar-O)2CO, (III) с получением соединения (IV), при этом в формулах (II), (II-S) и (III) символы Ar, B и R имеют те же значения, что и в формуле (IV). Полученный согласно способу карбамат (IV) можно на промежуточной стадии выделить в соответствии с традиционными методами или подвергнуть непосредственно дальнейшей обработке. Прямая дальнейшая обработка неожиданно обеспечивает хороший выход и без дорогостоящих мероприятий, таких как замена растворителя или частичное удаление побочных продуктов или вспомогательных веществ из предшествующих стадий способа. Предметом изобретения является поэтому также способ получения в одном аппарате сульфонилмочевины формулы (I) или ее солей, отличающийся тем, что соединение формулы (II) H-NR-B, (II) с помощью основания M  Base Base , которое представляет собой алкоголят щелочного металла, где M , которое представляет собой алкоголят щелочного металла, где M означает эквивалент катиона щелочного металла, а Base означает эквивалент катиона щелочного металла, а Base означает эквивалент аниона остатка алкоголята. In situ переводят в соответствующую соль формулы (II-S) означает эквивалент аниона остатка алкоголята. In situ переводят в соответствующую соль формулы (II-S)M   NR-B, (II-S) NR-B, (II-S)и полученную реакционную смесь подвергают взаимодействию с диарилкарбонатом формулы (III) (Ar-O)2CO, (III) в которой Ar представляет собой незамещенный или замещенный фенил, при этом образуется карбамат формулы (IV) Ar-O-CO-NR-B, (IV) и полученную реакционную смесь подвергают взаимодействию с сульфонамидом формулы (V) A-SO2NH2, (V) затем выделяют соединение формулы (I) или его соль, причем в формулах (II), (II-S), (IV) и (V) символы A, B и R имеют значения, как в формуле (I). Способ по изобретению, соответственно способ получения в одном аппарате, осуществляют таким образом, что сначала депротонирутот гетероциклические амины формулы (II) с помощью пригодных оснований M  Base Base (окисей, гидроокисей, карбонатов или алкоголятов) в растворителе с образованием соли (II-S).
Пригодными солями оснований M (окисей, гидроокисей, карбонатов или алкоголятов) в растворителе с образованием соли (II-S).
Пригодными солями оснований M Base Base являются, например, соли из группы алкоголятов щелочных металлов, например, этилата натрия, метилата натрия, этилата калия, метилата калия, изопропилата натрия, изопропилата калия, трет. -бутилата натрия, трет. -бутилата калия и аналогичных разветвленных алкоголятов и алкоголятов щелочноземельных металлов, предпочтительно алкоголятов щелочных металлов – натрия и калия.
В качестве растворителей пригодны такие, которые могут растворять реагенты при выбранных температурах или, по меньшей мере, способствовать набуханию. Пригодные растворители можно легко извлечь на предварительных стадиях. Особый интерес представляют органические растворители, инертные в реакционных условиях, прежде всего апротонные диполярные растворители, а также их смеси.
Примеры в принципе подходящих растворителей: являются, например, соли из группы алкоголятов щелочных металлов, например, этилата натрия, метилата натрия, этилата калия, метилата калия, изопропилата натрия, изопропилата калия, трет. -бутилата натрия, трет. -бутилата калия и аналогичных разветвленных алкоголятов и алкоголятов щелочноземельных металлов, предпочтительно алкоголятов щелочных металлов – натрия и калия.
В качестве растворителей пригодны такие, которые могут растворять реагенты при выбранных температурах или, по меньшей мере, способствовать набуханию. Пригодные растворители можно легко извлечь на предварительных стадиях. Особый интерес представляют органические растворители, инертные в реакционных условиях, прежде всего апротонные диполярные растворители, а также их смеси.
Примеры в принципе подходящих растворителей:– простые эфиры, как например, диэтиловый эфир, тетрагидрофуран (THF), диоксан, диглимы и тетраглимы, – амиды, как например, диметилформамид (DMF), диметилацетамид (DMA) и N-метилпирролидон, – кетоны, как например, ацетон, – нитрилы, как например, ацетонитрил, пропионитрил, бутиронитрил и бензнитрил, – сульфоксиды и сульфоны, как диметилсульфоксид (DMSO) и сульфолан, – галогенированные алифатические и ароматические углеводороды, как например, метиленхлорид и хлорбензол. Образование соли (II-S) может происходить в широком диапазоне температур, который в отдельном случае может быть ограничен точкой плавления или точкой кипения используемого растворителя, а также его свойствами как растворителя. Как правило, при солеобразовании температура находится в диапазоне от -40oC до точки кипения соответствующего растворителя, предпочтительно в диапазоне от -20oC до точки кипения соответствующего растворителя, в особенности от -10oC до +100oC. Реакционноспособный анион в соли (II-S) гетероциклического амина далее подвергают предпочтительно без промежуточного выделения взаимодействию с диарилкарбонатом (III), как например, дифенилкарбонатом, с образованием соответствующего карбамата (IV). Эту реакцию можно проводить в широком диапазоне температур в зависимости от растворителя, и ее осуществляют, например, при температурах от -40oC до +180oC, предпочтительно от -20 до +150oC, наиболее предпочтительно от -10oC до 100oC, в особенности от 0 до 100oC. При проведении реакции аниона (II-S) и диарилкарбоната (III) от случая к случаю может быть предпочтительным добавление сушильного агента, например, молекулярного сита ( 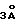 или или 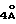 ) или добавление катализаторов фазового перехода, например, эфиров полиэтиленгликоля, органических солей аммония, крон-эфиров и т.д.
Карбамат (IV) может быть затем выделен традиционными, например, комбинированными способами, такими как фильтрация раствора, концентрирование, перекристаллизация, экстракция при разных значениях pH, хроматография и т.п. Так, например, 4-метокси-6-метил-2-феноксикарбониламино-1,3,5-триазин может быть получен с удовлетворительной чистотой и выходом 1H-ЯМР (200 МГц, D6DMSO): ) или добавление катализаторов фазового перехода, например, эфиров полиэтиленгликоля, органических солей аммония, крон-эфиров и т.д.
Карбамат (IV) может быть затем выделен традиционными, например, комбинированными способами, такими как фильтрация раствора, концентрирование, перекристаллизация, экстракция при разных значениях pH, хроматография и т.п. Так, например, 4-метокси-6-метил-2-феноксикарбониламино-1,3,5-триазин может быть получен с удовлетворительной чистотой и выходом 1H-ЯМР (200 МГц, D6DMSO):  ppm – 8,5 (s, 1H), 7,4 (m, 2H), 7,2 (m, 3H), 4,05 (s, 3H)).
Оптимальные соотношения компонентов гетероциклического амина (II), M ppm – 8,5 (s, 1H), 7,4 (m, 2H), 7,2 (m, 3H), 4,05 (s, 3H)).
Оптимальные соотношения компонентов гетероциклического амина (II), M Base Base и диарилкарбоната (III) можно варьировать от случая к случаю. Например, используют основание к амину (II) предпочтительно в эквимолярном соотношении или в избытке, например, при молярном соотношении от 1:1 до 5:1, предпочтительно от 1: 1 до 3:1. При этом диарилкарбонат (III) используют, например, в эквимолярном соотношении относительно к амину (II) в избытке или в недостатке, предпочтительно в молярном отношении от 1:2 до 2:1, в особенности от 1:1,5 до 1,5:1.
Образовавшийся промежуточный карбамат (IV) вступает во взаимодействие по способу в одном аппарате согласно изобретению без промежуточного выделения с сульфонамидом формулы (V). Температуры реакции составляют при этом, как правило, от -40 до 180oC, предпочтительно от -20 до 150oC, в особенности от 0 до 80oC.
После окончания реакции можно выделить по выбору сульфонилмочевину формулы (I) или ее соль (I-S) в соответствии с обычными способами очистки.
Для получения нейтральных сульфонилмочевин сначала, например, фильтруют реакционную смесь, а затем фильтрат осторожно выливают в разбавленную водой кислоту, как например, разбавленную соляную или муравьиную кислоты. После промывки выделенного продукта – например водой и/или одним или несколькими органическими растворителями (например, спиртами, такими как метанол, этанол и изопропанол; простыми эфирами, как например, диэтиловый эфир и трет.-бутилметиловый эфир; кетонамин, как например, ацетон; сложными эфирами, как например, этилацетат и метилацетат) и после сушки могут быть получены целевые продукты с хорошим выходом и с хорошей чистотой (как правило, более 90%-ной).
Альтернативно можно фильтрат добавить в двухфазную систему из органического растворителя, как например, толуол, трет.-бутилметиловый эфир, метилацетат или этилацетат, и разбавленной водой кислоты. Выделенная сульфонилмочевина получена с хорошими чистотой и выходом.
Для получения солей соединений (I) проводят выделение продукта без предварительного подкисления реакционной смеси. Соли сульфонилмочевины формулы (I) могут быть выделены, например, следующим путем.
После окончания реакции и фильтрации смеси к фильтрату добавляют неполярный органический растворитель для снижения растворимости солей в реакционной смеси.
Альтернативно реакционную смесь можно концентрировать путем отгонки летучих компонентов. Выделенная затем соль сульфонилмочевины может быть очищена, например, путем смешения с органическим растворителем, таким как например, метанол, диэтиловый эфир, этилацетат, метилацетат, этанол, трет. -бутилметиловый эфир или со смесью растворителей.
Для проведения реакции карбамата (IV) и сульфонамида (V) в некоторых случаях предпочтительно добавление сушильного агента, как например, молекулярного сита и диарилкарбоната (III) можно варьировать от случая к случаю. Например, используют основание к амину (II) предпочтительно в эквимолярном соотношении или в избытке, например, при молярном соотношении от 1:1 до 5:1, предпочтительно от 1: 1 до 3:1. При этом диарилкарбонат (III) используют, например, в эквимолярном соотношении относительно к амину (II) в избытке или в недостатке, предпочтительно в молярном отношении от 1:2 до 2:1, в особенности от 1:1,5 до 1,5:1.
Образовавшийся промежуточный карбамат (IV) вступает во взаимодействие по способу в одном аппарате согласно изобретению без промежуточного выделения с сульфонамидом формулы (V). Температуры реакции составляют при этом, как правило, от -40 до 180oC, предпочтительно от -20 до 150oC, в особенности от 0 до 80oC.
После окончания реакции можно выделить по выбору сульфонилмочевину формулы (I) или ее соль (I-S) в соответствии с обычными способами очистки.
Для получения нейтральных сульфонилмочевин сначала, например, фильтруют реакционную смесь, а затем фильтрат осторожно выливают в разбавленную водой кислоту, как например, разбавленную соляную или муравьиную кислоты. После промывки выделенного продукта – например водой и/или одним или несколькими органическими растворителями (например, спиртами, такими как метанол, этанол и изопропанол; простыми эфирами, как например, диэтиловый эфир и трет.-бутилметиловый эфир; кетонамин, как например, ацетон; сложными эфирами, как например, этилацетат и метилацетат) и после сушки могут быть получены целевые продукты с хорошим выходом и с хорошей чистотой (как правило, более 90%-ной).
Альтернативно можно фильтрат добавить в двухфазную систему из органического растворителя, как например, толуол, трет.-бутилметиловый эфир, метилацетат или этилацетат, и разбавленной водой кислоты. Выделенная сульфонилмочевина получена с хорошими чистотой и выходом.
Для получения солей соединений (I) проводят выделение продукта без предварительного подкисления реакционной смеси. Соли сульфонилмочевины формулы (I) могут быть выделены, например, следующим путем.
После окончания реакции и фильтрации смеси к фильтрату добавляют неполярный органический растворитель для снижения растворимости солей в реакционной смеси.
Альтернативно реакционную смесь можно концентрировать путем отгонки летучих компонентов. Выделенная затем соль сульфонилмочевины может быть очищена, например, путем смешения с органическим растворителем, таким как например, метанол, диэтиловый эфир, этилацетат, метилацетат, этанол, трет. -бутилметиловый эфир или со смесью растворителей.
Для проведения реакции карбамата (IV) и сульфонамида (V) в некоторых случаях предпочтительно добавление сушильного агента, как например, молекулярного сита 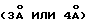 или добавление катализаторов фазового перехода, например, полиэтиленгликолевого эфира, органических солей аммония, крон-эфиров и т.д.
Соотношение компонентов сульфонамида (V), диарилкарбоната (III), гетероциклического амина (II) и основания M или добавление катализаторов фазового перехода, например, полиэтиленгликолевого эфира, органических солей аммония, крон-эфиров и т.д.
Соотношение компонентов сульфонамида (V), диарилкарбоната (III), гетероциклического амина (II) и основания M Base Base может варьироваться от случая к случаю. Предпочтительно молярное соотношение количеств сульфонамида (V) и компонентов формулы (III) или (II) составляет соответственно от 1:0,8 до 1: 3,5, в частности соответственно от 1:1 до 1:2.
В формуле (I) и во всех последующих формулах остатки – алкил, алкокси, галоалкил, галоалкокси, алкиламино и алкилтио, а также соответствующие ненасыщенные и/или замещенные остатки могут быть в углеродном скелете соответственно линейными или разветвленными. Если специально ничего не указано, то в этих остатках предпочтительны скелеты низших углеводородов, например, с 1-6 C-атомами, в случае ненасыщенных групп, предпочтительны скелеты с 2-6 C-атомами.
Галоген означает, например, фтор, хлор, бром или йод. Галоалкил, галоалкенил и галоалкинил означают алкил, алкенил или алкинил, частично или полностью замещенные галогеном, предпочтительно фтором, хлором и/или бромом, в особенности, фтором или хлором.
Ароматический карбоциклический остаток (=арил) означает моно-, би- или полициклическую ароматическую систему, например, фенил, нафтил, тетрагидронафтил, инденил, инданил, пенталенил, флуоренил и т.п., предпочтительно фенил.
Гетероциклический остаток или кольцо (гетероциклил) может быть насыщенным, ненасыщенным или гетероароматическим; содержащим, предпочтительно один или несколько гетероатомов в кольце, которые охватывают также замещенные гетероатомы, предпочтительно из группы N, O, S, SO, SO2; например, он является алифатическим гетероциклильным остатком с 3-7 атомами в кольце или гетероароматическим остатком с 5 или 6 атомами в кольце и содержит 1, 2 или 3 гетероединицы. Гетероциклический остаток может быть, например, гетероароматическим остатком или кольцом (гетероарил), как например, моно-, би- или полициклическая ароматическая система, в которой, по меньшей мере, 1 кольцо содержит один или несколько гетероатомов, например, пиридил, пиримидинил, пиридазинил, пиразинил, тиенил, тиазолил, оксазолил, фурил, пирролил, пиразолил и имидазолил, или является парциально и полностью гидрированным остатком, как например, оксиранил, пирролидил, пиперидил, пиперазинил, диоксоланил, морфолинил, тетрагидрофурил.
В качестве заместителей для замещенного ароматического или гетероароматического остатка во внимание принимают например: один или несколько, предпочтительно 1, 2 или 3 остатка из группы галоген, алкил, галоалкил, алкокси, галоалкокси, алкилтио, гидрокси, амино, нитро, карбокси, циано, азидо, алкоксикарбонил, алкилкарбонил, формил, карбамоил, моно- и диалкиламинокарбонил, замещенный амино, как например, ациламино, моно- и диалкиламино, и алкилсульфинил, галоалкилсульфинил, алкилсульфонил и галоалкилсульфонил; в понятие “замещенные остатки”, как замещенный арил и т.п., в качестве заместителей дополнительно к названным насыщенным, содержащим углеводород остаткам включены соответствующие ненасыщенные алифатические и ароматические остатки, как замещенный алкенил, алкинил, алкенилокси, алкинилокси, фенил, фенокси и т.д. В случае остатков с C-атомами предпочтительны остатки с 1-4 C-атомами, в частности, с 1 или 2 C-атомами. Предпочтительны, как правило, заместители из группы галогенов, например, фтор и хлор, C1-C4-алкил, предпочтительно, метил или этил, C1-C4-галоалкил, предпочтительно трифторметил, C1-C4-алкокси, предпочтительно метокси или этокси, C1-C4-галоалкокси, нитро и циано. Особенно предпочтительны при этом заместители метил, метокси и хлор.
Для способа по изобретению в качестве соединений формулы (III) пригодны первичные или вторичные аминопиримидины или же аминотриазины, причем гетероциклические кольца могут быть незамещенными или замещенными. Типичные амины представляют собой, например, соединения формулы (IIa), может варьироваться от случая к случаю. Предпочтительно молярное соотношение количеств сульфонамида (V) и компонентов формулы (III) или (II) составляет соответственно от 1:0,8 до 1: 3,5, в частности соответственно от 1:1 до 1:2.
В формуле (I) и во всех последующих формулах остатки – алкил, алкокси, галоалкил, галоалкокси, алкиламино и алкилтио, а также соответствующие ненасыщенные и/или замещенные остатки могут быть в углеродном скелете соответственно линейными или разветвленными. Если специально ничего не указано, то в этих остатках предпочтительны скелеты низших углеводородов, например, с 1-6 C-атомами, в случае ненасыщенных групп, предпочтительны скелеты с 2-6 C-атомами.
Галоген означает, например, фтор, хлор, бром или йод. Галоалкил, галоалкенил и галоалкинил означают алкил, алкенил или алкинил, частично или полностью замещенные галогеном, предпочтительно фтором, хлором и/или бромом, в особенности, фтором или хлором.
Ароматический карбоциклический остаток (=арил) означает моно-, би- или полициклическую ароматическую систему, например, фенил, нафтил, тетрагидронафтил, инденил, инданил, пенталенил, флуоренил и т.п., предпочтительно фенил.
Гетероциклический остаток или кольцо (гетероциклил) может быть насыщенным, ненасыщенным или гетероароматическим; содержащим, предпочтительно один или несколько гетероатомов в кольце, которые охватывают также замещенные гетероатомы, предпочтительно из группы N, O, S, SO, SO2; например, он является алифатическим гетероциклильным остатком с 3-7 атомами в кольце или гетероароматическим остатком с 5 или 6 атомами в кольце и содержит 1, 2 или 3 гетероединицы. Гетероциклический остаток может быть, например, гетероароматическим остатком или кольцом (гетероарил), как например, моно-, би- или полициклическая ароматическая система, в которой, по меньшей мере, 1 кольцо содержит один или несколько гетероатомов, например, пиридил, пиримидинил, пиридазинил, пиразинил, тиенил, тиазолил, оксазолил, фурил, пирролил, пиразолил и имидазолил, или является парциально и полностью гидрированным остатком, как например, оксиранил, пирролидил, пиперидил, пиперазинил, диоксоланил, морфолинил, тетрагидрофурил.
В качестве заместителей для замещенного ароматического или гетероароматического остатка во внимание принимают например: один или несколько, предпочтительно 1, 2 или 3 остатка из группы галоген, алкил, галоалкил, алкокси, галоалкокси, алкилтио, гидрокси, амино, нитро, карбокси, циано, азидо, алкоксикарбонил, алкилкарбонил, формил, карбамоил, моно- и диалкиламинокарбонил, замещенный амино, как например, ациламино, моно- и диалкиламино, и алкилсульфинил, галоалкилсульфинил, алкилсульфонил и галоалкилсульфонил; в понятие “замещенные остатки”, как замещенный арил и т.п., в качестве заместителей дополнительно к названным насыщенным, содержащим углеводород остаткам включены соответствующие ненасыщенные алифатические и ароматические остатки, как замещенный алкенил, алкинил, алкенилокси, алкинилокси, фенил, фенокси и т.д. В случае остатков с C-атомами предпочтительны остатки с 1-4 C-атомами, в частности, с 1 или 2 C-атомами. Предпочтительны, как правило, заместители из группы галогенов, например, фтор и хлор, C1-C4-алкил, предпочтительно, метил или этил, C1-C4-галоалкил, предпочтительно трифторметил, C1-C4-алкокси, предпочтительно метокси или этокси, C1-C4-галоалкокси, нитро и циано. Особенно предпочтительны при этом заместители метил, метокси и хлор.
Для способа по изобретению в качестве соединений формулы (III) пригодны первичные или вторичные аминопиримидины или же аминотриазины, причем гетероциклические кольца могут быть незамещенными или замещенными. Типичные амины представляют собой, например, соединения формулы (IIa),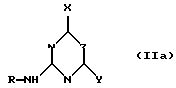 в которой R означает водород, C1-C5-алкил, C1-C5-галоалкил, C1-C5-алкокси или C1-C5-галоалкокси, предпочтительно водород и C1-C4-алкил, X, Y независимо друг от друга означают водород, галоген, C1-C6-алкил, C1-C6-алкокси, C1-C6-алкилтио, моно- и ди-(C1-C4-алкил)амино, причем каждый из шести названных последними остатков в алкильной части не замещен или замещен одним или несколькими остатками из группы галоген, C1-C4-алкокси, C1-C4-галоалкокси и C1-C4-алкилтио, или означают C3-C6-циклоалкил, C2-C6-алкенил, C2-C6-алкинил, C2-C6-алкенилокси или C2-C6-алкинилокси, и Z означает OH или N. Замещенные или незамещенные диарилкарбонаты формулы (III), в особенности, дифенилкарбонаты, пригодны в качестве реагента для способа согласно изобретению. Предпочтительные соединения соответствуют формуле (IIIa) 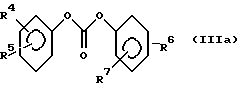 в которой R4, R5, R6 и R7 означают независимо друг от друга водород, галоген, C1-C4-алкил, C1-C4-галоалкокси, C1-C4-галоалкил, C1-C4-алкокси, нитро или CN. В качестве ароматических или гетероароматических сульфонамидов формулы A-SO2NH2 (V) предпочтительными являются соединения формул от (Va) до (Ve). 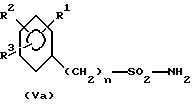 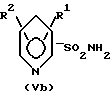 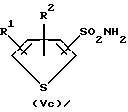 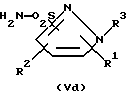 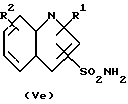 в которых n означает 0 или 1, R1 означает H, OH, CO2H, CONH2, галоген, CN, NO2, NH2, SO2NH2, C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, C3-C7-циклоалкил, C4-C10-циклоалкилалкил, C1-C6-алкокси, C2-C6-алкенокси, C2-C6-алкинокси, C3-C7-циклоалкокси, C4-C10-циклоалкилалкокси, моно- или ди-(C1-C4-алкил)амино, C1-C6-алкилтио, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, C2-C6-алкенилсульфинил, C2-C6-алкенилсульфонил, C2-C6-алканилтио, C2-C6-алкинилтио, C2-C6-алкинилсульфинил, C2-C6-алкинилсульфонил, C3-C7-циклоалкилсульфонил, C4-C9-циклоалкилалкилсульфонил, C1-C6-алкоксикарбонил, C2-C6-алкеноксикарбонил, C2-C6-алкиноксикарбонил, C3-C7-циклоалкоксикарбонил, моно и ди-(C1-C4-алкил)аминокарбонил, моно- и ди-(C1-C4-алкил)аминосульфонил, причем каждый из 31 названных последними остатка является незамещенным или замещенным одним или несколькими остатками из группы галоген, CN, OH, NH2, NO2, NHCH3, N(CH3)2, C1-C3-алкокси, C1-C3-галоалкокси, C1-C3-алкилтио, C1-C3-галоалкилтио, фенил, COOCH3, COOC2H5, CONH2, CONHCH3, CON(CH3)2, SO2CH3, SO2C2H5, SOCH3 и SOC2H5, R2 означает H, OH, NH2, моно- и ди-(C1-C4-алкил)амино, C1-C4-алкокси, C2-C4-алкенокси, C2-C4-алкинокси, причем названные последними пять остатков являются незамещенными или замещенными одним или несколькими остатками из группы галоген, CN, C1-C3-галоалкил, C1-C3-алкокси и C1-C3-галоалкокси, или NR’R”, CH2NR’R”, галоген, CN, NO2 или гетероциклил, причем R’ означает H, OH, C1-C6-алкил, C1-C5-алкокси, C3-C7-циклоалкил, C4-C8-циклоалкилалкил, причем четыре названных последними остатка являются незамещенными или замещенными одним или несколькими остатками из группы галоген, C1-C3-галоаклил, C1-C3-алкокси и C1-C3-галоалкокси, R” означает ацильный остаток, как например, CO-NH2, CHO, C1-C6-алкилкарбонил, C1-C6-алкоксикарбонил, C3-C7-циклоалкилкарбонил, C4-C9-циклоалкилкарбонил, C3-C7-циклоалкоксикарбонил, C4-C9-циклоалкилалкоксикарбонил, C1-C6-алкилсульфонил, моно- и ди-(C1-C4-алкил)аминокарбонил, моно- и ди-(C1-C4-алкил)аминосульфонил, причем каждый из 11 названных последними остатков является незамещенным или замещенным одним или несколькими остатками из группы галоген, C1-C3-алкокси и C1-C3-галоалкокси, или NR’R” означает замещенный или незамещенный остаток гидразина, и R3 означает H, галоген, C1-C3-алкил, C1-C3-галоалкил, C1-C3-алкокси, C1-C3-галоалкокси, NH2, NHCH3, N(CH3)2, NO2 или CN. Способ по изобретению представлен на схеме 1 на примере определенных пиримидинов и триазинов формулы (II). Схема 1 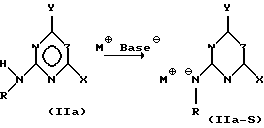 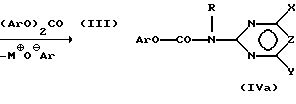 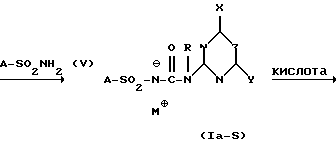 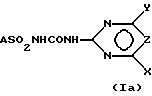 При синтезе сульфонилмочевин формулы (I) согласно способу по изобретению избегают названных выше недостатков, как например, использование высокотоксичных или же опасных химикатов (например, фосгена или же щелочных гидридов, как например, гидрид натрия). Далее, тем самым можно осуществлять взаимодействие также труднорастворимых гетероциклических аминов, как например, 2-амино-4-метокси-6-метилтриазина с очень хорошим выходом с получением сульфонилмочевины. В приводимых ниже примерах количественные данные и соотношения (в виде процентных данных) относятся к весу, если не указано иное. Пример 1 Сложный метиловый эфир 2-[[[[(4-метокси-6-метил- 1,3,5-триазин-2-ил) -амино]-карбонил]- амино]-сульфонил] -4-йодбензойной кислоты 2,85 г 2-амино-4-метокси-6-метил-1,3,5-триазина помещают в диметилацетамид (DMA) и смешивают с 2,22 г трет.-бутилата натрия. После 30-минутного перемешивания охлаждают до 5oC и добавляют 4,94 г дифенилкарбоната. После одночасового перемешивания при комнатной температуре эту смесь прикапывают к раствору 5,00 г сложного метилового эфира 2-амино-сульфонил-4-йодбензойной кислоты (92,5%-ная) и 15 мл DMA при 0oC. После перемешивания в течение 2 часов при комнатной температуре путем фильтрации из реакционной смеси отделяют твердые вещества. Фильтрат вносят в смесь из 200 мл ледяной воды и 10 мл концентрированной соляной кислоты. Выпавшую в осадок мочевину промывают водой, метанолом и диизопропиловым эфиром, а затем высушивают. Таким образом получают желаемую сульфонилмочевину с выходом готового продукта = 70% (5,2 г; чистота: 93,3% (ВЭЖХ)); 1H-ЯМР (D6-DMSO 200 МГц)  (ppm) – 12,6 (s, 1H), 8,4 (d, 1H), 8,2 (dd, 1H), 7,6 (d, 1H), 4,0 (s, 3H), 3,8 (s, 3H), 2,5 (s, 3H).
Пример 2 (ppm) – 12,6 (s, 1H), 8,4 (d, 1H), 8,2 (dd, 1H), 7,6 (d, 1H), 4,0 (s, 3H), 3,8 (s, 3H), 2,5 (s, 3H).
Пример 2Сложный метиловый эфир 2-[[[[(4-метокси-6-метил-1,3,5-триазин-2- ил) -амино]-карбонил]-амино] -сульфонил]-4-йодбензойной кислоты К суспензии из 2,85 г 2-амино-4-метокси-6-метил-1,3,5-триазина в 40 мл диметилацетамида (DMA) при комнатной температуре добавляют 2,59 г трет.-бутилата калия. После этого приблизительно при oC к этой смеси прикапывают раствор 4,94 г дифенилкарбоната в 20 мл DMA. Полученную смесь затем при температуре приблизительно 5oC прикапывают к раствору 5,00 г сложного метилового эфира 2-амино-сульфонил-4-йодбензойной кислоты (92,5%-ная) в 15 мл DMA. После окончания реакции смесь фильтруют на силикагеле  Celite. Фильтрат вносят в раствор из 200 мл ледяной воды и 10 мл концентрированной соляной кислоты. Выпавший в осадок сырой продукт затем очищают перемешиванием с метанолом и диизопропиловым эфиром, а затем высушивают.
Выход: 4,50 г (66% от теор.) Celite. Фильтрат вносят в раствор из 200 мл ледяной воды и 10 мл концентрированной соляной кислоты. Выпавший в осадок сырой продукт затем очищают перемешиванием с метанолом и диизопропиловым эфиром, а затем высушивают.
Выход: 4,50 г (66% от теор.)Пример 3 Сложный метиловый эфир 2-[[[[(4-метокси-6-метил- 1,3,5-триазин-2- ил)-амино] -карбонил]-амино]-сульфонил] -4-йодбензойной кислоты К суспензии из 1,05 г 2-амино-4-метокси-6-метил-1,3,5-триазина в 20 мл диметилацетамида (DMA) при комнатной температуре добавляют 0,96 г трет.-бутилата натрия. Затем в течение 7 минут при охлаждении на ледяной бане добавляют раствор 1,12 г дифенилкарбоната в 10 мл DMA. При этой температуре перемешивают 15 мин, а затем в течение 7 мин добавляют раствор 1,84 г сложного метилового эфира 2-аминосульфонил-4-йодбензойной кислоты (92,5%-ной) в DMA. После окончания реакции смесь обрабатывается так, как описано в примере 1. Таким образом получают 1,47 г желаемого продукта (58% от теории). Пример 4 Сложный метиловый эфир 2-[[[[(4-метокси-6-метил-1,3,5- триазин-2- ил)-амино] -карбонил]-амино]-сульфонил] -4-йодбензойной кислоты К суспензии 3,69 г 2-амино-4-метокси-6-метил-1,3,5-триазина в 100 мл DMA при комнатной температуре добавляют 5,09 г трет.-бутилата натрия. После охлаждения до 3-7oC прикапывают раствор 5,64 г дифенилкарбоната в 50 мл DMA. Реакционную смесь перемешивают в течение 15 мин при этой температуре. Затем полученную реакционную смесь прикапывают к раствору 8,85 г сложного метилового эфира 2-аминосульфонил-4-йодбензойной кислоты в 50 мл DMA при 3-7oC. После перемешивания реакционной смеси в течение 1 часа при 3oC и в течение 2 часов при комнатной температуре летучие компоненты отгоняют при пониженном давлении. Остаток растворяют в 250 мл воды и подкисляют концентрированной соляной кислотой (pH 2-3). Выпавший в осадок сырой продукт промывают метанолом и диизопропиловым эфиром. После высушивания получают 8,4 г желаемого продукта (чистота > 92%). Пример 5 Сложный метиловый эфир 2-[[[[(4-хлор-6-метоксипиримидин-2- ил)-амино]-карбонил]-амино]-сульфонил]-бензойной кислоты К суспензии из 1,68 г 2-амино-4-хлор-6-метоксипиримидина в 30 мл DMA добавляют 2,03 г трет.-бутилата натрия. После 30-минутного перемешивания при комнатной температуре реакционную смесь при 3-7oC прикапывают к раствору 1,68 г дифенилкарбоната в 25 мл DMA. Реакционную смесь медленно доводят до комнатной температуры, а затем эту смесь дозируют при 3-7oC к раствору 2,03 г сложного метилового эфира 2-аминосульфонилбензойной кислоты в 20 мл DMA. После перемешивания в течение 2 часов при этой температуре реакционную смесь концентрируют при пониженном давлении, остаток поглощают водой, смешивают с трет.-бутилметиловым эфиром и подкисляют концентрированной соляной кислотой. Выпавший твердый осадок отделяют, промывают трет.-бутилметиловым эфиром и сушат. Получают 2,36 г желаемого соединения (чистота > 90%); 1H-ЯМР (D6-DMSO, 200 МГц)  (ppm) – 12,0 (s, 1H), 10,9 (s, 1H), 8,2 (m, 1H), 7,8 (m, 3H), 6,9 (s, 1H), 4,0 (s, 3H), 3,8 (s, 3H).
Сравнительный пример (ppm) – 12,0 (s, 1H), 10,9 (s, 1H), 8,2 (m, 1H), 7,8 (m, 3H), 6,9 (s, 1H), 4,0 (s, 3H), 3,8 (s, 3H).
Сравнительный примерСложный метиловый эфир 2-[[[[(4-метокси-6-метил- 1,3,5-триазин-2- ил)-амино] -карбонил]-амино] -сульфонил]-4-йодбензойной кислоты К суспензии 0,23 г 2-амино-4-метокси-6-метил-1,3,5-триазина в 3 мл диметилацетамида (DMA) при комнатной температуре добавляют 0,084 г гидрида натрия (60%-ный в парафиновом масле) и перемешивают до завершения выделения газа. Затем к этому раствору при температуре приблизительно 5oC медленно прикапывают раствор 0,44 г дифенилкарбоната в 1 мл DMA. После 10-минутного перемешивания при охлаждении на ледяной бане медленно прикапывают раствор 0,68 г сложного метилового эфира 2-аминосульфонил-4-йодбензойной кислоты (92,5%-ная) в 2 мл DMA. После окончания реакции реакционную смесь вводят в раствор 30 мл ледяной воды и 0,25 мл концентрированной соляной кислоты. Выпавший в осадок сырой продукт очищают затем путем промывки небольшим количеством воды, метанолом и диизопропиловым эфиром и сушат. Выход готового продукта: 0,47 г (46% от теор.). Формула изобретения
Ar-O-CO-NR-B (IY) в которой Аr означает незамещенный или замещенный фенил; В означает остаток пиримидин-2-ила или 1,3,5-триазинил-2-ила, которые могут быть замещены; R означает водород, С1-5-алкил, С1-5-галоалкил, С1-5-алкокси, С1-5-галоалкокси, отличающийся тем, что соединение формулы (II) H-NR-B (II) с помощью основания M+Base–, которое представляет собой алкоголят щелочного металла, где M+ означает эквивалент катиона щелочного металла, Base– эквивалент аниона остатка алкоголята, in situ переводят в соответствующую соль формулы (II-S) М+ –NR-B (II-S) и полученную реакционную смесь подвергают взаимодействию с диарилкарбонатом формулы (III) (Аr-O)2СО (III) при этом символы Аr, В, R в формулах (II), (II-S) и (III) имеют значения, указанные для соединения формулы IV. 2. Способ по п.1, отличающийся тем, что в качестве соединения формулы III используют соединения формулы (IIа) 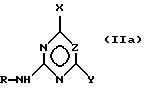 в которой R означает водород, С1-5-алкил, C1-5-галоалкил, C1-5-алкокси, C1-5-галоалкокси, Х и Y независимо друг от друга означают водород, галоген, C1-С6-алкил, C1-С6-алкокси, C1-С6-алкилтио, моно- и ди-(C1-С6-алкил)амино, при этом каждый из шести названных последними остатков в алкильной части не замещен или замещен одним или несколькими остатками из группы галоген, С1-С4-алкокси, С1-С4-галоалкокси, и С1-С4-алкилтио, или означают С3-С6-циклоалкил, С2-С6-алкенил, С2-С6-алкинил, С2-С6-алкенилокси или С2-С6-алкинилокси, и Z означает СН или CN. 3. Способ по п. 1 или 2, отличающийся тем, что в качестве соединения формулы II используют соединение формулы IIIа 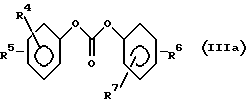 в которой R4, R5, R6 и R7 означают независимо друг от друга водород, галоген, С1-С4-алкил, С1-С4-галоалкокси, С1-С4-галоалкил, С1-С4-алкокси или CN. 4. Способ по одному из пп.1-3, отличающийся тем, что реакцию с основанием проводят в апротонном биполярном растворителе. 5. Способ по одному из п.4, отличающийся тем, что реакцию с основанием проводят при температуре от -40oС до температуры кипения соответствующего растворителя. 6. Способ по одному из пп.1-5, отличающийся тем, что реакцию с основанием проводят при температуре от -40 до 180oС. 7. Способ получения сульфонилмочевин формулы I A-SO2-NH-CO-NR-B, в которой Аr означает незамещенный или замещенный фенил; В означает остаток пиримидин-2-ила или 1,3,5-триазинил-2-ила, которые могут быть замещены; R означает водород, C1-5-алкил, C1-5-галоалкил, C1-5-алкокси, C1-5-галоалкокси; А означает незамещенный или замещенный фенил, или их солей, отличающийся тем, что соединение формулы (II) H-NR-B с помощью основания M+Base–, которое представляет собой алкоголят щелочного металла, где М+ означает эквивалент катиона щелочного металла, Base– эквивалент аниона остатка алкоголята, in situ переводят в соответствующую соль формулы (II-S) M+ –NR-B (II-S) и полученную реакционную смесь подвергают взаимодействию с диарилкарбонатом формулы (III) (Аr-О)2СО (III) с получением карбамата формулы (IY) Ar-O-CO-NR-B (IY) при этом символы Аr, В, R в формулах (II), (II-S), (III) и (IV) имеют значения, указанные для соединения формулы IV в п.1, и полученную реакционную смесь подвергают взаимодействию с сульфонамидом формулы (V) A-SO2-NH2, где А имеет вышеуказанное значение, и затем выделяют соединение формулы I или его соль. 8. Способ по п.7, отличающийся тем, что взаимодействие карбамата формулы IV с сульфонамидом формулы V проводят при температуре от -40 до 180oС. PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Адрес для переписки:
Извещение опубликовано: 10.06.2008 БИ: 16/2008
PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Адрес для переписки:
Извещение опубликовано: 10.07.2008 БИ: 19/2008
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 23.07.2008
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
