Патент на изобретение №2176912
|
||||||||||||||||||||||||||
(54) КОМПОЗИЦИИ ДЛИТЕЛЬНОГО ВЫСВОБОЖДЕНИЯ ВЕНЛАФАКСИН ГИДРОХЛОРИДА, КОМПОЗИЦИЯ ПЛЕНОЧНОГО ПОКРЫТИЯ, СПОСОБ ОБЕСПЕЧЕНИЯ ТЕРАПЕВТИЧЕСКИ АКТИВНОЙ КОНЦЕНТРАЦИИ ВЕНЛАФАКСИНА И СПОСОБ ИСКЛЮЧЕНИЯ НУЛЕВЫХ И ПИКОВЫХ КОНЦЕНТРАЦИЙ ЛЕКАРСТВЕННОГО СРЕДСТВА
(57) Реферат: Изобретение относится к дозированному составу длительного высвобождения в течение 24 ч и разовой дозированной форме этого состава в виде капсулы, включающей сфероиды, содержащие венлафаксин гидрохлорид, микрокристаллическую целлюлозу и гидроксипропилметилцеллюлозу. Изобретение касается также пленочного покрытия частиц, содержащего этилцеллюлозу с 44,0-51,0% этоксигрупп, и гидроксипропилметилцеллюлозу с 28,0-30,0% метоксигрупп и 7,0-12% гидроксипропоксигрупп. Композиция обеспечивает лучший контроль уровней плазмы крови, чем обычные таблетированные составы, которые нужно вводить два или более раз в день, и которая, кроме того, снижает количество случаев тошноты и рвоты по сравнению с обычными таблетками. 5 с. и 9 з.п. ф-лы, 3 табл. Лекарственные составы длительного высвобождения обычно изготавливают в виде спрессованных таблеток по гидрогелевой технологии таблетирования. Для получения таких лекарственных дозированных форм в виде таблеток с пролонгированным высвобождением активных ингредиент обычно смешивают с эфирами целлюлозы, такими как метилцеллюлоза, этилцеллюлоза или гидроксипропилметилцеллюлоза, с другими наполнителями или без них, и полученную смесь прессуют в таблетки. При оральном применении таблеток эфиры целлюлозы в таблетках набухают в результате гидратации от влаги в пищеварительной системе, тем самым ограничивая действие влаги на активный ингредиент. По мере постепенного выщелачивания влагой эфиров целлюлозы вода глубже проникает в гелевую матрицу, и активный ингредиент медленно растворяется и диффундирует через гель, что делает возможным его абсорбцию организмом. Пример такой лекарственной формы длительного высвобождения аналгезирующего/противовоспалительного препарата etodolac (Lodine  ) представлен в патенте США 4966768.
Когда производство таблеток невозможно, в лекарственной промышленности обычно практикуется выпуск инкапсулированных лекарственных форм, обеспечивающих свойства длительного или замедленного высвобождения. В такой ситуации можно приготовить лекарственные формы пролонгированного высвобождения в виде капсул путем смешивания лекарственного средства с одним или более связующими веществами для образования однородной смеси, которая затем смачивается водой или растворителем, таким как этанол с образованием пластической массы, которую можно шприцевать, из которой шприцуют лекарственное средство/матрицу в форме цилиндров небольшого диаметра, обычно 1 мм, разделяют на кусочки нужной длины и придают им сфероидальную форму, используя стандартное оборудование для сферонизации. После высушивания сфероиды можно покрыть пленкой, чтобы замедлить растворение. Желатиновые капсулы наполняют покрытыми пленкой сфероидальными частицами в количестве, необходимом для достижения желаемого терапевтического эффекта. Сфероидальные частицы, высвобождающие лекарственное средство с различной скоростью, можно объединить в желатиновой капсуле для получения нужных скоростей высвобождения и уровней содержания в крови. Патент США 4138475 раскрывает фармацевтическую композицию длительного высвобождения, состоящую из твердой желатиновой капсулы, наполненной покрытыми пленкой сфероидальными частицами, включающими пропанолол в смеси с микрокристаллической целлюлозой, у которых пленочное покрытие состоит из этилцеллюлозы, необязательно с гидроксипропилметилцеллюлозой и/или пластификатором.
Венлафаксин, 1-[2-(диметиламино)-1-(4-метоксифенил)- этил]циклогексанол является важным лекарственным средством в нейрофармакологическом арсенале, используемым для лечения депрессии. Венлафаксин и его кислотно-аддитивные соли раскрыты в патенте США 4535186. Венлафаксин назначают взрослым в дозах от 75 до 350 мг/день в форме спрессованных таблеток, в дробных дозах для приема два-три раза в день. При терапевтическом дозировании таблеток венлафаксин гидрохлорида быстрое растворение препарата дает быстрое повышение уровней активного соединения в плазме крови вскоре после приема лекарства, затем через несколько часов следует снижение этих уровней в плазме крови, поскольку активное соединение удаляется из организма или метаболизирует, пока уровни плазмы не приблизятся к предтерапевтическим через примерно двенадцать часов после приема лекарства, требуя таким образом дополнительную дозу лекарства. При многократном приеме лекарства в день наиболее частым побочным эффектом является тошнота, которую испытывают около сорока пяти процентов пациентов, принимающих венлафаксин гидрохлорид. У около семнадцати процентов пациентов также бывает рвота.
В соответствии с изобретением обеспечивается инкапсулированное лекарственное средство длительного высвобождения (ER), содержащее венлафаксин гидрохлорид в качестве активного лекарственного компонента, которое при однократной дозе обеспечивает терапевтический уровень сыворотки крови в течение двадцати четырех часов.
Путем введения состава венлафаксина по изобретению обеспечивают способ получения выровненной концентрации лекарственного средства в плазме в разрезе времени, таким образом возможен более жесткий контроль терапевтического уровня плазмы, нежели при многократном дневном приеме. Другими словами, изобретение обеспечивает способ исключения острых пиков и прямых линий (холмы и низменности) в уровнях лекарственного средства в плазме крови, вызванных многократным дневным дозированием таблеток с обычным немедленным высвобождением венлафаксина гидрохлорида. В сущности уровни венлафаксина гидрохлорида в плазме повышаются после введения составов длительного высвобождения согласно изобретению на период времени от около пяти до около восьми часов (оптимально около шести часов), а затем начинают падать путем растянутого, по существу линейного снижения от пика уровня лекарственного средства в плазме в течение оставшегося времени двадцатичетырехчасового периода, достигая по меньшей мере порогового значения терапевтического уровня лекарственного средства в течение всего 24-часового периода. Для сравнения, обычные таблетки венлафаксин гидрохлорида с немедленным высвобождением лекарственного средства дают пиковые уровни содержания в плазме крови через 2 – 4 часа. Следовательно, в соответствии с аспектом использования изобретения обеспечивается способ усреднения многочисленных пиковых и низших уровней плазмы крови, сопровождающих фармакокинетический метод многократного дневного дозирования таблеток венлафаксин гидрохлорида, включающий введение пациенту, нуждающемуся в лечении венлафаксин гидрохлоридом, однократной дневной дозы состава длительного высвобождения венлафаксин гидрохлорида.
Применение одноразовой дневной дозы составов венлафаксин гидрохлорида по изобретению снижает путем адаптации уровень тошноты и случаев рвоты, которые сопутствуют многократному дневному дозированному введению лекарства. При клинических испытаниях венлафаксин гидрохлорида длительного высвобождения возможность развития тошноты была заметно снижена в ходе испытаний уже через неделю. Венлафаксин гидрохлорид длительного высвобождения показал статистически значимое улучшение по сравнению с обычными таблетками венлафаксин гидрохлорида в двух восьминедельных и одном 12-недельном клинических исследованиях. Таким образом, в соответствии с аспектом использования изобретения данное изобретение обеспечивает способ снижения уровня тошноты и случаев рвоты, сопровождающих введение венлафаксин гидрохлорида, который включает дозированное введение пациенту, нуждающемуся в лечении венлафаксин гидрохлоридом, состава длительного высвобождения венлафаксин гидрохлорида один раз в день в терапевтически эффективном количестве.
1-[2-(диметиламино)-1-(4-метоксифенил)этил] циклогексанол гидрохлорид является полиморфным. Из форм, выделенных и охарактеризованных на сегодняшний день. Форма I считается кинетическим продуктом кристаллизации, который можно превратить в Форму II путем нагревания в растворителе кристаллизации. Формы I и II не различаются по температурам плавления, но представляют некоторые отличия в результатах исследования образцов методами инфракрасной спектрометрии и дифракции рентгеновских лучей. В составах по изобретению можно использовать любую из полиморфных форм, такую как Форму I или Форму II.
Составы длительного высвобождения по изобретению включают 1-[2-(диметиламино)-1-(4-метоксифенил)этил] циклогексанол гидрохлорид в смеси с микрокристаллической целлюлозой и гидроксипропилметилцеллюлозой. Сформированный в виде шариков или сфероидальных частиц, содержащий лекарственное средство состав покрывают смесью этилцеллюлозы и гидроксипропилметилцеллюлозы для обеспечения нужного уровня покрытия, обычно от около двух до около двенадцати процентов в расчете на вес/вес конечного продукта, или более предпочтительно от около пяти до около десяти процентов (вес/вес), и с лучшими результатами, получающимися при от около 6 до около 8 процентов (вес/вес). Более конкретно, составы длительного высвобождения в форме сфероидальных частиц по изобретению включают от около 30 до 40 процентов венлафаксин гидрохлорида, от около 50 до около 70 процентов микрокристаллической целлюлозы, NF, от около 0.25 до около 1 процента гидроксипропилметилцеллюлозы, USP, и от около 5 до около 10 процентов пленочного покрытия, все в расчете на вес/вес. Предпочтительно составы в форме сфероидальных частиц содержат около 35 процентов венлафаксин гидрохлорида, около 55 до 60 процентов микрокристаллической целлюлозы NF (Avicel ) представлен в патенте США 4966768.
Когда производство таблеток невозможно, в лекарственной промышленности обычно практикуется выпуск инкапсулированных лекарственных форм, обеспечивающих свойства длительного или замедленного высвобождения. В такой ситуации можно приготовить лекарственные формы пролонгированного высвобождения в виде капсул путем смешивания лекарственного средства с одним или более связующими веществами для образования однородной смеси, которая затем смачивается водой или растворителем, таким как этанол с образованием пластической массы, которую можно шприцевать, из которой шприцуют лекарственное средство/матрицу в форме цилиндров небольшого диаметра, обычно 1 мм, разделяют на кусочки нужной длины и придают им сфероидальную форму, используя стандартное оборудование для сферонизации. После высушивания сфероиды можно покрыть пленкой, чтобы замедлить растворение. Желатиновые капсулы наполняют покрытыми пленкой сфероидальными частицами в количестве, необходимом для достижения желаемого терапевтического эффекта. Сфероидальные частицы, высвобождающие лекарственное средство с различной скоростью, можно объединить в желатиновой капсуле для получения нужных скоростей высвобождения и уровней содержания в крови. Патент США 4138475 раскрывает фармацевтическую композицию длительного высвобождения, состоящую из твердой желатиновой капсулы, наполненной покрытыми пленкой сфероидальными частицами, включающими пропанолол в смеси с микрокристаллической целлюлозой, у которых пленочное покрытие состоит из этилцеллюлозы, необязательно с гидроксипропилметилцеллюлозой и/или пластификатором.
Венлафаксин, 1-[2-(диметиламино)-1-(4-метоксифенил)- этил]циклогексанол является важным лекарственным средством в нейрофармакологическом арсенале, используемым для лечения депрессии. Венлафаксин и его кислотно-аддитивные соли раскрыты в патенте США 4535186. Венлафаксин назначают взрослым в дозах от 75 до 350 мг/день в форме спрессованных таблеток, в дробных дозах для приема два-три раза в день. При терапевтическом дозировании таблеток венлафаксин гидрохлорида быстрое растворение препарата дает быстрое повышение уровней активного соединения в плазме крови вскоре после приема лекарства, затем через несколько часов следует снижение этих уровней в плазме крови, поскольку активное соединение удаляется из организма или метаболизирует, пока уровни плазмы не приблизятся к предтерапевтическим через примерно двенадцать часов после приема лекарства, требуя таким образом дополнительную дозу лекарства. При многократном приеме лекарства в день наиболее частым побочным эффектом является тошнота, которую испытывают около сорока пяти процентов пациентов, принимающих венлафаксин гидрохлорид. У около семнадцати процентов пациентов также бывает рвота.
В соответствии с изобретением обеспечивается инкапсулированное лекарственное средство длительного высвобождения (ER), содержащее венлафаксин гидрохлорид в качестве активного лекарственного компонента, которое при однократной дозе обеспечивает терапевтический уровень сыворотки крови в течение двадцати четырех часов.
Путем введения состава венлафаксина по изобретению обеспечивают способ получения выровненной концентрации лекарственного средства в плазме в разрезе времени, таким образом возможен более жесткий контроль терапевтического уровня плазмы, нежели при многократном дневном приеме. Другими словами, изобретение обеспечивает способ исключения острых пиков и прямых линий (холмы и низменности) в уровнях лекарственного средства в плазме крови, вызванных многократным дневным дозированием таблеток с обычным немедленным высвобождением венлафаксина гидрохлорида. В сущности уровни венлафаксина гидрохлорида в плазме повышаются после введения составов длительного высвобождения согласно изобретению на период времени от около пяти до около восьми часов (оптимально около шести часов), а затем начинают падать путем растянутого, по существу линейного снижения от пика уровня лекарственного средства в плазме в течение оставшегося времени двадцатичетырехчасового периода, достигая по меньшей мере порогового значения терапевтического уровня лекарственного средства в течение всего 24-часового периода. Для сравнения, обычные таблетки венлафаксин гидрохлорида с немедленным высвобождением лекарственного средства дают пиковые уровни содержания в плазме крови через 2 – 4 часа. Следовательно, в соответствии с аспектом использования изобретения обеспечивается способ усреднения многочисленных пиковых и низших уровней плазмы крови, сопровождающих фармакокинетический метод многократного дневного дозирования таблеток венлафаксин гидрохлорида, включающий введение пациенту, нуждающемуся в лечении венлафаксин гидрохлоридом, однократной дневной дозы состава длительного высвобождения венлафаксин гидрохлорида.
Применение одноразовой дневной дозы составов венлафаксин гидрохлорида по изобретению снижает путем адаптации уровень тошноты и случаев рвоты, которые сопутствуют многократному дневному дозированному введению лекарства. При клинических испытаниях венлафаксин гидрохлорида длительного высвобождения возможность развития тошноты была заметно снижена в ходе испытаний уже через неделю. Венлафаксин гидрохлорид длительного высвобождения показал статистически значимое улучшение по сравнению с обычными таблетками венлафаксин гидрохлорида в двух восьминедельных и одном 12-недельном клинических исследованиях. Таким образом, в соответствии с аспектом использования изобретения данное изобретение обеспечивает способ снижения уровня тошноты и случаев рвоты, сопровождающих введение венлафаксин гидрохлорида, который включает дозированное введение пациенту, нуждающемуся в лечении венлафаксин гидрохлоридом, состава длительного высвобождения венлафаксин гидрохлорида один раз в день в терапевтически эффективном количестве.
1-[2-(диметиламино)-1-(4-метоксифенил)этил] циклогексанол гидрохлорид является полиморфным. Из форм, выделенных и охарактеризованных на сегодняшний день. Форма I считается кинетическим продуктом кристаллизации, который можно превратить в Форму II путем нагревания в растворителе кристаллизации. Формы I и II не различаются по температурам плавления, но представляют некоторые отличия в результатах исследования образцов методами инфракрасной спектрометрии и дифракции рентгеновских лучей. В составах по изобретению можно использовать любую из полиморфных форм, такую как Форму I или Форму II.
Составы длительного высвобождения по изобретению включают 1-[2-(диметиламино)-1-(4-метоксифенил)этил] циклогексанол гидрохлорид в смеси с микрокристаллической целлюлозой и гидроксипропилметилцеллюлозой. Сформированный в виде шариков или сфероидальных частиц, содержащий лекарственное средство состав покрывают смесью этилцеллюлозы и гидроксипропилметилцеллюлозы для обеспечения нужного уровня покрытия, обычно от около двух до около двенадцати процентов в расчете на вес/вес конечного продукта, или более предпочтительно от около пяти до около десяти процентов (вес/вес), и с лучшими результатами, получающимися при от около 6 до около 8 процентов (вес/вес). Более конкретно, составы длительного высвобождения в форме сфероидальных частиц по изобретению включают от около 30 до 40 процентов венлафаксин гидрохлорида, от около 50 до около 70 процентов микрокристаллической целлюлозы, NF, от около 0.25 до около 1 процента гидроксипропилметилцеллюлозы, USP, и от около 5 до около 10 процентов пленочного покрытия, все в расчете на вес/вес. Предпочтительно составы в форме сфероидальных частиц содержат около 35 процентов венлафаксин гидрохлорида, около 55 до 60 процентов микрокристаллической целлюлозы NF (Avicel PH 101), около половины процента гидроксипропилметилцеллюлозы 2208 USP (К3, Dow, имеющей вязкость 3 сП в 2% водном растворе, содержание метоксигрупп 19-24% и содержание гидроксипропоксигрупп 4-13%), и от около 6 до 8 процентов пленочного покрытия.
Пленочное покрытие включает от 80 до 90 процентов этилцеллюлозы, NF, и 10-20 процентов гидроксипропилметилцеллюлозы (2910), USP, в расчете на вес/вес. Предпочтительно этилцеллюлоза имеет содержание этоксигрупп 44,0-51% и вязкость 50 сП в 5%-ном водном растворе, а гидроксипропилметилцеллюлоза является USP 2910 и имеет вязкость 6 сП в 2%-ном водном растворе с содержанием метоксигрупп 28-30% и содержанием гидроксипропоксигрупп 7-12%. Этилцеллюлоза, используемая по изобретению, представляет Aqualon HG 2834.
При формулировании состава, не меняя концепции изобретения, могут быть использованы другие эквиваленты гидроксипропилметилцеллюлоз 2208 и 2910 USP и этилцеллюлозы NF, имеющие такие же химические и физические свойства.
Получение состава длительного высвобождения, содержащего венлафаксин гидрохлорид, было совершенно неожиданным, поскольку известно, что гидрохлорид венлафаксина обладает сильной растворимостью в воде. Многочисленные попытки создания таблеток с длительным высвобождением с использованием гидрогелевой технологии оказались безуспешными, так как спрессованные таблетки были физически нестойкими (плохая прессуемость или проблемы с покрытием) или слишком быстро растворялись при исследованиях растворимости. Обычно таблетки, изготовленные как гидрогелевые составы замедленного высвобождения, показывали 40-50%-ную растворимость за 2 часа, 60-70%-ную растворимость за 4 часа и 85-100%-ную растворимость за 8 часов.
Многочисленные составы в виде сфероидальных частиц были получены с использованием различных сортов микрокристаллической целлюлозы и гидроксипропилметилцеллюлозы, различных соотношений венлафаксин гидрохлорида и наполнителя, различных связующих веществ, таких как поливинилпирролидон, метилцеллюлоза, вода и полиэтиленгликоль с различными значениями молекулярного веса с тем, чтобы найти состав, который бы обеспечивал подходящую грануляционную смесь, которую можно нужным образом шприцевать. В процессе шприцевания происходил разогрев при деформировании, что высушивало экструдат до такой степени, что трудно было преобразовывать экструдат цилиндрической формы в сфероидальные частицы. Добавление гидроксипропилметилцеллюлозы к смеси венлафаксин гидрохлорида с микрокристаллической целлюлозой сделало осуществимым производство сфероидальных частиц.
Следующие примеры представлены для иллюстрации способа решения заявителем проблемы получения лекарственного средства длительного высвобождения, содержащего составы по настоящему изобретению.
Пример 1.
КАПСУЛЫ С ДЛИТЕЛЬНЫМ ВЫСВОБОЖДЕНИЕМ ВЕНЛАФАКСИН ГИДРОХЛОРИДА PH 101), около половины процента гидроксипропилметилцеллюлозы 2208 USP (К3, Dow, имеющей вязкость 3 сП в 2% водном растворе, содержание метоксигрупп 19-24% и содержание гидроксипропоксигрупп 4-13%), и от около 6 до 8 процентов пленочного покрытия.
Пленочное покрытие включает от 80 до 90 процентов этилцеллюлозы, NF, и 10-20 процентов гидроксипропилметилцеллюлозы (2910), USP, в расчете на вес/вес. Предпочтительно этилцеллюлоза имеет содержание этоксигрупп 44,0-51% и вязкость 50 сП в 5%-ном водном растворе, а гидроксипропилметилцеллюлоза является USP 2910 и имеет вязкость 6 сП в 2%-ном водном растворе с содержанием метоксигрупп 28-30% и содержанием гидроксипропоксигрупп 7-12%. Этилцеллюлоза, используемая по изобретению, представляет Aqualon HG 2834.
При формулировании состава, не меняя концепции изобретения, могут быть использованы другие эквиваленты гидроксипропилметилцеллюлоз 2208 и 2910 USP и этилцеллюлозы NF, имеющие такие же химические и физические свойства.
Получение состава длительного высвобождения, содержащего венлафаксин гидрохлорид, было совершенно неожиданным, поскольку известно, что гидрохлорид венлафаксина обладает сильной растворимостью в воде. Многочисленные попытки создания таблеток с длительным высвобождением с использованием гидрогелевой технологии оказались безуспешными, так как спрессованные таблетки были физически нестойкими (плохая прессуемость или проблемы с покрытием) или слишком быстро растворялись при исследованиях растворимости. Обычно таблетки, изготовленные как гидрогелевые составы замедленного высвобождения, показывали 40-50%-ную растворимость за 2 часа, 60-70%-ную растворимость за 4 часа и 85-100%-ную растворимость за 8 часов.
Многочисленные составы в виде сфероидальных частиц были получены с использованием различных сортов микрокристаллической целлюлозы и гидроксипропилметилцеллюлозы, различных соотношений венлафаксин гидрохлорида и наполнителя, различных связующих веществ, таких как поливинилпирролидон, метилцеллюлоза, вода и полиэтиленгликоль с различными значениями молекулярного веса с тем, чтобы найти состав, который бы обеспечивал подходящую грануляционную смесь, которую можно нужным образом шприцевать. В процессе шприцевания происходил разогрев при деформировании, что высушивало экструдат до такой степени, что трудно было преобразовывать экструдат цилиндрической формы в сфероидальные частицы. Добавление гидроксипропилметилцеллюлозы к смеси венлафаксин гидрохлорида с микрокристаллической целлюлозой сделало осуществимым производство сфероидальных частиц.
Следующие примеры представлены для иллюстрации способа решения заявителем проблемы получения лекарственного средства длительного высвобождения, содержащего составы по настоящему изобретению.
Пример 1.
КАПСУЛЫ С ДЛИТЕЛЬНЫМ ВЫСВОБОЖДЕНИЕМ ВЕНЛАФАКСИН ГИДРОХЛОРИДАСмесь, состоящую из 44,8 части (88,4% свободного основания) венлафаксин гидрохлорида, 74,6 части микрокристаллической целлюлозы, NF, и 0,60 части гидроксипропилметилцеллюлозы 2208, USP, смешивают с добавлением 41,0 части воды. Пластическую массу материала шприцуют, придают сфероидальную форму и высушивают для получения непокрытых сфероидальных частиц, содержащих лекарственное средство. Перемешивают 38,25 част. этилцеллюлозы, NF, HG 2834 и 6,75 част. гидроксипропилметилцеллюлозы 2910, USP в 1:1 об/об смеси метиленхлорида и безводного метанола до полного растворения материала пленочного покрытия. К флюидизированному слою непокрытых сфероидальных частиц подают 0,667 част. раствора материала покрытия на часть непокрытых частиц для получения покрытых пленкой сфероидальных частиц с длительным высвобождением, имеющих уровень покрытия 3%. Сфероидальные частицы просеивают через сито для задержания покрытых частиц с диаметром от 0,85 мм до 1,76 мм. Такими отобранными покрытыми пленкой сфероидальными частицами заполняют твердые желатиновые капсулы с помощью обычных технологических способов. Пример 2 То же, что и для Примера 1, за исключением того, что вводят 1,11 част. раствора пленочного покрытия на часть непокрытых сфероидальных частиц для получения 5%-ного уровня покрытия. Пример 3 То же, что и для Примера 1, за исключением того, что вводят 1,33 част. раствора пленочного покрытия на 1 часть непокрытых сфероидальных частиц для получения 6%-ного уровня покрытия. Пример 4. То же, что для Примера 1, за исключением того, что вводят 1,55 част. раствора пленочного покрытия на 1 часть непокрытых сфероидальных частиц для получения 7%-ного уровня покрытия. Испытание на приемлемость уровня покрытия осуществляют с помощью анализа скорости растворения готовых сфероидальных частиц с покрытием перед их инкапсулированием. Процедуру растворения осуществляют с использованием USP Apparatus I (корзина) при 100 об/мин в очищенной воде при 37oC. Соответствие скорости растворения, приведенной в таблице 1, обеспечивает 24-часовые терапевтические уровни крови для лекарственного компонента капсул с длительным высвобождением по изобретению для препарата в форме капсул. Когда данная партия сфероидальных частиц с покрытием высвобождает лекарственное средство слишком медленно, чтобы соответствовать желаемой скорости растворения, к этой партии можно добавить порцию непокрытых сфероидальных частиц или частиц с более низким уровнем покрытия для обеспечения после тщательного смешивания загрузочной дозы для быстрого повышения уровней лекарственного средства в крови. Партия сфероидальных частиц с покрытием, которые высвобождают лекарственное средство слишком быстро, может получить дополнительное пленочное покрытие, что даст желаемый профиль растворения. Порциями содержащих венлафаксин гидрохлорид сфероидальных частиц с покрытием, имеющих скорость растворения, соответствующую скорости, приведенной в таблице 1, заполняют твердые желатиновые капсулы в количестве, необходимом для обеспечения желаемого уровня разовой дозы. Стандартная таблетка, содержащая разовую дозу с немедленным высвобождением (IR), используемая в настоящее время, обеспечивает количество венлафаксин гидрохлорида, эквивалентные 25 мг, 37,5 мг, 50 мг, 75 мг и 100 мг венлафаксина. Капсулы по настоящему изобретению наполняются так, чтобы обеспечить количество венлафаксин гидрохлорида, эквивалентное тому, которое в настоящее время используется в форме таблетки, а также до 150 мг венлафаксин гидрохлорида. Растворимость капсул венлафаксин гидрохлорида с длительным высвобождением определяют, как указано в Фармакопее США (USP) с использованием аппарата 1 при 100 об/мин и 0,9 л воды. Отфильтрованный образец среды растворения берут в определенные промежутки времени. Спектральную поглощательную способность чистого раствора определяют от 240 до 450 нанометров (нм) по отношению к среде растворения. Основную линию проводят от 450 нм через 400 нм и продлевают до 240 нм. Спектральную поглощательную способность на длине волны максимального поглощения (около 274 нм) определяют по отношению к этой основной линии. Шесть твердых желатиновых капсул заполняют теоретическим количеством сфероидальных частиц венлафаксин гидрохлорида и измеряют для растворения. Стандартные образцы состоят из стандартных растворов венлафаксин гидрохлорида плюс корректирующий раствор желатиновой капсулы. Количество высвобожденного венлафаксин гидрохлорида, выраженное в процентах, определяют из следующего уравнения: 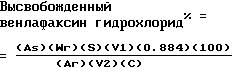 где As – спектральная поглощательная способность образца; Wг – вес эталона, мг; S – концентрация эталона, в виде десятичной дроби; V1 – объем среды растворения, используемой для растворения дозированной формы, мл; 0.884 – процент свободного основания; Aг – спектральная поглощательная способность стандартного препарата; V2 – объем эталонного раствора, мл; и C – заполняемость капсул в мг. Таблица 2 показывает уровень венлафаксина в плазме по отношению ко времени для одной обычной таблетки немедленного высвобождения весом 75 мг, вводимой каждые 12 часов, двух капсул длительного высвобождения весом 75 мг, вводимых одновременно каждые 24 часа, и одной капсулы длительного высвобождения весом 150 мг, вводимой раз в 24 часа человеческим мужским субъектам. Эти субъекты уже получали венлафаксин гидрохлорид в соответствии с протоколом дозирования, таким образом его уровень в плазме крови в нулевое время, когда вводили дозы, не был нулевым. Таблица 2 показывает, что две капсулы весом по 75 мг венлафаксин гидрохлорида с длительным высвобождением и одна капсула весом 150 мг венлафаксин гидрохлорида длительного высвобождения обеспечивают очень близкие уровни крови. Данные также показывают, что уровень плазмы после 24 часов для каждого из двух режимов длительного высвобождения очень близок к уровню, который обеспечивают две таблетки венлафаксин гидрохлорида немедленного высвобождения весом по 75 мг, вводимые с 12-часовыми интервалами. Кроме того, уровни венлафаксина в плазме, полученные с помощью состава длительного высвобождения, не поднимаются до пиковых уровней, полученных с обычными таблетками немедленного высвобождения, вводимыми каждые 12 часов. Пиковый уровень венлафаксина от препаратов длительного высвобождения несколько ниже 150 нг/мл достигается примерно через 6 часов, плюс или минус два часа, в расчете на эту конкретную дозу, вводимую пациентам, проходящим в настоящее время лечение препаратами венлафаксин гидрохлорида немедленного высвобождения. Пиковый уровень венлафаксина в плазме, несколько выше 200 нг/мл, после введения препарата немедленного высвобождения достигается через два часа и затем быстро падает. Таблица 3 показывает уровни венлафаксина в плазме крови мужских человеческих субъектов, имеющих нулевой начальный уровень венлафаксина в плазме крови. Снова пиковое значение концентрации венлафаксина в плазме крови наблюдается через примерно 6 часов после введения дозы венлафаксин гидрохлорида длительного высвобождения в форме капсул в указанных количествах. Субъекты, получающие одну таблетку с немедленным высвобождением весом 50 мг, показывали пиковый уровень плазмы через примерно 4 часа. Для сравнения уровни венлафаксина в плазме для субъектов, принимающих обычные таблетки, можно умножить на коэффициент 3, чтобы приблизительно получить уровни, ожидаемые для единичной дозы в 150 мг обычного состава. Уровни венлафаксина в плазме крови измеряли по следующему методу. Образцы крови субъектов собирали в гепаринизированные эвакуированные пробирки для сбора крови, и пробирки осторожно перевертывали несколько раз. Быстро как только возможно, пробирки центрифугировали при 2500 об/мин в течение 15 минут. С помощью пипетки плазму помещали в пластиковые пробирки и хранили при -20oC до завершения анализа. К 1 мл каждого образца плазмы в пластиковой пробирке добавляли 150 мкл основного внутреннего стандартного раствора (150 мкг/мл). Насыщенный раствор бората натрия (0,2 мл) добавляли в каждую пробирку и перемешивали с завихрением. 5 мл этилового эфира добавляли в каждую пробирку, которую потом закрывали колпачком и взбалтывали в течение 10 минут с высокой скоростью. Пробирки затем центрифугировали в течение 5 минут со скоростью 3000 об/мин. Водный слой замораживали в сухом льду, а органический слой переносили в чистую пробирку с завинчивающейся крышкой. 0,3 мл порцию 0,01 N раствора HCl добавляли в каждую пробирку и взбалтывали в течение 10 минут с высокой скоростью. Водный слой замораживали, а органический слой удаляли и отбрасывали. 50 мкл порцию подвижной фазы (23:77 ацетонитрил:0,1М моноосновный аммоний фосфатный буфер, pH 4,4) добавляли в каждую пробирку, перемешивали с завихрением, и пробы объемом 50 мкл впрыскивали на Supelco Supelcoil LC-8-DB, 5 см х 4,6 мм, 5  колонка в аппарате жидкостной хроматографии высокого давления, снабженного детектором Waters Lambda Мах 481 или эквивалентным на 229 нм. Растворы венлафаксин гидрохлорида при различных концентрациях использовали в качестве стандартных.
Таким образом желаемая скорость растворения дозированной формы венлафаксин гидрохлорида с длительным высвобождением, которого нельзя достичь с помощью гидрогелевой технологии таблетирования, была получена с композициями в форме покрытых пленкой сфероидальных частиц по настоящему изобретению. колонка в аппарате жидкостной хроматографии высокого давления, снабженного детектором Waters Lambda Мах 481 или эквивалентным на 229 нм. Растворы венлафаксин гидрохлорида при различных концентрациях использовали в качестве стандартных.
Таким образом желаемая скорость растворения дозированной формы венлафаксин гидрохлорида с длительным высвобождением, которого нельзя достичь с помощью гидрогелевой технологии таблетирования, была получена с композициями в форме покрытых пленкой сфероидальных частиц по настоящему изобретению.
Формула изобретения
РИСУНКИ
PD4A – Изменение наименования обладателя патента Российской Федерации на изобретение
Номер и год публикации бюллетеня: 23-2002
(73) Новое наименование патентообладателя:
Извещение опубликовано: 20.08.2002
|
||||||||||||||||||||||||||
