Патент на изобретение №2174983
|
||||||||||||||||||||||||||
(54) N-(S)-1-ФЕНИЛ-1-АЛКАНАМИД N-(3,3-ДИМЕТИЛБУТИЛ)-L-АСПАРТИЛ-D-
(57) Реферат: Описываются новые соединения N-(S)-1-фенил-1-алканамид N-(3,3-диметилбутил)-L-аспартил-D-  -аминоалкановой кислоты общей формулы (I), в которой Y является С2Н5 или СН(СН3)2 и R” является (S) СН(С2Н5)С6Н5, (S)CH(CH3)C6H5 или (R)CH(CH2OCH3)C6H5. Соединения могут быть использованы в качестве подсластителей. Описывается также способ их получения. 2 с. и 7 з.п.ф-лы, 1 табл., 2 ил. -аминоалкановой кислоты общей формулы (I), в которой Y является С2Н5 или СН(СН3)2 и R” является (S) СН(С2Н5)С6Н5, (S)CH(CH3)C6H5 или (R)CH(CH2OCH3)C6H5. Соединения могут быть использованы в качестве подсластителей. Описывается также способ их получения. 2 с. и 7 з.п.ф-лы, 1 табл., 2 ил.
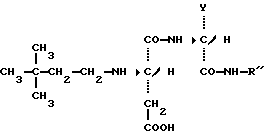
Настоящее изобретение относится к новым соединениям, производным дипептидов, используемых в качестве подсластителей, а также к способу их получения. Эти новые соединения особенно пригодны для подслащивания различных продуктов, в особенности напитков, продуктов питания, кондитерских изделий, продуктов выпечки, жевательных резинок, гигиенических продуктов и принадлежностей туалета, а также косметических, фармацевтических и ветеринарных продуктов. Известно, что для того, чтобы быть используемым в промышленных масштабах, подсластитель должен, во-первых, обладать значительным подслащивающим эффектом, делая возможным ограничение затрат на использование, и, во-вторых, иметь удовлетворительную стабильность, то есть стабильность, соответствующую условиям использования. Среди подсластителей, используемых в настоящее время на рынке, дипептидное производное L-аспартил-L- фенилаланинметиловый эфир, известный под наименованием аспартам и имеющий следующую формулу: 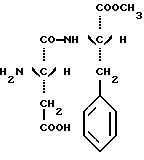 используется наиболее широко (US 3,475,403). Относительно слабый эффект подслащивания данного соединения приблизительно превышает подслащивающий эффект для сахарозы в от 120 до 180 раз, исходя из весовых количеств. Несмотря на его превосходные органолептические свойства, основной недостаток данного соединения заключается в том, что он является дорогостоящим продуктом в связи с его относительно низким подслащивающим эффектом, а также он имеет относительно низкую стабильность в условиях, обычно используемых для подсластителей, что ограничивает область его промышленного использования. В FR 92 13615 заявители предложили подсластители со следующей общей формулой: 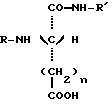 в которой R является насыщенной или ненасыщенной, ациклической, циклической или смешанной углеводородной группой, имеющей от четырех до тринадцати углеродных атомов; n равно 1 или 2; и R’ представляется следующей формулой: 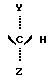 в которой Y выбирается из групп COOCH3, COOC2H5, CH3, CH2ОН, CON(CH3)2, С6H5, 2-фурил и H; Z выбирается из групп CH2C6H5, С6H5, н-C4H9, COOCH3, COOC2H5-, COOC3H7, COO-фенхил и CONHR”, где R” выбирается из групп CH3, CH2CH3, CH2CH2CH3, CH2CH2CH(CH3)2, CH(CH3)COOCH3, CH(с-C3H5)2, CH(с-C3H5)С(CH3)3, фенхил, 2,6- диметилциклогексил, 2,2,5,5-тетраметилциклопентил и 2,2,4,4- тетраметил-3-тиэтанил. Один из видов варианта реализации, описанный в документе FR 92 13615, касается производных L- аспарагиновой кислоты (n = 1) со следующей формулой: 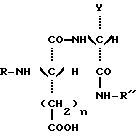 в которой R, Y и R” -те же, что и описаны ниже. Предпочтительным соединением данного изобретения является N-(3, 3-диметилбутил)-L-аспартил-N-(дициклопропилкарбинил)-D- аланинамид с формулой: 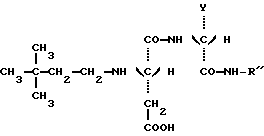 в которой Y представляет собой метильную группу, а R” является дициклопропилкарбинильной группой, которая обладает подслащивающим эффектом, в 2500 раз превышающим эффективность сахарозы, исходя из весовых количеств в сравнении с 2% раствором сахарозы. Было обнаружено, что возможно получить новые подслащиваюшие соединения вышеуказанных формул при соответствующем подборе заместителей Y и R”, отличных от тех, которые предлагаются в данном более раннем документе. Таким образом, в том случае, если Y представляет собой этильную, изопропильную или (R) –  -гидрооксиэтильную группу, а R” представляет собой (S)- -гидрооксиэтильную группу, а R” представляет собой (S)-  -этилбензильную, (S)- -этилбензильную, (S)-  – метилбензильную или (R)- – метилбензильную или (R)-  -метоксиметилбензильную группу, получаются новые соединения, которые обладают превосходными органолептическими качествами, связанными с очень высоким подслащивающим эффектом, превыщающий эффект сахарозы во вплоть до 8000 раз, исходя из весовых количеств. Более того, стабильность данных соединений в кислом или нейтральном растворе значительно превышает стабильность аспартама, что в результате должно увеличить по сравнению с аспартамом их возможности для использования при приготовлении пищевых продуктов.
Таким образом, задачей настоящего изобретения является создание новых подсластителей, имеющих следующую формулу: -метоксиметилбензильную группу, получаются новые соединения, которые обладают превосходными органолептическими качествами, связанными с очень высоким подслащивающим эффектом, превыщающий эффект сахарозы во вплоть до 8000 раз, исходя из весовых количеств. Более того, стабильность данных соединений в кислом или нейтральном растворе значительно превышает стабильность аспартама, что в результате должно увеличить по сравнению с аспартамом их возможности для использования при приготовлении пищевых продуктов.
Таким образом, задачей настоящего изобретения является создание новых подсластителей, имеющих следующую формулу: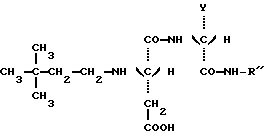 в которой: Y является C2H5 или CH(CH3)2 или (R)CH(OH)CH3; и R” является (S) CH(CH2H5)C6H5, (S)CH(CH3)С6H5 или (R)CH(CH2OCH3)C6H5. Наиболее предпочтительными являются соединения N-(S)-1- фенил-1-пропанамид N-(3,3-диметилбутил)-L-аспартил-D-  – аминомасляной кислоты с формулой: – аминомасляной кислоты с формулой: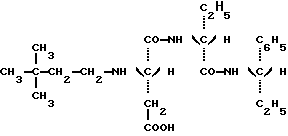 который имеет подслащивающий эффект, превышающий эффективность сахарозы приблизительно в 8000 раз, исходя из весовых количеств в сравнении с 2% раствором сахарозы; N-(S)-1-фенил-1-пропанамид N-(3,3-диметилбутил)-L-аспартил-D- валина с формулой: 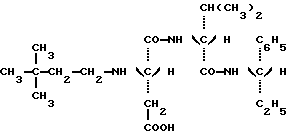 который имеет подслащивающий эффект, превышающий эффективность сахарозы приблизительно в 3000 раз, исходя из весовых количеств в сравнении с 2% раствором сахарозы; N-(S)-1-фенил-2-метокси-1-этанамид N-(3,3-диметилбутил)-L- аспартил-D-  -аминомасляной кислоты с формулой: -аминомасляной кислоты с формулой: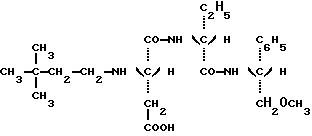 который имеет подслащивающий эффект, превышающий эффективность сахарозы приблизительно в 4000 раз, исходя из весовых количеств в сравнении с 2% раствором сахарозы; N-(S)-1-фенил-2-метокси-1-этанамид N-(3,3-диметилбутил)- L-аспартил-D-валина с формулой: 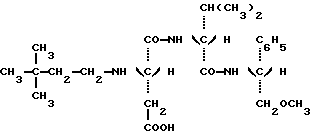 который имеет подслащивающий эффект, превышающий эффективность сахарозы приблизительно в 4000 раз, исходя из весовых количеств в сравнении с 2% раствором сахарозы; Более того, было продемонстрировано, что стабильность данных соединений настоящего изобретения значительно превышает стабильность аспартама в условиях, обычно используемых для приготовления пищевых продуктов. Данное преимущество является наиболее важным, поскольку одним из ограничений использования аспартама в некоторых пищевых продуктах является его очень низкая стабильность в средах, близких к нейтральным, то есть для значений pH приблизительно 7, значений pH, которые часто встречаются в продуктах, таких как молочные продукты, продукты выпечки или в других продуктах, требующих высоких температур при готовке. Также было показано, что стабильность соединений настоящего изобретения дополнительно улучшена в кислых средах при значениях pH приблизительно 3, что соответствует значениям pH шипучих напитков, которые представляют собой одно из основных использований подсластителей. Таким образом, в результате исследования ускоренного “старения” путем длительного нагревания водного раствора, pH которого равно 3 при 70oC, было показано, что одно из характеристических соединений настоящего изобретения, N-(S)- 1-фенил-1-пропанамид N-(3,3-диметилбутил)-L-аспартил-D-  – аминомасляной кислоты, обладает периодом полураспада, равным приблизительно 72 часам. Для сравнения период полураспада аспартама при тех же самых условиях составляет только приблизительно 24 часа, что соответствует стабильности, приблизительно в 3 раза большей, для соединения, соответствующего настоящему изобретению.
То же самое исследование ускоренного “старения” при pH 7 показало, что то же самое соединение, N-(S)-1-фенил-1- пропанамид N-(3,3-диметилбутил)-L-аспартил-D- – аминомасляной кислоты, обладает периодом полураспада, равным приблизительно 72 часам. Для сравнения период полураспада аспартама при тех же самых условиях составляет только приблизительно 24 часа, что соответствует стабильности, приблизительно в 3 раза большей, для соединения, соответствующего настоящему изобретению.
То же самое исследование ускоренного “старения” при pH 7 показало, что то же самое соединение, N-(S)-1-фенил-1- пропанамид N-(3,3-диметилбутил)-L-аспартил-D-  -аминомасляной кислоты, обладает периодом полураспада, равным приблизительно 12 дням, в то время как период полураспада аспартама при тех же самых условиях составляет только 10 минут, что соответствует стабильности, приблизительно в 1700 раз большей, для соединения, соответствующего настоящему изобретению. Сопоставимые результаты были получены и у других характеристических соединений настоящего изобретения.
Благодаря своей высокой подслащивающей способности другим преимуществом соединений настоящего изобретения по сравнению со аспартамом являются возможности, при их применении для пищевых продуктов, использования очень незначительных количеств активного вещества. Именно таким способом, например, можно заменить в одном литре шипучего напитка 550 мг аспартама на приблизительно 20 мг N-(S)-1- фенил-1-пропанамид N-(3,3-диметилбутил)-L-аспартил-D- -аминомасляной кислоты, обладает периодом полураспада, равным приблизительно 12 дням, в то время как период полураспада аспартама при тех же самых условиях составляет только 10 минут, что соответствует стабильности, приблизительно в 1700 раз большей, для соединения, соответствующего настоящему изобретению. Сопоставимые результаты были получены и у других характеристических соединений настоящего изобретения.
Благодаря своей высокой подслащивающей способности другим преимуществом соединений настоящего изобретения по сравнению со аспартамом являются возможности, при их применении для пищевых продуктов, использования очень незначительных количеств активного вещества. Именно таким способом, например, можно заменить в одном литре шипучего напитка 550 мг аспартама на приблизительно 20 мг N-(S)-1- фенил-1-пропанамид N-(3,3-диметилбутил)-L-аспартил-D-  – аминомасляной кислоты настоящего изобретения и таким образом уменьшить приблизительно в 27 раз израсходованные количества подсластителя, в то же самое время сохраняя идентичные органолептические свойства.
Подсластители настоящего изобретения могут быть добавлены в любой съедобный продукт, которому требуется придать сладкий вкус, при том условии, что он добавляется в достаточных количествах для достижения требуемого уровня сладкого вкуса. Оптимально используемые концентрации подсластителя будут зависеть от различных факторов, таких как, например, эффективность подслащивания подсластителя, условия хранения и использования продуктов, конкретные компоненты продуктов и требуемый уровень сладкого вкуса. Любой квалифицированный специалист может легко определить оптимальное количество подсластителя, которое должно быть использовано для того, чтобы получить съедобный продукт, путем проведения рутинных сенсорных анализов. Подсластители настоящего изобретения будут в общем добавляться в съедобные продукты в количествах, соответствующих подслащивающему эффекту, для соединения, находящемуся в диапазоне от 5 мг до 50 мг подсластителя на килограмм или на литр съедобного продукта. Концентрированные продукты очевидно будут содержать более значительные количества подсластителя и затем будут разбавляться в соответствии с конечным предполагаемым использованием.
Подсластители настоящего изобретения могут быть добавлены в чистом виде к подслащивающим продуктам, но вследствие их высокого подслащивающего эффекта они обычно смешиваются с подходящим носителем или наполнителем.
Преимущественно подходящие носители или наполнители выбираются из группы, состоящей из полидекстрозы, крахмала, мальтодекстринов, целлюлозы, метилцеллюлозы, карбоксиметилцеллюлозы и других производных целлюлозы, альгината натрия, пектинов, смол, лактозы, мальтозы, глюкозы, лейцина, глицерина, маннитола, сорбитола, бикарбоната натрия, ортофосфорной, лимонной, винной, фумаровой, бензойной, сорбиновой и пропионовой кислот и их натриевых, калиевых и кальциевых солей, и их эквивалентов.
Подсластители, соответствующие настоящему изобретению, в съедобном продукте могут быть использованы индивидуально или в комбинации с другими подсластителями, такими как сахароза, зерновой сироп, фруктоза, сладкие дипептидные аналоги или производные (аспартам, алитам), дигидрохалькон неохесперидина, гидрированная изомальтулоза, стевиозид, L сахара, глициризин, ксилитол, сорбитол, маннитол, ацесульфам-K, сахарин и их натриевые, калиевые, аммониевые и кальциевые соли, цикламовая кислота и ее натриевые, калиевые и кальциевые соли, сукралоза, монеллин, тауматин и их эквиваленты.
Соединения настоящего изобретения получают в результате восстановительного N-алкилирования, заключающего в конденсировании предшественника дипептида с формулой: – аминомасляной кислоты настоящего изобретения и таким образом уменьшить приблизительно в 27 раз израсходованные количества подсластителя, в то же самое время сохраняя идентичные органолептические свойства.
Подсластители настоящего изобретения могут быть добавлены в любой съедобный продукт, которому требуется придать сладкий вкус, при том условии, что он добавляется в достаточных количествах для достижения требуемого уровня сладкого вкуса. Оптимально используемые концентрации подсластителя будут зависеть от различных факторов, таких как, например, эффективность подслащивания подсластителя, условия хранения и использования продуктов, конкретные компоненты продуктов и требуемый уровень сладкого вкуса. Любой квалифицированный специалист может легко определить оптимальное количество подсластителя, которое должно быть использовано для того, чтобы получить съедобный продукт, путем проведения рутинных сенсорных анализов. Подсластители настоящего изобретения будут в общем добавляться в съедобные продукты в количествах, соответствующих подслащивающему эффекту, для соединения, находящемуся в диапазоне от 5 мг до 50 мг подсластителя на килограмм или на литр съедобного продукта. Концентрированные продукты очевидно будут содержать более значительные количества подсластителя и затем будут разбавляться в соответствии с конечным предполагаемым использованием.
Подсластители настоящего изобретения могут быть добавлены в чистом виде к подслащивающим продуктам, но вследствие их высокого подслащивающего эффекта они обычно смешиваются с подходящим носителем или наполнителем.
Преимущественно подходящие носители или наполнители выбираются из группы, состоящей из полидекстрозы, крахмала, мальтодекстринов, целлюлозы, метилцеллюлозы, карбоксиметилцеллюлозы и других производных целлюлозы, альгината натрия, пектинов, смол, лактозы, мальтозы, глюкозы, лейцина, глицерина, маннитола, сорбитола, бикарбоната натрия, ортофосфорной, лимонной, винной, фумаровой, бензойной, сорбиновой и пропионовой кислот и их натриевых, калиевых и кальциевых солей, и их эквивалентов.
Подсластители, соответствующие настоящему изобретению, в съедобном продукте могут быть использованы индивидуально или в комбинации с другими подсластителями, такими как сахароза, зерновой сироп, фруктоза, сладкие дипептидные аналоги или производные (аспартам, алитам), дигидрохалькон неохесперидина, гидрированная изомальтулоза, стевиозид, L сахара, глициризин, ксилитол, сорбитол, маннитол, ацесульфам-K, сахарин и их натриевые, калиевые, аммониевые и кальциевые соли, цикламовая кислота и ее натриевые, калиевые и кальциевые соли, сукралоза, монеллин, тауматин и их эквиваленты.
Соединения настоящего изобретения получают в результате восстановительного N-алкилирования, заключающего в конденсировании предшественника дипептида с формулой: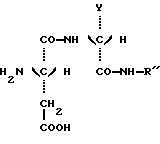 в которой Y и R” – те же, что определенные ранее, с 3,3-диметилбутиральдегидом в присутствии восстановителя. Восстановителем является или водород при относительном давлении между 1 и 3 бар и процесс ведут в присутствии катализатора на основе платины или палладия в соответствии с процедурой, описанной в WO 95/30689, или же цианборгидрид натрия и процесс проводят в соответствии с процедурой, описанной в FR 92 13615. Дипептидный предшественник приведенной выше формулы может быть легко получен пептидным синтезом, включающим защиту аминовых и карбоксильных групп предшественников аминокислоты и снятие с них защиты и классические методы активирования и пептидного сочетания. Эти методики описываются подробным образом в многочисленных публикациях, среди которых в особенности может быть процитирована работа М. Bodanszky, The Practice of Peptide Synthesis, Springer – Verlag, New York, 1984, 284 pp. Очистка соединений настоящего изобретения осуществляется в соответствии со стандартными методиками, такими как перекристаллизация и хроматография. Их структура и чистота были проверены при использовании классических методик (тонкослойная хроматография, жидкостная хроматография высокого разрешения, инфракрасная спектроскопия, ядерный магнитный резонанс, элементный анализ). Подслащивающий эффект соединений, описанных в примерах, был оценен группой восьми квалифицированных людей. Для этого соединения в водных растворах при меняющихся концентрациях были сравнены по вкусу с контрольным раствором сахарозы с концентрацией 2%, 5% или 10%. Подслащивающий эффект испытываемого соединения сравнивался с сахарозой, после этого приводился в соответствие с весовым отношением между соединением и сахарозой для равного подслащивающего эффекта, то есть тогда, когда сладкий вкус раствора испытываемого соединения и сладкий вкус контрольного раствора сахарозы признавались большинством людей как имеющие тот же самый подслащивающий эффект. Стабильность соединений настоящего изобретения и аспартама были измерены путем определения, используя жидкостную хроматографию высокого разрешения (HPLC), количества продукта, остающегося после проведения ускоренного “старения” в кислой среде (фосфатный буфер при pH 3) или в нейтральной среде (фосфатный буфер при pH 7) и при температуре 70oC. Стабильность соединения, испытанная таким образом, оценивалась по его времени полураспада (время, соответствующее 50%-ному разложению). Способ согласно изобретению и преимущества, вытекающие из него, станут более ясными из примеров, приведенных ниже. Примеры Получение N-(S)-1-фенил-1-пропанамида N-(3,3- диметилбутил)-L-аспартил-D-  -аминомасляной кислоты, имеющей формулу: -аминомасляной кислоты, имеющей формулу: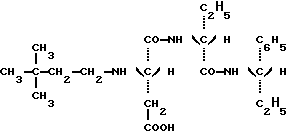 Смесь 15 г (0,145 моль) D-  -аминомасляной кислоты (продукт Aldrich N 11,612-2) и 5,82 г (0,145 моль) гидроксида натрия в 150 см3 воды охлаждают до 0oC. К этому раствору одновременно добавляют прикапыванием 24,38 г (0,145) бензилхлорформиата и 5,82 г (0,145 моль) гидроксида натрия в водном растворе (4 н). После этого смесь перемешивают в течение 3 часов при 0oC. Реакционную смесь промывают этиловым эфиром (3х30 см3) и после этого подкисляют раствором соляной кислоты (6 н) до получения pH приблизительно 1.
Образованный белый осадок отделяют фильтрацией, промывают водой и после этого высушивают. 26 г (выход 75%) N-бензилоксикарбонил-D- -аминомасляной кислоты (продукт Aldrich N 11,612-2) и 5,82 г (0,145 моль) гидроксида натрия в 150 см3 воды охлаждают до 0oC. К этому раствору одновременно добавляют прикапыванием 24,38 г (0,145) бензилхлорформиата и 5,82 г (0,145 моль) гидроксида натрия в водном растворе (4 н). После этого смесь перемешивают в течение 3 часов при 0oC. Реакционную смесь промывают этиловым эфиром (3х30 см3) и после этого подкисляют раствором соляной кислоты (6 н) до получения pH приблизительно 1.
Образованный белый осадок отделяют фильтрацией, промывают водой и после этого высушивают. 26 г (выход 75%) N-бензилоксикарбонил-D-  -аминомасляной кислоты было получено в конечном счете, ее температура плавления составляла 80oC.
К раствору 3 г (13 ммоль) таким образом полученного соединения в 50 см3 тетрагидрофурана, охлажденного до -15oC, последовательно добавляют 1,28 г (13 ммоль) N-метилморфолина и 1,15 г (13 ммоль) изобутилхлорформиата. После 2 минут перемешивания при этой температуре добавляют 1,71 г (13 ммоль) (S)-1-фенил-1-пропанамина (полученного заранее в соответствии с J.Chem.Soc., 1940, pp. 336-8). Реакционную смесь медленно нагревают и после этого перемешивают в течение 2 часов при комнатной температуре. Осадок гидрохлорида N-метилморфолина удаляют фильтрованием, после этого промывают 20 см3 тетрагидрофурана. Фильтраты концентрируют досуха в вакууме, и полученный осадок переносят в 150 см3 этилового эфира. Полученный раствор последовательно промывают 0,1 н раствором соляной кислоты, 5% раствором карбоната натрия и после этого водой (3 х 30 см3 для каждого промывания). После высушивания эфирного раствора над обезвоженным сульфатом натрия раствор концентрируют досуха в вакууме, в результате получают 3,8 г белого твердого осадка, N-(S)-1-фенил-1-пропанамида N-бензилоксикарбонил-D- -аминомасляной кислоты было получено в конечном счете, ее температура плавления составляла 80oC.
К раствору 3 г (13 ммоль) таким образом полученного соединения в 50 см3 тетрагидрофурана, охлажденного до -15oC, последовательно добавляют 1,28 г (13 ммоль) N-метилморфолина и 1,15 г (13 ммоль) изобутилхлорформиата. После 2 минут перемешивания при этой температуре добавляют 1,71 г (13 ммоль) (S)-1-фенил-1-пропанамина (полученного заранее в соответствии с J.Chem.Soc., 1940, pp. 336-8). Реакционную смесь медленно нагревают и после этого перемешивают в течение 2 часов при комнатной температуре. Осадок гидрохлорида N-метилморфолина удаляют фильтрованием, после этого промывают 20 см3 тетрагидрофурана. Фильтраты концентрируют досуха в вакууме, и полученный осадок переносят в 150 см3 этилового эфира. Полученный раствор последовательно промывают 0,1 н раствором соляной кислоты, 5% раствором карбоната натрия и после этого водой (3 х 30 см3 для каждого промывания). После высушивания эфирного раствора над обезвоженным сульфатом натрия раствор концентрируют досуха в вакууме, в результате получают 3,8 г белого твердого осадка, N-(S)-1-фенил-1-пропанамида N-бензилоксикарбонил-D-  -аминомасляной кислоты (выход 82%), имеющего температуру плавления 129oC. Его чистота была проверена тонкослойной хроматографией на силикагеле G 60 (носитель в виде окиси кремния Merck N 1.05554), при элюировании смесью хлороформ-ацетон (9-1) и проявлением изображения при помощи смеси дихромата калия – концентрированной серной кислоты, Rf = 0,45.
Раствор 3,6 г (10 ммоль) N-(3)-1-фенил-1-пропанамида N- бензилоксикарбонил-D- -аминомасляной кислоты (выход 82%), имеющего температуру плавления 129oC. Его чистота была проверена тонкослойной хроматографией на силикагеле G 60 (носитель в виде окиси кремния Merck N 1.05554), при элюировании смесью хлороформ-ацетон (9-1) и проявлением изображения при помощи смеси дихромата калия – концентрированной серной кислоты, Rf = 0,45.
Раствор 3,6 г (10 ммоль) N-(3)-1-фенил-1-пропанамида N- бензилоксикарбонил-D-  -аминомасляной кислоты в 100 см3 метанола помещают в присутствии 350 мг 10% палладия на активированном угле (продукт Fluka N 75990) в атмосферу водорода при атмосферном давлении на 18 часов. После удаления катализатора при помощи фильтрования раствор концентрируют досуха в вакууме. Получают 2,1 г (выход 91%) N-(S)-1-фенил-1-пропанамида D- -аминомасляной кислоты в 100 см3 метанола помещают в присутствии 350 мг 10% палладия на активированном угле (продукт Fluka N 75990) в атмосферу водорода при атмосферном давлении на 18 часов. После удаления катализатора при помощи фильтрования раствор концентрируют досуха в вакууме. Получают 2,1 г (выход 91%) N-(S)-1-фенил-1-пропанамида D-  -аминомасляной кислоты в виде маслянистого остатка. Его чистота была проверена при использовании тонкослойной хроматографии на силикагеле G 60 (носитель окись кремния Merck N 1.05554), элюирования смесью бутанол – уксусная кислота – вода (8-2-2) и проявления изображения при помощи нингидрина, Rf = 0,57.
К раствору 3,58 г (10 ммоль) -аминомасляной кислоты в виде маслянистого остатка. Его чистота была проверена при использовании тонкослойной хроматографии на силикагеле G 60 (носитель окись кремния Merck N 1.05554), элюирования смесью бутанол – уксусная кислота – вода (8-2-2) и проявления изображения при помощи нингидрина, Rf = 0,57.
К раствору 3,58 г (10 ммоль)  -бензилового эфира N- бензилоксикарбонил-L-аспарагиновой кислоты (продукт Bachem N С – 1350) в 50 см3 тетрагидрофурана, охлажденного до -15oC, последовательно добавляют 1 г (10 ммоль) N-метилморфолина и 1,37 г (10 ммоль) изобутилхлорформиата. После 2 минут перемешивания при данной температуре добавляют 2,1 г (10 ммоль) ранее полученного N-(S)-1-фенил-1- пропанамида D- -бензилового эфира N- бензилоксикарбонил-L-аспарагиновой кислоты (продукт Bachem N С – 1350) в 50 см3 тетрагидрофурана, охлажденного до -15oC, последовательно добавляют 1 г (10 ммоль) N-метилморфолина и 1,37 г (10 ммоль) изобутилхлорформиата. После 2 минут перемешивания при данной температуре добавляют 2,1 г (10 ммоль) ранее полученного N-(S)-1-фенил-1- пропанамида D-  -аминомасляной кислоты. Реакционную смесь медленно нагревают и после этого перемешивают в течение 2 часов при комнатной температуре. Осадок гидрохлорида N- метилморфолина удаляют фильтрованием и после этого его промывают 20 см3 тетрагидрофурана. Фильтраты концентрируют досуха в вакууме, и полученный остаток растирают в 50 см3 этилового эфира. Образованное белое твердое вещество отделяют фильтрованием и после этого промывают опять 20 см3 этилового эфира. 5 г (выход 89%) N-(S)-1-фенил-1-пропанамида N-бензилоксикарбонил- -аминомасляной кислоты. Реакционную смесь медленно нагревают и после этого перемешивают в течение 2 часов при комнатной температуре. Осадок гидрохлорида N- метилморфолина удаляют фильтрованием и после этого его промывают 20 см3 тетрагидрофурана. Фильтраты концентрируют досуха в вакууме, и полученный остаток растирают в 50 см3 этилового эфира. Образованное белое твердое вещество отделяют фильтрованием и после этого промывают опять 20 см3 этилового эфира. 5 г (выход 89%) N-(S)-1-фенил-1-пропанамида N-бензилоксикарбонил-  -бензилового эфира-L-аспартил-D- -бензилового эфира-L-аспартил-D-  -аминомасляной кислоты получают таким образом, его температура составляет 130oC. Его чистота была проверена с использованием тонкослойной хроматографии на силикагеле G 60 (носитель окись кремния Merck N 1.05554), элюирования при помощи смеси хлороформ – ацетон (8-2), проявления изображения при помощи сульфохромной смеси, Rf = 0,64.
Раствор 5 г (8,9 ммоль) N-(S)-1-фенил-1-пропанамида N- бензилоксикарбонил- -аминомасляной кислоты получают таким образом, его температура составляет 130oC. Его чистота была проверена с использованием тонкослойной хроматографии на силикагеле G 60 (носитель окись кремния Merck N 1.05554), элюирования при помощи смеси хлороформ – ацетон (8-2), проявления изображения при помощи сульфохромной смеси, Rf = 0,64.
Раствор 5 г (8,9 ммоль) N-(S)-1-фенил-1-пропанамида N- бензилоксикарбонил-  -бензиловый эфир-L-аспартил-D- -бензиловый эфир-L-аспартил-D- – аминомасляной кислоты в 100 см3 метанола помещают в атмосферу водорода, процесс проводят при атмосферном давлении в течение 18 часов в присутствии 500 мг 10% палладия на активированном угле (продукт Fluka N 75990). После удаления катализатора путем фильтрования раствор концентрируют досуха в вакууме. Таким образом получают 2,4 г (выход 80%) N-(S)-1 -фенил-1-пропанамида L-аспартил-D- – аминомасляной кислоты в 100 см3 метанола помещают в атмосферу водорода, процесс проводят при атмосферном давлении в течение 18 часов в присутствии 500 мг 10% палладия на активированном угле (продукт Fluka N 75990). После удаления катализатора путем фильтрования раствор концентрируют досуха в вакууме. Таким образом получают 2,4 г (выход 80%) N-(S)-1 -фенил-1-пропанамида L-аспартил-D-  -аминомасляной кислоты в виде белого твердого осадка. Его чистота была проверена при помощи тонкослойной хроматографии на силикагеле G 60 (носитель окись кремния Merck N 1.05554), элюирования при помощи смеси бутанол – уксусная кислота – вода (8-2-2) и проявления изображения при помощи нингидрина, Rf = 0,50. Его температура плавления в данном аморфном состоянии равнялась 195oC.
В реактор, оснащенный мешалкой, позволяющей проводить очень хороший перенос газообразного водорода в жидкую фазу, вводят при перемешивании в следующем порядке: 15 см3 0,1 М водного раствора уксусной кислоты, 26 мг палладия на активированном угле (продукт Fluka N 75990), 58 мг (0,57 ммоль) коммерческого 3,3-диметилбутиральдегида (Aldrich N 35,990-4), 15 см3 метанола и 130 мг (0,38 ммоль) ранее полученного N-(S)-1-фенил-1-пропанамида L-аспартил-D- -аминомасляной кислоты в виде белого твердого осадка. Его чистота была проверена при помощи тонкослойной хроматографии на силикагеле G 60 (носитель окись кремния Merck N 1.05554), элюирования при помощи смеси бутанол – уксусная кислота – вода (8-2-2) и проявления изображения при помощи нингидрина, Rf = 0,50. Его температура плавления в данном аморфном состоянии равнялась 195oC.
В реактор, оснащенный мешалкой, позволяющей проводить очень хороший перенос газообразного водорода в жидкую фазу, вводят при перемешивании в следующем порядке: 15 см3 0,1 М водного раствора уксусной кислоты, 26 мг палладия на активированном угле (продукт Fluka N 75990), 58 мг (0,57 ммоль) коммерческого 3,3-диметилбутиральдегида (Aldrich N 35,990-4), 15 см3 метанола и 130 мг (0,38 ммоль) ранее полученного N-(S)-1-фенил-1-пропанамида L-аспартил-D-  -аминомасляной кислоты.
После продувания реактора потоком газообразного азота смесь гидрируют при относительном давлении 1-2 бар (0,1-0,2 МПа) при комнатной температуре в течение 18 часов и в течение следующих 8 часов после еще одного добавления 19 мг (0,19 ммоль) 3,3-диметилбутиральдегида. Ход реакции контролируют при помощи тонкослойной хроматографии (TLC) на носителе Silica gel 60 F254 на алюминиевых листах (Merck N 1.05554), элюирования при помощи смеси бутанол – уксусная кислота – вода (8:2:2) и проявлении изображения при помощи нингидрина: Rf = 0,67.
Затем реакцию прерывают продуванием через реактор потока газообразного азота и катализатор отделяют фильтрованием на тонком фильтре (0,5 мкм). Раствор после этого концентрируют выпариванием в вакууме, и полученный белый твердый осадок промывают приблизительно 50 см3 этилового эфира. Получают 150 мг N-(S)-1-фенил-1-пропанамида N-(3,3-диметилбутил)-L- аспартил-D- -аминомасляной кислоты.
После продувания реактора потоком газообразного азота смесь гидрируют при относительном давлении 1-2 бар (0,1-0,2 МПа) при комнатной температуре в течение 18 часов и в течение следующих 8 часов после еще одного добавления 19 мг (0,19 ммоль) 3,3-диметилбутиральдегида. Ход реакции контролируют при помощи тонкослойной хроматографии (TLC) на носителе Silica gel 60 F254 на алюминиевых листах (Merck N 1.05554), элюирования при помощи смеси бутанол – уксусная кислота – вода (8:2:2) и проявлении изображения при помощи нингидрина: Rf = 0,67.
Затем реакцию прерывают продуванием через реактор потока газообразного азота и катализатор отделяют фильтрованием на тонком фильтре (0,5 мкм). Раствор после этого концентрируют выпариванием в вакууме, и полученный белый твердый осадок промывают приблизительно 50 см3 этилового эфира. Получают 150 мг N-(S)-1-фенил-1-пропанамида N-(3,3-диметилбутил)-L- аспартил-D-  -аминомасляной кислоты (выход 92%) в виде белого порошка с высокой чистотой (большей, чем 98% по данным Н. Р. L. С.) с температурой плавления 167oC.
Молекулярная формула: С23H37N3O4.
NMR (200 МГц, 1H, миллионные доли): DMSO D6: 0,80 (s, 15H), 1,33 (t, 2H) 1,67 (m, 4H), 2,4 (m, 4H), 3,54 (m, 1H), 4,30 (q, 1H), 4,70 (q, 1H), 7,22 (m, 1H), 7,28 (s, 5H), 8,35 (t, 2H).
Жидкостная хроматография высокого разрешения на колонке Merck типа “Lichrospher 100 RP – 18 endcapped”, длиной 244 мм, в диаметре 4,6 мм, элюент: 65 мМ аммониево-ацетатного буфера – ацетонитрила (70:30), расход: 1 мл/мин, детектор: рефрактометр, время удерживания: 16,1 мин.
Подслащивающий эффект данного соединения соответствует приблизительно, исходя из весовых количеств, эффекту, в 8000 раз превышающему эффекту сахарозы при сравнении с 2% раствором сахарозы, в 6000 раз превышающему эффект сахарозы при сравнении с 5% раствором сахарозы и превышающего в 5000 раз эффект сахарозы при сравнении с 10% раствором сахарозы.
При сравнении с аспартамом эффект подслащивания водного раствора 20 мг/л данного соединения эквивалентен раствору 550 мг/л аспартама, что соответствует эффекту подслащивания, приблизительно в 27 раз превышающему эффекту аспартама.
На фигуре 1 приведена сравнительная диаграмма кривых стабильности аспартама (кривая 1) и N-(S)-1-фенил-1-пропанамида N-(3,3-диметилбутил)-L-аспартил-D- -аминомасляной кислоты (выход 92%) в виде белого порошка с высокой чистотой (большей, чем 98% по данным Н. Р. L. С.) с температурой плавления 167oC.
Молекулярная формула: С23H37N3O4.
NMR (200 МГц, 1H, миллионные доли): DMSO D6: 0,80 (s, 15H), 1,33 (t, 2H) 1,67 (m, 4H), 2,4 (m, 4H), 3,54 (m, 1H), 4,30 (q, 1H), 4,70 (q, 1H), 7,22 (m, 1H), 7,28 (s, 5H), 8,35 (t, 2H).
Жидкостная хроматография высокого разрешения на колонке Merck типа “Lichrospher 100 RP – 18 endcapped”, длиной 244 мм, в диаметре 4,6 мм, элюент: 65 мМ аммониево-ацетатного буфера – ацетонитрила (70:30), расход: 1 мл/мин, детектор: рефрактометр, время удерживания: 16,1 мин.
Подслащивающий эффект данного соединения соответствует приблизительно, исходя из весовых количеств, эффекту, в 8000 раз превышающему эффекту сахарозы при сравнении с 2% раствором сахарозы, в 6000 раз превышающему эффект сахарозы при сравнении с 5% раствором сахарозы и превышающего в 5000 раз эффект сахарозы при сравнении с 10% раствором сахарозы.
При сравнении с аспартамом эффект подслащивания водного раствора 20 мг/л данного соединения эквивалентен раствору 550 мг/л аспартама, что соответствует эффекту подслащивания, приблизительно в 27 раз превышающему эффекту аспартама.
На фигуре 1 приведена сравнительная диаграмма кривых стабильности аспартама (кривая 1) и N-(S)-1-фенил-1-пропанамида N-(3,3-диметилбутил)-L-аспартил-D- -аминомасляной кислоты настоящего изобретения (кривая 2), полученные во время ускоренного “старения” путем нагревания их растворов в кислой среде при pH 3 (фосфатный буфер) при 70oC. При этих условиях время полураспада для аспартама составляет 24 часа, в то время как время полураспада соединения настоящего изобретения равно приблизительно 72 часам, что соответствует стабильности, которая в три раза больше для соединения настоящего изобретения по отношению к аспартаму.
На фигуре 2 приведена сравнительная диаграмма кривых стабильности (кривая 1) и N-(S)-1-фенил-1- пропанамида N-(3,3-диметилбутил)-L-аспартил-D- -аминомасляной кислоты настоящего изобретения (кривая 2), полученные во время ускоренного “старения” путем нагревания их растворов в кислой среде при pH 3 (фосфатный буфер) при 70oC. При этих условиях время полураспада для аспартама составляет 24 часа, в то время как время полураспада соединения настоящего изобретения равно приблизительно 72 часам, что соответствует стабильности, которая в три раза больше для соединения настоящего изобретения по отношению к аспартаму.
На фигуре 2 приведена сравнительная диаграмма кривых стабильности (кривая 1) и N-(S)-1-фенил-1- пропанамида N-(3,3-диметилбутил)-L-аспартил-D-  -аминомасляной кислоты настоящего изобретения (кривая 2), полученные во время ускоренного “старения” в результате нагревания их растворов в нейтральной среде при pH 7 при 70oC. При этих условиях аспартам не очень стабилен (время полураспада составляет 10 минут), в то время как соединение настоящего изобретения обладает временем полураспада, равным приблизительно 12 дням, что соответствует стабильности, которая приблизительно в 1700 раз превышает стабильность аспартама.
Подслащивающий эффект других соединений, соответствующих настоящему изобретению, полученных, следуя протоколу эксперимента, подобному тому, что приведен выше, и который специалисты в соответствующей области легко сформулируют, приведена в таблице. -аминомасляной кислоты настоящего изобретения (кривая 2), полученные во время ускоренного “старения” в результате нагревания их растворов в нейтральной среде при pH 7 при 70oC. При этих условиях аспартам не очень стабилен (время полураспада составляет 10 минут), в то время как соединение настоящего изобретения обладает временем полураспада, равным приблизительно 12 дням, что соответствует стабильности, которая приблизительно в 1700 раз превышает стабильность аспартама.
Подслащивающий эффект других соединений, соответствующих настоящему изобретению, полученных, следуя протоколу эксперимента, подобному тому, что приведен выше, и который специалисты в соответствующей области легко сформулируют, приведена в таблице.
Формула изобретения
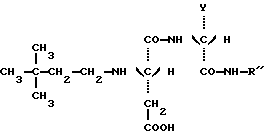 в которой Y является C2H5 или СН(СН3)2 и R” является (S) СН (С 2Н5) C6H5, (S) СН (СН3) С6Н5 или (R) СН (СН2OСН3) С6Н5.) 2. Соединение по п.1, отличающееся тем, что оно представляет собой N-(S)-1 -фенил-1-пропанамид N-(3,3-диметилбутил)-L-аспартил-D-  -аминомасляной кислоты, имеющей формулу -аминомасляной кислоты, имеющей формулу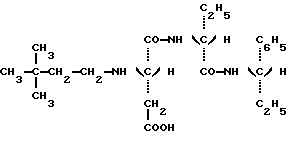 3. Соединение по п.1, отличающееся тем, что оно представляет собой N-(S)-1-фенил-1-пропанамид N-(3,3-диметилбутил)-L-аспартил-D-валина, имеющий формулу 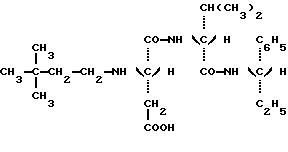 4. Соединение по п.1, отличающееся тем, что оно представляет собой N-(S)- 1 -фенил-2-метокси-1-этанамид N-(3,3-диметилбутил)-L-аспартил-D-  -аминомасляной кислоты, имеющий формулу -аминомасляной кислоты, имеющий формулу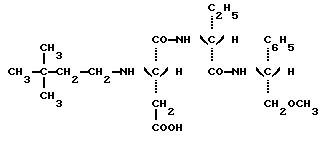 5. Соединение по п.1, отличающееся тем, что оно представляет собой N-(S)- 1-фенил-2-метокси-1-этанамид N-(3,3-диметилбутил)-L-аспартил-D-валина, имеющий формулу 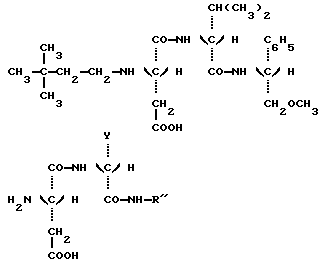 6. Соединение по любому из пп.1-5 в качестве подсластителей. 7. Способ получения соединений, по любому из пп.1-5, отличающийся тем, что он заключается в обработке восстановителем смеси 3,3-диметилбутиральдегида и соединения, имеющего формулу 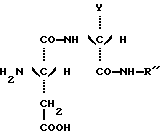 в которой Y и R” – те же, что и определенные в п.1. 8. Способ по п.7, отличающийся тем, что восстановителем является водород при относительном давлении между 1-3 бар в присутствии катализатора на основе платины или палладия. 9. Способ по п.7, отличающийся тем, что восстановителем является цианборгидрид натрия. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 08.02.2002
Номер и год публикации бюллетеня: 14-2004
Извещение опубликовано: 20.05.2004
|
||||||||||||||||||||||||||
