Патент на изобретение №2174124
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ТРИФЕНИЛСИЛАНОЛА
(57) Реферат: Описывается способ получения трифенилсиланола, заключающийся в том, что фенилхлорсилан подвергают взаимодействию с фенилмагнийхлоридом в смеси тетрагидрофурана и толуола и реакционную массу обрабатывают водой в среде тех же растворителей с последующим выделением целевого продукта, при этом тетрагидрофуран и толуол берут в объемном соотношении от 1 : 3 до 3 : 1 соответственно. Техническим результатом является возможность получать целевой продукт без выделения трифенилхлорсилана из реакционной среды с последующей обработкой водой и выделением конечного продукта, а также использование смеси растворителей, что приводит к увеличению селективности процесса. 1 табл. Изобретение относится к области получения кремнийорганических соединений, в частности к способу получения трифенилсиланола, который используется при осуществлении различных химических технологий – в качестве компонентов вулканизуемых резиновых смесей, компонента катализаторов полимеризации олефинов (полиэтилена, полипропилена), при вулканизации силиконовых каучуков, производстве термостойких покрытий, в синтезе поликарбонатов. Известен способ получения трифенилсиланола и его натриевых солей путем взаимодействия трифенилалкоксисилана или гексафенилдисилоксана с водным раствором щелочи (пат. Великобритании 631506, выданный американской корпорации Dow Corning в 1948 году) (C6H5)3SiOR + NaOH/H2O —> (C6H5)3SiOH R – алкил, Si(C6H5)3. Серьезным недостатком способа является дефицит исходных компонентов, трифенилалкоксисиланов и гексафенилдисилоксана, и сравнительно невысокий (60-70%) выход целевого продукта. Описан метод гидролиза трифенилгалоидсилана водным раствором поташа с получением калиевой соли трифенилсиланола (Андрианов К.А. Методы элементоорганической химии. Кремний. – М.: Наука, 1968, с. 207-212) (С6H5)3SiCl + К2СО3/H2O —> (С6H5)3SiOK Трифенилхлорсилан как побочный продукт образуется при прямом синтезе фенилхлорсиланов, который можно представить уравнением: 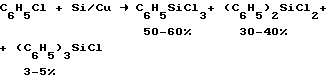 Выход последнего очень низкий, и выделение его необходимой степени чистоты (94-95%) осложняется присутствием сравнимого с ним количества примесей – тетрафенилсилана, гексафенилдисилана, фенилполисиланов, фенилполисилоксанов. Выделение и очистка трифенилхлорсилана осуществляется в несколько стадий (высоковакуумная перегонка, промывка концентрата трифенилхлорсилана и перекристаллизация остатка), что требует больших энергозатрат и значительного расхода растворителей (бензина, толуола, гексана). Эти же недостатки, связанные с использованием трифенилхлорсилана в качестве сырья для получения трифенилсиланола под действием органомагнийгалогенида и воды, присущи процессу, описанному в статье J. Organic Chemistry. 1959, v. 24, р. 1588. Наиболее близким по изобретательскому уровню и технической сущности является способ получения трифенилсиланола гидролизом трифенилхлорсилана, принятый за прототип, в растворе толуола (Назарова Д.В. и др. Металлорганические компоненты катализаторов, НИИТЭХИМ, 1986, с. 102-105) по реакции (С6H5)3SiCl + H2O —> (С6H5)3SiOH Выход трифенилсиланола при этом довольно высок (80-90% от теоретического), однако остаются труднодоступность и дороговизна исходного трифенилхлорсилана, как весьма существенный недостаток, который не позволяет эксплуатировать способ в широком масштабе. Задача предлагаемого изобретения – разработать эффективный способ получения трифенилсиланола с высоким выходом и чистотой продукта, не обладающий приведенными выше недостатками. Поставленная задача решена тем, что нами предложен и практически осуществлен способ взаимодействия дифенилдихлорсилана или фенилтрихлорсилана с реактивом Гриньяра (фенилмагнийхлоридом) и водой в смеси растворителей тетрагидрофурана (ТГФ) и толуола с последующим выделением целевого продукта из органической фазы. Процесс протекает согласно следующим уравнениям: C6H5Cl + Mg —> C6H5MgCl (С6Н5)2SiCl2 + C6H5MgCl —> (C6H5)3SiCl + MgCl2 (C6H5)SiCl3 + 2C6H5MgCl —> (C6H5)3SiCl + 2MgCl2 (С6H5)3SiCl + H2O —> (С6H5)3SiOH В ходе наших экспериментальных исследований установлено, что селективность процесса и направленность реакций на образование трифенилсиланола резко возрастают при использовании смеси растворителей ТГФ и толуола в объемном соотношении от 1:3 до 3:1. Найдена возможность получать целевой продукт без выделения трифенилхлорсилана из продуктов реакции путем простой обработки реакционной массы водой с последующим разделением водного и органического слоев, концентрированием органической фазы и отделением путем фильтрации трифенилсиланола необходимой степени чистоты (98-99%). Это характеризует предлагаемый способ как новый и промышленно применимый. Технический результат от использования смеси растворителей ТГФ и толуола оказался неожиданным и неочевидным, что позволяет отнести способ к числу процессов обладающих изобретательским уровнем. В самом деле, замена части тетрагидрофурана на толуол должна была бы уменьшить глубину протекания реакции образования фенилмагнийхлорида и селективность процесса конденсации фенилмагнийхлорида с хлорсиланом (могло оставаться значительное количество непрореагировавшего дифенилдихлорсилана и фенилтрихлорсилана). В нашем случае, наоборот, наблюдается увеличение селективности процесса как в первой, так и во второй реакциях. Предлагаемый способ может быть проиллюстрирован следующими примерами. Пример 1. В реакционный прибор, состоящий из 2-литровой четырехгорлой колбы, снабженной обратным холодильником, термометром, капельной воронкой для подачи хлорбензола и мешалкой, загружают 48,6 г (2 г-моля) магниевой стружки, 100 мл смеси ТГФ и толуола (50:50) и 10 г хлорбензола. Инициируют реакцию прибавлением 1 мл 1,2-дибромэтана при этом температура реакционной массы возрастает до 50-60oC. После инициирования начинают перемешивание и одновременно подачу из капельной воронки смеси 215 г хлорбензола, 200 мл толуола и 200 мл ТГФ. Подачу смеси ведут с такой скоростью, чтобы температура в реакционной колбе держалась на уровне 60-70oC. Процесс проводится до полного растворения магния и понижения температуры в колбе до 25-30oC. К образовавшемуся раствору фенилмагнийхлорида из капельной воронки приливают 500 г (2 г-моля) дифенилдихлорсилана, не допуская повышения температуры в колбе выше 70oC. После прибавления всего дифенилдихлорсилана реакционную массу выдерживают при температуре окружающей среды в течение 6 часов и обрабатывают водой. Водный слой отделяют. От органического слоя отгоняют часть растворителей (около 50%), остаток охлаждают и отфильтровывают выпавший трифенилсиланол. Получено 520 г (94,2% от теоретич.) трифенилсиланола чистотой 98,3%. Пример 2. В реакционный прибор, состоящий из 2-литровой четырехгорлой колбы, снабженной обратным холодильником, термометром, капельной воронкой для подачи хлорбензола и мешалкой, загружают 48,6 г (2 г-моля) магниевой стружки, 100 мл смеси ТГФ и толуола (50:50) и 10 г хлорбензола. Инициируют реакцию прибавлением 1 мл 1,2-дибромэтана; при этом температура реакционной массы возрастает до 50-60oC. После инициирования начинают перемешивание и одновременно подачу из капельной воронки смеси 215 г хлорбензола, 200 мл толуола и 200 мл ТГФ. Подачу смеси ведут с такой скоростью, чтобы температура в реакционной колбе держалась на уровне 60-70oC. Процесс проводится до полного растворения магния и понижения температуры в колбе до 25-30oC. К образовавшемуся раствору фенилмагнийхлорида из капельной воронки приливают 212 г (1 г-моль) фенилтрихлорсилана, не допуская повышения температуры в колбе выше 70oC. После прибавления всего дифенилдихлорсилана реакционную массу выдерживаниют при температуре окружающей среды в течение 6 часов и обрабатывают водой. Водный слой отделяют. От органического слоя отгоняют часть растворителей (около 50%), остаток охлаждают и отфильтровывают выпавший трифенилсиланол. Получено 235 г (85,1% от теоретич.) трифенилсиланола. Чистота продукта 99%. Формула изобретения
РИСУНКИ
MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины за
Дата прекращения действия патента: 04.12.2008
Дата публикации: 10.05.2011
|
||||||||||||||||||||||||||
