Патент на изобретение №2174118
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ФТОРСОДЕРЖАЩИХ ПРОИЗВОДНЫХ 3-АЗАБИЦИКЛО/3.3.1/НОНАНА
(57) Реферат: Изобретение относится к новому способу получения производных 3-азабицикло[3.3.1] нонана общей формулы (I), где Х = H, F; Y = OH, Cl, Br, СООН, С6Н5; n = 1-8; m = 1-2, с использованием реакции Манниха, исходные фторалкиловые эфиры 3,5-динитрофенола восстанавливают с помощью NaBH4 до динатриевых солей 1-полифторалкокси-3,5-6ис(ацинитро)циклогекс-1-ена формулы (II), где Х= Н, F; n = 1-8, на которую действуют смесью формальдегида и первичного амина с последующим подкислением реакционного раствора уксусной кислотой до рН 6. Технический результат: способ открывает возможность широкой химической модификации заместителей и функциональных групп в них с целью улучшения их свойств. 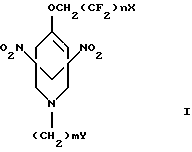 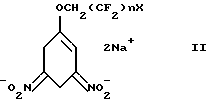
Изобретение относится к области органической химии, в частности способу получения производных 3-азабицикло[3.3.1]нонана, содержащих полифторалкоксильные группы. 1H- и 19F-ЯМР спектроскопии, а также результатами элементного анализа. 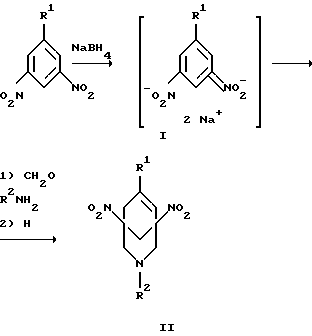 R1 = OCH2(CF2)nX, где X = H, F; n = 1-8 R2 = Alk, (CH2)mY, где Y = OH, Cl, Br, COOH, C6H5; m = 1-2 Отличительной особенностью предлагаемого метода синтеза является введение в реакцию Манниха с формальдегидом и первичными аминами в качестве кислотной компоненты 1-полифторалкокси-бис(ацинитро)циклогекс-1-енов (I), получаемых селективным восстановлением соответствующих O-полифторалкильных производных 3,5-динитрофенола действием NaBH4. К достоинствам рассматриваемого метода следует отнести простую схему синтеза и мягкие условия проведения реакций (5…20oC, 40 мин). Полифункциональность полученных соединений открывает возможности широкой химической модификации заместителей и функциональных групп в них с целью улучшения их свойств. Таким образом, предлагаемый метод получения фторсодержащих азабициклононановых структур открывает принципиально новые возможности для синтеза биологически активных веществ. Сущность метода заключается в следующем. К раствору соответствующего 1-полифторалкокси-3,5-динитробензола в смеси ТГФ-H2O (1:1 по объему) при перемешивании и охлаждении в течение 10…15 мин добавляют 2,5-кратный избыток твердого NaBH4 и перемешивают еще 5…10 мин. Температуру реакционной смеси все время поддерживают в пределах +10…+20oC. Затем приливают охлажденную смесь водных растворов формальдегида и первичного амина (или его гидрохлорида), после чего реакционный раствор подкисляют ледяной уксусной кислотой до pH 6. Продукт экстрагируют толуолом или дихлорэтаном, экстракт промывают водой и сушат над хлоридом кальция, после чего растворитель отгоняют в вакууме, остаток хроматографируют на колонке с силикагелем. Суть изобретения иллюстрируется следующими примерами. Пример 1. 3-Метил-7-(2,2,2-трифторэтокси)-1,5-динитро-3-азабицикло[3.3.1]нон-6-ен 1.06 г (0.004 моль) 1-(2,2,2-трифторэтокси)-3,5-динитробензола растворяют в 10 мл смеси ТГФ-H2O (1:1). При перемешивании и охлаждении ледяной водой добавляют 1.08 г (0.020 моль) NaBH4 в течение 10…15 мин, затем перемешивают еще 5…10 мин. Температуру реакционной смеси поддерживают в пределах +10…+20oC. После окончания восстановления приливают охлажденный раствор 2.3 мл 30% формалина (0.024 моль) и 0.81 г (0.012 моль) гидрохлорида метиламина в 20 мл воды и подкисляют ледяной уксусной кислотой до pH 6. Продукт экстрагируют толуолом, экстракт сушат безводным хлоридом кальция, затем растворитель отгоняют в вакууме. Остаток хроматографируют на колонке с силикагелем (АСКГ) (элюент – толуол), затем кристаллизуют из этанола. Выход 55%. Т. пл. 107oC. Rf 0.68. Найдено, %: C 40.57, 40.51; H 4.39, 4.32; N 12.85, 12.89; F. C11H14F3N3O5. Вычислено, %: C 40.62; H 4.34, N 12.92, F 17.52. ИК спектр, см-1:  (CHалиф) 2975, 2938, 2880, 2830, (CHалиф) 2975, 2938, 2880, 2830,  (C=C) 1645, (C=C) 1645,  as (NO2) 1550, as (NO2) 1550,  s (NO2) 1370, s (NO2) 1370,  (COC) 1160, (COC) 1160,  (CF) 980. Спектр 1H ЯМР в CD3CN, (CF) 980. Спектр 1H ЯМР в CD3CN,  , м. д. (J, Гц): 5.23 с (H6), 4.32 дк и 4.24 дк ( CH , м. д. (J, Гц): 5.23 с (H6), 4.32 дк и 4.24 дк ( CH , , 2CF3,J 2CF3,J  11.1, 3JHF 8.3), 3.30 д (He 4, Jea 10.6), 3.05 д (He 2, Jea 10.4), 2.48 д (Ha 2, Jae 10.4), 2.49 д (He 4, Jae 10.6), 2.92 д (He 8, Jea 17.9), 2.82 д (Ha 8, Jae 17.9), 2.81 д (He 9, Jea 11.2), 2.68 д (Ha 9, Jae 11.2).
Пример 2. 2-[7-(2,,2,2-трифторэтокси)-1,5-динитро-3-азабицикло[3.3.1] нон-6-ен-3-ил]этанол 11.1, 3JHF 8.3), 3.30 д (He 4, Jea 10.6), 3.05 д (He 2, Jea 10.4), 2.48 д (Ha 2, Jae 10.4), 2.49 д (He 4, Jae 10.6), 2.92 д (He 8, Jea 17.9), 2.82 д (Ha 8, Jae 17.9), 2.81 д (He 9, Jea 11.2), 2.68 д (Ha 9, Jae 11.2).
Пример 2. 2-[7-(2,,2,2-трифторэтокси)-1,5-динитро-3-азабицикло[3.3.1] нон-6-ен-3-ил]этанол1.06 г (0.004 моль) 1-(2,2,2-трифторэтокси)-3,5-динитробензола растворяют в 10 мл смеси ТГФ-H2O (1:1). При перемешивании и охлаждении ледяной водой добавляли 1.08 г (0.020 моль) NaBH4 в течение 10…15 мин, затем перемешивают еще 5…10 мин. Температуру реакционной смеси поддерживают в пределах +10…+20oC. После окончания восстановления приливают охлажденный раствор 2.3 мл 30% формалина (0.024 моль) и 1.17 г (0.012 моль) гидрохлорида 2-аминоэтанола в 20 мл воды и подкисляют ледяной уксусной кислотой до pH 6. Продукт экстрагируют дихлорэтаном, экстракт сушат безводным хлоридом кальция, затем растворитель отгоняют в вакууме. Остаток хроматографируют на колонке с силикагелем (АСКГ) (элюент – толуол-ацетон, 20:1), затем растворяют в этаноле, раствор обрабатывают активированным углем и фильтруют. Продукт высаждают из фильтрата путем добавления воды. Выход 40%. Т. пл. 77oC. Rf 0.33. Найдено, %: C 40.80, 40.31, H 4.26, 4.40, N 11.91, 11.89. C12H16F3N3O6. Вычислено, %: C 40.57, H 4.54, N 11.83. ИК спектр, см-1:  (OH) 3300…2500, (OH) 3300…2500,  (CHалиф) 2950, 2928, 2900, 2850, (CHалиф) 2950, 2928, 2900, 2850,  (C=O) 1725, (C=O) 1725,  (C=C) 1675, (C=C) 1675,  as (NO2) 1555, as (NO2) 1555,  3 (NO2) 1377, 3 (NO2) 1377,  (COC) 1285, 1210, (COC) 1285, 1210,  (C-F) 1180. Спектр 1H ЯМР в CD3CN, (C-F) 1180. Спектр 1H ЯМР в CD3CN,  м.д. (J, Гц): 5.24 с (H6), 4.35 дк и 4.25 дк ( CH м.д. (J, Гц): 5.24 с (H6), 4.35 дк и 4.25 дк ( CH , , 2CF3,J 2CF3,J  11.0, 3JHF 8.5), 3.39 д (He 4, Jea 10.3), 3.14 д (He 2, Jea 10.3), 2.75 д (Ha 2, Jae 10.3), 2.77 д (Ha 4, Jae 10.3), 2.94 д (He 8, Jea 17.8), 2.80 д (Ha 8, Jae 17.8), 2.82 д (He 9, Jea 11.0), 2.71 д (Ha 9, Jae 11.0), 2.55 т (OH, 7.0), 3.58 к (CH2CH2OH, 7.0), 2.75 т (CH2CH2OH, 7.0).
Пример 3. [7-(2,2,2-трифторэтокси)-1,5-динитро-3-азабицикло[3.3.1]нон-6-ен-3-ил]уксусная кислота 11.0, 3JHF 8.5), 3.39 д (He 4, Jea 10.3), 3.14 д (He 2, Jea 10.3), 2.75 д (Ha 2, Jae 10.3), 2.77 д (Ha 4, Jae 10.3), 2.94 д (He 8, Jea 17.8), 2.80 д (Ha 8, Jae 17.8), 2.82 д (He 9, Jea 11.0), 2.71 д (Ha 9, Jae 11.0), 2.55 т (OH, 7.0), 3.58 к (CH2CH2OH, 7.0), 2.75 т (CH2CH2OH, 7.0).
Пример 3. [7-(2,2,2-трифторэтокси)-1,5-динитро-3-азабицикло[3.3.1]нон-6-ен-3-ил]уксусная кислота1.06 г (0.004 моль) 1-(2,2,2-трифторэтокси)-3,5-динитробензола растворяют в 10 мл смеси ТГФ-H2O (1:1). При перемешивании и охлаждении ледяной водой добавляли 1.08 г (0.020 моль) NaBH4 в течение 10…15 мин, затем перемешивают еще 5…10 мин. Температуру реакционной смеси поддерживают в пределах +10…+20oC. После окончания восстановления приливают охлажденный раствор 2.3 мл 30% формалина (0.024 моль) и 0.90 г (0.012 моль) аминоуксусной кислоты в 20 мл воды и подкисляют ледяной уксусной кислотой до pH 6. Продукт экстрагируют дихлорэтаном, экстракт сушат безводным хлоридом кальция, затем растворитель отгоняют в вакууме. Остаток хроматографируют на колонке с силикагелем (АСКГ) (элюент – толуол-ацетон, 10:1), затем растворяют в этаноле, раствор обрабатывают активированным углем и фильтруют. Продукт высаждают из фильтрата путем добавления воды. Выход 45%. Т. пл. 138oC, Rf 0.36. Найдено, %: C 39.06, 38.92; H 4.01, 3.93; N 11.44, 11.40; F. C12H14F3N3O7. Вычислено, %: C 39.03, H 3.82, N 11.38, F 15.44. ИК спектр, см-1:  (OH) 3500…3300, (OH) 3500…3300,  (CHалиф) 2970, 2890, 2830, (CHалиф) 2970, 2890, 2830,  (C=C) 1678, (C=C) 1678,  as (NO2) 1545, as (NO2) 1545,  s (NO2) 1370, s (NO2) 1370,  (COC) 1155, (COC) 1155,  (CF) 980. Спектр 1H ЯМР в CD3CN, (CF) 980. Спектр 1H ЯМР в CD3CN,  м.д. (J, Гц): 9.50 с (COOH), 5.22 с (H6), 4.33 дк и 4.25 дк ( CH м.д. (J, Гц): 9.50 с (COOH), 5.22 с (H6), 4.33 дк и 4.25 дк ( CH , , 2CF3,J 2CF3,J  9.6, 3JHF 9.5), 3.52 д и 3.44 д ( C 9.6, 3JHF 9.5), 3.52 д и 3.44 д ( C  , , 2COOH,J 2COOH,J , , 9.6), 3.37 д (He 4, Jea 10.5), 3.10 д (He 2, Jea 10.5), 3.06 д (Ha 2, Jae 10.5), 3.05 д (Ha 4, Jae 10.5), 2.92 д (He 8, Jea 17.7), 2.83 д (Ha 8, Jae 17.7), 2.82 д (He 9, Jea 11.3), 2.71 д (Ha 9, Jae 11.3). 9.6), 3.37 д (He 4, Jea 10.5), 3.10 д (He 2, Jea 10.5), 3.06 д (Ha 2, Jae 10.5), 3.05 д (Ha 4, Jae 10.5), 2.92 д (He 8, Jea 17.7), 2.83 д (Ha 8, Jae 17.7), 2.82 д (He 9, Jea 11.3), 2.71 д (Ha 9, Jae 11.3).
Формула изобретения
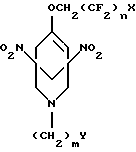 где X=H, F; Y=OH, Cl, Br, COOH, C6H5; n=1-8; m=1-2, c использованием реакции Манниха, отличающийся тем, что исходные фторалкиловые эфиры 3,5-динитрофенола восстанавливают с помощью NaBH4 до динатриевых солей 1-полифторалкокси-3,5-бис(ацинитро)циклогекс-1-ена формулы (II) 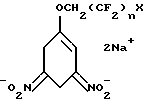 где X=H, F; n=1-8; на которую действуют смесью формальдегида и первичного амина с последующим подкислением реакционного раствора уксусной кислоты до pH 6. MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 18.12.2001
Номер и год публикации бюллетеня: 11-2003
Извещение опубликовано: 20.04.2003
|
||||||||||||||||||||||||||
