Патент на изобретение №2174013
|
||||||||||||||||||||||||||
(54) КОМПОЗИЦИЯ ДЛЯ СТИМУЛИРОВАНИЯ ИЛИ ПОВЫШЕНИЯ ПРОДУЦИРОВАНИЯ АНТИТЕЛ, КОТОРЫЕ РАСПОЗНАЮТ ГАНГЛИОЗИД
(57) Реферат: Изобретение предлагает композицию для стимулирования или повышения продуцирования антител, которые распознают ганглиозид у субъекта, которому вводят композицию. Она содержит количество ганглиозида (или олигосахаридной части его), конъюгированного с иммуногенным белком, эффективное для стимулирования или повышения продуцирования антител у субъекта. Композиция содержит также адъювант и фармацевтически приемлемый наполнитель. Изобретение предлагает также способ применения композиции для лечения или предотвращения рака, при котором ганглиозиды находятся на поверхности или в строме раковых клеток. 6 с. и 28 з.п. ф-лы, 14 табл., 26 ил. Ганглиозиды являются содержащими сиаловую кислоту гликосфинголипидами, состоящими из сложной углеводной части, соединенной с гидрофобной керамидной частью. Заключенная внутри внешних листочков клеточной мембраны углеводная цепь открыта внеклеточному матриксу. Наблюдаемые качественные и количественные изменения в составе ганглиозидов в процессе дифференциации и пролиферации клеток, по-видимому, отражают состояние злокачественного перерождения рака нейроэктодермального происхождения (Hakonori, 1985). Злокачественные меланомные клетки экспрессируют различные сложные ганглиозиды помимо GM3, основного ганглиозида в нормальных меланоцитах (Carubia et a1., 1984). Измененный ганглиозидный метаболизм в меланоме вызывает дополнительную экспрессию GD3, GD2, GM2, 9-0-ацетил-GD3 и GT3 (Hamilton et a1., 1993; Tsuchida et a1., 1987). Лечение пациентов моноклональными антителами против GD3 приводило к воспалению в месте опухоли, периодически наблюдалась частичная регрессия метастазов. Это подтверждает, что ганглиозиды являются подходящими мишенями для иммунной атаки (Houghton et a1., 1985). Генерирование моноклональных антител человека (MAb) реагирующих с GD3 от пациентов с меланомой (Yamaguchi et a1., 1987), подтверждает идею, что ганглиозиды также являются потенциальными иммуногенами. В исследовании, предназначенном для индуцирования гуморального иммунного ответа против ганглиозидов у пациентов с меланомой активной иммунизацией, вакцины GM2/BCG казались наиболее эффективными (Livingston et a1., 1987; Livingston et al., 1989). В исследовании со слепым отбором 122 пациентов с меланомой, которые не были больны после хирургической операции, было показано, что из 64 пациентов, которым вводили только BCG, и 58 пациентов, которым вводили GM2/BCG, основная часть пациентов (86%), получивших вакцину GM2, продуцировали антитела. Пациенты, которые продуцировали антитела на GM2, были значительно дольше здоровы и имели большее общее выживание, чем пациенты с отсутствием антител. Сравнение двух видов испытания показало, что пациенты, получившие вакцину GM2/BCG, имели 17%-ное повышение времени без заболевания и 9%-ное повышение выживания по сравнению с контрольной группой, получившей BCG, хотя ни один результат не был статистически значимым (Livinfston et a1., 1993a). К сожалению, иммунная реакция была только в течение короткого времени, в основном с образованием IgМ и умеренным титром. Это подтверждало, что GM2 распознавался как T-клетка-независимый антиген в результате присутствия углеводных антигенов (Livingston et a1., 1989) и также то, что ганглиозиды являются аутоантигенами, экспрессированными на той же нормальной ткани (Hamilton et a1., 1993). Аналогичные подходы с применением вакцин GD2 и 9-0-ацетил-CD3 у пациентов давали изредка низкие титры, не было обнаружено гуморального иммунного ответа против GD3 (Livingston, 1991). Новые сильнодействующие адъюванты были способны в некоторых случаях усилить иммунную реакцию против ганглиозидов, но специально для аутоантигенов, например связанных с опухолями ганглиозидов, следует применять другой подход. На основе классических экспериментов Landsteiner (Landsteiner and Chase, 1942) с конъюгатами гаптен-носитель для усиления иммунной реакции успешно использовали ковалентное присоединение слабо иммуногенных антигенов к иммуногенным белкам-носителям/ Например иммунную реакцию на углеводы, другие чем ганглиозиды, можно достичь конъюгированием с подходящими белками-носителями. Связывание бактериальных капсулярных полисахаридов с иммуногенными белками показало значительное усиление иммунной реакции и иммунитета (Eskola et a1., 1990). В последнее время работа по вакцинации пациентов с раком яичников синтетическим антигеном опухоли Thompson Friedenreich, конъюгированным с гемоцианином лимфы улитки, выявила гуморальный IgM- и IgG-иммунный ответ (MacLean et a1., 1992). Важным открытием, общим для этих исследований, было изотоническое превращение IgM -иммунного ответа с небольшой продолжительностью в длительный, высокоафинный IgG- иммунный ответ, указывающее на то, что аналогично имеет место активация Т-клеткизависимых путей против углеводов. Этот подход применяют теперь для антигена меланомной опухоли GD3 с целью разработки способа синтеза вакцин конъюгатов ганглиозид-белок и исследования иммуногенности различных конъюгатов GDS-белок на мышах. Настоящее изобретение предлагает вакцину для стимулирования или усиления у субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид. Эта вакцина содержит ганглиозид (или его олигосахаридную часть), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования в организме субъекта антител, эффективное количество адъюванта и фармацевтически приемлемый наполнитель. Настоящее изобретение предлагает также способ стимулирования или усиления продуцирования в организме субъекта антител, которые распознают ганглиозид, введением субъекту эффективной дозы вакцины для стимулирования или усиления в организме субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащей ганглиозид (или его олигосахаридную часть), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования в организме субъекта антител, эффективное количество адъюванта и фармацевтически приемлемый наполнитель. Краткое описание фигур Фиг. 1. Синтез конъюгатов CD3-белок после расщепления озоном и восстановительного аминирования. Вставка представляет ТСХВР GD3 до (А) и после (В) расщепления. Фиг. 2A и 2B. Изменение антител IgM (а) и IgG (b) антисыворотки на GD3-KLH от времени. Каждый символ фигуры относится к мыши. Фиг. 3А и 3B. Иммунная тонкослойная хроматография трех мышиных антисывороток после вакцинации GD3-KLH. Реактивность антител IgG (а) и IgM (b) тестировали на (А) ганглиозиды головного мозга человека, (В) ганглиозиды нейробластомы, (С) ганглиозиды меланомы и (D) GD3-антиген. Фиг. 4. Иммуноблот четырех мышей для показа специфичности иммунной реакции. Чистый ганглиозид наносили на дот-блот и инкубировали с сывороткой мыши. Фиг. 5. Представительный FACS-анализ реактивности мышиной сыворотки до (пик у 3) и после (пик у 50) иммунизации GD3-KLH и QS-21, испытанной на меланомной клеточной линии SK-VEL-28. Фиг. 6A и 6B. Изменение антител IgM (а) и IgG (b) антисыворотки на GD3-KLH со временем. Каждый символ фигуры относится к человеку. Фиг. 7. Детекция антител против GD2 в сыворотках пациентов, вакцинированных вакциной конъюгата GM2 плюс адъювантом, иммунным окрашиванием в дот-блотах. Пятна стандартных ганглиозидов наносили на нитроцеллюлозные полоски (указаны на вертикальной оси) и оставляли для реакции с сыворотками индивидуальных пациентов до вакцинации и после вакцинации с пиковым титром меченными пероксидазой козьими античеловеческими антителами IgМ и IgG. Полоски распределяли по шкале от 0 до +3. MAb 696 применяли в качестве положи тельного контроля для GM2. Фиг. 8A-1 и 8A-2. Специфичность сывороток с пиковым титром пациентов, иммунизированных GM2-KLH + QS-21, определяли иммунной тонкослойной хроматографией, как описано ранее (3, ссылка третьей серии экспериментов). GM2 (А) и экстракт ганглиозидов меланомной ткани (В) наносили на пластинки для ТСХ, инкубировали с сыворотками индивидуальных пациентов и окрашивали меченными пероксидазой козьими античеловеческими антителами IgМ или IgG. MAb 696 применяли в качестве положительного контроля для GM2 и для окрашивания ганглиозидов применяли резорцин. Фиг. 8B. Ингибирование IgG-реактивности сыворотки пациента против GM2 и GD2. GM2 (А) и экстракт ганглиозидов меланомной ткани (В) наносили на пластинки ТСХВР, инкубировали с сывороткой пациента N 2 и окрашивали меченными пероксидазой козьими античеловеческими антителами IgG. 3 мл сыворотки пациента при разведении 1:50 предварительно инкубировали с 150 мкг GM2 или 150 мкг GD2 до иммунного окрашивания. Фиг. 9A и 9B. IgM- и IgG-иммунные ответы у пациентов с меланомой после иммунизации вакцинами GM2-KLH плюс QS-21. Последовательные результаты у 6 пациентов, получивших дозу 100 мкг QS-21, показаны на фиг. 9A и для 6 пациентов, получивших дозу 200 мкг, показаны на фиг. 9B. Отметим, что один пациент в каждой группе получал только 4 вакцинации и был исключен из исследования из-за прогресса болезни. Стрелки указывают время инъекции циклофосфамида (Cy) и вакцины GM2-KLH плюс QS-21. Фиг. 10A и 10B. Детекция антител против GM2 иммунным окрашиванием на дот-блотах сывороток 10 пациентов, вакцинированных GM2-KLH. Стандарты ганглиозидов наносили на нитроцеллюлозные полоски (как указано слева) и инкубировали сначала с сыворотками и затем, после промывания, с меченными пероксидазой козьими античеловеческими антителами IgM или IgG. Приведены результаты детекции сывороток двух пациентов каждой их 5 групп, получивших различные дозы QS-21 (как показано наверху). Сыворотки до (а) и после иммунизации (b) приведены для каждого пациента. Мышиные моноклональные антитела 696 и 3F8 являются антителами IgМ и IgG (соответственно) против GM2 и GD2. Антитела IgМ против GM1 обнаруживали в сыворотках большинства пациентов до и после вакцинации. Антитела IgМ и IgG против GM2 не обнаруживали до вакцинации у любого из этих пациентов. После вакцинации антитела IgМ и IgG против GM2 обнаруживали в сыворотках всех пациентов. Реакции были распределены по степеням 0, 1+, 2+ или 3+. Пример распределения реакции по степеням для этого анализа следующий: Пациент 1 (100 мкг QS-21) IgМ (до/после вакцинации): KLH 1+/2+, GM3 0/0, GM2 0/3+, GM1 1+/1+, GD3 0/0, GD2 0/1+, GD1b 0/0. Фиг. 11A и 11B. IgМ – иммунные ответы у пациентов с меланомой после иммунизации вакциной GM2/BCG. Приведены последовательные результаты для 5 пациентов, обработанных в течение первоначальных 4 месяцев схемы (группы А) и 5 пациентов, обработанных в течение послед них 4 месяцев схемы (группа В). Стрелки указывают время инъекции циклофосфамида (Cy) и вакцины GM2/BCG. Фиг. 12. Детекция антител на GM2 иммунным окрашиванием на дот-блотах в сыворотках 10 пациентов с меланомой, вакцинированных GM2/BCG. Стандарты ганглиозидов наносили на нитроцеллюлозные полоски (как показано слева) и инкубировали сначала с сыворотками и затем, после промывания, с меченными пероксидазой козьими античеловеческими антителами IgM. GM2-MEL обозначает очищенный GM2, экстрагированный из проб биопсии меланомы, все другие ганглиозиды, включая GM2, получали из коровьего головного мозга. Указывается число пациентов (6-58) и приводятся сыворотки до (а) и после (Ь) иммунизации для каждого пациента. 696 и 3G6 являются мышиными моноклональными антителами IgМ против GM2 и GD2 соответственно. Антитела против GM2 детектировали в сыворотках после вакцинации 10 пациентов. Антитела против GM1 обнаруживали в сыворотках до и после иммунизации пациента 53 и в сыворотке после вакцинации пациента 57. Реакции были распределены по степеням 0, 1+, 2+ или 3+. Примеры распределения реакции по степеням следующие: пациент 8: GM2 3+, GM2-MEL 2+; пациент 54: GM2 3+, GM2-MEL 1+; и пациент 57: GM2 3+, GM2-MEL 3+. Самая низкая реактивность против GM2-MEL по сравнению с GM2 оказалась у сывороток после вакцинации, и мышиные моноклональные антитела 696 отражают самое малое количество ганглиозида GM2-MEL, нанесенного на полоски. Фиг. 13. Распределение по Kaplan-Meier пациентов без заболевания и выживших пациентов с продуцированием антител после вакцинации GM2. Пациентов относили к категории с положительной реакцией, если GM2-реактивность была а) 2+ или 3+ на дот-блотах и титр по ELISA был не ниже 1/20 или b) 1+ на дот-блотах и титр по ELISA не ниже 1/80. Фиг. 14. Распределение по Kaplan-Meier 59 пациентов без заболевания и выживших пациентов, рандомизированных для получения BCG, и 57 пациентов, рандомизированных для получения GM2/BCG, включая 6 пациентов, которые продуцировали антитела на GM2 до иммунизации (5, которым затем вводили BCG и 1, которому вводили GM2/BCG). Фиг. 15. Распределение по Kaplan-Meier 64 пациентов без заболевания и выживших пациентов, рандомизированных для получения BCG, и 58 пациентов, рандомизированных для получения GM2/BCG. Фиг. 16. Распределение по Kaplan-Meier 59 не заболевших и выживших пациентов с отрицательной реакцией на антитела против GM2, рандомизированных для получения BCG (  или или  ), в сравнении с 57 пациентами с отрицательной реакцией на антитела против GM2, рандомизированными для получения GM2/BCG ( ), в сравнении с 57 пациентами с отрицательной реакцией на антитела против GM2, рандомизированными для получения GM2/BCG ( или или  ). Пациенты разделяют на две группы: пациенты с одним положительным лимфатическим узлом ( ). Пациенты разделяют на две группы: пациенты с одним положительным лимфатическим узлом ( или или  ) и пациенты с двумя или более положительными лимфатическими узлами ( ) и пациенты с двумя или более положительными лимфатическими узлами ( или или ).
На всем протяжении настоящей заявки различные ссылки приводятся в круглых скобках. Описание этих публикаций полностью, таким образом, вводится в настоящую заявку ссылкой для более полного описания состояния области знаний, к которой относится настоящее изобретение. Полную библиографию этих ссылок можно найти в конце настоящей заявки до формулы изобретения.
Настоящее изобретение предлагает вакцину для стимулирования или усиления у субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащий ганглиозид (или его олигосахаридную часть), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования в организме субъекта антител, эффективное количество адъюванта и фармацевтически приемлемый наполнитель.
Олигосахаридная часть ганглиозида может быть образована расщеплением ганглиозида, или ее можно синтезировать непосредственно. В настоящей заявке термин “иммуногенный белок” означает белок, который при конъюгировании с ганглиозидом или его олигосахаридной частью стимулирует или усиливает продуцирование антител у субъекта.
В одном примере осуществления изобретения субъектом является человек.
Настоящее изобретение предлагает также указанную выше вакцину, у которой ганглиозид или его олигосахаридная часть конъюгирована с гемоцианином лимфы улитки или производным гемоцианина лимфы улитки.
Гемоцианин лимфы улитки является хорошо известным белком. Производное гемоцианина лимфы улитки можно получить прямым связыванием по меньшей мере одного иммунологического адъюванта, например монофосфолипида А, или неионогенных блок-сополимеров, или цитокина с гемоцианином лимфы улитки. Цитокины хорошо известны специалистам данной области науки. Примером цитокина является интерлейкин 2. Имеются другие известные интерлейкины, которые можно соединить с гемоцианином лимфы улитки для получения производного гемоцианина лимфы улитки.
В одном варианте указанной выше вакцины адъювантом является QS-21.
Имеются другие известные адъюванты, которые могут быть пригодны для настоящего изобретения. Они могут относиться к классам QS-21 или химикатам, подобным QS-21, которые можно аналогично применять в соответствии с настоящим изобретением.
Настоящее изобретение предлагает также указанные выше вакцины, у которых ганглиозид выбран из группы, состоящей из GM2, GM3, GD2, GD3, GDS-лактона, О-ацетил-GD3 и GT3.
В одном из предпочтительных вариантов осуществления настоящего изобретения ганглиозидом является GM2. В другом примере ганглиозидом является GD3. Еще в одном примере ганглиозидом является GD2.
В соответствии с настоящим изобретением можно применять различные эффективные количества конъюгированного ганглиозида или его олигосахаридной части. Специалист настоящей области знаний может проводить простые эксперименты по титрованию, чтобы определить, какое эффективное количество требуется для эффективной иммунизации. Примером такого эксперимента по титрованию является инъецирование различных количеств конъюгированного ганглиозида или конъюгированной олигосахаридной части его субъекту и затем определение иммунной реакции.
В одном из вариантов изобретения эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его находилось между около 1 мкг и около 200 мкг.
В другом варианте изобретения эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его находилось между около 50 мкг и около 90 мкг. Еще в одном примере изобретения эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его составляло около 70 мкг.
В другом варианте изобретения эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его находилось между около 1 мкг и около 10 мкг. В более конкретном примере эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его находилось между около 7 мкг и около 10 мкг. В одном примере эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его составляло около 7 мкг.
Кроме того, эффективное количество адъюванта можно также определить аналогично, т. е. введением различных количеств адъюванта с конъюгатами и установлением иммунной реакции, чтобы определить, какое количество адъюванта эффективно. Когда в качестве адъюванта применяют QS-21, эффективное количество QS-21 можно также определить аналогично.
В предпочтительном варианте осуществления изобретения эффективное количество QS-21 находится в пределах между около 10 мкг и около 200 мкг. В одном из примеров эффективное количество QS-21 около 100 мкг. В другом примере эффективное количество QS-21 около 200 мкг.
Настоящее изобретение предлагает также вакцину для стимулирования или усиления в организме субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащую ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител в организме субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель, причем субъект поражен раком и антитела, продуцированные у субъекта при введении вакцины, эффективно лечат рак.
Настоящее изобретение предлагает также вакцину для стимулирования или усиления в организме субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащую ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител в организме субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель, причем субъект восприимчив к поражению раком и антитела, продуцированные у субъекта при введении вакцины, эффективно предотвращают заболевание раком.
Настоящее изобретение предлагает также вакцину для раковых заболеваний, у которых раковые клетки на поверхности имеют ганглиозиды.
Настоящее изобретение предлагает, кроме того, вакцину для раковых заболеваний, при которых ганглиозиды находят в строме раковой опухоли.
Настоящее изобретение предлагает вакцину для раковых заболеваний эпителиального, мезодермального или нейроэктодермального происхождения. Примерами эпителиальных раков являются рак молочной железы и внутриматочный рак. Примером рака мезодермального происхождения является саркома. Одним из примеров рака нейроэктодермального происхождения является меланома.
Настоящее изобретение предлагает также способ стимулирования или усиления продуцирования в организме субъекта антител, которые распознают ганглиозиды, введением субъекту эффективной дозы вакцины для стимулирования или усиления у субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащей ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител у субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель.
В варианте указанного способа ганглиозидом является GM2.
Настоящее изобретение предлагает, кроме того, способ лечения рака у субъекта, пораженного раком, введением субъекту эффективной дозы вакцины для стимулирования или усиления у субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащей ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител у субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель, причем субъект поражен раком и антитела, продуцированные у субъекта при введении вакцины, эффективно лечат рак.
Настоящее изобретение предлагает также способ предотвращения заболевания раком субъекта, восприимчивого к такому заболеванию, введением субъекту эффективной дозы вакцины для стимулирования или усиления у субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащей ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител у субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель, причем субъект восприимчив к поражению раком и антитела, продуцированные у субъекта при введении вакцины, эффективно предотвращают заболевание раком.
Настоящее изобретение направлено также на создание способа применения указанной выше вакцины, у которой ганглиозид или олигосахаридная часть его конъюгирована с гемоцианином лимфы улитки или производным гемоцианина лимфы улитки. Настоящее изобретение направлено также на создание способа применения указанной выше вакцины, у которой адъювантом является QS-21.
Настоящее изобретение направлено также на создание способа применения указанной выше вакцины для лечения или предупреждения рака, у которого раковые клетки имеют на поверхности ганглиозиды.
Настоящее изобретение направлено также на создание способа применения указанной выше вакцины для лечения или предупреждения рака, при котором ганглиозиды находят в строме.
Настоящее изобретение направлено на создание способа применения указанной выше вакцины для лечения или предупреждения рака эпителиального или нейроэктодермального происхождения. Одним таким раковым заболеванием нейроэктодермального происхождения является меланома.
В настоящем изобретении термин “фармацевтически приемлемые наполнители” обозначает любой из стандартных фармацевтических наполнителей. Примеры пригодных наполнителей, хорошо известных в данной области, могут включать (но не ограничиваются ими) любой из стандартных фармацевтических наполнителей, например содержащие фосфатные буферы солевые растворы, фосфатный буферный солевой раствор, содержащий полисорб 80, воду, эмульсии, например эмульсия типа масло-в-воде, и различные типы смачивающих средств.
Вакцину настоящего изобретения можно вводить внутрикожно, подкожно или внутимышечно. Можно также применять другие способы, хорошо известные специалистам данной области.
В предпочтительном варианте осуществления настоящее изобретение направлено на создание способа стимулирования или усиления в организме субъекта антител, которые распознают ганглиозиды, введением субъекту эффективной дозы вакцины для стимулирования или усиления у субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащей ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител у субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель, причем введение предусматривает введение эффективной дозы в два или более мест. Термин “введение эффективной дозы в два или более мест” обозначает, что эффективную дозу делят на две или более частей и каждую часть вводят в различные места субъекта. В предпочтительном варианте части дозы вводят в три места.
Настоящее изобретение может быть лучше понято из приведенных ниже деталей экспериментальной части. Однако любому специалисту, работающему в настоящей области науки, должно быть очевидно, что обсуждаемые способы и результаты только иллюстрируют изобретение, более полно описанное в формуле изобретения, которая следует за деталями экспериментальной части.
Первая серия экспериментов ).
На всем протяжении настоящей заявки различные ссылки приводятся в круглых скобках. Описание этих публикаций полностью, таким образом, вводится в настоящую заявку ссылкой для более полного описания состояния области знаний, к которой относится настоящее изобретение. Полную библиографию этих ссылок можно найти в конце настоящей заявки до формулы изобретения.
Настоящее изобретение предлагает вакцину для стимулирования или усиления у субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащий ганглиозид (или его олигосахаридную часть), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования в организме субъекта антител, эффективное количество адъюванта и фармацевтически приемлемый наполнитель.
Олигосахаридная часть ганглиозида может быть образована расщеплением ганглиозида, или ее можно синтезировать непосредственно. В настоящей заявке термин “иммуногенный белок” означает белок, который при конъюгировании с ганглиозидом или его олигосахаридной частью стимулирует или усиливает продуцирование антител у субъекта.
В одном примере осуществления изобретения субъектом является человек.
Настоящее изобретение предлагает также указанную выше вакцину, у которой ганглиозид или его олигосахаридная часть конъюгирована с гемоцианином лимфы улитки или производным гемоцианина лимфы улитки.
Гемоцианин лимфы улитки является хорошо известным белком. Производное гемоцианина лимфы улитки можно получить прямым связыванием по меньшей мере одного иммунологического адъюванта, например монофосфолипида А, или неионогенных блок-сополимеров, или цитокина с гемоцианином лимфы улитки. Цитокины хорошо известны специалистам данной области науки. Примером цитокина является интерлейкин 2. Имеются другие известные интерлейкины, которые можно соединить с гемоцианином лимфы улитки для получения производного гемоцианина лимфы улитки.
В одном варианте указанной выше вакцины адъювантом является QS-21.
Имеются другие известные адъюванты, которые могут быть пригодны для настоящего изобретения. Они могут относиться к классам QS-21 или химикатам, подобным QS-21, которые можно аналогично применять в соответствии с настоящим изобретением.
Настоящее изобретение предлагает также указанные выше вакцины, у которых ганглиозид выбран из группы, состоящей из GM2, GM3, GD2, GD3, GDS-лактона, О-ацетил-GD3 и GT3.
В одном из предпочтительных вариантов осуществления настоящего изобретения ганглиозидом является GM2. В другом примере ганглиозидом является GD3. Еще в одном примере ганглиозидом является GD2.
В соответствии с настоящим изобретением можно применять различные эффективные количества конъюгированного ганглиозида или его олигосахаридной части. Специалист настоящей области знаний может проводить простые эксперименты по титрованию, чтобы определить, какое эффективное количество требуется для эффективной иммунизации. Примером такого эксперимента по титрованию является инъецирование различных количеств конъюгированного ганглиозида или конъюгированной олигосахаридной части его субъекту и затем определение иммунной реакции.
В одном из вариантов изобретения эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его находилось между около 1 мкг и около 200 мкг.
В другом варианте изобретения эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его находилось между около 50 мкг и около 90 мкг. Еще в одном примере изобретения эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его составляло около 70 мкг.
В другом варианте изобретения эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его находилось между около 1 мкг и около 10 мкг. В более конкретном примере эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его находилось между около 7 мкг и около 10 мкг. В одном примере эффективное количество конъюгированного ганглиозида или конъюгированной олигосахаридной части его составляло около 7 мкг.
Кроме того, эффективное количество адъюванта можно также определить аналогично, т. е. введением различных количеств адъюванта с конъюгатами и установлением иммунной реакции, чтобы определить, какое количество адъюванта эффективно. Когда в качестве адъюванта применяют QS-21, эффективное количество QS-21 можно также определить аналогично.
В предпочтительном варианте осуществления изобретения эффективное количество QS-21 находится в пределах между около 10 мкг и около 200 мкг. В одном из примеров эффективное количество QS-21 около 100 мкг. В другом примере эффективное количество QS-21 около 200 мкг.
Настоящее изобретение предлагает также вакцину для стимулирования или усиления в организме субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащую ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител в организме субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель, причем субъект поражен раком и антитела, продуцированные у субъекта при введении вакцины, эффективно лечат рак.
Настоящее изобретение предлагает также вакцину для стимулирования или усиления в организме субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащую ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител в организме субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель, причем субъект восприимчив к поражению раком и антитела, продуцированные у субъекта при введении вакцины, эффективно предотвращают заболевание раком.
Настоящее изобретение предлагает также вакцину для раковых заболеваний, у которых раковые клетки на поверхности имеют ганглиозиды.
Настоящее изобретение предлагает, кроме того, вакцину для раковых заболеваний, при которых ганглиозиды находят в строме раковой опухоли.
Настоящее изобретение предлагает вакцину для раковых заболеваний эпителиального, мезодермального или нейроэктодермального происхождения. Примерами эпителиальных раков являются рак молочной железы и внутриматочный рак. Примером рака мезодермального происхождения является саркома. Одним из примеров рака нейроэктодермального происхождения является меланома.
Настоящее изобретение предлагает также способ стимулирования или усиления продуцирования в организме субъекта антител, которые распознают ганглиозиды, введением субъекту эффективной дозы вакцины для стимулирования или усиления у субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащей ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител у субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель.
В варианте указанного способа ганглиозидом является GM2.
Настоящее изобретение предлагает, кроме того, способ лечения рака у субъекта, пораженного раком, введением субъекту эффективной дозы вакцины для стимулирования или усиления у субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащей ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител у субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель, причем субъект поражен раком и антитела, продуцированные у субъекта при введении вакцины, эффективно лечат рак.
Настоящее изобретение предлагает также способ предотвращения заболевания раком субъекта, восприимчивого к такому заболеванию, введением субъекту эффективной дозы вакцины для стимулирования или усиления у субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащей ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител у субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель, причем субъект восприимчив к поражению раком и антитела, продуцированные у субъекта при введении вакцины, эффективно предотвращают заболевание раком.
Настоящее изобретение направлено также на создание способа применения указанной выше вакцины, у которой ганглиозид или олигосахаридная часть его конъюгирована с гемоцианином лимфы улитки или производным гемоцианина лимфы улитки. Настоящее изобретение направлено также на создание способа применения указанной выше вакцины, у которой адъювантом является QS-21.
Настоящее изобретение направлено также на создание способа применения указанной выше вакцины для лечения или предупреждения рака, у которого раковые клетки имеют на поверхности ганглиозиды.
Настоящее изобретение направлено также на создание способа применения указанной выше вакцины для лечения или предупреждения рака, при котором ганглиозиды находят в строме.
Настоящее изобретение направлено на создание способа применения указанной выше вакцины для лечения или предупреждения рака эпителиального или нейроэктодермального происхождения. Одним таким раковым заболеванием нейроэктодермального происхождения является меланома.
В настоящем изобретении термин “фармацевтически приемлемые наполнители” обозначает любой из стандартных фармацевтических наполнителей. Примеры пригодных наполнителей, хорошо известных в данной области, могут включать (но не ограничиваются ими) любой из стандартных фармацевтических наполнителей, например содержащие фосфатные буферы солевые растворы, фосфатный буферный солевой раствор, содержащий полисорб 80, воду, эмульсии, например эмульсия типа масло-в-воде, и различные типы смачивающих средств.
Вакцину настоящего изобретения можно вводить внутрикожно, подкожно или внутимышечно. Можно также применять другие способы, хорошо известные специалистам данной области.
В предпочтительном варианте осуществления настоящее изобретение направлено на создание способа стимулирования или усиления в организме субъекта антител, которые распознают ганглиозиды, введением субъекту эффективной дозы вакцины для стимулирования или усиления у субъекта, которому вводят эту вакцину, продуцирования антител, которые распознают ганглиозид, содержащей ганглиозид (или олигосахаридную часть его), конъюгированный с иммуногенным белком, в количестве, эффективном для стимулирования или усиления продуцирования антител у субъекта, эффективное количество адъюванта и фармацевтически приемлемый наполнитель, причем введение предусматривает введение эффективной дозы в два или более мест. Термин “введение эффективной дозы в два или более мест” обозначает, что эффективную дозу делят на две или более частей и каждую часть вводят в различные места субъекта. В предпочтительном варианте части дозы вводят в три места.
Настоящее изобретение может быть лучше понято из приведенных ниже деталей экспериментальной части. Однако любому специалисту, работающему в настоящей области науки, должно быть очевидно, что обсуждаемые способы и результаты только иллюстрируют изобретение, более полно описанное в формуле изобретения, которая следует за деталями экспериментальной части.
Первая серия экспериментовДетали экспериментальной части. Повышенная иммуногенность вакцин конъюгата GD3; Сравнение различных белков-носителей и отбор GD3-KLH для дальнейшего испытания. Известно, что связанные с опухолями ганглиозиды являются пригодными мишенями для иммунных “атак” против рака, но они проявляют слабую иммуногенность. Активная иммунизация ими приводит к кратковременной иммунной реакции с низким титром антител IgМ. Ковалентное связывание слабо иммуногенных антигенов с иммуногенными белками-носителями является эффективным способом усиления гуморального иммунного ответа. GD3, доминантный ганглиозид на злокачественной меланоме, присоединяли к белкам-носителям двумя методами. Его присоединяли при помощи глюкозы олигосахарида GD3, но это приводило к потере антигенности и образованию антител, которые не могли реагировать с GD3 или экспрессирующими GD3 меланомными клетками. По второму методу GD3 модифицировали путем расщепления двойной связи в главной цепи керамида озоном, введения альдегидной группы и затем соединения этой группы восстановительным аминированием с аминолизильными группами белков. При помощи этого метода получали конъюгаты с синтетическими полиантигенными пептидами (MAP), обнаруживающими повторы Т-клеточного эпитопа малярии, белками наружной мембраны (OMP)Neisseria meningitidis, катионизированным бычьим сывороточным альбумином (cB SA), гемоцианином лимфы улитки (KLH) и полилизином. Антигенность конъюгатов подтверждали реакционной способностью с различными антителами и иммуногенность испытывали на мышах. Титр антител в иммунной сыворотке определяли ELISA и посредством иммунного окрашивания на очищенные гликозиды в дот-блотах. Специфичность реактивности сывороток далее анализировали иммунной тонкослойной хроматографией с применением экстрактов опухолевых тканей. Вакцины GD3-конъюгатов показали значительно усиленный гуморальный иммунный ответ, особенно вакцины с конъюгатами GD3-KLН. Были индуцированы IgМ- и IgG-иммунные ответы против GD3 с высоким титром. Этот метод пригоден для других ганглиозидов, он может быть пригоден для конструкции ганглиозидных вакцин против различных злокачественных новообразований человека, обогащенных ганглиозидами. Материалы и методы. Гликолипиды. GM3, GM2 и GD1b и экстракты бычьего головного мозга были представлены Fidia Research Laboratory (Abano Terme, Italy). GD2 получали из GD1b обработкой  -галактозидазой (Cahan et al., 1982). GD3 (mel) выделяли из меланомной ткани человека (Ritter et al., 1991). GD3 (bbm) (применяли для получения вакцины) и GT3, выделенные из пахты коровьего молока, были любезно предоставлены Dr.R.K.Yu (Medical College of Virginia, Richmond, VA) (Ritter et al., 1990f). Дисиалиллактон (олигосахарид GD3) выделяли из коровьего молозива, как описано ранее (Nicolai et al., 1978).
Химикаты. Пластинки с силикагелем для тонкослойной хроматографии высокого разрешения (ТСХВР) получали от E.Merck (Darmstadt, GRG); кассеты Sep-Pak C18 получали от Walters Associates (Milford, MA); двунатриевую соль п-нитрофенилфосфата и цианоборогидрид натрия получали от Sigma Chemical Cj. (St. Louis, МО); циклофосфамид (цитоксан) получали от Mead Johnson (Syracuse, NY); содержащий QS-21 сапониновый компонент Quil А получали от Cambridge Biotech (Wore ster, MA).
Белки. Гидробромид поли-L-лизина (вискозиметрическая мол. масса 3800) приобрели у Sigma, гемоцианин лимфы улитки (KLH) – y Calbiochem (LaJolla CA), иммуномодулятор cBSA – lmject Supercarrier – у Pierce (Rockfort, IL), белок наружных мембран (OMP) Niesseria Meningitidis был любезно предоставлен Dr. M. S. Blake (Rockefeller University New York, NY). Полиантигенный пептид (MAP) YAL-IV 294-1, содержащий 4 повтора Т-клеточного эпитопа малярии, был подарен Dr. J.P. Tam (Rockefeller University New York, NY).
Моноклональные антитела. Антимышиные кроличьи иммуноглобулины, конъюгированные с пероксидазой хрена, для ITLC и антимышиные кроличьи IgM и IgG, конъюгированные со щелочной фосфатазой, для ELISA получали от Zymed (San Francisco, CA), анти-GD3 mAb R24 был генерирован (Houghton et a1., 1985).
Серологические анализы. Твердофазный иммуноферментный анализ (ELISA) проводили, как описано ранее (Livingston et a1., 1989). Для контроля неспецифической “сцепляемости” иммунную сыворотку испытывали на пластинках, которые обрабатывали аналогично, но в которые не добавляли ганглиозид, и показатель вычитали из величины, полученной в присутствии ганглиозида. Титр определяли как наибольшее разведение, приводящее к корректированному поглощению 0,1 или выше. Иммунное окрашивание ганглиозидов моноклональными антителами или мышиной сывороткой крови проводили после разделения на стеклянных пластинках с силикагелем для тонкослойной хроматографии высокого разрешения (ТСХВР), как описано выше (Hamilton et a1.,1993). Пластинки проявляли в растворителе 1: смесь хлороформ/метанол/вода (25% CaCl2) с соотношением 50:40: 10 (объем/объем) или растворителе 2: смесь этанол/н- бутанол/пиридин/вода/уксусная кислота с соотношением 100:10:10:30:3 (объем/объем) и также визуализировали при помощи реагента резорцин/HCl.
Иммунизация. Шестинедельным самкам мышей BALB/cxC57BL76F1 (The Jackson Laboratory, Bar Harbor, ME) вводили внутрибрюшинной инъекцией циклофосфамид (15 мг/кг) за 3 дня до первой иммунизации и статистически распределили по группам, подвергаемым лечению. Группам из 4 или 5 мышей вводили подкожной инъекцией три вакцины по отдельности 2 недели, если не оговорено особо. Каждая вакцина содержала 20 мкг GD3 или 15 мкг дизиалиллактозы и 10 мкг QS21 в общем объеме 0,1 мл РВS/мышь. Кровь у мышей отбирали из позадиглазничной полости за 2 недели до и через 2 недели после вакцинации, если не оговорено особо.
Получение GD3-конъюгата. GD3 (2 мг) растворяли в 2 мл метанола при воздействии ультразвука и охлаждали до -78oC в бане этанол/сухой лед. Озон получали в генераторе озона (Del Industries, San Luis Obispo, CA) и пропускали через пробу в течение 30 минут при энергичном перемешивании (Criegee, 1957, Wiegandt and Baschang, 1965). Избыток озона вытесняли азотом в течение 10 минут. Добавляли 100 мкл S(CH3)2 (Pappas et al., 1966), пробу выдерживали 30 минут при -78oC, затем 90 минут при комнатной температуре при энергичном перемешивании. Пробу сушили над потоком азота и контролировали ТСХВР. Альдегид с длинной цепью отделяли добавлением 2 мл н-гексана в сухую пробу с последующей обработкой ультразвуком в течение 5 минут и центрифугированием при 2000 g в течение 15 минут. н-Гексан осторожно удаляли и выбрасывали, а пробу сушили над потоком азота. Полученный расщеплением GD3 и нативный GD3 разделяли ЖХВР (Waters, System 501, Milford, VA), применяя колонку с C18-обращенной фазой (10 х 250 мм, Rainin Instruments, Kidge-field, NJ). Ганглиозиды элюировали метанолом, контролируя по поглощению у 214 нм. Фракции анализировали также ТСХВР. Фракции, которые содержали полученный расщеплением GD3, объединяли и выпаривали при 37oC с применением роторного испарителя (Buchi, Switzerland). Полученный расщеплением GD3, белок-носитель в PB S и 2 мг цианоборогидрида натрия инкубировали при осторожном перемешивании в течение 48 часов при 37oC. Через 16 часов добавляли еще 1 мг NaCNBH3. Прогресс взаимодействия контролировали ТСХВР. В растворителе 1 и растворителе 2 конъюгаты GD3-белок не мигрировали и появлялись сначала в виде резорцин-положительной полосы. Смесь диализовали при помощи диализной трубы 1000 MWCO с тремя заменами каждого 4 л PBS при 4oC в течение 48 часов и пропускали через гель для удаления детергента Extractigel (Pierce) для окончательной очистки от неконъюгированного GD3. Пробы лиофилизировали и содержание белка и ганглиозида в них определяли белковым анализом Bioard и по определению нейраминовой кислоты по методике Svennerholm (1957).
Дисиалиллактозу выделяли из коровьего молозива, как описано ранее (Nicolai et a1., 1978). Углевод присоединяли к белку восстановительным аминированием (Gray, 1974). 10 мг дисиалиллактозы инкубировали с 2 мг белков в 2 мл PBS в течение 14 дней при 37oC. Вначале добавляли 2 мг цианоборогидрида натрия и 1 мг его добавляли каждые 3 дня. Присоединение контролировали ТСХВР в растворителе 2. Конъюгаты дисиалиллактозы очищали диализом с применением диализной мембраны 1000 MWCO и последующей лиофилизацией. Содержание белка и нейраминовой кислоты определяли, как описано выше. Дисиалиллактозу также конъюгировали с белками по методу, описанному Roy и Laferriere (1990). Во время этой процедуры сначала образуются N-акрилоилированные гликопиранозиламинопроизводные олигосахарида, которые затем конъюгируются путем реакции Михаэля с аминогруппами белка. Очистку и определение белка и нейраминовой кислоты проводили, как описано выше.
Определение подкласса IgG. Определение подкласса IgG проводили ELISA с применением подкласс-специфичных вторичных моноклональных антител (MAbs). Вторичные MAbs применяли при самом низком разведении, при котором не проявляется реактивность к пресывороткам или сывороткам с отрицательным контролем. Козьи антимышиные IgG, конъюгированные со щелочной фосфатазой, применяли в качестве третьего антитела при разведении 1:200.
FACS-анализ мышиной антисыворотки. Суспензию отдельных клеток меланомной клеточной линии SК-МЕ L-28 получали после обработки 0,1% этилендиаминтетрауксусной кислотой (EDTA) в PBS и последующего пропускания через иглу размера 26,5. Клетки (3 -галактозидазой (Cahan et al., 1982). GD3 (mel) выделяли из меланомной ткани человека (Ritter et al., 1991). GD3 (bbm) (применяли для получения вакцины) и GT3, выделенные из пахты коровьего молока, были любезно предоставлены Dr.R.K.Yu (Medical College of Virginia, Richmond, VA) (Ritter et al., 1990f). Дисиалиллактон (олигосахарид GD3) выделяли из коровьего молозива, как описано ранее (Nicolai et al., 1978).
Химикаты. Пластинки с силикагелем для тонкослойной хроматографии высокого разрешения (ТСХВР) получали от E.Merck (Darmstadt, GRG); кассеты Sep-Pak C18 получали от Walters Associates (Milford, MA); двунатриевую соль п-нитрофенилфосфата и цианоборогидрид натрия получали от Sigma Chemical Cj. (St. Louis, МО); циклофосфамид (цитоксан) получали от Mead Johnson (Syracuse, NY); содержащий QS-21 сапониновый компонент Quil А получали от Cambridge Biotech (Wore ster, MA).
Белки. Гидробромид поли-L-лизина (вискозиметрическая мол. масса 3800) приобрели у Sigma, гемоцианин лимфы улитки (KLH) – y Calbiochem (LaJolla CA), иммуномодулятор cBSA – lmject Supercarrier – у Pierce (Rockfort, IL), белок наружных мембран (OMP) Niesseria Meningitidis был любезно предоставлен Dr. M. S. Blake (Rockefeller University New York, NY). Полиантигенный пептид (MAP) YAL-IV 294-1, содержащий 4 повтора Т-клеточного эпитопа малярии, был подарен Dr. J.P. Tam (Rockefeller University New York, NY).
Моноклональные антитела. Антимышиные кроличьи иммуноглобулины, конъюгированные с пероксидазой хрена, для ITLC и антимышиные кроличьи IgM и IgG, конъюгированные со щелочной фосфатазой, для ELISA получали от Zymed (San Francisco, CA), анти-GD3 mAb R24 был генерирован (Houghton et a1., 1985).
Серологические анализы. Твердофазный иммуноферментный анализ (ELISA) проводили, как описано ранее (Livingston et a1., 1989). Для контроля неспецифической “сцепляемости” иммунную сыворотку испытывали на пластинках, которые обрабатывали аналогично, но в которые не добавляли ганглиозид, и показатель вычитали из величины, полученной в присутствии ганглиозида. Титр определяли как наибольшее разведение, приводящее к корректированному поглощению 0,1 или выше. Иммунное окрашивание ганглиозидов моноклональными антителами или мышиной сывороткой крови проводили после разделения на стеклянных пластинках с силикагелем для тонкослойной хроматографии высокого разрешения (ТСХВР), как описано выше (Hamilton et a1.,1993). Пластинки проявляли в растворителе 1: смесь хлороформ/метанол/вода (25% CaCl2) с соотношением 50:40: 10 (объем/объем) или растворителе 2: смесь этанол/н- бутанол/пиридин/вода/уксусная кислота с соотношением 100:10:10:30:3 (объем/объем) и также визуализировали при помощи реагента резорцин/HCl.
Иммунизация. Шестинедельным самкам мышей BALB/cxC57BL76F1 (The Jackson Laboratory, Bar Harbor, ME) вводили внутрибрюшинной инъекцией циклофосфамид (15 мг/кг) за 3 дня до первой иммунизации и статистически распределили по группам, подвергаемым лечению. Группам из 4 или 5 мышей вводили подкожной инъекцией три вакцины по отдельности 2 недели, если не оговорено особо. Каждая вакцина содержала 20 мкг GD3 или 15 мкг дизиалиллактозы и 10 мкг QS21 в общем объеме 0,1 мл РВS/мышь. Кровь у мышей отбирали из позадиглазничной полости за 2 недели до и через 2 недели после вакцинации, если не оговорено особо.
Получение GD3-конъюгата. GD3 (2 мг) растворяли в 2 мл метанола при воздействии ультразвука и охлаждали до -78oC в бане этанол/сухой лед. Озон получали в генераторе озона (Del Industries, San Luis Obispo, CA) и пропускали через пробу в течение 30 минут при энергичном перемешивании (Criegee, 1957, Wiegandt and Baschang, 1965). Избыток озона вытесняли азотом в течение 10 минут. Добавляли 100 мкл S(CH3)2 (Pappas et al., 1966), пробу выдерживали 30 минут при -78oC, затем 90 минут при комнатной температуре при энергичном перемешивании. Пробу сушили над потоком азота и контролировали ТСХВР. Альдегид с длинной цепью отделяли добавлением 2 мл н-гексана в сухую пробу с последующей обработкой ультразвуком в течение 5 минут и центрифугированием при 2000 g в течение 15 минут. н-Гексан осторожно удаляли и выбрасывали, а пробу сушили над потоком азота. Полученный расщеплением GD3 и нативный GD3 разделяли ЖХВР (Waters, System 501, Milford, VA), применяя колонку с C18-обращенной фазой (10 х 250 мм, Rainin Instruments, Kidge-field, NJ). Ганглиозиды элюировали метанолом, контролируя по поглощению у 214 нм. Фракции анализировали также ТСХВР. Фракции, которые содержали полученный расщеплением GD3, объединяли и выпаривали при 37oC с применением роторного испарителя (Buchi, Switzerland). Полученный расщеплением GD3, белок-носитель в PB S и 2 мг цианоборогидрида натрия инкубировали при осторожном перемешивании в течение 48 часов при 37oC. Через 16 часов добавляли еще 1 мг NaCNBH3. Прогресс взаимодействия контролировали ТСХВР. В растворителе 1 и растворителе 2 конъюгаты GD3-белок не мигрировали и появлялись сначала в виде резорцин-положительной полосы. Смесь диализовали при помощи диализной трубы 1000 MWCO с тремя заменами каждого 4 л PBS при 4oC в течение 48 часов и пропускали через гель для удаления детергента Extractigel (Pierce) для окончательной очистки от неконъюгированного GD3. Пробы лиофилизировали и содержание белка и ганглиозида в них определяли белковым анализом Bioard и по определению нейраминовой кислоты по методике Svennerholm (1957).
Дисиалиллактозу выделяли из коровьего молозива, как описано ранее (Nicolai et a1., 1978). Углевод присоединяли к белку восстановительным аминированием (Gray, 1974). 10 мг дисиалиллактозы инкубировали с 2 мг белков в 2 мл PBS в течение 14 дней при 37oC. Вначале добавляли 2 мг цианоборогидрида натрия и 1 мг его добавляли каждые 3 дня. Присоединение контролировали ТСХВР в растворителе 2. Конъюгаты дисиалиллактозы очищали диализом с применением диализной мембраны 1000 MWCO и последующей лиофилизацией. Содержание белка и нейраминовой кислоты определяли, как описано выше. Дисиалиллактозу также конъюгировали с белками по методу, описанному Roy и Laferriere (1990). Во время этой процедуры сначала образуются N-акрилоилированные гликопиранозиламинопроизводные олигосахарида, которые затем конъюгируются путем реакции Михаэля с аминогруппами белка. Очистку и определение белка и нейраминовой кислоты проводили, как описано выше.
Определение подкласса IgG. Определение подкласса IgG проводили ELISA с применением подкласс-специфичных вторичных моноклональных антител (MAbs). Вторичные MAbs применяли при самом низком разведении, при котором не проявляется реактивность к пресывороткам или сывороткам с отрицательным контролем. Козьи антимышиные IgG, конъюгированные со щелочной фосфатазой, применяли в качестве третьего антитела при разведении 1:200.
FACS-анализ мышиной антисыворотки. Суспензию отдельных клеток меланомной клеточной линии SК-МЕ L-28 получали после обработки 0,1% этилендиаминтетрауксусной кислотой (EDTA) в PBS и последующего пропускания через иглу размера 26,5. Клетки (3  105) инкубировали с 40 мкл разбавленной 1:20 сывороткой до и после иммунизации в течение 30 минут на льду. Клетки три раза промывали 3%-ной сывороткой плодного теленка в PBS. Добавляли 30 мкл разбавленного (1: 50) и меченного флуоресцеинизотиоцианатом козьего антимышиного IgG (Southern Biotechnology Associates Inc., Birmingham, AL) в качестве вторичного антитела и инкубировали на льду в течение 30 минут. Клетки промывали три раза, как указано выше, и снова суспензировали в 500 мкл 3%-ной сыворотки плодного теленка в PBS и анализировали проточной цитометрией (FACScan, Becton Dickinson, San Jose, CA).
Получение и характеризация вакцин GD3. GD3 из коровьей пахты селективно расщепляли у C4-C5-двойной связи в керамидной части при помощи озона. По-видимому, в метаноле метоксипероксиды являются промежуточными продуктами, которые легко восстанавливаются диметилсульфитом. В результате этого расщепления образовалось производное GD3 с альдегидной функциональной группой в положении бывшей двойной связи в керамидной части и элиминировался альдегид в длинной цепью (фиг. 1). Удачно расщепленный GD3 мигрировал ниже нативного GD3 и вследствие одновременно расщепляемых ненасыщенных жирных кислот он появлялся в виде двойной полосы на ТСХВР (см. ТСХВР, вставка в фиг. 1). Денситометрическое определение ТСХВР показало расщепление более 70% GD3, выделенного из коровьей пахты. Первоначальные эксперименты с пролонгированным периодом обработки озоном не изменили соотношение, указывая, что 30% GD3 из этого источника состоит из аналогов сфинганина и фитосфингозина. Было найдено, что расщепление GD3 при -78oC со временем реакции до 1 часа в зависимости от количества применяемого GD3 оптимально. Расщепленный GD3 сохранялся только в кислотных или нейтральных фосфатных буферах в течение до 72 часов, но с повышенным количеством побочного продукта. Из-за реакции 105) инкубировали с 40 мкл разбавленной 1:20 сывороткой до и после иммунизации в течение 30 минут на льду. Клетки три раза промывали 3%-ной сывороткой плодного теленка в PBS. Добавляли 30 мкл разбавленного (1: 50) и меченного флуоресцеинизотиоцианатом козьего антимышиного IgG (Southern Biotechnology Associates Inc., Birmingham, AL) в качестве вторичного антитела и инкубировали на льду в течение 30 минут. Клетки промывали три раза, как указано выше, и снова суспензировали в 500 мкл 3%-ной сыворотки плодного теленка в PBS и анализировали проточной цитометрией (FACScan, Becton Dickinson, San Jose, CA).
Получение и характеризация вакцин GD3. GD3 из коровьей пахты селективно расщепляли у C4-C5-двойной связи в керамидной части при помощи озона. По-видимому, в метаноле метоксипероксиды являются промежуточными продуктами, которые легко восстанавливаются диметилсульфитом. В результате этого расщепления образовалось производное GD3 с альдегидной функциональной группой в положении бывшей двойной связи в керамидной части и элиминировался альдегид в длинной цепью (фиг. 1). Удачно расщепленный GD3 мигрировал ниже нативного GD3 и вследствие одновременно расщепляемых ненасыщенных жирных кислот он появлялся в виде двойной полосы на ТСХВР (см. ТСХВР, вставка в фиг. 1). Денситометрическое определение ТСХВР показало расщепление более 70% GD3, выделенного из коровьей пахты. Первоначальные эксперименты с пролонгированным периодом обработки озоном не изменили соотношение, указывая, что 30% GD3 из этого источника состоит из аналогов сфинганина и фитосфингозина. Было найдено, что расщепление GD3 при -78oC со временем реакции до 1 часа в зависимости от количества применяемого GD3 оптимально. Расщепленный GD3 сохранялся только в кислотных или нейтральных фосфатных буферах в течение до 72 часов, но с повышенным количеством побочного продукта. Из-за реакции  -элиминирования выделение олигосахаридной части GD3 происходило во все возрастающем количестве с увеличением времени, как было описано ранее для щелочного значения pH (Wiegandt and Baseband, 1965). Углеводная часть, выделенная из GD3, не мигрировала в растворителе 1, но мигрировала вместе с дисиалиллактозой, выделенной из коровьего молозива, в растворителе 2, применяемом для разделения олигосахаридов (не показано). Повышенная по сравнению с природным GD3 гидрофобность расщепленного GD3 позволяла отделять его ЖХВР на колонках с обращенной фазой C18. Применение изократного элюирования метанолом приводило к образованию шиффовых оснований между модифицированным ганглиозидом и e-аминолизильными группами белков. Их восстанавливали для образования стабильных вторичных аминогрупп между ганглиозидом и белком при помощи цианоборогидрида натрия (Borch et a1., 1971). Этот восстановитель был селективен и альдегидные группы не восстанавливались в фосфатных буферах с pH 6.5-7.5. Реакцию контролировали ТСХВР, и было видно изменение отношения между расщепленным GD3 и положительной на резорцин полосы, которая появлялась первоначально. Эта полоса указывала на образование неогликоконъюгатов. Реакция обычно заканчивалась после инкубирования в течение 48 часов при 37oC. Дисиалиллактоза легко удалялась диализом, избыток расщепленного GD3 пропускали через колонку для удаления детергента. Степень сочетания определяли путем определения сиаловой кислоты и белка. Массовое соотношение GD3 и белков в конъюгатах зависело от доступности лизиновых групп в различных белках, оно приводится в таблице 1. Средний выход конъюгатов GD3 и белков был 30%.
Углеводную часть GD3, дисиалиллактозу, сочетали с белками при помощи двух различных методик. Конъюгирование дисиалиллактозы проводили восстановительным аминированием, которое приводило к образованию глюкозы в форме с раскрытым ядром, конъюгированной с белками (Gray et a1., 1978). Методика, требующая длинный период инкубирования олигосахаридов с белками, позволяла получать конъюгаты с выходом менее 20%. Второй способ олигосахаридного конъюгирования (Roy and Laferriere 1990) приводил к образованию продукта с замкнутым кольцом глюкозы, конъюгированным с белком.
Серологическая реакция против GD3 после вакцинации вакцинами, содержащими конъюгат GD3-белок -элиминирования выделение олигосахаридной части GD3 происходило во все возрастающем количестве с увеличением времени, как было описано ранее для щелочного значения pH (Wiegandt and Baseband, 1965). Углеводная часть, выделенная из GD3, не мигрировала в растворителе 1, но мигрировала вместе с дисиалиллактозой, выделенной из коровьего молозива, в растворителе 2, применяемом для разделения олигосахаридов (не показано). Повышенная по сравнению с природным GD3 гидрофобность расщепленного GD3 позволяла отделять его ЖХВР на колонках с обращенной фазой C18. Применение изократного элюирования метанолом приводило к образованию шиффовых оснований между модифицированным ганглиозидом и e-аминолизильными группами белков. Их восстанавливали для образования стабильных вторичных аминогрупп между ганглиозидом и белком при помощи цианоборогидрида натрия (Borch et a1., 1971). Этот восстановитель был селективен и альдегидные группы не восстанавливались в фосфатных буферах с pH 6.5-7.5. Реакцию контролировали ТСХВР, и было видно изменение отношения между расщепленным GD3 и положительной на резорцин полосы, которая появлялась первоначально. Эта полоса указывала на образование неогликоконъюгатов. Реакция обычно заканчивалась после инкубирования в течение 48 часов при 37oC. Дисиалиллактоза легко удалялась диализом, избыток расщепленного GD3 пропускали через колонку для удаления детергента. Степень сочетания определяли путем определения сиаловой кислоты и белка. Массовое соотношение GD3 и белков в конъюгатах зависело от доступности лизиновых групп в различных белках, оно приводится в таблице 1. Средний выход конъюгатов GD3 и белков был 30%.
Углеводную часть GD3, дисиалиллактозу, сочетали с белками при помощи двух различных методик. Конъюгирование дисиалиллактозы проводили восстановительным аминированием, которое приводило к образованию глюкозы в форме с раскрытым ядром, конъюгированной с белками (Gray et a1., 1978). Методика, требующая длинный период инкубирования олигосахаридов с белками, позволяла получать конъюгаты с выходом менее 20%. Второй способ олигосахаридного конъюгирования (Roy and Laferriere 1990) приводил к образованию продукта с замкнутым кольцом глюкозы, конъюгированным с белком.
Серологическая реакция против GD3 после вакцинации вакцинами, содержащими конъюгат GD3-белокСыворотка до иммунизации не показала реактивности IgМ или IgG с GD3. Иммунизация только 20 мкг GD3 или его в смеси с 10 мкг адъюванта QS-21 не вызывала индуцирование антител против GD3 (таблица 1). Некоторые группы мышей, иммунизированных 20 мкг GD3, конъюгированного с белками, плюс 10 мкг QS-21, проявляли повышенный иммунный ответ против GD3. Конъюгат GD3-поли-L-лизин, представляющий собой эпитоп GD3 высокой плотности, индуцировал IgM-иммунный ответ с умеренным титром (предел 1/20-1/320) и не индуцировал IgG-иммунный ответ. GD3-конъюгированный с белками наружной мембраны Neisseria meningitidis (GD3-OM3), также индуцировал умеренный титр IgM (предел 1/20-1/320) и низкий титр IgG (предел 1/20-1/80). Только одна мышь показала IgM-иммунный ответ с высоким титром (1/1280) и высокий титр IgG (1/2560) после вакцинации GD3-OMP, GD3, конъюгированный с катионизированным BSA (GD3-cBS А), показал низкий титр IgМ при определении ELISA (предел 1/20-1/80) и высокий титр IgG (предел 1/20-1/2560). Синтетический пептид MAP, содержащий Т-клеточный эпитоп малярии, имел 8 свободных аминогрупп в N-концевой части и 4 группы были способны конъюгироваться с GD3. Конъюгат GD3-MAP индуцировал низкий титр IgМ (предел 1/20-1/160) и только одна мышь продуцировала низкий титр IgG 1/40. Конъюгат GD3 с KLH (GD3-KLH) индуцировал самую сильную иммунную реакцию (по сравнению с другими конъюгатами) с самым высоким титром IgМ (предел 1/20-1/2560), а также самым высоким титром IgG (предел 1/40-1/10240). Иммунизация обоими типами конъюгатов дисиалиллактозы и белка индуцировала только IgМ со слабым титром, который был способен к перекрестной реакции с ганглиозидом GD3 (предел 1/20-1/160), и не индуцировала значительный IgG-иммунный ответ. Специфичность GD3-реактивности сывороток, определенная иммунной тонкослойной хроматографией. Иммунная тонкослойная хроматография (ИТСХ) позволяет тестировать GD3-антисыворотку на экстракты ганглиозидов из ткани тела человека и определять специфичность к ганглиозидам, полученным из опухолей. Примеры ИТСХ с экстрактами тканей тела человека и сывороток с высоким титром IgМ и IgG, индуцированных иммунизацией конъюгатом GD3-KLH, показаны на фиг. 3а и 3b. Сыворотки тестировали при разведении 1/150 на экстракт ганглиозидов головного мозга человека, нейробластомы, меланомы человека, а также иммуноген GD3 (bbm), выделенный из коровьего молозива. Реактивность на ИТСХ сравнивали с окрашенной резорцином ТСХВР, которая показала общий ганглиозидный состав, найденный в этих тканях. Нормальный головной мозг в основном содержит GM1, GD1a, GD1b и GT1b, тогда как экстракт нейробластомы содержит кроме основных ганглиозидов GD2 и GM2 и экстракт меланомы содержит в основном GM3 и GD3. IgG-антисыворотка показывала специфическую реактивность только с GD3 во всех трех тестируемых экстрактах тканей (фиг. 3A) как контрольные mAb R24. IgM-антисыворотка (фиг. 3), с другой стороны, показала некоторую перекрестную реактивность со структурно родственными ганглиозидами и сульфатидом в экстракте головного мозга. Иммунные реакции, индуцированные вакцинацией другими конъюгатами GD3, показали такую же специфическую реактивность, но были слабее и нужно было применять более концентрированную антисыворотку (не показано). Антисыворотки с высоким титром, идентифицированные ELISA у мышей, иммунизированных GD3-сBSA, имели на ИТСХ высокий фон. Применение различных блокирующих средств с этими сыворотками было неудачным. Невозможно было обнаружить никакой специфической реактивности с GD3 в экстракте ткани. Определение специфичности GD3-реактивных сывороток по окрашиванию в дот-блотах. Специфичность всех антисывороток с высоким титром IgM и IgG (по ELISA выше 1/160) изучали с применением чистых ганглиозидов GM3, GD2, GD1b, GD3 и GT3, выделенных из коровьего головного мозга или пахты, и GD3, выделенного из ткани меланомы человека. Эти структурно близкие ганглиозиды наносили в виде пятен на нитроцеллюлозные полосы в одинаковых количествах и обрабатывали иммунной сывороткой. Эксперименты с иммунным окрашиванием на дот-блотах с сыворотками, полученными до и после иммунизации мышей конъюгатами GD3-KLH и GD3-OMP, приведены на фиг. 4. Пресыворотки не показали реактивности с этими ганглиозидами. Сыворотки, полученные после иммунизации GD3-KLH, показали специфическую IgМ- и IgG-реактивность c GD3 из пахты коровьего молозива (иммуноген), а также с GD3, выделенным из ткани меланомы человека. В некоторых случаях наблюдалась перекрестная реактивность с GT3, реакцию наблюдали также с положительным контрольным mAb R24 (Houghton et a1., 1985). Сыворотки с высоким титром от мышей, иммунизированных конъюгатом GD3-cBSA, показали только фоновую реактивность, но не обнаружили специфическую реактивность против любого ганглиозида (не показано). Дот-блот-реактивности, индуцированные другими конъюгатами GD3, были специфичными для GD3 (не приведены). Результаты указывают, что специфические иммунные реакции с высоким титром IgМ и IgG можно индуцировать у мышей конъюгатами GD3 – белок и что самая сильная реактивность была индуцирована конъюгатами GD3-KLH. По-видимому, способ конъюгирования предохраняет важные эпитопы на GD3-oлигocaxapиднoй цепи и GD3-коньюгаты не индуцировали перекрестную реактивность со структурно родственными ганглиозидами. Клеточная поверхностная реактивность иммунной сыворотки, определенная FACS-анализом. Сыворотки мышей испытывали на связывание с клетками меланомной клеточной линии FK-MEL-28, которая, как известно, экспрессирует клеточный поверхностный GD3. Представительный пример FAC S-анализа с применением меченных флуоресцеинизотиоцианатом вторичных козьих антимышиных антител приведен на фиг. 5. Сыворотку тестировали до и после иммунизации GDS-KLH и QS-21. Сыворотка до иммунизации окрашивала 8% клеток-мишеней, после иммунизации – 92%. Здесь описан подход к созданию вакцин конъюгатов ганглиозидов с целью (1) установления реакции сочетания с белками, подходящими для ганглиозидов различных опухолей, (2) повышения иммуногенности GD3 как основного ганглиозида, связанного с меланомой и (3) определения наиболее эффективного белка-носителя. Конъюгирование ганглиозидов нужно проводить без затрагивания иммунной доминантной углеводной части. Было показано, что модификация GD3 в его углеводной части, например превращение карбоксигрупп в амидные группы, повышает иммуногенность синтетических антигенов, но не было значительного перекрестно реактивного гуморального иммунного ответа с нативным GD3 (Ritter et al. , 1990b). Следовательно, этот подход имел в виду сочетание GD3 через его керамидную часть без затрагивания углеводной части. Керамид, характеристичный для всех ганглиозидов, расщепляли озоном в положении 4 сфингозинового основания и вводили функциональную альдегидную группу. Сочетание с белками осуществляли восстановительным аминированием для образования стабильной аминной группы между ганглиозидом и  -аминолизильными группами белков. Расщепление -аминолизильными группами белков. Расщеплениеганглиозидов озонолизом и последующее конъюгирование еще не было описано, полагали, что альдегидный промежуточный продукт ганглиозидов нестабилен. О фрагментации сообщается, когда имеет место инициированная воздействием гидроксил-ионов в щелочных условиях миграция двойной связи и  -элиминирование вызывает освобождение олигосахаридной части (Kanfer and Hakomori, 1983; Wiegandt and Baschang, 1965). Найдено, что альдегидная функциональная группа достаточно стабильна при нейтральном значении pH, легко образуются шиффовы основания с аминогруппами белков и -элиминирование вызывает освобождение олигосахаридной части (Kanfer and Hakomori, 1983; Wiegandt and Baschang, 1965). Найдено, что альдегидная функциональная группа достаточно стабильна при нейтральном значении pH, легко образуются шиффовы основания с аминогруппами белков и  -элиминирование проходит в небольшой степени. Общий выход 30% был эффективный по сравнению с описанным для превращения ганглиозидов в лизопроизводные (Neuenhofer et a1., 1985). Альдегидное производное GD3 больше не реагировало на иммунной тонкослойной хроматографии (ИТСХ) с mAb R24. Аналогичный феномен описан в связи с реактивностью mAb М2590 с GD3, реактивность зависела от длины цепи ацила (Itonori et al., 1989). С другой стороны, конъюгаты GD3-белки проявили реактивность с mAb R24 при ИТСХ и вестерн-блоттинге. Это указывает на то, что иммунные доминантные эпитопы в GD3-неогликоконъюгатах были восстановлены.
Как только приняли способ конъюгирования для образования вакцины ганглиозида, нужно было выбрать пригодные белки-носители. Lowell et al., (1989) описал превосходную вакцинную систему, которая индуцировала иммунный ответ с высоким титром антител, путем комплексообразования бактериального углевода и пептидных антигенов через синтетическую гидрофобную “стопу” в белки наружных мембран (OMP) Neisseria meningitidis и была эффективной без дополнительного адъюванта (Donnely, 1991). Эта система была непосредственно пригодна для ганглиозидов благодаря их амфипатической природе. В предыдущих экспериментах заявители абсорбировали ганглиозиды гидрофобным взаимодействием на этих белках и могли индуцировать иммунные реакции с высоким титром IgM (Livingston et a1., 1993). Использовали ковалентное присоединение, но конъюгат GD3-OMP индуцировал только случайные IgG-ответные реакции, и IgM-ответная реакция не превышала результаты испытаний без конъюгирования GD3. Катионизированный BSA, который, как сообщалось, является сильным иммунным модулятором для белковых антигенов (Apple et a1., 1988), был способен повышать специфическую реакцию до слабо иммуногенных белков после конъюгирования. Конъюгаты GD3-CB6A индуцировали только умеренную IgM-ответную реакцию, но анализ ELISA показал высокий титр IgG-антител. Дальнейшее изучение этих антисывороток с высоким титром методами ИТСХ и иммунного окрашивания дот-блотинга показало, что иммунный ответ не был специфичным для GD3. Другой подход к приготовлению вакцин был описан J.Tam et a1. (Tam, 1988; Tam and Lu, 1989), которые предложили полиантигенную пептидную систему (MAP). Основанные на олигомерном разветвленном лизиновом коре, MAP состоят из 4 или 8 дендритных пептидных отростков, содержащих В- и Т-клеточные антигенные детерминанты. Иммунная реакция на пептиды при применении этих конструкций драматически возрастала по сравнению с пептидами только с В- и Т-клеточными антигенными детерминантами. Когда GD3 был присоединен к концевой аминогруппе MAP, содержащей T-клеточный эпитоп малярии, обнаруживали только умеренную IgМ-иммунную реакцию и не обнаруживали IgG-реакцию против GD3. Хотя такой подход очень эффективен для синтетических пептидов, по-видимому, лучше применять его для вакцин ганглиозидов. Сообщалось, что можно различать антитела против ганглиозидов GD3, полученных из опухолевых тканей, и против на нормальных тканях по причине их различной плотности клеточной поверхности (Nores et a1., 1987). Полагали, что конъюгат GD3 с полилизином имеет высокую плотность GD3-эпитопов, комбинированных на одинарной молекуле. Иммунная реакция на GD3-полилизин была средней, можно было обнаружить только средний титр IgМ и не было IgG-иммунного ответа. Наконец, мыши, иммунизированные GD3, конъюгированным с гемоцианином лимфы улитки, GD3-KLH, были способны генерировать иммунные ответы с самыми большими титрами IgМ и IgG, которые были значительно выше титров, генерированных предыдущими вакцинами.
Было найдено, что эти сыворотки при тестировании иммунным окрашиванием на дот-блотах проявляют высокую специфичность к GD3 в экстрактах ткани человека. Эксперименты по IgM-иммунной реакции в зависимости от времени показали результаты, аналогичные наблюдаемым в предыдущих исследованиях (фиг. 2). Пиковый титр IgМ получали после третьей вакцинации, когда вакцину вводили с интервалами в две недели. Быстро снижаемая иммунная реакция и непрерывная вакцинация не индуцировали значительное повышение гуморальной иммунной реакции. Это первое сообщение, показывающее индуцирование иммунного ответа с высоким титром IgG при помощи вакцин ганглиозидов. Эта иммунная реакция имела значительно большую длительность, чем IgМ-ответная реакция и повышалась непрерывной вакцинацией, но не могла быть сравнима с экспонентным потенциированием иммунного ответа, часто наблюдаемым с белковыми антигенами. Подкласс определяли, в основном, как IgGl, было неясно, активировали ли Т-клетка-зависимые пути вакцины с конъюгатами ганглиозида. Хотя важность Т-клеточной помощи в B-клеточном созревании несомненна, регулирование класса антител дискуссионно, и в нескольких сообщениях было показано, что переключение изотопа возможно T-клеткой-помощником (Teale and Abraham, 1978), Было найдено, что конъюгаты, содержащие только олигосахаридную часть GD3, не реагировали с mAb R24 и не были способны индуцировать значительный иммунный ответ против ганглиозида GD3. Модификация глюкозы у восстанавливающего конца олигосахаридной цепи в процессе конъюгирования или отсутствие части керамида может влиять на свойственную презентацию эпитопа и обнаружение иммунной системы. Оба метода, применяемые для конъюгирования, были менее эффективны и давали меньший выход. Индуцирование специфической иммунной реакции против ассоциированных с опухолью ганглиозидов менее эффективными вакцинами у пациентов, у которых уже была индуцирована иммунная реакция, было связано с лучшим прогнозом. Вакцины конъюгатов ганглиозида показали их способность индуцировать долго длящийся и специфический IgG-иммунный ответ у мышей, что позволяет предположить, что конкретно конъюгат GD3-KLH может скоро оказаться пригодным в качестве опухолевой вакцины для пациентов с меланомой.
Вторая серия экспериментов.
Стадия 1 исследования иммуноголического адъюванта -элиминирование проходит в небольшой степени. Общий выход 30% был эффективный по сравнению с описанным для превращения ганглиозидов в лизопроизводные (Neuenhofer et a1., 1985). Альдегидное производное GD3 больше не реагировало на иммунной тонкослойной хроматографии (ИТСХ) с mAb R24. Аналогичный феномен описан в связи с реактивностью mAb М2590 с GD3, реактивность зависела от длины цепи ацила (Itonori et al., 1989). С другой стороны, конъюгаты GD3-белки проявили реактивность с mAb R24 при ИТСХ и вестерн-блоттинге. Это указывает на то, что иммунные доминантные эпитопы в GD3-неогликоконъюгатах были восстановлены.
Как только приняли способ конъюгирования для образования вакцины ганглиозида, нужно было выбрать пригодные белки-носители. Lowell et al., (1989) описал превосходную вакцинную систему, которая индуцировала иммунный ответ с высоким титром антител, путем комплексообразования бактериального углевода и пептидных антигенов через синтетическую гидрофобную “стопу” в белки наружных мембран (OMP) Neisseria meningitidis и была эффективной без дополнительного адъюванта (Donnely, 1991). Эта система была непосредственно пригодна для ганглиозидов благодаря их амфипатической природе. В предыдущих экспериментах заявители абсорбировали ганглиозиды гидрофобным взаимодействием на этих белках и могли индуцировать иммунные реакции с высоким титром IgM (Livingston et a1., 1993). Использовали ковалентное присоединение, но конъюгат GD3-OMP индуцировал только случайные IgG-ответные реакции, и IgM-ответная реакция не превышала результаты испытаний без конъюгирования GD3. Катионизированный BSA, который, как сообщалось, является сильным иммунным модулятором для белковых антигенов (Apple et a1., 1988), был способен повышать специфическую реакцию до слабо иммуногенных белков после конъюгирования. Конъюгаты GD3-CB6A индуцировали только умеренную IgM-ответную реакцию, но анализ ELISA показал высокий титр IgG-антител. Дальнейшее изучение этих антисывороток с высоким титром методами ИТСХ и иммунного окрашивания дот-блотинга показало, что иммунный ответ не был специфичным для GD3. Другой подход к приготовлению вакцин был описан J.Tam et a1. (Tam, 1988; Tam and Lu, 1989), которые предложили полиантигенную пептидную систему (MAP). Основанные на олигомерном разветвленном лизиновом коре, MAP состоят из 4 или 8 дендритных пептидных отростков, содержащих В- и Т-клеточные антигенные детерминанты. Иммунная реакция на пептиды при применении этих конструкций драматически возрастала по сравнению с пептидами только с В- и Т-клеточными антигенными детерминантами. Когда GD3 был присоединен к концевой аминогруппе MAP, содержащей T-клеточный эпитоп малярии, обнаруживали только умеренную IgМ-иммунную реакцию и не обнаруживали IgG-реакцию против GD3. Хотя такой подход очень эффективен для синтетических пептидов, по-видимому, лучше применять его для вакцин ганглиозидов. Сообщалось, что можно различать антитела против ганглиозидов GD3, полученных из опухолевых тканей, и против на нормальных тканях по причине их различной плотности клеточной поверхности (Nores et a1., 1987). Полагали, что конъюгат GD3 с полилизином имеет высокую плотность GD3-эпитопов, комбинированных на одинарной молекуле. Иммунная реакция на GD3-полилизин была средней, можно было обнаружить только средний титр IgМ и не было IgG-иммунного ответа. Наконец, мыши, иммунизированные GD3, конъюгированным с гемоцианином лимфы улитки, GD3-KLH, были способны генерировать иммунные ответы с самыми большими титрами IgМ и IgG, которые были значительно выше титров, генерированных предыдущими вакцинами.
Было найдено, что эти сыворотки при тестировании иммунным окрашиванием на дот-блотах проявляют высокую специфичность к GD3 в экстрактах ткани человека. Эксперименты по IgM-иммунной реакции в зависимости от времени показали результаты, аналогичные наблюдаемым в предыдущих исследованиях (фиг. 2). Пиковый титр IgМ получали после третьей вакцинации, когда вакцину вводили с интервалами в две недели. Быстро снижаемая иммунная реакция и непрерывная вакцинация не индуцировали значительное повышение гуморальной иммунной реакции. Это первое сообщение, показывающее индуцирование иммунного ответа с высоким титром IgG при помощи вакцин ганглиозидов. Эта иммунная реакция имела значительно большую длительность, чем IgМ-ответная реакция и повышалась непрерывной вакцинацией, но не могла быть сравнима с экспонентным потенциированием иммунного ответа, часто наблюдаемым с белковыми антигенами. Подкласс определяли, в основном, как IgGl, было неясно, активировали ли Т-клетка-зависимые пути вакцины с конъюгатами ганглиозида. Хотя важность Т-клеточной помощи в B-клеточном созревании несомненна, регулирование класса антител дискуссионно, и в нескольких сообщениях было показано, что переключение изотопа возможно T-клеткой-помощником (Teale and Abraham, 1978), Было найдено, что конъюгаты, содержащие только олигосахаридную часть GD3, не реагировали с mAb R24 и не были способны индуцировать значительный иммунный ответ против ганглиозида GD3. Модификация глюкозы у восстанавливающего конца олигосахаридной цепи в процессе конъюгирования или отсутствие части керамида может влиять на свойственную презентацию эпитопа и обнаружение иммунной системы. Оба метода, применяемые для конъюгирования, были менее эффективны и давали меньший выход. Индуцирование специфической иммунной реакции против ассоциированных с опухолью ганглиозидов менее эффективными вакцинами у пациентов, у которых уже была индуцирована иммунная реакция, было связано с лучшим прогнозом. Вакцины конъюгатов ганглиозида показали их способность индуцировать долго длящийся и специфический IgG-иммунный ответ у мышей, что позволяет предположить, что конкретно конъюгат GD3-KLH может скоро оказаться пригодным в качестве опухолевой вакцины для пациентов с меланомой.
Вторая серия экспериментов.
Стадия 1 исследования иммуноголического адъювантаQS-21 в организме пациентов с меланомой, вакцинированных ганглиозидом GM2, ковалентно соединенным с KLH. Цель: Определение оптимальной безопасной дозы иммунологического адъюванта QS-21 для индуцирования антител против-GM2. Предпосылка. Пациенты со стадией III меланомы A JCC имеют частоту рецидивов в два года и коэффициент смертности за три года 60-70% (Hilal et al., 1981; Eilber et al., 1976). Пациенты со стадией IV меланомы, которые не болели после хирургической операции, имели более зловещий прогноз. Нет известных методов лечения для изменения этой частоты и коэффициента. Стандартным курсом лечения для стадии III меланомы после хирургической операции является тщательное обследование. Было показано, что некоторые пациенты с меланомой имеют в сыворотке антитела, которые реагируют с высоко консервативными (эволюционно стабильными) дифференцировочными антигенами меланоцитов. В некоторых случаях отмечалось, что присутствие этих антител было связано с неожиданно благоприятным течением болезни (Livingston et al., 1987). Поскольку только несколько пациентов имеют эти антитела в сыворотке, были сделаны попытки индуцировать образование антител иммунизацией этих пациентов меланомными вакцинами, содержащими соответствующие антигены. Вакцина, полученная из целых клеток, была неэффективна для этой цели (Livingston et a1., 1982). Для получения вакцины теперь предлагают вместо целых меланомных клеток применять очищенные антигены. В недавно завершенных исследованиях пациентов вакцинировали BCG-GM2 и у 33 из 44 пациентов обнаружили образование короткоживущих антител IgM (Livingston et al., 1989; Livingston, 1989), но образование антител IgG наблюдали редко. Идет постоянный поиск сильных адъювантов или других способов повышения иммуногенности ганглиозидов, например GM2, в частности для индуцирования IgG-иммунного ответа. Было найдено, что наиболее удачное индуцирование IgG-иммунной реакции на ганглиозиды у мышей достигается ковалентным присоединением ганглиозидов к гемоцианину лимфы улитки. Основой для этого является концепция расщепленной толерантности. Изучение иммунологической толерантности и путей преодоления ее показало, что в различных экспериментальных системах нереактивность Т-клеток быстрее индуцируется и легче поддерживается, чем нереактивность B-клеток (Romball et al., 1984; Weight, 1977). Содержание циркулирующих антигенов, подходящее для поддержания T-клеточной толерантности, не способно поддерживать B-клеточную толерантность. Следовательно, если обеспечиваются T-клетки-хелперы (как, например, сильными другими антигенами, например KLH, ковалентно присоединенными к целевому иммуногену), то могут индуцироваться антитела к толеризированным Т-клетка-зависимым антигенам. Этот способ удачно применяли для индуцирования антител IgG против различных углеводных антигенов в экспериментальных животных (Kundu et a1., 1980; Gray, 1978; Chang and Rittenderg, 1981; Longencker et a1., 1987) и недавно против полисахаридного антигена Н. Influenza у детей. Молекулярная масса KLH очень вариабельна, но приближается к 2  106 дальтонам. Его инъецировали внутрикожно пациентам несколько исследователей (Berd et a1. , 1982) в количестве 1 мг для индуцирования гиперчувствительности замедленного действия (DTH). Не содержащий пирогена KLH, полученный Biomira Inc. (Edmonton, Canada), ковалентно соединяли с GM2 при высокой эпитопной плотности (1000/1). При помощи этих препаратов в смеси с иммунологическими адъювантами индуцировали у мышей IgG-иммунную реакцию против GM2 с высоким титром.
Из иммунологических адъювантов, испытанных в доклинических исследованиях с вакцинами конъюгатов КLH, например T-антиген-KLH, QS был наиболее эффективным. У большинства мышей титр антител IgG был 1/4000 и наблюдался сильный DTH. При введении только T-KLH наблюдали средний титр 1/160 и не обнаружили DTH. QS-21 является углеводом, экстрагированным из коры дерева Quillaja saponaria Molina Южной Америки. Описан моносахаридный состав, молекулярная масса, адъювантный эффект и токсичность ряда этих сапонинов (Kensil et a1., 1991). QS-21 был выбран благодаря его адъювантной способности и отсутствию токсичности. Он имеет доказанную нетоксичность и высокую эффективность при повышении иммуногенности FeLV-субъединичной вакцины у кошек (Marciani et a1. ) и рекомбинантной вакцины ВИЧ-1 у макак-резусов.
Кроме того, было показано, что некоторые пациенты с меланомой имеют супрессорные клетки, которые могут мешать иммунизации и что эти клетки можно ингибировать низкой дозой циклофосфамида (Livingston et al., 1987), причем каждый пациент должен получить низкую дозу циклофосфамида до первой вакцинации. Найдено, что этот комбинированный метод повышает иммуногенность гликолипидов и других антигенов у экспериментальных животных и пациентов с меланомой (Livingston et al., 1987a, Livingston et al., 1989).
Популяция для изучения.
Желательны пациенты с высоким риском злокачественной меланомы AJCC стадии III или IV через 2-8 месяцев после хирургической резекции, микроскопические препараты патологии которых подвергались изучению в Memorial Hospital Department of Patology, у которых клинически не обнаружено заболевания. Они должны иметь состояние клинического эффекта 80 (Karnofsky) и предполагаемую хирургическую операцию (не считая меланомы) через по меньшей мере 5 лет. Исключаются беременные женщины, пациенты с аллергией на морскую пищу и пациенты с содержанием креатина или билирубина выше 2,0. Пациенты могут быть ранее подвергнуты облучению, химиотерапии или иммунотерапии (законченные за 8 недель до вакцинации).
Экспертиза лечения.
Пациенты должны получать физическое обследование в Memorial Hospital и рентгенографическое обследование грудной клетки, клинический анализ крови, анализ креатинина сыворотки крови и тест на функцию крови и тест на функцию печени в течение 3 недель лечения. Пациенты с ненормальным тестом на функцию печени или результатами рентгенографического обследования грудной клетки допускаются, если дальнейшее обследование (например CCT, томограммы) не выявит меланому.
Получение вакцины.
Химия и приготовление.
Лекарственное вещество 106 дальтонам. Его инъецировали внутрикожно пациентам несколько исследователей (Berd et a1. , 1982) в количестве 1 мг для индуцирования гиперчувствительности замедленного действия (DTH). Не содержащий пирогена KLH, полученный Biomira Inc. (Edmonton, Canada), ковалентно соединяли с GM2 при высокой эпитопной плотности (1000/1). При помощи этих препаратов в смеси с иммунологическими адъювантами индуцировали у мышей IgG-иммунную реакцию против GM2 с высоким титром.
Из иммунологических адъювантов, испытанных в доклинических исследованиях с вакцинами конъюгатов КLH, например T-антиген-KLH, QS был наиболее эффективным. У большинства мышей титр антител IgG был 1/4000 и наблюдался сильный DTH. При введении только T-KLH наблюдали средний титр 1/160 и не обнаружили DTH. QS-21 является углеводом, экстрагированным из коры дерева Quillaja saponaria Molina Южной Америки. Описан моносахаридный состав, молекулярная масса, адъювантный эффект и токсичность ряда этих сапонинов (Kensil et a1., 1991). QS-21 был выбран благодаря его адъювантной способности и отсутствию токсичности. Он имеет доказанную нетоксичность и высокую эффективность при повышении иммуногенности FeLV-субъединичной вакцины у кошек (Marciani et a1. ) и рекомбинантной вакцины ВИЧ-1 у макак-резусов.
Кроме того, было показано, что некоторые пациенты с меланомой имеют супрессорные клетки, которые могут мешать иммунизации и что эти клетки можно ингибировать низкой дозой циклофосфамида (Livingston et al., 1987), причем каждый пациент должен получить низкую дозу циклофосфамида до первой вакцинации. Найдено, что этот комбинированный метод повышает иммуногенность гликолипидов и других антигенов у экспериментальных животных и пациентов с меланомой (Livingston et al., 1987a, Livingston et al., 1989).
Популяция для изучения.
Желательны пациенты с высоким риском злокачественной меланомы AJCC стадии III или IV через 2-8 месяцев после хирургической резекции, микроскопические препараты патологии которых подвергались изучению в Memorial Hospital Department of Patology, у которых клинически не обнаружено заболевания. Они должны иметь состояние клинического эффекта 80 (Karnofsky) и предполагаемую хирургическую операцию (не считая меланомы) через по меньшей мере 5 лет. Исключаются беременные женщины, пациенты с аллергией на морскую пищу и пациенты с содержанием креатина или билирубина выше 2,0. Пациенты могут быть ранее подвергнуты облучению, химиотерапии или иммунотерапии (законченные за 8 недель до вакцинации).
Экспертиза лечения.
Пациенты должны получать физическое обследование в Memorial Hospital и рентгенографическое обследование грудной клетки, клинический анализ крови, анализ креатинина сыворотки крови и тест на функцию крови и тест на функцию печени в течение 3 недель лечения. Пациенты с ненормальным тестом на функцию печени или результатами рентгенографического обследования грудной клетки допускаются, если дальнейшее обследование (например CCT, томограммы) не выявит меланому.
Получение вакцины.
Химия и приготовление.
Лекарственное веществоНазвание и источник Правильное название: GM2-KLH, связанный с опухолью синтетический гликоконъюгат (S-TAG) – применяют для активной специфической иммунотерапии. GM2-HSA, связанный с опухолью синтетический гликоконъюгат (S-TAG) – применяют для испытания кожи пациентов, подвергаемых активной специфической иммунотерапии конъюгатом GM2-KLH. Химическое название: 11 3NeuAc-GgoSe3Cer-гемоцианин лимфы улитки (KLH) Лабораторное кодирование: GM2-KLH серия #5 GM2-HSA серия #1 Производитель: Biomira Inc. Research Centre One, Edmonton Research and Development Park, 9411-20 Avenue Edmonton, Alberta T6N IE5 Canada Материалы, применяемые для получения гаптена GM2, см. в табл. 11 Материалы, применяемые для коньюгирования, см. в табл. 12. Химия проявления Данные для GM2 и GМ2-альдегида см. в табл. 13. Структуру GM2 и GМ2-альдегида характеризовали 1H ЯМР-спектроскопией, тонкослойной хроматографией (TCX), FAB-масс-спектроскопией и FT-ИК-спектроскопией. Структурные данные 1H (DMSO-d6😀2)  : 9.48 (д, 1H, J=2,0 Гц), 4.79 (д, 1H, J=8.5 Гц, Ш-1), 4.26 (д, 1H, J=8.0 Гц, П-1), 4.19 (д, 1H, J=8.0 Гц, 1-1), 2.54 (дд, 1H, A-3e), 1.88 (с, 3H, Ас), 1.78 (с, 3H, Ас), 0.85 (т, 3H, J=6.6 Гц, CH3).
FT-ИК-спектроскопия (таблетка Квr, см-1): 3439, 3420, 2952, 2923, 2851, 1634, 1070 (вероятно гем-диол) : 9.48 (д, 1H, J=2,0 Гц), 4.79 (д, 1H, J=8.5 Гц, Ш-1), 4.26 (д, 1H, J=8.0 Гц, П-1), 4.19 (д, 1H, J=8.0 Гц, 1-1), 2.54 (дд, 1H, A-3e), 1.88 (с, 3H, Ас), 1.78 (с, 3H, Ас), 0.85 (т, 3H, J=6.6 Гц, CH3).
FT-ИК-спектроскопия (таблетка Квr, см-1): 3439, 3420, 2952, 2923, 2851, 1634, 1070 (вероятно гем-диол)TCX: Rf = 0,5 (CHCl3-CH3ОН-0,2% водный CaCl2 5:4:1) Данные для KLH, GM2-KLH, HSA и GM2-HSA см. в табл. 14. Гемоцианин лимфы улитки (KLH) является большим сложным белком, состоящим из ряда субъединиц с меньшей молекулярной массой. KLH экстрагируют из лимфы моллюска (Megathura crenulara) и очищают. KLH, HSA и конъюгаты характеризовали Biomira Inc. гель-фильтрационной хроматографией на сефарозе CL-4B, изоэлектрическим фокусированием (IEF) и колориметрическим методом с применением резорцин-соляной кислоты (1) – см. таблю 1, 7. 1. L.Svennerholm, Biochimica et Biophysica Acta, 24, (1957), 604-611. 2. С применением гель-фильтрационного метода на сефарозе CL-4B элюируются целые молекулы белка KLH. Объем колонки, которая указала, что молекулярная масса KLH выше 2  106. Эта величина согласуется с пределом масс, приведенных в литературе для этого белка.
Технологическая схема получения GM2-KLH.
Стадия 1 – очистка GM2: 106. Эта величина согласуется с пределом масс, приведенных в литературе для этого белка.
Технологическая схема получения GM2-KLH.
Стадия 1 – очистка GM2:GM2 (FIDIA) передав для вирусного испытания  Колоночная хроматография на силикагеле 1. хлороформ-метанол, 65:35 2. хлороформ-метанол-вода, 65:35:4  Для проведения QC – испытания применяли: 1. TCX 2. 1H ЯМР-спектроскопию Стадия 2 – очистка KLH: KLH растворяли в PBS, pH 7.5 (около 3 мг/мл)  Центрифугировали  Пробу растворенного KLH пропускали через колонку с сефарозой для определения молекулярной массы  Диафильтровали с последовательным применением следующих буферов: 1. PBS, pH 7.5 2. трис-HCl, EDTA, pH 7.75 3. трис-HCI, EDTA, 0,5% DOC, pH 7.75 4. трис-HCI, EDTA, pH 7.75 5. PBS, pH 7.5 Добавляли стерильный, не содержащий пирогена PBS до установлено объема 75 мл  Центрифугировали  Стерильно фильтровали  Проводили анализ белка методом Biorad  Пробу KLH пропускали через колонку сефарозы для определения молекулярной массы  Устанавливали концентрацию 10 мг/мл буфером PBS, pH 7.5 Аликвоты KLH помещали в пробирки для сыворотки  и замораживали при -25o +5oC  В процессе испытаний применяли: 1. Изоэлектрическое фокусирование (IEF) 2. Тест на пироген лизата Limulus amebocyte(LAL)  Стадия 3 – синтез GM2-альдегида (соединение #2): GM2 (соединение # 1)  (1) О3, метанол  (2) CH3S CH3 GM2-альдегид (соединение # 2, может быть гем-диол) В испытаниях, проведенных у себя, применяли: 1. ТСХ  Стадия 4 – конъюгирование гаптена GM2 с KLH:  Размораживали стерильный, не содержащий пирогена KLH  KLH добавляли в гаптен в соотношении 4:1 (масса/масса)  Инкубировали при комнатной температуре при встряхивании в течение 3 минут  Добавляли NaBH3CN в смесь гаптен/KLH в соотношении 1:1 (масса/масса) к гаптену  Реакционную смесь осторожно перемешивали при комнатной температуре в течение ночи и затем при 40oC в течение 4 дней  Стадия 5 – диафильтрование конъюгата: Конъюгат диафильтровали с применением 1. PBS, pH 7.5 2. трис/EDTA, pH 7.75 3. трис/EDTA/0,05% DOC, pH 7.75 4. трис/EDTA, pH 7.5 5. PBS, pH 7.5 Конъюгат асептически удаляли из прибора титрования Amicon  Центрифугировали  Конъюгат стерильно фильтровали  В процессе QC-испытания применяли: 1. Анализ белка методом Biorad 2. Гель-фильтрование на сефарозе 3. Изоэлектрическое фокусирование (IEF)  Концентрацию конъюгата асептически устанавливали 1 мг/мл  Конъюгат распределяли в 1 мл стерильной, не содержащей пирогенов сыворотке крови и замораживали при -20o +5oC  Конечное QC-испытание: 1. Иммуноферментный анализ с аффинной хроматографией (EIA) 2. Тест на пироген LAL 3. Анализ белка методом Biorad 4. Анализ с применением резорцин-HCl 5. Тест на кроличий пироген 6. Тест на общую безопасность 7. Тест на стерильность 8. Тест на примеси для цианида Способ получения конъюгатов GM2-KLH Получение полусинтетического гликоконъюгата GM2-KLH для ASI и полусинтетического гликоконъюгата GM2-HSA для испытания кожи проводят в 5 стадий: 1. Очистка полученного GM2 (коровий источник) (соединение # 1). 2. Очистка гемоцианина лимфы улитки (KLH). 3. Синтез GM2-альдегида (соединение #2). 4. Конъюгирование гаптена GM2 с KLH. 5. Диафильтрование конъюгата. Стадия 1: Очистка GM2 (соединение #1): Название: ганглиозид GM2 Аббревиатурное название: II 3NeuAc-GgOse3Cer Пробу ганглиозида GM2 (коровий источник), исходный материал, представленный FIDIA, посылают на вирусное тестирование (протокол 8CFR). Все стеклянные изделия промывают перегнанным ацетоном и затем перегнанным этанолом и затем выдерживают при 130oC в течение 18 часов до применения. Колонку (Michel-Miller S 795-10) силикагеля (30,5 г, кизельгель 60H, Art 7736, E.Merck) заполняют при давлении 5,3 ат (насос SSI Model 300Lo)c применением смеси хлороформа и метанола (65:35) в качестве растворителя. GM2 (200 мг) вводят в виде концентрированного раствора смеси хлороформа и метанола (65: 35). Элюирование осуществляют этим растворителем и затем смесью хлороформа, метанола и воды (65:35:4). Фракции анализируют ТСХ (Rf 0,6, смесь хлороформ-метанол-0,2% водный CaCl2, 5: 4:1). Содержащие GM2 фракции объединяют и выпаривают для получения кремово-белого аморфного твердого вещества. Способ тестирования этого материала (соединение 1) включает 1H ЯМР-спектроскопию и тонкослойную хроматографию (ТСХ) для подтверждения идентичности и чистоты ганглиозида. Результаты тестирования должны удовлетворять спецификациям, указанным в химии новых разработок. Если находят, что этот материал нечистый, то такую очистку повторяют. Стадия 2: Получение стерильного, не содержащего пирогена гемоцианина лимфы улитки (KLH). Получение KLH: Эту всю процедуру проводят внутри биологически безопасной камеры Class 100. Гемоцианин лимфы улитки (KLH), полученный от Calbiochem, растворяют в 100 мл стерильного не содержащего пирогенов фосфатного буферного солевого раствора (PBSP, pH 7.5). Этот раствор инкубируют при 2o – 6oС в течение 18 часов для растворения KLH в растворе. Раствор затем центрифугируют со скоростью 200 об./мин в течение 30 минут. Супернатант отбирают и пробу его пропускают через колонку с гелем сефарозы CL-4В для определения молекулярной массы необработанного KLH. До диализа KLH установку для ультрафильтрации при перемешивании Amicon стерилизуют и освобождают от пирогенов промыванием ее 4 раза сначала стерильной водой для инъекций (WFI) и затем заполнением ее 95%-ным этанолом и выдерживанием этанола в ней при перемешивании в течение 2 часов. Установку снова споласкивают водой WFI, затем автоклавируют. Супернатант, содержащий KLH, выливают в стерильную, не содержащую пирогены установку для диафильтрации Amicon с фильтром YM 30 (отделяют вещество с молекулярной массой 30000). Общий объем KLH затем доводят до 350 мл последовательно следующими стерильными, не содержащими пирогены или имеющими низкое содержание пирогенов буферами: 1. 1 полная замена PBS с pH 7.5 (стерильный, не содержащий пирогена) 2. 3 полных замен трис-HCl, EDTA, pH 7.67 (стерильный, низкое содержание пирогена) 3. 2 полные замены трис-HCl, EDTA, pH 7.75 с 0,5% дезоксихолевой кислоты (DOC) (стерильный, низкое содержание пирогенов) 4. 4 полные замены трис-HCl, EDTA, pH 7.75 (стерильный, низкое содержание пирогена) 5. 3 полные замены PBS с pH 7.5 (стерильный, не содержащий пирогенов). Каждая буферная замена состояла в уменьшении объема установки Amicon до 50 мл или ниже и затем добавлении буфера до достижения объема 350 мл. Стерильный, не содержащий пирогена PBS получают, применяя химикаты, которые нагревали при 180-185oC в течение 4,5 часов. Химикаты добавляют в стерильную воду для инъекций (WFI) и смешивают в стерильном, не содержащем пирогена контейнере. Химикаты или другие буферы нельзя нагревать для депирогенирования их, поскольку они плавятся при таких экстремальных температурах, поэтому эти буферы получают в стерильной воде WFI в стерильных, не содержащих пирогены контейнерах и стерильно фильтруют через фильтр 0,22 мкм. pH PBS и трис-HCl-буферов устанавливают до требуемой величины, применяя стерильный, не содержащий пирогенов 2 раствор едкого натра. DOC в буфере трис-E ТА, pH 7.75, служит для разложения пирогенов в их меньшие по молекулярным массам субъединицы, которые проходят через фильтр, тогда как белок KLH задерживается на фильтре Amicon (8, 9). Раствор KLH асептически удаляют из установки Amicon и снова центрифугируют со скоростью 2000 об./мин в течение 30 минут. Раствор затем переносят в стерильный, не содержащий пирогена градуированный цилиндр и конечный объем устанавливают на уровне 75 мл при помощи стерильного, не содержащего пирогена PBS с pH 7.5. Супернатант затем стерильно фильтруют через фильтр 0,22 мкм, фиксирующий белок с меньшей молекулярной массой. Пробу KLH пропускают через колонку с сефарозой CL-4B для определения, не изменилась ли молекулярная масса KLH в результате обработки его буферами (в частности, DOC) по сравнению с результатами колоночной хроматографии необработанного KLH. Молекулярная масса не должна изменяться значительно. Отбирают аликвоту KLH и анализ белка по методу Biorad проводят с применением KLH для стандартной кривой. Конечный объем раствора KLH асептически устанавливают при помощи стерильного, не содержащего пирогена РВS, получая конечную концентрацию белка 10 мг/мл. LAL-тестирование проводят для определения содержания пирогенов в очищенном KLH. Содержание пирогена должно быть ниже 10 EU/мг для KLH, который применяют для процедуры конъюгирования. Изоэлектрическое фокусирование (IEF) проводят для контроля чистоты и идентичности KLH. Прошлые партии KLH применяли параллельно в качестве стандартов. Аликвоты раствора KLH по 10 мл разливают по стерильным, не содержащим пирогенов пробиркам для сыворотки на 30 мл и закрывают стерильными, не содержащими пирогена пробками. KLH затем замораживают при -20o  5oC до времени конъюгирования с гаптеном.
Стадия 3: Синтез GM2-альдегида (соединения #2, гем-диола) 5oC до времени конъюгирования с гаптеном.
Стадия 3: Синтез GM2-альдегида (соединения #2, гем-диола)Все стеклянные изделия промывают перегнанным метанолом и сушат (130oC) в течение 18 часов до использования. Приготовляют раствор очищенного ганглиозида. GM2 (соединение # 1) (40 мг) в перегнанном метаноле (10 мл) перемешивают при -15oC (охлаждение сухим льдом в этаноле) и через раствор в течение 7 минут пропускают газ озон (озонатор Orec 03V10-0). Затем через раствор пропускают поток аргона при контроле реакции ТСХ (хлороформ-метанол-0,2% водный раствор CaCl2, 5:4:1). Растворители затем удаляют при пониженном давлении и полученный материал растворяют в перегнанном метаноле. В этот раствор добавляют метилсульфид (200 мл) и реакционную смесь перемешивают при комнатной температуре 1 час. Растворители затем удаляют и остаток растирают с диэтиловым эфиром (4 х 25 мл). Полученное белое твердое вещество (соединение # 2) сушат в вакууме 15 минут для удаления оставшегося количества растворителя и затем применяют непосредственно в последующей стадии конъюгирования. Из-за нестабильной природы полученного альдегида (  -элиминирование) соединение 2 идентифицируют, как обычно только ТСХ. ТСХ обычно указывает на присутствие небольшого количества аналога сфинганина или фитосфингозина (имеет такое же Rf, как соединение #1) и небольшого количества восстанавливающего сахара (Rf 0,32).
Стадия 4: Конъюгирование гаптена GM2 с KLH (или HSA) -элиминирование) соединение 2 идентифицируют, как обычно только ТСХ. ТСХ обычно указывает на присутствие небольшого количества аналога сфинганина или фитосфингозина (имеет такое же Rf, как соединение #1) и небольшого количества восстанавливающего сахара (Rf 0,32).
Стадия 4: Конъюгирование гаптена GM2 с KLH (или HSA)Все операции проводят в биологически безопасной камере Class 100. Две ампулы, каждая из которых содержит 10 мл замороженного стерильного, не содержащего пирогена KLH (10 мг/мл), размораживают до комнатной температуры непосредственно перед применением. Асептически измеренное количество (16 мл) белка KLH добавляют в склянку, содержащую лиофилизированный гаптен GM2 и магнитный стержень для перемешивания. Раствор осторожно перемешивают 3 минуты при комнатной температуре для перевода всего гаптена в раствор. В раствор гаптен/KLH добавляют цианоборогидрид натрия (NaBH3CN) (40 мг) и склянку герметизируют пробкой, снабженной стерильной фильтр-иглой. Раствор осторожно встряхивают и затем инкубируют в течение ночи при комнатной температуре. Затем раствор инкубируют при 40oC в течение 40 дней. Стадия 5: Диафильтрование гликоконъюгатов (GM2-KLH) Содержимое склянки для реакции гаптен/KLH асептически переносят в стерильную, не содержащую пирогена установки для фильтрования Amicon с фильтром YM-30. Фильтрованный азот пропускают для установления рабочего давления в камере Amicon 1,125 ат. Конъюгат затем диафильтруют с применением последовательно следующих стерильных, не содержащих пирогена или имеющих низкое содержание пирогена буферов: 1. 2 полные замены PBS с pH 7.5 (стерильный, не содержит пирогена) 2. 2 полные замены трис-HCI, EDTA с pH 7.75 (стерильный, имеет низкое содержание пирогена) 3. 2 полные замены трис-HCI с pH 7.75 и с 0,5% дезоксихолевой кислоты (DOC) (стерильный, имеет низкое содержание пирогена) 4. 4 полные замены трис-HCI с pH 7.75 (стерильный, имеет низкое содержание пирогена) 5. 3 полные замены PBS с pH 7.5 (стерильный, не содержит пирогена). Гликоконъюгат затем асептически удаляют из установки фильтрования и центрифугируют 30 минут при скорости 2000 об./мин. Супернатант затем стерильно фильтруют с применением фильтра 0,22 мм, фиксирующего низшие белки. Получают пробу гликоконъюгата и проводят следующие QC-тесты: 1. Гель-фильтрование через сефарозу 2. Изоэлектрическое фокусирование (IEF) 3. Анализ белка по методике Biorad На основании результатов анализа белка конечный объем гликоконъюгата устанавливают при помощи стерильного, не содержащего пирогена буфера с pH 7.5 на таком уровне, чтобы достичь концентрацию белка 1 мг/мл. Конечный гликоконъюгат затем внутри биологически безопасной камеры Class 100 разливают порциями по 0,5 мл с объемом отклонения 0,1 мл в стерильные, не содержащие пирогена, прозрачные боросиликатные пробирки для сыворотки на 1 мл с пробками из красного каучука и замораживают при -20oC. В процессе наполнения пробирок воздух внутри наполняемого пространства контролируют, подвергая две пластинки с кровяным агаром действию воздуха около рабочего пространства внутри камеры в течение минимум 30 минут. Эти пластинки затем переносят в инкубатор (37oC) и инкубируют в течение 1-2 дней. Пластинки затем обследуют на присутствие бактериальных или грибковых колоний. Пробирки помещают внутри камеры с меткой, указывающей название продукта, номер серии и число пробирок. Камеру затем герметизируют и метку с той же информацией помещают на внешней стороне камеры. Камеру подвергают карантину в холодильнике в течение 1-2 дней до того, как можно проводить мечение. После того, как сделаны последние QC-тестирования, требуется мечение. Продукт метит персонал, затем мечение проверяет Quality Control department или Regulatory Affairs department. Документ конечного продукта затем подписывает директор Regulatory Affairs и вице-президент и COO Immunotherapeutics division. Продукт затем освобождают и хранят в холодильнике для “освобожденного” продукта при -20oC. Каждую серию конъюгатов GM2-KLH и GM2-HSА подвергают следующему тестированию для конечного контроля качества: 1. Иммуноферментный анализ с аффинной хроматографией (EIA) 2. Тест на LAL-пироген 3. Анализ белка по методике Biorad 4. Резорцин-HCl-углеводный анализ 5. Тест на кроличий пироген 6. Тест на общую безопасность 7. Тест на стерильность 8. Тестирование на примеси для цианида. GM2-KLH получает Biomira Inc. (Edmonton, Alberta), его применяют под IND U.S. Food and Drug Administration. Молярное соотношение GM2 и KLH составляет 800/1 (реальное 200-1400). Конъюгат подают с концентрацией 0,57 мг на 0,5 мл фосфатного буферного солевого раствора (PBS). Это составляет приблизительно 70 мкг ганглиозида GM2 и 500 мкг KLH на 0,5 мл PBS. В день вакцинации для первоначальных 5 иммунизаций 0,5 мл вакцины следует поместить в индивидуальные шприцы и доставить в клинику для введения. Эта доза, содержащая 70 мкг GM2, как было показано в предыдущих исследованиях с GM2 и различными адъювантами, является эффективной дозой. Последняя (шестая) иммунизация должна содержать половину этой дозы, 35 мкг GM2 и 250 мкг KLH. QS-21 экстрагировала Cambridge Bioscience Inc. (Worcester, MA) из коры дерева Quillaja saponaria Molina хроматографией на диоксиде кремния и хроматографией с обращенной фазой, как описано ранее (16). Очищенный конъюгат GM2-KLH и QS-21 тестируют на стерильность стандартными методиками в бактериологической лаборатории для контроля пирогенности для кроликов и безопасности для кроликов и мышей. Их делят на аликвоты и хранят при температуре от -15o до -25oС. В день вакцинации 570 мкг GM2-KLH (или 285 мкг для шестой вакцинации) смешивают с QS-21, вводят в индивидуальный шприц, метят и доставляют в клинику. Следует применять 4 дозы: 10, 50, 100 и 200 мкг, каждую из которых разбавляют до общего объема 0,25 мл PBS. Первая группа из 3 пациентов должна получить 6 вакцин, содержащих 10 мкг QS-21, следующие 3 пациента – 50 мкг QS-21, следующие 3 пациента – 100 мкг QS-21 и затем 3 пациента – 200 мкг QS-21. Ни один пациент не должен перейти на следующую дозу до тех пор, пока все 3 пациента, получивших предыдущую дозу, не получат по меньшей мере две вакцинации. Если не наблюдается токсичность при дозе 200 мкг и если иммунологическая реактивность к GM2-антигену и KLH не выходит из прямолинейного участка в пределах 50-200 мкг, то 3 дополнительным пациентам можно ввести дозу 400 мкг. После определения безопасной и максимально иммуногенной дозы следует иммунизировать 6 дополнительных пациентов этой же дозой для лучшего определения гуморального иммунного ответа. IND для применения GM2-KLH плюс QS-21 владеет MSKCC. Вакцинация. За три-пять дней до первой иммунизации вводят 200 мг/м2 циклофосфамида IV. Эту дозу и схему заявители применяли удачно в прошедших исследованиях вакцинации. Четыре вакцинации затем проводили подкожным введением с интервалами две недели, начиная через 2-30 недель после хирургической резекции всего известного поражения. Две дополнительные вакцинации проводили с интервалами в два месяца. Оценка. Серологическая реакция: основной конечной точкой этого испытания является серологическая реакция. Кровь периферической системы (30 мл) следует отбирать непосредственно перед каждой вакцинацией и через 2 и 5 недель после четвертой, пятой и шестой вакцинаций. Следовательно, кровь можно отбирать в течение 3-месячного интервала, пока сохраняется обнаруживаемое количество антител на GM2. Сыворотку, полученную через 2 недели после четвертой, пятой и шестой вакцинации у всех пациентов, следует тестировать ELISA на антитела против GM2 и родственные ганглиозиды. Пациенты с титром 1/80 и выше, определенным ELISA или иммунной тонкослойной хроматографией на различные гликолипиды, которые реагируют специфично, считаются имеющими серологическую реакцию (серологическими респондентами). Дополнительную сыворотку у серологических респондентов можно тестировать для лучшего определения гуморальной иммунной реакции на вакцинацию. Дополнительные 60 мл периферической крови можно было получить через 2 недели после четвертой вакцинации для изучения иммунной реакции против GM2 на клональном уровне, если заявители имели доказательство индуцирования высокого титра антител IgG против GM2. Супернатанты из EBV-трансформированных лимфобластов и затем полученные гибридомы следует применять для этой цели. Гиперчувствительность замедленного типа: тестирование кожи на гиперчувствительность замедленного типа против KLH, GM2 и GM2, присоединенного к сывороточному альбумину человека, следует проводить во время пятой иммунизации. Реакции с индурацией более 5 мм за 48 часов следует считать положительными, но в случае GM2 следует проводить дальнейшее тестирование кожи с различными ганглиозидами. Клинический период: пациентов следует обследовать в Memorial Hospital во время их четвертой или шестой вакцинаций, рентгеновское обследование грудной клетки и рентгеноскопический профиль следует проводить во время шестой вакцинации. Дополнительное и последующее наблюдение следует проводить их онкологами. Критерий для прекращения иммунизации. Местный рецидив, который лечат обычным образом локальной терапией (хирургической операцией или инъекцией в место повреждения), не служит причиной для прекращения иммунизации, если пациента освободили от заболевания. Иммунизацию следует прекратить, если у пациента развивается рецидивное заболевание, требующее системного лечения или радиационной терапии. Статистические обсуждения. Эта фаза 1 изучения, имеющая дело главным образом с оценкой токсичности и IgG-иммунной реакции против GM2 и KLH после вакцинации. Трех пациентов следует вакцинировать 4 раза с увеличиваемой каждый раз дозой QS-21. Если IgG-иммунный ответ продолжает возрастать при каждом увеличении дозы, то можно будет отобрать самую большую дозу, вызывающую не более чем системную токсичность 1 степени или местную токсичность 2 степени. Если токсичность не наблюдается, то следует тестировать введение пятой дозы. На основании изучения мышей предполагается, что IgG-иммунный ответ после второй или третьей дозы будет в виде пика или плато. После того, как безопасный и иммуногенный предел доз установлен, 3-6 дополнительных пациентов следует иммунизировать дозой, которая оказалась наиболее иммуногенной, и следующими более высокими и более низкими дозами, чтобы быть уверенными в степени токсичности и иммуногенности этих доз. Риск. GM2-KLH: у 100 пациентов, которым ввели вакцины, содержащие 200 мкг GM2, не наблюдали никакой токсичности, обусловленной GM2. KLH применяли в дозах 1 мг, чтобы иммунизировать и тестировать иммунный статус у 50 пациентов без токсичности (15). 18 пациентов иммунизировали вакцинами, содержащими GM2-KLH. Один пациент испытывал боль и болезненность при дотрагивании в местах вакцинации в течение 48 часов, приписываемую GM2-KLН, вероятно, гиперчувствительности замедленного типа на KLH. Не требовалось ослабления ни одной дозы. Единственным предполагаемым побочным действием GM2-KLH было воспаление мест вакцинации в течение нескольких дней. Если имеет место жар с температурой выше 38oC или сильная локальная токсичность, которая ограничивает нормальную активность, то дозу GM2-KLH в следующих вакцинах можно снизить фактором 3. Сапонины не применяли на людях. Они, как известно, являются гемолитическими, но фракцию QS-21 выбирали потому, что она не проявляет явную токсичность при таких высоких дозах, как 125 мкг на мышь, кошку или макаку-резуса. При подсчете на м2 или кг эта доза в сотни раз превышает предложенную здесь максимальную дозу. Аутоиммунные реакции или реакции повышенной чувствительности на компоненты вакцины или кожные тест-антигены являются теоретическими, но действуют в пределах возможности. Критерий токсичности: токсичность следует распределить по степеням в соответствии с Common Toxicity Criteria, разработанной National Cancer Institute (NCl). Эти критерии находятся в документах с IRB. Важность изучения. Повысить иммунную реакцию на рак можно пытаться двумя основными способами неспецифического иммунопотенциирования, которые составляют основную часть прошлых и настоящих достижений иммунотерапии рака, и специфической иммунизации, которая реально не оценена при лечении рака, но значительно содействовала борьбе с инфекционными болезнями. Это знание микробного антигена, которое позволяет развивать успешную специфическую иммунизацию против инфекций. С другой стороны, недостаток знания антигенов рака человека препятствовал должному исследованию специфической иммунизации в контексте рака с применением вакцин с определенной, относящейся к раку, антигенностью и демонстрацией их иммуногенности у раковых пациентов. Недавний прогресс в определении поверхностных антигенов клеток меланомы теперь дает возможность исследовать специфическую иммунизацию. Результаты. GM2-KLН применяли в качестве антигена в исследовании фазы 1 с QS-21. Пациентов с меланомой AJCC стадии III и IV, которые не имели этого заболевания после хирургической резекции всего известного пораженного участка, иммунизировали 500 мкг GM2-KLH (соотношение (GM2/KLH составляло 200-1400/1, доза GM2 70 мкг) плюс 10, 50, 100 или 200 мкг QS-21 в группах по 3 пациента в каждой. Все пациенты получали полностью по 6 иммунизаций. Не наблюдали токсичность, связанную с дозой 10 или 50 мкг QS-21. Доза 100 мкг была также вполне толерантна, но каждый из 3 пациентов, которым ввели эту дозу, имел по меньшей мере после первой из 6 вакцинаций осязаемую припухлость и болезненность при нажатии в течение 24-48 часов и 2 из этих пациентов имели это явление после 2 из 6 иммунизаций. Не были обнаружены никакие системные побочные действия. 3 пациента, которым ввели по 200 мкг, при каждой вакцинации испытывали болезненность при нажатии и боль в местах инъекции в течение 2-10 дней и слабое проявление лихорадки и симптомы гриппа, включая несильную головную боль и рассеянные боли, в течение 8-24 часов после большинства из вакцинаций. Серологические реакции против GM2 и KLH для этих 12 пациентов суммированы в нижней части таблицы 2. Хотя токсичность с дозой 200 мкг не была действительно максимально переносимой, она была существенной и не было доказательства того, что она связана с повышенной иммуногенностью по сравнению с дозой 100 мкг. Обычным образом иммунизировали дополнительно 9 человек, причем по 3 из них получали дозу из 50, 100 или 200 мкг, для подтверждения этих результатов токсичности и иммуногенности. Титры IgМ и IgG 6 пациентов, получающих GM2-KLH плюс 100 или 200 мкг QS-21, приведены на фиг. 6. Видно, что GM2-KLH плюс QS-21 (100 мкг) является ударно иммуногенной вакциной, намного превосходящей вакцину GM2/BCG или GM2-KLH плюс DETOX или BCG как по титрам, так и продолжительностью присутствия антител IgM и IgG. Показав, что вакцины GM2-KLH и GD3-KLH плюс QS-21 значительно более иммуногенны, чем предыдущие вакцины ганглиозид/BCG, следует иммуногенность GD2, GD3 и GD3-лактона в этих вакцинах новых конъюгатов испытывать в клинических условиях. Основой для отбора этих ганглиозидов в качестве иммуногенов в меланоме является количественный анализ 20 биопсий меланомы при помощи иммунной тонкослойной хроматографии для количественного определения содержания этих ганглиозидов на меланоме и различных нормальных тканях. 6-12 пациентов с меланомой следует вакцинировать каждым из этих конъюгатов ганглиозидов, которые были получены и ковалентно связаны с KLH. Конъюгаты, которые обнаруживают иммуногенность в этих поисковых исследованиях, следует затем объединить и испытывать в дополнительной группе из 12 пациентов в качестве вступления в большое мультицентральное исследование, нацеленное на определение влияния стойко иммуногенной поливалентной меланомной ганглиозидной вакцины на частоту рецидивов и выживаемость. Пиковый титр антител против ганглиозида GМ2 после иммунизации GM2-KLH плюс различными иммуногенными адъювантами приведены в табл. 2. Третья серия экспериментов Клеточные поверхностные ганглиозиды GM2, GD2 или GD3 часто сверхэкспрессируются в злокачественной меланоме. Заявители ранее обнаружили, что иммунизация пациентов с меланомой GM2 и BCG индуцировала IgM-иммунный ответ у большинства пациентов и что пациенты с высоким титром антител на GM2 обнаруживали повышенную выживаемость. Как обычно при применении углеводных антигенов (которые T-независимые), IgM-иммунный ответ был кратковременным и IgG-иммунный ответ наблюдался редко. Для повышения иммуногенности заявители конъюгировали ковалентно GM2 с гемоцианином лимфы улитки (KLH). Вакцину GM2-KLH пациентам с меланомой вводили с одним из трех адъювантов: BCG, DETOX или QS-21. Более эффективной вакциной была GM2-KLH с QS-21. Она индуцировала много более высокий титр и более продолжительный IgM-иммунный ответ на GM2 и стойкий IgG-ответ (изотип IgGI и IgG3). Она индуцировала также самый высокий титр антител против KLH. Результаты подтвердили, что вакцина конъюгата GM2-KLH плюс QS-21 вызывала значительную T-клеточную помощь. Так как не обнаруживалась значительная токсичность, способ с применением такой вакцины привлекателен для повышения иммуногенности других ганглиозидов, например GD2 и GD3, и определения действия ганглиозидных антител на развитие меланомы. Кроме того, открытие, что QS-21 значительно повышает иммуногенность GM2-KLH, предполагает, что такое повышение может быть действительно для вакцин других конъюгатов, многие из которых обычно применяют без адъюванта. Введение. Одним из изменений, которые имеют место в процессе злокачественной трансформации, является измененный характер экспресии клеточных поверхностных ганглиозидов в некоторых типах рака, включая злокачественную меланому (1). В нормальных меланоцитах основным ганглиозидом является GM3. Содержание других ганглиозидов, которые включают GD3, GM2, GD1a и GT1b, составляет менее 10% от общего количества ганглиозидов (2). В злокачественной меланоме активация гликозилирующих ферментов ведет к повышенной экспрессии GD3, GD2, GM2 и 9-0-ацетил-GD3 (3, 4). Эти сверхэкспрессированные ганглиозиды являются привлекательными мишенями для иммунотерапии, включая активную иммунизацию ганглиозидными вакцинами. В ряде исследований, включающих иммунизацию вакцинами GM2 пациентов со злокачественной меланомой, заявители обнаружили, что вакцинация (после низкой дозы циклофосфамида и с BCG в качестве адъюванта) индуцирует образование IgM-антител на GM2 у большинства пациентов (5) и что период без заболевания и выживаемость повышается у пациентов, продуцирующих высокий титр антител на GM2 (6, 7). Однако индуцированный иммунный ответ на GM2 имеет характеристики T-независимого иммунного ответа (образование в основном антител IgM, короткий период действия, неустойчивый IgG-иммунный ответ, отсутствие вторичного иммунного ответа) и другие ганглиозиды меланомы, GD3 и GD2, не иммуногенны при введении таким же образом (8). Поскольку пригодные эпитопы являются углеводами, заявители исследовали подходы повышения иммуногенности на основе успешной разработки углеводных вакцин для бактериальных инфекций. Заявители обнаружили, что у мышей иммуногенность GD3 заметно повышается ковалентным связыванием его с гемоцианином лимфы улитки и что мыши, иммунизированные конъюгатом GD3-KLH и адъювантом QS-21, имеют IgM-иммунный ответ с высоким титром, за которым следует сильный, долговременный IgG-иммунный ответ (9). Заявители теперь начали испытывать вакцины конъюгированных ганглиозидов в клинических условиях и сообщают здесь первые результаты иммунизации пациентов со злокачественной меланомой вакциной конъюгата GM2-KLH. Материалы и методы. Пациенты Пациенты со злокачественной меланомой III стадии считались подходящими, если все метастатическое поражение было удалено в течение последних 4 месяцев. Ни один из пациентов не подвергался до этого химиотерапии или радиационной терапии. Получение и введение вакцины Вакцина GM2-KLH: конъюгат GM2-KLH получали Biomira Inc. (Edmonton, Alberta), как описано ранее для вакцины конъюгата GD3-KLH (9). Говоря кратко, процедура конъюгирования включала расщепление озоном двойной связи керамидной части GM2, введение альдегидной группы и конъюгирование с аминолизильными группами KLH восстановительным аминированием. Молярное соотношение GM2/KLH было приблизительно 800/1, и вакцину вводили с концентрацией конъюгата 0,57 мг в 0,5 мл обычного солевого раствора. Это количество представляло собой дозу для одного пациента и содержало 70 мкг GM2 и 500 мкг KLH. Каждая группа 6 пациентов получала конъюгат GM2-KLH без адъюванта, GM2-KLH с DETOX, GM2-KLH с BCG и GM2-KLH с QS-21. Четыре вакцинации проводили внутрикожно, в крайнем случае с прямым лимфатическим дренажем с интервалами 2 недели и следующей дополнительной вакцинацией с интервалами 8 недель. За 4-6 дней до первой вакцинации всем пациентам внутривенно вводили 200 мг/м2 циклофосфамида (Cytoxan, Mead Johnson and Co., Evansville, N). Иммунологические адъюванты: DETOX был получен и представлен Ribi Immunochem Research Inc. (Hamilton, MT) в виде лиофилизованной масляной эмульсии. Он состоял из остовов клеточных стенок (CWS) бациллы Galmette-Guorin и монофосфориллипида A (MPLA) из сальмонеллы minnesota R595. В день вакцинации 0,25 мл DETOX (250 мкг CWS и 25 мкг MPLA) смешивали с препаратом GM2-KLH. Вакцину (конечный объем 0,75 мл) перемешивали завихрением в течение 2-3 минут и вводили пациентам в течение 15 минут. BCG был приобретен у Bionetics Research Inc. (Rockville, MD). В день вакцинации 107 жизнеспособных единиц BCG в 0,1 мл обычного солевого раствора добавляли в вакцину GM2-KLH в каждом индивидуальном шприце (общий объем 0,6 мл). Содержимое перемешивали и вводили пациенту в течение 15 минут. Адъювант QS-21 (гомогенный сапонин, выделенный из коры Quillaja saponaria Molina и очищенный) (10, 11) был любезно предоставлен Cambridge Biotech. Inc. (Worcester, MA). 100 мкг или 200 мкг QS-21 разбавляли 0,25 мл обычного солевого раствора и смешивали с GM2-KLH. Вакцину (конечный объем 0,75 мл), перемешивали завихрением 2-3 минуты и вводили в течение 15 минут. Ганглиозиды GM2 и GD1b из коровьего головного мозга были подарены нам Fidia Research Laboratory (Abano Terme, Italy). GM3, GM1 и GD1a из коровьего головного мозга были куплены у Sigma Chemical Co (St. Louis, МО). Асиало-GM2 получали обработкой GM2 0,1 М трифторуксусной кислотой при 100oC в течение 1 часа с последующим разделением на колонке с обращенной фазой C18 Sep-Pak (Waters, Milford MA). GD2 получали из GD1b обработкой  -галактозидазой (12). GD3, выделенный из коровьей пахты, был любезно предоставлен Dr.R.K.Yu (Medical Colledge of Virginia, Richmond, VA).
Реагенты и моноклональные антитела -галактозидазой (12). GD3, выделенный из коровьей пахты, был любезно предоставлен Dr.R.K.Yu (Medical Colledge of Virginia, Richmond, VA).
Реагенты и моноклональные антителаПластины с силикагелем для тонкослойной хроматографии высокого разрешения (ТСХВР) получали от E.Merck (Darmstadt, Germany). 4-Хлор-1-нафтол и двунатриевую соль п-нитрофенилфосфата получали от Sigma. Для твердофазных иммуноферментных анализов (ELISA) применяли конъюгированный со щелочной фосфатазой козий античеловеческий IgM (Kierkgaard and Perry Labs, Gaithersburg, MD) и очищенный мышиный античеловеческий IgG (Southern Biotech, Birmingham, AL) и затем конъюгированный со щелочной фосфатазой козий антимышиный IgG (Southern Biotech). Конъюгированный с пероксидазой из хрена козлиный античеловеческий IgM или IgG, купленный у TAGO (Burlingame, CA), применяли для иммунного анализа с окрашиванием дот-блотов и иммунной тонкослойной хроматографии (HTLC) Кроличий антимышиный иммуноглобулин, конъюгированный с пероксидазой хрена, для (ИТСХ), и кроличий антимышиный IgM и IgG, конъюгированный со щелочной фосфатазой, для ELISA применяли с контрольными моноклональными мышиными антителами, их получали от Zymed (San Francisco, CA). Анти-GM2 mAb 696 получали от Kyowa Hakko Kogyo (Tokyo, Japan) и анти-GM3 mAb R24 генерировали (13). Серологические анализы ELISA проводили, как описано ранее (6). Для контроля неспецифичной “сцепляемости” иммунную сыворотку тестировали также на пластинках, которые были обработаны идентично, но в которые не был добавлен ганглиозид, и показание вычитали из величины, полученной в присутствии ганглиозида. Титр определяли как наивысшее разведение, дающее корректированное поглощение 0,1 или выше. Иммуноокрашивание ганглиозидов моноклональными антителами или сывороткой человека проводили после нанесения пятен на нитроцеллюлозные полосы (14) или разделения на стеклянных пластинках с силикагелем для ТСХВР, как описано ранее (3). Пластинки проявляли в смеси хлороформ/метанол/вода (0,25% CaCl2) с соотношением 50:40:10 (объем/ объем) и ганглиозиды визуализировали окрашиванием реагентом резорцин/HCl или моноклональными антителами. Определение подкласса IgG Определение подкласса IgG проводили ELISA с применением специфических для подкласса вторичных мышиных античеловеческих mAbs IgG1, IgG2, IgG3 и IgG4. Применяли вторичные mAb из различных источников (таблица 4). Щелочную фосфатазу, конъюгированную с козьим антимышиным IgG (Southern Biotech, Birmingham, AL), применяли в качестве третьего антитела при разведении 1:200. Проверка на медиированную комплементом цитотоксичность Проверку на медиированную комплементом цитотоксичность проводили анализом с выделением в течение 4 часов 51Cr. Клетки из GM2-положительной меланомной клеточной линии SK-MEL-173 служили клетками-мишенями, 2х106 клеток метили 100 мк CiNa2 51CrO4 (New England Nuclear, Boston, MA) в 10% FCS RPMI в течение I часа при 37oC в CO2-инкубаторе. Клетки промывали два раза и 104 клеток/лунку в планшете с 96 лунками с круглым дном (Corning New York, NY) метили и инкубировали с разбавленной 1:5 сывороткой до и после вакцинации или только со средой в течение 1 часа при 37oC в CO2-инкубаторе. Клетки промывали и инкубировали с комплементом человека (Sigma) при разбавлении 1:4 в течение 4 часов при 37oC. Планшеты центрифугировали при 500 г в течение 5 минут и отбирали аликвоту 125 мкл супернатанта каждой лунки для определения выделенного 51Cr. Все анализы повторяли трижды, они включали контрольные лунки для максимального выделения в 1% NP-40 (Sigma) и для спонтанного выделения в отсутствие комплемента. Процент специфического лизиса подсчитывали следующим образом: 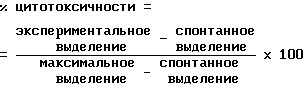 Результаты Введение вакцины и побочные действия 24 пациента иммунизировали вакциной GM2-KLH. Группы из 6 пациентов получали GM2-KLH без иммунологического адъюванта или с DETOX, BCG или QS-21 Ни локальной, ни системной токсичности не обнаружили после введения только GM2-KLH. Вакцины, содержащие DETOX, вызывали образование узелковых утолщений в местах вакцинации у 4 из 6 пациентов, не исчезающих в течение 2-10 недель. У 4 пациентов вакцинация вызывала эритемы и индурацию 3-10 см, но только с минимальной болезненностью. У одного пациента образовалась эритема и индурация 25 см после одной иммунизации и у второго пациента была слабая лихорадка и недомогание в течение 72 часов после первой иммунизации. Для этого пациента дозу DETOX для следующей иммунизации снизили до 50 мкг CWS и 5 мкг MPLA. BCG вызывал локальное воспаление и появление струпьев в одном и том же месте у всех пациентов, которые залечивались через 2-12 недель. Когда это имело место, дозу BCG снижали с 1х107 жизнеспособных единиц до конечной дозы 3х106 единиц у 4 пациентов и 1х106 единиц у одного пациента. Шестой пациент имел туберкулезное воздействие и положительный PPD-тест. Его поэтому начали вакцинировать с дозы 1х106 единиц, которую в конце снизили до 1х105 единиц. QS-21 индуцировал слабую локальную эритему и болезненность при дотрагивании в течение 24-48 часов у всех пациентов при дозе 100 мкг. Доза QS-21 вызывала локальную болезненность и воспаление, длящиеся 2-10 дней после всех иммунизаций, а также симптомы гриппа, включая небольшую лихорадку (ниже 38oC) головную боль и миалгию в течение 8-24 часов после 3 из 18 иммунизаций. Не наблюдались нейрологические нарушения или другие побочные действия. Гуморальный иммунный ответ на вакцины конъюгата GM2-KLH До вакцинации IgG-антитела против GM2 не находили и IgM-антитела были обнаружены только у трех пациентов с титром 1:80 у двух и 1:320 у одного. Остальные 21 пациент не обнаружили GM2-реактивность до вакцинации. Результаты анализов сывороток до и после иммунизации ELISA и иммунным окрашиванием дот-блотов суммаризованы в таблице 3. Титры антител IgM после иммунизации GM2-KLH или GM2-KLH и BCG или GM2-KLH и DETOX были близкими (средний титр 1: 80-1: 160). Напротив, 5 или 6 пациентов, иммунизированных GM2-KLH и QS-21, имели титр антител IgM 1:1280 или выше, значительно выше, чем титры в других группах или у пациентов, предварительно иммунизированных вакцинами неконъюгированного GM2 и BCG (6). Кроме того, иммунизация GM2-KLH и QS-21 индуцировала стойкий IgG-ответ в первое время у всех пациентов; только 2 из других 18 пациентов, получивших вакцины GM2-KLH, продуцировали сравнимый титр IgG. Последовательные титры антител IgM и IgG против GM2 у пациентов, получивших GM2-KLH и QS-21, показаны на фиг. 6. Пиковые титры IgM были обнаружены после третьей или четвертой вакцинации и сохранялись высокими у большинства пациентов в течение по меньшей мере 20 недель. Повторные иммунизации на 14 и 22 неделе не повысили далее титры IgM. Титры IgG 1:160 или выше были обнаружены через 2 недели после четвертой вакцинации у пяти из шести пациентов. Титры понижались до 1:40 или менее, но быстро повышались снова после повторной вакцинации до прежнего уровня (средний 1:160) и оставались на этом уровне в течение более чем 11 недель. Вторая повторная вакцинация не оказывала в большинстве случаев заметного влияния на титр антител. Таким образом, реакция на повторную вакцинацию показала только одну из двух характеристик классического вторичного иммунного ответа. Иммунный ответ проявлялся более быстро, но титр антител не поднимался выше титра после первоначальной иммунизации. Антитела на KLH в сыворотках до вакцинации не определяли. После вакцинации сыворотки всех пациентов обнаружили реактивность с KLH, как показано в таблице 3. Самый высокий титр антител IgG был после введения с QS-21, значительно выше, чем во всех других группах, включая следующую лучшую группу пациентов, вакцинированных GM2-KLH и BCG (p ниже 0,005). В QS-21 группе не было корреляции между интенсивностью иммунного ответа на GM2 и иммунного ответа на KLH. Анализ специфичности антител против GM2 Специфичность антител против ганглиозидов, обнаруженных в сыворотках пациентов до и после иммунизации, определяли иммунным окрашиванием дот-блотов с применением стандартов ганглиозидов GM3, асиало-GM2, GM2, GM1, GD2, GD3, GD1a и GD1b (фиг. 7). Антитела IgM и IgG до иммунизации у большинства пациентов показали слабую реактивность с асиало-GM2, некоторые пациенты имели также антитела IgM против GM1 и GD1b. Реактивность антител с этими ганглиозидами не изменялась после иммунизации. Единственными индуцированными вакциной изменениями была сильная реактивность с GM2 и слабая реактивность с GD2. Иммунное окрашивание дот-блотов располагали по интенсивности как 0, 1+, 2+ и 3+. Реактивность 3+ антител IgM против GM2 обнаруживали в сыворотке пяти из шести пациентов, иммунизированных GM2-KLH и QS-21, у одного из шести пациентов, иммунизированных GM2-KLH и BCG и у двух из шести пациентов, иммунизированных GM2-KLH без адъюванта или GM2-KLH и DETOX. Реактивность 3+ антител IgG обнаружили у пяти из шести пациентов, иммунизированных GM2-KLH и QS-21, и не обнаружили ни у одного из пациентов других групп. Сыворотки после вакцинации пациентов, иммунизированных GM2-KLH и QS-21, анализировали также иммунной тонкослойной хроматографией (фиг. 8A) для определения реактивности с GM2 и другими ганглиозидами экстракта меланомной ткани. Сыворотки большинства пациентов показали сильную IgM- и IgG-реактивность с GM2, выделенным из коровьего головного мозга или меланомы. Реактивность показали также медленно мигрирующей полосой в экстракте меланомы, предположительно GD2, при сравнении с величиной Rf очищенного стандарта GD2 (не показана). Для подтверждения GD2-пepeкpecтнoй реактивности антител IgG сыворотку пациента N2 после вакцинации предварительно инкубировали с GM2 или GD2 до проведения иммунного окрашивания (фиг. 8B). Реактивность с GM2 и с GD2 в экстракте ганглиозидов меланомы полностью ингибировалась предварительным инкубированием с GD2. С другой стороны, предварительное инкубирование той же сыворотки с GD2 приводило к ингибированию только GD2- реактивности и не изменяло реактивность с GM2. Эти результаты предполагают присутствие двух популяций антител, причем одна реагирует только с GM2, другая реагирует с GM2 и GD2. Определение подкласса антител IgG Сыворотки с высоким титром IgG шести пациентов, иммунизированных GM2-KLH и QS-21, анализировали ELISA с применением панели IgG-подкласс-специфичных вторичных антител. Результаты суммированы в таблице 4. Антитела IgG всех шести сывороток были подклассов IgG1 и IgG3. Медиированная комплементом цитотоксичность Функцию эффектора антител против GM2 в сыворотке пациентов, вакцинированных GM2-KLH и QS-21 (разбавление 1:5), определяли анализами на медиированную комплементом цитотоксичность. Как показано в таблице 5, сыворотка после вакцинации всех трех пациентов лизировала СМ2-положительные SK-MEL-173 меланомные клетки в присутствии комплемента человека. Сыворотки до вакцинации не показали цитотоксичность при добавлении комплемента. Сыворотки после вакцинации не были цитотоксичными для GM2-отрицательных меланомных клеток или без добавления комплемента. Несомненно, это только предварительные результаты, и более детальное изучение функций эффектора клеточного поверхностного связывания и цитотоксичности индуцированных вакциной антител и их подклассов проводится в настоящее время. Обсуждение. В ряде изучений пациентов со злокачественной меланомой объективно нужно было конструировать вакцины, которые эффективны в индуцировании продуцирования антител против трех ганглиозидов, часто сверхэкспрессируемых в меланоме -GM2, GD2 и CD3. Первоначальным подходом к этому было вакцинирование пациентов неконъюгированными ганглиозидами, адсорбированными BCG. Этим путем нам удалось индуцировать продуцирование антител против GM2 (5, 6), но не против GD2 или GD3. Антитела против GM2, индуцированные вакцинами GM2-BCG, были в основном класса IgM, иммунный ответ был кратковременный и повторная иммунизация приводила снова к короткому периоду продуцирования антител IgM, аналогичному периоду первичного иммунного ответа – все характеристики T-клетка-независимого иммунного ответа, хорошо известные при изучении других углеводных антигенов. Тем не менее, индуцированное вакциной продуцирование антител против GD2 пациентами с меланомой стадии III после хирургической операции было связано с повышенной выживаемостью. Это наблюдение предполагает, что ганглиозиды меланомы являются подходящими кандидатами для конструкции вакцин и что вакцины меланомных ганглиозидов с повышенной иммуногенностью могут привести к лучшим клиническим результатам. Поскольку пригодные эпитопы меланомных ганглиозидов являются углеводами, полезно рассмотреть исследования, которые предназначались для повышения иммуногенности других углеводных вакцин, а именно вакцин против некоторых бактериальных инфекций. Основное отличие иммунного ответа углеводных антигенов от белковых антигенов в том, что он не зависит от тимуса. Концепция, что углеводные антигены являются тимус-независимыми (TI), основана на наблюдении, что неонатально тимэктомизированные мыши, а также тимусные мыши проявляют незатронутые гуморальные иммунные ответы на бактериальные полисахариды (15). B-клетки, которые отвечают на TI-антигены, имеют несколько характерных черт. Они проявляются позже в онтогенезе, являются долго живущими и не требуют Т-клеток для активации, по меньшей мере in vivo. Хотя Т-клетки требуются B-клеткам для ответной реакции на TI-антигены in vitro, природа действия Т-клеток недостаточно понятна и определенно отличается от NHC-рестриктированной T-клеточной помощи в T-зависимом иммунном ответе на белковые антитела. Хотя Т-клетки не являются необходимыми для иммунного ответа in vivo на TI- антигены, титр антител выше, когда Т-клетки присутствуют, что подтверждает общее повышение активности Т-клеток, но снова неизвестными механизмами (16). В попытках повысить иммуногенность углеводных антигенов исследовали большое число подходов. Они включали химическую модификацию (17), введение с адъювантами, нековалентное комплексообразование с белками, ковалентное присоединение к иммуногенным белковым носителям (18) и замену углеводного эпитопа белковой репликой или пептидами, синтезированными de novo (так называемыми мимитопами), (19) или антиидиотипными антителами (20). Большинство из этих подходов приводит к повышенной T-клеточной помощи для углеводоспецифического иммунного ответа. Хотя каждый подход подавал надежды в начальном экспериментировании, ковалентное присоединение углеводных антигенов к иммуногенным E-зависимым белкам-носителям, которое сначала предлагалось для гаптенов (21) и затем для сахаридов (22), является концепцией, которой занимались наиболее энергично, что привело к созданию вакцин, которые, как было показано в некоторых примерах, наиболее эффективны в недавних клинических испытаниях. Превосходными примерами их являются вакцины конъюгатов полисахарида H. influenzae типа b(Hib) с белками. Четыре вакцины, которые были разработаны в течение последнего десятилетия, различаются в углеводных компонентах, белковых носителях и линкерах между углеводом и белком (23-27). В сравнительных изучениях на детях вакцины конъюгатов индуцировали значительно более сильный иммунный ответ, чем вакцина неконъюгированного полисахарида фосфорибозил/рибитфосфат (PRP) Hib (28). Наиболее интересны наблюдения, что новорожденные, которых сначала иммунизировали вакцинами HbOC (олигосахарид/нетоксичный токсин дифтерии) или PRP-OMPC (белковый комплекс наружных мембран Neisseria meningitidis типа В) и позднее лечили вакциной неконъюгированного PRP, проявляли анамнестический IgG-иммунный ответ, даже если лечили в возрасте, в котором они не отвечали на первичную иммунизацию неконъюгированной вакциной (29, 30). Теперь Т-клетками занимаются, но все еще далеко неясно, как они взаимодействуют с Hib PRP-реактивными B-клетками. Тот факт, что повышенная иммуногенность и Т-зависимость требуют ковалентного связывания между PRP и белком, предполагает, что близость между белком и PRP не должна нарушаться по меньшей мере в ранней фазе процессирования антигена. Когда изотоп и биологическая активность антител, индуцированных Hib PRP и конъюгатами Hib PRP, одинаковая, оказывается, что B-клетки, которые отвечают индуцированному конъюгатом T-клеточному сигналу, количественно идентичны клеткам, обязанным только Hib PRP. Привлекая значительный опыт, который накапливался при разработке углеводных вакцин для бактериальных инфекций, заявители исследовали в течение последних нескольких лет подобные подходы к попыткам повысить иммуногенность меланомных ганглиозидов. Химическая модификация GD3, приводящая к образованию амида, лактона или ганглиозидола или О-ацетилированию, позволяет получать производные, которые очень эффективны в индуцировании образования антител у пациентов с меланомой. Однако, антитела, индуцированные этими производными GD3, не реагируют перекрестно с GD3 (31,32). Антиидиотипические антитела ВЕС-2, имитирующие GD3, получали иммунизацией мышей моноклональными антителами R24, которые узнают GD3. Кролики, иммунизированные ВЕС-2, продуцировали антитела против GD3(33). Начальные исследования иммуногенности ВЕС-2 на людях проводятся в настоящее время. По вакцинам конъюгатов начальные исследования с GD3 на мышах касались трех вопросов – разработки способа конъюгирования, отбора белка-носителя и выбора адъюванта (7). Методика оптимального конъюгирования включала расщепление озоном двойной связи GD3 в керамидной цепи, введение альдегидной группы и сочетание с белковыми аминолизильными группами восстановительным аминированием. Найдено, что из пяти испытанных носителей – поли-L-лизина, гемоцианина лимфы улитки (KLH), катионизированного бычьего сывороточного альбумина, белкового комплекса наружных мембран Neisseria meningitidis (ОМРС) и полиантигенных пептидных конструкций, содержащих 4 повтора T-клеточного эпитопа малярии на разветвленном полилизиновом коре, KLH является наиболее эффективным. Нековалентные комплексы GD3/KLH были неиммуногенные. Самым лучшим адъювантом был QS-21, гомогенная сапониновая фракция, выделенная из коры Quillaja saponaria Molina и очищенная. Характеристики гуморального иммунного ответа на иммунизацию конъюгатом GD3-KLH и QS-21 включали а) высокий начальный титр антител IgM, b) быстрое вторичное повышение титра антител IgM после повторной иммунизации, с) поддержание титра антител IgM после повторной иммунизации в течение вплоть до 10 недель и d) стойкое продуцирование антител IgG с высокими титрами параллельно с продуцированием антител IgM, за исключением первоначальной задержки в течение двух недель. Эти открытия теперь воспроизводятся у пациентов (людей) с меланомой иммунизацией другой вакциной конъюгата ганглиозида, GM2-KLH, с применением такой же методики конъюгирования. Оказывается, как и при исследованиях на мышах, QS-21 является значительно более эффективным адъювантом, чем DETOX или BCG, с приемлемой токсичностью. Иммунный ответ против GM2 имел многие характеристики T-клетка-зависимого ответа. Он был долговременным, и были индуцированы антитела подкласса IgGl и IgG3 (обычно связанные с T-клетка-зависимым иммунным ответом). Как показано с вакцинами Hib PRP, эти изотипы были такие же, как изотипы, индуцированные изредка со слабыми титрами неконъюгированными вакцинами GM2/BCG. Отсутствие ясного повторного ответа в длительном IgM- и IgG-иммунном ответе с высоким титром после вакцинации в течение трех или пяти месяцев после первоначальной серии можно объяснить тем фактом, что пациенты были иммунизированы первоначально с двухнедельными интервалами. В классическом эксперименте, показывающем вторичный иммунный ответ на белковые антигены, вторую инъекцию антигена проводят через 4 недели после первой. Содержания антител после первой иммунизации более высокие в течение одной или двух недель после инъекции, затем снижаются до очень низких значений до вторичной инъекции антигена после четырех недель. В выбранной заявителями схеме иммунизации первоначальный иммунный ответ не понижался, а повышался ступенчато в ответ на первые четыре вакцинации с интервалами две недели, предвосхищая вторичный иммунный ответ, который наблюдается в более драматическом виде в классическом эксперименте. В отличие от иммунного ответа на большинство белковых антигенов IgM-иммунный ответ был долговременным и титр антител IgM оставался выше, чем у антител IgG, даже после повторяющихся бустер-иммунизаций, как это характеристично для углеводных антигенов. Поэтому иммунный ответ против ганглиозидов, которые содержат сравнительно короткую олигосахаридную цепь, соединенную с липидной цепью, и которые являются аутоантигенами, проявляет много общего с иммунным ответом против Hib-PRP и других бактериальных углеводов. Разработка вакцины СМ2-конъюгата даст возможность определить, будет ли более высокий титр антител IgM и IgG против GM2, поддерживаемый в течение более продолжительных периодов, более эффективным в задержании рецидива меланомы, чем более низкие титры главным образом антител IgM, присутствующих в течение более коротких периодов, у пациентов, иммунизированных неконъюгированным GM2. Помимо этого, заявители могут теперь испытать, придает ли конъюгирование с иммуногенными белковыми носителями иммуногенность GD2 и GD3 основным ганглиозидам, которые не индуцируют иммунный ответ у пациентов с меланомой, при введении их в виде неконъюгированных вакцин. Если это может быть выполнено, то конструирование и испытание поливалентных меланомных ганглиозидных вакцин могли бы быть привлекательной следующей стадией. Четвертая серия экспериментов Повышенные дозы сапониновой фракции QS-21 вводили в качестве иммунологического адъюванта в исследовании фазы 1 при постоянной дозе меланомного ганглиозида GM2, ковалентно присоединенного к гемоцианину лимфы улитки (KLH). 28 пациентам с меланомой AJCC стадии III или IV, которые не имели заболевания после хирургической операции, проводили шесть вакцинаций подкожно в течение периода более 5 месяцев. Локальные и системные реакции были, как при введении QS-21. Дозы 100 мкг или менее индуцировали слабую местную болезненность и воспаление в местах вакцинации, сохраняющиеся в течение 2-4 дней, и редкую кратковременную слабую лихорадку и недомогание, но без потери трудоспособности. Доза 200 мкг индуцировала слабую лихорадку и недомогание после 30%-ной вакцинации и локальные реакции в размере 20 см в диаметре появлялись у всех пациентов, что приводило к ограниченному действию инъецированных конечностей в течение 5-10 дней. Титры антител IgM и IgG против GM2 и антител IgG против KLH были выше при дозах QS-21 100 и 200 мкг. Антитела против QS-21 не были обнаружены. Это исследование устанавливает дозу QS-21 100 мкг как оптимальную, хорошо переносимую дозу для индуцирования антител против GM2 и KLH у меланомных пациентов. Введение. Заявители и другие сотрудники имеют меланомных пациентов, вакцинированных рядом вакцин целых меланомных клеток, выбранных для экспрессии различных гликопротеиновых и ганглиозидных антигенов (1, 2). Ганглиозид, узнаваемый наиболее часто антителами в сыворотках после иммунизации, был ганглиозидом GM2. Ганглиозид GM2 является дифференцировочным антигеном, сверхэкспрессированным на поверхности клеток злокачественных меланом человека. Было найдено, что инъецирование только GM2 не иммуногенно, поэтому испытывали вакцины GM2, содержащие различные иммунологические адъюванты (3, 4). Иммунизация очищенным ганглиозидом GM2, склеенным с Bacillus Calmette-Guerin (BCG), индуцировала продуцирование антител IgM против GM2 у большинства меланомных пациентов, и пациенты, продуцирующие антитела, имели больший период времени без заболевания и более высокую выживаемость по сравнению с пациентами, которые не продуцировали антитела (4, 5). В рандомизированном изучении с 122 меланомными пациентами, которые не имели заболевания после хирургической операции, основная часть пациентов (86%), получивших вакцину GM2/BcG, продуцировали антитела (6). Пациенты, которые продуцировали антитела против GM2, имели значительно более длинный период времени без заболевания и более высокую общую выживаемость, чем пациенты с отрицательным анализом на антитела. Сравнение двух направлений исследования показывает, что пациенты, получившие вакцину GM2/BCG, имели на 18% более длинный интервал без заболевания и на 11% большую выживаемость по сравнению с BCG-контрольной группой, хотя различие не было статистически значимым. Иммунный ответ был кратковременным, в основном с продуцированием IgM с умеренным титром. Аналогичные подходы с вакцинами других меланомных ганглиозидов GD2, GD3 и 9-0-ацетил-GD3/BCG у пациентов вызывали только случайные иммунные ответы с низким титром (7). Была очевидной необходимость в более эффективной вакцине. Классические эксперименты Landsteiner с конъюгатами гаптен-носитель удачно применяли для вакцинации детей против различных антигенов, включая бактериальные капсулярные полисахариды (8). Основываясь на этом, несколько различных углеводных опухолевых антигенов конъюгировали с гемоцианином лимфы улитки (KLH) и показали, что они вызывают IgM- и IgG-иммунный ответ с более высоким титром, чем ранее наблюдаемые титры при применении неконъюгированных вакцин (9-11). Заявители испытывали иммуногенность GD3, соединенного с различными молекулами носителей, на мышах и определили KLH как оптимальный носитель (12). Вакцину конъюгата GM2-KLH испытывали отдельно или в смеси с иммунологическими адъювантами BCG и DETOX на меланомных пациентах, но иммунный ответ значительно не отличается от ответа, индуцированного вакцинами GM2-BCG, были индуцированы только IgM-антитела с умеренным титром (13). Нужен был более сильный иммунологический адъювант. QS-21 является сапониновой фракцией, очищенной почти до гомогенности и полученной из коры Quillaja saponaria Molina, его выбрали вследствие высокого адъювантного действия при низкой токсичности (14, 15). Сапонины применяли в качестве иммуногенных адъювантов в различных наборах (обзор их дается). QS-21 применяли для усиления иммунного ответа против полисахарида E.coli (16) и гуморального иммунного ответа и T-клеточного ответа против белка оболочки ВИЧ-1 (17), овальбумина (18) и вируса лейкоза кошек (19). Цитотоксичные Т-клетки индуцировали против ВИЧ-инфицированных клеток и трансфектированных овальбумином клеток иммунизацией смесями белок/QS-21 (17, 18). Заявители испытывали различные новые иммунологические адъюванты с различными вакцинами углеводной антиген-KLH и показали, что иммунологические адъюванты QS-21 и SAFm наиболее эффективно повышают титры антител IgM и IgG (9). Эксперименты сосредоточили на применении QS-21, поскольку он был наименее токсичен и был приемлем для испытаний с конъюгированными вакцинами. Вакцины GD3-ганглиозид-KLH плюс QS-21 в мышах индуцировали стойкие IgM- и IgG-иммунные ответы с высоким титром (12), обеспечивая основу для испытания этого подхода на меланомных пациентах. Описанное здесь является результатом исследования фазы 1 с применением постоянной дозы GM2-KLH плюс увеличиваемой дозы QS-21. Поскольку очищенный QS-21 и частично очищенные сапонины, например Quil А, ранее не применяли на людях, целью было определение максимальной толерантной дозы, пригодной для многократного введения амбулаторному больному, и оптимальной дозы для усиления иммунного ответа против GM2. Материалы и методы. Ганглиозиды GM2 и GD1b из коровьего головного мозга были подарены Gidia Research Laboratory (Abano Terme, Italy). GM3, GM1 и GD1a из коровьего головного мозга были куплены у Sigma Chemical Со. (St.Louis, MO). GD2 получали из GD1b обработкой  -галактозидазой (20). GD3 выделяли из коровьей пахты и он любезно был предоставлен Dr.R.K.Yu (Medical Colledge of Virginia, Richmond, VA).
Реагенты и моноклональные антитела -галактозидазой (20). GD3 выделяли из коровьей пахты и он любезно был предоставлен Dr.R.K.Yu (Medical Colledge of Virginia, Richmond, VA).
Реагенты и моноклональные антителаПластины с силикагелем для ТСХВР получали от E.Merck (Darm stadt, Germany); 4-хлор-1-нафтол, двунатриевую соль п-нитрофенилфосфата получали от Sigma. Конъюгированные со щелочной фосфатазой козьи античеловеческие IgM (Kierkegaarg and Perry Labs, Gaithersburg, MD) и мышиные античеловеческие LgG, очищенные за тем конъюгированными со щелочной фосфатазой козьими антимышиными IgG (Southern Biotech), применяли для ELISA. Конъюгированные с пероксидазой хрена козьи античеловеческие IgM или IgG, купленные у TAGO (Burlingame, CA), применяли для иммунного окрашивания дот-блотов и иммунной тонкослойной хроматографии. Конъюгаты кроличьих антимышиных иммуноглобулинов с пероксидазой хрена для ИТСХ и кроличьи антимышиные IgM и IgG, конъюгированные со щелочной фосфатазой, для ELISA применяли с контрольными моноклональными антителами и получали от Zymed (San Francisco, CA). mAb 696 против GM2 получали от Kyowa Hakko Kogyo (Tokyo, Japan) и mAb R24 против GD3 генерировали (21). Пациенты Меланомные пациенты со стадией заболевания AJCC III или IV считались подходящими, если все симптомы метастатического заболевания были ликвидированы в течение последних 8 месяцев. Ни один из пациентов не получал до этого химиотерапию или радиационную терапию. Пациентов обследовали на токсичность во время каждой вакцинации. Кроме того, пациентов инструктировали для измерения местных реакций и температуры. Эти результаты фиксировались и затем просматривались во время следующего клинического посещения. Четыре пациента (по одному на каждую из 4 доз) получили только по 4 иммунизации, поскольку необходимо было другое лечение из-за прогресса заболевания. Получение и введение вакцин Конъюгат GM2-KLH был получен Biomira Inc. (Edmonton,Alberta). Молярное соотношение GM2/KLH было приблизительно 800/1. Конъюгат вводили в количестве 0,57 мг на 0,5 мл обычного солевого раствора. Эта доза для одного введения пациенту, она содержит 79 мкг GM2, 500 мкг KLH и 0,5 мл обычного солевого раствора. Адъювант QS-21, содержащий сапониновый компонент, выделенный из коры дерева Quillaja saponaria Molina, был представлен Cambridge Biotech. Corp. (Worcester, MA). Чистоту QS-21 определили как превышающую 98% аналитической ЖХВР с обратимой фазой. Затем 50, 100 или 200 мкг QS-21 разбавляли 0,25 мл обычного солевого раствора и смешивали с GM2-KLH. Вакцину (конечный объем 0,75 мл) перемешивали вихревым образом в течение 2-3 минут и вводили в течение 15 минут. Четыре вакцинации проводили подкожным введением с интервалами в две недели и затем две вакцинации с интервалами восемь недель. Сначала вакцинировали 12 пациентов, по 3 на каждую из 4 доз QS-21. Затем 1 дополнительный пациент получил дозу 10 мкг и 3 дополнительных пациента получили 3 более высокие дозы. 200 мг/м2 циклофосфамида (Cytoxan, Mead Johnson and Co., Evansville, IN) вводили IV всем пациентам за 3-6 дней до первой вакцинации. Серологические анализы и анализы гиперчувствительности замедленного типа (DTH) Твердофазный иммуноферментный анализ (ELISA) проводили, как ранее описано для ганглиозидов (5). Для ELISA-анализов QS-21, QS-21:этилендиамин (получен присоединением этилендиамина к карбоксигруппе глюкуроновой кислоты QS-21), наносили на пластины обработанного глутаровым альдегидом Immulon 4 (Dynatech Labs, Chanlilly, VA). Для контроля неспецифической “сцепляемости” иммунные сыворотки тестировали также на пластинках, которые были обработаны идентично, но в которые не был добавлен ганглиозид-KLH или QS-21, и показатель вычитали из величины, полученной в присутствии антигена. Титр определяли как наибольшее разведение, приводящее к корректированному поглощению 0,1 или выше. Иммунное окрашивание ганглиозидов моноклональными антителами и сыворотками крови человека проводили после нанесения пятен на нитроцеллюлозные полоски, как описано ранее (22). Кожу пациентов подвергали тестированию на GM2, GM2-HSA и KLH во время пятой вакцинации. 25 мкг каждого из них разбавляли 0,05 мл PBS и вводили внутрикожно. Результаты интерпертировали, как описано ранее (5). Результаты. Токсичность Число введенных вакцин, содержащих только GM2-KLH или конъюгат в комбинации с различными дозами QS-21, и локальные и системные реакции, связанные с этими вакцинациями, приведены в таблице 6. Тогда как GM2-KLH или этот конъюгат с 10 мкг QS-21 вызывал иногда слабую местную эритему и индурацию, повышенные дозы QS-21 приводили к повышению частоты и остроты локальных реакций. При дозах 10 и 50 мкг это было связано со слабой болезненностью в месте нажатия и эритемой и индурацией 2-4 см в течение 24-48 часов (токсичность выше степени 1 не наблюдали). При самых высоких дозах эти реакции становились более заметными с наибольшей реакцией в размере 8-10 см и в некоторых случаях (при дозе 200 мкг) достигали 20 см в диаметре. Эти реакции обычно продолжались 2-4 дня, в одном случае 7 дней при дозе 100 мкг, и обычно 7 дней, в одном случае 10 дней при дозе 200 мкг. Ни в одном случае не требовались аналгетики более сильные, чем тиленол, и пациенты при дозах 10, 50 и 100 мкг продолжали заниматься своей трудовой деятельностью. Деятельность вакцинированных конечностей была ограничена в течение 5-8 дней после введения в основном вакцин, содержащих 200 мкг, но все свидетельства локальных реакций исчезали в течение двух недель до следующего осмотра. Не были выявлены образования язв и дренирование или подкожные узелковые утолщения (как было обнаружено с большинством других адъювантов). Хотя случайные кратковременные слабые проявления лихорадки или миалгии наблюдались после введения вакцин, содержащих более низкие 3 дозы QS-21, приблизительно треть вакцинаций с содержанием QS-21 200 мкг была связана с этими симптомами. В общем, системные симптомы были наиболее заметны после повторной иммунизации. Всем пациентам группы с 200 мкг QS-21 дозу QS-21 снижали до 100 мкг или 50 мкг для третьей и четвертой иммунизаций из-за усиления локальных и системных реакций (побочные эффекты при иммунизации с этими сниженными дозами указаны в таблице 6 для доз 100 мкг и 50 мкг). Эти дозы хорошо переносились и поэтому для всех 5 пациентов (у одного пациента болезнь прогрессировала и он был исключен из протокола после 4 иммунизаций) дозу повысили снова до 200 мкг для пятой иммунизации. Две из пяти пятых иммунизаций были связаны с лихорадкой и симптомами, подобными гриппу. Одна из них вызывала также местную 20 см эритему и индурацию. Дозу QS-21 для шестой вакцинации этому пациенту снизили до 100 мкг и в результате этого не было развития системных симптомов и локальная реакция была слабая (3-4 см эритема и индурация). Ни одна из четырех оставшихся иммунизаций с применением 200 мкг QS-21 не вызывала появления системных симптомов. Хотя общие системные симптомы были совсем слабые, местная эритема, индурация и болезненность при дозе 200 мкг были достаточно заметными для того, чтобы заявители не выбрали для продолжения вакцинации более высокие дозы QS-21. Гуморальный иммунный ответ против GM2 после вакцинаций (см. таблицу 7) Иммунизация только GM2-KLH приводила к появлению титров антител, аналогичных титрам в предыдущих исследованиях с вакцинами, содержащими GM2, прилипшего к поверхности BCG. Пять из 6 пациентов продуцировали IgM-антитела, только один продуцировал IgG-антитела (с низким титром). Титр IgM-антител повышался с повышением дозы QS-21. Реципрокный средний титр IgM-антител после иммунизации только GM2-KLH был 80, после введения конъюгата с 10 или 50 мкг QS-21 был 480 и 240 (соответственно) и после 100 и 200 мкг QS-21 был 1280. Титр IgG-антител повышался прогрессивно с повышением доз от 0 у пациентов, получивших только GM2-KLH, до 10, 60, 200 и 640 у пациентов, получивших 10, 50, 100 и 200 мкг QS-21 соответственно. Заметное содержание IgM-антител и поддающееся обнаружению содержание IgG-антител (ELISA и иммунным окрашиванием дот-блотов) были выявлены у каждого пациента, получившего GM2-KLH плюс QS-21. Последовательные титры IgM- и IgG-антител для групп из шести пациентов, получивших 100 и 200 мкг QS-21, приведены на фиг. 9. В общем, иммунные ответы были совсем одинаковые в двух группах, хотя титры IgG (ELISA) были незначительно выше при дозе 200 мкг. Иммунное окрашивание дот-блотов против GM2 подтвердило специфичность для GM2 и аналогичность реакций при дозах 100 и 200 мкг (см. таблицу 7 и фиг. 10). Средняя IgM-реакция дот-блотов против GM2 повышалась от 2+ у пациентов, получивших только GM2-KLH, до значений между 2+ и 3+ у пациентов, получивших 10 или 50 мкг QS-21, и до 3+ у пациентов, получивших 100 и 200 мкг QS-21. IgG-реакции повышались с 0 у пациентов, не получивших QS-21, до 2+ у пациентов, получивших 10 или 50 мкг QS-21, и до 3+ у пациентов, получивших 100 или 200 мкг QS-21. Анализ специфичности гуморального иммунного ответа против GM2 Иммунное окрашивание дот-блотов сыворотками, полученными до и после иммунизации у двух представительных пациентов каждой из 5 групп иммунизируемых пациентов, приведены на фиг. 10. До иммунизации IgM-реактивность против GM1 была обнаружена в сыворотках многих пациентов, как заявители описали ранее, но реактивность была обнаружена против GM2 или других ганглиозидов. После иммунизации GM1-реактивности не обнаруживали, но IgM- и IgG-антитела против GM2 обнаруживали у всех пациентов. Как заявители описали ранее (13), эти индуцированные GM2 антитела иногда проявляют перекрестную реактивность с GM2 (пациент 1, доза 100 мкг). Серологические ответы против KLH и QS-21 Как показано в таблице 7, реактивность против KLH не обнаруживали до иммунизации и эта реактивность прогрессивно увеличивалась с повышением доз QS-21. В то время как дозы QS-21 50, 100 и 200 мкг индуцировали значительно более высокие титры IgG-антител против KLH по сравнению с дозой 0 или 10 мкг, не было значительного различия между серологическими титрами, индуцированными при дозах 50, 100 и 200 мкг. Титры антител против QS-21 определяли ELISA после четырех иммунизаций. Не наблюдали значительного повышения антител против QS-21 в пробах сывороток до и после иммунизации (данные не приведены). DТН-ответы против GM2 и KLH. Ни эритему, ни индурацию не обнаружили в местах тестирования кожи на GM2 или GM2-KLH. Заметные эритематозные реакции были обнаружены через 24 и 48 часов в большинстве мест тестирования кожи на KLH. Эти реакции были самые сильные у пациентов, получивших дозу 200 мкг (средние диаметры 4,0 на 6,0 см). Они были связаны только с минимальной индурацией, что предполагает комбинацию DTH и медиированной антителами реакции, а это делает точное количественное определение DTH-ответа (пациентами дома) трудным. Другие клинические исследования Применяя такую же дозу вакцины, которая указана выше (Biomira. Inc.), лечили шесть пациентов с прогрессирующим заболеванием. Дополнительным шести пациентам с прогрессирующим заболеванием вводили снова 1/10 дозу GM2-KLH с 100 мкг QS-21. Титры антител в обеих группах были ниже, чем у пациентов с ранней стадией заболевания, но доза GM2 7 мкг оказалась при индуцировании титров IgM- и IgG-антител такой же эффективной, как и доза 70 мкг. В другом исследовании 6 пациентам с ранней стадией заболевания вводили конструкцию GM2-KLH. Титры IgG-антител были сравнимы с титрами после введения конструкции Biomira, хотя титры IgM-антител оказались иногда ниже. Однако все пациенты продуцировали антитела после иммунизации и вакцина была хорошо переносима. Дальнейшее изучение будет включать 18 пациентов, получающих вакцины GM2-KLH, первоначально еженедельно (показанная схема предпочтительна для изучения мышей). Пациентов рандомизировали, причем некоторые не получали предварительно низкую дозу циклофосфамида и другие предварительно получали низкую дозу циклофосфамида. В это время изучали 10 пациентов и оказалось, что нет различия между пациентами, получающими циклофосфамид, и пациентами, не получающими фосфамид, и титр антител по новой схеме оказался в то же время предпочтительнее титров в предыдущих исследованиях с тем же конъюгатом. Обсуждение. Это было исследование фазы 1, предназначенное для идентификации максимальной толерантной дозы (MTD) QS-21 для применения в комплектах для амбулаторных больных, и дозы QS-21, обеспечивающей самый сильный иммунопотенциирующий эффект. Вероятная MTD была установлена как 200 мкг QS-21 на вакцинацию. Несмотря на слабое проявление лихорадки и недомогания и сильные локальные воспалительные реакции при дозе 200 мкг, нельзя рассматривать MTD в контексте высокой дозы IL2 или комбинационной химиотерапии, которую применяют для госпитализированных пациентов с прогрессирующей меланомой (23, 24), они были важными в контексте амбулаторного лечения раковых больных в наборе адъювантов и могут быть приемлемыми для иммунизации против инфекционных заболеваний нормальных реципиентов. Доза 100 мкг, однако, вызывала только в двух случаях слабое проявление лихорадки в 44 инъекциях и местные воспалительные реакции, которые не мешали ежедневной деятельности и были обычно ограничены 2-4 днями. Эта доза была вполне толерантной для группы пациентов в клиническом исследовании. Было четкое повышение локальной и системной токсичности с ростом дозы от 100 мкг до 200 мкг, которое делало нас нерешительными для дальнейшего повышения дозы. Тогда как лихорадка и недомогание при самой большой дозе были подобны лихорадке и недомоганию, иногда проявляемым другими иммунологическими адъювантами, например BCG и DETOX (15,5), локальные реакции были совсем другими. Доза QS-21 200 мкг при инъецировании подкожно вызывала образование с диаметром 10-20 см эритемы или индурации, которая была горячей и мокрой при прикосновении. Эта локальная реакция больше распространяется, чем реакция, обычно вызываемая дозами DETOX или BCG, индуцирующими сравнительные системные симптомы. Неожиданной характерной чертой этих реакций было то, что через несколько дней (или самое большее через 10 дней) эти реакции полностью ослабевали и не было очевидным, что вакцинацию проводили в этом месте. Ни у одного пациента не обнаружили образования язвы, дренажа или узелков в месте инъецирования. Вторым неожиданным открытием настоящего изучения было то, что QS-21 при любых применяемых дозах вызывает качественно другой иммунный ответ на ганглиозид GM2. Даже при дозе 10 мкг все пациенты продуцировали IgG-антитела, поддающиеся обнаружению иммунным окрашиванием дот-блотов против GM2. Вакцины GM2-KLH или эти вакцины с оптимальными дозами BCG, или DETOX, или GM2, прилипший к поверхности BCG, мутант R595 сальмонеллы Minnesota или протеозомы только редко вызывали более чем один поддающийся определению IgG-ответ среди 6 иммунизированных пациентов (2, 4, 5). Титры антител IgM и IgG против GM2 продолжали расти с повышением дозы QS-21, но, как оказалось, достигали плато между дозами 100 и 200 мкг. Титр антител IgG против KLH рос подобным образом с повышением доз QS-21. Пиковые титры IgG были значительно выше при дозах 50, 100 и 200 мкг, чем при дозах 0 и 10 мкг, но титры при трех более высоких дозах значительно не отличались друг от друга. Эти результаты показывают, что дозы 100 и 200 мкг QS-21 индуцируют оптимальный иммунный ответ против GM2 и что доза 100 мкг более толерантна. Были неожиданными в первую очередь ответы на тестирование эритематозной кожи против KLH у пациентов, иммунизированных только GM2-KLH или GM2-KLH плюс различными дозами QS-21. Их можно представить комбинацией медиированного антителами arthus-подобного и DTH ответов. Возможно также, что самая низкая доза KLH в кожных тестах по сравнению с дозами, применяемыми при изучении другими (26) (25 мкг в противоположность 100 мкг), была недостаточна для продуцирования сильной, поддающейся определению DTH-реакции, или что высокая эпитопная плотность ганглиозида GM2 на KLH в вакцинах не позволяет проходить нормальному процессированию и представлению антигенов, необходимых для индуцирования классического DTH-ответа против KLH. Несмотря на широкое применение QS-21 и других содержащих сапонин адъювантов на экспериментальных животных и в ветеринарной практике (14-19), механизм действия остается неизвестным. Из этих исследований можно сделать некоторые выводы по механизму действия QS-21. Отсутствие пальпируемых узелков в местах инъекции подтверждает, что не имеется депо-эффекта с образованием гранулемы. Несмотря на эффективность QS-21 в качестве адъюванта, оказывается, он является слабым иммуногеном. Даже после многократных иммунизаций не были получены поддающиеся определению иммунные ответы. Следовательно, в отличие от других адъювантов, например парвума С, BCG и полного адъюванта Freund, иммуногенность QS-21 не может содействовать его адъювантному действию. Слабое проявление лихорадки и недомогание, проявляемые при дозе 200 мкг, и эритема и индурация в месте инъекции подтверждают, что имеет место выделение цитокина. Внутрикожная инъекция IL-2 приводила к очень похожим реакциям, которые при биопсии являются характерными классическими DTH-ответами (27, 28). Частичное переключение антител против GM2 на IgG-иммунный ответ предполагает индуцирование Т-клеточной помощи, возможно, как следствие индуцирования цитокина. Заявители недавно показали превосходство KLH над другими носителями, испытанными для повышения иммуногенности ганглиозидов (12), и здесь заявители показали оптимальную дозу QS-21 для дальнейшего усиления этого эффекта. Поскольку заявители готовятся к большому исследованию фазы III ганглиозидной вакцины на пациентах с меланомой AJCC стадий III, имеется ряд переменных величин, которые остаются для испытания. Заявители в настоящее время проводят доклиническое исследование с этой вакциной (ганглиозид-KLH плюс QS-21) плюс применение некоторых других иммунологических адъювантов. Кроме того, планируются клинические исследования с различными схемами иммунизации и различными дозами GM2-KLH. Неожиданными открытиями в описанном здесь исследовании фазы 1 являются 1) отсутствие доказательства образования гранулемы при любой дозе QS-21 и 2) то, что при вполне толерантной дозе 100 мкг серологический ответ против GM2 поразительно превосходил количественно и качественно любой ответ с применением ранее испытанных вакцин GM2. Пятая серия экспериментов. Введение. Заболеваемость злокачественной меланомой повышалась быстро в последние 10 лет. В 1992 году в США было зарегистрировано свыше 32000 случаев прогрессирующей меланомы и 6700 смертей от меланомы (1). После адекватной резекции первичной меланомы коэффициент пятилетней выживаемости варьируется от более чем 95% для пациентов с первичными опухолями толщиной не более 0,75 мм до 50% для пациентов с толщиной первичных опухолей более 4,0. мм (2). Пациенты с региональными метастазами лимфатических узлов (стадия III AJ СС) имеют пятилетнюю выживаемость 25-35% после элективного или терапевтического рассечения (3). Было показано, что никакие дополнительные лечебные мероприятия не снижают скорость рецидивов и не повышают выживаемость после хирургической операции у этих пациентов. Большое число средств испытывали в этих исследованиях дополнительного лечения (обзор в ссылках 4, 5), включая химиотерапию, неспецифические иммуномодуляторы, интерфероны и различные типы меланомных вакцин. Для меланомных вакцин проблема состояла в разработке способов, которые могут контролировать иммуногенность вакцин по силе и специфичности образуемого иммунного ответа. Поскольку гуморальные иммунные реакции на вакцины можно количественно определить и анализировать с точностью, которая только сейчас становится возможной с клеточными иммунными реакциями, заявители сосредоточили свои усилия на меланомных антигенах, которые вызывают гуморальный иммунитет. Из этих серологически определенных антигенов ганглиозиды, в частности GM2, выявлены в качестве привлекательных целей для активной иммунизации (5-8). Заявители недавно показали, что иммунизация очищенным GM2, прилипшим к BCG, после предварительного введения низкой дозы Cy приводила к индуцированию IgM-антител у большого процента меланомных пациентов (8, 9). Иммунный ответ на GM2 показал Т-клетка-независимый результат, т. е. малую продолжительность, отсутствие IgG-ответа и отсутствие вторичного иммунного ответа при повторных вакцинациях. Индуцированные антитела были цитотоксичными для GM2- экспрессирующих меланомных клеток в присутствии комплемента человека, и пациенты, которые продуцировали антитела против GM2 после иммунизации, имели значительно больший интервал без заболевания и большую выживаемость, чем пациенты без такой иммунизации (9). Целью настоящего изучения было подтверждение благотворного воздействия продуцирования индуцированных вакциной антител против GM2 в рандомизированном контролированном исследовании. Материалы и методы. Пациенты Пациенты с патологически документированными меланомными метастазами, ограниченными до региональных кожных и лимфатических узелков (стадия III AJCC), были подходящими через 2-13 недель после полной резекции кожных метастаз или региональных лимфатических узелков. Другие критерии пригодности включают: возраст более 15 лет, состояние здоровья по Karnofsky не ниже 90; креатинин сыворотки менее 2,5 мг/дл, билирубин сыворотки менее 2,5 мг/дл и отсутствие химиотерапии или радиационной терапии в течение периода 8 недель до вакцинации. Исключались беременные женщины. Все пациенты были осмотрены и пригодность их была определена в течение двух недель до рандомизации. Последующее клиническое врачебное наблюдение проводил первоначальный онколог пациента. Рандомизация и последующее врачебное наблюдение Информированное согласие получали от всех пациентов и их распределяли по числу положительных лимфатических узлов (1, 2-4, не более 5), присутствию непроходящего заболевания и интервалу между хирургической операцией и вакцинацией (2-6 недель, 7-13 недель). Рандомизацию пациентов для вакцинации GM2/BCG или только ВCG проводил компьютер (для обеспечения обоснованно равного числа пациентов в двух группах исследования). Ни один из пациентов и медицинского персонала не был информирован о типе введенной вакцины до прошествия двух недель после последней вакцинации. Информацию о последующем врачебном осмотре всех пациентов получали в течение одной недели каждые 4-6 месяцев по телефону от их первоначальных врачей. Данные рецидива, документированного радиографически или патологически, применяли для определения интервала без заболевания. Поскольку два неспецифических компонента настоящего подхода к вакцинации, BCG и циклофосфамид с низкой дозой, могут иметь демонстрируемую противоопухолевую активность (10, 11, 12), их считали более подходящими, чем отсутствие такой обработки для контрольной цели. Вакцина GM2/BCG Ганглиозид GM2, применяемый для получения вакцин, получали из двух источников, ткани головного мозга кошек с болезнью Tay-Sachs (передается в этих кошках как аутосомный рецессивный признак) и GM1, полученного из головного мозга домашнего молочного скота и купленного у Sureico, Beliefonte, PA. Срезы головного мозга кошек с Tay-Sachs (предоставлены Dr.Mario Ratazzi, Mt. Sinai Hospital, New York, NY) экстрагировали смесью хлороформ/метанол и экстракт перацилировали, хроматографировали на флорсилиле для удаления фосфолипидов, дезацетилировали, диализовали и хроматографировали на колонках с DEAE-сефадексом (13). После диализа GM2 основную фракцию разделяли препаративной тонкослойной хроматографией. GM2 получали из GM1 коровьего головного мозга расщеплением концевой галактозы  -галактозидазой, как ранее описано (14). GM2 из двух источников были неразличимы тонкослойной хроматографией (ТСХ) и иммунной ТСХ с применением мышиных моноклональных антител, узнающих GM2 (13). Каждая порция GKR имела чистоту выше 98%, определенную тонкослойной хроматографией и денситометрическим сканированием. Порции были испытаны обычными тестами на стерильность и на безопасность на гвинейских свиньях и мышах.
Очищенный GM2 сушили и хранили при 4oC. 107 жизнеспособных единиц (или 3 -галактозидазой, как ранее описано (14). GM2 из двух источников были неразличимы тонкослойной хроматографией (ТСХ) и иммунной ТСХ с применением мышиных моноклональных антител, узнающих GM2 (13). Каждая порция GKR имела чистоту выше 98%, определенную тонкослойной хроматографией и денситометрическим сканированием. Порции были испытаны обычными тестами на стерильность и на безопасность на гвинейских свиньях и мышах.
Очищенный GM2 сушили и хранили при 4oC. 107 жизнеспособных единиц (или 3 106 для применения в пациентах с положительным PPD-тестом) BCG штамма Tice (University of Illinois, Chicago, IL) суспендировали в дистиллированной воде действием ультразвука вместе с 200 мкг высушенного и очищенного GM2. Суспензию лиофилизовали и хранили при -80oC. Остаток снова суспендировали в 0,5 мл содержащего фосфатный буфер солевого раствора (PBS) незадолго до введения вакцины. В этих условиях, как было установлено, GM2 прилипает к BCG, вероятно, за счет образования гидрофобных связей, о чем заявители сообщали ранее (8). BCG суспендировали в PBS для применения в контрольной группе. Все пациенты в GM2/BCG-rpynne получали 200 мкг GM2 за одну вакцинацию. Эти вакцины и протокол вакцинации были одобрены Memorial Hospital Institutional Review Board, их применяли под IND U.S. Food and Drug Administration. Первоначально пациенты получали GM2 из головного мозга кошек. Затем применяли увеличиваемую часть GM2, полученного из GM1, поскольку GM2 из головного мозга не был далее доступен. Все пациенты получали вакцины внутрикожной инъекцией в 6-10 мест конечности с интактным лимфатическим дренажем, и это введение повторяли дважды с интервалами две недели, применяя каждый раз разные конечности. Повторные иммунизации проводили через два и пять месяцев после первоначальной серии вакцинирования.
Введение Cy 106 для применения в пациентах с положительным PPD-тестом) BCG штамма Tice (University of Illinois, Chicago, IL) суспендировали в дистиллированной воде действием ультразвука вместе с 200 мкг высушенного и очищенного GM2. Суспензию лиофилизовали и хранили при -80oC. Остаток снова суспендировали в 0,5 мл содержащего фосфатный буфер солевого раствора (PBS) незадолго до введения вакцины. В этих условиях, как было установлено, GM2 прилипает к BCG, вероятно, за счет образования гидрофобных связей, о чем заявители сообщали ранее (8). BCG суспендировали в PBS для применения в контрольной группе. Все пациенты в GM2/BCG-rpynne получали 200 мкг GM2 за одну вакцинацию. Эти вакцины и протокол вакцинации были одобрены Memorial Hospital Institutional Review Board, их применяли под IND U.S. Food and Drug Administration. Первоначально пациенты получали GM2 из головного мозга кошек. Затем применяли увеличиваемую часть GM2, полученного из GM1, поскольку GM2 из головного мозга не был далее доступен. Все пациенты получали вакцины внутрикожной инъекцией в 6-10 мест конечности с интактным лимфатическим дренажем, и это введение повторяли дважды с интервалами две недели, применяя каждый раз разные конечности. Повторные иммунизации проводили через два и пять месяцев после первоначальной серии вакцинирования.
Введение CyРазовую дозу 200 мг/м2 Cy (Cytoxan, Mead Johnson and Co., Evansville, IN) вводили внутривенно всем пациентам за 5-7 дней до первой и четвертой вакцинной инъекций. Ганглиозидные реагенты GD2 получали обработкой GD1b  -галактозидазой (G.W.Jourdian, University of Michigan, Ann Arbor, MI) по опубликованным методикам (14). GM1 купили у Supelco (Bellefonte, PA). GD3 был подарен Fidia Research Laboratories (Abano Terme, Italy) и GDib купили у того же источника. GM3 выделяли из собачьих эритроцитов и очищали (13). GM2 для иммунного окрашивания дот-блотов (фиг. 11) получали из GM1 обработкой -галактозидазой (G.W.Jourdian, University of Michigan, Ann Arbor, MI) по опубликованным методикам (14). GM1 купили у Supelco (Bellefonte, PA). GD3 был подарен Fidia Research Laboratories (Abano Terme, Italy) и GDib купили у того же источника. GM3 выделяли из собачьих эритроцитов и очищали (13). GM2 для иммунного окрашивания дот-блотов (фиг. 11) получали из GM1 обработкой  -галактозидазой или экстрагировали из образцов меланомной биопсии человека, как описано ранее (13).
Серологические методики -галактозидазой или экстрагировали из образцов меланомной биопсии человека, как описано ранее (13).
Серологические методикиСыворотки получали во время каждой вакцинации, через 2-6 недель после введения вакцин 3, 4 и 5 и через 3 месяца после введения вакцины 5. ELISA для антител против GM2 или BCG (9) проводили с сыворотками пациентов и кроличьими античеловеческими IgM- или античеловеческими IgM -“вторыми” антителами, или белком А, конъюгированным со щелочной протеазой (Kirkegaard and Perry Labs, Gaithersburg, MD). Значения, полученные с нормальными сыворотками от доноров без GM2-реактивности, вычитали из значений, полученных с сыворотками пациентов. Титр антител определяли как наибольшее разведение сыворотки, при котором получают корректированное поглощение более 0,10, как ранее описано (9). Иммунное окрашивание дот-блотов проводили как ранее описано (8, 9) и распределяли по степеням 0, 1+, 2+ и 3+, как показано на фиг. 11. Сыворотки относили к категории положительных, если GM2-реактивность была 2+ или 3+ на дот-блотах при титре ELISA не ниже 1/20 или 1+ на дот-блотах при титре ELISA не менее 1/80. Анализы комплементзависимой цитотоксичности проводили, как ранее описано с нормальной сывороткой человека (разбавлена 1/3) в качестве источника комплемента и визуальным количественным определением нежизнеспособных клеток окрашиванием Giemsa (8, 15). Тестирования кожи на гиперчувствительность замедленного типа (DTH) Однослойные липосомы получали из яичного фосфатидилхолина и пропускали через фильтр 0,1 мк десять раз. В день тестирования кожи (через 2 недели после четвертой вакцинации) 1,2 мг фосфатидилхолиновых липосом и 25 мкг GM2 смешивали в PBS и обрабатывали ультразвуком в ультразвуковом дезинтеграторе Бронсона 1200 с водяной баней (Shelton, СТ). Тесты кожи проводили с а) 25 мкг GM2 и b) 25 мкг/1,5 мг GM2/липосом через 48 часов, как описано ранее (16, 17). Результаты. Характеристики пациентов Всего 123 пациента зарегистрировали между 10 марта 1987 года и 17 марта 1989 года. При рассмотрении нашли, что один пациент имел заболевание стадии II AJCC (не имел лимфатических узелков) и поэтому не был включен в анализ. Всех (122) пригодных пациентов, не считая получивших вакцины, включают рандомизированными в анализ. Два пациента (по одному в каждой группе) решили не участвовать в изучении после первой иммунизации, поскольку нашли, что оно слишком трудное для преодоления неопределенностей экспериментальной терапии и рандомизации. Один пациент в BCG-группе получил только две иммунизации, когда обнаружили, что болезнь прогрессировала, и иммунизацию прекратили. Все другие пациенты получили по меньшей мере первоначальную серию трех иммунизаций и остались в протоколе до полного завершения изучения или до того, как болезнь прогрессировала. Один пациент в BCG-группе случайно получил GM2/BCG в пятой вакцинации (он продуцировал антитела против GM2 и остался здоровым). Среднее время последующего врачебного обследования составляет пять лет и три месяца с минимальным временем последующего врачебного обследования четыре года и три месяца после хирургии до рандомизации. Характеристики 122 рандомизированных пациентов приведены в таблице 8. Единственным наиболее важным прогностическим индикатором для пациентов с меланомой стадии III является число положительных лимфатических узлов (3). Другие факторы, связанные с плохим прогнозом, включают голову и шею или туловище в качестве главного места и непроходящую меланому (3). GM2/BCG и все BCG-группы были сравнимы по их прогностическим индикаторам. Побочные эффекты Предварительное введение Cy иногда вызывало тошноту или недомогание в течение 2-24 часов, но в основном хорошо переносилось. Внутрикожная инъекция BCG приводила к воспалению и образованию струпьев с дренажем у всех пациентов, получивших три или более иммунизаций. Для поддерживания воспалительного ответа на пригодном уровне дозу BCG снижали фактором 3, когда впервые обнаруживали образование струпьев или дренаж. Поэтому средняя доза BCG во время последней иммунизации была 3  106 жизнеспособных единиц в обеих изучаемых группах. Дозу 107 единиц поддерживали только у 10% пациентов, для некоторых пациентов требовалось дальнейшее снижение дозы до 106 единиц. GM2 не оказывал влияние на воспалительный ответ на BCG и не вызывал дополнительные побочные эффекты.
Серологический ответ против GM2 106 жизнеспособных единиц в обеих изучаемых группах. Дозу 107 единиц поддерживали только у 10% пациентов, для некоторых пациентов требовалось дальнейшее снижение дозы до 106 единиц. GM2 не оказывал влияние на воспалительный ответ на BCG и не вызывал дополнительные побочные эффекты.
Серологический ответ против GM2Последовательные титры IgM-антител против GM2 до и после вакцинации GM2/BCG показаны на фиг. 10 для первых пяти пациентов (1987) и последних пяти пациентов (1989), получивших все серии GM2/BCG-иммунизаций. Как и в предыдущем изучении (9), иммунный ответ был преимущественно IgM-типа, часто наблюдалось повышение титра после каждой иммунизации, что было похоже скорее на повторный первичный иммунный ответ, чем на вторичный иммунный ответ. Сыворотки до иммунизации и после иммунизации (пиковые титры) всех пациентов тестировали также иммунным окрашиванием дот-блотов для подтверждения специфичности антител, обнаруживаемых ELISA. Результаты иммунного окрашивания дот-блотов 10 сыворотками, приведенными на фиг. 10, показаны на фиг. 11. Была обнаружена случайная реактивность против GM1 при низком титре в сыворотках до иммунизации, как описано ранее (8, 9). Реактивность, индуцированная вакциной, была ограничена GM2-реактивностью, не обнаружена GM3-, GD2-, GD1b- и GD3-реактивность. Антитела против GM2 были способны медиировать комплементзависимую цитотоксичность в тестах на GM2-экспрессирующие опухолевые клетки с комплементом человека (таблица 9). Никакие изменения в этой особенности иммунных ответов и специфичности не наблюдали у пациента в течение периода двух лет. Результаты серологического анализа для всех пациентов суммированы в таблице 10. Семь из 64 пациентов в BCG-группе, как было показано, обладали антителами против GM2, определенными как ELISA (средний титр 1/40), так и иммунным окрашиванием на дот-блотах (средняя интенсивность 2+). Антитела ранее присутствовали в 5 случаях и впервые были обнаружены после BCG-вакцинации в 2 случаях. Титры антител против GM2 возрастали в 4 раза или более после BCG-иммунизации у 3 из 5 пациентов с антителами против GM2 до BCG-вакцинации. Напротив, только один из 58 пациентов, получивших GM2/BCG, обладал GM2-реактивностью по результатам двух анализов до иммунизации и 50 из 58 пациентов обнаруживали антитела против GM2 (средний титр ELISA 1/160) в их сыворотке после иммунизации, что подтверждалось иммунным окрашиванием дот-блотов (средний титр 3+). Общая степень серологического IgM-ответа против GM2 (2+ или 3+ на дот-блотах и титр ELISA не менее 1/20 или 1+ на дот-блотах и титр ELISA не менее 1/80) в двух группах была 11% только для BCG и 86% для GM2/BCG. IgG-антитела не были обнаружены в сыворотке любого пациента до иммунизации и не были индуцированы у любого пациента BCG-иммунизацией (таблица 10). Вакцинация GM2/BCG индуцировала положительный IgG-иммунный ответ у восьми пациентов (средний титр по ELISA 1/80, средний ответ на дот-блоте 2+). Эти ответы были кратковременными (средняя продолжительность 8 недель) и обычно не усиливались при дополнительной иммунизации. IgG-реактивность во всех случаях была ограничена реактивностью с GM2 (данные не приведены). Все 8 пациентов имели также IgM-антитела, титр которых был выше и продолжительность присутствия которых была больше, чем у IgG-антител. DTH-ответ на GM2 Тесты кожи для DTH против GM2 и других антигенов проводили после первоначальной серии трех вакцинации. Все пациенты, получившие три и более иммунизаций, проявляли сильные DTH-реакции против BCG. Восемь пациентов (четыре пациента вакцинированы BCG и четыре – вакцинированы GM2/BCG) показали положительные DTH-реакции на GM2 и липосомы GM2 (применяли для поддерживания GM2 на месте тестирования кожи) в виде индурации от 10 до 33 мм. Дальнейшее тестирование показало, что эти 8 пациентов имели аналогичную реактивность с липосомами без ганглиозидов и с другими ганглиозидами. Таким образом, у любого пациента не имелось доказательства GM2-специфичного DTH. Серологический ответ против BCG Сыворотки всех пациентов испытывали на реактивность (ELISA) IgG против 103 жизнеспособных организмов/лунку BCG, высушенных на пластинках ELISA, как описано для ганглиозидов. До вакцинации реактивность не была обнаружена. После вакцинации сыворотки показали титры антител против BCG 1/40-1/80 в обеих изучаемых группах, независимо от того, продуцировали ли пациенты антитела против GM2 или нет. Корреляция гуморального иммунного ответа и иммунизация с периодом без заболевания и выживаемостью Сравнение периода заболевания и общей выживаемости для всех пациентов, продуцирующих антитела против GM2, документированных двумя анализами (титр ELISA не ниже 1/180 и окрашивание дот-блота 1+ или титр ELISA не менее 1/20 и окрашивание дот-блота не ниже 2+), с такими показателями пациентов, которые не продуцировали антитела против GM2, показано на фиг. 12. Значительная разница видна как для периода без заболевания, так и для общей выживаемости (p = 0,004 и 0,02 соответственно, log- тест). Из шести пациентов, которые продуцировали антитела против GM2 до иммунизации (пять получали BCG и один получал GM2/BCG) только один (пациент в BCG-группе) имел рецидивное заболевание. Это подтверждает, что природное продуцирование антител против GM2 у пациентов с меланомой связано с благоприятным ходом процесса. Наоборот, из восьми пациентов, которые не продуцировали антитела против GM2 после иммунизации GM2/BCG, шесть имели рецидивную меланому и умерли. Это подтверждает, что отсутствие продуцирования антител против GM2 после вакцинации обозначает неблагоприятный прогноз. Средние титры антител против BCG у шести пациентов, продуцирующих природные антитела GM2, были такие же, как титры у восьми пациентов с отрицательными реакциями на антитела против GM2 в части, вакцинированной GM2/BCG. Это указывает на то, что эти пациенты не отличались по их способности обеспечивать серологический ответ на неродственный антиген. Когда шесть пациентов, продуцирующих антитела против GM2, до рандомизации (шесть в BCG-части и один в GM2/BCG-части) были исключены из анализа, период без заболевания в GM2/BCG-группе был значительно длиннее, чем в BCG-группе (p = 0,02, log-тест), и тенденция к повышению общей выживаемости наблюдалась также в GM2/BCG-группе (фиг. 13). Кривые переходили в плато для времени 40-52 месяца после хирургической операции, разница в 23% и 14% была для периода без заболевания и общей выживаемости соответственно. Небольшое число пациентов, продуцирующих IgG-антитела, реагирующие с GM2, после иммунизации, не дает возможности делать вывод от относительном вкладе IgM- и IgG-антител против GM2. Пять из восьми пациентов, обнаруживших положительную реакцию на IgG-антитела против GM2, остались здоровыми за этот же период времени. Сравнение двух иммунизированных групп, которые рандомизированы, приведено на фиг. 14. Кривые образуют плато при времени после хирургической операции от 40 до 52 месяцев, разница в 18% для периода без заболевания и 11% для общего выживания была в пользу вакцинации GM2/BCG. Эти различия не были статистически значимыми. Степени периода без заболевания (30%) и общей выживаемости (46%) после 51 месяца (минимальный период последующего врачебного обследования) в BCG-группе были аналогичны степеням, которые заявители наблюдали ранее у пациентов, рандомизированных для введения BCG или контрольных целей (28). Как показано на фиг. 14, благоприятное влияние иммунизации было более очевидным, когда две иммунизируемые группы классифицировали по числу положительных узлов (1 против 2 или более). Иммунизация оказывала меньшее влияние на период без заболевания у пациентов только с одним положительным узлом. Напротив, период без заболевания у пациентов с двумя или более положительными узлами, которые получали GM2/BCG, был значительно длиннее, чем у пациентов, иммунизированных только BCG (p = 0,02). Аналогичная тенденция наблюдалась для выживаемости (p = 0,08, log- тест). Обсуждение. Заявители значительные усилия направляли на разработку вакцин ганглиозидов, которые индуцируют высокие титры сывороточных антител (18, 19), потому что 1) ганглиозиды являются основными компонентами поверхности меланомных клеток (14, 20-25), 2) человеческие моноклональные антитела со специфичностью для ганглиозидов можно выделить с относительно высокой частотой у пациентов с меланомой (14, 25-28) и 3) опухолевые клетки человека, экспрессирующие ганглиозидные антигены, можно лизировать антителами против ганглиозидов в присутствии комплемента человека (13, 29). Было показано, что ганглиозид GM2, в частности, является иммуногеном для людей и вакцины, содержащие очищенный GM2 и BCG в качестве адъюванта, вызывают образование антител против GM2 у меланомных пациентов, которым предварительно ввели низкую дозу циклофосфамида (8, 9). Изложенное здесь исследование было предназначено для ответа на два вопроса – индуцирует ли вакцинация GM2/BCG -вакциной продуцирование антител против GM2 у высокого процента меланомных пациентов и изменяет ли индуцирование антител против GM2 течение заболевания у пациентов со стадией III меланомы после полной резекции всей выявленной опухоли. Что касается индуцирования антител против GM2, иммунизация вакциной GM2/BCG была отчетливо эффективной у основного числа пациентов. Из 58 пациентов, получивших GM2/BCG-вакцину, 50 продуцировали антитела против GM2, обнаруженные как ELISA, так и иммунным окрашиванием на дот-блотах. Как и в ранних опытах (9), индуцированные антитела против GM2 были в основном IgM-класса; IgG-антитела обнаруживали менее часто. Корреляция между продуцированием антител против GM2 и более благоприятным клиническим курсом (9) была здесь также подтверждена и расширена для более однородной группы пациентов, не имеющих стадию III AJCC меланомы. Пациенты, продуцирующие антитела против GM2 (природное продуцирование или продуцирование, индуцированное вакциной), имели значительно более длинный период без заболевания и общее выживание, чем пациенты, которые не обнаруживали гуморальную ответную реакцию. Изначальное присутствие антител против GM2 (до вакцинации) было обнаружено у шести пациентов в этой серии и оказалось связанным с особенно благоприятным прогнозом. Поскольку охват пациентов со спонтанным продуцированием антител против GM2 оказался одинаковым (10%) для общей группы и пациентов с меланомой (8, 9). их связь с развитием и ростом меланомы остается неизвестной. Известно, что титр ранее присутствующих антител против GM2 не изменялся в течение девятимесячного периода последующего обследования, тогда как титр индуцированных вакциной антител против GM2 обычно удавалось выявлять только в течение 8-12 месяцев после иммунизации. Это наблюдение увеличивает вероятность того, что постоянство продуцирования антител может быть важным для благоприятного клинического результата, и это указывает на необходимость разработки GM2-вакцин, которые продуцируют долговременные иммунные ответы против GM2. В отличие от вакцинированных пациентов, развивавших образование антител против GM2, у 8 пациентов, которые не продуцировали антитела против GM2 после иммунизации GM2/BCG, наблюдалось особенно быстрое прогрессирование болезни, причем рецидив обнаруживали обычно до введения всей серии пяти иммунизаций. Другие факторы прогноза были не менее благоприятными для этих пациентов и их иммунный ответ против BCG не был менее сильным, чем ответ у пациентов с положительной иммунной реакцией против GM2. Это указывает на то, что общая иммуносупрессия не является основным механизмом. Связь между продуцированием антител против GM2 и улучшенным прогнозом подтверждена также в исследованиях антигена, обозначенного OFA-1 (31), клеточной поверхностной антигенной системы, эксперссированной многими меланомами. Несколько линий доказательства указывают, что реактивность антител против OFA в основном направлена против ганглиозида GM2 (30, 25). Пациенты с повышенными титрами IgG против OFA-1, имеющие их до иммунизации или после иммунизации облученными меланомными клетками, имели повышенную выживаемость. Хотя настоящее исследование усиливает доказательство того, что продуцирование антител против GM2 связано с благоприятным прогнозом у пациентов с меланомой, оно также иллюстрирует проблемы, которые появляются при назначении рандомизированных исследований вакцин. Предварительное продуцирование (до иммунизации) антител против GM2 у 5 пациентов в контрольной группе в противоположность 1 пациенту в GM2/BCG-rpynne, отсутствие иммунного ответа против GM2 у 8 вакцинированных пациентов в GM2/BCG-rpynne содействовало сглаживанию различия между двумя рандомизированными вакцинированными группами до точки, в которой терапевтический результат в GM2/BCG-группе был незначительным. Очевидно, что пациентов с предварительным присутствием антител против GM2 следует исключить или по меньшей мере выделять в отдельные группы в будущих исследованиях. Равно важной задачей является необходимость повышения иммуногенности вакцин. Что касается этого, заявители исследовали подходы, которые были удачно разработаны в контексте углеводных вакцин против бактериальных инфекций (обзор в 32), включая химическую модификацию ганглиозидов для получения близко родственных конгенеров (33, 34), конъюгирование ганглиозида с иммуногенными белками-носителями (35) и применение более сильных адъювантов (36). Заявители показали, что этот подход был наиболее эффективен для конъюгирования GM2 с гемоцианином лимфы улитки (KLH) и введения конъюгата GM2-KLH с QS-21 (экстракт сапонина из Saponaria Quillaja), применяемым в качестве адъюванта. В поисковом изучении на пациентах с меланомой введение этой вакцины приводило к обнаружению титров IgM-антител против GM2 значительно более высоких, чем титры после GM2/BCG и, что даже более важно, стойкому продуцированию антител против GM2, принадлежащих к классу IgG, таким образом, по-видимому, превращая T-независимый иммунный ответ в T-зависимый иммунный ответ (37). Дополнительным подходом к улучшению клинической эффективности вакцины GM2/BCG, описанной здесь, должно быть введение в вакцину дополнительных иммуногенных меланомных ганглиозидов. Эксперименты на мышах показывают, что конъюгирование с KLH и применение в качестве адъюванта QS-21 также повышают иммуногенность GD3 (35), наиболее высоко экспрессируемого меланомой ганглиозида, который обладает, как показано до сих пор, очень слабой иммуногенностью у пациентов с меланомой. Если бы эти высказывания можно было подтвердить на изучении людей, то заявители могли бы иметь основу для конструирования поливалентной ганглиозидной конъюгатной вакцины, включающей несколько основных ганглиозидов меланомы, таким образом обойдя гетерогенность ганглиозидной экспрессии, обнаруженной в меланомах человека. Заявители полагают, что результаты изложенного здесь исследования подтверждают дальнейшие исследования этого подхода. Формула изобретения
 -аминолизильную группу и в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным носителем на основе белка через -аминолизильную группу и в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным носителем на основе белка через  -аминолизильную группу иммуногенного белкового носителя.
4. Композиция по п.1, отличающаяся тем, что церамидная часть включает сфингозиновое основание, а иммуногенный носитель на основе белка включает -аминолизильную группу иммуногенного белкового носителя.
4. Композиция по п.1, отличающаяся тем, что церамидная часть включает сфингозиновое основание, а иммуногенный носитель на основе белка включает  -аминолизильную группу и в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным носителем на основе белка через С-4 углерод сфингозинового основания церамидной части ганглиозидного производного с -аминолизильную группу и в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным носителем на основе белка через С-4 углерод сфингозинового основания церамидной части ганглиозидного производного с  -аминолизильной группой иммуногенного белкового носителя.
5. Композиция по любому из пп.1-4, отличающаяся тем, что сапонин, получаемый из коры Quillaria saponaria Molina, представляет собой QS-21.
6. Композиция для стимулирования или повышения продуцирования антител, которые распознают ганглиозид, включающая а) конъюгат i) олигосахаридную часть ганглиозида с ii) гемоцианином лимфы улитки b) сапонин, получаемый из коры Quillaria saponaria Мolina, и с) фармацевтически приемлемый носитель, при этом относительные количества конъюгата и сапонина являются эффективными для стимулирования или повышения продуцирования антител у субъекта.
7. Композиция по п.6, отличающаяся тем, что сапонин, получаемый из коры Quillaria saponaria Molina, представляет собой QS-21.
8. Композиция по любому из пп.1-5, отличающаяся тем, что производное ганглиозида конъюгировано с гемоцианином лимфы улитки.
9. Композиция по любому из пп.1-5 и 8, отличающаяся тем, что ганглиозидное производное является производным ганглиозида, выбранного из группы, включающей GM2, GM3, GD2, GD3, GD3 лактон, О-ацетил GD3 и GT3.
10. Композиция по п.9, отличающаяся тем, что ганглиозидное производное является производным GM2 или GD2.
11. Композиция по п.10, отличающаяся тем, что ганглиозидное производное является производным GM2.
12. Композиция по п.10, отличающаяся тем, что ганглиозидное производное является производным GD2.
13. Композиция по пп. 1-12, отличающаяся тем, что включает конъюгат в количестве от около 1 мкг до около 200 мкг.
14. Композиция по п.13, отличающаяся тем, что включает конъюгат в количестве от около 50 мкг до около 90 мкг.
15. Композиция по п.14, отличающаяся тем, что количество конъюгата составляет около 70 мкг.
16. Композиция по п.13, отличающаяся тем, что включает конъюгат в количестве от около 1 мкг до около 10 мкг.
17. Композиция по п.16, отличающаяся тем, что количество конъюгата составляет около 7 мкг.
18. Композиция по любому из пп.1-17, отличающаяся тем, что включает сапонин в количестве от около 10 мкг до около 200 мкг.
19. Композиция по п.18, отличающаяся тем, что количество сапонина составляет около 100 мкг.
20. Композиция по п.18, отличающаяся тем, что количество сапонина составляет около 200 мкг.
21. Композиция по любому из пп.1-5 и 8-20, отличающаяся тем, что молярное отношение ганглиозидного производного к иммуногенному белковому носителю находится в пределах от около 200 до около 1400.
22. Композиция по п.6 или 7, отличающаяся тем, что молярное отношение олигосахарида к гемоцианину лимфы улитки находится в пределах от около 200 до около 1400.
23. Способ стимулирования или повышения продуцирования антител, которые распознают ганглиозид у субъекта, который включает введение субъекту эффективного количества композиции, которая включает а) конъюгат i) производного ганглиозида, включающего неизмененную олигосахаридную часть и измененную церамидную часть, с ii) иммуногенным носителем на основе белка, b) сапонин, получаемый из коры Quillaria saponaria Моlina, с) фармацевтически приемлемый носитель, при этом относительные количества конъюгата и сапонина являются эффективными для стимулирования или повышения продуцирования антител у субъекта; причем иммуногенный носитель на основе белка получают из белка, выбранного из группы, включающей малярийный Т-клеточный эпитоп, внешний мембранный белок Neisseria meningitidis, катионизированный бычий сывороточный альбумин, гемоцианин лимфы улитки или его производное, полилизин и альбумин сыворотки человека, отличающийся тем, что в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным носителем на основе белка через церамидный углерод ганглиозидного производного, связанный с иммуногенным белковым носителем.
24. Способ предотвращения или лечения рака у субъекта, который включает введение субъекту эффективного для предотвращения или лечения рака количества композиции, которая включает а) конъюгат i) производного ганглиозида, которое включает неизмененную олигосахаридную часть и измененную церамидную часть, с ii) иммуногенным носителем на основе белка, b) сапонин, получаемый из коры Quillaria saponaria Моlina с) фармацевтически приемлемый носитель, при этом относительные количества конъюгата и сапонина являются эффективными для стимулирования или повышения продуцирования антител у субъекта; причем иммуногенный носитель на основе белка получают из белка, выбранного из группы, включающей малярийный Т-клеточный эпитоп, внешний мембранный белок Neisseria meningitidis, катионизированный бычий сывороточный альбумин, гемоцианин лимфы улитки или его производное, полилизин и альбумин сыворотки человека; отличающийся тем, что в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным носителем на основе белка через церамидный углерод ганглиозидного производного, связанный с иммуногенным белковым носителем.
25. Способ по п.23 или 24, отличающийся тем, что церамидная часть включает сфингозиновое основание и где в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным носителем на основе белка через С-4 углерод сфингосфинового основания церамидной части ганглиозидного производного, связанный с иммуногенным белковым носителем.
26. Способ по п.23 или 24, отличающийся тем, что иммуногенный носитель на основе белка включает -аминолизильной группой иммуногенного белкового носителя.
5. Композиция по любому из пп.1-4, отличающаяся тем, что сапонин, получаемый из коры Quillaria saponaria Molina, представляет собой QS-21.
6. Композиция для стимулирования или повышения продуцирования антител, которые распознают ганглиозид, включающая а) конъюгат i) олигосахаридную часть ганглиозида с ii) гемоцианином лимфы улитки b) сапонин, получаемый из коры Quillaria saponaria Мolina, и с) фармацевтически приемлемый носитель, при этом относительные количества конъюгата и сапонина являются эффективными для стимулирования или повышения продуцирования антител у субъекта.
7. Композиция по п.6, отличающаяся тем, что сапонин, получаемый из коры Quillaria saponaria Molina, представляет собой QS-21.
8. Композиция по любому из пп.1-5, отличающаяся тем, что производное ганглиозида конъюгировано с гемоцианином лимфы улитки.
9. Композиция по любому из пп.1-5 и 8, отличающаяся тем, что ганглиозидное производное является производным ганглиозида, выбранного из группы, включающей GM2, GM3, GD2, GD3, GD3 лактон, О-ацетил GD3 и GT3.
10. Композиция по п.9, отличающаяся тем, что ганглиозидное производное является производным GM2 или GD2.
11. Композиция по п.10, отличающаяся тем, что ганглиозидное производное является производным GM2.
12. Композиция по п.10, отличающаяся тем, что ганглиозидное производное является производным GD2.
13. Композиция по пп. 1-12, отличающаяся тем, что включает конъюгат в количестве от около 1 мкг до около 200 мкг.
14. Композиция по п.13, отличающаяся тем, что включает конъюгат в количестве от около 50 мкг до около 90 мкг.
15. Композиция по п.14, отличающаяся тем, что количество конъюгата составляет около 70 мкг.
16. Композиция по п.13, отличающаяся тем, что включает конъюгат в количестве от около 1 мкг до около 10 мкг.
17. Композиция по п.16, отличающаяся тем, что количество конъюгата составляет около 7 мкг.
18. Композиция по любому из пп.1-17, отличающаяся тем, что включает сапонин в количестве от около 10 мкг до около 200 мкг.
19. Композиция по п.18, отличающаяся тем, что количество сапонина составляет около 100 мкг.
20. Композиция по п.18, отличающаяся тем, что количество сапонина составляет около 200 мкг.
21. Композиция по любому из пп.1-5 и 8-20, отличающаяся тем, что молярное отношение ганглиозидного производного к иммуногенному белковому носителю находится в пределах от около 200 до около 1400.
22. Композиция по п.6 или 7, отличающаяся тем, что молярное отношение олигосахарида к гемоцианину лимфы улитки находится в пределах от около 200 до около 1400.
23. Способ стимулирования или повышения продуцирования антител, которые распознают ганглиозид у субъекта, который включает введение субъекту эффективного количества композиции, которая включает а) конъюгат i) производного ганглиозида, включающего неизмененную олигосахаридную часть и измененную церамидную часть, с ii) иммуногенным носителем на основе белка, b) сапонин, получаемый из коры Quillaria saponaria Моlina, с) фармацевтически приемлемый носитель, при этом относительные количества конъюгата и сапонина являются эффективными для стимулирования или повышения продуцирования антител у субъекта; причем иммуногенный носитель на основе белка получают из белка, выбранного из группы, включающей малярийный Т-клеточный эпитоп, внешний мембранный белок Neisseria meningitidis, катионизированный бычий сывороточный альбумин, гемоцианин лимфы улитки или его производное, полилизин и альбумин сыворотки человека, отличающийся тем, что в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным носителем на основе белка через церамидный углерод ганглиозидного производного, связанный с иммуногенным белковым носителем.
24. Способ предотвращения или лечения рака у субъекта, который включает введение субъекту эффективного для предотвращения или лечения рака количества композиции, которая включает а) конъюгат i) производного ганглиозида, которое включает неизмененную олигосахаридную часть и измененную церамидную часть, с ii) иммуногенным носителем на основе белка, b) сапонин, получаемый из коры Quillaria saponaria Моlina с) фармацевтически приемлемый носитель, при этом относительные количества конъюгата и сапонина являются эффективными для стимулирования или повышения продуцирования антител у субъекта; причем иммуногенный носитель на основе белка получают из белка, выбранного из группы, включающей малярийный Т-клеточный эпитоп, внешний мембранный белок Neisseria meningitidis, катионизированный бычий сывороточный альбумин, гемоцианин лимфы улитки или его производное, полилизин и альбумин сыворотки человека; отличающийся тем, что в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным носителем на основе белка через церамидный углерод ганглиозидного производного, связанный с иммуногенным белковым носителем.
25. Способ по п.23 или 24, отличающийся тем, что церамидная часть включает сфингозиновое основание и где в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным носителем на основе белка через С-4 углерод сфингосфинового основания церамидной части ганглиозидного производного, связанный с иммуногенным белковым носителем.
26. Способ по п.23 или 24, отличающийся тем, что иммуногенный носитель на основе белка включает  -аминолизильную группу и где в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным белковым носителем через -аминолизильную группу и где в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным белковым носителем через  -аминолизильную группу иммуногенного белкового носителя.
27. Способ по п.23 или 24, отличающийся тем, что церамидная часть включает сфингозиновое основание, а иммуногенный носитель на основе белка включает -аминолизильную группу иммуногенного белкового носителя.
27. Способ по п.23 или 24, отличающийся тем, что церамидная часть включает сфингозиновое основание, а иммуногенный носитель на основе белка включает  -аминолизильную группу и где в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным белковым носителем через С-4 углерод сфингозинового основания церамидной части ганглиозидного производного, связанный с -аминолизильную группу и где в указанном конъюгате ганглиозидное производное конъюгировано с иммуногенным белковым носителем через С-4 углерод сфингозинового основания церамидной части ганглиозидного производного, связанный с  -аминолизильной группой иммуногенного белкового носителя.
28. Способ по п.24, отличающийся тем, что рак представляет рак эпителиального происхождения.
29. Способ по п.24, отличающийся тем, что рак представляет рак нейроэктодермального происхождения.
30. Способ по п. 29, отличающийся тем, что раком нейроэктодермального происхождения является меланома.
31. Способ по п.23 или 24, отличающийся тем, что введение осуществляют в двух или более местах.
32. Способ по п.31, отличающийся тем, что введение осуществляют в трех местах.
33. Способ стимулирования или повышения продуцирования антител у субъекта, включающий введение субъекту эффективного количества композиции, включающей а) конъюгат i) олигосахаридную часть ганглиозида с ii) гемоцианином лимфы улитки, b) сапонин, получаемый из коры Quillaria saponaria Моlina, с) фармацевтически приемлемый носитель, при этом носительные количества конъюгата и сапонина являются эффективными для стимулирования или повышения продуцирования антител у субъекта.
34. Способ предотвращения или лечения рака у субъекта, включающий введение субъекту эффективного для предотвращения или лечения рака количества композиции, включающей а) конъюгат i) олигосахаридную часть гинглиозида с ii) гемоцианином лимфы улитки, b) сапонин, получаемый из коры Quillaria saponaria Моlina и с) фармацевтически приемлемый носитель, при этом относительные количества конъюгата и сапонина являются эффективными для стимулирования или повышения продуцирования антител у субъекта. -аминолизильной группой иммуногенного белкового носителя.
28. Способ по п.24, отличающийся тем, что рак представляет рак эпителиального происхождения.
29. Способ по п.24, отличающийся тем, что рак представляет рак нейроэктодермального происхождения.
30. Способ по п. 29, отличающийся тем, что раком нейроэктодермального происхождения является меланома.
31. Способ по п.23 или 24, отличающийся тем, что введение осуществляют в двух или более местах.
32. Способ по п.31, отличающийся тем, что введение осуществляют в трех местах.
33. Способ стимулирования или повышения продуцирования антител у субъекта, включающий введение субъекту эффективного количества композиции, включающей а) конъюгат i) олигосахаридную часть ганглиозида с ii) гемоцианином лимфы улитки, b) сапонин, получаемый из коры Quillaria saponaria Моlina, с) фармацевтически приемлемый носитель, при этом носительные количества конъюгата и сапонина являются эффективными для стимулирования или повышения продуцирования антител у субъекта.
34. Способ предотвращения или лечения рака у субъекта, включающий введение субъекту эффективного для предотвращения или лечения рака количества композиции, включающей а) конъюгат i) олигосахаридную часть гинглиозида с ii) гемоцианином лимфы улитки, b) сапонин, получаемый из коры Quillaria saponaria Моlina и с) фармацевтически приемлемый носитель, при этом относительные количества конъюгата и сапонина являются эффективными для стимулирования или повышения продуцирования антител у субъекта.
РИСУНКИ
|
||||||||||||||||||||||||||
