Патент на изобретение №2172323
|
||||||||||||||||||||||||||
(54) ИОННЫЕ МОЛЕКУЛЯРНЫЕ КОНЪЮГАТЫ N-АЦИЛИРОВАННЫХ ПРОИЗВОДНЫХ ПОЛИ(2-АМИНО-2-ДЕОКСИ-D-ГЛЮКОЗЫ) И ПОЛИПЕПТИДОВ
(57) Реферат: Описывается новый сополимер, N-ацилированное производное поли(2-амино-2-деокси-D-глюкозы), где 1 – 50% свободных аминогрупп указанной поли(2-амино-2-деокси-D-глюкозы) проацилировано первой ацильной группой, причем первая ацильная группа представляет собой COE1, где Е1 выбирают из группы, включающей С3-33-карбоксиалкил, С3-33-карбоксиалкенил, С7-39-карбоксиарилалкил и С9-39-карбоксиарилалкенил, 50 – 99% свободных аминогрупп поли(2-амино-2-деокси-D-глюкозы) проацилировано второй ацильной группой и эта вторая ацильная группа представляет собой COE2, где Е2 выбирают из группы, включающей С1-30-алкил, С2-30-алкенил, С6-37арилалкил и С8-37-арилалкенил, при условии, что по меньшей мере одна из свободных аминогрупп указанной поли(2-амино-2-деокси-D-глюкозы)проацилирована первой ацильной группой и до 30% свободных гидроксильных групп поли(2-амино-2-деокси-D-глюкозы) проацилировано первой ацильной группой или второй ацильной группой, имеющей молекулярный вес примерно 600 – 1300000 Дальтон. Описываются также полипептиды и композиции, которые могут быть использованы для лечения ряда заболеваний, например рака, а также для стимуляции роста как в подростковом, так и в пожилом возрасте и для лечения остеопороза. 5 с. и 14 з.п. ф-лы, 6 табл. 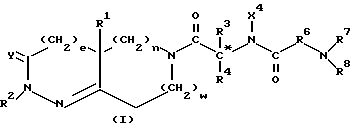 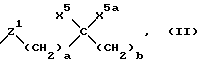
Область техники Полимерные лекарственные системы для доставки лекарственного вещества разработаны для контролируемого высвобождения фармацевтических полипептидов. Например, синтетические сложные полиэфиры, такие как пoли(DL-мoлoчнaя кислота), поли(гликолевая кислота), поли(молочно-гликолевая кислота) и поли(  – капролактон), используются в форме микрокапсул, пленок или брусков для высвобождения биологически активных полипептидов (см., например, патенты США NN 4767628 и 4675189, а также PCT-публикацию N WO 94/00148).
Помимо синтетических полимерных цепочек в качестве компонентов аналогичных композиций с длительным выделением вещества, которые диссоциируют при ферментативном расщеплении, используют природные полимеры и их производные. Например, к таким природным полимерам относят полимеры на основе хитина, поли(N-ацетилглюкозамина). Однако, поскольку хитин не растворим в воде, изучены солюбилизируемые производные, главным образом, на основе частично деацетилированного хитина, например хитозана (см., например, Sanford P.A. et al. , Eds., Advances in Chitin and Chitosan (1992)). Хотя хитозан может быть выделен из некоторых видов плесени, производство биодеградируемого хитозана обычно осуществляют синтетическим путем (см., например, Mima et al., J.Appl. Polym. Sci., 28, 1909-1917 (1983)). Синтетические производные хитозана также получены с целью изменения биологических характеристик полимеров in vivo (см., например, Muzzarelli et al. Carbohydrate Res., 207, 199-214 (1980)).
Предложено использование хитина, а также производных хитина в ряде лекарственных систем для доставки лекарственного средства (см., например, Европейские патентные публикации NN 486959, 482649, 525813 A1 и 544000 A1 и патент США N 5271945).
Сущность изобретения – капролактон), используются в форме микрокапсул, пленок или брусков для высвобождения биологически активных полипептидов (см., например, патенты США NN 4767628 и 4675189, а также PCT-публикацию N WO 94/00148).
Помимо синтетических полимерных цепочек в качестве компонентов аналогичных композиций с длительным выделением вещества, которые диссоциируют при ферментативном расщеплении, используют природные полимеры и их производные. Например, к таким природным полимерам относят полимеры на основе хитина, поли(N-ацетилглюкозамина). Однако, поскольку хитин не растворим в воде, изучены солюбилизируемые производные, главным образом, на основе частично деацетилированного хитина, например хитозана (см., например, Sanford P.A. et al. , Eds., Advances in Chitin and Chitosan (1992)). Хотя хитозан может быть выделен из некоторых видов плесени, производство биодеградируемого хитозана обычно осуществляют синтетическим путем (см., например, Mima et al., J.Appl. Polym. Sci., 28, 1909-1917 (1983)). Синтетические производные хитозана также получены с целью изменения биологических характеристик полимеров in vivo (см., например, Muzzarelli et al. Carbohydrate Res., 207, 199-214 (1980)).
Предложено использование хитина, а также производных хитина в ряде лекарственных систем для доставки лекарственного средства (см., например, Европейские патентные публикации NN 486959, 482649, 525813 A1 и 544000 A1 и патент США N 5271945).
Сущность изобретенияОдним из объектов настоящего изобретения является сополимер, включающий N-ацилированное производное поли (2-амино-2-деокси-D-глюкозы), где от 1 до 50% свободных аминогрупп поли(2-амино-2-деокси-D-глюкозы) проацилировано первой ацильной группой, причем первая ацильная группа представляет собой COE1, где E1 выбирается из группы, включающей C3-33-карбоксиалкил, C3-33-карбоксиалкенил, C7-39-карбоксиарилалкил и C9-39-карбоксиарилалкенил, и от 50 до 99% свободных аминогрупп поли(2-амино-2-деокси-D-глюкозы) проацилировано второй ацильной группой и эта вторая ацильная группа представляет собой COE2, где E2 выбирается из группы, включающей C1-30-алкил, C2-30-алкенил, C6-37-арилалкил и C8-37-арилалкенил, при условии, что по меньшей мере одна из свободных аминогрупп производного проацилирована первой ацильной группой и до 30% свободных гидроксильных групп указанной поли(2-амино-2-деокси-D-глюкозы) проацилировано первой ацильной группой или второй ацильной группой. Сополимер предпочтительно имеет молекулярный вес приблизительно от 3000 до 90000 Дальтон, который определяют с помощью гельпроникающей хроматографии или любым другим аналогичным методом. В другом предпочтительном варианте осуществления изобретения свыше 90% свободных аминогрупп поли(2-амино-2-деокси-D-глюкозы) проацилировано либо первой ацильной группой, либо второй ацильной группой. Предпочтительно от 10 до 30% свободных аминогрупп поли(2-амино-2-деокси- D-глюкозы) должно быть проацилировано первой ацильной группой. Часть свободных гидроксильных групп (например, от 1 до 30%) производного может быть проацилировано либо первой ацильной группой, либо второй ацильной группой. В предпочтительном варианте осуществления изобретения сополимер имеет формулу: 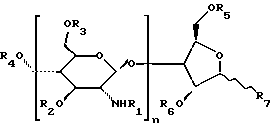 где заместитель R1 каждого отдельного повторяющегося звена выбирается из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R2 каждого отдельного повторяющегося звена выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R3 каждого отдельного повторяющегося звена выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R4 выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R5 выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R6 выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R7 выбирают из группы, включающей CHO и CH2OR8; заместитель R8 выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; n принимает значения от 2 до 200; и для 1-50% повторяющихся звеньев заместитель R1 представляет собой первую ацильную группу, а для 50-99% повторяющихся звеньев заместитель R1 представляет собой вторую ацильную группу, при условии, что для по меньшей мере одного из повторяющихся звеньев заместитель R1 представляет собой первую ацильную группу. Понятия COE1 и COE2 обозначают соответственно -C=O  E1 и -C=O E1 и -C=O E2. Заместители карбоксиалкил, карбоксиалкенил, карбоксиарилалкил и карбоксиарилалкенил могут содержать 1-4 функциональности карбоновой кислоты. Примерами первой ацильной группы являются, но не ограничиваются только ими, сукцинил, 2-(C1-30-алкил)сукцинил, 2-(C2-30-алкенил)сукцинил, малеил, фталил, глутарил и итаконил. Примерами второй ацильной группы являются, но не ограничиваются только ими, ацетил, бензоил, пропионил и фенилацетил.
Настоящее изобретение также относится к композиции, которая включает описанный выше сополимер и полипептид, причем полипептид содержит по меньшей мере одну эффективную ионогенную аминогруппу, где по меньшей мере 50% вес. присутствующего в композиции полипептида связано с полимером ионной связью. Предпочтительно композиция включает от 5 до 50% вес. полипептида.
Примерами приемлемых полипептидов являются рилизинг-пептид гормона роста (РПГР, GHRP), гонодотропин-рилизинг гормон (ГТРГ, LHRH), соматостатин, бомбезин, гастрин-рилизинг пептид (ГРП, GRP), кальцитонин, брадикинин (каллидин), галанин, меланоцитстимулирующий гормон (МСГ, MSH), рилизинг-фактор гормона роста (РФГР, GRF), гормон роста (ГР, GH), амилин, тахикинины, секретин, паратиреоидный гормон (ПТГ, РТН), энкафелин, эндотелин, кальцитонинген-рилизин пептид (КГРГ, CGRP), нейромедины, рилизинг-пептид паратиреоидного гормона (РППГ, РТНгР), глюкагон, нейротензин, адренокортикотропный гормон (АКТГ, АСТН), пептид YY (ПYY, PYY), рилизинг-пептид глюкагона (ГПГ, GLP), вазоактивный кишечный пептид (ВКП, VIP), пептид, активирующий гипофизарную аденилатциклазу (ПАГАЦ, РАСАР), мотилин, вещество P, нейропептид Y (НПУ, NPY), тиреостимулирующий гормон (ТСГ, TSH) и их биологически активные аналоги. Понятие “биологически активные аналоги” используется для того, чтобы охватить природные, рекомбинантные и синтетические пептиды, полипептиды и протеины, обладающие физиологической или терапевтической активностью. В общем случае, это понятие охватывает все фрагменты и производные пептидов, белков или полипептидов, которые проявляют агонистический или антагонистический эффект, качественно аналогичный эффекту немодифицированного или природного пептида, белка или полипептида, например, те в которых один или несколько аминокислотных остатков, присутствующих в природных соединениях, замещены или удалены, или в которых N- или C-концевые остатки структурно модифицированы. Понятие эффективная ионогенная аминогруппа относится к свободной аминогруппе, присутствующей в полипептиде, которая способна образовывать ионную связь со свободными карбоксильными группами сополимера.
Высвобождение полипептида из композиции может быть модифицировано путем изменения химической структуры композиции. Повышение молекулярного веса полимера будет понижать скорость высвобождения пептида из конъюгата. Увеличение числа карбоксильных групп у полимера будет повышать количество полипептида, ионосвязанного с композицией, и, следовательно, увеличивать количество высвобождаемого из конъюгата пептида.
Высвобождение полипептида может быть дополнительно модулировано посредством: (a) обработки композиции растворимыми солями ионов двухвалентных или поливалентных металлов и слабых кислот (например, солями кальция, железа, магния или цинка); (b) нанесения на частицы покрытия в виде тонкого, абсорбируемого слоя, изготовленного из гликолидного сополимера или силиконового масла, в сферической, цилиндрической или плоской конфигурации; или (c) микрокапсулирования композиции в абсорбируемом гликолидном сополимере. В одном из вариантов осуществления изобретения композиция содержит от 0,01 до 20% вес. поливалентного металла.
В зависимости от выбранного полипептида композиции могут быть использованы для лечения ряда заболеваний. Например, соматостатин, бомбезин, ГРП (GRP), ГТРГ (LHRH) и их аналоги предназначены для лечения различных форм рака. Ростовые факторы, такие как ГР (GH), РФГР (GRF) и РПГР (GHRP) и их аналоги, как показано, стимулируют рост как в подростковом, так и в пожилом возрасте. Кальцитонин, амилин, ПТГ (PTH) и РППГ (PTHrP) и их аналоги используются при лечении остеопороза и других заболеваний костей.
Композиции изготовлены для парентерального применения, например для внутримышечной, подкожной, интрадуральной или внутрибрюшинной инъекций. Предпочтительно композиции вводят внутримышечно.
Композиции изобретения могут иметь форму порошка или микрочастиц для введения в виде суспензии с фармацевтически приемлемым наполнителем (например, с водой и с веществом-носителем, таким как маннит или полисорбат, или без него). Композиции также могут быть выполнены в форме бруска для парентеральной имплантации с использованием троакара, например, для внутримышечной имплантации.
Доза композиции настоящего изобретения для лечения перечисленных выше заболеваний или болезней меняется в зависимости от способа введения, возраста и веса пациента, а также от состояния, которое подвергается лечению, и, в конечном итоге, определяется лечащим врачом или ветеринаром.
Такое количество композиции, определенное лечащим врачом или ветеринаром, называется в данном описании “терапевтически эффективное количество”.
В соответствии с другим аспектом настоящее изобретение предлагает способ синтеза сополимера, который включает стадии: взаимодействия хитозана со слабой кислотой с получением полисахарида с низким молекулярным весом; взаимодействия 1-50% свободных аминогрупп полисахарида с низким молекулярным весом с первым ацилирующим агентом, причем первый ацилирующий агент выбирают из группы, включающей C4-C34-поликарбоксиалкан, C4– C34-поликарбоксиалкен, C4-C40-поликарбоксиарилалкан, C10-C40– поликарбоксиарилалкен или их ацилирующие производные; и взаимодействия 50-100% свободных аминогрупп полисахарида с низким молекулярным весом со вторым ацилирующим агентом, причем второй ацилирующий агент выбирают из группы, включающей C2-31– монокарбоксиалкан, C3-31-монокарбоксиалкен, C7-38– монокарбоксиарилалкан, C9-35-монокарбоксиарилалкен или их ацилирующие производные. Реакцию низкомолекулярного полисахарида как с первым, так и со вторым ацилирующим агентом можно контролировать с помощью агента, определяющего наличие аминогрупп (например, флуоресамина), чтобы гарантировать, что от 1 до 50% свободных аминогрупп полисахарида с низким молекулярным весом проацилировано первым ацилирующим агентом и от 50 до 99% свободных аминогрупп полисахарида с низким молекулярным весом проацилировано вторым ацилирующим агентом (см., например, Bailey P.D., An Introduction to Peptide Chemistry (Wiley, NY) (1990); Oppenheimer H. et al. Archives Biochem. Biophys. 120, 108-118 (1967); Stein S., Arch. Biochem. Biophys. 155, 203-212 (1973).
Взаимодействие хитозана со слабой кислотой (например, с азотистой кислотой) приводит к расщеплению полимера и уменьшению его молекулярного веса (например, 2500-80000 Дальтонов). В предпочтительных вариантах осуществления изобретения первая ацилирующая группа и второй ацилирующий агент реагирует с низкомолекулярным полисахаридом последовательно, например, или первый ацилирующий агент реагируют перед вторым ацилирующим агентом, или второй ацилирующий агент реагирует перед первым ацилирующим агентом, либо они реагируют одновременно. При ацилировании свободных аминогрупп может быть проацилировано некоторое количество свободных гидроксильных групп низкомолекулярного полисахарида. Степень ацилирования свободных гидроксильных групп может меняться при изменении значения pH или растворителей или агентов, используемых в реакциях ацилирования, а также используемых ацилирующих агентов.
Примерами ацилирующих производных являются, но не ограничиваются только ими, ангидриды и N-ацилированные гетероциклы (например, имидазолы и пиразолы) (см., например, Bodansky et al. The Practice of Peptide Synthesis, 87-150, Springer-Verlag, 1984). Агенты поликарбоксиалкан, поликарбоксиалкен, поликарбоксиарилалкан и поликарбоксиарилалкен или их ацилирующие производные содержат или их получают из реагентов, содержащих 2-5 функциональностей карбоновой кислоты. Заместители монокарбоксиалкан, монокарбоксиалкен, монокарбоксиарилалкан и монокарбоксиарилалкен содержат или берут начало от реагентов, содержащих единственную карбоксильную группу. Примерами первых ацилирующих агентов являются, но не ограничиваются только ими, янтарный ангидрид, 2-(C1-30-алкил) янтарный ангидрид, 2-(C2-30-алкенил) янтарный ангидрид, малеиновый ангидрид, грутаровый ангидрид, итаконовый ангидрид и фталевый ангидрид. Примерами вторых ацилирующих агентов являются, но не ограничиваются только ими, уксусный ангидрид, бензойный ангидрид, N,N’-диацетил-3,5-диметилпиразол, N, N’-диацетилимидазол, фенилуксусный ангидрид, пропионовый ангидрид и масляный ангидрид.
В соответствии с еще одним аспектом настоящее изобретение предлагает способ синтеза композиции, который включает стадии: взаимодействия хитозана со слабой кислотой с получением полисахарида с низким молекулярным весом; взаимодействия 1-50% свободных аминогрупп полисахарида с низким молекулярным весом с первым ацилирующим агентом, причем первый ацилирующий агент выбирают из группы, включающей C4-34-поликарбоксиалкан, C4-34-поликарбоксиалкен, C8-40-поликарбоксиарилалкан, C10-40-поликарбоксиарилалкен или их ацилирующие производные; и взаимодействия от 50 до 100% свободных аминогрупп полисахарида с низким молекулярным весом со вторым ацилирующим агентом, причем второй ацилирующий агент выбирают из группы, включающей C2-31– монокарбоксиалкан, C3-31-монокарбоксиалкен, C7-38– монокарбоксиарилалкан, C9-35-монокарбоксиарилалкен или их ацилирующие производные; нейтрализации ацилированного низкомолекулярного полисахарида основанием; и смешения нейтрализованного низкомолекулярного ацилированного полисахарида с солью полипептида, где соль полипептида содержит по меньшей мере одну ионогенную аминогруппу с образованием ионного конъюгата полипептид-сополимер.
На стадии нейтрализации низкомолекулярный полисахарид предпочтительно становится эмульгируемым или растворимым в воде. В предпочтительном варианте основание представляет собой неорганическое основание (например, гидроксид натрия). Полипептидная соль предпочтительно является солью слабой кислоты (например, ацетатом, лактатом или цитратом). Ионный конъюгат может быть выделен фильтрацией или путем центрифугирования полученной смеси.
Конъюгаты настоящего изобретения могут быть введены в инъецируемые микросферы или микрочастицы и имплантируемые пленки или бруски без необходимости применения обработки, которая приводит к микрофазным эмульсиям. Предпочтительно микрочастицы производят путем (а) растворения композиции в апротонном, смешивающемся с водой органическом растворителе; (в) смешении органического растворителя с водой и (с) выделения микрочастиц из воды. В предпочтительном варианте осуществления изобретения органический растворитель выбирают из группы, включающей ацетон, ацетонитрил, тетрагидрофуран, диметилформамид и диметилэтиленгликоль.
Другие признаки и преимущества настоящего изобретения станут понятны из подробного описания и из формулы изобретения.
Подробное описание изобретения E2. Заместители карбоксиалкил, карбоксиалкенил, карбоксиарилалкил и карбоксиарилалкенил могут содержать 1-4 функциональности карбоновой кислоты. Примерами первой ацильной группы являются, но не ограничиваются только ими, сукцинил, 2-(C1-30-алкил)сукцинил, 2-(C2-30-алкенил)сукцинил, малеил, фталил, глутарил и итаконил. Примерами второй ацильной группы являются, но не ограничиваются только ими, ацетил, бензоил, пропионил и фенилацетил.
Настоящее изобретение также относится к композиции, которая включает описанный выше сополимер и полипептид, причем полипептид содержит по меньшей мере одну эффективную ионогенную аминогруппу, где по меньшей мере 50% вес. присутствующего в композиции полипептида связано с полимером ионной связью. Предпочтительно композиция включает от 5 до 50% вес. полипептида.
Примерами приемлемых полипептидов являются рилизинг-пептид гормона роста (РПГР, GHRP), гонодотропин-рилизинг гормон (ГТРГ, LHRH), соматостатин, бомбезин, гастрин-рилизинг пептид (ГРП, GRP), кальцитонин, брадикинин (каллидин), галанин, меланоцитстимулирующий гормон (МСГ, MSH), рилизинг-фактор гормона роста (РФГР, GRF), гормон роста (ГР, GH), амилин, тахикинины, секретин, паратиреоидный гормон (ПТГ, РТН), энкафелин, эндотелин, кальцитонинген-рилизин пептид (КГРГ, CGRP), нейромедины, рилизинг-пептид паратиреоидного гормона (РППГ, РТНгР), глюкагон, нейротензин, адренокортикотропный гормон (АКТГ, АСТН), пептид YY (ПYY, PYY), рилизинг-пептид глюкагона (ГПГ, GLP), вазоактивный кишечный пептид (ВКП, VIP), пептид, активирующий гипофизарную аденилатциклазу (ПАГАЦ, РАСАР), мотилин, вещество P, нейропептид Y (НПУ, NPY), тиреостимулирующий гормон (ТСГ, TSH) и их биологически активные аналоги. Понятие “биологически активные аналоги” используется для того, чтобы охватить природные, рекомбинантные и синтетические пептиды, полипептиды и протеины, обладающие физиологической или терапевтической активностью. В общем случае, это понятие охватывает все фрагменты и производные пептидов, белков или полипептидов, которые проявляют агонистический или антагонистический эффект, качественно аналогичный эффекту немодифицированного или природного пептида, белка или полипептида, например, те в которых один или несколько аминокислотных остатков, присутствующих в природных соединениях, замещены или удалены, или в которых N- или C-концевые остатки структурно модифицированы. Понятие эффективная ионогенная аминогруппа относится к свободной аминогруппе, присутствующей в полипептиде, которая способна образовывать ионную связь со свободными карбоксильными группами сополимера.
Высвобождение полипептида из композиции может быть модифицировано путем изменения химической структуры композиции. Повышение молекулярного веса полимера будет понижать скорость высвобождения пептида из конъюгата. Увеличение числа карбоксильных групп у полимера будет повышать количество полипептида, ионосвязанного с композицией, и, следовательно, увеличивать количество высвобождаемого из конъюгата пептида.
Высвобождение полипептида может быть дополнительно модулировано посредством: (a) обработки композиции растворимыми солями ионов двухвалентных или поливалентных металлов и слабых кислот (например, солями кальция, железа, магния или цинка); (b) нанесения на частицы покрытия в виде тонкого, абсорбируемого слоя, изготовленного из гликолидного сополимера или силиконового масла, в сферической, цилиндрической или плоской конфигурации; или (c) микрокапсулирования композиции в абсорбируемом гликолидном сополимере. В одном из вариантов осуществления изобретения композиция содержит от 0,01 до 20% вес. поливалентного металла.
В зависимости от выбранного полипептида композиции могут быть использованы для лечения ряда заболеваний. Например, соматостатин, бомбезин, ГРП (GRP), ГТРГ (LHRH) и их аналоги предназначены для лечения различных форм рака. Ростовые факторы, такие как ГР (GH), РФГР (GRF) и РПГР (GHRP) и их аналоги, как показано, стимулируют рост как в подростковом, так и в пожилом возрасте. Кальцитонин, амилин, ПТГ (PTH) и РППГ (PTHrP) и их аналоги используются при лечении остеопороза и других заболеваний костей.
Композиции изготовлены для парентерального применения, например для внутримышечной, подкожной, интрадуральной или внутрибрюшинной инъекций. Предпочтительно композиции вводят внутримышечно.
Композиции изобретения могут иметь форму порошка или микрочастиц для введения в виде суспензии с фармацевтически приемлемым наполнителем (например, с водой и с веществом-носителем, таким как маннит или полисорбат, или без него). Композиции также могут быть выполнены в форме бруска для парентеральной имплантации с использованием троакара, например, для внутримышечной имплантации.
Доза композиции настоящего изобретения для лечения перечисленных выше заболеваний или болезней меняется в зависимости от способа введения, возраста и веса пациента, а также от состояния, которое подвергается лечению, и, в конечном итоге, определяется лечащим врачом или ветеринаром.
Такое количество композиции, определенное лечащим врачом или ветеринаром, называется в данном описании “терапевтически эффективное количество”.
В соответствии с другим аспектом настоящее изобретение предлагает способ синтеза сополимера, который включает стадии: взаимодействия хитозана со слабой кислотой с получением полисахарида с низким молекулярным весом; взаимодействия 1-50% свободных аминогрупп полисахарида с низким молекулярным весом с первым ацилирующим агентом, причем первый ацилирующий агент выбирают из группы, включающей C4-C34-поликарбоксиалкан, C4– C34-поликарбоксиалкен, C4-C40-поликарбоксиарилалкан, C10-C40– поликарбоксиарилалкен или их ацилирующие производные; и взаимодействия 50-100% свободных аминогрупп полисахарида с низким молекулярным весом со вторым ацилирующим агентом, причем второй ацилирующий агент выбирают из группы, включающей C2-31– монокарбоксиалкан, C3-31-монокарбоксиалкен, C7-38– монокарбоксиарилалкан, C9-35-монокарбоксиарилалкен или их ацилирующие производные. Реакцию низкомолекулярного полисахарида как с первым, так и со вторым ацилирующим агентом можно контролировать с помощью агента, определяющего наличие аминогрупп (например, флуоресамина), чтобы гарантировать, что от 1 до 50% свободных аминогрупп полисахарида с низким молекулярным весом проацилировано первым ацилирующим агентом и от 50 до 99% свободных аминогрупп полисахарида с низким молекулярным весом проацилировано вторым ацилирующим агентом (см., например, Bailey P.D., An Introduction to Peptide Chemistry (Wiley, NY) (1990); Oppenheimer H. et al. Archives Biochem. Biophys. 120, 108-118 (1967); Stein S., Arch. Biochem. Biophys. 155, 203-212 (1973).
Взаимодействие хитозана со слабой кислотой (например, с азотистой кислотой) приводит к расщеплению полимера и уменьшению его молекулярного веса (например, 2500-80000 Дальтонов). В предпочтительных вариантах осуществления изобретения первая ацилирующая группа и второй ацилирующий агент реагирует с низкомолекулярным полисахаридом последовательно, например, или первый ацилирующий агент реагируют перед вторым ацилирующим агентом, или второй ацилирующий агент реагирует перед первым ацилирующим агентом, либо они реагируют одновременно. При ацилировании свободных аминогрупп может быть проацилировано некоторое количество свободных гидроксильных групп низкомолекулярного полисахарида. Степень ацилирования свободных гидроксильных групп может меняться при изменении значения pH или растворителей или агентов, используемых в реакциях ацилирования, а также используемых ацилирующих агентов.
Примерами ацилирующих производных являются, но не ограничиваются только ими, ангидриды и N-ацилированные гетероциклы (например, имидазолы и пиразолы) (см., например, Bodansky et al. The Practice of Peptide Synthesis, 87-150, Springer-Verlag, 1984). Агенты поликарбоксиалкан, поликарбоксиалкен, поликарбоксиарилалкан и поликарбоксиарилалкен или их ацилирующие производные содержат или их получают из реагентов, содержащих 2-5 функциональностей карбоновой кислоты. Заместители монокарбоксиалкан, монокарбоксиалкен, монокарбоксиарилалкан и монокарбоксиарилалкен содержат или берут начало от реагентов, содержащих единственную карбоксильную группу. Примерами первых ацилирующих агентов являются, но не ограничиваются только ими, янтарный ангидрид, 2-(C1-30-алкил) янтарный ангидрид, 2-(C2-30-алкенил) янтарный ангидрид, малеиновый ангидрид, грутаровый ангидрид, итаконовый ангидрид и фталевый ангидрид. Примерами вторых ацилирующих агентов являются, но не ограничиваются только ими, уксусный ангидрид, бензойный ангидрид, N,N’-диацетил-3,5-диметилпиразол, N, N’-диацетилимидазол, фенилуксусный ангидрид, пропионовый ангидрид и масляный ангидрид.
В соответствии с еще одним аспектом настоящее изобретение предлагает способ синтеза композиции, который включает стадии: взаимодействия хитозана со слабой кислотой с получением полисахарида с низким молекулярным весом; взаимодействия 1-50% свободных аминогрупп полисахарида с низким молекулярным весом с первым ацилирующим агентом, причем первый ацилирующий агент выбирают из группы, включающей C4-34-поликарбоксиалкан, C4-34-поликарбоксиалкен, C8-40-поликарбоксиарилалкан, C10-40-поликарбоксиарилалкен или их ацилирующие производные; и взаимодействия от 50 до 100% свободных аминогрупп полисахарида с низким молекулярным весом со вторым ацилирующим агентом, причем второй ацилирующий агент выбирают из группы, включающей C2-31– монокарбоксиалкан, C3-31-монокарбоксиалкен, C7-38– монокарбоксиарилалкан, C9-35-монокарбоксиарилалкен или их ацилирующие производные; нейтрализации ацилированного низкомолекулярного полисахарида основанием; и смешения нейтрализованного низкомолекулярного ацилированного полисахарида с солью полипептида, где соль полипептида содержит по меньшей мере одну ионогенную аминогруппу с образованием ионного конъюгата полипептид-сополимер.
На стадии нейтрализации низкомолекулярный полисахарид предпочтительно становится эмульгируемым или растворимым в воде. В предпочтительном варианте основание представляет собой неорганическое основание (например, гидроксид натрия). Полипептидная соль предпочтительно является солью слабой кислоты (например, ацетатом, лактатом или цитратом). Ионный конъюгат может быть выделен фильтрацией или путем центрифугирования полученной смеси.
Конъюгаты настоящего изобретения могут быть введены в инъецируемые микросферы или микрочастицы и имплантируемые пленки или бруски без необходимости применения обработки, которая приводит к микрофазным эмульсиям. Предпочтительно микрочастицы производят путем (а) растворения композиции в апротонном, смешивающемся с водой органическом растворителе; (в) смешении органического растворителя с водой и (с) выделения микрочастиц из воды. В предпочтительном варианте осуществления изобретения органический растворитель выбирают из группы, включающей ацетон, ацетонитрил, тетрагидрофуран, диметилформамид и диметилэтиленгликоль.
Другие признаки и преимущества настоящего изобретения станут понятны из подробного описания и из формулы изобретения.
Подробное описание изобретенияСинтез и применение сополимера и сополимер-пептидных ионных конъюгатов настоящего изобретения находится в компетенции квалифицированного в данной области специалиста. Если не оговорено особо, все технические и научные термины, используемые в данном описании, имеют общепринятое значение, понятное для специалиста в области, к которой принадлежит рассматриваемое изобретение. Кроме того, все публикации, патентные публикации, патенты и другие ссылки упомянуты в качестве справочного материала. Мы полагаем, что квалифицированный в данной области специалист на основании приведенного описания сможет использовать настоящее изобретение в полном объеме. Следующие конкретные варианты осуществления изобретения, следовательно, следует рассматривать только в качестве иллюстративных и ни коим образом не ограничивающих остальное открытие. Пример 1: Деполимеризация хитозана Хитозан (Protan, Inc., Portsmouth, NH) растворяют в водной уксусной кислоте при перемешивании механической мешалкой в течение одного дня. Через раствор барботируют газообразный азот, добавляя при этом водный раствор нитрита натрия. Через 0,5 часа раствор фильтруют через фильтр Шотта при пониженном давлении с целью удаления нерастворившихся частиц, которые присутствуют в исходном растворе хитозана. К отфильтрованному раствору добавляют водный раствор NaOH и раствор интенсивно перемешивают в метаноле для осаждения полимера. Полученный осадок затем отфильтровывают и промывают поочередно пять раз водой и метанолом. Осадок сушат в вакуумном сушильном шкафу при 60oC в течение двух дней. Деполимеризованный хитозан содержит альдегидную группу на одном конце цепочки. Концевую альдегидную группу можно восстановить до первичной гидроксильной группы с помощью NaBH4. Деполимеризованный продукт может быть проанализирован с помощью гельпроникающей хроматографии (ГПХ) для определения как его молекулярного веса, так и молекулярно-массового распределения (ММР) в сравнении со справочным стандартом Пуллулана (Pullulan). Для определения степени N-ацилирования деполимеризованного продукта могут быть использованы ядерный магнитный резонанс (ЯМР) и ИК-спектроскопия (ИК). Пример 2: Частичное сукцинилирование деполимеризованного хитозана Деполимеризованный хитозан примера 1 растворяют в 0,1 М водном растворе уксусной кислоты. К полученному раствору добавляют метанол, а затем раствор янтарного ангидрида в ацетоне. Полученный раствор перемешивают при комнатной температуре в течение 24 часов. По окончании сукцинилирования реакционную массу выливают в водный ацетон для осаждения осадка. Полученный осадок собирают при центрифугировании и промывают пять раз метанолом. Затем осадок растворяют в 0,5 М КОН и диализируют относительно воды до значения pH 7. Диализированный раствор затем концентрируют при пониженном давлении, осаждают в водном ацетоне и сушат в вакуумном сушильном шкафу при 60oC. Для достижения переменных уровней сукцинилирования степень протекания реакции ацилирования можно контролировать путем анализа числа непрореагировавших аминогрупп. Количество непрореагировавших аминогрупп может быть определено с помощью остановки реакции в отобранном образце реакционной смеси с использованием аминопределяющего реагента (например, флуоресамина). Количество присутствующего амина может быть измерено спектрофотометрически с использованием стандартной кривой для сополимера. Кроме того, янтарный ангидрид можно добавлять последовательно до достижения желаемого процента ацилирования. Точная степень сукцинилирования очищенного продукта может быть определена с помощью спектроскопии 1Н ЯМР и кондуктометрическим титрованием. Пример 3: Ацетилирование N-сукцинилированного хитозана Частично сукцинилированный образец примера 2 растворяют в 0,1 М водном растворе уксусной кислоты. К полученному раствору затем добавляют метанол и уксусный ангидрид и реакционную смесь перемешивают при комнатной температуре в течение одного дня. Полученный раствор затем выливают в водный ацетон для осаждения. Образовавшийся осадок отделяют центрифугированием и промывают пять раз метанолом. Затем осадок растворяют в 0,1 н. растворе КОН и диализируют относительно воды до значения pH 7. Конечный раствор лиофилизируют с получением продукта. Процесс ацилирования можно контролировать спектрофотометрически, как это описано в примере 2, а точную степень ацилирования очищенного продукта можно определить с помощью спектроскопии 1H ЯМР и кондуктометрическим титрованием. Пример 4: Получение поли(N-ацил-D-глюкозамин)-пептидного ионного конъюгата Калиевую соль N-сукцинилированного хитозана примера 3 растворяют в воде. К раствору полимера при перемешивании добавляют водный раствор ацетатной соли аналога соматостатинового полипептида SOMATULINETM (D-Nal-c[Cys-Tyr-D-Trp-Lys-Val-Cys] -Thr-NHz; Kinerton, Dublin, Ireland). Образуется осадок, который отфильтровывают и сушат в вакуумном сушильном шкафу при 40oC. Содержание полипептида конечного ионного конъюгата может быть определено по разнице между добавленным вначале пептидом и количеством свободного остатка пептида, содержащегося в фильтрате и промывном растворе. Содержание пептида в конечном ионном конъюгате может быть определено при сравнении углерод/азотного соотношения исходного N-сукцинилированного хитозана с углерод/азотным соотношением полученного ионного конъюгата. ГПХ может быть использована для определения молекулярного веса и ММР, дифференциальная сканирующая калориметрия (ДСК) – для определения тепловых свойств, а спектроскопия ЯМР и ИК-спектроскопия – для химической идентификации. Пример 5: Гомогенная деполимеризация хитозана Хитозан (Aldrich, Sigma-Aldrich Co. Ltd., Gillingham, Dorset, England, высокомолекулярный, 10 г) растворяют в 1 л 0,1 М водной уксусной кислоты (уксусная кислота, миним. 99,8%, Riedel-de Haen, артикул 33209) в 2 л стеклянном химическом стакане при перемешивании механической мешалкой Хейдолфа (Heidolph) (модель RZR 2102, Kelheim, Germany) приблизительно при 144 оборотах в минуту. Растворение завершается в пределах ~4 часов. Показано, что характеристическая вязкость,  хар, конечного деполимеризованного хитозана зависит от концентрации нитрита натрия и времени, предоставленного для деполимеризации, tдепол, (таблица 1). Характеристическую вязкость определяли с 0,1 М уксусной кислотой в качестве раствора, используя методику Кеннона-Фенске (Cannon-Fenske) на вискозиметре Уббелоде (Poulten Seife & Lee Ltd., 50 с константой 0,003890 (мм2/сек)/сек при 40oC).
К раствору добавляют нитрит натрия (Aldrich, Sigma-Aldrich Co. Ltd., Gillingham, Dorset, England) в 5-20 мл деионизованной (ДИ) воды. После необходимого для деполимеризации времени раствор отфильтровывают как можно быстрее через воронку со спеченным стеклянным фильтром (25-50 микрон. Ace Glass Incorporated, Vineland, N.J.) для удаления нерастворимых частиц. Для гашения деполимеризующего действия NaNO2 к отфильтрованному раствору добавляют NaOH (Aldrich) в ДИ воде в количестве от 4,5 г в 100 мл до 20 г в 400 мл. Затем для осаждения полимера раствор добавляют к интенсивно перемешиваемому метанолу (Labscan, чистый для ВЭЖХ, 300 мл). Суспензию центрифугируют при 4000 оборотов в минуту при 4oC в течение 35 минут, используя центрифугу Sorvall RC 5В. После центрифугирования супернатант сливают, а осадок промывают смесью вода/метанол (Labscan, чистый для анализа) (1 л, 80:20). Суспензию центрифугируют, как указано выше, супернатант снова сливают, а деполимеризованный хитозан после замораживания в течение ночи лиофилизируют в лиофилизаторе Edwards Super Modulyo в течение двух дней. Деполимеризованный хитозан далее высушивают в течение 1 дня в вакуумном сушильном шкафу (Bloblock Scientific, Strasbourg, – 22 мм Hg при 30oC).
Пример 6: Гетерогенная деполимеризация хар, конечного деполимеризованного хитозана зависит от концентрации нитрита натрия и времени, предоставленного для деполимеризации, tдепол, (таблица 1). Характеристическую вязкость определяли с 0,1 М уксусной кислотой в качестве раствора, используя методику Кеннона-Фенске (Cannon-Fenske) на вискозиметре Уббелоде (Poulten Seife & Lee Ltd., 50 с константой 0,003890 (мм2/сек)/сек при 40oC).
К раствору добавляют нитрит натрия (Aldrich, Sigma-Aldrich Co. Ltd., Gillingham, Dorset, England) в 5-20 мл деионизованной (ДИ) воды. После необходимого для деполимеризации времени раствор отфильтровывают как можно быстрее через воронку со спеченным стеклянным фильтром (25-50 микрон. Ace Glass Incorporated, Vineland, N.J.) для удаления нерастворимых частиц. Для гашения деполимеризующего действия NaNO2 к отфильтрованному раствору добавляют NaOH (Aldrich) в ДИ воде в количестве от 4,5 г в 100 мл до 20 г в 400 мл. Затем для осаждения полимера раствор добавляют к интенсивно перемешиваемому метанолу (Labscan, чистый для ВЭЖХ, 300 мл). Суспензию центрифугируют при 4000 оборотов в минуту при 4oC в течение 35 минут, используя центрифугу Sorvall RC 5В. После центрифугирования супернатант сливают, а осадок промывают смесью вода/метанол (Labscan, чистый для анализа) (1 л, 80:20). Суспензию центрифугируют, как указано выше, супернатант снова сливают, а деполимеризованный хитозан после замораживания в течение ночи лиофилизируют в лиофилизаторе Edwards Super Modulyo в течение двух дней. Деполимеризованный хитозан далее высушивают в течение 1 дня в вакуумном сушильном шкафу (Bloblock Scientific, Strasbourg, – 22 мм Hg при 30oC).
Пример 6: Гетерогенная деполимеризацияХитозан (18,0 г, как указано выше) и NaNO2 (как указано выше) добавляют в 1 л стеклянный химический стакан. Раствор трифторуксусной кислоты (TFA) (Riedel-de Haen, 23 мл в 600 мл ДИ воды, 0,5 М) добавляют в химический стакан и смесь перемешивают, используя механическую мешалку Хейдолфа (как указано выше). При добавлении раствора TFA наблюдают значительное газообразование. Раствор отфильтровывают на воронке со спеченным стеклянным фильтром (как указано выше). К отфильтрованному раствору добавляют раствор NaOH (13,3 г в 165 мл ДИ воды). Полученный раствор затем добавляют к интенсивно перемешиваемому метанолу (Labscan, чистый для ВЭЖХ, 300 мл). Центрифугирование и промывание проводят как при гомогенной деполимеризации. Таблица 2 представляет результаты серии экспериментов по деполимеризации. При осуществлении гетерогенного способа растворение и деполимеризация происходят одновременно, делая этот способ более быстрым. Оба способа дают одинаковый выход (таблица 1; 0,33 дл/г с выходом 76,7% и 0,30 дл/г с выходом 69,1%), но при гетерогенном способе может быть использован хитозан в большем количестве: 18 г в противоположность 10 г. Образцы высушенного деполимеризованного хитозана (из примеров 5 и 6) с величиной характеристической вязкости в области 0,23-1,51 дл/г анализируют с помощью 13C ЯМР в водном CD3COOD, используя ЯМР спектрометр Bruker Spectrospin 400. Химические сдвиги атомов углерода с C1 по C6 представлены в таблице 3. Химический сдвиг отдельного атома углерода увеличивается с характеристической вязкостью. Элементный анализ проводили на образцах деполимеризованного хитозана из примеров 5 и 6 (таблица 4). Содержание аминогрупп, то есть долю повторяющихся структурных единиц хитозана, содержащих аминогруппы, определяют метахроматическим титрованием, используя кислый красный 88 (Aldrich, содержание красителя ~75%), следуя методу, описанному Гаммоу и Робертсом (Beryl. D. Gummow, George A.F. Roberts, Makromol. Chem. 186, 1239-1244 (1985)), содержание которого упомянуто здесь для сведения. Содержание аминогрупп представлено в таблице 5. Из показателей % азота и количества аминогрупп в серии образцов деполимеризованного хитозана в таблицах 4 и 5 очевидно, что снижение значения  хар. сопровождается уменьшением количества аминогрупп, что указывает на деаминирование при деполимеризации.
Расчеты для проведения глутарилирования/пропионилирования: хар. сопровождается уменьшением количества аминогрупп, что указывает на деаминирование при деполимеризации.
Расчеты для проведения глутарилирования/пропионилирования:Количество глутарового и пропионового ангидридов, требуемое для реакции глутарилирования/пропионилирования, зависит от необходимого молярного соотношения между двумя ангидридами, массы и содержания аминогрупп используемого деполимеризованного хитозана. Общие уравнения для расчета масс ангидридов, необходимых для стехиометрического глутарилирования/пропионилирования, имеют следующий вид: Требуемая масса глутарового ангидрида (GA) = требуемая доля GA  масса хитозана масса хитозана  количество аминогрупп количество аминогрупп  114,1*/161**.
*мольная масса (мм) глутарового ангидрида (GA) 114,1*/161**.
*мольная масса (мм) глутарового ангидрида (GA)**161 = мм структурной единицы хитозана Требуемая масса пропионового ангидрида (PA) = требуемая доля PA  масса хитозана масса хитозана  количество аминогрупп количество аминогрупп  130,14***/161 130,14***/161***мм (PA) Пример 7А: Глутарилирование/пропионилирование деполимеризованного хитозана Деполимеризованный хитозан из примера 5 с характеристической вязкостью 1,51 дл/г растворяют в 0,1 М уксусной кислоте (4,01 г в 150 мл). В это время количество аминогрупп этого образца неизвестно, но можно предположить, что оно изменяется от 0,74 для деполимеризованного хитозана с характеристической вязкостью 0,98 дл/г до 0,78 для низкомолекулярного хитозана от Aldrich (таблица 5). К раствору хитозана добавляют глутаровый ангидрид (Aldrich, 95%, 6,0 г) приблизительно в 5,7-кратном избытке и пропионовый ангидрид (Aldrich, 99%, 6,0 г) приблизительно в 5,0-кратном избытке в растворе ацетона (Labscan, Dublin, Ireland, чистый для анализа, 29,9 мл, 23,62 г) и оставляют для перемешивания в течение ночи. Полученный раствор, который имеет гелеобразную природу, вливают в ацетон (Labscan, чистый для анализа, 200 мл), чтобы индуцировать осаждение. Дисперсию центрифугируют приблизительно при 4oC в течение 25 минут. После центрифугирования супернатант промывают метанолом (Labscan, чистый для ВЭЖХ, 600 мл) и центрифугируют, как указано выше. Супернатант сливают и продукт лиофилизируют после замораживания в течение ночи. Из-за большого избытка использованного ангидрида лиофилизированный продукт промывают повторным растворением в 0,2 М растворе NaOH, фильтрованием удаляют не растворившиеся частицы и осаждают в метаноле (Labscan, чистый для ВЭЖХ, 300 мл). После центрифугирования при 4000 оборотов в минуту приблизительно при 4oC в течение около 25 минут супернатант сливают и продукт высушивают лиофилизацией (2 дня) и в вакуумном сушильном шкафу в течение 1 дня. Определенный с помощью элементного анализа % азота в конечном продукте составил 3,92%. Пример 7В: Глутарилирование/пропионилирование деполимеризованного хитозана Деполимеризованный хитозан из примера 5 с характеристической вязкостью 0,98 дл/г растворяют в 0,1 М уксусной кислоте (1,23 г в 46 мл). Проводят расчет, согласно которому количество аминогрупп этого образца составляет 0,74 (таблица 5). К раствору хитозана добавляют глутаровый ангидрид (Aldrich, 95%, 1,33 г) и пропионовый ангидрид (Aldrich, 99%, 1,33 г) при приблизительно 3,8-кратном избытке глутарового ангидрида и приблизительно 3,3-кратном избытке пропионового ангидрида в растворе ацетона (Labscan, чистый для анализа, 10,1 мл, 8 г) и оставляют перемешиваться в течение ночи. Полученный раствор вливают в ацетон (Labscan, чистый для анализа, 80 мл), чтобы вызвать осаждение. Дисперсию центрифугируют при 4000 оборотов в минуту приблизительно при 4oC в течение 25 минут. После центрифугирования супернатант промывают метанолом (Labscan, чистый для ВЭЖХ, 600 мл) и центрифугируют, как указано выше. Супернатант сливают и продукт лиофилизируют после замораживания в течение ночи, а затем высушивают в вакуумном сушильном шкафу (1 день). Определенный при элементном анализе % азота этого продукта составляет 5,11%. Пример 7С: Глутарилирование/пропионилирование деполимеризованного хитозана Деполимеризованный хитозан из примера 5 с характеристической вязкостью 0,98 дл/г растворяют в 0,1 М уксусной кислоте (4,02 г в 150 мл). Проводят расчет, согласно которому количество аминогрупп этого образца составляет 0,74 (таблица 5). К раствору хитозана добавляют глутаровый ангидрид (Aldrich, 95%, 4,01 г) и пропионовый ангидрид (Aldrich, 99%, 4,05 г) при приблизительно 3,8-кратном избытке глутарового ангидрида и приблизительно 3,3-кратном избытке пропионового ангидрида в растворе ацетона (Labscan, чистый для анализа, 29,4 мл, 2,2 г) и оставляют перемешиваться в течение ночи. Полученный раствор вливают в ацетон (Labscan, чистый для анализа, 200 мл), чтобы вызвать осаждение. Дисперсию центрифугируют при 4000 оборотов в минуту приблизительно при 4oC в течение 25 минут. После центрифугирования супернатант промывают метанолом (Labscan, чистый для ВЭЖХ, 600 мл) и центрифугируют, как указано выше. Супернатант сливают и продукт лиофилизируют после замораживания в течение ночи. Из-за большого избытка использованного ангидрида лиофилизированный продукт промывают повторным растворением в 0,2 М растворе NaOH, отфильтровывают для удаления не растворившихся частиц и осаждают в метаноле (Labscan, чистый для ВЭЖХ, 300 мл). После центрифугирования при 4000 оборотов в минуту приблизительно при 4oC в течение 25 минут супернатант сливают, а продукт высушивают лиофилизацией (2 дня) и высушивают в вакуумном сушильном шкафу в течение 1 дня. Определенный с помощью элементного анализа% азота этого продукта составляет 5,11%. Пример 7D: Глутарилирование/пропионилирование деполимеризованного хитозана Деполимеризованный хитозан из примера 6 с характеристической вязкостью 0,30 дл/г растворяют в 0,1 М уксусной кислоты (4,01 г в 150 мл). Проводят расчет, согласно которому количество аминогрупп этого образца составляет 0,56. К раствору хитозана добавляют глутаровый ангидрид (Aldrich, 95%, 3,0 г) и пропионовый ангидрид (Aldrich, 99%, 1,0 г) в растворе ацетона (Labscan, Dublin, Ireland, чистый для анализа, 29,9 мл, 23,6 г) и оставляют перемешиваться в течение ночи. Полученный раствор вливают в ацетон (Labscan, чистый для анализа, 200 мл), чтобы вызвать осаждение. Дисперсию центрифугируют при 4000 оборотов приблизительно при 4oC в течение 25 минут. После центрифугирования супернатант промывают метанолом (Labscan, чистый для ВЭЖХ, 600 мл) и центрифугируют, как указано выше. Супернатант сливают, а продукт лиофилизируют в течение 2 дней и высушивают в вакуумном сушильном шкафу в течение 1 дня. Определенный с помощью элементного анализа % азота этого продукта составляет 5,29%. Глутарилирование/пропионилирование – Кинетическое исследование 6,51 грамма хитозана из примера 5 с характеристической вязкостью 0,98 дл/г и содержанием аминогрупп 0,74 растворяют в 0,1 М водной уксусной кислоте (225 мл). В конечном продукте желательно мольное отношение пропионового ангидрида к глутаровому ангидриду 4. Глутаровый ангидрид (Aldrich, 95%, 1,443 г) растворяют в метаноле (10 мл) (Labscan, Dublin, Ireland, чистый для ВЭЖХ) и раствор добавляют к раствору хитозана при перемешивании при комнатной температуре. Приблизительно через 2 часа 40 мл аликвоту реакционной смеси осаждают центрифугированием в ацетоне (Labscan, Dublin, Ireland, чистый для анализа) при 2900 оборотов в минуту приблизительно при 4oC в течение 25 минут. Осадок промывают метанолом (Labscan, чистый для ВЭЖХ) и высушивают. Другую аликвоту, 40 мл, берут через 4 часа, осаждают, промывают и высушивают, как указано выше. Непосредственно после отбора аликвоты 40 мл к реакционной смеси добавляют раствор пропионового ангидрида (Aldrich, 99%, 2,6489 г) в метаноле (Labscan, чистый для ВЭЖХ, 10 мл)). Еще через два часа реакции (что эквивалентно общему времени реакции 6 часов от добавления раствора глутарового ангидрида) всю смесь осаждают в ацетоне (Labscan, чистый для анализа, 330 мл), дисперсию центрифугируют приблизительно при 4oC в течение 30 минут на центрифуге Sorvall RC plus. После центрифугирования супернатант сливают и осадок дважды промывают метанолом (Labscan, чистый для ВЭЖХ, 400 мл), лиофилизируют и высушивают в вакуумном сушильном шкафу. Проводят метахроматическое титрование, которое упоминается в примерах 5 и 6, трех модифицированных образцов хитозана, взятых через 2 часа, 4 часа и, наконец, 6 часов. Содержание аминогрупп для этих трех образцов представлено в таблице 6. Пример 8A: Получение поли(N-пропионилированного, N- глутарилированного)пептидного ионного конъюгата 1,0038 граммов продукта примера 7А растворяют в 20 мл 0,2 М раствора NaOH. К глутарированному/пропионилированному раствору добавляют 450 мкл уксусной кислоты для снижения pH до ~6. Раствор модифицированного хитозана затем медленно добавляют к раствору 122,9 мг ацетатной соли H-  -D-Nal-Cys-Tyr-D-Trp-Lys-Val-Cys-Thr-NH2, известной также как SOMATULINETM), где два цистеина связаны дисульфидной связью (Kinerton Ltd., Blanchardstown, Dublin, Ireland, B/N 93K2505DL3, ацетат = 12,37%, эффективность 82,68%) в 3,73 г ДИ воды и наблюдают осаждение. Осадок также известен как конъюгат полимера и лекарственного средства. Дисперсию центрифугируют при 2900 оборотов в минуту приблизительно при 4oC в течение 25 минут на центрифуге Sorvall RT 6000. Супернатант сливают и оставляют для дальнейших манипуляций. Осадок помещают в холодильник. К сохраненному супернатанту добавляют уксусную кислоту до тех пор пока pH не снизится до 4. Происходит дальнейшее осаждение. Дисперсию центрифугируют, как указано выше, а затем хранят в холодильнике. Осадок после первого и второго центрифугирования лиофилизируют, высушивают в вакуумном сушильном шкафу, при этом полученный выход составляет соответственно 31,7% (356,9 мг) и 36,4 о (409,6 мг) с объединенным выходом 68,1%. Проводят элементный анализ объединенного продукта. % Азота, определенный с помощью элементного анализа объединенного конъюгата, составляет 4,60%, а по расчету с использованием % азота 3,92% для продукта примера 7А, % нагрузки SOMATULINETM составляет 6,7%.
Исследование in vivo: Конъюгат примера 8А суспендируют в солевом растворе, содержащем твинR 20 (1%), и вводят в количестве 7,5 мг пептидного эквивалента на крысу. Уровни SOMATULINETM в плазме крысы, индуцированные этим конъюгатом, измеряются между максимальным значением 636757+/-124759 пг/мл и минимальным значением 863+/-145 пг/мл в продолжение 15-дневного периода, -D-Nal-Cys-Tyr-D-Trp-Lys-Val-Cys-Thr-NH2, известной также как SOMATULINETM), где два цистеина связаны дисульфидной связью (Kinerton Ltd., Blanchardstown, Dublin, Ireland, B/N 93K2505DL3, ацетат = 12,37%, эффективность 82,68%) в 3,73 г ДИ воды и наблюдают осаждение. Осадок также известен как конъюгат полимера и лекарственного средства. Дисперсию центрифугируют при 2900 оборотов в минуту приблизительно при 4oC в течение 25 минут на центрифуге Sorvall RT 6000. Супернатант сливают и оставляют для дальнейших манипуляций. Осадок помещают в холодильник. К сохраненному супернатанту добавляют уксусную кислоту до тех пор пока pH не снизится до 4. Происходит дальнейшее осаждение. Дисперсию центрифугируют, как указано выше, а затем хранят в холодильнике. Осадок после первого и второго центрифугирования лиофилизируют, высушивают в вакуумном сушильном шкафу, при этом полученный выход составляет соответственно 31,7% (356,9 мг) и 36,4 о (409,6 мг) с объединенным выходом 68,1%. Проводят элементный анализ объединенного продукта. % Азота, определенный с помощью элементного анализа объединенного конъюгата, составляет 4,60%, а по расчету с использованием % азота 3,92% для продукта примера 7А, % нагрузки SOMATULINETM составляет 6,7%.
Исследование in vivo: Конъюгат примера 8А суспендируют в солевом растворе, содержащем твинR 20 (1%), и вводят в количестве 7,5 мг пептидного эквивалента на крысу. Уровни SOMATULINETM в плазме крысы, индуцированные этим конъюгатом, измеряются между максимальным значением 636757+/-124759 пг/мл и минимальным значением 863+/-145 пг/мл в продолжение 15-дневного периода,Пример 8В: Получение поли(N-пропионилированного, N- глутарилированного) пептидного ионного конъюгата 1,0010 граммов продукта примера 7А растворяют в 12 мл 0,2 М раствора NaOH. 250 мкл уксусной кислоты добавляют к глутарилированному/пропионилированному раствору для снижения pH до ~6. Затем раствор модифицированного хитозана медленно добавляют к раствору 120,3 мг SOMATULINETM (Kinerton Ltd. , Blanchardstown, Dublin, Ireland, B/N 93k2505DL3, ацетат = 12,37%, эффективность = 82,68%) в 2,87 г ДИ воды и наблюдают осаждение. Из-за меньшего объема используемого раствора NaOH полученный раствор является чрезвычайно вязким. Дисперсию центрифугируют при 2900 оборотов в минуту приблизительно при 4oC в течение около 25 минут на центрифуге Sorvall RT 6000. Супернатант сливают и оставляют для дальнейших манипуляций. Осадок помещают в холодильник. К сохраненному супернатанту добавляют уксусную кислоту до тех пор пока pH не снизится до ~4. Происходит дальнейшее осаждение. Дисперсию центрифугируют, как указано выше, и затем хранят в холодильнике. Осадок от первого и второго центрифугирования лиофилизируют, высушивают в вакуумном сушильном шкафу и полученные выходы составляют, соответственно, 53,5% (600,4 мг) и 20,9% (234,8 мг) с объединенным выходом 74,4%. Проводят элементный анализ объединенного продукта. % Азота, определенный с помощью элементного анализа объединенного конъюгата, составляет 4,30%, а по расчетам с использованием% азота 3,92% для продукта примера 7А, % нагрузки SOMATULINETM составляет 4,0%. Исследование in vivo: Конъюгат суспендируют в солевом растворе, содержащем твинR 20 (1%) и вводят в количестве 7,5 мг пептидного эквивалента на крысу. Индуцированные конъюгатом уровни SOMATULINETM в плазме крысы изменяются между максимальным значением 545367+/-69445 пг/мл и минимальным значением 1134+/-325 пг/мл в продолжение 15-дневного периода, Пример 8С: Получение поли(N-пропионилированного, N- глутарилированного) пептидного ионного конъюгата 1,0190 граммов продукта примера 7В растворяют в 20 мл 0,2 М раствора NaOH. 200 мкл уксусной кислоты добавляют к глутарилированному/пропионилированному раствору для снижения pH до ~6. Затем раствор модифицированного хитозана медленно добавляют к раствору 102,1 мг SOMATULINETM (Kinerton Ltd. , Blanchardstown, Dublin, Ireland, D/N 93K2505DL3, ацетат = 12,37%, эффективность = 82,68%) в 2,56 г ДИ воды и наблюдают осаждение. Дисперсию центрифугируют при 2900 оборотов в минуту приблизительно при 4oC в течение 25 минут на центрифуге Sorvall RT 6000. Супернатант сливают и оставляют для дальнейших манипуляций. Осадок помещают в холодильник. К сохраненному супернатанту добавляют уксусную кислоту до тех пор, пока pH не снизится до ~ 4. Наблюдают дальнейшее осаждение. Дисперсию центрифугируют, как указано выше, а затем хранят в холодильнике. Осадки после первого и второго центрифугирования лиофилизируют, высушивают в вакуумном сушильном шкафу, и при этом полученный объединенный выход составляет 74% (827,1 мг). % нагрузки SOMATULINETM в этом конъюгате оказывается подобным % нагрузки SOMATULINETM примера 4D, то есть 14%. Исследование in vivo: Конъюгат суспендируют в солевом растворе, содержащем твинR 20 (1%) и вводят в количестве 7,5 мг пептидного эквивалента на крысу. Уровни SOMATULINETM в плазме крысы, индуцированные этим конъюгатом, изменяются между максимальным значением 168141+/-90972 пг/мл и минимальным значением 1000 пг/мл в продолжение 9-дневного периода. Пример 8D: Получение поли(N-пропионилированного, N- глутарилированного) пептидного ионного конъюгата 1,0149 граммов продукта примера 7C растворяют в 15 мл 0,05 М растворе NaOH. Молярность NaOH в этом примере ниже, чем молярность в примере 8C. 200 мкл уксусной кислоты добавляют к глутарилированному/пропионилированному раствору для снижения pH до ~ 6. Затем раствор модифицированного хитозана медленно добавляют к раствору 125,2 мг SOMATULINETM (Kinerton Ltd., Blanchardstown, Dublin, Ireland, B/N 93K2505DL3, ацетат = 9,37%, эффективность = 80,68%) в 3,0 г ДИ воды и наблюдают осаждение. Дисперсию центрифугируют при 2900 оборотов приблизительно при 4oC в течение 25 минут на центрифуге Sorvall RT 6000. Супернатант сливают и оставляют для дальнейших манипуляций. Осадок помещают в холодильник. К сохраненному супернатанту добавляют уксусную кислоту до тех пор пока pH не снизится до ~4. Наблюдают дальнейшее осаждение. Дисперсию центрифугируют, как указано выше, а затем хранят в холодильнике. Осадок от первого и второго центрифугирования лиофилизируют, высушивают в вакуумном сушильном шкафу и полученный объединенный выход составляет только 24% (270 мг). Проводят элементный анализ объединенного продукта. % Азота, определенный с помощью элементного анализа объединенного конъюгата, составляет 6,34%, а по расчетам, произведенным с использованием % азота 5,11% для продукта примера 7C, % нагрузки SOMATULINETM составляет 14,0%. Исследование in vivo: Конъюгат суспендируют в солевом растворе, содержащем твинR 20 (1%), и вводят в количестве 7,5 мг пептидного эквивалента на крысу. Уровни SOMATULINETM в плазме крысы, индуцированные этим конъюгатом, изменяются между максимальным значением 192419+/112621 пг/мл и минимальным значением 1000/мл в продолжение 12-дневного периода, Пример 8Е: Получение поли(N-пропионилированного, N- глутарилированного)пептидного ионного конъюгата 2,0 грамма продукта примера 7D растворяют в 28 мл 0,05 М раствора NaOH. Затем раствор хитозана медленно добавляют к раствору 246,0 мг SOMATULINETM (Kinerton Ltd. , Blanchardstown, Dublin, Ireland, B/N 93K2505DL3, ацетат = 9,37%, эффективность = 80,68%) в 6,0 г ДИ воды и наблюдают осаждение. Дисперсию центрифугируют при 2900 оборотов в минуту приблизительно при 4oC в течение 25 минут на центрифуге Sorvall RT 6000. Супернатант сливают. Осадок промывают 24 мл ДИ воды и центрифугируют, как указано выше. Осадок затем помещают в холодильник. Проводят элементный анализ продукта. % Азота, определенный с помощью элементного анализа конъюгата, составляет 6,6%, а по расчету, произведенному с использованием % азота 5,29% для продукта примера 7D, % нагрузки SOMATULINETM составляет 15%. Исследование in vivo: Конъюгат суспендируют в солевом растворе, содержащем твинR 20 (1%) и вводят в количестве 3,75 мг пептидного эквивалента на крысу. Уровни SOMATULINETM в плазме крысы, индуцированные этим конъюгатом, изменяются между максимальным значением 145429+/-122743 пг/мл и минимальным значением 500+/-159/мл в продолжение 10-дневного периода. Формула изобретения
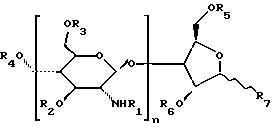 где заместитель R1 каждого отдельного повторяющегося звена выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R2 каждого отдельного повторяющегося звена выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R3 каждого отдельного повторяющегося звена выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R4 выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R5 выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R6 выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; заместитель R7 выбирают из группы, включающей СНО и СН2ОR8; заместитель R8 выбирают из группы, включающей первую ацильную группу, вторую ацильную группу и Н; n принимает значения 2 – 200; для 1 – 50% повторяющихся звеньев заместитель R1 представляет собой первую ацильную группу, а для 50 – 99% повторяющихся звеньев заместитель R1 представляет собой вторую ацильную группу, при условии, что для по меньшей мере одного из повторяющихся звеньев заместитель R1 представляет собой первую ацильную группу. 5. Сополимер по п.1, где первая ацильная группа представляет собой СОЕ1, где Е1 представляет собой С3-C33-карбоксиалкил. 6. Сополимер по п. 5, где первая ацильная группа представляет собой сукцинил. 7. Сополимер по п. 6, где вторая ацильная группа представляет собой ацетил, а R7 представляет собой СОН или СН2ОН. 8. Композиция, содержащая сополимер по п.1 и полипептид, причем указанный полипептид содержит, по меньшей мере, одну эффективную ионогенную аминогруппу, где указанный полипептид выбирают из группы, состоящей из рилизинг-пептида гормона роста, рилизинг-гормона лютеинизирующего гормона, соматостатина, бомбезина, рилизинг-пептида гастрина, кальцитонина, брадикинина, галанина, меланоцитостимулирующего гормона, рилизинг-фактора гормона роста, гормона роста, амилина, тахикининов, секретина, паратиреоидного гормона, энкефалина, эндотелина, рилизинг-пептида гена кальцитонина, нейромединов, связанного с паратиреоидным гормоном протеина, глюкагонов, нейротензина, адренокортикотропного гормона, пептида YY, рилизинг-пептида глюкагона, вазоактивного интестинального пептида, активирующего аденилатциклазу гипофиза пептида, мотилина, субстанции Р, нейропептида Y и тиреостимулирующего гормона, и где по меньшей мере 50 мас.% полипептида, присутствующего в композиции, ионно связано с указанным сополимером. 9. Композиция по п.9, включающая 5 – 50 вес.% полипептида. 10. Композиция по п. 9, где первая ацильная группа представляет собой сукцинил и вторая ацильная группа представляет собой ацетил. 11. Композиция, содержащая сополимер по п.4 и полипептид, причем указанный полипептид содержит, по меньшей мере, одну эффективную ионогенную аминогруппу, где указанный полипептид выбирают из группы, состоящей из рилизинг-пептида гормона роста, рилизинг-гормона лютеинизирующего гормона, соматостатина, бомбезина, рилизинг-пептида гастрина, кальцитонина, брадикинина, галанина, меланоцитостимулирующего гормона, рилизинг-фактора гормона роста, гормона роста, амилина, тахикининов, секретина, паратиреоидного гормона, энкефалина, эндотелина, рилизинг-пептида гена кальцитонина, нейромединов, связанного с паратиреоидным гормоном протеина, глюкагонов, нейротензина, адренокортикотропного гормона, пептида YY, рилизинг-пептида глюкагона, вазоактивного интестинального пептида, активирующего аденилатциклазу гипофиза пептида, мотилина, субстанции Р, нейропептида Y и тиреостимулирующего гормона и где, по меньшей мере, 50 мас.% полипептида, присутствующего в композиции, ионно связано с указанным сополимером. 12. Композиция по п.1, включающая 5 – 50 вес.% полипептида. 13. Композиция по п.12, где полипептид представляет собой соматостатин или аналог соматостатина. 14. Способ получения сополимера, который включает следующие стадии: взаимодействие хитозана со слабой кислотой с получением низкомолекулярного полисахарида; взаимодействие 1 – 50% свободных аминогрупп низкомолекулярного полисахарида с первым ацилирующим агентом, причем первый ацилирующий агент выбирают из группы, включающей C4-C34-поликарбоксиалкан, C4-C34-поликарбоксиалкен, C8-C40-поликарбоксиарилалкан, C10-C40-поликарбоксиарилалкен или их ацилирующие производные; взаимодействие 50 – 100% свободных аминогрупп низкомолекулярного полисахарида со вторым ацилирующим агентом, причем второй ацилирующий агент выбирают из группы, включающей C2-31-монокарбоксиалкан, C3-31-монокарбоксиалкен, C7-38-монокарбоксиарилалкан, C9-35-монокарбоксиарилалкен или их ацилирующие производные. 15. Способ по п.14, где процентное содержание проацилированных свободных аминогрупп определяют с помощью реагента на свободные аминогруппы. 16. Способ по п. 14, где первый ацилирующий агент представляет собой янтарный ангидрид, второй ацилирующий агент представляет собой уксусный ангидрид, а слабая кислота представляет собой азотистую кислоту. 17. Способ получения композиции, который включает следующие стадии: взаимодействие хитозана со слабой кислотой с получением низкомолекулярного полисахарида; взаимодействие 1 – 50% свободных аминогрупп низкомолекулярного полисахарида с первым ацилирующим агентом, причем первый ацилирующий агент выбирают из группы, включающей C4-C34-поликарбоксиалкан, C4-C34-поликарбоксиалкен, C8-C40-поликарбоксиарилалкан, C10-C40-поликарбоксиарилалкен или их ацилирующие производные; взаимодействие 50 – 100% свободных аминогрупп низкомолекулярного полисахарида со вторым ацилирующим агентом, причем второй ацилирующий агент выбирают из группы, включающей СООН, C2-31-монокарбоксиалкан, C3-31-монокарбоксиалкен, C7-38-монокарбоксиарилалкан, C9-35-монокарбоксиарилалкен или их ацилирующие производные; нейтрализацию ацилированного низкомолекулярного полисахарида основанием; и смешение нейтрализованного низкомолекулярного ацилированного полисахарида с солью полипептида, где указанная соль содержит, по меньшей мере, одну эффективную ионогенную аминогруппу, и где полипептид выбирают из группы, состоящей из рилизинг-пептида гормона роста, рилизинг-гормона лютеинизирующего гормона, соматостатина, бомбезина, рилизинг-пептида гастрина, кальцитонина, брадикинина, галанина, меланоцитостимулирующего гормона, рилизинг-фактора гормона роста, гормона роста, амилина, тахикининов, секретина, паратиреоидного гормона, энкефалина, эндотелина, рилизинг-пептида гена кальцитонина, нейромединов, связанного с паратиреоидным гормоном протеина, глюкагонов, нейротензина, адренокортикотропного гормона, пептида YY, рилизинг-пептида глюкагона, вазоактивного интестинального пептида, активирующего аденилатциклазу гипофиза пептида, мотилина, субстанции Р, нейропептида Y и тиреостимулирующего гормона, с образованием ионного конъюгата полипептид-сополимер. 18. Способ по п.17, где процентное содержание проацилированных свободных аминогрупп определяют с использованием реагента на свободные аминогруппы. 19. Способ по п.17, где первый ацилирующий агент представляет собой янтарный ангидрид, второй ацилирующий агент представляет собой уксусный ангидрид, а слабая кислота представляет собой азотистую кислоту. РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Номер и год публикации бюллетеня: 21-2003
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 23.05.2003 № 16756
Извещение опубликовано: 27.07.2003
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
(73) Патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 21.09.2005 № РД0002266
Извещение опубликовано: 20.11.2005 БИ: 32/2005
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 25.05.2007
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
