Патент на изобретение №2172314
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ ХЛОРПИРИДИЛКАРБОНИЛА И ИХ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ И СРЕДСТВО ДЛЯ БОРЬБЫ С ФИТОПАТОГЕННЫМИ ГРИБАМИ
(57) Реферат: Изобретение относится к новым производным хлорпиридилкарбонила формулы I, где Het – группа формулы а, b, с, d или е, R1 – водород, незамещенный или замещенный С1 – С6 алкил, причем заместители выбраны из группы, включающей галоид, фенил, циано, С1 – С4 алкокси, С1 – С4 алкилтио, С1 – С4 алкилкарбонил; С2 – С4 алкенил, незамещенный или замещенный С1 – С4 алкоксигруппами; фенил или незамещенный или замещенный 1 или 2 С1 – С4 алкоксигруппами, n = 1 или 2, и их кислотно-аддитивными солями. Соединения формулы I и их соли обладают фунгицидной активностью и могут быть использованы в сельском хозяйстве для борьбы с фитопатогенными грибами. Описывается также средство для борьбы с фитопатогенными грибами. 2 с. и 2 з.п.ф-лы, 2 табл. 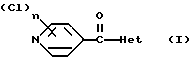 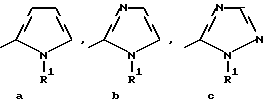 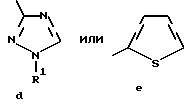
Изобретение относится к новым азотсодержащим гетероциклическим соединениям, обладающим биологической активностью, в частности к производным хлорпиридилкарбонила и их кислотно-аддитивным солям и средству для борьбы с фитопатогенными грибами. Известны производные пиразола и ацилимидазола, обладающие микробицидной, в частности фунгицидной активностью (см. опубликованные заявки JP N Sho 60-13764, Hei 6-65237 и Hei 8-53464, акцептованную заявку JP N Sho 51-7669, заявку DE N 1926206). Задачей изобретения является расширение ассортимента азотсодержащих гетероциклических соединений, обладающих фунгицидной активностью. Поставленная задача решается предлагаемыми производными хлорпиридилкарбонила формулы (I) 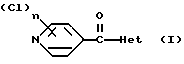 где Het – группа формулы 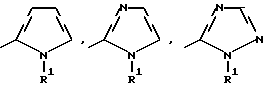 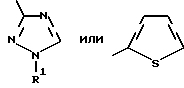 R1 – водород, незамещенный или замещенный алкил с 1-6 атомами углерода, причем заместители выбраны из группы, включающей галоид, фенил, циано, алкокси с 1 – 4 атомами углерода, алкилтио с 1 – 4 атомами углерода, алкилкарбонил с 1-4 атомами углерода; алкоксикарбонил с 1 – 4 атомами углерода, алкенил с 2 – 4 атомами углерода, незамещенный или замещенный алкоксигруппами с 1 – 4 атомами углерода; фенил или незамещенный или замещенный 1 или 2 алкоксигруппами с 1 – 4 атомами углерода пиримидинил; n – число 1 или 2, и их кислотно-аддитивными солями. Предпочтительными производными хлорпиридилкарбонила формулы (I) являются соединения, у которых Het – группа формулы 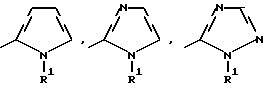 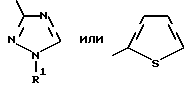 n – число 1; а атом хлора связан с положением 2 или 6 пиридильной группы, или n – число 2, а атомы хлора связаны с положениями 2 и 3 пиридильной группы, R1 – водород или алкил с 1 – 4 атомами углерода, незамещенный или замещенный 1 – 3 одинаковыми или различными заместителями, выбранными из группы, включающей галоид, фенил, циано, алкокси с 1 – 4 атомами углерода, алкилтио с 1 – 4 атомами углерода, алкилкарбонил с 1 – 4 атомами углерода, алкоксикарбонил с 1 – 4 атомами углерода; или R1 – алкенил с 2 – 4 атомами углерода, незамещенный или замещенный 1 – 3 одинаковыми или различными алкокси с 1 – 4 атомами углерода; или R1 – фенил или пиримидинил, незамещенный или замещенный 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей метокси и этокси. В частности, предпочитаются соединения формулы (I), где Het – группа формулы 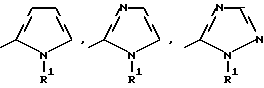 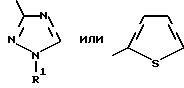 n – число 1, а атом хлора связан с положением 2 или 6 пиридильной группы, или n – число 2, а атомы хлора связаны с положениями 2 и 6 пиридильной группы, R1 – водород или алкил с 1 – 4 атомами углерода, незамещенный или замещенный 1 – 3 одинаковыми или различными заместителями, выбранными из группы, включающей фтор, хлор, фенил, циано, метокси, метилтио, метилкарбонил, трет.бутилкарбонил, метоксикарбонил, этоксикарбонил, или R1 – алкенил с 2 – 4 атомами углерода, незамещенный или замещенный 1 – 3 метоксигруппами, или R1 – фенил или пиримидинил, незамещенный или замещенный 1 или 2 метоксигруппами. Производные хлорпиридилкарбонила формулы (I), их кислотно-аддитивные соли можно получать способами-аналогами, например, а) путем взаимодействия хлорпиридилкарбонилгалоида формулы (II) 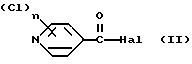 где n имеет вышеуказанное значение, и Hal означает галоид, с гетероциклическим соединением формулы (III) Het-H, (III) где Het – группа формулы 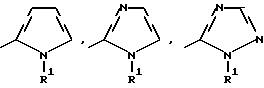 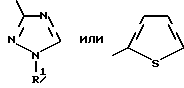 где R1 имеет вышеуказанное значение в присутствии инертного разбавителя и, в случае необходимости, в присутствии связывающего кислоту агента и, в случае необходимости, в присутствии катализатора, или б) путем взаимодействия производных хлорпиридилкарбонила формулы (I’) 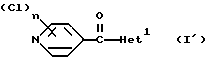 где n имеет вышеуказанное значение, и Het1 – группа формулы 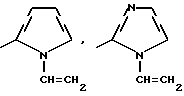 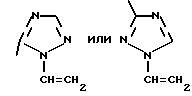 с йодной кислотой или солью йодной кислоты в присутствии двуокиси осмия и инертного разбавителя, или в) путем взаимодействия производных хлорпиридилкарбонила формулы (I”) 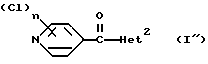 где n имеет вышеуказанное значение, и Het2 – группа формулы 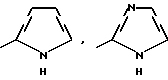 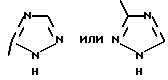 с галоидным соединением формулы R2Hal, (IV) где Hal имеет вышеуказанное значение, R2 имеет значения радикала R1 за исключением водорода, в присутствии инертного разбавителя и, в случае необходимости, в присутствии связывающего кислоту агента и, в случае необходимости, в присутствии катализатора. Целевой продукт выделяют в свободном виде или в виде кислотно-аддитивной соли. Для солеобразования предпочтительно применяют галоидводородные кислоты, такие, как, например, хлористоводородная кислота или бромистоводородная кислота, в частности хлористоводородная кислота, фосфорную кислоту, азотную кислоту, серную кислоту, моно- и бифункциональные карбоновые кислоты и оксикарбоновые кислоты, такие, как, например, уксусная кислота, малеиновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, салициловая кислота, сорбиновая кислота и молочная кислота, сульфоновые кислоты, такие, как, например, n- толуолсульфоновая кислота, 1,5-нафталендисульфоновая кислота или камфарсульфокислота, а также сахарин и тиосахарин. В случае применения в качестве исходных соединений хлорангидрида 2,6-дихлоризоникотиновой кислоты и 1-метил-1,2,4- триазола способ (а) протекает по следующей реакционной схеме: 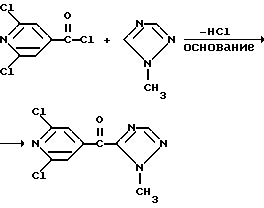 Если в качестве исходного соединения применяют 5-(2′,6′- дихлор-4′-пиридилкарбонил)-1-этенил-1,2,4-триазол, а в качестве окислителя – перйодат натрия в присутствии двуокиси осмия, то способ (б) протекает по следующей реакционной схеме: 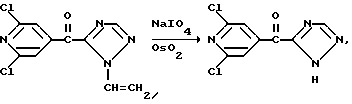 В случае применения в качестве исходных соединений 2-(2′,6′- дихлор-4′-пиридилкарбонил)-имидазола и изопропилбромида способ (в) протекает по следующей реакционной схеме: 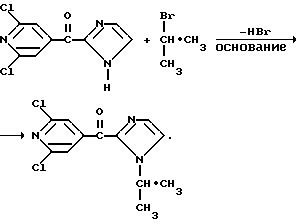 Хлорпиридилкарбонилгалоиды формулы (II), гетероциклические соединения формулы (III) и галоидные соединения формулы (IV) известны и их можно получать известными способами. Производные хлорпиридилкарбонила формулы (I’) можно получать вышеупомянутым способом (а), а производные формулы (I”) можно получать вышеупомянутым способом (б). В качестве разбавителей при проведении способа (а) можно применять все общепринятые в таких реакциях инертные органические растворители. Предпочтительно применяют следующие растворители: нехлорированные или хлорированные алифатические, алициклические и ароматические углеводороды, такие, как, например, пентан, гексан, циклогексан, петролейный эфир, лигроин, бензол, толуол, ксилол, дихлорметан, хлороформ, тетрахлорметан, 1,2-дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие, как, например, простой диэтиловый эфир, простой метилэтиловый эфир, простой диизопропиловый эфир, простой дибутиловый эфир, диоксан, диметоксиэтан, тетрагидрофуран и простой диметиленгликольдиметиловый эфир; кетоны, такие, как, например, ацетон, метилэтилкетон, метилизопропилкетон и метилизобутилкетон; нитрилы, такие, как, например, ацетонитрил и пропионитрил; сложные эфиры, такие, как, например, сложный этиловый эфир уксусной кислоты и сложный амиловый эфир уксусной кислоты; амиды кислоты, такие, как, например, диметилформамид, диметилацетамид, N- метилпирролидон, 1,3-диметил-2-имидазолидинон и гексаметилфосфортриамид; сульфоны и сульфоксиды, такие, как, например, диметилсульфоксид и сульфолан; основания, например, пиридин, а также нитрометан. Способ (а) можно осуществлять в присутствии связывающего кислоту агента и катализатора, если используются гетероциклические соединения формулы (III), где Het означает имидазолильную, 1,2,4- триазолильную, тиазолильную, бензотиазолильную или бензоимидазолильную группу. Пригодные связывающие кислоту агенты представляют собой органические основания, такие, как, например, третичные амины, диалкиламиноанилины и пиридины, такие, как, например, триэтиламин, 1,1,4,4-тетраметилэтилендиамин, N,N-диметиланилин, N,N-диэтиланилин, пиридин, 4-диметиламинопиридин, 1,4-диазабицикло[2,2,2] октан и 1,8-диазабицикло[5,4,0] ундец-6-ен. Примеры пригодных катализаторов представляют собой: соли четвертичного аммония, такие, как, например, бромид тетраметиламмония, бромид тетрапропиламмония, бромид тетрабутиламмония, бисульфат тетрабутиламмония, йодид тетрабутиламмония, хлорид триоктилметиламмония, бромид бензилтриэтиламмония, бромид бутилпиридиния, бромид гептилпиридиния и хлорид бензилтриэтиламмония; а также сложные крауновые эфиры, такие, как, например, дибензо-18-краун-6, дициклогексил-18-краун-6, 18-краун-6, [2,2,2] -криптат, [2,1,1] -криптат, [2,2,1]-криптат, [2,2,3]-криптат, [3,2,2]-криптат. Способ (а) можно осуществлять в присутствии кислоты Льюиса в качестве катализатора, если применяют гетероциклические соединения формулы (III), в которых Het означает тиенильную, фурильную или пирролильную группу. Примерами пригодных кислот Льюиса являются: хлорид алюминия, пятихлористая сурьма, хлорид железа (III), хлорид олова (IV), тетрахлорид титана, хлорид цинка, фтористый водород, фтористый бор, фосфорная кислота и полифосфорная кислота. При проведении способа (а) температуру реакции можно варьировать в широких пределах. Реакцию обычно осуществляют при температуре от примерно -76oC до примерно +150oC, предпочтительно от 0oC до примерно 120oC. Способ (а) обычно осуществляют при атмосферном давлении, однако, осуществление реакции возможно и при повышенном или пониженном давлении. При проведении способа (а), как правило, 1 моль хлорпиридилкарбонилгалоида формулы (II) подвергают взаимодействию с 0,1 – 10 моль гетероциклического соединения формулы (III), причем реакцию осуществляют в присутствии разбавителя и, в случае необходимости, в присутствии связывающего кислоту агента и/или катализатора. Продукт перерабатывают обычными способами. В качестве разбавителей при проведении способа (б) можно применять все общепринятые в таких реакциях инертные органические растворители. Предпочтительно применяют следующие растворители: нехлорированные или хлорированные алифатические, алициклические и ароматические углеводороды, такие, как, например, пентан, гексан, циклогексан, петролейный эфир, лигроин, бензол, толуол, ксилол, дихлорметан, хлорбензол и дихлорбензол; простые эфиры, такие, как, например, простой диэтиловый эфир, простой метилэтиловый эфир, простой диизопропиловый эфир, простой дибутиловый эфир, диоксан, диметоксиэтан, тетрагидрофуран и простой диметиленгликольдиметиловый эфир; кетоны, такие, как, например, ацетон, метилэтилкетон, метилизопропилкетон и метилизобутилкетон; нитрилы, такие, как, например, ацетонитрил и пропионитрил; спирты, такие, как, например, метанол, этанол, изопропанол, бутанол и этиленгликоль; сложные эфиры, такие, как, например, сложный этиловый эфир уксусной кислоты и сложный амиловый эфир уксусной кислоты; амиды кислоты, такие, как, например, диметилформамид, диметилацетамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и гексаметилфосфортриамид; сульфоны и сульфоксиды, такие, как, например, диметилсульфоксид и сульфолан; а также основания, например, пиридин. Возможно также применение в качестве разбавителя смеси воды и смешивающегося с водой органического растворителя, такого, как, например, диоксан. При проведении способа (б) температуру реакции можно варьировать в широких пределах. Реакцию обычно осуществляют при температуре от примерно -70oC до примерно +150oC, предпочтительно от 20oC до примерно 120oC. Способ (б) обычно осуществляют при атмосферном давлении, однако, осуществление реакции возможно и при повышенном или пониженном давлении. При проведении способа (б), как правило, 1 моль хлорпиридилкарбонилгалоида формулы (I’) подвергают взаимодействию с 2-20 моль йодной кислоты или ее соли, причем реакцию осуществляют в присутствии двуокиси осмия и разбавителя. Продукт перерабатывают обычными методами. В качестве разбавителей при проведении способа (в) можно применять все общепринятые в таких реакциях инертные органические растворители. Предпочтительно применяют следующие растворители: нехлорированные или хлорированные алифатические, алициклические и ароматические углеводороды, такие, как, например, пентан, гексан, циклогексан, петролейный эфир, лигроин, бензол, толуол, ксилол, дихлорметан, хлороформ, тетрахлорметан, 1,2-дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие, как, например, простой этиловый эфир, простой метилэтиловый эфир, простой изопропиловый эфир, простой бутиловый эфир, диоксан, диметоксиэтан, тетрагидрофуран и простой диэтиленгликольдиметиловый эфир; нитрилы, такие, как, например, ацетонитрил и пропионитрил; спирты, такие, как, например, метанол, этанол, изопропанол, бутанол и этиленгликоль; сложные эфиры, такие, как, например, сложный этиловый эфир уксусной кислоты и сложный амиловый эфир уксусной кислоты; амиды кислоты, такие, как, например, диметилформамид, диметилацетамид, N- метилпирролидон, 1,3-диметил-2-имидазолидинон и гексаметилфосфортриамид; сульфоны и сульфоксиды, такие, как, например, диметилсульфоксид и сульфолан: а также основания, например, пиридин. Пригодные для проведения способа (в) связывающие кислоту агенты представляют собой обычные органические основания. Предпочтительно применяют такие связывающие кислоту агенты, как, например, третичные амины, диалкиламиноанилины и пиридины, такие, как, например, триэтиламин, 1,1,4,4-тетраметил-этилендиамин, N, N- диметиланилин, N,N-диэтиланилин, пиридин, 4-диметиламинопиридин, 1,4-диазабицикло[2,2,2]октан и 1,8-диазабицикло[5,4,0]-ундец-6-ен. Способ (в) можно осуществлять в присутствии обычного в таких реакциях катализатора. Примеры предпочтительно применяемых катализаторов представляют собой: соли четвертичного аммония, такие, как, например, бромид тетраметиламмония, бромид тетрапропиламмония, бромид тетрабутиламмония, бисульфат тетрабутиламмония, йодид тетрабутиламмония, хлорид триоктилметиламмония, бромид бензилтриэтиламмония, бромид бутилпиридиния, бромид гептилпиридиния и хлорид бензилтриэтиламмония: а также сложные крауновые эфиры, такие, как, например, дибензо-18-краун-6, дициклогексил-18-краун-6, 18-краун-6, [2,2,2] -криптат, [2,1,1]- криптат, [2,2,1]-криптат, [2,2,3]-криптат, [3,2,2]-криптат. При проведении способа (в) температуру реакции можно варьировать в широких пределах. Реакцию обычно осуществляют при температуре от примерно -76oC до примерно +50oC, предпочтительно от 0oC до примерно 120oC. Способ (в) обычно осуществляют при атмосферном давлении, однако, осуществление реакции возможно и при повышенном или пониженном давлении. При проведении способа (в), как правило, 1 моль производного хлорпиридилкарбонила формулы (I”) подвергают взаимодействию с 0,1 – 10 моль галоидного соединения формулы (IV), причем реакцию осуществляют в присутствии разбавителя и, в случае необходимости, в присутствии связывающего кислоту агента и катализатора. Продукт перерабатывают обычными методами. Кислотно-аддитивные соли производных хлорпиридилкарбонила формулы (I) можно получать обычными способами солеобразования, например, путем растворения соединения формулы (I) в подходящем инертном растворителе и добавления кислоты, такой, как, например, хлористоводородная кислота, и их можно выделять известным путем, например фильтрацией, и, в случае необходимости, очищать путем промывки инертным органическим растворителем. Благодаря фунгицидной активности предлагаемые соединения можно использовать для борьбы с фитопатогенными грибками, такими, как, например, плазмодиофоромицеты, оомицеты, хитридиомицеты, аскомицеты, цигомицеты, базидиомицеты и дейтромицеты. Таким образом, дальнейшим объектом изобретения является средство для борьбы с фитопатогенными грибами, содержащее по меньшей мере один носитель и активное вещество, при этом в качестве активного вещества оно содержит соединение формулы (Iа) 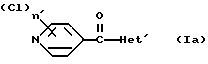 где Het’ – группа формулы 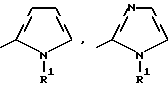 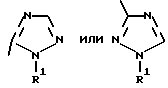 R1 – водород, незамещенный или замещенный алкил с 1 – 6 атомами углерода, причем заместители выбраны из группы, включающей галоид, фенил, циано, алкокси с 1 – 4 атомами углерода, алкилтио с 1 – 4 атомами углерода, алкилкарбонил с 1 – 4 атомами углерода, алкоксикарбонил с 1 – 4 атомами углерода, алкенил с 2 – 4 атомами углерода, незамещенный или замещенный алкоксигруппами с 1 – 4 атомами углерода; фенил или незамещенный или замещенный 1 или 2 алкоксигруппами с 1 – 4 атомами углерода пиримидинил; n – число 1 или 2 или его кислотно-аддитивную соль в эффективном количестве. Хорошая переносимость растениями предлагаемых соединений формулы (I’) в концентрации, необходимой для борьбы с фитопатогенными грибами, позволяет производить обработку частей растений над землей, материала для вегетативного размножения и семян, а также почвы. Предлагаемые активные соединения формулы (Iа) (далее: “активные вещества”) могут быть переведены в обычные препараты, такие, как растворы, эмульсии, смачиваемые порошки, суспензии, порошки, пены, пасты, гранулы, таблетки, аэрозоли, пропитанные активным соединением натуральные и синтетические вещества, полимерные микрокапсулы, применяемые в качестве оболочки семени композиции, применяемые с зажигательными устройствами препараты, такими, как, например, дымокурные патроны, банки и катушки, а также холодные или горячие аэрозольные препараты, предназначенные для распределения в ультранизком объеме. Эти препараты получают известными приемами, например, перемешением активного вещества с наполнителями, т.е. жидкими или сжиженными газовыми или твердыми растворителями или носителями, при необходимости, с применением поверхностно-активных средств, т. е. эмульгаторов и/или диспергаторов и/или вспенивателей. При применении воды в качестве наполнителя возможно и использование органических растворителей в качестве вспомогательных растворителей. В качестве жидких растворителей разбавителей или носителей применяют в основном ароматические углеводороды, как ксилол, толуол или алкилнафталины, хлорированные ароматические или алифатические углеводороды, как хлорбензолы, хлорэтилены или метиленхлорид, алифатические углеводороды, как циклогексан или парафины, например, нефтяные фракции, спирты, как бутанол или гликоль, а также их простые и сложные эфиры, кетоны, как ацетон, метилэтилкетон, метилизобутилкетон или циклогексанон, сильно полярные растворители, как диметилформамид и диметилсульфоксид, а также воду. Под сжиженными газовыми разбавителями или носителями понимают жидкости, которые при нормальной температуре и атмосферном давлении газообразны, например, аэрозольные пропелленты, такие, как, например, галогенированные углеводороды, а также бутан, пропан, азот и двуокись углерода. В качестве твердых носителей применяют измельченные природные минералы, такие, как каолины, глины, тальк, мел, кварц, аттапульгит, монтмориллонит или диатомовая земля, а также измельченные синтетические минералы, такие, как высокодисперсная кремневая кислота, окись алюминия и силикаты. В качестве твердых носителей для гранул применяют, например, раздробленные и фракционированные природные камни, такие, как кальцит, мрамор, пемза, сепиолит, доломит, а также синтетические гранулы из неорганической и органической муки, а также гранулы из органического материала, такого, как опилки, кокосовая кожура, початки кукурузы и стебли табака. В качестве эмульгатора и/или вспенивателя применяют, например, неионогенные и анионные эмульгаторы, такие, как сложные полиоксиэтиленовые эфиры кислоты жирного ряда, простые полиоксиэтиленовые эфиры спирта жирного ряда, например, простые алкиларилполигликолевые эфиры, алкилсульфонаты, алкилсульфаты, арилсульфонаты, а также белковые гидролизаты. В качестве диспергатора применяют, например, лигнинсульфитный отработанный щелок и метилцеллюлозу. В препаратах можно также использовать адгезивы, такие, как, например, карбоксиметилцеллюлоза, а также природные и синтетические полимеры в виде порошка или гранул, такие, как гуммиарабик, поливиниловый спирт и поливинилацетат. Препараты могут также содержать красители, такие, как неорганические пигменты, например, окись железа, окись титана, прусская лазурь, и органические красители, как ализариновые, азо- и металлфталоцианиновые красители, а также микроэлементы, такие, как соли металлов, например, соли железа, марганца, бора, меди, кобальта, молибдена и цинка. Препараты содержат, как правило, 0,1 – 95 вес.%, предпочтительно 0,5 – 90 вес.% активного вещества. Предлагаемые активные вещества могут применяться в препаратах или разных рабочих формах в виде смеси с другими известными активными веществами, такими, как, например, фунгициды, бактерициды, инсектициды, акарициды, нематициды, гербициды, отпугивающие птицы репелленты, стимуляторы роста, питательные вещества и средства для улучшения качества почвы. Активные вещества могут применяться как таковые или в виде полученных разбавлением препаратов или готовых к применению форм, таких, как, например, готовые к применению растворы, эмульсии, суспензии, порошки, пасты, гранулы. Они применяются обычным способом, таким, как, например, поливка, погружение, распыление, опрыскивание, испарение, впрыскивание, образование суспензии, нанесение щеткой, опыление, разбрасывание, нанесение препарата в сухом, влажном или жидком состоянии или в виде суспензии, нанесение покрытия. При обработке частей растений концентрация активного начала в препаратах можно варьировать в широком диапазоне. Обычно применяют 1-0,0001 вес.%, предпочтительно 0,5-0,001 вес.%. При обработке семян обычно применяют 0,001-50 г, в частности 0,01-10 г активного вещества на килограмм семян. При обработке почвы обычно применяют концентрацию активного начала в месте обработки, равную 0,00001-0,1 вес.%, в частности 0,0001-0,02 вес.%. Получение соединений формулы (I) поясняется следующими примерами. Пример 1 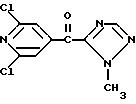 4,4 г пиридина подают в раствор 4,15 г 1-метил-1,2,4- триазола в 300 мл дихлорметилена. При перемешивании и охлаждении льдом в раствор по каплям подают 10,6 г хлорангидрида 2,6- дихлоризоникотиновой кислоты. Реакционную смесь перемешивают при комнатной температуре в течение 8 ч. После окончания реакции реакционную смесь последовательно промывают водным 3%-ным раствором соляной кислоты, водным 3%-ным раствором гидроокиси натрия и водой. Органический слой сушат над безводным сульфатом натрия, сгущают при пониженном давлении, а получаемый остаток очищают путем колоночной хроматографии на силикагеле с применением хлороформа в качестве элюента. Получают 4,7 г 5-(2′,6′-дихлор-4′-пиридилкарбонил)-1-метил- 1,2,4-триазола с точкой плавления 130,5 – 131,5oC. Пример 2 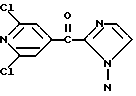 5,1 г триэтиламина подают в раствор 1,7 г имидазола в 10 мл пиридина. С перемешиванием при температуре 0 – 10oC в раствор по каплям подают 10,6 г хлорангидрида 2,6-дихлоризоникотиновой кислоты. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч. Затем в реакционную смесь подают водный 7,5 н. раствор гидроокиси натрия, и смесь нагревают с обратным холодильником в течение 1 ч. После окончания реакции добавляют воду, и реакционную смесь охлаждают. Выпадают кристаллы, которые собирают путем фильтрации. Получают 5,2 г 2-(2′,6′-дихлор-4′-пиридилкарбонил)- имидазола с точкой плавления 173,5 – 175oC. Пример 3 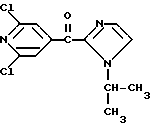 1,5 г безводного карбоната калия и 1,23 г изопропилбромида подают в раствор 2,42 г 2-(2′,6′-дихлор-4′- пиридилкарбонил)-имидазола в 50 мл ацетонитрила. Смесь в течение 6 ч нагревают с обратным холодильником. После окончания реакции добавляют воду и экстрагируют метиленхлоридом. Органический слой сушат над безводным сульфатом натрия, сгущают при пониженном давлении, а получаемый при этом остаток очищают путем колоночной хроматографии на силикагеле с применением хлороформа в качестве элюента. Получают 1,8 г 2-(2′,6′-дихлор-4′-пиридилкарбонил)-1- изопропилимидазола. Показатель преломления nD20: 1,5820. Пример 4 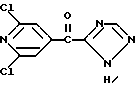 2,69 г 5-(2′,6′-дихлорпиридилкарбонил)-1-винил-1,2,4- триазола с перемешиванием при комнатной температуре подают в раствор 4,3 г перйодата натрия и 0,05 г двуокиси осмия в смеси 70 мл диоксана и 20 мл воды. Смесь в течение ночи перемешивают при комнатной температуре. После окончания реакции добавляют воду и экстрагируют метиленхлоридом. Органический слой сушат над безводным сульфатом натрия, сгущают при пониженном давлении, а получаемый при этом остаток очищают путем колоночной хроматографии на силикагеле с применением хлороформа в качестве элюента. Получают 1,7 г 3-(2′,6′-дихлорпиридилкарбонил)-1,2,4- триазола с точкой плавления 155-158oC. Пример 5 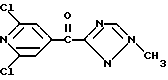 1,5 г безводного карбоната калия и 1,4 г метилйодида подают в раствор 2,41 г 3-(2′, 6′- дихлорпиридилкарбонил)-1,2,4- триазола в 50 мл ацетонитрила. Смесь в течение 6 ч нагревают с обратным холодильником. После окончания реакции добавляют воду и экстрагируют метиленхлоридом. Органический слой сушат над безводным сульфатом натрия, сгущают при пониженном давлении, а получаемый при этом остаток очищают путем колоночной хроматографии на силикагеле с применением хлороформа в качестве элюента. Получают 1,5 г 3-(2′,6′-дихлорпиридилкарбонил)-1-метил- 1,2,4-триазола с точкой плавления 203 – 206oC. Пример 6 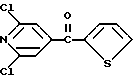 2,6 г безводного тетрахлорида олова подают в раствор 2,1 г 2,6-дихлорпиримидин-4-карбонилхлорида и 3 г тиофена в 30 мл нитрометана при комнатной температуре. Смесь в течение 5 ч нагревают с обратным холодильником. После окончания реакции смесь подают в 50 г ледяной воды и 10 мл соляной кислоты, затем трижды экстрагируют метиленхлоридом, взятым в количестве по 50 мл. Органический слой промывают водой и сушат над безводным сульфатом натрия. Растворитель отгоняют и сырой продукт очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента смеси толуола и хлороформа в соотношении 1:1. Получают 1 г 2-(2′,6′-дихлор-4′-пиридилкарбонил)-тиофена с точкой плавления 129 – 130oC. В таблице 1 сведены соединения формулы (I), получаемые вышеупомянутыми способами. Указанные в таблице 1 гетероциклические радикалы поясняются в конце таблицы. Фунгицидная активность соединений формулы (Ia) поясняется следующими примерами. Пример 7: Тест распыляемого на листья препарата на активность против пирикуляриоза риса Подготовка содержащих испытуемые соединения препаратов: Активное вещество: 30 – 40 вес.ч. Носитель: смесь диатомовой земли и каолина в соотношении 1:5, 55 – 65 вес.ч. Эмульгатор: простой полиоксиэтиленалкилфениловый эфир, 5 вес. ч. Смачивающиеся порошки получают путем измельчения в порошок и смешивания активного вещества, носителя и эмульгатора, взятых в вышеуказанных количествах. Содержащую указанное количество активного вещества часть смачивающегося порошка разбавляют водой и подвергают описанному в следующем опыту. Осуществление опыта: Сеянцы риса (культивар: Kusabue) выращивают в виниловых горшочках диаметром 6 см. Разбавленный до указанной концентрации раствор активного вещества, взятый в количестве 25 мл на 3 горшка, распыляют на листья сеянцев, достигнутых стадии 1,5 листьев. Через 10 дней после обработки активным веществом суспензию искусственно культивированных спор Pyricularia oryzae распыляют на сеянцы, которые для поражения хранят при температуре 25oC и 100% относительной влажности воздуха. Через 7 дней после инокуляции определяют степень поражения растений в каждом сосуде и оценивают ее по нижеприведенным критериям. Подсчитывают контрольное значение (%). Одновременно проверяют фитотоксичность. Результаты сведены в нижеследующей таблице 2. Указания в таблице 2 являются средними значениями результатов 3 горшков. Степень поражения – Процент пораженной области (%) 0 – 0 0,5 – < 2 1 – 2 – <5 2 – 5 – <10 3 – 10 – <20 4 – 20 – <40 5 –  40 40Контрольное значение (%) = (1-(степень поражения обработанных растений – степень поражения необработанных растений))  100.
Примечание: В примерах 7 – 10 используют одни и те же методы оценки степени поражения и расчета контрольного значения 100.
Примечание: В примерах 7 – 10 используют одни и те же методы оценки степени поражения и расчета контрольного значенияПример 8: Тест апплицируемого на поверхность воды препарата на активность против пирикуляриоза риса Осуществление теста: Сеянцы риса (культивар: Kusabue) на стадии 1,5 листьев пересаживают в орошенные пластмассовые горшочки площадью 100 см2, один сеянец в каждый горшочек. Через 7 дней после пересаживания, когда сеянцы находятся в стадии 3 – 4 листьев, препарат разбавленного до указанной концентрации активного вещества, полученного описанным в примере 7 способом, в количестве 10 мл/сосуд пипеткой по каплям подают на поверхность воды. Через 20 дней после химической обработки суспензию искусственно культивированных спор пирикуляриоза риса (грибок пирикуляриозы расы C) распыляют на сеянцы, которые для поражения в течение 12 ч хранят в инокуляционном ящике при температуре 25oC и 100% относительной влажности воздуха, а затем в теплице. Через 10 дней после инокуляции определяют степень поражения растений в каждом сосуде. Подсчитывают контрольное значение (%). Одновременно проверяют фитотоксичность. Результаты сведены в нижеследующей таблице 2. Пример 9: Тест распыляемого на листья препарата на активность против фитофтороза томата Подготовка содержащих испытуемые соединения препаратов: Активное вещество: 30 – 40 вес.ч. Носитель: смесь диатомовой земли и каолина в соотношении 1:5, 55 – 65 вес.ч. Эмульгатор: простой полиоксиэтиленалкилфениловый эфир, 5 вес.ч. Смачивающиеся порошки получают путем измельчения в порошок и смешивания активного вещества, носителя и эмульгатора, взятых в вышеуказанных количествах. Содержащую указанное количество активного вещества часть смачивающегося порошка разбавляют водой и подвергают описанному в следующем опыту. Осуществление опыта: По примерно 5 семен томата (культивар: Kurihara) засеивают в виниловые горшки диаметром 7 см и выращивают в теплице при температуре 15 – 25oC. Препарат разбавленного до указанной концентрации подопытного соединения в количестве 25 мл на 3 горшка распыляют на маленькие сеянцы, достигнутые стадии 4 листьев. Через 10 дней после распыления зооспорангии на пораженных областях, предварительно инфицированных возбудителем Phytophthora infestans, кистью смывают в дистиллированную воду с тем, чтобы подготовить суспензию. Суспензию распыляют на обработанные растения, которые затем хранят в теплице при температуре 15 – 20oC. Через 7 дней после инокуляции определяют степень поражения в каждом горшке и подсчитывают контрольное значение. Результаты являются средними значениями результатов 3 горшков. Одновременно проверяют фитотоксичность. Результаты сведены в таблице 2. Пример 10: Тест распыляемого на листья препарата на активность против настоящей мучнистой росы ячменя Осуществление опыта: По примерно 10 зерен ячменя (культивар: Haruna 2jo) засеивают в виниловые горшки диаметром 7 см и выращивают в теплице при температуре 15 – 25oC. Препарат разбавленного до указанной концентрации подопытного соединения, полученного аналогичным примеру 9 способом, в количестве 25 мл на 3 горшка распыляют на маленькие сеянцы, достигнутые стадии 2 листьев. Через 5 дней после распыления конидиоспоры на пораженных областях, предварительно инфицированных возбудителем Erysiphe graminis, разбрызгивают на обработанные ячменные листья. Растения хранят в теплице при температуре 15 – 20oC. Через 7 дней после инокуляции определяют степень поражения растений в каждом горшке и подсчитывают контрольное значение. Результаты являются средними значениями результатов 3 сосудов. Одновременно проверяют фитотоксичность. Результаты сведены в таблице 2. Формула изобретения
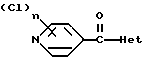 где Het – группа формулы 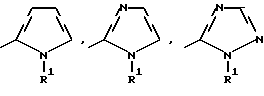 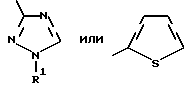 R1 – водород, незамещенный или замещенный алкил с 1 – 6 атомами углерода, причем заместители выбраны из группы, включающей галоид, фенил, циано, алкокси с 1 – 4 атомами углерода, алкилтио с 1 – 4 атомами углерода, алкилкарбонил с 1 – 4 атомами углерода, алкоксикарбонил с 1 – 4 атомами углерода; алкенил с 2 – 4 атомами углерода, незамещенный или замещенный алкоксигруппами с 1 – 4 атомами углерода; фенил или незамещенный или замещенный 1 или 2 алкоксигруппами с 1 – 4 атомами углерода пиримидинил; n = 1 или 2, и их кислотно-аддитивные соли. 2. Производные хлорпиридилкарбонила формулы I по п.1, где Het – группа формулы 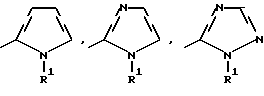 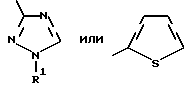 n = 1, а атом хлора связан с положением 2 или 6 пиридильной группы, или n = 2, а атомы хлора связаны с положениями 2 и 6 пиридильной группы; R1 – водород, алкил с 1 – 4 атомами углерода, незамещенный или замещенный 1 – 3 одинаковыми или различными заместителями, выбранными из группы, включающей галоид, фенил, циано, алкокси с 1 – 4 атомами углерода, алкилтио с 1 – 4 атомами углерода, алкилкарбонил с 1 – 4 атомами углерода, алкоксикарбонил с 1 – 4 атомами углерода; или R1 – алкенил с 2 – 4 атомами углерода, незамещенный или замещенный 1 – 3 одинаковыми или различными алкокси с 1 – 4 атомами углерода; или R1 – фенил или пиримидинил, незамещенный или замещенный 1 или 2 одинаковыми или различными заместителями, выбранными из группы, включающей метокси и этокси. 3. Производные хлорпиридилкарбонила формулы I по п.1, где Het – группа формулы 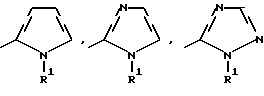 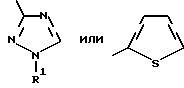 n = 1, а атом хлора связан с положением 2 или 6 пиридильной группы, или n = 2, а атомы хлора связаны с положениями 2 и 6 пиридильной группы; R1 – водород или алкил с 1 – 4 атомами углерода, незамещенный или замещенный 1 – 3 одинаковыми или различными заместителями, выбранными из группы, включающей галоид, фенил, циано, метокси, метилтио, метилкарбонил, трет. бутилкарбонил, метоксикарбонил, этоксикарбонил, или R1 – алкенил с 2 – 4 атомами углерода, незамещенный или замещенный 1 – 3 метоксигруппами, или R1 – фенил или пиримидинил, незамещенный или замещенный 1 или 2 метоксигруппами. 4. Средство для борьбы с фитопатогенными грибами, содержащее по меньшей мере один носитель и активное вещество, отличающееся тем, что в качестве активного вещества оно содержит соединение формулы Iа 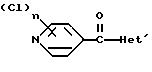 где Het – группа формулы 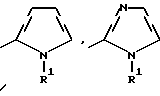 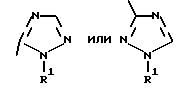 R1 – водород, незамещенный или замещенный алкил с 1 – 6 атомами углерода, причем заместители выбраны из группы, включающей галоид, фенил, циано, алкокси с 1 – 4 атомами углерода, алкилтио с 1 – 4 атомами углерода, алкилкарбонил с 1 – 4 атомами углерода, алкоксикарбонил с 1 – 4 атомами углерода; алкенил с 2 – 4 атомами углерода, незамещенный или замещенный алкоксигруппами с 1 – 4 атомами углерода; фенил или незамещенный или замещенный 1 или 2 алкоксигруппами с 1 – 4 атомами углерода пиримидинил; n = 1 или 2, или его кислотно-аддитивную соль в эффективном количестве. Приоритет по признакам: 13.09.1995 – Het представляет собой пятичленное гетероциклическое кольцо, содержащее 1 – 3 атома азота; 21.06.1996 – Het представляет собой тиенил. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 14.09.2001
Номер и год публикации бюллетеня: 5-2004
Извещение опубликовано: 20.02.2004
|
||||||||||||||||||||||||||
