Патент на изобретение №2172167
|
||||||||||||||||||||||||||
(54) КОМПОЗИЦИЯ ДЛЯ УХОДА ЗА КОЖЕЙ, КОСМЕТИЧЕСКИЕ СПОСОБЫ УХОДА ЗА КОЖЕЙ
(57) Реферат: Изобретение относится к медицине, к композиции для ухода за кожей, содержащей 0,001-10,0% ретинола или его сложного эфира, 0,0001-50,0% ингибитора реакции этерификации ретинола и носитель. Композиция потенцирует действие ретинола. Заявлен также способ ухода за кожей путем нанесения предложенной композиции. 3 с. и 3 з.п. ф-лы, 21 табл. Изобретение относится к композициям для ухода за кожей, содержащим некоторые соединения в комбинации с ретинолом и/или ретиниловым сложным эфиром, а также к косметическим способам, предусматривающим нанесение этих композиций на кожу. Предпосылки создания изобретения Ретинол (витамин А) представляет собой эндогенное соединение, которое в естественных условиях присутствует в организме человека, и имеет важное значение для нормальной дифференцировки эпителиальных клеток. Природные и синтетические производные витамина А широко применяются для лечения ряда кожных нарушений, а также используются в качестве средств для восстановления биологических функций кожи или для обновления клеток кожи. Ретиноевая кислота используется для лечения ряда состояний кожи, например, акне (угри), морщины, псориаз, старческие пятна и депигментация (обесцвечивание кожи). См., например Vahlquist, A. et al., J.Invest. Dermatol., Vol.94, Holland D.B. & Cunliffe, W. J. (1990), pp. 496-498; Ellis, C.N. et а1., “Pharmacology of Retinols in Scin”, Vasel, Karger, Vol.3 (1989), pp.249-252; Lowe, N.J. et al., “Pharmacology of Retinols in Skin”, Vol.3 (1989), pp.240-248; публикация PCT заявки N WO 93/19743. Очевидно, что использование ретинола или сложных эфиров ретинола предпочтительней, чем использование ретиноевой кислоты. Ретинол присутствует в организме человека в естественных условиях, а поэтому считается, что он более безопасен, чем ретиноевая кислота. Сложные эфиры ретинола гидролизуются in vivo с продуцированием ретинола. Очевидно, что в коже сложные эфиры ретинола и ретинол метаболически превращаются в ретиноевую кислоту в соответствии со следующим механизмом: 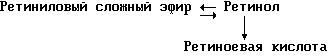 Однако, большая часть эндогенно введенного ретинола быстро превращается в неактивные сложные эфиры жирной кислоты, которые сохраняются в эпидермальных клетках (кератиноцитах). Такая этерификация ретинола в клетках с образованием неактивных ретиниловых сложных эфиров достигается путем переноса жирной ацильной группы из ацил-CoA, катализируемого ферментом ацил-CoA- ретинолтрансферазой (ARAT), либо путем переноса ацильной группы из фосфатидилхолина, катализируемого ферментом лецитин-ретинол- ацилтрансферазой (LRAT). Эти реакции этерификации являются очень эффективными в кератиноцитах, в результате чего большинство (95%) клеточных ретиноидов присутствуют в форме ретиниловых сложных эфиров жирной кислоты. Но, к сожалению, хотя ретинол и ретиниловые сложные эфиры являются более безопасными для использования, чем ретиноевая кислота, однако, их благоприятное действие на кожу является менее эффективным, чем действие ретиноевой кислоты. Настоящее изобретение, отчасти, основано на обнаружении того факта, что некоторые соединения ингибируют эти реакции этерификации и таким образом потенцируют действие ретинола путем увеличения количества присутствующего ретинола, превращающегося в ретиноевую кислоту. Таким образом, смесь этих соединений с ретинолом или ретиниловыми сложными эфирами имитирует действие ретиноевой кислоты, но является, в то же время, более безопасной для использования, чем ретиноевая кислота. Краткое описание изобретения Настоящее изобретение относится, отчасти, к композиции для ухода за кожей, содержащей: (а) от 0,001 до 10% соединения, выбранного из группы, состоящей из ретинола, ретинилового сложного эфира и их смесей; (b) от 0,0001 до 50% соединения, которое при концентрации 100 мкМ ингибирует, по крайней мере, на 20% LRAT- или ARAT-катализируемую реакцию этерификации ретинола, как было определено с помощью микросомного in vitro-анализа, описанного в настоящей заявке; где указанное соединение не является ни амидом жирной кислоты, ни диметилимидазолидиноном и где указанное соединение выбирают из группы, состоящей из циклических алифатических ненасыщенных углеводородов, дитерпенов, и гидроксиэтилимидазолиновых поверхностно-активных веществ с жирной цепью, имеющих следующую структуру: 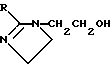 где R представляет собой алифатическую насыщенную или ненасыщенную, прямую или разветвленную углеводородную цепь, содержащую от 8 до 20 атомов углерода; и их смеси (с) косметически приемлемый носитель. Соединения настоящего изобретения, используемые в комбинации с ретинолом и/или ретиниловым сложным эфиром, выбирают исходя из их способности образовывать такие комбинации, которые имитируют действие ретиноевой кислоты на кожу. Другими словами, если данное соединение в достаточной степени ингибирует LRAT- или ARAT-катализируемую реакцию этерификации ретинола, как было определено с помощью микросомного in vitro-анализа, то в комбинации с ретинолом или ретиниловым сложным эфиром, оно будет оказывать действие на кератиноциты (клетки кожи), имитирующее действие ретиноевой кислоты. Настоящее изобретение, кроме того, обеспечивает косметический способ ухода за кожей, предусматривающий местное нанесение данной композиции на кожу. Настоящее изобретение также относится к косметическому способу имитации действия ретиноевой кислоты на кожу, предусматривающему местное нанесение данной композиции на кожу. Термин “кондиционирование”, используемый в настоящем описании, означает предупреждение и лечение сухости кожи, повреждения кожи под действием ультрафиолетового излучения, появления морщин, старческих пятен и увядания кожи. Эти композиции могут быть также использованы для повышения эластичности рогового слоя, отбеливания кожи, регуляции экскреции сальных желез, а в основном, для повышения качества кожи. Композиция настоящего изобретения может быть использована для улучшения отшелушивания кожи и эпидермальной дифференцировки. Присутствие выбранных соединений в композиции настоящего изобретения существенно повышает эффективность ретинола и ретинилового сложного эфира. В соответствии с настоящим изобретением, эффективность композиций существенно повышается благодаря включению в композиции, содержащие ретинол или ретиниловый сложный эфир, эффективного количества соединения, которое, при концентрации 100 мкМ, ингибирует, по крайней мере, на 20%, LRAT- или ARAT-катализируемую реакцию этерификации ретинола, как было определено в микросомном in vitro-анализе. Описание предпочтительного варианта осуществления изобретения Композиции настоящего изобретения содержат в качестве первого главного ингредиента соединение, выбранное из группы, состоящей из ретинола и ретинилового сложного эфира. Термин “ретинол” включает, среди прочих, следующие изомеры ретинола: полностью-транс-ретинол, 13-цис-ретинол, 11-цис-ретинол, 9-цис-ретинол, 3,4-дидeгидpo-peтинoл. Из них предпочтительными изомерами являются полностью-транс-ретинол, 13-цис-ретинол, 3,4-дидегидро-ретинол, 9-цис-ретинол. Наиболее предпочтительным является полностью-транс-ретинол, благодаря его широкой коммерческой доступности. Ретиниловый сложный эфир представляет собой сложный эфир ретинола. Термин “ретинол” был определен выше. Ретиниловыми сложными эфирами, подходящими для использования в настоящем изобретении, являются сложные C1– C30-эфиры ретинола, предпочтительно, сложные C2-C20-эфиры, а наиболее предпочтительно C2, C3 и C16-сложные эфиры, поскольку они являются наиболее коммерчески доступными. Примерами ретиниловых сложных эфиров являются, но не ограничиваются ими, ретинил-пальмитат, ретинилформиат, ретинилацетат, ретинилпропионат, ретинилбутират, ретинилвалерат, ретинилизовалерат, ретинилгексаноат, ретинилгептаноат, ретинилоктаноат, ретинилнонаноат, ретинилдеканоат, ретинилундекандат, ретиниллаурат, ретинилтридеканоат, ретинилмиристат, ретинилпентадеканоат, ретинилгептадеканоат, ретинилстеарат, ретинилизостеарат, ретинилнонадеканоат, ретиниларахидонат, ретинилбегенат, ретиниллинолеат, ретинилолеат. Предпочтительный сложный эфир для использования в настоящем изобретении выбирают из ретинилпальмитата, ретинилацетата и ретинилпропионата, поскольку эти сложные эфиры являются наиболее коммерчески доступными, а поэтому они являются наименее дорогостоящими. Ретиниллинолеат также является предпочтительным благодаря своей эффективности. Ретинол и/или ретиниловый сложный эфир используются в композиции настоящего изобретения в количестве от 0,001 до 10%, предпочтительно, в количестве от 0,01 до 1%, а более предпочтительно в количестве от 0,01 до 0,5%. Вторым неотъемлемым ингредиентом композиций настоящего изобретения является соединение, которое удовлетворяет микросомному in vitro-анализу. Соединение, подходящее для использования в настоящем изобретении и взятое в концентрации 100 мкМ, по крайней мере, на 20% ингибирует LRAT- или ARAT-катализируемую реакцию этерификации ретинола, как было определено с помощью микросомного in vitro-анализа. Микросомный in vitro-анализ, используемый для определения возможности включения соединения в композиции настоящего изобретения, проводят следующим образом: В предпочтительном варианте осуществления настоящего изобретения, выбранным соединением является соединение, которое при концентрации 100 мкМ ингибирует, по крайней мере, на 40%, а наиболее предпочтительно, по крайней мере, на 50%, LRAT- или ARAT-катализируемую реакцию этерификации ретинола. Микросомный анализ in vitro Микросомы были получены, как описано J.C.Saari and D.L.Bredberg, в “CoA and Non-CoA Dependent Retinol Esterification in Retinal Pigment Epithelium” J.Biol.Chem.263, 8084-90 (1988). Раствор, содержащий 0,1 М фосфатно-натриевого буфера, pH 7, 5 мМ дитиотреитола, 2 мг/мл альбумина бычьей сыворотки; 40 микромоль пальмитоил-CoA, 40 микромоль дилауроилфосфатидилхолина, 10 микромоль ретинола, и тестируемое соединение или растворитель-основу, инкубировали в течение 1 ч при 37oC с микросомной фракцией, выделенной из бычьих эпителиальных клеток, содержащих ретинальный пигмент. После инкубирования, реакцию гасили путем добавления равного объема этанола, и образовавшиеся ретиниловые сложные эфиры (ретиниллаурат из LRAT-катализируемой реакции, и ретинилпальмитат из ARAT-катализируемой реакции) экстрагировали гексаном. Для количественной оценки ретинилового сложного эфира, гексановый слой удаляли, упаривали в атмосфере азота, и остаток анализировали посредством ВЭЖХ на обращенно-фазовой колонке (3,9 x 300 мм) с C19 с использованием 80% метанола в тетрагидрофуране в качестве подвижной фазы, и посредством флуоресцентной детекции (возбуждение на 325 нм, излучение на 480 нм). Количество образовавшегося сложного эфира в присутствии растворителя-основы принимали за 100%, и использовали для вычисления процента ингибирования образования сложного эфира в случае тестируемых соединений. В случае контроля, аликвоту микросом инактивировали путем кипячения в течение 5 мин, что приводило, по крайней мере, к 95%-ному ингибированию образования сложного эфира. Примерами соединений, которые удовлетворяют микросомному in vitro-анализу, описанному выше, являются циклические алифатические ненасыщенные углеводороды, дитерпены, флавононы, флавонолы и некоторые гидроксиэтилимидазолиновые поверхностно-активные вещества, содержащие жирную цепь. Эти соединения описаны отдельно ниже. Очевидно, что в композиции настоящего изобретения могут быть включены и другие соединения, которые не были упомянуты выше, при условии, что эти соединения прошли микросомный in vitro-тест, описанный выше. Циклические алифатические ненасыщенные соединения Подходящие циклические алифатические ненасыщенные соединения выбирают в соответствии с микросомным in vitro-анализом, описанным выше. Предпочтительное циклическое алифатическое ненасыщенное соединение выбирают из циклических алифатических ненасыщенных альдегидов, кетонов, спиртов и сложных эфиров. Предпочтительными циклическими алифатическими ненасыщенными альдегидами, кетонами, спиртами и сложными эфирами являются: альфа-дамаскон, бета- дамаскон, дельта-дамаскон, изо-дамаскон, дамаскенон, альфа-ионон, бета-ионон, аллил-альфа-ионон, изобутилионон, альфа-метилионон, гамма-метилионон, брахманол, санданол, альфа-терпинеол, лираль, этилсафранат, и их смеси. Эти соединения имеют следующую структуру: 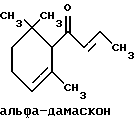 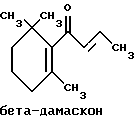 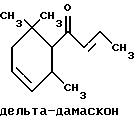 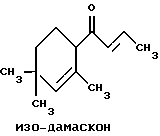 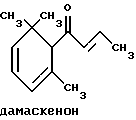 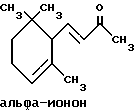 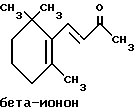 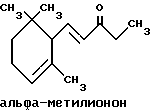 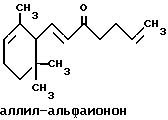 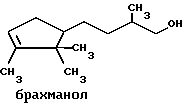 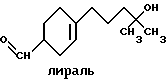  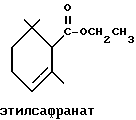 Предпочтительно, для достижения максимального эффекта при минимальных экономических затратах, циклическое алифатическое ненасыщенное соединение выбирают из группы, состоящей из дамасконов и иононов, имеющих структуры, описанные выше. Наиболее предпочтительно, чтобы циклическим алифатическим ненасыщенным соединением являлся  -дамаскон и/или -дамаскон и/или  -ионон.
Циклическое алифатическое ненасыщенное соединение может быть включено в композиции настоящего изобретения в количестве, составляющем от 0,0001 до 50%, предпочтительно, от 0,01 до 10%, а наиболее предпочтительно, от 0,1 до 5% по массе композиции.
Дитерпены -ионон.
Циклическое алифатическое ненасыщенное соединение может быть включено в композиции настоящего изобретения в количестве, составляющем от 0,0001 до 50%, предпочтительно, от 0,01 до 10%, а наиболее предпочтительно, от 0,1 до 5% по массе композиции.
ДитерпеныДитерпенами, подходящими для использования в настоящем изобретении, являются дитерпены, которые удовлетворяют микросомному in vitro-анализу, описанному выше. Предпочтительным дитерпеновым соединением является геранилгераниол, который имеет следующую структуру: 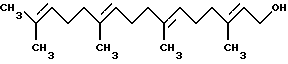 Дитерпен может быть включен в композиции настоящего изобретения в количестве, составляющем от 0,0001 до 50%, предпочтительно, от 0,01 до 10%, а наиболее предпочтительно, от 0,1 до 5%. Флавононы и флавонолы Флавононами и флавонолами, подходящими для использования в настоящем изобретении, являются те флавононы и флавонолы, которые удовлетворяют микросомному in vitro-анализу, описанному выше. Предпочтительные флавононы и флавонолы выбирают из нарингенина, кверцитина, и их смесей. Нарингенин и кверцитин имеют следующую структуру: 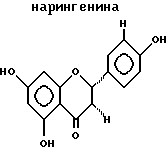 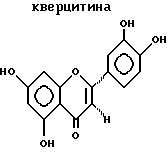 Флавонон и флавонол может быть включен в композиции настоящего изобретения в количестве, составляющем от 0,0001 до 50%, предпочтительно, от 0,01 до 10%, а наиболее предпочтительно, от 0,1 до 5%. Кверцитин и/или нарингенин могут быть получены от фирмы Sigma. В настоящем изобретении также могут быть использованы экстракты растений, содержащие квертицин и/или нарингенин, например, рутин, энотера, лук, виды цитрусовых растений. Гидроксиэтилимидазолиновые поверхностно-активные вещества, содержащие жирную цепь Гидроксиэтилимидазолиновые поверхностно-активные вещества с жирной цепью, используемые в настоящем изобретении, удовлетворяют микросомному in vitro-анализу, описанному выше. Предпочтительные гидроксиэтилимидазолины с жирной цепью имеют следующую общую структуру: 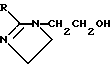 где R представляет собой алифатическую насыщенную или ненасыщенную, прямую или разветвленную углеводородную цепь, содержащую от 8 до 20 атомов углерода. Примерами подходящих гидроксиэтилимидазолинов с жирной цепью являются, но не ограничиваются ими, кокоилгидроксиэтилимидазолин (R происходит от жирных кислот кокосового масла и представляет, главным образом, C12 и немного более длинную цепь), лаурилгидроксиэтилимидазолин (R=CH3(CH2)10), миристилгидроксиэтилимидазолин (R=CH3(CH2)12), стеарилгидроксиэтилимидазолин (R= CH3(CH2)16) и олеилгидроксиэтилимидазолин (R=CH3(CH2)7CH=CH(CH2)7). R в гидроксиэтилимидазолине с жирной цепью, предпочтительно, содержит от 8 до 18 атомов углерода, а более предпочтительно от 11 до 18 атомов углерода. Наиболее предпочтительным гидроксиэтилимидазолином с жирной цепью является олеилгидроксиэтилимидазолин, поскольку он является коммерчески доступным и эффективным соединением. Гидроксиэтилимидазолин с жирной цепью может быть включен в композиции настоящего изобретения в количестве, составляющем от 0,0001 до 50%; при этом, предпочтительно, если он используется в количестве от 0,01 до 10%, а наиболее предпочтительно, в количестве от 0,1 до 5%. Косметически приемлемый носитель Композиция настоящего изобретения также включает косметически приемлемый носитель, который действует как разбавитель, диспергирующий агент, или носитель для активных ингредиентов в композиции, таким образом, что он облегчает их распределение при нанесении композиции на кожу. Безводные носители или носители, используемые в добавление к воде, могут включать жидкие или твердые смягчающие вещества, растворители, влагоудерживающие агенты, загустители и порошки. Особенно предпочтительным безводным носителем является полидиметилсилоксан и/или полидиметилфенилсилоксан. Силиконами настоящего изобретения могут быть силиконы с вязкостями, составляющими примерно от 10 до 10.000.000 мм2/сСт (сантистокс) при 25oC. Особенно предпочтительными являются смеси силиконов низкой и высокой вязкости. Эти силиконы изготавливаются компанией Дженерал Электрик (General Electric Company) под товарными знаками Vicasil, SE и SF, и компанией Dow Corning под серийными марками 200 и 550. Количество силикона, который может быть использован в композициях настоящего изобретения, варьируется где-то в пределах от 5 до 95%, а предпочтительно, от 25 до 90% по массе композиции. Косметически приемлемый носитель обычно составляет от 5 до 99,9%, предпочтительно, от 25 до 80% по массе композиции, и может быть использован в отсутствии других косметических добавок, то есть, он может составлять всю остальную часть композиции (помимо активных ингредиентов). Предпочтительно, чтобы носитель содержал, по крайней мере, 50%, а более предпочтительно, по крайней мере, 80% воды по массе носителя. При этом, предпочтительно, чтобы вода составляла, по крайней мере, 50%, а наиболее предпочтительно, по крайней мере, от 60 до 80% по массе композиции настоящего изобретения. Необязательные материалы для ухода за кожей и косметические добавки Масло или маслообразный материал могут присутствовать в композиции вместе с эмульгатором для образования эмульсии типа “вода в масле” или “масло в воде”, главным образом, в зависимости от гидрофильно-липофильного баланса (ГЛБ) используемого эмульгатора. Композиции настоящего изобретения содержат, предпочтительно, солнцезащитные вещества. Солнцезащитные вещества включают соединения, которые обычно используются для защиты от воздействия ультрафиолетового излучения. Характерными соединениями являются производные РАВА, циннамат и салицилат. Так, например, могут быть использованы октилметоксициннамат и 2-гидрокси-4- метоксибензофенон (известный так же как оксибензон). Октилметоксициннамат и 2-гидрокси-4-метоксибензофенон являются коммерчески доступными соединениями, выпускаемыми под товарными знаками Parsol МСХ и Бензофенон-3, соответственно. Точное количество солнцезащитного вещества, используемого в эмульсиях, может варьироваться в зависимости от степени нужной защиты от солнечного УФ-излучения. Другие предпочтительные, но необязательные ингредиенты выбирают из незаменимых жирных кислот (НЖК), то есть, тех жирных кислот, которые имеют важное значение для образования плазматической мембраны всех клеток; так, например, в кератиноцитах, недостаток НЖК приводит к гиперпролиферации этих клеток. Добавление в эти клетки НЖК позволяет корректировать это явление. Кроме того, НЖК усиливают липидный биосинтез эпидермиса и обеспечивают наличие липидов для формирования структур, выполняющих барьерную роль эпидермиса. Незаменимые жирные кислоты выбирают, предпочтительно, из линолевой кислоты,  -линоленовой кислоты, гомо- -линоленовой кислоты, гомо- -линоленовой кислоты, колумбиновой кислоты, эйкоза-(н-6,9,13)-триеновой кислоты, арахидоновой кислоты, -линоленовой кислоты, колумбиновой кислоты, эйкоза-(н-6,9,13)-триеновой кислоты, арахидоновой кислоты,  -линоленовой кислоты, тимнодоновой кислоты, гексаеновой кислоты, и их смесей.
В косметические композиции настоящего изобретения часто вводят смягчающие агенты. Уровни таких смягчающих агентов могут составлять от 0,5 до 50%, а предпочтительно, от 5 до 30% по массе всей композиции. Смягчающие агенты могут быть классифицированы по таким общим химическим категориям, как сложные эфиры, жирные кислоты и спирты, полиолы и углеводороды.
Сложными эфирами могут быть сложные моно- или ди- эфиры. Подходящими примерами сложных ди-эфиров жирных кислот являются дибутиладипат, диэтилсебацат, диизопропилдимерат и диоктилсукцинат. Подходящими сложными эфирами жирных кислот с разветвленной цепью являются 2-этил-гексилмиристат, изопропилстеарат и изостеарилпальмитат. Подходящими сложными эфирами трехосновных кислот являются триизо-пропилтрилинолеат и трилаурилцитрат. Подходящими сложными эфирами жирных кислот с прямой цепью являются лаурилпальмитат, миристиллактат, олеилэуркат и стеарилолеат. Предпочтительными сложными эфирами являются коко-каприлат/капрат (смесь коко-каприлата и коко-капрата), ацетат миристилового эфира пропиленгликоля, диизопропиладипат и цетилоктаноат.
Подходящими жирными спиртами и кислотами являются соединения, имеющие от 10 до 20 атомов углерода. Особенно предпочтительными являются такие соединения, как цетиловые, миристиловые, пальмитиновые и стеариловые спирты и кислоты.
Полиолами, которые могут служить в качестве смягчающих агентов, являются линейные и разветвленные алкилполигидроксильные соединения. Так например, предпочтительными являются пропиленгликоль, сорбит и глицерин. Могут быть также использованы полимерные полиолы, такие как полипропиленгликоль и полиэтиленгликоль. В качестве интенсификаторов впитываемости особенно предпочтительными являются также бутилен- и пропиленгликоль.
Примерами углеводородов, которые могут служить в качестве смягчающих агентов, являются углеводородные цепи, имеющие примерно от 12 до 30 атомов углерода. Конкретными примерами таких соединений являются минеральное масло, вазелин, сквален и изопарафины.
Другой категорией функциональных ингредиентов косметических композиций настоящего изобретения являются загустители. Загуститель обычно присутствует в количествах примерно от 0,1 до 20%, а предпочтительно от 0,5 до 10% по массе композиции. Примерами таких загустителей являются сшитые полиакрилатные материалы, поставляемые компанией В.F.Goodrich Company под товарным знаком Carbopol. Используемыми смолами могут быть такие смолы, как ксантановая камедь, каррагеновая камедь, желатин, камедь карайи, пектиновая смола и смола рожкового дерева. При определенных условиях, функция загущения может быть осуществлена с использованием материала, который служит также в качестве силикона или смягчающего агента. Так, например, силиконовые смолы с вязкостью, превышающей 10 сантистоксов, и сложные эфиры, такие как, стеарат глицерина, имеют двойную функцию.
В косметическую композицию настоящего изобретения могут быть введены порошки. Такими порошками являются мел, тальк, каолин, крахмал, смектитовые глины, химически модифицированный алюмосиликат магния, органически модифицированная монтмориллонитная глина, гидратированный силикат алюминия, тонкоизмельченный диоксид кремния, алюмооктенилсукцинат крахмала и их смеси.
В косметические композиции настоящего изобретения могут быть также включены и другие вспомогательные компоненты-добавки. Такими вспомогательными ингредиентами могут быть красители, замутнители и отдушки. Количества этих вспомогательных компонентов-добавок могут составлять примерно от 0,001% и вплоть до 20% по массе композиции.
Использование композиции -линоленовой кислоты, тимнодоновой кислоты, гексаеновой кислоты, и их смесей.
В косметические композиции настоящего изобретения часто вводят смягчающие агенты. Уровни таких смягчающих агентов могут составлять от 0,5 до 50%, а предпочтительно, от 5 до 30% по массе всей композиции. Смягчающие агенты могут быть классифицированы по таким общим химическим категориям, как сложные эфиры, жирные кислоты и спирты, полиолы и углеводороды.
Сложными эфирами могут быть сложные моно- или ди- эфиры. Подходящими примерами сложных ди-эфиров жирных кислот являются дибутиладипат, диэтилсебацат, диизопропилдимерат и диоктилсукцинат. Подходящими сложными эфирами жирных кислот с разветвленной цепью являются 2-этил-гексилмиристат, изопропилстеарат и изостеарилпальмитат. Подходящими сложными эфирами трехосновных кислот являются триизо-пропилтрилинолеат и трилаурилцитрат. Подходящими сложными эфирами жирных кислот с прямой цепью являются лаурилпальмитат, миристиллактат, олеилэуркат и стеарилолеат. Предпочтительными сложными эфирами являются коко-каприлат/капрат (смесь коко-каприлата и коко-капрата), ацетат миристилового эфира пропиленгликоля, диизопропиладипат и цетилоктаноат.
Подходящими жирными спиртами и кислотами являются соединения, имеющие от 10 до 20 атомов углерода. Особенно предпочтительными являются такие соединения, как цетиловые, миристиловые, пальмитиновые и стеариловые спирты и кислоты.
Полиолами, которые могут служить в качестве смягчающих агентов, являются линейные и разветвленные алкилполигидроксильные соединения. Так например, предпочтительными являются пропиленгликоль, сорбит и глицерин. Могут быть также использованы полимерные полиолы, такие как полипропиленгликоль и полиэтиленгликоль. В качестве интенсификаторов впитываемости особенно предпочтительными являются также бутилен- и пропиленгликоль.
Примерами углеводородов, которые могут служить в качестве смягчающих агентов, являются углеводородные цепи, имеющие примерно от 12 до 30 атомов углерода. Конкретными примерами таких соединений являются минеральное масло, вазелин, сквален и изопарафины.
Другой категорией функциональных ингредиентов косметических композиций настоящего изобретения являются загустители. Загуститель обычно присутствует в количествах примерно от 0,1 до 20%, а предпочтительно от 0,5 до 10% по массе композиции. Примерами таких загустителей являются сшитые полиакрилатные материалы, поставляемые компанией В.F.Goodrich Company под товарным знаком Carbopol. Используемыми смолами могут быть такие смолы, как ксантановая камедь, каррагеновая камедь, желатин, камедь карайи, пектиновая смола и смола рожкового дерева. При определенных условиях, функция загущения может быть осуществлена с использованием материала, который служит также в качестве силикона или смягчающего агента. Так, например, силиконовые смолы с вязкостью, превышающей 10 сантистоксов, и сложные эфиры, такие как, стеарат глицерина, имеют двойную функцию.
В косметическую композицию настоящего изобретения могут быть введены порошки. Такими порошками являются мел, тальк, каолин, крахмал, смектитовые глины, химически модифицированный алюмосиликат магния, органически модифицированная монтмориллонитная глина, гидратированный силикат алюминия, тонкоизмельченный диоксид кремния, алюмооктенилсукцинат крахмала и их смеси.
В косметические композиции настоящего изобретения могут быть также включены и другие вспомогательные компоненты-добавки. Такими вспомогательными ингредиентами могут быть красители, замутнители и отдушки. Количества этих вспомогательных компонентов-добавок могут составлять примерно от 0,001% и вплоть до 20% по массе композиции.
Использование композицииКомпозиция настоящего изобретения используется, главным образом, как продукт, предназначенный для местного нанесения на кожу человека, а особенно, в качестве кондиционирующего и смягчающего кожу агента, а также для предупреждения образования или для сокращения количества морщин на кожу или улучшения внешнего вида увядшей кожи. При использовании небольшого количества композиции, например, от 1 до 100 мл, эту композицию наносят на обрабатываемые участки кожи, из соответствующего контейнера или аппликатора, а затем, если это необходимо, ее распределяют и/или втирают в кожу ладонью или пальцами, либо с использованием соответствующего приспособления. Форма продукта и упаковка Композиция настоящего изобретения, предназначенная для ухода за кожей путем местного применения, может быть изготовлена в виде лосьона, крема или геля. Эта композиция может быть упакована в подходящую емкость, которая соответствует вязкости этой композиции и пригодна для ее использования потребителем. Например, лосьон или крем могут быть упакованы во флаконы или в шариковый аппликатор, либо в распыляющее аэрозольное устройство или в баллон, снабженный дозатором насосного типа, пригодным для нажатия пальцем. Если данная композиция изготовлена в виде крема, то ее просто хранят в недеформируемом сосуде или в сжимаемом контейнере, таком как, тюбик или закрывающаяся крышкой косметическая баночка. Эта композиция может быть также заключена в капсулы, такие как, капсулы, описанные в патенте США N 5063057. Настоящее изобретение также относится к плотно закрывающейся емкости, содержащей косметически приемлемую композицию, описанную в настоящей заявке. Настоящее изобретение более подробно проиллюстрировано в нижеследующих конкретных примерах. Материалы и методы Клеточная культура: Кератиноциты человека, выделенные из неонатальной крайней плоти путем обработки трипсином, культивировали на модифицированной по способу Дульбекко среде Игла (DME) и среде Хемса F12 (1:1)/10% фетальной телячьей сыворотке в присутствии облученных фибробластов мыши 3Т3 для создания колоний делящихся кератиноцитов. Клетки культивировали в вышеуказанных условиях до их второго пассажа (включительно) и хранили в замороженном виде для дальнейшего использования. Замороженные кератиноциты второго пассажа оттаивали, засевали на вышеуказанную среду и культивировали в течение пяти дней, после чего их переносили в бессывороточную среду на основу MCDB 153 (KGM) для культивирования кератиноцитов, полученную от Clonetics Corporation, San Diego, CA, и содержащую 0,15 мМ Ca, или бессывороточную среду (KSFM) для культивирования кератиноцитов, полученную от GIBCO и содержащую 0,09 мМ Са. На 7-й день, когда клетки достигали 80-90%-ной конфлюентности, их обрабатывали трипсином и засевали в бессывороточную среду для проведения различных экспериментов. Тимидиновый анализ Включение 3H-тимидина и пролиферация кератиноцитов Включение 3Н-тимидина культивированными кератиноцитами использовали в качестве анализа на пролифирацию кератиноцитов. Тимидин является одним из четырех дезоксинуклеозидов, которые представляют собой мономерные звенья ДНК, то есть, универсальную библиотеку генетической информации в царстве животного мира. Перед клеточным делением соматической клетки, такой как, кератиноцит, полный геном клетки, подвергающейся делению, реплицируется. Этот процесс включает в себя крупномасштабный синтез ДНК клеткой и обеспечивает обе дочерние клетки идентичными копиями генетического материала. Если 3H-тимидин ввести в среду для культивирования кератиноцитов, которые синтезируют ДНК в препаратах для деления клеток, то меченный нуклеозид включается во вновь синтезированную ДНК. Степень включения 3H-тимидина в популяцию клеток пропорциональна скорости синтеза ДНК этой популяцией клеток, а поэтому она может служить показателем пролиферации этих клеток. Кератиноциты (которые были культивированы как описано выше) засевали в 24- луночные планшеты при плотности 20000 клеток на лунку в 1 мл среды. После инкубирования в течение четырех дней, или до того времени, пока клетки не достигали 60-70%-ной конфлюентности, среду заменяли. Через 24 ч после замены среды, в лунки добавляли тестируемые соединения (в трех дубликатах), а затем, через 4 ч, в лунки добавляли 1 мкКи 3H-тимидина в 50 мкл среды на лунку. После этого, клетки инкубировали в течение 24 ч. Затем среду удаляли, к клеткам добавляли охлажденную льдом 10% трихлоруксусную кислоту (ТХК), и планшеты инкубировали на льду в течение 30 мин. Клетки пять раз промывали 5% ТХК и оставляли, по крайней мере, на 1 час (обычно в течение ночи) в 500 мкл 0,1 М NaOH для растворения. Препараты нейтрализовали 0,1М HCl; и 50 мкл этого клеточного препарата использовали для определения содержания полного белка. Дезинтеграцию в минуту (DPM) в результате 3H-мечения ДНК определяли с помощью анализа 900 мкл клеточного препарата путем подсчета на жидкостном сцинтилляторе. Результаты включения тимидина выражали как DPM/мкг белка. Анализ на трансглутаминазу Анализ на трансглутаминазу и дифференцировку кератиноцитов В процессе терминальной дифференцировки в эпидермисе, на внутренней поверхности периферического клеточного слоя образуется слой белка толщиной 15 нм, известный как ороговевший слой (СЕ). Этот ороговевший слой состоит из многочисленных различных белков, которые перекрестно сшиты друг с другом посредством образования N  -( -( -глутамил) лизиновых изодипептидных связей, катализируемого действием, по крайней мере, двух различных трансглутаминаз (TGases), экспрессированных в эпидермисе. Трансглутаминаза I (TGasa I) экспрессируется в избытке в дифференцированных слоях эпидермиса, особенно в зернистом слое, но отсутствует в недифференцированном базальном эпидермисе. Таким образом, трансглутаминаза I может быть использована в качестве маркера эпидермальной дифференцировки кератиноцитов с высокими уровнями трансглутаминазы I, что указывает на их более дифференцированное состояние. Оценку состояния дифференцировки культивированных кератиноцитов проводили с помощью анализа ELISA с использованием антитела против трансглутаминазы I, как описано в нижеприведенных примерах.
Для примера 1 использовали следующую процедуру: -глутамил) лизиновых изодипептидных связей, катализируемого действием, по крайней мере, двух различных трансглутаминаз (TGases), экспрессированных в эпидермисе. Трансглутаминаза I (TGasa I) экспрессируется в избытке в дифференцированных слоях эпидермиса, особенно в зернистом слое, но отсутствует в недифференцированном базальном эпидермисе. Таким образом, трансглутаминаза I может быть использована в качестве маркера эпидермальной дифференцировки кератиноцитов с высокими уровнями трансглутаминазы I, что указывает на их более дифференцированное состояние. Оценку состояния дифференцировки культивированных кератиноцитов проводили с помощью анализа ELISA с использованием антитела против трансглутаминазы I, как описано в нижеприведенных примерах.
Для примера 1 использовали следующую процедуру:Кератиноциты (культивированные как описано выше) засевали в 96-луночные планшеты при плотности 3000 клеток на лунку в 200 мкл среды. После инкубирования в течение четырех дней, среду заменяли на среду, содержащую тестируемые соединения (6 дубликатов на тест). Клетки культивировали еще 72 ч, после чего среду отсасывали, и планшеты хранили при температуре -70oC. Затем планшеты удаляли из холодильника, и клетки промывали PBS. После добавления 100 мкл стерильной воды, клетки разрушали путем замораживания при -70oC, а затем оттаивания. Клетки инкубировали в течение еще 1 ч при комнатной температуре (К/Т) с PBS/3% BSA (буфер для отмывки, альбумин бычьей сыворотки), а затем промывали свежей аликвотой буфера для отмывки. Клетки инкубировали в течение 1 ч при 37oC с 50 мкл мышиных моноклональных антител (IgG) против трансглутаминазы человека (“первых” антител), полученных от Biomedical Industries и разведенных 1:2000 в буфере для отмывки, а затем два раза промывали буфером для отмывки. После этого клетки в течение 1 ч при 37oC инкубировали с 50 мкл “вторых” антител (Fab-фрагмент; конъюгированное с пероксидазой антитело против мышиных иммуноглобулинов IgG, полученное от Amersham), разведенных в отношении 1: 4000 в буфере для отмывки, а затем два раза промывали буфером для отмывки. Клетки инкубировали с раствором субстрата (4 мг о-фенилендиамина и 3,3 мкл 30% H2O2 в 10 мл 0,1 М цитратного буфера, pH 5,0) в течение 5 мин, при комнатной температуре, в темноте (под алюминиевой фольгой). Реакцию прекращали путем добавления 50 мкл 4 н. H2SO4. Оптическую плотность образцов считывали при 492 нм на планшет-ридере. Из шести дубликатов, четыре дубликата обрабатывали обоими антителами, а два дубликата обрабатывали только “вторым” антителом (то есть, для определения фонового связывания антитела, конъюгированного с ферментом Ab). Уровни трансглутаминазы I определяли путем вычитания фоновых значений из значений, полученных после каждой обработки и определения средней квадратичной ошибки  ср.кв.ош.) для дубликатов, обработанных обоими антителами.
Для других примеров, в которых измеряли уровень трансглутаминазы I, использовали следующую процедуру: ср.кв.ош.) для дубликатов, обработанных обоими антителами.
Для других примеров, в которых измеряли уровень трансглутаминазы I, использовали следующую процедуру:Кератиноциты (культивированные, как описано выше) засевали в 96-луночные планшеты при плотности 3000 клеток на лунку в 200 мкл среды для культивирования клеток. После инкубирования в течение четырех дней, среду заменяли на среду, содержащую тестируемые соединения (6 дубликатов на тест). Клетки культивировали еще 72 ч, после чего среду отсасывали, и планшеты хранили при температуре -70oC. После удаления планшетов из холодильника, клетки разрушали путем замораживания при -70oC и оттаивания, а затем три раза промывали PBS. Клетки инкубировали в течение еще 1 ч при комнатной температуре (К/Т) с буфером TBS/5% BSA. Затем клетки инкубировали в течение 2 ч при 37oC с 100 мкл мышиных моноклональных антител (IgG) против трансглутаминазы человека (“первых” антител), полученных от Biomedical Technologies Inc. и разведенных 1: 2000 в буфере TBS/1% BSA, а затем шесть раз промывали буфером для отмывки (TBS/1% BSA/0,05% Твин-20). После этого клетки инкубировали в течение 2 ч при 37oC с 100 мкл Fab-фрагмента антитела против мышиных IgG, конъюгированного с пероксидазой антитела (“второго” антитела), полученного от Amersham и разведенного в отношении 1: 4000 в буфере для отмывки, а затем три раза промывали буфером для отмывки и три раза PBS. Клетки инкубировали с раствором субстрата (4 мг о-фенилендиамина и 3,3 мкл 30% H2O2 в 10 мл 0,1 М цитратного буфера, pH 5,0) в течение 5 мин, при комнатной температуре, в темноте (под алюминиевой фольгой). Реакцию прекращали путем добавления 50 мкл 4 н. H2SO4. Оптическую плотность образцов считывали при 492 нм на планшет-ридере. Из шести дубликатов четыре дубликата обрабатывали обоими антителами, а два дубликата обрабатывали только “вторым” антителом (то есть, для определения фонового связывания антитела, конъюгированного с ферментом). Уровни трансглутаминазы I определяли путем вычитания фоновых значений из значений, полученных после каждой обработки, и определения средней квадратичной ошибки  ср.кв.ош.) для дубликатов, обработанных обоими антителами.
Анализ ДНК ср.кв.ош.) для дубликатов, обработанных обоими антителами.
Анализ ДНКУровень трансглутаминазы I, обнаруживаемой после обработки клеток, должен зависеть от числа клеток, то есть, чем больше число клеток, тем больше уровень обнаруживаемой трансглутаминазы I. Уровень трансглутаминазы I был нормализован на содержание ДНК в клетках в той же самой лунке, что позволило устранить расхождения, обусловленные различием в числе клеток. Количественная оценка ДНК может быть, в частности, использована как индикатор числа клеток, включая число кератиноцитов, поскольку каждая клетка имеет, в сущности, идентичный геном, а поэтому идентичное количество ДНК. Следовательно, полное содержание ДНК клеток в лунке прямо пропорционально числу клеток в этой лунке. Количественную оценку ДНК использовали для нормализации данных уровней трансглутаминазы на количество клеток. Кератиноциты засевали в 96-луночные планшеты при плотности 3000 клеток на лунку в 200 мкл среды. После инкубирования в течение четырех дней, среду заменяли на среду, содержащую тестируемые соединения (6 дубликатов на тест). Клетки культивировали еще 72 ч, после чего среду отсасывали, и планшеты хранили в течение, по крайней мере, 1,5 ч при температуре -70oC. Затем планшеты удаляли из холодильника и оттаивали в течение 30 мин. После этого добавляли 100 мкл/лунку красителя Hoechst (в конечной концентрации 1 мкг/мл) и инкубировали в течение 15 мин, после чего планшеты покрывали и считывали на флуориметре (возбуждение на 360 нм и излучение на 460 нм). Раствор красителя удаляли и лунки промывали PBS при подготовке для анализа на трансглутаминазу. Пример 1 Ретиноевая кислота является более эффективной, чем ретинол при изменении состояния дифференцировки кератиноцитов Было исследовано влияние ретиноевой кислоты (RA) и ретинола (ROH) на уровни трансглутаминазы, нормализованные на содержание клеточных ДНК, после добавления RA ROH, и результаты этого исследования представлены в таблице 1. Все концентрации тестированной ретиноевой кислоты, то есть, 2,5 x 10-7 М, 2,5 x 10-8 М и 2,5 x 10-9 М, способствовали снижению дифференцировки кератиноцитов по сравнению с контролем (этанол), и это снижение было в значительно большей степени, чем то, которое достигалось с использованием каждой из соответствующих концентраций 2,5 x 10-7 М, 2,5 x 10-8 М и 2,5 x 10-9 М обработки ретинолом. Снижение уровня трансглутаминазы является дозозависимым как для ретиноевой кислоты, так и для ретинола. Это согласуется с тем, что ретиноевая кислота имеет более сильное ингибирующее действие на эпителиальную дифференцировку кератиноцитов, чем ретинол. Пример 2 Метод микросомной этерификации ретинола in vitro: Микросомы были получены, как описано J.C.Saari and D.L.Bredberg, в “CoA and Non-CoA Dependent Retinol Esterification in Retinal Pigment Epithelium” J.Biol.Chem. 23, 8084-90 (1988). Раствор, содержащий 0,1М фосфатно-натриевого буфера, pH 7, 5 мМ дитиотреитола, 2 мг/мл альбумина бычьей сыворотки, 40 микромолей пальмитоил-СоА, 40 микромолей дилауроил-фосфатидилхолина, 10 микромолей ретинола и тестируемое соединение или растворитель- основу, инкубировали в течение 1 ч при 37oC с микросомной фракцией, выделенной из бычьих эпителиальных клеток, содержащих ретинальный пигмент. После инкубирования, реакцию гасили путем добавления равного объема этанола, и образовавшиеся ретиниловые сложные эфиры (ретиниллаурат из LRAT-катализируемой реакции и ретинил-пальмитат из ARAT-катализируемой реакции) экстрагировали гексаном. Для количественной оценки ретинилового сложного эфира, гексановый слой удаляли, упаривали в атмосфере азота, и остаток анализировали посредством ВЭЖХ на обращенно-фазовой колонке (3,9 x 300 мм) с C18 с использованием 80% метанола в тетрагидрофуране в качестве подвижной фазы, и посредством флуоресцентной детекции (возбуждение на 325 нм, излучение на 480 нм). Количество образовавшегося сложного эфира в присутствии растворителя-основы принимали за 100%, и использовали для вычисления процента ингибирования образования сложного эфира для тестируемых соединений. В случае контроля, аликвоту микросом инактивировали путем кипячения в течение 5 мин, что приводило, по крайней мере, к 95%-ному ингибированию образования сложного эфира. Полученные результаты систематизировали в таблице 2. Следует отметить, что поверхностно-активное вещество гидроксиэтилимидазолин является сильным ингибитором этерификации, тогда как другие поверхностно-активные вещества и другие гетероциклические соединения, в основном, являются неактивными. Каприлгидроксиэтилимидазолин (R=CH3(CH2)6) не ингибировал в достаточной степени LRAT. Пример 3 Процедуру примера 2 повторяли с использованием различных гидроксиэтилимидазолиновых поверхностно-активных веществ, имеющих группы R, приведенные в таблице 3. Полученные результаты систематизированы в таблице 3. Результаты в таблице 3 указывают на относительную активность олеила > коко > лаурила. Коко-соединение является, вероятно, лучшим, поскольку оно имеет не только С12, но также и другие более длинные алкильные группы. Данные, представленные в таблице 2 для каприлгидроксиэтилимидазолина, показывают лишь 8%-ное ингибирование при концентрации 100 микромоль. Эти данные, взятые вместе, ясно указывают на относительную активность олеила > коко > лаурила > каприла. Пример 4 Анализ на трансглутаминазу проводили с использованием олеилгидроксиэтилимидазолина (OHI), ретиноевой кислоты (RA), ретинола (ROH) и ретинилпальмитата (RP). Полученные результаты систематизированы в таблице 4. Из результатов, полученных в таблице 4, можно видеть, что ретиноевая кислота значительно снижает дифференцировку кератиноцитов, тогда как, ретинол, олеилгидроксиэтилимидазолин и ретинилпальмитат, взятые отдельно, не влияют на дифференцировку кератиноцитов или влияют в значительно меньшей степени, чем ретиноевая кислота. В экспериментах 1 и 2, где ретинол использовали в комбинации с олеилгидроксиэтилимидазолином, наблюдалось синергическое действие, снижающее дифференцировку кератиноцитов до уровня, приближающегося к уровню действия ретиноевой кислоты. В эксперименте 3, где олеилгидроксиэтилимидазолин был использован в комбинации с ретинилпальмитатом, не было обнаружено такого же резкого снижения, как в экспериментах 1 и 2, но тем не менее, наблюдалось синергическое снижающее действие. Этот пример также подтверждает, что соединение, прошедшее микросомный in vitro-анализ, описанный в настоящей заявке, действительно оказывает воздействие на кератиноциты в том случае, если оно используется в комбинации с ретинолом; причем уровень этого воздействия аналогичен уровню действия ретиноевой кислоты. Пример 5 Микросомному in vitro-анализу подвергали соединения, перечисленные в таблицах 5A и 5B. Соединения в таблице 5A тестировали при концентрации 100 мкМ. Соединения в таблице 5B тестировали при концентрации 10 мкМ. Как видно из результатов, представленных в таблицах 5A и 5B, некоторые циклические алифатические ненасыщенные соединения являются сильными ингибиторами LRAT- или ARAT-катализируемой реакции этерификации ретинола. Сравнительный пример 6 Микросомному in vitro-тесту были, кроме того, подвергнуты дополнительные циклические алифатические ненасыщенные соединения. Полученные результаты систематизированы в таблице 6. Соединения, представленные в таблице 6, были протестированы при концентрации 100 мкМ. Из результатов, представленных в таблице 6, можно видеть, что не все циклические алифатические ненасыщенные соединения ингибируют LRAT- или ARAT-катализируемую реакцию этерификации ретинола или ингибируют указанную реакцию в достаточной степени. Пример 7 Было оценено действие соединений и комбинаций, перечисленных в таблице 7, на дифференцировку кератиноцитов. Результаты выражали как % от контроля. Уровень трансглутаминазы был нормализован на содержание ДНК. Были получены данные из двух экспериментов, в которых концентрация ретинола была изменена. Полученные результаты систематизированы в таблице 7. Результаты, представленные в таблице 7, указывают на то, что хотя  -Дамаскон и ретинол, взятые отдельно, не очень эффективны, однако, их комбинация приводит к синергическому снижению уровней трансглутаминазы и имитирует действие ретиноевой кислоты на дифференцировку кератиноцитов. Этот пример также свидетельствует о хорошей корреляции между данными, полученными с помощью микросомного анализа, и данными, полученными с помощью клеточных культур.
Пример 8 -Дамаскон и ретинол, взятые отдельно, не очень эффективны, однако, их комбинация приводит к синергическому снижению уровней трансглутаминазы и имитирует действие ретиноевой кислоты на дифференцировку кератиноцитов. Этот пример также свидетельствует о хорошей корреляции между данными, полученными с помощью микросомного анализа, и данными, полученными с помощью клеточных культур.
Пример 8Микросомному in vitro-тесту были, кроме того, подвергнуты дитерпеновое соединение, геранилгераниол или фарнезол. Полученные результаты систематизированы в таблице 8. Из результатов, представленных в таблице 8, можно видеть, что как геранилгераниол, так и фарнезол ингибируют этерификацию ретинола. Геранилгераниол является значительно более сильным ингибитором этерификации ретинола, чем фарнезол, и имеет следующую структуру: 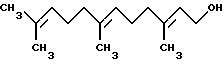 Пример 9 Включение 3H-тимидина измеряли в соответствии с процедурой, описанной выше в главе “Материалы и методы”. Полученные результаты систематизированы в таблицах 9A и 9B. Из результатов, представленных в таблицах, можно видеть, что геранилгераниол способен значительно повышать усиливающее пролиферацию действие ретинола до уровней, аналогичных уровням, которые могут быть достигнуты с использованием сравнимого количества ретиноевой кислоты. И в этом случае наблюдалась хорошая корреляция между данными, полученными с помощью микросомного теста, и данными, полученными в эксперименте по воздействию соединения на клеточную культуру. Пример 10 Микросомному in vitro-тесту были подвергнуты соединения, представленные в таблице 10. Полученные результаты систематизированы в таблице 10. Соединения в таблице 10 были протестированы при концентрации 100 мкМ. Пример 11 Нарингенин и ретинол синергически ингибируют дифференцировку кератиноцитов Действие на уровни трансглутаминазы I, нормализованные на содержание ДНК в клетках, оценивали в ответ на 72-часовую обработку тестируемыми соединениями. Результаты представлены в таблице 11. Нарингенин был получен от фирмы Sigma. Из результатов, представленных в таблице 11, можно видеть, что концентрация 2,5 x 10-7 М ретиноевой кислоты очень эффективно подавляет уровни трансглутаминазы I кератиноцитов (до 42% от контрольного уровня). Концентрация 2,5 x 10-9 М ретинола была неэффективна (92%) и концентрация 10-7 М нарингенина не оказывала ингибирующего действия на уровни трансглутаминазы I кератиноцитов, когда они использовались отдельно. Однако, объединенные концентрации 2,5 x 10-7 М ретинола + 10-9 М нарингенина ингибировали трансглутаминазу I кератиноцитов до уровня 53% от контрольных уровней. Отсюда следует, что нарингенин и ретинол синергически подавляют дифференцировку кератиноцитов аналогично действию ретиноевой кислоты. Пример 12 Нарингенин и ретинилпальмитат синергически ингибируют дифференцировку кератиноцитов Действие на уровни трансглутаминазы I, нормализованные на содержание ДНК в клетках, оценивали в ответ на 72-часовую обработку тестируемыми соединениями. Результаты представлены в таблице 12. Из результатов, представленных в таблице 12, можно видеть, что концентрация 2,5 x 10-7 М ретиноевой кислоты очень эффективно подавляет уровни трансглутаминазы I кератиноцитов (до 32% от контрольного уровня). Концентрация 2,5 x 10-8 М ретинилпальмитата является неэффективной (93%), а концентрация 10-8 М нарингенина, взятого отдельно, оказывает очень незначительное ингибирующее действие на уровень трансглутаминазы I кератиноцитов. Однако, объединенные концентрации 2,5 x 10-8 М ретинола +10-8 М нарингенина ингибировали трансглутаминазу I кератиноцитов до уровня 85% от контрольных уровней. Отсюда следует, что нарингенин и ретинилпальмитат синергически подавляют дифференцировку кератиноцитов способом аналогично ретиноевой кислоте. Пример 13 Кверцитин и ретинол синергически ингибируют дифференцировку кератиноцитов Действие тестируемых соединений на уровни трансглутаминазы I, нормализованные на содержание ДНК в клетках, оценивали в ответ на 72-часовую обработку этими соединениями. Результаты представлены в таблице 13. Кверцетин был получен от фирмы Sigma. Из результатов, представленных в таблице 13, можно видеть, что концентрация 2,5 x 10-7 М ретиноевой кислоты эффективно подавляет уровни трансглутаминазы I кератиноцитов (до 52% от контрольного уровня). Концентрация 2,5 x 10-7 М ретинола является неэффективной (90%), а концентрация 10-6 М кверцетина, взятого отдельно, оказывает очень незначительное ингибирующее действие на уровни трансглутаминазы I кератиноцитов. Однако, объединенные концентрации 2,5 х 10-7 М ретинола +10-6 М кверцетина ингибировали трансглутаминазу I кератиноцитов до уровня 70% от контрольных уровней. Отсюда следует, что кверцетин и ретинол синергически подавляют дифференцировку кератиноцитов способом аналогично ретиноевой кислоте. При проведении этих исследований ретиноевую кислоту использовали в качестве позитивного контроля, а эталонное соединение использовали для сравнения с другими соединениями. Ретиноевая кислота дозозависимым способом снижает уровни трансглутаминазы I в кератиноцитах кожи. Другими словами, ретиноевая кислота ингибирует дифференцировку кератиноцитов. Ретинол и ретинилпальмитат оказывают значительно менее эффективное ингибирующее действие на дифференцировку кератиноцитов, чем ретиноевая кислота. Однако, неожиданные результаты, продемонстрированные в вышеописанных примерах, указывают на то, что действие ретинола или ретинилового сложного эфира на культивированные кератиноциты может быть усилено до уровней, приближающихся к уровням действия ретиноевой кислоты, путем объединения ретинола или его сложного эфира с соединением, количество которого составляет 0,0001-50% и которое при концентрации 100 мкМ ингибирует, по крайней мере, на 20%, LRAT- или ARAT-катализируемую реакцию этерификации, как было определено с помощью микросомного in vitro-анализа. Это действие не только превышает действие ретинола или его сложного эфира, или соединения, взятых отдельно, но, кроме того, эти два ингредиента, взятые вместе, действуют синергически, стимулируя действие на кератиноциты, аналогичное действию ретиноевой кислоты. Результаты, проиллюстрированные выше, свидетельствуют о том, что соединения, удовлетворяющие микросомному in vitro-анализу и взятые в комбинации с ретинолом и с ретиниловыми сложными эфирами, действуют синергически, способствуя снижению дифференцировки кератиноцитов и/или увеличению пролиферации кератиноцитов и имитируя, тем самым, действие ретиноевой кислоты на кератиноциты. В примерах 14-19 проиллюстрированы композиции настоящего изобретения для местного применения. Эти композиции могут быть получены стандартным способом. Они являются пригодными для применения в косметике. В частности, эти композиции могут быть использованы для нанесения на морщинистую, шероховатую, сухую, шелушащуюся, увядшую и/или УФ-поврежденную кожу в целях улучшения ее внешнего вида и чувствительности, а также для нанесения на здоровую кожу в целях предупреждения или замедления ее деградации. Пример 14 В этом примере проиллюстрированы тонкодисперсные эмульсии типа “вода в масле”, включающие композицию настоящего изобретения, мас.% (табл. 14). Пример 15 В этом примере проиллюстрированы кремы типа “масло в воде”, включающие композицию настоящего изобретения, мас.% (табл. 15). Пример 16 В этом примере проиллюстрированы спиртовые лосьоны, включающие композицию настоящего изобретения, мас.% (табл. 16). Пример 17 В этом примере проиллюстрирован другой спиртовой лосьон, содержащий композицию настоящего изобретения, мас.% (табл. 17). Пример 18 В этом примере проиллюстрирован солнцезащитный крем, включающий композицию настоящего изобретения, мас.% (табл. 18). Пример 19 В этом примере проиллюстрирована безводная композиция для ухода за кожей, включающая комбинацию соединений настоящего изобретения, мас.% (табл. 19). Если это конкретно не указано в примерах, то материалы, используемые в настоящем изобретении, были получены из следующих источников: Пальмитоил CoA, BSA, дилауроилфосфатидилхолин, ретинол, ретиноевая кислота, дитиотреитол – от Sigma. Циклические алифатические ненасыщенные соединения: дамасконы – от Firmenich; иононы -от IFF. Другие соединения – от поставщиков в “Flavor and Fragrance Materials”, Allured Pub. Co. Имидазолиновые поверхностно-активные вещества: олеилимидазолином является соединение Scherocozoline О, поставляемое фирмой Scher Chemical Co.; другими соединениями, полученными от Mclntyre, под названием Mackazoline, были следующие соединения: Каприл, Коко, Лаурил: Mackazoline CY, C и L соответственно. Формула изобретения
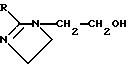 где R представляет собой алифатическую насыщенную или ненасыщенную, прямую или разветвленную углеводородную цепь, содержащую от 8 до 20 атомов углерода, и их смесей и косметически приемлемый носитель. 2. Композиция по п.1, где циклическое алифатическое ненасыщенное соединение выбирают из группы, состоящей из альфа-дамаскона, бета-дамаскона, дельта-дамаскона, изодамаскона, дамаскенона, альфа-ионона, бета-ионона, аллил-альфа-ионона, изобутил-ионона, альфа-метилионона, гамма-метилионона, брахманола, санданола, альфа-терпинеола, лираля, этилсафраната и их смесей. 3. Композиция по п.1, где дитерпеном является геранил-гераниол. 4. Композиция по любому из пп.1 – 3, где ретиниловый эфир выбирают из группы, состоящей из ретинилпальмитата, ретинилацетата, ретинилпропионата, ретиниллинолеата и их смесей. 5. Косметический способ ухода за кожей, предусматривающий местное нанесение на кожу косметической композиции по любому из пп.1 – 4. 6. Косметический способ ухода за кожей путем имитации действия на кожу ретиноевой кислоты, где указанный способ предусматривает нанесение на кожу косметической композиции по любому из пп.1 – 4. РИСУНКИ
|
||||||||||||||||||||||||||
