Патент на изобретение №2171863
|
||||||||||||||||||||||||||
(54) ПЛАЗМОХИМОТРОННЫЙ СПОСОБ ПОЛУЧЕНИЯ ПАРОГАЗОВОЙ СМЕСИ H2O2+O2
(57) Реферат: Изобретение относится к области обработки растворов физико-химическими и электрохимическими технологиями. Способ заключается в пропускании асимметричного по плотности выпрямленного электрического тока между анодом и стержневым катодом с одновременным продавливанием через дырчатый анод и полый катод, создающими газожидкостную смесь в межэлектродной камере, подкисленного или подщелоченного водного раствора электролита. В этих условиях, при потенциалах в межэлектродной камере от 220  10 до 140 10 до 140  5 В, в прикатодном пространстве спонтанно образуется химотронная плазма, в которой при температуре выходящего из реактора раствора, находящейся в интервале от 70 до 98° С, происходит синтез парогазовой смеси H2O2+O2 с выходом по энергии, приближающимся к теоретически возможному. Технический результат – повышение выхода по энергии парогазовой смеси H2O2+O2 при одновременном снижении затрат электроэнергии на синтез целевых продуктов, возможность достижения экологической чистоты продуктов синтеза. 3 з.п.ф-лы, 1 ил., 4 табл. 5 В, в прикатодном пространстве спонтанно образуется химотронная плазма, в которой при температуре выходящего из реактора раствора, находящейся в интервале от 70 до 98° С, происходит синтез парогазовой смеси H2O2+O2 с выходом по энергии, приближающимся к теоретически возможному. Технический результат – повышение выхода по энергии парогазовой смеси H2O2+O2 при одновременном снижении затрат электроэнергии на синтез целевых продуктов, возможность достижения экологической чистоты продуктов синтеза. 3 з.п.ф-лы, 1 ил., 4 табл.
Изобретение основывается на открытом в 1987-89 годах “Плазмохимотронном эффекте” [1]. Условия, необходимые для существования в высоковольтном электролизере устойчивой химотронной плазмы – проточная подкисленная или подщелоченная деионизованная вода в межэлектродном пространстве, неоднородное электрическое поле, позволяющее создать высокую плотность тока на катоде. При достижении в межэлектродном пространстве потенциалов от 115  5 до 57 5 до 57  3 В (2 М раствор H2SO4) спонтанно в прикатодном пространстве появляется устойчивая химотронная плазма, излучающая монохроматический свет. Цвет, а следовательно, и длина волны монохроматического света в плазмотроне изменяется плавно при снижении потенциала от потенциала зажигания плазмы (115 3 В (2 М раствор H2SO4) спонтанно в прикатодном пространстве появляется устойчивая химотронная плазма, излучающая монохроматический свет. Цвет, а следовательно, и длина волны монохроматического света в плазмотроне изменяется плавно при снижении потенциала от потенциала зажигания плазмы (115  5 В) до потенциала ее затухания (57 5 В) до потенциала ее затухания (57  3 В).
Цвет изменяется в следующей последовательности: красно-розовый, голубой, фиолетовый, невидимый ультрафиолет, т.е. полностью воспроизводится Бальмаровская серия спектральных линий атомарного водорода, что подтверждается спектрометрическим анализом.
Появление в межэлектродной камере высоковольтного электролизера устойчивой химотронной плазмы, представляющей собою биполярный плазменный электрод, сформированный в неоднородном электрическом поле ионизированным атомарным водородом и молекулами химически чистой воды на межфазной границе водородосодержащий катодный газ – водный раствор электролита, изменяет традиционные представления об электрохимических процессах синтеза H2O2+O2 в плотном элекролитическом веществе.
В ходе выполнения НИОКР теория и модель биполярного плазменного электрода получили дальнейшее развитие. На их основе установлены причинно-следственные связи механизма образования предельно энергонасыщенной для водных растворов электролитов перекиси водорода в химотронной плазме, позволяющие усовершенствовать известные технические решения [1-7].
Предлагаемое изобретение относится к области обработки растворов физико-химическими и электрохимическими технологиями и технике для их осуществления.
Изобретение может быть использовано во всех отраслях промышленности, сельском хозяйстве, медицине, коммунальном и водном хозяйствах, нетрадиционных энергетических установках.
Конкретное внедрение изобретения планируется в производствах получения кислородонасыщенных вод для пищевой промышленности.
Наиболее энергоемкой в парогазовой смеси H2O2+O2 является перекись водорода.
В водных растворах перекись водорода имеет два характерных потенциала: 3 В).
Цвет изменяется в следующей последовательности: красно-розовый, голубой, фиолетовый, невидимый ультрафиолет, т.е. полностью воспроизводится Бальмаровская серия спектральных линий атомарного водорода, что подтверждается спектрометрическим анализом.
Появление в межэлектродной камере высоковольтного электролизера устойчивой химотронной плазмы, представляющей собою биполярный плазменный электрод, сформированный в неоднородном электрическом поле ионизированным атомарным водородом и молекулами химически чистой воды на межфазной границе водородосодержащий катодный газ – водный раствор электролита, изменяет традиционные представления об электрохимических процессах синтеза H2O2+O2 в плотном элекролитическом веществе.
В ходе выполнения НИОКР теория и модель биполярного плазменного электрода получили дальнейшее развитие. На их основе установлены причинно-следственные связи механизма образования предельно энергонасыщенной для водных растворов электролитов перекиси водорода в химотронной плазме, позволяющие усовершенствовать известные технические решения [1-7].
Предлагаемое изобретение относится к области обработки растворов физико-химическими и электрохимическими технологиями и технике для их осуществления.
Изобретение может быть использовано во всех отраслях промышленности, сельском хозяйстве, медицине, коммунальном и водном хозяйствах, нетрадиционных энергетических установках.
Конкретное внедрение изобретения планируется в производствах получения кислородонасыщенных вод для пищевой промышленности.
Наиболее энергоемкой в парогазовой смеси H2O2+O2 является перекись водорода.
В водных растворах перекись водорода имеет два характерных потенциала:– окислительный потенциал 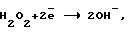 со значением со значением  o= 1,8 o= 1,8 0,1 В; 0,1 В;– восстановительный потенциал 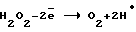 со значением со значением  в= 0,7 в= 0,7 0,1 В; 0,1 В;Окислительный потенциал должен соответствовать анодному образованию H2O2, восстановительный – образованию ее при самоокислении на катоде. Механизм процесса получения катодной перекиси водорода очень сложен и является малоизученным. Единственным электродным материалом, позволяющим достигнуть необходимых для электрохимических процессов получения H2O2+O2 при высоких потенциалах, являются платина или платиносодержащие материалы. Известны электрохимические способы получения H2O2+O2 на платиносодержащих анодах в растворах кислородосодержащих кислот или щелочей [2]. В промышленных электролизерах используется раствор H2SO4 или подкисленных H2SO4 сульфатов. При потенциалах 4-6 В они окисляются на платиновых анодах до надсерной кислоты H2S2O8 или ее солей. Из надсерной кислоты (или ее солей) путем гидролиза образуется H2SO4 и перекись водорода. Круговой процесс для серной кислоты может быть представлен в виде следующей схемы: 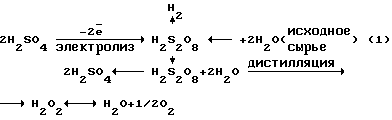 В результате кругового процесса образуется H2O2+O2, расходуется только электрическая энергия и вода. Выход H2O2+O2 по току составляет 70  20%. Выход по энергии при электрохимическом синтезе H2O2 составляет 20%. Выход по энергии при электрохимическом синтезе H2O2 составляет  10% от теоретического выхода (1250 г H2O2 на 1 кВт 10% от теоретического выхода (1250 г H2O2 на 1 кВт  ч).
Недостатки известного метода: ч).
Недостатки известного метода:– высокие затраты электроэнергии, 10-15 кВт  ч на 1 кг 100% H2O2 ч на 1 кг 100% H2O2– необратимый расход драгметаллов – высокие капитальные затраты для осуществления способа Известны электрохимические способы получения H2O2+O2 катодным восстановлением кислорода [3]. Теоретически установлено, что для хороших выходов H2O2 на катоде необходимы: высокая концентрация кислорода в католите и низкая плотность тока (  10-4 – 10-3 А/см2).
Механизм процесса описывается уравнениями: 10-4 – 10-3 А/см2).
Механизм процесса описывается уравнениями: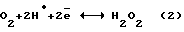 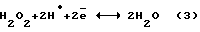 По уравнению (2) каталитическое восстановление растворенного в электролите кислорода выделяющимся с катода атомарным водородом идет при малых концентрациях H2O2. С повышением концентрации H2O2 (более 0,7%) включается механизм реакции (3), сопровождающийся резким снижением выхода по току H2O2. Для промышленной реализации метода предложено вести электролиз под давлением (  30-100 атм), предварительно насыщая раствор электролита кислородом.
При этих условиях напряжение в межэлектродных камерах достигает 2 В, плотность тока – 0,05 А/см2.
Применяется альмагамированные катоды и платинированные аноды. Выход по току H2O2 составляет 60 30-100 атм), предварительно насыщая раствор электролита кислородом.
При этих условиях напряжение в межэлектродных камерах достигает 2 В, плотность тока – 0,05 А/см2.
Применяется альмагамированные катоды и платинированные аноды. Выход по току H2O2 составляет 60  20%.
Недостатки известного способа: 20%.
Недостатки известного способа:– высокие затраты электроэнергии, 10-20 кВт  ч на 1 кг 100% H2O2; ч на 1 кг 100% H2O2;– применение высокого давления для осуществления способа; – низкая концентрация H2O2 в водном растворе; – применение амальгам и драгоценных металлов. Известен электрохимический способ [4], согласно которому для получения H2O2 + O2 применяются как анодный, так и катодный процессы. Благодаря двойному использованию тока количество электричества, затраченное на синтез целевого продукта уменьшается вдвое. Разработанному способу присущи недостатки перечисленные в технологиях [2, 3]. Известны физико-химические методы получения парогазовой смеси H2O2 + O2 при электрических разрядах (тлеющем, электродуговом, электроискровом) [5]. Смесь получается в качестве промежуточного продукта реакций между ионизированным водородом и кислородом. Выход 2O2 при этом зависит от температуры охлаждения стенок физико-химического реактора. Так, если при температуре 20oC выход H2O2 составляет 6,4%, то при температуре жидкого воздуха – 87,5%. Недостатки известных физико-химических методов: – высокая энергоемкость, 30- 60 кВт  ч на 1 кг 100% H2O2; ч на 1 кг 100% H2O2;– применение вакуума; – интенсивная эрозия материалов электродов; – применение драгоценных и редкорассеянных металлов. Известен метод получения H2O2 + O2 воздействием на газовую смесь H2+O2 атомарным водородом [6]. Газовую смесь H2+O2 облучают ультрафиолетовым светом длиной волны 2537А в присутствии сенсибилизатора (паров ртути). Поглощая свет, молекулы сенсибилизатора активизируются и передают избыток энергии молекулам водорода, заставляя их диссоциировать. Водородные атомы реагируют с кислородом с образованием преимущественно H2O2. Вода является вторичной реакцией, бурно протекающей при неохлажденной ртутной дуге. Процесс идет с аномально высокими скоростями, механизм которого основывается на цепных физико-химических реакциях. Максимальное количество смеси образуется в глубоком вакууме (P  0,035 мм рт. ст.).
Выход H2O2 на 1 квант УФ-света превышает 100%.
Недостатки метода: 0,035 мм рт. ст.).
Выход H2O2 на 1 квант УФ-света превышает 100%.
Недостатки метода:– высокая энергоемкость, 30-50 кВт  ч. на 1 кг 100% H2O2; ч. на 1 кг 100% H2O2;– применение вакуума; – использование паров ртути; – необходимость создания высоких скоростей в камере для газовой смеси H2+O2. Известен способ синтеза H2O2 из газовой смеси с предварительной атомизацией H2 в ионизационной камере (между конденсаторными пластинами из покрытого алюминием кварца, питаемый током с частотой 104 Гц и напряжением 12000 В) [7]. Пары конденсируются в колонне и дают 10% H2O2. Недостатки метода: – высокие затраты на ионизацию, 30 – 40 кВт  ч на 1 кг 100% H2O2; ч на 1 кг 100% H2O2;– высокие капитальные затраты на реализацию метода. Необходимость создания высоких скоростей для газовой смеси и использования вакуума. Наиболее близким из перечисленных выше аналогов является плазмохимотронный способ получения H2O2 + O2 в водных растворах электролитов [1]. В указанном способе H2O2 получается на межфазной границе водородосодержащий катодный газ – водный раствор электролита в химотронной плазме, спонтанно образующейся из ионизированных в неоднородном электрическом поле атомов водорода и молекул химической чистой воды. H2O2 в химотронной плазме синтезируется с аномально высокими скоростями. Механизм синтеза основан на взаимосогласованных ионно-атомных и ионно-молекулярных цепных реакциям. Для плазмохимотронного реактора [1] баланс материальных и энергетических потоков. 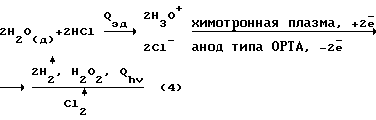 Баланс материальных энергетических потоков в адекватных условиях для электрохимического реактора (представлен для сравнения): 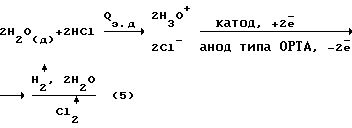 где Qэ.д. – энергия электролитической диссоциации Qhv – энергия монохроматического (красно-розового) излучения химотронной плазмы (Д) – индекс относится к деионизированной воде. H2O2 выделяется в раствор электролита из внешней (обращенной к аноду, отрицательно заряженной) обкладки биполярного плазменного электрода за счет электродонорной реакции, происходящей в химотронной плазме. 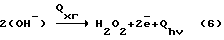 где Qхп – энергия химотронной плазмы Из анализа экспериментальных данных следует, что выход H2O2 по энергии составляет ~50  20%, т.е. составляет ~3 кВт 20%, т.е. составляет ~3 кВт ч на 1 кг 100% H2O2.
Недостатки известного метода: ч на 1 кг 100% H2O2.
Недостатки известного метода:– низкий выход парогазовой смеси H2O2 + O2 из химотронной плазмы и, как следствие, повышенные затраты электрической энергии на синтез целевого продукта. Техническим решением задачи является увеличение выхода парогазовой смеси H2O2 + O2 в плазмохимотронном реакторе и снижение затрат электроэнергии на ее получение. Решение задачи достигается: 1. за счет формирования химотронной плазмы в межзлектродной камере при потенциалах от 220  10 до 140 10 до 140 5 В в газожидкостном потоке, исходящем от дырчатого анода, смешивающимся в прикатодном пространстве с газожидкостным потоком, выходящим из полого катода, расположенного в центре цилиндрического отверстия межэлектродной камеры; 5 В в газожидкостном потоке, исходящем от дырчатого анода, смешивающимся в прикатодном пространстве с газожидкостным потоком, выходящим из полого катода, расположенного в центре цилиндрического отверстия межэлектродной камеры;2. расширенным применением компонентов в водном растворе электролита; 3. оптимальным интервалом температуры, необходимой для выхода парогазовой смеси H2O2+O2 из водного раствора электролита при синтезе; 4. эжекциoннoгo ввода через полый катод газожидкостной смеси за счет избыточного давления сжатого газа, неразрушающего парогазовую смесь. На чертеже представлены вольт-амперные характеристики заявляемого способа и известного технического решения, снятые в адекватных условиях. Смещение вольт-амперной характеристики в область высоких потенциалов изменяет механизм реакций синтеза H2O2 + O2 в химотронной плазме по отношению к реакциям (4,6) известного способа. Теории предсказывает, что при достижении в межэлектродном пространстве потенциалов 142  2 В биполярный плазменный электрод формирует на ионно-атомном и ионно-молекулярном уровнях материальные и энергетические потоки согласно уравнению (7): 2 В биполярный плазменный электрод формирует на ионно-атомном и ионно-молекулярном уровнях материальные и энергетические потоки согласно уравнению (7): где    ( ( )/ реверсивный потенциал таутомерного энергетического поля активированного вещества; )/ реверсивный потенциал таутомерного энергетического поля активированного вещества;(хп) – индекс, относящийся к химотронной плазме; (г) – индекс, относящийся к гидратированному протону и гидратированному электрону; (д) – индекс, относящийся к деионизованной воде. Уравнение (7) раскрывает физический смысл химотронной плазмы в биполярном плазменном электроде. Биполярный плазменный электрод состоит из биполярных кластерныx комплексов, образующихся в неоднородном электрическом поле высокой напряженности на межфазной границе водородосодержащий газ – водный раствор электролита, которые обладают способностью как к разделению протонно-электронных зарядов, так и связанного с ними вещества, используя неизвестное ранее явление “таутомерного энергетического поля активированного вещества”. Химически чистая перекись водорода получается в парогазовой смеси H2O2 + O2 при распаде отрицательно заряженных кластеров внешней обкладки биполярного плазменного электрода по уравнению: 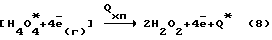 где Q* – дополнительная энергия, выделяющаяся в водный раствор электролита при распаде электронизированных кластеров химически чистой перекиси водорода; 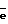 – электроны низкой энергии, участвующие в электрохимических; процессах на дырчатом аноде.
С учетом электрохимических реакций, происходящих по уравнению (9) на дырчатом аноде, выход целевых продуктов по энергии в заявляемом способе должен в два раза превышать выход парогазовой смеси H2O2+O2 в известном техническом решении. – электроны низкой энергии, участвующие в электрохимических; процессах на дырчатом аноде.
С учетом электрохимических реакций, происходящих по уравнению (9) на дырчатом аноде, выход целевых продуктов по энергии в заявляемом способе должен в два раза превышать выход парогазовой смеси H2O2+O2 в известном техническом решении.
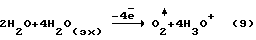 где (эх) – индекс, относящийся к адсорбированным дырчатым анодом молекулам H2O. Механизм синтеза вещества в заявляемом способе имеет биотический аналог – фотосинтез вещества в клетках. Признаки, совпадающие в механизме синтеза вещества заявляемым способом и в его биотическом аналоге: – энергия H4O*4 в два раза превышает энергию H2O2, полученную в известном техническом решении, равную 1,85+0,05 эВ (  = 667 = 667  5 нм), т.е. в синтезе кластерной химически чистой перекиси водорода разрешены длины волн от 667 5 нм), т.е. в синтезе кластерной химически чистой перекиси водорода разрешены длины волн от 667  5 до 333 5 до 333  5 нм. Длина волны фотонов зеленого цвета, резонансно поглощаемых растительными клетками ~520 нм, фотобактериями ~660 нм, митических волн ~300 – 350 нм.; 5 нм. Длина волны фотонов зеленого цвета, резонансно поглощаемых растительными клетками ~520 нм, фотобактериями ~660 нм, митических волн ~300 – 350 нм.;– в синтезе вещества клетками, также как и в заявляемом способе, участвуют от 4 до 8 молекул H2О [8]; – аномально высокие выходы целевых продуктов по энергии [8]; – в механизме синтеза вещества растительными и животными клетками используется дополнительная энергия от источника энергии, возникающем в активированном веществе, природа происхождения которого до сих пор была неизвестна [9]. Учитывая сказанное выше, полученная заявленным способом парогазовая смесь H2O2+O2 является экологически чистым продуктом для живых организмов. При нормированной дозировке смесь H2O2 + O2 может быть широко использована для приготовления кислородонасыщенной воды и напитков, способствующих стабилизации синхронных обменных процессов в клетках растений, животных и человека. На основе разработанной выше технологии планируется выпуск (широкой гаммы продукции с этикеткой “Супервода”. В таблицах 1-4 представлены экспериментальные данные, снятые на стендовой установке, позволяющей в адекватных условиях испытать заявленный способ и известное техническое решение. В опытах были использованы методики проведения эксперимента и анализов [1]. Выход парогазовой смеси H2O2+O2 по энергии определены прямым методом по разнице между весом раствора на входе в реактор и на выходе из него с использованием диагностического стенда, включающего: – систему одновременного взвешивания водного раствора электролита, входящего в реактор и выходящего из него (вес пропускаемого раствора – 6000 грамм, точность взвешивания  10 грамм); 10 грамм);– счетчика злектроэнергии, установленного на входе в блок питания реактора; – систему одновременного замера температуры водного раствора электролита, входящего в реактор и выходящего из него; – систему наличия в парогазовой смеси H2O2+O2 водорода, использующей нижнию границу взрыва гремучей смеси (4  1% Н2 в смеси H2 + O2 при нормальных условиях); 1% Н2 в смеси H2 + O2 при нормальных условиях);– часы и секундомеры для фиксирования времени работы реактора. Точность показания диагностического стенда при определении активной и нейтральной форм кислорода в парогазовой смеси проверялась методом поглощения парогазовой смеси в 60 литрах подкисленной деионизованной воды, находящейся в закрытом циркуляционном контуре в термостатированных условиях при t = 20+2oC, герметично соединенном с барабанным счетчиком газа. Содержание растворенных в подкисленной деионизованной воде форм кислорода замеряли с использованием проточного датчика растворенного кислорода и методами титрования по стандартным методикам. Выход парогазовой смеси H2O2+O2 по энергии (  в) определяли по уравнению (10) в) определяли по уравнению (10)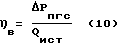 где  Pпгс = Рисх – Ркон; Pпгс = Рисх – Ркон; Рпгс – вес парогазовой смеси H2O2+O2 в граммах (кг); Рпгс – вес парогазовой смеси H2O2+O2 в граммах (кг);Рисх – вес водного раствора электролита, входящего в реактор, в граммах (кг); Ркон – вес водного раствора электролита, выходящего из реактора, в граммам (кг); Qист – количество электроэнергии от внешнего источника на синтез парогазовой смеси, замеренное по счетчику электроэнергии за промежуток времени работы реактора, кДж (кВт  ч).
Точность определения ч).
Точность определения  в с помощью приборов систем диагностического стенда (с учетом погрешностей, вносимых приборами и методами проверки стенда) находилась в пределах в с помощью приборов систем диагностического стенда (с учетом погрешностей, вносимых приборами и методами проверки стенда) находилась в пределах  20%.
Количество дополнительной энергии, выделяемой химотронной плазмой при взаимосогласованных цепных реакциях синтеза и распада биполярных энергетических комплексов, спонтанно возникающим на межфазной границе водородосодержащий газ – раствор электролита в таутомерном энергетическом поле активированного вещества, определяли по уравнению (11): 20%.
Количество дополнительной энергии, выделяемой химотронной плазмой при взаимосогласованных цепных реакциях синтеза и распада биполярных энергетических комплексов, спонтанно возникающим на межфазной границе водородосодержащий газ – раствор электролита в таутомерном энергетическом поле активированного вещества, определяли по уравнению (11):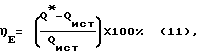 где Q* = Qпгсmin + Qp; 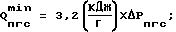 Qp = Pисх  Cp Cp  (tpk – tpн (tpk – tpнQ* – энергия, затраченная на синтез парогазовой смеси H2O2+O2 в реакторе, кДж (кВт  ч); ч);Qпгсmin – минимальная энергоемкость 1 г парогазовой смеси, определяемая по выходу 100% H2O2 (1125 г на 1 кВт  ч), кДж; ч), кДж;Qр – затраты энергии на нагрев раствора в реакторе до температуры выхода парогазовой смеси H2O2+O2, кДж; Cр – теплоемкость исходного раствора Дж/г oC; t рк и tрн – соответственно температура раствора на выходе из реактора и на входе в реактор, oC; Точность определения  E адекватна точности определения E адекватна точности определения  В.
В таблице 1 представлены экспериментальные данные по влиянию потенциала устойчивой химотронной плазмы в межзлектродной камере заявляемого и известного способов на выход парогазовой смеси H2O2 + O2 ( В.
В таблице 1 представлены экспериментальные данные по влиянию потенциала устойчивой химотронной плазмы в межзлектродной камере заявляемого и известного способов на выход парогазовой смеси H2O2 + O2 ( В) и количество дополнительной энергии, генерируемой химотроной плазмой в таутомерном энергетическом поле активированного вещества ( В) и количество дополнительной энергии, генерируемой химотроной плазмой в таутомерном энергетическом поле активированного вещества ( E).
Условия проведения испытаний: E).
Условия проведения испытаний:– состав раствора – H2SO4 (хч) + деионизованная вода; – концентрация раствора – 2 М (2H раствор H2SO4); – массовая скорость раствора, проходящего через работающий реактор – 3,3  0,3 г/с; 0,3 г/с;– температура исходного раствора – 20  1oC; 1oC;– масса пропускаемого раствора – 6000 г. Данные табл. 1 показывают, что при V от 220  10 до 140 10 до 140 5 В (tр – от 70 до 98oC) выход H2O2+O2 по энергии увеличивается в 1,8 – 2,5 раза, а энергозатраты на ее получение снижаются в 1,5 – 1,8 раза по отношению к известному способу [1].
Влияние показателя среды pH водного раствора электролита в заявляемом способе представлено экспериментальными табл. 2.
Условия проведения испытаний: 5 В (tр – от 70 до 98oC) выход H2O2+O2 по энергии увеличивается в 1,8 – 2,5 раза, а энергозатраты на ее получение снижаются в 1,5 – 1,8 раза по отношению к известному способу [1].
Влияние показателя среды pH водного раствора электролита в заявляемом способе представлено экспериментальными табл. 2.
Условия проведения испытаний:– общая концентрация ионов приведена к 1Н раствору H2SO4; – реактивы чистотой ЧДА, ХЧ; – растворители – деионизованная или дистилированная вода (   200 кОм 200 кОм см); см);– потенциал устойчивый химотронной плазмы в межэлектродной камере – 200  10 В; 10 В;– массовая скорость раствора, проходящего через реактор, температура, масса – см. табл. 1. Данные табл. 2 экспериментально подтверждают, что для существования в межэлектродном пространстве реактора химотронной плазмы необходимо присутствие в водном растворе ионов гидроксония (H3O+) или ионов гидроксила (OH–), обладающих аномально высокой подвижностью (превышающих на порядок подвижность ионов Na+, SO4– и других). Влияние химического состава водного раствора электролита на  В, В,  E в заявляемом способе представлены данными табл. 3.
Условия проведения испытаний: E в заявляемом способе представлены данными табл. 3.
Условия проведения испытаний:– общая концентрация ионов приведена к 1Н раствора H2SO4; – реактивы чистотой ЧДА, ХЧ; – растворители – деионизованная или дистилированная вода (   200 кОм 200 кОм см); см);– массовая скорость раствора, проходящая через реактор, температура, масса – см. условия табл. 1. Экспериментальные данные табл. 3 доказывают возможность применения в заявляемом способе широкого спектра кислородосодержащих химических соединений в водном растворе электролита, применяемых для синтеза парогазовой смеси H2O2+O2. При этом наблюдается незначительное отклонение  В, В,  E от данных, полученных в табл. 1 при оптимальных V.
В таблице 4 представлены данные по влиянию эжекционного ввода водного раствора электролита через полый катод в виде газожидкостной смеси в межэлектродную камеру за счет избыточной энергии сжатого газа.
Условия проведения испытаний: E от данных, полученных в табл. 1 при оптимальных V.
В таблице 4 представлены данные по влиянию эжекционного ввода водного раствора электролита через полый катод в виде газожидкостной смеси в межэлектродную камеру за счет избыточной энергии сжатого газа.
Условия проведения испытаний:– концентрация ионов в водном растворе электролита – 1 Н раствор; – реактивы чистотой ЧДА, ХЧ, растворенные в деионизованной воде; – потенциал устойчивой химотронной плазмы – 200  10 В; 10 В;– массовый расход, температура и масса пропускаемого раствора, см. условия в табл. 1. Эжекционный ввод водного раствора электролита через полый катод в виде газожидкостной смеси в межэлектродную камеру за счет избыточной энергии сжатого газа обеспечивает повышение не менее чем на 10%.  В и В и  E. E.Т.о., на основании экспериментальных данных, подтверждающих теорию механизма формирования химотронной плазмы и модель биполярного плазменного электрода, заявляемый способ по выходу целевых продуктов и по затратам электроэнергии в 1,5 – 2,0 раза более эффективен, чем технология получения H2O2+O2 в техническом решении [1]. Источники информации 1. Отчет о НИР “Разработка и испытание инженерно-энергетических комплексов обработки бытовых и агропромышленных сточных вод с использованием возобновляемых источников энергии” N Гос. регистрации 01890007585, Инв N – 2890055415, 1989, 143 с. 2. Перекись водорода и перекисные соединения. Под ред. Проф. Позина М.Е. М-Л, Изд-во ГНТИ Химической литературы 1951, с. 162-207. 3. Перекись водорода и перекисные соединения, М. – Л., Изд-во ГНТИ Хим. лит. 1951, с. 140-144. 4. Перекись водорода и перекисные соединения, М. – Л., Изд-во ГНТИ Хим. лит. 1951, с. 145-146. 5. Перекись водорода и перекисные соединения, М. – Л., Изд-во ГНТИ Хим. лит. 1951, с. 43-44. 6. Перекись водорода и перекисные соединения, М. – Л., Изд-во ГНТИ Хим. лит. 1951, с. 140-144. 7. Перекись водорода и перекисные соединения, М. – Л., Изд-во ГНТИ Хим. лит. 1951, с. 135 – 136. 8. Бергельсон Л.Д. Мембраны, молекулы, клетки. М., Наука, 1982, 182 с. 9. Ясайтис А. А. Молекулярная биоэнергетика. М., ВИНИТИ, 1973 (итоги науки и техники. Биофизика; т. 3). Формула изобретения
 5 до 57 5 до 57  3 В спонтанно образовать в прикатодном пространстве из ионизированных в неоднородном электрическом поле атомов водорода и молекул химически чистой воды, находящихся на межфазной границе водородосодержащий катодный газ – водный раствор электролита, устойчивую химотронную плазму, отличающийся тем, что устойчивая химотронная плазма формируется в прикатодном пространстве межэлектродной камеры при потенциалах от 220 3 В спонтанно образовать в прикатодном пространстве из ионизированных в неоднородном электрическом поле атомов водорода и молекул химически чистой воды, находящихся на межфазной границе водородосодержащий катодный газ – водный раствор электролита, устойчивую химотронную плазму, отличающийся тем, что устойчивая химотронная плазма формируется в прикатодном пространстве межэлектродной камеры при потенциалах от 220  10 до 140 10 до 140  5 В в газожидкостном потоке, восходящим к катоду от дырчатого анода, смешивающимся с газожидкостным потоком, выходящим из отверстия полого катода, расположенного в центре цилиндрического отверстия межэлектродной камеры.
2. Способ по п.1, отличающийся тем, что синтез парогазовой смеси Н2O2 + O2 в химотронной плазме проводят при оптимальной температуре водного раствора электролита, выходящего из реактоpa, определенной интервалом от 70 до 98oС.
3. Способ по п.1, отличающийся тем, что в подкисленную или подщелоченную деионизованную воду добавляют соли металлов с кислородосодержащими анионами в количестве, не изменяющем рН среды, при котором происходит синтез.
4. Способ по п.1, отличающийся тем, что поток водного раствора электролита в виде газожидкостной смеси вводят эжекционно через полый катод в межэлектродную камеру реактора за счет избыточной энергии сжатого газа, неразрушающего парогазовую смесь Н2О2 + O2. 5 В в газожидкостном потоке, восходящим к катоду от дырчатого анода, смешивающимся с газожидкостным потоком, выходящим из отверстия полого катода, расположенного в центре цилиндрического отверстия межэлектродной камеры.
2. Способ по п.1, отличающийся тем, что синтез парогазовой смеси Н2O2 + O2 в химотронной плазме проводят при оптимальной температуре водного раствора электролита, выходящего из реактоpa, определенной интервалом от 70 до 98oС.
3. Способ по п.1, отличающийся тем, что в подкисленную или подщелоченную деионизованную воду добавляют соли металлов с кислородосодержащими анионами в количестве, не изменяющем рН среды, при котором происходит синтез.
4. Способ по п.1, отличающийся тем, что поток водного раствора электролита в виде газожидкостной смеси вводят эжекционно через полый катод в межэлектродную камеру реактора за счет избыточной энергии сжатого газа, неразрушающего парогазовую смесь Н2О2 + O2.
РИСУНКИ
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Номер и год публикации бюллетеня: 32-2001
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 25.09.2001 № 13163
Извещение опубликовано: 20.11.2001
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Номер и год публикации бюллетеня: 4-2003
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 25.11.2002 № 15558
Извещение опубликовано: 10.02.2003
PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Номер и год публикации бюллетеня: 21-2003
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 03.06.2003 № 16861
Извещение опубликовано: 27.07.2003
QB4A Регистрация лицензионного договора на использование изобретения
Лицензиар(ы): ООО “Оргсин-Инвест”
Вид лицензии*: НИЛ
Лицензиат(ы): ООО “Компания “ОКСИТЕХ”
Номер и год публикации бюллетеня: 10-2004
Договор № 18372 зарегистрирован 04.02.2004
Извещение опубликовано: 10.04.2004
* ИЛ – исключительная лицензия НИЛ – неисключительная лицензия
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 31.07.2008
Извещение опубликовано: 20.04.2009 БИ: 11/2009
NF4A Восстановление действия патента СССР или патента Российской Федерации на изобретение
Дата, с которой действие патента восстановлено: 20.04.2009
Извещение опубликовано: 20.04.2009 БИ: 11/2009
|
||||||||||||||||||||||||||
