Патент на изобретение №2170252
|
||||||||||||||||||||||||||
(54) ШТАММ STREPTOMYCES SP. Z-11-6-ПРОДУЦЕНТ ВНЕКЛЕТОЧНОЙ L-ГЛУТАМАТОКСИДАЗЫ
(57) Реферат: Изобретение относится к области биотехнологии и медицины. Получаемый фермент может быть использован в аналитической химии, пищевой промышленности и клинической биохимии. Предложен генетически стабильный штамм Streptomyces sp. Z-11-6 с высокой L-глутаматоксидазной активностью – 1,6-1,8 ед/мл культуральной жидкости. L-глутаматоксидаза из Streptomyces sp. Z-11-6 обладает более высокой субстратной специфичностью к L-глутамату, температурной и рН стабильностью, устойчивостью к действию ионов металлов, ингибиторов и хелатирующих агентов. 3 табл., 6 ил. Изобретение относится к области биотехнологии и медицины, конкретно к новому штамму – продуценту внеклеточной L-глутаматоксидазы, обладающей высокой субстратной специфичностью к L-глутамату. Внеклеточная глутаматоксидаза микробного происхождения (L-глутамат: O2 оксидо-редуктаза (дезаминаза) ЕС 1.4.3.11] – фермент, который специфично катализирует реакцию окислительного дезаминирования L-глутамата в присутствии воды и кислорода с образованием  -кетоглутарата, аммиака и перекиси водорода: -кетоглутарата, аммиака и перекиси водорода: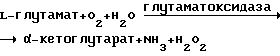 Этот фермент может быть использован как в качестве аналитического реагента, так и для создания на его основе биосенсоров для определения L-глутамата, аммиака,L-глутамина, креатинина, аминотрансфераз, что открывает широкие возможности в аналитической химии (качественная и количественная оценка ферментативных процессов), а также в пищевой промышленности (оценка качества пищевых продуктов). Особенно важно использование этого фермента в клинической биохимии для определения глутамат- пируват-трансаминазы и глутамат-оксалоацетат-трансаминазы в биологических жидкостях, что позволяет осуществлять раннюю диагностику заболеваний сердца и печени. Известно, что при инфаркте миокарда глутамат-пируват-трансаминаза и глутамат- оксалоацетат-трансаминаза выходят из поврежденных клеток миокарда и попадают в кровоток. Определение в сыворотке крови концентрации этих двух трансаминаз может дать ценную информацию о степени тяжести и о стадии повреждения сердечной мышцы. Кроме того, определение концентрации этих двух трансаминаз в сыворотке крови играет важную роль в ранней диагностике таких профзаболеваний, как заболевание печени у лиц, работающих с различными органическими растворителями, применяемыми в химической и других отраслях промышленности. До настоящего времени была известна глутаматоксидаза из змеиного яда, почек крыс и мышей, печени птиц. Были обнаружены продуценты глутаматоксидазы и среди грибов: пиреномицетов – Neurospora crassa и дейтеромицетов – Colletotrichum sp. M 5073, паразитирующий на семенах Calophyllum inophyllum (пат. США N 4 357 425). Продуцентами глутаматоксидазы микробного происхождения являются микроорганизмы, относящиеся к группе стрептомицетов: Streptomyces endus, ZIMET 43772 – пат. ГДР N 240910. пат. ГДР N 272 101; Streptomyces cattleya, ZIMET 4 378 5 – пат. ГДР N 261932. пат. ГДР N 272 101; Streptomyces sp. A 7700, FERMP-6241 и Streptomyces sp. A 8063, FERM8-6242 -пат. США N 4605615 и его аналоги: пат. Японии N 58 149 676, пат. ФРГ N 3307607 и N 3348379; Streptomyces violascens, H 82-N-SY7 – пат. Японии N 057043685 Streptomyces sp. X-119-6, FERMP-6560 – пат. США N 4 623 626. пат. США N 4 614 714 и их патенты-аналоги: ЕР N 097949, пат. Японии N 112271, N 145346, N 146707, N 59002 686, N 59034882. Из указанных выше ссылок только подчеркнутые имеют непосредственное отношение к новым штаммам-продуцентам глутаматоксидазы. Остальные – к практическому использованию этих штаммов для получения L-глутаматоксидазы в лабораторных условиях. Все технические решения содержат одинаковое количество сходных признаков. В качестве прототипа был выбран штамм-продуцент с наибольшей глутаматоксидазной активностью, описанный в патенте США N 4623626. Этот продуцент был выделен из почвенных образцов, взятых в Тоношо-маши, Катори-гун и Шиба-кен (Япония). По своим морфолого-культуральным и физиолого-биохимическим свойствам данный штамм был отнесен к группе стрептомицетов: Streptomyces sp. Х-119-6, FERM P 65-60. Была проведена очистка фермента, включающая стадии высаливания и фракционирования органическими растворителями, избирательную адсорбцию, ионообменную хроматографию, гель-фильтрацию, диализ и лиофилизацию. Очищенный таким образом фермент имел удельную активность порядка 55 ед/мг белка, а выход его составлял 18,4% от исходного. Очищенный фермент обладал относительной субстратной специфичностью к L-глутамату: если принять за 100% активность фермента к L-глутамату, то его активность к L-аспартату составляла 0,6%, в отношении других аминокислот активность фермента была менее 0,1%. KM по L-глутамату составляет 2,1  10-4 М при pH 7,4. Оптимум pH: от 7,0 до 8,5. pH стабильность: стабилен в диапазоне pH от 5,5 до 10,5 при 37oC в течение 60 мин. Температурная стабильность: стабилен до 65oC при pH 5,5 в течение 15 мин. Фермент не инактивируется хлоридом меди в концентрации 1 мМ при pH 7,4, но ингибируется на 45% п-хлормеркурибензоатом.
В настоящее время актуальна задача по получению высоко продуктивных штаммов-продуцентов внеклеточной L-глутаматоксидазы, обладающей высокой субстратной специфичностью. Задача была решена в процессе поиска природного штамма-продуцента и получения из него в результате мутационно-селекционного подхода генетически стабильного мутантного штамма, обладающего всем комплексом улучшенных свойств.
В 1996 году на кафедре микробиологии Московского Государственного Университета им. М.В. Ломоносова из почвенного образца, взятого из торфяника Липецкой области, был выделен Streptomyces sp. Z-11, являющийся продуцентом внеклеточной глутамат-оксидазы. Согласно определителю актиномицетов Гаузе (1983), по своим морфолого-культуральным и физиолого-биохимическим свойствам данный штамм наиболее близок к Streptomyces canofumeus, Krassilnikov 1970 (типовой штамм: ИНМИ 516 = ВКМ 70). В результате проведенного мутагенеза, при котором в качестве мутагена применяли азотистую кислоту, из природного штамма был получен генетически стабильный мутантный штамм Streptomyces sp. Z-11-6, глутаматоксидазная активность которого была в 40 раз выше природного и составляет порядка 1,6-1,8 ед/мл культуральной жидкости. Частично очищенный фермент обладает высокой субстратной специфичностью к L-глутамату. Из 20 аминокислот, включая D-глутамат, глутаматоксидаза из Streptomyces sp. Z-11-6 проявляла высокую активность только к L-глутамату, что позволяет определять концентрацию L-глутамата на фоне других аминокислот. Кроме того, Streptomyces sp. Z-11-6 при культивировании на жидких средах, содержащих дрожжевой или кукурузный экстракты, образует пигменты меланоидного типа в значительно меньшем количестве, чем природный штамм, что облегчает операцию по экстракции и очистке фермента. Полученный мутантный штамм генетически стабилен: при хранении штамма на овсяном агаре при 4oC в течение 4-6 месяцев наблюдалось сохранение продуктивности на 99-98%. По своим морфолого-культуральным и физиолого-биохимическим свойствам мутантный штамм, Streptomyces sp Z-11-6, близок к природному.
Морфолого-культуральные свойства Streptomyces sp. Z-11-6 10-4 М при pH 7,4. Оптимум pH: от 7,0 до 8,5. pH стабильность: стабилен в диапазоне pH от 5,5 до 10,5 при 37oC в течение 60 мин. Температурная стабильность: стабилен до 65oC при pH 5,5 в течение 15 мин. Фермент не инактивируется хлоридом меди в концентрации 1 мМ при pH 7,4, но ингибируется на 45% п-хлормеркурибензоатом.
В настоящее время актуальна задача по получению высоко продуктивных штаммов-продуцентов внеклеточной L-глутаматоксидазы, обладающей высокой субстратной специфичностью. Задача была решена в процессе поиска природного штамма-продуцента и получения из него в результате мутационно-селекционного подхода генетически стабильного мутантного штамма, обладающего всем комплексом улучшенных свойств.
В 1996 году на кафедре микробиологии Московского Государственного Университета им. М.В. Ломоносова из почвенного образца, взятого из торфяника Липецкой области, был выделен Streptomyces sp. Z-11, являющийся продуцентом внеклеточной глутамат-оксидазы. Согласно определителю актиномицетов Гаузе (1983), по своим морфолого-культуральным и физиолого-биохимическим свойствам данный штамм наиболее близок к Streptomyces canofumeus, Krassilnikov 1970 (типовой штамм: ИНМИ 516 = ВКМ 70). В результате проведенного мутагенеза, при котором в качестве мутагена применяли азотистую кислоту, из природного штамма был получен генетически стабильный мутантный штамм Streptomyces sp. Z-11-6, глутаматоксидазная активность которого была в 40 раз выше природного и составляет порядка 1,6-1,8 ед/мл культуральной жидкости. Частично очищенный фермент обладает высокой субстратной специфичностью к L-глутамату. Из 20 аминокислот, включая D-глутамат, глутаматоксидаза из Streptomyces sp. Z-11-6 проявляла высокую активность только к L-глутамату, что позволяет определять концентрацию L-глутамата на фоне других аминокислот. Кроме того, Streptomyces sp. Z-11-6 при культивировании на жидких средах, содержащих дрожжевой или кукурузный экстракты, образует пигменты меланоидного типа в значительно меньшем количестве, чем природный штамм, что облегчает операцию по экстракции и очистке фермента. Полученный мутантный штамм генетически стабилен: при хранении штамма на овсяном агаре при 4oC в течение 4-6 месяцев наблюдалось сохранение продуктивности на 99-98%. По своим морфолого-культуральным и физиолого-биохимическим свойствам мутантный штамм, Streptomyces sp Z-11-6, близок к природному.
Морфолого-культуральные свойства Streptomyces sp. Z-11-6Вегетативные гифы, 0,6-0,8 мкм в диаметре, образуют хорошо развитый разветвленный мицелий, не распадающийся на фрагменты. Гифы воздушного мицелия, 0,9-1,0 мкм, в зрелом состоянии несут цепочки спор. Цепочки спор спиральные, в виде хорошо развитых, правильных, растянутых спиралей от двух до четырех оборотов. Споры, 0,6-0,7 х 0,9-1,0 мкм, неподвижны, элипсовидные с гладкой поверхностью. Склероцио-, спорангио-, пикнидио- и синнемаподобные структуры не обнаружены. Штамм грамположителен, не кислотоустойчив. Клеточная стенка содержит L-диами-нопимелиновую кислоту (клеточная стенка 1 типа). Рост штамма Streptomyces sp. Z-11-6 на различных диагностических средах при 28oC в течение 14 дней представлена в таблице 1. При росте на овсяном агаре при 28oC в течение 7-14 дней Streptomyces sp. Z-11-6 образует плотные, врастающие в агар концентрические колонии с фестончатым краем d ~ 1-3 мм. Поверхность колонии покрыта бархатистым воздушным мицелием, который обладает гидрофобными свойствами. Streptomyces sp. Z-11-6 растет при температуре от 20 до 37oC, оптимум при 26-28oC. Аэроб. Физиолого-биохимичские свойства Использование источников углерода: Данный штамм выращивали на среде ISP 9 (среда Готтлиба и Придгема) с различными источниками углерода при 28oC в течение 21 дня. Результаты оценивались на 7, 14 и 21-й день роста при сравнении с отрицательным контролем (среда без добавления источника углерода) и положительным контролем (среда с D-глюкозой). Streptomyces sp. Z- 11-6 хорошо утилизирует глюкозу, арабинозу, сахарозу, ксилозу, маннит, фруктозу, галактозу, мальтозу, рамнозу, крахмал, глицерин и гидролизат казеина. Относительно хорошо – раффинозу, не использует – инозит. Слабо разлагает желатину, хорошо гидролизует крахмал. Использование источников азота: Данный штамм выращивали на среде следующего состава (%): глюкоза – 1, MgSO4  7H2O – 0,05, NaCl – 0,05, FeSO4 7H2O – 0,05, NaCl – 0,05, FeSO4  7H2O – 0,001, K2HPO4 – 0,1, агар 1,5, pH 7,0. Результаты оценивали на 15 сутки в сравнении с отрицательным контролем (среда без источника азота) и положительными контролями (среда с L-пролином и среда с L-аспарагином). Штамм Streptomyces sp. Z-11-6 плохо потребляет в качестве единственного источника азота следующие соединения: аргинин, цистеин, цистин, фенилаланин, аспарагин, нитрат аммония.
Способ получения внеклеточной L-глутаматоксидазы: 7H2O – 0,001, K2HPO4 – 0,1, агар 1,5, pH 7,0. Результаты оценивали на 15 сутки в сравнении с отрицательным контролем (среда без источника азота) и положительными контролями (среда с L-пролином и среда с L-аспарагином). Штамм Streptomyces sp. Z-11-6 плохо потребляет в качестве единственного источника азота следующие соединения: аргинин, цистеин, цистин, фенилаланин, аспарагин, нитрат аммония.
Способ получения внеклеточной L-глутаматоксидазы:Среда, используемая для поддержания штамма, состоит из 2% овсяной муки и 1,8% агара. Жидкая среда для культивирования содержит: 3% глюкозы, 0,6% кукурузного экстракта, 0,6% сульфата аммония, 3% карбоната кальция, 0,3% хлорида кальция и по 0,1% хлорида магния и хлорида калия; pH среды 7,0. Посевной материал выращивали в течение ночи и полученным инокулятом (5% по объему) засевали среду, разлитую по 100 мл в 750-миллиметровые качалочные колбы. Выращивание проводили при 26oC на качалке (190 об/мин). Максимальный выход продукта наблюдался через 28 ч от начала культивирования и составлял порядка 1,6-1,8 ед/мл культуральной жидкости. Была разработана схема очистки фермента. Мицелий выросшей культуры Strepto-myces sp. Z-11-6 отделяли от культуральной жидкости фильтрованием через плотную ткань. Фильтрат концентрировали на разделительном аппарате АР – 0,1 [0,2 мПа] (“Биотест”, г. Кириши). Для осаждения белковой смеси использовали сульфат аммония (50% от насыщения). Осадок, собранный центрифугированием при 8000 g в течение 15 мин, перерастворяли в 0,05 М K-фосфатном буфере (pH 7,0) с 0,6 М NaCl. Полученный раствор фермента пропускали через колонку (2,0 х 25 см) с ДЕАЕ-целлюлозой (диэтиламиноэтил), уравновешенную 0,05 М К-фосфатным буфером (pH 7,0). Отобранные активные фракции были подвергнуты диализу в 0,005 М К-фосфатном буфере (pH 7,0) в течение ночи. Осадок, образовавшийся в процессе диализа, удалили центрифугированием, а супернатант вновь пропустили через колонку (2,0 х 25 см) с ДЕАЕ-целлюлозой, уравновешенную 0,05 М К-фосфатным буфером (pH 7,0). Очищенный таким образом фермент имел удельную активность порядка 10 ед/мг белка, а выход его составлял 25-30%. Чистоту фермента определяли по нативному гель-электрофорезу в 10% ПААГе. Измерение глутаматоксидазной активности. Измерение ферментной активности проводили на основе пероксидазной хромогенной реакции. Реакционная смесь содержала (на 1 мл): 2,5 ед пероксидазы из хрена (300 ед/мг), 1,0 мкмоль 4-аминоантипирина, 17,5 мкмоля фенола, 10 мкмолей L-глутамата в 0,1 М K-фосфатном буфере, pH 7,0. Реакционную смесь инкубировали при 37oC в течение двух минут и реакцию инициировали, добавляя исследуемый фермент. Глутаматоксидазную активность измеряли по изменению оптической плотности раствора при длине волны 500 нм на спектрофотометре Хитачи 200-20 (Япония). Активность фермента рассчитывали по формуле: 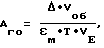 где Aго – глутаматоксидазная активность исследуемых образцов;  – изменение величины оптической плотности раствора в кювете за одну минуту при 37oC; Vоб – общий объем раствора в кювете; VE – объем вносимой пробы; – изменение величины оптической плотности раствора в кювете за одну минуту при 37oC; Vоб – общий объем раствора в кювете; VE – объем вносимой пробы;  м – коэффициент молярной экстинкции хромогенного соединения – хинонимина. За единицу активности фермента (ед) принимали такое его количество, которое катализирует образование одного мкмоля перекиси водорода за одну минуту при 37oC.
Был изучен ряд энзимологических свойств исследуемой L- глутаматоксидазы.
Субстратная специфичность: полученный фермент обладает высокой субстратной специфичностью к L-глутамату: из 20 аминокислот глутаматоксидаза из Streptomyces sp. Z-11-6 проявляла высокую активность только к L-глутамату (табл.2). m для L- глутамата составляет 0,34 мМ при pH 7,0.
Оптимум pH: активность фермента при различных значениях pH измеряли при 30oC, используя в качестве субстрата L-глутамат в 0,2 М ацетатном буфере (pH 3,5-6,0); 0,2 М фосфатном буфере (pH 6,0- 8,5) и 0,2 М глицин-NaOH буфере (pH 8,5-11,5). Оптимум pH исследуемого фермента широк и наблюдается в области pH от 6,5 до 9,5 (фиг. 1).
pH стабильность: фермент инкубировали при соответствующих значениях pH от 3,5 до 11,5 при 37oC в течение 60 мин, при 45oC и 60oC в течение 15 мин, затем быстро охлаждали и измеряли глутаматоксидазную активность описанным выше методом. При инкубировании фермента при 37oC в течение 60 мин последний был стабилен при pH от 5,5 до 9,5 (фиг. 2); при инкубировании в течение 15 мин при 45oC стабильность фермента наблюдалась при pH от 5,5 до 9,5 (фиг. 3); при инкубировании при 60oC в течение 15 мин – в диапазоне pH от 5,5 до 6,5 (фиг. 4).
Диапазон рабочей температуры: реакционную смесь, содержащую в качестве субстрата L-глутамат (10 мкмоль/мл), инкубировали при температурах от 20 до 90oC в течение 20 мин. Глутаматоксидазную активность измеряли описанным выше методом, используя в качестве инициатора реакции исследуемый фермент. Согласно полученным данным, диапазон рабочей температуры, при которой активность фермента составляет более 50% от исходной, находится от 20 до 65oC, с оптимумом около 40oC (фиг. 5). Температурная стабильность: после инкубирования фермента при температуре от 30 до 90oC и pH буферных растворов 5,5,6,5 и 9,5 в течение 20 мин, раствор быстро охлаждали и измеряли глутаматоксидазную активность описанным выше методом.
Согласно полученным данным, при pH 5,5 фермент был стабилен в диапазоне температур от 30 до 60oC и терял 45% от исходной активности при 70oC; при pH 6,5 фермент оставался стабильным до 50oC, теряя 45% от исходной активности при 60oC; при pH 9,5 – до 40oC и терял 45% от исходной активности при 50oC (фиг. 6). При инкубировании фермента в буферных растворах с pH 5,5,6,5 и 9,5 при 90oC остаточная активность составила порядка 10% от исходной, не зависимо от pH раствора.
Влияние ионов металлов, ингибиторов и хелатирующих агентов на активность фермента: для изучения влияния различных химических веществ на глутаматоксидазную активность исследуемого фермента в реакционную смесь добавляли вещества в концентрации 1 мМ и после инкубирования в течение пяти минут проводили измерение активности фермента описанным выше методом. Результаты представлены в таблице 3.
Как видно из таблицы 3, фермент довольно устойчив к ионам металлов и SH-реагентам. Фермент ингибируется на 18% ПХМБ и на 10% KSCN, но не подавляется хлоридом меди и диэтилдитиокарбаматом, в то время как активность уже известных глутаматоксидаз подавляется ПХМБ на 45% (пат. США N 4623626), а хлоридом меди на 50% (пат. США N 4623626).
Стабильность фермента. Очищенный фермент был лиофилизирован. При хранении в лиофилизированном виде в запечатанных флаконах под аргоном в течение 6 месяцев при комнатной температуре фермент сохраняет 90% от исходной активности.
Таким образом, относительно высокие температурная и pH стабильности исследуемого фермента, а также его устойчивость к ионам меди и ПХМБ, высокая субстратная специфичность и высокая степень сродства к L-глутамату позволяют сделать вывод о больших перспективах использования глутаматоксидазы из нового штамма Streptomyces sp. Z-11-6 в качестве реагента в различных клинических, биохимических и диагностических анализах.
Штамм Streptomyces sp. Z-11-6 депонирован в коллекции культур кафедры микробиологии Московского государственного университета им. М.В.Ломоносова и на протяжении уже более двух лет сохраняет свои свойства.
В работе использовали реактивы “Реахим” (РФ), все марки ч.д.а.
Описание фиг. 1-6: Фиг.1. Оптимум pH исследуемой L-глутаматоксидазы из Streptomyces sp. Z-11-6. Фиг.2. pH стабильность внеклеточной L-глутаматоксидазы из Streptomyces sp. Z-11-6 при ее инкубировании в течение 60 минут при 37oC. Фиг.3. pH стабильность внеклеточной L-глутаматоксидазы из Streptomyces sp. Z-11-6 при ее инкубировании в течение 15 минут при 45oC. Фиг.4. pH стабильность внеклеточной L- глутаматоксидазы из Streptomyces sp. Z-11-6 при ее инкубировании в течение 15 минут при 60oC. Фиг.5. Диапазон рабочей температуры внеклеточной L-глутаматоксидазы из Streptomyces sp. Z-11-6. Фиг.6. Температурная стабильность внеклеточной L-глутаматоксидазы из Streptomyces sp. Z-11-6. м – коэффициент молярной экстинкции хромогенного соединения – хинонимина. За единицу активности фермента (ед) принимали такое его количество, которое катализирует образование одного мкмоля перекиси водорода за одну минуту при 37oC.
Был изучен ряд энзимологических свойств исследуемой L- глутаматоксидазы.
Субстратная специфичность: полученный фермент обладает высокой субстратной специфичностью к L-глутамату: из 20 аминокислот глутаматоксидаза из Streptomyces sp. Z-11-6 проявляла высокую активность только к L-глутамату (табл.2). m для L- глутамата составляет 0,34 мМ при pH 7,0.
Оптимум pH: активность фермента при различных значениях pH измеряли при 30oC, используя в качестве субстрата L-глутамат в 0,2 М ацетатном буфере (pH 3,5-6,0); 0,2 М фосфатном буфере (pH 6,0- 8,5) и 0,2 М глицин-NaOH буфере (pH 8,5-11,5). Оптимум pH исследуемого фермента широк и наблюдается в области pH от 6,5 до 9,5 (фиг. 1).
pH стабильность: фермент инкубировали при соответствующих значениях pH от 3,5 до 11,5 при 37oC в течение 60 мин, при 45oC и 60oC в течение 15 мин, затем быстро охлаждали и измеряли глутаматоксидазную активность описанным выше методом. При инкубировании фермента при 37oC в течение 60 мин последний был стабилен при pH от 5,5 до 9,5 (фиг. 2); при инкубировании в течение 15 мин при 45oC стабильность фермента наблюдалась при pH от 5,5 до 9,5 (фиг. 3); при инкубировании при 60oC в течение 15 мин – в диапазоне pH от 5,5 до 6,5 (фиг. 4).
Диапазон рабочей температуры: реакционную смесь, содержащую в качестве субстрата L-глутамат (10 мкмоль/мл), инкубировали при температурах от 20 до 90oC в течение 20 мин. Глутаматоксидазную активность измеряли описанным выше методом, используя в качестве инициатора реакции исследуемый фермент. Согласно полученным данным, диапазон рабочей температуры, при которой активность фермента составляет более 50% от исходной, находится от 20 до 65oC, с оптимумом около 40oC (фиг. 5). Температурная стабильность: после инкубирования фермента при температуре от 30 до 90oC и pH буферных растворов 5,5,6,5 и 9,5 в течение 20 мин, раствор быстро охлаждали и измеряли глутаматоксидазную активность описанным выше методом.
Согласно полученным данным, при pH 5,5 фермент был стабилен в диапазоне температур от 30 до 60oC и терял 45% от исходной активности при 70oC; при pH 6,5 фермент оставался стабильным до 50oC, теряя 45% от исходной активности при 60oC; при pH 9,5 – до 40oC и терял 45% от исходной активности при 50oC (фиг. 6). При инкубировании фермента в буферных растворах с pH 5,5,6,5 и 9,5 при 90oC остаточная активность составила порядка 10% от исходной, не зависимо от pH раствора.
Влияние ионов металлов, ингибиторов и хелатирующих агентов на активность фермента: для изучения влияния различных химических веществ на глутаматоксидазную активность исследуемого фермента в реакционную смесь добавляли вещества в концентрации 1 мМ и после инкубирования в течение пяти минут проводили измерение активности фермента описанным выше методом. Результаты представлены в таблице 3.
Как видно из таблицы 3, фермент довольно устойчив к ионам металлов и SH-реагентам. Фермент ингибируется на 18% ПХМБ и на 10% KSCN, но не подавляется хлоридом меди и диэтилдитиокарбаматом, в то время как активность уже известных глутаматоксидаз подавляется ПХМБ на 45% (пат. США N 4623626), а хлоридом меди на 50% (пат. США N 4623626).
Стабильность фермента. Очищенный фермент был лиофилизирован. При хранении в лиофилизированном виде в запечатанных флаконах под аргоном в течение 6 месяцев при комнатной температуре фермент сохраняет 90% от исходной активности.
Таким образом, относительно высокие температурная и pH стабильности исследуемого фермента, а также его устойчивость к ионам меди и ПХМБ, высокая субстратная специфичность и высокая степень сродства к L-глутамату позволяют сделать вывод о больших перспективах использования глутаматоксидазы из нового штамма Streptomyces sp. Z-11-6 в качестве реагента в различных клинических, биохимических и диагностических анализах.
Штамм Streptomyces sp. Z-11-6 депонирован в коллекции культур кафедры микробиологии Московского государственного университета им. М.В.Ломоносова и на протяжении уже более двух лет сохраняет свои свойства.
В работе использовали реактивы “Реахим” (РФ), все марки ч.д.а.
Описание фиг. 1-6: Фиг.1. Оптимум pH исследуемой L-глутаматоксидазы из Streptomyces sp. Z-11-6. Фиг.2. pH стабильность внеклеточной L-глутаматоксидазы из Streptomyces sp. Z-11-6 при ее инкубировании в течение 60 минут при 37oC. Фиг.3. pH стабильность внеклеточной L-глутаматоксидазы из Streptomyces sp. Z-11-6 при ее инкубировании в течение 15 минут при 45oC. Фиг.4. pH стабильность внеклеточной L- глутаматоксидазы из Streptomyces sp. Z-11-6 при ее инкубировании в течение 15 минут при 60oC. Фиг.5. Диапазон рабочей температуры внеклеточной L-глутаматоксидазы из Streptomyces sp. Z-11-6. Фиг.6. Температурная стабильность внеклеточной L-глутаматоксидазы из Streptomyces sp. Z-11-6.
Формула изобретения
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 12.03.2008
Извещение опубликовано: 20.05.2009 БИ: 14/2009
|
||||||||||||||||||||||||||
