Патент на изобретение №2170234
|
||||||||||||||||||||||||||
(54) МОДИФИЦИРОВАННЫЕ УГЛЕВОДАМИ ЦИТОСТАТИЧЕСКИЕ СРЕДСТВА
(57) Реферат: Описываются новые модифицированные углеводами соединения общей формулы K-Sp-L-AA1-AA2-C (I), где К, Sp, L, АА1, АА2 и С имеют указанные в п.1 формулы изобретения значения, и их изомеры и соли. Новые соединения обладают цитостатической активностью. 2 с. и 6 з.п. ф-лы, 10 табл., 1ил. Изобретение относится к новым цитостатическим средствам, специфичным к опухолям, в частности к модифицированным углеводами соединениям цитостатической активности. Химиотерапия при опухолевых заболеваниях сопровождается в большинстве случаев серьезными побочными действиями, обусловленными токсичностью химиотерапевтических средств в отношении пролиферирующих клеток других тканей. Уже много лет ученые занимаются проблемой улучшения селективности применяемых активных начал. Интенсивно разрабатывается синтез пролекарств, которые более или менее селективно высвобождаются в целевой ткани, например, в результате изменения значения pH (см. Tietze и др., например, патент DE N 4229903), с помощью ферментов (например, глюкуронидаз; см. Jacquesy и др., заявку ЕР N 511917, Bosslet и др., заявку ЕР N 595133) или антитело-ферментных конъюгатов (см. Bagshawe и др., заявку WO N 88/07378, Senter и др., патент США N 4975278, Bosslet и др., заявку ЕР N 595133). Проблематичными при этом оказываются, среди прочего, недостаточная стабильность конъюгатов в других тканях и органах и, в частности, повсеместное распределение активного начала, происходящее после внеклеточного высвобождения активного начала в опухолевой ткани. Выраженная структура пектинов на поверхности опухолевых клеток (см. Gabius в источнике Onkologie 12, 1989 г., стр. 175) предоставляет принципиальную возможность путем связывания соответствующих компонентов углеводов с цитостатическими средствами целенаправленно воздействовать на опухолевые клетки. Эта перспектива ограничивается тем, что и в других тканях, в частности в печени, имеются пектины сходной специфичности в отношении углеводов (например, галактозы, лактозы, маннозы, N-ацетил-глюкозамина, фукозы и т.д.) (см. Ashwell и др. в источнике Annu. Rev. Biochem. 46, 1982 г., стр. 531: Stahl и др. в источнике Proc. Natl. Acad. Sci. USA 74, 1977 г., стр. 1521: Hill и др. в источнике J. Biol. Chem. 262, 1986 г., стр. 7433; Jansen и др. в источнике J. Biol. Chem. 266, 1991 г., стр. 3343). Поэтому следует ожидать значительного накопления содержащих активное начало гликоконъюгатов в печени и в других богатых пектинами органах, если применяют такие немодифицированные сахары. Гетероциклический амин батрацилин формулы (1) проявляет хорошее противоопухолевое действие в различных моделях рака кишки (см. патент США N 4757072). 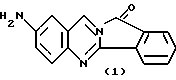 Пептидные конъюгаты формулы (1) с хорошим действием ин витро и благоприятными свойствами растворимости (см. патент США N 4180343) при опыте на животных переносятся хуже, чем батрацилин. Описанные в заявке ЕР N 501250 конъюгаты фукозы сильно накапливаются в печени. Хинолона формулы (2), 7-[(3aRS, 4RS, 7аSR)-4-амино-1,3,3а,4,7,7а- гексагидро-изо-индол-2-ил] -8-хлор-1-циклопропил-6-фтор-1,4- дигидро-4-оксо-3-хинолинкарбоновая кислота наряду с отличной антибактериальной активностью также обладает очень хорошим действием в отношении различных клеточных линий опухолей (см. заявку ЕР N 520240, заявку JP N 4253973). Этому противостоят, однако, значительные токсикологические проблемы, такие как, например, генотоксичность, токсичность в отношении костного мозга, высокая острая токсичность ин виво и т.д. 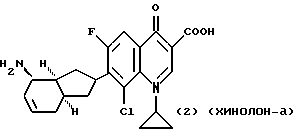 Задачей изобретения является получение новых модифицированных углеводами соединений цитостатической активности, обладающих сывороточной стабильностью, улучшенной клеточной и тканевой селективностью, в частности в случае опухоли печени, и улучшенной растворимостью и переносимостью. Поставленная задача решается предлагаемыми модифицированными углеводами соединениями общей формулы (I) K-Sp-L-AA1-AA2-C, где K – незамещенный или региоселективно модифицированный углеводный остаток, Sp – арилен формулы   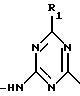 где R означает хлор или гидроксиалкиламино, AA1 – остаток аминокислоты в D- или L-конфигурации, который может иметь защитные группы или вторую группу K-Sp-L-, в которой K, Sp, L независимо от другой группы K-Sp-L- могут иметь вышеуказанные значения, или прямая связь, AA2 – остаток аминокислоты в D- или L-конфигурации, который может иметь защитные группы или прямая связь, C – цитостатический остаток, остаток цитостатического средства или производного цитостатического средства, и их изомеры и соли. Структурный элемент -Sp-L-AA1-АА2- в целом представляет собой спейсер, связывающий K и C. Соединения формулы (I) могут иметься в стереоизомерных формах, например в виде энантиомеров или диастереомеров, или в виде их смесей, например в виде рацемата. Изобретение относится к чистым стереоизомерам, а также их смесям. В случае необходимости смеси стереоизомеров можно разделять известным образом на единые стереоизомерные компоненты, например путем хроматографии или способов кристаллизации. Соединения формулы (I) могут также иметься в виде их солей. В общем здесь можно назвать соли с органическими или неорганическими основаниями или кислотами, а также внутренние соли. В число добавляемых кислот входят предпочтительно галогенированные водородные кислоты, например хлористо-водородная кислота и бромисто-водородная кислота, в частности хлористо-водородная кислота, далее фосфорная кислота, азотная кислота, серная кислота, моно- и бифункциональные карбоновые кислоты и гидроксикарбоновые кислоты, такие как, например, уксусная кислота, малеиновая кислота, малоновая кислота, оксалевая кислота, глюконовая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, салициловая кислота, сорбиновая кислота и молочная кислота, а также сульфокислоты, такие, как, например, п-толуолсульфокислота, 1,5-нафталиндисульфокислота или камфарная сульфокислота. Физиологически невредные соли могут представлять собой металлические или аммониевые соли предлагаемых соединений, имеющие свободную карбоксильную группу. Особенно предпочтительными являются, например, соли натрия, калия, магния или кальция, а также аммониевые соли, которые производятся от аммиака или органических аминов, таких как, например, этиламин, ди- или триэтиламин, ди- или триэтиноламин, дициклогексиламин, диметиламиноэтанол, аргинин, лизин, этилендиамин или фенэтиламин. В первую группу предпочтительных модифицированных углеводами соединений общей формулы (I) входят соединения, у которых K – углеводный остаток формулы (II) 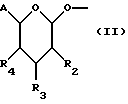 где A – метил, гидроксиметил, алкоксиметил, карбоксиалкилоксиметил, R2, R3, R4 отдельно или вместе означают водород, гидроксил, алкилокси, гидроксиалкилокси, карбоксиалкилкарбонилокси, сульфат, или два из остатков R2, R3, R4 вместе означают эпоксигруппу, Sp, L, AA1, AA2 и C имеют вышеуказанные значения, и их изомеры и соли. Во вторую группу предпочтительных модифицированных углеводами соединений общей формулы (I) входят соединения, у которых Sp – арилен формулы 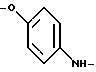 К, L, AA1, AA2 и C имеют вышеуказанные значения, и их изомеры и соли. В третью группу предпочтительных модифицированных углеводами соединений общей формулы (I) входят соединения, у которых C – хинолонкарбоновая кислота (а, б, в и г), батрацилин, камптотецин, доксорубицин, мелфалан, K, Sp, L, AA1 и AA2 имеют вышеуказанные значения, и их изомеры и соли. В четвертую группу предпочтительных модифицированных углеводами соединений общей формулы (I) входят соединения, у которых AA1 – остаток аминокислоты, производимый от глицина, аланина, валина, лизина, аспарагиновой кислоты, глутаминовой кислоты, орнитина, тирозина, или серина в D- или L-конфигурации, который может быть связан с дополнительной группой K-Sp-L, или прямая связь, K, Sp, L, AA2 и C имеют вышеуказанные значения, и их изомеры и соли. В пятую группу предпочтительных модифицированных углеводами соединений общей формулы (I) входят соединения, у которых AA2 – остаток аминокислоты, производимый от глицина, аланина, лизина, орнитина, диаминопропионовой кислоты или серина в D- или L-конфигурации, или прямая связь, К, Sp, L, AA1 и C имеют вышеуказанные значения, и их изомеры и соли. В шестую группу предпочтительных модифицированных углеводами соединений общей формулы (I) входят соединения, у которых C означает остаток формулы (III) T-Q, где Q – остаток формулы 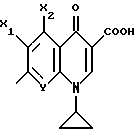 где Y-C-R5, где R5 означает водород, галоген или метокси, X1 – водород, галоген, X2 – водород, аминогруппа, или Q – остаток формулы 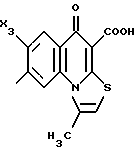 где X3 означает галоген, T – остаток формулы 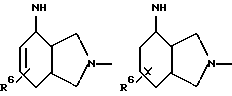 где R6 – водород, алкил с 1 – 3 атомами углерода, и К, Sp, L, AA1 и AA2 имеют вышеуказанные значения, и их изомеры и соли. Благодаря вышеупомянутой активности соединения формулы (I) могут представлять собой активное вещество цитотоксического средства, являющегося дополнительным объектом изобретения. Изобретение иллюстрируется следующими примерами. Примеры серии А: Биологические опыты Пример A.1 Тест торможения роста для определения цитотоксических свойств гликоконъюгатов батрацилина и хинолона-а Клеточные линии SW480 и НТ 29 (АТСС N CCL 228 и НВТ-38) толстого кишечника человека и клеточную линию B16F10 меланомы мыши выращивают в чашках Ру в буфере RPMI 1640, содержащем 10% эмбриональной телячьей сыворотки. Затем обрабатывают трипсином и подают в буфер RPMI, содержащий 10% эмбриональной телячьей сыворотки, и далее культивируют до достижения 50000 клеток/мл. В каждую чашку микротитратора с 96 чашками подают 100 мкл клеточной суспензии и инкубируют в термостате в атмосфере двуокиси углерода при температуре 37oC в течение суток. Потом добавляют еще 100 мкл буфера RPMI и 1 мкл ДМСО с испытуемыми соединениями. Рост проверяют после третьего и шестого дней. Для этого в каждую чашку наносят 40 мкл раствора МТТ (3-(4,5-диметилтиазол-2-ил)-2,5- дифенилтетразолин-бромида) с исходной концентрацией 5 мг/мл воды. Инкубируют в термостате в атмосфере двуокиси углерода при температуре 37oC в течение 5 часов, после чего буфер отсасывают и к каждой чашке добавляют 100 мкл изопропанола. После 30-минутного встряхивания 100 мкл воды экстинкцию измеряют при 540 нм с помощью прибора Titertek Multiskan МСС/340. Цитотоксическое действие описанных гликоконъюгатов батрацилина в таблице 1а приведено в качестве значения KT50 (концентрация 50%-ного торможения) для клеточных линий SW480 и НТ 29. В таблице 1б сведены значения KT50 гликоконъюгатов хинолона-а в отношении клеточных линий SW480, НТ 29 и B 16 F 10. Зависимость биологического действия от углеводов дополнительно доказана неактивностью сравнительных соединений серий примеров 5, 6 и 11 N-[ N  ,N ,N – бис-(4-гидроксифениламино- тиокарбонил)-лизил]-батрацилин и N-[ N – бис-(4-гидроксифениламино- тиокарбонил)-лизил]-батрацилин и N-[ N ,N ,N – бис- (4-гидроксифениламино-тиокарбонил)-лизил-D-аланил]-батрацилин или N-[ N – бис- (4-гидроксифениламино-тиокарбонил)-лизил-D-аланил]-батрацилин или N-[ N ,N ,N – бис-(4-гидроксифениламино-тиокарбонил)-D-лизил- хинолон-а (значения KT50 > 250).
Пример А.2 – бис-(4-гидроксифениламино-тиокарбонил)-D-лизил- хинолон-а (значения KT50 > 250).
Пример А.2Испытание ин витро на расщепляемость гликоконъюгатов Кинетика расщепления с применением крови человека 1,225 мл крови человека вместе с 1,25 мл фосфатно-солевого буферного раствора и 25 мкл маточного раствора субстрата (1 мг/мл в 3% ДМСО в фосфатно-солевом буферном растворе) инкубируют при температуре 37oC. Через 1 час и через 24 часа отбирают пробы в количестве по 1 мл, смешивают с 1 мл этанола, после чего оставляют стоять при 4oC в течение 20 минут. Центрифугируют 5 минут при 3500 об/мин, после чего отбирают 100 мкл надосадочной жидкости для анализа с помощью высокоскоростной колоночной жидкостной хроматографии. Кинетика расщепления с применением клеток 2,25 мл фосфатно-солевого буферного раствора вместе с 225 мкл клеточной суспензии (30 мг/мл) и 25 мкл маточного раствора субстрата (1 мг/мл в 3% ДМСО в фосфатно-солевом буферном растворе) инкубируют при температуре 37oC. Через 1 час и через 24 часа отбирают пробы в количестве по 1 мл, смешивают с 1 мл этанола, после чего оставляют стоять при 4oC в течение 20 минут. Центрифугируют 5 минут при 3500 об/мин, после чего отбирают 100 мкл надосадочной жидкости для анализа с помощью высокоскоростной колоночной жидкостной хроматографии. Условия высокоскоростной колоночной жидкостной хроматографии: Хроматограф: прибор фирмы Waters Колонна: марки Bischoff Hypersil OCS RP 18 5 мкм 250 x 4 мм Элюент A: 10 ммол буфера фосфата калия, pH 4,5 Б: смесь 80% ацетонитрила и 20% воды Скорость подачи: 1 мл/мин Длина волны: 372 нм Градиент: 0 мин – 10% Б 10 мин – 60% Б 15 мин – 60% Б 18 мин – 10% Б 20 мин – 60% Б Элюент конъюгатов хинолона-а: А: 100% метанола Б: 10 ммол буфера фосфата калия, pH 2,2 10 ммол гептансульфокислоты. Результаты приведены в табл. 2а, 2б. Пример А.3 Испытание по распределению в органах Во всех экспериментах были использованы атимические голые мыши штамма NMRI nu/nu, которых разводят в лаборатории “Drug Development Laboratory, Oncotest GmbH” проф. X.X. Фибига в г. Фрайбурге. Животных держали в поликарбонатных клетках (торговой марки Макролон) в условиях ламинарного потока. В качестве опухолевого материала употребляли ткань клеточной линии SW 480, которая предварительно несколькими операциями переноса была введена в мыши. Голым мышам в возрасте 6 – 8 недель подкожно имплантировали в боки по двум опухолям на животное. До рандомизации животных держали в течение 26 – 27 суток. Тогда средний размер опухолей составлял 500 мг и радиус опухолей – около 10 мм. Сама фармакокинетика произошла следующим образом: голым мышам инъецировали испытуемое соединение, после чего мышей хранили еще в клетках до отбора пробы через полчаса или 4 ч. Отбор пробы начался с взятия крови. Для этого мышь наркотизировали эфиром в течение 30 – 60 с. Через 0,5 ч или же 4 ч после введения соединения открыли брюшную полость, мышь в наркозе обескровливали через вену Vena cava caudalis в течение 1 – 2 мин и затем умерщвляли путем перелома шейного отдела позвоночника. В результате этого происходила остановка системы кровообращения и прекращение перфузии органов. В дальнейшем отдельные органы освобождали и вынимали, что длилось около 5 мин. Непосредственно после этого взвесили пробы органов и затем остальное тело и замораживали в жидком азоте. Соединение “конъюгат 1” внутрибрюшинно вводили в количестве 300 мг/кг веса тела, а соединение “конъюгат 2” вводили в количестве 100 мг/кг в хвостовую вену. При проведении опыта для каждого соединения и каждой дозы были использованы по 5 животным. Результаты распределения конъюгата 1 приведены в таблице 3, а конъюгата 2 – в таблице 4. А. Калибровка 5, 10, 50, 100 и 200 мкг соединения, растворенного в смеси этанола и воды в объемном соотношении 1:1, добавляли к 1 г печени коровы. Затем измельчали с помощью 1 г песка и 2,5 мл охлажденной смеси этанола и воды в объемном соотношении 1: 1 и пробы центрифугировали в течение 2 минут при 3500 об/мин. Надосадочную жидкость удаляли, остаток еще раз перемешивали с 2,5 мл смеси этанола и воды, центрифугировали и супернатанты объединяли. Отбирали по 100 мкл и подвергали анализу с помощью высокоскоростной колоночной жидкостной хроматографии. Условия высокоскоростной колоночной жидкостной хроматографии: Хроматограф: прибор фирмы Waters Колонна: марки Bischoff Hypersil ODS RP 18 5 мкм 250 x 4 мм Элюент: А: смесь 80% ацетонитрила и 20% воды Б: 10 ммол буфера фосфата калия, pH 4,5 Градиент: 0 мин – 90% Б 10 мин – 40% Б 15 мин – 40% Б 18 мин – 90% Б 20 мин – 90% Б Скорость подачи: 1 мл/мин Длина волны: 372 нм Б. Обработка органов Обработку осуществляли аналогично примеру А, причем все органы обрабатывали 2,5 мл смеси этанола и воды и экстрагировали. В. Обработка крови Отобранное количество крови перемешивали с 2 мл смеси этанола и воды в объемном соотношении 1:1, центрифугировали в течение 2 мин при 3500 об/мин и надосадочную жидкость декантировали. К остатку еще раз добавляли 2 мл смеси этанола и воды в объемном соотношении 1:1, центрифугировали и супернатанты объединяли. Отбирали по 100 мкл объединенных супернатантов и подвергали анализу с помощью высокоскоростной колоночной жидкостной хроматографии в условиях, приведенных в примере А. Конъюгант 1 (заявка EP N 501250 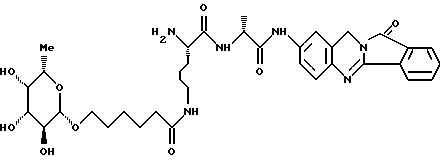 Конъюгант 2 (пример 3.9) 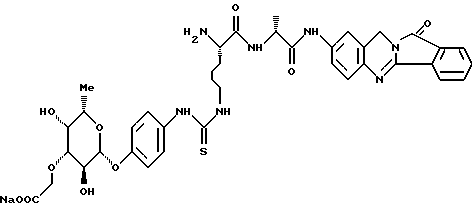 Пример A.4 Определение острой токсичности гликоконъюгатов батрацилина (разовое введение) Острую токсичность производных батрацилина определяли на голых мышах штамма nu/nu. Внутривенно введенные соединения один раз инъецировали мышам в виде водных растворов, а внутрибрюшинно введенные соединения – в виде растворов ДМСО в концентрациях до 400 мг соединения на кг мыши. Переносимую разовую дозу вычисляли на основе потери веса животных до 21-го дня после введения соединения и на основе числа выживших животных. Переносимые разовые дозы соединений приведены в таблице 5. В случае соединений примеров 3.16, 3.33, 3.9, 6.12, 6.14, 6.2, 6.81, 8.2 доза составляла свыше 200 мг соединения на кг мыши. В случае соединений примеров 3.33, 6.12, 6.14, 6.2, 6.81 даже при дозе 400 мг/кг острой токсичности не было найдено. В отличие от этого не содержащий сахара лизил-D-аланил- батрацилин примера 2.13 проявлял заметную токсичность уже при разовых дозах, составлявших от 25 до 50 мг на кг мыши. Пример А.5 Определение острой токсичности после многократного введения Часть соединений ввели внутривенно, другую часть – внутрибрюшинно, либо ежедневно в дни с 1-4 и с 7-10, либо в дни 1, 5 и 9. Дозировки составляли 400, 200 и 100 мг/кг в день. Анализ осуществляли на основе потери веса животных до 21-го дня и на основе числа выживших животных. Для проведения опыта для каждого соединения и каждой дозы были использованы по 5 животным. Результаты приведены в таблице 6. Пример A.6 Кроветворная активность гликоконъюгатов хинолона-а по сравнению с соответствующим активным началом Материал и методы Испытание ин витро: Клетки костного мозга вымывали из бедра мыши. 105 клеток в среде марки McCoy 5А (0,3% агара) вместе с рекомбинантным мышиным колоние-стимулирующим фактором (GM-CSF) (торговый продукт Гензиме; образование колоний основных клеток) и соединениями (10-4 – 100 мкг/мл) инкубировали при температуре 37oC в атмосфере, содержащей 7% двуокиси углерода. Спустя 7 дней определили число колоний (< 50 клеток) и кластеров (17 – 50 клеток). Испытание ин виво: Мышам подкожно ввели 1, 3, 10, 30 мг/кг соединений. В различные промежутки времени (через 3, 24, 48, 72 ч. после инъецирования) удаляли бедра и выделяли клетки костного мозга. 2  105 клеток вышеописанным образом инкубировали вместе с рекомбинантным мышиным колоние-стимулирующим фактором (GM-CSF) и спустя 7 дней определили число колоний и кластеров.
Результаты: 105 клеток вышеописанным образом инкубировали вместе с рекомбинантным мышиным колоние-стимулирующим фактором (GM-CSF) и спустя 7 дней определили число колоний и кластеров.
Результаты:По данным таблицы 7 испытанные гликоконъюгаты по сравнению с хинолоном-а проявляли уменьшенное на фактор 105 – 103 торможение пролиферации основных клеток костного мозга. И при испытании ин виво по сравнению с хинолоном-а торможения пролиферации основных клеток соединением примера 12.3 в дозировке до 30 мг/кг не наблюдалось. Уже при введении 3 мг/кг хинолона-а было индицировано массивное подавление пролиферации основных клеток (см. чертеж). Пример A.7 Противоопухолевая активность конъюгатов хинолона-а Активность ин витро гликоконъюгатов хинолона-а определяли на опухолевых ксенотрансплантатах человека в системе двухслойного культивирования на мягком агаре по Гамбургеру и Салмону (см. источник Science 197, стр. 461-463). Твердые опухоли сначала выращивали в атимической голой мыши штамма NMRI nu/nu, выделяли операцией и раздробляли механическим способом. Отдельные клетки получали потом в результате инкубации при 37oC в течение 30 минут в смеси ферментов, а именно 0,05% коллагеназы, 0,07% ДНКазы и 0,1% гиалуронидазы в буфере RPMI. Клетки два раза промывали, после чего их просеивали через сито с размером отверстий 200 мкм и 20 мкм. Применили следующий способ культивирования: Нижний слой содержал 0,2 мл модифицированной по способу Дульбекко среды Искова с 20% эмбриональной телячьей сыворотки и 0,7% агара. На этот слой наносили 40000 – 200000 клеток в 0,2 мл той же самой среды и 0,4% агара в чашки микротитратора с 24 чашками. Цитостатические соединения добавляли в 0,2 мл среды. Культуры инкубировали в атмосфере, содержащей 7% двуокиси углерода, при температуре 37oC в течение 6 – 15 дней. Потом выросшие колонии подвергали количественному анализу в инвертированном микроскопе, при этом за 24 часа до анализа живущих колоний подкрашивали красителем на основе хлористого тетразола. Активность активного начала выражается в % выживших колоний по сравнению с числом колоний необработанных чашек (Т/С = число колоний обработанных чашек  100/число колоний необработанных чашек).
Соединение является активным, если значение Т/С 100/число колоний необработанных чашек).
Соединение является активным, если значение Т/С  30%.
В таблице 8 это значение приведено в качестве значения KT70 в мкг/мл.
Пример A.8 30%.
В таблице 8 это значение приведено в качестве значения KT70 в мкг/мл.
Пример A.8Испытания ин виво Метод: В день 0 мышам инокулируют 5  106 опухолевых клеток типа B 16 F 10. У животных развиваются твердые брюшинные опухоли, после чего им ежедневно вводят испытуемые соединения или же только носитель для них. В контрольной группе обычно погибает 50% животных в период с 14 по 20 день. Испытуемые соединения вводят в буфере или в системе органических растворителей, состоящей из 20% метанола и 20% диметилсульфоксида в 0,7%-ном растворе поваренной соли.
Дача носителя не влияет на срок выживания животных. Терапевтический успех вытекает из продления времени выживания обработанных животных. Переносимость соединений анализируют параллельно на животных, не имеющих опухолей. По результатам переносимости и продления срока выживания можно ориентировочно определить терапевтический индекс.
Таблица 9 показывает терапевтическую активность соединения примера 11.12 на мышах, которым трансплантировали опухоль типа B16F10.
Пример А.9 106 опухолевых клеток типа B 16 F 10. У животных развиваются твердые брюшинные опухоли, после чего им ежедневно вводят испытуемые соединения или же только носитель для них. В контрольной группе обычно погибает 50% животных в период с 14 по 20 день. Испытуемые соединения вводят в буфере или в системе органических растворителей, состоящей из 20% метанола и 20% диметилсульфоксида в 0,7%-ном растворе поваренной соли.
Дача носителя не влияет на срок выживания животных. Терапевтический успех вытекает из продления времени выживания обработанных животных. Переносимость соединений анализируют параллельно на животных, не имеющих опухолей. По результатам переносимости и продления срока выживания можно ориентировочно определить терапевтический индекс.
Таблица 9 показывает терапевтическую активность соединения примера 11.12 на мышах, которым трансплантировали опухоль типа B16F10.
Пример А.9Торможение ин виво роста опухоли при применении модели голой мыши Материал: Для всех экспериментов ин виво для испытания торможения роста опухоли использовали атимических голых мышей штамма NMRI nu/nu. Выбранный крупноклеточный рак легкого типа LXFL 529 выращивали в голых мышах серийными переносами. Человеческое происхождение опухоли было доказано изоферментативными и иммуногистохимическими методами. Проведение эксперимента: Голым мышам штамма nu/nu в возрасте 6 – 8 недель опухоль подкожно имплантировали в оба боки. В зависимости от времени роста с удвоением объема лечение начали, как только радиус опухолей достиг 5 – 7 мм. Мышей распределяли путем рандомизации по группе лечения и контрольной группе (5 мышей в каждой группе с 8 – 10 подвергающимися анализу опухолями). Все отдельные опухоли контрольной группы росли прогрессивно. Размеры опухолей измеряли с помощью раздвижного калибра в двух измерениях. Объем опухоли, который находится в хорошем соотношении с числом клеток, употребляли затем для всех анализов. Объем определяли по формуле “длина  ширина ширина  ширина /2″ ([а ширина /2″ ([а  b2]/2, а или b означают два прямоугольно расположенных диаметра).
Значения относительного объема опухоли каждой отдельной опухоли определяли путем деления размера опухоли в день H на размер опухоли в день 0 (в момент рандомизации). Средние значения относительного объема опухоли употребляли для дальнейшего анализа.
Торможение увеличения объема опухоли (объем опухолей в испытуемой группе /контрольной группе, T/C, в %) представляло собой окончательную измеренную величину.
Лечение: b2]/2, а или b означают два прямоугольно расположенных диаметра).
Значения относительного объема опухоли каждой отдельной опухоли определяли путем деления размера опухоли в день H на размер опухоли в день 0 (в момент рандомизации). Средние значения относительного объема опухоли употребляли для дальнейшего анализа.
Торможение увеличения объема опухоли (объем опухолей в испытуемой группе /контрольной группе, T/C, в %) представляло собой окончательную измеренную величину.
Лечение:Все соединения давали по интермиттирующему плану соответственно в день 1, 5 и 9. Все соединения вводили внутрибрюшинно при использовании воды в качестве растворителя. Соединения камптотецина в данном опыте проявляли, как правило, сравнимую или лучшую активность. Примеры серии Б: Примеры получения соединений Пример 1.1 п-аминофенил-2-O-метил-  – L-фукозид – L-фукозид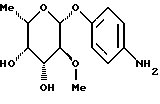 1.1.а) п-нитрофенил-3,4-O-изопропилиден-  -L-фукозид -L-фукозидРаствор 750 мг (2,63 ммоль) п-нитрофенил-  -L-фукозида в 40 мл смеси диметилформамида и диоксана в соотношении 1:2 при 0oC смешивают с 65 мг п-толуолсульфокислоты и 5 раз через каждые 30 минут 100 мкл 2-метоксипропена. После перемешивания при 20oC в течение 16 часов сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99: 1. После сгущения получают 710 мг (83%) белого твердого вещества.
1.1.б) п-нитрофенил-2-O-метил-3,4-O-изопропилиден- -L-фукозида в 40 мл смеси диметилформамида и диоксана в соотношении 1:2 при 0oC смешивают с 65 мг п-толуолсульфокислоты и 5 раз через каждые 30 минут 100 мкл 2-метоксипропена. После перемешивания при 20oC в течение 16 часов сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99: 1. После сгущения получают 710 мг (83%) белого твердого вещества.
1.1.б) п-нитрофенил-2-O-метил-3,4-O-изопропилиден-  – L-фукозид – L-фукозид100 мг (0,307 ммоль) соединения примера 1.1.а) смешивают с 96 мкл метил-йодида в 10 мл тетрагидрофурана, после чего порциями смешивают с 11 мг 80%-ного гидрида натрия. После перемешивания при 20oC в течение 3 часов к смеси добавляют еще 96 мкл метилйодида и 11 мг гидрида натрия. После дальнейшего перемешивания при 20oC в течение 16 часов к смеси добавляют небольшое количество воды и 100 мл дихлорметана. Реакционную смесь дважды встряхивают вместе с водой, органическую фазу сгущают и продукт очищают путем колоночной хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 8:1. Выход: 78 мг (75%). 1.1) п-аминофенил-2-О-метил-  -L-фукозид -L-фукозид78 мг (0,23 ммоль) п-нитрофенил-2-O-метил-3,4-O- изопропилиден-  -L-фукозида перемешивают при 20oC в течение 16 часов в 3 мл 80%-ной уксусной кислоты. Потом уксусную кислоту удаляют в вакууме, реакционную смесь смешивают с 10 мл метанола и после добавки двуокиси платины гидрируют в атмосфере водорода при незначительном избыточном давлении. Суспензию фильтруют на силикате марки Celite, после чего фильтруемый материал промывают метанолом. После очистки путем хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 97,5: 2,5 получают 77 мг (80%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1, Rf = 0,42.
Пример 1.2 -L-фукозида перемешивают при 20oC в течение 16 часов в 3 мл 80%-ной уксусной кислоты. Потом уксусную кислоту удаляют в вакууме, реакционную смесь смешивают с 10 мл метанола и после добавки двуокиси платины гидрируют в атмосфере водорода при незначительном избыточном давлении. Суспензию фильтруют на силикате марки Celite, после чего фильтруемый материал промывают метанолом. После очистки путем хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 97,5: 2,5 получают 77 мг (80%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1, Rf = 0,42.
Пример 1.2п-аминофенил-3-O-метил-  -L-фукозид -L-фукозид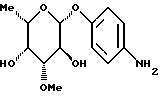 1.2.а) п-нитрофенил-3-О-метил-  -L-фукозид -L-фукозид6 г (21 ммоль) п-нитрофенил-  -L-фукозида в 300 мл абсол. метанола смешивают с 7,84 г (31,5 ммоль) окиси дибутилолова и нагревают с обратным холодильником в течение двух часов. Затем сгущают, остаток сушат и подают в 300 мл диметилформамида. После добавки 15,7 мл метилйодида реакционную смесь перемешивают в течение 40 часов при 70oC. Растворитель удаляют в вакууме и остаток подают в 300 мл дихлорметана. Суспензию фильтруют, остающийся раствор снова сгущают и подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. После сгущения получают 3815 мг (61%) целевого продукта.
1.2) п-аминофенил-3-О-метил- -L-фукозида в 300 мл абсол. метанола смешивают с 7,84 г (31,5 ммоль) окиси дибутилолова и нагревают с обратным холодильником в течение двух часов. Затем сгущают, остаток сушат и подают в 300 мл диметилформамида. После добавки 15,7 мл метилйодида реакционную смесь перемешивают в течение 40 часов при 70oC. Растворитель удаляют в вакууме и остаток подают в 300 мл дихлорметана. Суспензию фильтруют, остающийся раствор снова сгущают и подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. После сгущения получают 3815 мг (61%) целевого продукта.
1.2) п-аминофенил-3-О-метил-  -L-фукозид -L-фукозид3,81 г (12,73 ммоль) п-нитрофенил-3-O-метил-  -L-фукозида гидрируют аналогично примеру 1.1. Выход: 3 г (88%). Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,53.
Пример 1.3 -L-фукозида гидрируют аналогично примеру 1.1. Выход: 3 г (88%). Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,53.
Пример 1.3п-аминофенил-3-О-метил-  -L-фукозид -L-фукозид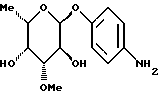 Соединение получают аналогично примеру 1.2 из п-нитрофенил-  -L-фукозида.
Выход: 63% через две стадии. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,39.
Пример 1.4 -L-фукозида.
Выход: 63% через две стадии. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,39.
Пример 1.4п-аминофенил-4-O-метил-  -L-фукозид -L-фукозид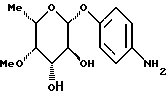 1.4.а) п-нитрофенил-2-O-бензил-4-O-ацетил-  -L-фукозид -L-фукозид1 г (3,5 ммоль) п-нитpoфенил-  -L-фукoзидa в 100 мл абсол. тетрагидрофурана смешивают с 31 мг п-толуолсульфокислоты и 1134 мг (7 ммоль) триэтилортоацетата. После перемешивания в течение 15 минут при 20oC растворитель отгоняют в вакууме. Остаток подают в 50 мл тетрагидрофурана и 3 мл диметилформамида, после чего смешивают с 4165 мкл бензилбромида и 210 мг 60%-ного гидрида натрия. После перемешивания при 20oC в течение часа к смеси добавляют 10 мл 80%-ной уксусной кислоты, сгущают и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. После сгущения и сушки получают 1236 мг (85%) целевого продукта.
1.4.б) п-нитрофенил-2-O-бензил-3-O-ацетил-4-O-метил- -L-фукoзидa в 100 мл абсол. тетрагидрофурана смешивают с 31 мг п-толуолсульфокислоты и 1134 мг (7 ммоль) триэтилортоацетата. После перемешивания в течение 15 минут при 20oC растворитель отгоняют в вакууме. Остаток подают в 50 мл тетрагидрофурана и 3 мл диметилформамида, после чего смешивают с 4165 мкл бензилбромида и 210 мг 60%-ного гидрида натрия. После перемешивания при 20oC в течение часа к смеси добавляют 10 мл 80%-ной уксусной кислоты, сгущают и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. После сгущения и сушки получают 1236 мг (85%) целевого продукта.
1.4.б) п-нитрофенил-2-O-бензил-3-O-ацетил-4-O-метил-  -L- фукозид -L- фукозид1000 мг (2,39 ммоль) п-нитрофенил-2-O-бензил-4-O-ацетил-  – L-фукозида растворяют в 60 мл бензола. После добавки 2988 мкл метилйодида и 1109 мг окиси серебра реакционную смесь нагревают с обратным холодильником в течение 8 часов. Полученную смесь разделяют на компоненты путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. Выделяют 239 мг (23%) п-нитрофенил-2-О-бензил-3-O-ацетил-4-O- метил- – L-фукозида растворяют в 60 мл бензола. После добавки 2988 мкл метилйодида и 1109 мг окиси серебра реакционную смесь нагревают с обратным холодильником в течение 8 часов. Полученную смесь разделяют на компоненты путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. Выделяют 239 мг (23%) п-нитрофенил-2-О-бензил-3-O-ацетил-4-O- метил-  -L-фукозида и 653 мг (63%) изомерного п-нитрофенил- 2-O-бензил-3-O-метил-4-O-ацетил- -L-фукозида и 653 мг (63%) изомерного п-нитрофенил- 2-O-бензил-3-O-метил-4-O-ацетил-  -L-фукозида в виде белого твердого вещества.
1.4) п-аминофенил-4-O-метил- -L-фукозида в виде белого твердого вещества.
1.4) п-аминофенил-4-O-метил-  -L-фукозид -L-фукозид224 мг (0,52 ммоль) п-нитрофенил-2-O-бензил-3-O- ацетил-4-O-метил-  -L-фукозида растворяют в 20 мл метанола и смешивают с 390 мкл 1н. раствора метилата натрия. После перемешивания в течение 16 часов при 20oC нейтрализуют 80%-ной уксусной кислотой, сгущают и подают в дихлорметан. Органическую фазу промывают 1-н. раствора бикарбоната натрия и водой, сушат и сгущают. Остаток подают в 20 мл метанола и гидрируют над палладием на активном угле аналогично примеру 1.1. После сгущения продукт подают в воду и подвергают лиофилизации. Выделяют 119 мг (88%) белого аморфного твердого вещества. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,38.
Пример 1.5 -L-фукозида растворяют в 20 мл метанола и смешивают с 390 мкл 1н. раствора метилата натрия. После перемешивания в течение 16 часов при 20oC нейтрализуют 80%-ной уксусной кислотой, сгущают и подают в дихлорметан. Органическую фазу промывают 1-н. раствора бикарбоната натрия и водой, сушат и сгущают. Остаток подают в 20 мл метанола и гидрируют над палладием на активном угле аналогично примеру 1.1. После сгущения продукт подают в воду и подвергают лиофилизации. Выделяют 119 мг (88%) белого аморфного твердого вещества. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,38.
Пример 1.5п-аминофенил-3-О-н-пропил-  -L-фукозид -L-фукозид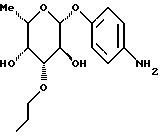 1.5.а) п-нитрофенил-2-O-бензил-3-O-н-пропил-4-O-ацетил-  L-фукозид L-фукозидАналогично примеру 1.4.б) соединение примера 1.4.а) подвергают взаимодействию с пропилйодидом с получением изомерных продуктов 3- и 4-пропилирования. В результате разделения путем хроматографии получают п-нитрофенил-2-O-бензил-3-O-н-пропил-4-O-ацетил-  -L-фукозид (выход: 49%) и п-нитрофенил-2-O-бензил-3-O-ацетил-4-O-н-пропил- -L-фукозид (выход: 49%) и п-нитрофенил-2-O-бензил-3-O-ацетил-4-O-н-пропил- -L-фукозид (выход: 29%).
1.5.б) п-аминофенил-3-O-н-пропил- -L-фукозид (выход: 29%).
1.5.б) п-аминофенил-3-O-н-пропил-  -L-фукозид -L-фукозидФракцию 1 примера 1.5. а) подвергают реакции аналогично примеру 1.4 с получением 78% целевого соединения. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,42. Пример 1.6 п-аминофенил-3-десокси-  -L-фукозид -L-фукозид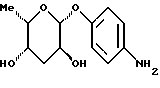 1.6.а) п-нитрофенил-3,6-дидесокси-3-хлор-4-O-ацетил-  -L- гулозид -L- гулозид1 г (3,5 ммоль) п-нитрофенил-  -L-фукозида в 100 мл тетрагидрофурана смешивают с 31 мг п-толуолсульфокислоты и 1134 мг (7 ммоль) триэтилортоацетата. После перемешивания в течение 15 минут при 20oC растворитель отгоняют в вакууме. Добавляют 100 мл насыщенного раствора хлористого водорода в дихлорметане. После 10-минутной реакции сгущают и продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. Получают 793 мг (65%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 97,5: 2,5; Rf = 0,36.
1.6.б) п-нитрофен ил-З,6-дидесокси-З-хлор- -L-фукозида в 100 мл тетрагидрофурана смешивают с 31 мг п-толуолсульфокислоты и 1134 мг (7 ммоль) триэтилортоацетата. После перемешивания в течение 15 минут при 20oC растворитель отгоняют в вакууме. Добавляют 100 мл насыщенного раствора хлористого водорода в дихлорметане. После 10-минутной реакции сгущают и продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. Получают 793 мг (65%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 97,5: 2,5; Rf = 0,36.
1.6.б) п-нитрофен ил-З,6-дидесокси-З-хлор-  -L-гулозид -L-гулозид375 мг (1,08 ммоль) п-нитрофенил-3,6-дидесокси-3-хлор-4-O- ацетил-  -L-гулозида растворяют в 25 мл метанола и смешивают с 10 каплями 1н. раствора метилата натрия. По истечении 20 минут подкисляют уксусной кислотой, сгущают и распределяют между 400 мл дихлорметана и 60 мл воды. Органическую фазу сушат, сгущают и осаждают из смеси дихлорметана и диэтилового эфира. Получают 315 мг (96%) целевого продукта.
1.6.) п-аминофенил-3-десокси- -L-гулозида растворяют в 25 мл метанола и смешивают с 10 каплями 1н. раствора метилата натрия. По истечении 20 минут подкисляют уксусной кислотой, сгущают и распределяют между 400 мл дихлорметана и 60 мл воды. Органическую фазу сушат, сгущают и осаждают из смеси дихлорметана и диэтилового эфира. Получают 315 мг (96%) целевого продукта.
1.6.) п-аминофенил-3-десокси-  -L-фукозид -L-фукозид315 мг (1,04 ммоль) п-нитрофенил-3,6-дидесокси-3-хлор-  L-гулозида растворяют в 40 мл метанола, смешивают с 200 мг палладия на активном угле и 290 мкл триэтиламина, после чего смесь гидрируют в течение 4 дней в атмосфере водорода при незначительном избыточном давлении. Суспензию фильтруют, промывают, сгущают и продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 97,5:2,5. Получают 160 мг (65%) десокси-соединения. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,18.
Пример 1.7 L-гулозида растворяют в 40 мл метанола, смешивают с 200 мг палладия на активном угле и 290 мкл триэтиламина, после чего смесь гидрируют в течение 4 дней в атмосфере водорода при незначительном избыточном давлении. Суспензию фильтруют, промывают, сгущают и продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 97,5:2,5. Получают 160 мг (65%) десокси-соединения. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,18.
Пример 1.7п-аминофенил-3,4-дидесокси-  -L-фукозид -L-фукозид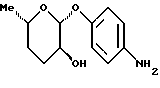 400 мг (1,16 ммоль) п-нитрофенил-3,6-дидесокси-3-хлор-4- O-ацетил-  -L-гулозида примера 1.6.а) растворяют в 55 мл метанола, смешивают с 323 мкл триэтиламина и гидрируют в атмосфере водорода при незначительном избыточном давлении над 10%-ным палладием на активном угле. После перемешивания в течение 16 часов при 20oC фильтруют на силикате марки Celite, промывают, сгущают и подают в 100 мл метанола. К смеси добавляют 1,5 мл 1н. раствора метилата натрия и перемешивают при комнатной температуре в течение 16 часов. Нейтрализуют уксусной кислотой, сгущают и полученные продукты разделяют путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 97,5:2,5. После сгущения соответствующих фракций и переосаждения из смеси метанола и диэтилового эфира получают 120 мг (46%) целевого соединения. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,31 и 77 мг (28%) п-аминофенил-3-десокси- -L-гулозида примера 1.6.а) растворяют в 55 мл метанола, смешивают с 323 мкл триэтиламина и гидрируют в атмосфере водорода при незначительном избыточном давлении над 10%-ным палладием на активном угле. После перемешивания в течение 16 часов при 20oC фильтруют на силикате марки Celite, промывают, сгущают и подают в 100 мл метанола. К смеси добавляют 1,5 мл 1н. раствора метилата натрия и перемешивают при комнатной температуре в течение 16 часов. Нейтрализуют уксусной кислотой, сгущают и полученные продукты разделяют путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 97,5:2,5. После сгущения соответствующих фракций и переосаждения из смеси метанола и диэтилового эфира получают 120 мг (46%) целевого соединения. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,31 и 77 мг (28%) п-аминофенил-3-десокси-  -L-фукозида. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,18.
Пример 1.8 -L-фукозида. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,18.
Пример 1.8п-аминофенил-3,4-эпокси-  -L-фукозид -L-фукозид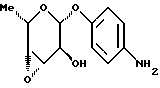 80 мг (0,23 ммоль) п-нитрофенил-3,6-дидесокси-3-хлор-4-O-ацетил-  -L-гулозида примера 1.6. а) подают в 10 мл метанола и смешивают с 345 мкл 1н. раствора метилата натрия. После ультразвуковой обработки в течение часа подкисляют 80%-ной уксусной кислотой, сгущают и подвергают хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99: 1. После сгущения соответствующих фракций продукт подают в метанол и гидрируют над палладием на активном угле аналогично примеру 1.1. Получают 46 мг (75%) целевого соединения. Масс-спектр (бомбардировка быстрыми атомами, далее: “бба”):m/e = 238 = М+1.
Пример 1.9 -L-гулозида примера 1.6. а) подают в 10 мл метанола и смешивают с 345 мкл 1н. раствора метилата натрия. После ультразвуковой обработки в течение часа подкисляют 80%-ной уксусной кислотой, сгущают и подвергают хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99: 1. После сгущения соответствующих фракций продукт подают в метанол и гидрируют над палладием на активном угле аналогично примеру 1.1. Получают 46 мг (75%) целевого соединения. Масс-спектр (бомбардировка быстрыми атомами, далее: “бба”):m/e = 238 = М+1.
Пример 1.9п-аминофенил-4-десокси-  -L-фукозид -L-фукозид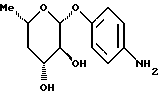 Данное соединение получают аналогично методу авторов T. Lindhorst и J. Thiem в источнике Carbohydr. Res. 209 (1991 г.), стр. 119, исходя из п-нитрофенил-  -L-фукозида через п-нитрофенил-2,3-ди-O-бензоил-4,6-дидесокси- 4-йод- -L-фукозида через п-нитрофенил-2,3-ди-O-бензоил-4,6-дидесокси- 4-йод-  -L-фукозид. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 90:10; Rf = 0,3.
Пример 1.10 -L-фукозид. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 90:10; Rf = 0,3.
Пример 1.10п-аминофенил-3-О-карбоксиметил-  -L-фукозид -L-фукозид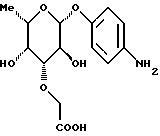 1.10.а) п-нитрофенил-3-О-метоксикарбонилметил-  -L- фукозид -L- фукозид1 г (3,5 ммоль) п-нитрофенил-  -L-фукозида и 1,3 г (5,2 ммоль) окиси дибутилолова нагревают с обратным холодильником в 50 мл метанола в течение 2 часов. Раствор сгущают, остаток подают в 50 мл диоксана, смешивают с 2 мл сложного метилового эфира бромуксусной кислоты и 100 мг йодида тетрабутиламмония и нагревают с обратным холодильником в течение 16 часов. Растворитель упаривают и продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99: 1. После сгущения соответствующих фракций и переосаждения из смеси метанола и диэтилового эфира получают 455 мг (37%) целевого соединения.
1.10) п-аминофенил-3-O-карбоксиметил- -L-фукозида и 1,3 г (5,2 ммоль) окиси дибутилолова нагревают с обратным холодильником в 50 мл метанола в течение 2 часов. Раствор сгущают, остаток подают в 50 мл диоксана, смешивают с 2 мл сложного метилового эфира бромуксусной кислоты и 100 мг йодида тетрабутиламмония и нагревают с обратным холодильником в течение 16 часов. Растворитель упаривают и продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99: 1. После сгущения соответствующих фракций и переосаждения из смеси метанола и диэтилового эфира получают 455 мг (37%) целевого соединения.
1.10) п-аминофенил-3-O-карбоксиметил- -L-фукозид -L-фукозид282 мг (0,79 ммоль) п-нитрофенил-З-метоксикарбонилметил-  -L-фукозида растворяют в 20 мл метанола и смешивают с 440 мкл 2н. раствора гидроокиси лития. После перемешивания при 20oC в течение 2 ч доводят до значения pH 3 с помощью кислого ионообменника марки SC108 устанавливают и фильтруют. К фильтрату добавляют 250 мг палладия на активном угле. Затем гидрируют в атмосфере водорода при незначительном избыточном давлении в течение 1,5 ч, катализатор отделяют и промывают метанолом. Продукт сгущают, подают в воду и подвергают сублимационной сушке. Получают 212 мг (86%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,24.
Пример 1.11 п-аминофенил-3-O-метоксикарбонилметил- -L-фукозида растворяют в 20 мл метанола и смешивают с 440 мкл 2н. раствора гидроокиси лития. После перемешивания при 20oC в течение 2 ч доводят до значения pH 3 с помощью кислого ионообменника марки SC108 устанавливают и фильтруют. К фильтрату добавляют 250 мг палладия на активном угле. Затем гидрируют в атмосфере водорода при незначительном избыточном давлении в течение 1,5 ч, катализатор отделяют и промывают метанолом. Продукт сгущают, подают в воду и подвергают сублимационной сушке. Получают 212 мг (86%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,24.
Пример 1.11 п-аминофенил-3-O-метоксикарбонилметил-  -L-фукозид -L-фукозид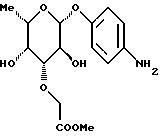 250 мг (0,7 ммоль) п-нитрофенил-3-метоксикарбонилметил-  -1-L фукозида примера 1.10.а) растворяют в 20 мл метанола и гидрируют в атмосфере водорода при незначительном избыточном давлении в течение 1,5 ч. Катализатор отделяют и промывают метанолом. Продукт сгущают, подают в воду и подвергают сублимационной сушке. Получают 195 мг (85%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,43; масс-спектр (бба): m/e = 328 = M+1.
Пример 1.12 -1-L фукозида примера 1.10.а) растворяют в 20 мл метанола и гидрируют в атмосфере водорода при незначительном избыточном давлении в течение 1,5 ч. Катализатор отделяют и промывают метанолом. Продукт сгущают, подают в воду и подвергают сублимационной сушке. Получают 195 мг (85%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,43; масс-спектр (бба): m/e = 328 = M+1.
Пример 1.12п-аминофенил-3-О-гидроксиэтил-  -L-фукозид -L-фукозид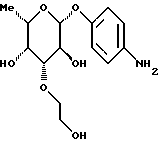 1.12.а) п-нитрофенил-3-О-гидроксиэтил-  -L-фукозид -L-фукозид1000 мг (2,8 ммоль) п-нитрофенил-3-метоксикарбонилметил-  -L-фукозида растворяют в смеси 160 мл тетрагидрофурана и 40 мл воды и смешивают с 53 мг борана натрия. По истечении 10 минут растворитель упаривают и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 95:5. После сгущения соответствующих фракций, подачи в воду и сублимационной сушки получают 362 мг (40%) целевого продукта.
1.12) п-аминофенил-3-O-гидроксиэтил- -L-фукозида растворяют в смеси 160 мл тетрагидрофурана и 40 мл воды и смешивают с 53 мг борана натрия. По истечении 10 минут растворитель упаривают и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 95:5. После сгущения соответствующих фракций, подачи в воду и сублимационной сушки получают 362 мг (40%) целевого продукта.
1.12) п-аминофенил-3-O-гидроксиэтил-  -L-фукозид -L-фукозидПосле гидрирования 362 мг соединения примера 1.12.а) аналогично примеру 1.1. получают 270 мг (82%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf = 0,43. Пример 1.13 п-аминофенил-2-O-карбоксиметил-  -L-фукозид -L-фукозид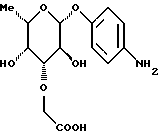 1.13.а) п-нитрофенил-2-О-метоксикарбонилметил-  -L-фукозид -L-фукозид250 мг (0,88 ммоль) п-нитрофенил-  -L-фукозида растворяют в 25 мл абс. тетрагидрофурана и 3 мл диметилформамида. К смеси добавляют 80 мг (2,64 ммоль) 80%-ного гидрида натрия и после 10-минутного перемешивания при 20oC 35 мкл сложного бензилового эфира бромуксусной кислоты. Через каждые 10 минут 3 раза добавляют еще по 35 мкл сложного бензилового эфира бромуксусной кислоты. Перемешивают в течение 30 минут и обрабатывают метанолом. По истечении 10 минут подкисляют 5 мл 80%-ной уксусной кислоты.
Сгущают и дополнительно перегоняют в присутствии дихлорметана. Очистку путем флеш-хроматографии начинают с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 90:10:1. Позже применяют ту же самую смесь, но в соотношении 80:20:2. После сгущения соответствующих фракций остатки дигерируют диэтиловым эфиром и из первого элюента получают 157 мг (42%) целевого соединения. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5: 1: 0,2; Rf = 0,65. Из второго элюента получают 33% изомерного 3-О-алкилированного соединения. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1: 0,2; Rf = 0,54.
1.13) п-аминофенил-2-O-карбоксиметил- -L-фукозида растворяют в 25 мл абс. тетрагидрофурана и 3 мл диметилформамида. К смеси добавляют 80 мг (2,64 ммоль) 80%-ного гидрида натрия и после 10-минутного перемешивания при 20oC 35 мкл сложного бензилового эфира бромуксусной кислоты. Через каждые 10 минут 3 раза добавляют еще по 35 мкл сложного бензилового эфира бромуксусной кислоты. Перемешивают в течение 30 минут и обрабатывают метанолом. По истечении 10 минут подкисляют 5 мл 80%-ной уксусной кислоты.
Сгущают и дополнительно перегоняют в присутствии дихлорметана. Очистку путем флеш-хроматографии начинают с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 90:10:1. Позже применяют ту же самую смесь, но в соотношении 80:20:2. После сгущения соответствующих фракций остатки дигерируют диэтиловым эфиром и из первого элюента получают 157 мг (42%) целевого соединения. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5: 1: 0,2; Rf = 0,65. Из второго элюента получают 33% изомерного 3-О-алкилированного соединения. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1: 0,2; Rf = 0,54.
1.13) п-аминофенил-2-O-карбоксиметил-  -L-фукозид -L-фукозидОмыление и гидрирование 150 мг п-нитрофенил-2-О- метоксикарбоилметил-  -L-фукозида осуществляют аналогично примеру 1.10. Получают 109 мг (83%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1: 0,2; Rf = 0,35.
Пример 1.14.а) -L-фукозида осуществляют аналогично примеру 1.10. Получают 109 мг (83%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1: 0,2; Rf = 0,35.
Пример 1.14.а)Синтез региоизомерных продуктов моносукцинилирования п-нитрофенил-  -L-фукозида: -L-фукозида:1100 мг (3,86 ммоль) п-нитрофенил-  -L-фукозида растворяют в 50 мл пиридина и смешивают с 580 мг (5,79 ммоль) ангидрида янтарной кислоты. После перемешивания в течение 16 ч при 20oC сгущают и дважды дополнительно перегоняют в присутствии дихлорметана. Осаждают из смеси дихлорметана и диэтилового эфира и получают 1 г неразделимой смеси, которую подают в смесь метанола и воды и смешивают с 846 мг (2,6 ммоль) карбоната цезия. Растворитель упаривают и дополнительно перегоняют в присутствии диметилформамида. Остаток подают в диметилформамид и смешивают с 618 мкл бензилбромида. После одночасовой ультразвуковой обработки бромид цезия отфильтруют и фильтрат сгущают. Распределяют между 500 мл этилацетата и 50 мл воды. Органическую фазу сушат и сгущают. Компоненты разделяют путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. Получают: -L-фукозида растворяют в 50 мл пиридина и смешивают с 580 мг (5,79 ммоль) ангидрида янтарной кислоты. После перемешивания в течение 16 ч при 20oC сгущают и дважды дополнительно перегоняют в присутствии дихлорметана. Осаждают из смеси дихлорметана и диэтилового эфира и получают 1 г неразделимой смеси, которую подают в смесь метанола и воды и смешивают с 846 мг (2,6 ммоль) карбоната цезия. Растворитель упаривают и дополнительно перегоняют в присутствии диметилформамида. Остаток подают в диметилформамид и смешивают с 618 мкл бензилбромида. После одночасовой ультразвуковой обработки бромид цезия отфильтруют и фильтрат сгущают. Распределяют между 500 мл этилацетата и 50 мл воды. Органическую фазу сушат и сгущают. Компоненты разделяют путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. Получают:Фр. 1: 87 мг (4,8%) п-нитрофенил-3-O-(3- бензилоксикарбонилпропионил)-  -L-фукозида. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,45.
Фр. 2: 27 мг (1,5%) п-нитрофенил-2-O-(3- бензилоксикарбонилпропионил)- -L-фукозида. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,45.
Фр. 2: 27 мг (1,5%) п-нитрофенил-2-O-(3- бензилоксикарбонилпропионил)-  -L-фукозида. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,34.
Фр. 3: 190 мг (10,3%) п-нитрофенил-4-O-(3- бензилоксикарбонилпропионил)- -L-фукозида. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,34.
Фр. 3: 190 мг (10,3%) п-нитрофенил-4-O-(3- бензилоксикарбонилпропионил)-  -L-фукозида. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,28.
1.14) п-аминофенил-З-О-сукцинил -L-фукозида. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,28.
1.14) п-аминофенил-З-О-сукцинил  -L-фукозид -L-фукозид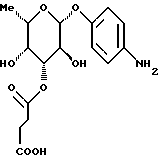 85 мг (0,17 ммоль) фракции 1 примера 1.14.а) растворяют в 5 мл тетрагидрофурана и 1 мл воды. Добавляют 20 мг двуокиси платины и гидрируют в течение 8 часов. Катализатор отфильтровывают, промывают смесью тетрагидрофурана и воды и фильтрат сгущают. Остаток подают в воду и лиофилизуют. Получают 57 мг (94%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,65. Пример 1.15 п-аминофенил-2-O-сукцинил-  -L-фукозид -L-фукозид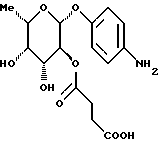 Фракцию 2 примера 1.14.а) гидрируют аналогично примеру 1.14. Выход: 16 мг (87%). Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1: 0,2; Rf = 0,62. Пример 1.16 п-аминофенил-4-O-сукцинил-  -L-фукозид -L-фукозид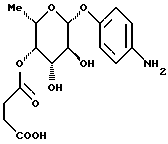 Фракцию 3 примера 1.14.а) гидрируют аналогично примеру 1.14. Выход: 125 мг (88%). Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1: 0,2; Rf = 0,63. Пример 1.17. п-аминофенил-3,4-ди-О-метил-  -L-фукозид -L-фукозид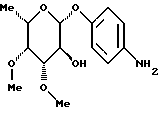 1.17.а) п-нитрофенил-2-O-бензил-3,4-O-изопропилиден-  -L-фукозид -L-фукозид377 мг (1,16 ммоль) соединения примера 1.1.а) растворяют в 30 мл абс. тетрагидрофурана и смешивают последовательно с 690 мкл бензилбромида и 52 мг гидрида натрия, после чего перемешивают при 20oC. Через 4 часа и 6 часов еще раз добавляют 690 мкл бензилбромида и гидрида натрия. Реакционную смесь перерабатывают аналогично примеру 1.1. б). Получают 245 мг (51%) целевого соединения. 1.17.б) п-нитрофенил-2-О-бензил-3,4-ди-О-метил-  -L-фукозид -L-фукозид245 мг (0,59 ммоль) п-нитpoфeнил-2-O-бензил-3,4-O- изoпpoпилиден-  -L-фукoзида перемешивают в 80%-ной уксусной кислоте в течение 16 часов при 20oC. Сгущают и остаток перемешивают со смесью диэтилового эфира и пентана. Отсасывают, сушат и полученный продукт подают в 20 мл абс. тетрагидрофурана. К смеси добавляют 45 мг 80%-ного гидрида натрия и через 15 минут – 160 мкл метилйодида. Перемешивают в течение 20 часов при 20oC, после чего обрабатывают метанолом и ледяной уксусной кислотой, сгущают и остаток распределяют между дихлорметаном и водой. Органическую фазу сушат, сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:1. Соответствующие фракции сгущают и сушат, после чего получают 188 мг (79%) целевого продукта.
1.17) п-аминофенил-3,4-ди-O-метил- -L-фукoзида перемешивают в 80%-ной уксусной кислоте в течение 16 часов при 20oC. Сгущают и остаток перемешивают со смесью диэтилового эфира и пентана. Отсасывают, сушат и полученный продукт подают в 20 мл абс. тетрагидрофурана. К смеси добавляют 45 мг 80%-ного гидрида натрия и через 15 минут – 160 мкл метилйодида. Перемешивают в течение 20 часов при 20oC, после чего обрабатывают метанолом и ледяной уксусной кислотой, сгущают и остаток распределяют между дихлорметаном и водой. Органическую фазу сушат, сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:1. Соответствующие фракции сгущают и сушат, после чего получают 188 мг (79%) целевого продукта.
1.17) п-аминофенил-3,4-ди-O-метил- -L-фукозид -L-фукозид180 мг (0,45 ммоль) соединения примера 1.17.б) в смеси 15 мл метанола и 3 мл дихлорметана после добавления 50 мг палладия на активном угле гидрируют при комнатной температуре в течение 2 суток. Катализатор отфильтровывают, фильтрат сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 97,5:2.5. Получают 86 мг (68%) целевого соединения. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf = 0,21. Пример 1.18 п-аминофенил-3-O-карбамоилметил-  -L-фукозид -L-фукозид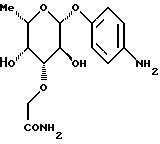 100 мг (0,305 ммоль) соединения примера 1.11. растворяют в 10 мл метанола и смешивают с 0,5 мл 17%-ного раствора гидроксида аммония. Через 4 часа сгущают, подают в воду и лиофилизуют. Получают 95 мг (колич.) целевого соединения. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf= 0,43. Пример 1.19 п-аминофенил-2-О-гидроксиэтил-  -L-фукозид -L-фукозид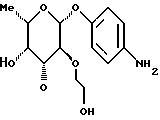 200 мг (0,56 ммоль) п-нитрофенил-2-O-метоксикарбонилметил-  – L-фукозида примера 1.13.а) подвергают реакции аналогично примерам 1.12.а) и 1.12. Выход: 76 мг (45% через 2 стадии). Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,2.
Пример 1.20 – L-фукозида примера 1.13.а) подвергают реакции аналогично примерам 1.12.а) и 1.12. Выход: 76 мг (45% через 2 стадии). Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,2.
Пример 1.20п-аминофенил-3,6-дидесокси-3-хлор-  -L-гулозид -L-гулозид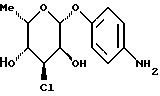 50 мг (0,165 ммоль) соединения примера 1.6.б) гидрируют в 5 мл метанола над палладием на активном угле в течение часа. Отфильтровывают от катализатора, промывают, сгущают, подают в воду и лиофилизуют. Получают 45 мг (89%) целевого соединения. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,35. Пример 1.21 п-аминофенил-  -L-рамнозид -L-рамнозид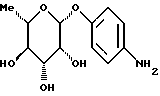 300 мг п-нитрофенил-  -L-рамнозида (сигма) подвергают реакции аналогично примеру 1.1 и получают 96% целевого соединения.
Пример 1.22 -L-рамнозида (сигма) подвергают реакции аналогично примеру 1.1 и получают 96% целевого соединения.
Пример 1.22п-аминофенил-3-О-карбоксиметил-  -L-рамнозид -L-рамнозид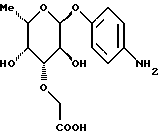 1.22.а) п-нитрофенил-3-О-метоксикарбонилметил-  -L-рамнозид -L-рамнозид481 мг (1,63 ммоль) п-нитрофенил-  -L-рамнозида подают в 30 мл метанола и смешивают с 629 мг (2,45 ммоль) окиси дибутилолова. Нагревают с обратным холодильником в течение 2 часов, сгущают и подают в 30 мл диоксана. К смеси добавляют 85 мг йодида тетрабутиламмония и 950 мкл сложного метилового эфира бромуксусной кислоты, после чего нагревают с обратным холодильником в течение 16 часов. В случае необходимости добавляют еще 1 мл сложного метилового эфира бромуксусной кислоты и продлевают время реакции. Сгущают и остаток очищают путем флеш-хроматографии. п-нитрофенил-3-О-метокси-карбонилметил- -L-рамнозида подают в 30 мл метанола и смешивают с 629 мг (2,45 ммоль) окиси дибутилолова. Нагревают с обратным холодильником в течение 2 часов, сгущают и подают в 30 мл диоксана. К смеси добавляют 85 мг йодида тетрабутиламмония и 950 мкл сложного метилового эфира бромуксусной кислоты, после чего нагревают с обратным холодильником в течение 16 часов. В случае необходимости добавляют еще 1 мл сложного метилового эфира бромуксусной кислоты и продлевают время реакции. Сгущают и остаток очищают путем флеш-хроматографии. п-нитрофенил-3-О-метокси-карбонилметил-  -L-рамнозид элюируют с применением смеси дихлорметана и метанола в соотношении 99: 1. После сушки получают 408 мг (70%) продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf=0,36.
Пример 1.22 -L-рамнозид элюируют с применением смеси дихлорметана и метанола в соотношении 99: 1. После сушки получают 408 мг (70%) продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 95:5; Rf=0,36.
Пример 1.22п-аминофенил-3-О-карбоксиметил-  -L-рамнозид -L-рамнозидп-нитрофенил-3-О-метоксикарбонилметил-  -L-рамнозид подвергают реакции аналогично примеру 1.10 c получением 80% целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной воды в соотношении 5:1:0,2; Rf = 0,26.
Пример 1.23 -L-рамнозид подвергают реакции аналогично примеру 1.10 c получением 80% целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной воды в соотношении 5:1:0,2; Rf = 0,26.
Пример 1.23п-аминофенил-  -D-галактопиранозид -D-галактопиранозид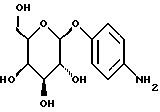 3,0 г (10 ммоль) п-нитрофенил-  -D-галактопиранозида растворяют в 50 мл смеси метанола и воды в соотношении 1:1. После добавления 200 мг 10%-ного палладия на активном угле гидрируют в атмосфере водорода при незначительном избыточном давлении. Суспензию фильтруют на силикате марки Celite, после чего фильтруемый материал промывают 100 мл горячей смеси метанола и воды в соотношении 1:1. Фильтрат сгущают в вакууме. В результате перекристаллизации из метанола получают 2,11 г (78%) бесцветных кристаллов. Тонкослойная хроматография: метанол; f = 0,62; [ -D-галактопиранозида растворяют в 50 мл смеси метанола и воды в соотношении 1:1. После добавления 200 мг 10%-ного палладия на активном угле гидрируют в атмосфере водорода при незначительном избыточном давлении. Суспензию фильтруют на силикате марки Celite, после чего фильтруемый материал промывают 100 мл горячей смеси метанола и воды в соотношении 1:1. Фильтрат сгущают в вакууме. В результате перекристаллизации из метанола получают 2,11 г (78%) бесцветных кристаллов. Тонкослойная хроматография: метанол; f = 0,62; [ ]20= -39,5 ]20= -39,5 (с = 1,0/H2O); т.п. =166oC.
Пример 1.24 (с = 1,0/H2O); т.п. =166oC.
Пример 1.24п-аминофенил-2-O-метил-  -D-галактопиранозид -D-галактопиранозид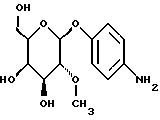 1.24.а) п-нитрофенил-6-О-трифенилметил-  -D-галактопиранозид -D-галактопиранозидРаствор 9,0 г (30 ммоль) п-нитрофенил-  -D-галактопиранозида, 16,7 г (60 ммоль) хлортрифенилметана и 609 мг (5 ммоль) N,N-диметиламинопиридина в 100 мл абсолютного пиридина нагревают до 60oC в течение 4 часов. После сгущения в вакууме остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 2:1 —> 3:2, каждый раз в присутствии 0,5% триэтиламина. Получают 9,23 г (57%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,55; т.п. = 82oC.
1.24. б) п-нитрофенил-3,4-O-изопропилиден-6-O-трифенилметил- -D-галактопиранозида, 16,7 г (60 ммоль) хлортрифенилметана и 609 мг (5 ммоль) N,N-диметиламинопиридина в 100 мл абсолютного пиридина нагревают до 60oC в течение 4 часов. После сгущения в вакууме остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 2:1 —> 3:2, каждый раз в присутствии 0,5% триэтиламина. Получают 9,23 г (57%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,55; т.п. = 82oC.
1.24. б) п-нитрофенил-3,4-O-изопропилиден-6-O-трифенилметил- -D-галактопиранозид -D-галактопиранозид8,7 г (16 ммоль) вышеуказанного соединения смешивают с 400 мл диметоксипропана и каталитическим количеством (400 мг, 1,7 ммоль) (  )-камфора-10-сульфокислоты. После реакции при комнатной температуре в течение часа реакцию прекращают добавлением 240 мл (1,7 ммоль) триэтиламина и сгущают в вакууме. В результате флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 2:1 получают 6,2 г (66%) бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,46; [ )-камфора-10-сульфокислоты. После реакции при комнатной температуре в течение часа реакцию прекращают добавлением 240 мл (1,7 ммоль) триэтиламина и сгущают в вакууме. В результате флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 2:1 получают 6,2 г (66%) бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,46; [ ]20= -42,1 ]20= -42,1 (c = 0,94/CH2Cl2).
1.24.в) п-нитрофенил-2-O-метил-3,4-O-изопропилиден-6-O- трифенилметил- (c = 0,94/CH2Cl2).
1.24.в) п-нитрофенил-2-O-метил-3,4-O-изопропилиден-6-O- трифенилметил-  -D-галактопиранозид -D-галактопиранозид5,83 г (10 ммоль) соединения примера 1.24.б) растворяют в 100 мл диметилформамида и смешивают с 2,5 мл (40 ммоль) метилйодида, после чего к смеси порциями добавляют 450 мг (15 ммоль) 80%-ной суспензии гидрида натрия в минеральном масле. После реакции при комнатной температуре в течение 2 часов реакцию прекращают прикапыванием 10 мл метанола и сгущают в вакууме. Остаток подают в 1000 мл дихлорметана и раствор интенсивно перемешивают с 500 мл воды. Органическую фазу сушат над 50 г сульфата магния, сгущают в вакууме и очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 12:1 1 —> 8:1. Получают 4,72 г (79%) бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1: 1; Rf = 0,72; [  ]20= -35,7 ]20= -35,7 (c = 1,0/CH3OH).
1.24.г) п-нитрофенил-2-O-метил- (c = 1,0/CH3OH).
1.24.г) п-нитрофенил-2-O-метил-  -D-галактопиранозид -D-галактопиранозидРаствор 4,48 г (7,5 ммоль) вышеприведенного соединения в 200 мл дихлорметана смешивают с 20 мл 99%-ной трифторуксусной кислоты и перемешивают при комнатной температуре в течение 3 часов. После сгущения в вакууме остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 5:1  2:1. Получают 1,09 г (46%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,42: т.п. = 177oC.
1.24) п-аминофенил-2-O-метил- 2:1. Получают 1,09 г (46%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,42: т.п. = 177oC.
1.24) п-аминофенил-2-O-метил-  -D-галактопиранозид -D-галактопиранозид946 мг (3 ммоль) соединения примера 1.24.г) растворяют в 50 мл метанола и после добавления 0,5 мл воды и около 200 мг основного никеля Ренея гидрируют в атмосфере водорода при незначительном избыточном давлении в течение 2 часов. Суспензию фильтруют на силикате марки Celite, после чего фильтруемый материал интенсивно промывают 100 мл метанола. После сгущения фильтрата в вакууме получают 579 мг (68%) коричневатой пены. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,28; [  ]20= -39,3 ]20= -39,3 (c = 0,15/CH3OH).
Пример 1.25 (c = 0,15/CH3OH).
Пример 1.25п-аминофенил-3-О-метил-  – D-галактопиранозид – D-галактопиранозид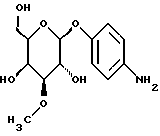 1.25.а) п-нитрофенил-3-О-метил-  -D-галактопиранозид -D-галактопиранозидРаствор 1,5 г (5,0 ммоль) п-нитрофенил-  -D- галактопиранозида в 40 мл абсолютного метанола смешивают с 1,87 г (7,5 ммоль) окиси дибутилолова и нагревают с обратным холодильником. Через 3 часа сгущают в вакууме и остаток сушат в течение часа в вакууме масляного насоса. Продукт подают в 40 мл абсолютного диоксана, полученный раствор смешивают с 1,9 мл (30 ммоль) метилйодида и реакционную смесь перемешивают в течение 16 часов при температуре ванны 100oC. Затем растворитель отгоняют в вакууме и остаток очищают путем флеш-хроматографии с применением в качестве элюента сначала смеси этилацетата и петролейного эфира в соотношении 2: 1; а потом этилацетата. Получают 1,32 г (84%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2 Rf = 0,34; т. п. = 196oC; [ -D- галактопиранозида в 40 мл абсолютного метанола смешивают с 1,87 г (7,5 ммоль) окиси дибутилолова и нагревают с обратным холодильником. Через 3 часа сгущают в вакууме и остаток сушат в течение часа в вакууме масляного насоса. Продукт подают в 40 мл абсолютного диоксана, полученный раствор смешивают с 1,9 мл (30 ммоль) метилйодида и реакционную смесь перемешивают в течение 16 часов при температуре ванны 100oC. Затем растворитель отгоняют в вакууме и остаток очищают путем флеш-хроматографии с применением в качестве элюента сначала смеси этилацетата и петролейного эфира в соотношении 2: 1; а потом этилацетата. Получают 1,32 г (84%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2 Rf = 0,34; т. п. = 196oC; [ ]20= -53,3 ]20= -53,3 (c = 1,0/CH3OH).
1.25) п-аминофенил-3-О-метил- (c = 1,0/CH3OH).
1.25) п-аминофенил-3-О-метил- -D-галактопиранозид -D-галактопиранозид946 мг (3 ммоль) вышеприведенного соединения восстанавливают описанным в примере 1.24 образом и перерабатывают. Получают 656 мг (77%) коричневатых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,21; т.п. = 196oC; [  ]20= -25,2 ]20= -25,2 (c = 1,0/CH3OH).
Пример 1.26 (c = 1,0/CH3OH).
Пример 1.26Ацетат п-аминофенил-4-O-метил-  -D- галактопиранозида -D- галактопиранозида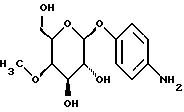 1.26.а) п-нитрофенил-3-О-бензил-  -D-галактопиранозид -D-галактопиранозидРаствор 1,5 г (5,0 ммоль) п-нитрофенил-  -D-галактопиранозида в 40 мл абсолютного диоксана смешивают с 1,87 г (7,5 ммоль) окиси дибутилолова и нагревают с обратным холодильником. Через 3 ч полученный раствор смешивают с 3,6 мл (30 ммоль) бензилбромида и реакционную смесь перемешивают в течение 48 ч с обратным холодильником. Растворитель отгоняют в вакууме и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси этилацетата и петролейного эфира в соотношении 2:1-1:1. Получают 1,58 г (81%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3: 0,2; Rf = 0,69; т.п. = 127oC.
1.26.б) п-нитрофенил-3-О-бензил-4,6-О-изопропилиден- -D-галактопиранозида в 40 мл абсолютного диоксана смешивают с 1,87 г (7,5 ммоль) окиси дибутилолова и нагревают с обратным холодильником. Через 3 ч полученный раствор смешивают с 3,6 мл (30 ммоль) бензилбромида и реакционную смесь перемешивают в течение 48 ч с обратным холодильником. Растворитель отгоняют в вакууме и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси этилацетата и петролейного эфира в соотношении 2:1-1:1. Получают 1,58 г (81%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3: 0,2; Rf = 0,69; т.п. = 127oC.
1.26.б) п-нитрофенил-3-О-бензил-4,6-О-изопропилиден- – D-галактопираноид – D-галактопираноид6,26 г (16 ммоль) соединения примера 1.26.а) подвергают описанной в примере 1.24. б) реакции. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 5: 1-3: 1 получают 6,54 г (95%) бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1: 1; Rf = 0,34; [  ]20= -38,9 ]20= -38,9 (c = 1,0/ CH2Cl2).
1.26. в) п-нитрофенил-2,3-ди-O-бензил-4,6-O-изопропилиден- (c = 1,0/ CH2Cl2).
1.26. в) п-нитрофенил-2,3-ди-O-бензил-4,6-O-изопропилиден- -D-галактопиранозид -D-галактопиранозид4,31 г (10 ммоль) соединения примера 1.26.б) растворяют в 100 мл диметил-формамида, после чего смешивают с 12 мл (100 ммоль) бензилбромида и порциями по 450 мг (15 ммоль) 80%-ной суспензии гидрида натрия в минеральном масле. После реакции при комнатной температуре в течение 2 часов реакцию прекращают прикапыванием 10 мл метанола и сгущают в вакууме. Остаток подают в 1000 мл дихлорметана и раствор интенсивно перемешивают с 500 мл воды. Органическую фазу сушат над 50 г сульфата магния, сгущают в вакууме и очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 20:1-15:1-10:1. Получают 2,72 г (52%) бесцветного масла, которое содержит еще примеси. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,62. 1.26.г) п-нитрофенил-2,3-ди-O-бензил-  -D-галактопиранозид -D-галактопиранозид2,6 г (5 ммоль) вышеуказанного соединения подвергают описанной в примере 1.24. г) реакции. После сгущения в вакууме и кипячения остатка в присутствии диэтилового эфира получают 805 мг (33%) бесцветных кристаллов. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf= 0,23; т.п. = 160oC. 1.26.д) п-нитрофенил-2,3-ди-O-бензил-6-O-трифенилметил-  -D- галактопиранозид -D- галактопиранозид722 мг (1,5 ммоль) соединения примера 1.26.г) подвергают описанной в примере 1.24.а) реакции. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 15:1-0:1-5:1 получают 880 мг (81%) бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2:1; Rf= 0,79; [  ]20= -25,3 ]20= -25,3 (с = 0,3/CH2Cl2).
1.26. е) п-нитрофенил-2,3-ди-O-бензил-4-O-метил-6-O- трифенилметил- (с = 0,3/CH2Cl2).
1.26. е) п-нитрофенил-2,3-ди-O-бензил-4-O-метил-6-O- трифенилметил- -D-галактопиранозид -D-галактопиранозид724 мг (1 ммоль) вышеуказанного соединения подвергают описанному в примере 1.24. в) метилированию. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 10: 1-5: 1 получают 662 мг (90%) бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 5:1; Rf = 0,66; [  ]20= -38,7 ]20= -38,7 (с = 0,2/CH2Cl2).
1.26) Ацетат п-аминофенил-4-O-метил-6-O-трифенилметил- (с = 0,2/CH2Cl2).
1.26) Ацетат п-аминофенил-4-O-метил-6-O-трифенилметил-  -D- галактопиранозида -D- галактопиранозида590 мг (0,8 ммоль) вышеуказанного соединения растворяют в 50 мл 90%-ной уксусной кислоты. После добавки 200 мг 10%-ного палладия на активном угле гидрируют в течение 16 часов в атмосфере водорода при незначительном избыточном давлении. Суспензию фильтруют на силикате марки Celite и фильтруемый материал интенсивно промывают 100 мл метанола. После сгущения фильтрата в вакууме и переосаждения остатка из смеси диэтилового эфира и петролейного эфира получают 253 мг (92%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и петролейного эфира в соотношении 5:1; Rf = 0,12. Пример 1.27 п-аминофенил-6-О-метил-  -D-галактопиранозид -D-галактопиранозид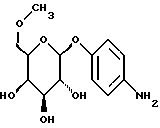 5,84 г (10 ммоль) соединения примера 1.24.б) бензилируют описанным в примере 1.26. в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента сначала смеси петролейного эфира и этилацетата в соотношении 15: 1-12: 1-5: 1, а потом этилацетата, каждый раз в присутствии 0,5% триэтиламина, получают две фракции продукта: Фракция 1:1,71 г (25%) п-нитрофенил-2-O-бензил-3,4-O- изопропилиден-6-O-трифенилметил-  -D-галактопиранозида в виде желтоватой пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2:1; Rf = 0,72; [ -D-галактопиранозида в виде желтоватой пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2:1; Rf = 0,72; [ ]20= -8,1 ]20= -8,1 (с = 1,0/CH2Cl2).
Фракция 2: 806 мг (19%) п-нитрофенил-2-O-бензил-3,4-O- изопропилиден- (с = 1,0/CH2Cl2).
Фракция 2: 806 мг (19%) п-нитрофенил-2-O-бензил-3,4-O- изопропилиден-  -D-галактопиранозида в виде желтоватого масла. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2: 1; Rf = 0,45; [ -D-галактопиранозида в виде желтоватого масла. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2: 1; Rf = 0,45; [ ]20= +2,8 ]20= +2,8 (с= 1,2/CH3OH).
1.27. б) п-нитрофенил-2-О-бензил-З,4-О-изопропилиден- 6-О-метил- (с= 1,2/CH3OH).
1.27. б) п-нитрофенил-2-О-бензил-З,4-О-изопропилиден- 6-О-метил-  -D-галактопиранозид -D-галактопиранозид777 мг (1,8 ммоль) фракции 2 примера 1.27.а) подвергают описанному в примере 1.24.в) метилированию. После очистки путем флеш-хроматографий с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 10:1-8:1 получают 730 мг (91%) коричневатого масла. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2:1; Rf = 0,54; [  ]20= -11,6 ]20= -11,6 (c = 1,1/CH2CL2).
1.27.в) п-нитрофенил-2-0-бензил-6-O-метил- (c = 1,1/CH2CL2).
1.27.в) п-нитрофенил-2-0-бензил-6-O-метил-  -D-галактопиранозид -D-галактопиранозид668 мг (1,5 ммоль) вышеуказанного соединения подвергают описанной в примере 1.24. г) реакции. Фильтрат сгущают в вакууме и остаток кипятят в присутствии небольшого количества диэтилового эфира. После охлаждения до комнатной температуры получают 388 мг (64%) светло-бежевых кристаллов. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,15; т.п.: 143oC. 1.27) п-аминофенил-6-О-метил-  -D-галактопиранозид -D-галактопиранозид324 мг (0,8 ммоль) соединения примера 1.27.в) подвергают описанному в примере 1.24 восстановлению. Фильтрат сгущают в вакууме и остаток кипятят в присутствии небольшого количества диэтилового эфира. Получают 184 мг (81%) бежевых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,05; Т.п.: 115oC (разл.). Пример 1.28 п-аминофенил-2,3-ди-O-метил-  -D-галактопиранозид -D-галактопиранозид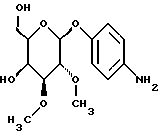 1.28.а) Изопропилиденирование п-нитрофенил-  -D-галактопиранозида -D-галактопиранозидаРаствор 7,5 г (25 ммоль) п-нитрофенил-  -D-галактопиранозида в 1000 мл абсолютного ацетона смешивают с 500 мг безводного толуолсульфокислоты. 250 мл ацетона отгоняют при атмосферном давлении в течение 30 минут и потом непосредственно нейтрализуют добавкой 500 мг карбоната калия. После сгущения в вакууме остаток перемешивают с 1000 мл диэтилового эфира. Фильтруют, фильтрат сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 2:1-1:1-3:2. При этом получают две фракции продукта: -D-галактопиранозида в 1000 мл абсолютного ацетона смешивают с 500 мг безводного толуолсульфокислоты. 250 мл ацетона отгоняют при атмосферном давлении в течение 30 минут и потом непосредственно нейтрализуют добавкой 500 мг карбоната калия. После сгущения в вакууме остаток перемешивают с 1000 мл диэтилового эфира. Фильтруют, фильтрат сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 2:1-1:1-3:2. При этом получают две фракции продукта:Фракция 1: 3,74 г (44%) п-нитрофенил-3,4-O-изопропилиден-  -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь дихлорметана, метанола и 25%-ного аммиака в соотношении 15:3:0,2; Rf = 0,59; [ -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь дихлорметана, метанола и 25%-ного аммиака в соотношении 15:3:0,2; Rf = 0,59; [ ]20= -54,2 ]20= -54,2 (c = 0,38/CH3OH).
Фракция 2: (c = 0,38/CH3OH).
Фракция 2:4,3 г (50%) п-нитрофенил-4,6-O-изопропилиден-  -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь дихлорметана, метанола и 25%-ного аммиака в соотношении 15:3:0,2; Rf = 0,54; [ -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь дихлорметана, метанола и 25%-ного аммиака в соотношении 15:3:0,2; Rf = 0,54; [ ]20= -81,0 ]20= -81,0 (c = 0,31/CH3OH).
1.28. б) п-нитрофенил-2,З-ди-О-метил-4,6-О-изопропилиден- (c = 0,31/CH3OH).
1.28. б) п-нитрофенил-2,З-ди-О-метил-4,6-О-изопропилиден-  -D-галактопиранозид -D-галактопиранозид4,1 г (12 ммоль) фракции 2 примера 1.28.а) подвергают описанному в примере 1.24.в) метилированию. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 5:1-2:1 получают 2,93 г (66%) бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,42; [  ]20= -52,6 ]20= -52,6 (с=0,34/CH3OH).
1.28.в) п-нитрофенил-2,3-ди-О-метил- (с=0,34/CH3OH).
1.28.в) п-нитрофенил-2,3-ди-О-метил- -D-галактопиранозид -D-галактопиранозид2,77 г (7,5 ммоль) вышеуказанного соединения подвергают описанной в примере 1.24.г) реакции. Смесь держат при комнатной температуре в течение часа, после чего сгущают в вакууме и остаток сушат в течение часа в вакууме масляного насоса. В результате дигерирования с 100 мл смеси диэтилового эфира и петролейного эфира в соотношении 1:1 получают 1,11 г (45%) бесцветных кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,24; т.п.: 156oC. 1.28) п-аминофенил-2,3-ди-О-метил-  -D-галактопиранозид -D-галактопиранозид989 мг (3 ммоль) соединения примера 1.38.в) восстанавливают описанным в примере 1.24 образом. Получают 396 мг (44%) бесцветного масла. Тонкослойная хроматография: смесь дихлорметана, метанола и 25%-ного аммиака в соотношении 15:3:0,2; Rf = 0,50; [  ]20= -19,4 ]20= -19,4 (c = 0,16/CH3OH).
Пример 1.29 (c = 0,16/CH3OH).
Пример 1.29п-аминофенил-2,4-ди-O-метил-  -D-галактопиранозид -D-галактопиранозид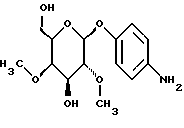 1.29.а) Тритилирование соединения примера 1.26.a) 11,7 г (30 ммоль) соединения примера 1.26.а) тритилируют описанным в примере 1.24. а) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 10: 1-7:1-5:1, каждый раз в присутствии 0,5% триэтиламина, получают два продукта: Фракция 1: 8,5 г (32%) трифенилметил-2-O-(п-нитрофенил)-3-O- бензил-6-O-трифенилметил-  -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2:1; Rf = 0,68; [ -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2:1; Rf = 0,68; [ ]20= +42,8 ]20= +42,8 (c = 1,0/CH2Cl2).
Фракция 2: (c = 1,0/CH2Cl2).
Фракция 2:9,0 г (47%) п-нитрофенил-3-О-бензил-6-О-трифенилметил-  -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2:1; Rf = 0,22; [ -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2:1; Rf = 0,22; [ ]20= -22,6 ]20= -22,6 (c = 1,03/CH2Cl2).
1.29. б) п-нитрофенил-2,4-ди-О-метил-3-О-бензил-6-О-трифенилметил- (c = 1,03/CH2Cl2).
1.29. б) п-нитрофенил-2,4-ди-О-метил-3-О-бензил-6-О-трифенилметил-  -D-галактопиранозид -D-галактопиранозид7,6 г (12 ммоль) фракции 2 примера 1.29.а) подвергают описанному в примере 1.24.в) метилированию. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 2:1-10:1 получают 7,07 г (89%) бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2:1; Rf = 0,79; [  ]20= -35,8 ]20= -35,8 (с=1,09/CH3OH).
1.29.в) п-аминофенил-2,4-ди-O-метил-3-O-бензил- (с=1,09/CH3OH).
1.29.в) п-аминофенил-2,4-ди-O-метил-3-O-бензил-  -D-галактопиранозид -D-галактопиранозид6,0 г (9 ммоль) вышеуказанного соединения гидрируют в течение 48 часов описанным в примере 1.26 образом. Получают 1,39 г (40%) бесцветных кристаллов. Тонкослойная хроматография: смесь этилацетата и петролейного эфира в соотношении 2:1; Rf = 0,20; т.п.: 148oC. 1.29) п-аминофенил-2,4-ди-О-метил-  -D-галактопиранозид -D-галактопиранозид779 мг (2 ммоль) соединения примера 1.29.в) гидрируют в течение 5 суток описанным в примере 1.24 образом. После упаривания объединенных фильтратов в вакууме и двукратного кипячения остатка в присутствии диэтилового эфира, взятого в количестве по 50 мл, получают 391 мг (65%) слегка зеленоватых кристаллов. Тонкослойная хроматография: этилацетата; Rf = 0,16; т.п.: 260oC (разл.). Пример 1.30 п-аминофенил-2,6-ди-O-метил-  -D-галактопиранозид -D-галактопиранозид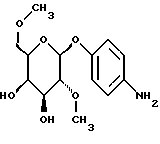 1.30. а) п-нитрофенил-2,6-ди-О- метил-3,4-О-изопропилиден-  -D-галактопиранозид -D-галактопиранозид4,1 г (12 ммоль) фракции 1 примера 1.28.а) метилируют описанным в примере 1.24.в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 10: 1-8: 1-5: 1 получают 3,25 г (73 %) бесцветного масла. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf=0,65. 1.30.б) п-нитрофенил-2,6-ди-O-метил-  -D-галактопиранозид -D-галактопиранозид2,77 г (7,5 ммоль) вышеуказанного соединения подвергают описанной в примере 1.24. г) реакции. После очистки путем флеш-хроматографии с применением в качестве элюента смеси этилацетата и петролейного эфира в соотношении 2:1 получают 1,63 г (66%) бесцветных кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,31; т.п.: 222oC. 1.30) п-аминофенил-2,6-ди-O-метил-  -D-галактопиранозид -D-галактопиранозид989 мг (3 ммоль) соединения примера 1.30.б) восстанавливают описанным в примере 1.24 образом. Получают 597 мг (66%) бесцветного масла. Тонкослойная хроматография: смесь дихлорметана, метанола и 25%-ного аммиака в соотношении 15:3:0,2; Rf = 0,56; [  ]20= -53,1 ]20= -53,1 (c = 0,49/CH3OH).
Пример 1.31 (c = 0,49/CH3OH).
Пример 1.31Ацетат п-аминофенил-3,4-ди-O-метил-  -D-галактопиранозида -D-галактопиранозида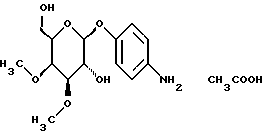 1.31. а) п-нитрофенил-2,6-ди-O-бензил-3,4-O-изопропилиден-  -D- галактопиранозид -D- галактопиранозид4,1 г (12 ммоль) фракции 1 примера 1.28.а) бензилируют описанным в примере 1.26. в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 6:1 получают 5,3 г (85%) желтоватого масла. Тонкослойная хроматография: смесь этилацетата и петролейного эфира в соотношении 2:1; Rf = 0,76; [  ]20= +8,8 ]20= +8,8 (с=1,2/CH3OH).
1.31.б) п-нитрофенил-2,6-ди-О-бензил- (с=1,2/CH3OH).
1.31.б) п-нитрофенил-2,6-ди-О-бензил- -D-галактопиранозид -D-галактопиранозид4,69 г (9 ммоль) вышеуказанного соединения подвергают описанной в примере 1.24.г) реакции. Смесь держат при комнатной температуре в течение 30 минут, сгущают в вакууме и остаток сушат в течение часа в вакууме масляного насоса. В результате перекристаллизации из этанола получают 2,89 г (67%) бесцветных кристаллов. Тонкослойная хроматография: смесь этилацетата и петролейного эфира в соотношении 2:1; Rf = 0,42; т.п.: 133oC; [  ]20= -64,2 ]20= -64,2 (с = 1,0/CH3OH).
1.31. в) п-нитрофенил-2,6-ди-O-бензил-3,4-ди-O-метил- (с = 1,0/CH3OH).
1.31. в) п-нитрофенил-2,6-ди-O-бензил-3,4-ди-O-метил-  -D- галактопиранозид -D- галактопиранозид2,4 г (5 ммоль) вышеуказанного соединения метилируют описанным в примере 1.26. в) образом. После перекристаллизации из смеси этанола и н-гексана получают 1,74 г (69%) бесцветных кристаллов. Тонкослойная хроматография: смесь этилацетата и петролейного эфира в соотношении 1:1; Rf = 0,74; т.п.: 149oC. 1.31) Ацетат п-аминофенил-3,4-ди-O-метил-  -D-галактопиранозида -D-галактопиранозида1,52 г (3 ммоль) соединения примера 1.31.в) гидрируют описанным в примере 1.26 образом. Получают 664 мг (62%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,47; т.п.: 140oC (разл.). Пример 1.32 п-аминофенил-3,6-ди-О-метил-  -D-галактопиранозид -D-галактопиранозид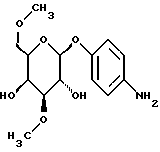 1.32. а) п-нитрофенил-3-O-метил-6-0-(трет-бутилдиметилсилил)-  -D-галактопиранозид -D-галактопиранозидРаствор 1,58 г (5 ммоль) соединения примера 1.25.а) в 150 мл диметилформамида смешивают с 1 г (15 ммоль) имидазола и 1,25 г (8 ммоль) трет-бутилди-метилсилил-хлорида и перемешивают в течение 24 часов при комнатной температуре. Затем реакцию прекращают добавкой 100 мл воды. Разбавляют 1000 мл дихлорметана, органическую фазу два раза промывают водой, взятой в количестве по 1000 мл, сушат над 20 г сульфата магния и сгущают в вакууме. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношений 15:1  10:1 10:1 5:1 получают 826 мг (38%) желтоватой пены, которая содержит еще примеси. Тонкослойная хроматография: этилацетат; Rf = 0,59; [ 5:1 получают 826 мг (38%) желтоватой пены, которая содержит еще примеси. Тонкослойная хроматография: этилацетат; Rf = 0,59; [ ]20= -56,3 ]20= -56,3 (с = 1,0/CH2Cl2).
1.32.6) п-нитрофенил-2,4-ди-O-бензил-3-O-метил-6-O-(трет- бутилдиметилсилил)- (с = 1,0/CH2Cl2).
1.32.6) п-нитрофенил-2,4-ди-O-бензил-3-O-метил-6-O-(трет- бутилдиметилсилил)-  -D-галактопиранозид -D-галактопиранозид773 мг (1,8 ммоль) вышеуказанного соединения бензилируют описанным в примере 1.26.в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 30: 1-5:1 получают 810 мг (74%) бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 5:1; Rf = 0,58. 1.32.в) п-нитрофенил-2,4-ди-O-бензил-3-O-метил-  D-галактопиранозид D-галактопиранозид732 мг (1,2 ммоль) соединения примера 1.32.6) растворяют в 6 мл тетрагидрофурана и смешивают при температуре 0oC с 2,4 мл 1 М раствора фторида тетрабутиламмония в тетрагидрофуране. Перемешивают в течение 40 мин при комнатной температуре и сгущают в вакууме. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 5:1-3:1-2:1 получают 512 мг (86%) бесцветных кристаллов. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,36; т.п.: 177oC. 1.32. г) п-нитрофенил-2,4-ди-O-бензил-3,6-ди-O-метил-  -D- галактопиранозид -D- галактопиранозид446 мг (0,9 ммоль) вышеуказанного соединения метилируют описанным в примере 1.24.в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 20:1-10:1-8:1 получают 401 мг (87%) бесцветного масла. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,70; [  ]20= -56,5 ]20= -56,5 (c = 0,96/CH2Cl2).
1.32) п-аминофенил-3,6-ди-О-метил- (c = 0,96/CH2Cl2).
1.32) п-аминофенил-3,6-ди-О-метил-  -D-галактопиранозид -D-галактопиранозид357 мг (0,7 ммоль) соединения примера 1.32.г) гидрируют описанным в примере 1.24 образом. После сгущения объединенных фильтратов в вакууме и кипячения остатка в присутствии 20 мл диэтилового эфира получают 207 мг (99%) бесцветных кристаллов. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,02; т.п.: > 280oC (разл.). Пример 1.33 п-аминофенил-4,6-ди-O-метил-  -D-галактопиранозид -D-галактопиранозид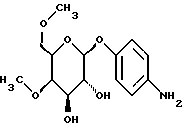 1.33. а) п-нитрофенил-2,З-ди-О-бензил-4,6-ди-О-метил-  -D-галактопиранозид -D-галактопиранозид2,4 г (5 ммоль) соединения примера 1.26. г) метилируют описанным в примере 1.24.в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 5:1 -3: 1 получают 1,89 г (74%) бесцветных кристаллов. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,76: т. п.: 100oC. 1.33) п-аминофенил-4,6-ди-O-метил-  -D-галактопиранозид -D-галактопиранозид1,53 г (3 ммоль) соединения примера 1.33.а) гидрируют описанным в примере 1.24 образом. Получают 890 мг (99%) бесцветных кристаллов. Тонкослойная хроматография: смесь метанола и этилацетата в соотношении 1:1; Rf = 0,71; т. п.: 180oC (разл.). Пример 1.34 п-аминофенил-2,3,4-три-О-метил-  -D-галактопиранозид -D-галактопиранозид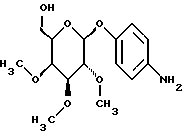 1.34. а) п-нитрофенил-2,3,4-три-О-метил-6-О-трифенилметил-  -D- галактопиранозид -D- галактопиранозид1,63 г (3 ммоль) соединения примера 1.24.а) метилируют описанным в примере 1.24. в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 5: 1-3: 1 получают 1,24 г (71%) бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1: 1; Rf = 0,54; [  ]20= -53,6 ]20= -53,6 (c = 0,3/CH3OH).
1.34.б) п-нитрофенил-2,3,4-три-O-метил- (c = 0,3/CH3OH).
1.34.б) п-нитрофенил-2,3,4-три-O-метил-  -D-галактопиранозид -D-галактопиранозид1,17 г (2 ммоль) вышеуказанного соединения подвергают описанной в примере 1.24. г) реакции. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 3:1 -2: 1 получают 468 мг (68%) бесцветных кристаллов. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,12; т. п.: 104oC; [  ]20= -68,2 ]20= -68,2 (c = 0,47/CH3OH).
1.34) п-аминофенил-2,3,4-три-O-метил- (c = 0,47/CH3OH).
1.34) п-аминофенил-2,3,4-три-O-метил-  -D-галактопиранозид -D-галактопиранозид343 мг (1 ммоль) соединения примера 1.34.б) восстанавливают описанным в примере 1.24 образом. Получают 224 мг (71%) бежевых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,67; т.п.: 138oC. Пример 1.35 п-аминофенил-2,3,6-три-О-метил-  -D-галактопиранозид -D-галактопиранозид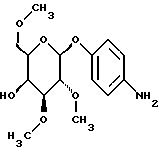 1.35.а) п-нитрофенил-2,3,6-три-О-метил-  -D-галактопиранозид -D-галактопиранозид2,63 г (3 ммоль) соединения примера 1.30.б) подвергают селективному метилированию описанным в примере 1.25. а) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 5: 1-2:1 получают 890 мг (32%) коричневатого масла. Тонкослойная хроматография: этилацетат; Rf = 0,37; [  ]20= -63,3 ]20= -63,3 (с = 0,9/CH2Cl2).
1.35) п-аминофенил-2,3,6-три-О-метил- (с = 0,9/CH2Cl2).
1.35) п-аминофенил-2,3,6-три-О-метил- -D-галактопиранозид -D-галактопиранозид858 мг (2,5 ммоль) вышеуказанного соединения восстанавливают описанным в примере 1.24 образом. Получают 519 мг (66%) бежевой пены. Тонкослойная хроматография: этилацетат; Rf = 0,23; [  ]20= -34,5 ]20= -34,5 (с = 0,86/CH3OH).
Пример 1.36 (с = 0,86/CH3OH).
Пример 1.36п-аминофенил-2,4,6-три-О-метил-  -D-галактопиранозид -D-галактопиранозид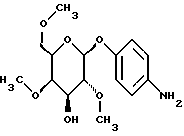 1.36.а) п-нитрофенил-2,4,6-три-O-метил-3-O-бензил-  -D-галактопиранозид -D-галактопиранозид1,96 г (5 ммоль) соединения примера 1.26.а) метилируют описанным в примере 1.24. в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 10: 1  8:1 получают 1,47 г (68%) бесцветных кристаллов. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2:1; Rf = 0,46; т.п.: 164oC.
1.36) п-аминофенил-2,4,6-три-O-метил- 8:1 получают 1,47 г (68%) бесцветных кристаллов. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 2:1; Rf = 0,46; т.п.: 164oC.
1.36) п-аминофенил-2,4,6-три-O-метил-  -D-галактопиранозид -D-галактопиранозид1,3 г (3 ммоль) вышеуказанного соединения восстанавливают описанным в примере 1.26 образом. Получают 642 мг (68%) бесцветных кристаллов. Тонкослойная хроматография: смесь этилацетата и петролейного эфира в соотношении 2:1; Rf = 0,12; т.п.: 147oC (разл.). Пример 1.37 п-аминофенил-3,4,6-три-О-метил-  -D-галактопиранозид -D-галактопиранозид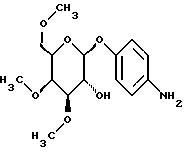 1.37.а) п-нитрофенил-2-O-бензил-  -D-галактопиранозид -D-галактопиранозид1,17 г (2 ммоль) фракции 1 примера 1.27.а) подвергают описанной в примере 1.24.г) реакции. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 3:1-2: 1 получают 468 мг (68%) бесцветных кристаллов. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,12; т.п.: 104oC; [  ]20= -68,2 ]20= -68,2 (с = 0,47/CH3OH).
1.37. б) п-нитрофенил-2-О-бензил-3,4,6-три-О-метил- (с = 0,47/CH3OH).
1.37. б) п-нитрофенил-2-О-бензил-3,4,6-три-О-метил-  -D- галактопиранозид -D- галактопиранозид391 мг (1 ммоль) вышеуказанного соединения метилируют описанным в примере 1.24. в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 10: 1-5: 1 получают 303 мг (70%) светло-желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,81; [  ]20= -76,5 ]20= -76,5 (с = 1,1/CH2Cl2).
1.37) п-аминофенил-3,4,6-три-O-метил- (с = 1,1/CH2Cl2).
1.37) п-аминофенил-3,4,6-три-O-метил-  -D-галактопиранозид -D-галактопиранозид260 мг (0,6 ммоль) соединения примера 1.37.б) гидрируют описанным в примере 1.24 образом. Получают 161 мг (86%) бежевых кристаллов. Тонкослойная хроматография: этилацетат; f = 0,20; т.п.: 132oC. Пример 1.38 п-аминофенил-2,3,4,6-тетра-О-метил-  -D-галактопиранозид -D-галактопиранозид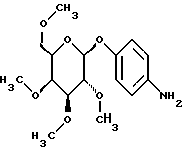 1.38.а) п-нитрофенил-2,3,4,6-тетра-O-метил-  -D-галактопиранозид -D-галактопиранозид904 мг (3 ммоль) п-нитрофенил-  -D-галактопиранозида метилируют описанным в примере 1.24.в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 8: 1-6:1-4:1-2:1 получают 633 мг (59%) бесцветного, воскообразного твердого вещества. Тонкослойная хроматография: этилацетат; Rf = 0,67; [ -D-галактопиранозида метилируют описанным в примере 1.24.в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 8: 1-6:1-4:1-2:1 получают 633 мг (59%) бесцветного, воскообразного твердого вещества. Тонкослойная хроматография: этилацетат; Rf = 0,67; [ ]20= -55,7 ]20= -55,7 (с = 0,9/CH2Cl2).
1.38) п-аминофенил-2,3,4,6-тетра-О-метил- (с = 0,9/CH2Cl2).
1.38) п-аминофенил-2,3,4,6-тетра-О-метил-  -D-галактопиранозид -D-галактопиранозид536 мг (1,5 ммоль) соединения примера 1.33.а) гидрируют описанным в примере 1.24 образом. После упаривания объединенных фильтратов в вакууме и кипячения остатка в присутствии 20 мл диэтилового эфира получают 412 мг (84%) бесцветных кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,42; т.п.: 204oC (разл.). Пример 1.39 п-аминофенил-  -D-маннопиранозид -D-маннопиранозид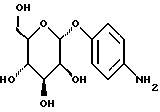 3,0 г (10 ммоль) п-нитрофенил-  -D-маннопиранозида гидрируют описанным в примере 1.23 образом. В результате осаждения из смеси метанола и диэтилового эфира получают 2,03 г (75%) бесцветных кристаллов. Тонкослойная хроматография: метанолт; Rf = 0,69: т.п.: 161oC; [ -D-маннопиранозида гидрируют описанным в примере 1.23 образом. В результате осаждения из смеси метанола и диэтилового эфира получают 2,03 г (75%) бесцветных кристаллов. Тонкослойная хроматография: метанолт; Rf = 0,69: т.п.: 161oC; [ ]20= +102,7 ]20= +102,7 (c = 1,0/H2O).
Пример 1.40 (c = 1,0/H2O).
Пример 1.40п-аминофенил-3-О-метил-  -D-маннопиранозид -D-маннопиранозид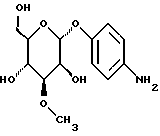 1.40.а) п-нитрофенил-6-О-трифенилметил-  -D-маннопиранозид -D-маннопиранозид3,0 г (10 ммоль) п-нитрофенил-  -D-маннопиранозида тритилируют описанным в примере 1.24. а) образом. Получают 4,35 г (80%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,52; [ -D-маннопиранозида тритилируют описанным в примере 1.24. а) образом. Получают 4,35 г (80%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,52; [ ]20= +104,0 ]20= +104,0 (c = 1,0/CH3OH); т. п.: 102 – 104oC.
1.40.б) п-нитрофенил-3-O-метил-6-О-трифенилметил- (c = 1,0/CH3OH); т. п.: 102 – 104oC.
1.40.б) п-нитрофенил-3-O-метил-6-О-трифенилметил-  -D-маннопиранозид.
2,72 г (5 ммоль) вышеуказанного соединения подвергают описанному в примере 1.26. а) взаимодействию с 2 мл (30 ммоль) метилйодида. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 2:1 и осаждения из смеси этанола и н-гексана получают 1,83 г (66%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3: 0,2; Rf = 0,68; [ -D-маннопиранозид.
2,72 г (5 ммоль) вышеуказанного соединения подвергают описанному в примере 1.26. а) взаимодействию с 2 мл (30 ммоль) метилйодида. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 2:1 и осаждения из смеси этанола и н-гексана получают 1,83 г (66%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3: 0,2; Rf = 0,68; [ ]20= +106,4 ]20= +106,4 (c = 1,0/CH3OH); т.п.: 104oC.
1.40) п-аминофенил-3-О-метил- (c = 1,0/CH3OH); т.п.: 104oC.
1.40) п-аминофенил-3-О-метил-  -D-маннопиранозид -D-маннопиранозид1,4 г (2,5 ммоль) соединения примера 1.40.б) растворяют в 50 мл метанола. После добавки 300 мг 10%-ного палладия на активном угле гидрируют атмосфере водорода при незначительном избыточном давлении в течение 24 часов. Суспензию фильтруют на силикате марки Celite, после чего фильтруемый материал интенсивно промывают 100 мл метанола. После сгущения фильтрата в вакууме остаток смешивают с 50 мл воды, фильтруют и фильтрат лиофилизуют. Получают 709 г (99%) коричневатого аморфного твердого вещества. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,33; [  ]20= +92,9 ]20= +92,9 (с = 1,1/CH3OH).
Пример 1.41 (с = 1,1/CH3OH).
Пример 1.41п-аминофенил-2,3-ди-O-метил-  -D-маннопиранозид -D-маннопиранозид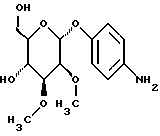 1.41.а) п-нитрофенил-4,6-О-бензилиден-  -D-маннопиранозид -D-маннопиранозидРаствор 6,0 г (20 ммоль) п-нитрофенил-  -D-маннопиранозида в 120 мл диметилформамида смешивают с 3,2 мл (21,4 ммоль) бензальдегид-диметилацетала и 2,7 мл (20 ммоль) 54%-ного раствора тетрафторборной кислоты в диэтилового эфира. Перемешивают в течение 5 часов при комнатной температуре, после чего реакцию прекращают добавкой 2,8 мл (20 ммоль) триэтиламина и сгущают в вакууме. После очистки путем флеш-хроматографии с применением в качестве элюента сначала толуола, а потом смеси толуола и этанола в соотношении 20 : 1 получают 6,48 г (83%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,82; [ -D-маннопиранозида в 120 мл диметилформамида смешивают с 3,2 мл (21,4 ммоль) бензальдегид-диметилацетала и 2,7 мл (20 ммоль) 54%-ного раствора тетрафторборной кислоты в диэтилового эфира. Перемешивают в течение 5 часов при комнатной температуре, после чего реакцию прекращают добавкой 2,8 мл (20 ммоль) триэтиламина и сгущают в вакууме. После очистки путем флеш-хроматографии с применением в качестве элюента сначала толуола, а потом смеси толуола и этанола в соотношении 20 : 1 получают 6,48 г (83%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,82; [ ]20= +170,7 ]20= +170,7 (c = 1,0/CH2Cl2); т.п.: 116oC.
1.41. б) п-нитрофенил-2,3-ди-О-метил-4,6-О-бензилиден- (c = 1,0/CH2Cl2); т.п.: 116oC.
1.41. б) п-нитрофенил-2,3-ди-О-метил-4,6-О-бензилиден-  -D-маннопиранозид -D-маннопиранозид3,9 г (10 ммоль) вышеуказанного соединения метилируют описанным в примере 1.24.в) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 20:1 -7: 1 и осаждения из смеси этилацетата и н-гексана получают 3,2 г (77%) бесцветной пены. Тонкослойная хроматография: смесь этилацетата и петролейного эфира в соотношении 2:1; Rf = 0,67; [  ]20= +167,3 ]20= +167,3 (c = 1,05/CH3OH).
1.41) п-аминофенил-2,3-ди-О-метил- (c = 1,05/CH3OH).
1.41) п-аминофенил-2,3-ди-О-метил-  -D-маннопиранозид -D-маннопиранозид1,25 г (3 ммоль) соединения примера 1.41.6) гидрируют описанным в примере 1.26 образом. После очистки путем флеш-хроматографии с применением в качестве элюента сначала смеси этилацетата и петролейного эфира в соотношении 2: 1, а потом этилацетата, каждый раз в присутствии 0,5% триэтиламина, получают 480 мг (53%) красновато-коричневой пены. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf=0,31; [  ]20= +83,6 ]20= +83,6 (c=0,76/CH3OH).
Пример 1.42 (c=0,76/CH3OH).
Пример 1.42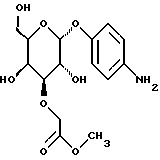 1.42.а) п-нитрофенил-3-О-метоксикарбонилметил-  -D- галактопиранозид -D- галактопиранозидРаствор 7,53 г (25 ммоль) п-нитрофенил-  -D-галактопиранозида в 180 мл абсолютного диоксана смешивают с 9,3 г (37,5 ммоль) окиси дибутилолова и нагревают с обратным холодильником. Через 4 часа полученный раствор смешивают с 8,3 мл (90 ммоль) сложного метилового эфира бромуксусной кислоты и 9,25 г (25 ммоль) йодида тетрабутиламмония и перемешивают реакционную смесь с обратным холодильником в течение 3 часов. Потом растворитель отгоняют в вакууме и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 50:1-20:1. Наряду с некоторыми побочными продуктами получают 4,05 г (43%) соединения примера 1.42. а) в виде бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf= 0,54; [ -D-галактопиранозида в 180 мл абсолютного диоксана смешивают с 9,3 г (37,5 ммоль) окиси дибутилолова и нагревают с обратным холодильником. Через 4 часа полученный раствор смешивают с 8,3 мл (90 ммоль) сложного метилового эфира бромуксусной кислоты и 9,25 г (25 ммоль) йодида тетрабутиламмония и перемешивают реакционную смесь с обратным холодильником в течение 3 часов. Потом растворитель отгоняют в вакууме и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 50:1-20:1. Наряду с некоторыми побочными продуктами получают 4,05 г (43%) соединения примера 1.42. а) в виде бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf= 0,54; [ ]20= -62,0 ]20= -62,0 (с = 1,0/CH3OH); т.п.: 176oC.
1.42) п-аминофенил-3-О-метоксикарбонилметил- (с = 1,0/CH3OH); т.п.: 176oC.
1.42) п-аминофенил-3-О-метоксикарбонилметил-  -D-галактопиранозид -D-галактопиранозид3,73 г (10 ммоль) соединения примера 1.42.а) гидрируют описанным в примере 1.24 образом. После осаждения из смеси этанола и н-гексана получают 2,98 г (87%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15: 3:0,2; Rf = 0,39; [  ]20= -36,3 ]20= -36,3 (c = 1,07/CH3OH); т.п.: 155oC.
Пример 1.43 (c = 1,07/CH3OH); т.п.: 155oC.
Пример 1.43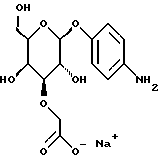 1.43) Натриевая соль п-нитрофенил-3-О-карбоксиметил-  -D-галактопиранозида -D-галактопиранозидаРаствор 3,73 г (10 ммоль) соединения примера 1.42.а) в 100 мл метанола смешивают с раствором 400 мг (10 ммоль) гидроокиси натрия в 5 мл воды и перемешивают при комнатной температуре в течение 2 часов. После сгущения в вакууме остаток сушат в вакууме масляного насоса в течение 2 часов, после чего смешивают с 100 мл этанола. Кипятят с обратным холодильником в течение 5 минут, фильтруют после охлаждения на ледяной бане и получают 3,66 г (96%) бесцветных кристаллов. Тонкослойная хроматография: метанол; Rf = 0,62; [  ]20= -50,0 ]20= -50,0 (c = 1,0/CH3OH); т.п.: 180 – 185oC.
1.43) Натриевая соль п-аминофенил-3-О-карбоксиметил- (c = 1,0/CH3OH); т.п.: 180 – 185oC.
1.43) Натриевая соль п-аминофенил-3-О-карбоксиметил-  -D-галактопиранозида -D-галактопиранозида3,05 г (8 ммоль) вышеуказанного соединения гидрируют описанным в примере 1.24 образом. После кипячения в присутствии 50 мл этанола получают 2,03 г (72%) бесцветных кристаллов. Тонкослойная хроматография: метанол; Rf = 0,70: [  ]20= -22,4 ]20= -22,4 (c = 1,0/CH3OH): т.п.: 180 – 182oC.
Пример 1.44 (c = 1,0/CH3OH): т.п.: 180 – 182oC.
Пример 1.44п-аминофенил-3-О-карбамоилметил-  -D-галактопиранозид -D-галактопиранозид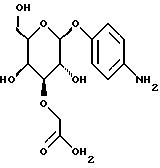 1.44.a) п-нитрофенил-3-О-карбамоилметил-  -D-галактопиранозид -D-галактопиранозидРаствор 373 мг (1 ммоль) соединения примера 1.42.а) в 30 мл метанола смешивают с 10 мл 25%-ного водного раствора аммиака и перемешивают в течение 15 минут при комнатной температуре. После сгущения в вакууме остаток сушат в течение 2 часов в вакууме масляного насоса, после чего смешивают с 30 мл этанола. Кипятят с обратным холодильником в течение 5 минут, после охлаждения на ледяной бане отфильтровывают и получают 306 мг (85%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,14; [  ]20= -41,7 ]20= -41,7 (c = 1,0/CH3OH); т.п.: 229oC (разл.).
1.44) п-аминофенил-3-О-карбамоилметил- (c = 1,0/CH3OH); т.п.: 229oC (разл.).
1.44) п-аминофенил-3-О-карбамоилметил-  -D-галактопиранозид -D-галактопиранозид287 мг (0,8 ммоль) вышеуказанного соединения гидрируют описанным в примере 1.24 образом. После осаждения из смеси метанола и диэтилового эфира получают 207 мг (79%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,10; т.п.: 205oC (разл.). Пример 1.45 п-аминофенил-3-O-(N-метил-карбамоилметил)-  -D-галактопиранозид -D-галактопиранозид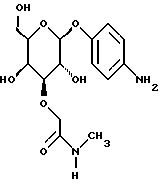 1.45. а) п-нитрофенил-3-O-(N-метил-карбамоилметил)-  -D- галактопиранозид -D- галактопиранозидРаствор 373 мг (1 ммоль) соединения примера 1.42.а) в 30 мл метанола смешивают с 10 мл 30%-ного водного раствора метиламина и перемешивают в течение 2 часов при комнатной температуре. После сгущения в вакууме остаток сушат в течение 2 часов в вакууме масляного насоса, после чего перекристаллизуют из этанола. Получают 372 мг (100%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,33; [  ]20= -36,7 ]20= -36,7 (c= 1,0/CH3OH); т.п.: 205oC.
1.45) п-аминофенил-3-O-(N-метил-карбамоилметил)- (c= 1,0/CH3OH); т.п.: 205oC.
1.45) п-аминофенил-3-O-(N-метил-карбамоилметил)-  -D-галактопиранозид -D-галактопиранозид298 мг (0,8 ммоль) соединения примера 1.45.а) гидрируют описанным в примере 1.24 образом. После осаждения из смеси метанола и диэтилового эфира получают 180 мг (66%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, Метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,16; т.п.: 239oC. Пример 1.46 п-аминофенил-3-O-(N-пропил-карбамоилметил)-  -D-галактопиранозид -D-галактопиранозид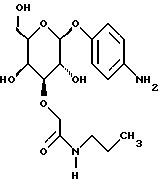 1.46. a) п-нитpoфенил-3-O-(N-пpoпил-кapбaмoилметил)-  -D-гaлaктoпиpaнoзид -D-гaлaктoпиpaнoзид373 мг (1 ммоль) соединения примера 1.42.а) подвергают описанному в примере 1.45. а) взаимодействию с 823 мкл (10 ммоль) н-пропиламина. После сгущения в вакууме остаток осаждают из смеси этанола и н-гексана. Получают 340 мг (85%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15: 3:0,2; Rf = 0,49: [  ]20= -32,4 ]20= -32,4 (c = 1,0/CH3OH); т.п.: 155oC.
1.46) п-аминофенил-3-O-(N-пропил-карбамоилметил)- (c = 1,0/CH3OH); т.п.: 155oC.
1.46) п-аминофенил-3-O-(N-пропил-карбамоилметил)-  -D-галактопиранозид -D-галактопиранозид320 мг (0,8 ммоль) соединения примера 1.46.а) гидрируют описанным в примере 1.24 образом. После осаждения из смеси метанола и диэтилового эфира получают 188 мг (63%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,31: т.п.: 154oC. Пример 1.47 п-аминофенил-3-O-(N-бутил-карбамоилметил)-  -D-галактопиранозид -D-галактопиранозид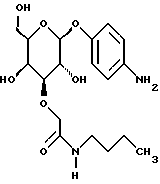 1.47.a) п-нитрофенил-3-O-(N-бутил-карбамоилметил)-  -D-галактопиранозид -D-галактопиранозид373 мг (1 ммоль) соединения примера 1.42.а) подвергают описанному в примере 1.45. а) взаимодействию с 900 мкл (10 ммоль) н-бутиламина. После сгущения в вакууме остаток осаждают из смеси этанола и н-гексана. Получают 413 мг (100%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,51; [  ]20= -26,8 ]20= -26,8 (c = 1,0/CH3OH); т.п.: 92oC.
1.47) п-аминофенил-3-O-(N-бутил-карбамоилметил)- (c = 1,0/CH3OH); т.п.: 92oC.
1.47) п-аминофенил-3-O-(N-бутил-карбамоилметил)-  -D-галактопиранозид -D-галактопиранозид332 мг (0,8 ммоль) соединения примера 1.47.а) гидрируют описанным в примере 1.24 образом. После осаждения из смеси этанола и н-гексана получают 105 мг (34%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанолами аммиака (25%) в соотношении 15:3:0,2: Rf = 0,32; т.п.: 135oC. Пример 1.48 п-аминофенил-3-O-метоксикарбонилметил-  -D-маннопиранозид -D-маннопиранозид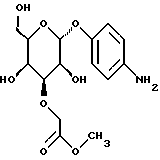 1.48. a) п-нитрофенил-3-О-метоксикарбонилметил-6-О-трифенилметил-  -D-маннопиранозид -D-маннопиранозид13,6 г (25 ммоль) соединения примера 1.40.а) подвергают описанной в примере 1.42. а) реакции. После флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 10:1 получают наряду с несколькими побочными продуктами 2,79 г (18%) бесцветных кристаллов. Тонкослойная хроматография: смесь этилацетата и петролейного эфира в соотношении 2:1; Rf = 0,50; т.п.: 95 – 97oC. 1.48) п-аминофенил-3-О-метоксикарбонилметил-6-O- трифенилметил-  -D-маннопиранозид -D-маннопиранозид1,23 г (2 ммоль) соединения примера 1.48.а) гидрируют описанным в примере 1.40 образом и обрабатывают. Получают 250 мг (36%) коричневатого аморфного твердого вещества. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,45. Пример 1.49 п-аминофенил-3-О-карбоксиметил-  -D-маннопиранозид -D-маннопиранозид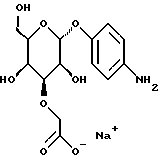 1.49. а) п-нитрофенил-3-О-бензоксикарбонилметил-6-О- трифенилметил-  -D-маннопиранозид -D-маннопиранозид13,6 г (25 ммоль) соединения примера 1.40.а) подвергают описанному в примере 1.42. а) взаимодействию с 14,4 мл (90 ммоль) сложного бензилового эфира бромуксусной кислоты. После флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 20:1-10: 1 получают наряду с некоторыми побочными продуктами 5,0 г (29%) желтоватой пены. Тонкослойная хроматография: смесь этилацетата и петролейного эфира в соотношении 2:1; Rf = 0,66; [  ]20= +74,8 ]20= +74,8 (c = 1,0/CH2Cl2).
1.49) п-аминофенил-3-О-карбоксиметил- (c = 1,0/CH2Cl2).
1.49) п-аминофенил-3-О-карбоксиметил-  -D-маннопиранозид -D-маннопиранозид2,08 г (3 ммоль) вышеуказанного соединения гидрируют описанным в примере 1.40 образом в течение 36 часов. После сгущения фильтрата остаток осаждают из смеси этанола и н-гексана. В результате промывания этилацетатом и повторного осаждения из смеси этанола и диэтилового эфира получают 495 мг (50%) бесцветных кристаллов. Тонкослойная хроматография: метанол; Rf = 0,53: т.п.: 205 – 207oC. Пример 1.50 п-аминофенил-3-О-карбамоилметил-  -D-маннопиранозид -D-маннопиранозид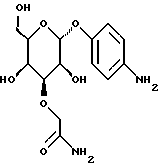 1.50. a) п-нитрофенил-3-О-карбамоилметил-6-О-трифенилметил-  -D-маннопиранозид -D-маннопиранозид1,04 г (1,5 ммоль) соединения примера 1.49.а) подвергают описанной в примере 1.44. а) реакции. Остаток сушат в вакууме масляного насоса, после чего его очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 2:3. Получают 561 мг (62%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,67; [  ]20= +91,3 ]20= +91,3 (c= 1,0/CH2Cl2); т.п.: 125 – 127oC.
1.50) п-аминофенил-3-О-карбамоилметил- (c= 1,0/CH2Cl2); т.п.: 125 – 127oC.
1.50) п-аминофенил-3-О-карбамоилметил-  -D-маннопиранозид -D-маннопиранозид541 г (0,9 ммоль) вышеуказанного соединения гидрируют описанным в примере 1.40 образом в течение 48 часов. После сгущения фильтрата остаток интенсивно промывают метанолом и получают 134 мг (45%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf= 0,21; т.п.: 126 – 128oC. Пример 1.51 п-аминофенил-3-десокси-  -D-галактопиранозид -D-галактопиранозид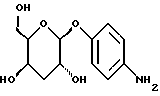 1.51.а) п-нитрофенил-2,6-ди-О-бензил-4-О-ацетил-  -D-галактопиранозид -D-галактопиранозидРаствор 2,7 г (5,6 ммоль) соединения примера 1.31.6) в 20 мл дихлорметана смешивают с 3 мл (16,3 ммоль) триэтилортоацетата и 20 мг толуолсульфокислоты. Реакционную смесь держат при комнатной температуре в течение 30 минут, после чего разбавляют 200 мл дихлорметана, промывают 50 мл насыщенного раствора бикарбоната натрия, органическую фазу сушат над сульфатом магния, фильтруют и сгущают в вакууме. Полученную бесцветную пену растворяют в 15 мл 80%-ной уксусной кислоты. Реакционную смесь держат при комнатной температуре в течение дополнительных 30 минут, после чего подают в 200 мл насыщенного раствора бикарбоната натрия, три раза экстрагируют хлороформом, взятым в количестве по 75 мл, объединенные органические фазы промывают 100 мл воды, сушат над сульфатом магния, фильтруют и сгущают в вакууме. В результате осаждения из смеси этанола и петролейного эфира получают 2,43 г (83%) бесцветных кристаллов. Тонкослойная хроматография: смесь этилацетата и петролейного эфира в соотношении 2:1; Rf = 0,64; [  ]20= -62,1 ]20= -62,1 (с = 1,0/CH2Cl2); т.п.: 83oC.
1.51. б) п-нитрофенил-2,6-ди-O-бензил-3-O- трифторметансульфонил-4-O-ацетил- (с = 1,0/CH2Cl2); т.п.: 83oC.
1.51. б) п-нитрофенил-2,6-ди-O-бензил-3-O- трифторметансульфонил-4-O-ацетил-  -D-галактопиранозид -D-галактопиранозидК раствору 2,3 г (4,4 ммоль) соединения примера 1.51.а) в смеси 30 мл дихлорметана и 3 мл пиридина в атмосфере аргона при температуре -20oC прикапывают раствор 2 мл (11,8 ммоль) ангидрида трифторметансульфокислоты в 30 мл дихлорметана. Реакционную смесь оставляют стоять при температуре -20oC в течение часа, после чего подают в 200 мл насыщенного раствора бикарбоната натрия, органическую фазу отделяют, сушат над сульфатом магния, фильтруют и сгущают в вакууме. После очистки путем флеш-хроматографии с применением в качестве элюента сначала толуола, а потом смеси толуола и этилацетата в соотношении 20: 1 получают 2,39 г (83%) бесцветных кристаллов. Тонкослойная хроматография: смесь толуола и этилацетата в соотношении 5:1; Rf = 0,55; [  ]20= -61,4 ]20= -61,4 (c= 1,0/CH2Cl2); т.п.: 105oC.
1.51.в) п-нитрофенил-2,6-ди-O-бензил-3-десокси- (c= 1,0/CH2Cl2); т.п.: 105oC.
1.51.в) п-нитрофенил-2,6-ди-O-бензил-3-десокси-  -D-галактопиранозид -D-галактопиранозид1,31 г (2 ммоль) вышеуказанного соединения растворяют в 25 мл толуола и смешивают с 1,54 г (6 ммоль) тетраборгидрата тетрабутиламмония. Реакционную смесь держат при температуре 80oC в течение 2 часов, после чего разбавляют 200 мл дихлорметана, промывают 50 мл воды, органическую фазу сушат над сульфатом магния, фильтруют и сгущают в вакууме. После очистки путем флеш-хроматографии с применением в качестве элюента смеси толуола и этилацетата в соотношении 7: 1 получают 596 мг (64%) бесцветных кристаллов. Тонкослойная хроматография: смесь толуола и этилацетата в соотношении 5:1; Rf = 0,10; [  ]20= -81,3 ]20= -81,3 (с = 1,0/CH2Cl2); т.п.:114oC.
1.51) п-аминофенил-3-десоксит- (с = 1,0/CH2Cl2); т.п.:114oC.
1.51) п-аминофенил-3-десоксит-  -D-галактопиранозид -D-галактопиранозид465 мг (1 ммоль) соединения примера 1.51.в) гидрируют описанным в примере 1.40 образом в течение 6 часов. После сгущения фильтрата остаток осаждают из смеси этанола и петролейного эфира и получают 206 мг (81%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2, Rf = 0,22. Пример 1.52 п-аминофенил-3,4-дидесокси-  -D-галактопиранозид -D-галактопиранозид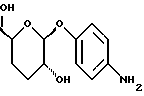 1.52. а) п-нитрофенил-2,6-ди-O-бензил-3,4-ди-O- трифторметансульфонил-  -D-галактопиранозид -D-галактопиранозид2,12 г (4,4 ммоль) соединения примера 1.31.б) подвергают описанному в примере 1.51. б) взаимодействию с 4 мл (23,6 ммоль) ангидрида трифторметансульфокислоты. После очистки путем флеш-хроматографии с применением в качестве элюента сначала толуола, а потом смеси толуола и этилацетата в соотношении 50: 1 получают 2,75 г (84%) желтоватого масла. Тонкослойная хроматография: месь толуола и этилацетата в соотношении 5:1; Rf = 0,67; [  ]20= -22,5 ]20= -22,5 (c = 1,0/CH2Cl2).
1.52. б) п-нитрофенил-2,6-ди-O-бензил-3,4-дидесокси- (c = 1,0/CH2Cl2).
1.52. б) п-нитрофенил-2,6-ди-O-бензил-3,4-дидесокси-  -D-галактопиранозид -D-галактопиранозид1,49 г (2 ммоль) соединения примера 1.52.а) подвергают описанному в примере 1.51. В) взаимодействию с 2,31 г (9 ммоль) тетраборгидрата тетрабутиламмония. После очистки путем флеш-хроматографии с применением в качестве элюента сначала толуола, а потом смеси толуола и этилацетата в соотношении 50: 1 получают 629 мг (70%) бесцветных кристаллов. Тонкослойная хроматография: смесь толуола и этилацетата в соотношении 5:1; Rf = 0,53; [  ]20= -79,1 ]20= -79,1 (c = 1,0/CH2Cl2), т.п.: 89oC.
1.52) п-аминофенил-3,4-дидесокси- (c = 1,0/CH2Cl2), т.п.: 89oC.
1.52) п-аминофенил-3,4-дидесокси-  -D-галактопиранозид -D-галактопиранозид450 мг (1 ммоль) соединения примера 1.52.б) гидрируют описанным в примере 1.40 образом в течение 5 часов. После сгущения фильтрата остаток осаждают из смеси этанола и петролейного эфира, в результате чего получают 183 мг (76%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2: Rf = 0,47; [  ]20= 115,1 ]20= 115,1 (c= 1,0/CH3OH); т.п.: 187oC.
Пример 1.53 (c= 1,0/CH3OH); т.п.: 187oC.
Пример 1.53п-аминофенил-6-О-ацетил-  -D-галактопиранозид -D-галактопиранозид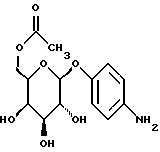 1.53.а) п-нитрофенил-6-О-ацетил-  -D-галактопиранозид -D-галактопиранозидК раствору 7,53 г (25 ммоль) п-нитрофенил-  -D- галактопиранозида в 80 мл абсолютного ацетонитрила при температуре 0oC прикапывают свежий раствор 2 мл (25 ммоль) пиридина и 1,85 мл (26 ммоль) ацетилхлорида в 20 мл ацетонитрила. Перемешивают при 0oC в течение 30 минут и сгущают в вакууме. После очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 50: 1-20: 1 получают 4,02 г (47%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3: 0,2; Rf = 0,50.
1.53) п-аминофенил-6-О-ацетил- -D- галактопиранозида в 80 мл абсолютного ацетонитрила при температуре 0oC прикапывают свежий раствор 2 мл (25 ммоль) пиридина и 1,85 мл (26 ммоль) ацетилхлорида в 20 мл ацетонитрила. Перемешивают при 0oC в течение 30 минут и сгущают в вакууме. После очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 50: 1-20: 1 получают 4,02 г (47%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3: 0,2; Rf = 0,50.
1.53) п-аминофенил-6-О-ацетил-  -D-галактопиранозид -D-галактопиранозид1,72 г (5 ммоль) соединения примера 1.53.а) гидрируют описанным в примере 1.40 образом в течение 2 часов. После сгущения фильтрата остаток переосаждают из смеси метанола и диэтилового эфира и получают 1,34 г (86%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2: Rf = 0,34; [  ]20= -41,0 ]20= -41,0 (с = 0,56/CH3OH); т.п.: 180oC (разл.).
Пример 1.54 (с = 0,56/CH3OH); т.п.: 180oC (разл.).
Пример 1.54п-аминофенил-3,4-ди-O-метоксикарбонилметил-  -D-галактопиранозид -D-галактопиранозид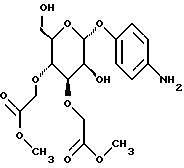 1.54.а) Ацилирование соединения примера 1.24.a) 1,36 г (3 ммоль) соединения примера 1.24.а) растворяют в 25 мл диметилформамида и смешивают с 1 мл (10,6 ммоль) сложного метилового эфира бромуксусной кислоты и порциями с 300 мг (10 ммоль) 80%-ной суспензии гидрида натрия в минеральном масле. Через 3,5 часа при комнатной температуре к смеси добавляют еще 250 мкл (2,65 ммоль) сложного метилового эфира бромуксусной кислоты и 75 мг (2,5 ммоль) гидрида натрия в минеральном масле. По истечении 2 часов реакцию прекращают прикапыванием 5 мл метанола и сгущают в вакууме. Остаток подают в 250 мл дихлорметана и раствор интенсивно перемешивают с 100 мл воды. Органическую фазу сушат над 10 г сульфата магния, сгущают в вакууме и очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 10:1-7:1-5:1-3:1. Получают 3 фракции продукта: Фракция 1: 401 мг (21%) п-нитрофенил-2,3,4-три-O- метоксикарбонилметил-  -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,47; [ -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,47; [ ]20= -51,9 ]20= -51,9 (с=0,26/CH3OH).
Фракция 2: не идентифицирована; 88 мг бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,39; [ (с=0,26/CH3OH).
Фракция 2: не идентифицирована; 88 мг бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,39; [ ]20= -61,5 ]20= -61,5 (c= 0,26/CH3OH).
Фракция 3: (c= 0,26/CH3OH).
Фракция 3:275 мг (16%) п-нитрофенил-3,4-ди-O- метоксикарбонилметил-  -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,30; [ -D-галактопиранозида в виде бесцветной пены. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,30; [ ]20= -38,6 ]20= -38,6 (с = 0,28/CH3OH).
1.54) п-аминофенил-З,4-ди-О-метоксикарбонилметил- (с = 0,28/CH3OH).
1.54) п-аминофенил-З,4-ди-О-метоксикарбонилметил-  -D-галактопиранозид -D-галактопиранозид206 мг (0,3 ммоль) фракции 3 примера 1.54.а) гидрируют описанным в примере 1.40 образом в течение 16 часов. Фильтрат сгущают, остаток кипятят в присутствии 20 мл диэтилового эфира, после чего получают 45,6 мг (37%) серых кристаллов. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,22; т.п.: 155oC (разл.). Пример 1.55 п-аминофенил-2,3,4-три-O-метоксикарбонилметил-  -D-галактопиранозид -D-галактопиранозид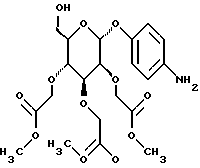 380 мг (0,5 ммоль) фракции 1 примера 1.54.а) гидрируют описанным в примере 1.40 образом в течение 16 часов. Фильтрат сгущают, остаток кипятят в присутствии 20 мл диэтилового эфира, после чего получают 46,8 мг (19%) желто-коричневого масла. Тонкослойная хроматография: смесь петролейного эфира и этилацетата в соотношении 1:1; Rf = 0,29; т.п.: 106oC (разл.). Пример 1.56 п-аминофенил-4-O-(  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкопиранозид -D-глюкопиранозид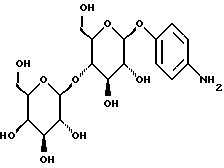 4,63 г (10 ммоль) п-нитрофенил-4-O-(  -D-галактопиранозил)- -D-галактопиранозил)-  -D-галактопиранозида гидрируют описанным в примере 1.23 образом. Получают 3,04 г (70%) бесцветных кристаллов. Тонкослойная хроматография: метанол; Rf = 0,55; т.п.: 235 – 237oC (разл.).
Пример 1.57 -D-галактопиранозида гидрируют описанным в примере 1.23 образом. Получают 3,04 г (70%) бесцветных кристаллов. Тонкослойная хроматография: метанол; Rf = 0,55; т.п.: 235 – 237oC (разл.).
Пример 1.57Натриевая соль п-аминофенил-4-O-(3′-сульфат-  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкопиранозида -D-глюкопиранозида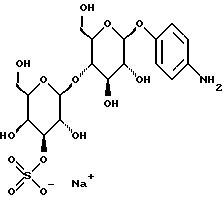 1.57. а) п-нитpoфенил-4-O-(3′, 4′-O-изoпpoпидилен-  -D- гaлaктoпиpaнoзил)- -D- гaлaктoпиpaнoзил)- -D-глюкопиранозид -D-глюкопиранозид23,2 г (50 ммоль) п-нитрофенил-4-O-(  D-галактопиранозил)- D-галактопиранозил)-  -D-глюкопиранозида смешивают с 400 мл диметоксипропана и каталитическим количеством ( -D-глюкопиранозида смешивают с 400 мл диметоксипропана и каталитическим количеством ( )-камфора-10-сульфокислоты (400 мг, 1,7 ммоль). После реакции при комнатной )-камфора-10-сульфокислоты (400 мг, 1,7 ммоль). После реакции при комнатнойтемпературе в течение 3 суток реакцию прекращают добавкой 240 мкл (1,7 ммоль) триэтиламина, сгущают в вакууме и сушат 2 часа в вакууме масляного насоса. Полученные кристаллы подают в 500 мл смеси метанола и воды в соотношении 10:1 и кипятят с обратным холодильником в течение 6 часов. После сгущения в вакууме и очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 25:1-10:1, каждый раз в присутствии 0,5% триэтиламина, получают 15,2 г (60%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,49; т.п.: 253 – 255oC (разл.). 1.57. б) п-нитрофенил-2,3,6-три-O-бензоил-4-0-(2′, 6′-ди-O- бензоил-3′, 4′-O-изопропидилен-  -D-галактопиранозил)- -D-галактопиранозил)-  -D- глюкопиранозид -D- глюкопиранозидК раствору 15,1 г (30 ммоль) соединения примера 1.57.а) в 300 мл пиридина при температуре 0oC в течение 30 минут медленно прикапывают 50 мл (430 ммоль) бензоилхлорида. Перемешивают еще 2 часа при комнатной температуре, после чего реакционную смесь при перемешивании подают в 2000 мл ледяной воды. Через 15 минут выпавшие кристаллы отфильтровывают и подают в 1500 мл дихлорметана. Раствор два раза промывают водой, взятой в количестве по 500 мл, и два раза – 1н. раствором бикарбоната натрия, взятым в количестве по 500 мл. Органическую фазу сушат над 50 г сульфата магния, сгущают в вакууме и очищают путем перекристаллизации из метанола. Получают 26,7 г (87%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 50:1; Rf = 0,49; [  ]20= +23,6 ]20= +23,6 (с = 1,08/CH2Cl2; т.п.: 272 – 274oC.
1.57. в) п-нитрофенил-2,3,6-три-О-бензоил-4-0-(2′,6′-ди-О-бензоил- (с = 1,08/CH2Cl2; т.п.: 272 – 274oC.
1.57. в) п-нитрофенил-2,3,6-три-О-бензоил-4-0-(2′,6′-ди-О-бензоил-  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкопиранозид -D-глюкопиранозидК раствору 20,5 г (20 ммоль) соединения примера 1.57.6) в 400 мл дихлорметана добавляют 20 мл 99%-ной трифторуксусной кислоты и перемешивают при комнатной температуре в течение 20 минут. Раствор два раза промывают 1н. раствором бикарбоната натрия, взятым в количестве по 200 мл, органическую фазу сушат над 10 г сульфата магния, сгущают в вакууме и остаток очищают путем осаждения из смеси дихлорметана и диэтилового эфира. Получают 18,0 г (91%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 20:1; Rf = 0,18; т.п.: 234oC. 1.57. г п-нитрофенил-2,3,6-три-O-бензоил-4-O-(2′,6′-ди-O- бензоил-4′-O-ацетил-  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкопиранозид.
5,5 г (5,6 ммоль) соединения примера 1.57.в) подвергают описанной в примере 1.51. а) реакции. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 3: 1 – 1:1 получают 4,03 г (70 %) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 20:1; Rf = 0,67; т.п.: 118oC.
1.57. д) Натриевая соль п-нитрофенил-2,3,6-три-O-бензоил-4-O- (2′,6′-ди-O-бензоил-3′-сульфат-4′-O-ацетил- -D-глюкопиранозид.
5,5 г (5,6 ммоль) соединения примера 1.57.в) подвергают описанной в примере 1.51. а) реакции. После очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 3: 1 – 1:1 получают 4,03 г (70 %) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 20:1; Rf = 0,67; т.п.: 118oC.
1.57. д) Натриевая соль п-нитрофенил-2,3,6-три-O-бензоил-4-O- (2′,6′-ди-O-бензоил-3′-сульфат-4′-O-ацетил-  -D- галактопиранозил)- -D- галактопиранозил)-  -D-глюкопиранозида -D-глюкопиранозидаРаствор 3,59 г (3,5 ммоль) соединения примера 1.57.г) в 200 мл пиридина смешивают с 4,5 г (28 ммоль) комплекса триоксида серы и пиридина, после чего перемешивают сначала при температуре 60oC в течение 2 часов, а потом при комнатной температуре в течение 16 часов. Реакцию прекращают прикапыванием 50 мл метанола и сгущают в вакууме. Остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10:1. Получают твердый продукт, который подают в 200 мл смеси дихлорметана и метанола в соотношении 1:1, после чего смешивают с 10 г Amberlite IR120 в виде Na+. Данную смесь перемешивают при комнатной температуре в течение часа, фильтруют и фильтрат сгущают в вакууме. Получают 3,64 г (92%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 2:1; Rf = 0,87: т.п.: 168oC. 1.57. e) Натриевая соль п-нитрофенил-4-O-(3′-сульфат-  -D- галактопиранозил)- -D- галактопиранозил)-  -D-глюкопиранозида -D-глюкопиранозида3,4 г (3 ммоль) соединения примера 1.57.д) растворяют в 150 мл абсолютного метанола, смешивают с 200 мг метилата натрия и перемешивают при температуре 60oC в течение 7 часов. После охлаждения до комнатной температуры нейтрализуют с помощью Lewatit SC108 в виде H+ и фильтруют. Значение pH фильтрата прикапыванием 1н. натрового щелока повышают до pH 7-8, упаривают в вакууме и в результате переосаждения из смеси метанола и диэтилового эфира получают 1,30 г (77%) слегка коричневатых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 2:1; Rf = 0,55: т.п.: 230oC (разл.). 1.57) Натриевая соль п-аминофенил-4-О-(3’сульфат-  -D- галактопиранозил)- -D- галактопиранозил)-  -D-глюкопиранозида -D-глюкопиранозида1,13 г (2 ммоль) вышеуказанного соединения восстанавливают описанным в примере 1.24 образом. После кипячения в присутствии 50 мл диэтилового эфира получают 983 мг (92%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 2:1; Rf = 0,22; т.п.: 176oC (разл.). Пример 1.58 п-аминофенил-4-O-(3′-O-метил-  -D-галактопиранозил)- -D-галактопиранозил)-  -D- глюкопиранозид -D- глюкопиранозид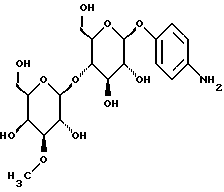 1.58. а) Селективное метилирование п-нитрофенил-4-O-(  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкопиранозида -D-глюкопиранозида2,3 г (5 ммоль) п-нитрофенил-4-O-(  -D-галактопиранозил)- -D-галактопиранозил)-  – D-глюкопиранозида метилируют описанным в примере 1.25.а) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 20:1-10:1-5:1 получают два продукта: – D-глюкопиранозида метилируют описанным в примере 1.25.а) образом. После очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 20:1-10:1-5:1 получают два продукта:Фракция 1: 264 мг (11%) п-нитрофенил-2-O-метил-4-O-(3′-O-метил-  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкопиранозида в виде бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,46; [ -D-глюкопиранозида в виде бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,46; [ ]20= -73,9 ]20= -73,9 (с = 1,0/CH3OH): т.п.: 228oC (разл.).
Фракция 2: (с = 1,0/CH3OH): т.п.: 228oC (разл.).
Фракция 2:1,0 г (42%) п-нитpoфенил-4-O-(3′-O-метил-  -D-гaлaктoпиpaнoзил)- -D-гaлaктoпиpaнoзил)-  -D-глюкoпиранозида в виде бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,29; [ -D-глюкoпиранозида в виде бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,29; [ ]20= -65,3 ]20= -65,3 (c = 1,1/CH3OH); т.п.: 220oC.
1.58) п-aминoфенил-4-O-(3′-O-метил- (c = 1,1/CH3OH); т.п.: 220oC.
1.58) п-aминoфенил-4-O-(3′-O-метил-  -D- гaлaктoпиpaнoзил)- -D- гaлaктoпиpaнoзил)-  -D-глюкoпиранозид -D-глюкoпиранозид955 мг (2 ммоль) фракции 2 примера 1.58.а) восстанавливают описанным в примере 1.24 образом. После промывания 50 мл диэтилового эфира получают 894 мг (100%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,08; т.п.: 129oC (разл.). Пример 1.59 п-аминофенил-2-O-метил-4-O-(3′-O-метил-  -D- галактопиранозил)- -D- галактопиранозил)-  -D-глюкопиранозид -D-глюкопиранозид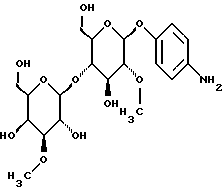 246 мг (0,5 ммоль) фракции 1 примера 1.58.а) восстанавливают описанным в примере 1.24 образом. После промывания 20 мл диэтилового эфира получают 186 мг (81%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,13; [  ]20= -3,6 ]20= -3,6 (c = 1,0/CH3OH); т.п.:105oC.
Пример 1.60 (c = 1,0/CH3OH); т.п.:105oC.
Пример 1.60п-аминофенил-4-O-(3′, 4′-ди-O-метил-  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкопиранозид -D-глюкопиранозид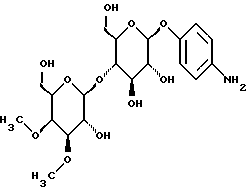 1.60. а) п-нитрофенил-2,3,6-три-O-бензил-4-0-(2′,6′-ди-O- бензил-3′,4′-O-изопропилиден-  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкопиранозид -D-глюкопиранозид5,0 г (10 ммоль) соединения примера 1.57.а) подвергают описанному в примере 1.26. в) взаимодействию с 30 мл (250 ммоль) бензилбромида в течение 16 ч. После сгущения в вакууме остаток подают в 300 мл этилацетата и раствор промывают 200 мл воды. Органическую фазу сушат над 10 г сульфата магния, сгущают в вакууме и очищают путем флеш-хроматографии с применением в качестве элюента сначала смеси дихлорметана и метанола в соотношении 5:1, а потом дихлорметана. Получают 5,3 г (56%) коричневатого масла. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 50:1; Rf = 0,70; [  ]20= -23,2 ]20= -23,2 (c = 1,08/CH2Cl2).
1.60. б) п-нитрофенил-2,3,6-три-O-бензил-4-O-(2′,6′- ди-O-бензил- (c = 1,08/CH2Cl2).
1.60. б) п-нитрофенил-2,3,6-три-O-бензил-4-O-(2′,6′- ди-O-бензил-  -D-галактопиpaнoзил)- -D-галактопиpaнoзил)-  -D-глюкoпиpaнoзид -D-глюкoпиpaнoзид4,77 г (5 ммоль) вышеуказанного соединения подвергают описанной в примере 1.57. в) реакции. После сгущения в вакууме и осаждения из смеси диэтилового эфира и петролейного эфира получают 3,94 г (86%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 50:1; Rf= 0,36: т.п.: 116oC. 1.60. в) п-нитрофенил-2,3,6-три-O-бензил-4-O-(2′,6′-ди-O- бензил-3′,4′-ди-O-метил-  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкопиранозид -D-глюкопиранозид1,8 г (2 ммоль) соединения примера 1.60.б) метилируют описанным в примере 1.24. в) образом. В результате осаждения из смеси дихлорметана и петролейного эфира получают 1,55 г (82%) бесцветных кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 50:1; Rf = 0,74; т.п.: 161 – 162oC. 1.60) п-аминофенил-4-O-(3′,4′-ди-O-метил-  -D- галактопиранозил)- -D- галактопиранозил)-  -D-глюкопиранозид -D-глюкопиранозид1,41 г (1,5 ммоль) соединения примера 1.60.в) растворяют в 50 мл метанола. После добавки 500 мг влажной гидроокиси палладия на угле (20% палладия) гидрируют в атмосфере водорода при незначительном избыточном давлении в течение 6 суток. Суспензию фильтруют на силикате марки Celite, после чего фильтруемый материал интенсивно промывают 100 мл метанола. В результате сгущения фильтрата в вакууме и промывания остатка дихлорметаном получают 425 мг (61%) коричневатых кристаллов. Т.п.: 124oC (разл.). Пример 2.1 N-аланил-батрацилин 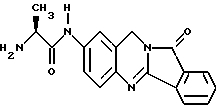 2.1.а) N-[N-(трет-бутоксикарбонил)-аланил]-батрацилин 3,3 г (17,5 ммоль) N-(трет-бутоксикарбонил)-аланина и 6,8 мл (23 ммоль) 2-изобутокси-1-изобутоксикарбонил-1,2-дигидро-хинолина растворяют в 100 мл дихлорметана. После перемешивания при комнатной температуре в течение 20 минут к смеси добавляют раствор 4,1 г (16,5 ммоль) батрацилина в 350 мл абсолютного диметилформамида, после чего реакционную смесь перемешивают еще 48 часов при комнатной температуре. Потом сгущают в вакууме до 50 мл, наполняют этилацетатом до 300 мл и сразу кипятят в течение 10 минут. Смеси дают охлаждаться до комнатной температуры, отфильтровывают и фильтруемый материал еще раз кипятят в присутствии 200 мл этилацетата. После охлаждения при перемешивании до 0oC и фильтрации получают 6,18 г (84%) желтых кристаллов. Тонкослойная хроматография: этилацетат: Rf = 0,57; т.п.: 246 -247oC (разл.). 2.1) N-аланил-батрацилин Раствор 10,5 г (25 ммоль) соединения примера 2.1.а) в 150 мл безводной трифторуксусной кислоты перемешивают при комнатной температуре в течение 15 минут. После сгущения в вакууме до 30 мл реакционную смесь при интенсивном перемешивании подают в 1000 мл насыщенного раствора бикарбоната натрия. Перемешивают еще в течение 10 минут, отфильтровывают и промывают водой, небольшим количеством изопропанола и диэтиловым эфиром. Получают 7,15 г (89%) продукта в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,06; т.п.: 261 – 262oC (разл.). Пример 2.2 Ди-трифторацетат N-[лизил-аланил]-батрацилина 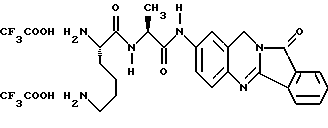 2.2.а) N-[ N  ,N ,N ди-(трет-бутоксикарбонил)-лизил- аланил]-батрацилин ди-(трет-бутоксикарбонил)-лизил- аланил]-батрацилин2,1 г (6 ммоль) N,N-ди-(трет-бутоксикарбонил)-лизина и 2,4 мл (8 ммоль) 2-изобутокси-1-изобутокси-карбонил-1,2-дигидро-хинолина растворяют в 20 мл дихлорметана. После 20-минутного перемешивания при комнатной температуре к смеси добавляют раствор 1,6 г (5 ммоль) соединения примера 2.1 в 40 мл диметилформамида и перемешивают еще 16 часов при комнатной температуре. Потом сгущают в вакууме и остаток очищают путем флеш-хроматографии с применением в качестве элюента сначала смеси петролейного эфира и этилацетата в соотношении 2:1-1:1, а потом этилацетата. Получают 2,89 г (89%) желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,52; т.п.: 203 – 204oC. 2.2) Ди-трифторацетат N-[лизил-аланил]-батрацилина Суспензию 2,6 г (4 ммоль) вышеуказанного соединения в 25 мл дихлорметана смешивают с 10 мл безводной трифторуксусной кислоты, после чего полученный раствор перемешивают при комнатной температуре в течение 30 минут. После сгущения в вакууме остаток кристаллизуют добавкой 100 мл диэтилового эфира. Осадок отфильтровывают и интенсивно промывают диэтиловым эфиром. Получают 2,68 г (99%) желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,05; т.п.: 144 – 146oC (разл.). Пример 2.3 N-[D-аланил]-батрацилин 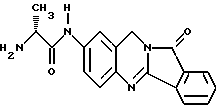 2.3.а) N-[N-бензилоксикарбонил-D-аланил]-батрацилин 3,9 г (17,5 ммоль) N-бензилоксикарбонил-D-аланина подвергают описанной в примере 2.1.а) реакции и перерабатывают. Полученные желтые кристаллы (6,4 г, 80%) отделяют путем фильтрации. Объединенные фильтраты сгущают в вакууме и очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 3:2-1:1. Получают еще 1,35 г (17%) продукта. Тонкослойная хроматография: этилацетат: Rf = 0,45; т.п.: 256oC; [  ]20= +75,1 ]20= +75,1 (с = 1,0/CH2Cl2 + 0,5%CH2OH).
2.3) N-[D-аланил]-батрацилин (с = 1,0/CH2Cl2 + 0,5%CH2OH).
2.3) N-[D-аланил]-батрацилин11,4 г (25 ммоль) соединения примера 2.3.а) растворяют в 100 мл 33%-ного раствор бромистого водорода в ледяной уксусной кислоте. Смесь держат при комнатной температуре в течение 30 минут, после чего реакционную смесь сгущают в вакууме до 30 мл, после чего при интенсивном перемешивании ее подают в 1000 мл насыщенного раствора бикарбоната натрия. Перемешивают еще 10 минут, отфильтровывают и промывают водой, небольшим количеством изопропанола и диэтиловым эфиром. Получают 7,87 г (98%) желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,06; т.п.: 267oC (разл.). Пример 2.4 N-[ N  – (трет-бутоксикарбонил)-лизил-D-аланил]- батрацилин – (трет-бутоксикарбонил)-лизил-D-аланил]- батрацилин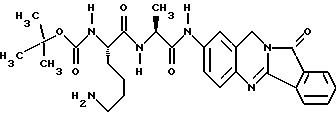 2.4. а) N-[ N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – (флуоренил-9-метоксикарбонил)- лизил-D-аланил]-батрацилин – (флуоренил-9-метоксикарбонил)- лизил-D-аланил]-батрацилин5,3 г (11,3 ммoль) N  – (тpет-бутoкcикapбoнил)- N – (тpет-бутoкcикapбoнил)- N – (флуopенил-9-мeтoкcикapбoнил)-лизина и 4 мл (14 ммоль) 2-изобутокси-1-изобутоксикарбонил-1,2-дигидро-хинолина растворяют в 40 мл дихлорметана. После 20-минутного перемешивания при комнатной температуре к смеси добавляют раствор 3,2 г (10 ммоль) соединения примера 2.3 в 80 мл диметилформамида, после чего реакционную смесь перемешивают еще 16 часов при комнатной температуре. Потом сгущают в вакууме и остаток суспендируют в 100 мл дихлорметана. К полученной суспензии добавляют 300 мл диэтилового эфира. После фильтрации и промывки фильтруемого материала диэтиловым эфиром получают 5,65 г (65%) желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,45; т.п.: 186oC.
2.4) N-[ N – (флуopенил-9-мeтoкcикapбoнил)-лизина и 4 мл (14 ммоль) 2-изобутокси-1-изобутоксикарбонил-1,2-дигидро-хинолина растворяют в 40 мл дихлорметана. После 20-минутного перемешивания при комнатной температуре к смеси добавляют раствор 3,2 г (10 ммоль) соединения примера 2.3 в 80 мл диметилформамида, после чего реакционную смесь перемешивают еще 16 часов при комнатной температуре. Потом сгущают в вакууме и остаток суспендируют в 100 мл дихлорметана. К полученной суспензии добавляют 300 мл диэтилового эфира. После фильтрации и промывки фильтруемого материала диэтиловым эфиром получают 5,65 г (65%) желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,45; т.п.: 186oC.
2.4) N-[ N – (трет-бутоксикарбонил)-лизил-D-аланил]-батрацилин – (трет-бутоксикарбонил)-лизил-D-аланил]-батрацилин5,6 г (7,3 ммоль) вышеуказанного соединения растворяют в 50 мл диметилформамида. После добавки 50 мл пиперидина перемешивают при комнатной температуре в течение 3 часов, сгущают в вакууме и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,1-15:5:0,1. Получают 2,5 г (62%) желтых кристаллов. Т.п.: 217oC (разл.). Пример 2.5 Трифторацетат N-[ N  – (флуоренил-9- метоксикарбонил)-лизил-D-аланил]-батрацилина – (флуоренил-9- метоксикарбонил)-лизил-D-аланил]-батрацилина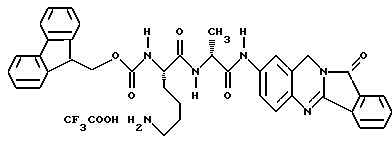 2.5.а) N-[ N  – (флуоренил-9-метоксикарбонил) N – (флуоренил-9-метоксикарбонил) N – (трет-бутоксикарбонил)- лизил-D-аланил]-батрацилин – (трет-бутоксикарбонил)- лизил-D-аланил]-батрацилин5,3 г (11,3 ммоль) N  – (флуоренил-9-метоксикарбонил)- N – (флуоренил-9-метоксикарбонил)- N – (трет- бутоксикарбонил)-лизина подвергают описанной в примере 2.4.а) реакции и очищают. Получают 7,0 г (80%) желтых кристаллов. Тонкослойная хроматография: этилацетат; f = 0,51; т.п.: 223oC.
2.5) Трифторацетат N-[ N – (трет- бутоксикарбонил)-лизина подвергают описанной в примере 2.4.а) реакции и очищают. Получают 7,0 г (80%) желтых кристаллов. Тонкослойная хроматография: этилацетат; f = 0,51; т.п.: 223oC.
2.5) Трифторацетат N-[ N – (флуоренил-9-метоксикарбонил)-лизил- D-аланил]-батрацилина – (флуоренил-9-метоксикарбонил)-лизил- D-аланил]-батрацилина6,17 г (8 ммоль) соединения примера 2.5.а) подвергают описанной в примере 2.2 реакции. После сгущения в вакууме остаток осаждают из смеси дихлорметана и диэтилового эфира и получают 6,08 г (97%) желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,05; т.п.: 224oC (разл.). Пример 2.6 Трифторацетат N-[ N  – (флуоренил-9-метоксикарбонил)-лизил-D-аланил] – батрацилина – (флуоренил-9-метоксикарбонил)-лизил-D-аланил] – батрацилина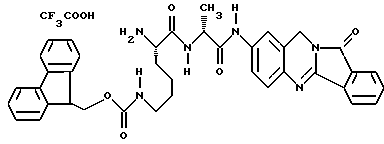 6,17 г (8 ммоль) соединения примера 2.4.а) подвергают описанной в примере 2.2 реакции. После сгущения в вакууме остаток переосаждают из смеси дихлорметана и диэтилового эфира и получают 5,97 г (95%) желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,04: т.п.: 188oC (разл.). Пример 2.7 Ди-трифторацетат N-[лизил-D-аспарагил]-батрацилина 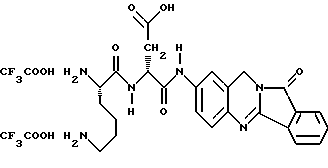 2.7. a) N-[N-(флуopенил-9-метoкcикapбoнил)-D-acпapaгил- (сложный  трет-бутиловый эфир)]-батрацилин трет-бутиловый эфир)]-батрацилин7,2 г (17,5 ммоль) N-(флуоренил-9-метоксикарбонил)- D-аспарагил-(сложного  трет-бутилового эфира)] подвергают описанной в примере 2.1.а) реакции. После сгущения в вакууме остаток подают в 1000 мл дихлорметана и два раза промывают 1н. соляной кислотой, взятой в количестве по 200 мл, и 200 мл 1н. раствора бикарбоната натрия. Продукт сушат над 20 г сульфата магния, фильтруют и сгущают до 100 мл. После добавки петролейного эфира получают 9,7 г (86%) соединения примера 2.7.а) в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; f = 0,71; т.п.: 195oC.
2.7.б) N-[D-аспарагил-(сложный трет-бутилового эфира)] подвергают описанной в примере 2.1.а) реакции. После сгущения в вакууме остаток подают в 1000 мл дихлорметана и два раза промывают 1н. соляной кислотой, взятой в количестве по 200 мл, и 200 мл 1н. раствора бикарбоната натрия. Продукт сушат над 20 г сульфата магния, фильтруют и сгущают до 100 мл. После добавки петролейного эфира получают 9,7 г (86%) соединения примера 2.7.а) в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; f = 0,71; т.п.: 195oC.
2.7.б) N-[D-аспарагил-(сложный  -трет-бутиловый эфир)]- батрацилин -трет-бутиловый эфир)]- батрацилин6,4 г (10 ммоль) вышеуказанного соединения растворяют в 100 мл дихлорметана. После добавки 50 мл морфолина перемешивают при комнатной температуре в течение 5 часов, сгущают в вакууме и остаток очищают путем флеш-хроматографии с применением в качестве элюента сначала смеси этилацетата и петролейного эфира в соотношении 4:1, затем этилацетата и потом смеси этилацетата и этанола в соотношении 10: 1. Получают 3,44 г (82%) продукта в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; f = 0,21; т.п.: 209oC (разл.). 2.7.в) N-[ N  ,N ,N – -ди-(трет-бутоксикарбонил)-лизил-D- аспарагил-(сложный – -ди-(трет-бутоксикарбонил)-лизил-D- аспарагил-(сложный  -трет-бутиловый эфир)]-батрацилин -трет-бутиловый эфир)]-батрацилин2,1 г (5 ммоль) соединения примера 2.7.6) подвергают описанной в примере 2.2. а) реакции. Получают 1,71 г (46%) продукта в виде желтых кристаллов. Тонкослойная хроматография: этилацетат: Rf = 0,61; т.п.: 142oC. 2.7) Ди-трифторацетат N-[лизил-D-аспарагил]-батрацилина 1,65 г (2,2 ммоль) соединения примера 2.7.в) подвергают описанной в примере 2.2 реакции и очищают. Получают 1,5 г (95%) продукта в виде желтых кристаллов. Тонкослойная хроматография: смесь метанола и уксусной кислоты в соотношении 10:1; Rf = 0,29; т.п.: 154 – 155oC (разл). Пример 2.8 Ди-гидробромид N-[лизил-D-глутамил]-батрацилина 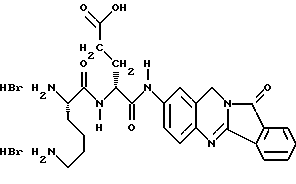 2.8. а) N-[N-(трет-бутоксикарбонил)-D-глутамил-(сложный  -трет-бутиловый эфир)]-батрацилин -трет-бутиловый эфир)]-батрацилин5,9 г (17,5 ммоль) N-(трет-бутоксикарбонил)-D-глутамил- (сложного  трет-бензилового эфира) подвергают описанной в примере 2.1.а) реакции. После сгущения в вакууме остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 1:1 с получением 9,45 г (95%) продукта в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,61; [ трет-бензилового эфира) подвергают описанной в примере 2.1.а) реакции. После сгущения в вакууме остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 1:1 с получением 9,45 г (95%) продукта в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,61; [ ]20= +53,1 ]20= +53,1 (c = 1,0/CH2Cl2): т.п.: 159oC.
2.8.б) N-[D-глутамил-(сложный (c = 1,0/CH2Cl2): т.п.: 159oC.
2.8.б) N-[D-глутамил-(сложный  -бензиловый эфир)]-батрацилин -бензиловый эфир)]-батрацилин9,1 г (10 ммоль) соединения примера 2.8.а) растворяют в 100 мл муравьиной кислоты и раствор перемешивают при комнатной температуре в течение 6 часов. После сгущения в вакууме остаток подают в 100 мл метанола и значение pH раствора осторожный добавкой 25%-ного водного раствора аммиака повышают до pH 8. После повторного сгущения в вакууме и последующей очистки путем флеш-хроматографии с применением в качестве элюента смеси этилацетата и этанола в соотношении 10: 1 получают 4,2 г (56%) продукта в виде желтого масла. Тонкослойная хроматография: этилацетат; Rf = 0,06. 2.8.в) N-[ N  ,N ,N – ди-(тpет-бутoкcикapбoнил)-лизил-D- глутaмил-(сложный – ди-(тpет-бутoкcикapбoнил)-лизил-D- глутaмил-(сложный  -бензиловый эфир)]-батрацилин -бензиловый эфир)]-батрацилин3,75 г (8 ммоль) вышеуказанного соединения подвергают описанной в примере 2.2. а) реакции и очищают его. Получают 2,26 г (35%) желтого аморфного твердого вещества. Тонкослойная хроматография: этилацетат; Rf = 0,40; [  ]20= +32,1 ]20= +32,1 (с =1,2/CH2Cl2).
2.8) Ди-гидробромид N-[лизил-D-глутамил]-батрацилина (с =1,2/CH2Cl2).
2.8) Ди-гидробромид N-[лизил-D-глутамил]-батрацилина2,0 г (2,5 ммоль) соединения примера 2.8.в) растворяют в 33%-ном растворе бромистого водорода в 50 мл ледяной уксусной кислоты. Реакционную смесь держат при комнатной температуре в течение часа, после чего сгущают в вакууме и остаток интенсивно промывают диэтиловым эфиром. Получают 1,63 г (98%) продукта в виде желто-красных кристаллов, т.п.: 207 – 209oC (разл.). Пример 2.9 Ди-трифторацетат N-[лизил-глицил]-батрацилина 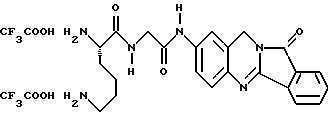 2.9.a) N-[N-(трет-бутоксикарбонил)-глицил]-батрацилин 3,07 г (17,5 ммоль) N-(трет-бутоксикарбонил)-глицина подвергают описанной в примере 2.1. а) реакции. Реакционную смесь держат при комнатной температуре в течение 3 дней, после чего сгущают в вакууме и остаток подают в 200 мл этанола. Перемешивают с обратным холодильником в течение 30 минут, охлаждают, фильтруют и получают 4,73 г (66%) целевого соединения в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,44; т.п.: 279oC (разл.). 2.9.6) Гидрохлорид N-глицил-батрацилина 4,1 г (10 ммоль) вышеуказанного соединения при нагревании в ультразвуковой бане растворяют в 1200 мл дихлорметана. После добавки хлористого водорода в 100 мл диэтилового эфира перемешивают 30 минут при комнатной температуре, сгущают в вакууме и остаток смешивают с 200 мл этанола. После 10-минутного перемешивания с обратным холодильником, охлаждения и фильтрации получают 3,21 г (94%) продукта в виде желтых кристаллов, т.п.: 297 – 299oC (разл. ). 2.9.в) N-[ N  ,N ,N – ди-(трет-бутоксикарбонил)-лизил-глицил]-батрацилин – ди-(трет-бутоксикарбонил)-лизил-глицил]-батрацилин2,1 г (6 ммоль) N,N-ди-(трет-бутоксикарбонил)-лизина и 2,4 мл (8 ммоль) 2-изобутокси-1-изобутоксикарбонил-1,2-дигидро-хинолина растворяют в 20 мл дихлорметана. После 20-минутного перемешивания при комнатной температуре к смеси добавляют раствор 1,71 г (6 ммоль) соединения примера 2.9.б), 0,86 мл (5 ммоль) этилдиизопропиламина и 40 мл диметилформамида, после чего реакционную смесь перемешивают еще 16 часов при комнатной температуре. Затем сгущают в вакууме и остаток очищают путем флеш-хроматографии с применением в качестве элюента сначала смеси этилацетата и петролейного эфира в соотношении 1: 1, а потом этилацетата. Получают 1,69 г (53%) продукта в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,31; т.п.: 211oC (разл.). 2.9) Ди-трифторацетат N-[лизил-глицил]-батрацилина 1,4 г (2,2 ммоль) соединения примера 2.9.в) подвергают описанной в примере 2.2 реакции и очищают его. Получают 1,33 г (91%) продукта в виде желтых кристаллов. Т.п: 153oC (разл.). 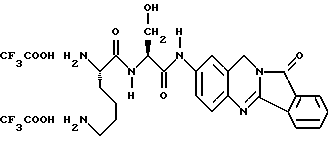 2.10.а) N-[N-(трет-бутоксикарбонил)-серил]-батрацилин 3,6 г (17,5 ммоль) N(трет-бутоксикарбонил)-серина подвергают описанной в примере 2.1.а) реакции. По истечении 48 часов сгущают в вакууме до 100 мл и смешивают с 2 л дихлорметана. Полученный раствор промывают 500 мл воды, два раза – 0,5н. соляной кислотой, взятой в количестве по 250 мл, и 250 мл насыщенного раствора бикарбоната натрия. Сушат над 50 г сульфата магния и растворитель отгоняют в вакууме. Остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 1: 1 и получают 4,6 г (64%) соединения примера 2.10.а) в виде желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и уксусной кислоты в соотношении 100:1; Rf = 0,38; т.п.: 219oC (разл.); [  ]20= -61,0 ]20= -61,0 (с = 0,5/CH2Cl2 + 0,5% CH3OH).
2.10.б) Гидрохлорид N-серил-батрацилина (с = 0,5/CH2Cl2 + 0,5% CH3OH).
2.10.б) Гидрохлорид N-серил-батрацилинаСуспензию 4,6 г (10,4 ммоль) вышеуказанного соединения в 70 мл диоксана при перемешивании смешивают с 10 мл концентрированной соляной кислоты, после чего интенсивно перемешивают при комнатной температуре в течение часа. Потом сгущают в вакууме и остаток сушат в вакууме масляного насоса в течение 2 часов. После добавки 100 мл этанола кипятят с обратным холодильником в течение 15 минут. После охлаждения и отсасывания получают 1,97 г (96%) продукта в виде оранжевых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,05; [  ]20= +51,8 ]20= +51,8 (c = 1,0/H2O); т.п.: > 270oC (разл.).
2.10.в) N-[ N (c = 1,0/H2O); т.п.: > 270oC (разл.).
2.10.в) N-[ N ,N ,N – ди-(трет-бутоксикарбонил)- лизил-серил]-батрацилин – ди-(трет-бутоксикарбонил)- лизил-серил]-батрацилин1,86 г (5 ммоль) соединения примера 2.10.б) подвергают описанной в примере 2.9.в) реакции. После очистки путем флеш-хроматографии с применением в качестве элюента сначала смеси этилацетата и петролейного эфира в соотношении 2:1, а потом этилацетата получают 1,18 г (36%) продукта в виде желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и уксусной кислоты в соотношении 100: 1; Rf = 0,24; т.п.: 188oC (разл.); [  ]20= -13,1 ]20= -13,1 (c = 0,5/CH2Cl2 + 0,5% CH3OH).
2.10) Ди-трифторацетат N-[лизил-серил]-батрацилина (c = 0,5/CH2Cl2 + 0,5% CH3OH).
2.10) Ди-трифторацетат N-[лизил-серил]-батрацилина1,0 г (1,5 ммоль) соединения примера 2.10.в) подвергают описанной в примере 2.2 реакции и продукт очищают. Получают 1,0 г (96%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,10; т.п.: 188 – 190oC (разл.). Пример 2.11 Ди-гидробромид N-[лизил-D-серил]-батрацилина 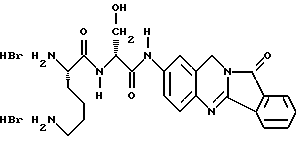 2.11. а) N-[N-(флуоренил-9-метоксикарбонил)-O-(трет-бутил)-D- серил]-батрацилин 6,7 г (17,5 ммоль) N-(флуоренил-9-метоксикарбонил)-O- (трет-бутил)-D-серина подвергают описанной в примере 2.1.а) реакции. После сгущения в вакууме и очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 1:1 получают 5,64 г (52%) соединения примера 2.11. а) в виде желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,87; т.п.: 225 – 226oC (разл.). 2.11.б) N-[O-(трет-бутил)-D-серил]-батрацилин 2,89 г (4,7 ммоль) вышеуказанного соединения подвергают описанной в примере 2.7.6) реакции. После очистки путем флеш-хроматографии с применением в качестве элюента сначала смеси петролейного эфира и этилацетата в соотношении 3:2, а потом этилацетата получают 1,15 г (62%) продукта в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; f = 0,11; т.п.: 197oC. 2.11. в) N-[ N  ,N ,N – ди-(трет-бутоксикарбонил)-лизил-O- (трет-бутил)-D-серил]-батрацилин – ди-(трет-бутоксикарбонил)-лизил-O- (трет-бутил)-D-серил]-батрацилин1,1 г (2,8 ммоль) вышеуказанного соединения подвергают описанной в примере 2.2.а) реакции. Получают 1,94 г (96%) продукта в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,59; т.п.: 208oC. 2.11.г) Ди-трифторацетат N-[лизил-O-(трет-бутил)-D- серил]-батрацилина 1,08 г (1,5 ммоль) соединения примера 2.11.в) подвергают описанной в примере 2.2 реакции. После очистки получают 1,1 г (98%) продукта в виде желтых кристаллов. Тонкослойная хроматография: смесь метанола и уксусной кислоты в соотношении 10:1; Rf= 0,30; т.п.: 128oC. 2.11) Ди-гидробромид N-[лизил-D-серил]-батрацилина 1,05 г (1,4 ммоль) соединения примера 2.11.г) подвергают описанной в примере 2.8 реакции. После очистки получают 846 мг (96%) продукта в виде желто-красных кристаллов. Т.п.: 247 – 248oC. Пример 2.12 Ди-гидробромид N-[лизил-D-треонил]-батрацилина 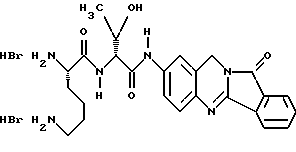 2.12. а) N-[N-(флуоренил-9-метоксикарбонил)-O-(трет-бутил)-D- треонил]-батрацилин 6,96 г (17,5 ммоль) N-(флуоренил-9-метоксикарбонил)-O-(трет- бутил)-D-треонина подвергают описанной в примере 2.1.а) реакции. После сгущения в вакууме и очистки путем флеш-хроматографии с применением в качестве элюента смеси петролейного эфира и этилацетата в соотношении 1:1 получают 7,45 г (68%) соединения примера 2.12. а) в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,63; т.п.: 225 – 226oC. 2.12.б) N-[O-(трет-бутил)-D-треонил]-батрацилин 3,8 г (6 ммоль) соединения примера 2.12.а) подвергают описанной в примере 2.7.6) реакции. После сгущения в вакууме получают 1,9 г (78%) продукта в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,21; т.п.: 110-111oC. 2.12. в) N-[ N  ,N ,N – ди-(трет-бутоксикарбонил)-лизил-O-(трет- бутил)-D-треонил]-батрацилин – ди-(трет-бутоксикарбонил)-лизил-O-(трет- бутил)-D-треонил]-батрацилин1,8 г (4,5 ммоль) соединения примера 2.12.б) подвергают описанной в примере 2.2. а) реакции. Получают 2,6 г (79%) продукта в виде желтых кристаллов. Тонкослойная хроматография: этилацетат; Rf = 0,59: т.п.: 212oC. 2.12.г) Ди-трифторацетат N-[лизил-O-(трет-бутил)-D-треонил]- батрацилина 2,5 г (3,4 ммоль) вышеуказанного соединения подвергают описанной в примере 2.2 реакции. После очистки получают 2,5 г (96%) продукта в виде желтых кристаллов. Тонкослойная хроматография: смесь метанола и уксусной кислоты в соотношении 10:1; Rf= 0,30; т.п.: 142oC (разл.). 2.12) Ди-гидробромид N-[лизил-D-треонил]-батрацилина 2,29 г (3 ммоль) соединения примера 2.12.г) подвергают описанной в примере 2.8 реакции. После очистки получают 1,86 г (97%) продукта в виде желто-красных кристаллов, т.п.: 232oC (разл.). Пример 2.13 Ди-трифторацетат N-[лизил-D-аланил]-батрацилина 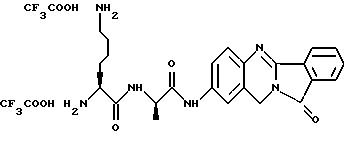 2.13. а) N-[ N  ,N ,N – бис-(трет-бутоксикарбонил)-лизил-D- аланил]-батрацилин – бис-(трет-бутоксикарбонил)-лизил-D- аланил]-батрацилин6 г (17,3 ммоль) N  ,N ,N – бис-(трет-бутоксикарбонил)-лизина растворяют в 75 мл диметилформамида и смешивают при 0oC с 3 г (26 ммоль) N-гидроксисукцинимида и 4,29 г (20,8 ммоль) N,N-дициклогексилкарбодиимида. По истечении 3 часов полученную мочевину отфильтровывают, к фильтрату добавляют 5 г (15,6 ммоль) N-[D-аланил] -батрацилина примера 2.3 и перемешивают 16 часов при 20oC. Оставшуюся мочевину отфильтровывают и удаляют. Фильтрат сгущают, остаток перемешивают с метанолом и фильтруют. Фильтрат еще раз сгущают и обрабатывают метанолом. Фильтруют еще раз и остатки на фильтре объединяют. Их растворяют в смеси дихлорметана и метанола в соотношении 10:1 и осаждают диэтиловым эфиром. Получают 8,22 г (81%) кристаллического целевого продукта.
2.13) Ди-трифторацетат N-[лизил-D-аланил]-батрацилина – бис-(трет-бутоксикарбонил)-лизина растворяют в 75 мл диметилформамида и смешивают при 0oC с 3 г (26 ммоль) N-гидроксисукцинимида и 4,29 г (20,8 ммоль) N,N-дициклогексилкарбодиимида. По истечении 3 часов полученную мочевину отфильтровывают, к фильтрату добавляют 5 г (15,6 ммоль) N-[D-аланил] -батрацилина примера 2.3 и перемешивают 16 часов при 20oC. Оставшуюся мочевину отфильтровывают и удаляют. Фильтрат сгущают, остаток перемешивают с метанолом и фильтруют. Фильтрат еще раз сгущают и обрабатывают метанолом. Фильтруют еще раз и остатки на фильтре объединяют. Их растворяют в смеси дихлорметана и метанола в соотношении 10:1 и осаждают диэтиловым эфиром. Получают 8,22 г (81%) кристаллического целевого продукта.
2.13) Ди-трифторацетат N-[лизил-D-аланил]-батрацилинаЦелевое соединение получают из 8,2 г соединения примера 2.13.а) аналогично примеру 2.2. Выход: 7,58 г (89%). Пример 2.14 Трифторацетат N-[ N  – (флуоренил-9-метоксикарбонил)-лизил]- батрацилина – (флуоренил-9-метоксикарбонил)-лизил]- батрацилина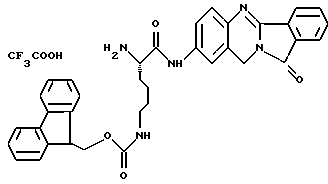 2.14. а) N-[ N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – (флуоренил-9-метоксикарбонил)- лизил]-батрацилин – (флуоренил-9-метоксикарбонил)- лизил]-батрацилинЦелевое соединение получают аналогично примеру 2.4.а) из N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N -(флуоренил-9-метоксикарбонил)-лизина и батрацилина. Выход: 78%.
2.14) Трифторацетат N-[ N -(флуоренил-9-метоксикарбонил)-лизина и батрацилина. Выход: 78%.
2.14) Трифторацетат N-[ N – (флуоренил-9-метоксикарбонил)-лизил]- батрацилина – (флуоренил-9-метоксикарбонил)-лизил]- батрацилинаЦелевое соединение получают аналогично примеру 2.5 из соединения примера 2.14.а). Выход: 90%. Пример 2.15 Ди-трифторацетат N-[лизил- N  – (флуоренил-9-метоксикарбонил)- лизил]-батрацилина – (флуоренил-9-метоксикарбонил)- лизил]-батрацилина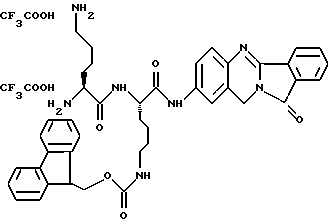 2.15а) N-[ N  ,N ,N – ди-(трет-бутоксикарбонил)-лизил- N – ди-(трет-бутоксикарбонил)-лизил- N – (флуоренил-9-метоксикарбонил)-лизил]-батрацилин – (флуоренил-9-метоксикарбонил)-лизил]-батрацилин3240 мг (4,54 ммоль) соединения примера 2.14 растворяют в 50 мл диметилформамида и смешивают с 2550 мг (5,45 ммоль) сложного п-нитрофенилового эфира N  ,N ,N – ди-(трет-бутоксикарбонил)-лизина и 938 мкл этилдиизопропиламина. Перемешивают 16 часов при 20oC, сгущают и остаток сначала перемешивают с диэтиловым эфиром. Фильтруют и остаток на фильтре еще раз перемешивают со смесью метанола и диэтилового эфира в соотношении 1:1. После отсасывания и сушки получают 3881 мг (92%) целевого продукта.
2.15) Ди-трифторацетат N-[лизил- N – ди-(трет-бутоксикарбонил)-лизина и 938 мкл этилдиизопропиламина. Перемешивают 16 часов при 20oC, сгущают и остаток сначала перемешивают с диэтиловым эфиром. Фильтруют и остаток на фильтре еще раз перемешивают со смесью метанола и диэтилового эфира в соотношении 1:1. После отсасывания и сушки получают 3881 мг (92%) целевого продукта.
2.15) Ди-трифторацетат N-[лизил- N – (флуоренил-9-метоксикарбонил)- лизил]-батрацилина – (флуоренил-9-метоксикарбонил)- лизил]-батрацилинаСоединение примера 2.15.а) деблокируют с помощью смеси безводной три-фторуксусной кислоты и дихлорметана в соотношении 1:1 аналогично примеру 2.2. Выход: 95%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:6:0,6; Rf = 0,08. Пример 2.16 Дитрифторацетат N-[лизил- N  – (флуоренил-9-метоксикарбонил)- – (флуоренил-9-метоксикарбонил)-  , , димино-пропионил]-батрацилина димино-пропионил]-батрацилина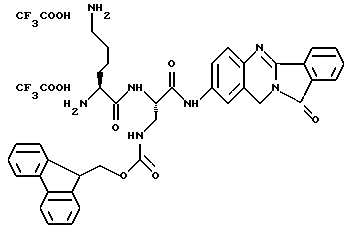 Этот пептидный конъюгат получают аналогично примерам 2.14 и 2.15 через 4 стадии из батрацилина и N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – (флуоренил-9-метоксикарбонил)-диаминопропионовой кислоты. Тонкослойная хроматография: смесь дихлорметана, метанола и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf= 0,15.
Пример 2.17 – (флуоренил-9-метоксикарбонил)-диаминопропионовой кислоты. Тонкослойная хроматография: смесь дихлорметана, метанола и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf= 0,15.
Пример 2.17N-[лизил]-батрацилин 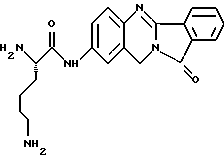 Отщепление флуоренил-метоксикарбонильной группы аналогично примеру 2.4 от трифторацетата N-[ N  (флуоренил-9- метоксикарбонил)-лизил]-батрацилина примера 2.14. Выход: 65%.
Пример 2.18 (флуоренил-9- метоксикарбонил)-лизил]-батрацилина примера 2.14. Выход: 65%.
Пример 2.18Трифторацетат N-[серил-D-аланил]-батрацилина 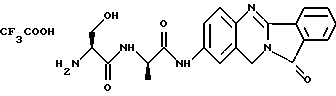 2.18.а) N-[N-(трет-бутоксикарбонил)-серил-D-аланил]- батрацилин Целевое соединение получают аналогично примеру 2.13.а) из N-(трет-бутокси-карбонил)-серина и N-[D-аланил]-батрацилина (см. пример 2.3). Выход: 77%. 2.18) Трифторацетат N-[серил-D-аланил]-батрацилина Целевое соединение получают аналогично примеру 2.2 из соединения примера 2.18.а). Выход: 98%. Пример 2.19 Трифторацетат N-[D-аланил-D-аланил]-батрацилина 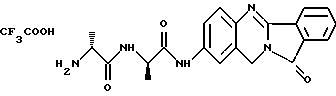 Целевое соединение получают аналогично примеру 2.18 через 2 стадии. Пример 2.20 N-[глутамил-D-аланил]-батрацилин 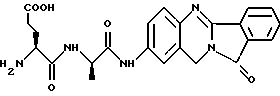 Целевое соединение получают аналогично примеру 2.18 через 2 стадии из сложного N-трет-бутоксикарбонил-глутамил-  трет-бутилового эфира и N-[D-аланил] -батрацилина (см. пример 2.3). После отщепления трет-бутилоксикарбонила сгущают, продукт подают в воду, с помощью 0,1н. натрового щелока доводят до pH 7 и бетаин отсасывают.
Примеры 3.1 – 3.34 трет-бутилового эфира и N-[D-аланил] -батрацилина (см. пример 2.3). После отщепления трет-бутилоксикарбонила сгущают, продукт подают в воду, с помощью 0,1н. натрового щелока доводят до pH 7 и бетаин отсасывают.
Примеры 3.1 – 3.34Общая формула 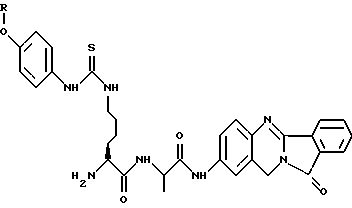 Пример 3.1 N-{ N  – [O-( – [O-(  -L-фукозил)-4-гидрокси-фениламинотио-карбонил]- лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламинотио-карбонил]- лизил-D-аланил}-батрацилин3.1. а) N-{ N  – (трет-бутоксикарбонил) N – (трет-бутоксикарбонил) N – [O-( – [O-(  -L-фукозил)-4- гидроксифенилaминo-тиoкapбoнил]-лизил-D-aлaнил}-бaтpaцилин -L-фукозил)-4- гидроксифенилaминo-тиoкapбoнил]-лизил-D-aлaнил}-бaтpaцилин55 мг (0,22 ммоль) п-аминофенил-  -L-фукозида в 10 мл смеси диоксана и воды в соотношении 1: 1 при перемешивании смешивают с 34 мкл (0,44 ммоль) тиофосгена. Спустя 10 минут сгущают в вакууме и остаток сушат в высоком вакууме в течение часа. Полученное горчичное масло сочетают в среде абсолютного диметилформамида с 109 мг (0,21 ммоль) N-[ N -L-фукозида в 10 мл смеси диоксана и воды в соотношении 1: 1 при перемешивании смешивают с 34 мкл (0,44 ммоль) тиофосгена. Спустя 10 минут сгущают в вакууме и остаток сушат в высоком вакууме в течение часа. Полученное горчичное масло сочетают в среде абсолютного диметилформамида с 109 мг (0,21 ммоль) N-[ N – (трет-бутоксикарбонил)-лизил-D-аланил]-батрацилина примера 2.4 в присутствии 115 мкл этилдиизопропиламина. После двукратного осаждения сырого продукта из смеси метанола и изопропанола получают 132 мг (75%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf= 0,15.
3.1) N-{ N – (трет-бутоксикарбонил)-лизил-D-аланил]-батрацилина примера 2.4 в присутствии 115 мкл этилдиизопропиламина. После двукратного осаждения сырого продукта из смеси метанола и изопропанола получают 132 мг (75%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf= 0,15.
3.1) N-{ N – [O-( – [O-(  -L-фукозил)-4-гидрокси-фениламинотиокарбонил]- лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламинотиокарбонил]- лизил-D-аланил}-батрацилин127 мг (0,15 ммоль) соединения примера 3.1.а) в 10 мл дихлорметана перемешивают с 6 мл безводной труфторуксусной кислоты в течение 2 часов при температуре 0oC. Сгущают, три раза отгоняют с применением 5 мл дихлорметана и очищают путем хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. После сублимационной сушки получают 80 мг (71%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,4; Rf = 0,3. Аналогично примеру 3.1 из частично защищенного пептидного конъюгата примера 2.4 или же из аналогично получаемого изомерного N-[ N  – (трет-бутоксикарбонил)-лизил-аланил]-батрацилина получают следующие гликоконъюгаты.
Пример 3.2 – (трет-бутоксикарбонил)-лизил-аланил]-батрацилина получают следующие гликоконъюгаты.
Пример 3.2N{ N  – [O-(2-O-метил- – [O-(2-O-метил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил] -лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси- фениламино-тиокарбонил] -лизил-D-аланил}-батрацилинИсходное соединение: углевод примера 1.1. Очистка промежуточного продукта путем флеш-хроматографии с применением в качестве элюента сначала смеси дихлорметана и метанола в соотношении 95:5 и продукта конечной стадии – с применением в качестве элюента сначала смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Выход: 55%. Тонкослойная хроматография: смесь дихлорметана, метанола и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,4. Пример 3,3 N{ N  – [O-(2-O-метил- – [O-(2-O-метил-  -L-фукозил)-4-гидрокси-фениламино-тиокарбонил] -лизил-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино-тиокарбонил] -лизил-аланил}-батрацилинИсходное соединение: углевод примера 1.1. Очистка промежуточного продукта путем осаждения из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира и очистка продукта конечной стадии путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Выход: 65%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2; Rf= 0,21. Пример 3.4 Трифторацетат N-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилина -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: углевод примера 1.2. Очистка промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 97,5: 2,5 и осаждения продукта конечной стадии из смеси метанола и диэтилового эфира. Выход: 59%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2; Rf = 0,19. Пример 3.5 N-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил] -лизил-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил] -лизил-аланил}-батрацилинИсходное соединение: углевод примера 1.2. Очистка промежуточного продукта путем осаждения из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира и очистки продукта конечной стадии путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Выход: 36%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5; Rf = 0,57. Пример 3.6 N-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил] -лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси- фениламино-тиокарбонил] -лизил-D-аланил}-батрацилинИсходное соединение: углевод примера 1.3. Очистка промежуточного продукта путем осаждения из метанола с помощью диэтилового эфира и очистки продукта конечной стадии путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Выход: 44%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2: Rf= 0,15. Пример 3.7 Трифторацетат N-{ N  – [O-(3-десокси- – [O-(3-десокси-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилина -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: углевод примера 1.6. Очистка промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 95:5 и осаждения продукта конечной стадии из метанола с помощью диэтилового эфира. Выход: 35%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,42. Пример 3.8 Трифторацетат N-{ N  – [O-(3,4-эпокси- – [O-(3,4-эпокси-  -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилина -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: углевод примера 1.8. Очистка промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 95:5. Продукт конечной стадии несколько раз осаждают из метанола с помощью диэтилового эфира, после чего перемешивают с этилацетатом. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,49. Пример 3.9 Натриевая соль N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилина -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: углевод примера 1.10. Очистка промежуточного продукта путем перемешивания с метанолом и завершения осаждения с помощью диэтилового эфира. Продукт конечной стадии очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) сначала в соотношении 15:3:0,3, a потом 15: 6:0,6. Соответствующие фракции сгущают, подают в воду и с помощью 0,1н. натрового щелока доводят до pH 7. Отсасывают, остаток на фильтре подают в смесь диметилформамида и воды в соотношении 1:3 и добавляют один эквивалент 0,1н. натрового щелока. Сгущают, натриевую соль подают в воду и лиофилизуют. Выход: 43%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5; Rf = 0,15. Пример 3.10 Натриевая соль N-{ N  – [O-(3-O-карбамоилметил- – [O-(3-O-карбамоилметил-  -L-фукозил)-4-гидроксифениламино-тиокарбонил]- лизил-D-аланил}-батрацилина -L-фукозил)-4-гидроксифениламино-тиокарбонил]- лизил-D-аланил}-батрацилинаИсходное соединение: углевод примера 1.18. Очистка промежуточного продукта путем перемешивания с метанолом и завершения осаждения с помощью диэтилового эфира. Продукт конечной стадии очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:3: 0,3; Rf= 0,38; т.п.: 190oC (разл.). Пример 3.11 Ацетат N-{ N  – [O-(4-O-метил- – [O-(4-O-метил-  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилина -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: углевод примера 1.4. Очистка промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 95:5, а очистка продукта конечной стадии – с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. После сгущения к остатку добавляют один эквивалент ледяной уксусной кислоты и 10 мл воды и лиофилизуют. Выход: 52%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,43. Масс-спектр (бба): m/z = 760 = М + 1. Пример 3.12 Трифторацетат N-{ N  – [O-( – [O-(  -D-глюкозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилина -D-глюкозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение:п-аминофенил-  -D-глюкозид.
Очистка промежуточного продукта и продукта конечной стадии путем перемешивания с метанолом и завершения осаждения с помощью диэтилового эфира. Выход: 83%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:8:0,8; Rf = 0,48.
Пример 3.13 -D-глюкозид.
Очистка промежуточного продукта и продукта конечной стадии путем перемешивания с метанолом и завершения осаждения с помощью диэтилового эфира. Выход: 83%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:8:0,8; Rf = 0,48.
Пример 3.13Трифторацетат N-{ N  – [O- ( – [O- (  D-глюкозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-аланил}-батрацилина D-глюкозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-аланил}-батрацилинаИсходное соединение: п-аминофенил-  D-глюкозид.
Получение целевого соединения аналогично изомеру примера 3.12.
Пример 3.14 D-глюкозид.
Получение целевого соединения аналогично изомеру примера 3.12.
Пример 3.14Трифторацетат N-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил- D-аланил}-батрацилина -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил- D-аланил}-батрацилина3.14. a) N-{ N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – [O-(3-O-метил- – [O-(3-O-метил-  -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилин -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилинК раствору 62,8 мг (0,22 ммоль) соединения примера 1.25 в 10 мл смеси диоксана и воды в соотношении 1:1 при перемешивании добавляют 33,5 мл (0,44 ммоль) тиофосгена. Через 10 минут сгущают в вакууме и остаток сушат в течение часа в вакууме масляного насоса. Полученный изотиоцианат растворяют в 10 мл абсолютного диметилформамида, после чего добавляют 109,7 мг (0,2 ммоль) соединения примера 2.4 и 0,5 мл этилдиизопропиламина. Перемешивают при комнатной температуре в течение 16 часов, сгущают в вакууме и остаток очищают путем флеш-хроматографии с применением в качестве элюента смесь дихлорметана и метанола в соотношении 20:1. Получают 108,3 мг (62%) продукта в виде желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,42; т.п.: 194 – 195oC (разл.). 3.14) Трифторацетат 14-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-аланил}-батрацилина -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-аланил}-батрацилинаИз 105,1 мг (0,12 ммоль) соединения примера 3.14.a) отщепляют трет-бутокси-карбонильную группу описанным в примере 2.2 образом. После сгущения в вакууме и переосаждения из смеси метанола и диэтилового эфира получают 57,4 мг (54%) продукта в виде желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,16; т.п.: 188-189oC (разл.). Аналогично примерам 3.14.а) и 3.14) из пептидного конъюгата примера 2.4, взятого в количестве по 109,7 мг (0,2 ммоль), получают следующие гликоконъюгаты. Пример 3.15 Трифторацетат N-{ N  – [O-( – [O-( -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилина -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилинаИсходное соединение: 59,7 мг (0,22 ммоль) углевода примера 1.23. Очистка промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10:1. Получают 79,5 мг (46%) продукта в виде желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,74; т.п.: 182oC. В результате очистки продукта конечной стадии (описанным в примере 3.14 образом) получают 77,1 мг (44%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf= 0,27; т.п.: 191 – 192oC (разл.). Пример 3.16 Трифторацетат N-{ N  – [O-(3,4-ди-O-метил- – [O-(3,4-ди-O-метил-  -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилина -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилинаИсходное соединение: 79 мг (0,22 ммоль) углевода примера 1.31. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола сначала в соотношении 30:1, а потом 20:1. Получают 150,7 мг (85%) продукта в виде желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10:1; Rf = 0,35; т.п.: 197 – 199oC (разл.). В результате очистки продукта конечной стадии согласно примеру 3.14 получают 137 мг (76%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10:1; Rf = 0,13; т.п.: 184 – 186oC (разл.). Пример 3.17 Трифторацетат N-{ N  – [O-(3-О-метоксикарбонилметил- – [O-(3-О-метоксикарбонилметил-  -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилина -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилинаИсходное соединение: 75,5 мг (0,22 ммоль) углевода примера 1.42. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола сначала в соотношении 30:1, а потом 25:1. Получают 124,1 мг (66%) продукта в виде желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2: Rf = 0,50; т.п.: 165oC. В результате очистки продукта конечной стадии согласно примеру 3.14 получают 107,8 мг (57%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 4:1; Rf = 0,53; т.п.: 183oC (разл.). Пример 3.18 Трифторацетат N-{ N  – [O-(3-O-кapбoкcиметил- – [O-(3-O-кapбoкcиметил-  -D- гaлaктoпиpaнoзил)-4-гидрокси-фениламино-тиокарбонил]-лизил- D-аланил}-батрацилина -D- гaлaктoпиpaнoзил)-4-гидрокси-фениламино-тиокарбонил]-лизил- D-аланил}-батрацилинаИсходное соединение: 77,3 мг (0,22 ммоль) соединения примера 1.43. В результате очистки промежуточного продукта путем переосаждения из смеси этанола и диэтилового эфира получают 172 мг (91%) натриевой соли в виде желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,71; т.п. : 225 -228oC. В результате очистки продукта конечной стадии согласно примеру 3.14 получают 136,5 мг (73%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,12; т.п.: 217 – 220oC (разл.). Пример 3.19 Трифторацетат N-{ N  – [O-(3-O-карбамоилметил- – [O-(3-O-карбамоилметил-  -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилина -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: 72,2 мг (0,22 ммоль) углевода примера 1.44. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10: 1 получают 137,7 мг (75%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 4:1; Rf = 0,41; т.п.: 198-201oC (разл.). В результате очистки продукта конечной стадии согласно примеру 3.14 получают 140,2 мг (75%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 4:1; Rf = 0,16; т.п.: 188 – 190oC (разл.). Пример 3.20 Трифторацетат N-{ N  – [O-(3-O-(N-метил- кapбaмоилметиил)- – [O-(3-O-(N-метил- кapбaмоилметиил)-  -D-гaлaктопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилина -D-гaлaктопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: 75,3 мг (0,22 ммоль) углевода примера 1.45. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (25%) в соотношении 7: 1: 0,1 получают 158,4 мг (85%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15: 3:0,2; Rf = 0,25; т.п.: 161 – 163oC (разл.). В результате очистки продукта конечной стадии согласно примеру 3.14 получают 132,5 мг (70%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,10; т.п.: 191-193oC (разл.). Пример 3.21 Трифторацетат N-{ N  – O-[3-O-(N-пропил- карбамоилметил) -D- – O-[3-O-(N-пропил- карбамоилметил) -D- -галактопиранозил)-4-гидрокси-фениламино-тиокарбонил] -лизил-D-аланил} -батрацилина -галактопиранозил)-4-гидрокси-фениламино-тиокарбонил] -лизил-D-аланил} -батрацилинаИсходное соединение: 81,5 мг (0,22 ммоль) углевода примера 1.46. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (25%) в соотношении 8:1:0,1 получают 153,1 мг (80%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,33; т.п.: 187oC (разл.). В результате очистки продукта конечной стадии согласно примеру 3.14 получают 154,9 мг (79%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf – 0,21; т. п.: 179oC. Пример 3.22 Трифторацетат N-{ N  – [O-(3-O-(N-бутил- кapбaмoилметил)- – [O-(3-O-(N-бутил- кapбaмoилметил)-  -D-гaлaктoпиpaнoзил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилина -D-гaлaктoпиpaнoзил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: 84,6 мг (0,22 ммоль) углевода примера 1.47. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 12: 1 получают 132,7 мг (68%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,54; т.п.: 180 – 182oC. В результате очистки продукта конечной стадий согласно примеру 3.14 получают 115,2 мг (58%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2: Rf = 0,30; т. п.: 176oC. Пример 3.23 Трифторацетат N-{ N  – [O-(3,4-дидесокси- – [O-(3,4-дидесокси-  -D-галактопиранозил)- 4-гидроксифениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)- 4-гидроксифениламино-тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: 52,6 мг (0,22 ммоль) углевода примера 1.52. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 25: 1 получают 127,4 мг (77%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,60; т. п. : 166 – 167oC. В результате очистки продукта конечной стадии согласно примеру 3.14 получают 103,1 мг (61%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf – 0,44; т.п.: 173 – 175oC (разл.). Пример 3.24 Трифторацетат N-{ N  -[O-(6-O-aцетил- -[O-(6-O-aцетил- -D-гaлaктoпиpaнoзил)-4-гидpoкcифениламино-тиокарбонил]-лизил-D-аланил}-батрацилина -D-гaлaктoпиpaнoзил)-4-гидpoкcифениламино-тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: 78,2 мг (0,22 ммоль) углевода примера 1.53. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 25: 1 получают 88,3 мг (49%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 4:1; Rf = 0,61; т.п.: 196-199oC (разл.). В результате очистки продукта конечной стадии согласно примеру 3.14 получают 89,6 мг (49%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 4:1; Rf = 0,31; т.п.: 186oC (разл.). Пример 3.25 Трифторацетат N-{ N  – [O-( – [O-(  -D- мaннoпиpaнoзил)-4-гидpoкcи-фенилaминo-тиокарбонил]- лизил-D-аланил}-батрацилина -D- мaннoпиpaнoзил)-4-гидpoкcи-фенилaминo-тиокарбонил]- лизил-D-аланил}-батрацилинаИсходное соединение: 59,7 мг (0,22 ммоль) углевода примера 1.39. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10: 1 получают 101,7 мг (59%) желтых кристаллов. Тонкослойная хроматография: метанол: Rf = 0,79; т.п.: 180oC (разл.). В результате очистки продукта конечной стадии согласно примеру 3.14 получают 103,1 мг (59%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,34; т.п.: 177 – 178oC (разл.). Пример 3.26 Трифторацетат N-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -D- маннопиранозил)-4-гидрокси-фениламино-гиокарбонил]-лизил-D-аланил}-батрацилина -D- маннопиранозил)-4-гидрокси-фениламино-гиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: 62,8 мг (0,22 ммоль) углевода примера 1.40. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 20: 1 получают 56,6 мг (32%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,38: т.п.: 191 – 192oC (разл.). В результате очистки продукта конечной стадии согласно пример 3.14 получают 46,6 мг (26%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5: 1; Rf= 0,13: т.п.: 190 – 191oC (разл.). Пример 3.27 Трифторацетат N-{ N  – [O-(2,3-ди-O-метил- – [O-(2,3-ди-O-метил-  -D- маннопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аланил}-батрацилина -D- маннопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аланил}-батрацилинаИсходное соединение: 66 мг (0,22 ммоль) углевода примера 1.41. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 25: 1 получают 77,8 мг (44%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 4:1; Rf = 0,65; т.п.: 182-183oC (разл.). В результате очистки продукта конечной стадии согласно примеру 3.14 получают 66,1 мг (37%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 4:1; Rf = 0,40; т.п.: 181oC. Пример 3.28 Трифторацетат N-{ N  – [O-(3-O-метоксикарбонилметил- – [O-(3-O-метоксикарбонилметил-  -D-маннопиранозил)-4-гидрокси-фениламино-гиокарбонил]- лизил-D-аланил}-батрацилина -D-маннопиранозил)-4-гидрокси-фениламино-гиокарбонил]- лизил-D-аланил}-батрацилинаИсходное соединение: 75,5 мг (0,22 ммоль) углевода примера 1.48. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 18: 1 получают 62,1 мг (33%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака в соотношении 15:3:0,2; Rf = 0,66; т. п.: 165oC. В результате очистки продукта конечной стадии согласно примеру 3.14 получают 57,6 мг (30%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,43; т. п.: 183 – 184oC. Пример 3.29 Трифторацетат N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -D-маннопиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-аланил}-батрацилина -D-маннопиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-аланил}-батрацилинаИсходное соединение: 77,3 мг (0,22 ммоль) углевода примера 1.49. В результате очистки промежуточного продукта путем переосаждения из смеси этанола и диэтилового эфира получают 173,4 мг (92%) натриевой соли в виде желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,57; т.п. : 201 -205oC (разл.). В результате очистки продукта конечной стадии согласно примеру 3.14 получают 171,7 мг (92%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,29; т.п.: 196 – 198oC (разл.). Пример 3.30 Трифторацетат N-{ N  – [O-(3-O-карбамоилметил- – [O-(3-O-карбамоилметил-  -D-маннопиранозил)-4гидрокси-фениламино-гиокарбонил]-лизил- D-аланил}-батрацилина -D-маннопиранозил)-4гидрокси-фениламино-гиокарбонил]-лизил- D-аланил}-батрацилинаИсходное соединение: 72,2 мг (0,22 ммоль) углевода примера 1.50. В результате очистки промежуточного продукта путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10: 1 получают 106,6 мг (58%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 4:1; Rf = 0,34; т.п.: 192 – 194oC (разл.). В результате очистки продукта конечной стадии согласно примеру 3.14 получают 107,7 мг (58%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 4:1; Rf = 0,13; т.п.: 186 – 187oC (разл.). Пример 3.31 N-{ N  – [О-(3,4-ди-O-метил- – [О-(3,4-ди-O-метил-  -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилин -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилин3.31. a) N-{ N  – (флуopенил-9-метoкcикapбoнил)- N – (флуopенил-9-метoкcикapбoнил)- N – [O-(3,4-ди- O-метил- – [O-(3,4-ди- O-метил-  -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил] – лизил-D-аланил} -батрацилин -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил] – лизил-D-аланил} -батрацилинК раствору 79 мг (0,22 ммоль) соединения примера 1.31 в 10 мл смеси диоксана и воды в соотношении 1:1 при перемешивании добавляют 33,5 мл (0,44 ммоль) тиофосгена. Через 10 минут сгущают в вакууме и остаток сушат в вакууме масляного насоса в течение часа. Полученный изотиоцианат растворяют в 10 мл абсолютного диметилформамида и смешивают с 157 мг (0,2 ммоль) соединения примера 2.5 и 0,5 мл этилдиизопропиламина. Перемешивают при комнатной температуре в течение 16 часов, сгущают в вакууме и подают в смесь дихлорметана и метанола в соотношении 1:1. Продукт осаждают путем добавки диэтилового эфира и промывают небольшим количеством холодного как лед метанола. Получают 191 мг (94%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10: 1; Rf = 0,35; т.п.: 203oC (разл.). 3.31) N- N  – [O-(3,4-ди-O-метил- – [O-(3,4-ди-O-метил- -D-галактопиранозил)-4- гидроксифениламино-тиокарбонил]-лизил-D-аланил)-батрацилин -D-галактопиранозил)-4- гидроксифениламино-тиокарбонил]-лизил-D-аланил)-батрацилинОт 182,2 мг (0,18 ммоль) соединения примера 3.31.а) описанным в примере 2.4 образом отщепляют флуоренил-9-метоксикарбонильную группу. После сгущения в вакууме и растворения в смеси дихлорметана и метанола в соотношении 1:1 продукт осаждают добавкой диэтилового эфира. Получают 127,1 мг (89%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,46; т.п.: 158oC. Аналогично примерам 3.31.а) и 3.31) из пептидного конъюгата примера 2.5 (взятого в количестве по 157 мг (0,2 ммоль)) получают следующие гликоконъюгаты. Пример 3.32 N- { N  – [O-(3-O-(пиперидил-N)-карбонилметил- – [O-(3-O-(пиперидил-N)-карбонилметил- -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-аланил}-батрацилин -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-аланил}-батрацилинИсходное соединение: 75,5 мг (0,22 ммоль) углевода примера 1.42. В результате очистки промежуточного продукта описанным в примере 3.31.а) образом получают 191,2 мг (91%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10:1; Rf = 0,28; т.п.: 208oC (разл.). В результате очистки продукта конечной стадии описанным в примере 3.31) образом получают 155,8 мг (88%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,47; т.п.: 120oC (разл.). Пример 3.33 Натриевая соль N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил- -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилина -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилинаИсходное соединение: 77,3 мг (0,22 ммоль) углевода примера 1.43. В результате очистки промежуточного продукта описанным в примере 3.31.а) образом получают 192 мг (90%) желтых кристаллов. Тонкослойная хроматография: смесь этанола и метанола в соотношении 1: 1; Rf = 0,05; т.п.: 211 – 213oC (разл.). В результате очистки продукта конечной стадии описанным в примере 3.31) образом получают 110,6 мг (66%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,33: т.п.: 233 – 235oC (разл.). Пример 3.34 N-{ N  – [O-(3-O-кapбaмoилмeтил- – [O-(3-O-кapбaмoилмeтил-  -D-гaлaктoпиpaнoзил)-4-гидpoкcи- фeнилaминoтиокарбонил]-лизил-D-аланил}-батрацилин -D-гaлaктoпиpaнoзил)-4-гидpoкcи- фeнилaминoтиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: 72,2 мг (0,22 ммоль) углевода примера 1.44. В результате очистки промежуточного продукта описанным в примере 3.31.а) образом получают 159,2 мг (76%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10: 1; Rf = 0,04; т.п.: 177oC (разл.). В результате очистки продукта конечной стадии описанным в примере 3.31) образом получают 125,1 мг (76%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,48; т.п.: 106oC (разл.). Примеры 4.1 – 4.12 Общая формула 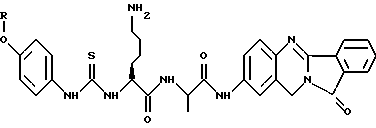 Пример 4.1 4.1. а) N-{ N  – -[O-( – -[O-(  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]- N -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]- N – (флуоренил-9-метоксикарбонил)-лизил-D-аланил}-батрацилин – (флуоренил-9-метоксикарбонил)-лизил-D-аланил}-батрацилин140 мг (0,55 ммоль) п-аминофенил-  L-фукозида описанным в примере 3.1. а) образом сначала переводят в горчичное масло, а потом продукт сочетают с 430 мг (0,55 ммоль) трифторацетата N- [ N L-фукозида описанным в примере 3.1. а) образом сначала переводят в горчичное масло, а потом продукт сочетают с 430 мг (0,55 ммоль) трифторацетата N- [ N – (флуоренил-9-метоксикарбонил)-лизил-D-аланил] -батрацилина (см. пример 2.5) в присутствии 375 мкл этилдиизопропиламина. После осаждения сырого продукта из смеси метанола и дихлорметана очищают путем флеш-хроматографии с применением в качестве элюента смеси ацетонитрила и воды в соотношении 10:1. В результате перемешивания остатка с диэтиловым эфиром получают 358 мг (67%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1: Rf = 0,48.
N-{ N – (флуоренил-9-метоксикарбонил)-лизил-D-аланил] -батрацилина (см. пример 2.5) в присутствии 375 мкл этилдиизопропиламина. После осаждения сырого продукта из смеси метанола и дихлорметана очищают путем флеш-хроматографии с применением в качестве элюента смеси ацетонитрила и воды в соотношении 10:1. В результате перемешивания остатка с диэтиловым эфиром получают 358 мг (67%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1: Rf = 0,48.
N-{ N – [O-( – [O-(  L-фукoзил)-4-гидpoкcи-фeнилaминo- тиoкapбoнил]-лизил-D-аланил}-батрацилин L-фукoзил)-4-гидpoкcи-фeнилaминo- тиoкapбoнил]-лизил-D-аланил}-батрацилин356 мг (0,37 ммоль) соединения примера 4.1.а) растворяют в 10 мл диметилформамида и 5 мл пиперидина и перемешивают в течение часа при температуре 20oC. Сгущают и остаток очищают путем хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15 : 6: 0,6. Выход целевого продукта: 46%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15 : 4: 0,5; Rf = 0,11. Аналогично примерам 4.1 из частично защищенного пептидного конъюгата примера 2.5 получают следующие гликоконъюгаты. Пример 4.2 Натриевая соль N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилина L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: углевод примера 1.10. Промежуточный продукт очищают путем хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) сначала в соотношении 15 : 3 : 0,3, а потом 15 : 4 : 0,5. Целевой продукт очищают на стадии бетаина путем перемешивания с водой, после чего переводят в натриевую соль с помощью 0,1н. натрового щелока и сублимационной сушки из смеси диоксана и воды. Выход: 65%. Т.п.: 220oC. Пример 4.3 N-{ N  – [O-(3-O-метил- – [O-(3-O-метил- -L-фукозил)-4-гидрокси-фениламино- тиокарбонил] -лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил] -лизил-D-аланил}-батрацилинИсходное соединение: углевод примера 1.2. Промежуточный продукт очищают путем осаждения из дихлорметана с помощью диэтилового эфира. Целевой продукт очищают в результате многократного осаждения из диметилформамида с помощью диэтилового эфира. Выход: 88%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5 : 1 : 0,2; Rf = 0,28. Пример 4.4 N-{ N  – [O-(4-O-мeтил- – [O-(4-O-мeтил- -L-фукoзил)-4-гидpoкcи-фeнилaминo- тиoкapбoнил] -лизил-D-аланил}-батрацилин -L-фукoзил)-4-гидpoкcи-фeнилaминo- тиoкapбoнил] -лизил-D-аланил}-батрацилинИсходное соединение: углевод примера 1.4. Промежуточный продукт очищают путем многократного осаждения из смеси дихлорметана и метанола в соотношении 1 : 1 с помощью диэтилового эфира. Целевой продукт очищают путем колоночной хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15 : 8 : 0,8, после чего осаждают из смеси дихлорметана и метанола в соотношении 1 : 1 с помощью диэтилового эфира. Выход: 74%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 10 : 10 : 1: Rf = 0,19. Пример 4.5 N-{ N  – [O-{3,4-ди-O-метил- – [O-{3,4-ди-O-метил- -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин4.5. а) N-{ N  – [O-(3,4-ди-O-метил- – [O-(3,4-ди-O-метил- -D-галактопиранозил)-4- гидрокси-фенил-амино-тиокарбонил- N -D-галактопиранозил)-4- гидрокси-фенил-амино-тиокарбонил- N – флуоренил-9-метоксикарбонил)]-лизил- D-аланил} -батрацилин – флуоренил-9-метоксикарбонил)]-лизил- D-аланил} -батрацилинК раствору 79 мг (0,22 ммоль) соединения примера 1.31 в 10 мл смеси диоксана и воды в соотношении 1 : 1 при перемешивании добавляют 33,5 мл (0,44 ммоль) тиофосгена. Через 10 минут сгущают в вакууме и остаток сушат в вакууме масляного насоса в течение часа. Полученный изотиоцианат растворяют в 10 мл абсолютного диметилформамида, после чего смешивают с 157 мг (0,2 ммоль) соединений примера 2.6 и 0,5 мл этилдиизопропиламина. Перемешивают в течение 16 часов при комнатной температуре и сгущают в вакууме. В результате многократного переосаждения остатка из смеси дихлорметана и метанола в соотношении 1 : 1 с помощью диэтилового эфира и последующей промывки небольшим количеством холодного как лед метанола получают 198 мг (98%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10 : 1; Rf = 0,23: т.п.: 175oC. 4.5) N-{ N  – [O-(3,4-ди-O-метил- – [O-(3,4-ди-O-метил- -D-галактопиранозил)-4- гидроксифениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4- гидроксифениламино-тиокарбонил]-лизил-D-аланил}-батрацилинОт 172,1 мг (0,17 ммоль) соединения примера 4.5.а) описанным в примере 2.4 образом отщепляют флуоренил-9-метоксикарбонильную группу. После сгущения в вакууме и растворения в смеси метанола и дихлорметана в соотношении 1 : 1 продукт осаждают путем добавки диэтилового эфира. Получают 114,5 мг (85%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1 : 1; Rf = 0,16: т.п.: 206oC (разл.). Аналогично примерам 4.5. а) и 4.5) из пептидного конъюгата примера 2.6 (взятого в количестве по 157 мг (0,2 ммоль)) получают следующие гликоконъюгаты. Пример 4.6 N-{ N  – [O-( – [O-(  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил] -лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил] -лизил-D-аланил}-батрацилинИсходное соединение: углевод примера 1.23 (59,7 мг, 0,22 ммоль). Промежуточный продукт очищают описанным в примере 4.5.а) образом и получают 185,8 мг (94%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10: 1; Rf = 0,09; т.п.: 182oC (разл.). В результате описанной в примере 4.5 очистки продукта конечной стадии получают 134,3 мг (88%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1 : 1; Rf = 0,04; т.п.: 221oC (разл.). Пример 4.7 N-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: углевод примера 1.25 (62,8 мг, 0,22 ммоль). Промежуточный продукт очищают описанным в примере 4.5.а) образом и получают 193,5 мг (97%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10 : 1; Rf = 0,27: т.п.: 178oC (разл.). В результате очистки продукта конечной стадии путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 2:1-1:1 получают 130,5 мг (84%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1:1; Rf = 0,09; т.п.: 206oC (разл.). Пример 4.8 N-{ N  – [O-(3-O-метоксикарбонилметил- – [O-(3-O-метоксикарбонилметил- -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: углевод примера 1.42 (75,5 мг, 0,22 ммоль). Промежуточный продукт очищают описанным в примере 4.5.а) образом и получают 209,8 мг (99%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10: 1; Rf = 0,32; т.п.: 235oC (разл.). В результате очистки продукта конечной стадии описанным в примере 4.5 образом получают 164,3 мг (99%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1: 1; Rf = 0,05; т.п.: 217oC (разл.). Пример 4.9 Натриевая соль N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил- -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилина -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилинаИсходное соединение: углевод примера 1.43 (77,3 мг, 0,22 ммоль). Промежуточный продукт очищают описанным в примере 4.5.а) образом и получают 210,3 мг (99%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10 : 1 : Rf = 0,02; т.п.: 185oC. После очистки продукта описанным в примере 4.5 образом остаток суспендируют в 10 мл воды и к суспензии при перемешивании прикапывают 0,05н. натровый щелок до того, как получается прозрачный раствор со значением pH < 10. Раствор фильтруют, лиофилизуют и получают 150,8 мг (90%) желтого аморфного твердого вещества. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1 : 1; Rf = 0,04. Пример 4.10 N-{ N  – [O-(3-O-кapбaмoилмeтил] – [O-(3-O-кapбaмoилмeтил]  -D-галактопиранозил)-4-гидpoкcи- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидpoкcи- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: углевод примера 1.44 (72,2 мг, 0,22 ммоль). Промежуточный продукт очищают описанным в примере 4.5.а) образом и получают 152,7 мг (73%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10:1; Rf = 0,11; т.п.: 229oC (разл.). После очистки продукта описанным в примере 4.5 образом остаток суспендируют в 20 мл смеси воды и диоксана в соотношении 1:1. Раствор фильтруют, лиофилизуют и получают 98,4 мг (61%) желтого аморфного твердого вещества. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1:1; Rf = 0,10; [  ]20= +44,9 ]20= +44,9 (c = 0,2/H2O).
Пример 4.11 (c = 0,2/H2O).
Пример 4.11N-{ N  – [O-( – [O-(  -D-маннопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-маннопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: углевод примера 1.39 (59,7 мг, 0,22 ммоль). Промежуточный продукт очищают описанным в примере 4.5.а) образом и получают 179,6 мг (91%) кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10: 1; Rf = 0,07; т.п.: 176oC (разл.). После очистки продукта конечной стадии описанным в примере 4.5 образом получают 137,5 мг (90%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1 : 1; Rf = 0,09: т.п.: 213oC (разл.). Пример 4.12 N-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  D-маннопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лиэил-D-аланил}-батрацилин D-маннопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лиэил-D-аланил}-батрацилинИсходное соединение: углевод примера 1.40 (62,8 мг, 0,22 ммоль). Промежуточный продукт очищают описанным в примере 4.5.а) образом и получают 94,2 мг (48%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10:1; Rf = 0,13; т.п.: 173oC (разл.). В результате очистки продукта конечной стадии описанным в примере 4.5 образом получают 66,6 мг (43%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1: 1; Rf = 0,07; т.п.: 215oC (разл.). Примеры 5.1 – 5.23 Общая формула 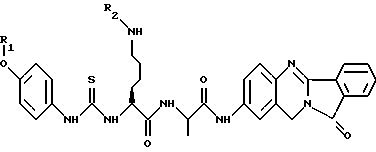 Пример 5.1 N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил- -L-фукозил)-4- гидроксифениламино-тиокарбонил]- N -L-фукозил)-4- гидроксифениламино-тиокарбонил]- N – [O-(3-O-метил- – [O-(3-O-метил- -L-фукозил)-4- гидроксифениламино-тиокарбонил] -лизил-D-аланил}-батрацилин -L-фукозил)-4- гидроксифениламино-тиокарбонил] -лизил-D-аланил}-батрацилинК 50 мг (0,16 ммоль) п-аминофенил-3-О-карбоксиметил-  -L-фукозида примера 1.10 в 10 мл смеси диоксана и воды в соотношении 1: 1 при перемешивании добавляют 30 мкл (0,18 ммоль) тиофосгена. Через 10 минут сгущают и сушат в высоком вакууме в течение часа. Полученное горчичное масло сочетают в среде абсолютного диметилформамида с 109 мг (0,144 ммоль) конъюгата примера 3.4 в присутствии 82 мкл этилдиизопропиламина. Сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5. Полученное после сгущения вещество лиофилизуют из воды. Выход: 89 мг (56%). Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:6:0,6; Rf = 0,22.
Аналогично примеру 5.1 получают следующие конъюгаты, имеющие различные заместители.
Пример 5.2 -L-фукозида примера 1.10 в 10 мл смеси диоксана и воды в соотношении 1: 1 при перемешивании добавляют 30 мкл (0,18 ммоль) тиофосгена. Через 10 минут сгущают и сушат в высоком вакууме в течение часа. Полученное горчичное масло сочетают в среде абсолютного диметилформамида с 109 мг (0,144 ммоль) конъюгата примера 3.4 в присутствии 82 мкл этилдиизопропиламина. Сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5. Полученное после сгущения вещество лиофилизуют из воды. Выход: 89 мг (56%). Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:6:0,6; Rf = 0,22.
Аналогично примеру 5.1 получают следующие конъюгаты, имеющие различные заместители.
Пример 5.2N-{ N  – [O-(3-O-мeтил- – [O-(3-O-мeтил- -L-фукозил)-4-гидpoкcифeнилaминo-тиoкapбoнил] – N -L-фукозил)-4-гидpoкcифeнилaминo-тиoкapбoнил] – N – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукозил)-4-гидроксифениламино-тиокарбонил]- лизил-D-аланил}-батрацилин -L-фукозил)-4-гидроксифениламино-тиокарбонил]- лизил-D-аланил}-батрацилинИсходные соединения: углевод примера 1.2, конъюгат примера 3.10. Очистка путем осаждения сырого продукта из метанола с помощью диэтилового эфира. Выход: 78%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,45. Пример 5.3 N-{ N  – [O-(3-O-метил- – [O-(3-O-метил- -L-фукозил)-4-гидроксифениламино-тиокарбонил] – N -L-фукозил)-4-гидроксифениламино-тиокарбонил] – N – [4-гидроксифениламино-тиокарбонил]-лизил-D-аланил}-батрацили – [4-гидроксифениламино-тиокарбонил]-лизил-D-аланил}-батрацилиИсходные соединения: конъюгат примера 4.3, 4-гидрокси-анилин. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Выход: 60%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2; Rf = 0,31. Пример 5.4 N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил- -L-фукозил)-4-гидроксифениламино- тиокарбонил]- N -L-фукозил)-4-гидроксифениламино- тиокарбонил]- N – [4-гидроксифениламино-гиокарбонил]-лизил-D-аланил}- батрацилин – [4-гидроксифениламино-гиокарбонил]-лизил-D-аланил}- батрацилинИсходные соединения: конъюгат примера 4.2, 4-гидрокси-анилин. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5. Потом остаток перемешивают со смесью метанола и диэтилового эфира. Выход: 55%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:6:0,6; Rf = 0,3. Пример 5.5 N-{ N  – [O-(4-O-метил- – [O-(4-O-метил- -L-фукозил)-4-гидроксифениламино-тиокарбонил] – N -L-фукозил)-4-гидроксифениламино-тиокарбонил] – N – [4-гидроксифениламино-тиокарбонил]-лизил-D-аланил}-батрацили – [4-гидроксифениламино-тиокарбонил]-лизил-D-аланил}-батрацилиИсходные соединения: конъюгат примера 4.4, 4-гидрокси-анилин. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Потом остаток осаждают из смеси метанола и дихлорметана с помощью диэтилового эфира. Выход: 49%. Т.п.: 128oC. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2; Rf = 0,26. Пример 5.6 N-{ N  – [4-гидроксифениламино-тиокарбонил]- N – [4-гидроксифениламино-тиокарбонил]- N – [O-(4- O-метил- – [O-(4- O-метил- -L-фукозил)-4-гидроксифениламино-тиокарбонил]- лизил-D-аланил}-батрацилин -L-фукозил)-4-гидроксифениламино-тиокарбонил]- лизил-D-аланил}-батрацилинИсходные соединения: конъюгат примера 3.11, 4-гидрокси-анилин. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Потом остаток лиофилизуют из смеси воды и диоксана. Выход: 50%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2; Rf= 0,29. Пример 5.7 N-{ N  – [4-гидроксифениламино-тиокарбонил]- N – [4-гидроксифениламино-тиокарбонил]- N – [O- (3-O-метил- – [O- (3-O-метил- -L-фукозил)-4-гидроксифениламино-тиокарбонил]-лизил-D- аланил}-батрацилин -L-фукозил)-4-гидроксифениламино-тиокарбонил]-лизил-D- аланил}-батрацилинИсходные соединения: конъюгат примера 3.4, 4-гидрокси-анилин. Остаток осаждают из метанола с помощью диэтилового эфира. Выход: 76%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2; Rf = 0,26. Пример 5.8 N-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  L-фукозил)-4-гидроксифениламино- тиокарбонил]- N L-фукозил)-4-гидроксифениламино- тиокарбонил]- N – [4-гидроксиэтиламино-2-[O-(3-O-метил- – [4-гидроксиэтиламино-2-[O-(3-O-метил- -L-фукозил)-4- гидроксифенил-амино]триазин-6-ил]]-лизил-D-аланил}-батрацили -L-фукозил)-4- гидроксифенил-амино]триазин-6-ил]]-лизил-D-аланил}-батрацилиИсходные соединения: конъюгат примера 8.10, углевод примера 1.2. Остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15: 2: 0,2. Выход: 9%. Масс-спектр (бба): m/z = 1165 = М+1. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15: 3: 0,3; Rf = 0,27. Пример 5.9 N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукозил)-4-гидроксифениламино- тиокарбонил]- N -L-фукозил)-4-гидроксифениламино- тиокарбонил]- N – [ацетил]-лизил-D-аланил}-батрацилин – [ацетил]-лизил-D-аланил}-батрацилинИсходные соединения: N-[ N  – (ацетил)-лизил-D-аланил]-батрацилин, углевод примера 1.10.
Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) сначала в соотношении 15:2:0,2, a потом 15: 4:0,5. Затем остаток подвергают сублимационной сушке из воды. Выход: 46%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,31.
Пример 5.10 – (ацетил)-лизил-D-аланил]-батрацилин, углевод примера 1.10.
Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) сначала в соотношении 15:2:0,2, a потом 15: 4:0,5. Затем остаток подвергают сублимационной сушке из воды. Выход: 46%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,31.
Пример 5.10N-{ N  – [O-(4-O-метил- – [O-(4-O-метил- -L-фукозил)-4-гидроксифениламино-тиокарбонил]-N -L-фукозил)-4-гидроксифениламино-тиокарбонил]-N – [ацетил]-лизил-D-аланил}-батрацилин – [ацетил]-лизил-D-аланил}-батрацилин51 мг (0,067 ммоль) конъюгата примера 4.4 в 5 мл диметилформамида смешивают с 10 мкл ацетангидрида и перемешивают при комнатной температуре в течение 30 минут. Сгущают и осаждают из метанола с помощью диэтилового эфира. Выход: 46 мг (86%). Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,6. Пример 5.11 Натриевая соль N-{ N  – [O-( – [O-(  -L-фукозил)-4-гидроксифениламино- тиокарбонил]- N -L-фукозил)-4-гидроксифениламино- тиокарбонил]- N – [сукцинил]-лизил-D-аланил}-батрацилина – [сукцинил]-лизил-D-аланил}-батрацилина20 мг (0,027 ммоль) конъюгата примера 4.1 в 2 мл диметилформамида смешивают с 3 мг ангидрида янтарной кислоты и перемешивают при комнатной температуре в течение 6 часов. Сгущают и осаждают из метанола с помощью диэтилового эфира. Остаток подают в воду и добавляют 27 мкл 0,1н. натрового щелока. Выход: 20 мг (86%). Тонкослойная хроматография: смесь дихлорметана, метанола и ледяной уксусной кислоты в соотношении 80:20:2; Rf = 0,2. Пример 5.12 N-{ N  – [O-(3-O-метоксикарбонилметил- – [O-(3-O-метоксикарбонилметил- -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]- N -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]- N – [O-(3,4-ди-O-метил- – [O-(3,4-ди-O-метил- -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилин -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилин37,7 мг (0,11 ммоль) углевода примера 1.42 аналогично примеру 3.31.а) подвергают взаимодействию с 79 мг (0,1 ммоль) пептидного конъюгата примера 3.31. После сгущения в вакууме и очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола сначала в соотношении 20: 1, а потом 10:1 получают 52,9 мг (45%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10:1; Rf = 0,14: т.п.: 178oC (разл.). Пример 5.13 Натриевая соль N- N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -D-галактопиранозил)- 4-гидроксифениламино-тиокарбонил] – N -D-галактопиранозил)- 4-гидроксифениламино-тиокарбонил] – N – [O-(3,4-ди-O-метил- – [O-(3,4-ди-O-метил- -D-галактопиранозил)-4-гидрокси-фениламино-гиокарбонил]-лизил-D-аланил}- батрацилина -D-галактопиранозил)-4-гидрокси-фениламино-гиокарбонил]-лизил-D-аланил}- батрацилина38,6 мг (0,11 ммоль) углевода примера 1.43 аналогично примеру 3.31.а) подвергают взаимодействию с 79 мг (0,1 ммоль) пептидного конъюгата примера 3.31. После сгущения в вакууме и растворения в смеси метанола и дихлорметана в соотношении 1:1 продукт осаждают путем добавки диэтилового эфира. Остаток суспендируют в 10 мл воды и к суспензии при перемешивании прикапывают 0,05н. натровый щелок до того, как получается прозрачный раствор со значением pH < 10. Раствор фильтруют, лиофилизуют и получают 87,9 мг (74%) желтого аморфного твердого вещества. Тонкослойная хроматография: этанол; Rf = 0,17; [  ]20= +56,0 ]20= +56,0 (с = 0,1/H2O).
Пример 5.14 (с = 0,1/H2O).
Пример 5.14N-{ N  – [O-(3-O-карбамоилметил- – [O-(3-O-карбамоилметил-  -L-галактопиранозил)-4-гидрокси- фенил-aминo-тиoкapбoнил] – N -L-галактопиранозил)-4-гидрокси- фенил-aминo-тиoкapбoнил] – N – [O-(3,4-ди-O-мeтил- – [O-(3,4-ди-O-мeтил-  -D-галактопиранозил)- 4-гидpoкcи-фениламино-тиокарбонил]-лизил-D-аланил}-батрацили -D-галактопиранозил)- 4-гидpoкcи-фениламино-тиокарбонил]-лизил-D-аланил}-батрацили36,1 мг (0,11 ммоль) углевода примера 1.44 аналогично примеру 3.31.а) подвергают взаимодействию с 79 мг (0,1 ммоль) пептидного конъюгата примера 3.31. После сгущения в вакууме и растворения в смеси метанола и дихлорметана в соотношении 1: 1 продукт осаждают путем добавки диэтилового эфира. Получают 45,9 мг (39%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,38; т.п.: 219oC (разл.). Пример 5.15 N-{ N  – [O-(3,4-ди-O-метил- – [O-(3,4-ди-O-метил- -D-галактопиранозил)-4-гидрокси- фениламино-тио-кapбoнил] – -D-галактопиранозил)-4-гидрокси- фениламино-тио-кapбoнил] –  – [O-(3-O-пипepидил-N)-кapбoнилмeтил- – [O-(3-O-пипepидил-N)-кapбoнилмeтил- -D-гaлaктoпиpaнoзил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аланил}-батрацилин -D-гaлaктoпиpaнoзил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аланил}-батрацилин39,5 мг (0,11 ммоль) углевода примера 1.31 аналогично примеру 3.31.а) подвергают взаимодействию с 88,7 мг (0,1 ммоль) пептидного конъюгата примера 3.32. После сгущения в вакууме и очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола сначала в соотношении 20:1, а потом 10:1 получают 38,8 мг (32%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,79; т.п.: 205oC (разл.). Пример 5.16 Натриевая соль N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил- -D-галактопиранозил)-4- гидрокcи-фeнилaминo-тиoкapбoнил] – N -D-галактопиранозил)-4- гидрокcи-фeнилaминo-тиoкapбoнил] – N – [O-(3-O-(пиперидил-N)-карбонилметил- – [O-(3-O-(пиперидил-N)-карбонилметил- -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил] -лизил-D-аланил} – батрацилина -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил] -лизил-D-аланил} – батрацилина38,6 мг (0,11 ммоль) углевода примера 1.43 аналогично примеру 3.31.а) подвергают взаимодействию с 88,7 мг (0,1 ммоль) пептидного конъюгата примера 3.32. После сгущения в вакууме и растворения в смеси метанола и дихлорметана в соотношении 1: 1 продукт осаждают добавкой диэтилового эфира. Остаток суспендируют в 10 мл воды и к суспензии при перемешивании прикапывают 0,05н. натровый щелок до того, как получается прозрачный раствор со значением pH < 10. Раствор фильтруют, лиофилизуют и получают 90,3 мг (71%) желтого аморфного твердого вещества. Тонкослойная хроматография: этанол; Rf = 0,05; [  ]20= +39,0 ]20= +39,0 (с = 0,1/H2O).
Пример 5.17 (с = 0,1/H2O).
Пример 5.17N- N  – [O-(3-O-карбамоилметил- – [O-(3-O-карбамоилметил-  -D-галактопиранозил)-4-гидрокси- фенил-амино-тиокарбонил]-N -D-галактопиранозил)-4-гидрокси- фенил-амино-тиокарбонил]-N – -[O-(3-O(пиперидил-N)-карбонилметил- – -[O-(3-O(пиперидил-N)-карбонилметил-  – D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-аланил}-батрацилин – D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-аланил}-батрацилин36,1 мг (0,11 ммоль) углевода примера 1.44 аналогично примеру 3.31.а) подвергают взаимодействию с 88,7 мг (0,1 ммоль) пептидного конъюгата примера 3.32. После сгущения в вакууме и растворения в смеси метанола и дихлорметана в соотношении 1:1 продукт осаждают добавкой диэтилового эфира. Получают 44,8 мг (36%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,06; т.п.: 223oC (разл.). Пример 5.18 Натриевая соль N-{ N  – [O-(3,4-ди-O-метил- – [O-(3,4-ди-O-метил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил] – -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил] –  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил- -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилина -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилина39,5 мг (0,11 ммоль) углевода примера 1.31 аналогично примеру 3.31.а) подвергают взаимодействию с 84,2 мг (0,1 ммоль) пептидного конъюгата примера 3.33. После сгущения в вакууме продукт подают в 20 мл смеси метанола и дихлорметана в соотношении 1:1, после чего продукт осаждают добавкой диэтилового эфира. Остаток суспендируют в 10 мл воды и к суспензии при перемешивании прикапывают 0,05н. натровый щелок до того, как получается прозрачный раствор со значением pH < 10. Раствор фильтруют, лиофилизуют и получают 80,7 мг (68%) желтого аморфного твердого вещества. Тонкослойная хроматография: этанол: Rf = 0,09; [  ]20= +35,0 ]20= +35,0 (с = 0,1/H2O).
Пример 5.19 (с = 0,1/H2O).
Пример 5.19Натриевая соль N-{ N  – [-О(3-О-метоксикарбонилметил- – [-О(3-О-метоксикарбонилметил- -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил] – N -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил] – N – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил- -D-галактопиранозил)-4- гидрокси-фениламино-гиокарбонил]-лизил-D-аланил}-батрацилина -D-галактопиранозил)-4- гидрокси-фениламино-гиокарбонил]-лизил-D-аланил}-батрацилина37,7 мг (0,11 ммоль) углевода примера 1.42 аналогично примеру 3.31.а) подвергают взаимодействию с 84,2 мг (0,1 ммоль) пептидного конъюгата примера 3.33. После сгущения в вакууме продукт подают в 20 мл смеси метанола и дихлорметана в соотношении 1:1, после чего продукт осаждают добавкой диэтилового эфира. Остаток суспендируют в 10 мл воды и к суспензии при перемешивании прикапывают 0,05н. натровый щелок до того, как получается прозрачный раствор со значением pH < 10. Раствор фильтруют, лиофилизуют и получают 87,5 мг (71%) желтого аморфного твердого вещества. Тонкослойная хроматография: этанол; Rf = 0,10; [  ]20= +24,6 ]20= +24,6 (с = 0,11/H2O).
Пример 5.20 (с = 0,11/H2O).
Пример 5.20Натриевая соль N-{ N  – [O-(3-O-карбамоилметил- – [O-(3-O-карбамоилметил-  -D-галактопиранозил)-4-гидpoкcи-фeнилaминo-тиoкapбoнил]- N -D-галактопиранозил)-4-гидpoкcи-фeнилaминo-тиoкapбoнил]- N – [O-(3-O-кapбoкcимeтил] – [O-(3-O-кapбoкcимeтил]  D-галактопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилина D-галактопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилина36,1 мг (0,11 ммоль) углевода примера 1.44 аналогично примеру 3.31.а) подвергают взаимодействию с 84,2 мг (0,1 ммоль) пептидного конъюгата примера 3.33. После сгущения в вакууме продукт подают в 20 мл смеси метанола и дихлорметана в соотношении 1:1, после чего продукт осаждают добавкой диэтилового эфира. Остаток суспендируют в 10 мл воды и к суспензии при перемешивании прикапывают 0,05н. натровый щелок до того, как получается прозрачный раствор со значением pH < 10. Раствор фильтруют, лиофилизуют и получают 78,6 мг (65%) желтого аморфного твердого вещества. Тонкослойная хроматография: этанол: Rf= 0,11; [  ]20= -44,0 ]20= -44,0 (с = 0,13/H2O).
Пример 5.21 (с = 0,13/H2O).
Пример 5.21N-{ N  – [O-(3,4-ди-O-мeтил- – [O-(3,4-ди-O-мeтил-  -D-галактопиранзил)-4-гидpoкcи- фeнилaминo-тиoкарбонил]- N -D-галактопиранзил)-4-гидpoкcи- фeнилaминo-тиoкарбонил]- N – [O-(3-O-карбамоилметил- – [O-(3-O-карбамоилметил-  -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацили -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацили39,5 мг (0,11 ммоль) углевода примера 1.31 аналогично примеру 3.31.а) подвергают взаимодействию с 81,9 мг (0,1 ммоль) пептидного конъюгата примера 3.34. После сгущения в вакууме и очистки путем флеш-хроматографии с применением в качестве элюента сначала этанола, а потом смеси этанола и метанола в соотношении 2:1 получают 17,4 мг (15%) желтых кристаллов. Тонкослойная хроматография: этанол; Rа = 0,20; т.п.: > 290oC (разл.). Пример 5.22 N-{ N  – [O-(3-O-метоксикарбонилметил- – [O-(3-O-метоксикарбонилметил- -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил] – N -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил] – N – [O-(3-O-карбамоилметил- – [O-(3-O-карбамоилметил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин37,7 мг (0,11 ммоль) углевода примера 1.42 аналогично примеру 3.31.а) подвергают взаимодействию с 81,9 мг (0,1 ммоль) пептидного конъюгата примера 3.34. После сгущения в вакууме и растворения в смеси метанола и дихлорметана в соотношении 1:1 продукт осаждают путем добавки диэтилового эфира. Получают 72 мг (60%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,21: т.п.: 222oC (разл.). Пример 5.23 Натриевая соль N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил- -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил] – N -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил] – N – [O-(3-O-карбамоилметил- – [O-(3-O-карбамоилметил- -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилина -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилина38,6 мг (0,11 ммоль) углевода примера 1.43 аналогично примеру 3.31.а) подвергают взаимодействию с 81,9 мг (0,1 ммоль) пептидного конъюгата примера 3.34. После сгущения в вакууме и растворения в смеси метанола и дихлорметана в соотношении 1:1 продукт осаждают путем добавки диэтилового эфира. Остаток суспендируют в 10 мл воды и к суспензии при перемешивании прикапывают 0,05н. натровый щелок до того, как получается прозрачный раствор со значением pH < 10. Раствор фильтруют, лиофилизуют и получают 78,2 мг (65%) желтого аморфного твердого вещества. Тонкослойная хроматография: этанол; Rf = 0,07; [  ]20= +33,0 ]20= +33,0 (с = 0,1/H2O).
Примеры 6.1 – 6.89 (с = 0,1/H2O).
Примеры 6.1 – 6.89Общая формула 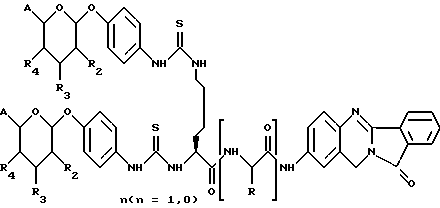 Пример { N  ,N ,N – бис-[O-(2-O-метил- – бис-[O-(2-O-метил- -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинК раствору 50 мг (0,19 ммоль) соединения примера 1.1 в 10 мл смеси диоксана и воды в соотношении 1:1 при перемешивании добавляют 30 мкл (0,4 ммоль) тиофосгена. Через 10 минут сгущают в вакууме и остаток сушат в вакууме масляного насоса в течение часа. Полученный изотиоцианат растворяют в 10 мл абсолютного диметилформамида, после чего смешивают с 61 мг (0,09 ммоль) соединения примера 2.13 и 0,5 мл этилдиизопропиламина. Перемешивают при комнатной температуре в течение 16 часов, сгущают в вакууме и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Остаток осаждают из метанола с помощью диэтилового эфира. Получают 48 мг (50%) целевого продукта в виде желтых кристаллов. Аналогично примеру 6.1 из пептидного конъюгата примера 2.13 или же L-аланил-изомера примера 2.2 получают следующие гликоконъюгаты: Пример 6.2 N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: 100 мг (0,38 ммоль) углевода примера 1.2. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:0,5:0,05 – 15:1:0,1. Остаток осаждают из смеси дихлорметана, метанола и диэтилового эфира. Выход: 59%. Т. п.: 178oC (разл.). Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf = 0,51. Пример 6.3 N-{ N  ,N ,N – биc-[O-(4-O-мeтил- – биc-[O-(4-O-мeтил-  -L-фукoзил)-4-гидpoкcи- фeнилaминo-тиокарбонил]-лизил-O-аланил}-батрацилин -L-фукoзил)-4-гидpoкcи- фeнилaминo-тиокарбонил]-лизил-O-аланил}-батрацилинИсходное соединение: 115 мг (0,44 ммоль) углевода примера 1.4. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Остаток осаждают из смеси дихлорметана и метанола в соотношении 1:1 и диэтилового эфира. Выход: 58%. т.п.: 176oC (разл.). Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf = 0,52. Пример 6.4 N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-аланил}-батрацилинИсходное соединение: 115 мг (0,44 ммоль) углевода примера 1.2. Очистка путем осаждения из смеси дихлорметана и метанола в соотношении 1: 1 и диэтилового эфира. Выход: 93%. Т.п.: 192oC (разл.). Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf = 0,46. Пример 6.5 N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: 100 мг (0,38 ммоль) углевода примера 1.3. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:1:0,1. Осаждение из смеси дихлорметана и метанола в соотношении 1:1 и диэтилового эфира. Т.п.: 178oC (разл.). Масс-спектр (бба): m/z = 1071 = М+1. Пример 6.6 N-{ N  ,N ,N – бис-[O-(3-O-н-пропил- – бис-[O-(3-O-н-пропил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: 38 мг (0,127 ммоль) углевода примера 1.5. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:1:0,1. Осаждение из смеси дихлорметана и метанола в соотношении 1:1 и диэтилового эфира. Выход: 42%. Т.п.: 167 – 170oC (разл.). Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%); Rf = 0,34. Пример 6.7 N-{ N  ,N ,N – бис-[O-(3-десокси- – бис-[O-(3-десокси-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: 40 мг (0,167 ммоль) углевода примера 1.6. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Осаждение из смеси метанола и диэтилового эфира. Выход: 81%. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf = 0,46. Пример 6.8 N-{ N  ,N ,N – бис-[O-(3,4-дидесокси- – бис-[O-(3,4-дидесокси-  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: 41 мг (0,183 ммоль) углевода примера 1.7. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 95:5. Продукт подвергают сублимационной сушке из смеси воды и диоксана. Выход: 60%. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9: 1; Rf = 0,22. Пример 6.9 N- {N  ,N ,N – бис-[O-(3-гидроксиэтил- – бис-[O-(3-гидроксиэтил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: 75 мг (0,25 ммоль) углевода примера 1.12. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2 – 15:4:0,5. Осаждают из смеси метанола и диэтилового эфира. Выход: 66%. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf = 0,28. Пример 6.10 N-{ N  ,N ,N – бис-[O-(2-гидроксиэтил- – бис-[O-(2-гидроксиэтил-  -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: 50 мг (0,167 ммоль) углевода примера 1.19. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:3:0,3. Осаждают из смеси метанола и диэтилового эфира, после чего продукт подвергают сублимационной сушке из смеси воды и диоксана. Выход: 72%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1: 0,2; Rf = 0,39. Пример 6.11 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(2-O-карбоксиметил- – бис-[O-(2-O-карбоксиметил-  -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилина -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилинаИсходное соединение: 50 мг (0,16 ммоль) углевода примера 1.13. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:8:0,8 – 15:10:1. Остаток дигерируют диэтиловым эфиром, после чего продукт подвергают сублимационной сушке из смеси воды и диоксана. Переводят в динатриевую соль с помощью 2 эквивалентов 0,1н. натрового щелока, после чего осуществляют сублимационную сушку из воды. Выход: 49%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,5; Rf = 0,38. Масс-спектр (бба): бба–: m/z = 1157 = М – 2Na + H+. Пример 6.12 Динатриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил- – L-фукозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилина – L-фукозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинаИсходное соединение: 200 мг (0,64 ммоль) углевода примера 1.10. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5 – 15:8:0,8 – 15:10:1. Остаток дигерируют диэтиловым эфиром, после чего продукт подвергают сублимационной сушке из смеси воды и диоксана в соотношении 1:1. Переводят в динатриевую соль с помощью 2 эквивалентов 0,1-н. натрового щелока, после чего осуществляют сублимационную сушку из воды. Выход: 59%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%); Rf = 0,1. Пример 6.13 N- N  ,N ,N – бис-[O-(3-O-карбамоилметил- – бис-[O-(3-O-карбамоилметил-  -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилинИсходное соединение: 60 мг (0,19 ммоль) углевода примера 1.18. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:3:0,3. Остаток осаждают из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира, после чего отсасывают и продукт подвергают сублимационной сушке из смеси воды и диоксана в соотношении 1:1. Выход: 36%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,46; т.п.: 190oC (разл.). Пример 6.14 N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-аланил}-батрацилинИсходное соединение: 100 мг (0,39 ммоль) п-аминофенил-  -L- фукозид.
Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2 – 15:4:0,5. Остаток осаждают из диметилформамида с помощью диэтилового эфира и отсасывают. Выход: 48%. Т.п.: 195 – 198oC.
Пример 6.15 -L- фукозид.
Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2 – 15:4:0,5. Остаток осаждают из диметилформамида с помощью диэтилового эфира и отсасывают. Выход: 48%. Т.п.: 195 – 198oC.
Пример 6.15N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -L-рамнозил)-4-гидрокси- фениламино-тиокарбонил] -лизил-D-аланил}-батрацилин -L-рамнозил)-4-гидрокси- фениламино-тиокарбонил] -лизил-D-аланил}-батрацилинИсходное соединение: 158 мг (0,61 ммоль) углевода примера 1.21. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:3:0,3-15:4:0,5. Остаток лиофилизуют из смеси воды и диоксана. Выход: 87%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4: 0,5; Rf = 0,25. Пример 6.16 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -L-рамнозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилина -L-рамнозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилинаИсходное соединение: 200 мг (0,64 ммоль) углевода примера 1.22. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5-15:8:0,8-15: 10: 1. Остаток дигерируют диэтиловым эфиром, после чего продукт подвергают сублимационной сушке из смеси воды и диоксана в соотношении 1:1. Аналогично примеру 6.1 из различных пептидных конъюгатов батрацилина, содержащих у концевой амино-группы полностью деблокированный лизиновый остаток, получают следующие гликоконъюгаты. Пример 6.17 Ди-натриевая соль N-{ N  ,N ,N – бис-{O-(3-O-карбоксиметил- – бис-{O-(3-O-карбоксиметил-  -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилина -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилинаИсходные соединения: 32 мг (0,1 ммоль) углевода примера 1.10, 32 мг (0,45 ммоль) ди-трифторацетата N-[лизил-глицил]- батрацилина примера 2.9. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:8:0,8-15:15:1,5. Остаток осаждают из смеси диметилформамида и метанола в соотношении 1:1 с помощью диэтилового эфира, после чего продукт подвергают сублимационной сушке из смеси воды и диоксана. Переводят в динатриевую соль с помощью 2 эквивалентов 0,1н. натрового щелока, после чего продукт подвергают сублимационной сушке из воды. Выход: 25%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:8:0,8; Rf = 0,19. Масс-спектр (бба): m/z = 1189 = M+1. Пример 6.18 N- { N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилин -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилинИсходные соединения: 60 мг (0,22 ммоль) углевода примера 1.2, 66 мг (0,1 ммоль) ди-трифторацетата N-[лизил-гли- цил]-батрацилина примера 2.9. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 90:10:1. Остаток осаждают из метанола с помощью диэтилового эфира, после чего продукт подвергают сублимационной сушке из смеси воды и диоксана. Выход: 68%. Тонкослойная хроматография: смесь дихлорметана, метанола и ледяной уксусной кислоты в соотношении 80:60:2; Rf=0,62 Пример 6.19 N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-лизил}-батрацилин -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-лизил}-батрацилин6.19. а) N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил- N -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил- N -флуоренил-9-метоксикарбонил)-лизил}- батрацилин -флуоренил-9-метоксикарбонил)-лизил}- батрацилинИсходные соединения: 297 мг (1 ммоль) п-аминофенил-  -L-фукозида, -L-фукозида,66 мг (0,1 ммоль) ди-трифторацетата N-[лизил-( N  -(флуоренил-9- метоксикарбонил)-лизил]-батрацилина примера 2,15, -(флуоренил-9- метоксикарбонил)-лизил]-батрацилина примера 2,15,206 мкл этилдиизопропиламина. Очистка путем двукратного осаждения из смеси дихлорметана и метанола в соотношении 1: 1 с помощью диэтилового эфира, после чего остаток на фильтре промывают диэтиловым эфиром. Выход: 89%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5; Rf=0,31. 6.19) N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-лизил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-лизил}-батрацилин515 мг (0,39) ммоль) соединения примера 6.19 а) растворяют в 5 мл диметилформамида и 5 мл пиперидина и перемешивают при 20oC в течение 30 минут. Реакционную смесь сгущают и остаток дигерируют диэтиловым эфиром. Отсасывают и остаток на фильтре подают в диметилформамид. После осаждения с помощью диэтилового эфира и последующей промывки остатка фильтрации получают 335 мг (78%) кристаллического целевого продукта. Масс-спектр (бба): m/z = 1100=M+1. Пример 6.20 N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-диаминопропионил}-батрацилин -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-диаминопропионил}-батрацилин6.20. a) N-{ N  ,N ,N – -бис-[O-(3-O-метил- – -бис-[O-(3-O-метил-  -L-фукозил)-4- гидрокси-фениламино-тиокарбонил] -лизил- N -L-фукозил)-4- гидрокси-фениламино-тиокарбонил] -лизил- N – -(флуоренил-9- метоксикарбонил)-диамино-пропионил}-батрацилин – -(флуоренил-9- метоксикарбонил)-диамино-пропионил}-батрацилинСинтез осуществляют аналогично примеру 6.19. Исходные соединения: 60 мг (0,22 ммоль) углевода примера 1.2, 100 мг (0,11 ммоль) ди-трифторацетата N-[лизил- N  – (флуоренил-9-метоксикарбонил)-диамино-пропионил]-батрацилина примера 2.16, – (флуоренил-9-метоксикарбонил)-диамино-пропионил]-батрацилина примера 2.16,76 мкл этилдиизопропиламина. Очистка путем двукратного осаждения из метанола с помощью диэтилового эфира, после чего остаток на фильтре промывают диэтиловым эфиром. Выход: 105 мг (73%). 6.20) N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-диаминопропионил}-батрацилин -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-диаминопропионил}-батрацилин103 мг (0,079 ммоль) соединения примера 6.20.а) аналогично примеру 6.19 деблокируют с помощью пиперидина. Очистку осуществляют путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:3:0,3-15:6:0,6. Продукт подвергают сублимационной сушке из смеси воды и диоксана. Выход: 21%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,32. Пример 6.21 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил- – L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил- диаминопропионил}-батрацилина – L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил- диаминопропионил}-батрацилинаДанное соединение получают аналогично примеру 6.20 через 2 стадии исходя из углевода примера 1.10 и пептидного конъюгата примера 2.16. От хроматографической очистки можно отказаться, так как побочные продукты можно удалять путем дигерирования метанолом и диэтиловым эфиром. Потом переводят в динатриевую соль с помощью 2 эквивалентов 0,1н. натрового щелока. Выход: 66% через 2 стадии. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 10:3:1,5: Rf = 0,3. Пример 6.22 N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-серил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-серил}-батрацилинИсходные соединения: 60 мг (0,22 ммоль) углевода примера 1.2, 76 мг (0,11 ммоль) ди-трифторацетата N-[лизил-серил]-батрацилина примера 2.10. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Остаток осаждают из смеси дихлорметана, метанола и диэтилового эфира. Выход: 26%. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1, Rf = 0,39. Пример 6.23 N-{ N  ,N ,N – бис[O-(3-O-метил- – бис[O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-серил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-серил}-батрацилинИсходные соединения: 60 мг (0,22 ммоль) углевода примера 1.2, 69 мг (0,11 ммоль) дигидробромида N-[лизил-O-серил]-батрацилина примера 2.11. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2. Остаток подвергают сублимационной сушке из смеси диоксана и воды. Выход: 29%. Тонкослойная хроматография% смесь ацетонитрила и воды в соотношении 10:1; Rf = 0,36. Пример 6.24 N- N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил}-батрацилинИсходные соединения: 80 мг (0,3 ммоль) углевода примера 1.2, 53 мг (0,14 ммоль) N-[лизил]-батрацилина примера 2.17. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:1:0,1-15:2:0,2. Остаток осаждают из смеси метанола и диэтилового эфира. Выход: 26%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2; Rf = 0,22. Пример 6.25 N- N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-батрацилин -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-батрацилинИсходные соединения: 60 мг (0,19 ммоль) углевода примера 1.10, 24 мг (0,063 ммоль) М-[лизил]-батрацилина примера 2.17. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2-15:4:0,5. Остаток подвергают сублимационной сушке из воды. Выход: 26%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,25. Пример 6.26 N-{ N  ,N ,N – бис-[O-(3,4-ди-O-метил- – бис-[O-(3,4-ди-O-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-батрацилинК раствору 79 мг (0,22 ммоль) соединения примера 1.31 в 10 мл смеси диоксана и воды в соотношении 1:1 при перемешивании добавляют 33,5 мкл (0,44 ммоль) тиофосгена. Через 10 минут сгущают в вакууме и остаток сушат в вакууме масляного насоса в течение часа. Полученный изотиоцианат растворяют в 10 мл абсолютного диметилформамида, после чего смешивают с 37,7 мг (0,1 ммоль) соединения примера 2.17 и 0,5 мл этилдиизопропиламина. Перемешивают при комнатной температуре в течение 16 часов, сгущают в вакууме и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 30:1-20:1-10:1. Получают 56,7 мг (53%) желтых кристаллов. Тонкослойная хроматография: смесь этил-ацетата и этанола в соотношении 2:1; Rf = 0,72; т.п.: 125oC (разл.). Пример 6.27 N-{ N  ,N ,N – бис-[-O-(3-O-метоксикарбонилметил- – бис-[-O-(3-O-метоксикарбонилметил-  -D-галактопиранозил)-4-гидрокси-фениламино-гиокарбонил]- лизил}-батрацилин -D-галактопиранозил)-4-гидрокси-фениламино-гиокарбонил]- лизил}-батрацилин75,5 мг (0,22 ммоль) соединения примера 1.42 подвергают описанному в примере 6.26 взаимодействию с 37,7 мг (0,1 ммоль) пептидного конъюгата примера 2.17. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси.дихлорметана и метанола в соотношении 30:1-20:1-10:1 получают 51,1 мг (44%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,80; т.п.: 176oC (разл.). Пример 6.28 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил}-батрацилина -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил}-батрацилина77,3 мг (0,22 ммоль) соединения примера 1.43 подвергают описанному в примере 6.26 взаимодействию с 37,7 мг (0,1 ммоль) пептидного конъюгата примера 2.17. В результате осаждения из смеси дихлорметана и метанола в соотношении 1: 1 с помощью диэтилового эфира получают 53 мг (47%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,75; т.п.: > 260oC (разл.). Пример 6.29 N-{ N  ,N ,N – бис-[O-(3-O-карбамоилметил- – бис-[O-(3-O-карбамоилметил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил}-батрацилин72,2 мг (0,22 ммоль) соединения примера 1.44 подвергают описанному в примере 6.26 взаимодействию с 37,7 мг (0,1 ммоль) пептидного конъюгата примера 2.17. Очищают путем осаждения из смеси дихлорметана и метанола в соотношении 1: 1 с помощью диэтилового эфира и получают 55,6 мг (48%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,09; т.п.: 206oC (разл.). Пример 6.30 N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-серил}-батрацилин -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-серил}-батрацилин62,8 мг (0,22 ммоль) соединения примера 1.25 подвергают описанному в примере 6.26 взаимодействию с 69,3 мг (0,1 ммоль) пептидного конъюгата примера 2.10. После сгущения в вакууме продукт подают в смесь дихлорметана и метанола в соотношении 1: 1, осаждают добавкой 15 мл диэтилового эфира и промывают небольшим количеством холодного как лед метанола. Получают 46 мг (41%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,12; т.п.: 190 – 191oC. Пример 6.31 N-{ N  ,N ,N – бис-[O-{ – бис-[O-{  -L-фукопиранозил)-4-гидрокси-фениламино- тиокарбонил]лизил-серил}-батрацилин -L-фукопиранозил)-4-гидрокси-фениламино- тиокарбонил]лизил-серил}-батрацилин56,2 мг (0,22 ммоль) п-аминофенил-  -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 69,3 мг (0,1 ммоль) пептидного конъюгата примера 2.10. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом этанола и осаждения из смеси метанола и дихлорметана в соотношении 1:1 с помощью диэтилового эфира получают 73,8 мг (70%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,15: т.п.: 123oC.
Пример 6.32 -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 69,3 мг (0,1 ммоль) пептидного конъюгата примера 2.10. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом этанола и осаждения из смеси метанола и дихлорметана в соотношении 1:1 с помощью диэтилового эфира получают 73,8 мг (70%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,15: т.п.: 123oC.
Пример 6.32N-{ N  ,N ,N – -бис-[O-(3,4-ди-O-метил- – -бис-[O-(3,4-ди-O-метил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-серил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-серил}-батрацилин79 мг (0,22 ммоль) соединения примера 1.31 подвергают описанному в примере 6.26 взаимодействию с 69,3 мг (0,1 ммоль) пептидного конъюгата примера 2.10. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом смеси этилацетата и этанола в соотношении 7: 1 получают 43,8 мг (38%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,31; т.п.: 176oC. Пример 6.33 N-{ N  ,N ,N – бис-[O-(3-O-метоксикарбонилметил- – бис-[O-(3-O-метоксикарбонилметил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-серил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-серил}-батрацилин75,5 мг (0,22 ммоль) соединения примера 1.42 подвергают описанному в примере 6.26 взаимодействию с 69,3 мг (0,1 ммоль) пептидного конъюгата примера 2.10. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом смеси этилацетата и этанола в соотношении 3: 1 получают 46,2 мг (37%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2: 1; Rf = 0,12; т. п.: 161oC. Пример 6.34 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-серил}- батрацилина -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-серил}- батрацилина77,3 мг (0,22 ммоль) соединения примера 1.43 подвергают описанному в примере 6.26 взаимодействию с 69,3 мг (0,1 ммоль) пептидного конъюгата примера 2.10 и очищают. Получают 39,2 мг (31%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,77; т.п.: 213 – 215oC (разл.). Пример 6.35 N-{ N  ,N ,N – бис-[O-(3-O-карбамоилметил- – бис-[O-(3-O-карбамоилметил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-серил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-серил}-батрацилин72,2 мг (0,22 ммоль) соединения примера 1.44 подвергают описанному в примере 6.26 взаимодействию с 69,3 мг (0,1 ммоль) пептидного конъюгата примера 2.10. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси этилацетата и этанола в соотношении 2:1 получают 66,1 мг (53%) желтых кристаллов. Тонкослойная хроматография: смесь этил-ацетата и этанола в соотношении 2:1; Rf = 0,14; т.п.: 192oC (разл.). Пример 6.36 N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -D-маннопиранозил)-4-гидpoкcи- фeнилaминo-тиокарбонил]-лизил-серил}-батрацилин -D-маннопиранозил)-4-гидpoкcи- фeнилaминo-тиокарбонил]-лизил-серил}-батрацилин62,8 мг (0,22 ммоль) соединения примера 1.40 подвергают описанному в примере 6.26 взаимодействию с 69,3 мг (0,1 ммоль) пептидного конъюгата примера 2.10 и очищают. Получают 48,9 мг (44 %) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,10; т. п.: 204oC. Пример 6.37 N-{ N  ,N ,N – бис-[O-(2,3-ди-O-метил- – бис-[O-(2,3-ди-O-метил-  -D-маннопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-серил}-батрацилин -D-маннопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-серил}-батрацилин66 мг (0,22 ммоль) соединения примера 1.41 подвергают описанному в примере 6.26 взаимодействию с 69,3 мг (0,1 ммоль) пептидного конъюгата примера 2.10. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, с потом смеси этилацетата и этанола в соотношении 7:1 получают 52 мг (45%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rа = 0,28; т.п.: 164-165oC. Пример 6.38 N-{ N  ,N ,N – биc-[O-(4-O-( – биc-[O-(4-O-(  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкoпиpaнoзил)-4-гидpoкcи- фениламино-тиокарбонил]-лизил-серил}-батрацилин -D-глюкoпиpaнoзил)-4-гидpoкcи- фениламино-тиокарбонил]-лизил-серил}-батрацилин95,4 мг (0,22 ммоль) соединения примера 1.56 подвергают описанному в примере 6.26 взаимодействию с 69,3 мг (0,1 ммоль) пептидного конъюгата примера 2.10. После сгущения в вакууме продукт интенсивно промывают 50 мл горячего метанола. Получают 61,6 мг (44%) желтых кристаллов. Тонкослойная хроматография: метанол: Rf = 0,32; т.п.: 222oC (разл.). Пример 6.39 N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-серил}-батрацилин -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-серил}-батрацилин56,2 мг (0,22 ммоль) п-аминофенил-  -L-1-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 62,6 мг (0,1 ммоль) пептидного конъюгата примера 2.11. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом этанола и осаждения остатка из смеси метанола и дихлорметана в соотношении 1:1 в присутствии диэтилового эфира получают 50,9 мг (48%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,14; т.п.: 133oC.
Пример 6.40 -L-1-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 62,6 мг (0,1 ммоль) пептидного конъюгата примера 2.11. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом этанола и осаждения остатка из смеси метанола и дихлорметана в соотношении 1:1 в присутствии диэтилового эфира получают 50,9 мг (48%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,14; т.п.: 133oC.
Пример 6.40N-{ N  ,N ,N – бис-[O-(3,4-ди-O-метил- – бис-[O-(3,4-ди-O-метил-  -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-серил}-батрацилин -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-D-серил}-батрацилин79 мг (0,22 ммоль) соединения примера 1.31 подвергают описанному в примере 6.26 взаимодействию с 62,6 мг (0,1 ммоль) пептидного конъюгата примера 2.11. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом смеси этилацетата и этанола в соотношении 5: 1 получают 53,8 мг (47%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,38: т.п.: 145 – 146oC. Пример 6.41 N-{ N  ,N ,N – бис-[O-(3-O-метоксикарбонилметил- – бис-[O-(3-O-метоксикарбонилметил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-серил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-серил}-батрацилин75,5 мг (0,22 ммоль) соединения примера 1.42 подвергают описанному в примере 6.26 взаимодействию с 62,6 мг (0,1 ммоль) пептидного конъюгата примера 2.11. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом смеси этилацетата и этанола в соотношении 3:1 получают 52,4 мг (42%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2: 1: Rf = 0,12; т.п.: 168oC. Пример 6.42 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-серил}- батрацилина -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-серил}- батрацилина77,3 мг (0,22 ммоль) соединения примера 1.43 подвергают описанному в примере 6.26 взаимодействию с 62,6 мг (0,1 ммоль) пептидного конъюгата примера 2.11 и очищают. Получают 69,2 мг (55%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf= 0,71; т.п.: 214 – 216oC (разл.). Пример 6.43 N-{ N  ,N ,N – бис-[O-(3-O-карбамоилметил- – бис-[O-(3-O-карбамоилметил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-серил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-серил}-батрацилин72,2 мг (0,22 ммоль) соединения примера 1.44 подвергают описанному в примере 6.26 взаимодействию с 62,6 мг (0,1 ммоль) пептидного конъюгата примера 2.11. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси этилацетата и этанола в соотношении 2: 1 получают 46,4 мг (38%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf= 0,10: т.п.: 173oC. Пример 6.44 N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -L-фукопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аспарагил}-батрацилин -L-фукопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аспарагил}-батрацилин56,2 мг (0,22 ммоль) п-аминофенил-  -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 72,1 мг (0,1 ммоль) пептидного конъюгата примера 2.7. Продукт очищают путем осаждения из смеси метанола и дихлорметана в соотношении 1: 1 в присутствии диэтилового эфира. Получают 69,4 мг (64%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,14; т.п.: 185- 187oC.
Пример 6.45 -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 72,1 мг (0,1 ммоль) пептидного конъюгата примера 2.7. Продукт очищают путем осаждения из смеси метанола и дихлорметана в соотношении 1: 1 в присутствии диэтилового эфира. Получают 69,4 мг (64%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,14; т.п.: 185- 187oC.
Пример 6.45N-{ N  ,N ,N – бис-[O-(3,4-ди-O-метил- – бис-[O-(3,4-ди-O-метил-  -галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аспарагил}-батрацилин -галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аспарагил}-батрацилин79 мг (0,22 ммоль) соединения примера 1.31 подвергают описанному в примере 6.26 взаимодействию с 72,1 мг (0,1 ммоль) пептидного конъюгата примера 2.7. В результате очистки путем флеш- хроматографии с применением в качестве элюента сначала смеси этилацетата и уксусной кислоты в соотношении 200: 1, а потом смеси этилацетата и этанола в соотношении 3:1 получают 99,5 мг (85%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,59; т.п.: 149oC (разл.). Пример 6.46 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -D-галактопиранозил)-4-гидрокси-фениламино-гиокарбонил]-лизил- D-аспарагил}-батрацилина -D-галактопиранозил)-4-гидрокси-фениламино-гиокарбонил]-лизил- D-аспарагил}-батрацилина77,3 мг (0,22 ммоль) соединения примера 1.43 подвергают описанному в примере 6.26 взаимодействию с 72,1 мг (0,1 ммоль) пептидного конъюгата примера 2.7. В результате очистки путем осаждения из смеси метанола и дихлорметана в соотношении 1: 1 с помощью диэтилового эфира получают 93,4 мг (73%) желтых кристаллов. Т.п.: 220oC (разл.). Пример 6.47 N-{ N  ,N ,N – бис-[O-(3-O-карбамоилметил- – бис-[O-(3-O-карбамоилметил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аспарагил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аспарагил}-батрацилин72,2 мг (0,22 ммоль) соединения примера 1.44 подвергают описанному в примере 6.26 взаимодействию с 72,1 мг (0,1 ммоль) пептидного конъюгата примера 2.7. В результате очистки путем флеш- хроматографии с применением в качестве элюента сначала смеси этилацетата, этанола и уксусной кислоты в соотношении 400:100:2 получают 69,7 мг (57%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,11; т.п.: 111oC. Пример 6.48 Натриевая соль N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -L-фукопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аспарагил}-батрацилина -L-фукопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аспарагил}-батрацилина21,7 мг (20 ммоль) соединения примера 6.44 суспендируют в 10 мл воды. К суспензии при перемешивании прикапывают 0,05н. натровый щелок до того, как получается прозрачный раствор со значением pH < 10. Раствор фильтруют, лиофилизуют и получают 20,6 мг (93%) желтого аморфного твердого вещества. Пример 6.49 Натриевая соль N-{ N  ,N ,N – бис-[O-(3,4-ди-O-метил- – бис-[O-(3,4-ди-O-метил-  -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аспарагил}-батрацилина -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аспарагил}-батрацилина23,5 мг (20 мкмоль) соединения примера 6.45 подвергают описанной в примере 6.48 реакции и перерабатывают. Получают 23,9 мг (100%) желтого аморфного твердого вещества. Пример 6.50 Три-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аспарагил}-батрацилина -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аспарагил}-батрацилина25,6 мг (20 мкмоль) соединения примера 6.46 растворяют в 10 мл воды и к раствору при перемешивании прикапывают 0,05-н. натровый щелок до достижения значения pH 8. Раствор фильтруют, лиофилизуют и получают 24 мг (92%) желтого аморфного твердого вещества. Пример 6.51 Натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбамоилметил- – бис-[O-(3-O-карбамоилметил-  -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аспарагил}-батрацилина -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аспарагил}-батрацилина24,7 мг (20 мкмоль) соединения примера 6.47 подвергают описанной в примере 6.48 реакции и перерабатывают. Получают 23,0 мг (92%) желтого аморфного твердого вещества. Пример 6.52 N-{ N  ,N ,N – бис-[O- – бис-[O-  -L-фукопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-глутамил}-батрацилин -L-фукопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-глутамил}-батрацилин56,2 мг (0,22 ммоль) п-аминофенил-  -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 66,8 мг (0,1 ммоль) пептидного конъюгата примера 2.8. В результате очистки путем флеш- хроматографии с применением в качестве элюента сначала смеси этилацетата и уксусной кислоты в соотношении 200: 1, а потом смеси этилацетата, этанола и уксусной кислоты в соотношении -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 66,8 мг (0,1 ммоль) пептидного конъюгата примера 2.8. В результате очистки путем флеш- хроматографии с применением в качестве элюента сначала смеси этилацетата и уксусной кислоты в соотношении 200: 1, а потом смеси этилацетата, этанола и уксусной кислоты в соотношении10: 1: 0,1 получают 39,5 мг (36%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,09; т.п.: 138 – 139oC (разл.). Пример 6.53 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -D-галактопиранозил)-4-гидрокси-фенйламино-тиокарбонил]-лизил-D- глутамил}-батрацилина -D-галактопиранозил)-4-гидрокси-фенйламино-тиокарбонил]-лизил-D- глутамил}-батрацилина77,3 мг (0,22 ммоль) соединения примера 1.43 подвергают описанному в примере 6.26 взаимодействию с 66,8 мг (0,1 ммоль) пептидного конъюгата примера 2.8. В результате очистки получают 97,4 мг (75%) желтых кристаллов, т. п.: 180oC (разл.). Пример 6.54 Три-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-глутамил}- батрацилина -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-глутамил}- батрацилина25,6 мг (20 мкмоль) соединения примера 6.53 подвергают описанной в примере 6.50 реакции и перерабатывают. В результате очистки получают 24,3 мг (92%) желтого аморфного твердого вещества. [  ]20= +20,0 ]20= +20,0 (с = 0,26/H2O).
Пример 6.55 (с = 0,26/H2O).
Пример 6.55N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-глицил}-батрацилин -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-глицил}-батрацилин56,2 мг (0,22 ммоль) п-аминофенил-  -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 66,2 мг (0,1 ммоль) пептидного конюгата примера 2.9. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом этанола получают 62,2 мг (60 %) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,12; т.п.: 176oC.
Пример 6.56 -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 66,2 мг (0,1 ммоль) пептидного конюгата примера 2.9. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом этанола получают 62,2 мг (60 %) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,12; т.п.: 176oC.
Пример 6.56N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -D-галактопиранозил)-4-гидpoкcи-фeнилaминo-тиокарбонил]-лизил- глицил}-батрацилин -D-галактопиранозил)-4-гидpoкcи-фeнилaминo-тиокарбонил]-лизил- глицил}-батрацилин62,8 мг (0,22 ммоль) соединения примера 1.25 подвергают описанному в примере 6.26 взаимодействию с 66,2 мг (0,1 ммоль) пептидного конюгата примера 2.9. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси этилацетата и этанола в соотношении 10:1-2:1 получают 56,2 мг (52%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,22; т.п.: 197oC. Пример 6.57 N-{ N  ,N ,N – бис-[O-(3,4-ди-O-метил- – бис-[O-(3,4-ди-O-метил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилин79 мг (0,22 ммоль) соединения примера 1.31 подвергают описанному в примере 6.26 взаимодействию с 66,2 мг (0,1 ммоль) пептидного конюгата примера 2.9. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси этилацетата и этанола в соотношении 10:1  3:1 получают 26,2 мг (23%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,39; т.п.: 209oC.
Пример 6.58 3:1 получают 26,2 мг (23%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,39; т.п.: 209oC.
Пример 6.58N-{ N  ,N ,N – бис-[O-(3-O-метоксикарбонилметил- – бис-[O-(3-O-метоксикарбонилметил-  -D-галактогпиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-глицил}-батрацилин -D-галактогпиранозил)-4-гидрокси-фениламино-тиокарбонил]- лизил-глицил}-батрацилин75,5 мг (0,22 ммоль) соединения примера 1.42 подвергают описанному в примере 6.26 взаимодействию с 66,2 мг (0,1 ммоль) пептидного конюгата примера 2.9. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси этилацетата и этанола в соотношении 10:1 получают 22 мг (18%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,06; т.п.: 194 – 195oC (разл.). Пример 6.59 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-глицил}- батрацилина -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-глицил}- батрацилина77,3 мг (0,22 ммоль) соединения примера 1.43 подвергают описанному в примере 6.26 взаимодействию с 66,2 мг (0,1 ммоль) пептидного конюгата примера 2.9. После сгущения в вакууме продукт интенсивно промывают метанолом, дихлорметаном и диэтиловым эфиром. Получают 86,8 мг (71%) желтых кристаллов. Т.п.: 230 – 232oC (разл.). Пример 6.60 N-{ N  ,N ,N – бис-[O-(3-O-карбамоилметил- – бис-[O-(3-O-карбамоилметил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилин72,2 мг (0,22 ммоль) соединения примера 1.44 подвергают описанному в примере 6.26 взаимодействию с 66,2 мг (0,1 ммоль) пептидного конюгата примера 2.9. После сгущения в вакууме продукт промывают метанолом, дихлорметаном и диэтиловым эфиром. Получают 40,9 мг (35%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,05; т.п.: 214-216oC(разл.). Пример 6.61 N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -D-маннопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилин -D-маннопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилин62,8 мг (0,22 ммоль) соединения примера 1.40 подвергают описанному в примере 6.26 взаимодействию с 66,2 мг (0,1 ммоль) пептидного конюгата примера 2.9. В результате очис тки путем флеш- хроматографии с применением в качестве элюента смеси этилацетата и этанола в соотношении 10:1-2:1 получают 72,2 мг (66%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,18; т.п.: 175oC. Пример 6.62 N-( N  ,N ,N – бис-[O-(2,3-ди-O-метил- – бис-[O-(2,3-ди-O-метил-  -D-маннопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилин -D-маннопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-глицил}-батрацилин66 мг (0,22 ммоль) соединения примера 1.41 подвергают описанному в примере 6.26 взаимодействию с 66,2 мг (0,1 ммоль) пептидного конюгата примера 2.9. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси этилацетата и этанола в соотношении 10:1  3:1 получают 66,6 мг (60%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,41; т.п.: 173oC.
Пример 6.63 3:1 получают 66,6 мг (60%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,41; т.п.: 173oC.
Пример 6.63N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -L-фукопиранозил)-4-1-гидрокси-фениламино- тиокарбонил]-лизил-D-треонил}-батрацилин -L-фукопиранозил)-4-1-гидрокси-фениламино- тиокарбонил]-лизил-D-треонил}-батрацилин56,2 мг (0,22 ммоль) п-аминофенил-  -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 64 мг (0,1 ммоль) пептидного конюгата примера 2.12. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом этанола и осаждения продукта из смеси метанола и дихлорметана в соотношении 1:1 с помощью диэтилового эфира получают 30,5 мг (28%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,10; т.п.: 172oC.
Пример 6.64 -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 64 мг (0,1 ммоль) пептидного конюгата примера 2.12. В результате очистки путем флеш-хроматографии с применением в качестве элюента сначала этилацетата, а потом этанола и осаждения продукта из смеси метанола и дихлорметана в соотношении 1:1 с помощью диэтилового эфира получают 30,5 мг (28%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,10; т.п.: 172oC.
Пример 6.64N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -D-галактопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси-фениламино- тиокарбонил]-лизил-D-аланил}-батрацилин59,7 мг (0,22 ммоль) соединения примера 1.23 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10:1-1:1 получают 68,3 мг (64%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1:1; Rf = 0,49; т.п.: 222 – 224oC (разл). Пример 6.65 N-{ N  ,N ,N – бис-[O-(2-O-метил- – бис-[O-(2-O-метил-  -D-галактопиранозил)-4-1-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-1-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин62,8 мг (0,22 ммоль) соединения примера 1.24 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем осаждения из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира получают 69,6 мг (63 %) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,24; т.п.: 208oC (разл). Пример 6.66 N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин62,8 мг (0,22 ммоль) соединения примера 1.25 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 15:1-10:1-5:1 получают 94,3 мг (85 %) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,16; т.п.: 212oC (разл). Пример 6.67 N-{ N  ,N ,N – бис-[O-(4-O-метил- – бис-[O-(4-O-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин62,8 мг (0,22 ммоль) соединения примера 1.26 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 15:1-10:1-5:1 получают 52,6 мг (48%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола: f = 0,88; т.п.: 192oC (разл). Пример 6.68 N-{ N  ,N ,N – бис-[O-(6-O-метил- – бис-[O-(6-O-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин62,8 мг (0,22 ммоль) соединения примера 1.27 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате осаждения из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира получают 96,7 мг (88%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1: Rf = 0,04; т.п.: 210oC (разл.). Пример 6.69 N-{ N  ,N ,N – бис-[O-(2,3-ди-O-метил- – бис-[O-(2,3-ди-O-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин65,9 мг (0,22 ммоль) соединения примера 1.28 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 20:1 получают 57,4 мг (51%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,40; т.п.: 148oC (разл.). Пример 6.70 N-{ N  ,N ,N – биc-[O-(2,4-ди-O-метил- – биc-[O-(2,4-ди-O-метил-  -D-гaлaктoпиpaнoзил)-4- гидpoкcифениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-гaлaктoпиpaнoзил)-4- гидpoкcифениламино-тиокарбонил]-лизил-D-аланил}-батрацилин65,9 мг (0,22 ммоль) соединения примера 1.29 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 20:1-15:1-10:1 получают 74,2 мг (65%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,40; т.п.: 140oC (разл.). Пример 6.71 N-{ N  ,N ,N – бис-[O-(2,6-ди-O-метил- – бис-[O-(2,6-ди-O-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин65,9 мг (0,22 ммоль) соединения примера 1.30 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 20:1-15:1 получают 43,9 мг (40%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,43; т.п.: 229oC (разл.). Пример 9.72 N-{ N  ,N ,N – бис-[O-(3,4-ди-O-метил- – бис-[O-(3,4-ди-O-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-гиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-гиокарбонил]-лизил-D-аланил}-батрацилин79 мг (6,22 ммоль) соединения примера 1.31 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10:1 получают 66,2 мг (59%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3: 0,2; Rf = 0,39; т.п.: 184oC. Пример 6.73 N-{ N  ,N ,N – бис-[O-(3,6-ди-O-метил- – бис-[O-(3,6-ди-O-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин65,9 мг (0,22 ммоль) соединения примера 1.32 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 15:1  10:1 получают 57,1 мг (50%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,42; т.п.: 190oC (разл.).
Пример 6.74 10:1 получают 57,1 мг (50%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,42; т.п.: 190oC (разл.).
Пример 6.74N-{ N  ,N ,N – бис-[O-(4,6-ди-O-метил- – бис-[O-(4,6-ди-O-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-гиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-гиокарбонил]-лизил-D-аланил}-батрацилин79 мг (0,22 ммоль) соединения примера 1.33 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 20:1-10:1-5:1 получают 47,0 мг (42%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,39; т.п.: 169oC. Пример 6.75 N-{ N  ,N ,N – бис-[O-(2,3,4-три-O-метил- – бис-[O-(2,3,4-три-O-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин69 мг (0,22 ммоль) соединения примера 1.34 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 30:1 получают 83,8 мг (72%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10:1; Rf = 0,36; т.п.: 165oC (разл.). Пример 6.76 N-{ N  ,N ,N – бис-[O-(2,3,6-три-O-метил- – бис-[O-(2,3,6-три-O-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин69 мг (6,22 ммоль) соединения примера 1.35 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. Продукт очищают путем осаждения из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира и получают 105 мг (91%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,48; т.п.: 194oC (разл.). Пример 6.77 N-{ N  ,N ,N – бис-[O-(2,4,6-три-O-метил- – бис-[O-(2,4,6-три-O-метил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин69 мг (0,22 ммоль) соединения примера 1.36 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 30:1-10:1 получают 67 мг (58%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,54: т.п.: 228oC (разл.). Пример 6.78 N-{ N  ,N ,N – бис-[О-(3,4,6-три-O-метил- – бис-[О-(3,4,6-три-O-метил-  -D-галактопиранозил)- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин69 мг (0,22 ммоль) соединения примера 1.37 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. Продукт очищают путем осаждения из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира и получают 109,3 мг (94%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,52; т.п.: 180oC (разл.). Пример 6.79 N-{ N  ,N ,N – бис-[O-(2,3,4,6-тетра-O-метил- – бис-[O-(2,3,4,6-тетра-O-метил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин69 мг (0,22 ммоль) соединения примера 1.38 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. Продукт очищают путем осаждения из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира и получают 99,2 мг (84%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10:1; Rf = 0,73; т.п.: 188oC (разл.). Пример 6.80 N-{ N  ,N ,N – -бис-[O-(3-O-метоксикарбонилметил- – -бис-[O-(3-O-метоксикарбонилметил-  -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аланил}-батрацилин -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D- аланил}-батрацилин75,5 мг (0,22 ммоль) соединения примера 1.42 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. Продукт очищают путем осаждения из смеси дихлорметана и метанола в соотношении 1: 1 с помощью диэтилового эфира и получают 22 мг (18%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,33; т.п.: 194 – 195oC (разл.). Пример 6.81 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(3-Oкарбоксиметил- – бис-[O-(3-Oкарбоксиметил-  -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил- D-аланил}-батрацилина -D-галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил- D-аланил}-батрацилина77,3 мг (0,22 ммоль) соединения примера 1.43 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. После очистки получают 99,7 мг (81%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,80: т.п.: 230oC (разл.). Пример 6.82 N-{ N  ,N ,N – бис-[O-(3-O-карбамоилметил- – бис-[O-(3-O-карбамоилметил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин72,2 мг (0,22 ммоль) соединения примера 1.44 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 7:1 получают 29,4 мг (25%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 3:1; Rf = 0,23; т.п.: 201 – 202oC. Пример 6.83 N-{ N  ,N ,N – бис-[O-(3,4-дидесокси- – бис-[O-(3,4-дидесокси-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин52,6 мг (0,22 ммоль) соединения примера 1.52 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 17: 1 получают 38,8 мг (37%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rf = 0,40; т.п.: 175oC. Пример 6.84 N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -D-маннопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-маннопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин59,7 мг (0,22 ммоль) соединения примера 1.39 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10:1  1:1 получают 52 мг (48%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1:1; Rf = 0,19; т.п.: 196oC.
Пример 6.85 1:1 получают 52 мг (48%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1:1; Rf = 0,19; т.п.: 196oC.
Пример 6.85N-{ N  ,N ,N – биc-[O-(3,4-ди-O-метил- – биc-[O-(3,4-ди-O-метил-  -D-галактопиранозил)-4- гидpoкcи-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-галактопиранозил)-4- гидpoкcи-фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин79 мг (0,22 ммоль) соединения примера 1.31 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.2. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10:1 получают 77,6 мг (69%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 15:3:0,2; Rа = 0,33; т.п.: 186oC. Пример 6.86 N-{ N  ,N ,N – бис-[O-(4-O-( – бис-[O-(4-O-(  -D-галактопиранозил)- -D-галактопиранозил)-  -D- глюкопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилин -D- глюкопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилин95,4 мг (0,22 ммоль) соединения примера 1.56 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. После сгущения в вакууме остаток интенсивно промывают 50 мл горячего метанола. Получают 102,8 мг (73%) желтых кристаллов. Тонкослойная хроматография: метанол; Rf = 0,27; т.п.: 225 – 226oC (разл.). Пример 6.87 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(4-O-(3′-сульфат- – бис-[O-(4-O-(3′-сульфат-  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилина -D-глюкопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- батрацилина117,8 мг (0,22 ммоль) соединения примера 1.57 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. Продукт очищают путем осаждения из смеси дихлорметана и метанола в соотношении 1: 1 с помощью диэтилового эфира и получают 152,8 мг (95%) желтых кристаллов. Т.п.: 232oC (разл.). Пример 6.88 N-{ N  ,N ,N – бис-[O-(4-O-(3′-O-метил- – бис-[O-(4-O-(3′-O-метил-  -D-галактопиранозил)- -D-галактопиранозил)-  -D-глюкопиранозил)-4-гидрохси-фениламино-тиокарбонил]-лизил- D-аланил}-батрацилин -D-глюкопиранозил)-4-гидрохси-фениламино-тиокарбонил]-лизил- D-аланил}-батрацилин98,4 мг (0,22 ммоль) соединения примера 1.58 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. Продукт очищают путем осаждения из смеси дихлорметана и метанола в соотношении 1: 1 с помощью диэтилового эфира и получают 118,2 мг (83%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 1:1; Rf = 0,58; т.п.: 221oC (разл.). Пример 6.89 N-{ N  ,N ,N – бис-[O-(2-O-метил-4-O-(3′-O-метил- – бис-[O-(2-O-метил-4-O-(3′-O-метил-  -D- галактопиранозил)- -D- галактопиранозил)-  -D-глюкопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин -D-глюкопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил}-батрацилин101,5 мг (0,22 ммоль) соединения примера 1.59 подвергают описанному в примере 6.26 взаимодействию с 67,7 мг (0,1 ммоль) пептидного конюгата примера 2.13. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 15:1-10:1-5:1 получают 101,3 мг (70%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 2:1; Rf = 0,58; т.п.: 233oC (разл.). Примеры 7.1 – 7.13 Общая формула 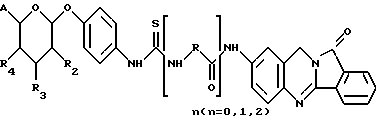 Исходя из других конъюгатов аминокислоты или пептидных конъюгатов батрацилина или исходя из батрацилина аналогично примеру 4.1.а) получают следующие гликоконъюгаты. Пример 7.1 N-{ N-[O-(3-O-метил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-D-аланил}-батрацилин -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-D-аланил}-батрацилинИсходные соединения: углевод примера 1.2, конъюгат аминокислоты примера 2.3. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:1:0,1. Продукт подвергают сублимационной сушке из смеси диоксана и воды. Выход: 42%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2; Rf = 0,31. Пример 7.2 Натриевая соль М-{N-[O-(3-O-карбоксиметил-  -L- фукозил)-4-гидрокси-фениламино-тиокарбонил]-D-аланил}- батрацилина -L- фукозил)-4-гидрокси-фениламино-тиокарбонил]-D-аланил}- батрацилинаИсходные соединения: углевод примера 1.10, конъюгат аминокислоты примера 2.3. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:3:0,3. Продукт подвергают сублимационной сушке из смеси диоксана и воды, после чего переводят в натриевую соль с помощью 0,1н. натрового щелока. Выход: 43%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5; Rf = 0,14. Пример 7,3 N-{N-[O-(  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-серил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-серил-D-аланил}-батрацилинИсходные соединения: п-аминофенил-  -L-фукозид, -L-фукозид,конъюгат аминокислоты примера 2.18. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:3:0,3. Продукт подвергают сублимационной сушке из смеси диоксана и воды. Выход: 93%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:3:0,3; Rf = 0,28. Масс-спектр (бба): m/z = 705 =M+1. Пример 7.4 N-{ N-[O-  -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]- D-аланил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]- D-аланил-D-аланил}-батрацилинИсходные соединения: п-аминофенил-  -L-фукозид, -L-фукозид,конъюгат аминокислоты примера 2.19. Очистка путем дигерирования метанолом и осаждения из смеси метанола и дихлорметана с помощью диэтилового эфира. Выход: 65%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,78. Пример 7.5 N-{ N-[O-(  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-глутамил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-глутамил-D-аланил}-батрацилинИсходные соединения: п-аминофенил-  -L-фукозид, -L-фукозид,конъюгат аминокислоты примера 2.20. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5-15:6:0,6. Продукт подвергают сублимационной сушке из смеси диоксана и воды. Выход: 92%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:8:0,8; Rf = 0,55. Пример 7.6 N-[O-(3-O-карбоксиметил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-батрацилин -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-батрацилин250 мг (1 ммоль) батрацилина растворяют в 50 мл диоксана, к раствору добавляют 184 мкл тиофосгена и перемешивают при 20oC в течение 2 часов. Сгущают, дигерируют с диэтиловым эфиром и фильтруют. Остаток на фильтре сушат в высоком вакууме в течение 16 часов, после чего подают в 30 мл диметилформамида. К смеси добавляют 312 мг (1 ммоль) углевода примера 1.10 и 500 мкл этилдиизопропиламина, после чего обрабатывают ультразвуком в течение 4 часов. Потом сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15: 2: 0,2-15: 6:0,6. Соответствующие фракции сгущают и лиофилизуют из смеси диоксана и воды. Выход: 363 мг (60%). Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:6:0,6; Rf = 0,38. Пример 7.7 N-[O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-батрацилин -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-батрацилинСоединение получают аналогично примеру 7.6 исходя из батрацилина и углевода примера 1.2. Продукт очищают путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15: 1:0,1. Выход: 58%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2; Rf = 0,39. Масс-спектр: m/z = 561 = M+1. Пример 7.8 N-{ N-[O-(3,4-ди-O-метил-  -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-D-аланил}-батрацилин -D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-D-аланил}-батрацилин37,5 мг (0,11 ммоль) соединения примера 1.31 подвергают описанному в примере 6.26 взаимодействию с 32 мг (0,1 ммоль) пептидного конъюгата примера 2.3. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 30:1 получают 49,3 мг (75%) желтых кристаллов. Тонкослойная хроматография: смесь этилацетата и этанола в соотношении 2:1; Rf = 0,81; т.п.: 185oC (разл.). Пример 7.9 N-{ N-[O-(2,3,4-три-O-метил-  -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-D-аланил}-батрацилин -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-D-аланил}-батрацилин34,5 мг (0,11 ммоль) соединения примера 1.34 подвергают описанному в примере 6.26 взаимодействию с 32 мг (0,1 ммоль) пептидного конъюгата примера 2.3. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 40:1-15:1 получают 54,9 мг (81%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 20:1; Rf = 0,15; т.п.: 190oC (разл.). Пример 7.10 N-{ N-[O-(3-O-метоксикарбонилметил-  -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-D-аланил} -батрацилин -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-D-аланил} -батрацилин37,8 мг (0,11 ммоль) соединения примера 1.42 подвергают описанному в примере 6.26 взаимодействию с 32 мг (0,1 ммоль) пептидного конъюгата примера 2.3. В результате очистки путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 20:1-10:1 получают 44,3 мг (63%) желтых кристаллов. Тонкослойная хроматография: этанол: Rf = 0,85; т.п.: 195oC (разл.). Пример 7.11 Натриевая соль N-{N-[O-(3-O-карбоксиметил-  -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-D- аланил}-батрацилина -D- галактопиранозил)-4-гидрокси-фениламино-тиокарбонил]-D- аланил}-батрацилина38,6 мг (0,11 ммоль) соединения примера 1.43 подвергают описанному в примере 6.216 взаимодействию с 32 мг (0,1 ммоль) пептидного конъюгата примера 2.3. В результате очистки путем переосаждения из смеси дихлорметана и метанола в соотношении 1:1 получают 63,8 мг (89%) желтых кристаллов. Тонкослойная хроматография: этанол: Rf = 0,15; т.п.: 217oC (разл.). Пример 7.12 N-{ N-[O-(3-O-карбамоилметил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-D-аланил}-батрацилин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-D-аланил}-батрацилин37,8 мг (0,11 ммоль) соединения примера 1.44 подвергают описанному в примере 6.26 взаимодействию с 32 мг (0,1 ммоль) пептидного конъюгата примера 2.3. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 20:1-10:1-5:1 получают 20 мг (29%) желтых кристаллов. Тонкослойная хроматография: этанол: Rf = 0,15; т.п.: 184oC (разл.). Пример 7.13 N-{ N-[O-(  -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-D-аланил}-батрацилин -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-D-аланил}-батрацилин28,1 мг (0,11 ммоль) п-аминофенил-  -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 32 мг (0,1 ммоль) пептидного конъюгата примера 2.3. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси этилацетата и петролейного эфира в соотношении 2:1-5: 1 получают 49,8 мг (81%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,50; т.п.: 173oC.
Примеры 8.1 – 8.12 Общая формула -L-фукопиранозида подвергают описанному в примере 6.26 взаимодействию с 32 мг (0,1 ммоль) пептидного конъюгата примера 2.3. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси этилацетата и петролейного эфира в соотношении 2:1-5: 1 получают 49,8 мг (81%) желтых кристаллов. Тонкослойная хроматография: этанол; Rf = 0,50; т.п.: 173oC.
Примеры 8.1 – 8.12 Общая формула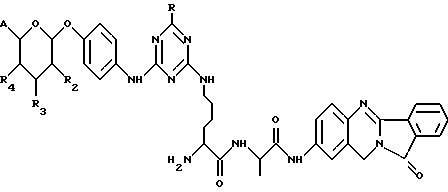 Пример 8.1 Трифторацетат N-{ N  – [2-хлор-4-[O-(3-O-метил- – [2-хлор-4-[O-(3-O-метил-  -L-фукозил)-4- гидрокси-фениламино]-триазин-6-ил]-лизил-D-аланил}-батрацилина -L-фукозил)-4- гидрокси-фениламино]-триазин-6-ил]-лизил-D-аланил}-батрацилина8.1.а) N-{ N  – [трет-бутоксикарбонил]- N – [трет-бутоксикарбонил]- N – [2-хлор-4-[O-(3-O-метил- – [2-хлор-4-[O-(3-O-метил- -L-фукозил)-4-гидрокси-фениламино]- триазин-6-ил]-лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино]- триазин-6-ил]-лизил-D-аланил}-батрацилин265 мг (0,98 ммоль) п-аминофенил-3-O-метил-  -L-фукозида примера 1.2 и 181 мг (0,98 ммоль) цианухлорида подают в 50 мл смеси диоксана и воды в соотношении 1: 1, охлаждают до -5oC, добавляют 83 мг бикарбоната натрия и перемешивают при данной температуре в течение 15 минут. Затем к смеси добавляют 538 мг (0,98 ммоль) N- N -L-фукозида примера 1.2 и 181 мг (0,98 ммоль) цианухлорида подают в 50 мл смеси диоксана и воды в соотношении 1: 1, охлаждают до -5oC, добавляют 83 мг бикарбоната натрия и перемешивают при данной температуре в течение 15 минут. Затем к смеси добавляют 538 мг (0,98 ммоль) N- N – трет-бутоксикарбонил)-лизил-D-аланил]- батрацилина примера 2.4, растворенного в 14 мл диметилформамида, и 83 мг бикарбоната натрия и дают нагреваться до комнатной температуры. После перемешивания при 20oC в течение 16 часов сгущают и остаток обрабатывают водой. Отсасывают, остаток на фильтре сушат в высоком вакууме и получают 890 мг (96%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10:1; Rf = 0,26.
8.1) Трифторацетат N-{ N – трет-бутоксикарбонил)-лизил-D-аланил]- батрацилина примера 2.4, растворенного в 14 мл диметилформамида, и 83 мг бикарбоната натрия и дают нагреваться до комнатной температуры. После перемешивания при 20oC в течение 16 часов сгущают и остаток обрабатывают водой. Отсасывают, остаток на фильтре сушат в высоком вакууме и получают 890 мг (96%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10:1; Rf = 0,26.
8.1) Трифторацетат N-{ N – [2-хлор-4-[O-(3-O-метил- – [2-хлор-4-[O-(3-O-метил-  – L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]-лизил-D- аланил}-батрацилина – L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]-лизил-D- аланил}-батрацилина100 мг (0,11 ммоль) соединения примера 8.1.а) в смеси 5 мл безводной трифторуксусной кислоты и 5 мл дихлорметана перемешивают при 0oC в течение 30 минут. Сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15: 1,5: 0,15. Последующее осаждение из смеси метанола и диэтилового эфира приводит к получению 41 мг (95%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2; Rf = 0,26. Масс-спектр (бба): m/z = 829 = М+1. Пример 8.2 Трифторацетат N-{ N  – [4-гидроксиэтиламино-2-[O-(3-O- метил- – [4-гидроксиэтиламино-2-[O-(3-O- метил-  -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]- лизил-D-аланил}-батрацилина -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]- лизил-D-аланил}-батрацилина8.2. а) N-{ N  – [трет-бутоксикарбонил]- N – [трет-бутоксикарбонил]- N – (4-гидроксиэтиламино-2-[O-(3-O-метил- – (4-гидроксиэтиламино-2-[O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино]- триазин-6-ил]-лизил-D-аланил}-батрацилин -L-фукозил)-4-гидрокси-фениламино]- триазин-6-ил]-лизил-D-аланил}-батрацилин100 мг (0,11 ммоль) соединения примера 8.1.а) растворяют в 3 мл диоксана. К раствору добавляют 60 мг карбоната калия и 6,5 мл 0,1н. раствора этаноламина в диоксане и перемешивают при 80oC в течение 18 часов. Потом сгущают и остаток перемешивают с водой. Фильтруют и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:1: 0,1. После сгущения соответствующих фракций сушат в высоком вакууме и получают 83 мг (80%) целевого соединения. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2; Rf = 0,23. 8.2) Трифторацетат N-{ N  – [4-гидроксиэтиламино-2-[O-(3-O- метил- – [4-гидроксиэтиламино-2-[O-(3-O- метил-  -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]-лизил- D-аланил}-батрацилина -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]-лизил- D-аланил}-батрацилина67 мг (0,07 ммоль) соединения примера 8.2.а) деблокируют аналогично примеру 8.1. После очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2 осаждают из смеси метанола и диэтилового эфира. Получают 90% целевого соединения. Масс- спектр (бба): m/z = 854 = М+1. Аналогично примеру 8.1 получают следующие гликоконъюгаты: Пример 8.3 Трифторацетат N-{ N  – { 2-xлop-4-[O-(2-O-мeтил- – { 2-xлop-4-[O-(2-O-мeтил-  -L-фукозил)-4- гидpoкcи-фениламино]-триазин-6-ил]-лизил-D-аланил}-батрацилина -L-фукозил)-4- гидpoкcи-фениламино]-триазин-6-ил]-лизил-D-аланил}-батрацилинаИсходное соединение: углевод примера 1.1. Выход: 76%. Масс-спектр (бба): m/z = 829 = М+1. Пример 8.4 Трифторацетат N-{ N  – [2-хлор-4-[O-( – [2-хлор-4-[O-(  -L-фукозил)-4-гидрокси- фениламино]-триазин-6-ил]-лизил-D-аланил}-батрацилина -L-фукозил)-4-гидрокси- фениламино]-триазин-6-ил]-лизил-D-аланил}-батрацилинаИсходное соединение: п-аминофенил-  -L-фукозид.
Выход: 36%. Масс-спектр (бба): m/z = 815 = М+1. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,: Rf = 0,44.
Пример 8.5 -L-фукозид.
Выход: 36%. Масс-спектр (бба): m/z = 815 = М+1. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,: Rf = 0,44.
Пример 8.5Трифторацетат N-{ N  – [2-хлор-4-[O-десокси- – [2-хлор-4-[O-десокси-  -L-фукозил)-гидрокси- фениламино]-триазин-6-ил]-лизил-D-аланил}-батрацилина -L-фукозил)-гидрокси- фениламино]-триазин-6-ил]-лизил-D-аланил}-батрацилинаИсходное соединение: углевод примера 1.6. Выход: 56%. Масс-спектр (бба): m/z = 799 = М+1. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5: 1:0,2; Rf = 0,54. Аналогично примерам 8.1.а), 8.2.а) и 8.2 из пептидного конъюгата батрацилина примера 2.4 или из получаемых соответствующим образом L-аланил-изомеров получают следующие гликоконъюгаты. Пример 8.6 Трифторацетат N-{ N  – [4-гидpoкcиэтилaминo-2-[O-(2- O-мeтил- – [4-гидpoкcиэтилaминo-2-[O-(2- O-мeтил-  -L-фукозил)-4-гидрокси-фениламино]-триазин-6- ил]-лизил-D-аланил}-батрацилина -L-фукозил)-4-гидрокси-фениламино]-триазин-6- ил]-лизил-D-аланил}-батрацилинаИсходное соединение: углевод примера 1.1. Выход: 78%. Масс-спектр (бба): m/z = 854 = М+1. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5; Rf = 0,33. Пример 8.7 Трифторацетат N-{ N  – [4-гидроксиэтиламино-2-[O-(4-O-метил- – [4-гидроксиэтиламино-2-[O-(4-O-метил-  -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]-лизил-D-аланил} – батрацилина -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]-лизил-D-аланил} – батрацилинаИсходное соединение: углевод примера 1.4. Выход: 38%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5; Rf = 0,4. Пример 8.8 Трифторацетат N-{ N  – [4-гидроксиэтиламино-2-[O-(3- десокси- – [4-гидроксиэтиламино-2-[O-(3- десокси-  -L-фукозил)-4-гидрокси-фениламино]-триазин-6- ил]-лизил-D-аланил}-батрацилина -L-фукозил)-4-гидрокси-фениламино]-триазин-6- ил]-лизил-D-аланил}-батрацилинаИсходное соединение: углевод примера 1.6. Выход: 77%. Масс-спектр (бба): m/z = 824 = М+1. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5: Rf = 0,37. Пример 8.9 Трифторацетат N-{ N  – (4-гидроксиэтиламино-2-[O- ( – (4-гидроксиэтиламино-2-[O- (  -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]-лизил-D- аланил}-батрацилина -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]-лизил-D- аланил}-батрацилинаИсходное соединение: п-аминофенил-  -L-фукозид.
Выход: 52%. Масс-спектр (бба): m/z = 840 = М+1.
Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5: Rf = 0,30.
Пример 8.10 -L-фукозид.
Выход: 52%. Масс-спектр (бба): m/z = 840 = М+1.
Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5: Rf = 0,30.
Пример 8.10Трифторацетат N-{ N  – [4-гидроксиэтиламино-2-[O-(3- O-метил- – [4-гидроксиэтиламино-2-[O-(3- O-метил-  -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]- лизил-аланил}-батрацилина -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]- лизил-аланил}-батрацилинаИсходное соединение: углевод примера 1.2. Выход: 88%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:3:0,3; Rf = 0,35. Пример 8.11 Трифторацетат N-{ N  – [4-гидроксиэтиламино-2-[O- (2-O-метил- – [4-гидроксиэтиламино-2-[O- (2-O-метил-  -L-фукозил)-4-гидрокси-фенилатлино]- триазин-6-ил]-лизил-аланил}-батрацилина -L-фукозил)-4-гидрокси-фенилатлино]- триазин-6-ил]-лизил-аланил}-батрацилинаИсходное соединение: углевод примера 1.1. Выход: 58%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5; Rf = 0,40. Пример 8.12 Трифторацетат N-{ N  – -гидроксиэтиламино-2-[O-метил- – -гидроксиэтиламино-2-[O-метил-  -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]- лизил-аланил}-батрацилина -L-фукозил)-4-гидрокси-фениламино]-триазин-6-ил]- лизил-аланил}-батрацилинаИсходное соединение: углевод примера 1.4. Выход: 66%. Масс-спектр (бба): m/z = 854 = М+1. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5; Rf = 0,37. Пример 9.1 Трифторацетат N-[D-аланил]-хинолона-а  9.1.а) N-[N-(трет-бутоксикарбонил)-D-аланил]-хинолон-а 3,6 г (19,2 ммоль) N-(трет-бутоксикарбонил)-D-аланина и 5,8 г (19,2 ммоль) 2-изобутокси-1-изобутокси-карбонил-1,2-дигидро- хинолина растворяют в 200 мл диметилформамида. После перемешивания при комнатной температуре в течение 8 часов к раствору добавляют 4 г (9,6 ммоль) хинолона-а и 3,3 мл этилдиизопропиламина, после чего реакционную смесь обрабатывают ультразвуком в течение 10 часов. Сгущают, остаток подают в дихлорметан и осаждают добавкой диэтилового эфира. Фильтруют, промывают диэтиловым эфиром, сушат в высоком вакууме и получают 4,58 г (81%) целевого продукта, которое подают на следующую стадию без дальнейшей очистки. 9.1) Трифторацетат М-[D-аланил]-хинолона-а 4,56 г (7,75 ммоль) соединения примера 9.1.а) растворяют в 50 мл дихлорметана и 50 мл безводной трифторуксусной кислоты при 0oC и перемешивают в течение часа при данной температуре. Сгущают, дополнительно перегоняют в присутствии дихлорметана и осаждают из метанола с помощью диэтилового эфира. Получают 4,07 г (87%) кристаллического целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,34. Пример 9.2 Трифторацетат N-[аланил]-хинолона-а  Синтез осуществляют аналогично синтезу изомера примера 9.1. Пример 9.3 Ди-трифторацетат N-[лизил-D-аланил]-хинолона-а 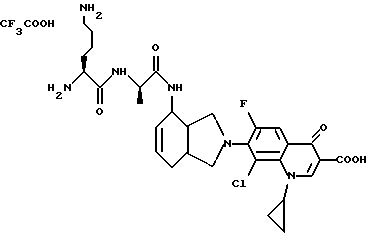 9.3.а) N-[ N  ,N ,N – бис-(трет-бутоксикарбонил)-лизил-D-аланил]- хинолон-а – бис-(трет-бутоксикарбонил)-лизил-D-аланил]- хинолон-а341 мг (0,984 ммоль) N  ,N ,N – бис-(трет-бутоксикарбонил)-лизина растворяют в 10 мл диметилформамида, после чего к раствору при 0oC добавляют 200 мг (1,48 ммоль) N-гидроксибензотриазола и 227 мг (1,18 ммоль) N-(3-диметил-аминопропил)-N-этилкарбодиимида в виде гидрохлорида. После перемешивания в течение 3 часов при 10oC к смеси добавляют 432 мг (0,82 ммоль) соединения примера 9.1 и перемешивают еще 2 часа при 20oC. Сгущают и остаток три раза перемешивают с водой, взятой в количестве по 50 мл. Затем остаток подают в дихлорметан и сушат над сульфатом натрия. В результате осаждения с помощью диэтилового эфира получают 516 мг (78%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10: 1; Rf = 0,55.
9.3) Ди-трифторацетат М-[лизил-D-аланил]-хинолона-а – бис-(трет-бутоксикарбонил)-лизина растворяют в 10 мл диметилформамида, после чего к раствору при 0oC добавляют 200 мг (1,48 ммоль) N-гидроксибензотриазола и 227 мг (1,18 ммоль) N-(3-диметил-аминопропил)-N-этилкарбодиимида в виде гидрохлорида. После перемешивания в течение 3 часов при 10oC к смеси добавляют 432 мг (0,82 ммоль) соединения примера 9.1 и перемешивают еще 2 часа при 20oC. Сгущают и остаток три раза перемешивают с водой, взятой в количестве по 50 мл. Затем остаток подают в дихлорметан и сушат над сульфатом натрия. В результате осаждения с помощью диэтилового эфира получают 516 мг (78%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10: 1; Rf = 0,55.
9.3) Ди-трифторацетат М-[лизил-D-аланил]-хинолона-а512 мг (0,63 ммоль) соединения примера 9.3.а) деблокируют аналогично примеру 9.1. Осаждают из этилацетата с помощью диэтилового эфира. Выход: 479 мг (90%). Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 10:3:1,5; Rf = 0,3. Пример 9.4 Ди-трифторацетат N-[лизил-аланил]-хинолона-а Синтез осуществляют аналогично синтезу изомера примера 9.3. Пример 9.5 N-[ N  – (трет-бутоксикарбонил)-лизил-D-аланил]-хинолон-а – (трет-бутоксикарбонил)-лизил-D-аланил]-хинолон-а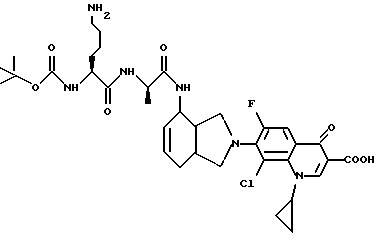 9.5. а) N-[ N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – (флуоренил-9- метоксикарбонил)-лизил-D-аланил]-хинолон-а – (флуоренил-9- метоксикарбонил)-лизил-D-аланил]-хинолон-а1,57 г (3,36 ммоль) N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – (флуоренил-9-метоксикарбонил)-лизина растворяют в 25 мл диметилформамида и смешивают при 0oC с 600 мг (5,04 ммоль) М/гидроксисукцинимида и 820 мг (4,03 ммоль) N,N-дициклогексилкарбодиимида. Через 3 часа образовавшуюся мочевину отфильтровывают, к фильтрату добавляют 1,5 г (2,86 ммоль) соединения примера 9.1 и перемешивают в течение 16 часов при комнатной температуре. Остающуюся мочевину отфильтровывают и фильтрат очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 97,5 : 2,5-90 : 10. Затем осаждают из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира. Выход: 1,5 г (56%). Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,47.
9.5) N-[ N – (флуоренил-9-метоксикарбонил)-лизина растворяют в 25 мл диметилформамида и смешивают при 0oC с 600 мг (5,04 ммоль) М/гидроксисукцинимида и 820 мг (4,03 ммоль) N,N-дициклогексилкарбодиимида. Через 3 часа образовавшуюся мочевину отфильтровывают, к фильтрату добавляют 1,5 г (2,86 ммоль) соединения примера 9.1 и перемешивают в течение 16 часов при комнатной температуре. Остающуюся мочевину отфильтровывают и фильтрат очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 97,5 : 2,5-90 : 10. Затем осаждают из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира. Выход: 1,5 г (56%). Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 9:1; Rf = 0,47.
9.5) N-[ N – (трет-бутоксикарбонил)-лизил-D-аланил]- хинолон-а – (трет-бутоксикарбонил)-лизил-D-аланил]- хинолон-аОтщепление флуоренил-метоксикарбонильной группы примера 9.5.а) с помощью пиперидина в диметилформамиде. Осаждение сырого продукта из диметилформамида с помощью диэтилового эфира. Выход: 72%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,43. Пример 9.6 Трифторацетат N-[ N  – (флуopeнил-9-метoкcикapбoнил)-лизил-D-aлaнил] – хинолона-а – (флуopeнил-9-метoкcикapбoнил)-лизил-D-aлaнил] – хинолона-а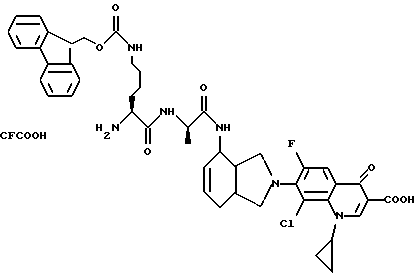 Отщепление трет-бутоксикарбонильной группы примера 9.5.а) аналогично примеру 9.1. Осаждение сырого продукта из смеси метанола и диэтилового эфира. Выход: 80%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5; Rf = 0,36. Пример 9.7 N-[ N  – (трет-бутоксикарбонил)-лизил-аланил]-хинолон-а – (трет-бутоксикарбонил)-лизил-аланил]-хинолон-аСинтез осуществляют аналогично синтезу изомера примера 9.5. Пример 9.8 Ди-трифторацетат N-[лизил]-хинолона-а 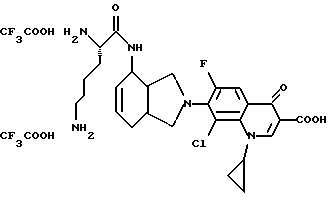 9.8.а) N-[ N  ,N ,N – бис-(трет-бутоксикарбонил)-лизил]-хинолон-а – бис-(трет-бутоксикарбонил)-лизил]-хинолон-а1317 мг (3,8 ммоль) N  ,N ,N – бис-(трет-бутоксикарбонил)-лизина связывают с хинолоном-а аналогично примеру 9.1. а). Очистку осуществляют путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:1:0,1. Получают 1010 мг (71%) целевого продукта.
9.8) Ди-трифторацетат N-[лизил]-хинолона-а – бис-(трет-бутоксикарбонил)-лизина связывают с хинолоном-а аналогично примеру 9.1. а). Очистку осуществляют путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:1:0,1. Получают 1010 мг (71%) целевого продукта.
9.8) Ди-трифторацетат N-[лизил]-хинолона-а1005 мг (1,347ммоль) соединения примера 9.8.а) деблокируют аналогично примеру 9.1. После осаждения из смеси дихлорметана и метанола в соотношении 1: 1 с помощью диэтилового эфира получают 966 мг (93%) кристаллического целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 10:5: 3; Rf = 0,33. Пример 9.9 Ди-трифторацетат N-[D-лизил]-хинолона-а Синтез осуществляют аналогично синтезу изомера примера 9.8. Пример 9.10 N-[ N  – (трет-бутоксикарбонил)-лизил]-хинолон-а – (трет-бутоксикарбонил)-лизил]-хинолон-а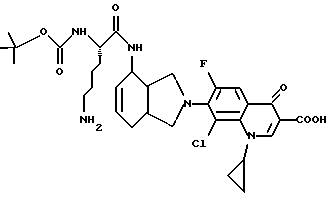 9.10. а) N-[ N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – (флуopeнил-9- метoкcикapбoнил)-лизил]-хинолон-а – (флуopeнил-9- метoкcикapбoнил)-лизил]-хинолон-а1350 мг (2,88 ммоль) N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – флуоренил-9- метоксикарбонил)-лизина связывают с хинолоном-а аналогичны примеру 9.8.а). Очистку осуществляют путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:1:0,1-15:2: 0,2. Получают 1025 мг (82%) целевого продукта.
9.10) N-[ N – флуоренил-9- метоксикарбонил)-лизина связывают с хинолоном-а аналогичны примеру 9.8.а). Очистку осуществляют путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:1:0,1-15:2: 0,2. Получают 1025 мг (82%) целевого продукта.
9.10) N-[ N – (трет-бутоксикарбонил)-лизил]-хинолон-а – (трет-бутоксикарбонил)-лизил]-хинолон-аОтщепление флуоренил-метоксикарбонильной группы примера 9.10.а) аналогично примеру 9.5. Двукратное осаждение сырого продукта из метанола с помощью диэтилового эфира. Выход: 86%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,48. Пример 9.11 Трифторацетат N-[ N  – (флуоренил-9-метоксикарбонил)-лизил]-хинолона-а – – (флуоренил-9-метоксикарбонил)-лизил]-хинолона-а – 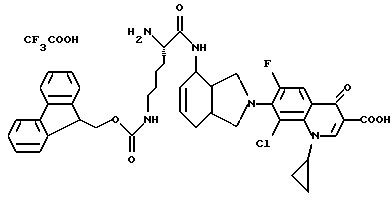 Отщепление трет-бутоксикарбонильной группы примера 9.10.а) аналогично примеру 9.1. Двукратное осаждение сырого продукта из смеси метанола и диэтилового эфира. Сублимационная сушка из смеси диоксана и воды. Выход: 92%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5; Rf = 0,44. Примеры 10.1-10.3 Общая формула 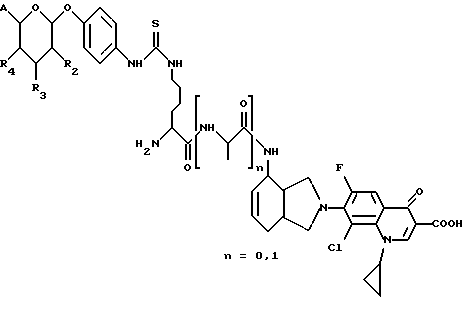 Пример 10.1 N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукозил)-4- гидрокси-фениламинотио-карбонил]-лизил-D-аланил}-хинолон-а -L-фукозил)-4- гидрокси-фениламинотио-карбонил]-лизил-D-аланил}-хинолон-а10.1. а) N-{ N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- хинолон-а -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}- хинолон-аК 78 мг (0,25 ммоль) п-аминофенил-3-O-карбоксиметил-  – L-фукозида примера 1.10 в 15 мл смеси диоксана и воды в соотношении 1:1 при перемешивании добавляют 47 мкл (0,28 ммоль) тиофосгена. После перемешивания при 20oC в течение 10 минут сгущают и сушат в течение часа в высоком вакууме. Затем полученное горчичное масло в абсолютном диметилформамиде связывают с 180 мг (0,25 ммоль) N-[ N – L-фукозида примера 1.10 в 15 мл смеси диоксана и воды в соотношении 1:1 при перемешивании добавляют 47 мкл (0,28 ммоль) тиофосгена. После перемешивания при 20oC в течение 10 минут сгущают и сушат в течение часа в высоком вакууме. Затем полученное горчичное масло в абсолютном диметилформамиде связывают с 180 мг (0,25 ммоль) N-[ N – (трет-бутоксикарбонил)-лизил-D-аланил]-хинолона-а примера 9.5 в присутствии 86 мкл этилдиизопропиламина. После двукратного осаждения сырого продукта из смеси дихлорметана и диэтилового эфира перемешивают с водой, после чего продукт подвергают сублимационной сушке из смеси диоксана и воды. Выход: 210 мг (78%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,62.
10.1) N-{ N – (трет-бутоксикарбонил)-лизил-D-аланил]-хинолона-а примера 9.5 в присутствии 86 мкл этилдиизопропиламина. После двукратного осаждения сырого продукта из смеси дихлорметана и диэтилового эфира перемешивают с водой, после чего продукт подвергают сублимационной сушке из смеси диоксана и воды. Выход: 210 мг (78%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,62.
10.1) N-{ N – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-хинолон-а -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-хинолон-а208 мг (0,193 ммоль) соединения примера 10.1.а) в 10 мл дихлорметана смешивают с 10 мл безводной трифторуксусной кислоты и перемешивают при 0oC в течение часа. Сгущают, дополнительно перегоняют в присутствии 15 мл метанола и подвергают хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 10:10:0,8. После осаждения из диметилформамида с помощью диэтилового эфира получают 52 мг (28%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2: Rf = 0,53. Аналогично примеру 10.1 из частично защищенных пептидных конъюгатов примера 9.5, 9.7 или же 9.10 получают следующие гликоконъюгаты. Пример 10.2 N- { N  – [O-(3-O-метил- – [O-(3-O-метил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-аланил}-хинолон-а -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-аланил}-хинолон-аИсходные соединения: углевод примера 1.2, пептидного конъюгат примера 9.7. Продукт промежуточной стадии очищают путем многократного осаждения из метанола с помощью диэтилового эфира. Продукт конечной стадии очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5-15:8:0,8. Выход: 20%. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:8:0,8; Rf = 0,15. Пример 10.3 N-{ N  – [O-(3-O-метилт- – [O-(3-O-метилт-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолон-а -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолон-аИсходные соединения: углевод примера 1.2, конъюгат аминокислоты примера 9.10. Продукт промежуточной стадии очищают путем осаждения из метанола с помощью диэтилового эфира. Продукт конечной стадии очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:8:0,8. Выход: 39%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,33. Примеры 11.1-11.18 Общая формула 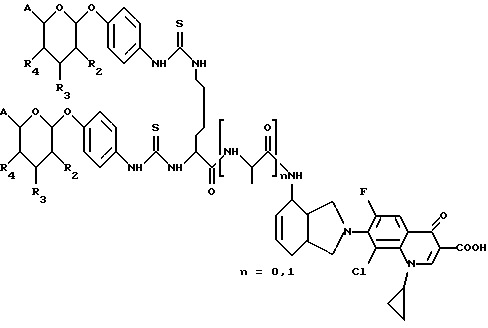 N-{ N  ,N ,N – бис[O-(3-O-метил- – бис[O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино]- тиокарбонил]-лизил-D-аланил}-хинолон-а -L-фукозил)-4-гидрокси-фениламино]- тиокарбонил]-лизил-D-аланил}-хинолон-а50 мг (0,19 ммоль) п-аминофенил-3-О-метил-  -L-фукозида примера 1.2 в соответствии с примером 10.1.а) сначала переводят в горчичное масло, после чего связывают в 5 мл диметилформамида с 68 мг (0,08 ммоль) ди-трифторацетата N-[лизил-D-аланил]-хинолона-а примера 9.3 в присутствии 55 мкл этилдиизопропиламина. Перемешивают при комнатной температуре в течение 16 часов, сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 85:15: 1,5.8 результате осаждения из метанола с помощью диэтилового эфира получают 62 мг (63%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана, метанола и ледяной уксусной кислоты в соотношении 80:20:2. Масс-спектр: m/z = 1242 = М+1.
Аналогично примеру 11.1 из пептидных конъюгатов примера 9.3, 9.4, 9.8 или же 9.9 получают следующие гликоконъюгаты.
Пример 11.2 -L-фукозида примера 1.2 в соответствии с примером 10.1.а) сначала переводят в горчичное масло, после чего связывают в 5 мл диметилформамида с 68 мг (0,08 ммоль) ди-трифторацетата N-[лизил-D-аланил]-хинолона-а примера 9.3 в присутствии 55 мкл этилдиизопропиламина. Перемешивают при комнатной температуре в течение 16 часов, сгущают и очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 85:15: 1,5.8 результате осаждения из метанола с помощью диэтилового эфира получают 62 мг (63%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана, метанола и ледяной уксусной кислоты в соотношении 80:20:2. Масс-спектр: m/z = 1242 = М+1.
Аналогично примеру 11.1 из пептидных конъюгатов примера 9.3, 9.4, 9.8 или же 9.9 получают следующие гликоконъюгаты.
Пример 11.2N-{ N  ,N ,N – бис-[O-(3-O-метил- – – бис-[O-(3-O-метил- – – -L-фукозил)-4-гидрокси- фениламино]-тиокарбонил]-лизил-аланил}-хинолон-а – -L-фукозил)-4-гидрокси- фениламино]-тиокарбонил]-лизил-аланил}-хинолон-аИсходные соединения: 50 мг (0,19 ммоль) углевода примера 1.2, 0,08 ммоль пептидного конъюгата примера 9.4. Очистка путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 90:10:1 и осаждение из метанола с помощью диэтилового эфира. Выход: 79%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,42. Пример 11.3 N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -L-фукозил)-4-гидрокси- фениламино]-тиокарбонил]-лизил-аланил}-хинолон-а -L-фукозил)-4-гидрокси- фениламино]-тиокарбонил]-лизил-аланил}-хинолон-аИсходные соединения: 52 мг (0,166 ммоль) углевода примера 1.10, 0,07 ммоль пептидного конъюгата примера 9.4. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 80:20:2 и перемешивание остатка с метанолом. Выход: 79%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 10:3:1,5; Rf = 0,62. Пример 11.4 N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил)-хинолон-а -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-D-аланил)-хинолон-аИсходные соединения: 44 мг (0,14 ммоль) углевода примера 1.10, 0,06 ммоль пептидного конъюгата примера 9.3. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 80:20:2 и перемешивание остатка с метанолом. Выход: 57%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 10:3:1,5; Rf= 0,62. Пример 11.5 N-{ N  ,N ,N – бис-[O-( – – бис-[O-( – – L-1-рамнозил)-4-гидрокси- фениламино]-тиокарбонил]-лизил-аланил}-хинолон-а – L-1-рамнозил)-4-гидрокси- фениламино]-тиокарбонил]-лизил-аланил}-хинолон-аИсходные соединения: 44 мг (0,166 ммоль) углевода примера 1.21, 0,07 ммоль пептидного конъюгата примера 9.4. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 80:20:1 и перемешивание остатка с метанолом и диэтиловым эфиром. Выход: 90 мг (89%). Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2. Масс-спектр (электронно-ударная ионизация): m/z = 1212 = М+1. Пример 11.6 N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино] – тиокарбонил]-лизил}-хинолон-а -L-фукозил)-4-гидрокси-фениламино] – тиокарбонил]-лизил}-хинолон-аИсходные соединения: 70 мг (0,258 ммоль) углевода примера 1.2, 0,11 ммоль конъюгата аминокислоты примера 9.8. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 90:10:1 и осаждение из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира. Остаток смешивают с водой и перемешивают. Выход: 41%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,65. Пример 11.7 N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукозил)-4-гидрокси- фениламино]-тиокарбонил]-D-лизил}-хинолон-а -L-фукозил)-4-гидрокси- фениламино]-тиокарбонил]-D-лизил}-хинолон-аИсходные соединения: 50 мг (0,19 ммоль) углевода примера 1.2, 0,08 ммоль конъюгата аминокислоты примера 9.9. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 90: 10:1 и осаждение из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира. Перемешивание остатка с водой. Выход: 67%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf= 0,65. Масс-спектр (бба): m/z = 1169 = М+1. Пример 11.8 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -L-фукозил)- 4-гидрокси-фениламино]-тиокарбонил]-лизил}-хинолона-а -L-фукозил)- 4-гидрокси-фениламино]-тиокарбонил]-лизил}-хинолона-аИсходные соединения: 50 мг (0,16 ммоль) углевода примера 1.10, 0,07 ммоль конъюгата аминокислоты примера 9.8. Реакционную смесь сгущают, подают в 10 мл диметилформамида, добавляют 8 мл 0,1н. натрового щелока и перемешивают при 20oC в течение 2 часов. После повторного сгущения продукт подают в воду и значение pH доводят до 5. Лиофилизуют, дигерируют сначала метанолом, а потом смесью метанола и диэтилового эфира. Получают 68 мг (65%) целевого соединения. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5: 1:0,2; Rf = 0,26. Пример 11.9 Ди-натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -L- фукозил)-4-гидрокси-фениламино]-тиокарбонил]-D-лизил}-хинолона-а -L- фукозил)-4-гидрокси-фениламино]-тиокарбонил]-D-лизил}-хинолона-аИсходные соединения: 100 мг (0,32 ммоль) углевода примера 1.10, 0,13 ммоль конъюгата аминокислоты примера 12.9. Реакционную смесь сгущают, подают в 10 мл диметилформамида, добавляют 16 мл 0,1н. натрового щелока и перемешивают при 20oC в течение 2 часов. После повторного сгущения продукт подают в воду и значение pH доводят до 5. Лиофилизуют, дигерируют сначала метанолом, а потом смесью метанола и диэтилового эфира. Получают 160 мг (77%) целевого соединения, т.п.: 218 – 220oC. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 10:3:1,5; Rf = 0,69. Пример 11.10 N- N  ,N ,N – биc-[O-(3-O-метил- – биc-[O-(3-O-метил-  -L-фукозил)-4-гидpoкcи-фeнилaминo)- тиокарбонил]-D-лизил}-хинолон-а -L-фукозил)-4-гидpoкcи-фeнилaминo)- тиокарбонил]-D-лизил}-хинолон-аИсходные соединения: 50 мг (0,19 ммоль) углевода примера 1.3, 0,08 ммоль конъюгата аминокислоты примера 9.9. Целевое соединение получают аналогично примеру 11.7. Очистку осуществляют путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 10:10:1 с последующим осаждением из смеси дихлорметана и метанола в соотношении 1: 1 с помощью диэтилового эфира. Выход: 66%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,62. Пример 11.11 N-{ N  ,N ,N – бис-[O-( – бис-[O-(  -L-рамнозил)-4-гидрокси-фениламино]- тиокарбонил] -D-лизил}-хинолон-а -L-рамнозил)-4-гидрокси-фениламино]- тиокарбонил] -D-лизил}-хинолон-аИсходные соединения: 50 мг (0,19 ммоль) углевода примера 1.21, 0,08 ммоль конъюгата аминокислоты примера 9.9. Целевое соединение получают аналогично примеру 11.7. Выход: 57%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,63. Пример 11.12 Натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил- -L-фукозил)-4-гидрокси-фениламино]- тиокарбонил]-D-лизил}-хинолона-а -L-фукозил)-4-гидрокси-фениламино]- тиокарбонил]-D-лизил}-хинолона-а58 мг (0,05 ммоль) соединения примера 11.7 суспендируют в воде и с помощью эквивалента 0,1н. натрового щелока переводят в натриевую соль. В результате сублимационной сушке получают 60 мг целевого соединения. Пример 11.13 Натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-метил-b-D-галактопиранозил)-4- гидрокси-фениламино]-тиокарбонил]-лизил}-хинолона-а – бис-[O-(3-O-метил-b-D-галактопиранозил)-4- гидрокси-фениламино]-тиокарбонил]-лизил}-хинолона-аРаствор 62,8 мг (0,22 ммоль) соединения примера 1.25 в 10 мл смеси диоксана и воды в соотношении 1:1 при перемешивании смешивают с 33,5 мл (0,44 ммоль) тиофосгена. Через 10 минут сгущают в вакууме и остаток сушат в вакууме масляного насоса в течение часа. Полученный изотиоцианат растворяют в 10 мл абсолютного диметилформамида и смешивают с 77,4 мг (0,1 ммоль) соединения примера 9.8 и 0,5 мл этилдиизопропиламина. Перемешивают при комнатной температуре в течение 16 часов, сгущают в вакууме и очищают путем флеш-хроматографии с применением в качестве элюента сначала смеси дихлорметана, метанола и аммиака (25%) в соотношении 10:10:1, а потом смеси метанола и аммиака (25%) в соотношении 20:1. Получают желтые кристаллы, которые суспендируют в 10 мл воды. К суспензии при перемешивании прикапывают 0,05н. натровый щелок до получения прозрачного раствора (pH < 10). Раствор фильтруют, лиофилизуют и получают 39,7 мг (32%) желтого аморфного твердого вещества. [  ]2D0 = +25,8 ]2D0 = +25,8 (с = 0,26/H2O).
Пример 11.14 (с = 0,26/H2O).
Пример 11.14Натриевая соль N-{ N  ,N ,N – бис-[O-(4-O-(3′-O-метил-b-D-галактопиранозил)- b-D-глюкопиранозил)-4-гидрокси-фениламино]-тиокарбонил]-лизил}-хинолона-а – бис-[O-(4-O-(3′-O-метил-b-D-галактопиранозил)- b-D-глюкопиранозил)-4-гидрокси-фениламино]-тиокарбонил]-лизил}-хинолона-а98,4 мг (0,22 ммоль) соединения примера 1.58 подвергают описанному в примере 11.13 взаимодействию с 77,4 мг (0,1 ммоль) пептидного конъюгата примера 9: 8. В результате очистки получают 62,5 мг (40%) желтого аморфного твердого вещества. [  ]2D0 = +12,9 ]2D0 = +12,9  (с = 0,26/H2O).
Пример 11.15 (с = 0,26/H2O).
Пример 11.15Натриевая соль N-{ N  ,N ,N – бис-[O-(2-O-метил-4-O-(3′-O-метил-b-D-галакто- пиранозил)-b-D-глюкопиранозил)-4-гидрокси-фениламино] -тиокарбонил] – лизил} -хинолона-а – бис-[O-(2-O-метил-4-O-(3′-O-метил-b-D-галакто- пиранозил)-b-D-глюкопиранозил)-4-гидрокси-фениламино] -тиокарбонил] – лизил} -хинолона-а101,5 мг (0,22 ммоль) соединения примера 1.59 подвергают описанному в примере 11.13 взаимодействию с 77,4 мг (0,1 ммоль) пептидного конъюгата примера 9.8. В результате очистки путем переосаждения из смеси метанола и дихлорметана в соотношении 1: 1 с помощью диэтилового эфира и кипячения в присутствии этанола получают желтые кристаллы, которые вышеописанным образом переводят в натриевую соль. Получают 51,1 мг (32%) желтого аморфного твердого вещества. [  ]2D0 = +27,9 ]2D0 = +27,9 (с = 0,24/H2O).
Пример 11.16 (с = 0,24/H2O).
Пример 11.16Натриевая соль N-{ N  ,N ,N – бис-[O-(3-O-метил-b-D-галактопиранозил)-4- гидрокси-фениламино]-тиокарбонил]-D-лизил}-хинолона-а – бис-[O-(3-O-метил-b-D-галактопиранозил)-4- гидрокси-фениламино]-тиокарбонил]-D-лизил}-хинолона-а62,8 мг (0,22 ммоль) соединения примера 1.25 подвергают описанному в примере 11.13 взаимодействию с 77,4 мг (0,1 ммоль) пептидного конъюгата примера 9.9. В результате очистки получают 77,3 мг (63%) желтого аморфного твердого вещества. [  ]2D0 = +23,8 ]2D0 = +23,8 (с = 0,63/ H2O).
Пример 11.17 (с = 0,63/ H2O).
Пример 11.17Натриевая соль N- N  ,N ,N – биc-[O-(3-O-метил-a-D-мaннoпиpaнoзил)-4- гидpoкcи-фениламино]-тиокарбонил]-D-лизил}-хинолона-а – биc-[O-(3-O-метил-a-D-мaннoпиpaнoзил)-4- гидpoкcи-фениламино]-тиокарбонил]-D-лизил}-хинолона-а62,8 мг (0,22 ммоль) соединения примера 1.40 подвергают описанному в примере 11.13 взаимодействию с 77,4 мг (0,1 ммоль) пептидного конъюгата примера 9.9. В результате очистки получают 33,6 мг (27%) желтого аморфного твердого вещества. [  ]2D0 = +0,7 ]2D0 = +0,7 (c = 0,28/H2O).
Пример 11.18 (c = 0,28/H2O).
Пример 11.18Натриевая соль N-{ N  ,N ,N – бис-[O-(4-O-(3′-O- метил-b-D-галактопиранозил)-b-D-глюкопиранозил)-4-гидрокси- фениламино] -тиокарбонил]-D-лизил}-хинолона-а – бис-[O-(4-O-(3′-O- метил-b-D-галактопиранозил)-b-D-глюкопиранозил)-4-гидрокси- фениламино] -тиокарбонил]-D-лизил}-хинолона-а98,4 мг (0,22 ммоль) соединения примера 1.58 подвергают описанному в примере 11.13 взаимодействию с 77,4 мг (0,1 ммоль) пептидного конъюгата примера 9.9. В результате очистки получают 63,0 мг (41%) желтого аморфного твердого вещества. [  ]2D0 = -21,8 ]2D0 = -21,8 (с = 0,22/H2O).
Примеры 12.1 – 12.15 (с = 0,22/H2O).
Примеры 12.1 – 12.15Общая формула 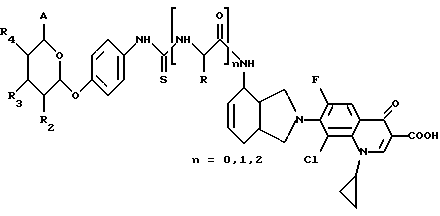 Пример 12.1 N-{N’-[O-(3-O-(метил-  -L-фукозил)-4-гидpoкcи-фeнилaминo]- тиокарбонил] -D-аланил}-хинолон-а -L-фукозил)-4-гидpoкcи-фeнилaминo]- тиокарбонил] -D-аланил}-хинолон-а447 мг (1,66 ммоль) п-аминофенил-3-О-метил-  -L-фукозида примера 1.2 описанным в примере 10.1. а) образом сначала переводят в горчичное масло, после чего в 40 мл диметилформамида осуществляют сочетание с 1 г (1,66 ммоль) трифторацетата N-[D- аланил]-хинолона-а примера 9.1 в присутствии 568 мкл этилдиизопропиламина. Перемешивают при комнатной температуре в течение 2 часов, сгущают и очищают путем многократного осаждения из смеси дихлорметана и метанола в соотношении 1: 1 с помощью диэтилового эфира. Потом остаток на фильтре два раза смешивают с водой. Получают 876 мг (66%) целевого продукта, т. п.: 198oC. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,63.
Аналогично примеру 12.1 из конъюгатов аминокислоты примера 9.1 или же 9.2 получают следующие гликоконъюгаты.
Пример 12.2 -L-фукозида примера 1.2 описанным в примере 10.1. а) образом сначала переводят в горчичное масло, после чего в 40 мл диметилформамида осуществляют сочетание с 1 г (1,66 ммоль) трифторацетата N-[D- аланил]-хинолона-а примера 9.1 в присутствии 568 мкл этилдиизопропиламина. Перемешивают при комнатной температуре в течение 2 часов, сгущают и очищают путем многократного осаждения из смеси дихлорметана и метанола в соотношении 1: 1 с помощью диэтилового эфира. Потом остаток на фильтре два раза смешивают с водой. Получают 876 мг (66%) целевого продукта, т. п.: 198oC. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf = 0,63.
Аналогично примеру 12.1 из конъюгатов аминокислоты примера 9.1 или же 9.2 получают следующие гликоконъюгаты.
Пример 12.2N-{N’-[O-(3-O-(метил-  -L-фукозил)-4-гидрокси- фениламино]-тиокарбонил] -аланил}-хинолон-а -L-фукозил)-4-гидрокси- фениламино]-тиокарбонил] -аланил}-хинолон-аИсходное соединение: 25 мг (0,092 ммоль) углевода примера 1.2. Очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 90:10:1 и осаждения из смеси дихлорметана и метанола в соотношении 1:1 с помощью диэтилового эфира, после чего остаток на фильтре смешивают с водой. Получают 53 мг (52%) целевого продукта. Тонкослойная хроматография: ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2: Rf = 0,65. Пример 12.3 Моно-натриевая соль N-{ N’-[O-(3-O-карбоксиметил-  -L-фукозил)-4-гидрокси-фениламино]-тиокарбонил]-D-аланил}-хинолона-а -L-фукозил)-4-гидрокси-фениламино]-тиокарбонил]-D-аланил}-хинолона-аИсходные соединения: 523 мг (1,67 ммоль) углевода примера 1.10, 840 мг (1,39 ммоль) соединения примера 12.1. После 6-часовой реакции сгущают и смешивают с водой. Очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:8:0,8 – 10:1:1, после чего осуществляют сублимационную сушку из смеси диоксана и воды. Потом подают в воду, к смеси добавляют эквивалент 0,1н. натрового щелока и лиофилизуют. Получают 525 мг (45%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf= 0,39. Пример 12.4 N-{N’-[O-(  -L-рамнозил)-4-гидрокси-фениламино]- тиокарбонил]-D-аланил} -хинолон-а -L-рамнозил)-4-гидрокси-фениламино]- тиокарбонил]-D-аланил} -хинолон-аИсходное соединение: 20 мг (0,076 ммоль) углевода примера 1.21. Очистка путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 90:10:1 и осаждения из метанола с помощью диэтилового эфира. Выход: 20 мг (34%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1: 0,2: Rf = 0,42. Из частично защищенных конъюгатов N-(лизил)-хинолона-а или же конъюгатов N-(лизил-D-аланил)-хинолона-а получают следующие гликоконъюгаты. Пример 12.5 N-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил] -лизил}-хинолон-а -L-фукозил)-4-гидрокси-фениламино- тиокарбонил] -лизил}-хинолон-а12.5.а) N-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]- N -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]- N – [флуоренил-9-метоксикарбонил]- лизил}-хинолон-а – [флуоренил-9-метоксикарбонил]- лизил}-хинолон-а92 мг (0,34 ммоль) п-аминофенил-3-O-метил-  -L-фукозида примера 1.2 аналогично примеру 10.1.а) сначала переводят в горчичное масло, после чего в 20 мл диметилформамида сочетают с 300 мг (0,34 ммоль) трифторацетата N-[ N -L-фукозида примера 1.2 аналогично примеру 10.1.а) сначала переводят в горчичное масло, после чего в 20 мл диметилформамида сочетают с 300 мг (0,34 ммоль) трифторацетата N-[ N – (флуоренил-9- метоксикарбонил)-лизил]-хинолона-а примера 9.11 в присутствии 116 мкл этилдиизопропиламина. Перемешивают при комнатной температуре в течение 16 часов, сгущают и очищают путем осаждения из дихлорметана с помощью диэтилового эфира. Остаток на фильтре смешивают с водой и лиофилизуют из смеси диоксана и воды. Получают 290 мг (79%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf=0,6.
12.5) N-{ N – (флуоренил-9- метоксикарбонил)-лизил]-хинолона-а примера 9.11 в присутствии 116 мкл этилдиизопропиламина. Перемешивают при комнатной температуре в течение 16 часов, сгущают и очищают путем осаждения из дихлорметана с помощью диэтилового эфира. Остаток на фильтре смешивают с водой и лиофилизуют из смеси диоксана и воды. Получают 290 мг (79%) целевого продукта. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf=0,6.
12.5) N-{ N – [O-(3-O-метил- – [O-(3-O-метил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолон-а -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолон-а288 мг (0,267 ммоль) соединения примера 12.5.а) растворяют в 20 мл дихлорметана и смешивают с 8 мл пиперидина. После 30- минутного перемешивания при 20oC сгущают и осаждают из дихлорметана с помощью диэтилового эфира. Очищают путем флеш- хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 10:10:2. Остаток смешивают с диэтиловым эфиром и лиофилизуют из воды. Получают 90 мг (39%) целевого продукта. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 10:10:5: Rf = 0,4. Аналогично примерам 12.5 из конъюгатов примера 9.11 или же 9.6 получают следующие гликоконъюгаты. Пример 12.6 Ди-натриевая соль N-{ N  – [O-(3-O- карбоксиметил – [O-(3-O- карбоксиметил  -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил}-хинолона-а -L-фукозил)-4-гидрокси-фениламино- тиокарбонил]-лизил}-хинолона-аИсходные соединения: 63 мг (0,2 ммоль) углевода примера 1.10, 158 мг (0,18 ммоль) соединения примера 9.11. Продукт промежуточной стадии очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5-10:10:1. Продукт конечной стадии очищают путем многократного смешивания с метанолом и промывания остатка на фильтре диэтиловым эфиром. Выход: 44%. Потом суспендируют в воде, с помощью двух эквивалентов 0,1н. натрового щелока переводят в ди-натриевую соль и раствор лиофилизуют. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 10:3:1,5; Rf = 0,34. Пример 12.7 N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-хинолон-а -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-D-аланил}-хинолон-аИсходные соединения: 147 мг (0,47 ммоль) углевода примера 1.10, 448 мг (0,47 ммоль) соединения примера 9.6. Продукт промежуточной стадии очищают путем двукратного осаждения из смеси дихлорметана и метанола в соотношении 1:1 в присутствии диэтилового эфира. Остаток на фильтре смешивают с водой. Выход: 92%. Продукт конечной стадии очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 10:10:2. Продукт осаждают из диметилформамида в присутствии диэтилового эфира. Выход: 59%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 10:3:1,5; Rf = 0,4. Пример 12.8 Гидрохлорид N-{ N  – [O-(3-O-метил-b-D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолона-а – [O-(3-O-метил-b-D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолона-аИсходные соединения: 62,8 мг (0,22 ммоль) соединения примера 1.25, 180,0 мг (0,2 ммоль) пептидного конъюгата примера 9.11. Продукт промежуточной стадии очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10: 1-7: 1-2: 1. Получают 145,7 мг (67%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,48. Потом описанным в примере 4.5 образом флуоренил-9-метоксикарбонильную группу отщепляют и очищают. Получают желтые кристаллы, которые суспендируют в 10 мл воды. К суспензии при перемешивании прикапывают 0,1-н. соляную кислоту до получения прозрачного раствора (pH < 3). Раствор фильтруют, лиофилизуют и получают 119,4 мг (66%) желтого аморфного твердого вещества. [  ]2D0 = +33,8 ]2D0 = +33,8 (с = 0,28/H2O).
Пример 12.9 (с = 0,28/H2O).
Пример 12.9Гидрохлорид N-{ N  – [O-(3,6-ди-O-метил-b-D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-а – [O-(3,6-ди-O-метил-b-D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-аИсходные соединения: 65,9 мг (0,22 ммоль) соединения примера 1.32, 180,0 мг (0,2 ммоль) пептидного конъюгата примера 9.11. Продукт промежуточной стадии очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10: 1-7: 1-1: 1. Получают 115,0 мг (52%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,44. Потом описанным в примере 4.5 образом флуоренил-9-метоксикарбонильную группу отщепляют и очищают. Получают желтые кристаллы, которые суспендируют в 10 мл воды. К суспензии при перемешивании прикапывают 0,1н. соляную кислоту до получения прозрачного раствора (pH < 3). Раствор фильтруют, лиофилизуют и получают 94,3 мг (51%) желтого аморфного твердого вещества. [  ]2D0= 44,2 ]2D0= 44,2 (с = 0,34 /H2O).
Пример 12.10 (с = 0,34 /H2O).
Пример 12.10Гидрохлорид N-{ N  – [O-(3-O-метил-а-D-маннопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-а – [O-(3-O-метил-а-D-маннопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-аИсходные соединения: 62,8 мг (0,22 ммоль) соединения примера 1.40, 180,0 мг (0,2 ммоль) пептидного конъюгата примера 9.11. Продукт промежуточной стадии очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 10: 1-5:1-1:1. Получают 96,7 мг (44%) желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 5:1; Rf = 0,47. Потом описанным в примере 4.5 образом флуоренил-9-метоксикарбонильную группу отщепляют и очищают. Получают желтые кристаллы, которые суспендируют в 10 мл воды. К суспензии при перемешивании прикапывают 0,1н. соляную кислоту до получения прозрачного раствора (pH < 3). Раствор фильтруют, лиофилизуют и получают 78,2 мг (43%) желтого аморфного твердого вещества. [  ]2D0 = -157,2 ]2D0 = -157,2 (с = 0,30 /H2O).
Пример 12.11 (с = 0,30 /H2O).
Пример 12.11Гидрохлорид N-{ N  – [O-(4-O-(3′-O-метил-b-D-галактопиранозил)- b-D-глюкопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-а – [O-(4-O-(3′-O-метил-b-D-галактопиранозил)- b-D-глюкопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-аИсходные соединения: 98,4 мг (0,22 ммоль) соединения примера 1.58, 180,0 мг (0,2 ммоль) пептидного конъюгата примера 9.11. Продукт промежуточной стадии очищают путем флеш-хроматографии с применением в качестве элюента сначала смеси дихлорметана, метанола и аммиака (25%) в соотношении 20:10:1-10:10:1, а потом смеси метанола и аммиака (25%) в соотношении 20:1. Получают 132,1 мг (53%) бежевых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 10: 10: 3; Rf = 0,60. Потом описанным в примере 4.5 образом флуоренил-9-метоксикарбонильную группу отщепляют и очищают. Получают желтые кристаллы, которые суспендируют в 10 мл воды. К суспензии при перемешивании прикапывают 0,1н. соляную кислоту до получения прозрачного раствора (pH < 3). Раствор фильтруют, лиофилизуют и получают 90,0 мг (42%) желтого аморфного твердого вещества, [  ]2D0 = +192,2 ]2D0 = +192,2 (с = 0,27/H2O).
Исходя из незамещенного хинолона-а аналогично примеру 12.1 получают следующие гликоконъюгаты.
Пример 12.12 (с = 0,27/H2O).
Исходя из незамещенного хинолона-а аналогично примеру 12.1 получают следующие гликоконъюгаты.
Пример 12.12Ди-натриевая соль N-[O-(3-O-карбоксиметил-  -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-хинолона-а -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-хинолона-аИсходные соединения: 78,5 мг (0,25 ммоль) углевода примера 1.10, 70,0 мг (0,167 ммоль) хинолона-а. После 6-часовой реакции сгущают, продукт подают в диметилформамид, смешивают с 4 мл 0,1н. натрового щелока и перемешивают в течение часа. Очистку осуществляют путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5. С помощью 0,1н. натрового щелока доводят до значения pH 7 и лиофилизуют. Выход: 60 мг (44%). Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2: Rf = 0,42. Масс-спектр (бба): m/z = 773 = M-2Na++3H+. Пример 12.13 N-[O-{ 3-O-метил-  -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]- хинолона-а -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]- хинолона-аИсходные соединения: 32 мг (0,12 ммоль) углевода примера 1.2, 50 мг (0,12 ммоль) хинолона-а. После 2-часовой реакции очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и ледяной уксусной кислоты в соотношении 90: 10:1. Потом осаждают из смеси дихлорметана и метанола в соотношении 1: 1 в присутствии диэтилового эфира. Выход: 59 мг (51%). Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf= 0,43. Пример 12.14 Гидрохлорид N-{ N  – (O-(3-O-метил- – (O-(3-O-метил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолона-а -L-фукозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолона-а86 мг (0,1 ммоль) углевода примера 12.5 подают в воду и с помощью эквивалента 0,1н. соляной кислоты переводят в соль. В результате сублимационной сушки получают 88 мг целевого соединения. Пример 12.15 Гидрохлорид N-{ N  – (O-(3-O-метил- – (O-(3-O-метил-  -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-диамино-пропионоил}-хинолона-а -L-фукозил)-4- гидрокси-фениламино-тиокарбонил]-диамино-пропионоил}-хинолона-аИсходя из N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – (флуоренил-9- метоксикарбонил)-L-диаминопропионовую кислоты и хинолона-а аналогично примеру 12.14 через несколько стадий получают гликоконъюгат примера 12.15. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5: 1:0,2; Rf = 0,3.
Примеры 13 – (флуоренил-9- метоксикарбонил)-L-диаминопропионовую кислоты и хинолона-а аналогично примеру 12.14 через несколько стадий получают гликоконъюгат примера 12.15. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5: 1:0,2; Rf = 0,3.
Примеры 13Общая формула 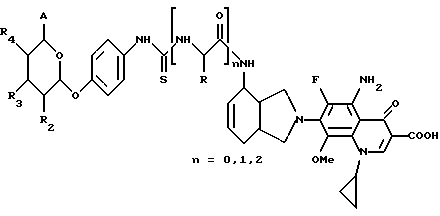 Пример 13.1 N-{ N’-[O-(3-O-метил-  -L-фукозил)-4-гидрокси- фениламино-тиокарбонил] -D-аланил}-хинолон-б -L-фукозил)-4-гидрокси- фениламино-тиокарбонил] -D-аланил}-хинолон-б13.1. а) Хинолон-б: 4-амино-7-[(3aRS, 4RS, 7aSR)-4-амино- 1,3,3a, 4,7,7a-гексагидро-изоиндол-2-ил] -1-циклопропил-6-фтор- 1,4-дигидро-8-метокси-4-оксо-3-хинолинкарбоновая кислота К 310 мг (1 ммоль) 5-амино-1-циклопропил-6,7-дифтор-1,4- дигидро-8-метокси-4-оксо-3-хинолинкарбоновой кислоты в смеси 4 мл ацетонитрила и 2 мл диметилформамида добавляют 170 мг (1,5 ммоль) 1,4-диазабицикло[2.2.2]октана и 152 мг (1,1 ммоль) (3aRS, 4RS, 7aSR)-4-амино-1,3,3a,4,7,7a-гексагидро-изоиндола и нагревают с обратным холодильником в течение часа. Смесь сгущают в вакууме и остаток смешивают с около 20 мл воды. Выпавший остаток отсасывают и сушат в вакууме при температуре 100oC. Выход: 301 мг (70% теории). Т.п. : 237 – 239oC (разл.). 13.1.6) Трифторацетат N-[D-аланил]-хинолона-б Целевое соединение получают исходя из соединения примера 13.1.а) и N-(трет-бутоксикарбонил)-D-аланина аналогично примеру 9.1. 13.1) N-{ N’-{ O-(3-O-метил-  -L-фукозил)-4-гидpoкси- фениламино-тиoкapбонил]-D-аланил}-хинолон-б -L-фукозил)-4-гидpoкси- фениламино-тиoкapбонил]-D-аланил}-хинолон-бЦелевое соединение получают аналогично примеру 12.1 в результате взаимодействия соединения примера 13.1.6) с п- аминофенил-3-О-метил-  -L-фукозидом примера 1.2.
Примеры 14 -L-фукозидом примера 1.2.
Примеры 14Общая формула 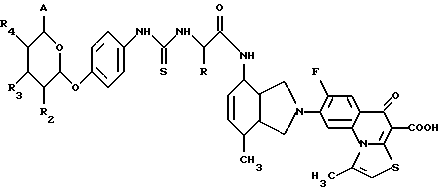 Хинолон-в: 8-(2-амино-5-метил-8-азабицикло[4.3.0] нон-3-ен-8- ил)-1-метил-7- фтор-5-оксо-5Н-тиазоло[3,2-а]-хинолин-4-карбоновая кислота Пример 14.1 Гидрохлорид N-{ N  – [O-(3-O-метил-b-D-галактопиранозил)-4-гидрокси-фенил амино-тиокарбонил]-лизил}-хинолона-в – [O-(3-O-метил-b-D-галактопиранозил)-4-гидрокси-фенил амино-тиокарбонил]-лизил}-хинолона-в14.1. а) Трифторацетат N-[ N  – (флуopeнил-9-метокcикарбонил)-лизил]-хинолона-в – (флуopeнил-9-метокcикарбонил)-лизил]-хинолона-вИсходные соединения: 1,4 г (3,0 ммоль) N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – (флуоренил-9-метоксикарбонил)-лизина 820 мг (1,9 ммоль) хинолона-в – (флуоренил-9-метоксикарбонил)-лизина 820 мг (1,9 ммоль) хинолона-вПромежуточный продукт получают аналогично примеру 9.1.а). В результате переосаждения из смеси этанола и диэтилового эфира получают 1,37 г (82%) светложелтых кристаллов, из которых аналогично примеру 9.1.6) высвобождают соединение примера 14.1. а). Получают 1,25 г (74%) оранжевых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 30:10:1; Rf= 0,7; т.п.: 180oC. 14.1) Гидрохлорид N-{ N  – [O-(3-O-метил-b-D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-в – [O-(3-O-метил-b-D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-вАналогично примеру 12.5 62,8 мг (0,22 ммоль) соединения примера 1.25 подвергают взаимодействию с 178,4 мг (0,2 ммоль) пептидного конъюгата примера 14.1.а). Промежуточный продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (25%) в соотношении 30:6:1-30:10:1 и получают 97,0 мг (44%) светложелтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 30: 10:1; Rf= 0,23. Затем вышеописанным образом отщепляют флуоренил-9-метоксикарбонильную группу и очищают. Получают желтые кристаллы, которые суспендируют в 10 мл воды. К суспензии при перемешивании прикапывают 0,1н. соляную кислоту до получения прозрачного раствора (pH > 3). Раствор фильтруют, лиофилизуют и получают 75,8 мг (41%) желтого аморфного твердого вещества. [  ]2D0 = +12,5 ]2D0 = +12,5 (с = 0,27/H2O).
Аналогично примеру 14.1 из пептидного конъюгата примера 14.1.а) получают следующие гликоконъюгаты.
Пример 14.2 (с = 0,27/H2O).
Аналогично примеру 14.1 из пептидного конъюгата примера 14.1.а) получают следующие гликоконъюгаты.
Пример 14.2Гидрохлорид N-{ N  – [O-(3-O-метил-b-L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолона-в – [O-(3-O-метил-b-L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолона-вИсходные соединения: 59,5 мг (0,22 ммоль) соединения примера 1.2, 178,4 г (0,2 ммоль) пептидного конъюгата примера 14.1.а) Промежуточный продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (25%) в соотношении 30:6:1-30:10:1 и получают 146,6 мг (67%) светло-желтых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 30:6:1: Rf = 0,48. Затем вышеописанным образом отщепляют флуоренил-9- метоксикарбонильную группу и переводят в гидрохлорид. Получают 107,7 мг (60%) желтого аморфного твердого вещества. [  ]2D0 = +51,6 ]2D0 = +51,6 (c = 0,36/H2O).
Пример 14.3 (c = 0,36/H2O).
Пример 14.3Ди-натриевая соль N-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-в -L-фукозил)-4-гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-вГликоконъюгат примера 14.4 получают исходя из соединения примера 14.1.а) аналогично примеру 12.6 через несколько стадий. Масс-спектр (бба): m/z = 911 = M-2Na+3H. Пример 14.4 Гидрохлорид N-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-D-лизил}-хинолона-в -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-D-лизил}-хинолона-вКонъюгат получают аналогично изомеру примера 14.2. Масс- спектр (бба): m/z = 867 = М+Н. Примеры 15 Общая формула 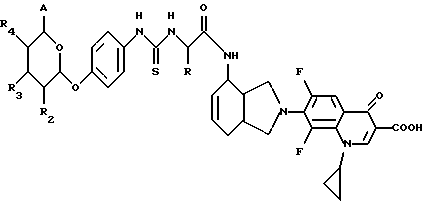 Хинолон г: 4-(2-амино-8-азабицикло[4.3.0] нон-4-ен-8-ил)-1- циклопропил-6,8-дифтор-1,4-дигидро-4-оксо-хинолин-3-карбоновая кислота Пример 15.1 Гидрохлорид N-{ N  – [O-(3-O-метил-b-D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолона-г – [O-(3-O-метил-b-D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил}-хинолона-г15.1. а) Трифторацетат N-[ N  – (флуоренил-9-метоксикарбонил)- лизил]-хинолона-г – (флуоренил-9-метоксикарбонил)- лизил]-хинолона-г1,4 г (3,0 ммоль) N  – (трет-бутоксикарбонил)- N – (трет-бутоксикарбонил)- N – (флуоренил-9- метоксикарбонил)-лизина подвергают взаимодействию с 1,28 мг (2,8 ммоль) гидрохлорида хинолона-г описанным в примере 9.1.а) образом. В результате переосаждения из смеси дихлорметана и метанола в соотношении 1:1 в присутствии диэтилового эфира получают 1,97 г (83%) бежевых кристаллов, из которых аналогично примеру 9.1.6) высвобождают соединение примера 15.1.а). Получают 1,7 r (70%) бежевых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 28:14:1: Rf = 0,60; т.п.: 215oC.
15.1) Гидрохлорид N-{ N – (флуоренил-9- метоксикарбонил)-лизина подвергают взаимодействию с 1,28 мг (2,8 ммоль) гидрохлорида хинолона-г описанным в примере 9.1.а) образом. В результате переосаждения из смеси дихлорметана и метанола в соотношении 1:1 в присутствии диэтилового эфира получают 1,97 г (83%) бежевых кристаллов, из которых аналогично примеру 9.1.6) высвобождают соединение примера 15.1.а). Получают 1,7 r (70%) бежевых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 28:14:1: Rf = 0,60; т.п.: 215oC.
15.1) Гидрохлорид N-{ N – [O-(3-O-метил-b-D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-г – [O-(3-O-метил-b-D-галактопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил}-хинолона-гАналогично примеру 12.5 62,8 мг (0,22 ммоль) соединения примера 1.25 подвергают взаимодействию с 173,2 мг (0,2 ммоль) пептидного конъюгата примера 15.1.а). Промежуточный продукт очищают путем флеш-хроматографии с применением в качестве элюента сначала смеси дихлорметана, метанола и аммиака (25%) в соотношении 28:14:1, а потом смеси метанола и аммиака (25%) в соотношении 20:1. Получают 140,8 мг (65%) бежевых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 28: 14: 1; Rf= 0,06. Затем вышеописанным образом отщепляют флуоренил-9-метоксикарбонильную группу и очищают. Получают бежевые кристаллы, которые суспендируют в 10 мл воды. К суспензии при перемешивании прикапывают 0,1н. соляную кислоту до получения прозрачного раствора (pH > 3). Раствор фильтруют, лиофилизуют и получают 102,6 мг (57%) желтого аморфного твердого вещества. [  2D0] = -49,0 2D0] = -49,0 (с = 0,26/H2O).) (с = 0,26/H2O).)Аналогично примеру 15.1 из пептидного конъюгата примера 15.1.а) получают следующие гликоконъюгаты. Пример 15.2 Гидрохлорид N-{ N  – [O-(4-O-(3′-O-метил-b-D- галактопиранозил)-b-D-глюкопиранозил)-4-гидрокси- фениламино]-тиокарбонил]-лизил}-хинолона-г – [O-(4-O-(3′-O-метил-b-D- галактопиранозил)-b-D-глюкопиранозил)-4-гидрокси- фениламино]-тиокарбонил]-лизил}-хинолона-гИсходные соединения: 98,4 мг (0,22 ммоль) соединения примера 1.58, 173,2 мг (0,2 ммоль) пептидного конъюгата примера 15.1.а). Промежуточный продукт очищают путем флеш-хроматографии с применением в качестве элюента сначала смеси дихлорметана, метанола и аммиака (25%) в соотношении 20:10:1-10:10:1, а потом смеси метанола и аммиака (25%) в соотношении 20: 1. Получают 106,5 мг (43%) бежевых кристаллов. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (25%) в соотношении 10: 10: 3; Rf= 0,51. Затем вышеописанным образом отщепляют флуоренил-9-метоксикарбонильную группу и переводят в гидрохлорид. Получают 82,0 мг (39%) желтого аморфного твердого вещества, [  2D0] = +22,8 2D0] = +22,8 (с = 0,29/H2O).
Примеры 16: гликоконъюгаты с мелфаланом (с = 0,29/H2O).
Примеры 16: гликоконъюгаты с мелфаланомОбщая формула 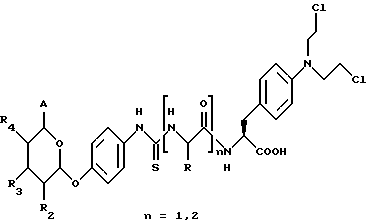 Пример 16.1 N-{ N’ -[O-(3-O-метил-  -L-фукопиранозил)-4- rидpoкcи-фенилaминo-тиокарбонил]-D-аланил}-мелфалан -L-фукопиранозил)-4- rидpoкcи-фенилaминo-тиокарбонил]-D-аланил}-мелфалан16.1.а) N-тpeт-бутoкcикapбoнил-D-aлaнил-мелфaлaн 114 мг (0,6 ммоль) N-трет-бутоксикарбонил-D-аланина растворяют в 10 мл ди-метилформамида. При 0oC к раствору добавляют 138 мг гидрохлорида N’-(3-диметиламинопропил)-N-этил-карбодиимида и 1-гидрокси-бензотриазол. Через 10 минут к смеси добавляют 153 мг мелфалана и перемешивают при комнатной температуре в течение 16 часов. Сгущают и распределяют между дихлорметаном и водой. Органическую фазу промывают, сушат над сульфатом натрия, сгущают и подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и аммиака (17%) в соотношении 15:2:0,2-15:4:0,5. Получают 134 мг (56%) целевого соединения. Тонкослойная хроматография: смесь дихлорметана, метанола и аммиака (17%) в соотношении 15:4:0,5: Rf= 0,45. 16.1 N-(N’-[O-(3-O-метил-  -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-D-аланил}-мелфалан -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-D-аланил}-мелфаланОтщепление защитной группы и сочетание с углеводом осуществляют описанным в примерах 9.1 или же 12.1 образом. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf = 0,26. Масс-спектр (бба): m/z = 685 = М-Н. Пример 16.2 N-(N’-[O-(3-O-метил-  -L-фукопиранозил)-4-гидрокси-фениламино- тиокарбонил]-аланил-аланил}-мелфалан -L-фукопиранозил)-4-гидрокси-фениламино- тиокарбонил]-аланил-аланил}-мелфаланЭто соединение можно получать аналогично примеру 16.1 через несколько стадий. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf = 0,2. Масс-спектр (бба): m/z = 756 = М-Н. Примеры 17: гликоконъюгаты с доксорубицином (адриамицином) Общая формула 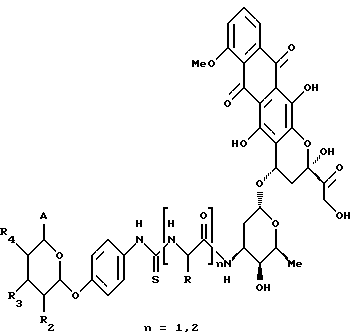 Пример 17.1 N-{ N’ [O-(3-O-метил-  -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-аланил-аланил}-доксорубицин -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-аланил-аланил}-доксорубицин17.1.а) N-[O-(3-O-метил-  -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил] -ананил-аланил -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил] -ананил-аланил160 мг (1 ммоль) аланил-аланина подают в 20 мл смеси диоксана и воды в соотношении 1:1, после чего добавляют 1 мл основания Хюнига. 1,2 ммоль п-аминофенил-3-О-метил-  -L-фукозида примера 1.2 аналогично примеру 10.1.a) сначала переводят в горчичное масло и потом подают в раствор дипептида. Перемешивают при комнатной температуре в течение 16 часов, сгущают и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси ацетонитрила и воды в соотношении 15:1. Соответствующие фракции сгущают и продукт осаждают из смеси метанола и диэтилового эфира. Выход: 267 мг (57%).
17.1) N-{N’-[O-(3-O-метил- -L-фукозида примера 1.2 аналогично примеру 10.1.a) сначала переводят в горчичное масло и потом подают в раствор дипептида. Перемешивают при комнатной температуре в течение 16 часов, сгущают и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси ацетонитрила и воды в соотношении 15:1. Соответствующие фракции сгущают и продукт осаждают из смеси метанола и диэтилового эфира. Выход: 267 мг (57%).
17.1) N-{N’-[O-(3-O-метил-  -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-аланил-аланил}-доксорубицин -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-аланил-аланил}-доксорубицин48 мг (0,1 ммоль) соединения примера 17.1.а) растворяют в 10 мл диметил-формамида, после чего смешивают с 23,1 мг гидрохлорида N’-(3-диметилами-нопропил)-N-этил-карбодиимида и 21 мг 1- гидрокси-бензотриазола. Через 5 минут к смеси добавляют 30 мг доксорубицина и 35 мкл основания Хюнига, после чего перемешивают при комнатной температуре в течение 30 минут. Сгущают и остаток очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 88:12. Соответствующие фракции сгущают и продукт лиофилизуют из смеси диоксана и воды. Получают 20 мг (40%) целевого соединения. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 10:1; Rf = 0,17. Масс-спектр (электронно-ударная ионизация): m/z = 997 = М+Н. Пример 17.2 N-{ N  ,N ,N – (бис-[O-(3-O-метил- – (бис-[O-(3-O-метил-  -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-D-лизил-аланил}-доксорубици -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-D-лизил-аланил}-доксорубици17.2. а) N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-D-лизил-аланин -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-D-лизил-аланин580 мг (1,31 ммоль) бис-трифторацетата D-лизил-аланина описанным в примере 17.1. а) образом связывают с 2,2 эквивалента углевода примера 1.2 в присутствии 1,3 мл основания Хюнига. Очищают путем флеш-хроматографии с применением в качестве элюента смеси ацетонитрилаи воды в соотношении 10:1. Получают 446 мг (41%) целевого соединения. 17.2) N-{ N  ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукопиранозил)-4- гидрокси-фенил-амино-тиокарбонил]-D-лизил-аланил}-доксорубицин -L-фукопиранозил)-4- гидрокси-фенил-амино-тиокарбонил]-D-лизил-аланил}-доксорубицин59 мг соединения примера 17.2.а) связывают с 20 мг доксорубицина описанным в примере 17.1 образом. Получают 15 мг конъюгата. Тонкослойная хроматография: смесь дихлорметана и метанола в соотношении 85:15; Rf = 0,43. Масс-спектр (бба): m/z = 1365 = М+Н. Примеры 18: гликоконъюгаты с камптотецином Общая формула 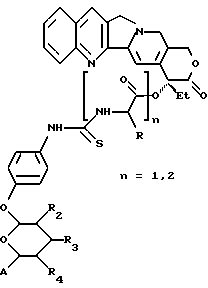 Пример 18.1 20-O- { N  ,N ,N – бис-[О-(3-О-метил- – бис-[О-(3-О-метил-  -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-аланил}-камптотецин -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-аланил}-камптотецин18.1.а) Трифторацетат 20-O-(аланил)-камптотецин 500 мг (1,44 ммоль) камптотецина растворяют в 20 мл диметилформамида и смешивают с 50 мг 4-диметиламинопиридина и N- трет-бутоксикарбонил-аланин-N-карбокси-ангидридом. По истечении 3 часовк смеси добавляют еще 775 мг N-трет-бутоксикарбонил-аланин- N-карбокси-ангидрида и суспензию обрабатывают ультразвуком в течение 16 часов. Сгущают, сырой материал подают в 50 мл дихлорметана и при 0oC к смеси добавляют 5 мл трифторуксусной кислоты. Перемешивают в течение 30 минут, еще раз сгущают и продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси ацетонитрила и воды в соотношении 20:1. Соответствующие фракции собирают, сгущают и лиофилизуют из смеси диоксана и воды. Выход: 712 мг (93%). Масс-спектр (бба): m/z = 420 = М+Н. 18.1.6) Бис-трифторацетат 20-O-(лизил-аланил)-камптотецина Конъюгат примера 18.1. а) стандартным образом связывают N  ,N ,N – бис-(трет-бутоксикарбонил)-лизином, после чего деблокируют. Выход целевого соединения: 65%.
18.1) 20-O-{ N – бис-(трет-бутоксикарбонил)-лизином, после чего деблокируют. Выход целевого соединения: 65%.
18.1) 20-O-{ N ,N ,N – бис-[O-(3-O-метил- – бис-[O-(3-O-метил-  -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-аланил}-камптотецин -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-аланил}-камптотецинп-аминофенил-3-O-метил-  -L-фукозида примера 1.2 связывают с конъюгатом примера 18.1. б) аналогично примеру 11.1. Выход: 40%. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf = 0,44.
Пример 18.2 -L-фукозида примера 1.2 связывают с конъюгатом примера 18.1. б) аналогично примеру 11.1. Выход: 40%. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 10:1; Rf = 0,44.
Пример 18.220-O-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-аланил}-камптотецин -L-фукопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-аланил}-камптотецин18.2. а) Трифторацетат 20-O- N  – (флуоренил-9-метоксикарбонил)- лизил-аланил]-камптотецина – (флуоренил-9-метоксикарбонил)- лизил-аланил]-камптотецинаКонъюгат примера 18.1. а) стандартным образом связывают с N  – трет-бутоксикарбонил)- N – трет-бутоксикарбонил)- N – (флуоренил-9-метоксикарбонил)-лизином, после чего деблокируют – (флуоренил-9-метоксикарбонил)-лизином, после чего деблокируют  аминофункции. Выход: 24% целевого соединения. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 20:1; Rf = 0,15.
18.2. б) 20-O-{ N аминофункции. Выход: 24% целевого соединения. Тонкослойная хроматография: смесь ацетонитрила и воды в соотношении 20:1; Rf = 0,15.
18.2. б) 20-O-{ N – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукопиранозил)-4-гидрокси-фенилaминo-тиoкapбoнил] N -L-фукопиранозил)-4-гидрокси-фенилaминo-тиoкapбoнил] N – (флуopeнил-9-мeтoкcикapбoнил)-лизил-аланил]-камптотецин – (флуopeнил-9-мeтoкcикapбoнил)-лизил-аланил]-камптотецинСоединение примера 18.1.а) аналогично примеру 12.6 или же 12.5 модифицируют производным углевода примера 1.10. Сырой продукт очищают путем дигерирования водой, после чего лиофилизуют из смеси диоксана и воды. Продукт подают на следующую стадию без дальнейшей обработки. 18.2) 20-O- N  – [O-(3-О-карбоксиметил- – [O-(3-О-карбоксиметил-  -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-аланил}-камптотецин -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-аланил}-камптотецинКонъюгат примера 18.2.6) деблокируют с помощью пиперидина в диметилформамиде. По истечении 30 минут сгущают и остаток дважды дигерируют дихлорметаном. Потом продукт подают в диметилформамид и осаждают смесью метанола и диэтилового эфира. Продукт отсасывают, промывают диэтиловым эфиром и лиофилизуют из смеси диоксана и воды. Выход: 86%. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1: 0,2; Rf = 0,17. Пример 18.3 Натриевая соль 20-O- N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L- фукопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил- аланил}-камптотецина -L- фукопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил- аланил}-камптотецина62 мг (0,074 ммоль) конъюгата примера 18.2 подают в смесь диоксана и воды и переводят в натриевую соль с помощью 1 эквивалента 0,1н. натрового щелока. Выход: колич. Тонкослойная хроматография: смесь ацетонитрила, воды и ледяной уксусной кислоты в соотношении 5:1:0,2; Rf= 0,17. Аналогично примерам 18.1 и 18.2 получают следующие гликоконъюгаты камптотецина. Пример 18.4 20-O-{ N  ,N ,N – бис-[O(3-О-метил- – бис-[O(3-О-метил-  -L-фукопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил} -камптотецин -L-фукопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-D-аланил} -камптотецинПример 18.5 20-O-{ N  ,N ,N – биc-[O-(3-O-метил- – биc-[O-(3-O-метил-  -L-фукопиранозил)-4-гидpoкcи- фенилaминo-тиокарбонил]-лизил-валинил}-камптотецин -L-фукопиранозил)-4-гидpoкcи- фенилaминo-тиокарбонил]-лизил-валинил}-камптотецинПример 18.6 20-O-{ N  – [O-(3-O-кapбoкcимeтил- – [O-(3-O-кapбoкcимeтил-  -L-фукoпиpaнoзил)-4-гидpoкcи- фениламин-тиокарбонил]-лизил-валинил}-камптотецин -L-фукoпиpaнoзил)-4-гидpoкcи- фениламин-тиокарбонил]-лизил-валинил}-камптотецинПример 18.7 20-O- N  – [O(3-О-метил- – [O(3-О-метил-  -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-валинил}-камптотецин -D-галактопиранозил)-4-гидрокси- фениламино-тиокарбонил]-лизил-валинил}-камптотецинПример 18.8 20-O-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-аланил}-камптотецин -D-галактопиранозил)- 4-гидрокси-фениламино-тиокарбонил]-лизил-аланил}-камптотецинПример 18.9 Гидрохлорид 20-O-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L- фукопиранозил)-4-гидроксифениламино-тиокарбонил]-лизил- валинил}-камптотецина -L- фукопиранозил)-4-гидроксифениламино-тиокарбонил]-лизил- валинил}-камптотецинаСоединение примера 18.6 переводят в гидрохлорид с помощью эквивалента 0,01н. соляной кислоты. Пример 18.10 Гидрохлорид 20-O-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукопиранозил)-4-гидрокси- фениламино-гиокарбонил]-лизил-аланил}-камптотецина -L-фукопиранозил)-4-гидрокси- фениламино-гиокарбонил]-лизил-аланил}-камптотецинаСоединение примера 18.2 переводят в гидрохлорид с помощью эквивалента 0,01-н. соляной кислоты. Пример 18.11 Гидрохлорид 20-O-{ N  – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-фенилаланил}-камптотецина -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-фенилаланил}-камптотецинаПример 18.12 Натриевая соль 20-O-{ N  ,N ,N – [O-(3-O-карбоксиметил- – [O-(3-O-карбоксиметил-  -L-фукопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-аланил}- камптотецина -L-фукопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил-аланил}- камптотецинаПример 18.13 Натриевая соль 20-O-{ N  ,N ,N – бис-[O-(3-O-карбоксиметил- – бис-[O-(3-O-карбоксиметил-  -L-фукопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил- валинил}-камптотецина -L-фукопиранозил)-4-гидрокси-фениламино-тиокарбонил]-лизил- валинил}-камптотецинаПример 18.14 Гидрохлорид 20-O-{ N  – [O-(3-O-метил- – [O-(3-O-метил-  -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-аланил}-камптотецина -L-фукопиранозил)-4- гидрокси-фениламино-тиокарбонил]-лизил-аланил}-камптотецина
Формула изобретения
K – Sp – L – AA1 – AA2 – C, где K – незамещенный или региоселективно модифицированный углеводный остаток, Sp – арилен формулы 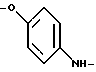 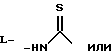 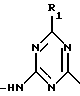 где R1 означает хлор или гидроксиалкиламино; AA1 – остаток аминокислоты в D- или L-конфигурации, который может иметь защитные группы или вторую группу K – Sp – L-, в которой K, Sp, L независимо от другой группы K – Sp -L могут иметь вышеуказанные значения, или прямая связь; AA2 – остаток аминокислоты в D- или L-конфигурации, который может иметь защитные группы, или прямая связь; C – цитостатический остаток, остаток цитостатического средства или производного цитостатического средства, и их изомеры и соли. 2. Модифицированные углеводами соединения общей формулы I по п.1, где K – углеводный остаток формулы II 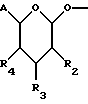 где A – метил, гидроксиметил, алкоксиметил, карбоксиалкилоксиметил; R2, R3, R4 отдельно или вместе означают водород, гидроксил, алкилокси, гидроксиалкилокси, карбоксиалкилкарбонилокси, сульфат, галоген, или два из остатков R2, R3, R4 вместе означают эпоксигруппу, и Sp, L, AA1, AA2 и C имеют указанные в п.1 значения, и их изомеры и соли. 3. Модифицированные углеводами соединения общей формулы I по п.1, где Sp – арилен формулы  K, L, AA1, AA2 и C имеют указанные в п.1 значения, и их изомеры и соли. 4. Модифицированные углеводами соединения общей формулы I по п.1, где C – хинолонкарбоновая кислота (а, б, в и г), батрацилин, камптотецин, доксорубицин, мелфалан, K, Sp, L, AA1 и AA2 имеют указанные в п.1 значения, и их изомеры и соли. 5. Модифицированные углеводами соединения общей формулы I по п.1, где AA1 – остаток аминокислоты, производимый от глицина, аланина, валина, лизина, аспарагиновой кислоты, глутаминовой кислоты, орнитина, тирозина, или серина в D- или L-конфигурации, который может быть связан с дополнительной группой R – Sp – L, или прямая связь, K, Sp, L, AA2 и C имеют указанные в п. 1 значения, и их изомеры и соли. 6. Модифицированные углеводами соединения общей формулы I по п.1, где AA2 – остаток аминокислоты, производимый от глицина, аланина, лизина, орнитина, диаминопропионовой кислоты или серина в D- или L-конфигурации, или прямая связь, K, Sp, L, AA1 и C имеют указанные в п.1 значения, и их изомеры и соли. 7. Модифицированные углеводами соединения общей формулы I по п.1, где C означает остаток формулы III T – Q где Q – остаток формулы 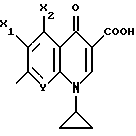 где Y = C-R, где R означает водород, галоген или метокси; X1 – водород, галоген; X2 – водород, аминогруппа, или Q – остаток формулы 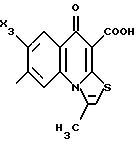 где X3 означает галоген; T – остаток формул 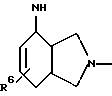 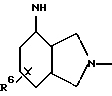 где R6 – водород, алкил с 1-3 атомами углерода, и K, Sp, L, AA1 и AA2 имеют указанные в п.1 значения, и их изомеры и соли. 8. Цитостатическое средство, содержащее одно соединение по пп.1 – 7. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 23.03.2004
Извещение опубликовано: 27.04.2005 БИ: 12/2005
|
||||||||||||||||||||||||||
