Патент на изобретение №2170233
|
||||||||||||||||||||||||||
(54) ЗАМЕЩЕННЫЕ МОРФОЛИНЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПРОТИВОДЕЙСТВИЯ ВЕЩЕСТВУ Р ИЛИ БЛОКИРОВАНИЯ РЕЦЕПТОРОВ НЕЙРОКИНИНА-1
(57) Реферат: Предложены замещенные морфолины формулы I или их фармацевтически приемлемые соли, где R2 и R3 каждый означает водород; R6, R7 и R8 выбирают из водорода, фтора или CF3; R11, R12 и R13 каждый независимо означает водород или галоген; A представляет незамещенный C1-6 алкилен; B представляет гетероцикл, выбранный из 1,2,4-триазолила, 5-оксо-1,2,4-триазолила, 2-оксо-1,3-имидазолила или имидазолила, замещенного X, где X означает остаток соли фосфорила -PO(O–)2  2M+ и M+ является фармацевтически приемлемым одновалентным противоионом, Y представляет -O-; Z – атом водорода или C1-6 алкил; p = 0. Соединения формулы I получают путем фосфорилирования соответствующих исходных производных морфолина фосфорилпереносящим реагентом. Технический результат – получение новых соединений – антагонистов вещества P и нейрокинина-1, которые являются пролекарствами и имеют повышенную растворимость в водных растворах по сравнению с родительскими лекарственными средствами. Предложена также фармацевтическая композиция, проявляющая активность блокирования рецепторов нейрокинина-1, содержащая эффективное количество соединения формулы I. Кроме того, предложен способ противодействия вещества P у сайта его рецепторов или блокирования рецепторов нейрокинина-1. 4 с. и 18 з. п. ф-лы. 2M+ и M+ является фармацевтически приемлемым одновалентным противоионом, Y представляет -O-; Z – атом водорода или C1-6 алкил; p = 0. Соединения формулы I получают путем фосфорилирования соответствующих исходных производных морфолина фосфорилпереносящим реагентом. Технический результат – получение новых соединений – антагонистов вещества P и нейрокинина-1, которые являются пролекарствами и имеют повышенную растворимость в водных растворах по сравнению с родительскими лекарственными средствами. Предложена также фармацевтическая композиция, проявляющая активность блокирования рецепторов нейрокинина-1, содержащая эффективное количество соединения формулы I. Кроме того, предложен способ противодействия вещества P у сайта его рецепторов или блокирования рецепторов нейрокинина-1. 4 с. и 18 з. п. ф-лы.
Аналгезия исторически достигалась в центральной нервной системе опиатами и аналогами, которые являются наркотиками и периферически ингибиторами циклооксигеназы, которые обладают желудочными побочными эффектами. Антагонисты вещества P могут индуцировать аналгезию как центрально, так и периферически. Кроме того, антагонисты вещества P являются ингибиторами нейрогенного воспаления. Нейропептидные рецепторы вещества P (нейрокинин-1; NK-1) широко распространены во всей нервной системе млекопитающих (особенно ганглиях головного мозга и спинномозговых ганглиях), сердечно-сосудистой системе и периферических тканях (особенно двенадцатиперстной кишке и тощей кишке) и принимают участие в регулировании ряда разнообразных биологических процессов. Оно включает сенсорное восприятие обоняния, зрения, слуха и боли, управление движением, двигательную функцию желудка, расширение кровеносных сосудов, слюноотделение и мочеиспускание (B. Pernow, Pharmacol. Rev., 1983, 35, 85-141). Подтипы рецепторов NK1 и NK2 соучаствуют в синаптической передаче [Laneuville et al., Life Sci., 42; 1295-1305 (1988)]. Рецептор вещества P является членом суперсемейства G-белок-связанных рецепторов. Это суперсемейство является крайне разнообразной группой рецепторов исходя из активирующих лигандов и биологических функций. Кроме рецепторов тахикининов это суперсемейство рецепторов включает опсины, адренергические рецепторы, мускариновые рецепторы, рецепторы допамина, рецепторы серотонина, рецептор тиреотропного гормона, рецептор лютеинизирующего гормона-хорионического гонадотропного гормона, продукт онкогена ras, рецепторы фактора скрещивания дрожжей, рецептор сАМР(цАМФ) Dictiostelium и рецепторы других гормонов и нейротрансмиттеров (см. A.D.Hershey et al., J. Biol. Chem. , 1991, 226, 4366-4373). Вещество P (называемое здесь также SP) является природным ундекапептидом, принадлежащим к тахикининовому семейству пептидов, причем последние так названы из-за их быстрого сократительного действия на экстраваскулярную ткань гладких мышц. Эти тахикинины отличаются сохраняемой карбоксил-концевой последовательностью Phe-X-Gly-Leu-Met-NH2. Кроме SP известные тахикинины млекопитающих включают нейрокинин A и нейрокинин B. Принятая в настоящее время номенклатура обозначает рецепторы SP, нейрокинина A и нейрокинина В как NK-1, NK-2 и NK-3 соответственно. Более конкретно, вещество P является фармакологически активным нейропептидом, который продуцируется в организме млекопитающих и имеют характеристичную аминокислотную последовательность [Chang et al., Nature New Biol. 23286 (1971); D.F. Veber et al., US Patent N 4680283]. Вещество P является фармакологически активным нейропептидом, которое продуцируется в организме млекопитающих и действует в качестве сосудорасширяющего фактора, депрессанта, стимулирует слюноотделение и вызывает повышенную проницаемость капилляров. Оно способно также вызывать у животных в зависимости от дозы и болевой чувствительности животного как аналгезию, так и гипералгезию [см. R.C.A. Frederickson et al., Science, 199, 1359 (1978); P. Oehme et al., Science, 208, 305 (1980)] и играет роль в сенсорной передаче и болевом восприятии [T.M. Jessell, Advan. Biochem. Psychopharmacol., 28, 189 (1981)] . Например, полагают, что вещество P вовлекается в нейропередачу болевых ощущений [Otsuka et al., “Role of Subtance P as a Sensory Transmitter in Spinal Cord and Sympathetic Ganglia” in 1982 Substance Pin the Nervous System, Ciba Foundation Symposium 91, 13-34 (published by Pitman) and Otsuka and Yanagisawa, “Doses Substance P act as a Pain Transmitter?” TIPS, 8, 506-510 (Dec. 1987)] , в частности в передаче боли при мигрени [см. В.E.В. Sandberg et al., Journal of Medicinal Chemistry, 25, 1009 (1982); M.A. Moskowitz, Trends Pharmacol. Sci., 13, 307-311 (1992)] и артрите [Levine, et al. , Science, 226, 547-549 (1984); M. Lotz. et al., Science, 235, 893-895 (1987)] . Тахикинины вовлекались также в желудочно-кишечные (GI) нарушения и заболевания GI тракта, например воспалительное заболевание кишечника [см. Mantyh et al., Neuroscience, 25(3), 817-37 (1988) and D. Regoli in “Trends in Cluster Headache” Ed. F. Sicuteri et al., Elsevier Scientific Publishers, Amsterdam, p. 85-95 (1987)] и рвоту [Trends in Pharmacol. Sci., 9, 334-341 (1988), F.D. Tatersall, et al., Eur. J. Pharmacol., 250, R5-R6 (1993)]. Высказывается также гипотеза, что для артрита имеется нейрогенный механизм, в котором может играть роль вещество P [Kidd et al., “A Neurogenic Mechanism for Summetric Artritis” in The Lancet, 11 November 1989 and Gronblad et al. “Neuropeptides in Synovium of Patients with Rheumatoid Arthritis and Osteoarthritis”, J. Rheumatol. 15(12) 1807-10 (1988)]. Поэтому полагают, что вещество P вовлекается в воспалительную реакцию в таких заболеваниях, как ревматический артрит и остеоартрит [O’Byrne, et al., Arthritis and Rheumatism, 33, 1023-8 (1990)]. Доказательство пользы антагонистов рецепторов тахикининов при боли, головной боли, особенно мигрени, болезни Альцгеймера, рассеянном склерозе, ослаблении синдрома отмены морфина, сердечно-сосудистых изменениях, отеке, например отеке, вызванном термическим повреждением, хронических воспалительных болезнях, например ревматическом артрите, астме, бронхиальной повышенной реактивности и других респираторных заболеваниях, включающих аллергический ринит, воспалительных болезнях кишечника, включая язвенный колит и болезнь Chrohn’s, глазном повреждении и глазных воспалительных болезнях, пролиферативной витреоретинопатии, синдроме раздражимого кишечника и нарушениях функции мочевого пузыря, включая цистит и гиперрефлексию сжимателя мочевого пузыря, рассматривается в “Tachikinin Receptors and Tachikin Receptor Antagonists”, C.A. Maggi, R. Patacchini, P. Robero and A. Giachetti, J. Auton. Pharmacol. , 13, 23-93 (1933); см. также R.M. Snider at al., Chem. Ind., 792-794 (1991). Только антагонисты рецептора нейрокинина-1 или эти антагонисты в комбинации с антагонистами рецептора брадикинина могут быть также полезны для предупреждения и лечения воспалительных состояний в нижней части мочевых путей, особенно цистита [Giuliani et al., J. Urology, 150, 1014-1017 (1993)]. Полагают, что другими заболеваниями, где антагонисты тахикининов полезны, являются аллергические состояния [Hamelet et al., Can. J. Pharmacol. Physiol. , 66, 1361-7 (1988)], иммунорегулирование [Lotz et al., 241, 1218-21 (1988), Kimball, et al., J. Immunol., 141 (10), 3564-9 (1988); A. Perianin et al., Biochem. Biophys. Res. Commun. 161, 520 (1989)]; послеоперационная боль и тошнота [C. Bountra, et al., Eur. J. Pharmacol., 249, R3-R4 (1993), F.D. Tattersall et al., Neuropharmacology, 33, 259-260 (1994)] , расширение кровеносных сосудов, бронхоспазм, рефлекторная или нейронная регуляция деятельности внутренних органов [Mantyh et al., PNAS, 85, 3235-9 (1988)] и, возможно, прекращение или замедление  -амилоид-медиированных нейродегенеративных изменений [Yankner et al., Science, 250, 279-82 (1990)] при старческом слабоумии типа Альцгеймера, болезни Альцгеймера и синдроме Дауна. Вещество P может играть также роль в демиелинизирующих заболеваниях, например рассеянном склерозе и боковом амиотрофическом склерозе [J. Luber-Narod, et al., poster C.I.N.P. XVIII Congress, 28th June-2nd July, 1992] и в нарушениях функции мочевого пузыря, например гиперрефлексии сжимателя мочевого пузыря (Lancet, 16th May 1992, 1239]. Антагонисты, селективные для рецептора нейрокинина-1 (NK-1) и/или нейрокинина-2 (NK-2), могут быть полезны при лечении астматического заболевания (Frossard et al., 49, 1941-1953 (1991); Advenier, et al., Life Sci., Biochem. Biophys. Res. Comm., 184(3), 1418-1424 (1992); P. Barnes, et al., Trends Pharmacol. Sci., 11, 185-189 (1993)). Антагонисты тахикининов могут быть также полезны при лечении мелкоклеточных раков, в частности мелкоклеточного рака легких (SCLC) [Langdon et al., Cancer Research, 52, 4554-7 (1992)].
Кроме того, было предположено, что антагонисты рецепторов тахикининов имеют применение при следующих нарушениях: депрессии, дистимических нарушениях, хронической обструкции дыхательных путей, аллергических нарушениях, например вызванных ядовитым плющем, вазоспастических болезнях, например стенокардии и болезни Reynauld’s фиброзных и коллагеновых болезнях, например склеродермии и эозинофильном фасциолезе, рефлекторной симпатической дистрофии, например плечевом синдроме, нарушениях, связанных с аддикцией, например алкоголизме, связанных со стрессами соматических нарушениях, невропатии, невралгии, нарушении, связанном с иммунным усилением или подавлением, например системной красной волчанке (EPO Publication N 436334), глазных болезнях, например конъюнктивите, весеннем конъюнктивите и подобном, и кожных болезнях, например дерматите, атопическом дерматите, крапивнице, и других экземоподобных дерматитах (EPO Publication N 0394989).
Антагонисты вещества P могут быть полезны при медиировании нейрогенной секреции слизи в дыхательных путях млекопитающих и, следовательно, лечении и симптоматическом ослаблении при болезнях, характеризующихся секрецией слизи, в частности муковисцидоза [S. Ramnarine, et al., abstract presented at 1993 ALA/ATS Int’l Conterence, 16-19, 1993, published in Am. Rev. of Respiratory Dis. May, 1993].
Недавно некоторые попытки были сделаны для получения пептидоподобных веществ, которые являются антагонистами рецепторов вещества P и других тахикининовых пептидов, чтобы более эффективно лечить указанные выше различные нарушения и болезни. Например, Lowe в Drugs of Future, 17 (12), 1115-1121 (1992) и публикация EPO N 0347802, 0401177 и 0412452 описывают разные пептиды в качестве антагонистов нейрокинина A. В патентной публикации PCT WO 93/14113 некоторые пептиды описываются в качестве антагонистов тахикининов. Кроме того, в публикации EPO N 0336230 описываются гептапептиды, которые являются антагонистами вещества P, полезными при лечении астмы. В патенте США N 4680283 (Меrck) описываются также пептидные аналоги вещества Р. В патенте США N 4501733 описываются некоторые ингибиторы тахикининов, у которых остатки в последовательности вещества P заменены на остатки Тrр. Другой класс антагонистов рецепторов тахикининов, содержащих мономерное или димерное гекса- или гептапептидное звено в линейной или циклической форме, описывается в патенте Великобритании A-2216529.
Пептидоподобная природа таких веществ делает их с метаболической точки зрения слишком лабильными, чтобы служить в качестве практических терапевтических средств при лечении болезни. Непептидные антагонисты данного изобретения, с другой стороны, не обладают таким недостатком, так как они, как ожидается, более стабильны с метаболической точки зрения, чем предварительно обсужденные средства.
Внастоящейобластиизвестно,чтобаклофен( -амилоид-медиированных нейродегенеративных изменений [Yankner et al., Science, 250, 279-82 (1990)] при старческом слабоумии типа Альцгеймера, болезни Альцгеймера и синдроме Дауна. Вещество P может играть также роль в демиелинизирующих заболеваниях, например рассеянном склерозе и боковом амиотрофическом склерозе [J. Luber-Narod, et al., poster C.I.N.P. XVIII Congress, 28th June-2nd July, 1992] и в нарушениях функции мочевого пузыря, например гиперрефлексии сжимателя мочевого пузыря (Lancet, 16th May 1992, 1239]. Антагонисты, селективные для рецептора нейрокинина-1 (NK-1) и/или нейрокинина-2 (NK-2), могут быть полезны при лечении астматического заболевания (Frossard et al., 49, 1941-1953 (1991); Advenier, et al., Life Sci., Biochem. Biophys. Res. Comm., 184(3), 1418-1424 (1992); P. Barnes, et al., Trends Pharmacol. Sci., 11, 185-189 (1993)). Антагонисты тахикининов могут быть также полезны при лечении мелкоклеточных раков, в частности мелкоклеточного рака легких (SCLC) [Langdon et al., Cancer Research, 52, 4554-7 (1992)].
Кроме того, было предположено, что антагонисты рецепторов тахикининов имеют применение при следующих нарушениях: депрессии, дистимических нарушениях, хронической обструкции дыхательных путей, аллергических нарушениях, например вызванных ядовитым плющем, вазоспастических болезнях, например стенокардии и болезни Reynauld’s фиброзных и коллагеновых болезнях, например склеродермии и эозинофильном фасциолезе, рефлекторной симпатической дистрофии, например плечевом синдроме, нарушениях, связанных с аддикцией, например алкоголизме, связанных со стрессами соматических нарушениях, невропатии, невралгии, нарушении, связанном с иммунным усилением или подавлением, например системной красной волчанке (EPO Publication N 436334), глазных болезнях, например конъюнктивите, весеннем конъюнктивите и подобном, и кожных болезнях, например дерматите, атопическом дерматите, крапивнице, и других экземоподобных дерматитах (EPO Publication N 0394989).
Антагонисты вещества P могут быть полезны при медиировании нейрогенной секреции слизи в дыхательных путях млекопитающих и, следовательно, лечении и симптоматическом ослаблении при болезнях, характеризующихся секрецией слизи, в частности муковисцидоза [S. Ramnarine, et al., abstract presented at 1993 ALA/ATS Int’l Conterence, 16-19, 1993, published in Am. Rev. of Respiratory Dis. May, 1993].
Недавно некоторые попытки были сделаны для получения пептидоподобных веществ, которые являются антагонистами рецепторов вещества P и других тахикининовых пептидов, чтобы более эффективно лечить указанные выше различные нарушения и болезни. Например, Lowe в Drugs of Future, 17 (12), 1115-1121 (1992) и публикация EPO N 0347802, 0401177 и 0412452 описывают разные пептиды в качестве антагонистов нейрокинина A. В патентной публикации PCT WO 93/14113 некоторые пептиды описываются в качестве антагонистов тахикининов. Кроме того, в публикации EPO N 0336230 описываются гептапептиды, которые являются антагонистами вещества P, полезными при лечении астмы. В патенте США N 4680283 (Меrck) описываются также пептидные аналоги вещества Р. В патенте США N 4501733 описываются некоторые ингибиторы тахикининов, у которых остатки в последовательности вещества P заменены на остатки Тrр. Другой класс антагонистов рецепторов тахикининов, содержащих мономерное или димерное гекса- или гептапептидное звено в линейной или циклической форме, описывается в патенте Великобритании A-2216529.
Пептидоподобная природа таких веществ делает их с метаболической точки зрения слишком лабильными, чтобы служить в качестве практических терапевтических средств при лечении болезни. Непептидные антагонисты данного изобретения, с другой стороны, не обладают таким недостатком, так как они, как ожидается, более стабильны с метаболической точки зрения, чем предварительно обсужденные средства.
Внастоящейобластиизвестно,чтобаклофен( -(аминоэтил)-4-хлорбензолпропановая кислота) эффективно блокирует в центральной нервной системе возбудительную активность вещества P и, кроме того, ингибирует ответные реакции на возбуждение другими соединениями, например ацетилхолином и глутаматом. Заявки на патент Pfizer WIPO (PCT Publication N WO 90/05525, WO 90/05729, WO 91/18899, WO 92/12151 и WO 92/12152) и публикации [Science, 251, 435-437 (1991); Science, 251, 437-439 (1991); J. Med. Chem., 35, 2591-2600 (1992)] описывают производные 2-арилметил-3-замещенные аминохинуклидинов как полезные в качестве антагонистов вещества P при лечении желудочно-кишечных нарушений, нарушений деятельности центральной нервной системы, воспалительных болезней и боли или мигрени. Заявка на eвропейский патент Glaxo (EPO Publication N 0360390) описывает различные спиролактамзамещенные аминокислоты и пептиды, которые являются антагонистами или агонистами вещества P. Заявка на патент Pfizer IPO (PCT Publication N WO 92/06079) описывает конденсированные в ядре аналоги азотсодержащих неароматических гетероциклов как полезные для лечения болезней, медиированных избытком вещества P. Заявка на патент Pfizer WIPO (PCT Publication N WO 92/15585) описывает производные 1-азабицикло[3.2.2] нонан-3-амина в качестве антагонистов вещества P. Заявка на патент Pfizer WIPO (PCT Publication N WO 93/10073) описывает производные этилендиамина в качестве антагонистов вещества P. Публикация PCT N WO 93/01169 описывает некоторые ароматические соединения в качестве антагонистов рецепторов тахикининов. Публикация Sanofi [Life Sci., 50, PL101-PL106 (1992)] описывает производное 4-фенил-пиперидина в качестве антагониста рецептора нейрокинина A (NK2).
Howson и др. (Biorg. and Меd. Chem. Lett., 2(6), 559-564 (1992) описывают некоторые соединения 3-амино- и 3-оксихинуклидинов и их связывание с рецепторами вещества P. Публикация EPO 0499313 описывает некоторые 3-окси- и 3-тиоазабициклические соединения в качестве антагонистов тахикининов. В патенте США N 3506673 описываются некоторые соединения 3-гидроксихинуклидина в качестве стимуляторов центральной нервной системы. Заявка на патент EPO Pfizer (EPO Publication 0436334) описывает некоторые соединения 3- аминопиперидина в качестве антагонистов вещества P. В патенте США N 5064838 в качестве аналгетиков описываются некоторые 1,4- дизамещенные пепиридинилсоединения. В публикации PCT N WO 92/12128 в качестве аналгетиков описываются некоторые соединения пиперидина и пирролидина. Peyronel и др. [Biorg. and Med. Chem. Lett., 2(!), 37-40 (1992)] описывают конденсированное в ядре соединение пирролидина в качестве антагониста вещества P. В публикации EPO N 0360390 описываются некоторые производные спиролактама в качестве антагонистов вещества P. Патент США N 4804661 описывает некоторые соединения пиперазина в качестве аналгетиков. В патенте США N 4943578 описываются некоторые соединения пиперазина, полезные при лечении боли. Публикация PCT N WO 92/01679 описывает некоторые 1,4-дизамещенные пиперазины, полезные при лечении психических расстройств, в которых имеет место допаминергический дефицит. Публикация PCT N WO 94/00440 и публикация EPO N 0577394 описывают некоторые морфолиновые и тиоморфолиновые антагонисты вещества P, некоторые из которых являются “родительскими” соединениями пролекарств данного описания.
Пролекарства по существу структурно относят к биологически активному веществу (“родительскому лекарственному средству”), которое после введения высвобождает “родительское” лекарственное средство в результате некоторого метаболического процесса, например ферментативного или химического гидролиза карбонового, фосфорного или сульфатного эфира или восстановления, или окисления восприимчивой функциональной группы [см., например, обсуждения, проведенные (1) A. A. Sinkula and S.H. Yalkowsky, J. Parm. Sci., 64, 181(1975); (2) L. A. Svensson. Pharm. Weekbl. 122, 245-250 (1987); (3) L.P. Balant, E. Doelker and P. Buri Eur. J. Drug Metab, and Pharmacokinetics, 15, 143-153 (1990); (4) N. Bodor, Drugs of Future, 6, 165-182 (1981); (5) Design of Biopharmaceutical Properties through Prodrugs and Analogs, E.B. Roche, Ed., American Pharmaceutical Association Academy of Pharmaceutical Sciences, Washington, DC (1977); (6) H. Bundgaard Advanced Drug Delivery Reviews, 3, 39-65 (1989)]. Преимущество пролекарства может заключаться в его физических свойствах, например повышенной растворимости в воде при парентеральном введении по сравнению с “родительским” лекарственным средством, или в том, что оно может повышать адсорбцию из пищеварительного тракта, или может повышать стабильность лекарственного средства при долговременном хранении. Обычно пролекарство обладает меньшей биологической активностью, чем его “родительское” лекарственное средство.
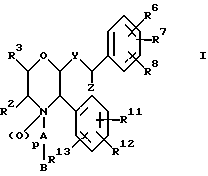
Данное изобретение относится к новым соединениям, представленным структурной формулой I -(аминоэтил)-4-хлорбензолпропановая кислота) эффективно блокирует в центральной нервной системе возбудительную активность вещества P и, кроме того, ингибирует ответные реакции на возбуждение другими соединениями, например ацетилхолином и глутаматом. Заявки на патент Pfizer WIPO (PCT Publication N WO 90/05525, WO 90/05729, WO 91/18899, WO 92/12151 и WO 92/12152) и публикации [Science, 251, 435-437 (1991); Science, 251, 437-439 (1991); J. Med. Chem., 35, 2591-2600 (1992)] описывают производные 2-арилметил-3-замещенные аминохинуклидинов как полезные в качестве антагонистов вещества P при лечении желудочно-кишечных нарушений, нарушений деятельности центральной нервной системы, воспалительных болезней и боли или мигрени. Заявка на eвропейский патент Glaxo (EPO Publication N 0360390) описывает различные спиролактамзамещенные аминокислоты и пептиды, которые являются антагонистами или агонистами вещества P. Заявка на патент Pfizer IPO (PCT Publication N WO 92/06079) описывает конденсированные в ядре аналоги азотсодержащих неароматических гетероциклов как полезные для лечения болезней, медиированных избытком вещества P. Заявка на патент Pfizer WIPO (PCT Publication N WO 92/15585) описывает производные 1-азабицикло[3.2.2] нонан-3-амина в качестве антагонистов вещества P. Заявка на патент Pfizer WIPO (PCT Publication N WO 93/10073) описывает производные этилендиамина в качестве антагонистов вещества P. Публикация PCT N WO 93/01169 описывает некоторые ароматические соединения в качестве антагонистов рецепторов тахикининов. Публикация Sanofi [Life Sci., 50, PL101-PL106 (1992)] описывает производное 4-фенил-пиперидина в качестве антагониста рецептора нейрокинина A (NK2).
Howson и др. (Biorg. and Меd. Chem. Lett., 2(6), 559-564 (1992) описывают некоторые соединения 3-амино- и 3-оксихинуклидинов и их связывание с рецепторами вещества P. Публикация EPO 0499313 описывает некоторые 3-окси- и 3-тиоазабициклические соединения в качестве антагонистов тахикининов. В патенте США N 3506673 описываются некоторые соединения 3-гидроксихинуклидина в качестве стимуляторов центральной нервной системы. Заявка на патент EPO Pfizer (EPO Publication 0436334) описывает некоторые соединения 3- аминопиперидина в качестве антагонистов вещества P. В патенте США N 5064838 в качестве аналгетиков описываются некоторые 1,4- дизамещенные пепиридинилсоединения. В публикации PCT N WO 92/12128 в качестве аналгетиков описываются некоторые соединения пиперидина и пирролидина. Peyronel и др. [Biorg. and Med. Chem. Lett., 2(!), 37-40 (1992)] описывают конденсированное в ядре соединение пирролидина в качестве антагониста вещества P. В публикации EPO N 0360390 описываются некоторые производные спиролактама в качестве антагонистов вещества P. Патент США N 4804661 описывает некоторые соединения пиперазина в качестве аналгетиков. В патенте США N 4943578 описываются некоторые соединения пиперазина, полезные при лечении боли. Публикация PCT N WO 92/01679 описывает некоторые 1,4-дизамещенные пиперазины, полезные при лечении психических расстройств, в которых имеет место допаминергический дефицит. Публикация PCT N WO 94/00440 и публикация EPO N 0577394 описывают некоторые морфолиновые и тиоморфолиновые антагонисты вещества P, некоторые из которых являются “родительскими” соединениями пролекарств данного описания.
Пролекарства по существу структурно относят к биологически активному веществу (“родительскому лекарственному средству”), которое после введения высвобождает “родительское” лекарственное средство в результате некоторого метаболического процесса, например ферментативного или химического гидролиза карбонового, фосфорного или сульфатного эфира или восстановления, или окисления восприимчивой функциональной группы [см., например, обсуждения, проведенные (1) A. A. Sinkula and S.H. Yalkowsky, J. Parm. Sci., 64, 181(1975); (2) L. A. Svensson. Pharm. Weekbl. 122, 245-250 (1987); (3) L.P. Balant, E. Doelker and P. Buri Eur. J. Drug Metab, and Pharmacokinetics, 15, 143-153 (1990); (4) N. Bodor, Drugs of Future, 6, 165-182 (1981); (5) Design of Biopharmaceutical Properties through Prodrugs and Analogs, E.B. Roche, Ed., American Pharmaceutical Association Academy of Pharmaceutical Sciences, Washington, DC (1977); (6) H. Bundgaard Advanced Drug Delivery Reviews, 3, 39-65 (1989)]. Преимущество пролекарства может заключаться в его физических свойствах, например повышенной растворимости в воде при парентеральном введении по сравнению с “родительским” лекарственным средством, или в том, что оно может повышать адсорбцию из пищеварительного тракта, или может повышать стабильность лекарственного средства при долговременном хранении. Обычно пролекарство обладает меньшей биологической активностью, чем его “родительское” лекарственное средство.
Данное изобретение относится к новым соединениям, представленным структурной формулой I где R2, B3, R6, R7, R8, R11, R12, R13, A, B, p, Y и Z имеют значения, указанные ниже. Данное изобретение относится также к фармацевтическим готовым препаративным формам, содержащим эти новые соединения в качестве активных ингредиентов, и применению данных новых соединений и их готовых препаративных форм при лечении некоторых нарушений. Соединения данного изобретения являются антагонистами рецепторов тахикининов и полезны при лечении воспалительных болезней, боли или мигрени, астмы и рвоты. Новые соединения данного изобретения представляют структурной формулой I  или их фармацевтически приемлемыми солями, где R2 и R3 независимо выбирают из группы, состоящей из: 1) водорода, 2) C1-6 алкила, незамещенного или замещенного одним или несколькими заместителями, выбранными из: а) гидрокси, b) оксо, с) C1-6 алкокси, d) фенил-C1-3 алкокси, e) фенила, f) -CN, g) галогена, h) -NR9R10, где R9 и R10 независимо выбирают из: i) водорода, ii) C1-6 алкила, iii) гидрокси -C1-6 алкила и iv) фенила, i) -NR9COR10, где R9 и R10 имеют указанные выше определения, j) NR9CO2R10, где R9 и R10 имеют указанные выше определения, k) -CONR9R10, где R9 и R10 имеют указанные выше определения, j) -COR9, где R9 имеет указанные выше определения, m) -CO2R9, где R9 имеет указанные выше определения; 3) C2-6 алкенила, незамещенного или замещенного одним или несколькими заместителями, выбранными из: а) гидрокси, b) оксо, с) C1-6 алкокси, d) фенил-C1-3 алкокси, e) фенила, f) -CN, g) галогена, h) -CONR9R10, где R9 и R10 имеют указанные выше определения, i) -COR9, где R9 имеет указанные выше определения, j) -CO2R9, где R9 имеет указанные выше определения; 4) C2-6 алкинила; 5) фенила, незамещенного или замещенного одним или несколькими заместителями, выбранными из: а) гидрокси, b) C1-6 алкокси, с) C1-6 алкила, d) C2-5 алкенила, e) галогена, f) -CN, g) -NO2, h) -CF3, i) -(CH2)m-NR9R10, где m, R9 и R10 имеют указанные выше определения, j) -NR9COR10, где R9 и R10 имеют указанные выше определения, k) -NR9CO2R10, где R9 и R10 имеют указанные выше определения, l) -CON9R10, где R9 и R10 имеют указанные выше определения, m) -CO2NR9R10, где R9 и R10 имеют указанные выше определения, n) -COR9, где R9 имеет указанные выше определения, o) -CO2R9, где R9 имеет указанные выше определения; и альтернативно группы R2 и R3 соединяются вместе, образуя карбоциклическое ядро, выбранное из группы, состоящей из: а) циклопентила, b) циклогексила, с) фенила, и где карбоциклическое ядро незамещено или замещено одним или несколькими заместителями, выбранными из: i) C1-6 алкила, ii) C1-6 алкокси, iii) -NR9R10, где R9 и R10 имеют указанные выше определения, iv) галогена и v) трифторметила; и альтернативно группы R2 и R3 соединяются вместе, образуя гетероциклическое ядро, выбранное из группы, состоящей из: а) пирролидинила, b) пиперидинила, с) пирролила, d) пиридинила, e) имидазолила, f) фуранила, g) оксазолила, h) тиенила и i) тиазолила, и где гетероциклическое ядро незамещено или замещено одним или несколькими заместителями, выбранными из: i) C1-6 алкила, ii) оксо, iii) C1-6 алкокси, iv) -NR9R10, где R9 и R10 имеют указанные выше определения, v) галогена и vi) трифторметила; R6, R7 и R8 независимо выбирают из группы, состоящей из 1) водорода, 2) C1-6 алкила, незамещенного или замещенного одним или несколькими заместителями, выбранными из: а) гидрокси, b) оксо, с) C1-6 алкокси, d) фенил-C1-3 алкокси, e) фенила, f) -CN g) галогена, h) -NR9R10, где R9 и R10 имеют указанные выше определения, i) -NR9COR10, где R9 и R10 имеют указанные выше определения, j) -NR9CO2R10, где R9 и R10 имеют указанные выше определения, k) -CONR9R10, где R9 и R10 имеют указанные выше определения, l) -COR9, где R9 имеет указанные выше определения, m) -CO2R9, где R9 имеет указанные выше определения; 3) C2-6 алкенила, незамещенного или замещенного одним или несколькими заместителями, выбранными из: а) гидрокси, b) оксо, с) C1-6 алкокси, d) фенил-C1-3 алкокси, e) фенила, f) -CN, g) галогена, h) -CONR9R10, где R9 и R10 имеют указанные выше определения, i) -COR9, где R9 имеет указанные выше определения, j) -CO2R9, где R9 имеет указанные выше определения; 4) C2-6 алкинила; 5) фенила, незамещенного или замещенного одним или несколькими заместителями, выбранными из: а) гидрокси, b) C1-6 алкокси, с) C1-6 алкила, d) C2-5 алкенила, e) галогена, f) -CN, g) -NO2, h) -CF3, i) -(CH2)m-NR9R10, где R9 и R10 имеют указанные выше определения, j) -NR9COR10, где R9 и R10 имеют указанные выше определения, k) -NR9CO2R10, где R9 и R10 имеют указанные выше определения, l) -CONR9R10, где R9 и R10 имеют указанные выше определения, m) -CO2NR9R10, где R9 и R10 имеют указанные выше определения, n) -COR9, где R9 имеет указанные выше определения, о) -CO2R9, где R9 имеет указанные выше определения; 6) галогена, 7) -CN, 8) -CF3, 9) -NO2, 10) -SR14, где R14 представляет собой водород или C1-5 алкил, 11) -SOR14, где R14 имеет указанные выше определения; 12) -SO2R14, где R14 имеет указанные выше определения; 13) NR9COR10, где R9 и R10 имеют указанные выше определения, 14) CONR9COR10, где R9 и R10 имеют указанные выше определения, 15) NR9R10, где R9 и R10 имеют указанные выше определения, 16) -NR9CO2R10, где R9 и R10 имеют указанные выше определения, 17) гидрокси, 18) C1-6 алкокси, 19) COR9, где R9 имеет указанные выше определения, 20) CO2R9, где R9 имеет указанные выше определения, 21) 2-пиридила, 22) 3-пиридила, 23) 4-пиридила, 24) 5-тетразолила, 25) 2-оксазолила и 26) 2-тиазолила; R11, R12 и R13 независимо выбирают из определений R6, R7 и R8 или -OX; A выбирают из группы, состоящей из 1) C1-6 алкила, незамещенного или замещенного одним или несколькими заместителями, выбранными из: а) гидрокси, b) оксо, с) C1-5 алкокси, d) фенил-C1-3 алкокси, e) фенила, f) -CN, g) галогена, где галоген является фтором, хлором, бромом или иодом, h) -NR9R10, где R9 и R10 имеют указанные выше определения, i) -NR9COR10, где R9 и R10 имеют указанные выше определения, j) -NR9CO2R10, где R9 и R10 имеют указанные выше определения, k) -CONR9R10, где R9 и R10 имеют указанные выше определения, l) -COR9, где R9 имеет указанные выше определения, m) -CO2R9, где R9 имеет указанные выше определения; 2) C2-6 алкенила, незамещенного или замещенного одним или несколькими заместителями, выбранными из: а) гидрокси, b) оксо, с) C1-6 алкокси, d) фенил-C1-3 алкокси, e) фенила, f) -CN, g) галогена, h) -CONR9R10, где R9 и R10 имеют указанные выше определения, i) -COR9, где R9 имеет указанные выше определения, j) -CO2R9, где R9 имеет указанные выше определения; 3) C2-6 алкинила; B представляет собой гетероцикл, который выбран из группы, состоящей из: 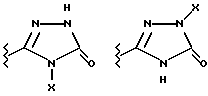 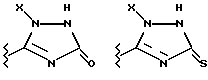 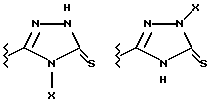 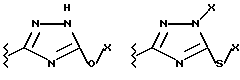 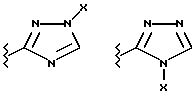 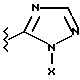 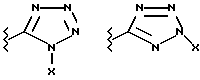 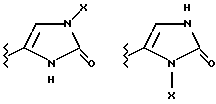 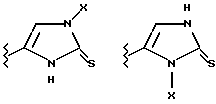 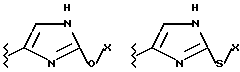 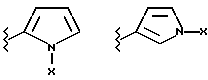 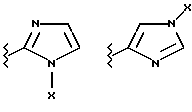 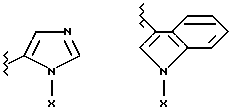 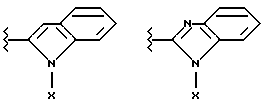 и где гетероцикл замещен помимо -X одним или несколькими заместителями, выбранными из: i) водорода, ii) C1-6 алкила, незамещенного или замещенного галогеном, -CF3, -OCH3 или фенилом, iii) C1-6 алкокси, iv) оксо, v) гидрокси, vi) тиоксо, vii) -SR9, где R9 имеет указанные выше определения, viii) галогена, ix) циано, х) фенила, xi) трифторметила, xii) -(CH2)m-NR9R10, где m является 0, 1 или 2 и R9 и R10 имеют указанные выше определения. xiii) -NR9COR10, где R9 и R10 имеют указанные выше определения, xiv) -CONR9R10, где R9 и R10 имеют указанные выше определения, xv) -CO2R9, где R9 имеет указанные выше определения и xvi) -(CH2)m-OR9, где m и R9 имеют указанные выше определения; p является 0 или 1; X выбирают из: а) -PO(OH)O–, M+, где M+ является фармацевтически приемлемым одновалентным противоионом, b) -PO(O–)2  2M+, 2M+,c) -PO(O–)2  D2+, где D2+ является фармацевтически приемлемым двухвалентным противоионом, D2+, где D2+ является фармацевтически приемлемым двухвалентным противоионом,d) -CH(R4)-PO(ОН)O–  M+, где R4 представляет собой водород или C1-3 алкил, M+, где R4 представляет собой водород или C1-3 алкил,e) -CH(R4)-PO(O–)2  2M+, 2M+,f) -CH(R4)-PO(O–)2  D2+, D2+,g) -SO3–  M+, M+,h) -CH(R4)-SO3–  М+ М+i) -CO-CH2CH2-CO2–  М+, М+,j) -CH(CH3)-O-CO-R5, где R5 выбирают из группы, состоящей из: 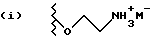 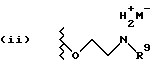 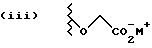 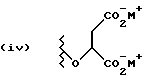 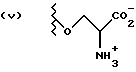 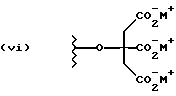 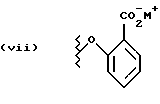 и k) водорода, при условии, что, если p является O и ни один из R11, R12 и R13 не является -OX, то X не является водородом; Y выбирают из группы, состоящей из: 1) одинарной (прямой) связи, 2) -O- 3) -S-, 4) -CO-, 5) -CH2-, 6) -CHR15-, и 7) -CR15R16-, где R15 и R16 независимо выбирают из группы, состоящей из: а) C1-6 алкила, незамещенного или замещенного одним или несколькими заместителями, выбранными из: i) гидрокси, ii) оксо, iii) C1-6 алкокси, iv) фенил -C1-3 алкокси, v) фенила, vi) -CN; vii) галогена, viii) -NR9R10, где R9 и R10 имеют указанные выше определения, ix) -NR9COR10, где R9 и R10 имеют указанные выше определения, х) -NR9CO2R10, где R9 и R10 имеют указанные выше определения, xi) -CONR9R10, где R9 и R10 имеют указанные выше определения, xii) -COR9-, где R9 имеет указанные выше определения; xiii) -CO2R9, где R9 имеет указанные выше определения; b) фенила, незамещенного или замещенного одним или несколькими заместителями, выбранными из: i) гидрокси, ii) C1-6 алкокси, iii) C1-6 алкила, iv) C2-5 алкенила, v) галогена, vi) -CN, vii) -NO2, viii) -CF3, ix) -(CH2)m-NR9R10, где m, R9 и R10, имеют указанные выше определения, x) -NR9COR10, где R9 и R10 имеют указанные выше определения, xi) -NR9CO2R10, где R9 и R10 имеют указанные выше определения, xii) -CONR9R10, где R9 и R10 имеют указанные выше определения, xiii) -CO2NR9R10, где R9 и R10 имеют указанные выше определения, xiv) -COR9, где R9 имеет указанные выше определения, xv) -CO2R9, где R9 имеет указанные выше определения, Z выбирают из: 1) водорода, 2) C1-6 алкила и 3) гидрокси, при условии, что, если Y является -О-, то Z не может быть гидрокси, или, если Y является -CHR15-, то Z и R15 необязательно соединяются вместе, образуя двойную связь (вместе с уже присутствующей связью). Соединения данного изобретения являются пролекарствами их “родительских” соединений. Основное преимущество соединений данного изобретения состоит в том, что они обладают повышенной растворимостью в водных растворах относительно их “родительских” соединений. Кроме того, эти пролекарства обычно обладают уменьшенной активностью в качестве антагонистов рецепторов тахикининов, чем их “родительские” соединения. Таким образом, активность, проявляемая при введении пролекарства, в основном обусловлена присутствием “родительского” соединения, которое является результатом расщепления пролекарства. Термин “пролекарство” относится к соединениям, которые являются предшественниками лекарственных средств и которые после введения и абсорбции высвобождают лекарственное средство in vivo в результате метаболического процесса. Пролекарства в сущности структурно относятся к биологически активному веществу (“родительскому” лекарственному средству), которые после введения высвобождают “родительское” лекарственное средство in vivo в результате некоторого метаболического процесса, например ферментативного или химического гидролиза карбонового, фосфорного или сульфатного эфира или восстановления, или окисления восприимчивой функциональной группы [см., например, обсуждения, проведенныe (1) A.A. Sinkula and S.H. Yalkowsky, J. Pharm. Sci., 64, 181 (1975); (2) L.A. Svensson. Pharm. Weekbl. 122, 245-250 (1987); (3) L.P. Balant, E. Doelker and P. Buri, Eur. J. Drug. Metab. and Pharmacokinetics, 15, 143-153 (1990); (4) N. Bodor, Drugs of Future, 6, 165-182 (1981); (5) Design of Biopharmaceutical Properties through Prodrugs and Analogs, E.B. Roche, Ed. American Pharmaceutical Sciences, Washington, DC (1977); (6) H. Bundgaard Advanced Drug Delivery Reviews, 3, 39-65 (1989)]. Преимущество пролекарства может заключаться в его физических свойствах, например повышенной растворимости в воде при парентеральном введении по сравнению с “родительским” лекарственным средством или в том, что оно может повышать адсорбцию из пищеварительного тракта или оно может повышать стабильность лекарственного средства при долговременном хранении. Обычно пролекарство обладает меньшей биологической активностью, чем “родительское” лекарственное средство. Пролекарство может также повышать общую эффективность лекарственного средства, например посредством снижения токсичности и нежелательных эффектов лекарственного средства путем регулирования его абсорбции, содержания в крови, метаболического распределения и включения клеткой. Термин “родительское соединение” или “родительское лекарственное средство” относится к биологически активной форме, которая высвобождается после введения пролекарства посредством ферментативного действия метаболического или катаболического процесса или химического процесса. “Родительское” соединение может также быть исходным материалом для получения соответствующего пролекарства. Хотя все обычные способы введения пригодны для соединений данного изобретения, предпочтительными способами введения являются пероральный и внутривенный. После желудочно-кишечной абсорбции или внутривенного введения данные соединения гидролизуются или расщепляются иным путем in vivo в соответствующие “родительские” соединения формулы I, где X представляет собой водород или X отсутствует, или их соли. Поскольку родительские соединения могут быть относительно нерастворимыми в водных растворах, данные пролекарства имеют явное преимущество благодаря их относительно повышенной водной растворимости. Соединения данного изобретения имеют асимметричные центры, и это изобретение включает все их оптические изомеры и их смеси. Кроме того, соединения с углерод-углеродными двойными связями могут существовать в Z- и E-формах, все изомерные формы соединений включены в данное изобретение. Когда любая изменяемая часть (например, алкил, арил, R6, R7, R8, R9, R10, R11, R12, R13 и т.д.) встречается более одного раза в любой изменяемой части или в формуле I, ее значение каждый раз не зависит от ее значения в каждом другом случае. Термин “алкил” как использован здесь включает алкильные группы с определенным числом атомов углерода и нормальной, разветвленной или циклической конфигурацией. Примеры “алкила” включают метил, этил, пропил, изопропил, бутил, изо-, втор- и трет-бутил, пентил, гексил, гептил, 3-этилбутил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, норборнил и тому подобные алкилы. “Алкокси” представляет собой алкильную группу с указанным числом атомов углерода, присоединенную через кислородный мостик, например метокси, этокси, пропокси, бутокси и пентокси. “Алкенил” предназначен для включения углеводородных цепей с указанным числом атомов углерода и нормальной или разветвленной конфигурацией и по меньшей мере одной ненасыщенной связью, которая может присутствовать в любом положении цепи, например, этенил, пропенил, бутенил, пентенил, диметилпентил и подобный алкенил и, если возможно, включает E- и Z-формы. “Галоген” как использован здесь обозначает фтор, хлор, бром или иод. Соединения данного изобретения способны образовать соли с различными неорганическими и органическими кислотами и основаниями, и такие соли также находятся в пределах объема этого изобретения. Примеры таких солей с кислотами (которые являются отрицательными противоионами, определенные здесь как M) включают ацетат, адипат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорасульфонат, цитрат, этансульфонат, фумарат, полусульфат, 2- гидроксиэтилсульфонат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, лактат, малат, малеат, метансульфонат, 2-нафталинсульфонат, оксалат, памоат, персульфат, пикрат, пивалат, пропионат, салицилат, стеарат, сукцинат, сульфат, тартрат, тозилат (п-толуолсульфонат) и ундеканоат. Соли с основаниями (которые являются фармацевтически приемлемыми одновалентными катионами, определенными здесь как M+ или K+, или фармацевтически приемлемыми двухвалентными катионами, определенными здесь как D2+n, если уместно) включают аммониевые соли, соли щелочных металлов, например натриевые, литиевые и калиевые соли, соли щелочноземельных металлов, например алюминиевые, кальциевыe и магниевые соли, соли с неорганическими основаниями, например соли c дициклогексиламином, N-метил-D-глюкамином, и соли с аминокислотами, например аргинином, лизином, орнитином и т.д. Если М+ является одновалентным катионом, признается, что если присутствует 2M+, то эти М+ могут быть одинаковыми или разными. Кроме того, аналогично признается, что, если присутствует 2M+, вместо него может присутствовать двухвалентный катион D2+. Кроме того, азотсодержащие группы основного характера могут быть кватернизованы такими агентами, как алкилгалогениды, например метил-, этил-, пропил- и бутилхлорид, бромиды и иодиды; диалкилсульфаты, подобные диметил-, диэтил-, дибутил-, диамилсульфатам; галогениды с длинной цепью (высшие), например децил-, лаурил-, миристил- и стеарилхлориды, бромиды и иодиды; аралкилгалогениды, подобные бензилбромиду и другим. Предпочтительны нетоксичные физиологически приемлемые соли, хотя полезны также другие соли, например для выделения и очистки продукта. Соли можно образовать обычными способами, например реакцией продукта в форме свободного основания с одним или более эквивалентами подходящей кислоты в растворителе или среде, в которой соль нерастворима, или в растворителе, например воде, который удаляют в вакууме, или сушкой вымораживанием, или обменом анионов имеющейся соли на другой анион на подходящей ионообменной смоле. В соединениях формулы I предпочтительно, чтобы R2 и R3 независимо выбирали из группы, состоящей из: 1) водорода, 2) C1-6 алкила, 3) C2-6 алкенила и 4) фенила; R6, R7 и R8 независимо выбирали из группы, состоящей из: 1) водорода, 2) C1-6 алкила, 3) фтора, 4) хлора, 5) брома, 6) иода и 7) -CF3; R11, R12 и R13 независимо выбирали из группы, состоящей из: 1) фтора, 2) хлора, 3) брома и 4) иода; A представлял собой незамещенный C1-6 алкил; B выбирали из группы, состоящей из: 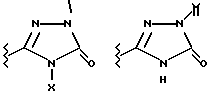 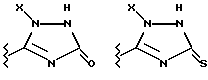 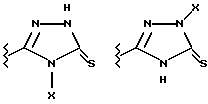 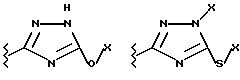 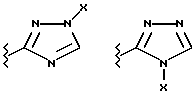 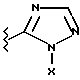 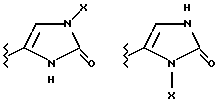 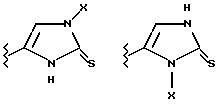 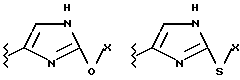 p являлся O; X выбирали из: а) -PO(ОН)–  М+, где М+ является фармацевтически приемлемым одновалентным противоионом, М+, где М+ является фармацевтически приемлемым одновалентным противоионом,b) -PO(O–)2  2M+, 2M+,с) -PO(O–)2  D2+, где D2+ является фармацевтически приемлемым двухвалентным противоионом, D2+, где D2+ является фармацевтически приемлемым двухвалентным противоионом,d) -CH(R4)-PO(ОН)O–  М+, где R4 представляет собой водород или метил, М+, где R4 представляет собой водород или метил,e) -CH(R4)-PO(O–)2  2M+, где R4 представляет собой водород или метил, 2M+, где R4 представляет собой водород или метил,f) -CH(R4)-PO(O–)2  D2+, где R4 представляет собой водород или метил, D2+, где R4 представляет собой водород или метил,i) -CO-CH2CH2-CO2–  М+, М+,j) -CH(CH3)-O-CO-R5, где R5 выбирают из группы, состоящей из: 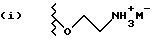 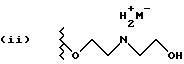  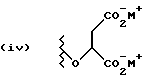 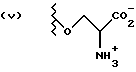 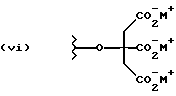 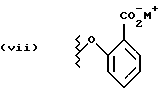 Y представлял собой водород или -O-; Z представлял собой водород или C1-4 алкил. В соединениях данного изобретения предпочтительное воплощение включает те соединения, у которых Z представляет собой C1-4 алкил. Особенно предпочтительное воплощение соединений формулы I включает те соединения, у которых Z представляет собой -CH3. Соединения, имеющие заместитель у альфа-атома углерода, проявляют выгодные фармакологические свойства, в частности, увеличенную продолжительность действия в моделях экстравазации, вероятно вследствие биологической стабильности и устойчивости к ферментативному разрушению. В соединениях данного изобретения, если p является 1, то предпочтительно, чтобы X был водородом или отсутствовал. В соединениях данного изобретения особенно предпочтительно то воплощение, в котором A является -CH2– или -CH(CH3)-. Особенно предпочтительное воплощение соединений данного изобретения включает пролекарства соединений формулы I, где -A-B представляет собой (1,2,4-триазоло)метильную или (5-оксо-1,2, 4-триазоло)метильную группу. Другое особенно предпочтительное воплощение соединений данного изобретения включает пролекарства соединений формулы I, где -A-B представляет собой (1,3-имидазо) метильную или (5-оксо-1,3-имидазо) метильную группу. Дополнительное особенно предпочтительное воплощение соединений данного изобретения включает те соединения формулы I, у которых -A-B представляет собой (1,2,4-триазоло)метильную или (5- оксо-1,2,4-триазоло)метильную группу, имеющую фосфорильную группу, присоединенную к гетероциклу. Еще одно особенно предпочтительное воплощение соединений данного изобретения включает те соединения формулы I, у которых -A-A представляет собой (1,3-имидазоло)метильнуго или (1,3-имидазоло)метильную группу, имеющую фосфорильную группу, присоединенную к гетероциклу. Предпочтительное воплощение соединений данного изобретения включает соединения формулы I, у которых X выбирают из: а) -PO(O–)2M+, где М+ является фармацевтически приемлемым одновалентным противоионом, b) -PO(O–)2D2+, где D2+ является фармацевтически приемлемым двухвалентным противоионом, с) -CH(CH3)-O-CO-CH2CH2-NH3+ М– и d) -CH(CH3)-O-CO-CH2CH2NH2+ (CH2CH2-OH)M–. В соединениях данного изобретения особенно предпочтительным воплощением является то, у которого -A-B выбирают из следующей группы заместителей: 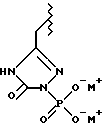 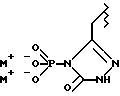 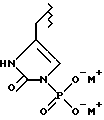 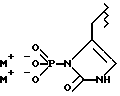 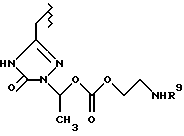 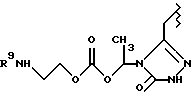 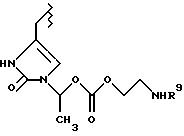 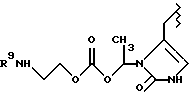 Конкретные соединения в пределах объема данного изобретения включают пролекарства следующих “родительских” соединений: 1) (+/-) -2-(3,5-бис(трифторметил)бензилокси)-3-фенилморфолина; 2) (2R, S)-(3,5-бис(трифторметил)бензилокси)-(3R)-фенил- (6R)-метилморфолина; 3) (2R, S)-(3,5-бис(трифторметил)бензилокси)-(3S)- фенил-(6R)-метилморфолина; 4) (+/-)-2-(3,5-бис(трифторметил)бензилокси) -3-фенил-4-метилкарбоксамидоморфолина; 5) (+/-)-2-(3, 5-бис(трифторметил)бензилокси)-3-фенил-4- метоксикарбонилметилморфолина; 6) 2-(2-(3,5-бис(трифторметил)фенил)этенил)-3-фенил- 5-оксоморфолина; 7) 3-фенил-2-(2-(3,5-бис(трифторметил)фенил)этил) морфолина; 8) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил- 6-(S)-метилморфолина; 9) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)- фенил-6-(S)-метилморфолина, 10) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-6-(S) -метилморфолина; 11) 2-(S)-(3,5-(трифторметил)бензилокси)-3-(S)-фенил-6-(S) -метилморфолина; 12) 2-(R)-(3,5-бис(трифторметил)бензилокси) -3-(R)-фенил-(R)-метилморфолина; 13) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-6- (R)-метилморфолина; 14) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R) -фенил-6-(R)-метилморфолина; 15) 2-(, S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-6- (R)-метилморфолина; 16) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенилморфолина 17) 4-(3-(1,2,4-триазоло)метил)-2-(S)-(3,5-бис (трифторметил)бензилокси)-3-(S)-фенилморфолина; 18) 4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)-2-(S)-(3,5-бис (трифторметил)бензилокси)-3-(S)-фенилморфолина; 19) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-6- (R)-метилморфолина; 20) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-6- (R)-метилморфолина; 21) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(R)- фенил-6-(R)-метилморфолина; 22) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-6-(R) -метилморфолина; 23) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил- 5-(S)-метилморфолина; 24) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S) -метилморфолина; 25) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S) -метилморфолина; 26) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(R) -фенилморфолина; 27) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5- (R)-фенилморфолина; 28) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-5-(S) -фенилморфолина; 29) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-5-(S) -фенилморфолина; 30) 2-(S)-(3,5-бис(трифторметил)бензилокси)-6-(R) -метил-3-(S)-фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 31) 2-(S)-(3,5-бис(трифторметил)бензилокси)-6-(R)-метил-4- (3-(5-окco-1H,4H-1,2,4-триазоло)метил)-3-(S)-фенилморфолина; 32) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)- фенилморфолина; 33) 4-(3-(1,2,4-триазоло)метил)-2-(S)-(3,5- бис(трифторметил)бензилокси)-3-(R)-фенилморфолина; 34) 4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)-2-(S)-(3,5-бис (трифторметил)бензилокси)-3-(R)-фенилморфолина; 35) 4-(2-имидазоло)метил)-2-(S)-(3,5-бис(трифторметил) бензилокси)-3-(R)-фенилморфолина; 36) 4-(4-(имидазоло)метил)-2-(S)-(3,5-бис(трифторметил) бензилокси)-3-(R)-фенилморфолина; 37) 4-(аминокарбонилметил)-2-(S)-(3,5-бис(трифторметил) бензилокси)-3-(R)-фенилморфолина; 38) 4-(2-(имидазоло)метил)-2-(S)-(3,5-бис(трифторметил) бензилокси)-3-(R)-фенилморфолина; 39) 4-(4-(имидазоло)метил)-2-(S)-(3,5-бис(трифторметил) бензилокси)-3-(S)-фенилморфолина; 40) 4-(2-(имидазоло)метил)-2-(S)-(3,5-бис(трифторметил) бензилокси)-3-(S)-фенил-6-(R)-метилморфолина; 41) 4-(4-(имидазоло)метил)-2-(S)-(3,5-бис(трифторметил) бензилокси)-3-(S)-фенил-6-(R)-метилморфолина; 42) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4-((6-гидрокси) гексил)-3-(R)-фенилморфолина; 43) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4-(5-метиламинокарбонил) пентил)-3-(R)-фенилморфолина; 44) 4-(3-(1,2,4-триазоло)метил)-2-(3,5-диметилбензилокси) -3-фенилморфолина; 45) 4-(3-(5-оксо-1H, 4H-1,2,4-триазоло)метил)-2-(3,5-диметил) бензилокси)-3-фенилморфолина; 46) 4-(3-(1,2,4-триазоло)метил)-2-(3,5-ди(трет-бутил) бензилокси)-3-фенилморфолина; 47) 4-(3-(5-оксо-1H, 4H-1,2,4-триазоло)метил)-2-(3, 5-ди(трет-бутил)-бензилокси)-3-фенилморфолина; 48) 4-(3-(1,2,4-триазоло)метил)-2-(3-(трет-бутил) -5-метилбензилокси)-3-фенилморфолина; 49) 4-(3-(5-оксо-1H,4H-1,2,4- триазоло)метил-2-(3-(трет-бутил) -5-метилбензилокси)-3-фенилморфолина; 50) 4-(3-(1,2,4-триазоло)метил)-2-(3-(трифторметил) -5-метилбензилокси)-3-фенилморфолина; 51) 4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)-2-(3-(трифторметил) -5-метилбензилокси)-3-фенилморфолина; 52) 4-(3-(1,2,4-триазоло)метил)-2-(3-(трет-бутил)-5- (трифторметил)-бензилокси)-3-фенилморфолина: 53) 4-(3-(5-оксо-1H, 4H-1,2,4-триазоло)метил)-2-(3-(трет-бутил) -5-(трифторметил)бензилокси)-3-фенилморфолина; 54) 4-(2-имидазоло)метил)-2-(3,5-диметилбензилокси)-3- фенилморфолина; 55) 4-(4-(имидазоло)метил)-2-(3,5-диметилбензилокси)- 3-фенилморфолина; 56) 4-(2-(имидазоло)метил)-2-(3,5-ди(трет-бутил)бензилокси)-3 -фенилморфолина; 57) 4-(4-(имидазоло)метил)-2-(3,5-ди(трет-бутил)бензилокси) -3-фенилморфолина; 58) 4-(2-(имидазоло)метил)-2-(3-трет-бутил)-5-метилбензилокси) -3-фенилморфолина; 59) 4-(4-(имидазоло)метил)-2-(3-трет-бутил)-5-метилбензилокси) -3-фенилморфолина; 60) 4-(2-(имидазоло)метил)-2-(З-трифторметил)-5-метилбензилокси) -3-фенилморфолина; 61) 4-(4-(имидазоло)метил)-2-(3-(трифторметил)-5-метилбензилокси) -3-фенилморфолина; 62) 4-(2-(имидазоло)метил)-2-(3-трет-бутил)-5-(трифторметил) бензилокси)-3-фенилморфолина; 63) 2-(S)-(3,5-дихлорбензилокси)-3-(S)-фенилморофолина; 64) 2-(S)-(3,5-дихлорбензилокси)-4-(3-(5-оксо-1H; 4H-1,2,4-триазоло)-метил-3-(S)-фенилморфолина; 65) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4- (метоксикарбонилметил)-3-(S)-фенилморфолина; 66) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4-(карбоксиметил) -3-(S)-фенилморфолина; 67) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4-((2-аминоэтил) -аминокарбонилметил)-3-(S)-фенилморфолина; 68) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4-((3-аминопропил) – аминокарбонилметил)-3-(S)-фенилморфолина; 69) 4-бензил-5-(S), 6-(R)-диметил-3-(S)-фенилморфолинона и 4-бензил-5-(R), 6-(S)-диметил-3-(S)-фенилморфолинона; 70) 2-(R)-(3,5-бис(трифторметил)бензилокси)-[5-(S), 6- (R)- или 5-(R), 6-(S)-диметил]-3-(S)-фенилморфолинона; 71) 2-(S)-(3,5-бис(трифторметил)бензилокси)-[5-(R), 6-(S)- или 5-(S), 6-(R)-диметил]-3-(S)-фенилморфолинона; 72) 2-(R)-(3,5-бис(трифторметил)бензилокси)-4-(3-(1,2,4- триазоло)метил)-[5-(S), 6-(R)- или 5-(R), 6-(3)-диметил]-3- (S)-фенилморфолинона; 73) 2-(R)-(3,5-бис(трифторметил)бензилокси)-4-(3-(5-оксо- 1H,4H-1,2,4-триазоло)метил)-[5-(S), 6-(R)- или 5-(R), 6-(S) -диметил]-3-(S)-фенилморфолинона; 74) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4-(3-(1,2, 4-триазоло)-метил)-[5-(R), 6-(S)- или 5-(S), 6-(R)-диметил] -3-(S)-фенилморфолинона; 75) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4-(3-(5-оксо-1H,4H -1,2,4-триазоло)метил)-[5-(R), 6-(S)- или 5-(S), 6-(R)-диметил]-3- (S)-фенилморфолинона; 76) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4-(2-(1-(4-бензил) пиперидино)этил)-3-(S)-фенилморфолина; 77) 3-(5)-(4-фторфенил)-4-бензил-2-морфолинона; 78) 3-(5)-(3,5-бис(трифторметил)бензилокси)-3-(S)-(4-фторфенил) -4-бензилморфолина; 79) 3-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-(4-фторфенил) -морфолина; 80) 3-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-(4-фторфенил) -4-(3-(5-оксо-1H,4H-триазоло)метилморфолина; 81) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4-((3-пиридил) метилкарбонил)-3-(R)-фенилморфолина; 82) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4- (метоксикарбонилпентил)-3-(R)-фенилморфолина; 83) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4- (карбоксипентил)-3-(R)-фенилморфолина; 84) 2-(S)-(3,5-бис(трифторметил)бензилокси)-4- (метиламинокарбонилпентил)-6-оксогексил)-3-(R)-фенилморфолина; 85) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил 4-бензилморфолина; 86) 2-(R)-(1-(3,5-бис(трифторметил)фенил)бензилокси)-3-(S)-фенил 4-бензилморфолина; 87) 2-(R)-(1-(S)-(3,5-бис(трифторметил)фенил) этокси)-3-(S)-фенилморфолина; 88) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S) -фенилморфолина; 89) 2-(R)-(1-(S)-(3,5-бис(трифторметил)фенил)этокси)-3-(S) -фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метилморфолина; 90) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3- (S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метилморфолина; 91) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-(4-фторфенил) -4-бензилморфолина; 92) 2-(R)-(1-(3,5-бис(трифторметил)фенил)этенилокси)-3- (S)-4-хлор)фенил-4-бензилморфолина; 93) 2-(R)-(1-(S)-(3,5-бис(трифторметил)фенил)этокси)-3- (S)-(4-хлор)-фенилморфолина; 94) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси) -3-(S)-(4-хлор)-фенилморфолина; 95) 2-(R)-(1-(S)-(3,5-бис(трифторметил)фенил)этокси)-3-(S))- (4-хлор)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метилморфолина; 96) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил) этокси)-3-(S)-(4-хлор)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло) метилморфолина; 97) 2-(R)-(1-(R)-(1-(3-(метил)нафтил)этокси)-3- (S)-фенил-4-(3-(1,2,4-триазоло)метилморфолина; 98) 2-(R)-(1-(R)-(1-(3-(метил)нафтил)этокси)-3-(S) -фенил-4-(4-(2-оксо-1,3-имидазоло)метилморфолина; 99) 2-(R)-(1-(R)-(3-(фтор)-5-(трифторметил)фенил)этокси)-3- (S)-фенилморфолина; 100) 2-(R)-(1-(1-(3-(фтор)-5-(трифторметил) фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло) метил)морфолина; 101) 2-(R)-(1-(R)-(3-(хлор)-5-(трифторметил)фенил)этокси) -3-(S)-фенилморфолина; 102) 2-(R)-(1-(R)-(3-(хлор)-5-(трифторметил)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 103) 2-(R)-(1-(R)-(3,5-(диметил)фенил)этокси)-3-(S)- фенилморфолина; 104) 2-(R)-(1-(R)-(3,5(диметил)фенил)этокси)-3-(5)-фенил-4- (3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 105) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил)этокси) -3-(S)-фенилморфолина; 106) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил) этокси)-3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло) метилморфолина; 107) 2-(R)-(1-(R)-(3-(хлор)-5-(метил)фенил)этокси)-3-(S) -фенилморфолина; 108) 2-(R)-1-(R)-(3-(хлор)-5-(метил)фенил)этокси)-3-(S)фенил-4- (3-(5-оксо-1H,4H-1,2,4-триазоло)метилморфолина; 109) 2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил)этокси)- 3-(S)-фенилморфолина; 110) (2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил)этокси)-3- (S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 111) 2-(R)-(1-(R)-3-(изопропокси)фенил)этокси)-3- (S)-фенилморфолина; 112) 2-(R)-(1-(R)-(3-(изопропокси)фенил)этокси)-3-(S)- фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метилморфолина; 113) 2-(R)-(1-(R)-(3-(изопропокси)-5-(трифторметил)фенил) этокси)-3-(S)-фенилморфолина; 114) 2-(R)-(1-(R)-(3-(изопропокси)-5-трифторметил)фенил)этокси)- 3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-тразоло)метилморфолина; 115) 2-(R)-(1-(R)-(3-(хлор)-5-(изопропокси)фенил)этокси)-3-(S) -фенилморфолина; 116) 2-(R)-(1-(R)-(3-(хлор)-5-(изопропокси)фенил)этокси)-3-(S) фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метилморфолина; 117) 2-(R)-(1-(R)-(3-(фтор)-5-(изопропокси)фенил)этокси) -3-(S)-фенилморфолина; 118) 2-(R)-(1-(R)-(3-(фтор)-5-(изопропокси)фенил) этокси)-3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло) метилморфолина; 119) 2-(R)-(1-(R)-(1-(3-(трифторметил)нафтил) этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло)метилморфолина; 120) 2-(R)-(1-(R)-(1-(3-(трифторметил)нафтил)этокси)- 3-(S)-фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 121) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(хлор)фенил) этокси)-3-(S)-фенилморфолина; 122) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(хлор)фенил) этокси)-3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил) морфолина; 123) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(трифторметил)фенил) этокси)-3-(S)-фенилморфолина; 124) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(трифторметил))фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 125) 2-(R)-(1-(R)-(3,5-(диметил)-4-(фтор)фенил)этокси)-3-(S) -фенилморфолина; 126) 2-(R)-(1-(R)-(3,5-(диметил)-4-(фтор)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 127) 2-(R)-(1-(R)-(3,5-(диметил)-4-(хлор)фенил)этокси)-3-(S) -фенилморфолина; 128) 2-(R)-(1-(R)-(3,5-(диметил)-4-(хлор)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 129) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(фтор)фенил) этокси)-3-(S)-фенилморфолина; 130) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(фтор)фенил) этокси)-3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 131) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси) -3-(S)-фенилморфолина; 132) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси) -3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 133) 2-(R)-(1-(R)-(3,5-(дихлор)фенил)этокси)-3(S)-фенилморфолина; 134) 2-(R)-(1-(R)-(3,5-(дихлор)фенил)этокси)-3-(S)-фенил-4-(3- (5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 135)2- (R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3(S)- фенилморфолина; 136) 2-(R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3-(S)-фенил-4- (3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 137) 2-(R)-(1-(R)-(1-нафтил)этокси)-3(S)-фенилморфолина; 138) 2-(R)-(1-(R)-(1-нафтил)этокси)-3-(S)-фенил-4-(3-(5-оксо- 1H, 4H-1,2,4-триазоло)метил)морфолина; 139) 2-(R)-(1-(R)-(1-(4-(фтор)нафтил)этокси)-3-(S)-фенилморфолина 140) 2-(R)-(1-(R)-(1-(4-(фтор)нафтил)этокси)-3-(S)-фенил-4- (3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 141) 2-(R)-(1-(R)-(1-(3-(фтор)нафтил)этокси)-3-(S)-фенилморфолина 142) 2-(R)-(1-(R)-(1-(3-(фтор)нафтил)этокси)-3-(5)-фенил-4- (3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 143) 2-(R)-(1-(R)-(1-(3-(хлор)нафтил)этокси)-3-(S)- фенилморфолина; 144) 2-(R)-(1-(R)-(1-(3-(хлор)нафтил)этокси)-3-(S)-фенил-4- (3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 145) 2-(R)-(1-(R)-(1-(3-(метил)нафтил)этокси)-3-(S)- фенилморфолина; 146) 2-(R)-(1-(S)-(1-(3-(метил)нафтил)этокси)-3-(S)-фенил-4- (3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 147) 2-(R)-(1-(R)-(1-(3-(трифторметил)нафтил) этокси)-3-(5)-фенилморфолина; 148) 2-(R)-(1-(R)-(1-(3-(трифторметил)нафтил)этокси)-3-(S)- фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 149) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-(4-гидрокси) фенилморфолина; 150) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(3)-(4-гидрокси) фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 151) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)- фенилморфолина; 152) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)-(4-фтор) фенилморфолина; 153) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенил)этокси)-3-(S) -фенилморфолина; 154) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S) -(4-фтор)фенилморфолина; 155) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)- фенил-(4-(3-(1,2,4-триазоло)метил)морфолина; 156) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)-(4-фтор) фенил-(4-(3-(1,2,4-триазоло)метил)морфолина; 157) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)- 3-(S)-фенил-(4-(3-(1,2,4-триазоло)метил)морфолина; 158) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)- 3-(S)-(4-фтор)фенил-(4-(3-(1,2,4-триазоло)метил)морфолина; 159) 2-(S)-(2-фтор-5-трифторметил)бензилокси)- 3-(S)-фенил-(4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 160) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)-(4- фтор)фенил-(4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 161) 2-(R)(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S) -фенил-(4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 162) 2-(R)(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S)- (4-фтор)фенил-(4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 163) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)-фенил-4- (4-(2-оксо-1,3-имидазоло)метилморфолина; 164) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)-(4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метилморфолина; 165) 2-(R)(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S) -фенил-(4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 166) 2-(R)(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S)- (4-фтор)фенил-(4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 167) 2- (S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)- фенил-4-(2-имидазоло)метилморфолина; 168) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)-(4-фтор) фенил-4-(2-имидазоло)метилморфолина; 169) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S) -фенил-4-(2-имидазоло)метилморфолина; 170) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)- 3-(5)-(4-фтор)фенил-4-(2-имидазоло)метилморфолина; 171) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)фенил-4- (4-имидазоло)метилморфолина; 172) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)-(4-фтор) фенил-4-(4-имидазоло)метилморфолина; 173) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S) -фенил-4-(4-имидазоло)метилморфолина; 174) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S) -(4-фтор)фенил-4-(4-имидазоло)метилморфолина; 175) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)-фенил-4- (5-тетразоло)метилморфолина; 176) 2-(S)-(2-фтор-5-трифторметил)бензилокси)-3-(S)- (4-фтор)фенил-4-(5-тетразоло)метилморфолина; 177) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3- (S)-фенил-4-(5-тетразоло)метилморфолина; 178) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S)- (4-фтор)фенил-4-(5-тетразоло)метилморфолина; 179) 2-(S)-(2-фтор-5-трифторметил)бензилокси-3-(S)-фенил- 4-(2-оксо-5H-пиррол-4-ил)метилморфолина; 180) 2-(S)-(2-фтор-5-трифторметил)бензилокси-3-(S)-(4-фтор) фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолина; 181) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси) -3-(S)-фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолина; 182) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S)- (4-фтор)фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолина;. 183) 2-(S)-(2-хлор-5-трифторметил)бензилокси-3-(S)- фенилморфолина; 184) 2-(S)-(2-хлор-5-трифторметил)бензилокси-3-(S)-(4-фтор) фенилморфолина; 185) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S) -фенилморфолина; 186) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S)- (4-фтор)фенилморфолина; 187) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 188) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 189) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S) -фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 190) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S)- (4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 191) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S)-фенил-4- (3-(5-оксо-1Н,4Н-1,2,4-триазоло)метил)морфолина; 192) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3- (S)-(4-фтор)фенил-4-(3-(5-оксо-1Н,4Н-1,2,4-триазоло)метил)морфолина; 193) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси) -3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил) морфолина; 194) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3- (S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло) метил)морфолина; 195) 2-(S)-(2-хлор-5-трифторметил)бензилокси-3-(S)-фенил-4 -(4-(2-oкco-1,3-имидазоло)метил)морфолина; 196) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S)-(4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 197) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S) фенил-4-(4-(2-oкco-1,3-имидазоло)метил)морфолина; 198) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S) -(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 199) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S)-фенил-4- (2-имидазоло)метил)морфолина; 200) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S)- (4-фтор)фенил-4-(2-имидазоло)метил)морфолина; 201) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S) -фенил-4-(2-имидазоло)метил)морфолина; 202) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S) -(4-фтор)фенил-4-(2-имидазоло)метил)морфолина; 203) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S)-фенил-4- (4-имидазоло)метил)морфолина; 204) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S)- (4-фтор)фенил-4-(4-имидазоло)метил)морфолина; 205) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3- (S)-фенил-4-(4-имидазоло)метил)морфолина; 206) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)- 3-(S)-(4-фтор)фенил-4-(4-имидазоло)метил)морфолина; 207) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S) фенил-4-(5-тетразоло)метил)морфолина; 208) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S)- (4-фтор)фенил-4-(5-тетразоло)метил)морфолина; 209) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S) -фенил-4-(5-тетразоло)метил)морфолина; 210) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S) -(4-фтор)фенил-4-(5-тетразоло)метил)морфолина; 211) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S) -фенил-4-(2-оксо-5H-пиррол-4-ил)метил)морфолина; 212) 2-(S)-(2-хлор-5-трифторметил)бензилокси)-3-(S)- (4-фтор)фенил-4-(2-оксо-5H-пиррол-4-ил)метил)морфолина; 213) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S) -фенил-4-(2-оксо-5H-пиррол-4-ил)метил)морфолина; 214) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S) -(4-фтор)фенил-4-(2-оксо-5H-пиррол-4-ил)метил)морфолина; 215) 2-(S)-(3-метил)бензилокси-3-(S)-фенилморфолина; 216) 2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенилморфолина; 217) 2-(R)-(1-(R)-(3-метил)фенилэтокси-3-(S)-фенилморфолина; 218) 2-(R)-(1-(R)-(3-метил)фенилэтокси-3-(S)-(4- фтор)фенилморфолина; 219) 2-(S)-(3-метил)бензилокси-3-(S)-фенил-4-(3-(1,2,4- триазоло)метил)морфолина; 220) 2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенил-4-(3-(1,2, 4-триазоло)метил)морфолина; 221) 2-(R)-(1-(R)-(3-метил)фенилэтокси-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 222) 2-(R)-(1-(R)-(3-метил)фенилэтокси-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 223) 2-(S)-(3-метил)бензилокси-3-(S)-фенил-4-(3-(5-оксо-1, 2,4-триазоло)метил)морфолина; 224) 2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенил-4- (3-(5-оксо-1,2,4-триазоло)метил)морфолина; 225) 2-(R)-(1-(R)-3-метил)фенилэтокси-3-(S)-фенил-4-(3- (5-оксо-1,2,4-триазоло)метил)морфолина; 226) 2-(R)-(1-(R)-(3-метил)фенилэтокси-3-(S)-(4-фтор) фенил-4-(3-(5-оксо-1,2,4-триазоло)метил)морфолина; 227) 2-(S)-(3-метил)бензилокси-3-(S)-фенил-4-(4-(2-окco-1, 3-имидазоло)метил)морфолина; 228) 2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенил-4-(4- (2-оксо-1,3-имидазоло)метил)морфолина; 229) 2-(R)-(1-(R)-(3-метил)фенилэтокси-3-(S)-фенил-4 -(4-(2-оксо-1,3-имидазоло)метил)морфолина; 230) 2-(R)-(1-(R)-(3-метил)фенилэтокси-3-(S)-(4-фтор)фенил- 4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 231) 2-(S)-(3-метил)бензилокси-3-(S)-фенил-4-(2-имидазоло) метил)-морфолина; 232) 2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенил-4- (2-имидазоло)метил)морфолина; 233) 2-(R)-(1-(R)-(3-метил)фенилэтокси-3-(S)-фенил-4- (2-имидазоло)метил)морфолина; 234) 2-(R)-(1-(R)-(3-метил)фенилэтокси-3-(S)-(4-фтор) фенил-4-(2-имидазоло)метил)морфолина; 235) 2-(S)-(3-метил)бензилокси-3-(S)-фенил-4-(4-имидазоло) метил)-морфолина; 236) 2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенил-4-(4- имидазоло)метил)морфолина; 237) 2-(R)-(1-(R)-(3-метил)фенилэтокси)-3-(S)-фенил-4- (4-имидазоло)метилморфолина; 238) 2-(R)-(1-(R)-(3-метил)фенилэтокси-3-(S)-(4-фтор) фенил-4-(4-имидазоло)метилморфолина; 239) 2-(S)-(3-метил)бензилокси-3-(S)-фенил-4-(5-тетразоло) метилморфолина; 240) 2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенил-4- (5-тетразоло)-метилморфолина; 241) 2-(R)-(1-(R)-(3-метил)фенилэтокси)-3-(S)-фенил-4- (5-тетразоло)метилморфолина; 242) 2-(R)-(1-(R)-(3-метил)фенилэтокси)-3-(S)-(4-фтор) фенил-4-(5-тетразоло)метилморфолина; 243) 2-(S)-(3-метил)бензилокси-3-(S)-фенил-4-(2-оксо- 5H-пиррол-4-ил)метилморфолина; 244) 2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенил-4-(2- оксо-5H-пиррол-4-ил)метилморфолина; 245) 2-(R)-(1-(R)-(3-метил)фенилэтoкcи-3-(S)-фенил-4- (2-оксо-5H-пиррол-4-ил)метилморфолина; 246) 2-(R)-(1-(R)-(3-метил)фенилэтокси-3-(S) -(4-фтор)фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолина; 247) 2-(S)-(3-бром)бензилокси-3-(S)-фенилморфолина; 248) 2-(S)-(3-бром)бензилокси-3-(S)-(4-фтор)фенилморфолина; 249) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-фенилморфолина; 250) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-(4-фтор)фенилморфолина; 251) 2-(S)-(3-бром)бензилокси-3-(S)-фенил-4-(3-(1,2, 4-триазоло)метилморфолина; 252) 2-(S)-(3-бром)бензилокси-3-(S)-(4-фтор)фенил-4-(3- (1,2,4-триазоло)метилморфолина; 253) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-фенил-4-(3- (1,2,4-триазоло)метилморфолина; 254) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метилморфолина; 255) 2-(S)-(3-бром)бензилокси-3-(S)-фенил-4-(3- (5-оксо-1H, 4H-1,2,4-триазоло)метилморфолина; 256) 2-(S)-(3-бром)бензилокси-3-(S)-(4-фтор) фенил-4-(3-(5-оксо-1Н,4Н-1,2,4-триазоло)метилморфолина; 257) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-фенил-4-(3- (5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 258) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-(4-фтор) фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 259) 2-(S)-(3-бром)бензилокси-3-(S)-фенил-4-(4-(2-оксо-1,3- имидазоло)метил)морфолина; 260) 2-(S)-(3-бром)бензилокси-3-(S)-(4-фтор)фенил-4-(4- (2-оксо-1,3-имидазоло)метил)морфолина; 261) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-фенил-4-(4- (2-оксо-1,3-имидазоло)метил)морфолина; 262) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-(4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 263) 2-(S)-(3-бром) бензилокси-3-(S)-фенил-4-(2-имидазоло) метилморфолина; 264) 2-(S)-(3-бром)бензилокси-3-(S)-(4-фтор) фенил-4-(2-имидазоло)-метилморфолина; 265) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-фенил-4- (2-имидазоло)-метилморфолина; 266) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-(4-фтор) фенил-4-(2-имидазоло)метилморфолина; 267) 2-(S)-(3-бром)бензилокси-3-(S)-фенил-4- (4-имидазоло)метилморфолина; 268) 2-(S)-(3-бром)бензилокси-3-(S)-(4-фтор)фенил-4- (4-имидазоло)-метилморфолина; 269) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-фенил-4- (4-имидазоло)-метилморфолина; 270) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-(4-фтор) фенил-4-(4-имидазоло)метилморфолина; 271) 2-(S)-(3-бром)бензилокси-3-(S)-фенил-4-(5- тетразоло)метилморфолина; 272) 2-(S)-(3-бром)бензилокси-3-(S)-(4-фтор)фенил-4- (5-тетразоло)-метилморфолина; 273) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-фенил-4- (5-тетразоло)-метилморфолина; 274) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-(4-фтор)фенил-4- (5-тетразоло)метилморфолина; 275) 2-(S)-(3-бром)бензилокси-3-(S)-фенил-4-(2-оксо-5H-пиррол-4-ил) метилморфолина; 276) 2-(S)-(3-бром)бензилокси-3-(S)-(4-фтор) фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолина; 277) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-фенил-4- (2-оксо-5H-пиррол-4-ил)метилморфолина; 278) 2-(R)-(1-(R)-(3-бром)фенилэтокси-3-(S)-(4-фтор)фенил- 4-(2-оксо-5H-пиррол-4-ил)метилморфолина; 279) 2-(S)-(3-хлор)бензилокси-3-(S)-фенилморфолина; 280) 2-(S)-(3-хлор)бензилокси-3-(S)-(4-фтор)фенилморфолина; 281) 2-(R)-(1- (R)-(3-хлор)фенилэтокси-3-(S) -фенилморфолина; 282) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)- (4-фтор)фенилморфолина; 283) 2-(S)-(3-хлор)бензилокси-3-(S)-фенил-4-(3-(1,2,4- триазоло)метил)морфолина; 284) 2-(S)-(3-хлор)бензилокси-3-(S)-(4-фтор)фенил- -4-(3-(1,2,4-триазоло)метил)морфолина; 285) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-фенил-4-(3- (1,2,4-триазоло)метил)морфолина; 286) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-(4- фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 287) 2-(S)-(3-хлор)бензилокси-3-(S)-фенил-4-(3-(5-оксо-1H, 4H-1,2,4-триазоло)метил)морфолина; 288) 2-(S)-(3-хлор)бензилокси-3-(S)-(4-фтор)фенил-4-(3- (5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 289) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-фенил-4-(3- (5-оксо-1H,4H-1,2,4-триаэоло)метил)морфолина; 290) 2-(R)-(1-(R) (3-хлор)фенилэтокси-3-(S)-(4-фтор) фенил-4-(3-(5-окco-1H,4H-1,2,4-триазоло)метил)морфолина; 291) 2-(S)-(3-хлор)бензилокси-3-(S)-фенил-4-(4- (2-оксо-1,3-имидазоло)метил)морфолина; 292) 2-(S)-(3-хлор)бензилокси-3-(S)-(4-фтор) фенил-4-(4-(2-oксо-1,3-имидазоло)метил)морфолина; 293) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-фенил-4-(4- (2-oксо-1,3-имидазоло)метил)морфолина; 294) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-(4-фтор)фенил- 4-(4-(2-oксо-1,3-имидазоло)метил)морфолина; 295) 2-(S)-(3-хлор)бензилокси-3-(S)-фенил-4-(2-имидазоло) метил)-морфолина; 296) 2-(S)-(3-хлор)бензилокси-3-(S)-(4-фтор)фенил-4- (2-имидазоло)-метил)морфолина; 297) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-фенил-4- (2-имидазоло)-метил)морфолина; 298) 2-(R)-(1-(R)-3-хлор)фенилэтокси-3-(S)-(4-фтор) фенил-4-(2-имидазоло)метилморфолина; 299) 2-(S)-(3-хлор)бензилокси-3-(S)-фенил-4-(4-имидазоло) метил)-морфолина; 300) 2-(S)-(3-хлор)бензилокси-3-(S)-(4-фтор)фенил-4-(4-имидазоло) -метил)морфолина; 301) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-фенил-4- (4-имидазоло)-метил)морфолина; 302) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-(4-фтор) фенил-4-(4-имидазоло)метилморфолина; 303) 2-(S)-(3-хлор)бензилокси-3-(S)-фенил-4- (5-тетразоло)метилморфолина; 304) 2-(S)-(3-хлор)бензилокси-3-(S)-(4-фтор)фенил-4- (5-тетразоло)-метилморфолина; 305) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-фенил-4- (5-тетразоло)-метилморфолина; 306) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-(4-фтор)фенил-4- (5-тетразоло)метил)морфолина; 307) 2-(S)-(3-хлор)бензилокси-3-(S)-фенил-4- (2-оксо-5H-пиррол-4-ил)метилморфолина; 308) 2-(S)-(3-хлор)бензилокси-3-(S)-(4-фтор)фенил-4- (2-оксо-5H-пиррол-4-ил)метилморфолина; 309) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-фенил-4- (2-оксо-5H-пиррол-4- ил)метилморфолина; 310) 2-(R)-(1-(R)-(3-хлор)фенилэтокси-3-(S)-(4- фтор)фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолина; 311) 2-(S)-(3-трифторметил)бензилокси-3-(S) -фенилморфолина; 312) 2-(S)-(3-трифторметил)бензилокси-3-(S)-(4-фтор) фенилморфолина; 313) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S)-фенилморфолина; 314) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S)-(4-фтор) фенилморфолина; 315) 2-(S)-(3-трифторметил)бензилокси-3-(S)-фенил-4- (3-1Н, 4Н-1,2,4-триазоло)метилморфолина; 316) 2-(S)-(3-трифторметил)бензилокси-3-(S)-(4-фтор)фенил-4- (3-1H,4H-1,2,4-триазоло)метилморфолина; 317) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S) -фенил-4-(3-1Н,4H-1,2,4-триазоло)метилморфолина; 318) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S)- (4-фтор)фенил-4-(3-1Н,4Н-1,2,4-триазоло)метилморфолина; 319) 2-(R)-(1-(R)-3-трифторметил)бензилокси-3-(S)-фенил-4- (3-(5-оксо)-1H,4H-1,2,4-триазоло)метил)морфолина; 320) 2-(S)-(3-трифторметил)бензилокси-3-(S)-(4-фтор) фенил-4-(3-(5-оксо)-1H,4H-1,2,4-триазоло)метил)морфолина; 321) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3- (S)-фенил-4-(3-(5-оксо)-1H,4H-1,2,4-триазоло)метил)морфолина 322) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S)-(4-фтор) фенил-4-(3-(5-оксо)-1Н,4Н-1,2,4-триазоло)метил)морфолина; 323) 2-(S)-(3-трифторметил)бензилокси-3-(S)-фенил-4-(4- (2-оксо-1,3-имидазоло)метил)морфолина; 324) 2-(S)-(3-трифторметил)бензилокси-3-(S)-(4-фтор) фeнил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 325) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S) -фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 326) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S)-(4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 327) 2-(S)-(3-трифторметил)бензилокси-3-(S)-фенил-4- (2-имидазоло)метилморфолина; 328) 2-(S))-(3-трифторметил)бензилокси-3-(S)-(4-фтор) фенил-4-(2-имидазоло) метилморфолина; 329) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S)-фенил-4- (2-имидазоло)метилморфолина; 330) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S)-(4-фтор) фенил-4-(2-имидазоло)метилморфолина; 331) 2-(S)-(3-трифторметил)бензилокси-3-(S)-фенил-4-(4- имидазоло)метилморфолина; 332) 2-(S)-(3-трифторметил)бензилокси-3-(S)-(4-фтор) фенил-4-(4-имидазоло)метилморфолина; 333) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3- (S)-фенил-4-(4-имидазоло)метилморфолина; 334) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S)-(4-фтор) фенил-4-(4-имидазоло)метилморфолина; 335) 2-(S)-(3-трифторметил)бензилокси-3-(S)-фенил-4- (5-тетразоло)-метилморфолина; 336) 2-(S)-(3-трифторметил)бензилокси-3-(S)-(4-фтор) фенил-4-(5-тетразоло)метилморфолина; 337) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S)-фенил-4- (5-тетразоло)метилморфолина; 338) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S)-(4-фтор) фенил-4-(5-тетразоло)метилморфолина; 339) 2-(S)-(3-трифторметил)бензилокси-3-(S)-фенил-4- (2-оксо-5H-пиррол-4-ил)метилморфолина; 340) 2-(S)-(3-трифторметил)бензилокси-3-(S)-(4-фтор)фенил-4- (2-оксо-5H-пиррол-4-ил)метилморфолина; 341) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S) -фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолина; 342) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси-3-(S) -(4-фтор)фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолина; 343) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенилморфолина; 344) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-(4-фтор) фенилморфолина; 345) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3- (S)-фенилморфолина; 346) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)-(4-фтор) фенилморфолина; 347) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенил-4-(3-(1, 2,4-триазоло)метилморфолина; 348) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-(4-фтор)фенил-4- (3-(1,2,4-триазоло)метилморфолина; 349) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)-фенил-4- (3-(1,2,4-триазоло)метилморфолина; 350) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)-(4- фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолина; 351) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенил-4-(3- (5-оксо-1H, 4H-1,2,4-триазоло)метилморфолина; 352) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-(4-фтор)фенил- 4-(3-(5-оксо-1H,4Н-1,2,4-триазоло)метилморфолина; 353) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)- фенил-4-(3-(5-оксо-1Н,4Н-1,2,4-триазоло)метилморфолина; 354) 2-(R)-(1-(R-(3-трет-бутил)фенилэтокси-3-(S)-(4-фтор) фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метилморфолина; 355) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенил-4-(4- (2-окco-1,3-имидазоло)метилморфолина; 356) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-(4-фтор) фенил-4-(4-(2-окco-1,3-имидазоло)метилморфолина; 357) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)-фенил-4- (4-(2-окco-1,3-имидазоло)метилморфолина; 358) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)- (4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метилморфолина; 359) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенил-4- (2-имидазоло)метилморфолина; 360) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-(4-фтор) фенил-4-(2-имидазоло)метилморфолина; 361) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)-фенил-4- (2-имидазоло)метилморфолина; 362) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)- (4-фтор)фенил-4-(2-имидазоло)метилморфолина; 363) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенил-4- (4-имидазоло)метилморфолина; 364) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-(4-фтop)фенил-4- (4-имидазоло)метилморфолина; 365) 2-(R)-(1-(R)-3-трет-бутил)фенилэтокси-3-(S)-фенил-4- (4-имидазоло)метилморфолина; 366) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)- (4-фтор)фенил-4-(4-имидазоло)метилморфолина; 367) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенил-4- (5-тетразоло)метилморфолина; 368) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-(4-фтор)фенил-4- (5-тетразоло)метилморфолина; 369) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)-фенил-4- (5-тетразоло)метилморфолина; 370) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)-(4-фтор)фенил- 4-(5-тетразоло)метилморфолина; 371) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенил-4- (2-оксо-5H-пиррол-4-ил)метилморфолина; 372) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-(4-фтор)фенил-4- (2-оксо-5H-пиррол-4-ил)метилморфолина; 373) 2-(R)-(1-(R)-(3-(трет-бутил)фенилэтокси-3-(S)-фенил- 4-(2-оксо-5H-пиррол-4-ил)метилморфолина; 374) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси-3-(S)-(4-фтор)фенил-4- (2-оксо-5H-пиррол-4-ил)метилморфолина; 375) 3-(4-(имидазоло)метил-2-(3-(трет-бутил)-5-(трифторметил) бензилокси)-3-фенилморфолина; 376) 2-(R)-(2,5-бис(трифторметил)бензилокси)-3-(S)-(4-фторфенил)-4- бензилморфолина; 377) 2-(R)-(1-(2,5-бис(трифторметил)фенил)этенилокси)- 3-(S)-(4-фторфенил)-4-бензилморфолина; 378) 2-(R)-(1-(R)-(2,5-бис(трифторметил)фенил)этокси)-3- (S)-(4-фторфенил)морфолина; 379) 2-(R)-(1-(R)-(2,5-бис(трифторметил)фенил)этокси)-3- (S)-(4-фторфенил)-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 380) 2-(R)-(1-(R)-(2,5-бис(трифторметил)фенил)этокси)-3-(S) -(4-фторфенил)-4-(3-(1,2,4-триазоло)метил)морфолина; 381) 2-(R)-(1-(R)-(2,5-бис(трифторметил)фенил)этокси)-3-(S)- (4-фторфенил)-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 382) 2-(R)-(1-(R)-(3-(тиометил)фенил)этокси-3-(S)-фенилморфолина; 383) 2-(R)-(1-(R)-(3-(тиометилфенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1H, 4H-1,2,4-триазоло)метил)морфолина; 384) 2-(R)-(1-R)-(3-(тиометилфенил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 385) 2-(R)-(1-(R)-(3-(тиометилфенил)этокси)-3-(S)-фенил)-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 386) 2-(R)-(1-(R)-(3-(тиометил)-5-(трифторметил))фенил)этокси) -3-(S)-фенилморфолина; 387) 2-(R)-(1-(R)-(3-(тиометил)-5-(трифторметил)фенил)этокси)- 3-(S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 388) 2-(R)-(1-(R)-(3-тиометил)-5-(трифторметил)фенил)этокси)- 3-(S)-фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 389) 2-(R-(1-(R)-(3-(тиометил)-5-(трифторметил) фенил)этокси)-3-(S)-фенил-4-(4-(2-оксо-1,3-имидазоло)метил) морфолина; 390) 2-(R)-(1-(R)-(2,2-(диметил)-5-(тиометил)- 2, 3-дигидробензофуран-7-ил)этокси)-3-(S)-фенилморфолина; 391) 2-(R)-(1-(R)-(2,2-(диметил)-5-(тиометил)-2,3- дигидробензофуран-7-ил)этокси)-3-(S)-фенил-4-(3-(5-оксо- 1H,4H-1,2, 4-триазоло)метил)морфолина; 392) 2-(R)-(1-(R)-(2,2-(диметил)-5-(тиометил)-2,3- дигидробензофуран-7-ил)этокси)-3-(S)-фенил-4-(3-(1,2,4- триазоло)метилморфолина; 393)2-(R)-(1-(R)-(2,2-(диметил)-5-(тиометил)-2,3- дигидробензофуран-7-ил)этокси)-3-(S)-фенил-4-(2-оксо-1, 3-имидазоло)метил)морфолина; 394) 2-(R-)-(1-(R)-(3,5-(диметокси)фенил)этокси)-3-(S)- фенилморфолина; 395) 2-(R)-(1-(R)-(3,5-диметокси)фенил)этокси)-3-(S)- фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 396) 2-(R)-(1-(R)-(3,5-(диметокси)фенил)этокси)-3-(S)-фенил- 4-(3-(1,2,4-триазоло)метил)морфолина; 397) 2-(R)-(1-(R)-(3,5-(диметокси)фенил)этокси)-3-(S)-фенил- 4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 398) 2-(R)-(1-(R)-(3-(фтор)-5-(трифторметил)фенил)этокси)-3- (S)-(4-фторфенил)морфолина; 399) 2-(R)-(1-(R)-(3-(фторфенил)-5-(трифторметил)этокси)-3-(S)- (4-фторфенил)-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 400) 2-(R)-(1-(R)-(3-(фторфенил)-5-(трифторметил)этокси)-3- (S)-(4-фторфенил)-4-(3-(1,2,4-триазоло)метил)морфолина; 401) 2-(R)-(1-(R)-(3-(фторфенил)-5-(тpифтopмeтил)этoкси)- 3-(S)-(4-фторфенил)-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 402) 2-(R)-(1-(R)-(3-(хлор)-5-(трифторметил) фенил)этокси)-3-(S)-(4-фторфенил)морфолина; 403) 2-(R)-(1-(R)-(3-(хлорфенил)-5-(трифторметил)этокси)- 3-(S)-(4-фтор)фенил)-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 404) 2-(R)-(1-(R)-(3-(хлорфенил)-5-(трифторметил)этокси)-3-(S)- (4-фтор)фенил)-4-(3-(1,2,4-триазоло)метил)морфолина; 405) 2-(R)-(1-(R)-(3-(хлорфенил)-5-(трифторметил)этокси)-3-(S)- (4-фтор)фенил)-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 406) 2-(R)-(1-(R)-(3,5-(диметил)фенил)этокси)-3-(S)-(4-фтор) фенилморфолина; 407) 2-(R)-(1-(R)-(3,5-(диметил)фенил)этокси)-3-(5)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 408) 2-(R)-(1-(R)-(3,5-(диметил)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 409) 2-(R)-(1-(R)-(3,5-(диметил)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 410) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил)этокси)- 3-(S)-(4-фтор)фенилморфолина; 411) 2-(R)-(1-(R)-(3-фтор)-5-(метил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 412) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил)этокси)- 3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 413) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил)этокси)- 3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 414) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил)этокси)- 3-(S)-(4-фтор)фенилморфолина; 415) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил)этокси)- 3-(S)-(4- фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)ме- тилморфолина; 416) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил)этокси)- 3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морофолина; 417) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил)этокси)-3-(S)-(4- фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 418) 2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил)этокси)-3-(S)-(4- фтор)фенилморфолина; 419) 2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 420) 2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил)этокси)-3-(S)- (4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 421) 2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил)этокси)- 3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 422) 2-(R)-(1-(R)-(3-(изопропокси)фенил)этокси)-3-(S)- (4-фтор)фенилморфолина; 423) 2-(R)-(1-(R)-(3-(изопропокси)фенил)этокси-3-(S)- (4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2, 4-триазоло)метил)морфолина; 424) 2-(R)-(1-(R)-(3-изопропокси)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 425) 2-(R)-(1-(R)-(3-(изопропокси)фенил)этокси)-3-(S)- (4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 426) 2-(R)-(1-(R)-(3-(изопропокси)-5-(трифторметил)фенил)этокси) -3-(S)-(4-фтор)фенилморфолина; 427) 2-(R)-(1-(R)-(3-изопропокси)-5-(трифторметил)фенил) этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло) метил)морфолина; 428) 2-(R)-(1-(R)-(3-(изопропокси)-5-(трифторметил)фенил) этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 429) 2-(R)-(1-(R)-(3-изопропокси)-5-(трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(2-оксо-1,3-имидазоло)метил)морфолина; 430) 2-(R)-(1-(R)-(3-(хлор)-5-(изопропокси)фенил)этокси)-3-(S)-4- фтор)фенилморфолина; 431) 2-(R)-(1-(R)-(3-(хлор)-5-(изопропокси)фенил)этокси)-3-(S) -(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло) метил)морфолина; 432) 2-(R)-(1-(R)-(3-(хлор)-5-(изопропокси)фенил)этокси) -3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 433) 2-(R)-(1-(R)-(3-(хлор)-5-(изопропокси)фенил)этокси) -3-(S)-4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 434) 2-(R)-(1-(R)-(3-(фтор)-5-(изопропокси)фенил)этокси)- 3-(S)-(4-фтор)фенилморфолина; 435) 2-(R)-(1-(R)-(3-(фтор)-5-(изопропокси) фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2, 4-триазоло)метил)морфолина; 436) 2-(R)-(1-(R)-(3-(фтор)-5-(изопропокси)фенил)этокси)- 3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 437) 2-(R)-(1-(R)-(3-(фтор)-5-(изопропокси)фенил)этокси)- 3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазо)метил)морфолина 438) 2-(R)-(1-(R)-(3-трет-бутил)-5-(хлор)фенил)этокси)-3-(S) -(4-фтор)фенилморфолина; 439) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(хлор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина 440) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(хлор)фенил)этокси)-3-(S)- (4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 441) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(хлор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 442) 2-(R)-(1-(R)-(3-(тpeт-бутил)-5-(тpифтopмeтил) фенил)этокси)-3-(S)-(4-фтор)фенилморфолина; 443) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(трифторметил)фенил)этокси) -3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил) морфолина; 444) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(трифторметил)фенил)этокси) -3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 445) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(трифторметил)фенил) этокси)-3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 446) 2-(R)-(1-(R)-(3,5-(диметил)-4-(фтор)фенил)этокси)-3-(S)- (4-фтор)фенилморфолина; 447) 2-(R)-(1-(R)-(3,5-(диметил)-4-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 448) 2-(R)-(1-(R)-(3,5-(диметил)-4-(фтор)фенил)этокси)-3-(S) -(4-фтор)фенил-4-(3-1,2,4-триазоло)метил)морфолина; 449) 2-(R)-(1-(R)-(3,5-(диметил)-4-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 450) 2-(R)-(1-(R)-(3,5-(диметил)-4-(хлор)фенил)этокси)-3-(S) -(4-фтор)фенилморфолина; 451) 2-(R)-(1-(R)-(3,5-(диметил)-4-(хлор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 452) 2-(R)-(1-(R)-(3,5-(диметил)-4-(хлор)фенил) этокси)-3- (S) (4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 453) 2-(R)-(1-(R)-(3,5-(диметил)-4-(хлор)фенил)этокси)-3-(S)- (4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метил) морфолина; 454) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(фтор)фенил)этокси) -3-(S)-(4-фтор)фенилморфолина; 455) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(фтор)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(5-оксо-1Н,4Н-1,2,4-триазоло)метил)морфолина; 456) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(фтор)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолина; 457) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(фтор)фенил)этокси) -3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 458) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси)-3- (S)-(4-фтор)фенилморфолина; 459) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(5-оксо-1Н,4Н-1,2,4-триазоло)метил)морфолина; 460) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 461) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина 462) 2-(R)-(1-(R)-(3,5-(дихлор) фенил)этокси)-3-(S)-(4-фтор) фенилморфолина; 463) 2-(R)-(1-(R)-(3,5-(дихлор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1Н,4Н-1,2,4-триазоло)метил)морфолина; 464) 2-(R)-(1-(R)-(3,5-(дихлор)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 465) 2-(R)-(1-(R)-(3,5-(дихлор)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(4-(2-oкco-1,3-имидазоло)метил)морфолина; 466) 2-(R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3-(S)-(4-фтор) фенилморфолина; 467) 2-(R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1Н,4Н-1,2,4-триазoлo)метил)морфолина; 468) 2-(R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 469) 2-(R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 470) 2-(R)-(1-(R)-нафтил)этокси)-3-(S)-(4-фтор)фенилморфолина; 471) 2-(R)-(1-(R)(1-нафтил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1Н, 4Н,1,2,4-триазоло)метил)морфолина; 472) 2-(R)-(1-(R)-(1-нафтил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2, 4-триазоло)метил)морфолина; 473) 2-(R)-(1-(R)-(1-нафтил)этокси)-3-(S)-(4-фтор)фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 474) 2-(R)-(1-(R)-(1-(4-фтор)нафтил)этокси-3-(S)-(4-фтор) фенилморфолина; 475) 2-(R)-(1-(R)-(1-(4-(фтор)нафтил)этокси)-3-(S)- (4-фтор)фенил-4-(3-(5-оксо-1Н,4H-1,2,4-триазоло)метил) морфолина; 476) 2-(R)-(1-(R)-1(4-(фтор)нафтил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 477) 2-(R)-(1-(R)-(1-(4-(фтор)нафтил)этокси)-3-(S)-(4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 478) 2-(R)-(1-(R)-(1-(3-фтор)нафтил)этокси)-3-(S)-(4-фтор) фенилморфолина; 479) 2-(R)-(1-(R)-(1-(3-(фтор)нафтил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(5-оксо-1Н,4Н-1,2,4-триазоло)метил)морфолина; 480) 2-(R)-(1-(R)-(1-(3-(фтор)нафтил)этокси)-3-(S)-(4-фтор)фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 481) 2-(R)-(1-(R)-(1-(3-(фтор)нафтил)этокси)-3-(S)-(4-фтор)фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 482) 2-(R)-(1-(R)-(1-(3-(хлор)нафтил)этокси)-3-(S)-(4-фтор) фенилморфолина; 483) 2-(R)-(1-(R)-(1-(3-(хлор)нафтил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(5-оксо-1Н,4Н-1,2,4-триазоло)метил)морфолина; 484) 2-(R)-(1-(R)-(1-(3-(хлор)нафтил)этокси)-3-(S)-(4-фтор)фенил- 4-(3-(1,2,4-триазоло)метил)морфолина; 485) 2-(R)-(1-(R)-1-(3-хлор)нафтил)этокси)-3-(S)-(4-фтор)фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 486) 2-(R)-(1-(R) -(1-(3-метил)нафтил)этокси)-3-(S)-(4-фтор) фенилморфолина; 487) 2-(R)-(1-(R)-(1-(3-(метил)нафтил)этокси)-3-(S)-(4- фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина 488) 2-(R)-(1-(R)-(1-(3-метил)нафтил)этокси)-3-(S)(4-фтор)фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 489) 2-(R)-(1-(R)-(1-(3-(метил)нафтил)этокси)-3-(S)-(4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 490) 2-(R)-(1-(R)-(1-(3-трифторметил)нафтил)этокси)-3-(S) -(4-фтор)-фенилморфолина; 491) 2-(R)-(1-(R)-(1-(3-(трифторметил)нафтил)этокси)-3-(S)- (4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 492) 2-(R)-(1-(R)-(1-(3-(трифторметил)нафтил)этокси)-3-(S)-(4-фтор) -фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 493) 2-(R)-(1-(R)-(1-(3-(трифторметил)нафтил)этокси)-3-(S)-(4-фтор)-фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 494) 2-(R)-(1-(R)-(3-(тиометил)фенил)этокси)-3-(S)-(4-фтор) фенилморфолина; 495) 2-(R)-(1-(R)-(3-(тиометил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 496) 2-(R)-(1-(R)-(3-(тиометил)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 497) 2-(R)-(1-(R)-(3-(тиометил)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 498) 2-(R)-(1-(R)-(3-(тиометил)-5-(трифторметил)фенил)этокси)-3- (S)-(4-фтор)фенилморфолина; 499) 2-(R)-(1-(R)-(3-тиометил)-5-(трифторметил)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4Н-1,2,4-триазоло)метил)морфолина; 500) 2-(R)-(1-(R)-(3-(тиометил)-5-(трифторметил)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 501) 2-(R)-(1-(R)-(3-(тиометил)-5-(трифторметил)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина 502) 2-(R)-(1-(R)-(2,2-(диметил)-5-(тиометил)-2,3-дигидробензофуран-7-ил) этокси)-3-(S)-(4-фтор)фенилморфолина; 503) 2-(R)-(1-(R)-(2,2-диметил)-5-(тиометил)-2,3-дигидробензофуран-7-ил) этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 504) 2-(R)-(1-(R)-(2,2-диметил-5-(тиометил)-2,3-дигидробензофуран-7-ил) этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 505) 2-(R)-(1-(R)-(2,2-диметил)-5-(тиометил)-2,3-дигидробензофуран-7-ил) этокси)-3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)-морфолина; 506) 2-(R)-(1-(R)-(3,5-диметокси)фенил)этокси)-3-(S)-(4-фтор) фенилморфолина; 507) 2-(R)-(1-(R)-(3,5-диметокси)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 508) 2-(R)-(1-(R)-(3,5-диметокси)фенил)этокси)-3-(S)-(4- фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 509) 2-(R)-(1-(R)-(3,5-диметокси)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 510) 2-(R)-(1-(R)-(фенил))этокси)-3-(S)-фенилморфолина; 511) 2-(R)-(1-(R)-фенил)этокси)-3-(S)-фенил-4-(3-(5-оксo-1H, 4H-1,2,4- триазоло)метил)морфолина; 512) 2-(R)-(1-(R)-(фенил)этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло)-метил) морфолина; 513) 2-(R)-(1-(R)-(фенил)этокси)-3-(S)-фенил-4-(4-(2-оксо-1,3-имидазоло) метил)морфолина; 514) 2-(R)-(1-(R)-(фенил)этокси)-3-(S)-(4-фтор)фенилморфолина; 515) 2-(R)-(1-(R)-(фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H, 4H-1,2,4-триазоло)метил)морфолина; 516) 2-(R)-(1-(R)-(фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло) метил)морфолина; 517) 2-(R)-(1-(R)-(фенил)этокси)-3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3- имидазоло)метил)морфолина; 518) 2-(R)-(1-(R)-(3-фтор)фенил)этокси)-3-(S)-фенилморфолина; 519) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)-3-(S)-фенил-4-(3- (5-оксо-1H, 4H-1,2,4-триазоло)метил)морфолина; 520) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 521) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)-3-(S)- фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 522) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)-3-(S)-(4-фтор) фенилморфолина; 523) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 524) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 525) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 526) 2-(R)-(1-(R)-(4-фтор)фенил)этокси)-3-(S)-фенилморфолина; 527) 2-(R)-(1-(R)-(4-(фтор)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1H, 4H-1,2,4-триазоло)метил)морфолина; 528) 2-(R)-(1-(R)-(4-(фтор)фенил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 529) 2-(R)-(1-(R)-(4-(фтор)фенил)этокси)-3-(S)-фенил-4-(4- (2-оксо-1,3-имидазоло)метил)морфолина; 530) 2-(R)-(1-(R)-(4-(фтор)фенил)этокси)-3-(S)-(4-фтор) фенилморфолина; 531) 2-(R)-(1-(R)-(4-(фтор)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 532) 2-(R)-(1-(R)-(4-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 533) 2-(R)-(1-(R)-(4-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 534) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3- (S)-(3-фтор)фенилморфолина; 535) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)- (3-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 536) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)- (3-фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 537) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3- (S)-(3-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина 538) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-дифтор) фенилморфолина; 539) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-дифтор) фенил-4-(3-(5-оксо-1H,4Н-1,2,4-триазоло)метил)морфолина; 540) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-дифтор) фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 541) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-дифтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 542) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-дихлор) фенилморфолина; 543) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-дихлор) фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 544) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3- (S)-(3,4-дихлор)фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 545) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-дихлор) фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 546) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-диметил) фенилморфолина; 547) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-диметил) фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 548) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-диметил) фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 549) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-диметил) фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 550) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)- (3,4-метилендиоксифенилморфолина; 551) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-метилендиоксифенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 552) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4- метилендиоксифенил-4-(3-(1,2,4-триазоло)метил)морфолина; 553) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)- (3,4-метилендиоксифенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 554) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3- (S)-(2-нафтил)морфолина: 555) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(2-нафтил) -4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 556) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)- (2-нафтил)-4-(3-(1,2,4-триазоло)метил)морфолина; 557) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S) -(2-нафтил)-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 558) 2-(R)-(1-(R)-(3-(фторфенил)-5-(трифторметил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 559) 2-(R)-(1-(R)-(3-(фторфенил)-5-(трифторметил)этокси)-3-(S)-фенил- 4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 560) 2-(R)-(1-(R)-(3-(хлорфенил)-5-(трифторметил)-этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 561) 2-(R)-(1-(R)-(3-(хлорфенил)-5-(трифторметил)этокси)-3-(S)-фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 562) 2-(R)-(1-(R)-(3,5-диметил)фенил)этокси)-3-(S)-фенил-4-(3-(1,2,4- триазоло)метил)морфолина; 563) 2-(R)-(1-(R)-(3,5-(диметил)фенил)этокси)-3-(S)-фенил-4-(4-(2-оксо- 1,3-имидазоло)метил)морфолина; 564) 2-(R)-(1-(R)-(3-фтор)-5-(метил)фенил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 565) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил)этокси)-3-(S)-фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 566) 2-(R)-(1-(R)-(3-(хлор)-5-(метил)фенил)этокси)-3-(S)-фенил-4- (3-(1H,4H-1,2,4-триазоло)метил)морфолина; 567) 2-(R)-(1-(R)-(3-(хлор)-5-(метил)фенил)этокси)-3-(S)-фенил-4-(4-(2-оксо-1,3- имидазоло)метил)морфолина; 568) 2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 569) 2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил)этокси)-3-(S)-фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 570) 2-(R)-(1-(R)-(3-(изопропокси)фенил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 571) 2-(R)-(1-(R)-(3-(изопропокси)фенил)этокси)-3-(S)-фенил-4-(4- (2-оксо-1,3-имидазоло)метил)морфолина; 572) 2-(R)-(1-(R)-(3-(изопропокси)-5-(трифторметил)фенил)этокси)-3- (S)-фенил-4-(3-(1H,4H-1,2,4-триазоло)метил)морфолина; 573) 2-(R)-(1-(R)-(3-(изопропокси)-5-(трифторметил)фенил)этокси)-3-(S)-фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 574) 2-(R)-(1-(R)-(3-(хлор)-5-(изопропокси)фенил)этокси)-3-(S)-фенил-4- (3-(1H,4H-1,2,4-триазоло)метил)морфолина; 575) 2-(R)-(1-(R)-(3-(хлор)-5-(изопропокси)фенил)этокси)-3- (S)-фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 576) 2-(R)-(1-(R)-(3-(фтор)-5-(изопропокси)фенил)этокси)-3-(S)-фенил-4- (3-(1H,4H-1,2,4-триазоло)метил)морфолина; 577) 2-(R)-(1-(R)-(3-(фтор)-5-(изопропокси)фенил)этокси)-3-(S)-фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 578) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(хлор)фенил)этокси)-3-(S)-фенил-4 (3-(1H,4H-1,2,4-триазоло)метил)морфолина; 579) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(хлор)фенил)этокси)-3-(S)-фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 580) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(трифторметил)фенил)этокси-3-(S)- фенил-4-(3-(1H,4H-1,2,4-триазоло)метил)морфолина; 581) 2-(R-(1-(R)-(3-(трет-бутил)-5-(трифторметил)фенил)этокси-3-(S)-фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 582) 2-(R)-(1-(R)-(3,5-(диметил)-4-(фтор)фенил)этокси)-3-(S) -фенил-4-(3-(1,2,4-триазоло)метил)морфолина; 583) 2-(R)-(1-(R)-(3,5-(диметил)-4-(фтор)фенил)этокси)-3-(S)-фенил- 4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 584) 2-(R)-(1-(R)-(3,5-(диметил)-4-(хлор)фенил)этокси)-3-(S)-фенил-4- (3-(1H,4H-1,2,4-триазоло)метил)морфолина; 585) 2-(R)-(1-(R)-(3,5-(диметил)-4-(хлор)фенил)этокси)-3-(S)-фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 586) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(фтор)фенил) этокси)-3-(S)-фенил-4-(3-(1H,4H-1,2,4-триазоло)метил)морфолина; 587) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(фтор)фенил) этокси)-3-(S)-фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 588) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси)-3-(S)- фенил-4-(3-(1H,4H-1,2,4-триазоло)метил)морфолина; 589) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси)-3- (S)-фенил-4(4-(2-оксо-1,3-имидазоло)метил)морфолина; 590) 2-(R)-(1-(R)-(3,5-(дихлор)фенил)этокси)-3-(S)-фенил-4-(3- (1H,4H-1,2,4-триазоло)метил)морфолина; 591) 2-(R)-(1-(R)-(3,5-(дихлор)фенил)этокси)-3-(S)-фенил-4- (2-оксо-1,3-имидазоло)метил)морфолина; 592) 2-(R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3-(S)-фенил-4-(3- (1,2,4-триазоло)метил)морфолина; 593) 2-(R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3-(S)-фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; 594) 2-(R)-(1-(R)-(1-нафтил)этокси)-3-(S)-фенил-4-(3-(1,2,4- триазоло)метил)морфолина; 595) 2-(R)-(1-(R)-(1-(нафтил)этокси)-3-(S)-фенил-4-(4- (2-оксо-1,3-имидазоло)метил)морфолина; 596) 2-(R)-(1-(R)-(1-(4-(фтор)нафтил)этокси-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 597) 2-(R)-(1-(R)-(1-(4-(фтор)нафтил)этокси)-3-(S)- фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолина; 598) 2-(R)-1(R)-(1-(3-(фтор)нафтил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 599) 2-(R)-(1-(R)-(1-(3-(фтор)нафтил)этокси)-3-(S)фенил-4-(4- (2-оксо-1,3-имидазоло)метил)морфолина; 600) 2-(R)-(1-(R)-(1-(3-(хлор)нафтил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метил)морфолина; 601) 2-(R)-(1-(R)-(1-(3-(xлop)нaфтил)этoкcи)-3-(S)-фенил-4- (4-(2-оксо-1,3-имидазоло)метил)морфолина; и их фармацевтически приемлемых солей. Репрезентативные примеры применяемой здесь номенклатуры приводятся ниже: 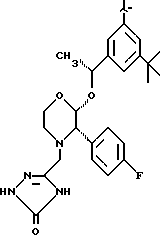 439) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(хлор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолин; 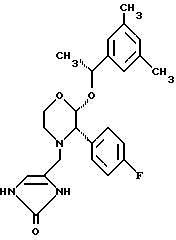 449) 2-(R)-(1-(R)-(3,5-(диметил)-4-(фтор)фенил)этокси)- 3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метил)морфолин; 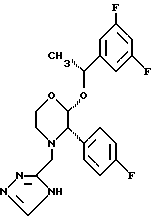 468) 2-(R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3-(S)-(4- фтор)фенил-4-(3-(1,2,4-триазоло)метил)морфолин; Конкретные соединения в пределах объема данного изобретения включают: 1) N-оксид 2(S)-(3,5-бис(трифторметил)бензилокси)-3- (S)-фенил-4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолина; 2) 2(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-4- (3-(4-(этоксикарбонилокси-1-этил)-5-оксо-1H-1,2,4-триазоло) метил)морфолин; 3) 2(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор) -фенил-4-(3-(4-монофосфорил-5-оксо-1H-1,2,4-триазоло)метил)морфолин; 4) 2(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3- (S)-(4-фтор)-фенил-4-(3-(1-монофосфорил-5-оксо-1H-1,2,4-триазоло)метил) морфолин; 5) 2(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)- фенил-4-(3-(2-монофосфорил-5-оксо-1H-1,2,4-триазоло)метил)морфолин; 6) 2(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)-фенил-4-(3-(5-оксифосфорил-1H-1,2,4-триазоло)метил)морфолин; 7) 2(S)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)-фенил- 4-(3-(1-фосфорил-5-оксо-4H-1,2,4-триазоло)метил)морфолин; или их фармацевтически приемлемые соли. Особенно предпочтительные соединения включают те соединения, у которых фармацевтически приемлемая соль является солью бис(N-метил-D- глюкамина). Конкретные соединения в пределах объема данного изобретения включают также 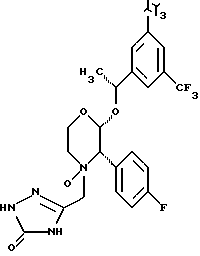 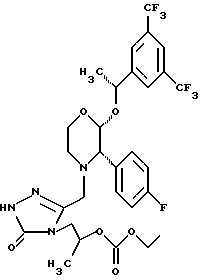 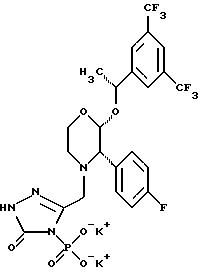 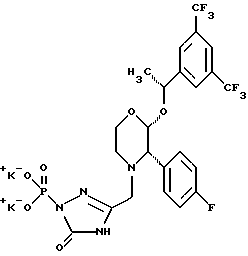 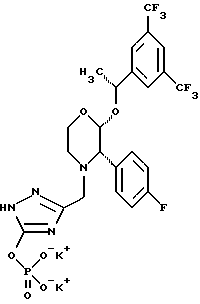 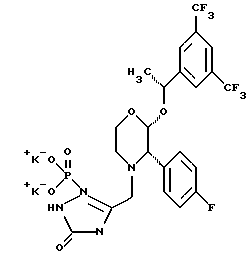 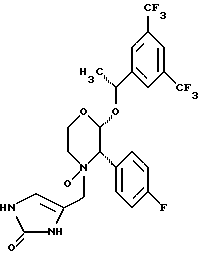 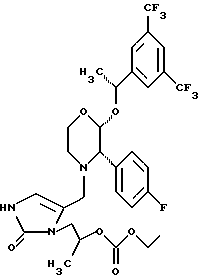 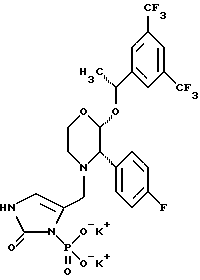 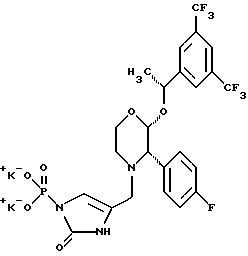 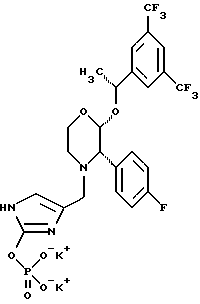 где К+ представляет собой фармацевтически приемлемый противоион. Испытание на антагонизм тахикининам Соединения данного изобретения полезны в качестве антагонистов тахикининов, в частности вещества В и нейрокинина А, при лечении нарушений желудочно-кишечного тракта, нарушений деятельности центральной нервной системы, воспалительных болезней, боли или мигрени и астмы у млекопитающего, нуждающегося в таком лечении. Эту активность можно демонстрировать следующим испытанием. А. Экспрессия рецепторов в COS-клетках Для временной экспрессии рецептора клонированного человеческого нейрокинина-1 (NKIR) в COS-клетках кДНК для человеческого NKIR клонировали в вектор экспрессии pCDM9, который получали из pCDM8 (INVITROGEN) вставкой устойчивого к ампициллину гена (нуклеотидная последовательность 1973-2964 BLUESCRIPT SK+) в сайт Sac II. Трансфекцию 20 мкг плазмидной ДНК в 10 миллионах клеток COS достигали электропорацией в 800 мкл буфера трансфекции (135 мМ NaCl, 1,2 мМ CaCl2, 1,2 мМ MgCl2, 2,4 мМ K2HPO4, 0,6 мМ KH2PO4, 10 мМ глюкозы, 10 мМ HEPES, pH 7.4) при 260 В и 950 мкФ при помощи IBI GENEZAPPER (IBI, New Haven, ст). Клетки инкубировали в 10% фетальной бычьей сыворотки, 2 мМ глутамина, 100 Е/мл пенициллин-стрептомицина и 90% среды DMEM (модифицированная по способу Дульбекко среда Игла) (GIBCO, Grand Island, ny) в 5% CO2 при 37oC в течение трех дней до анализа связывания. В. Стабильная экспрессия в CHO-клетках Для установления стабильной клеточной линии, экспрессирующей клонированный человеческий NKIR, кДНК субклонировали в вектор pRcCMV (INVITROGEN). Трансфекцию 20 мкг плазмидной ДНК в клетки CHO достигали электропорациeй в 800 мкл буфера для трансфекции, снабженного 0,625 мг/мл ДНК спермы сельди при 300 В и 950 мкФ при помощи IBI GENEZAPPER (IBI). Трансфекцированные клетки инкубировали в среде для CHO-клеток [10% фетальной бычьей сыворотки, 100 Е/мл пенициллин-стрептомицина, 2 мМ глутамина, 1/500 гипоксантин-тимидина (АТСС), 90% среды IMDM (среда Дульбекко, модифицированная по способу Исков) (JRH BIOSCIENCES, Lenexa, KS), 0,7 мг/мл G418 (GIBCO)] в 5% CO2 при 37oC до тех пор, пока колонии не становились видимыми. Каждую колонию отделяли и выращивали. Клеточный клон с самым большим числом человеческого NKIR отбирали для последующих использований, например отбора лекарственных средств. C. Способ анализа с применением COS- или CHO-клеток Анализ связывания человеческого NKIR, экспрессированного в клетках COS или CHO, основан на применении 125I-вещества P (125I-SP, от DU PONT, Boston, MA) в качестве меченого радиоактивным изотопом лиганда, который конкурирует с немеченым веществом P или любым другим лигандом в связывании с человеческим NKIR. Монослойные клеточные культуры COS или CHO диссоциировали неферментативным раствором (SPECIALITY MEDIA, Lavallette, NJ) и повторно суспендировали в таком объеме буфера для связывания (50 мМ Трис, pH 7,5, 5 мМ MgCl2, 150 мМ NaCl, 0,04 мг/мл бацитрацина, 0,004 мг/мл лейпептина, 0,2 мг/мл BSA, 0,01 мМ фосфорамидона), чтобы 200 мкл клеточной суспензии давали около 10000 импульсов в минуту специфического 125I-SP-связывания (около 50000-200000 клеток). В анализе связывания 200 мкл клеток добавляли в пробирку, содержащую 20 мкл 1,5-2,5 нМ 125I-SP и 20 мкл немеченого вещества P или любого другого испытуемого соединения. Пробирки инкубировали при 4oC или при комнатной температуре в течение 1 ч при осторожном встряхивании. Связанную радиоактивную часть отделяли от несвязанной радиоактивной части при помощи фильтра GF/C (BRANDLER, Gaithersburg, MD), который предварительно смачивали 0,1%-ным полиэтиленимином. Фильтр три раза промывали 3 мл промывочного буфера (50 мМ Трис, pH 7,5, 5 мМ MnCl2, 150 мМ NaCl, и его радиоактивность определяли гамма-счетчиком. Активацию фосфолипазы C рецептором NKIR можно также измерить в клетках CHO, экспрессирующих человеческий NKIR, путем определения аккумуляции инозитмонофосфата, который является продуктом разрушения IP3 (инозиттрифосфата). Клетки CHO засевают в планшете с 12 лунками, применяя 250000 клеток на лунку. После инкубирования в среде CHO в течение 4 дней клетки загружают 0,025 мкКи/мл 3H-миоинозита при инкубировании в течение ночи. Внеклеточную радиоактивность удаляют промыванием содержащим фосфатный буфер солевым раствором. В лунку добавляют LiCl до конечной концентрации 0,1 мМ с испытуемым соединением или без него и инкубирование продолжают при 37oC в течение 15 мин. Для активации человеческого NKIR в лунку добавляют вещество P до конечной концентрации 0,3 нМ. После 30-минутного инкубирования при 37oC среду удаляют и добавляют 0,1 н HCl. Каждую лунку подвергают ультразвуковой обработке (для разрушения клеток) при 4oC и экстрагируют смесью CHCl3/метанол (1: 1). Водную фазу вводят в ионообменную колонку с 1 мл DOWEX AG 1ХВ. Колонку промывают 0,1 н муравьиной кислотой и затем раствором 0,025 М формат аммония-0,1 н муравьиная кислота. Инозитмонофосфат элюируют смесью 0,2 М формат аммония-0,1 н муравьиная кислота и количественно определяют бета-счетчиком. Обнаружено, что соединения формулы I, приведенные в качестве указанных ниже примеров, замещают радиоактивный лиганд рецептором нейрокинина-1 при концентрации в диапазоне от 0,01 нМ до 1,0 мкМ. Активность данных соединений можно также демонстрировать при помощи анализа, описанного Lri, et al., British J. Pharmacol., 105, 261-262 (1992). Соединения данного изобретения полезны для предупреждения и лечения большого числа клинических состояний, которые характеризуются присутствием избытка активности тахикинина, в частности вещества Р. Эти состояния могут включать нарушения деятельности центральной нервной системы, например тревогу, депрессию, психоз и шизофрению; нейродегенеративные нарушения, например связанную со СПИДом деменцию, старческую деменцию типа Альцгеймера, болезнь Альцгеймера и синдром Дауна; демиелинирующие болезни, например рассеянный склероз (MS) и боковой амиотрофический склероз (ALS; болезнь Lou Gehrig), и другие невропатологические нарушения, такие как периферическая невропатия, например связанная со СПИДом невропатия, диабетическая невропатия, индуцированная химиотерапией невропатия и послегерпетические и другие невралгии; респираторные заболевания, например хроническую обструкцию дыхательных путей: бронхопневмонию, хронический бронхит, бронxоспазм и астму; заболевание дыхательных путей, модулированное нейрогенным воспалением; болезни, характеризующиеся нейрогенной секрецией слизи, например муковисцидоз; болезни, связанные с повышенной гландулярной секрецией, включая слезотечение, например синдром Шегрена, гиперлипопротеинемии IV и V, гемохроматоз, саркоидоз или амилоидоз; воспалительные заболевания, например воспалительное заболевание кишечника, синдром раздраженной толстой кишки, псориаз, фиброзит, глазное воспаление, остеоартрит и ревматический артрит; аллергии, например экзему и ринит; повышенную чувствительность, например вызванную ядовитым плющем; глазные болезни, например конъюнктивит, весенний конъюнктивит, синдром сухих глаз и тому подобное; кожные болезни, например контактный дерматит, атопический дерматит, крапивницу и другие экзематоидные дерматиты; отек, например отек, вызванный термическим повреждением; нарушения, связанные с привыканием, например алкоголизм; связанные со стрессом соматические нарушения, рефлекторную симпатическую дистрофию, например синдром плеча; дистимические нарушения; неблагоприятные иммунологические реакции, например отторжение трансплантированных тканей, и нарушения, относящиеся к иммунному усилению или подавлению, например системную красную волчанку; желудочно-кишечные (GI) нарушения и болезни GI тракта, например нарушения, связанные с нейpональным регулированием функции внутренних органов, например неспецифический язвенный колит, гранулематозная болезнь и недержание, тошноту или рвоту, включая острую, замедленную, послеоперационную, позднефазную и преждевременную рвоту, например вызванную химиотерапией, радиацией, токсинами, беременностью, вестибулярным нарушением, укачиванием, послеоперационной болезнью, хирургической операцией, желудочно-кишечной непроходимостью, пониженной двигательной функцией желудочно-кишечного тракта, висцеральной болью, мигренью, опиоидными аналгетиками и изменениями внутричерепного давления (за исключением четвертичных солей); нарушения функции мочевого пузыря, например гиперрефлексии сжимателя мочевого пузыря; фиброзные и коллагеновые болезни, например склеродермию и эозинофильный фасциолез; нарушения кровотока, вызванные расширением кровеносных сосудов и ангиоспастическими болезнями, например, стенокардию, мигрень и болезнь Reynaud; и боли или восприятие боли, например хроническую боль или боль, свойственную или связанную с любыми вышеупомянутыми состояниями, особенно передачей боли при мигрени. Следовательно, эти соединения можно легко приспособить для терапевтического применения с целью лечения физиологических нарушений, связанных с чрезмерным стимулированием рецепторов тахикининов, особенно нейрокинина-1, и в качестве антагонистов нейрокинина-1 при регулировании и/или лечении любых вышеуказанных клинических состояний у млекопитающих, включая людей. Соединения данного изобретения ценны также при лечении комбинации указанных выше состояний, в частности при лечении сочетания послеоперационной боли и послеоперационной тошноты и рвоты. Соединения данного изобретения особенно полезны при лечении тошноты или рвоты, включая острую, замедленную, послеоперационную, позднефазную и преждевременную рвоту, например рвоту или тошноту, вызванную химиотерапией, радиацией, хирургической операцией, мигренью, токсинами, например метаболическими или микробными токсинами, вирусными или бактериальными инфекциями, беременностью, вестибулярным нарушением, укачиванием, механическим раздражением, желудочно-кишечной непроходимостью, пониженной двигательной функцией желудочно-кишечного тракта, висцеральной болью, психологическим стрессом или нарушением, большой высотой, невесомостью, опиодными аналгетиками, интоксикацией, являющейся результатом, например, потребления алкоголя, и изменениями во внутричерепном давлении. Особенно это соединение пригодно при лечении рвоты, вызванной противоопухолевыми (цитотоксичными) средствами, включая средства, обычно применяемые в химиотерапии рака. Примеры таких химиотерапевтических средств включают алкилирующие агенты, например эфиры изотиоциановой кислоты, этилениминовые соединения, алкилсульфонаты и другие соединения с алкилирующим действием, например нитрозокарбамиды, цисплатин и дакарбазин; антиметаболиты, например фолиевая кислота, пуриновые или пиримидиновые антагонисты; митотические ингибиторы, например винкаалкалоиды и производные подофиллотоксина; и цитотоксичные антибиотики. Конкретные примеры химиотерапевтических средств описываются, например, D. J. Stewart in “Nausea and Vomitting: Recent Research and Clinical Advances; Eds. J. Kucharczyk, et al., CRC Press Inc., Boca Ration, Florida, USA (1991), p. 177-203, особенно на р. 188. Обычно применяемые химиотерапевтические средства включают цисплатин, декарбазин (DTIC), дактиномицин, мехлоретамин (эфир изотиоциановой кислоты), стрептозоцин, циклофосфамид, кармустин (BCNU), ломустин (CCNU), доксорубицин (адриамицин), даунорубицин, прокарбазин, митомицин, цитарабин, этопозид, метотрексат, 5-фторурацил, винбластин, винкристин, блеомицин и хлорамбуцил [R.J. Gralla et al., Cancer Treatment Reports, 68 (1), 163-172 (1984)]. Соединения данного изобретения пригодны также при лечении рвоты, вызванной радиацией, включая радиационную терапию, например при лечении рака, или лучевую болезнь, и при лечении послеоперационной тошноты и рвоты. Соединения данного изобретения пригодны также для предупреждения или лечения нарушений деятельности центральной нервной системы, например тревоги, психоза и шизофрении; нейродегенеративных нарушений, например старческого слабоумия типа Альцгеймера, болезни Альцгеймера и синдрома Дауна; респираторных болезней, особенно болезней, связанных с избыточной секрецией слизи, например хронической обструкции дыхательных путей, бронхопневмонии, хронического бронхита, муковисцидоза и астмы, и бронхоспазм; воспалительных болезней, например воспалительного заболевания кишечника, остеоартрита и ревматического артрита; неблагоприятных иммунологических реакций, например отторжения трансплантированных тканей; желудочно-кишечных (Gl) нарушений и болезней Gl тракта, например нарушений, связанных с нейронным управлением функции внутренних органов, например неспецифического язвенного колита, болезни Крона и недержания; нарушений кровотока, вызванного расширением кровеносных сосудов; и боли или чувствительности к боли, например относящейся или связанной с любыми вышеуказанными состояниями или передачей боли при мигрени (как профилактика, так и лечение острой боли). В качестве средств, блокирующих кальциевые каналы, некоторые из соединений данного изобретения полезны для предупреждения или лечения клинических состояний, которым приносит пользу ингибирование переноса кальциевых ионов через клеточные оболочки. Они включают болезни и нарушения сердечной и сосудистой системы, например стенокардию, инфаркт миокарда, сердечную аритмию, сердечную гипертрофию, сердечный вазоспазм, гипертензию, цереброваскулярный спазм и другую ишемическую болезнь. Кроме того, эти соединения могут быть способны снижать повышенное внутриглазное давление при введении местно в гипертензивный глаз в растворе подходящего офтальмического наполнителя. Эти соединения могут быть также полезны для обратного развития резистентности ко многим лекарственным средствам в опухолевых клеткаx путем повышения эффективности химиотерапевтических средств. Кроме того, эти соединения могут обладать активностью при блокировании кальциевых каналов в мембранах мозга насекомых и поэтому могут быть полезны в качестве инсектицидов. Соединения данного изобретения особенно полезны при лечении боли и/или чувствительности к боли, и/или воспаления и нарушений, связанных с ними, такими, как, например, невропатия, например диабетическая или периферическая невропатия и вызванная химиотерапией невропатия; послегерпетическая и другие невралгии; астма; остеоартрит; ревматический артрит и особенно мигрень. Соединения данного изобретения полезны также, в частности, при лечении болезней, характеризующихся нейрогенной секрецией слизи, в частности муковисцидоза. Для лечения некоторых состояний может быть желательно применение соединения данного изобретения в сочетании с другим фармакологически активным средством. Например, соединение данного изобретения может присутствовать вместе с другим терапевтическим средством как комбинированный препарат для одновременного, раздельного или последовательного применения для ослабления рвоты. Такие комбинированные препараты могут быть, например, в форме упаковки, состоящей из двух частей. Предпочтительная комбинация содержит соединение данного изобретения с химиотерапевтическим средством, например алкилирующим агентом, антиметаболитом, митотическим ингибитором или цитотоксическим ингибитором, описанным выше. Обычно для применения в таких комбинациях должны быть пригодны доступные в настоящее время лекарственные формы известных терапевтических средств. Аналогично этому для лечения респираторных болезней, например астмы, соединение данного изобретения может быть полезным в сочетании с бронхорасширяющим средством, например агонистом  2– адренергического рецептора или антагонистом тахикинина, который действует в качестве рецепторов нейрокинина-2. Подходящие агонисты 2– адренергического рецептора или антагонистом тахикинина, который действует в качестве рецепторов нейрокинина-2. Подходящие агонисты  2-адренергических рецепторов включают Бамбутерол (US 4138581 issued to Draco on 12/6/83); Битолтерол мезилат (US 4138581 issued to Sterling 2/6/79); Брозатерол (US 4276299 issued to Zambon 6/30/81 and US 4520200 issued to Zambon 5/28/85), Карбутерол (US 3763232 issued to Smith Kline 10/2/73); Кленбутерол (US 3536712 issued to Boehringer Ingelheim 10/27/70); Циматерол (US 4407819 issued to American Cyanamid 10/4/83); Докарпамин (US 4228183 issued to Tanabe 10/14/80); Допексамин (US 4645768 issued to Fisons 2/24/87); Формотерол (US 3994974 issued to Jamanouchi 11/30/76); Мабутерол (US 4119710 issued to Boehringer Inhelheim 10/10/78); Пирбутерол гидрохлорид (US 3700681 issued to Pfiser 10/24/72); Прокатерол гидрохлорид (US 4026897 issued to Oysuka 5/31/77); Ритодрин гидрохлорид (US 3410944 issued to North American Philips 11/12/68) или Салметерол (US 4992474 issued to Glaxo 2/21/91 and US 5091422 issued to Glaxo 2/25/92).
Кроме того, для лечения состояний, которые требуют антагонизма как для нейрокинина-1, так и нейрокинина-2, включая нарушения, связанные с бронхостенозом и/или экстравазацией плазмы в дыхательных путях, например астмы, хронического бронхита, болезни дыхательных путей или муковисцидоза; невропатию, например диабетическую или периферическую невропатию и вызванную химиотерапией невропатию; остеоартрит; ревматический артрит и мигрень, соединение данного изобретения можно применять в сочетании с антагонистом тахикинина, который действует у рецепторов нейрокинина-2, или с антагонистом рецептора тахикинина, который действует как у рецепторов нейрокинина-1, так и нейрокинина-2.
Подобным образом соединение данного изобретения можно применять с антагонистом лейкотриенов, например антагонистом лейкотриена D4, примеры этих антагонистов описываются в патентной публикации ЕП 0480717, опубликованной 15 апреля 1992; патентной публикации ЕП 0604114; опубликованной в июне 1994; патенте США N 5279324, выданном 14 декабря 1993 и патенте США N 4859692, выданном 22 августа 1989. Эта комбинация, в частности, полезна при лечении респираторных болезней, например астмы, хронического бронхита и кашля.
Соединение данного изобретения можно, кроме того, применять в комбинации с кортикостероидом, например дексаметазоном, кеналогом, аристокортом, назалидом, преферидом, бенекортеном или другими, например описанными в патентах США N 2789118, 2990401, 3048581, 3126375, 3929768, 3996359, 3928326 и 3749712.
Аналогично этому для предупреждения или лечения рвоты соединение данного изобретения можно применять в комбинации с другими противорвотными средствами, в частности антагонистами 5HT3-рецепторов (5HT = 5-гидрокситриптамину), например ондансетроном, гранисетроном, тропистероном, декадроном и затисетроном, или агонистами GABA8-рецептором (GABA обозначает гамма-аминомасляную кислоту), например баклофеном. Таким же образом для предупреждения или лечения мигрени соединение данного изобретения можно применять в сочетании с другими средствами против мигрени, например эрготаминами или 5HT1-агонистами, конкретно суматриптаном.
Подобным образом для лечения поведенческой гипералгезии соединение данного изобретения можно применять в комбинации с антагонистом N-метил-D-аспартата (NMDA), например дизоциплином. Для предупреждения или лечения воспалительных состояний в нижней части мочевых путей, особенно цистита, соединение данного изобретения можно применять в комбинации с противовоспалительным средством, например антагонистом рецептора брадикинина. Соединение данного изобретения и другое фармакологически активное средство можно вводить пациенту одновременно, последовательно или в комбинации.
При лечении указанных выше клинических состояний соединения данного изобретения можно применять в композициях, например таблетках, капсулах или эликсирах для перорального введения, суппозиториях для ректального введения, стерильных растворах или суспензиях для парентерального или внутримышечного введения и т.д.
Фармацевтические композиции данного изобретения можно применять в форме фармацевтического препарата, например в твердой, полутвердой или жидкой форме, которая содержит одно или несколько соединений настоящего изобретения в качестве активного ингредиента в смеси с органическим или неорганическим носителем или наполнителем, пригодным для наружного, внутреннего или парентерального применения. Активный ингредиент можно смешивать, например, с обычными нетоксичными фармацевтически приемлемыми носителями для получения таблеток, шариков, капсул, суппозиториев, растворов, эмульсий, суспензий и любой другой формы, пригодной для применения. Носителями, которые можно применять, являются глюкоза, лактоза, аравийская камедь, желатин, маннит, крахмальный клейстер, трисиликат магния, тальк, кукурузный крахмал, кератин, коллоидальный диоксид кремния, картофельный крахмал, карбамид и другие носители, пригодные для применения при изготовлении препаратов в твердой, полутвердой или жидкой форме, и, кроме того, можно применять вспомогательные, стабилизирующие, загущающие и красящие средства и отдушки. Активное целевое соединение включают в фармацевтический препарат в количестве, достаточном для создания желаемого эффекта в процессе или состоянии болезни.
Для получения твердых препаратов, например таблеток, основной активный ингредиент смешивают c фармацевтически приемлемым носителем, например обычными таблетирующими ингредиентами, такими как крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, фосфат дикальция или камеди, и другими фармацевтическими разбавителями, например водой, для образования композиции в виде твердой предварительной готовой препаративной формы, содержащей гомогенную смесь соединения данного изобретения или его нетоксичной фармацевтически приемлемой соли. Когда эти композиции в виде предварительной готовой препаративной формы указываются как гомогенные, это означает, что активный ингредиент диспергирован равномерно по всей композиции, так что композицию можно легко разделить на равно эффективные унифицированные лекарственные формы, например таблетки, шарики и капсулы. Эту композицию в виде твердой предварительной готовой препаративной формы затем делят на унифицированные лекарственные формы описанного выше типа, содержащие от 0,1 до около 500 мг активного ингредиента данного изобретения. Таблетки или шарики новой композиции можно покрыть оболочкой или обработать иным образом, чтобы получить лекарственную форму, преимущество которой в пролонгированном действии. Например, таблетка или шарик может содержать внутренний дозированный и наружный дозированный компонент, причем последний находится в форме оболочки на первом. Два компонента могут быть разделены энтеросолюбильным слоем, который служит препятствием дезинтеграции внутреннего компонента в желудке и позволяет внутреннему компоненту проходить неповрежденному в двенадцатиперстную кишку или высвобождаться замедленно. Для таких энтеросолюбильных слоев или оболочек можно применять различные материалы, например материалы, включающие ряд полимерных кислот и смеси полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетата целлюлозы.
Жидкие формы, в которые можно ввести новые композиции данного изобретения для перорального или инъекционного введения, включают водный раствор, пригодным образом отдушенные сиропы, водные или масляные суспензии и отдушенные эмульсии с пищевыми маслами, например хлопковым маслом, кунжутным маслом, кокосовым маслом или арахисовым маслом, эликсиры и подобные фармацевтические наполнители. Пригодные диспергирующие или суспендирующие агенты для водных суспензий включают синтетические и природные камеди, например трагакант, аравийскую камедь, альгинат, декстран, натриевую соль карбоксиметилцеллюлозы, метилцеллюлозу, поливинилпирролидон или желатин.
Диспергируемые порошки и гранулы, пригодные для получения водной суспензии добавлением воды, обеспечивают активный ингредиент в смеси с диспергатором или смачивающим веществом, суспендирующим агентом и одним или несколькими консервантами. Примеры пригодных диспергаторов или смачивающих веществ и суспендирующих агентов уже указывались выше. Могут также присутствовать дополнительные наполнители, например подслащивающие вещества, отдушки и окрашивающие вещества.
Композиции для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смесях и порошки. Жидкие или твердые композиции могут содержать пригодные фармацевтически приемлемые наполнители, указанные выше. Композиции предпочтительно вводят пероральным или назальным респираторным способом для достижения локального или системного действия. Композиции в предпочтительно стерильных фармацевтически приемлемых растворителях можно распылять при помощи инертных газов. Распыленные растворы можно вдыхать непосредственно из распыляющего устройства или распыляющее устройство можно присоединить к маске для лица, тенту или машине для вдыхания под перемежающимся положительным давлением. Композиции в виде растворов, суспензий или порошков можно вводить, что предпочтительно, перорально или назально из устройств, которые доставляют готовую препаративную форму подходящим образом.
Для лечения указанных выше клинических состояний и болезней соединения данного изобретения можно вводить перорально, местно, парентерально, ингаляционным распылением или ректально в виде унифицированных готовых препаративных форм, содержащих обычные нетоксичные фармацевтически приемлемые носители, вспомогательные ингредиенты и наполнители. Термин “парентеральный” как использован здесь включает способы подкожных инъекций, внутривенной, внутримышечной, внутригрудинной инъекции или инфузии.
Соединения этого изобретения можно вводить пациентам (животным и человеку), нуждающимся в таком лечении, в дозах, которые будут обеспечивать оптимальную фармацевтическую эффективность. Дозы будут изменяться от пациента к пациенту в зависимости от природы и тяжести болезни, массы пациента, специальных диет, которые затем применяются пациентом, одновременно проводимой лекарственной терапии и других факторов, которые будут признаны специалистами данной области.
При лечении состояния, связанного с избытком тахикининов, подходящий уровень доз обычно будет от около 0,001 до около 50 мг на 1 кг массы тела пациента в день, причем это количество можно ввести в виде одной дозы или нескольких доз. Предпочтительно уровень доз будет от около 0,01 до около 25 мг/кг в день; более предпочтительно от около 0,05 до около 10 мг в день. Например, при лечении состояний, включающих нейропередачу болевого восприятия, пригодный уровень доз составляет от около 0,001 до 25 мг/кг в день, предпочтительно от около 0,05 до около 10 мг/кг в день, и конкретно от около 0,1 до около 5 мг/кг в день. Соединение можно вводить по схеме 1-4 раза в день, предпочтительно один или два раза в день. При лечении рвоты с применением инъецируемой готовой препаративной формы пригодный уровень доз составляет около 0,001-10 мг/кг в день, предпочтительно около 0,005-5 мг/кг в день и в особенности около 0,05-5 мг/кг в день. Соединение можно вводить по схеме 1-4 раза в день, предпочтительно один или два раза в день.
В схемах 1-15 (в конце описания) и примерах приводится несколько способов получения соединений этого изобретения, где R2, R3, R6, R7, R8, R11, R12, R13, A, B, p, Y и Z имеют указанные выше значения.
Аббревиатуры, применяемые в схемах и примерах 2-адренергических рецепторов включают Бамбутерол (US 4138581 issued to Draco on 12/6/83); Битолтерол мезилат (US 4138581 issued to Sterling 2/6/79); Брозатерол (US 4276299 issued to Zambon 6/30/81 and US 4520200 issued to Zambon 5/28/85), Карбутерол (US 3763232 issued to Smith Kline 10/2/73); Кленбутерол (US 3536712 issued to Boehringer Ingelheim 10/27/70); Циматерол (US 4407819 issued to American Cyanamid 10/4/83); Докарпамин (US 4228183 issued to Tanabe 10/14/80); Допексамин (US 4645768 issued to Fisons 2/24/87); Формотерол (US 3994974 issued to Jamanouchi 11/30/76); Мабутерол (US 4119710 issued to Boehringer Inhelheim 10/10/78); Пирбутерол гидрохлорид (US 3700681 issued to Pfiser 10/24/72); Прокатерол гидрохлорид (US 4026897 issued to Oysuka 5/31/77); Ритодрин гидрохлорид (US 3410944 issued to North American Philips 11/12/68) или Салметерол (US 4992474 issued to Glaxo 2/21/91 and US 5091422 issued to Glaxo 2/25/92).
Кроме того, для лечения состояний, которые требуют антагонизма как для нейрокинина-1, так и нейрокинина-2, включая нарушения, связанные с бронхостенозом и/или экстравазацией плазмы в дыхательных путях, например астмы, хронического бронхита, болезни дыхательных путей или муковисцидоза; невропатию, например диабетическую или периферическую невропатию и вызванную химиотерапией невропатию; остеоартрит; ревматический артрит и мигрень, соединение данного изобретения можно применять в сочетании с антагонистом тахикинина, который действует у рецепторов нейрокинина-2, или с антагонистом рецептора тахикинина, который действует как у рецепторов нейрокинина-1, так и нейрокинина-2.
Подобным образом соединение данного изобретения можно применять с антагонистом лейкотриенов, например антагонистом лейкотриена D4, примеры этих антагонистов описываются в патентной публикации ЕП 0480717, опубликованной 15 апреля 1992; патентной публикации ЕП 0604114; опубликованной в июне 1994; патенте США N 5279324, выданном 14 декабря 1993 и патенте США N 4859692, выданном 22 августа 1989. Эта комбинация, в частности, полезна при лечении респираторных болезней, например астмы, хронического бронхита и кашля.
Соединение данного изобретения можно, кроме того, применять в комбинации с кортикостероидом, например дексаметазоном, кеналогом, аристокортом, назалидом, преферидом, бенекортеном или другими, например описанными в патентах США N 2789118, 2990401, 3048581, 3126375, 3929768, 3996359, 3928326 и 3749712.
Аналогично этому для предупреждения или лечения рвоты соединение данного изобретения можно применять в комбинации с другими противорвотными средствами, в частности антагонистами 5HT3-рецепторов (5HT = 5-гидрокситриптамину), например ондансетроном, гранисетроном, тропистероном, декадроном и затисетроном, или агонистами GABA8-рецептором (GABA обозначает гамма-аминомасляную кислоту), например баклофеном. Таким же образом для предупреждения или лечения мигрени соединение данного изобретения можно применять в сочетании с другими средствами против мигрени, например эрготаминами или 5HT1-агонистами, конкретно суматриптаном.
Подобным образом для лечения поведенческой гипералгезии соединение данного изобретения можно применять в комбинации с антагонистом N-метил-D-аспартата (NMDA), например дизоциплином. Для предупреждения или лечения воспалительных состояний в нижней части мочевых путей, особенно цистита, соединение данного изобретения можно применять в комбинации с противовоспалительным средством, например антагонистом рецептора брадикинина. Соединение данного изобретения и другое фармакологически активное средство можно вводить пациенту одновременно, последовательно или в комбинации.
При лечении указанных выше клинических состояний соединения данного изобретения можно применять в композициях, например таблетках, капсулах или эликсирах для перорального введения, суппозиториях для ректального введения, стерильных растворах или суспензиях для парентерального или внутримышечного введения и т.д.
Фармацевтические композиции данного изобретения можно применять в форме фармацевтического препарата, например в твердой, полутвердой или жидкой форме, которая содержит одно или несколько соединений настоящего изобретения в качестве активного ингредиента в смеси с органическим или неорганическим носителем или наполнителем, пригодным для наружного, внутреннего или парентерального применения. Активный ингредиент можно смешивать, например, с обычными нетоксичными фармацевтически приемлемыми носителями для получения таблеток, шариков, капсул, суппозиториев, растворов, эмульсий, суспензий и любой другой формы, пригодной для применения. Носителями, которые можно применять, являются глюкоза, лактоза, аравийская камедь, желатин, маннит, крахмальный клейстер, трисиликат магния, тальк, кукурузный крахмал, кератин, коллоидальный диоксид кремния, картофельный крахмал, карбамид и другие носители, пригодные для применения при изготовлении препаратов в твердой, полутвердой или жидкой форме, и, кроме того, можно применять вспомогательные, стабилизирующие, загущающие и красящие средства и отдушки. Активное целевое соединение включают в фармацевтический препарат в количестве, достаточном для создания желаемого эффекта в процессе или состоянии болезни.
Для получения твердых препаратов, например таблеток, основной активный ингредиент смешивают c фармацевтически приемлемым носителем, например обычными таблетирующими ингредиентами, такими как крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, фосфат дикальция или камеди, и другими фармацевтическими разбавителями, например водой, для образования композиции в виде твердой предварительной готовой препаративной формы, содержащей гомогенную смесь соединения данного изобретения или его нетоксичной фармацевтически приемлемой соли. Когда эти композиции в виде предварительной готовой препаративной формы указываются как гомогенные, это означает, что активный ингредиент диспергирован равномерно по всей композиции, так что композицию можно легко разделить на равно эффективные унифицированные лекарственные формы, например таблетки, шарики и капсулы. Эту композицию в виде твердой предварительной готовой препаративной формы затем делят на унифицированные лекарственные формы описанного выше типа, содержащие от 0,1 до около 500 мг активного ингредиента данного изобретения. Таблетки или шарики новой композиции можно покрыть оболочкой или обработать иным образом, чтобы получить лекарственную форму, преимущество которой в пролонгированном действии. Например, таблетка или шарик может содержать внутренний дозированный и наружный дозированный компонент, причем последний находится в форме оболочки на первом. Два компонента могут быть разделены энтеросолюбильным слоем, который служит препятствием дезинтеграции внутреннего компонента в желудке и позволяет внутреннему компоненту проходить неповрежденному в двенадцатиперстную кишку или высвобождаться замедленно. Для таких энтеросолюбильных слоев или оболочек можно применять различные материалы, например материалы, включающие ряд полимерных кислот и смеси полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетата целлюлозы.
Жидкие формы, в которые можно ввести новые композиции данного изобретения для перорального или инъекционного введения, включают водный раствор, пригодным образом отдушенные сиропы, водные или масляные суспензии и отдушенные эмульсии с пищевыми маслами, например хлопковым маслом, кунжутным маслом, кокосовым маслом или арахисовым маслом, эликсиры и подобные фармацевтические наполнители. Пригодные диспергирующие или суспендирующие агенты для водных суспензий включают синтетические и природные камеди, например трагакант, аравийскую камедь, альгинат, декстран, натриевую соль карбоксиметилцеллюлозы, метилцеллюлозу, поливинилпирролидон или желатин.
Диспергируемые порошки и гранулы, пригодные для получения водной суспензии добавлением воды, обеспечивают активный ингредиент в смеси с диспергатором или смачивающим веществом, суспендирующим агентом и одним или несколькими консервантами. Примеры пригодных диспергаторов или смачивающих веществ и суспендирующих агентов уже указывались выше. Могут также присутствовать дополнительные наполнители, например подслащивающие вещества, отдушки и окрашивающие вещества.
Композиции для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смесях и порошки. Жидкие или твердые композиции могут содержать пригодные фармацевтически приемлемые наполнители, указанные выше. Композиции предпочтительно вводят пероральным или назальным респираторным способом для достижения локального или системного действия. Композиции в предпочтительно стерильных фармацевтически приемлемых растворителях можно распылять при помощи инертных газов. Распыленные растворы можно вдыхать непосредственно из распыляющего устройства или распыляющее устройство можно присоединить к маске для лица, тенту или машине для вдыхания под перемежающимся положительным давлением. Композиции в виде растворов, суспензий или порошков можно вводить, что предпочтительно, перорально или назально из устройств, которые доставляют готовую препаративную форму подходящим образом.
Для лечения указанных выше клинических состояний и болезней соединения данного изобретения можно вводить перорально, местно, парентерально, ингаляционным распылением или ректально в виде унифицированных готовых препаративных форм, содержащих обычные нетоксичные фармацевтически приемлемые носители, вспомогательные ингредиенты и наполнители. Термин “парентеральный” как использован здесь включает способы подкожных инъекций, внутривенной, внутримышечной, внутригрудинной инъекции или инфузии.
Соединения этого изобретения можно вводить пациентам (животным и человеку), нуждающимся в таком лечении, в дозах, которые будут обеспечивать оптимальную фармацевтическую эффективность. Дозы будут изменяться от пациента к пациенту в зависимости от природы и тяжести болезни, массы пациента, специальных диет, которые затем применяются пациентом, одновременно проводимой лекарственной терапии и других факторов, которые будут признаны специалистами данной области.
При лечении состояния, связанного с избытком тахикининов, подходящий уровень доз обычно будет от около 0,001 до около 50 мг на 1 кг массы тела пациента в день, причем это количество можно ввести в виде одной дозы или нескольких доз. Предпочтительно уровень доз будет от около 0,01 до около 25 мг/кг в день; более предпочтительно от около 0,05 до около 10 мг в день. Например, при лечении состояний, включающих нейропередачу болевого восприятия, пригодный уровень доз составляет от около 0,001 до 25 мг/кг в день, предпочтительно от около 0,05 до около 10 мг/кг в день, и конкретно от около 0,1 до около 5 мг/кг в день. Соединение можно вводить по схеме 1-4 раза в день, предпочтительно один или два раза в день. При лечении рвоты с применением инъецируемой готовой препаративной формы пригодный уровень доз составляет около 0,001-10 мг/кг в день, предпочтительно около 0,005-5 мг/кг в день и в особенности около 0,05-5 мг/кг в день. Соединение можно вводить по схеме 1-4 раза в день, предпочтительно один или два раза в день.
В схемах 1-15 (в конце описания) и примерах приводится несколько способов получения соединений этого изобретения, где R2, R3, R6, R7, R8, R11, R12, R13, A, B, p, Y и Z имеют указанные выше значения.
Аббревиатуры, применяемые в схемах и примерахРеагенты: Et3 – N триэтиламин Ph3P – трифенилфосфин ТФУ – трифторуксусная кислота NaOEt – этоксид натрия ДЦК – N,N’-дициклогексилкарбодиимид ДЦК – N,N’-дициклогексилкарбамид КДН – 1,1′-карбонилдиимидазол МХПБК – м-хлорпербензойная кислота ДАУ – 1,8-диазабицикло[5,4,0]ундец-7-ен БХФ – бензилхлорформиат ХЭХФ – альфа-хлорэтилхлорформиат ДИЭА – N,N-диизопропилэтиламин NГС – N-гидроксисукцинимид ДИБАГ – диизобутилалюминийгидрид ДМС – диметилсульфат ГБТ – гидрат 1-гидроксибензотриазола ЭДАК – гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида Растворители: ДМФ – диметилформамид ТГФ – тетрагидрофуран MeOH – метанол EtOH – этанол AmOH – н-амиловый спирт AcOH – уксусная кислота MeCN – ацетонитрил ДМСО – диметилсульфоксид Другие: Ph – фенил Ar – арил Me – метил Et – этил iPr – изопропил Am – н-амил Cbz – карбобензилокси (бензилоксикарбонил) BOC – трет-бутоксикарбонил МФК – межфазный катализатор кат. – катализатор FAB-MS – масс-спектрометрия с бомбардировкой ускоренными атомами к.т. – комнатная температура УГ – уходящая группа (Cl, Br, I, OTs, OMs, OTf и т.д.). Соединения данного изобретения, у которых Y = О, можно получить общим путем, приведенным на схеме 1. Так, например, диметилацеталь соответственно замещенного  -бромфенилацетальдегида (получен способом Jacobs in Journal of Umerican Chemical Society, 1953, 75, 5500) можно превратить в дибензилацеталь II перемешиванием I и избытка бензилового спирта в присутствии кислотного катализатора при удалении образуемого метанола. Алкилированием замещенного аминоспирта бензилбромидом II можно получить N-алкиламиноспирт III; применение хирального аминоспирта приведет к образованию диастереомеров, их можно разделить на этой (или более поздней) стадии, применяя стандартные хроматографические способы. N-Алкилированием или N-ацилированием можно получить диалкил- или ацил/алкиламиноспирт IV, у которого группа А-В может служить защитной группой или ее можно применять в качестве заместителя в конечном целевом соединении или можно превратить в такой заместитель. Циклизацию для получения замещенного морфолина V можно осуществлять нагреванием раствора IV и кислотного катализатора. Диастереомеры V, которые могут образоваться, можно разделить при помощи стандартных хроматографических способов. Если А-В является защитной группой, ее можно удалить известными способами (Greene T. W., Wuts P.G.M. Protective Groups in Organic Synthesis, 2nd ed., John Wiley and Sons, Inc., N.Y. 1991). Если получение I-V приводит к образованию энантиомеров, их можно разделить алкилированием или ацилированием V (А-В= Н) хиральным вспомогательным агентом, разделением таким образом полученных диастереомеров известными хроматографическими способами и удалением хиральной вспомогательной группы для получения энантиомеров V. Альтернативно диастереомеры V можно разделить путем фракционной кристаллизации из подходящего растворителя диастереомерных солей, образованных V и хиральной органической кислотой.
Соединения данного изобретения, у которых Y = CH2, можно получить общим путем, приведенным на схеме 2. так, например, N-метокси-N-метиламид защищенного фенилглицина VI (получен из карбоновой кислоты через смешанный ангидрид в соответствии с методикой Rapoport in Journal of Organic Chemistry, 1985, 50, 2972) можно применять для ацилирования энолята лития метилдиэтилфосфоната для получения кетофосфоната VII. Натриевую соль VII можно конденсировать с соответственно замещенным бензальдегидом для получения -бромфенилацетальдегида (получен способом Jacobs in Journal of Umerican Chemical Society, 1953, 75, 5500) можно превратить в дибензилацеталь II перемешиванием I и избытка бензилового спирта в присутствии кислотного катализатора при удалении образуемого метанола. Алкилированием замещенного аминоспирта бензилбромидом II можно получить N-алкиламиноспирт III; применение хирального аминоспирта приведет к образованию диастереомеров, их можно разделить на этой (или более поздней) стадии, применяя стандартные хроматографические способы. N-Алкилированием или N-ацилированием можно получить диалкил- или ацил/алкиламиноспирт IV, у которого группа А-В может служить защитной группой или ее можно применять в качестве заместителя в конечном целевом соединении или можно превратить в такой заместитель. Циклизацию для получения замещенного морфолина V можно осуществлять нагреванием раствора IV и кислотного катализатора. Диастереомеры V, которые могут образоваться, можно разделить при помощи стандартных хроматографических способов. Если А-В является защитной группой, ее можно удалить известными способами (Greene T. W., Wuts P.G.M. Protective Groups in Organic Synthesis, 2nd ed., John Wiley and Sons, Inc., N.Y. 1991). Если получение I-V приводит к образованию энантиомеров, их можно разделить алкилированием или ацилированием V (А-В= Н) хиральным вспомогательным агентом, разделением таким образом полученных диастереомеров известными хроматографическими способами и удалением хиральной вспомогательной группы для получения энантиомеров V. Альтернативно диастереомеры V можно разделить путем фракционной кристаллизации из подходящего растворителя диастереомерных солей, образованных V и хиральной органической кислотой.
Соединения данного изобретения, у которых Y = CH2, можно получить общим путем, приведенным на схеме 2. так, например, N-метокси-N-метиламид защищенного фенилглицина VI (получен из карбоновой кислоты через смешанный ангидрид в соответствии с методикой Rapoport in Journal of Organic Chemistry, 1985, 50, 2972) можно применять для ацилирования энолята лития метилдиэтилфосфоната для получения кетофосфоната VII. Натриевую соль VII можно конденсировать с соответственно замещенным бензальдегидом для получения  , , -ненасыщенного кетона VIII. Восстановлением кетона и удалением трет-бутилкарбаматной защитной группы можно получить аминоспирт IX; диастереомеры, которые могут образоваться, можно разделить на этой (или более поздней) стадии стандартными хроматографическими способами. Превращение IX в простой эфир по Williamson с применением замещенного хлорацетата и последующее нагревание может привести к образованию морфолинона X. Восстановление двойной связи и карбонила амидной группы можно проводить прямым способом, чтобы получить замещенный морфолин XI. Если получение VI-XI приводит к образованию энантиомеров, их можно разделить алкилированием или ацилированием XI (A-В = Н) хиральным вспомогательным агентом, разделением таким образом полученных диастереомеров известными хроматографическими способами и удалением хиральной вспомогательной группы для получения энантиомеров XI. Альтернативно диастереомеры XI можно разделить фракционной кристаллизацией из подходящего растворителя диастереомерных солей, образованных из XI и хиральной органической кислоты. Если желательно, чтобы A-B не был H, атом азота морфолина XI можно далее функционализировать стандартными способами алкилирования или ацилирования вторичных аминов. Если желательно, чтобы R2 не был H, морфолинон X можно превратить в карбинолкарбонат (A-B = RO2C, R2 = ОН), полупродукт, который можно алкилировать и который будет допускать изменения в R2.
Соединения данного изобретения, у которых Y = O, можно также получить общим путем, приведенным на схеме 3. Так, например, диметилацеталь соответственно замещенного -ненасыщенного кетона VIII. Восстановлением кетона и удалением трет-бутилкарбаматной защитной группы можно получить аминоспирт IX; диастереомеры, которые могут образоваться, можно разделить на этой (или более поздней) стадии стандартными хроматографическими способами. Превращение IX в простой эфир по Williamson с применением замещенного хлорацетата и последующее нагревание может привести к образованию морфолинона X. Восстановление двойной связи и карбонила амидной группы можно проводить прямым способом, чтобы получить замещенный морфолин XI. Если получение VI-XI приводит к образованию энантиомеров, их можно разделить алкилированием или ацилированием XI (A-В = Н) хиральным вспомогательным агентом, разделением таким образом полученных диастереомеров известными хроматографическими способами и удалением хиральной вспомогательной группы для получения энантиомеров XI. Альтернативно диастереомеры XI можно разделить фракционной кристаллизацией из подходящего растворителя диастереомерных солей, образованных из XI и хиральной органической кислоты. Если желательно, чтобы A-B не был H, атом азота морфолина XI можно далее функционализировать стандартными способами алкилирования или ацилирования вторичных аминов. Если желательно, чтобы R2 не был H, морфолинон X можно превратить в карбинолкарбонат (A-B = RO2C, R2 = ОН), полупродукт, который можно алкилировать и который будет допускать изменения в R2.
Соединения данного изобретения, у которых Y = O, можно также получить общим путем, приведенным на схеме 3. Так, например, диметилацеталь соответственно замещенного  -бромацетальдегида (получен способом Jacobs in Journal of American Chemical Soc., 1953, 75, 5500) можно превратить в другой ацеталь перемешиванием с небольшим избытком соответствующего спирта в присутствии кислотного катализатора при удалении образуемого метанола. Алкилированием замещенного аминоспирта бромидом можно получить N-алкиламиноспирт; применение хирального аминоспирта приведет к образованию диастереомеров, которые можно разделить на этой (или более поздней) стадии стандартными хроматографическими способами. N-Алкилированием или N-ацилированием можно получить диалкил- или ацил/алкиламиноспирт, у которого группа А-В может служить защитной группой или ее можно применять в качестве заместителя в конечном целевом соединении или можно превратить в такой заместитель. Циклизацию для получения замещенного морфолина можно осуществлять нагреванием раствора с кислотным катализатором. Диастереомеры, которые могут образоваться, можно разделить стандартными хроматографическими способами. Если A-B является защитной группой, ее можно удалить известными способами (Greene T.W., Wuts P. G. M. Protective Groups in Organic Synthesis, 2nd ed., John Wiley & Sons, Inc. , N. Y. 1991). Если получение таких соединений приводит к образованию энантиомеров, их можно разделить алкилированием или ацилированием конечного продукта (A-B = H) хиральным вспомогательным агентом, разделением таким образом полученных диастереомеров известными хроматографическими способами и удалением хиральной вспомогательной группы для получения целевых энантиомеров. Альтернативно диастереомеры можно разделить путем фракционной кристаллизации из подходящего растворителя диастереомерных солей, образованных данным соединением и хиральной органической кислотой.
Один способ синтеза энантиомерно чистых замещенных морфолинов приводится на схеме 4. Защитой энантиомерно чистого фенилглицина как N-бензилпроизводного с последующим двойным алкилированием производным 1,2-дибромэтана получают морфолинон. Восстановление активным гидридным реагентом, например диизобутилалюминийгидридом, алюмогидридом лития, три(втор-бутил)борогидридом лития (L-Selectride -бромацетальдегида (получен способом Jacobs in Journal of American Chemical Soc., 1953, 75, 5500) можно превратить в другой ацеталь перемешиванием с небольшим избытком соответствующего спирта в присутствии кислотного катализатора при удалении образуемого метанола. Алкилированием замещенного аминоспирта бромидом можно получить N-алкиламиноспирт; применение хирального аминоспирта приведет к образованию диастереомеров, которые можно разделить на этой (или более поздней) стадии стандартными хроматографическими способами. N-Алкилированием или N-ацилированием можно получить диалкил- или ацил/алкиламиноспирт, у которого группа А-В может служить защитной группой или ее можно применять в качестве заместителя в конечном целевом соединении или можно превратить в такой заместитель. Циклизацию для получения замещенного морфолина можно осуществлять нагреванием раствора с кислотным катализатором. Диастереомеры, которые могут образоваться, можно разделить стандартными хроматографическими способами. Если A-B является защитной группой, ее можно удалить известными способами (Greene T.W., Wuts P. G. M. Protective Groups in Organic Synthesis, 2nd ed., John Wiley & Sons, Inc. , N. Y. 1991). Если получение таких соединений приводит к образованию энантиомеров, их можно разделить алкилированием или ацилированием конечного продукта (A-B = H) хиральным вспомогательным агентом, разделением таким образом полученных диастереомеров известными хроматографическими способами и удалением хиральной вспомогательной группы для получения целевых энантиомеров. Альтернативно диастереомеры можно разделить путем фракционной кристаллизации из подходящего растворителя диастереомерных солей, образованных данным соединением и хиральной органической кислотой.
Один способ синтеза энантиомерно чистых замещенных морфолинов приводится на схеме 4. Защитой энантиомерно чистого фенилглицина как N-бензилпроизводного с последующим двойным алкилированием производным 1,2-дибромэтана получают морфолинон. Восстановление активным гидридным реагентом, например диизобутилалюминийгидридом, алюмогидридом лития, три(втор-бутил)борогидридом лития (L-Selectride ) или другими восстановителями ведет к образованию преимущественно производных 2,3-транс-морфолина. Алкилированием спирта, удалением защитной группы у атома азота (например, с применением палладиевого катализатора гидрогенизации или 1-хлорэтилхлорформиата (Olofson in J. Org. Chem. , 1984, 2081 и 2795) и алкилированием атома азота (где в A-B-CH2– или A-B-CHO присутствуют A-B, имеющие подходящие значения) получают 2,3-транссоединения.
Один способ получения энантиомерно чистых 2,3-цис-морфолинов приводится на схеме 5. В первой стадии образование трифторметансульфонатного эфира подходящего бензилового спирта (конкретно бензиловых спиртов, которые замещены электронно-акцепторными группами, например -NO2, -F, -Cl, -Br, -COR, CF3 и т. д.) проводят в присутствии нереакционноспособного основания в инертном растворителе. Можно также применять другие уходящие группы, например иодидную, мезилатную, тозилатную, п-нитрофенилсульфонатную и подобные группы. Пригодные основания включают 2,6-ди-трет-бутилпиридин, 2,6-ди-трет-бутил-4-метилпиридин, диизопропилэтиламин, карбонат калия, карбонат натрия и подобные основания. Пригодные растворители включают толуол, гексаны, бензол, четыреххлористый углерод, дихлорметан, хлороформ, дихлорэтан и т.д. и их смеси. Фильтрованный раствор трифлата затем добавляют в раствор промежуточного продукта, образованного при контактировании морфолинона с активным гидридным реагентом, например диизобутилалюминийгидридом, алюмогидридом лития или три(втор- бутил)борогидридом лития (L-Selectride ) или другими восстановителями ведет к образованию преимущественно производных 2,3-транс-морфолина. Алкилированием спирта, удалением защитной группы у атома азота (например, с применением палладиевого катализатора гидрогенизации или 1-хлорэтилхлорформиата (Olofson in J. Org. Chem. , 1984, 2081 и 2795) и алкилированием атома азота (где в A-B-CH2– или A-B-CHO присутствуют A-B, имеющие подходящие значения) получают 2,3-транссоединения.
Один способ получения энантиомерно чистых 2,3-цис-морфолинов приводится на схеме 5. В первой стадии образование трифторметансульфонатного эфира подходящего бензилового спирта (конкретно бензиловых спиртов, которые замещены электронно-акцепторными группами, например -NO2, -F, -Cl, -Br, -COR, CF3 и т. д.) проводят в присутствии нереакционноспособного основания в инертном растворителе. Можно также применять другие уходящие группы, например иодидную, мезилатную, тозилатную, п-нитрофенилсульфонатную и подобные группы. Пригодные основания включают 2,6-ди-трет-бутилпиридин, 2,6-ди-трет-бутил-4-метилпиридин, диизопропилэтиламин, карбонат калия, карбонат натрия и подобные основания. Пригодные растворители включают толуол, гексаны, бензол, четыреххлористый углерод, дихлорметан, хлороформ, дихлорэтан и т.д. и их смеси. Фильтрованный раствор трифлата затем добавляют в раствор промежуточного продукта, образованного при контактировании морфолинона с активным гидридным реагентом, например диизобутилалюминийгидридом, алюмогидридом лития или три(втор- бутил)борогидридом лития (L-Selectride ) при низкой температуре, предпочтительно от -78 до -20oC. После нескольких часов выдерживания смеси при низкой температуре, обработки и очистки получают в преобладающем количестве 2,3-цис-замещенные продукты, которые можно превратить в конечные соединения, как показано на схеме 5.
Энантиомерно чистые фенилглицины, замещенные в фенильном ядре, можно получить способом, показанным на схеме 6 (D.A. Evans, et al., J. Am. Chem. Soc., 1990, 112, 4011).
Способы получения азотистых алкилирующих агентов A-B-CH2-LG (где LG обозначает целесообразно подходящую уходящую группу), применяемых в схеме 4 и схеме 5, основаны на известных литературных способах [для A-B = 3-(1,2,4-триазолил) или 5-(1,2,4-триазол-3-он)ил и LG=Cl см. Janagisawa I., Hirata, J. , Ishii J., Journal of Medical Chemistry, 27, 849 (1984); для A-B = 4-((2H)-имидазол-2-она)ил или 5-(4-этоксикарбонил-(2H)-имидазол-2-он)ил и X= Br см. Ducschinsky R., Dolan Z.A., Journal of the American Chemical Soc., 70, 657 (1948)].
Один способ получения энантиомерно чистых 2,3-цис-морфолинов, которые замещены в ) при низкой температуре, предпочтительно от -78 до -20oC. После нескольких часов выдерживания смеси при низкой температуре, обработки и очистки получают в преобладающем количестве 2,3-цис-замещенные продукты, которые можно превратить в конечные соединения, как показано на схеме 5.
Энантиомерно чистые фенилглицины, замещенные в фенильном ядре, можно получить способом, показанным на схеме 6 (D.A. Evans, et al., J. Am. Chem. Soc., 1990, 112, 4011).
Способы получения азотистых алкилирующих агентов A-B-CH2-LG (где LG обозначает целесообразно подходящую уходящую группу), применяемых в схеме 4 и схеме 5, основаны на известных литературных способах [для A-B = 3-(1,2,4-триазолил) или 5-(1,2,4-триазол-3-он)ил и LG=Cl см. Janagisawa I., Hirata, J. , Ishii J., Journal of Medical Chemistry, 27, 849 (1984); для A-B = 4-((2H)-имидазол-2-она)ил или 5-(4-этоксикарбонил-(2H)-имидазол-2-он)ил и X= Br см. Ducschinsky R., Dolan Z.A., Journal of the American Chemical Soc., 70, 657 (1948)].
Один способ получения энантиомерно чистых 2,3-цис-морфолинов, которые замещены в  -положении C2-бензилового простого эфира, приводится на схеме 7. Так, например, замещенный 2-морфолинон (получен, как описано в схеме 4) обрабатывают активным гидридным реагентом, например диизобутил-алюминийгидридом, алюмогидридом лития или три(втор-бутил)борогидридом лития, и полученный промежуточный продукт реакции гасят замещенным бензоилгалогенидом, ангидридом бензойной кислоты или другим активированным переносящим ацил реагентом. После водной обработки получают 2-бензоилокси-соединение, показанное на схеме 7. Это соединение превращают в соответствующий -положении C2-бензилового простого эфира, приводится на схеме 7. Так, например, замещенный 2-морфолинон (получен, как описано в схеме 4) обрабатывают активным гидридным реагентом, например диизобутил-алюминийгидридом, алюмогидридом лития или три(втор-бутил)борогидридом лития, и полученный промежуточный продукт реакции гасят замещенным бензоилгалогенидом, ангидридом бензойной кислоты или другим активированным переносящим ацил реагентом. После водной обработки получают 2-бензоилокси-соединение, показанное на схеме 7. Это соединение превращают в соответствующийпростой эфир енола с применением “титанилида”, полученного из реагентов, например  -хлор- -хлор- -метилен[бис(циклопентадиенил) титан] диметилалюминия (“Tebbe Reagent Tebbe F.N., Parshall G.W., Reddy G.S., Journal of American Society, 100, 3611 (1978), диметилтитаноцена (Petasis N.A., Bzowej E.I., Journal of American Chemical Society, 112, 6392 (1990) или реагента, полученного восстановлением 1,1-дибромалканов цинком тетрахлоридом титана в присутствии N, N, N’, N’- тетраметилэтилендиамина (Takai К. et al., Journal of Organic Chemistry 52, 4412 (1987)). Полученный простой эфир енола восстанавливают в насыщенный аналог гидрированием в присутствии катализатора на родиевой основе, например родия на оксиде алюминия или угле; если желательно одновременное удаление N-бензильной группы у атома азота морфолина, гидрирование можно проводить в присутствии катализатора – палладий на угле. Если в этом случае получают диастереомеры, их можно разделить хроматографическими способами или перекристаллизацией смеси диастереомеров. Превращение таким образом полученных морфолинов в конечный продукт проводят способами, аналогичными описанным в схемах 4 и 5.
Способы, которыми заместитель в положение C-3 фенильного ядра морфолинов данного изобретения можно ввести или заменить на другой заместитель, показываются на схеме 8. Так, например, замещенный морфолин можно получить, как описано на схеме 4, 5 или 7, из энантиомерно чистого бензилоксизамещенного арилглицина (получен как описывается в литературе [например, L-n-бензилоксифенилглицин можно получить по способу Kamiya et al. Tetrahedron, 35, 323 (1979) или при помощи способов, описанных на схеме 6]. Селективным расщеплением бензилового простого эфира через гидрогенолиз или неселективный гидрогенолиз и последующим проведением синтетической последовательности, показанной на схеме 8, можно получить пригодно защищенный фенольный промежуточный продукт. Этот фенол можно превратить в соответствующий арилтрифлат (как показано или применяя N-фенилтрифторметансульфимид в присутствии основания третичного амина в хлористом метилене), и трифлат можно превратить в целевую функциональную группу, применяя катализируемые палладием или никелем способы, описанные в Ritter, Synthesis, 735 (1993) и ссылках в нем. Превращение в целевой конечный продукт можно проводить, как описано в схеме 4 или 5.
“Родительские” соединения, полученные выше, превращают в их пролекарственные двойники алкилированием, ацилироваиием, фосфорилированием или сульфонилированием для образования простых эфирных, сложных эфирных, фосфатных или сульфонатных производных (где “родительские” соединения имеют заместитель -X, определенный выше) обычными способами, указанными здесь ссылками, или приемлемыми их модификациями.
В частности, как изображено на схеме 9, обработкой, например триазолон- или имидазолонсодержащего антагониста тахикинина, пригодным основанием, например н-бутиллитием, гидридом натрия, гидридом калия, гексаметилдисилазидом лития, гексаметилдисилазидом натрия, гексаметилдисилазидом калия или диизопропиламидом лития в ТГФ при низкой температуре и последующим добавлением подходящего фосфорилпереносящего реагента, например тетрабензилпирофосфата, дибензилфосфохлоридата или дибензилфосфофторидата, получают промежуточный продукт с защищенной фосфорильной группой. После очистки, например, градиентной хроматографией на силикагеле или жидкостной хроматографией при высоком давлении с обращенной фазой, дибензиловый эфир можно превратить в целевой продукт гидрогенолизом, например обработкой водородом-газом в присутствии палладия на угле и в присутствии двух эквивалентов пригодного солеобразующего агента, например бикарбоната натрия (для получения динатриевой соли фосфорамидатного продукта) или бикарбоната калия (для получения дикалиевой соли продукта). Продукт можно очистить кристаллизацией или хроматографией с нормальной или обращенной фазой.
Как изображено на схеме 10, обработкой, например триазолон- или имидазолонсодержащего антагониста тахикинина, пригодным основанием, например диизопропилэтиламином, 2.6-диметилпиридином или триэтиламином, и 1-хлорэтилэтилкарбонатом (где R может быть этилом, -CH2CO2CH2-фенил или -CH2CH2NHP-BOC) в совместимом растворителе, например толуоле или дихлорэтане, и последующим нагреванием смеси при кипячении с обратным холодильником в течение 12-24 ч получают соответствующей N-алкилкарбонатный продукт, который можно очистить флэш-хроматографией.
Подобным же образом такой же субстрат можно обработать функционализированным карбонатом, приведенным на схеме 11, в аналогичных условиях, например кипячением с обратным холодильником в толуоле в присутствии диизопропилэтиламина, 2,6-диметилпиридина или триэтиламина, для получения N-Boc- защищенного промежуточного продукта. Отщеплением Boc-группы, например трифторуксусной кислотой в хлористом метилене или хлористым водородом в этилацетате, получают соответствующую соль пролекарственного продукта.
Получение N-оксидного пролекарства вышеуказанных морфолиновых антагонистов тахикининов можно достичь, как показано на схеме 12, обработкой агентом переноса кислорода (окислителем), например надкислотой, такой как 3 хлорпероксибензойная кислота или трифторметилперуксусная кислота, или пероксидом водорода или алкилгидропероксидами, таким как трет-бутилгидропероксид, в присутствии катализатора (переходной металл) или кислотой Каро (H2SO5).
Соединения, содержащие соединяющие группы между гетероциклом и фосфорильной группой, можно также получить, например как показано на схеме 13 [см. S. A. Varia, S. Schuller, K.B. Sloan and V.J. Stella, J. Pharm, Sci., 73, 1068-1073 (1984)]. Обработкой “родительского” соединения алифатическим альдегидом, например водным формальдегидом, получают соответствующие гидроксиметилпроизводные, которые после превращения в хлорид треххлористым фосфором можно обработать дибензилфосфатом серебра. Полученные защищенные фосфаты можно разделить обычными способами, например хроматографией на силикагеле. Очищенные продукты можно затем превратить в свободные фосфорные кислоты, как показано на схемах 14 и 15, обработкой восстановителем, например газообразным водородом в присутствии палладия на угле.
Целевые соединения формулы I, полученные в соответствии с реакциями, представленные выше, можно выделить и очистить обычным способом, например экстракцией, осаждением, фракционной кристаллизацией, перекристаллизацией, хроматографией и т.д.
Соединения данного изобретения способны образовать соли с различными неорганическими и органическими кислотами и основаниями, такие соли также входят в объем этого изобретения. Примеры таких солей с кислотами включают ацетат, адипат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорасульфонат, этансульфонат, фумарат, полусульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, метансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, оксалат, памоат, персульфат, пикрат, пивалат, пропионат, суцинат, тартрат, тозилат и ундеканоат. Соли с основанием включают аммониевые соли, соли щелочных металлов, например натриевые, литиевые и калиевые соли, соли щелочноземельных металлов, например кальциевые и магниевые соли, соли с органическими основаниями, например соли с дициклогексиламином, N-метил-D-глюкамином, и соли с аминокислотами, например аргинином, лизином, орнитином и т.д. Кроме того, азотсодержащие группы основного характера можно кватернизовать такими агентами, как алкилгалогениды, например метил-, этил-, пропил- и бутилхлорид, бромиды и иодиды; диалкилсульфаты, подобные диметил-, диэтил-, дибутил-, диамилсульфатам; галогениды с длинной цепью (высшие), например децил-, лаурил-, миристил- и стеарилхлориды, бромиды и иодиды; аралкилгалогениды, подобные бензилбромиду и другим. Предпочтительны нетоксичные физиологически приемлемые соли, хотя полезны также другие соли, например для выделения и очистки продукта.
Соли можно образовать обычными способами, например реакцией продукта в форме свободного основания с одним или более эквивалентами подходящей кислоты в растворителе или среде, в которой соль нерастворима, или в растворителе, например воде, который удаляют в вакууме, или сушкой вымораживанием, или обменом анионов имеющейся соли на другой анион на подходящей ионообменной смоле.
Хотя реакционные схемы, описанные здесь, обоснованно общие, специалистам в области органического синтеза должно быть понятно, что одна или несколько функциональных групп, присутствующих в данном соединении формулы I, могут придать молекуле несовместимость с конкретной синтетической схемой. В таком случае можно применять альтернативный путь, измененный порядок стадий или стратегию защиты и удаления защитной группы. Во всех случаях следует выбирать такие конкретные условия реакции, включая реагенты, растворитель, температуру и время, чтобы они согласовались с природой функциональных групп, присутствующих в молекуле.
Как обнаружит специалист в данной области, примеры 1-93 описывают получение различных “родительских” соединений, тогда как примеры 94-96 подробно описывают получение конкретных пролекарств некоторых “родительских” соединений. В соответствии с этим методологию, имеющуюся в примерах 94-96, легко приспособить без неуместного экспериментирования для получения соединений данного изобретения, включая пролекарства “родительских” соединений примеров 1-93.
Следующие, примеры приводятся для цели иллюстрации данного изобретения и не должны рассматриваться как ограничения объема и сущности данного изобретения.
ПРИМЕР 1 -метилен[бис(циклопентадиенил) титан] диметилалюминия (“Tebbe Reagent Tebbe F.N., Parshall G.W., Reddy G.S., Journal of American Society, 100, 3611 (1978), диметилтитаноцена (Petasis N.A., Bzowej E.I., Journal of American Chemical Society, 112, 6392 (1990) или реагента, полученного восстановлением 1,1-дибромалканов цинком тетрахлоридом титана в присутствии N, N, N’, N’- тетраметилэтилендиамина (Takai К. et al., Journal of Organic Chemistry 52, 4412 (1987)). Полученный простой эфир енола восстанавливают в насыщенный аналог гидрированием в присутствии катализатора на родиевой основе, например родия на оксиде алюминия или угле; если желательно одновременное удаление N-бензильной группы у атома азота морфолина, гидрирование можно проводить в присутствии катализатора – палладий на угле. Если в этом случае получают диастереомеры, их можно разделить хроматографическими способами или перекристаллизацией смеси диастереомеров. Превращение таким образом полученных морфолинов в конечный продукт проводят способами, аналогичными описанным в схемах 4 и 5.
Способы, которыми заместитель в положение C-3 фенильного ядра морфолинов данного изобретения можно ввести или заменить на другой заместитель, показываются на схеме 8. Так, например, замещенный морфолин можно получить, как описано на схеме 4, 5 или 7, из энантиомерно чистого бензилоксизамещенного арилглицина (получен как описывается в литературе [например, L-n-бензилоксифенилглицин можно получить по способу Kamiya et al. Tetrahedron, 35, 323 (1979) или при помощи способов, описанных на схеме 6]. Селективным расщеплением бензилового простого эфира через гидрогенолиз или неселективный гидрогенолиз и последующим проведением синтетической последовательности, показанной на схеме 8, можно получить пригодно защищенный фенольный промежуточный продукт. Этот фенол можно превратить в соответствующий арилтрифлат (как показано или применяя N-фенилтрифторметансульфимид в присутствии основания третичного амина в хлористом метилене), и трифлат можно превратить в целевую функциональную группу, применяя катализируемые палладием или никелем способы, описанные в Ritter, Synthesis, 735 (1993) и ссылках в нем. Превращение в целевой конечный продукт можно проводить, как описано в схеме 4 или 5.
“Родительские” соединения, полученные выше, превращают в их пролекарственные двойники алкилированием, ацилироваиием, фосфорилированием или сульфонилированием для образования простых эфирных, сложных эфирных, фосфатных или сульфонатных производных (где “родительские” соединения имеют заместитель -X, определенный выше) обычными способами, указанными здесь ссылками, или приемлемыми их модификациями.
В частности, как изображено на схеме 9, обработкой, например триазолон- или имидазолонсодержащего антагониста тахикинина, пригодным основанием, например н-бутиллитием, гидридом натрия, гидридом калия, гексаметилдисилазидом лития, гексаметилдисилазидом натрия, гексаметилдисилазидом калия или диизопропиламидом лития в ТГФ при низкой температуре и последующим добавлением подходящего фосфорилпереносящего реагента, например тетрабензилпирофосфата, дибензилфосфохлоридата или дибензилфосфофторидата, получают промежуточный продукт с защищенной фосфорильной группой. После очистки, например, градиентной хроматографией на силикагеле или жидкостной хроматографией при высоком давлении с обращенной фазой, дибензиловый эфир можно превратить в целевой продукт гидрогенолизом, например обработкой водородом-газом в присутствии палладия на угле и в присутствии двух эквивалентов пригодного солеобразующего агента, например бикарбоната натрия (для получения динатриевой соли фосфорамидатного продукта) или бикарбоната калия (для получения дикалиевой соли продукта). Продукт можно очистить кристаллизацией или хроматографией с нормальной или обращенной фазой.
Как изображено на схеме 10, обработкой, например триазолон- или имидазолонсодержащего антагониста тахикинина, пригодным основанием, например диизопропилэтиламином, 2.6-диметилпиридином или триэтиламином, и 1-хлорэтилэтилкарбонатом (где R может быть этилом, -CH2CO2CH2-фенил или -CH2CH2NHP-BOC) в совместимом растворителе, например толуоле или дихлорэтане, и последующим нагреванием смеси при кипячении с обратным холодильником в течение 12-24 ч получают соответствующей N-алкилкарбонатный продукт, который можно очистить флэш-хроматографией.
Подобным же образом такой же субстрат можно обработать функционализированным карбонатом, приведенным на схеме 11, в аналогичных условиях, например кипячением с обратным холодильником в толуоле в присутствии диизопропилэтиламина, 2,6-диметилпиридина или триэтиламина, для получения N-Boc- защищенного промежуточного продукта. Отщеплением Boc-группы, например трифторуксусной кислотой в хлористом метилене или хлористым водородом в этилацетате, получают соответствующую соль пролекарственного продукта.
Получение N-оксидного пролекарства вышеуказанных морфолиновых антагонистов тахикининов можно достичь, как показано на схеме 12, обработкой агентом переноса кислорода (окислителем), например надкислотой, такой как 3 хлорпероксибензойная кислота или трифторметилперуксусная кислота, или пероксидом водорода или алкилгидропероксидами, таким как трет-бутилгидропероксид, в присутствии катализатора (переходной металл) или кислотой Каро (H2SO5).
Соединения, содержащие соединяющие группы между гетероциклом и фосфорильной группой, можно также получить, например как показано на схеме 13 [см. S. A. Varia, S. Schuller, K.B. Sloan and V.J. Stella, J. Pharm, Sci., 73, 1068-1073 (1984)]. Обработкой “родительского” соединения алифатическим альдегидом, например водным формальдегидом, получают соответствующие гидроксиметилпроизводные, которые после превращения в хлорид треххлористым фосфором можно обработать дибензилфосфатом серебра. Полученные защищенные фосфаты можно разделить обычными способами, например хроматографией на силикагеле. Очищенные продукты можно затем превратить в свободные фосфорные кислоты, как показано на схемах 14 и 15, обработкой восстановителем, например газообразным водородом в присутствии палладия на угле.
Целевые соединения формулы I, полученные в соответствии с реакциями, представленные выше, можно выделить и очистить обычным способом, например экстракцией, осаждением, фракционной кристаллизацией, перекристаллизацией, хроматографией и т.д.
Соединения данного изобретения способны образовать соли с различными неорганическими и органическими кислотами и основаниями, такие соли также входят в объем этого изобретения. Примеры таких солей с кислотами включают ацетат, адипат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорасульфонат, этансульфонат, фумарат, полусульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, метансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, оксалат, памоат, персульфат, пикрат, пивалат, пропионат, суцинат, тартрат, тозилат и ундеканоат. Соли с основанием включают аммониевые соли, соли щелочных металлов, например натриевые, литиевые и калиевые соли, соли щелочноземельных металлов, например кальциевые и магниевые соли, соли с органическими основаниями, например соли с дициклогексиламином, N-метил-D-глюкамином, и соли с аминокислотами, например аргинином, лизином, орнитином и т.д. Кроме того, азотсодержащие группы основного характера можно кватернизовать такими агентами, как алкилгалогениды, например метил-, этил-, пропил- и бутилхлорид, бромиды и иодиды; диалкилсульфаты, подобные диметил-, диэтил-, дибутил-, диамилсульфатам; галогениды с длинной цепью (высшие), например децил-, лаурил-, миристил- и стеарилхлориды, бромиды и иодиды; аралкилгалогениды, подобные бензилбромиду и другим. Предпочтительны нетоксичные физиологически приемлемые соли, хотя полезны также другие соли, например для выделения и очистки продукта.
Соли можно образовать обычными способами, например реакцией продукта в форме свободного основания с одним или более эквивалентами подходящей кислоты в растворителе или среде, в которой соль нерастворима, или в растворителе, например воде, который удаляют в вакууме, или сушкой вымораживанием, или обменом анионов имеющейся соли на другой анион на подходящей ионообменной смоле.
Хотя реакционные схемы, описанные здесь, обоснованно общие, специалистам в области органического синтеза должно быть понятно, что одна или несколько функциональных групп, присутствующих в данном соединении формулы I, могут придать молекуле несовместимость с конкретной синтетической схемой. В таком случае можно применять альтернативный путь, измененный порядок стадий или стратегию защиты и удаления защитной группы. Во всех случаях следует выбирать такие конкретные условия реакции, включая реагенты, растворитель, температуру и время, чтобы они согласовались с природой функциональных групп, присутствующих в молекуле.
Как обнаружит специалист в данной области, примеры 1-93 описывают получение различных “родительских” соединений, тогда как примеры 94-96 подробно описывают получение конкретных пролекарств некоторых “родительских” соединений. В соответствии с этим методологию, имеющуюся в примерах 94-96, легко приспособить без неуместного экспериментирования для получения соединений данного изобретения, включая пролекарства “родительских” соединений примеров 1-93.
Следующие, примеры приводятся для цели иллюстрации данного изобретения и не должны рассматриваться как ограничения объема и сущности данного изобретения.
ПРИМЕР 1(+/-)-  -Бромфенилацетальдегид, 3,5-бис(трифторметил)бензилацеталь -Бромфенилацетальдегид, 3,5-бис(трифторметил)бензилацетальРаствор 2,50 г (10,2 ммоль) диметалацеталя  -бромфенилацетальдегида, 8,00 г (32,8 ммоль) 3,5-бис (трифторметил)бензилового спирта и 0,50 г (2,6 ммоль) моногидрата п-толуолсульфокислоты в 10 мл толуола перемешивали в вакууме (35 мм рт.ст.) при к.т. в течение 3 дней. Реакционную смесь распределяли между 100 мл эфира и 50 мл насыщенного водного раствора бикарбоната натрия, и слои разделяли. Органический слой промывали 25 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией на 200 г силикагеля с применением в качестве элюента смеси гексан/хлористый метилен (9:1, об./об.) получали 5,41 г (81%) заглавного соединения в виде твердого вещества, т.пл. 79-82oC. 1H ЯМР-спектр: 4,47 и 4,62 (AB к, 2H, J=12,5), 4,78-4,93 (2H), 5,09 и 5,21 (AB к, 2H, J = 7,7), 7,31-7,44 (м, 7H), 7,70 (прибл. с, 1H), 7,82 (прибл. с, 1H), 7,84 (прибл. с, 2H); ИК-спектр (тонкая пленка): 1363, 1278, 1174, 1130, 704, 682.
Анализ. Рассчитано для C26H17BrF12O2: -бромфенилацетальдегида, 8,00 г (32,8 ммоль) 3,5-бис (трифторметил)бензилового спирта и 0,50 г (2,6 ммоль) моногидрата п-толуолсульфокислоты в 10 мл толуола перемешивали в вакууме (35 мм рт.ст.) при к.т. в течение 3 дней. Реакционную смесь распределяли между 100 мл эфира и 50 мл насыщенного водного раствора бикарбоната натрия, и слои разделяли. Органический слой промывали 25 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией на 200 г силикагеля с применением в качестве элюента смеси гексан/хлористый метилен (9:1, об./об.) получали 5,41 г (81%) заглавного соединения в виде твердого вещества, т.пл. 79-82oC. 1H ЯМР-спектр: 4,47 и 4,62 (AB к, 2H, J=12,5), 4,78-4,93 (2H), 5,09 и 5,21 (AB к, 2H, J = 7,7), 7,31-7,44 (м, 7H), 7,70 (прибл. с, 1H), 7,82 (прибл. с, 1H), 7,84 (прибл. с, 2H); ИК-спектр (тонкая пленка): 1363, 1278, 1174, 1130, 704, 682.
Анализ. Рассчитано для C26H17BrF12O2:C 46,76; H 2,23; Br 11,64; F 33,70 Найдено: C 46,65; H 2,56; Br 11,94; F 34,06. ПРИМЕР 2 (+/-)-N-(2-Гидроксиэтил)фенилглициналь, 3,5-бис(трифторметил) бензилацеталь Раствор 1,50 г (2,2 ммоль) (+/-)-  -бромфенилацетальдегида в виде 3,5-бис(трифторметил)бензилацеталя (пример 1), 100 мг (0,67 ммоль) иодида натрия и 3 мл этаноламина в 6 мл изопропанола кипятили с обратным холодильником в течение 20 ч. Раствор охлаждали и концентрировали в вакууме до около 25% от начального объема. Концентрированный раствор распределяли между 50 мл эфира и 20 мл 2 н водного раствора едкого натра, и слои разделяли. Органический слой промывали 20 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией на 50 г силикагеля с применением смеси эфир/гексан (65:35, об./об. ) в качестве элюента получали 1,18 г (83%) заглавного соединения в виде масла. 1H ЯМР-спектр: 2,66 (шир. с, 2H), 2,61 и 2,68 (dd AB к, 2H, JAB = 12,4, J2,61 = 6,8,6,2, J2,68= 6,2, 6,2), 3,57 и 3,66 (dd AB к, 2H, JAB = 10,8, J3,57 = 6,2, 6,2, J3,66 =6,8, 6,2), 4,02 (д, 1H, J = 7,0), 4,37 и 4,64 (AB к 2 H, J = 12,5), 4,80 и 4,87 (AB к, 2H, J = 12,8), 4,87 (д, 1H, J = 7,0), 7,31-7,40 (7H), 7,73 (прибл. с, 1H), 7,81 (прибл. с, 3H); ИК-спектр (чистое): 3342, 1456, 1373, 1278, 1278, 1173, 1128, 704, 682; FAB-MS: 650(М+1)+.
Анализ. Рассчитано для C28H23F12NO3: C 51,78; H 3,57; N 2,16; F 35,11 -бромфенилацетальдегида в виде 3,5-бис(трифторметил)бензилацеталя (пример 1), 100 мг (0,67 ммоль) иодида натрия и 3 мл этаноламина в 6 мл изопропанола кипятили с обратным холодильником в течение 20 ч. Раствор охлаждали и концентрировали в вакууме до около 25% от начального объема. Концентрированный раствор распределяли между 50 мл эфира и 20 мл 2 н водного раствора едкого натра, и слои разделяли. Органический слой промывали 20 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией на 50 г силикагеля с применением смеси эфир/гексан (65:35, об./об. ) в качестве элюента получали 1,18 г (83%) заглавного соединения в виде масла. 1H ЯМР-спектр: 2,66 (шир. с, 2H), 2,61 и 2,68 (dd AB к, 2H, JAB = 12,4, J2,61 = 6,8,6,2, J2,68= 6,2, 6,2), 3,57 и 3,66 (dd AB к, 2H, JAB = 10,8, J3,57 = 6,2, 6,2, J3,66 =6,8, 6,2), 4,02 (д, 1H, J = 7,0), 4,37 и 4,64 (AB к 2 H, J = 12,5), 4,80 и 4,87 (AB к, 2H, J = 12,8), 4,87 (д, 1H, J = 7,0), 7,31-7,40 (7H), 7,73 (прибл. с, 1H), 7,81 (прибл. с, 3H); ИК-спектр (чистое): 3342, 1456, 1373, 1278, 1278, 1173, 1128, 704, 682; FAB-MS: 650(М+1)+.
Анализ. Рассчитано для C28H23F12NO3: C 51,78; H 3,57; N 2,16; F 35,11Найдено: C 51,80; H 3,67; N 2,10; F 35,41 ПРИМЕР 3 (+/-)-N-(2-Гидроксиэтил)-N-(проп-2-енил)фенилглициналь, 3,5-бис(трифторметил)бензилацеталь Смесь 1,45 г (2,2 моль) (+/-)-N-(2-гидроксиэтил)фенилглициналя, 3,5-бис(трифторметил)бензилацеталя (пример 2), 1,0 г (7,2 ммоль) карбоната калия, 3,0 мл (35,0 ммоль) аллилбромида и 15 мл этанола перемешивали при 60oC в течение 20 ч. Смесь охлаждали, распределяли между 100 мл эфира и 25 мл воды, и слои разделяли. Органический слой сушили над сульфатом магния. Водный слой экстрагировали 100 мл эфира, эфирный экстракт сушили и объединяли с первым органическим слоем. Объединенные органические слои концентрировали в вакууме. Флэш-хроматографией на 50 г силикагеля с применением смеси гексан/эфир (4: 1, об./об) в качестве элюента получали 1,36 г (88%) заглавного соединения в виде масла. 1H ЯМР-спектр: 2,40 (дт, 1H, J = 13,2, 2,8), 2,93-3,08 (3H), 3,30 (ддт, 1H, J = 12,0, 2,8, 1), 3,54 (шир. м, 2H), 3,65 (дт, 1H, J = 10,0, 2,8), 4,23 (д, 1H, J = 8,4), 4,52 и 4,58 (AB к, 2H, J = 12,4), 4,85 и 4,95 (AB к, 2H, J = 12,4), 5,25 (д, 1H, J = 9,6), 5,28 (д, 1H, J = 16,4), 5,39 (д, 1H, J = 8,4), 5,81 (м, 1H), 7,24 -7,40 (7H), 7,68 (с, 1H), 7,83 (c, 1H), 7,86 (c, 2H). ИК-спектр (чистое): 3457, 1362, 1278, 1174, 1132, 1056, 759, 705, 682; FAB-MS: 690(М+1)+. Анализ. Рассчитано: для C31H27F12NO3: C 53,99; H 3,95; N 2,03; F 33,07 Найдено: C 54,11; H 4,08; N 1,78; F 32,75. ПРИМЕР 4 (+/-)-2-(3,5-Бис(трифторметил)бензилокси)-3-фенилморфолин Стадия А: Раствор 850 мг (1,2 ммоль) (+/-)-N-(2-гидроксиэтил)- N-(проп-2-енил)фенилглициналя в виде 3,5-бис(трифторметил)бензилацеталя (пример 3), 700 мг (3,7 ммоль) моногидрата п-толуолсульфокислоты в 15 мл толуола кипятили с обратным холодильником в течение 1,5 ч. Реакционную смесь охлаждали и распределяли между 100 мл эфира и 25 мл насыщенного водного раствора бикарбоната натрия. Слои разделяли, органический слой промывали 25 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией на 30 г силикагеля с использованием в качестве элюента смеси гексан/эфир (50:1, об./об.) получали 426 мг (78%) N-аллилморфолинов, которые применяли в следующей стадии без дополнительной очистки. Стадия В: В двухгорлую колбу на 50 мл, снабженную пробкой и коротким устройством для дистилляции, загружали раствор N-аллилморфолинов (пример 4, стадия А) (540 мг, 1,2 ммоль) и 80 мг (0,09 ммоль) трис(трифенилфосфин)родийхлорида (катализатор Wilkinson) в 25 мл смеси ацетонитрил/вода (4: 1, об./об.). Реакционную смесь нагревали до кипения, и растворитель отгоняли из реакционной смеси. Объем реакционной смеси поддерживали между 10 и 20 мл добавлением растворителя через закрытое пробкой впускное отверстие. Через 1 ч и 4 ч реакционную смесь обрабатывали дополнительными порциями по 80 мг катализатора Wilkinson. Через 6 ч реакционную смесь охлаждали и распределяли между 75 мл эфира и 50 мл воды. Слои разделяли, и органический слой сушили над сульфатом магния. Водный слой экстрагировали 75 мл эфира, экстракт сушили и объединяли с первым органическим слоем. Объединенные органические слои концентрировали в вакууме. Флэш-хроматографией на 35 г силикагеля с применением в качестве элюента смеси эфир/гексан (1:1, об. /об. ) выделяли 200 мг транс-изомера и 130 мг смеси цис- и транс-изомеров (общий выход 68%). Хроматографией смеси на 8 г силикагеля с использованием в качестве элюента смеси гексан/эфир (4:1, об./об.) выделяли 64 мг цис-изомера и 57 мг смеси цис- и транс-изомеров заглавного соединения. Для транс-изомера: 1H ЯМР-спектр: 2,03 (шир. с, 1H), 2,94 (ддд, 1H, J = 11,0, 2,5, 2,5), 3,08 (дт, 1H, J = 11,0, 3,2), 3,71 (д, 1H, J = 7,0), 3,83 (дт, 1H, J = 11,2, 2,8), 4,05 (ддд, 1H, J = 11,2, 3,2, 3,2), 4,43 (д, 1H, J = 7,0), 4,53 и 4,88 (AB к, 2H, J = 13,3), 7,26-7,45 (7H), 7,70 (c, 1H). ИК-спектр: 3333, 2859, 1374, 1278, 1173, 1131, 1082, 757, 702, 682; FAB-MS: 406(М+1)+. Анализ. Рассчитано для C19H17F6NO2: C 56,30; H 4,23; N 3,46; F 28,12 Найдено: C 56,39; H 4,28; N 3,36; F 28,32. Для цис-изомера: 1H ЯМР-спектр: 2,10 (шир. с, 1H), 3,13 (дд, 1H, J = 12,4, 3,0), 3,26 (дт, 1H, J = 12, 4, 3, 6), 3,65 (дд, 1H, J = 11,6, 3,6), 4,07 (дт, 1H, J = 11,6, 3,0), 4,14 (д, 1H, J = 2,4), 4,52 (AB к, 2H, J = 13,6), 4,76 (д, 1H, J = 2,4), 7,30-7,42 (6H), 7,70 (с, 1H); FAB-MS 406 (M+1)+. ПРИМЕР 5 (+/-)-2-(3,5-Бис(трифторметил)бензилокси)-3-фенил-4- метилкарбоксамидоморфолин Раствор 105 мг (0,26 ммоль) транс-изомера (+/-)-2-(3,5-бис(трифторметил)бензилокси)-3-фенилморфолина (пример 4) и 0,09 мл (0,50 ммоль) N,N-диизопропилэтиламина в 3 мл ацетонитрила обрабатывали 90 мг (0,50 ммоль) иодацетамида, и образованный раствор перемешивали при к.т. в течение 16 ч. Раствор концентрировали в вакууме и остаток распределяли между 20 мл этилацетата и 10 мл 0,5 н водного раствора кислого сульфата калия. Слои разделяли, органический слой промывали 10 мл 5%-ного водного раствора тиосульфата натрия, 10 мл насыщенного водного раствора бикарбоната натрия, 10 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией на 5 г силикагеля с использованием в качестве элюента смеси этилацетат/гексан (2:1, об./об) выделяли 99 мг (82%) транс-изомера заглавного соединения в виде масла. 1H ЯМР-спектр: 2,56 (дт, 1H, J = 3,2, 11,6), 2,67 и 3,16 (AB к, 2Н, J = 16,4), 2,96 (дт, 1H, J = 12,0, 1,6), 3,30 (д, 1H, J = 7,0), 3,96 (дт, 1H, J = 3,2, 12,0), 4,08 (ддт, 1H, J = 11,6, 3,2, 1,6), 4,48 и 4,84 (AB к, 2H, J = 13,2), 4,49 (д, 1H, J = 7,0), 5,98 (шир. с, 1H), 6,83 (шир. с, 1H), 7,33 (прибл. с, 7H), 7,70 (с, 1H). ИК-спектр (чистое): 3445, 2838, 1682, 1278, 1132, 760, 704, 682; FAB-MS: 463 (M+1)+. Анализ. Рассчитано для C21H20F6NO3: C 54,54; H 4,36; N 6,06; F 24,65 Найдено: C 54,54; H 4,52; N 5,61; F 24,45. Аналогичный эксперимент проводили с 40 мг (0,99 ммоль) цис-изомера (+/-)-2-(3,5-бис(трифторметил)бензилокси)-3-фенилморфолина (пример 4), применяя в реакции 0,035 мл (0,2 ммоль) N,N-диизопропилэтиламина и 37 мг (0,2 ммоль) иодацетамида. После обработки и флэш-хроматографии продукта получали 30 мг (65%) цис-изомера заглавного соединения в виде масла. 1H ЯМР-спектр: 2,54 и 3,04 (AB, к, 2H, J = 16,8), 2,63 (дт, 1H, J = 3,6, 12,0), 3,04 (д, 1H, J = 11,6), 3,65 (д, 1H, J = 2,8), 3,71 (ддт, 1H, J = 11,6, 3,2, 1,2), 4,21 (дт, 1H, J = 11,6, 2,4), 4,44 и 4,89 (AB к, 2H, J = 13,6), 4,71 (д, 1H, J = 2,8), 5,86 (шир. с, 1H), 7,15 (шир. с, 1H), 7.45 (7H), 7,73 (c, 1H); FAB-MS: 463 (M+1)+. ПРИМЕР 6 (+/-)-2-(3,5-Бис(трифторметил)бензилокси)-3-фенил- 4-(метоксикарбонилметил)морфолин Раствор 150 мг (0,37 ммоль) транс-изомера (+/-)-2-(3,5-бис(трифторметил)бензилокси)-3-фенилморфолина (пример 4) и 18 мл (1,00 моль) N, N-диизопропилэтиламина в 2 мл ацетонитрила обрабатывали 0,095 мл (1,00 ммоль) метилбромацетата, и образованный раствор перемешивали при к.т. в течение 20 ч. Раствор концентрировали в вакууме, и остаток распределяли между 20 мл этилацетата и 5 мл 0,5 н водного раствора кислого сульфата калия. Слои разделяли, органический слой промывали 10 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией на 10 г силикагеля с использованием в качестве элюента смеси гексан/эфир (4:1, об./об.) выделяли 164 мг (93%) транс-изомера заглавного соединения в виде масла. 1H ЯМР-спектр: 2,79 (дт, 1H, J = 3,2, 11,2), 2,93 (дт, 1H, J = 11,2, 1,6), 3,52 (д, 1H, J = 7,2), 3,63 (с, 3H), 3,92 (дт, 1H, J = 2,8, 11,6), 4,04 (ддд, 1H, J = 11,6, 3,2, 1,6), 4,45 и 4,84 (AB, к, 2H, J = 13,2), 4,46 (д, 1H, J = 7,2), 7,31-7,38 (м, 6H), 7,68 (с, 1H). ИК-спектр (чистое): 2861, 1744, 1455, 1375, 1346, 1278, 1170, 887, 759, 704, 682; FAB-MS: 478 (M+1)+. Анализ. Рассчитано для C22H21F6NO4: C 55,35; H 4,43; N 2,93; F 23,88 Найдено: C 55,74; H 4,50; N 2,79; F 24,01. ПРИМЕР 7 N-Метокси-N-метил-(N-трет-бутоксикарбонил)фенилглицинамид В раствор 20,0 г (79,7 ммоль) (N-трет-бутоксикарбонил)фенилглицина в 150 мл этилацетата при -10oC обрабатывали 8,8 мл (79,7 ммоль) 4-метилморфолина. В течение 10 мин при поддерживании температуры -10oC добавляли по каплям изобутилхлорформиат (10,3 мл, 79,7 ммоль), полученную суспензию перемешивали на холоде в течение 15 мин. Смесь обрабатывали 11,6 г (119,0 ммоль) соединением N,O-диметилгидроксиламин HCl. Добавляли вторую порцию 4-метилморфолина (13,0 мл, 119,0 ммоль), и реакционную смесь перемешивали 15 мин при -10oC и 2 ч при 25oC. Реакционную смесь распределяли между 100 мл этилацетата и 100 мл 10%-ного водного раствора лимонной кислоты, и слои разделяли. Органический слой промывали 100 мл насыщенного водного раствора бикарбоната натрия, 100 мл насыщенного водного раствора хлорида аммония, сушили над сульфатом магния и концентрировали в вакууме. Кристаллизацией из гексана при -20oC в течение 72 ч выделяли 8,0 г (34%) заглавного соединения в виде твердого вещества. 1H ЯМР-спектр: 1,40 (с, 9H), 3,20 (с, 3H), 3,40 (с, 3H), 5,80 (м, 2H), 7,40 (м, 5H). ПРИМЕР 8 Диэтил-(2-оксо-3-трет-бутоксикарбамидо-3-фенил)пропилфосфона Раствор 7,45 мл (51,0 ммоль) диэтилметилфосфоната в тетрагидрофуране при -78oC обрабатывали 31,8 мл (51,0 ммоль) 1,6 М раствора н-бутиллития в гексанах, и полученную смесь перемешивали на холоде в течение 30 мин. Добавляли раствор 4,0 г (14,0 ммоль) N-метокси-N-метил-(N-трет-бутоксикарбонил)фенилглицинамида (пример 7) в 20 мл тетрагидрофурана, и реакционную смесь перемешивали при -78oC в течение 15 мин и при 25oC в течение 15 мин. Реакцию гасили 150 мл насыщенного водного раствора хлорида аммония, разбавляли 300 мл этилацетата, и слои разделяли. Органический слой сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат/гексаны (7:3, об./об., затем 4:1, об./об.) получали 4,8 г (92%) заглавного соединения в виде масла. 1H ЯМР-спектр: 1,20-1,42 (15H), 2,84 (дд, 1H), 3,20 (дд, 1H), 4,00-4,20 (м, 4H), 5,50 (д, 1H), 5,94 (шир. с, 1H), 7,32 (м, 5H). ПРИМЕР 9 N-трет-Бутоксикарбонил-1-фенил-2-оксо-4-(3,5- бис(трифторметил)фенил)бут-3-енамин Раствор 4,80 г (12,5 ммоль) диэтил-(2-оксо-3-трет-бутоксикарбамидо-3-фенил)пропилфосфоната (пример 8) в 20 мл ТТФ добавляли по каплям в суспензию 1,05 г (26,3 ммоль, 60%-ная дисперсия в минеральном масле) гидрида натрия в 30 мл тетрагидрофурана при 0oC. Через 15 мин медленно добавляли 2,06 мл (12,5 ммоль) 3,5-бис(трифторметил)бензальдегида, и полученную смесь перемешивали на холоде в течение 15 мин. Реакцию гасили 50 мл насыщенного водного раствора хлорида аммония, разбавляли 50 мл этилацетата, и слои разделяли. Органический слой сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией на силикагеле с использованием в качестве элюента смеси этилацетат/петролейный эфир (19: 1, об./об., затем 9:1, об./об.) выделяли 3,30 г (56%) заглавного соединения в виде твердого вещества. 1H ЯМР-спектр: 1,40 (с, 9H), 5,38 (д, 1H), 5,90 (д, 1H), 6,80 (д, 1H), 7,39 (м, 5H), 7,70 (с, 1H), 7,84 (с, 3H). ПРИМЕР 10 1-Фенил-2-гидрокси-4-(3,5-бис(трифторметил)фенил)бут-3-енамин HCl Раствор 1,00 г (2,1 ммоль) N-трет-бутоксикарбонил-1-фенил-2-оксо- 4-(3,5-бис(трифторметил)фенил)бут-3-енамина (пример 8) в 30 мл метанола при 0oC обрабатывали 241 мг (6,3 ммоль) борогидридом натрия. Через 30 мин реакционную смесь гасили 50 мл воды и концентрировали в вакууме для удаления метанола. Смесь распределяли между 100 мл этилацетата и 50 мл воды, и слои разделяли. Органический слой сушили над сульфатом магния и концентрировали в вакууме. Кристаллизацией из смеси эфир/гексан получали 680 мг (68%) заглавного соединения в виде смеси (5:1) диастереомеров (каждый защищен как трет-бутилкарбамат). 1H ЯМР-спектр (* указывает резонансы диастереомера, присутствующего в меньшем количестве): 1,40 (с, 9H), 4,60 (дд, 1H), 4,90 (шир. с, 1H), 5,20 (шир. д, 1 Н), 6,30 (дд, 1H), 6,40 (дд, 1H*), 6,70 (дд, 1H), 6,80 (дд, 1H*), 7,40 (м, 5H), 7,80 (м, 3H). Раствор BOC-защишенного заглавного соединения в метаноле (насыщен HCl) оставляли на 72 ч. Раствор концентрировали в вакууме. Перекристаллизацией образованного твердого продукта из смеси эфир/гексан получали 500 мг (80%) заглавного соединения (как HCl) в виде твердого вещества. 1H ЯМР-спектр: 4,20 (шир. с, 1H), 4,40 (д, 1H), 6,20 (дд, 1H), 6,60 (дд, 1H), 7,30 (м, 5H), 7,80 (м, 3H). Заглавное соединение (как HCl) растворяли в этилацетате и 1 н водном растворе едкого натра. Слои разделяли, органический слой сушили над сульфатом магния и концентрировали в вакууме, получая заглавное соединение в форме свободного основания. ПРИМЕР 11 2-(2-(3,5-Бис(трифторметил)фенил)этенил)-3-фенил-5-оксоморфолин Раствор 1,95 г (5,2 ммоль) 1-фенил-2-гидрокси-4-(3,5-бис(трифторметил)фенил)бут-3-енамина (пример 10) в 20 мл толуола добавляли в суспензию 250 мг (6,2 ммоль, 60%-ная дисперсия в минеральном масле) гидрида натрия в 30 мл толуола, и образованную смесь перемешивали 15 мин при к.т. Медленно добавляли раствор 0,60 мл (1,15 моль) этилхлорацетата в 5 мл толуола и образованную смесь кипятили с обратным холодильником в течение 3 ч. Реакционную смесь охлаждали, гасили 50 мл насыщенного водного раствора хлорида аммония, разбавляли 50 мл этилацетата, и слои разделяли. Органический слой сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией с использованием в качестве элюента смеси этилацетат/гексан (4:1, об./об., затем 3:1, об./об., затем 1:1, об./об.), затем этилацетата получали 300 мг транс-изомера заглавного соединения и 800 мг цис-изомера заглавного соединения (общий выход 55%) в виде твердых веществ. Для цис-изомера: 1H ЯМР-спектр: 1,20-1,40 (м, 1H), 1,50-1,62 (м, 1H), 2,60-2,98 (м, 2H), 3,86 (дт, 1H), 4,24 (д, 1H), 4,34 (дд, 1H), 4,45 (д, 1H), 6,40 (шир. с, 1H), 7,24 (м, 2H), 7,40 (м, 3H), 7,50 (с, 2H), 7,70 (с, 1H). ПРИМЕР 12 3-Фенил-2-(2-(3,5-бис(трифторметил)фенил)этил)морфолин Раствор 95 мг (0,23 ммоль) 2-(2-(3,5-бис(трифторметил)фенил)этенил)-3-фенил-5-оксоморфолина (пример 11) в 10 мл смеси этанол/этилацетат (1:1, об. /об. ) обрабатывали 10 мг гидроксида палладия, и образованную смесь перемешивали 2 ч в атмосфере водорода. Катализатор отделяли фильтрованием, и фильтрат концентрировали в вакууме. Неочищенный продукт применяли непосредственно без дальнейшей очистки. Раствор 65 мг неочищенного морфолинона в 10 мл тетрагидрофурана обрабатывали 0,84 мл 1 М раствора комплекса боран-тетрагидрофуран в тетрагидрофуране, и образованный раствор 16 ч кипятили с обратным холодильником. Реакцию гасили добавлением 10 мл метанола и 70 мг карбоната калия, и реакционную смесь кипятили 3 ч с обратным холодильником. Все летучие компоненты удаляли в вакууме, и остаток распределяли между 20 мл этилацетата и 10 мл насыщенного раствора хлорида аммония. Органический слой отделяли, сушили над карбонатом натрия и концентрировали в вакууме. Остаток растворяли в метаноле, насыщенном HCl, и концентрировали в вакууме. Остаток растирали с эфиром, образованный твердый продукт фильтровали и сушили, получая 32 мг (46%) заглавного соединения в форме соли с HCl, т.пл. 114-116oC. 1H ЯМР-спектр: 1,42 (м, 1H), 1,66-1,84 (м, 1H), 2,70-2,94 (м, 2H), 3,00 (м, 1H), 3,30-3,46 (м, 1H), 3,80-3,94 (м, 2H), 4,10 (м, 1H), 4,20 (д, 1H), 7,40 (м, 3H), 7,64 (м, 5H); Cl-MS: 402 (M+1)+. ПРИМЕР 13 N-Бензил-(S)-фенилглицин Раствор 1,51 г (10,0 ммоль) (S)-фенилглицина в 5 мл 2 н водного раствора едкого натра обрабатывали 1,0 мл (10,0 ммоль) бензальдегида и перемешивали 20 мин при комнатной температуре. Раствор разбавляли 5 мл метанола, охлаждали до oC и осторожно обрабатывали 200 мг (5,3 ммоль) борогидрида натрия. Охлаждающую баню удаляли, и реакционную смесь перемешивали 1,5 ч при комнатной температуре. Реакционную смесь разбавляли 20 мл воды и экстрагировали 2 х 25 мл хлористого метилена. Водный слой подкисляли концентрированной соляной кислотой до pH 6 и образованный осадок отделяли фильтрованием, промывали 50 мл воды, 50 мл смеси метанол/диэтиловый эфир (1:1, об./об.) и 50 мл эфира и сушили, получая 1,83 г (76%) продукта, т.пл. 230-232oC. Анализ. Рассчитано для C15H15NO2: C 74,66; H 6,27; N 5,81 Найдено: C 74,17; H 6,19; N 5,86 ПРИМЕР 14 3-(S)-Фенил-4-бензил-2-морфолинон Смесь 4,00 г (16,6 ммоль) N-бензил-(S)-фенилглицина (из примера 13), 5,00 г (36,0 ммоль) карбоната калия, 10,0 мл 1,2-дибромэтана и 25 мл N,N-диметилформамида перемешивали 20 ч при 100oC. Смесь охлаждали и распределяли между 200 мл диэтилового эфира и 100 мл воды. Слои разделяли, и органический слой промывали водой 3х50 мл, сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали флэш-хроматографией на 125 г силикагеля, элюируя смесью гексаны/эфир (9: 1, об. /об., 4:1, об./об.). Получали 2,41 г (54%) продукта в виде твердого вещества, т.пл. 98-100oC. Масс-спектр (FAB): m/z 268 (M+H, 100%); 1H ЯМР-спектр (CDCl3, 200 МГц, м.д.):  2,54-2,68 (м, 1H), 2,96 (дт, J = 12,8, 2,8, 1H), 3,14 (д, J = 13,3, 1H), 3,75 (д, J = 13,3, 1H), 4,23 (с, 1H), 4,29-4,37 (м, 1H), 4,53 (дт, J = 3,2, 11,0), 7,20-7,56 (м, 10H).
Анализ. Рассчитано для C17H17NO2: 2,54-2,68 (м, 1H), 2,96 (дт, J = 12,8, 2,8, 1H), 3,14 (д, J = 13,3, 1H), 3,75 (д, J = 13,3, 1H), 4,23 (с, 1H), 4,29-4,37 (м, 1H), 4,53 (дт, J = 3,2, 11,0), 7,20-7,56 (м, 10H).
Анализ. Рассчитано для C17H17NO2:C 76,38; H 6,41; N 5,24 Найдено: C 76,06; H 6,40; N 5,78 ПРИМЕР 15 2-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенилморфолин Стадия A: 3,5-Бис(трифторметил)бензиловый спирт, трифторметансульфонатный эфир Раствор 1,00 г (4,1 ммоль) 3,5-бис(трифторметил)бензилового спирта и 1,05 г (5,12 ммоль) 2,6-ди-трет-бутил-4-метилпиридина в 45 мл сухого четыреххлористого углерода в атмосфере азота обрабатывали 0,74 мл (4,38 ммоль) ангидрида трифторметансульфокислоты при комнатной температуре. Вскоре после добавления ангидрида образовался белый осадок. Через 90 мин осадок фильтровали в атмосфере азота на фильтре Шленка, и фильтрат концентрировали в вакууме. Остаток, который был двухфазным маслом, растворяли в атмосфере азота в 10 мл сухого толуола. Полученный прозрачный раствор немедленно применяли в указанной ниже стадии B. Стадия B: 4-Бензил-2-(S)-(3,5-бис(трифторметил)бензилокси)- 3-(S)-фенилморфолин В раствор 0,500 г (1,87 ммоль) N-бензил-3-(S)-фенилморфолин-2-она (из примера 14) в 10 мл сухого ТГФ после охлаждения до -75oC в атмосфере азота добавляли по каплям 2,06 мл (2,06 ммоль) 1М раствора три(втор-бутил)борогидрида лития (L-Selectrid  ) в ТГФ. После перемешивания раствора при -75oC в течение 30 мин через канюлю добавляли трифторметансульфонатный эфир 3,5-бис(трифторметил)бензилового спирта таким образом, чтобы внутренняя температура была ниже -60oC. Образованный раствор перемешивали при -75oC в течение 1 ч и затем между -38 и -50oC в течение 2 ч. Раствор затем выливали в смесь 25 мл этилацетата и 20 мл насыщенного водного раствора бикарбоната натрия, и слои разделяли. Водную фазу экстрагировали этилацетатом 2х30 мл, объединенные органические слои сушили над сульфатом натрия, смесь фильтровали, и фильтрат концентрировали в вакууме. Остаток очищали флэш-хроматографией на 130 г диоксида кремния, элюируя 2 л смеси гексан/этилацетат (100:5). Получали 0,68 г (73%) масла, которое как было показано 1H ЯМР-спектроскопией, представляло собой смесь (20:1) цис- и транс-морфолинов. 1H-ЯМР-спектр (CDCl3, 400 МГц, м.д.): ) в ТГФ. После перемешивания раствора при -75oC в течение 30 мин через канюлю добавляли трифторметансульфонатный эфир 3,5-бис(трифторметил)бензилового спирта таким образом, чтобы внутренняя температура была ниже -60oC. Образованный раствор перемешивали при -75oC в течение 1 ч и затем между -38 и -50oC в течение 2 ч. Раствор затем выливали в смесь 25 мл этилацетата и 20 мл насыщенного водного раствора бикарбоната натрия, и слои разделяли. Водную фазу экстрагировали этилацетатом 2х30 мл, объединенные органические слои сушили над сульфатом натрия, смесь фильтровали, и фильтрат концентрировали в вакууме. Остаток очищали флэш-хроматографией на 130 г диоксида кремния, элюируя 2 л смеси гексан/этилацетат (100:5). Получали 0,68 г (73%) масла, которое как было показано 1H ЯМР-спектроскопией, представляло собой смесь (20:1) цис- и транс-морфолинов. 1H-ЯМР-спектр (CDCl3, 400 МГц, м.д.):  основной (цис)изомер: 2,37 (тд, J = 12, 3,6, 1H), 2,86 (прибл. т, J = 13,2H), 3,57 (д, J = 2,6, 1H), 3,63 (дк, J = 11,3, 1,6 1H), 3,89 (д, J = 13,3, 1H), 4,12 (тд, J = 11,6, 2,4, 1H), 4,40 (д, J = 13,6, 1H), 4,69 (д, J = 2,9, 1H), 4,77 (д, J = 13,6), 7,2-7,4 (м, 8H), 7,43 (c, 2H), 7,55 (шир. д, 2H), 7,69 (с, 1H).
Стадия C: 2-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(S)- фенилморфолин основной (цис)изомер: 2,37 (тд, J = 12, 3,6, 1H), 2,86 (прибл. т, J = 13,2H), 3,57 (д, J = 2,6, 1H), 3,63 (дк, J = 11,3, 1,6 1H), 3,89 (д, J = 13,3, 1H), 4,12 (тд, J = 11,6, 2,4, 1H), 4,40 (д, J = 13,6, 1H), 4,69 (д, J = 2,9, 1H), 4,77 (д, J = 13,6), 7,2-7,4 (м, 8H), 7,43 (c, 2H), 7,55 (шир. д, 2H), 7,69 (с, 1H).
Стадия C: 2-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(S)- фенилморфолинСмесь 0,68 г (1,37 ммоль) 4-бензил-2-(S)-(3,5-бис(трифторметил)бензилокси-3-(S)-фенилморфолина и 280 мг 10% Pd/C в 36 мл смеси этанол/вода (97:3) перемешивали 15 ч в атмосфере азота. Смесь фильтровали через целит, фильтровальную лепешку обильно промывали этанолом, и фильтрат концентрировали в вакууме. Остаток очищали флэш-хроматографией на 68 г оксида кремния, элюируя 1 л смеси гексан/эфир (33:67), затем 1 л смеси гексан/эфир (25: 75). Получали 0,443 г (80%) масла, которое как показала 1H ЯМР-спектроскопия, было чистым цис-морфолином. 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,8 (шир. с, 1H), 3,10 (дд, J = 12,5, 2,9, 1H), 3,24 (тд, J = 12,2, 3,6, 1H), 3,62 (дд, J = 11,3, 2,5, 1H), 4,04 (дт, J = 11,7, 3, 1H), 4,11 (д, J = 2,4, 1H), 4,49 (д, J = 13,5, 1H), 4,74 (д, J = 2,5, 1H), 4,80 (д, 13,3, 1H), 7,25-7,40 (м, 5H), 7,40 (с, 2H), 7,68 (с, 1H).
Анализ. Рассчитано для C19H17F6NO2: 1,8 (шир. с, 1H), 3,10 (дд, J = 12,5, 2,9, 1H), 3,24 (тд, J = 12,2, 3,6, 1H), 3,62 (дд, J = 11,3, 2,5, 1H), 4,04 (дт, J = 11,7, 3, 1H), 4,11 (д, J = 2,4, 1H), 4,49 (д, J = 13,5, 1H), 4,74 (д, J = 2,5, 1H), 4,80 (д, 13,3, 1H), 7,25-7,40 (м, 5H), 7,40 (с, 2H), 7,68 (с, 1H).
Анализ. Рассчитано для C19H17F6NO2:C 56,30; H 4,23; N 3,46; F 28,12 Найдено: C 56,30; H 4,29; N 3,34; F 27,94. ПРИМЕР 16 2(R)-(3,5-Бис(трифторметил)бензилокси)-3(R)-фенилморфолин Заглавное соединение получали из (R)-фенилглицина, применяя способы примеров 13, 14 и 15. ПРИМЕР 17 4-(3-(1,2,4-Триазоло)метил)-2-(S)-(3,5-бис(трифторметил)бензилокси)- 3-(S)-фенилморфолин Стадия A: N-формил-2-хлорацетамидразон Раствор 5 г (66,2 ммоль) хлорацетонитрила в 30 мл сухого метанола охлаждали до 0oC в атмосфере азота и обрабатывали 0,1 г (1,8 ммоль) метоксида натрия. Смесь оставляли для нагревания до комнатной температуры и перемешивали 30 мин, затем добавляли 0,106 мл (1,8 ммоль) уксусной кислоты. В полученную смесь затем добавляли 3,9 г (64,9 ммоль) гидразида муравьиной кислоты, и смесь перемешивали в течение 30 мин. Реакционную смесь концентрировали в вакууме, получая твердый продукт, который непосредственно применяли в указанной ниже стадии B. Стадия B: 4-(3-(1,2,4-Триазоло)метил)-2-(S)-(3,5- бис(трифторметил)бензилокси)-3-(S)-фенилморфолин Раствор 0,295 г (0,73 ммоль) 3-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенилморфолина (из примера 15) в 10 мл сухого ДМФ обрабатывали 0,302 г (2,18 ммоль) безводного карбоната калия и затем 0,168 г (1,24 ммоль) N-формил-2-хлорацетамидразона (из примера 17, стадия A), и суспензию перемешивали при 60oC в течение 4 ч. Смесь затем нагревали 4,5 ч при температуре до 120oC. После охлаждения реакционную смесь разбавляли 80 мл этилацетата, и органический слой промывали 3х20 мл воды. Органический слой сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на 67 г диоксида кремния, элюируя 1,5 л смеси хлористый метилен/метанол (100:2). Получали 0,22 г желтого твердого продукта, который перекристаллизовали из смеси гексан/хлористый метилен, получая 0,213 г (60%) белого кристаллического твердого продукта, т. пл. 134-135oC. Масс-спектр (FAB): m/z 487 (M+H, 100%), 259 (35%), 243 (65%), 227 (40%), 174 (25%), 1H ЯМР-спектр (CDCl3, 400 МГц, м. д.):  2,67 (тд, J = 11,9, 3,4, 1H), 2,90 (шир.д, J = 11,7, 1H), 3,43 (д, J = 15,2, 1H), 3,66 (прибл. дд, J = 13, 1,9, 2H), 3,88 (д, J = 15,1, 1H), 4,17 (тд, J = 11,7, 2,3, 1H), 4,42 (д, J = 13,5, 1H), 4,69 (д, J = 2,6, 1H), 4,77 (д, J = 13,5, 1H), 7,30-7,50 (м, 7H), 7,70 (с, 1H), 7,94 (c, 1H).
ПРИМЕР 18 2,67 (тд, J = 11,9, 3,4, 1H), 2,90 (шир.д, J = 11,7, 1H), 3,43 (д, J = 15,2, 1H), 3,66 (прибл. дд, J = 13, 1,9, 2H), 3,88 (д, J = 15,1, 1H), 4,17 (тд, J = 11,7, 2,3, 1H), 4,42 (д, J = 13,5, 1H), 4,69 (д, J = 2,6, 1H), 4,77 (д, J = 13,5, 1H), 7,30-7,50 (м, 7H), 7,70 (с, 1H), 7,94 (c, 1H).
ПРИМЕР 184-(3-(5-Оксо-1H,4H-1,2,4-триазоло)метил)-2-(S)-(3,5- бис(трифторметил)бензилокси)-3-(S)-фенилморфолин Стадия A: N-Метилкарбокси-2-хлорацетамидразон Раствор 5,0 г (66,2 ммоль) хлорацетонитрила в 35 мл сухого метанола охлаждали до 0oC и обрабатывали 0,105 г (1,9 ммоль) метоксида натрия. Ледяную баню убирали, и смесь перемешивали при комнатной температуре в течение 30 мин. В реакционную смесь затем добавляли 0,110 мл (1,9 ммоль) уксусной кислоты и затем 5,8 г (64,9 ммоль) метилгидразинкарбоксилата. После перемешивания 30 мин при комнатной температуре суспензию концентрировали в вакууме и оставляли при высоком вакууме на ночь, получая 10,5 г (98%) желтого продукта, который применяли в приведенной ниже стадии C. 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  3,71 (с, 3H), 4,06 (с, 2H).
Стадия B: 4-(2-(N-Метилкарбоксиацетамидразон)-2-(S)-(3,5- бис(трифторметил)бензилокси)-3-(S)-фенилморфолин 3,71 (с, 3H), 4,06 (с, 2H).
Стадия B: 4-(2-(N-Метилкарбоксиацетамидразон)-2-(S)-(3,5- бис(трифторметил)бензилокси)-3-(S)-фенилморфолинРаствор 2,30 г (5,7 ммоль) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенилморфолина (из примера 15), 1,13 г (6,8 ммоль) N-метилкарбокси-2-хлорацетамидразона (стадия A) и 1,50 мл (8,6 ммоль) N,N-диизопропилэтиламина в 25 мл ацетонитрила перемешивали при комнатной температуре в течение 20 ч. Продукт, который выпал в осадок, фильтровали, промывали 5 мл охлажденного льдом ацетонитрила и сушили, получая 1,83 г белого твердого вещества. Фильтрат концентрировали в вакууме, и остаток распределяли между 50 мл хлористого метилена и 20 мл воды. Слои разделяли, и органический слой сушили над сульфатом магния. Водный слой экстрагировали 50 мл хлористого метилена, экстракт сушили, объединяли с первым органическим слоем, и объединенный продукт концентрировали в вакууме. Остаток очищали флэш-хроматографией на 30 г силикагеля, элюируя смесью хлористый метилен/метанол/гидроксид аммония (50:1: 0,1, об. /об. /об. ). Таким образом, получали дополнительно 1,09 г продукта (общий выход 96%). Масс-спектр (FAB): m/z 535 (M+H, 100%), 462 (16%), 291 (30%), 226 (35%), 173 (25%); 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  2,53 (дт, J = 3,5, 12,2, 1H), 2,59 (д, J = 14,6, 1H), 2,94 (д, J = 11,8, 1H), 3,37 (д, J = 14,6, 1H), 3,58 (д, J = 2,8), 3,62-3,72 (м, 1H), 3,75 (с, 3H), 4,16 (дт, J = 2,2, 11,8, 1H), 4,44 (д,7 = 13,2, 1H), 4,70 (д, J = 2,8, 1H), 4,79 (д, J = 13,2), 5,55 (шир.с, 2H), 7,30-7,46 (м, 7H), 7,72 (с, 1H).
Стадия C: 2-(S)-(3,5-Бис(трифторметил)бензилокси)-4-(3-(5- оксо-1H,4H-1,2,4-триазоло)метил)-3-(S)-фенилморфолин 2,53 (дт, J = 3,5, 12,2, 1H), 2,59 (д, J = 14,6, 1H), 2,94 (д, J = 11,8, 1H), 3,37 (д, J = 14,6, 1H), 3,58 (д, J = 2,8), 3,62-3,72 (м, 1H), 3,75 (с, 3H), 4,16 (дт, J = 2,2, 11,8, 1H), 4,44 (д,7 = 13,2, 1H), 4,70 (д, J = 2,8, 1H), 4,79 (д, J = 13,2), 5,55 (шир.с, 2H), 7,30-7,46 (м, 7H), 7,72 (с, 1H).
Стадия C: 2-(S)-(3,5-Бис(трифторметил)бензилокси)-4-(3-(5- оксо-1H,4H-1,2,4-триазоло)метил)-3-(S)-фенилморфолинРаствор 2,89 г (5,4 ммоль) 4-(2-(N-метилкарбоксиацетамидразоно)-2-(S)-(3,5- бис(трифторметил)бензилокси)-3-(S)-фенилморфолина (из стадии B) в 36 мл ксилолов кипятили с обратным холодильником в течение 1,5 ч. Раствор охлаждали и концентрировали в вакууме. Остаток переносили в 50 мл смеси гексан/этилацетат (3: 1, об. /об.), которая вызывает кристаллизацию продукта. Продукт фильтровали и промывали, получая 1,85 г твердого вещества. Перекристаллизацией его из 30 мл смеси гексан/этилацетат (4:1, об./об.) получали 1,19 г чистого продукта в виде белого твердого вещества, т.пл. 156-157oC. Все жидкости после кристаллизации (маточные растворы), объединяли и концентрировали в вакууме. Остаток очищали флэш-хроматографией на 30 г силикагеля, элюируя смесью хлористый метилен/метанол/гидроксид аммония (50:1: 0,1, об. / об. /об.). Таким образом получали дополнительно 0,69 г твердого продукта. После трех перекристаллизаций из 20 мл смеси гексан/этилацетат (4: 1, об. /об) получали дополнительно 0,39 г чистого продукта в виде белого твердого вещества (всего 58%). Масс-спектр (FAB): m/z 503 (M+H), 259 (55%), 226 (40%), 160 (30%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  2,57 (прибл. т, J = 9,6, 1H), 2,87-2,97 (м, 2H), 3,58-3,71 (м, 3H), 4,18 (прибл. т, J = 10,4, 1H), 4,46 (д, J = 13,6), 4,68 (д, J = 2,8, 1H), 4,85 (д, J = 13,6, 1H), 7,30-7,45 (м, 7H), 7,64 (с, 1H), 10,40 (шир. с, 1H), 10,73 (шир. с, 1H).
ПРИМЕР 19 2,57 (прибл. т, J = 9,6, 1H), 2,87-2,97 (м, 2H), 3,58-3,71 (м, 3H), 4,18 (прибл. т, J = 10,4, 1H), 4,46 (д, J = 13,6), 4,68 (д, J = 2,8, 1H), 4,85 (д, J = 13,6, 1H), 7,30-7,45 (м, 7H), 7,64 (с, 1H), 10,40 (шир. с, 1H), 10,73 (шир. с, 1H).
ПРИМЕР 19N-(2-R)-Гидроксипропил)фенилглициналь, 3,5-бис(трифторметил)бензилацеталь Смесь 1,00 г (1,5 ммоль) 3,5-бис(трифторметил)бензилацеталя (+/-)-  -бромфенилацетальдегида (из примера 12), 1,25 мл (R)-1-амино-2-пропанола, 225 мг (1,5 ммоль) иодида натрия и 3,75 мл изопропанола кипятили с обратным холодильником в течение 20 ч. Раствор охлаждали и концентрировали до около 25% первоначального объема в вакууме. Концентрированный раствор распределяли между 50 мл эфира и 20 мл 2 н водного раствора едкого натра, и слои разделяли. Органический слой промывали 20 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией на 50 г силикагеля, применяя в качестве элюента смесь эфир/гексан (65: 35, об./об.) получали 948 мг (95% продукта в виде смеси (1:1) неразделяемых диастереомеров. Масс-спектр (FAB): m/z 664 (M+H, 25%), 420 (20%), 226 (100%).
ПРИМЕР 20 -бромфенилацетальдегида (из примера 12), 1,25 мл (R)-1-амино-2-пропанола, 225 мг (1,5 ммоль) иодида натрия и 3,75 мл изопропанола кипятили с обратным холодильником в течение 20 ч. Раствор охлаждали и концентрировали до около 25% первоначального объема в вакууме. Концентрированный раствор распределяли между 50 мл эфира и 20 мл 2 н водного раствора едкого натра, и слои разделяли. Органический слой промывали 20 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией на 50 г силикагеля, применяя в качестве элюента смесь эфир/гексан (65: 35, об./об.) получали 948 мг (95% продукта в виде смеси (1:1) неразделяемых диастереомеров. Масс-спектр (FAB): m/z 664 (M+H, 25%), 420 (20%), 226 (100%).
ПРИМЕР 20N-(2-(S)-Гидроксипропил)фенилглициналь, 3,5-бис(трифторметил)бензилацеталь Заменой (R)-1-амино-2-пропанола (S)-1-амино-2-пропанолом в эксперименте, идентичном предыдущему примеру, получали 940 мг (95%) продукта как смесь (1: 1) диастереомеров. ПРИМЕР 21 N-(2-(R)-Гидроксипропил)-N-(проп-2-енил)-(R)-фенилглициналь, 3,5-бис(трифторметил)бензилацеталь, и N-(2-(R)-гидроксипропил)-N-(проп-2-енил)-(S)-фенилглициналь, 3,5-бис(трифторметил)бензилацеталь. Смесь 933 мг (1,40 ммоль) 3,5-бис(трифторметил)бензилацеталя N-(2-(R)-гидроксипропил)фенилглициналя (из примера 19), 1 мл аллилбромида, 600 мг (4,3 ммоль) карбоната калия и 5 мл этанола перемешивали при 60 в течение 20 ч. Смесь охлаждали, распределяли между 100 мл эфира и 25 мл воды и слои разделяли. Флэш-хроматографией на 50 г силикагеля, применяя в качестве элюента смесь эфир/гексан (20:1, об./об), получали 380 мг (R,R)-аминоспирта (Rf = 0,72, элюент смесь эфир/гексан, 3:2, об./об.), 220 мг (R,S)-аминоспирта (Rf = 0,62, элюент смесь эфир/гексан, 3:2, об./об.) и 285 мг смеси диастереомерных аминоспиртов. Для (RR)-аминоспирта: масс-спектр (FAB): m/z 704 (M+H). ИК-спектр (чистое): 3476, 2932, 1624, 1454, 1361, 1278, 1175, 1132, 760, 704, 682. 1H ЯМР-спектр (CDCl3, 400 МГц, м. д.):  1,12 (д, 2H, J = 6,4), 2,19 и 2,62 (дABк, J2,19 = 2,3 J2,62 = 10,4), 2,97 (дд, 1H, J = 14,0, 8,8), 3,25-3,30 (м, 1H), 3,76 (с, 1H), 3,77-3,85 (м, 1H), 4,21 (д, 1H, J = 8,8), 4,49 и 4,55 (AB к, 2H, J = 12,4), 4,86 и 4,92 (AB, к, 2H, J = 12,4), 5,27-5,33 (м, 2H), 5,39 (д, 1H, J = 8,8), 5,79-5,89 (м, 1H), 7,21-7,26 (м, 4H), 7,35-7,40 (м, 3H), 7,67 (с, 1H), 7,81 (с, 1H), 7,85 (с, 2H).
Анализ. Рассчитано для C32H29F12NO3: 1,12 (д, 2H, J = 6,4), 2,19 и 2,62 (дABк, J2,19 = 2,3 J2,62 = 10,4), 2,97 (дд, 1H, J = 14,0, 8,8), 3,25-3,30 (м, 1H), 3,76 (с, 1H), 3,77-3,85 (м, 1H), 4,21 (д, 1H, J = 8,8), 4,49 и 4,55 (AB к, 2H, J = 12,4), 4,86 и 4,92 (AB, к, 2H, J = 12,4), 5,27-5,33 (м, 2H), 5,39 (д, 1H, J = 8,8), 5,79-5,89 (м, 1H), 7,21-7,26 (м, 4H), 7,35-7,40 (м, 3H), 7,67 (с, 1H), 7,81 (с, 1H), 7,85 (с, 2H).
Анализ. Рассчитано для C32H29F12NO3:C 54,63; H 4,15; N 1,99; F 32,41 Найдено: C 54,72; H 3,94; N 1,95; F 32,17. Для (RS)-аминоспирта: масс-спектр (FAB): m/z 704 (M+1). ИК-спектр (неразбавленное соединение): 3451, 2931, 1624, 1454, 1362, 1277, 704, 683. 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,09 (д, 3H, J = 6,0), 2,48 и 2,71 (дAB к, JAB = 13,2, J2,28 = 9,6, J2,62 = 3,6), 3,05 (дд, 1H, J = 14,4. 6,8), 3,34-3,39 (м, 1H), 3,35 (с, 1H), 3,76-3,81 (м, 1H), 4,21 (д, 1H, J = 8,4), 4,50 и 4,54 (AB к, 2H, J = 12,8), 4,86 и 4,96 (AB, к, 2H, J = 12,4), 5,10-5,17 (м, 2H), 5,39 (д, 1H, J = 8,4), 5,68-5,78 (м, 1H), 7,23-7,32 (м, 4H), 7,34-7,39 (м, 3H), 7,69 (с, 1H), 7,83 (с, 1H), 7,86 (с, 2H).
Анализ. Рассчитано для C32H29F12NO3: 1,09 (д, 3H, J = 6,0), 2,48 и 2,71 (дAB к, JAB = 13,2, J2,28 = 9,6, J2,62 = 3,6), 3,05 (дд, 1H, J = 14,4. 6,8), 3,34-3,39 (м, 1H), 3,35 (с, 1H), 3,76-3,81 (м, 1H), 4,21 (д, 1H, J = 8,4), 4,50 и 4,54 (AB к, 2H, J = 12,8), 4,86 и 4,96 (AB, к, 2H, J = 12,4), 5,10-5,17 (м, 2H), 5,39 (д, 1H, J = 8,4), 5,68-5,78 (м, 1H), 7,23-7,32 (м, 4H), 7,34-7,39 (м, 3H), 7,69 (с, 1H), 7,83 (с, 1H), 7,86 (с, 2H).
Анализ. Рассчитано для C32H29F12NO3:C 54,63; H 4,15; N 1,99; F 32,41 Найдено: C 54,80; H 4,16; N 1,90; F 32,36. ПРИМЕР 22 N-(2-(S)-Гидроксипропил)-N-(проп-2-енил)-(S)-фенилглициналь, 3,5-бис(трифторметил)бензилацеталь, и N-(2-(S)-гидроксипропил-N-(проп-2-енил)-(R)-фенилглициналь, 3,5-бис(трифторметил)бензилацеталь Применяя 880 мг (1,33 ммоль) N-(2-(S)-гидроксипропил)фенилглициналя, 3,5-бис(трифторметил)бензилацеталь, (пример 20) вместо N-(2-(R)-гидроксипропил)фенилглициналя, 3,5-бис(трифторметил)бензилацеталь, в экспериментах предыдущего примера получали 281 мг (S,S)аминоспирта (Rf = 0,72, элюент смесь эфир/гексан, 3:2, об. /об.), 367 мг (S,R)-аминоспирта (Rf = 0,62, элюент смесь эфир/гексан, 3: 2, об./об.) и 197 мг смеси диастереомерных аминоспиртов. ПРИМЕР 23 2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-6-(R)-метилморфолин и 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-6-(R)-метилморфолин Стадия A: 2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(R)- фенил-4-(2-пропенил)-6-(R)-метилморфолин и 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-4-(2-пропенил)-6-(R)-метилморфолин Раствор 355 мг (0,50 ммоль) N-(2-(R)-гидроксипропил)-N-(2-пропенил)-(R)-фенилглициналя, 3,3-бис(трифторметил)бензилацеталь (из примера 21) и 285 мг (1,5 ммоль) моногидрата п-толуолсульфокислоты в 5 мл толуола кипятили с обратным холодильником в течение 40 мин. Раствор охлаждали и распределяли между 40 мл эфира и 15 мл насыщенного водного раствора бикарбоната натрия. Слои разделяли, органический слой промывали 10 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией концентрата на 10 г силикагеля, элюируя смесью гексан/эфир (19:1, об./об.), получали 122 мг (2R,3R,6R)-продукта (Rf = 0,53, элюент смесь гексан/эфир, 4: 1, об./об.) и 62 мг (2S,3R,6R)-продукта (Rf= 0,23, элюент смесь гексан/эфир, 4:1, об./об.). Для (2R, 3R, 6R)-продукта: масс-спектр (FAB): m/z 460 (M+H, 65%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,35 (д, 3H, J = 6,4), 2,53 и 2,63 (дAB к, 2H, JAB = 12,0, J2,53 = 3,2, J2,63 = 6,9), 2,83-2,96 (м, 2H), 3,60 (д, 1H, J = 4,0), 4,27-4,32 (м, 1H), 4,57 и 4,84 (AB к, 2H, J = 13,2), 4,87 (д, 1H, J = 4,0), 5,08-5,13 (м, 2H), 5,76-5,86 (м, 1H), 7,31-7,37 (м, 3H), 7,50-7,52 (м, 2H), 7,58 (с, 2H), 7,71 (с, 1H).
Для (2S, 3R, 6R)-продукта: масс-спектр (FAB): m/z 460 (M+H, 65%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.): 1,35 (д, 3H, J = 6,4), 2,53 и 2,63 (дAB к, 2H, JAB = 12,0, J2,53 = 3,2, J2,63 = 6,9), 2,83-2,96 (м, 2H), 3,60 (д, 1H, J = 4,0), 4,27-4,32 (м, 1H), 4,57 и 4,84 (AB к, 2H, J = 13,2), 4,87 (д, 1H, J = 4,0), 5,08-5,13 (м, 2H), 5,76-5,86 (м, 1H), 7,31-7,37 (м, 3H), 7,50-7,52 (м, 2H), 7,58 (с, 2H), 7,71 (с, 1H).
Для (2S, 3R, 6R)-продукта: масс-спектр (FAB): m/z 460 (M+H, 65%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,37 (д, 3H, J = 6,8), 2,48-2,50 (м, 2H), 2,74 и 3,01 (дтAB к, 2H, J = 6,4, J = 1,2, 12,4), 3,84 (д, 1H, J = 3,6), 3,92-3,99 (м, 1H), 4,70, 4,93 (AB к, 2H, J = 13,6), 4,87 (д, 1H, J = 3,6), 5,08-5,14 (м, 2H), 5,74-5,84 (м, 1H), 7,28-7,36 (м, 3H), 7,43-7,46 (м, 2H), 7,64 (с, 2H), 7,75 (с, 1H).
Стадия B: 2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(R)- фенил-6-(R)-метилморфолин 1,37 (д, 3H, J = 6,8), 2,48-2,50 (м, 2H), 2,74 и 3,01 (дтAB к, 2H, J = 6,4, J = 1,2, 12,4), 3,84 (д, 1H, J = 3,6), 3,92-3,99 (м, 1H), 4,70, 4,93 (AB к, 2H, J = 13,6), 4,87 (д, 1H, J = 3,6), 5,08-5,14 (м, 2H), 5,74-5,84 (м, 1H), 7,28-7,36 (м, 3H), 7,43-7,46 (м, 2H), 7,64 (с, 2H), 7,75 (с, 1H).
Стадия B: 2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(R)- фенил-6-(R)-метилморфолинРаствор 115 мг (0,25 ммоль) 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-4-(2-пропенил)- 6-(R)-метилморфолина (из примера 22, стадия A) и 230 мг (0,25 ммоль) трис(трифенилфосфин)родийхлорида в 15 мл смеси ацетонитрил/вода (4:1, об./об.) 30 мин кипятили с обратным холодильником. Реакционную смесь охлаждали и распределяли между 50 мл этилацетата и 15 мл воды. Слои разделяли, и органический слой сушили над сульфатом магния. Водный слой экстрагировали 2х25 мл этилацетата, экстракты сушили и объединяли с первоначальным органическим слоем. Объединенный органический продукт концентрировали в вакууме. Остаток фильтровали через слой силикагеля (около 20 г), применяя в качестве растворителя смесь эфир/гексан (2:1, об./об.). Фильтрат концентрировали. Флэш-хроматографией концентрата с применением в качестве элюента смеси гексан/эфир (17:3, об./об.) получали 67 мг (64%) 2-(R)-(3,5-бис(трифторметил)бензилокси-3-(R)-фенил-6-(R)-метилморфолина в виде масла. Масс-спектр (FAB): m/z 420 (M+H, 90%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,21 (д, 3H, J = 6,4), 2,02 (шир. с, 1H), 2,67, 2,77 (д, AB к, 2H, JAB = 13,2, J2,67 = 8,8, J2,77 = 3,2), 3,89 (д, 1H, J = 2,4), 4,07-4,15 (м, 1H), 4,68 и 4,90 (AB к, 2H J = 12,8), 5,03 (д, 1H, J = 2,4), 7,28-7,38 (м, 3H), 7,51-7,53 (м, 2H), 7,77 (с, 2H), 7,79 (с, 1H).
Стадия C: 2-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил- 6-(R)-метилморфолин 1,21 (д, 3H, J = 6,4), 2,02 (шир. с, 1H), 2,67, 2,77 (д, AB к, 2H, JAB = 13,2, J2,67 = 8,8, J2,77 = 3,2), 3,89 (д, 1H, J = 2,4), 4,07-4,15 (м, 1H), 4,68 и 4,90 (AB к, 2H J = 12,8), 5,03 (д, 1H, J = 2,4), 7,28-7,38 (м, 3H), 7,51-7,53 (м, 2H), 7,77 (с, 2H), 7,79 (с, 1H).
Стадия C: 2-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил- 6-(R)-метилморфолинАналогичную реакцию проводили, применяя 55 мг (0,12 ммоль) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-4-(2-пропенил)- 6-(R)-метилморфолина (из примера 23, стадия A) и 111 мг (0,12 ммоль) трис(трифенилфосфин)родийхлорида в 12 мл смеси ацетонитрил/вода (4:1, об. /об.). Из продукта флэш-хроматографией на 4 г силикагеля, применяя в качестве элюента смесь хлористый метилен/ацетонитрил (50:1, об./об.), получали 14 мг (28%) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-6-(R)-метилморфолина в виде масла. Масс-спектр (FAB): m/z 420 (M+H, 90%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,39 (д, 3H, J = 6,8), 1,92 (шир. с, 1H), 2,84 и 2,95 (дAB к, 2H, JAB = 12,8, J2,84 = 6,4, J2,95 = 3,6), 3,93-4,00 (м, 1H), 4,07 (д, 1H, J = 2,8), 4,68 и 4,95 (AB к, 2H, J = 13,2), 4,93 (д, 1H, J = 2,8), 7,28-7,37 (м, 3H), 7,48-7,52 (м, 2H), 7,55 (с, 2H), 7,72 (с, 1H).
ПРИМЕР 24 1,39 (д, 3H, J = 6,8), 1,92 (шир. с, 1H), 2,84 и 2,95 (дAB к, 2H, JAB = 12,8, J2,84 = 6,4, J2,95 = 3,6), 3,93-4,00 (м, 1H), 4,07 (д, 1H, J = 2,8), 4,68 и 4,95 (AB к, 2H, J = 13,2), 4,93 (д, 1H, J = 2,8), 7,28-7,37 (м, 3H), 7,48-7,52 (м, 2H), 7,55 (с, 2H), 7,72 (с, 1H).
ПРИМЕР 242-(5)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-6-(S)-метилморфолин и 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-6-(S)-метилморфолин Заменой N-(2-(R)-гидроксипропил)-N-(2-пропенил)-(R)-фенилглициналя, как 3,5-бис(трифторметил)бензилацеталь, на 350 мг N-(2-(S)-гидроксипропил)-N-(2-пропенил)-(S)-фенилглициналя, как 3,5-бис(трифторметил)бензилацеталь (из примера 22) в эксперименте, аналогичном предыдущему примеру, получали 50 мг 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-6-(S)-метилморфолина и 14 мг 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-6-(S)- метилморфолина. ПРИМЕР 25 2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-6-(R)-метилморфолин и 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-6-(R-метилморфолин Стадия A: 2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-4-(2- пропенил)-6-(R)-метилморфолин и 2-(S)-(3,5-бис(трифторметил)бензилокси)- 3-(S)-фенил-4-(2-пропенил)-6-(R)-метилморфолин Заглавное соединение получали способом, аналогичным способу примера 23, стадия A. Циклизацию 300 мг (0,43 ммоль) N-(2-(R)-гидроксипропил)-N-(проп-2-енил)-(S)-фенилглициналя в виде 3,5-бис(трифторметил)бензилацеталя (из примера 23) проводили с применением 246 мг (1,29 ммоль) моногидрата п-толуолсульфокислоты и 5 мл толуола. Флэш-хроматографией на 8 г силикагеля, используя в качестве элюента смесь гексан/эфир (20:1, об./об.), получали 149 мг (75%) продукта как смесь неразделяемых диастереомеров. Масс-спектр (FAB): m/z 460 (M+H, 65%). Стадия B: 2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил- 6-(R)-метилморфолин и 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)- фенил-6-(R)-метилморфолин Раствор 150 мг (0,33 моль) 2-(R)-(3,5-бис(трифторметил)бензилокси)- 3-(S)-фенил-4-(2-пропенил)-6-(R)-метилморфолина и 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-4-(2-пропенил)- 6-(R)-метилморфолина (из примера 25, стадия A) и 318 мг (0,32 ммоль) трис(трифенилфосфин)родийхлорида в 20 мл смеси ацетонитрил/вода (4:1, об. /об. ) кипятили 1 ч с обратным холодильником. Флэш-хроматографией на 5 г силикагеля, применяя в качестве элюента смесь гексан/эфир (9:1, об./об.), получали 35 мг продукта как смесь и 26 мг 2-(R)-(3,6-бис(трифторметил)бензилокси)-3-(S)-фенил-6-(R)-метилморфолина (Rf = 0,22, элюент смесь гексан-эфир). Хроматографией смеси на 5 г силикагеля, применяя в качестве элюента смесь (20:1), получали 14 мг 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-6-(R)-метилморфолина (Rf = 0,14, элюент смесь гексан/эфир, 3:2, об./об) и 17 мг 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-6-(R)-метилморфолин (общий выход 41%). Для (2R, 3S, 6R)-продукта: (FAB): m/z 420 (M+H, 90%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,30 (д, 3H, J = 6,4), 1,74 (шир. с, 1H), 2,73 и 2,98 (дAB к, 2H, JAB = 11,8, J2,73 = 10,0, J2,98 = 2,4), 3,65 (д, 1H, J = 7,2), 3,89-3,94 (м, 1H), 4,45 (д, 1H, J = 7,2), 4,53 и 4,90 (AB к, 2H, J = 13,2), 7,28-7,38 (м, 3H), 7,41-7,43 (м, 2H), 7,45 (с, 2H), 7,70 (с, 1H).
Для (2S, 3S, 6R)-продукта: (FAB): m/z 420 (M+H, 90%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.): 1,30 (д, 3H, J = 6,4), 1,74 (шир. с, 1H), 2,73 и 2,98 (дAB к, 2H, JAB = 11,8, J2,73 = 10,0, J2,98 = 2,4), 3,65 (д, 1H, J = 7,2), 3,89-3,94 (м, 1H), 4,45 (д, 1H, J = 7,2), 4,53 и 4,90 (AB к, 2H, J = 13,2), 7,28-7,38 (м, 3H), 7,41-7,43 (м, 2H), 7,45 (с, 2H), 7,70 (с, 1H).
Для (2S, 3S, 6R)-продукта: (FAB): m/z 420 (M+H, 90%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,20 (д, 3H, J = 6,4), 2,04 (шир. с, 1H), 2,84 и 3,15 (дAB к, 2H, JAB = 12,8, J2,84 = 10,8, J3,15 = 2,8), 4,08 (д, 1H, J = 2,8), 4,09-4,15 (м, 1H), 4,53 и 4,80 (AB к, 2H, J = 13,2), 4,79 (д, 1H, J = 2,8), 7,28-7,38 (м, 5H), 7,43 (с, 2H), 7,70 (с, 1H).
ПРИМЕР 26 1,20 (д, 3H, J = 6,4), 2,04 (шир. с, 1H), 2,84 и 3,15 (дAB к, 2H, JAB = 12,8, J2,84 = 10,8, J3,15 = 2,8), 4,08 (д, 1H, J = 2,8), 4,09-4,15 (м, 1H), 4,53 и 4,80 (AB к, 2H, J = 13,2), 4,79 (д, 1H, J = 2,8), 7,28-7,38 (м, 5H), 7,43 (с, 2H), 7,70 (с, 1H).
ПРИМЕР 262-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-6-(S)-метилморфолин и 2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-6-(S)-метилморфолин Заменой N-(2-(R)-гидроксипропил)-N-(2-пропенил)-(R)-фенилглициналя, как 3,5-бис(трифторметил)бензилацеталь, на 250 мг N-(2-(S)-гидроксипропил)-N-(2-пропенил)-(S)-фенилглициналя, как 3,5-бис(трифторметил)бензилацеталь (из примера 22) в эксперименте, аналогичном предыдущему примеру, получали 42 мг 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-6-(S)-метилморфолина и 17 мг 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-6-(S)-метилморфолина ПРИМЕР 27 2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(R)- метилморфолин, 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил- 5-(R)-метилморфолин, 2-(R- или S)-(3,5-бис(трифторметил)бензилокси)- 3-(R)-фенил-5-(R)-метилморфолин и 2-(S или R)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-5-(R)-метилморфолин Проведением последовательности реакций, описанной в примере 19, при замене (R)-2-амино-1-пропанола на (R)-1-амино-2-пропанол, получали смесь 55 мг вещества с высоким значением Rf и 56 мг вещества с низким значением Rf. Вещество с высоким Rf обрабатывали аналогично примеру 23, стадия A, получая 10 мг вещества с высоким значением Rf (2-(R)-(3,5-бис(трифторметил)бензилокси)- 3-(S)-фенил-5-(R)-метилморфолин) и 7 мг вещества с низким значением Rf (2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(R)- метилморфолин). Вещество с низким значением Rf (после объединения с дополнительными 30 мг вещества) обрабатывали аналогично примеру 23, стадия A, получая 24 мг вещества с высоким Rf (2-(R- или S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-5-(R)- метилморфолин) и 18 мг вещества с низким Rf (2-(S- или R)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-5-(R)-метилморфолин). 2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(R)-метилморфолин. Масс-спектр (FAB): m/z 420 (M+H, 100%), 227 (50%), 192 (75%), 176 (65%), ЯМР-спектр (CDCl3, 400 МГц, м.д.):  0,98 (д, 3H, J = 6,3 Гц), 3,16-3,20 (м, 1H), 3,43-3,47 (м, 1H), 3,79 (д, 1H, J = 7,5 Гц), 3,91 (дд, 1H, J = 3,2 и 11,5 Гц), 4,51 (д, 2H, J = 13,4 Гц), 4,85 (д, 1H, J = 13,2 Гц), 7,29-7,45 (м, 7H), 7,67 (с, 1H).
2-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(5)-фенил-5-(R)-метилморфолин. Масс-спектр (FAB): m/z 420 (M+H, 48%), 227 (35%), 192 (39%), 176 (100%). ЯМР-спектр (CDCl3, 400 МГц, м.д.): 0,98 (д, 3H, J = 6,3 Гц), 3,16-3,20 (м, 1H), 3,43-3,47 (м, 1H), 3,79 (д, 1H, J = 7,5 Гц), 3,91 (дд, 1H, J = 3,2 и 11,5 Гц), 4,51 (д, 2H, J = 13,4 Гц), 4,85 (д, 1H, J = 13,2 Гц), 7,29-7,45 (м, 7H), 7,67 (с, 1H).
2-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(5)-фенил-5-(R)-метилморфолин. Масс-спектр (FAB): m/z 420 (M+H, 48%), 227 (35%), 192 (39%), 176 (100%). ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,10 (д, 3H, J = 6,4 Гц), 3,23-3,26 (м, 1H), 3,56-3,61 (м, 2H), 4,17 (д, 1H, J = 2,3 Гц), 4,51 (дд, 1H, J = 13,7 Гц), 4,71 (д, 1H, J = 2,4 Гц), 4,78 (д, 1H, J = 13,5 Гц), 7,28-7,39 (м, 7H), 7,68 (с, 1H).
2-(R или S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(R)- метилморфолин. Масс-спектр (FAB): m/z 281 (35%), 221 (55%), 207 (45%), 192 (40%), 147 (100%), ЯМР-спектр (CDCl3, 400 МГц, м.д.): 1,10 (д, 3H, J = 6,4 Гц), 3,23-3,26 (м, 1H), 3,56-3,61 (м, 2H), 4,17 (д, 1H, J = 2,3 Гц), 4,51 (дд, 1H, J = 13,7 Гц), 4,71 (д, 1H, J = 2,4 Гц), 4,78 (д, 1H, J = 13,5 Гц), 7,28-7,39 (м, 7H), 7,68 (с, 1H).
2-(R или S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(R)- метилморфолин. Масс-спектр (FAB): m/z 281 (35%), 221 (55%), 207 (45%), 192 (40%), 147 (100%), ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,13 (д, 3H, J = 6,6 Гц), 3,10-3,14 (м, 1H), 3,66 (дд, 1H, J = 6,6 и 11,4 Гц), 3,76 (дд, 1H, J = 3,5 и 11,2 Гц), 4,04 (д, 1H, J = 4,0 Гц), 4,61 (д,1H, J = 13,2 Гц), 4,74 (д, 1H, J = 3,9 Гц), 4,89 (д, 1H, 13,2 Гц), 7,26-7,35 (м, 3H), 7,47-7,49 (м, 2H), 7,64 (с, 1H), 7,74 (с, 1H).
2-(R или S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(R)- метилморфолин ЯМР-спектр (CDCl3, 400 МГц, м.д.): 1,13 (д, 3H, J = 6,6 Гц), 3,10-3,14 (м, 1H), 3,66 (дд, 1H, J = 6,6 и 11,4 Гц), 3,76 (дд, 1H, J = 3,5 и 11,2 Гц), 4,04 (д, 1H, J = 4,0 Гц), 4,61 (д,1H, J = 13,2 Гц), 4,74 (д, 1H, J = 3,9 Гц), 4,89 (д, 1H, 13,2 Гц), 7,26-7,35 (м, 3H), 7,47-7,49 (м, 2H), 7,64 (с, 1H), 7,74 (с, 1H).
2-(R или S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(R)- метилморфолин ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,36 (д, 3H, J = 6,7 Гц), 3,27-3,31 (м, 1H), 3,39 (дд, 1H, J = 2,2 и 11,3 Гц), 4,16 (дд, 1H, J = 3,2 и 11,0 Гц), 4,37 (д, 1H, J = 2,3 Гц), 4,53 (д, 1H, J = 13,5 Гц), 4,75 (д, 1H, J = 2,5 Гц), 4,81 (д, 1H, 13,6 Гц), 7,26-7,35 (м, 3H), 7,26-7,43 (м, 7H), 7,68 (с, 1H).
ПРИМЕР 28 1,36 (д, 3H, J = 6,7 Гц), 3,27-3,31 (м, 1H), 3,39 (дд, 1H, J = 2,2 и 11,3 Гц), 4,16 (дд, 1H, J = 3,2 и 11,0 Гц), 4,37 (д, 1H, J = 2,3 Гц), 4,53 (д, 1H, J = 13,5 Гц), 4,75 (д, 1H, J = 2,5 Гц), 4,81 (д, 1H, 13,6 Гц), 7,26-7,35 (м, 3H), 7,26-7,43 (м, 7H), 7,68 (с, 1H).
ПРИМЕР 282-(R или S)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)- метилморфолин, 2-(S или R)-(3,5-бис(трифторметил)бензилокси)-3-(S)- фенил-5-(S)-метилморфолин и 2-(R)-(3,5-бис(трифторметил)бензилокси)- 3-(R)-фенил-5-(S)-метилморфолин Проведением последовательности реакций, описанной в примере 19, заменяя (S)-2-амино-1-пропанол на (R)-1-амино-2-пропанол, получали смесь 78 мг вещества с высоким значением Rf и 70 мг вещества с низким значением Rf. Вещество с высоким Rf обрабатывали аналогично примеру 23, стадия A, получая менее 1 мг вещества с высоким значением Rf (2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(3)-метилморфолин) и 9 мг вещества с низким значением Rf (2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)-метилморфолин). Вещество с низким значением Rf обрабатывали аналогично примеру 23, стадия A, получая 20 мг вещества с высоким Rf (2-(R- или S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)-метилморфолин) и 14 мг вещества с низким Rf (2-(S- или R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)-метилморфолин). 2-(R- или S)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)- метилморфолин Масс-спектр (FAB): m/z 420 (M+H, 60%), 227 (68%), 192 (56%), 176 (100%), ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,12 (д, 3H, J = 6,6 Гц), 3,09-3,14 (м, 1H), 3,65 (дд, 1H, J = 6,6 и 11,0 Гц), 3,75 (дд, 1H, J = 3,6 и 11,1 Гц), 4,04 (д, 1H, J = 3,9 Гц), 4,61 (д, 1H, J = 13,2 Гц), 4,73 (д, 1H, J = 3,9 Гц), 4,89 (д, 1H, 13,2 Гц), 7,28-7,35 (м, 3H), 7,47 (д, 2H, 7,0 Гц) 7,64 (с, 1H), 7,74 (с, 1H).
2-(S или R)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)- метилморфолин 1,12 (д, 3H, J = 6,6 Гц), 3,09-3,14 (м, 1H), 3,65 (дд, 1H, J = 6,6 и 11,0 Гц), 3,75 (дд, 1H, J = 3,6 и 11,1 Гц), 4,04 (д, 1H, J = 3,9 Гц), 4,61 (д, 1H, J = 13,2 Гц), 4,73 (д, 1H, J = 3,9 Гц), 4,89 (д, 1H, 13,2 Гц), 7,28-7,35 (м, 3H), 7,47 (д, 2H, 7,0 Гц) 7,64 (с, 1H), 7,74 (с, 1H).
2-(S или R)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)- метилморфолинМасс-спектр (FAB): m/z 420 (M+H, 50%), 227 (45%), 192 (40%), 176 (100%). ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,36 (д, 3H, J = 6,9 Гц), 3,27-3,29 (м, 1H), 3,39 (дд, 1H, J = 2,2 и 11,1 Гц), 4,15 (дд, 1H, J = 3,3 и 11,1 Гц), 4,37 (д, 1H, J = 2,5 Гц), 4,52 (д, 1H, J = 13,3 Гц), 4,75 (д, 1H, J = 2,4 Гц), 4,81 (д, 1H, 13,5 Гц), 7,28-7,43 (м, 7H), 7,68 (с, 1H).
2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(S)-метилморфолин 1,36 (д, 3H, J = 6,9 Гц), 3,27-3,29 (м, 1H), 3,39 (дд, 1H, J = 2,2 и 11,1 Гц), 4,15 (дд, 1H, J = 3,3 и 11,1 Гц), 4,37 (д, 1H, J = 2,5 Гц), 4,52 (д, 1H, J = 13,3 Гц), 4,75 (д, 1H, J = 2,4 Гц), 4,81 (д, 1H, 13,5 Гц), 7,28-7,43 (м, 7H), 7,68 (с, 1H).
2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(S)-метилморфолинЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,10 (д, 3H, J = 6,4 Гц), 3,22-3,25 (м, 1H), 3,55-3,60 (м, 2H), 4,17 (д, 1H, J = 2,3 Гц), 4,51 (д, 1H, J = 13,5 Гц), 4,71 (д, 1H, J = 2,4 Гц), 4,77 (д, 1H, J = 13,6 Гц), 7,28-7,38 (м, 7H), 7,67 (с, 1H).
ПРИМЕР 29 1,10 (д, 3H, J = 6,4 Гц), 3,22-3,25 (м, 1H), 3,55-3,60 (м, 2H), 4,17 (д, 1H, J = 2,3 Гц), 4,51 (д, 1H, J = 13,5 Гц), 4,71 (д, 1H, J = 2,4 Гц), 4,77 (д, 1H, J = 13,6 Гц), 7,28-7,38 (м, 7H), 7,67 (с, 1H).
ПРИМЕР 292-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(R)-фенилморфолин, 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(R)-фенилморфолин и 2-(R или S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-5-(R)-фенилморфолин Проведением последовательности реакций, описанной в примере 19, заменяя (R)-2-амино-2-пропанол на (R)-2-амино-2-фенилэтанол, получали смесь 62 мг вещества с высоким значением Rf и 52 мг вещества с низким значением Rf. Вещество с высоким Rf обрабатывали аналогично примеру 23, стадия A, получая 16 мг вещества с высоким значением Rf (2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(R)-фенилморфолин) и 4 мг вещества с низким значением Rf (2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(R)-фенилморфолин). Вещество с низким значением Rf обрабатывали аналогично примеру 23, стадия A, получая 4 мг 2-(R- или S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-5-(R)-фенилморфолин). 2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(R)-фенилморфолин ЯМР-спектр (CDCl3, 400 МГц, м.д.):  3,62 (т, 1H, J = 10,7 и 21,5 Гц), 3,93 (д, 1H, J = 7,4 Гц), 3,99 (дд, 1H, J = 3,1 и 11,2 Гц), 4,18 (дд, 1H, J = 3,0 и 10,2 Гц), 4,46 (д, 1H, J = 7,4 Гц), 4,53 (д, 1H, J = 13,5 Гц), 4,89 (д, 1H, J = 13,3 Гц), 7,28-7,55 (м, 12H), 7,69 (с, 1H).
2-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(R)-фенилморфолин 3,62 (т, 1H, J = 10,7 и 21,5 Гц), 3,93 (д, 1H, J = 7,4 Гц), 3,99 (дд, 1H, J = 3,1 и 11,2 Гц), 4,18 (дд, 1H, J = 3,0 и 10,2 Гц), 4,46 (д, 1H, J = 7,4 Гц), 4,53 (д, 1H, J = 13,5 Гц), 4,89 (д, 1H, J = 13,3 Гц), 7,28-7,55 (м, 12H), 7,69 (с, 1H).
2-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(R)-фенилморфолинЯМР-спектр (CDCl3, 400 МГц, м.д.):  3,67 (дд, 1H, J = 3,5 и 11,0 Гц), 3,89 (д, 1H, J = 10,8 и 21,6 Гц), 4,25 (дд, 1H, J = 3,3 и 11,0 Гц), 4,34 (д, 1H, J = 2,2 Гц), 4,52 (д, 1H, J = 13,8 Гц), 4,78-4,87 (м, 2H), 7,28-7,51 (м, 12H), 7,69 (с, 1H).
2-(R или S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(R)- фенилморфолин 3,67 (дд, 1H, J = 3,5 и 11,0 Гц), 3,89 (д, 1H, J = 10,8 и 21,6 Гц), 4,25 (дд, 1H, J = 3,3 и 11,0 Гц), 4,34 (д, 1H, J = 2,2 Гц), 4,52 (д, 1H, J = 13,8 Гц), 4,78-4,87 (м, 2H), 7,28-7,51 (м, 12H), 7,69 (с, 1H).
2-(R или S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(R)- фенилморфолинЯМР-спектр (CDCl3, 400 МГц, м.д.):  4,10-4,25 (м, 2H), 4,30-4,38 (м, 1H), 4,48-4,54 (м, 1H), 4,59-4,66 (м, 1H), 4,86-5,00 (м, 2H), 7,25-7,74 (м, 13H).
ПРИМЕР 30 4,10-4,25 (м, 2H), 4,30-4,38 (м, 1H), 4,48-4,54 (м, 1H), 4,59-4,66 (м, 1H), 4,86-5,00 (м, 2H), 7,25-7,74 (м, 13H).
ПРИМЕР 302-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(S)- фенилморфолин, 2(R)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-5-(S)- фенилморфолин, 2-(R или S)-(3,5-бис(трифторметил)бензилокси)-3-(S)- фенил-5-(S)-фенилморфолин и 2-(R или S)-(3,5-бис(трифторметил)бензилокси)- 3-(S)-фенил-5-(S)-фенилморфолин Проведением последовательности реакций, описанной в примере 19, заменяя (R)-1-амино-2-пропанол на (S)-2-амино-2-фенилэтанол, получали смесь 75 мг вещества с высоким значением Rf и 64 мг вещества с низким значением Rf. Вещество с высоким Rf обрабатывали аналогично примеру 23, стадия A, получая 23 мг вещества с высоким значением Rf (2-(S)-(3,5-бис)трифторметил)бензилокси)-3-(R)-фенил-5-(S)-фенилморфолин [L-740, 930]) и 7 мг вещества с низким значением Rf (2-(R)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенил-5-(S)-фенилморфолин). Вещество с низким значением Rf обрабатывали аналогично примеру 23, стадия A, получая 26 мг вещества с высоким Rf (2-(R- или S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)-фенилморфолин) и 6 мг вещества с низким Rf ((2-(R- или S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)-фенилморфолин)). 2-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(S)-фенилморфолин ЯМР-спектр (CDCl3, 400 МГц, м.д.):  3,60-3,74 (м, 1H), 3,94 (д, 1H, J = 7,6 Гц), 4,00 (дд, 1H, J = 3,2 и 11,3 Гц), 4,18-4,21 (м, 1H), 4,50-4,55 (м, 2H), 4,89 (м, 1H), 7,26-7,55 (м, 12H), 7,69 (с, 1H).
2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(S)-фенилморфолин 3,60-3,74 (м, 1H), 3,94 (д, 1H, J = 7,6 Гц), 4,00 (дд, 1H, J = 3,2 и 11,3 Гц), 4,18-4,21 (м, 1H), 4,50-4,55 (м, 2H), 4,89 (м, 1H), 7,26-7,55 (м, 12H), 7,69 (с, 1H).
2-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенил-5-(S)-фенилморфолинЯМР-спектр (CDCl3, 400 МГц, м.д.):  3,68 (дд, 1H, J = 3,0 и 11,0 Гц), 3,88-3,94 (м, 1H), 4,26-4,30 (м, 1H), 4,36 (с, 1H), 4,52 (д, 1H, J = 13,5 Гц), 4,77-4,86 (м, 2H), 7,27-7,51 (м, 12H), 7,69 (с, 1H).
2-(R или S)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)- фенилморфолин 3,68 (дд, 1H, J = 3,0 и 11,0 Гц), 3,88-3,94 (м, 1H), 4,26-4,30 (м, 1H), 4,36 (с, 1H), 4,52 (д, 1H, J = 13,5 Гц), 4,77-4,86 (м, 2H), 7,27-7,51 (м, 12H), 7,69 (с, 1H).
2-(R или S)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)- фенилморфолинЯМР-спектр (CDCl3, 400 МГц, м.д.):  3,93-3,95 (м, 1H), 4,06-4,21 (м, 2H), 4,38-4,42 (м, 1H), 4,59-4,68 (м, 2H), 4,83-4,94 (м, 2H), 7,25-7,81 (м, 13H).
2-(R или S)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)- метилморфолин 3,93-3,95 (м, 1H), 4,06-4,21 (м, 2H), 4,38-4,42 (м, 1H), 4,59-4,68 (м, 2H), 4,83-4,94 (м, 2H), 7,25-7,81 (м, 13H).
2-(R или S)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-5-(S)- метилморфолинЯМР-спектр (CDCl3, 400 МГц, м.д.):  3,43-3,59 (м, 2H), 3,82 (д, 1H, J = 7,2 Гц), 4,25 (д, 1H, J = 12,5 Гц), 4,52-4,63 (м, 3H), 4,80-4,90 (шир. с, 1H), 7,11-7,81 (м, 13H).
ПРИМЕР 31 3,43-3,59 (м, 2H), 3,82 (д, 1H, J = 7,2 Гц), 4,25 (д, 1H, J = 12,5 Гц), 4,52-4,63 (м, 3H), 4,80-4,90 (шир. с, 1H), 7,11-7,81 (м, 13H).
ПРИМЕР 312-(S)-(3,5-Бис(трифторметил)бензилокси)-6-(R)-метил-3-(S)-фенил- 4-(3-(1,2,4-триазоло)метил)морфолин В соответствии со способом, данным в примере 17, стадия B, реакцией 98 мг (0,24 ммоль) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-6-(R)-метилморфолина (из примера 25), 38 мг (0,28 ммоль) N-формил-2-хлорацетамидразона (из примера 17, стадия A) и 97 мг (0,7 ммоль) безводного карбоната калия и последующей флэш-хроматографией продукта на 28 г силикагеля при элюировании 1 л смеси хлористый метилен/метанол/водный аммоний (100:4:0,5) получали желтое твердое вещество, которое перекристаллизовали из смеси гексан/хлористый метилен. Получали 77 мг (66%) 2-(S)-(3,5-бис(трифторметил)бензилокси)- 6-(R)-метил-3-(S)-фенил-4-(3-(1,2,4-триазоло)метил)морфолина в виде белого порошка. ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,17 (д, J = 6,3, 3H), 2,29 (т, J = 11,1, 1H), 2,92 (д, J = 11,1, 1H), 3,42 (д, J = 15,3, 1H), 3,58 (с, 1H), 3,88 (д, J = 15,4, 1H), 4,20-4,33 (м, 1H), 4,43 (д, 13,5, 1H), 4,71 (д, J = 2,4, 1H), 4,74 (д, J = 13,3, 1H), 7,30-7,55 (м, 7H), 7,69 (с, 1H), 7,95 (с, 1H).
ПРИМЕР 32 1,17 (д, J = 6,3, 3H), 2,29 (т, J = 11,1, 1H), 2,92 (д, J = 11,1, 1H), 3,42 (д, J = 15,3, 1H), 3,58 (с, 1H), 3,88 (д, J = 15,4, 1H), 4,20-4,33 (м, 1H), 4,43 (д, 13,5, 1H), 4,71 (д, J = 2,4, 1H), 4,74 (д, J = 13,3, 1H), 7,30-7,55 (м, 7H), 7,69 (с, 1H), 7,95 (с, 1H).
ПРИМЕР 322-(S)-(3,5-Бис(трифторметил)бензилокси)-6-(R)-метил-4-(3-(5- оксо-1H, 4H-1,2,4-триазоло)метил)-3-(S)-фенил)морфолин Смесь 96 мг (0,23 ммоль) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-6-(R)-метилморфолина (из примера 25), 46 мг (0,28 ммоль) N-метилкарбокси-2-хлорацетамидразона и 95 мг (0,69 ммоль) безводного карбоната калия в 3 мл сухого ДМФ перемешивали при комнатной температуре в течение 20 мин, затем при 60oC в течение 90 мин и при 120oC в течение 2 ч. Смесь охлаждали до комнатной температуры, переносили в 15 мл этилацетата и промывали 3х10 мл воды. Объединенные водные слои обратно экстрагировали 10 мл этилацетата, объединенные органические слои промывали 10 мл соляного раствора, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на 28 г силикагеля, элюируя 1 л смеси хлористый метилен/метанол (100:4). Получали 65 мг (55%) 2-(S)-(3,5-бис(трифторметил)бензилокси)-6-(R)-метил-4-(3-(5-оксо-1H, 4H- 1,2,4-триазоло)метил)-3-(S)-фенил)морфолин в виде желтого порошка. ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,18 (д, J = 6,2, 3H), 2,15 (т, J = 11,1, 1H), 2,89 (д, J = 14,2H), 3,49 (д, J = 2,2, 1H), 3,61 (д, J = 14,4, 1H), 4,20-4,30 (м, 1H), 4,45 (д, 13,6, 1H), 4,67 (д, J = 2,5, 1H), 4,79 (д, J = 13,5, 1H), 7,25-7,50 (м, 7H), 7,62 (с, 1H), 10,07 (с, 1H), 10,35 (с, 1H).
ПРИМЕР 33 1,18 (д, J = 6,2, 3H), 2,15 (т, J = 11,1, 1H), 2,89 (д, J = 14,2H), 3,49 (д, J = 2,2, 1H), 3,61 (д, J = 14,4, 1H), 4,20-4,30 (м, 1H), 4,45 (д, 13,6, 1H), 4,67 (д, J = 2,5, 1H), 4,79 (д, J = 13,5, 1H), 7,25-7,50 (м, 7H), 7,62 (с, 1H), 10,07 (с, 1H), 10,35 (с, 1H).
ПРИМЕР 332-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенилморфолин Стадия A: 4-Бензил-2-(S)-гидрокси-3-(R)-фенилморфолин Раствор 3,72 г (13,9 ммоль) 4-бензил-3-(R)-фенил-2-морфолинона, полученного из (R)-фенилглицина, как описано в примере 14, в 28 мл CH2Cl2 охлаждали в бане с температурой -78oC в атмосфере азота и добавляли в него 14 мл 1,5 М раствора ДИБАГ (21 ммоль) в толуоле. После перемешивания раствора в течение 0,5 ч его оставляли для нагревания до -50oC и выдерживали при этой температуре в течение 0,5 ч. Реакционную смесь гасили добавлением 10 мл водного тартрата калия и натрия. Смесь разбавляли CH2Cl2, и слои разделяли. Водный слой экстрагировали 3 раза хлористым метиленом. Слои CH2Cl2 промывали соляным раствором, сушили над Na2SO4 и фильтровали. Концентрацией фильтрата получали 3,32 г (88%) 4-бензил-2-(S)-гидрокси-3-(R)-фенилморфолина, пригодного для применения в следующей стадии. ЯМР-спектр (CDCl3, 400 МГц, м.д.):  2,28 (м, 1H), 2,71 (м, 1H), 2,91 (д, J = 13 Гц, 1H), 3,09 (д, J = 6 Гц, 1H), 3,69 (д, J = 13,1H), 3,82 (тд, J = 10 Гц и 2 Гц, 1H), 3,91 (д, J = 10 Гц, 1H), 4,73 (т, J = 6 Гц, 1H), 7,2-7,52 (м, 10H).
Стадия B: 4-Бензил-2-(S)-(3,5-бис(трифторметил)бензилокси-3-(R)- фенилморфолин 2,28 (м, 1H), 2,71 (м, 1H), 2,91 (д, J = 13 Гц, 1H), 3,09 (д, J = 6 Гц, 1H), 3,69 (д, J = 13,1H), 3,82 (тд, J = 10 Гц и 2 Гц, 1H), 3,91 (д, J = 10 Гц, 1H), 4,73 (т, J = 6 Гц, 1H), 7,2-7,52 (м, 10H).
Стадия B: 4-Бензил-2-(S)-(3,5-бис(трифторметил)бензилокси-3-(R)- фенилморфолинВ суспензию 0,592 г (14,8 ммоль) NaH в 30 мл сухого ТГФ при 0oC добавляли 3,32 г (12,3 ммоль) 4-бензил-2-(S)-гидрокси-3-(R)-фенилморфолина, полученного на стадии A. Через 15 мин добавляли 0,915 г иодида тетрабутиламмония (2,47 ммоль) и 2,4 мл (13 ммоль) 3,5-бис(трифторметил)бензилбромида. Образованную смесь перемешивали при температуре бани со льдом в течение 1 ч, затем выливали в насыщенный раствор NaHCO3 и экстрагировали этилацетатом (EtOAc). Органические слои объединяли, промывали соляным раствором, сушили над Na2SO4 и фильтровали. Фильтрат концентрировали в вакууме, и остаток хроматографировали на высокоэффективном жидкостном хроматографе (ВЭЖХ) Waters Prep 500, применяя 50% EtoAc/гексан, чтобы выделить 3,6 г (59%) 4-бензил-2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенилморфолина. 1H ЯМР-спектр (CDCl3): 2,3 (тд, J = 11 Гц и 3 Гц, 1H), 2,71 (д, J = 11 Гц, 1H), 2,90 (д, J = 13 Гц, 1H), 3,22 (д, J = 7,3 Гц, 1H), 3,75 (м, 2H), 3,93 (м, 1H), 4,43 (д, J = 13 Гц, 1H), 4,45 (д, J = 7,3 Гц, 1H), 4,82 (д, J = 13 Гц, 1H), 7,19-7,5 (м, 12H), 7,67 (с, 1H). Стадия C: 2-(S)-(3,5-Бис(трифторметил)бензилокси)-3-(R)-фенилморфолин Раствор 3,6 г (7,27 ммоль) 4-бензил-2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенилморфолина в 100 мл этанола и 5 мл воды, содержащий 0,72 г 10% Pd/C, гидрировали в аппарате Парра в течение 36 ч. Катализатор отделяли фильтрованием и тщательно промывали EtOAc. Фильтрат концентрировали, и остаток распределяли между водой и EtOAc. Слой EtOAc промывали соляным раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали флэш-хроматографией, применяя градиент 10-60% EtOAc/гексан. Таким образом выделяли 2,05 г (70%) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(R)-фенилморфолина 1H ЯМР-спектр (CDCl3): 1,92 (шир. с, 1H), 2,91 (м, 1H), 3,05 (тд, J = 11 Гц и 3 Гц, 1H), 3,68 (д, J = 7 Гц, 1H), 3,81 (тд, J = 11 Гц и 3 Гц, 1H), 4,01 (м, 1H), 4,44 (д, J = 7 Гц), 4,5 (д, J = 13 Гц, 1H), 4,85 (д, J = 13 Гц, 1H), 7,28-7,42 (м, 7H), 7,67 (с, 1H). ПРИМЕР 34 4-(3-(1,2,4-Триазоло)метил)-2-(S)-(3,5-бис(трифторметил)бензилокси)- 3-(R)-фенилморфолин Целевое соединение получали способом примера 17, стадия B, применяя продукт примера 33, стадия C, в качестве исходного соединения. 1H ЯМР-спектр (CDCl3): 1,75 (шир. с, 1H), 2,61 (тд, J = 12 Гц, 1H), 2,83 (д, J = 12 Гц, 1H), 3,33 (д, J = 7 Гц, 1H), 3,48 (д, J = 15 Гц, 1H), 3,78 (д, J = 15 Гц, 1H), 3,85 (м, 1H), 3,99 (м, 1H), 4,44 (д, J = 13 Гц, 1H), 4,49 (д, J = 7 Гц, 1H), 4,81 (д, J = 13 Гц, 1H), 7,23-7,45 (м, 7H), 7,67 (с, 1H), 7,96 (с, 1H). ПРИМЕР 35 4-(3-(5-Оксо-1H,4H-1,2,4-триазоло)метил)-2-(S)-(3,5- бис(трифторметил)бензилокси)-3-(R)-фенилморфолин Целевое соединение получали способом примера 18, стадии B и C, применяя продукт примера 33, стадия C, в качестве исходного соединения. ПРИМЕР 36 4-(2-(Имидазоло)метил)-2-(S)-(3,5-бис(трифторметил)бензилокси)- 3-(S)-фенилморфолин Раствор 101 мг (0,25 ммоль) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенилморфолина (пример 15), 98 мг (1,0 ммоль) имидазол-2-карбоксальдегида и 5 капель ледяной уксусной кислоты в 3 мл метанола обрабатывали 1,5 мл 1 М раствора цианоборогидрида натрия в ТГФ. Через 16 ч реакцию гасили 5 мл насыщенного водного раствора бикарбоната натрия и распределяли между 40 мл этилацетата 20 мл воды. Органический слой отделяли, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией концентрата на 8 г силикагеля, применяя в качестве элюента смесь хлористый метилен/метанол/гидроксид аммония (50: 1:0,1), получали 54 мг (выход 44%) заглавного соединения в виде белого твердого вещества. 1H ЯМР-спектр (CDCl3): 2,60 (дт, J = 3,2 Гц, 12,4 Гц, 1H), 2,85 (д, J = 12,4 Гц, 1H), 3,28 (д, J = 14,4 Гц, 1H), 3,59 (д, J = 2,8 Гц, 1H), 3,66 (дд, J = 2,0, 11,6 Гц, 1H), 3,84 (д, J = 14,4 Гц, 1H), 3,94 (прибл. с, 26), 4,14 (дт, J = 2,2, 12,0 Гц, 1H), 4,43 (д, J = 13,6 Гц, 1H), 4,71 (д, J = 2,8 Гц, 1H), 4,78 (д, J = 13,6 Гц, 1H), 6,99 (прибл. с, 2H), 7,25-7,48 (м, 6H), 7,72 (с, 1H). Масс-спектр (FA): m/z 486 (100%, M+H). ПРИМЕР 37 4-(2-(Имидазоло)метил)-2-(S)-(3,5-бис(трифторметил)бензилокси)- 3-(R)-фенилморфолин Заглавное соединение получали способом примера 36, применяя соответствующие исходные соединения. 1H ЯМР-спектр (CDCl3): 2,53 (дт, J = 11 Гц и 3 Гц, 1H) 2,74 (д, J = 12,4 Гц, 1H), 3,23 (д, J = 7 Гц, 1H), 3,32 (д, J = 15 Гц, 1H), 3,66 (д, J = 15 Гц, 1H), 3,77 (тд, J = 11 Гц и 2 Гц, 1H), 3,99 (м, 1H), 4,44 (м, 2H), 4,8 (д, J = 13 Гц, 1H), 6,94 (с, 2H), 7,2-7,45 (м, 7H), 7,67 (с, 1H). ПРИМЕР 38 4-(5-(Имидазоло)метил)-2-(S)-(3,5-бис(трифторметил)бензилокси)- 3-(R)-фенилморфолин Заглавное соединение получали способом примера 36, применяя соответствующие исходные соединения. 1H ЯМР-спектр (CDCl3): 2,47 (дт, J = 12 Гц и 3 Гц, 1H), 2,83 (д, J = 12 Гц, 1H), 3,2 (м, 2H), 3,61 (д, J = 14 Гц, 1H), 3,79 (тд, J = 12 Гц и 2 Гц, 1H), 3,96 (м, 1H), 4,44 (м, 2H), 4,8 (д, J = 13 Гц, 1H), 6,81 (с, 2H), 7,28-7,45 (м, 7H), 7,60 (с, 1H), 7,66 (с, 1H). ПРИМЕР 39 4-(Аминокарбонилметил)-2-(S)-(3,5-бис(трифторметил)бензилокси)- 3-(R)-фенилморфолин Заглавное соединение получали способом примера 15, применяя соответствующие исходные соединения. 1H ЯМР-спектр (CDCl3): 2,54 (дт, J = 11 Гц и 2 Гц, 1H), 2,64 (д, J = 17 Гц, 1H), 2,93 (д, J = 12 Гц, 1H), 3,14 (д, J = 17 Гц, 1H), 3,27 (д, J = 7 Гц, 1H), 3,83 (тд, J = 11 Гц и 2 Гц, 1H), 4,05 (м, 1H), 4,46 (м, 2H), 4,81 (д, J = 13 Гц, 1H), 5,62 (шир. с, 1H), 6,80 (шир.с, 1H), 7,28-7,32 (м, 7H), 7,67 (с, 1H). ПРИМЕР 40-43 4-(3-(1,2,4-Триазоло)метил)-2-(3-(трет-бутил)-5-метилбензилокси)- 3-фенилморфолин, 4-(3-(5-оксо-1H, 4H-1,2,4-триазоло)метил)- 2-(3-(трет-бутил)-5-метилбензилокси)-3-фенилморфолин, 4-(2-(имидазоло)метил)-2-(3-(трет-бутил)-5-метилбензилокси)-3- фенилморфолин, 4-(4-имидазоло)метил)-2-(3-(трет-бутил)-5- метилбензилокси)-3-фенилморфолин Заглавные соединения получали способами примеров 15, 17 и 18, применяя соответственно замещенные исходные соединения и реагенты. ПРИМЕР 44 2-(S)-(3,5-Дихлорбензилокси)-3-(S)-фенилморфолин Стадия A: 3,5-Дихлорбензиловый спирт, трифторметансульфонатный эфир Раствор 6,09 г (34,4 моль) 3,5-дихлорбензилового спирта и 8,48 г (41,3 ммоль) 3,6-ди-трет-бутил-4-метилпиридина в 280 мл сухого четыреххлористого углерода в атмосфере азота обрабатывали 5,95 мл (35,4 ммоль) ангидрида трифторметансульфокислоты при комнатной температуре. Вскоре после добавления ангидрида образовался белый осадок. Через 90 мин взвесь фильтровали в атмосфере азота через фильтр Шленка, и фильтрат концентрировали в вакууме. Остаток, который был двухфазным маслом, растворяли в 60 мл сухого толуола в атмосфере азота. Полученный раствор применяли сразу в стадии В, приведенной ниже. Стадия B: 4-Бензил-2-(S)-(3,5-дихлорбензилокси)-3-(S)-фенилморфолина Раствор 5,11 г (19,1 ммоль) N-бензил-3-(S)-фенилморфолин-2-она (из примера 14) в 100 мл сухого ТГФ охлаждали до -75oC в атмосфере азота и обрабатывали по каплям 20,5 мл (20,5 ммоль) 1 М раствора три(втор-бутил)борогидрида лития (L-Selectride  ) в ТГФ. После перемешивания раствора при -75oC в течение 30 мин добавляли через канюлю раствор трифторметансульфонатного эфира 3,5-дихлорбензилового спирта в толуоле (из примера 44, стадия A) таким образом, чтобы внутренняя температура была ниже -60oC. Образованный раствор перемешивали при температуре между -38oC и 50oC в течение 9 ч и затем обрабатывали 14 мл водного аммиака и выдерживали при -20oC в течение 12 ч. Раствор затем выливали в смесь 50 мл этилацетата и 100 мл воды, и слои разделяли. Водную фазу экстрагировали 2×100 мл этилацетата, каждый экстракт промывали соляным раствором. Объединенные органические слои сушили над сульфатом натрия, смесь фильтровали и фильтрат концентрировали в вакууме. Остаток очищали флэш-хроматографией на 235 г диоксида кремния, применяя 1,5 л смеси гексан/этилацетат (100:3) и затем 1,9 л смеси гексан/этилацетат (100:5). Получали 4,4 г (54%) масла. 1H ЯМР-спектроскопия показала, что масло является смесью цис- и транс-морфолинов. Масс-спектр (FAB): m/z 430, 428, 426 (M+H, около 60%), 268 (M-ArCH2, 100%), 252 (M-ArCH2O, 75%), 222 (20%), 159 (45%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.): ) в ТГФ. После перемешивания раствора при -75oC в течение 30 мин добавляли через канюлю раствор трифторметансульфонатного эфира 3,5-дихлорбензилового спирта в толуоле (из примера 44, стадия A) таким образом, чтобы внутренняя температура была ниже -60oC. Образованный раствор перемешивали при температуре между -38oC и 50oC в течение 9 ч и затем обрабатывали 14 мл водного аммиака и выдерживали при -20oC в течение 12 ч. Раствор затем выливали в смесь 50 мл этилацетата и 100 мл воды, и слои разделяли. Водную фазу экстрагировали 2×100 мл этилацетата, каждый экстракт промывали соляным раствором. Объединенные органические слои сушили над сульфатом натрия, смесь фильтровали и фильтрат концентрировали в вакууме. Остаток очищали флэш-хроматографией на 235 г диоксида кремния, применяя 1,5 л смеси гексан/этилацетат (100:3) и затем 1,9 л смеси гексан/этилацетат (100:5). Получали 4,4 г (54%) масла. 1H ЯМР-спектроскопия показала, что масло является смесью цис- и транс-морфолинов. Масс-спектр (FAB): m/z 430, 428, 426 (M+H, около 60%), 268 (M-ArCH2, 100%), 252 (M-ArCH2O, 75%), 222 (20%), 159 (45%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  основной (цис)изомер: 2,32 (тд, J = 12,3, 6, 1H), 2,84 (прибл., т, J = 13,2H), 3,52 (д, J = 2,6, 1H), 3,55 (дк, J = 11,3, 1,6, 1H), 3,91 (д, J = 13,3, 1H), 4,12 (тд, J = 11,6, 2,4, 1H), 4,29 (д, J = 13,6, 1H), 4,59 (д, J = 2,9, 1H), 4,60 (д, J = 13,6), 6,70 (с, 2H) 7,13 (т, J = 1,9, 1H), 7,2-7,6 (м, 8H), 7,53 (шир. д, 2H).
Стадия C: 2-(S)-(3,5-Дихлорбензилокси)-3-(S)-фенилморфолин основной (цис)изомер: 2,32 (тд, J = 12,3, 6, 1H), 2,84 (прибл., т, J = 13,2H), 3,52 (д, J = 2,6, 1H), 3,55 (дк, J = 11,3, 1,6, 1H), 3,91 (д, J = 13,3, 1H), 4,12 (тд, J = 11,6, 2,4, 1H), 4,29 (д, J = 13,6, 1H), 4,59 (д, J = 2,9, 1H), 4,60 (д, J = 13,6), 6,70 (с, 2H) 7,13 (т, J = 1,9, 1H), 7,2-7,6 (м, 8H), 7,53 (шир. д, 2H).
Стадия C: 2-(S)-(3,5-Дихлорбензилокси)-3-(S)-фенилморфолинРаствор 0,33 г (0,77 ммоль) 4-бензил-2-(S)-(3,5-дихлорбензилокси)-3-(S)-фенилморфолина (из примера 44, стадия B) и 0,22 г (1,54 ммоль) 1-хлорэтилхлорформиата в 4,5 мл 1,2-дихлорметана помещали в ампулу для реакции под давлением, которую опускали в масляную баню, нагреваемую до 110oC. После перемешивания в течение 60 ч раствор охлаждали и концентрировали в вакууме. Остаток растворяли в 7 мл метанола, и полученный раствор кипятили с обратным холодильником в течение 30 мин. Смесь охлаждали и обрабатывали несколькими каплями концентрированного водного раствора аммиака, и раствор концентрировали. Остаток частично очищали флэш-хроматографией на 67 г силикагеля, элюируя 1,5 л смеси хлористый метилен/метанол (100:1). Обогащенные фракции очищали флэш-хро-матографией на 32 г диоксида кремния, элюируя смесью гексан/этилацетат (50:50) и затем гексан/этилацетат/метанол (50:50:5). Получали 0,051 г (20%) масло, которое, как было показано 1H ЯМР-спектроскопией, является чистым цис-морфолином. Масс-спектр (FAB): m/z 468, 466, 464 (макс. 8%), 338, 340 (M+H, 25%), 178 (20%), 162 (100%), 132 (20%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,89 (шир. с, 1H), 3,08 (дд, J = 12,5, 2,9, 1H), 3,23 (тд, J = 12,2, 3,6, 1H), 3,59 (дд, J = 11,3, 2,5, 1H), 4,03 (тд, J = 11,7,3, 1H), 4,09 (д, J = 2,4, 1H), 4,37 (д, J = 13,5, 1H), 4,62 (д, J = 13,3, 1H), 4,67 (д, J = 2,5, 1H), 6,72 (д, J = 1,8, 1H), 7,14 (т, J = 1,8, 1H), 7,25-7,40 (м, 5H).
ПРИМЕР 45 1,89 (шир. с, 1H), 3,08 (дд, J = 12,5, 2,9, 1H), 3,23 (тд, J = 12,2, 3,6, 1H), 3,59 (дд, J = 11,3, 2,5, 1H), 4,03 (тд, J = 11,7,3, 1H), 4,09 (д, J = 2,4, 1H), 4,37 (д, J = 13,5, 1H), 4,62 (д, J = 13,3, 1H), 4,67 (д, J = 2,5, 1H), 6,72 (д, J = 1,8, 1H), 7,14 (т, J = 1,8, 1H), 7,25-7,40 (м, 5H).
ПРИМЕР 452-(S)-(3,5-Дихлорбензилокси)-4-(3-(5-оксо-1,2,4-триазоло)метил- 3-(S)-фенилморфолин Стадия A: N-Метилкарбокси-2-хлорацетамидразон Раствор 5,0 г (66,2 ммоль) хлорацетонитрила в 35 мл сухого метанола охлаждали до 0oC и обрабатывали 0,105 г (1,9 ммоль) метоксида натрия. Баню со льдом убирали, и смесь 30 мин перемешивали при комнатной температуре. В реакционную смесь затем добавляли 0,110 мл (1,9 ммоль) уксусной кислоты и затем 5,8 г (64,9 ммоль) метилгидразинкарбоксилата. После перемешивания 30 мин при комнатной температуре суспензию концентрировали в вакууме и помещали в высокий вакуум на ночь, получая 10,5 г (98%) желтого продукта, часть которого применяли в приведенной ниже стадии C. Стадия B: 4-(2-(N-Метилкарбоксиацетамидразоно)-2-(S)-(3,5- дихлорбензилокси)-3-(S)-фенилморфолин Раствор 0,050 г (0,15 ммоль) 2-(S)-(3,5-дихлорбензилокси)-3-(S)-фенилморфолина (из примера 44, стадия C), 0,034 г (0,21 ммоль) N-метилкарбокси-2-хлорацетамидразона (из стадии A) и 0,044 мл (0,25 ммоль) N,N-диизопропилэтиламина в 1 мл ацетонитрила перемешивали при комнатной температуре в течение 3 ч. Смесь распределяли между 20 мл хлористого метилена и 10 мл воды. Слои разделяли, органический слой сушили над сульфатом натрия и затем концентрировали в вакууме. Остаток очищали флэш-хроматографией на 35 г диоксида кремния, элюируя 1 л смеси хлористый метилен/метанол (50:1), затем 500 мл смеси хлористый метилен/метанол/водный аммиак (25:1:0,05). Получали 70 мг (около 100%) продукта в виде белого твердого вещества. Масс-спектр (FAB): m/z 469 (M+H, 60%), 467 (M+H, 100%), 291 (40%), 160 (20%), 158 (25%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  2,48 (тд, J = 3,5, 12,2, 1H), 2,53 (д, J = 14,6, 1H), 2,90 (д, J = 11,8, 1H), 3,37 (д, J = 14,6, 1H), 3,52 (д, J = 2,8, 1H), 3,62 (дм, J = 11,4, 1H), 3,75 (с, 3H), 4,14 (тд, J = 2,2, 11,8, 1H), 4,28 (д, J = 13,5, 1H), 4,58 (д, J = 13,6), 4,60 (д, J = 2,8, 1H), 5,45 (шир. с, 2H), 6,74 д, J = 1,9, 2H), 7,15 (т, J = 1,9, 1H), 7,30-7,46 (м, 6H).
Стадия C: 2-(S)-(3,5-Дихлорбензилокси)-4-(3-(5-оксо-1,2,4- триазоло)метил-3-(S)-фенилморфолин 2,48 (тд, J = 3,5, 12,2, 1H), 2,53 (д, J = 14,6, 1H), 2,90 (д, J = 11,8, 1H), 3,37 (д, J = 14,6, 1H), 3,52 (д, J = 2,8, 1H), 3,62 (дм, J = 11,4, 1H), 3,75 (с, 3H), 4,14 (тд, J = 2,2, 11,8, 1H), 4,28 (д, J = 13,5, 1H), 4,58 (д, J = 13,6), 4,60 (д, J = 2,8, 1H), 5,45 (шир. с, 2H), 6,74 д, J = 1,9, 2H), 7,15 (т, J = 1,9, 1H), 7,30-7,46 (м, 6H).
Стадия C: 2-(S)-(3,5-Дихлорбензилокси)-4-(3-(5-оксо-1,2,4- триазоло)метил-3-(S)-фенилморфолинРаствор 0,069 г (0,15 ммоль) 4-(2-(N-метилкарбоксиацетамидразоно)- 2-(S)-(3,5-дихлорбензилокси)-3-(S)-фенилморфолина (со стадии B) в 6 мл ксилолов кипятили с обратным холодильником в течение 2 ч. Раствор охлаждали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на 35 г силикагеля, элюируя 500 мл смеси хлористый метилен/метанол/водный аммиак (50:1: 0,1), затем 500 мл смеси хлористый метилен/метанол/водный аммиак (20:1:0,1). Получали 56 мг (88%) продукта в виде белого порошка. Масс-спектр (FAB): m/z 437 (M+H, 65%), 435 (M+H, 100%), 259 (85%), 161 (55%), 1H ЯМР-спектр (CDCl3, 400 МГц, м.д,):  2,53 (т, J = 11,7, 3,6, 1H), 2,88 (д, J = 11,6, 1H), 2,96 (д, J = 14,3, 1H), 3,54 (д, J = 2,6, 1H), 3,63 (дд, J = 11,6, 1,9, 1H), 3,68 (д, J = 14,6, 1H), 4,16 (т, J = 11,7, 2,2, 1H), 4,30 (д, J = 13,6), 4,58 (д, J = 2,7, 1H), 4,67 (д, J = 13,6, 1H), 6,65 (д, J = 1,8, 2H), 7,07 (т, J = 1,9, 1H), 7,29-7,44 (м, 5H), 10,25 (шир. с, 1H), 10,75 (шир. с, 1H).
ПРИМЕР 46 2,53 (т, J = 11,7, 3,6, 1H), 2,88 (д, J = 11,6, 1H), 2,96 (д, J = 14,3, 1H), 3,54 (д, J = 2,6, 1H), 3,63 (дд, J = 11,6, 1,9, 1H), 3,68 (д, J = 14,6, 1H), 4,16 (т, J = 11,7, 2,2, 1H), 4,30 (д, J = 13,6), 4,58 (д, J = 2,7, 1H), 4,67 (д, J = 13,6, 1H), 6,65 (д, J = 1,8, 2H), 7,07 (т, J = 1,9, 1H), 7,29-7,44 (м, 5H), 10,25 (шир. с, 1H), 10,75 (шир. с, 1H).
ПРИМЕР 462-(S)-(3,5-Бис(трифторметил)бензилокси-4-(метоксикарбонилметил)- 3-(S)-фенилморфолин Раствор 300 мг (0,74 ммоль) 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенилморфолина (из примера 15, стадия C) и 0,35 мл (2,0 ммоль) ДИЭА в 5 мл ацетонитрила обрабатывали 0,19 мл (2,0 ммоль) метилбромацетата, и смесь перемешивали 16 ч при комнатной температуре. Раствор затем концентрировали в вакууме, и остаток распределяли между 30 мл эфира и 15 мл 0,5 н водного раствора KHSO4. Слои разделяли, и органическую фазу промывали 10 мл соляного раствора и сушили над сульфатом магния. После фильтрования органическую фазу концентрировали в вакууме, и остаток очищали флэш-хроматографией на 20 г диоксида кремния, элюируя смесью гексан/эфир (80:20). Получали 351 мг (99%) продукта с [  ]D= +147,3 ]D= +147,3 (c = 1,6, CHCl3). Масс-спектр (FAB): m/z 478 (M+1, 40%), 477 (65%), 418 (50%), 250 (95%), 234 (90%), 227 (100%), 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.): (c = 1,6, CHCl3). Масс-спектр (FAB): m/z 478 (M+1, 40%), 477 (65%), 418 (50%), 250 (95%), 234 (90%), 227 (100%), 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  3,02 (шир.д, 2H), 3,13 (д, J = 16,9, 1H), 3,36 (n, J = 16,8), 3,62 (с, 3H), 3,69 (дт, J = 11,7, 2,2, 1H), 4,03 (шир. с, 1H), 4,23-4,32 (м, 1H), 4,44 (д, J = 13,3, 1H), 4,68 (д, J = 2,6, 1H), 4,81 (д, J = 13,5, 1H), 7,30-7,38 (м, 3H), 7,4-7,5 (м, 3H), 7,70 (с, 1H) 3,02 (шир.д, 2H), 3,13 (д, J = 16,9, 1H), 3,36 (n, J = 16,8), 3,62 (с, 3H), 3,69 (дт, J = 11,7, 2,2, 1H), 4,03 (шир. с, 1H), 4,23-4,32 (м, 1H), 4,44 (д, J = 13,3, 1H), 4,68 (д, J = 2,6, 1H), 4,81 (д, J = 13,5, 1H), 7,30-7,38 (м, 3H), 7,4-7,5 (м, 3H), 7,70 (с, 1H)Анализ Рассчитано для C22H21F6NO4: C 55,35; H 4,43; N 2,93; F 23,88 Найдено: C 55,09; H 4,43; N 2,83; F 24,05. ПРИМЕР 47 2-(S)-(3,5-Бис(трифторметил)бензилокси-4-(карбоксиметил)-3-(S)- фенилморфолин Раствор 0,016 г (0,034 ммоль) 2-(S)-(3,5-бис(трифторметил)-бензилокси- 4-(метоксикарбонилметил)-3-(S)-фенилморфолина (из примера 46) в 2 мл ТГФ и 0,5 мл воды обрабатывали 0,027 мл (0,067 ммоль) 2,5 н водного раствора едкого натра, и смесь перемешивали при комнатной температуре в течение 5 ч. Смесь обрабатывали 2 каплями 2 н водного HCl и 3 мл воды, и раствор экстрагировали 15 мл смеси гексан/этилацетат (1:1). Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на 13 г диоксидa кремния, элюируя 250 мл смеси хлористый метилен/метанол/уксусная кислота (100:3:0,1) и затем 100 мл смеси хлористый метилен/метанол/уксусная кислота (50:2:0,1). Получали 0,014 г (90%) масла. Масс-спектр (FAB): m/z 464 (M+H, 90%), 420 (M-CO2, 10%), 227 (ArCH2, 35%), 220 (M-OCH2AR, 100%), 161 (20%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  2,9 (прибл. д, 2H), 3,03 (д, 1H), 3,33 (д, 1H), 3,72 (д, 1H), 3,90 (д, 1H), 4,25 (т, 1H), 4,44 (д, 1H), 4,71 (д, 1H), 4,79 (д, 1H), 7,3-7,4 (м, 5H), 7,44 (с, 2H), 7,71 (с, 1H).
ПРИМЕР 48 2,9 (прибл. д, 2H), 3,03 (д, 1H), 3,33 (д, 1H), 3,72 (д, 1H), 3,90 (д, 1H), 4,25 (т, 1H), 4,44 (д, 1H), 4,71 (д, 1H), 4,79 (д, 1H), 7,3-7,4 (м, 5H), 7,44 (с, 2H), 7,71 (с, 1H).
ПРИМЕР 48Гидрохлорид 2-(S)-(3,5-бис(трифторметил)бензилокси-4-((2- аминоэтил)аминокарбонилметил)-3-(S)-фенилморфолина Раствор 54 мг (0,11 ммоль) 2-(S)-(3,5-бис(трифторметил)бензилокси- 4-(карбоксиметил)-3-(S)-фенилморфолина (из примера 46) и 0,15 мл этилендиамина (2,3 ммоль) в 1 мл метанола перемешивали 48 ч при 55oC. Смесь концентрировали, и остаток очищали флэш-хроматографией на 16 г диоксида кремния, элюируя 500 мл смеси хлористый метилен/метанол/водный аммиак (50:4:0,1). Получали 57 мл (100%) масла. Масло растворяли в эфире, и раствор обрабатывали эфиром, насыщенным газообразным HCl. После концентрирования в вакууме получали 58 мг (95%) стойкого масла. Масс-спектр (FAB): m/z 506 (M+H, 100%), 418 (15%), 262 (35%), 227 (30%), 173 (40%), 1H ЯМР-спектр (CDCl3, 400 МГц, м. д.):  2,56 (д, J = 15,5, 1H), 2,59 (тд, J = 12,0, 3,6, 1H), 2,82 (т, J = 6,5, 2H), 2,96 (д, J = 11,8, 1H), 3,21 (д, J = 15,8, 1H), 3,25-3,40 (м, 2H), 3,65 (д, J = 2,6, 1H), 3,67 (прибл. дт, J = 11,4, около 2, 1H), 4,18 (тд, J = 11,8, 2,6, 1H), 4,33 (д, J = 13,5, 1H), 4,69 (д, J = 2,7, 1H), 4,79 (д, J = 13,5, 1H), 7,25-7,40 (м, 5H), 7,46 (с, 2H), 7,59 (шир. т, 1H), 7,71 (с, 1H).
ПРИМЕР 49 2,56 (д, J = 15,5, 1H), 2,59 (тд, J = 12,0, 3,6, 1H), 2,82 (т, J = 6,5, 2H), 2,96 (д, J = 11,8, 1H), 3,21 (д, J = 15,8, 1H), 3,25-3,40 (м, 2H), 3,65 (д, J = 2,6, 1H), 3,67 (прибл. дт, J = 11,4, около 2, 1H), 4,18 (тд, J = 11,8, 2,6, 1H), 4,33 (д, J = 13,5, 1H), 4,69 (д, J = 2,7, 1H), 4,79 (д, J = 13,5, 1H), 7,25-7,40 (м, 5H), 7,46 (с, 2H), 7,59 (шир. т, 1H), 7,71 (с, 1H).
ПРИМЕР 49Гидрохлорид 2-(S)-(3,5-бис(трифторметил)бензилокси-4-((3- аминопропил)аминокарбонилметил)-3-(S)-фенилморфолина Раствор 59 мг (0,12 ммоль) 2-(S)-(3,5-бис(трифторметил)бензилокси- 4-(карбоксиметил)-3-(S)-фенилморфолина (из примера 46) и 0,21 мл 1,3-пропилендиамина (2,5 ммоль) в 1 мл метанола перемешивали 72 ч при 55oC. Смесь концентрировали, и остаток очищали флэш-хроматографией на 16 г диоксида кремния, элюируя 500 мл смеси хлористый метилен/метанол/водный аммиак (10:1: 0,05). Получали 56 мг (88%) масла. Масло растворяля в хлористом метилене и обрабатывали хлористым метиленом, насыщенным газообразным HCl. После концентрирования в вакууме получали белую пасту. Масс-спектр (FAB; свободное основание): m/z 520 (M+H, 100%), 418 (10%), 276 (30%), 227 (20%), 174 (30%), 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,64 (пентет, J = 6,6, 2H), 2,53 (д, J = 15,5, 1H), 2,58 (тд, J = 12,0, 3,6, 1H), 2,73 (т, J = 6,5, 2H), 2,92 (д, J = 11,8, 1H), 3,19 (д, J = 15,8, 1H), 3,25-3,40 (м, 2H), 3,62 (д, J = 2,6, 1H), 3,65 (прибл. дт, J = 11,4, около 2, 1H), 4,16 (тд, J = 11,8, 2,6, 1H), 4,41 (д, J = 13,5, 1H), 4,68 (д, J = 2,7, 1H), 4,79 (д, J = 13,5, 1H), 7,25-7,40 (м, 5H), 7,45 (с, 2H), 7,57 (шир. т, 1H), 7,70 (с, 1H).
ПРИМЕР 50 1,64 (пентет, J = 6,6, 2H), 2,53 (д, J = 15,5, 1H), 2,58 (тд, J = 12,0, 3,6, 1H), 2,73 (т, J = 6,5, 2H), 2,92 (д, J = 11,8, 1H), 3,19 (д, J = 15,8, 1H), 3,25-3,40 (м, 2H), 3,62 (д, J = 2,6, 1H), 3,65 (прибл. дт, J = 11,4, около 2, 1H), 4,16 (тд, J = 11,8, 2,6, 1H), 4,41 (д, J = 13,5, 1H), 4,68 (д, J = 2,7, 1H), 4,79 (д, J = 13,5, 1H), 7,25-7,40 (м, 5H), 7,45 (с, 2H), 7,57 (шир. т, 1H), 7,70 (с, 1H).
ПРИМЕР 504-Бензил-5-(S)-6-(R)-диметил-3-(S)-фенилморфолинон и 4-бензил-5-(R),6-(S)-диметил-3-(S)-фенилморфолинон В суспензию 1,7 г (7,0 ммоль) N-бензил-(S)-фенилглицина (пример 13) в 15 мл хлористого метилена при 0oC добавляли 6,9 мл (13,9 ммоль) триметилалюминия (2,0 М в толуоле). После выдерживания 1 ч при 0oC в смесь по каплям добавляли 0,625 мл (7,0 ммоль) (+/-)-транс-2,3-эпоксибутана (растворенный в 2,0 мл хлористого метилена) и затем ее перемешивали 16 ч при 22oC. Реакционную смесь затем переносили в другую колбу, содержащую 30 мл смеси гексан/хлористый метилен (1:1) и 30 мл 1М раствора тартрата калия и натрия, и смесь перемешивали 2 ч при 22oC. Слои разделяли, и водный слой экстрагировали хлористым метиленом (3х100 мл). Объединенные органические слои промывали 25 мл насыщенного раствора хлористого натрия, сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный спирт растворяли в 25 мл толуола, обрабатывали 93 мг (0,49 ммоль) п-толуолсульфокислоты и нагревали 20 ч при 50oC. Реакционную смесь затем охлаждали и концентрировали в вакууме. Остаток распределяли между 15 мл диэтилового эфира и 10 мл насыщенного раствора бикарбоната натрия. Слои разделяли, и органический слой промывали водой (3х10 мл). Объединенные органические слои промывали 25 мл насыщенного раствора хлорида натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Флэш-хроматографией остатка на 145 г силикагеля с использованием смеси этилацетат/гексан (1:4, об./об.) в качестве элюента получали 567 мг лактона с высоким Rf (изомер A) и 388 мг лактона с низким Rf (изомер B). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.)  изомер A: 1,04 (д, 3H, J = 8,0 Гц), 1,24 (д, 3H, J = 8,0 Гц), 2,92 (шир. кд, 1H), 3,41 (д, 1H, J = 16,0 Гц), 3,62 (д, 1H, J = 16,0 Гц), 4,38 (с, 1H), 4,96 (шир. кд, 1H), 7,20-7,42 (м, 8H), 7,58-7,64 (м, 2H); изомер B: 1,04 (д, 3H, J = 10,0 Гц), 1,39 (д, 3H, J = 10,0 Гц), 3,06 (шир. кд, 1H), 3,53 (д, 1H, J = 16,0 Гц), 3,81 (д, 1H, J = 16,0 Гц), 4,33 (с, 1H), 4,67 (шир. кд, 1H), 7,18-7,50 (м, 10H). Масс-спектр (FAB): m/z изомер A: 296 (M+H, 100%), 294 (50%), изомер B: 296 (M+H, 100%), 294 (50%).
ПРИМЕР 51 изомер A: 1,04 (д, 3H, J = 8,0 Гц), 1,24 (д, 3H, J = 8,0 Гц), 2,92 (шир. кд, 1H), 3,41 (д, 1H, J = 16,0 Гц), 3,62 (д, 1H, J = 16,0 Гц), 4,38 (с, 1H), 4,96 (шир. кд, 1H), 7,20-7,42 (м, 8H), 7,58-7,64 (м, 2H); изомер B: 1,04 (д, 3H, J = 10,0 Гц), 1,39 (д, 3H, J = 10,0 Гц), 3,06 (шир. кд, 1H), 3,53 (д, 1H, J = 16,0 Гц), 3,81 (д, 1H, J = 16,0 Гц), 4,33 (с, 1H), 4,67 (шир. кд, 1H), 7,18-7,50 (м, 10H). Масс-спектр (FAB): m/z изомер A: 296 (M+H, 100%), 294 (50%), изомер B: 296 (M+H, 100%), 294 (50%).
ПРИМЕР 512-(R)-(3,5-Бис(трифторметил)бензилокси)-[5-(S)-6-(R)- или 5-(R),6-(S)-диметил]-3-(S)-фенилморфолинон Стадия A: 4-Бензил-2-(R)-(3,5-бис(трифторметил)бензилокси)-[5-(S)- 6-(R)- или 5-(R),6-(S)-диметил]-3-(S)-фенилморфолинон В соответствии со способом примера 15, стадия B, из 251 мг (0,85 ммоль) изомера A из примера 50 (4-бензил-[5-(S),6-(R)- или 5-(R)-(6-(S)-диметил]-3-(S)-фенилморфолинон) получали 238 мг (53%) продукта в виде масла. 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,03 (д, 3H, J = 6,7 Гц), 1,13 (д, 3H, J = 6,6 Гц), 2,61 (кд, 1H, J = 2,2 и 6,6 Гц), 3,26 (д, 1H, J = 13,9 Гц), 3,55 (д, 1H, J = 13,9 Гц), 3,63 (д, 1H, J = 7,6 Гц), 4,01 (кд, 1H, J = 2,3 и 6,6 Гц), 4,44 (д, 1H, J = 13,1 Гц), 4,53 (д, 1H, J = 7,7 Гц), 4,71 (с, 1H), 4,85 (д, 1H, J = 13,2 Гц), 7,20-7,35 (м, 9H), 7,46-7,48 (м, 2H), 7,67 (с, 1H), 7,81 (с, 1H). Масс-спектр (FAB): m/z 523 (M+H, 100%), 296 (95%), 280 (40%), 227 (50%).
Стадия B: 2-(R)-(3,5-Бис(трифторметил)бензилокси)-[5-(S),6-(R)- или 5-(R),6-(S)-диметил]-3-(S)-фенилморфолинон 1,03 (д, 3H, J = 6,7 Гц), 1,13 (д, 3H, J = 6,6 Гц), 2,61 (кд, 1H, J = 2,2 и 6,6 Гц), 3,26 (д, 1H, J = 13,9 Гц), 3,55 (д, 1H, J = 13,9 Гц), 3,63 (д, 1H, J = 7,6 Гц), 4,01 (кд, 1H, J = 2,3 и 6,6 Гц), 4,44 (д, 1H, J = 13,1 Гц), 4,53 (д, 1H, J = 7,7 Гц), 4,71 (с, 1H), 4,85 (д, 1H, J = 13,2 Гц), 7,20-7,35 (м, 9H), 7,46-7,48 (м, 2H), 7,67 (с, 1H), 7,81 (с, 1H). Масс-спектр (FAB): m/z 523 (M+H, 100%), 296 (95%), 280 (40%), 227 (50%).
Стадия B: 2-(R)-(3,5-Бис(трифторметил)бензилокси)-[5-(S),6-(R)- или 5-(R),6-(S)-диметил]-3-(S)-фенилморфолинонВ соответствии со способом примера 15, стадия C, из 260 мг исходного соединения стадии A [получен из изомера A в примере 50 (4-бензил-2-(R)-(3,5-бис(трифторметил)бензилокси)-[5-(S), 6-(R)- или 5-(R),6-(S)-диметил]-3-(S)-фенилморфолинон)] получали 122 мг (57%) продукта в виде масла. 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,19 (д, 3H, J = 6,5 Гц), 1,27 (д, 3H, J = 6,7 Гц), 2,97 (кд, 1H, J = 2,9 и 6,9 Гц), 3,96 (д, 1H, J = 7,7 Гц), 4,08-4,11 (м, 2H), 4,39 (д, 1H, J = 7,7 Гц), 4,50 (д, 1H, J = 13,3 Гц), 4,88 (д, 1H, J = 13,2 Гц), 7,27-7,33 (м, 3H), 7,40-7,42 (м, 4H), 7,67 (с, 1H). Масс-спектр (FAB): m/z 434 (M+H, 45%), 227 (35%), 206 (40%), 190 (100%).
ПРИМЕР 52 1,19 (д, 3H, J = 6,5 Гц), 1,27 (д, 3H, J = 6,7 Гц), 2,97 (кд, 1H, J = 2,9 и 6,9 Гц), 3,96 (д, 1H, J = 7,7 Гц), 4,08-4,11 (м, 2H), 4,39 (д, 1H, J = 7,7 Гц), 4,50 (д, 1H, J = 13,3 Гц), 4,88 (д, 1H, J = 13,2 Гц), 7,27-7,33 (м, 3H), 7,40-7,42 (м, 4H), 7,67 (с, 1H). Масс-спектр (FAB): m/z 434 (M+H, 45%), 227 (35%), 206 (40%), 190 (100%).
ПРИМЕР 522-(S)-(3,5-Бис(трифторметил)бензилокси)-[5-(R), 6-(S)- или 5-(S),6-(R)-диметил]-3-(S)-фенилморфолинон Стадия A: 4-Бензил-2-(S)-(3,5-бис(трифторметил)бензилокси)-[5- (R),6-(S)- или 5-(S)-, 6-(R)-диметил]-3-(S)-фенилморфолинон В соответствии со способом примера 15, стадия B, из 449 мг (1,52 ммоль) изомера B из примера 50 (4-бензил-[5-(R),6-(S) или 5-(S)-6-(R)-диметил]-3-(S)-фенилморфолинон) получали 400 мг (51%) продукта в виде масла. 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  0,90 (д, 3H, J = 6,8 Гц), 1,37 (д, 3H, J = 6,6 Гц), 2,86-2,89 (кд, 1H), 3,47 (д, 1H, J = 15,0 Гц), 3,82-3,85 (м, 2H), 3,99-4,02 (шир. кд, 1H), 4,45 (д, 1H, J = 13,6 Гц), 4,81 (д, 1H, J = 2,0 Гц), 4,87 (д, 1H, J = 13,5 Гц), 7,17-7,83 (м, 13H).
Стадия B: 2-(S)-(3,5-Бис(трифторметил)бензилокси)-[5-(S)-6-(R)- или 5-(R),6-(S)-диметил]-3-(S)-фенилморфолинон 0,90 (д, 3H, J = 6,8 Гц), 1,37 (д, 3H, J = 6,6 Гц), 2,86-2,89 (кд, 1H), 3,47 (д, 1H, J = 15,0 Гц), 3,82-3,85 (м, 2H), 3,99-4,02 (шир. кд, 1H), 4,45 (д, 1H, J = 13,6 Гц), 4,81 (д, 1H, J = 2,0 Гц), 4,87 (д, 1H, J = 13,5 Гц), 7,17-7,83 (м, 13H).
Стадия B: 2-(S)-(3,5-Бис(трифторметил)бензилокси)-[5-(S)-6-(R)- или 5-(R),6-(S)-диметил]-3-(S)-фенилморфолинонВ соответствии со способом примера 15, стадия C, из 400 мг исходного соединения стадии A [получен из изомера B в примере 50 (4-бензил-2-(S)-(3,5-бис(трифторметил)бензилокси)-[5-(R), 6-(S) или 5-(S),6-(R)-диметил-3-(S)-фенилморфолинон)] получали 230 мг (69%) продукта в виде масла. 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,08 (д, 3H, J = 6,7 Гц), 1,38 (д, 3H, J = 7,0 Гц), 3,41-3,45 (шир. кд, 1H), 3,85-3,89 (шир.кд, 1H), 4,16 (д, 1H, J = 2,9 Гц), 4,49 (д, 1H, J = 13,6 Гц), 4,71 (д, 1H, J = 2,9 Гц), 4,82 (д, 1H, J = 13,6 Гц), 7,25-7,36 (м, 7H), 7,66 (с, 1H). Масс-спектр (FAB): m/z 434 (M+H, 35%), 227 (40%), 206 (40%), 190 (100%).
ПРИМЕР 53 1,08 (д, 3H, J = 6,7 Гц), 1,38 (д, 3H, J = 7,0 Гц), 3,41-3,45 (шир. кд, 1H), 3,85-3,89 (шир.кд, 1H), 4,16 (д, 1H, J = 2,9 Гц), 4,49 (д, 1H, J = 13,6 Гц), 4,71 (д, 1H, J = 2,9 Гц), 4,82 (д, 1H, J = 13,6 Гц), 7,25-7,36 (м, 7H), 7,66 (с, 1H). Масс-спектр (FAB): m/z 434 (M+H, 35%), 227 (40%), 206 (40%), 190 (100%).
ПРИМЕР 532-(R)-(3,5-Бис(трифторметил)бензилокси)-4-(3-(1,2,4- триазоло)метил)-[5-(S)-6-(R)- или 5-(R),6-(S)-диметил]-3-(S)-фенилморфолинон Смесь 62 мг (0,14 ммоль) 2-(R)-(3,5-бис(трифторметил)бензилокси)-[5-(S), 6-(R)- или 5-(R),6-(S)-диметил]-3-(S)-фенилморфолинона (из примера 51, стадия B), 62 мг (0,45 ммоль) безводного карбоната калия и 26 мг (0,19 ммоль) N-формил-2-хлорацетамидразона (из примера 17, стадия A) в 2,0 мл N,N-диметилформамида нагревали в течение 2 ч при температуре до 60oC и затем 1,5 ч до 118oC. Смесь затем охлаждали до комнатной температуры и гасили 5 мл воды и разбавляли 15 мл этилацетата. Слои разделяли и органический слой промывали этилацетатом (2 х 10 мл). Объединенные органические слои промывали 10 мл соляного раствора, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Флэш-хроматографией остатка на 42 г силикагеля с использованием в качестве элюента смеси хлористый метилен/метанол (95:5, об. /об.) получали 42 мг (57%) светлого масла. 1H ЯМР-спектр (CDCl3, 400 МГц, м. д.):  1,13 (д, 3H, J = 6,5 Гц), 1,19 (д, 3H, J = 6,5 Гц), 2,65 (кд, 1H, J = 1,9 и 6,5 Гц), 3,58 (д, 1H, J = 15,5 Гц), 3,65 (д, 1H, J = 7,7 Гц), 3,75 (д, 1H, J = 15,4 Гц), 4,06 (кд, 1H, J = 2,2 и 6,6 Гц), 4,45 (д, 1H, J = 13,2 Гц), 4,54 (д, 1H, J = 7,7 Гц), 4,84 (д, 1H, J = 13,2 Гц), 7,28-7,37 (м, 7H), 7,67 (с, 1H), 7,89 (с, 1H). Масс-спектр (FAB): m/z 516 (M+H, 52%), 287 (28%), 271 (100%), 227 (40%), 202 (38%).
ПРИМЕР 54 1,13 (д, 3H, J = 6,5 Гц), 1,19 (д, 3H, J = 6,5 Гц), 2,65 (кд, 1H, J = 1,9 и 6,5 Гц), 3,58 (д, 1H, J = 15,5 Гц), 3,65 (д, 1H, J = 7,7 Гц), 3,75 (д, 1H, J = 15,4 Гц), 4,06 (кд, 1H, J = 2,2 и 6,6 Гц), 4,45 (д, 1H, J = 13,2 Гц), 4,54 (д, 1H, J = 7,7 Гц), 4,84 (д, 1H, J = 13,2 Гц), 7,28-7,37 (м, 7H), 7,67 (с, 1H), 7,89 (с, 1H). Масс-спектр (FAB): m/z 516 (M+H, 52%), 287 (28%), 271 (100%), 227 (40%), 202 (38%).
ПРИМЕР 542-(R)-(3,5-Бис(трифторметил)бензилокси)-4-(3-(5-оксо-1,2,4- триазоло)метил)-[5-(S)-6-(R)- или 5-(R),6-(S)-диметил]-3-(S)-фенилморфолинон Раствор 96 мг (0,22 моль) 2-(R)-(3,5-бис(трифторметил)бензилокси)-[5-(S), 6-(R)- или 5-(R),6-(S)-диметил]-3-(S)-фенилморфолинона (из примера 51, стадия B), 92 мг (0,66 ммоль) карбоната калия и 48 мг (0,29 ммоль) N-метилкарбокси-2-хлорацетамидразона (из примера 18, стадия A) в 4 мл ДМФ нагревали при 60oC в течение 1,5 ч и при 120oC в течение 3,5 ч. Смесь охлаждали до комнатной температуры и распределяли между 15 мл воды и 25 мл этилацетата. Водный слой экстрагировали 3 х 10 мл этилацетата, объединенные органические слои промывали 10 мл соляного раствора, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток частично очищали флэш-хроматографией на 42 г силикагеля с использованием в качестве элюента 2 л смеси хлористый метилен/метанол (98:2, об./об.) и обогащенные фракции очищали в тех же условиях, получая 38 мг (33%) светлого масла. 1H ЯМР-спектр (CDCl3, 400 МГц, м. д.):  1,09 (д, 3H, J = 6,5 Гц), 1,20 (д, 3H, J = 6,6 Гц), 2,64 (кд, 1H, J = 2,4 и 6,6 Гц) 3,33 (с, 1H), 3,56 (д, 1H, J = 7,6 Гц), 4,11 (кд, 1H, J = 2,4 и 6,6 Гц), 4,41 (д, 1H, J = 13,2 Гц), 4,57 (д, 1H, J = 7,7 Гц), 4,82 (д, 1H, J = 13,2 Гц), 7,25-7,30 (м, 5H), 7,40 (д, 2H, J = 5,7 Гц), 7,65 (с, 1H), 9,46 (с, 1H), 10,51 (с, 1H). Масс-спектр (FAB): m/z 531 (M+H, 98%), 287 (100%), 227 (80%), 189 (65%).
ПРИМЕР 55 1,09 (д, 3H, J = 6,5 Гц), 1,20 (д, 3H, J = 6,6 Гц), 2,64 (кд, 1H, J = 2,4 и 6,6 Гц) 3,33 (с, 1H), 3,56 (д, 1H, J = 7,6 Гц), 4,11 (кд, 1H, J = 2,4 и 6,6 Гц), 4,41 (д, 1H, J = 13,2 Гц), 4,57 (д, 1H, J = 7,7 Гц), 4,82 (д, 1H, J = 13,2 Гц), 7,25-7,30 (м, 5H), 7,40 (д, 2H, J = 5,7 Гц), 7,65 (с, 1H), 9,46 (с, 1H), 10,51 (с, 1H). Масс-спектр (FAB): m/z 531 (M+H, 98%), 287 (100%), 227 (80%), 189 (65%).
ПРИМЕР 552-(S)-(3,5-Бис(трифторметил)бензилокси)-4-(3-(1,2,4- триазоло)метил)-[5-(R),6-(S)- или 5-(S),6-(R)-диметил]-3-(S)-фенилморфолинон В соответствии со способом примера 53 из 75 мг (0,17 ммоль) 2-(S)-(3,5-бис(трифторметил)бензилокси)-[5-(R), 6-(S)- или 5-(S),6-(R)-диметил]-3-(S)-фенилморфолнона (из примера 52, стадия B) получали после флэш-хроматографии на 73 г силикагеля с использованием в качестве элюента смеси хлористый метилен/метанол (98:2, об./об.) 46 мг (52%) желтого масла. 1H ЯМР-спектр (CDCl3, 400 МГц, м. д.):  1,04 (д, 3H, J = 6,6 Гц), 1,46 (д, 3H, J = 6,7 Гц), 3,05-3,08 (м, 1H), 3,74-3,81 (м, 2H), 3,91-3,95 (м, 2H), 4,41 (д, 1H, J = 13,2 Гц), 4,69 (д, 1H, J = 3,2 Гц), 4,82 (д, 1H, J = 13,5 Гц), 7,43-7,45 (м, 2H), 7,68 (с, 1H), 7,91 (с, 1H). Масс-спектр (EI): m/z 432 (36%), 287 (60%), 270 (65%), 227 (30%), 187 (48%), 83 (100%).
ПРИМЕР 56 1,04 (д, 3H, J = 6,6 Гц), 1,46 (д, 3H, J = 6,7 Гц), 3,05-3,08 (м, 1H), 3,74-3,81 (м, 2H), 3,91-3,95 (м, 2H), 4,41 (д, 1H, J = 13,2 Гц), 4,69 (д, 1H, J = 3,2 Гц), 4,82 (д, 1H, J = 13,5 Гц), 7,43-7,45 (м, 2H), 7,68 (с, 1H), 7,91 (с, 1H). Масс-спектр (EI): m/z 432 (36%), 287 (60%), 270 (65%), 227 (30%), 187 (48%), 83 (100%).
ПРИМЕР 562-(S)-(3,5-Бис(трифторметил)бензилокси)-4-(3-(5-оксо-1,2,4- триазоло)метил)-[5-(R),6-(S)- или 5-(S),6-(R)-диметил]-3-(S)-фенилморфолинон В соответствии со способом примера 54 из 86 мг (0,2 ммоль) 2-(S)-(3,5-бис(трифторметил)бензилокси)-[5-(R), 6-(S)- или 5-(S),6-(R)-диметил]-3-(S)-фенилморфолинона (из примера 47, стадия B) получали после флэш-хроматографии на 73 г силикагеля с использованием в качестве элюента смеси хлористый метилен/метанол (95: 5, об. /об. ) 32 мг (30%) желтого масла. 1H ЯМР-спектр (CDCl3, 400 МГц, м. д.):  1,03 (д, 3H, J = 6,7 Гц), 1,40 (д, 3H, J = 6,8 Гц), 3,00 (кд, 1H, J = 3,8 и 6,8 Гц), 3,44 (д, 1H, J = 16,1 Гц), 3,63 (д, 1H, J = 16,9), 3,82 (д, 1H, J = 3,3 Гц), 3,95 (кд, 1H, J = 3,7 и 6,7 Гц), 4,43 (д, 1H, J = 13,5 Гц), 4,73 (д, 1H, J = 3,3 Гц), 4,84 (д, 1H, J = 13,6 Гц), 7,28-7,47 (м, 7H), 7,68 (с, 1H), 9,52 (д, 2H). Масс-спектр (FAB): m/z 531 (M+H, 100%), 287 (55%), 227 (25%), 147 (50%).
ПРИМЕР 57 1,03 (д, 3H, J = 6,7 Гц), 1,40 (д, 3H, J = 6,8 Гц), 3,00 (кд, 1H, J = 3,8 и 6,8 Гц), 3,44 (д, 1H, J = 16,1 Гц), 3,63 (д, 1H, J = 16,9), 3,82 (д, 1H, J = 3,3 Гц), 3,95 (кд, 1H, J = 3,7 и 6,7 Гц), 4,43 (д, 1H, J = 13,5 Гц), 4,73 (д, 1H, J = 3,3 Гц), 4,84 (д, 1H, J = 13,6 Гц), 7,28-7,47 (м, 7H), 7,68 (с, 1H), 9,52 (д, 2H). Масс-спектр (FAB): m/z 531 (M+H, 100%), 287 (55%), 227 (25%), 147 (50%).
ПРИМЕР 572-(S)-(3,5-Бис(трифторметил)бензилокси)-4-(2-(1-(4- бензил)пиперилино)этил)-3-(S)-фенилморфолин В раствор 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенилморфолина (50 мг, 0,12 ммоль) и гидрохлорида 4-бензил-1-(2-хлорэтил)пиперидина (50 мг, 0,18 ммоль) в ацетонитриле (0,5 мл) добавляли диизопропилэтиламин (0,065 мл, 0,36 ммоль) при комнатной температуре. Через 60 ч ТСХ (5% MeOH/2% Et2N/93% EtOAc) показала, что реакция прошла только частично. Реакционную смесь разбавляли хлористым метиленом и промывали водой, затем соляным раствором, сушили над сульфатом натрия и выпаривали. Очисткой продукта препаративной ТСХ (5% MeOH/2% Et3N/93% EtOAc) получали 36 мг (50%) заглавного соединения в виде масла. 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,1-1,4 (м, 2H), 1,4-1,65 (2м, 4H), 1,65-2,05 (м, 3H), 2,05-2,3 (м, 1H), 2,35-2,5 (м и д, J = 7 Гц, 3H), 2,55 (шир. т, J = 11 Гц, 1H), 2,65-2,8 (м, 2H), 3,09 (д, J = 11 Гц, 1H), 3,50 (д, J = 2,5 Гц, 1H), 3,66 (дд, J = 2 и 11 Гц, 1H), 4,15 (дт, J = 2 и 12 Гц, 1H), 4,38 и 4,75 (AB к, J = 13 Гц, 2H), 4,61 (д, J = 2,5 Гц, 1H), 7,06 (д, J = 7 Гц, 2H), 7,15 (т, J = 7 Гц, 1H), 7,2-7,35 (м, 5H), 7,36 (м, 4H), 7,75 (с, 1H).
ПРИМЕР 58 1,1-1,4 (м, 2H), 1,4-1,65 (2м, 4H), 1,65-2,05 (м, 3H), 2,05-2,3 (м, 1H), 2,35-2,5 (м и д, J = 7 Гц, 3H), 2,55 (шир. т, J = 11 Гц, 1H), 2,65-2,8 (м, 2H), 3,09 (д, J = 11 Гц, 1H), 3,50 (д, J = 2,5 Гц, 1H), 3,66 (дд, J = 2 и 11 Гц, 1H), 4,15 (дт, J = 2 и 12 Гц, 1H), 4,38 и 4,75 (AB к, J = 13 Гц, 2H), 4,61 (д, J = 2,5 Гц, 1H), 7,06 (д, J = 7 Гц, 2H), 7,15 (т, J = 7 Гц, 1H), 7,2-7,35 (м, 5H), 7,36 (м, 4H), 7,75 (с, 1H).
ПРИМЕР 58(S)-(4-Фторфенил)глицин Через хиральный синтез Стадия A: 3-(4-Фторфенил)ацетил-4-(S)-бензил-2-оксазолидинон Высушенную в сушильном шкафу 3-горлую колбу на 1 л, снабженную мембраной, отверстием для ввода азота, термометром и магнитной мешалкой, заполняли азотом и загружали раствором 5,09 г (33,0 ммоль) 4-фторфенилуксусной кислоты в 100 мл безводного эфира. Раствор охлаждали до -10oC и обрабатывали 5,60 мл (40,0 ммоль) триэтиламина и затем 4,30 мл (35,0 ммоль) триметилацетилхлорида. Сразу образовался белый осадок. Образованную смесь перемешивали при -10oC в течение 40 мин, затем охлаждали до -78oC. Высушенную в сушильном шкафу круглодонную колбу на 250 мл, снабженную мембраной и магнитной мешалкой, заполняли азотом и загружали раствором 5,31 г (30,0 ммоль) 4-(S)-бензил-2-оксалидинона в 40 мл сухого ТГФ. Раствор перемешивали при охлаждении в бане с сухим льдом и ацетоном в течение 10 мин, затем медленно добавляли 18,8 мл 1,6 М раствора н-бутиллития в гексане. Через 10 мин раствор литированного оксазолидинона добавляли через канюлю в смесь в 3-горлой колбе. Охлаждающую баню убирали и температуру поднимали до 0oC. Реакцию гасили 100 мл насыщенного водного раствора хлорида аммония, смесь переносили в колбу на 1 л и эфир и ТГФ удаляли в вакууме. Концентрированную смесь распределяли между 300 мл хлористого метилена и 50 мл воды, и слои разделяли. Органический слой промывали 200 мл 2 н водного раствора соляной кислоты, 300 мл насыщенного водного раствора бикарбоната натрия, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией остатка на 400 г силикагеля с использованием в качестве элюента смеси гексан/эфир (3:2, об./об.) получали 8,95 г масла, которое при стоянии медленно твердело. Перекристаллизацией продукта из смеси гексан/эфир (10:1) получали 7,89 г (83%) заглавного соединения в виде белого твердого вещества, т.пл. 64-66oC. Масс-спектр (FAB): m/z 314 (M+H, 100%), 177 (м-ArCH2CO+H, 85%), 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  2,76 (дд, 1H, J = 13,2, 9,2), 3,26 (дд, J = 13,2, 3,2), 4,16-4,34 (м, 4H), 4,65-4,70 (м, 1H), 7,02-7,33 (м, 9H).
Анализ. Рассчитано для C18H16FNO: 2,76 (дд, 1H, J = 13,2, 9,2), 3,26 (дд, J = 13,2, 3,2), 4,16-4,34 (м, 4H), 4,65-4,70 (м, 1H), 7,02-7,33 (м, 9H).
Анализ. Рассчитано для C18H16FNO:C 69,00; H 5,57; N 4,47; F 6,06 Найдено: C 68,86; H 5,15; N 4,48; F 6,08. Стадия B: 3-((S)-Азидо-(4-фторфенил)ацетил-4-(S)-бензил-2-оксазолидино Высушенную в сушильном шкафу 3-горлую колбу на 1 л, снабженную мембраной, вводом для азота, термометром и магнитной мешалкой, заполняли азотом и загружали раствором 58,0 мл 1 М раствора бис(триметилсилил) амида калия в толуоле и 85 мл ТТФ и охлаждали до -78oC. Высушенную в сушильном шкафу круглодонную колбу на 250 мл, снабженную мембраной и магнитной мешалкой, заполняли азотом и загружали раствором 7,20 (23,0 ммоль) 3-(4-фторфенил)ацетил-4-(S)-бензил-2-оксазолидинона (из примера 58, стадия A) в 40 мл ТГФ. Раствор ацилоксазолидинона перемешивали при охлаждении в бане сухой лед/ацетон в течение 10 мин, затем переносили через канюлю в раствор бис(триметилсилил)амида калия с такой скоростью, чтобы внутренняя температура смеси поддерживалась ниже -70oC. Колбу ацилоксазолидинона споласкивали 15 мл ТГФ, и этот ТГФ также добавляли через канюлю в реакционную смесь, и полученную смесь перемешивали при -78oC в течение 30 мин. Высушенную в сушильном шкафу круглодонную колбу на 250 мл, снабженную мембраной и магнитной мешалкой, наполняли азотом и загружали раствором 10,89 г (35,0 ммоль) 2,4,6-триизопропилфенилсульфонилазида в 40 мл ТГФ. Раствор азида перемешивали при охлаждении баней сухой лед/ацетон в течение 10 мин, затем переносили через канюлю в реакционную смесь с такой скоростью, чтобы внутренняя температура смеси поддерживалась ниже -70oC. Через 2 мин реакцию гасили 6,0 мл ледяной уксусной кислоты, охлаждающую баню убирали, и смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь распределяли между 300 мл этилацетата и 300 мл насыщенного водного раствора бикарбоната натрия. Органический слой отделяли, сушили над сульфатом магния и концентрировали в вакууме. Флэш-xроматографией остатка на 500 г силикагеля с использованием в качестве элюента смеси гексан/хлористый метилен (2:1, об./об., затем 1:1, об./об.) получали 5,45 г (67%) заглавного соединения в виде масла. ИК-спектр (чистое, см-1): 2104, 1781, 1702. 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  2,86 (дд, 1H, J = 13,2, 9,6), 3,40 (дд, 1H, J = 13,2, 3,2), 4,09-4,19 (м, 2H), 4,62-4,68 (м, 1H), 6,14 (с, 1H), 7,07-7,47 (м, 9H).
Анализ. Рассчитано для C18H15FN4O3: 2,86 (дд, 1H, J = 13,2, 9,6), 3,40 (дд, 1H, J = 13,2, 3,2), 4,09-4,19 (м, 2H), 4,62-4,68 (м, 1H), 6,14 (с, 1H), 7,07-7,47 (м, 9H).
Анализ. Рассчитано для C18H15FN4O3:C 61,01; H 4,27; N 15,81; F 5,36 Найдено: C 60,99; H 4,19; N 15,80; F 5,34. Стадия C: (S)-Азидо-(4-фторфенил)уксусная кислота Раствор 5,40 г (15,2 ммоль) 3-(S)-азидо-(4-фторфенил)ацетил-4-(S)-бензил-2-оксазолидинона (из примера 58, стадия B) в 200 мл смеси ТГФ/вода (3:1, об. /об. ) перемешивали при охлаждении на ледяной бане в течение 10 мин. В виде одной порции добавляли 1,28 г (30,4 ммоль) моногидрата гидроксида лития, и полученную смесь перемешивали на холодe 30 мин. Реакционную смесь распределяли между 100 мл хлористого метилена и 100 мл 25% насыщенного водного раствора бикарбоната натрия, и слои разделяли. Водный слой промывали 2 х 100 мл хлористого метилена и подкисляли до pH 2 добавлением 2 н водного раствора соляной кислоты. Полученную смесь экстрагировали 2 х 100 мл этилацетата; экстракты объединяли, промывали 50 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме, получая 2,30 г (77%) заглавного соединения в виде масла, которое применяли в следующей стадии без дальнейшей очистки. ИК-спектр (чистое, см-1): 2111, 1724. 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  5,06 (с, 1H), 7,08-7,45 (м, 4H), 8,75 (шир. с, 1H).
Стадия D: (S)-(4-Фторфенил)глицин 5,06 (с, 1H), 7,08-7,45 (м, 4H), 8,75 (шир. с, 1H).
Стадия D: (S)-(4-Фторфенил)глицинСмесь 2,30 г (11,8 ммоль) (S)-азидо-(4-фторфенил)уксусной кислоты (из примера 58, стадия C), 250 мг катализатора, 10% палладия на угле, и 160 мл смеси вода/уксусная кислота (3:1, об./об.) перемешивали в атмосфере водорода в течение 18 ч. Реакционную смесь фильтровали через целит и колбу, и фильтровальную лепешку хорошо промывали около 1 л смеси вода/уксусная кислота (3: 1, об. /об.). Фильтрат концентрировали в вакууме до объема около 50 мл. Добавляли 300 мл толуола, и смесь концентрировали до получения твердого вещества, которое суспендировали в смеси метанол/эфир (1:1, об./об.), фильтровали и сушили, получая 1,99 г (100%) заглавного соединения. 1H ЯМР-спектр (400 МГц, D2O + NaOD):  3,97 (с, 1H), 6,77 (прибл. т, 2H, J = 8,8), 7,01 (прибл. т, 2H, J = 5,6).
Через разделение на изомеры 3,97 (с, 1H), 6,77 (прибл. т, 2H, J = 8,8), 7,01 (прибл. т, 2H, J = 5,6).
Через разделение на изомерыСтадия A: 4-Фторфенилацетилхлорид Раствор 150 г (0,974 моль) 4-фторфенилуксусной кислоты и 1 мл N,N-диметилформамида в 500 мл толуола при 40oC обрабатывали 20 мл хлористого тионила и нагревали до 40oC. По каплям добавляли дополнительно 61,2 мл хлористого тионила в течение 1,5 ч. После дополнительного добавления раствор нагревали 1 ч при 50oC, растворитель удаляли в вакууме, и остаточное масло перегоняли при пониженном давлении (1,5 мм рт.ст.), получая 150,4 г (89,5%) заглавного соединения, т. кип. 68-70oC. Стадия B: Метил-2-бром-2-(4-фтор)фенилацетат Смесь 150,4 г (0,872 моль) 4-фторфенилацетилхлорида (из примера 58, стадия A) и 174,5 г (1,09 моль) брома освещали при 40-50oC кварцевой лампой в течение 5 ч. Реакционную смесь добавляли по каплям в 400 мл метанола, и раствор перемешивали 16 ч. Растворитель удаляли в вакууме, и остаточное масло перегоняли при пониженном давлении (1,5 мм рт.ст), получая 198,5 г (92%) заглавного соединения, т. кип. 106-110oC. Стадия C: Метил-(  )(4-фторфенил)глицин )(4-фторфенил)глицинРаствор 24,7 г (0,1 моль)метил-2-бром-2-(4-фтор)фенилацетата (из примера 58, стадия B) и 2,28 г (0,01 моль) хлорида бензилтриэтиламмония в 25 мл метанола обрабатывали 6,8 г (0,105 моль), азида натрия и полученную смесь перемешивали 20 ч при комнатной температуре. Реакционную смесь фильтровали, фильтрат разбавляли 50 мл метанола и гидрировали в присутствии 0,5 г 10% Pd/C при 3,515 ат в течение 1 ч. Раствор фильтровали, и растворитель удаляли в вакууме. Остаток распределяли между 10%-ным водным раствором карбоната натрия и этилацетатом. Органическую фазу промывали водой, насыщенным водным раствором хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме, получая 9,8 г заглавного соединения в виде масла. Стадия D: Метил-(S)-(4-фторфенил)глицинат Раствор 58,4 г метил-(  )-4-фторфенилглицината (из примера 58, стадия C) в 110 мл смеси этанол/вода (7: 1, об./об.) смешивали с раствором 28,6 г (0,0799 моль) O,O’-(+)-дибензоил винной кислоты ((+)-ДБВ)) (28,6 г, 0,0799 моль) в 110 мл смеси этанол/вода (7:1, об./об.), и полученный раствор выдерживали для образования кристаллов при комнатной температуре. После окончания кристаллизации добавляли этилацетат (220 мл), и полученную смесь охлаждали до -20oC и фильтровали, получая 32,4 г метил-(S)-(4-фторфенил)глицината в виде соли с (+)-ДБВ [ee (энантиомерный избыток) = 93,2%]. Маточные растворы концентрировали в вакууме, и свободное основание выделяли распределением между этилацетатом и водным раствором карбоната натрия. Раствор полученного таким образом свободного основания в 110 мл смеси этанол/вода (7:1, об./об.) смешивали с раствором 28,6 (0,0799 моль) O,O’-(-)-дибензоилвинной кислоты ((-)-ДБВ)) (28,6 г, 0,0799 моль) в 110 мл смеси этанол/вода (7:1, об./об.) и полученный раствор выдерживали для образования кристаллов при комнатной температуре. После окончания кристаллизации добавляли этилацетат (220 мл), и образованную смесь охлаждали до -20oC и фильтровали, получая 47,0 г метил-(R)-(4-фторфенил)глицината как соль с (-)-ДБВ (ee = 75,8%). Рециркуляция маточных растворов и добавление (+)-ДБВ дали вторую порцию 7,4 г (S)-(4-фторфенил)глицината как соль с (+)-ДБВ (ee = 96,4%). Две порции (S)-аминоэфира (39,8 г) объединяли в 200 мл смеси этанол/вода (7: 1, об. /об.) и нагревали в течение 30 мин и охлаждали до комнатной температуры. В результате добавления этилацетата, охлаждения и фильтрования получали 31,7 г (S)-(4-фторфенил)глицината как соль с (+)-ДБВ (ee > 98%). Энантиомерный избыток определяли хиральнoй ВЭЖХ (Crownpak CR(+), 5% MeOH в водном HClO4, pH 2, 1,5 мл/мин, 40oC, 200 нм).
Смесь 17,5 г (S)-(4-фторфенил)глицината в виде соли с (+)-ДБВ и 32 мл 5,5 н HCl (32 мл) кипятили с обратным холодильником 1,5 ч. Реакционную смесь концентрировали в вакууме, и остаток растворяли в 40 мл воды. Водный раствор промывали 3 х 30 мл этилацетата, и слои разделяли; pH водного слоя устанавливали 7, применяя гидроксид аммония, и осажденный твердый продукт отделяли фильтрованием. Получали 7,4 г заглавного соединения (ee = 98,8%).
ПРИМЕР 59 )-4-фторфенилглицината (из примера 58, стадия C) в 110 мл смеси этанол/вода (7: 1, об./об.) смешивали с раствором 28,6 г (0,0799 моль) O,O’-(+)-дибензоил винной кислоты ((+)-ДБВ)) (28,6 г, 0,0799 моль) в 110 мл смеси этанол/вода (7:1, об./об.), и полученный раствор выдерживали для образования кристаллов при комнатной температуре. После окончания кристаллизации добавляли этилацетат (220 мл), и полученную смесь охлаждали до -20oC и фильтровали, получая 32,4 г метил-(S)-(4-фторфенил)глицината в виде соли с (+)-ДБВ [ee (энантиомерный избыток) = 93,2%]. Маточные растворы концентрировали в вакууме, и свободное основание выделяли распределением между этилацетатом и водным раствором карбоната натрия. Раствор полученного таким образом свободного основания в 110 мл смеси этанол/вода (7:1, об./об.) смешивали с раствором 28,6 (0,0799 моль) O,O’-(-)-дибензоилвинной кислоты ((-)-ДБВ)) (28,6 г, 0,0799 моль) в 110 мл смеси этанол/вода (7:1, об./об.) и полученный раствор выдерживали для образования кристаллов при комнатной температуре. После окончания кристаллизации добавляли этилацетат (220 мл), и образованную смесь охлаждали до -20oC и фильтровали, получая 47,0 г метил-(R)-(4-фторфенил)глицината как соль с (-)-ДБВ (ee = 75,8%). Рециркуляция маточных растворов и добавление (+)-ДБВ дали вторую порцию 7,4 г (S)-(4-фторфенил)глицината как соль с (+)-ДБВ (ee = 96,4%). Две порции (S)-аминоэфира (39,8 г) объединяли в 200 мл смеси этанол/вода (7: 1, об. /об.) и нагревали в течение 30 мин и охлаждали до комнатной температуры. В результате добавления этилацетата, охлаждения и фильтрования получали 31,7 г (S)-(4-фторфенил)глицината как соль с (+)-ДБВ (ee > 98%). Энантиомерный избыток определяли хиральнoй ВЭЖХ (Crownpak CR(+), 5% MeOH в водном HClO4, pH 2, 1,5 мл/мин, 40oC, 200 нм).
Смесь 17,5 г (S)-(4-фторфенил)глицината в виде соли с (+)-ДБВ и 32 мл 5,5 н HCl (32 мл) кипятили с обратным холодильником 1,5 ч. Реакционную смесь концентрировали в вакууме, и остаток растворяли в 40 мл воды. Водный раствор промывали 3 х 30 мл этилацетата, и слои разделяли; pH водного слоя устанавливали 7, применяя гидроксид аммония, и осажденный твердый продукт отделяли фильтрованием. Получали 7,4 г заглавного соединения (ee = 98,8%).
ПРИМЕР 593-(S)-(4-Фторфенил)-4-бензил-2-морфолинон Стадия A: N-Бензил-(S)-(4-фторфенил)глицин Раствор 1,87 г (11,05 ммоль) (S)-(4-фторфенил)глицина (из примера 58) и 1,12 мл (11,1 ммоль) бензальдегида в 11,1 мл 1 н водного раствора едкого натра и 11 мл метанола при 0oC обрабатывали 165 мг (4,4 ммоль) борогидрида натрия. Охлаждающую баню удаляли, и полученную смесь перемешивали 30 мин при комнатной температуре. В реакционную смесь добавляли вторую порцию бензальдегида (1,12 мл, 11,1 ммоль) и 165 мг (4,4 ммоль) борогидрида натрия, и перемешивание продолжали в течение 1,5 ч. Реакционную смесь распределяли между 100 мл эфира и 50 мл воды, и слои разделяли. Отделяли водный слой и фильтровали для удаления небольшого количества нерастворимого материала. Фильтрат подкисляли до pH 5, применяя 2 н водный раствор соляной кислоты, и твердую часть, которая осадилась, отделяли фильтрованием, промывали тщательно водой, затем эфиром и сушили, получая 1,95 г заглавного соединения. 1H ЯМР-спектр (400 МГц, D2O + NaOD):  3,33 (AB, к, 2H, J = 8,4), 3,85 (с, 1H), 6,79-7,16 (м, 4H).
Стадия B: 3-(S)-(4-Фторфенил)-4-бензил-2-морфолинон 3,33 (AB, к, 2H, J = 8,4), 3,85 (с, 1H), 6,79-7,16 (м, 4H).
Стадия B: 3-(S)-(4-Фторфенил)-4-бензил-2-морфолинонСмесь 1,95 г (7,5 ммоль) N-бензил-(S)-(4-фторфенил)глицина, 3,90 мл (22,5 ммоль) N,N-диизопропилэтиламина, 6,50 мл (75,0 ммоль) 1,2-дибромэтана и 40 мл N,N-диметилформамида перемешивали 20 ч при 100oC (растворение всей твердой части происходит при нагревании). Реакционную смесь охлаждали и концентрировали в вакууме. Остаток распределяли между 250 мл эфира и 100 мл 0,5 н раствора кислого сульфата калия, и слои разделяли. Органический слой промывали 100 мл насыщенного водного раствора бикарбоната натрия, 3 х 150 мл воды, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией остатка на 125 г силикагеля, применяя смесь гексан/эфир (3:1, об. /об.) в качестве элюента, получали 1,58 г (74%) заглавного соединения в виде масла. 1H ЯМР-спектр (400 МГц, CDCl3):  2,65 (дт, J = 3,2, 12,8), 3,00 (дт, 1H, J = 12,8, 2,8), 3,16 (д, 1H, J = 13,6), 3,76 (д, 1H, J = 13,6), 4,24 (с, 1H), 4,37 (дт, 1H, J = 13,2, 3,2), 4,54 (дт, 1H, J = 2,8, 13,2), 7,07-7,56 (м, 9H).
ПРИМЕР 60 2,65 (дт, J = 3,2, 12,8), 3,00 (дт, 1H, J = 12,8, 2,8), 3,16 (д, 1H, J = 13,6), 3,76 (д, 1H, J = 13,6), 4,24 (с, 1H), 4,37 (дт, 1H, J = 13,2, 3,2), 4,54 (дт, 1H, J = 2,8, 13,2), 7,07-7,56 (м, 9H).
ПРИМЕР 602-(S)-(3,5-Бис(трифторметил)бензилокси-3-(S)-(4-фторфенил)-4- бензилморфолин Заглавное соединение получали с выходом 72% из 3-(S)-(4-фторфенил)-4-бензил-2-морфолинона (из примера 59), применяя способы, аналогичные способам примера 15, стадии A и B. 1H ЯМР-спектр (200 МГц, CDCl3 ):  2,37 (дт, J = 3,6, 11,8), 2,83-2,90 (м, 2H), 3,55-3,63 (м, 2H), 3,85 (д, 1H, J = 13,4), 4,14 (дт, 1H, J = 2,0, 11,8), 4,44 (д, 1H, J = 13,6), 4,66 (д, 1H, J = 2,8), 4,79 (д, 1H, J = 13,4), 7,00-7,70 (12H).
ПРИМЕР 61 2,37 (дт, J = 3,6, 11,8), 2,83-2,90 (м, 2H), 3,55-3,63 (м, 2H), 3,85 (д, 1H, J = 13,4), 4,14 (дт, 1H, J = 2,0, 11,8), 4,44 (д, 1H, J = 13,6), 4,66 (д, 1H, J = 2,8), 4,79 (д, 1H, J = 13,4), 7,00-7,70 (12H).
ПРИМЕР 612-(S)-(3,5-Бис(трифторметил)бензилокси-3-(S)-(4-фторфенил)морфолин Заглавное соединение получали с выходом 70% из 2-(S)-(3,5-бис(трифторметил)бензилокси-3-(S)-(4-фторфенил)-4-бензилморфолина (из примера 60), применяя способ, аналогичный способу примера 15, стадия C. Масс-спектр (FAB): m/z 424 (M+H, 40%). 1H ЯМР-спектр (400 МГц, CDCl3):  1,80 (шир. c, 1H), 3,11 (прибл. дд, 1H, J = 2,2, 12,4), 3,25 (дт, J = 3,6, 12,4), 3,65 (прибл. дд, 1H, J = 3,6, 11,4), 4,05 (дт, 1H, J = 2,2, 11,8), 4,11 (д, 1H, J = 2,2), 4,53 (д, 1H, J = 13,6), 7,04 (т, 2H, J = 7,2), 7,33-7,37 (м, 2H), 7,42 (с, 2H), 7,72 (с, 1H).
ПРИМЕР 62 1,80 (шир. c, 1H), 3,11 (прибл. дд, 1H, J = 2,2, 12,4), 3,25 (дт, J = 3,6, 12,4), 3,65 (прибл. дд, 1H, J = 3,6, 11,4), 4,05 (дт, 1H, J = 2,2, 11,8), 4,11 (д, 1H, J = 2,2), 4,53 (д, 1H, J = 13,6), 7,04 (т, 2H, J = 7,2), 7,33-7,37 (м, 2H), 7,42 (с, 2H), 7,72 (с, 1H).
ПРИМЕР 622-(S)-(3,5-Бис(трифторметил)бензилокси-3-(S)-(4-фторфенил)- 4-(3-(5-оксо-1H,4H-1,2,4-триазоло)метилморфолин Заглавное соединение получали с выходом 69% из 2-(S)-(3,5-бис(трифторметил)бензилокси-3-(S)-(4-фторфенил)морфолина (из примера 61), применяя способ, аналогичный способу примера 18. Масс-спектр (FAB): m/z 521 (M+H), 100%).1H ЯМР-спектр (400 МГц, CDCl3):  1,80 (шир. с, 1H), 2,55 (дт, 1H, J = 3,6, 12,0), 2,91 (д, 1H, J = 11,6), 2,93 (д, 1H, J = 14,4), 3,57 (д, 1H, J = 2,8), 3,59 (д, 1H, J = 14,4), 3,67-3,70 (м, 1H), 4,18 (дт, 1H, J = 2,4, 11,6), 4,48 (д, 1H, J = 13,6), 4,65 (д, 1H J = 2,8), 4,84 (д, 1H, J = 13,6), 7,07 (т, 2H, J = 8,4), 7,40 (с, 2H), 7,45-7,48 (м, 2H), 7,68 (с, 2H), 10,04 (шир. с, 1H), 10,69 (шир. с, 1H).
Анализ. Рассчитано для C22H19F7N4O3: 1,80 (шир. с, 1H), 2,55 (дт, 1H, J = 3,6, 12,0), 2,91 (д, 1H, J = 11,6), 2,93 (д, 1H, J = 14,4), 3,57 (д, 1H, J = 2,8), 3,59 (д, 1H, J = 14,4), 3,67-3,70 (м, 1H), 4,18 (дт, 1H, J = 2,4, 11,6), 4,48 (д, 1H, J = 13,6), 4,65 (д, 1H J = 2,8), 4,84 (д, 1H, J = 13,6), 7,07 (т, 2H, J = 8,4), 7,40 (с, 2H), 7,45-7,48 (м, 2H), 7,68 (с, 2H), 10,04 (шир. с, 1H), 10,69 (шир. с, 1H).
Анализ. Рассчитано для C22H19F7N4O3:C 50,78; H 3,68; N 10,77; F 25,55 Найдено: C 50,89; H 3,76; N 10,62; F 25,56. ПРИМЕР 63 2-(S)-(3,5-Бис(трифторметил)бензилокси)-4-((3- пиридил)метилкарбонил)-3-(R)-фенилморфолин Раствор 55 мг (0,315 ммоль) 4-пиридилуксусной кислоты в 1 мл CH2Cl2, содержащем 0,079 мл (0,715 ммоль) N-метилморфолина, 53 мг (0,37 ммоль) HOBt (бутиловый спирт) и 73 мг (0,37 ммоль) EDC, перемешивали 10 мин. Добавляли раствор 2-(S)-(3,5-бис(трифторметил)бензилокси-3-(R)-фенилморфолина (из примера 33) в 1 мл CH2Cl2. После перемешивания в течение 2 ч раствор распределяли между водой и CH2Cl2. Органический слой промывали водой, соляным раствором и сушили фильтрованием через Na2SO4. Фильтрат концентрировали, и остаток очищали флэш-хроматографией, элюируя смесью 70% EtOAc/гексан. Получали 152 мг (100%) продукта. 1H ЯМР-спектр (400 МГц, CDCl3):  3,03-3,85 (м, 5H), 3,95 и 4,4 (шир. с, 1H), 4,66 (д, J = 13 Гц), 4,82 (д, J = 13 Гц, 1H), 5,0 и 5,9 (шир. с, 1H), 5,23 (с, 1H), 7,1-7,65 (м, 7H), 7,8 (м, 3H), 8,43 (шир. с, 2H).
ПРИМЕР 64 3,03-3,85 (м, 5H), 3,95 и 4,4 (шир. с, 1H), 4,66 (д, J = 13 Гц), 4,82 (д, J = 13 Гц, 1H), 5,0 и 5,9 (шир. с, 1H), 5,23 (с, 1H), 7,1-7,65 (м, 7H), 7,8 (м, 3H), 8,43 (шир. с, 2H).
ПРИМЕР 642-(S)-(3,5-Бис(трифторметил)бензилокси)-4-(метоксикарбонилпентил)- 3-(R)-фенилморфолин В раствор 0,259 г (0,64 ммоль) 3-(S)-(3,5-бис(трифторметил)-бензилокси)-3-(R)-фенилморфолина (из примера 33) в 2 мл ДМФ добавляли 0,16 г (0,77 ммоль) метил-6-бромгексаноата, 0,155 г (1,12 ммоль) K2CO3 и 2 кристалла н-Bu4Ni. Полученный раствор нагревали в бане при 60oC в течение 36 ч. В это время ТСХ показывала, что реакция прошла неполностью. Температуру бани поднимали до 100oC. Через 3 ч реакционную смесь охлаждали и разбавляли EtOAc. Раствор EtOAc промывали водой (2 раза), соляным раствором и сушили над Na2SO4. Фильтрат концентрировали, и остаток хроматографировали с использованием смеси 30% EtOAc/гексан, выделяя 220 мг (65%) продукта. 1H ЯМР-спектр (400 МГц, CDCl3):  1,0-1,4 (м, 4H), 1,47 (м, J = 8 Гц, 2H), 1,95 (м, 1H), 2,2 (т, J = 8 Гц, 2H), 2,35 (м, 2H), 2,9 (д, J = 13 Гц, 1H), 3,07 (д, J = 7 Гц, 1H), 3,62 (с, 3H), 3,81 (тд, J = 8 Гц и 2 Гц, 1H), 4,04 (дд, J = 10 Гц и 2 Гц, 1H), 4,36 (д, 7 Гц, 1H), 4,4 (д, J = 13 Гц, 1H), 4,79 (д, J = 13 Гц, 1H), 7,2-7,4 (м, 7H), 7,66 (с, 1H).
ПРИМЕР 65 1,0-1,4 (м, 4H), 1,47 (м, J = 8 Гц, 2H), 1,95 (м, 1H), 2,2 (т, J = 8 Гц, 2H), 2,35 (м, 2H), 2,9 (д, J = 13 Гц, 1H), 3,07 (д, J = 7 Гц, 1H), 3,62 (с, 3H), 3,81 (тд, J = 8 Гц и 2 Гц, 1H), 4,04 (дд, J = 10 Гц и 2 Гц, 1H), 4,36 (д, 7 Гц, 1H), 4,4 (д, J = 13 Гц, 1H), 4,79 (д, J = 13 Гц, 1H), 7,2-7,4 (м, 7H), 7,66 (с, 1H).
ПРИМЕР 652-(S)-(3,5-Бис(трифторметил)бензилокси)-4-(карбоксипентил)-3-(R)- фенилморфолин Раствор 0,15 г (0,28 ммоль) 3-(S)-(3,5-бис(трифторметил)бензилокси)- 4-(метоксикарбонилпентил)-3-(R)-фенилморфолина (из примера 64) в 3 мл MeOH омыляли обработкой 0,5 мл 5 н раствора NaOH при 65oC в течение 40 мин. Раствор охлаждали, концентрировали, и остаток разбавляли водой. В водном растворе устанавливали pH 6 добавлением 2 н HCl, и раствор экстрагировали EtOAc. Органический слой промывали соляным раствором, сушили и концентрировали. Флэш-хроматографией остатка с использованием смеси 50% EtOAc/гексан получали 0,13 г (89%) продукта. 1H ЯМР-спектр (400 МГц, CDCl3):  1,0-1,5 (м, 4H), 1,5 (м, 2H), 2,2 (м, 2H), 2,35 (м, 2H), 2,9 (д, J=13 Гц, 1H), 3,08 (д, J= 7 Гц, 1H), 3,82 (т, J=8 Гц, 1H), 4,09 (д, J=7 Гц, 1H), 4,38 (с, 1H), 4,4 (д, J=13 Гц, 1H), 4,79 (д, J=13 Гц, 1H), 7,2-7,4 (м, 7H), 7,66 (с, 1H).
ПРИМЕР 66 1,0-1,5 (м, 4H), 1,5 (м, 2H), 2,2 (м, 2H), 2,35 (м, 2H), 2,9 (д, J=13 Гц, 1H), 3,08 (д, J= 7 Гц, 1H), 3,82 (т, J=8 Гц, 1H), 4,09 (д, J=7 Гц, 1H), 4,38 (с, 1H), 4,4 (д, J=13 Гц, 1H), 4,79 (д, J=13 Гц, 1H), 7,2-7,4 (м, 7H), 7,66 (с, 1H).
ПРИМЕР 662-(S)-(3,5-Бис(трифторметил)бензилокси)-4-(метиламинокарбонилпентил)- 3-(R)-фенилморфолин Раствор 116 мг (0,22 ммоль) 3-(S)-(3,5-бис(трифторметил)бензилокси)- 4-(карбоксипентил)-3-(R)-фенилморфолина (из примера 65) в 1 мл CH2Cl2 обрабатывали 40 мг (0,29 ммоль) HOBt, 57 мг (0,29 ммоль) EDC и 0,037 мл N-метилморфолина. Через 10 мин добавляли 0,027 мл (0,3 ммоль) водного метиламина (40%), и полученную смесь перемешивали в течение 4 ч. Реакционную смесь разбавляли водой и экстрагировали CH2Cl2. Объединенный слой CH2Cl2 промывали водой, соляным раствором и сушили над Na2SO4 и фильтрат концентрировали. Очисткой остатка флэш-хроматографией с использованием EtOAc получали 0,10 г продукта. 1H ЯМР-спектр (400 МГц, CDCl3):  1,0-1,4 (м, 4H), 1,47 (м, 2H), 1,95 (м, 1H), 2,04 (т, J=8 Гц, 2H), 2,35 (м, 2H), 2,74 (д, J=5 Гц, 3H), 2,89 (д, J=12 Гц, 1H), 3,08 (д, J=7 Гц, 1H), 3,81 (т, J=7 Гц, 1H), 4,02 (д, J=11 Гц, 1H), 4,36 (д, J=7 Гц, 1H), 4,39 (д, J=13 Гц, 1H), 4,79 (д, J=13 Гц, 1H), 5,03 (шир. с, 1H), 7,2-7,4 (м, 7H), 7,65 (с, 1H).
ПРИМЕР 67 1,0-1,4 (м, 4H), 1,47 (м, 2H), 1,95 (м, 1H), 2,04 (т, J=8 Гц, 2H), 2,35 (м, 2H), 2,74 (д, J=5 Гц, 3H), 2,89 (д, J=12 Гц, 1H), 3,08 (д, J=7 Гц, 1H), 3,81 (т, J=7 Гц, 1H), 4,02 (д, J=11 Гц, 1H), 4,36 (д, J=7 Гц, 1H), 4,39 (д, J=13 Гц, 1H), 4,79 (д, J=13 Гц, 1H), 5,03 (шир. с, 1H), 7,2-7,4 (м, 7H), 7,65 (с, 1H).
ПРИМЕР 672-(R)-(3,5-Бис(трифторметил)бензилокси)-3-(S)-фенил-4-бензилморфолин Раствор 2,67 г (10,0 ммоль) 3-(S)-фенил-4-бензил-2-морфолинона (из примера 14) в 40 мл сухого ТГФ охлаждали до -78oC. Охлажденный раствор обрабатывали 12,5 мл 1,0 М раствора (L-Selectride  ) в ТГФ, поддерживая внутреннюю температуру ниже -70oC. Альтернативно может требоваться только 6% избытка (L-Selectride ) в ТГФ, поддерживая внутреннюю температуру ниже -70oC. Альтернативно может требоваться только 6% избытка (L-Selectride ). Полученный раствор перемешивали на холодe в течение 45 мин и добавляли 3,60 мл (20,0 ммоль) 3,5-бис(трифторметил)бензоилхлорида. Образованную желтую смесь перемешивали на холодe в течение 30 мин, и реакцию гасили добавлением 50 мл насыщенного водного раствора бикарбоната натрия. Альтернативно для гашения можно применять уксусную кислоту. Смесь после гашения распределяли между 300 мл эфира и 50 мл воды, и слои разделяли. Органический слой сушили над сульфатом магния. Водный слой экстрагировали 300 мл эфира, экстракт сушили и объединяли с первым органическим слоем. Объединенный слой концентрировали в вакууме. Флэш-хроматографией остатка на 150 г силикагеля с использованием в качестве элюента смеси гексан/эфир (37: 3, об./об.) получали 4,06 г (80%) заглавного соединения в виде твердого вещества. 1H ЯМР-спектр (CDCl3, 200 МГц, м.д.): ). Полученный раствор перемешивали на холодe в течение 45 мин и добавляли 3,60 мл (20,0 ммоль) 3,5-бис(трифторметил)бензоилхлорида. Образованную желтую смесь перемешивали на холодe в течение 30 мин, и реакцию гасили добавлением 50 мл насыщенного водного раствора бикарбоната натрия. Альтернативно для гашения можно применять уксусную кислоту. Смесь после гашения распределяли между 300 мл эфира и 50 мл воды, и слои разделяли. Органический слой сушили над сульфатом магния. Водный слой экстрагировали 300 мл эфира, экстракт сушили и объединяли с первым органическим слоем. Объединенный слой концентрировали в вакууме. Флэш-хроматографией остатка на 150 г силикагеля с использованием в качестве элюента смеси гексан/эфир (37: 3, об./об.) получали 4,06 г (80%) заглавного соединения в виде твердого вещества. 1H ЯМР-спектр (CDCl3, 200 МГц, м.д.):  2,50 (дт, J=3,4, 12,0, 1H), 2,97 (прибл. д, J=12,0, 1H), 2,99 (д, J=13,6, 1H), 3,72-3,79 (м, 1H), 3,82 (д, J= 2,6, 1H), 4,00 (д, J=13,6, 1H), 4,20 (дт, J=2,4, 11,6), 6,22 (д, J= 2,6, 1H), 7,22-7,37 (м, 7H), 7,57 (прибл. д, J=6,8, 2H), 8,07 (с, 1H), 8,47 (с, 2H).
Анализ. Рассчитано для C26H21F6NO3: 2,50 (дт, J=3,4, 12,0, 1H), 2,97 (прибл. д, J=12,0, 1H), 2,99 (д, J=13,6, 1H), 3,72-3,79 (м, 1H), 3,82 (д, J= 2,6, 1H), 4,00 (д, J=13,6, 1H), 4,20 (дт, J=2,4, 11,6), 6,22 (д, J= 2,6, 1H), 7,22-7,37 (м, 7H), 7,57 (прибл. д, J=6,8, 2H), 8,07 (с, 1H), 8,47 (с, 2H).
Анализ. Рассчитано для C26H21F6NO3:C 61,29; H 4,16; N 2,75; F 22,38 Найдено: C 61,18; H 4,14; N 2,70; F 22,13. ПРИМЕР 68 2-(R)-(1-(3,5-Бис(трифторметил)фенил) этенилокси)-3-(S)-фенил-4-бензилморфолин Стадия А: Диметилтитаноцен Раствор 2,49 г (10,0 ммоль) титаноцендихлорида в 50 мл эфира в темноте при 0oC обрабатывали 17,5 мл 1,4 М раствора метиллития в эфире, поддерживая внутреннюю температуру ниже 5oC. Полученную желто-оранжевую смесь перемешивали при комнатной температуре в течение 30 мин, и реакцию гасили медленным добавлением 25 г льда. Реакционную смесь после гашения разбавляли 50 мл эфира и 25 мл воды, и слои разделяли. Органический слой сушили над сульфатом магния и концентрировали в вакууме, получая 2,03 г (98%) заглавного соединения в виде светочувствительного твердого продукта. Альтернативно диметилферроцен можно получить из метилмагнийхлорида. Диметилтитаноцен можно хранить в виде раствора в толуоле при 0oC в течение по меньшей мере 2 недель без видимого химического разрушения. 1H ЯМР-спектр CDCl3, 200 МГц, м.д.):  0,15 (с, 6H), 6,06 (с, 10H).
Стадия В: 2-(R)-(1- (3,5-Бис(трифторметил)фенил)этенилокси)-3-(S)-фенил-4- бензилморфолин 0,15 (с, 6H), 6,06 (с, 10H).
Стадия В: 2-(R)-(1- (3,5-Бис(трифторметил)фенил)этенилокси)-3-(S)-фенил-4- бензилморфолинРаствор 2,50 г (4,9 ммоль) 2-(R)-(3,5-бис(трифторметил) бензоилокси)-3-(S)-фенил-4-бензилморфолина (из примера 67) и 2,50 г (12,0 ммоль) диметилтитаноцена (из примера 68, стадия А) в 35 мл смеси ТГФ/толуол (1:1, об. /об. ) перемешивали при нагревании на масляной бане при 80oC в течение 16 ч. Реакционную смесь охлаждали и концентрировали в вакууме. Флэш-хроматографией остатка на 150 г силикагеля с применением в качестве элюента смеси гексан/хлористый метилен (3:1, об./об.), получая 1,71 г (69%) заглавного соединения в виде твердого вещества. Альтернативно продукт можно выделить кристаллизацией из метанола с последующим осаждением титановых остатков. Масс-спектр (FAB): m/z 508 (М+H, 25%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  2,42 (дт, J= 3,6, 12,0, 1H), 2,89 (прибл. д, J =11,6), 2,92 (д, J=13,6, 1H), 3,61-3,66 (м, 1H), 3,73 (д, J=2,8, 1H), 4,00 (д,J =13,6 1H), 4,09 (дт, J= 2,4, 11,6, 1H), 4,75 (д, J=2,8, 1H), 4,79 (д, J=2,8, 1H), 5,36 (д, J=2,4, 1H), 7,23-7,41 (м, 7H), 7,63 (прибл. д, J=7,3, 2H), 7,79 (с, 1H), 7,91 (с, 2H).
Анализ. Рассчитано для C27H23F6NO2: 2,42 (дт, J= 3,6, 12,0, 1H), 2,89 (прибл. д, J =11,6), 2,92 (д, J=13,6, 1H), 3,61-3,66 (м, 1H), 3,73 (д, J=2,8, 1H), 4,00 (д,J =13,6 1H), 4,09 (дт, J= 2,4, 11,6, 1H), 4,75 (д, J=2,8, 1H), 4,79 (д, J=2,8, 1H), 5,36 (д, J=2,4, 1H), 7,23-7,41 (м, 7H), 7,63 (прибл. д, J=7,3, 2H), 7,79 (с, 1H), 7,91 (с, 2H).
Анализ. Рассчитано для C27H23F6NO2:С 63,90; H 4,57; N 2,76; F 22,46 Найдено: С 63,71; H 4,53; N 2,68; F 22,66. ПРИМЕР 69 2-(R)-(1-(S)-(3,5-Бис(трифторметил)фенил)этокси)- 3-(S)-фенилморфолин и 2-(S)-(1-(S)-(3,5-бис(трифторметил) фенил)этокси)-3-(S)-фенилморфолин Смесь 1,50 г (2,9 ммоль) 2-(R-)-(1-(3,5-бис(трифторметил)фенил) этенилокси)-3-(S)-фенил-4- бензилморфолина (из примера 68) и 750 мг катализатора. 10% палладия на угле, в 25 мл смеси изопропанол/этилацетат (3:2, об./об.) перемешивали в атмосфере водорода в течение 48 ч. Альтернативно гидрирование можно проводить с применением 5% палладия на оксиде алюминия. Катализатор отделяли фильтрованием на подушке целита, колбу для проведения реакции и фильтровальную подушку промывали 500 мл этилацетата. Фильтрат концентрировали в вакууме. Флэш-хроматографией остатка на 60 г силикагеля при использовании в качестве элюента смеси гексан/эфир (2:1, об./об.), затем смеси гексан/эфир (2:1, об./об.) получали 106 мг 2-(R)-(1-(S)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)- фенилморфолина и 899 мг 2-(R) -(1-(R)-(3,5-бис(трифторметил)- фенил) этокси)-3-(S)-фенилморфолина. Оба представляют собой масло (общий выход 84%). Для 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-фенилморфолина: масс-спектр (C1): m/z 420 (М+, 20%), 178 (100%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,46 (д, J=6,8), 1,92 (шир. с, 1H), 3,13 (дд, J= 3,0, 12,6, 1H), 3,24 (дт, J=3,6, 12,6 1H), 3,62 (дд, J=3,6, 11,2), 4,04 (д, J= 2,4, 1H), 4,14 (дт, J=3,0, 11,2, 1H), 4,48 (д, J=2,4 1H), 4,90 (к, J=6,8, 1H), 7,21-7,23 (м, 7H), 7,64 (с, 1H).
Анализ. Рассчитано для С20H19F6NO2: 1,46 (д, J=6,8), 1,92 (шир. с, 1H), 3,13 (дд, J= 3,0, 12,6, 1H), 3,24 (дт, J=3,6, 12,6 1H), 3,62 (дд, J=3,6, 11,2), 4,04 (д, J= 2,4, 1H), 4,14 (дт, J=3,0, 11,2, 1H), 4,48 (д, J=2,4 1H), 4,90 (к, J=6,8, 1H), 7,21-7,23 (м, 7H), 7,64 (с, 1H).
Анализ. Рассчитано для С20H19F6NO2:С 57,28; H 4,57; N 3,34; F 27,18 Найдено: С 57,41; H 4,13; N 3,29; F 27,23. ПРИМЕР 70 2-(R)-(1-(R)-(3,5-Бис(трифторметил)фенил)этокси)- 3-(S)-фенил-4-(3-(5-окco-1,2,4-триазоло)метилморфолин Стадия А: 2-(R)-(1-(R)-(3,5-Бис(трифторметил)фенил)этокси)-3-(S) фенил-4-(2-(N-метилкарбоксиацетамидразоно)морфолин Раствор 945 мг (2,3 ммоль) 2-(R)-(1-(R)-(3,5-бис(трифторметил) фенил)этокси)-3-(S)-фенилморфолина (из примера 69), 447 мг (2,7 ммоль) N-метилкарбокси-2-хлорацетамидразона (из примера 45, стадия А) и 0,78 мл (4,5 ммоль) N, N-диизопропилэтиламина в 17 мл ацетонитрила перемешивали 20 ч при комнатной температуре. Альтернативно алкилирование можно проводить в диметилсульфоксиде, применяя карбонат калия в качестве основания. Реакционную смесь концентрировали в вакууме, и остаток распределяли между 50 мл хлористого метилена и 25 мл воды. Органический слой отделяли, сушили над сульфатом магния и концентрировали в вакууме. Флэш-хроматографией остатка на 50 г силикагеля с использованием в качестве элюента смеси хлористый метилен/метанол/гидроксид аммония (50: 1:0,1) получали 1,12 г (90%) заглавного соединения в виде пены. Стадия В: 2-(R)-(1-(R)-(3,5-Бис(трифторметил)фенил)этокси)- 3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин Раствор 1,01 г (1,8 ммоль) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-фенил) этокси)-3-(S)-фенил-4-(2-(N – метилкарбокси-ацетамидразоно)-морфолина (из примера 70, стадия А) в 15 мл ксилолов 2 ч кипятили с обратным холодильником. Может присутствовать диизопропилэтиламин. Реакционную смесь охлаждали и концентрировали в вакууме. Флэш-хроматографией остатка на 50 г силикагеля при использовании смеси хлористый метилен/метанол/гидроксид аммония (50:1: 0,1) в качестве элюента получали 781 мг (76%) заглавного соединения в виде твердого вещества. Неочищенный продукт можно также выделить непосредственно охлаждением реакционной смеси. Очищенный продукт можно получить кристаллизацией из горячего метанола (обесцвечивание древесным углем) и растиранием с водой. Масс-спектр (FAB): m/z 517 (М+H, 18%), 178 (100%), 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,47 (д, J=6,8), 2,01-2,05 (м, 2H), 2,55 (дт, J= 3,6, 12,0, 1H), 2,91 (д, J=10,8, 1H), 2,95 (д, J=14,8, 1H), 3,49 (д, J=2,4 1H), 3,65 (д, J= 14,8, 1H), 3,69 (д, J=10,8, 1H), 4,29 (дт, J=2,4, 10,0), 4,38 (д, J= 2,8 1H), 4,88 (к, J=6,8, 1H), 7,14 (c, 2H), 7,33-7,40 (м, 5H), 7,62 (с, 1H), 9,91 (шир. с, 1H), 10,16 (шир. с, 1H).
Анализ. Рассчитано для C23H22F6N4O3.
С 53,49; H 4,06; N 10,85; F 22,07 1,47 (д, J=6,8), 2,01-2,05 (м, 2H), 2,55 (дт, J= 3,6, 12,0, 1H), 2,91 (д, J=10,8, 1H), 2,95 (д, J=14,8, 1H), 3,49 (д, J=2,4 1H), 3,65 (д, J= 14,8, 1H), 3,69 (д, J=10,8, 1H), 4,29 (дт, J=2,4, 10,0), 4,38 (д, J= 2,8 1H), 4,88 (к, J=6,8, 1H), 7,14 (c, 2H), 7,33-7,40 (м, 5H), 7,62 (с, 1H), 9,91 (шир. с, 1H), 10,16 (шир. с, 1H).
Анализ. Рассчитано для C23H22F6N4O3.
С 53,49; H 4,06; N 10,85; F 22,07Найдено: С 53,64; H 4,33; N 10,81; F 22,27. ПРИМЕР 71 2-(R)-(1-(S)-(3,5-Бис (трифторметил) фенил) этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин Заглавное соединение получали с выходом 32% из 2-(R)-(1- (R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-фенилморфолина (из примера 69) способом, аналогичным способу примера 70. Масс-спектр (FAB): m/z 517 (М+H, 100%), 259 (50%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,09 (д, J= 6,4, 3H), 2,27-2,53 (м, 1H), 2,83 (прибл. д, J= 11,6, 1H), 2,95 (д, J=14,0, 1H), 3,51-3,65 (м, 3H), 4,01 (прибл. т, J=11,6 1H), 4,60 (к, J=6,4, 1H), 4,84 (д, J= 2,4, 1H), 7,33-7,51 (м, 5H), 7,74 (с, 2H), 7,76 (с, 1H), 9,51 (шир. с, 1H), 10,00 (шир. с, 1H).
ПРИМЕР 72 1,09 (д, J= 6,4, 3H), 2,27-2,53 (м, 1H), 2,83 (прибл. д, J= 11,6, 1H), 2,95 (д, J=14,0, 1H), 3,51-3,65 (м, 3H), 4,01 (прибл. т, J=11,6 1H), 4,60 (к, J=6,4, 1H), 4,84 (д, J= 2,4, 1H), 7,33-7,51 (м, 5H), 7,74 (с, 2H), 7,76 (с, 1H), 9,51 (шир. с, 1H), 10,00 (шир. с, 1H).
ПРИМЕР 722-(R)-(3,5-Бис(трифторметил)бензоилокси)-3-(S)- (4-фтор) фенил-4-бензилморфолин Заглавное соединение получают с выходом 83% из 3-(R)- (4-фтор)фенил-4-бензил-2-морфолинона (из примера 59) способом, аналогичным примеру 67. Масс-спектр (FAB): m/z 528 (M+H, 25%), 270 (100%). 1H ЯМР-спектр (CDCl3, 400 МГц, м. д.):  2,50 (дт, J=3,2, 12,0, 1H), 2,96 (прибл. д, J=12,0 1H), 2,98 (д, J= 13,6, 1H), 3,74-3,78 (м, 1H), 3,81 (д, J=2,8, 1H), 3,94 (д, J=13,6, 1H), 4,19 (дт, J= 2,0, 12,0), 6,20 (д, J= 2,8, 1H), 6,99 (т, J=8,4, 2H), 7,27-7,38 (м, 5H), 7,52-7,56 (м, 2H), 8,09 (с, 1H), 8,46 (с, 2H).
ПРИМЕР 73 2,50 (дт, J=3,2, 12,0, 1H), 2,96 (прибл. д, J=12,0 1H), 2,98 (д, J= 13,6, 1H), 3,74-3,78 (м, 1H), 3,81 (д, J=2,8, 1H), 3,94 (д, J=13,6, 1H), 4,19 (дт, J= 2,0, 12,0), 6,20 (д, J= 2,8, 1H), 6,99 (т, J=8,4, 2H), 7,27-7,38 (м, 5H), 7,52-7,56 (м, 2H), 8,09 (с, 1H), 8,46 (с, 2H).
ПРИМЕР 732-(R)-(1-(3,5-Бис(трифторметил)фенил) этенилокси)-3-(S)-(4-фтор)-фенил-4-бензилморфолин Заглавное соединение получают с выходом 60% из 3-(R)-(3,5-бис (трифторметил)бензилокси)-3-(S)-(4-фтор)фенил-4- бензилморфолина (пример 72) способом, аналогичным способу примера 68. Масс-спектр (FAB): m/z 526 (М+H, 75%), 270 (100%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  2,42 (дт, J=3,6, 12,0), 2,90 (прибл. д, J=12,0, 1H), 2,91 (д, J=13,6, 1H), 3,62-3,66 (м, 1H), 3,72 (д, J=2,6), 3,94 (д, J=13,6, 1H), 4,09 (дт, J=2,4, 12.0, 1H), 4,75 (д, J= 3,2, 1H), 4,82 (д, J=3,2, 1H), 5,32 (д, J=2,6, 1H), 7,09 (т, J=8,8, 2H), 7,24-7,33 (м, 5H), 7,58-7,62 (м, 2H), 7,80 (с, 1H), 7,90 (c, 2H).
ПРИМЕР 74 2,42 (дт, J=3,6, 12,0), 2,90 (прибл. д, J=12,0, 1H), 2,91 (д, J=13,6, 1H), 3,62-3,66 (м, 1H), 3,72 (д, J=2,6), 3,94 (д, J=13,6, 1H), 4,09 (дт, J=2,4, 12.0, 1H), 4,75 (д, J= 3,2, 1H), 4,82 (д, J=3,2, 1H), 5,32 (д, J=2,6, 1H), 7,09 (т, J=8,8, 2H), 7,24-7,33 (м, 5H), 7,58-7,62 (м, 2H), 7,80 (с, 1H), 7,90 (c, 2H).
ПРИМЕР 742-(R)-(1-(S)-(3,5-Бис(трифторметил)фенил)этокси)- 3-(S)-(4-фтор)фенилморфолин и 2-(S)-(1-(R)-(3,5-бис (трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенилморфолин Смесь 1,83 г (3,5 ммоль) 2-(R)-(1-(3,5-бис(трифторетил)фенил)этенилокси) – 3-(S)-(4-фтор)фенил-4-бензилморфолина (из примера 73) и 800 мг катализатора, 5%-ного родия на оксиде алюминия, в 40 мл абсолютного этанола перемешивали в атмосфере водорода в течение 24 ч. Катализатор отделяли фильтрованием на подушке целита, реакционную колбу и фильтровальную лепешку промывали 200 мл этилацетата. Фильтрат концентрировали в вакууме, и остаток отсасывали в высоком вакууме (1 мм рт.ст., комнатная температура) досуха. Остаток повторно растворяли в 40 мл изопропанола, добавляли 800 мг катализатора, 10%-ный палладий на угле, и полученную смесь перемешивали в атмосфере водорода в течение 24 ч. Катализатор фильтровали на подушке целита, реакционную колбу и фильтровальную лепешку промывали 200 мл этилацетата. Фильтрат концентрировали в вакууме. Флэш-хроматографией остатка на 50 г силикагеля с использованием в качестве элюента смеси гексан/эфир (2:1, об./об.), затем гексан/эфир (3: 2, об. /об. ) получали 283 мг 2- (R)-(1-(S)-(3,5-бис(трифторметил) фенил)этокси)-3-(S)-(4- фтор)фенилморфолина и 763 мг 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенилморфолина, оба в виде масла (общий выход 68%). Для 2-(R)-(1-(S)-(3,5-бис(трифторметил)фенил)этокси)-3- (S)-(4-фтор)фенилморфолина: масс-спектр (FAB): m/z 438 (М+H, 65%), 180 (100%). 1H ЯМР-спектр (CDCl3 400 МГц, м.д.):  1,47 (д, J=6,8, 3H), 1,87 (шир. с, 1H), 3,03 (дд, J=2,8, 12,8), 3,17 (дт, J=4,0, 12,4, 1H), 3,43-3,47 (м, 1H), 3,80 (дт, J=3,2, 11,6), 4,10 (д,J =2,2, 1H), 4,70 (к, J=6,8, 1H), 4,87 (д, J=2,2, 1H), 6,99-7,03 (м, 2H), 7,23-7,27 (м, 2H), 7,63 (с, 2H), 7,66 (с, 1H).
Для 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил) этокси)-3-(S)-(4-фтор)фенилморфолина: масс-спектр (FAB): m/z 438 (М+H, 76,5%), 180 (100%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.): 1,47 (д, J=6,8, 3H), 1,87 (шир. с, 1H), 3,03 (дд, J=2,8, 12,8), 3,17 (дт, J=4,0, 12,4, 1H), 3,43-3,47 (м, 1H), 3,80 (дт, J=3,2, 11,6), 4,10 (д,J =2,2, 1H), 4,70 (к, J=6,8, 1H), 4,87 (д, J=2,2, 1H), 6,99-7,03 (м, 2H), 7,23-7,27 (м, 2H), 7,63 (с, 2H), 7,66 (с, 1H).
Для 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил) этокси)-3-(S)-(4-фтор)фенилморфолина: масс-спектр (FAB): m/z 438 (М+H, 76,5%), 180 (100%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,16 (д, J=6,8), 1,80 (шир. с, 1H), 3,13 (дд, J= 3,2, 12,4), 3,23 (дт, J=3,6, 12,4), 3,63 (дд, J =2,4, 11,2), 4,01 (д, J=2,4, 1H), 4,13 (дт, J=3,2, 12,0), 4,42 (д, J=2,4, 1H), 4,19 (к, J=6,8, 1H), 7,04-7,09 (м, 2H), 7,27-7,40 (м, 4H), 7,73 (c, 2H).
ПРИМЕР 75 1,16 (д, J=6,8), 1,80 (шир. с, 1H), 3,13 (дд, J= 3,2, 12,4), 3,23 (дт, J=3,6, 12,4), 3,63 (дд, J =2,4, 11,2), 4,01 (д, J=2,4, 1H), 4,13 (дт, J=3,2, 12,0), 4,42 (д, J=2,4, 1H), 4,19 (к, J=6,8, 1H), 7,04-7,09 (м, 2H), 7,27-7,40 (м, 4H), 7,73 (c, 2H).
ПРИМЕР 752-(R)-(1-(R)-(3,5- Бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)-фенил-4-(3-(5- оксо-1,2,4-триазоло)метилморфолин Заглавное соединение получали с выходом 79% из 2-(R)-(1- (R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор) фенилморфолина (из примера 74) способами, аналогичными способам примера 70. Масс-спектр (FAB): m/z 535 (М+H, 100%), 277 (60%). 1H ЯМР-спектр (CDCl3+CD3OD, 400 МГц, м.д.):  1,48 (д, J=6,8, 3H), 2,52 (прибл. т, J=10,4, 1H), 2,85-2,88 (м, 2H), 3,47 (д, J= 2,8, 1H), 3,63 (д, J=14,4, 1H), 3.70 (дд, J=2,0, 11,6, 1H), 4,24 (прибл. т, J= 10,8, 1H), 4,35 (д, J =2,8, 1H), 4,91 (к, J=6,8, 1H), 7,07 (прибл. т, J= 8,4, 2H), 7,15 (c, 2H), 7,37-7,40 (м, 2H), 7,65 (c, 1H).
ПРИМЕР 76 1,48 (д, J=6,8, 3H), 2,52 (прибл. т, J=10,4, 1H), 2,85-2,88 (м, 2H), 3,47 (д, J= 2,8, 1H), 3,63 (д, J=14,4, 1H), 3.70 (дд, J=2,0, 11,6, 1H), 4,24 (прибл. т, J= 10,8, 1H), 4,35 (д, J =2,8, 1H), 4,91 (к, J=6,8, 1H), 7,07 (прибл. т, J= 8,4, 2H), 7,15 (c, 2H), 7,37-7,40 (м, 2H), 7,65 (c, 1H).
ПРИМЕР 762-(R)-(1-(S)-(3,5-Бис(трифторметил)фенил) этокси)-3-(S)-(4-фтор)-фенил-4-(3-(5-оксо-1, 2, 4-триазоло) метилморфолин Заглавное соединение получали с выходом 60% из 2-(R)-(1- (S)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор) фенилморфолина (из примера 74) способом, аналогичным способу примера 70. Масс-спектр (FAB): m/z 535 (М+H, 50%), 293 (100%), 1H ЯМР-спектр (CDCl3+CD3OD), 400 МГц, м.д.):  1,11 (д, J= 6,8, 3H), 2,49 (дт, J =2,4, 11,2), 2,83 (прибл. д, J =11,2, 1H), 2,95 (д, J= 14,4, 1H), 2,48-2,58 (м, 3H), 3,99 (прибл. т, J=9,6, 1H), 4,61 (к, J =6,4, 1H), 4,81 (д, J= 2,4, 1H), 7,09 (т, J =8,8, 2H), 7,50-7,53 (м, 2H), 7,75 (прибл. с, 1H), 10,40 (шир. с, 1H), 11,00 (шир. с, 1H).
ПРИМЕР 77 1,11 (д, J= 6,8, 3H), 2,49 (дт, J =2,4, 11,2), 2,83 (прибл. д, J =11,2, 1H), 2,95 (д, J= 14,4, 1H), 2,48-2,58 (м, 3H), 3,99 (прибл. т, J=9,6, 1H), 4,61 (к, J =6,4, 1H), 4,81 (д, J= 2,4, 1H), 7,09 (т, J =8,8, 2H), 7,50-7,53 (м, 2H), 7,75 (прибл. с, 1H), 10,40 (шир. с, 1H), 11,00 (шир. с, 1H).
ПРИМЕР 772-(R)-(1-(R)-(3-(Трифторметил) фенил) этокси)-3- (S)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин Стадия A: 2-(R)-(1-(R)-(3-(трифторметил)фенил)этокси)-3-(S) – фенилморфолин Заглавное соединение получали с выходом 25% из 3- (S)-фенил-4-бензил-2-морфолинона (из примера 14) способами, аналогичными способам примеров 67-69. 1H ЯМР-спектр (CDCl2, 400 МГц, м.д.):  1,39 (д, J =6,6, ЗH), 1,93 (шир. с, 1H), 3,10 (дд, J =3,0, 12,7, 1H), 3,20 (дт, J =3,6, 12,4, 1H), 3,58 (ддд, J =l,l, 3,8, 11,2, 1H), 4,00 (д, J =2,4, 1H), 4,12 (дт, J=3,0, 11,2, 1H), 4,44 (д, J =2,4, 1H), 4,79 (к, J=6,6, 1H), 6,72 (д, J =7,7, 1H), 7,01 (c, 1H), 7,09 (т, J=7,7, 1H), 7,18-7,25 (м, 2H), 7,25-7,3 (м, 3H), 7,34 (д, J =7,7, 1H).
Анализ. Рассчитано для C19H19F3N1O2: 1,39 (д, J =6,6, ЗH), 1,93 (шир. с, 1H), 3,10 (дд, J =3,0, 12,7, 1H), 3,20 (дт, J =3,6, 12,4, 1H), 3,58 (ддд, J =l,l, 3,8, 11,2, 1H), 4,00 (д, J =2,4, 1H), 4,12 (дт, J=3,0, 11,2, 1H), 4,44 (д, J =2,4, 1H), 4,79 (к, J=6,6, 1H), 6,72 (д, J =7,7, 1H), 7,01 (c, 1H), 7,09 (т, J=7,7, 1H), 7,18-7,25 (м, 2H), 7,25-7,3 (м, 3H), 7,34 (д, J =7,7, 1H).
Анализ. Рассчитано для C19H19F3N1O2:C 65,14; H 5,47; N 4,00; F 16,27 Найдено: С 64,89; H 5,73; N 3,83; F 15,95. Стадия В: 2-(R)-(1-R)-(3-(Трифторметил)фенил)этокси)-3- (S)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин Заглавное соединение получали с выходом 90% из 2-(R)-(1- R)-(3-(трифторметил)фенил)этокси)-3-(S)-фенилморфолина (из примера 77, стадия А) способом, аналогичном способу примера 70. 1H ЯМР-спектр (CDCl3 400 МГц, м.д. ):  1,4 (д, J=6,3, 3H), 2,53 (шир. т, J=11,2, 1H), 2,86 (прибл. д, J=12,2, 1H), 2,94 (д, J=14,3, 1H), 3,44 (шир. с, 1H), 3,63 (шир. д, J=14, 2H), 4,27 (прибл. т, J=11,5, 1H), 4,34 (д, J =2,1, 1H), 4,76 (к, J=6,7, 1H), 6,63 (д, J=7,7, 1H), 6,93 (c, 1H), 7,06 (т, J=7,6, 1H), 7,25-7,45 (м, 6H), 9,63 (шир. с, 1H), 9.74 (шир. с, 1H).
Анализ. Рассчитано для C22H22F3N4O3: 1,4 (д, J=6,3, 3H), 2,53 (шир. т, J=11,2, 1H), 2,86 (прибл. д, J=12,2, 1H), 2,94 (д, J=14,3, 1H), 3,44 (шир. с, 1H), 3,63 (шир. д, J=14, 2H), 4,27 (прибл. т, J=11,5, 1H), 4,34 (д, J =2,1, 1H), 4,76 (к, J=6,7, 1H), 6,63 (д, J=7,7, 1H), 6,93 (c, 1H), 7,06 (т, J=7,6, 1H), 7,25-7,45 (м, 6H), 9,63 (шир. с, 1H), 9.74 (шир. с, 1H).
Анализ. Рассчитано для C22H22F3N4O3:C 59,06; H 4,96; N 12,52; F 12,74 Найдено: С 58,84; H 5,17; N 12,37; F 12,50. ПРИМЕР 78 2-(R)-(1-(R)-(3-(Фтор-5-(трифторметил) фенил) этокси-3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин Стадия А: 2-(R)-(1-(R)-(3-(фтор)-5-(трифторметил) фенил)этокси)-3-(S)-фенилморфолин Заглавное соединение получали с выходом 44% из 3-(S)-фенил- 4-бензил-2-морфолинона (из примера 14) способами, аналогичными способам примеров 67-69. 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,38 (д, J=6,6, 3H), 1,90 (шир. с, 1H), 3,17 (дд, J=3,0, 12,7, 1H), 3,18 (дт, J=3,6, 12,7, 1H), 3,58 (ддд, J= 1,1, 3,8, 11,2, 1H), 4,02 (д, J=2,3, 1H), 4,11 (дт, J=3,0, 11,2, 1H), 4,44 (д, J=2,3, 1H), 4,78 (к, J=6,6, 1H), 6,29 (д, J=9,2, 1H), 6,85 (c, 1H), 7,03 (т, J=8,4, 1H), 7,18-7,26 (м, 2H), 7,26-7,3 (м, 3H).
Анализ: Рассчитано для C19H18F4N1O2: 1,38 (д, J=6,6, 3H), 1,90 (шир. с, 1H), 3,17 (дд, J=3,0, 12,7, 1H), 3,18 (дт, J=3,6, 12,7, 1H), 3,58 (ддд, J= 1,1, 3,8, 11,2, 1H), 4,02 (д, J=2,3, 1H), 4,11 (дт, J=3,0, 11,2, 1H), 4,44 (д, J=2,3, 1H), 4,78 (к, J=6,6, 1H), 6,29 (д, J=9,2, 1H), 6,85 (c, 1H), 7,03 (т, J=8,4, 1H), 7,18-7,26 (м, 2H), 7,26-7,3 (м, 3H).
Анализ: Рассчитано для C19H18F4N1O2:C 61,95; H 4,93; N 3,80; F 20,63 Найдено: C 61,78; H 5,14; N 3,71; F 20,35. Стадия В: 2-(R)-(1-(R)-(3-(Фтор)-5- (трифторметил)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1, 2, 4-триазоло)метилморфолин Заглавное соединение получали с выходом 77% из 2-(R)-(1-(R)-(3-(фтор)-5-(трифторметил)фенил) этокси)-3-(S)-фенилморфолина (из примера 78, стадия А) способом, аналогичным способу примера 70. 1H ЯМР-спектр (CDCl3, 400 МГц, м. д.):  1,40 (д, J =6,3, 3H), 2,54 (шир. т, J=11, 1H), 2,87 (прибл. д, J = 12, 1H), 2,94 (д, J =14, 1H), 3,47 (шир. с, 1H), 3,63 (шир. д, J =14, 2H), 4,25 (прибл. т, J=11, 1H), 4,35 (д, J=1,5, 1H), 4,75 (к, J=6,3, 1H), 6,62 (д, J= 6,7, 1H), 6.78 (c, 1H), 7,01 (т, J =8,4, 1H), 7,24 (д, J=3,9, 1H), 7,35 (шир. с, 4H), 9,61 (шир. с, 1H), 9,89 (шир. с, 1H).
Анализ. Рассчитано для C22H22F4N4O3: 1,40 (д, J =6,3, 3H), 2,54 (шир. т, J=11, 1H), 2,87 (прибл. д, J = 12, 1H), 2,94 (д, J =14, 1H), 3,47 (шир. с, 1H), 3,63 (шир. д, J =14, 2H), 4,25 (прибл. т, J=11, 1H), 4,35 (д, J=1,5, 1H), 4,75 (к, J=6,3, 1H), 6,62 (д, J= 6,7, 1H), 6.78 (c, 1H), 7,01 (т, J =8,4, 1H), 7,24 (д, J=3,9, 1H), 7,35 (шир. с, 4H), 9,61 (шир. с, 1H), 9,89 (шир. с, 1H).
Анализ. Рассчитано для C22H22F4N4O3:С 56,77; H 4,55; N 12,04; F 16,33 Найдено: С 56,57; H 4,65; N 11,94; F 16,13. ПРИМЕР 79 2-(S)-(3-Фтор-5-трифторметил)бензоилокси)-3-(S)- (4-фтор)фенил-4-бензилморфолин Заглавное соединение получали с выходом 57% из 3-(S)-(4-фтор)фенил-4-бензил-2-морфолинона (из примера 59) способом, аналогичным способу примера 67. Масс-спектр (Сl): m/z 478 (М+H, 100%). 1H ЯМР-спектр (CDCl3, 400 МГц, м. д. ):  2,50 (дт, J=3,3, 12,0, 1H), 2,96 (д, J=12,0, 1H), 2,98 (д, J=13,6, 1H), 3,75 (дд, J= 1,7, 11,5, 1H), 3,80 (д, J=13,6, 1H), 3,75 (дд, J=1,7, 11,5, 1H), 3,80 (д, J=2,5, 1H), 3,92 (д, J=13,6, 1H), 4,19 (дт, J=2,1, 12,0, 1H), 6,20 (д, J=2,5, 1H), 6,99 (т, J=8,7, 2H), 7,2-7,37 (м, 5H), 7,51-7,55 (м, 3H), 7,89 (д, J=8,4, 1H), 8,09 (c, 1H).
ПРИМЕР 80 2,50 (дт, J=3,3, 12,0, 1H), 2,96 (д, J=12,0, 1H), 2,98 (д, J=13,6, 1H), 3,75 (дд, J= 1,7, 11,5, 1H), 3,80 (д, J=13,6, 1H), 3,75 (дд, J=1,7, 11,5, 1H), 3,80 (д, J=2,5, 1H), 3,92 (д, J=13,6, 1H), 4,19 (дт, J=2,1, 12,0, 1H), 6,20 (д, J=2,5, 1H), 6,99 (т, J=8,7, 2H), 7,2-7,37 (м, 5H), 7,51-7,55 (м, 3H), 7,89 (д, J=8,4, 1H), 8,09 (c, 1H).
ПРИМЕР 802-(S)-(1-(3-Фтор-5-трифторметил) фенил) этенилокси)-3-((S)-(4-фтор) -фенил-4-бензилморфолин Целевое соединение получали с выходом 85% из 2-(S)-(3-фтор-5- трифторметил) бензоилокси-3-(S)-(4-фтор)фенил-4-бензилморфолина (из примера 79) способом, аналогичным способу примера 68. Масс-спектр (С1): m/z 476 (М+H, 100%). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  2,42 (дт, J =3,6, 12,0, 1H), 2,90 (д, J =12,0, 1H), 2,91 (д, J =13,6, 1H), 3,60-3,62 (м, 1H), 3,72 (д, J = 2,6, 1H), 3,92 (д, J=13,6, 1H), 4,09 (дт, J=2,4, 12,0, 1H), 4,67 (д, J = 2,9, 1H), 4,76 (д, J=2,9, 1H), 5,28 (д, J =2,6, 12,0, 1H), 7,07 (т, J=8,7, 2H), 7,2-7,37 (м, 7H), 7,53 (с, 1H), 7,57-7,61 (м, 2H).
ПРИМЕР 81 2,42 (дт, J =3,6, 12,0, 1H), 2,90 (д, J =12,0, 1H), 2,91 (д, J =13,6, 1H), 3,60-3,62 (м, 1H), 3,72 (д, J = 2,6, 1H), 3,92 (д, J=13,6, 1H), 4,09 (дт, J=2,4, 12,0, 1H), 4,67 (д, J = 2,9, 1H), 4,76 (д, J=2,9, 1H), 5,28 (д, J =2,6, 12,0, 1H), 7,07 (т, J=8,7, 2H), 7,2-7,37 (м, 7H), 7,53 (с, 1H), 7,57-7,61 (м, 2H).
ПРИМЕР 812-(S)-(1-(S)-(3-Фтор-5-трифторметил) фенил) этокси)-3-(S)-(4-фтор)-фенилморфолин и 2-(S)-(1-(R)-(3-фтор-5- трифторметил) фенил) этокси)-3-(S)-(4-фтор) фенилморфолин Заглавные соединения получали из 2-(S)-(1-(3-Фтор-5- трифторметил) фенил) этенилокси)-3-(S)-(4-фтор)фенил-4- бензилморфолина (из примера 80) способом, аналогичным способу примера 74, но применяя в качестве катализатора 10% палладия на угле. Для 2-(S)-(1-(S)-(3-фтор-5-трифторметил)фенил)этокси)-3-(S)-(4-фтор) фенилморфолина: Масс-спектр (С1): m/z 338 (М+H, 100%). 1H ЯМР-спектр (CDCl3, 400 Мгц, м.д.):  1,12 (д, J=6,5, 1H), 1,83 (с, 1H), 3,02 (д, J=10,1, 1H), 3,16 (дт, J= 3,6, 12,5, 1H), 3,43 (дд, J=2,7, 11,4, 1H), 3,81 (дт, J=2,9, 11,7, 1H), 4,09 (д, J=2,1, 1H), 4,62 (к, J=6,5, 1H), 4,84 (д, J=2,1, 1H), 7,05 (т, J=8,8, 2H), 7,2(д, J=8,8, 2H), 7,32 (c, 1H), 7,38 (дд, J=5,5, 8,5, 2H).
Для 2-(S)-(1-(R)-(3- (фтор-5-трифторметил)фенил)этокси)-3-(S)-(4- фтор)фенилморфолина: масс-спектр (Сl): m/z 338 (М+H, 100%): 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.): 1,12 (д, J=6,5, 1H), 1,83 (с, 1H), 3,02 (д, J=10,1, 1H), 3,16 (дт, J= 3,6, 12,5, 1H), 3,43 (дд, J=2,7, 11,4, 1H), 3,81 (дт, J=2,9, 11,7, 1H), 4,09 (д, J=2,1, 1H), 4,62 (к, J=6,5, 1H), 4,84 (д, J=2,1, 1H), 7,05 (т, J=8,8, 2H), 7,2(д, J=8,8, 2H), 7,32 (c, 1H), 7,38 (дд, J=5,5, 8,5, 2H).
Для 2-(S)-(1-(R)-(3- (фтор-5-трифторметил)фенил)этокси)-3-(S)-(4- фтор)фенилморфолина: масс-спектр (Сl): m/z 338 (М+H, 100%): 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,42 (д, J=6,6, 3H), 1,91 (с, 1H), 3,11 (дд, J= 3,2, 12,4, 1H), 3,22 (дт, J=3,6, 12,4, 1H), 3,58-3,62 (м, 1H), 4,01 (д, J= 2,3, 1H), 4,11 (дт, J =3,2, 12,0, 1H), 4,41 (д, J=2,3, 1H), 4,80 (к, J=6,6, 1H), 6,41 (д, J =9,2, 1H), 6,86(с, 1H), 7,02 (т, J=8,7, 2H), 7,08 (д, J=9,2, 2H), 7,21-7,26 (м, 2H).
ПРИМЕР 82 1,42 (д, J=6,6, 3H), 1,91 (с, 1H), 3,11 (дд, J= 3,2, 12,4, 1H), 3,22 (дт, J=3,6, 12,4, 1H), 3,58-3,62 (м, 1H), 4,01 (д, J= 2,3, 1H), 4,11 (дт, J =3,2, 12,0, 1H), 4,41 (д, J=2,3, 1H), 4,80 (к, J=6,6, 1H), 6,41 (д, J =9,2, 1H), 6,86(с, 1H), 7,02 (т, J=8,7, 2H), 7,08 (д, J=9,2, 2H), 7,21-7,26 (м, 2H).
ПРИМЕР 822-(S)-(1-(R)-(3-Фтор-5-трифторметил) фенил) этокси)-3-(S)-(4-фтор)-фенил-4-(3-(5-оксо-1,2,4- триазоло)морфолин Заглавное соединение получали из 2-(S)-(1-(R)- (3-фтор-5-трифторметил) фенил) этокси)-3-(S)-(4-фтор) фенилморфолина (из примера 81) способом, аналогичным примеру 70, т. пл. 209-211oC [  ]D= +65,1o (с =1,0, метанол). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.): ]D= +65,1o (с =1,0, метанол). 1H ЯМР-спектр (CDCl3, 400 МГц, м.д.):  1,32 (д, J=6,4, 1H), 2,38 (т, J=11,9, 1H), 2,76 (д, J=13,9, 1H), 2,84 (д, J=11,5, 1H), 3,32 (c, 1H), 3,40 (д, J = 13,9, 1H), 3,49 (c, 1H), 3,61 (д, J =11,2, 1H), 4,11 (т, J=11,3, 1H), 4,8 (к, J=6,4, 1H), 6,57 (д, J=9,4, 1H), 6,94 (c, 1H), 7,1 (т, J=8,7, 2H), 7,39 (д, J=8,7, 2H), 7,51 (c, 2H), 11,26 (c, 2H), 11,38 (c,1H).
ПРИМЕР 83 1,32 (д, J=6,4, 1H), 2,38 (т, J=11,9, 1H), 2,76 (д, J=13,9, 1H), 2,84 (д, J=11,5, 1H), 3,32 (c, 1H), 3,40 (д, J = 13,9, 1H), 3,49 (c, 1H), 3,61 (д, J =11,2, 1H), 4,11 (т, J=11,3, 1H), 4,8 (к, J=6,4, 1H), 6,57 (д, J=9,4, 1H), 6,94 (c, 1H), 7,1 (т, J=8,7, 2H), 7,39 (д, J=8,7, 2H), 7,51 (c, 2H), 11,26 (c, 2H), 11,38 (c,1H).
ПРИМЕР 832-(S)-(1-(R)-(3,5-Бис(трифторметил) фенил) этокси)-3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло) метилморфолин Стадия A: N,N-Диацетил-4-бромметил-2-имидазолон Заглавное соединение получали в соответствии со способом Dolan and Dushinsky (Journal of American Chem. Soc., 70, 657 (1948). Стадия В: 2-(S)-(1-(R)-(3,5-Бис(трифторметил)фенил)этокси)- 3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метилморфолин Смесь 1,00 г (2,28 ммоль) 2-(S)-(1-(R)-(3,5-бис (трифторметил)-фенил)этокси)-3-(S)-(4-фтор)фенилморфолина (из примера 74), 0,62 г (2,40 ммоль) N, N-диацетил-4-бромметил- 2-имидазолона (из примера 83, стадия А) и 0,63 г (4,56 ммоль) карбоната калия в 10 мл N,N -диметилформамида перемешивали 15 мин при комнатной температуре. Реакционную смесь разбавляли 100 мл этилацетата и промывали водой, насыщенным водным раствором хлористого натрия, сушили над сульфатом магния и выпаривали в вакууме. Полученное масло растворяли в 10 мл этанола, раствор обрабатывали 1,05 мл 33% раствора метиламина в этаноле и перемешивали 10 мин при комнатной температуре. Реакционную смесь концентрировали в вакууме, получая твердый продукт. Перекристаллизацией из смеси этилацетат/метанол получали 0,63 г заглавного соединения, т. пл. 192-194oC. 1H ЯМР-спектр (d6-DMSO, 360 МГц, м.д.):  1,35 (д, J=6,5, 3H), 2,25 (дт, J = 8,7, 1H), 2,60 (д, J =13,8, 1H), 2,89 (д, J=11,6, 1H), 3,28-3,36 (м, 2H), 3,62 (д, J=10,2, 1H), 4,1 (т, J=10,0, 1H), 4,31 (д, J= 2,7, 1H), 4,92 (к, J=6,5, 1H), 5,97 (с, 1H), 7,06 (т, J=8,8, 2H), 7,36 (с, 2H), 7,65-7,85 (м, 2H), 7,84 (c, 1H), 9,58 (с, 1H), 9,8 (с, 1H).
ПРИМЕР 84 1,35 (д, J=6,5, 3H), 2,25 (дт, J = 8,7, 1H), 2,60 (д, J =13,8, 1H), 2,89 (д, J=11,6, 1H), 3,28-3,36 (м, 2H), 3,62 (д, J=10,2, 1H), 4,1 (т, J=10,0, 1H), 4,31 (д, J= 2,7, 1H), 4,92 (к, J=6,5, 1H), 5,97 (с, 1H), 7,06 (т, J=8,8, 2H), 7,36 (с, 2H), 7,65-7,85 (м, 2H), 7,84 (c, 1H), 9,58 (с, 1H), 9,8 (с, 1H).
ПРИМЕР 842-(S)-(1-(R)-(3-Фтор-5-(трифторметил)фенил) этокси-3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло) метилморфолин Заглавное соединение получали из 2-(S)-(1-(R)-(3- фтор-5-трифторметил)фенил)этокси)-3-(S)-(4-фтор) фенилморфолина из примера 82) способом, аналогичным способу примера 83, т. пл. 209-210oC, [  ]D= +92,8 ]D= +92,8 (с = 1,0, метанол). 1H ЯМР-спектр (d6-DMSO, 360 МГц, м.д.): (с = 1,0, метанол). 1H ЯМР-спектр (d6-DMSO, 360 МГц, м.д.):  1,31 (д, J=6,5, 3H), 2,24 (дт, J=3,0, 11,9, 1H), 2,6 (д, J=13,9, 1H), 3,61 (д, J=11,2, 1H), 4,1 (т, J= 11,0 1H), 4,29 (д, J =2,3, 1H), 4,8 (к, J=6,5, 1H), 6,00 (с, 1H), 6,55 (д, J=9,3, 1H), 6,94 (с, 1H), 7,11 (т, J=8,7, 2H), 7,39 (д, J=8,4, 1H), 7,51 (с, 2H), 9,59 (с, 1H), 9,84 (с, 1H).
ПРИМЕР 85 1,31 (д, J=6,5, 3H), 2,24 (дт, J=3,0, 11,9, 1H), 2,6 (д, J=13,9, 1H), 3,61 (д, J=11,2, 1H), 4,1 (т, J= 11,0 1H), 4,29 (д, J =2,3, 1H), 4,8 (к, J=6,5, 1H), 6,00 (с, 1H), 6,55 (д, J=9,3, 1H), 6,94 (с, 1H), 7,11 (т, J=8,7, 2H), 7,39 (д, J=8,4, 1H), 7,51 (с, 2H), 9,59 (с, 1H), 9,84 (с, 1H).
ПРИМЕР 852-(S)-(1-(S)-(3,5-Бис(трифторметил) фенилэтокси) -3-(R)-(4-фторфенил)4-(3-(5-оксо-1H,4H-1,2,4-триазоло) метилморфолин Заглавное соединение получали из (R)-(4-фтор)фенилглицина способами, аналогичными способам примеров 59, 67, 67, 69 и 70, [  ]D= -67,7 ]D= -67,7 (c = 0,7, MeOH, 20oC).
ПРИМЕР 86 (c = 0,7, MeOH, 20oC).
ПРИМЕР 86Следующие соединения получали из 3-(S)-фенил-4-бензил-2- морфолинона (из примера 14) или 3-(S)-(4-фтор)фенил-4-бензил-2- морфолинона (из примера 59) способами, аналогичными способам примеров 15, 67-69 и 74. Гидрогенизацию 1-(замещенный арил)этенилокси промежуточных продуктов можно проводить с применением в качестве катализатора 10% палладия на угле (пример 70) или 5% родия на оксиде алюминия (пример 74), чтобы достичь быстрого восстановления простого эфира енола. Удаление 4- бензильного заместителя можно осуществить каталитически при продолженном гидрировании с применением в качестве катализатора 10% палладия на угле или 5% родия на оксиде алюминия или (когда может происходить дегалогенирование или расщепление простой эфирной группы) во второй стадии с 1-хлор- этилхлорформиатом, как в примере 44, стадия С. 1) 2-(R)-(1-(R)-(3-(Хлор)-5-(трифторметил)фенил)этокси)-3-(S) -фенилморфолин; 2) 2-(R)-(1-(R)-(3,5-(диметил)фенил)этокси)-3-(S)-фенилморфолин 3) 2-(R)-(1-(R)-(3-(фтор)-5- (метил)фенил)этокси)-3-(S)-фенилморфолин; 4) 2-(R)-(1- (R)-(3-(хлор)-5-(метил)фенил)этокси)-3-(S)-фенилморфолин; 5) 2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил)этокси)-3-(S)-фенилморфолин; 6) 2-(R)-(1-(R)-(3-(изопропокси)фенил)этокси)-3-(S)-фенилморфолин; 7) 2-(R)-(1-(R)-(3-(изопропокси)-5-(трифторметил)фенил) этокси)-3-(S)-фенилморфолин; 8) 2-(R)-(1-(R)-(3-(хлор)-5- (изопропокси)фенил)этокси)-3-(S)-фенилморфолин; 9) 2-(R)-(1- (R)-(3-(фтор)-5-(изопропокси)фенил)этокси)-3-(S)-фенилморфолин; 10) 2-(R)-(1-(R)-(3-трет-бутил)фенил)этокси)-3- (S)-фенилморфолин; 11) 2-(R)-(1-(R)-(3-(трет-бутил)-5- (хлор) фенил) этокси)-3-(S)-фенилморфолин; 12) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(трифторметил) фенил)этокси)-3-(S)-фенилморфолин; 13) 2-(R)-(1-(R)-(3,5- (диметил)-4-(фтор)фенил)этокси)-3-(S)-фенилморфолин; 14) 2-(R)-(1-(R)-(3,5-(диметил)-4-(хлор)фенил)этокси)-3-(S)- фенилморфолин; 15) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(фтор)фенил)этокси-3- (S)-фенилморфолин; 16) 2-(R)-(1-(R)-(3,5- бис(трифторметил)-4-(хлор)фенил)этокси)-3-(S)-фенилморфолин; 17) 2-(R)-(1-(R)-(3,5-(дихлор)фенил)этокси)-3-(S)-фенилморфолин; 18) 2-(R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3-(S)- фенилморфолин; 19) 2-(R)-(1-(R)-(1-(нафтил)этокси)-3-(S) -фенилморфолин; 20) 2-(R)-(1-(R)-(1-(4-(фтор)нафтил)этокси)-3- (S)-фенилморфолин; 21) 2-(R)-(1-(R)-(1-(3-(фтор)нафтил) этокси)-3-(S)-фенилморфолин; 22) 2-(R)-(1-(R)-(1-(3- (хлор)нафтил)этокси)-3-(S)-фенилморфолин; 23) 2-(R)-(1-(R)-(1-(3- (метил)нафтил)этокси)-3-(S)-фенилморфолин; 24) 2-(R)-(1-(R)-(1- (3-(трифторметил)нафтил)этокси)-3-(S)-фенилморфолин; 25) 2-(S)-(2-фтор-5-трифторметил)бензилокси-3-(S)- фенилморфолин; 26) 2-(S)-(2-хлор-5-трифторметил)бензилокси-3-(S)-(4- фтор)фенилморфолин; 27) 2-(R)-(1-(R)-(2-фтор-5- трифторметил)фенилэтокси)-3-(S)-фенилморфолин; 28) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)- 3-(S)-(4-фтор)фенилморфолин; 29) 2-(S)-(2-хлор-5- трифторметил)бензилокси-3-(S)-фенилморфолин; 30) 2-(S)-(2- хлор-5-трифторметил)бензилокси-3-(S)-(4-фтор)фенилморфолин; 31) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S)- фенилморфолин; 32) 2-(R)-(1-(R)-(2-хлор-5- трифторметил)фенилэтокси)-3-(S)-(4-фтор)фенилморфолин; 33) 2-(S)-(3-метил)бензилокси)-3-(S)-фенилморфолин; 34) 2-(S)-(2-метил)бензилокси)-3-(S)-(4-фтор)фенилморфолин; 35) 2-(R)-(1-(R)-(3-метил)фенилэтокси)-3-(S) -фенилморфолин; 36) 2-(R)-(1-(R)-(3-метил)фенилэтокси)-3-(S)- (4-фтор) фенилморфолин; 37) 2-(S)-(3-бром) бензилокси)-3-(S)-фенилморфолин; 38) 2-(S)-(3-бром) бензилокси)-3-(S)-(4-фтор) фенилморфолин; 39) 2-(R)-(1-(R)-(3-бром)фенилэтокси)-3-(S)- фенилморфолин; 40)-2-(R)-(1-(R)-(3-бром)фенилэтокси)-3-(S)-(4-фтор) фенилморфолин; 41)-2-(S)-(3-хлор) бензилокси-3-(S)-фенилморфолин; 42) 2-(S)-(3-хлор)бензилокси)-3-(S)-(4-фтор)фенилморфолин; 43) 2-(R)-(1-(R)-(3-хлор)фенилэтокси)-3-(S)-фенилморфолин; 44) 2-(R)-(1-(R)-(3-хлор)фенилэтокси)-3-(S)-(4-фтор) фенилморфолин:, 45) 2-(S)-(3-трифторметил)бензилокси-3-(S)- фенилморфолин; 46) 2-(S)-(3-трифторметил)бензилокси-3-(S)- фенил-(4-фтор)фенилморфолин; 47) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенилморфолин; 48) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенил-(4- фтор) фенилморфолин; 49) 2-(R)-(1-(R)-(3-(тиометил)фенил)этокси)-3-(S)-фенилморфолин; 50) 2-(R)-(1-(R)-(3- тиометил)-5-(трифторметил)фенил)этокси)-3-(S)-фенилморфолин; 51) 2-(R)-(1-(R)-(2,2-(диметил)-5-(тиометил)-2,3- дигидробензофуран-7-ил)этокси)-3-(S)-фенилморфолин; 52) 2-(R)- (1-(R)-(3,5-(диметокси)фенил)этокси)-3-(S)-фенилморфолин; 53) 2-(R)-(1-(R)-(3-(трифторметил) фенил) этокси)-3-(S)-(4- фтор) фенилморфолин; 54) 2-(R)-(1-(R)-(3-(фтор)-5-(трифторметил)фенил)этокси) -3-(S)-(4-фтор)фенилморфолин; 55) 2-(R)-(1-(R)-(3-(хлор)-5-(трифторметил)фенил)этокси) -3-(R)-(4-фтор) фенилморфолин; 56) 2-(R)-(1-(R)-(3,5-(диметил)фенил)этокси)-3-(S)-(4- фтор) фенилморфолин; 57) 2-(R)-(1-(R)-(3-(фтор)-5-(метил) фенил) этокси)-3-(S)-(4-фтор) фенилморфолин; 58) 2-(R)-(1-(R)- (3-(хлор)-5-(метил)фенил)этокси)-3-(S)-(4-фтор) фенилморфолин; 59) 2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил) этокси)-3-(S)-(4-фтор) фенилморфолин; 60) 2-(R)-(1-(R)-(3- изопропокси)фенил)этокси)-3-(S)-(4-фтор)фенилморфолин; 61) 2-(R)-(1-(R)-(3-(изопропокси)-5-(трифторметил)фенил)этокси)-3- (S)-(4-фтор)фенилморфолин; 62)-2-(R)-(1-(R)-(3-(хлор)-5-(изопропокси)фенил)этокси) -3-(S)-(4-фтор)фенилморфолин; 63) 2-(R)-(1-(R)-(3-(фтор)-5- (изопропокси)фенил)этокси)-3-(S)-(4-фтор)фенилморфолин; 64) 2-(R)-(1-(R)-(3-(трет)бутил)фенил)этокси)-3-(S)-(4- фтор) фенилморфолин; 65) 2-(R)-(1-(R)-(3-(трет-бутил)-5- (хлор)фенил)этокси)-3-(S)-(4-фтор)-фенилморфолин; 66) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(трифторметил)фенил)этокси)-3- (S)-(4-фтор)фенилморфолин; 67)-2-(R)-(1-(R)-(3,5-(диметил)-4-(фтор)фенил)этокси)-3- (S)-(4-фтор)-фенилморфолин; 68) 2-(R)-(1-(R)-(3,5-(диметил)- 4-(хлор)фенил)этокси)-3-(S)-(4-фтор)-фенилморфолин; 69) 2-(R)-(1-(R)- (3,5-бис(трифторметил)-4-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенилморфолин; 70) 2-(R)- (1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси)-3-(S)- (4-фтор)фенилморфолин; 71) 2-(R)-(1-(R)-(3,5- (дихлор)фенил)этокси)-3-(S)-(4-фтор)фенилморфолин; 72) 2-(R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3-(S)-(4-фтор) фенилморфолин; 73) 2-(R)-(1-(R)-(1-нафтил) этокси)-3-(S)-(4-фтор) фенилморфолин; 74) 2-(R)-(1-(R)-(1-(4-(фтор)нафтил)этокси)-3- (S)-(4-фтор)фенилморфолин; 75) 2-(R)-(1-(R)-(1-(3-(фтор)нафтил)этокси)-3-(S)-(4- фтор)фенилморфолин; 76) 2-(R)-(1-(R)-(1-(3- (хлор)нафтил)этокси)-3-(S)-(4-фтор)фенилморфолин; 77) 2-(R)- (1-(R)-(1-(3-(метил)нафтил)этокси)-3-(S)-(4-фтор) фенилморфолин; 78) 2-(R)-(1-(R)-(1-(3-(трифторметил)нафтил) этокси)-3-(S)-(4-фтор)-фенилморфолин; 79) 2-(R)-(1-(R)- (3-(тиометил)фенил)этокси)-3-(S)-(4-фтор)фенилморфолин; 80) 2-(R)-(1-(R)-(3-тиометил)-5-(трифторметил) фенил)этокси)-3-(S)-(4-фтор) фенилморфолин; 81) 2-(R)-(1-(R)-(2,2-(диметил)-5-(тиометил)-2,3- дигидробензофуран-7-ил)этокси)-3-(S)-(4-фтор)фенилморфолин; 82) 2-(R)-(1-(R)-(3,5-(диметокси)фенил)этокси)-3-(S)- (4-фтор) фенилморфолин; 83) 2-(R)-(1-(R)-(фенил)этокси)-3-(S)-фенилморфолин; 84) 2-(R)-(1-(R)-(фенил)этокси)-3-(S)-(4-фтор)фенилморфолин; 85) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)-3-(S)-фенилморфолин; 86) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенилморфолин; 87) 2-(R)-(1-(R)-(4-(фтор)фенил)этокси)-3-(S)-фенилморфолин; 88) 2-(R)-(1-(R)-(4-фтор)фенил)этокси)-3-(S)-(4-фтор) фенилморфолин; 89) 2-(R)-(1-(R)-(3,5-бис- (трифторметил)фенил)этокси)-3-(S)-(3-фтор)фенилморфолин; 90) 2- (R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4- дифтор)фенилморфолин; 91) 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(3,4-дихлор)фенилморфолин; 92) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3, 4-диметил)фенилморфолин; 93) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3- (S)-(3,4-метилендиокси)фенилморфолин; 94) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3- (S)-(2-нафтил)морфолин; ПРИМЕР 87 Следующие соединения получали из соответствующих 2-(S)- (замещенная бензилокси)-3-(S)-арилморфолинов или 2-(R)-(1- (R)-(замещенный арил)этокси-3-(S)-арилморфолинов (из примера 86) способами, аналогичными способам примеров 17, 18, 36, 38, 83 или, в случае 4-(5-тетразолил)метилзамещенных морфолинов, алкилированием морфолина (из примера 86) хлорацетонитрилом в присутствии третичного амина (основание) в ацетонитриле с последующим образованием конечного продукта реакцией полученного нитрила с азидом или триметилсилилазидом натрия в подходящем растворителе. 1) 2-(R)-(1-(R)-(3-(xлор)-5- (трифторметилфенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4- триазоло)метилморфолин; 2) 2-(R)-(1- (R)-(3,5-(диметил)фенил)этокси) -3- (5)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 3) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил) этокси)-3-(S)-фенил-4-(3- (5-оксо-1,2,4-триазоло)метилморфолин; 4) 2-(R)-(1-(R)-(3- (хлор)-5-метил)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4- триазоло)метилморфолин; 5) 2-(R)-(1-(R)-(3-(бром)-5-(метилфенил) этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 6) 2-(R)-(1-(R)-(3-(изопропокси)фенил)этокси)- 3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 7) 2-(R)-(1-(R)-(3-(изопропокси)-5-(трифторметил)фенил) этокси) -3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 8) 2-(R)-(1-(R)-(3-(хлор)-5- (изопропокси)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 9) 2-(R)-(1-(R)-(3-(фтор)-5-(изопропокси)фенил)этокси)- 3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 10) 2-(R)-(1-(R)-1-(3-(трифторметил)нафтил)этокси)-3-(S)- фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 11) 2-(R)- (1-(R)-(3-(трет-бутил)-5-(хлор)фенил)этокси)-3-(S)-фенил-4- (3-(5-оксо-1,2,4-триазоло)метилморфолин; 12) 2-(R)-(1-(R)-(3- (трет-бутил)-5-(трифторметил)фенил)этокси)-3-(S)-фенил-4-(3- (5-оксо-1,2,4-триазоло)метилморфолин; 13) 2-(R)-(1-(R)-(3,5- (диметил)-4-(фтор)фенил)этокси)3-(S)-фенил-4-(3-(5-оксо-1, 2,4-триазоло)метилморфолин; 14) 2-(R)-(1-(R)-(3,5-(диметил)-4- (хлор)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4- триазоло)метилморфолин; 15) 2-(R)-(1-(R)-(3,5-бис(трифторметил)- 4-(фтор)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2, 4- триазоло)метилморфолин; 16) 2-(R)-(1-(R)-(3,5-бис(трифторметил)- 4-(хлор)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4- триазоло) метилморфолин; 17) 2-(R)-(1-(R)-(3,5- (дихлор)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4- триазоло) метилморфолин; 18) 2-(R)-(1-(R)-(3,5- (дифтор)фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 19) 2-(R)-(1-(R)-(1-(нафтил)этокси)-3-(S)-фенил-4-(3-(5- оксо-1,2,4-триазоло) метилморфолин; 20) 2-(R)-(1-(R)-(1-(4- фтор)нафтил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4- триазоло) метилморфолин; 21) 2-(R)-(1-(R)-(1-(3-фтор) нафтил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 22) 2-(R)-(1-(R)-(1-(3-хлор)нафтил)этокси)-3-(S)-фенил-4-(3-(5- оксо-1,2,4-триазоло)метилморфолин; 23) 2-(R)-(1-(R)-(1-(3- метил)нафтил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 24) 2-(R)-(1-(R)-(1-(3-трифторметил)нафтил) этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 25) 2-(S)-(2-фтор-5-трифторметил)бензилокси-3- (S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 26) 2-(S)-(2- фтор-5-трифторметил)бензилокси-3-(S)-(4-фтор)фенил-4-(3-(1,2, 4-триазоло)метилморфолин; 27) 2-(R)-(1-(R)-(2-фтор-5- трифторметил)фенилэтокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 28) 2-(R)-(1-(R)-(2-фтор-5-трифторметил) фенилэтокси)-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло) метилформолин; 29) 2-(S)-(2-фтор-5-трифторметил)бензилокси-3- (S)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 30) 2- (S)-(2-фтор-5-трифторметил)бензилокси-3-(S)-(4-фтор)фенил- 4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 31) 2-(R)-(1- (R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S)-фенил-4-(3-(5- оксо-1,2,4-триазоло)метилморфолин; 32) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S) -(4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 33) 2-(S)-(2-фтор-5-трифторметил)бензилокси-3-(S)- фенил-4-(4-(2-оксо-1,3-имидазоло)метилморфолин; 34) 2-(S)-(2-фтор-5-трифторметил)бензилокси-3-(S)-(4- фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метилморфолин; 35) 2- (R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S)-фенил-4- (4-(2-оксо-1,3-имидазоло)метилморфолин; 36) 2-(R)-(1-(R)-(2- фтор-5-трифторметил)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(4- (2-оксо-1,3-имидазоло)метилморфолин; 37) 2-(S)-(2-фтор-5- трифторметил)бензилокси-3-(S)-фенил-4-(2-имидазоло) метилморфолин; 38) 2-(S)-(2-фтор-5-трифторметил)бензилокси-3- (S)-(4-фтор)фенил-4-(2-имидазоло)метилморфолин; 39) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S) -фенил-4-(2-имидазоло)метилморфолин; 40) 2-(R)-(1-(R)-(2- фтор-5-трифторметил)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(2- имидазоло)метилморфолин; 41) 2-(S)-(2-фтор-5- трифторметил)бензилокси-3-(S)-фенил-4-(4-имидазоло) метилморфолин; 42) 2-(S)-(2-фтор-5-трифторметил)бензилокси-3- (S)-(4-фтор)фенил-4-(4-имидазоло)метилморфолин; 43) 2-(R)-(1- (R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S)-фенил-4-(4- имидазоло)метилморфолин; 44) 2-(R)-(1-(R)-(2-фтор-5-трифторметил)фенилэтокси)-3- (S)-(4-фтор)фенил-4-(4-имидазоло)метилморфолин; 45) 2-(S)- (2-фтор-5-трифторметил)бензилокси-3-(S)-фенил-4-(5-тетразоло) метилморфолин; 46) 2-(S)-(2-фтор-5-трифторметил) бензилокси-3-(S)-(4- фтор)фенил-4-(5-тетразоло)метилморфолин; 47) 2-(R)-(1- (R)-(2-фтор-5-трифторметил)фенилэтокси)-3-(S)-фенил-4-(5- тетразоло)метилморфолин; 48) 2-(R)-1-(R)-(2-фтор-5- трифторметил) фенилэтокси)-3-(S)-(4-фтор)фенил-4- (5-тетразоло)метилморфолин; 49) 2-(S)-(2-фтор-5- трифторметил) бензилокси-3-(S)-фенил-4-(2-оксо-5H-пиррол-4-ил) метилморфолин; 50) 2-(S)-(2-фтор-5-трифторметил)бензилокси- 3-(S)-(4-фтор) фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 51) 2-(R)-(1-(R)-(2-фтор-5-трифторметил) фенилэтокси)-3-(S)- фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 52) 2-(1R-(1- (R)-(2-фтор-5-трифторметил) фенилэтокси)-3-(S)-(4-фтор) фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 53) 2-(S)-(2- хлор-5-трифторметил)бензилокси-3-(S)-фенил-4-(3-(1,2,4- триазоло) метилморфолин; 54) 2-(S)-(2-хлор-5- трифторметил)бензилокси-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолин; 55) 2-(R)-(1-(R)-(2-хлор-5- трифторметил)фенилэтокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 56) 2-(R)-(1-(R)-(2-хлор-5- трифторметил)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4- триазоло)метилморфолин; 57) 2-(S)-(2-хлор-5-трифторметил)бензилокси-3-(S)-фенил- 4-(3-(5-окco-1,2,4-триазоло)метилморфолин; 58) 2-(S)-(2-хлор-5-трифторметил)бензилокси-3-(S)-(4- фтор)фенил-4-(3-(5-окco-1,2,4-триазоло)метилморфолин; 59) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)- 3-(S)-фенил-4-(3-(5-окco-1,2,4-триазоло)метилморфолин; 60) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3-(S)-(4 фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 61) 2-(S)-(2-хлор-5-трифторметил)бензилокси-3-(S)-фенил-4-(4- (2-оксо-1,3-имидазоло)метилморфолин; 62) 2-(S)-(2-хлор-5- трифторметил)бензилокси-3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1, 3-имидазоло)метилморфолин; 63) 2-(R)-(1-(R)-(2-хлор-5- трифторметил)фенилэтокси)-3-(S)-фенил-4-(4-(2-оксо-1,3- имидазоло)метилморфолин; 64) 2-(R)-(1-(R)-(2-хлор-5- трифторметил)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(4-(2-оксо- 1,3-имидазоло)метилморфолин: 65) 2-(S)-(2-хлор-5-трифторметил) бензилокси-3-(S)-фенил-4-(2-имидазоло)метилморфолин; 66) 2-(S) -(2-хлор-5-трифторметил)бензилокси-3-(S)-(4-фтор)фенил-4-(2- имидазоло)метилморфолин; 67) 2-(R)-(1-(R)-(2-хлор-5- трифторметил)фенилэтокси)-3-(S)- фенил-4-(2-имидазоло)метилморфолин; 68) 2-(R)-(1-(R)-(2-хлор-5-трифторметил) фенилэтокси)-3-(S)-(4-фтор)фенил-4-(2-имидазоло) метилморфолин; 69) 2-(S)-(2-хлор-5-трифторметил)бензилокси-3-(S)-фенил-4- (4-имидазоло)метилморфолин; 70) 2-(S)-(2-хлор-5-трифторметил)бензилокси-3-(S)-(4- фтор)фенил-4-(4-имидазоло)метилморфолин; 71) 2-(R)-(1-(R)-(2-хлор-5-трифторметил)фенилэтокси)-3- (S)-фенил-4-(4-имидазоло)метилморфолин; 72) 2-(R)-(1-(R)- (2-хлор-5-трифторметил)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(4- имидазоло)метилморфолин; 73) 2-(S)-(2-xлop-5- тpифтopмeтил)бeнзилoкcи-3-(S)-фeнил-4-(5-тетразоло) метилморфолин; 74) 2-(S)-(2-хлор-5-трифторметил)бензилокси-3- (S)-(4-фтор)фенил-4-(5-тетразоло)метилморфолин; 75) 2-(R) -(1-(R)-(2-хлор-5-трифторметил) фенилэтокси)-3-(S)-фенил-4- (5-тетразоло)метилморфолин; 76) 2-(R)-1-(R)-(2-хлор-5- трифторметил)фенилэтокси)-3-(S)-(4-фтор) фенил-4-(5- тетразоло) метилморфолин; 77) 2-(R)-(2-хлор-5- трифторметил)бензилокси-3-(S)-фенил-4-(2-оксо-5H-пиррол-4-ил) метилморфолин; 78) 2-(S)-(2-хлор-5-трифторметил) бензилокси-3-(S)-(4-фтор)фенил-4-(2-оксо-5H-пиррол-4-ил) метилморфолин; 79) 2-(R)-(1-(R)-(2-хлор-5-трифторметил) фенилэтокси)-3-(S)-фенил-4-(2-оксо-5H-пиррол-4-ил) метилморфолин; 80) 2-(R)-(1-(R)-(2-хлор-5-трифторметил) фенилэтокси)-3-(S))-(4-фтор) фенил-4-(2-оксо-5H-пиррол-4-ил) метилморфолин; 81) 2-(S)-(3-метил)бензилокси-3-(S)-фенил-4-(3- (1,2,4-триазоло)метилморфолин; 82) 2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенил-4- (3-(1,2,4-триазоло)метилморфолин; 83) 2-(R)-(1-(R)-(3- метил) фенилэтокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 84) 2-(R)-(1-(R)-(3-метил)фенилэтокси)-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метилморфолин; 85) 2-(S)-(3-метил) бензилокси-3-(S)-фенил-4-(3-(5- оксо-1,2,4-триазоло)метилморфолин; 86) 2-(S)-(3-метил) бензилокси-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 87) 2-(R)-(1-(R)-(3-метил)фенилэтокси)-3- (S)-фенил-4-(3-(5-оксo-1,2,4-триазоло)метилморфолин; 88) 2- (R)-(1-(R)-(3-метил) фенилэтокси)-3-(S)-(4-фтор)фенил-4-(3- (5-оксо-1,2,4-триазоло)метилморфолин; 89) 2-(S)-(3-метил) бензилокси-3-(S)-фенил-4-(4-(2-оксо-1,3-имидазоло) метилморфолин; 90) 2-(S)-(3-метил)бензилокси-3-(S)-(4- фтор)фенил-4-(4-(2-оксо-1,3-имидазоло) метилморфолин; 91) 2-(R)- (1-R)-(3-метил)фенилэтокси)-3-(S)-фенил-4-(4-(2-оксо-1, 3- имидазоло)метилморфолин; 92) 2-(R)-(1-(R)-(3-метил)фенилэтокси) -3-(S)-(4-фтор)фенил-4-(4-(2-окco-1,3-имидазоло) метилморфолин; 93) 2-(S)-(3-метил)бензилокси-3-(S)-фенил-4-(2- имидазоло)метилморфолин; 94) 2-(S)-(3-метил)бензилокси-3-(S) -(4-фтор)фенил-4-(2-имидазоло)метилморфолин; 95) 2-(R)-(1- (R)-(3-метил)фенилэтокси)-3-(S)-фенил-4-(2-имидазоло) метилморфолин; 96) 2-(R)-(1-(R)-(3-метил)фенилэтокси)-3-(S)-(4-фтор) фенил-4-(2-имидазоло)метилморфолин; 97) 2-(S)-(3-метил) бензилокси-3-(S)-фенил-4-(4-имидазоло)метилморфолин; 98) 2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенил- 4-(4-имидазоло)-метилморфолин; 99) 2-(R)-(1-(R)-(3-метил) фенилэтокси)-3-(S)-фенил-4-(4-имидазоло)метилморфолин; 100) 2-(R)-(1-(R)-(3-метил)фенилэтокси)-3-(S)-(4-фтор) фенил-4-(4-имидазоло)метилморфолин; 101) 2-(S)-(3-метил) бензилокси-3-(S)-фенил-4-(5-тетразоло)метилморфолин; 102) 2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенил- 4-(5-тетразоло)метилморфолин; 103) 2-(R)-(1-(R)-(3-метил) фенилэтокси)-3-(S)-фенил-4-(5-тетразоло)метилморфолин; 104) 2-(R)-1-(R)-(3-метил)фенилэтокси)-3-(S)-(4-фтор)фенил- 4-(5-тетразоло)метилморфолин; 105) 2-(S)-(3-метил) бензилокси-3-(S)-фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 106)2-(S)-(3-метил)бензилокси-3-(S)-(4-фтор)фенил-4- (2-оксо-5H-пиррол-4-ил)метилморфолин; 107) 2-(R)-(1-(R)-(3 метил)фенилэтокси)-3-(S)-фенил-4-(2-оксо-5H-пиррол-4-ил) метилморфолин; 108) 2-(R)-(1-(R)-(3-метил)фенилэтокси)-3-(S)- (4-фтор)фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 109) 2-(S)-(3-бром)бензилокси-3-(S)-фенил-4-(3-(1,2,4- триазоло)метилморфолин; 110) 2-(S)-(3-бром)бензилокси-3- (S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолин; 111) 2-(R)-(1-(R)-(3-бром)фенилэтокси)-3-(S)-фенил-4-(3-(1,2,4- триазоло)метилморфолин; 112) 2-(R)-(1-(R)-(3-бром) фенилэтокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло) метилморфолин; 113) 2-(S)-(3-бром)бензилокси-3-(S)-фенил-4- (3-(5-оксо-1,2,4-триазоло)метилморфолин; 114) 2-(S)-(3- бром)бензилокси-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1, 2, 4- триазоло)метилморфолин; 115) 2-(R)-(1-(R)-(3-бром)фенилэтокси) -3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 116) 2-(R-(1-(R)-(3-бром)фенилэтокси)-3-(S)-(4-фтор) фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 117) 2-(S) -(3-бром)бензилокси-3-(S)-фенил-4-(4-(2-оксо-1,3-имидазоло) метилморфолин; 118) 2-(S)-(3-бром)бензилокси-3-(S)-(4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метилморфолин; 119) 2-(R)- (1-(R)-(3-бром)фенилэтокси)-3-(S)-фенил-4-(4-(2-оксо-1,3- имидазоло)метилморфолин; 120) 2-(R)-(1-(R)-(3-бром) фенилэтокси)-3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1, 3- имидазоло)метилморфолин; 121) 2-(S)-(3-бром)бензилокси-3-(S)- фенил-4-(2-имидазоло)метилморфолин; 122) 2-(S)-(3-бром)бензилокси-3-(S)-(4-фтор)фенил-4-(2- имидазоло)метилморфолин; 123) 2-(R)-(1-(R)-(3- бром)фенилэтокси)-3-(S)-фенил-4-(2-имидазоло)метилморфолин; 124) 2-(R)-(1-(R)-(3-бром)фенилэтокси)-3-(S)-(4-фтор)фенил-4- (2-имидазоло)метилморфолин; 125) 2-(S)-(3-бром)бензилокси-3-(S)- фенил-4-(4-имидазоло)метилморфолин; 126) 2-(S)-(3- бром)бензилокси-3-(S)-(4-фтор)фенил-4-(4-имидазоло)метилморфолин; 127) 2-(R)-(1-(R)-(3-бром)фенилэтокси)-3-(S)- фенил-4-(4-имидазоло)метилморфолин; 128) 2-(R)-(1-(R)-(3- бром)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(4-имидазоло) метилморфолин; 129) 2-(S)-(3-бром)бензилокси-3-(S)-фенил-4-(5- тетразоло)метилморфолин; 130) 2-(S)-(3-бром) бензилокси-3- (S)-(4-фтор)фенил-4-(5-тетразоло)метилморфолин; 131) 2-(R)- (1-(R)-(3-бром) фенилэтокси)-3-(S)-фенил-4-(5-тетразоло)- метилморфолин; 132) 2-(R)-1-(R)-(3-бром) фенилэтокси)-3- (S)-(4-фтор)фенил-4-(5-тетразоло)метилморфолин; 133) 2- (S)-(3-бром) бензилокси-3-(S)-фенил-4-(2-оксо-5H-пиррол-4- ил)метилморфолин; 134) 2-(S)-(3-бром) бензилокси-3-(S)-(4- фтор)фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 135) 2-(R)-(1-(R)-(3-бром)фенилэтокси)-3-(S)-фенил-4- (2-оксо-5H-пиррол-4-ил)метилморфолин; 136) 2-(R)-(1- (R)-(3-бром)фенилэтокси)-3-(S)-(4- фтор)фенил-4-(2-оксо-5H- пиррол-4-ил)метилморфолин; 137) 2-(S)-(3-(хлор)бензилокси-3- (S)-фенил-4-(3-(1,2,4-триазоло)метилморфолин; 138) 2-(S)-(3- хлор)бензилокси-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло) метилморфолин; 139) 2-(R)-(1-(R)-(3-хлор)фенилэтокси)-3-(S)- фенил-4-(3-(1,2,4-триазоло)метилморфолин; 140) 2-(R)-(1-(R)-(3- хлор)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло) метилморфолин; 141) 2-(S)-(3-хлор)бензилокси-3-(S)-фенил-4-(3- (5-оксо-1,2,4-триазоло)метилморфолин; 142) 2-(S)-(3-хлор) бензилокси-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 143) 2-(R)-(1-(R)-(3-хлор)фенилэтокси)-3- (S)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 144) 2- (R)-(1-(3 хлор)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(3-(5- оксо-1,2,4-триазоло)метилморфолин; 145) 2-(S)- (3-хлор) бензилокси-3-(S)-фенил-4-(4-(2-оксо-1,3-имидазоло) метилморфолин; 146) 2-(S)-(3-хлор)бензилокси-3-(S)-(4-фтор) фенил-4-(4-(2-оксо-1,3-имидазоло)метилморфолин; 147) 2-(R)- (1-(R)-(3-хлор)фенилэтокси)-3-(S)-фенил-4-(4-(2-оксо-1,3- имидазоло)метилморфолин; 148) 2-(R)-(1-(R)-(3-хлор) фенилэтокси)-3-(S)-(4-фтор)фенил-4-(4-(2-оксо-1,3- имидазоло)метилморфолин; 149) 2-(S)-(3- хлор) бензилокси-3-(S)-фенил-4-(2-имидазоло)метилморфолин; 150) 2-(S)-(3-хлор) бензилокси-3-(S) – (4-фтор)фенил-4-(2-имидазоло)метилморфолин; 151) 2-(R)-(1- (R)-(3-хлор)фенилэтокси)-3-(5)-фенил-4-(2-имидазоло) метилморфолин; 152) 2-(R)-(1-(R)-(3-хлор) фенилэтокси)-3-(S) – (4-фтор)фенил-4-(2-имидазоло)метилморфолин; 153) 2-(S)-(3- хлор)бензилокси-3-(S)-фенил-4-(4-имидазоло)метилморфолин; 154) 2-(S)-(3-хлор)бензилокси-3-(S)-4-фтор) фенил-4-(4- имидазоло)метилморфолин; 155) 2-(R)-(1-(R)-(3-хлор) фенилэтокси)-3-(S)-фенил-4-(4-имидазоло)метилморфолин; 156) 2- (R)-(1-(R)-(3-хлор)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(4- имидазоло)метилморфолин; 157) 2-(S) -(3-хлор)бензилокси-3-(S)- фенил-4-(5-тетразоло)метилморфолин; 158) 2-(S) -(3-хлор) бензилокси-3-(S)-(4-фтор)фенил-4-(5-тетразоло)метилморфолин; 159) 2-(R)-(1-(R)-(3-хлор)фенилэтокси)-3-(S)-фенил- 4-(5-тетразоло)метилморфолин; 160) 2-(R)-1-(R)-(3-хлор) фенилэтокси)-3-(S)-(4-фтор)фенил-4-(5-тетразоло)метилморфолин; 161) 2-(S)-(3-хлор) бензилокси-3-(S)-фенил-4-(2-оксо-5H- пиррол-4-ил)метилморфолин; 162) 2-(S) -(3-хлор) бензилокси-3-(S)-(4-фтор)фенил- 4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 163) 2-(R)-(1-(R)-(3-хлор)фенилэтокси)-3-(S)-фенил- 4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 164) 2-(R)-(1- (R)-(3-хлор)фенилэтокси)-3-(S)-(4- фтор)фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 165) 2-(S)-(3-трифторметил)бензилокси-3-(S)-фенил-4-(3-(1,2,4- триазоло)метилморфолин; 166) 2-(S)-(3-трифторметил)бензилокси- 3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолин; 167) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси)-3-(S)-фенил-4-(3-(1, 2,4-триазоло)метилморфолин; 168) 2-(R)-(1-(R)-(3-трифторметил) фенилэтокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло) метилморфолин; 169) 2-(S)-(3-трифторметил)бензилокси-3-(S)- фенил-4-(3-(5-оксo-1,2,4-триазоло)метилморфолин; 170) 2-(S)-(3-трифторметил)бензилокси-3-(S)-(4-фтор) фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 171) 2-(R)- (1-(R)-(3-трифторметил)фенилэтокси)-3-(S)-фенил-4-(3-(5-оксо-1, 2, 4-триазоло)метилморфолин; 172) 2-(R)-(1-(R)-(3- трифторметил)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо- 1,2,4-триазоло)метилморфолин; 173) 2-(S)-(3-трифторметил) бензилокси-3-(S)-фенил-4-(4-(2-оксо-1,3-имидазоло)метилморфолин; 174) 2-(S)-(3-трифторметил)бензилокси-3-(S)-(4-фтор)фенил-4- (4-(2-оксо-1,3-имидазоло)метилморфолин; 175) 2-(R)-(1-(R)-(3- трифторметил)фенилэтокси)-3-(S)-фенил-4-(4-(2-оксо-1,3- имидазоло)метилморфолин; 176) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси)-3-(S) -(4-фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метилморфолин; 177) 2-(S)-(3-трифторметил)бензилокси-3-(S)-фенил-4-(2- имидазоло)метилморфолин; 178) 2-(S)-(3-трифторметил) бензилокси-3-(S)-(4-фтор)фенил-4-(2-имидазоло)метилморфолин; 179) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси)-3-(3)-фенил-4- (2-имидазоло)метилморфолин; 180) 2-(R)-(1-(R)-(3- трифторметил)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(2- имидазоло)метилморфолин; 181) 2-(S)-(3-трифторметил) бензилокси-3-(S)-фенил-4-(4-имидазоло)метилморфолин; 182) 2- (S)-(3-трифторметил) бензилокси-3-(S)-(4-фтор) фенил-4-(4- имидазоло)метилморфолин; 183) 2-(R)-(1-(R)-(3-трифторметил) фенилэтокси)-3-(S)-фенил-4-(4-имидазоло)метилморфолин; 184) 2- (R)-(1-(R)-(3-трифторметил)фенилэтокси)-3-(S)-(4-фтор) фенил-4-(4-имидазоло)метилморфолин; 185) 2-(S)-(3-трифторметил) бензилокси-3-(S)-фенил-4-(5-тетразоло)метилморфолин; 186) 2- (S)-(3-трифторметил) бензилокси-3-(S)-(4-фтор) фенил-4-(5- тетразоло)метилморфолин; 187) 2-(R)-(1-(R)-(3- трифторметил) фенилэтокси)-3-(S)-фенил-4-(5-тетразоло) метилморфолин; 188) 2-(R)-1-(R)-(3-трифторметил) фенилэтокси)-3-(S)-(4-фтор) фенил-4-(5-тетразоло) метилморфолин; 189) 2-(S)-(3-трифторметил)бензилокси-3-(S)- фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 190) 2-(S)-(3-трифторметил)бензилокси-3-(S)-(4-фтор) фенил- 4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 191) 2-(R)-(1-(R)-(3- трифторметил)фенилэтокси)-3-(S)-фенил-4-(2-оксо-5H-пиррол-4-ил) метилморфолин; 192) 2-(R)-(1-(R)-(3-трифторметил)фенилэтокси)- 3-(R)-(4-фтор)фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 193) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенил-4-(3-(1,2,4- триазоло)метилморфолин; 194) 2-(S)-(3-трет-бутил)бензилокси-3- (S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метилморфолин; 195) 2- (R)-(1-(R)-(3-трет-бутил) фенилэтокси)-3-(S)-фенил-4-(3- (1,2,4-триазоло)метилморфолин; 196) 2-(R)-(1-(R)-(3- трет-бутил) фенилэтокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4- триазоло)метилморфолин; 197) 2-(S)-(3-трет-бутил)бензилокси- 3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 198) 2-(S)-(3- трет-бутил) бензилокси-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1, 2, 4-триазоло)метилморфолин; 199) 2-(R-(1-(R)-(3-трет- бутил)фенилэтокси)-3-(S)-фенил-4-(3-(5-оксо-1, 2, 4-триазоло) метилморфолин; 200) 2-(R-(1-(R)-(3-трет-бутил) фенилэтокси)-3- (S)-(4-фтор) фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 201) 2-(S)-(3-трет-бутил) бензилокси-3-(S)-фенил-4- (4-(2-оксо-1, 3-имидазоло)метилморфолин; 202) 2-(S)-(3-трет- бутил)бензилокси-3-(S)-(4-фтор)фенил-4-(4-(2-окco-1,3- имидазоло)метилморфолин; 203) 2-(R)-(1-(R)-(3-трет-бутил) фенилэтокси)-3-(S)-фенил-4-(4-(2-окco-1,3-имидазоло) метилморфолин; 204) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси)-3-(S)-(4- фтор)фенил-4-(4-(2-оксо-1,3-имидазоло)метилморфолин; 205) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-фенил-4-(2-имидазоло)- метилморфолин; 206) 2-(S)-(3-трет-бутил)бензилокси-3-(S)- (4-фтор)фенил-4-имидазоло)метилморфолин; 207) 2-(R)-(1-(R)- (3-трет-бутил)фенилэтокси)-3-(S)-фенил-4-(2-имидазоло) метилморфолин; 208) 2-(R)-(1-(R)-(3-трет-бутил)фенилэтокси)- 3-(S)-(4-фтор)фенил-4-(2-имидазоло)метилморфолин; 209) 2-(S) -(3-трет-бутил)бензилокси-3-(S)-фенил-4-(4-имидазоло)- метилморфолин; 210) 2-(S)- (3-трет-бутил)бензилокси-3-(S)- (4-фтор)фенил-4-(4-имидазоло)метилморфолин; 211) 2-(R)-(1- (R)-(3-трет-бутил)фенилэтокси)-3-(S)-фенил-4-(4-имидазоло) метилморфолин; 212) 2-(R-)-(1-(R)-(3-трет-бутил)фенилэтокси)-3- (S)-(4-фтор)фенил-4-(4-имидазоло)метилморфолин; 213) 2-(S)- (3-трет-бутил)бензилокси-3-(S)-фенил-4-(5-тетразоло) метилморфолин; 214) 2-(S)-(3-трет-бутил)бензилокси-3-(S)- (4-фтор)фенил-4-(5-тетразоло)метилморфолин; 215) 2-(R)- (1-(R)-(3-трет-бутил)фенилэтокси)-3-(S)-фенил-4-(5- тетразоло)метилморфолин; 216) 2-(R)-1-(R)-(3-трет- бутил)фенилэтокси)-3-(S)-(4-фтор)фенил-4-(5-тетразоло) метилморфолин; 217) 2-(S)-(3-трет-бутил)бензилокси-3-(S)- фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 218) 2-(S)-(3-трет-бутил)бензилокси-3-(S)-(4-фтор) фенил-4-(2-оксо-5H-пиррол-4-ил)метилморфолин; 219) 2-(R)-(1-(R)- (3-трет-бутил)фенилэтокси)-3-(S)-фенил-4-(2-оксо-5H-пиррол-4-ил) метилморфолин; 220) 2-(R)-(1-(R)-(3-трет-бутил) фенилэтокси)-3-(S)-(4-фтор)фенил-4-(2-оксо-5H-пиррол-4-ил) метилморфолин; 221) 2-(R)-(1-(R)-(3-тиометилфенил)этокси-3-(S)- фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 222) 2-(R)- (1-(R)-(3-тиометил)фенил)этокси)-3-(S)-фенил-4-(3-(1,2,4- триазоло)метилморфолин; 223) 2-(R(-(1-(R)-(3-(тиометилфенил) этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло) метилморфолин; 224) 2-(R)-(1-(R)-(3-тиометил-5-(трифторметил) фенил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 225) 2-(R)-(1-(R)-(3-тиометил-5-(трифторметил) фенил)этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 226) 2-(R)-(1-(R)-(3-(тиометил-5-(трифторметил)) фенил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло) метилморфолин; 227) 2-(R)-(1-(R)-(2,2-диметил)-5-(тиометил)-2,3 дигидробензофуран-7-ил)этокси)-3-(S)-фенил-4-(3-5-оксо- 1,2,4-триазоло)метилморфолин; 228) 2-(R)-(1-(R)-(2,2-(диметил)- 5-(тиометил)-2,3-дигидробензофуран-7-ил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метилморфолин; 229) 2-(R)-(1-(R)-(2,2- (диметил)-5-(тиометил)-2,3-дигидробензофуран-7-ил) этокси)-3-(S)-фенил-4-(3-(-2-оксо-1,3-имидазоло)метилморфолин; 230) 2-(R)-(1-(R)-(3,5- (диметокси)фенил)этокси-3-(S)-фенил-4-(3-(5-оксо-1,2,4- триазоло)метилморфолин; 231) 2-(R)-(1-(R)-(3,5-(диметокси) фенил)этокси-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин: 232) 2-(R)-(1-(R)-(3,5-(диметокси)фенил)этокси- 3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 233) 2- (R)-(1-(R)-(3-(фтор)-5-(трифторметил)этокси-3-(S)-(4-фтор)- фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 234) 2-(R)- (1-(R, )-(3-(фтор)-5-(трифторметил)этокси-3-(S)-(4-фтор)-фенил- 4-(3-(1,2,4-триазоло)метилморфолин; 235) 2-(R)-(1-(R)-(3- (фтор)-5-(трифторметил)этокси-3-(S)-(4-фтор)-фенил-4-(3-(2- оксо-1,3-имидазоло)метилморфолин; 236) 2-(R)-(1-(R)-(3-(хлор)- 5-(трифторметил)этокси-3-(S)-(4-фтор)-фенил-4-(3-(5-оксо-1, 2,4-триазоло)метилморфолин; 237) 2-(R)-(1-(R)-(3-(хлор)-5- (трифторметил)этокси-3-(S)-(4-фтор)-фенил-4-(3-(1,2,4- триазоло)метилморфолин; 238) 2-(R)-(1-(R)-(3-(хлор)-5- (трифторметил)этокси-3-(S)-(4-фтор)-фенил-4-(3-(2-оксо-1, 3-имидазоло)метилморфолин; 239) 2-(R)-(1-(R)-(3,5- (диметил)фенил)этокси-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4- триазоло)метилморфолин; 240) 2-(R)-(1-(R)-(3,5- (диметил)фенил)этокси-3-(S)-(4-фтор)фенил-4-(3-(1,2,4- триазоло)метилморфолин; 241) 2-(R)-(1-(R)-(3,5-(диметил)фенил)этокси-3-(S)-(4-фтор) фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 242) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил)этокси- 3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 243) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил)этокси-3-(S)- (4-фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолин; 244) 2- (R)-(1-(R)-(3-фтор)-5-(метил)фенил)этокси-3-(S)-(4-фтор) фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 245) 2-(R)-(1- (R)-(3-(хлор)-5-(метил)фенил)этокси-3-(S)-(4-фтор)фенил-4-(3- (5-оксо-1,2,4-триазоло)метилморфолин; 246) 2-(R)-(1-(R)-(3- (хлор)-5-(метил)фенил)этокси-3-(S)-(4-фтор)фенил-4-(3-(1, 2,4-триазоло)метилморфолин; 247) 2-(R)-(1-(R)-(3-(хлор)-5- (метил)фенил)этокси-3-(S)-(4-фтор)фенил-4-(3-(2-оксо-1,3-имидазоло) метилморфолин; 248) 2-(R)-(1-(R)-(3-бром)-5-(метил)фенил)этокси-3-(S)- (4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 249) 2-(R)-(1-(R)-(3-(бром)-5-(метил) фенил)этокси-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метилморфолин; 250) 2-(R)-(1-(R)- (3-(бром)-5-(метил)фенил)этокси-3-(S)-(4-фтор)фенил-4-(3-(2- оксо-1,3-имидазоло)метилморфолин; 251) 2-(R)-(1-(R)-(3- (изопропокси)фенил)этокси-3-(S)-(4-фтор)фенил-4-(3-(5- оксо-1,2,4-триазоло)метилморфолин; 252) 2-(R)-(1-(R)-(3- (изопропокси)фенил)этокси-3-(S)(4-фтор)фенил-4-(3-(1,2,4- триазоло)метилморфолин; 253) 2-(R)-(1-(R)-(3-(изопропокси)фенил)этокси-3-(S)-4- фтор)фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 254) 2- (R)-(1-(R)-(3-(изопропокси)-5-(трифторметил)фенил)этокси-3- (S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 255) 2-(R)-(1-(R)-(3-(изопропокси)-5-(трифторметил) фенил)этокси-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло) метилморфолин; 256) 2-(R)-(1-(R)-(3-(изопропокси)-5- (трифторметил)фенил)этокси-3-(S)-(4-фтор)фенил-4-(3-(2- оксо-1,3-имидазоло)метилморфолин; 257) 2-(R)-(1-(R)-(3-(хлор)- 5-(изопропокси)фенил)этокси)-3-(S)-4-фтор)фенил-4-(3-(5- оксо-1,2,4-триазоло)метилморфолин; 258) 2-(R)-(1-(R)-(3- (хлор)-5-(изопропокси)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (3-(1,2,4-триазоло)метилморфолин; 259) 2-(R)-(1-(R)-(3- (хлор)-5-(изопропокси)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (3-(2-оксо-1,3-имидазоло)метилморфолин; 260) 2-(R)-(1-(R)-(3- (фтор)-5-(изопропокси)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (3-(5-оксо-1,2,4-триазоло)метилморфолин; 261) 2-(R)-(1-(R)-(3- (фтор)-5-(изопропокси)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (3-(1,2,4-триазоло)метилморфолин; 262) 2-(R)-(1-(R)-(3- (фтор)-5-(изопропокси)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (3-(2-оксо-1,3-имидазоло)метилморфолин; 263) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(хлор)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 264) 2-(R)-(1-(R-(3-(трет-бутил)-5-(хлор)фенил) этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло) метилморфолин; 265) 2-(R)-(1-(R)-(3-(трет-бутил)-5-(хлор)фенил)этокси) -3-(S)-(4-фтор)фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 266) 2-(R)-(1-(R)-(3-(трет-бутил)-5- (трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5- оксо-1,2,4-триазоло)метилморфолин; 267) 2-(R)-(1-(R)-(3- (трет-бутил)-5-(трифторметил)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метилморфолин; 268) 2-(R)-(1-(R)- (3-(трет-бутил)-5-(трифторметил)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 269) 2-(R)-(1- (R)-(3,5-(диметил)-4-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил- 4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 270) 2-(R)-(1-(R) -(3,5-(диметил)-4-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил- 4-(3-(1,2,4-триазоло)метилморфолин; 271) 2-(R)-(1-(R)-(3,5- (диметил)-4-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3- (2-оксо-1,3-имидазоло)метилморфолин; 272) 2-(R)-(1-(R)- (3,5-(диметил)-4-(хлор)фенил)этокси)-3-(S)-(4-фтор)фенил-4- (3-(5-оксо-1,2,4-триазоло)метилморфолин; 273) 2-(R)-(1-(R)-(3,5-диметил)-4-(хлор) фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло) метилморфолин; 274) 2-(R)-(1-(R)-(3,5-(диметил)-4-(хлор)фенил)этокси)- 3-(S)-(4-фтор)фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин 275) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(фтор)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4- триазоло)метилморфолин; 276) 2-(R)-(1-(R)-(3,5- бис(трифторметил)-4-(фтор)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(1,2,4-триазоло)метилформолин; 277) 2-(R)-(1-(R)- (3,5-бис(трифторметил)-4-(фтор)фенил)этокси)-3-(S)-(4- фтор)фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 278) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 279) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси) -3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолин; 280) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4-(хлор)фенил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 281) 2-(R)-(1-(R)-(3,5-(дихлор)фенил)этокси-3-(S)-(4-фтор)фенил) -4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 282) 2-(R)-(1-(R)-(3,5-(дихлор)фенил)этокси)-3-(S)-(4- фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолин; 283) 2-(R)- (1-(R)-(3,5-(дихлор)фенил)этокси)-3-(S)-14-фтор)фенил-4- (3-(2-оксо-1,3-имидазоло)метилморфолин; 284) 2-(R)-(1-(R)- (3,5-(дифтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5- оксо-1,2,4-триазоло)метилморфолин; 285) 2-(R)-(1-(R)-(3,5- (дифтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4- триазоло)метилморфолин; 286) 2-(R)-(1-(R)-(3,5-(дифтор) фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(2-оксо-1,3- имидазоло)метилморфолин; 287) 2-(R)-(1-(R)-(1-(нафтил) этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 288) 2-(R)-(1-(R)-(1-(нафтил)этокси)-3-(S)-(4- фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолин; 289) 2-(R)- (1-(R)-(1-(нафтил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(2- ОКСО-1,3-имидазоло)метилморфолин; 290) 2-(R)-(1-(R)-(1-(4- (фтор)нафтил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4- триазоло)метилморфолин; 291) 2-(R)-(1-(R)-(1-(4-фтор)нафтил) этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло) метилморфолин; 292) 2-(R)-(1-(R)-(1-(4-(фтор)нафтил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 293) 2-(R)-(1-(R)-(1-(3-(фтор)нафтил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 294) 2-(R)- (1-(R)-(1-(3-фтор)нафтил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2, 4-триазоло)метилморфолин; 295) 2-(R)-(1-(R)-(1-(3-(фтор)нафтил)этокси-3-(S)-(4- фтор)фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 296) 2-(R)-(1-(R)-(1-(3-(хлор)нафтил)этокси)-3-(S)- (4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 297) 2-(R)-(1-(R)-(1-(3-хлор)нафтил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолин; 298) 2-(R)-(1-(R)-(1-(3-(хлор)нафтил)этокси)-3-(S)-(4-фтор) фенил-4- (3-(2-оксо-1,3-имидазоло)метилморфолин; 299) 2-(R)-(1-(R)- (1-(3-(метил)нафтил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5- оксо-1,2,4-триазоло)метилморфолин; 300) 2-(R)-(1-(R)-(1-(3- метил)нафтил)этокси)-3-(S)-((4-фтор)фенил-4-(3-(1,2,4- триазоло)метилморфолин; 301) 2-(R)-(1-(R)-(1-(3- (метил)нафтил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(2-оксо-1,3- имидазоло)метилморфолин; 302) 2-(R)-(1-(R)-(1-(3-(трифторметил) нафтил)этокси-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4- триазоло)метилморфолин; 303) 2-(R)-(1-(R)-(1-(3-(трифторметил) нафтил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло) метилморфолин; 304) 2-(R)-(1-(R)-(1-(3- (трифторметил)нафтил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(2- оксо-1,3-имидазоло)метилморфолин; 305) 2-(R)-(1-(R)-(1-(3- (тиометилфенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1, 2,4-триазоло)метилморфолин; 306) 2-(R)-(1-(R)-(1-(3-(тиометилфенил)этокси)-3- (S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолин; 307) 2-(R)-(1-(R)-(1-(3-(тиометилфенил)этокси)-3-(S)-(4- фтор)фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 308) 2-(R)-(1-(R)-(1-(3-(тиометил-5-(трифторметил)фенил)этокси) -3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 309) 2-(R)-(1-(R)-(1-(3-(тиометил-5- (трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4- триазоло)метилморфолин; 310) 2-(R)-(1-(R)-(1-(3-(тиометил-5- (трифторметил)фенил)этокси)-3-9S)-(4-фтор)фенил-4-(3-(2- оксо-1,3-имидазоло)метилморфолин; 311) 2-(R)-(1-(R)-(2,2- (диметил)-5-(тиометил)-2,3-дигидробензофуран-7-ил)этокси)-3-(S)- (4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло)метилморфолин; 312) 2-(R)-(1-(R)-(2,2-(диметил)-5-(тиометил)-2,3- дигидробензофуран-7-ил)этокси-3-(S)-(4-фтор)фенил-4-(3-(1, 2,4-триазоло)метилморфолин; 313) 2-(R)-(1-(R)-(2,2-(диметил)-5- (тиометил)-2,3-дигидробензофуран-7-ил)этокси-3-(S)-(4-фтор) фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 314) 2-(R)- (1-(R)-(3,5-(диметокси)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3- (5-оксо-1,2,4-триазоло)метилморфолин; 315) 2-(R)-(1-(R)-(3,5- (диметокси)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1,2,4- триазоло)метилморфолин; 316) 2-(R)-(1-(R)-(3,5- (диметокси)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(2-оксо-1,3- имидазоло)метилморфолин; 317) 2-(R)-(1-(R)-(фенил)этокси)-3-(S)-фенил-4-(3-(5- оксо-1,2,4-триазоло)метилморфолин; 318) 2-(R)-(l-(R)-(фенил) этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло)метилморфолин; 319) 2-(R)-(1-(R)-(фенил)этокси)-3-(S)-фенил-4-(3-(2- оксо-1,3-имидазоло)метилморфолин; 320) 2-(R)-(1-(R)-(фенил) этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 321) 2-(R)-(1-(R)-(фенил)этокси)-3-(S)-(4-фтор)фенил-4- (3-1,2,4-триазоло)метилморфолин; 322) 2-(R)-(1-(R)- (фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(2-оксо-1,3- имидазоло)метилморфолин; 323) 2-(R)-(1-(R)-(3-(фтор)фенил) этокси)-3-(S)-фенил-4-(3-(5-оксo-1,2,4-триазоло) метилморфолин; 324) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)-3-(S) -фенил-4-(3-(1,2,4-триазоло)метилморфолин; 325) 2-(R)-(1-(R)- (3-(фтор)фенил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3- имидазоло)метилморфолин; 326) 2-(R)-(1-(R)-(3- (фтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1,2,4- триазоло)метилморфолин; 327) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)- 3-(S)-(4-фтор)фенил-4-(3-(1,2,4-триазоло)метилморфолин; 328) 2-(R)-(1-(R)-(3-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3- (2-оксо-1,3-имидазоло)метилморфолин; 329) 2-(R)-(1-(R)-(4- (фтор)фенил)этокси)-3-(S)-фенил-4-(3-5-оксо-1,2,4- триазоло)метилморфолин; 330) 2-(R)-(1-(R)-(4-(фтор) фенил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метилморфолин; 331) 2-(R)-(1-(R)-(4- (фтор)фенил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло) метилморфолин; 332) 2-(R)-(1-(R)-(4-(фтор)фенил)этокси)-3-(S)-(4- фтор) фенил-4-(3-(5-оксо-I,2,4-триазоло)метилморфолин; 333) 2-(R)-(1-(R)-(4-(фтор)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3- (1,2,4-триазоло)метилморфолин; 334) 2-(R)-(1-(R)-(4-(фтор) фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(2-оксо-1,3- имидазоло)метилморфолин; 335) 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(3-фтор)фенил-4-(3- (5-оксо-1,2,4-триазоло)метилморфолин; 336) 2-(R)-(1-(R)-(3, 5-бис(трифторметил)фенил)этокси)-3-(S)-(3-фтор)фенил-4-(3- (1,2,4-триазоло) метилморфолин; 337) 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(3-фтор)фенил-4-(3-(2-оксо-1,3 -имидазоло)метилморфолин; 338) 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-3,4-дифтор)фенил-4- (3-(5-оксо-1,2,4-триазоло)метилморфолин; 339) 2-(R)-(1-(R)- (3,5-бис(трифторметил)фенил)этокси)-3-(S)-(3,4-дифтор)фенил-4- (3-(1,2,4-триазоло)метилморфолин; 340) 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(3,4-дифтор)фенил-4- (3-(2-оксо-1,3-имидазоло)метилморфолин; 341) 2-(R)-(1-(R)-(3,5-бис(трифторметил) фенил)этокси)-3-(S)-(3,4-дихлор)фенил-4-(3-(5-оксо-1,2,4- триазоло)метилморфолин; 342) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)- (3,4-дихлор)фенил-4-(3-(1,2,4-триазоло)метилморфолин; 343) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил) этокси)-3-(S)-(3,4-дихлор)фенил-4-(3-(2-оксо-1,3- имидазоло)метилморфолин; 344) 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(3,4-диметил)фенил-4-(3- (5-оксо-1,2,4-триазоло)метилморфолин; 345) 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(3,4-диметил)фенил-4- (3-(1,2,4-триазоло)метилморфолин; 346) 2-(R)-(1-(R)-(3,5 бис(трифторметил)фенил)этокси)-3- (S)-(3,4-диметил)фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 347) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)3-(S)- (3,4-метилендиоксифенил-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин; 348)2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(3,4-метилендиоксифенил-4- (3-(1,2,4-триазоло)метилморфолин; 349) 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(3,4- метилендиоксифенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 350) 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(2-нафтил)-4-(3-(5-оксо- 1,2,4-триазоло)метилморфолин; 351) 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(2-нафтил)-4-(3-(1,2,4- триазоло)метилморфолин; 352) 2-(R)-(1-(R)-(3,5-бис(трифторметил) фенил)этокси)-3-(S)-(2-нафтил)-4-(3-(2-оксо-1,3- имидазоло)метилморфолин; 353) 2-(R)-(1-(R)-(3-(фтор)-5- (трифторметил)-этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3- имидазоло)метилморфолин; 354) 2-(R)-(1-(R)-(3-(фтор)-5- (трифторметил)этокси)-3-(S)-фенил-4-(3-(5-оксо-1,2,4- триазоло)метилморфолин; 355) 2-(R)-(1-(R)-(3-(хлор)-5- (трифторметил)этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 356) 2-(R)-(1-(R)-(3-(хлор-5-(трифторметил) этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло) метилморфолин; 357) 2-(R)-(1-(R)-(3,5-(диметил)фенил)этокси)-3- (S)-фенил-4-(3-(1,2,4-триазоло)метилморфолин; 358) 2-(R-)-(1-(R)-(3,5-(диметил)фенил)этокси)-3-(S)-фенил-4-(3- (2-оксо-1,3-имидазоло)метилморфолин; 359) 2-(R)-1-(R)-(3-(фтор)-5- (метил)фенил)этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 360) 2-(R)-(1-(R)-(3-(фтор)-5-(метил)фенил) этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин 361) 2-(R)-(1-(R)-(3-(хлор)-5-(метил)фенил)этокси)-3-(S)- фенил-4-(3-(1,2,4-триазоло)метилморфолин; 362) 2-(R)-(1-(R)-(3-(хлор)-5-(метил)фенил)этокси)-3- (S)-фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 363) 2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил)этокси)- 3-(S)-фенил-4-(3-(1,2,4-триазоло)метилморфолин; 364) 2-(R)-(1-(R)-(3-(бром)-5-(метил)фенил)этокси)- 3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 365) 2-(R)-(1-(R)-(3-(изопропокси)фенил)этокси)-3-(S)-фенил-4-(3- (1,2,4-триазоло)метилморфолин; 366) 2-(R)-(1-(R)-(3- (изопропокси)фенил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3- имидазоло)метилморфолин; 367) 2-(R)-(1-(R)-(3-(изопропокси)-5- (трифторметил)фенил)этокси)-3-(S)-фенил-4-(3-(1, 2, 4- триазоло)метилморфолин; 368) 2-(R)-(1-(R)-(3-(изопропокси)-5- (трифторметил)фенил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1, 3- имидазоло)метилморфолин; 369) 2-(R)-(1-(R)-(3-хлор)-5- (изопропокси)фенил)этокси)-3-(S)-фенил-4-(3-(1, 2, 4- триазоло)метилморфолин; 370) 2-(R)-(1-(R)-(3-хлор)-5- (изопропокси)фенил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1, 3- имидазоло)метилморфолин; 371) 2-(R)-(1-(R)-(3-фтор)-5- (изопропокси)фенил)этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 372) 2-(R)-(1-(R)-(3-фтор)-5-(изопропокси)фенил) этокси)-3-(S)-фенил-4-(3-(2-оксо-1, 3-имидазоло) метилморфолин; 373) 2-(R)-(1-(R)-(3-трет-бутил)-5-(хлор)фенил) этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло)метилморфолин; 374) 2-(R)-(1-(R)-(3-трет-бутил)-5-(хлор)фенил)этокси)-3-(S) -фенил-4-(3-(2-оксо-1, 3-имидазоло)метилморфолин; 375) 2-(R)-(1-(R)-(3-трет-бутил)-5-(трифторметил)фенил) этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло)метилморфолин; 376) 2-(R)-(1-(R)-(3-трет-бутил)-5-(трифторметил)фенил) этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин 377) 2-(R)-(1-(R)-(3,5-(диметил)-4- (фтор)фенил)этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 378) 2-(R)-(1-(R)-(3,5-(диметил)-4- (фтор)фенил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло) метилморфолин; 379) 2-(R)-(1-(R)-(3,5-(диметил)-4- (хлор)фенил)этокси)-3-(S)-фенил-4 (3-(1,2,4-триазоло) метилморфолин; 380) 2-(R)-(1-(R)-(3,5-(диметил)-4- (хлор)фенил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло) метилморфолин; 381) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4- (фтор)фенил) этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 382) 2-(R)-(1-(R)-(3,5-бис(трифторметил)-4- (фтор)фенил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3- имидазоло)метилморфолин; 383) 2-(R)-(1-(R)-(3,5- бис(трифторметил)-4-(хлор)фенил)этокси)-3-(S)-фенил-4-(3-(1, 2,4-триазоло)метилморфолин; 384) 2-(R)-(1-(R)-(3,5-бис (трифторметил)-4-(хлор)фенил)этокси)-3-(S)-фенил-4-(3-(2- оксо-1,3-имидазоло)метилморфолин; 385) 2-(R)-(1-(R)-(3,5- (дихлор)фенил)этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 386) 2-(R)-(1-(R)-(3,5-(дихлор)этокси)-3-(S)- фенил-4-(3-(2-оксо-1,3-имидазоло)метилморфолин; 387) 2-(R)-(1-(R)-(3,5-(дифтор)фенил)этокси)-3-(S)-фенил- 4-(3-(1,2,4-триазоло)метилморфолин; 388) 2-(R)-(1-(R)-(3,5- (дифтор)фенил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло) метилморфолин; 389) 2-(R)-(1-(R)-(1-нафтил)этокси)-3-(S)-фенил-4- (3-(1,2,4-триазоло)метилморфолин; 390) 2-(R)-(1-(R)-(1- нафтил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло) метилморфолин; 391) 2-(R)-(1-(R)-(1-(4-(фтор)нафтил)этокси) -3-(S)-фенил-4-(3-(1,2,4-триазоло)метилморфолин; 392) 2-(R)-(1-(R)-(1-(4-фтор(нафтил)этокси)-3-(S)-фенил-4-(3-(2- оксо-1,3-имидазоло)метилморфолин; 393) 2-(R)-(1-(R)-(1-(3- (фтор)нафтил)этокси)-3-(S)-фенил-4-(3-(1,2,4-триазоло) метилморфолин; 394) 2-(R)-(1-(R)-(1-(3-фтор)нафтил)этокси)-3- (S)-фенил-4-(3-(2-оксо-I, 3-имидазоло)метилморфолин; 395) 2-(R)-(1-(R)-(1-(3-(хлор)нафтил)этокси)-3-(S)-фенил-4-(3-(1,2, 4-триазоло)метилморфолин; 396) 2-(R)-(1-(R)-(1-(3- хлор)нафтил)этокси)-3-(S)-фенил-4-(3-(2-оксо-1,3-имидазоло) метилморфолин; 397) 2-(R)-(1-(R)-(1-(3-(метил)нафтил)этокси)-3- (S)-фенил-4-(3-(1,2,4-триазоло)метилморфолин; 398) 2-(R)-(1-(R)-(1-(3-метил)нафтил)этокси)-3-(S)-фенил-4-(3- (2-оксо-1,3-имидазоло)метилморфолин. ПРИМЕР 88 2-(R)-(2,5-Бис(трифторметил)бензилокси)-3-(S)-(4- фторфенил)-4-бензилморфолин Заглавное соединение получали из 3-(S)-(4-фторфенил)- 4-бензил-2-морфолинона (из примера 59) способом, аналогичным способу примера 67. Масс-спектр (С1): m/z 528 (М+H). 1H ЯМР- спектр (CDCl3, 360 МГц, м.д.);  2,46 (дт, 1H), 2,90 (дд, 2H), 2,76 (дд, J=11,6, 2,0, 1H), 3,88 (д, J=13,6, 1H), 4,18 (т, 1H), 6,20 (д, J=2,8, 1H), 7,04 (д, J =8,4, 2H), 7,24-7,32 (м, 5H), 7,50 (м, 2H), 7,60 (с, 1H), 7,88 (дд, 2H).
ПРИМЕР 89 2,46 (дт, 1H), 2,90 (дд, 2H), 2,76 (дд, J=11,6, 2,0, 1H), 3,88 (д, J=13,6, 1H), 4,18 (т, 1H), 6,20 (д, J=2,8, 1H), 7,04 (д, J =8,4, 2H), 7,24-7,32 (м, 5H), 7,50 (м, 2H), 7,60 (с, 1H), 7,88 (дд, 2H).
ПРИМЕР 892-(R)-(1-(2,5-Бис(трифторметил) фенил) этенилокси)-3-(S)-(4-фторфенил)-4-бензилморфолин Заглавное соединение получали из 2-(R)-(2,5-бис (трифторметил)бензилокси)-3-(S)-(4-фторфенил)-4- бензилморфолина (из примера 88) способом, аналогичным способу примера 68. 1H ЯМР-спектр (CDCl3, 250 МГц, м.д.):  2,30 (дт, J=3,5, 11,9, 1H), 2,74 (прибл. д, J=9,4, 1H), 2,82 (д, J= 13,5, 1H), 3,55-3,60 (м, 2H), 3,72 (д, J=13,5, 1H), 4,10 (дт, J= 2,4, 11,7, 1H), 4,22 (д, J=2,7, 1H), 4,67 (д, J=2,8, 1H), 5,18 (д, J=2,8, 1H), 6,90 (т, J=8,7, 2H), 7,08 (c, 1H), 7,13-7,23 (м, 5H), 7,36 (дд, J=5,6, 8,7, 2H), 7,62 (д, J=8,4, 1H), 7,72 (д, J =8,4, 1H).
ПРИМЕР 90 2,30 (дт, J=3,5, 11,9, 1H), 2,74 (прибл. д, J=9,4, 1H), 2,82 (д, J= 13,5, 1H), 3,55-3,60 (м, 2H), 3,72 (д, J=13,5, 1H), 4,10 (дт, J= 2,4, 11,7, 1H), 4,22 (д, J=2,7, 1H), 4,67 (д, J=2,8, 1H), 5,18 (д, J=2,8, 1H), 6,90 (т, J=8,7, 2H), 7,08 (c, 1H), 7,13-7,23 (м, 5H), 7,36 (дд, J=5,6, 8,7, 2H), 7,62 (д, J=8,4, 1H), 7,72 (д, J =8,4, 1H).
ПРИМЕР 902-(R)-(1-(R)-(2,5-Бис(трифторметил)фенил)этокси) -3-(S)-(4-фторфенил)морфолин Заглавное соединение получали из 2-(R)-(1-(2,5-бис (трифторметил) фенил) этенилокси)-3-(S)-(4-фторфенил)-4- бензилморфолина (из примера 89) способом, аналогичным способу примера 74. Масс-спектр (C1): m/z 438 (М+H). 1H ЯМР-спектр (соль с HCl, d6 -DMSO, 360 МГц, м.д.):  1,47 (д, J=8,7, 3H), 3,88 (д, J = 11,8, 1H), 4,20 (дт, J=3,7, 11,8, 1H), 4,50 (c, 1H), 4,58 (c, 1H), 5,17 (м, 1H), 7,04 (c, 1H), 7,23 (т, J=8,8, 2H), 7,55 (м, 2H), 7,77 (д, J= 8,1, 1H), 7,88 (д, J=8,3, 1H), 10,1 (шир. с, 1H).
ПРИМЕР 91 1,47 (д, J=8,7, 3H), 3,88 (д, J = 11,8, 1H), 4,20 (дт, J=3,7, 11,8, 1H), 4,50 (c, 1H), 4,58 (c, 1H), 5,17 (м, 1H), 7,04 (c, 1H), 7,23 (т, J=8,8, 2H), 7,55 (м, 2H), 7,77 (д, J= 8,1, 1H), 7,88 (д, J=8,3, 1H), 10,1 (шир. с, 1H).
ПРИМЕР 912-(R)-(1-(R)-(2,5-Бис(трифторметил)фенил) этокси)-3-(S)-(4-фторфенил)-4-(3-(5-оксо-1,2,4-триазоло) метилморфолин Заглавное соединение получали из 2-(R)-(1-(2,5-бис (трифторметил) фенил)этокси)-3-(S)-(4-фторфенил)морфолина (из примера 90) способом, аналогичным способу примера 70. Т.пл. 162-168oC. 1H-ЯМР-спектр (d6-DMSO, 360 МГц, м.д.):  1,37 (д, J =6,4, 3H), 2,40 (дт, J=3,3, 11,9, 1H), 2,77 (д, J=14,0, 1H), 2,86 (д, J=11,5, 1H), 3,37 (д, J=14,4, 1H), 3,48 (д, J=2,7, 1H), 3,64 (д, J= 11,0, 1H), 4,11 (т, J=9,8, 1H), 4,18 (д, J=2,8, 1H), 5,16 (к, J=6,2, 1H), 6,90(с, 1H), 7,08 (т, J=8,8, 2H), 7,50 (шир. т, 1H), 7,74 (д, J=8,3, 1H), 7,85 (д, J=8,3, 1H), 11,25 (с, 1H), 11,35 (с, 1H).
ПРИМЕР 92 1,37 (д, J =6,4, 3H), 2,40 (дт, J=3,3, 11,9, 1H), 2,77 (д, J=14,0, 1H), 2,86 (д, J=11,5, 1H), 3,37 (д, J=14,4, 1H), 3,48 (д, J=2,7, 1H), 3,64 (д, J= 11,0, 1H), 4,11 (т, J=9,8, 1H), 4,18 (д, J=2,8, 1H), 5,16 (к, J=6,2, 1H), 6,90(с, 1H), 7,08 (т, J=8,8, 2H), 7,50 (шир. т, 1H), 7,74 (д, J=8,3, 1H), 7,85 (д, J=8,3, 1H), 11,25 (с, 1H), 11,35 (с, 1H).
ПРИМЕР 922-(R)-(1-(R)-(2,5-Бис(трифторметил)фенил)этокси) -3- (S)-(4-фторфенил)-4-(3-(1,2,4-триазоло) метил) морфолин Заглавное соединение получали из 2-(R)-(1-(R)-(2,5- бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил) морфолина (из примера 90) способом, аналогичным способу примера 17. Т.пл. 98-100oC. Масс-спектр (С1): m/z 519 (М+Н). 1H ЯМР-спектр d6-DMSO, 360 МГц, м.д.):  1,36 (д,7=6,4, 3H), 2,46 (дт, J= 3,26, 11,9, 1H), 2,89 (д, J =11,0, 1H), 3,16 (д, J=13,9, 1H), 3,57-3,64 (м, 3H), 4,09 (т, J=10,5, 1H), 4,18 (д, J=2,6, 1H), 5,14 (к, J= 6,4, 1H), 6,90 (с, 1H), 7,11 (т, J=8,7, 2H), 7,48 (м, 2H), 7,72 (д, J=8,3, 1H), 7,83 (д, J=8,3, 1H), 8,36 (шир. с), 13,8 (с, 1H).
ПРИМЕР 93 1,36 (д,7=6,4, 3H), 2,46 (дт, J= 3,26, 11,9, 1H), 2,89 (д, J =11,0, 1H), 3,16 (д, J=13,9, 1H), 3,57-3,64 (м, 3H), 4,09 (т, J=10,5, 1H), 4,18 (д, J=2,6, 1H), 5,14 (к, J= 6,4, 1H), 6,90 (с, 1H), 7,11 (т, J=8,7, 2H), 7,48 (м, 2H), 7,72 (д, J=8,3, 1H), 7,83 (д, J=8,3, 1H), 8,36 (шир. с), 13,8 (с, 1H).
ПРИМЕР 932-(R)-(1-(R)-(2,5-Бис(трифторметил)фенил) этокси)-3-(S)-(4-фторфенил)-4-(4-(2-оксо-1,3-имидазоло) метил)морфолин Заглавное соединение получали из 2-(R)-(1-(R)- (2,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил) морфолина (из примера 90) способом, аналогичным способу примера 83. Образец перекристаллизовали из водного этанола. Т.пл. 203-205oC. 1H ЯМР-спектр (d6-DMSO, 360 МГц, м.д.):  1,35 (д, J=6,4, 3H), 2,25 (дт, J =3,1, 11,8, 1H), 2,58 (д, J=13,9, 2,88 (д, J= 11,6, 1H), 3,24 (д, J=14,0, 1H), 3,35 (д, J=2,7, 1H), 3,64 (дд, J=9,6, 1H), 4,09 (т, J=9,8, 1H), 4,16 (д, J=2,7, 1H), 5,14 (к, J=6,5, 1H), 5,97 (c, 1H), 6,89 (с, 1H), 7,07 (т, J =8,7, 1H), 7,49 (м, 1H), 7,72 (д, J=8,l, 1H), 7,83 (д, J=8,3, 1H), 9,57 (c, 1H), 9,80 (c, 1H).
ПРИМЕР 94 1,35 (д, J=6,4, 3H), 2,25 (дт, J =3,1, 11,8, 1H), 2,58 (д, J=13,9, 2,88 (д, J= 11,6, 1H), 3,24 (д, J=14,0, 1H), 3,35 (д, J=2,7, 1H), 3,64 (дд, J=9,6, 1H), 4,09 (т, J=9,8, 1H), 4,16 (д, J=2,7, 1H), 5,14 (к, J=6,5, 1H), 5,97 (c, 1H), 6,89 (с, 1H), 7,07 (т, J =8,7, 1H), 7,49 (м, 1H), 7,72 (д, J=8,l, 1H), 7,83 (д, J=8,3, 1H), 9,57 (c, 1H), 9,80 (c, 1H).
ПРИМЕР 94N-Оксид 2-(S)-(3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-4- (3-(5-оксо-1H,4H-1,2,4-триазоло)метил)морфолин Раствор 125 мг (0,25 ммоль)2-(S)-(3,5-бис(трифторметил) бензилокси)-3-(S)-фенил-4-(3-(5-оксо-1H, 4H-1,2,4- триазоло)метилморфолина в 10 мл хлористого метилена обрабатывали 100 мг 80-85% 3-хлорпероксибензойной кислотой, и полученную смесь перемешивали 1 ч при комнатной температуре. Реакционную смесь концентрировали в вакууме, и остаток распределяли между 25 мл этилацетата и 25 мл насыщенного водного раствора бикарбоната натрия. Органический слой отделяли, промывали 15 мл 0,1 н водного раствора едкого натра, сушили над сульфатом натрия и концентрировали в вакууме, получая 142 мг неочищенного продукта. Флэш-хроматографией остатка на силикагеле (колонка 15 мл) с использованием смеси хлористый метилен/метанол/вода (95:5:0,5) в качестве элюента получали 83 мг (64%) заглавного соединения. Масс-спектр (NH3– Cl): m/z 519 (20% М+), 406(90%), 404(100%). 1H ЯМР-спектр (500 МГц, CDCl3):  3,56-3,66(м, 1H), 3,80 (шир.д, J=10,0, 1H), 3,95-4,20 (м, 3H), 4,43-4,47 (м, 1H), 4,50 (д, J=13,4, 1H), 4,86-4,94 (м, 3H), 7,32 (прибл. с, 5H), 7,56 (с, 2H), 7,68 (с, 1H), 8,40 (шир.с, 1H), 12,15 (шир. с, 1H).
ПРИМЕР 95 3,56-3,66(м, 1H), 3,80 (шир.д, J=10,0, 1H), 3,95-4,20 (м, 3H), 4,43-4,47 (м, 1H), 4,50 (д, J=13,4, 1H), 4,86-4,94 (м, 3H), 7,32 (прибл. с, 5H), 7,56 (с, 2H), 7,68 (с, 1H), 8,40 (шир.с, 1H), 12,15 (шир. с, 1H).
ПРИМЕР 952-(S)-(3,5-Бис (трифторметил)бензилокси)-3- (S)-фенил-4-(3-(4-(этоксикарбонилокси-1-этил)-5-оксо-1H, 4H- 1,2,4-триазоло)метил)морфолин Смесь 250 мг (0,5 ммоль) 2-(S)- (3,5-бис(трифторметил)бензилокси)-3-(S)-фенил-4-(3-(5-оксо- 1H, 4H-1,2,4-триазоло) метилморфолина, 70 мг (0,5 ммоль) N, N-диизопропилэтиламина и 100 мг (1-хлорэтил)этилкарбоната в 15 мл дихлорэтана кипятили с обратным холодильником в течение 16 ч. ТСХ показывала, что реакция прошла неполностью. Дихлорэтан заменяли на толуол. В реакционную смесь добавляли 70 мг N,N- диизопропилэтиламина и 100 мг (1-хлорэтил)-этилкарбоната и смесь 24 ч кипятили с обратным холодильником. В это время вводили дополнительные 70 мг N,N-диизопропилэтиламина и 100 мг (1- хлорэтил)этилкарбоната, и полученную смесь кипятили 24 ч с обратным холодильником. Реакционную смесь охлаждали до комнатной температуры и распределяли между 25 мл этилацетата и 25 мл насыщенного водного раствора бикарбоната натрия, и слои разделяли. Водный слой экстрагировали этилацетатом. Органические слои объединяли, сушили над сульфатом натрия и концентрировали в вакууме, получая 420 мг неочищенного продукта в виде пены. Флэш-хроматографией остатка на силикагеле (колонка 25 мл) с использованием в качестве элюента смеси хлористый метилен/изопропанол (100: 1, об./об.) получали 68 мг (22%) заглавного соединения). Масс-спектр (ESI): m/z 619 (15%, M+1), 575 (100%). 1H ЯМР-спектр (CDCl3, 500 МГц, м.д.):  1,38 (т, J =7,0, 3H), 2,61 (дт, J=3,0, 12,0, 1H), 2,90 (д, J= 11,5, 1H), 3,03 (д, J =15,5, 1H), 3,63 (д, J =2,0, 1H), 3,66-3,71 (м, 2H), 4,20 (дт, J=2,0, 11,5, 1H), 4,41-4,45 (м, 2H), 4,48 (д, J = 13,5, 1H), 4,71 (д, J=2,0, 1H), 4,81 (д, J=13,5, 1H), 7,34-7,48 (м, 5H), 7,47 (с, 2H), 7,72 (с, 1H), 10,1 (шир.с, 1H). 13С ЯМР-спектр (CDCl3, 125 МГц, м. д. ): 1,38 (т, J =7,0, 3H), 2,61 (дт, J=3,0, 12,0, 1H), 2,90 (д, J= 11,5, 1H), 3,03 (д, J =15,5, 1H), 3,63 (д, J =2,0, 1H), 3,66-3,71 (м, 2H), 4,20 (дт, J=2,0, 11,5, 1H), 4,41-4,45 (м, 2H), 4,48 (д, J = 13,5, 1H), 4,71 (д, J=2,0, 1H), 4,81 (д, J=13,5, 1H), 7,34-7,48 (м, 5H), 7,47 (с, 2H), 7,72 (с, 1H), 10,1 (шир.с, 1H). 13С ЯМР-спектр (CDCl3, 125 МГц, м. д. ):  14,2, 25,2, 50,7, 52,6, 59,2, 64,1, 64,5, 67,7, 69,7, 97,9, 121,5, 123,1(к, J = 271), 127,2, 128,7, 129,1, 131,5 (к, J =32,9), 136,0, 140,0, 146,8, 148,4, 152,3, 163,1.
ПРИМЕР 96 14,2, 25,2, 50,7, 52,6, 59,2, 64,1, 64,5, 67,7, 69,7, 97,9, 121,5, 123,1(к, J = 271), 127,2, 128,7, 129,1, 131,5 (к, J =32,9), 136,0, 140,0, 146,8, 148,4, 152,3, 163,1.
ПРИМЕР 962-(R)-(1-(R)-(3,5- Бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор) фенил-4-(3-(4- монофосфорил-5-оксо-1H-1,2,4-триазоло)метил)морфолин, двукалиевая соль; или 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил) этокси)-3-(S)-(4-фтор)фенил-4-(3-(1-монофосфорил-5-оксо-1H- 1,2,4-триазоло)метил)морфолин, двукалиевая соль; или 2-(R)-(1- (R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-4-фтор) фенил-4-(3-(2-монофосфорил-5-оксо-1H-1,2,4-триазоло)метил) морфолин, двукалиевая соль; или 2-(R)-(1-(R)-(3,5- бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор фенил-4-(3-(5- оксифосфорил-1H-1,2,4-триазоло)метил)-морфолин, двукалиевая соль Раствор 450 мг (0,84 ммоль) 2-(R)-(1-(R)-(3,5-бис(трифторметил) фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксо-1H,4H- 1,2,4-триазоло) метилморфолина в 20 мл ТГФ при 0oC обрабатывали 0,84 мл 1,0 М раствора н-бутиллития в гексане. Полученный раствор перемешивали 5 мин на холодe и обрабатывали 630 мг (1,7 ммоль) тетрабензилпирофосфата (как одна порция в твердом виде). Охлаждающую баню убирали, и реакционную смесь перемешивали при комнатной температуре в течение 45 мин. Реакцию гасили 25 мл насыщенного водного раствора бикарбоната натрия и экстрагировали 50 мл диэтилового эфира. Органический слой отделяли, промывали 25 мл насыщенного водного раствора бикарбоната натрия, 25 мл 0,5 н водного раствора кислого сульфата калия, 25 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Неочищенный дибензиловый эфир растворяли в 25 мл метанола. В эфирный раствор добавляли раствор 168 мг (1,68 ммоль) бикарбоната калия, и полученную смесь гидрировали при 2,812 ат в присутствии 45 мг катализатора, 10% палладия на угле, в течение 75 мин. Катализатор отделяли фильтрованием на подушке целита; реакционную колбу и фильтровальную лепешку промывали тщательно метанолом (около 200 мл), фильтрат концентрировали в вакууме и сушили. Остаток частично растворяли в метаноле и фильтровали, фильтрат концентрировали и сушили. Выделенную твердую часть перекристаллизовали из изопропанола, получая 280 мг неочищенного заглавного соединения. Эту твердую часть распределяли между 40 мл диэтилового эфира и 20 мл воды; смешивание слоев приводило к образованию эмульсии. Эмульсию разбивали центрифугированием при 2800 об/мин в течение 15 мин. Водный слой отделяли и лиофилизовали, получая 188 мг (33%) соединения, экспериментально идентифицированное как 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4- фтор) фенил-4- (3- (4-монофосфорил-5-оксо-1H-1,2,4-триазоло) метил) морфолин, двунатриевая соль (твердое вещество). 1H ЯМР- спектр (CDCl3 500 МГц, м. д. ):  1,43 (д, J=6,5, 3H), 2,45 (прибл. т, J =8,5, 1H), 2,80 (д, J=14,0, 1H), 2,92 (д, J=11,5, 1H), 3,47-3,66 (м, 4H), 4,25 (прибл. т, J=11,5, 1H), 4,36 (д, J = 1,5, 1H), 4,94 (к, J=6,6, 1H), 7,05 (т, J=8,5, 2H), 7,31 (c, 2H), 7,52 (шир. с, 2H), 7,71 (с, 1H). 13С ЯМР-спектр (CD3OD, 125 МГц, м.д.): 1,43 (д, J=6,5, 3H), 2,45 (прибл. т, J =8,5, 1H), 2,80 (д, J=14,0, 1H), 2,92 (д, J=11,5, 1H), 3,47-3,66 (м, 4H), 4,25 (прибл. т, J=11,5, 1H), 4,36 (д, J = 1,5, 1H), 4,94 (к, J=6,6, 1H), 7,05 (т, J=8,5, 2H), 7,31 (c, 2H), 7,52 (шир. с, 2H), 7,71 (с, 1H). 13С ЯМР-спектр (CD3OD, 125 МГц, м.д.):  24,7, 52,3, 53,4, 60,5, 70,6, 73,7, 97,2, 116,1 (д, J=21,9), 122,3, 124,6 (к, J= 271,0), 127,7, 132,3, 132,6, 132,8, 134,3, 145,2 (д, J=11,0), 147,5, 159,0 (д, 7=10,1) 164,0 (д, J=244,4).
ПРИМЕР 97 24,7, 52,3, 53,4, 60,5, 70,6, 73,7, 97,2, 116,1 (д, J=21,9), 122,3, 124,6 (к, J= 271,0), 127,7, 132,3, 132,6, 132,8, 134,3, 145,2 (д, J=11,0), 147,5, 159,0 (д, 7=10,1) 164,0 (д, J=244,4).
ПРИМЕР 972-(S)-(1-(R)-(3,5-Бис(трифторметил) фенил) этокси)-3-(S)-(4-фтор)фенил-4-(3-(1-фосфорил-5-оксо-4H-1,2, 4-триазоло)метил)морфолин,соль с бис(N-метил-D-глюкамином) Тетрабензилпирофосфат получали с выходом 71%, применяя способ, аналогичный описанному Khorana and Todd (J. Chem. Soc., 2257 (1953)). Раствор 2,00 г (3,7 ммоль) 2-(S)-(1-(R)-(3,5-бис (трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1H, 4H-5-оксо-1,2,4-триазоло)метил)морфолина и 2,80 г (5,2 ммоль) тетрабензилпирофосфата в 50 мл сухого тетрагидрофурана охлаждали до 0oC. В охлажденную реакционную смесь при помощи шприца добавляли 1,0 М раствор бис(триметилсилил)амида натрия (“NaHMDS”. 9,4 мл, 9,4 ммоль) со скоростью 1 экв/ч, поддерживая внутреннюю температуру 0oC. После добавления NaHMDS реакционную смесь перемешивали при 0oC в течение 15 мин и гасили 100 мл насыщенного водного раствора бикарбоната натрия. Смесь после тушения экстрагировали 300 мл диэтилового эфира, и эфирный экстракт промывали 100 мл 0,5 н водного раствора бисульфата калия, 100 мл насыщенного водного раствора бикарбоната натрия, 100 мл насыщенного водного раствора хлористого натрия, сушили над сульфатом магния и концентрировали в вакууме. Смешивали раствор неочищенного дибензилового эфира в 50 мл метанола, раствор 1,45 г (7,4 ммоль) N-метил-D-глюкамина в 10 мл воды и 200 мг катализатора, 10% палладия на угле, и смесь гидрировали при давлении 2,812 ат в течение 2 ч. Реакционную смесь фильтровали через подушку целита, реакционную колбу и фильтровальную лепешку хорошо промывали метанолом (400 мл). Фильтрат концентрировали в вакууме. Неочищенный продукт повторно растворяли в 25 мл метанола, в раствор добавляли 125 мл изопропанола, и полученную смесь выдерживали при комнатной температуре в течение 30 мин. Осажденный твердый продукт отделяли фильтрованием, промывали 75 мл изопропанола, 75 мл диэтилового эфира и сушили на воздухе. Твердый продукт распределяли между 150 мл диэтилового эфира и 150 мл воды. При смешивании слоев образовывалась эмульсия. Эмульсию переносили в пробирки центрифуги на 50 мл. Разделение слоев достигалось при центрифугировании со скоростью 3000 об/мин в течение 15 минут. Органические слои сливали, а водные слои объединяли, фильтровали и фильтрат лиофилизовали, получая 3,40 г 2-(S)-(1-(R)-(3,5-бис (трифторметил) фенил) этокси)-3-(S)-(4-фтор)фенил-4-(3-(1- фосфорил-5-оксо-4H-1,2,4-триазоло)метил)морфолина, как соль с бис -(N-метил-D-глюкамином, в виде аморфной соли. Было определено ВЭЖХ, что чистота соли выше, чем 99%. 1H ЯМР-спектр (CD3OD, 500 МГц, м.д.):  1,43 (д, J=6,6, 3H), 2,46 (прибл. т, J=11,2, 1H), 2,72 (с, 6H), 2,84 (д, J=13,9, 1H), 2,94 (д, J=10,3, 1H), 3,12-3,30 (м, 4H), 3,42-3,83 (м, 14H), 4,19-4,25 (м, 3H), 4,35 (д, J=2,2, 1H), 7,04 (т, J=8,5, 2H), 7,30 (c, 2H), 7,52 (шир. с, 2H) 7,70 (c, 1H). 13С ЯМР-спектр (CD3OD, 125 МГц, м.д.): 1,43 (д, J=6,6, 3H), 2,46 (прибл. т, J=11,2, 1H), 2,72 (с, 6H), 2,84 (д, J=13,9, 1H), 2,94 (д, J=10,3, 1H), 3,12-3,30 (м, 4H), 3,42-3,83 (м, 14H), 4,19-4,25 (м, 3H), 4,35 (д, J=2,2, 1H), 7,04 (т, J=8,5, 2H), 7,30 (c, 2H), 7,52 (шир. с, 2H) 7,70 (c, 1H). 13С ЯМР-спектр (CD3OD, 125 МГц, м.д.):  24,7, 34,4 52,3, 53,1, 53,5, 60,6, 64,7, 69,9, 70,4, 72,0, 72,4, 72,6, 73,6, 97,1, 116,2 (д, J=21,9), 122,3, 124,5 (к, J=271,0), 127,7, 132,3, 132,7 (к, J=33,8), 134,2 145,9, 147,7, 158,9, 163,9 (д, J=245,3).
ПРИМЕР 98 24,7, 34,4 52,3, 53,1, 53,5, 60,6, 64,7, 69,9, 70,4, 72,0, 72,4, 72,6, 73,6, 97,1, 116,2 (д, J=21,9), 122,3, 124,5 (к, J=271,0), 127,7, 132,3, 132,7 (к, J=33,8), 134,2 145,9, 147,7, 158,9, 163,9 (д, J=245,3).
ПРИМЕР 98Типичные фармацевтические композиции, содержащие соединение изобретения А. Сухие желатиновые капсулы, содержащие 5 мг активного ингредиента на каждую капсулу Ингредиент – Количество на капсулу (мг) Активный ингредиент – 5 Лактоза – 194 Стеарат магния – 1 Капсула (размер N 1) – 200 Активный ингредиент можно измельчить в порошок N 60, лактозу и стеарат магния для получения порошка можно затем пропустить через блоттинг-ткань N 60. Объединенные ингредиенты можно затем перемешивать в течение около 10 мин и наполнять в сухие желатиновые капсулы N 1. В. Таблетки Типичная таблетка будет содержать активный ингредиент (25 мг), предварительно клейстеризованный крахмал USH (82 мг), микрокристаллическую целлюлозу (82 мг) и стеарат магния (1 мг). С. Суппозитории Типичные готовые препаративные формы в виде суппозиториев содержат активный ингредиент (0,08-1,0 мг), смешанную двунатриевую и кальциевую соль этилендиаминтетрауксусной кислоты (0,25-0,5 мг) и полиэтиленгликоль (775-1600 мг). Другие суппозитории можно изготовить, применяя бутилированный гидрокситолуол (0,04-0,08 мг) вместо указанной выше соли и гидрогенизированное растительное масло (675-1400 мг), например Suppjcire L., Wecobee F.S. , Wecobee М., Witepspls и другие, вместо полиэтиленгликоля. D. Инъекционная форма Типичная инъецируемая готовая препаративная форма содержит активный ингредиент, безводный вторичный кислый фосфат натрия (11,4 мг) и воду для инъекции (1,0 мл). Хотя данное изобретение было описано и иллюстрировано со ссылками на некоторые конкретные воплощения изобретения, специалисты данной области обычно понимают, что могут быть сделаны различные адаптации, изменения, модификации, замены, пропуски или добавления в способы и записи без отступления от сущности и объема данного изобретения. Например, эффективные дозы, отличающиеся от конкретных доз, указанных здесь выше, могут быть пригодны в результате изменений в восприимчивости млекопитающего, которого лечат по любому из показаний соединениями изобретения, указанными выше. Подобным же образом, наблюдаемые конкретные фармакологические реакции могут изменяться в соответствии или в зависимости от конкретных выбранных активных соединений или от того, присутствуют ли фармацевтические носители, а также типа готовой препаративной формы и способа применяемого введения, и такие ожидаемые изменения или различия в результатах рассматриваются в соответствии с целями и практическим использованием данного изобретения. Поэтому предполагается, что данное изобретение должно определяться объемом формулы изобретения, которая следует ниже, и что эта формула изобретения должна интерпретироваться настолько широко, насколько разумно. Формула изобретения
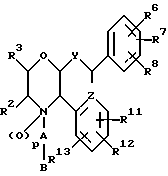 или их фармацевтически приемлемые соли, где R2 и R3 каждый означает водород, R6, R7 и R8 независимо выбирают из группы, состоящей из водорода, фтора или CF3; R11, R12 и R13 каждый независимо означает водород или галоген; A представляет собой незамещенный C1-6 алкилен; B представляет собой гетероцикл, выбираемый из группы, состоящей из 1,2,4-триазолила, 5-оксо-1,2,4-триазолила, 2-оксо-1,3-имидазолила или имидазолила, замещенного X, где X означает остаток соли фосфорила -PO(O–)22M+, и M+ является фармацевтически приемлемым одновалентным противоионом; Y представляет -O-; Z представляет атом водорода или C1-6алкил; p=0. 2. Соединение по п.1, где R2 и R3 каждый означает водород, R6, R7 и R8 независимо выбирают из группы, состоящей из: 1) водорода, 2) фтора, или 3) -CF3; R11, R12 и R13 независимо выбирают из группы, состоящей из: 1) фтора, 2) хлора; A представляет собой незамещенный C1-6 алкилен; B выбирают из группы, состоящей из 1,2,4-триазолила, 5-оксо-1,2,4-триазолила, 2-оксо-1,3-имидазолила или имидазолила, замещенного X, где X означает -PO(O–)22M+, и M+ является фармацевтически приемлемым одновалентным противоионом; Y представляет -O-; Z представляет атом водорода или C1-4 алкил; p=0. 3. Соединения по п.1, где Z представляет собой C1-4 алкил. 4. Соединения по п.1, где Z представляет собой -CH3. 5. Соединения по п.1, где A представляет собой -CH2-. 6. Соединения по п.1, где B выбирают из группы, состоящей из 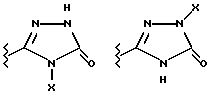 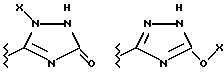 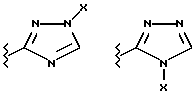 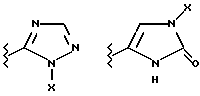 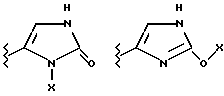 7. Соединения по п.1, где -A-B выбирают из группы, состоящей из: 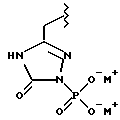 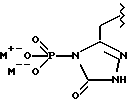 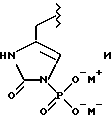 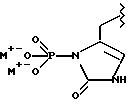 8. Соединения по п.1, структурной формулы II 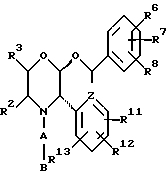 или его фармацевтически приемлемая соль, где R2, R3, R6, R7, R8, R11, R12, R13, A, B и Z имеют значения, указанные в п.1. 9. Соединения по п.1, структурной формулы III 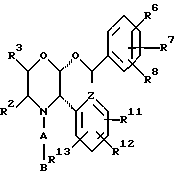 или его фармацевтически приемлемая соль, где R2, R3, R6, R7, R8, R11, R12, R13, A, B и Z имеют значения, указанные в п.1. 10. Соединение по п.1, которое выбирают из группы, состоящей из: 1) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(4-монофосфорил-5-оксо-1H-1,2,4-триазоло)-метил)морфолина; 2) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1-монофосфорил-5-оксо-1H-1,2,4-триазоло)-метил)морфолина; 3) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(2-монофосфорил-5-оксо-1H-1,2,4-триазоло)-метил)морфолина; 4) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(5-оксифосфорил-5-оксо-1H-1,2,4-триазоло)-метил)морфолина; 5) 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1-фосфорил-5-оксо-4H-1,2,4-триазоло)-метил)морфолина; или его фармацевтически приемлемой соли. 11. Соединение по п.10, которое является 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1-монофосфорил-5-оксо-1H-1,2,4-триазоло)-метил)морфолином или его фармацевтически приемлемой солью. 12. Соединение по п. 10, где фармацевтически приемлемая соль является солью бис(N-метил-D-глюкамина). 13. Соединение по п.10, которое представляет собой 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фтор)фенил-4-(3-(1-монофосфорил-5-оксо-1H-1,2,4-триазоло)-метил)морфолин, бис (N-метил-D-глюкамин). 14. Соединение по п.1, которое выбирают из группы, состоящей из 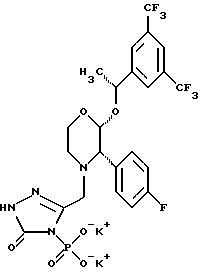 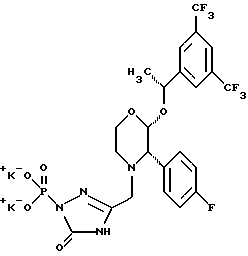 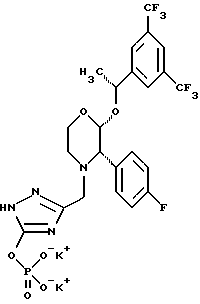 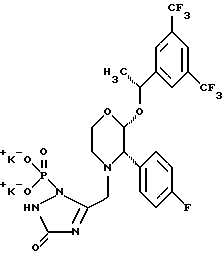 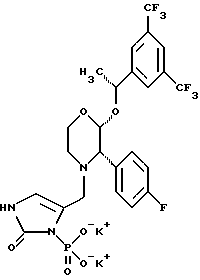 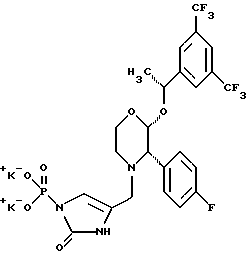 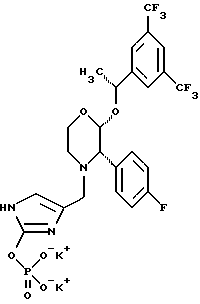 где K+ представляет собой фармацевтически приемлемый противоион. 15. Соединение по п.14, где K+ представляет собой N-метил-D-глюкамин. 16. Соединение по п.14 формулы 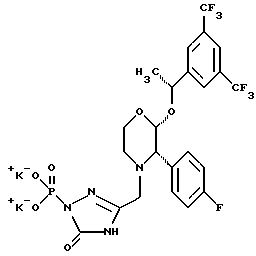 где K+ представляет собой фармацевтически приемлемый противоион. 17. Соединение по п.16, где K+ является N-метил-D-глюкамином. 18. Фармацевтическая композиция, проявляющая активность блокирования рецепторов нейрокинина-1, содержащая фармацевтически приемлемый носитель и эффективное количество соединения по п.1. 19. Фармацевтическая композиция по п.18, где фармацевтически приемлемый носитель представляет собой воду. 20. Фармацевтическая композиция по п.18, где фармацевтически приемлемый носитель представляет собой физиологически приемлемый солевой раствор. 21. Способ противодействия вещества P у сайта его рецепторов или блокирования рецепторов нейрокинина-1 у млекопитающего, который содержит введение млекопитающему соединения по п.1 в количестве, которое эффективно для противодействия вещества P у сайта его рецепторов у млекопитающего. 22. Способ получения замещенных морфолинов формулы I 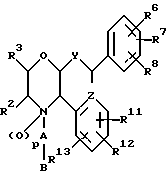 или их фармацевтически приемлемых солей, где Y, Z, R2, R3, R6, R7, R8, R11, R12, R13, A, B и p имеют значения, указанные в п.1, реакцией соединения формулы 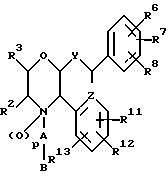 где A, B, Y, Z, p, R1, R2, R3, R6, R7, R8, R11, R12 и R13 имеют указанные выше значения, за исключением того, что в пределах таких изменяемых значений X является водородом, с фосфорилпереносящим реагентом в присутствии подходящего основания в течение времени, достаточного для получения соединения структурной формулы I. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 01.03.2002
Номер и год публикации бюллетеня: 14-2004
Извещение опубликовано: 20.05.2004
|
||||||||||||||||||||||||||
