Патент на изобретение №2169196
|
||||||||||||||||||||||||||
(54) ДЕЗОКСИРИБОНУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ БЕЛОК ГЛУТАТИОН-S-ТРАНСФЕРАЗУ IIIC И БЕЛОК С СООТВЕТСТВУЮЩЕЙ АМИНОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТЬЮ
(57) Реферат: Дезоксирибонуклеиновая кислота может быть использована в селекции растений. Введение в геном растения дезоксирибонуклеиновой кислоты, кодирующей глутатион-S-трансферазу, придает этому растению повышенную устойчивость к гербицидам. 2 с. и 7 з.п.ф-лы, 2 ил. Изобретение относится к новой дезоксирибонуклеиновой кислоте (ДНК), которую можно применять для трансформации векторов, организмов-хозяев и растений, а также для выведения растений с повышенной устойчивостью к гербицидам, и к белку с соответствующей аминокислотной последовательностью. Широко известно, что растения можно генетически так изменять, что они начинают проявлять повышенную устойчивость к определенным гербицидам. Это дает возможность использовать гербициды, которые при незначительной селективности в остальном обнаруживают полезные свойства, в культурах таких растений, которые в первоначальной нетрансгенной форме повреждались этими гербицидами. Путем выращивания устойчивых к гербицидам растений возрастает выбор применяемых гербицидов, и во многих случаях можно также обойтись относительно малыми количествами гербицидов, например, когда борьба с нежелательными растениями может начаться только после их усиленного роста при достижении в каждом случае порога вредности. При этом существует значительная потребность выведения новых культурных растений, проявляющих повышенную устойчивость в отношении других гербицидов. Глутатион-S-трансферазы являются многофункциональными белками, которые играют важную роль при обезвреживании цитотоксических соединений. Эти ферменты катализируют конъюгацию восстановленного глутатиона с электрофильными гидрофобными субстратами, которые могут быть природного или синтетического происхождения. Физиологические субстраты глутатион-S-трансфераз растений и их роль в обмене веществ растений, в частности, неизвестны. Однако доказано участие этих ферментов в обезвреживании и, таким образом, в механизме селективности для ряда важных гербицидов из группы тиокарбаматов, хлорацетанилида и S-триацина: Mozer T.J., Tiemeier D.C., Jaworski E.G., Biochemistry 22: 1068-1072 (1983); Moore R.E., Davies M.S., O’Connell K.M., Harding E.I., Wiegand R. C. , Tiemeier D. C., Nucleic Acids Res. 14: 7227-7235 (1983); Grove G., Zarlengo R.P., Timmermann K.P., Li N., Tarn M.F., Tuc C.P.D., Nucleic Acids Res. 16:425-438 (1988). Согласно изобретению предлагается новая дезоксирибонуклеиновая кислота, кодирующая новый белок глутатион-3-трансферазу IIIc (в дальнейшем “GSTIIIc”), имеющую аминокислотную последовательность SEQ ID N2, (при этом новая ДНК согласно изобретению в дальнейшем обозначается “GSTIIIc-ДНК”). Было найдено, что растения, в геном которых была вставлена новая GSTIIIc-ДНК, обладают по сравнению с соответствующими исходными растениями повышенной устойчивостью в отношении гербицидов, преимущественно в отношении гетероарилоксиацетамидных гербицидов. Новая GSTIIIc-ДНК была выделена из кукурузы (Zea mays) сорта Mutin. Эта ДНК кодирует белок GSTIIIc с аминокислотной последовательностью SEQ ID N2. В клетках растений две молекулы белка GSTIIIc спонтанно образуют димерный активный фермент (в дальнейшем обозначается как “GSTIIIc-фермент”), который способствует обезвреживанию добавленного гербицида, при этом растения становятся устойчивыми по отношению к гербициду. Предпочтительная GSTIIIc-ДНК согласно изобретению имеет последовательность SEQ ID N1. Также предпочтительна согласно изобретению GSTIIIc-ДНК, которая имеется в описанных ниже векторных плазмидах рЕТ3а-GSTIIIc и pSS-GSTIIIc. Новая GSTIIIc-ДНК может быть одноцепочечной или двуцепочечной, которая дополнительно содержит комплементарную к каждой отдельной цепи нить. Согласно предпочтительному варианту осуществления настоящего изобретения GSTIIIc-ДНК на 5′ конце предварительно присоединяют действующий в растениях промотор. Для этого могут быть использованы обычные эффективные промоторы растений. Например, следует упомянуть промотор гена малой субъединицы рибулоза-1,5-дифосфат-карбоксилазы (rbsc) (см. EMBO Journal, том 5, N9, 2063-2071 (1986)). Предпочтительно вставляются промоторы вирусов растений, при этом следует назвать в качестве примера РНК промотора CaMV 35S. Особенно предпочтительно используется известный конструкт из энхан-сера CaMV 35S и присоединенного к нему в порядке 5′ – 3′ промотора CaMV 35S (“двойной промотор CaMV 35S”). Соответствующий предпочтительный конструкт из GSTIIIc-ДНК и двойного промотора CaMV имеется в рассматриваемой ниже векторной плазмиде pSS-GSTIIIc. Однако также возможно использовать природный промотор, регулирующий экспрессию в GSTIIIc-ДНК в кукурузе сорта Mutin. Способ, которым с GSTIIIc-ДНК в порядке 5′ – 3′ соединяется 3′-концевая последовательность, может быть любым и не имеет решающего значения для настоящего изобретения. Предпочтительно вставляют 3′-концевые последовательности растений. Например, может быть также использована природная концевая последовательность GSTIIIc-гена из кукурузы сорта Mutin. Дополнительным объектом настоящего изобретения является новый белок GSTIIIc с аминокислотной последовательностью SEQ ID N2, а также его новый димер (GSTI Hc-фермент), который, как было указано выше, спонтанно образуется из 2 молекул белка GSTIIIc после его образования в клетках растений. GSTIIIc-ДНК согласно изобретению может иметься в качестве “чужеродной” или “дополнительной” ДНК в векторах (в частности, плазмидах, космидах или фагах), в трансформированных или трансгенных микроорганизмах (преимущественно в бактериях, например, Escherichia coli или агробактерия tumefaciens), а также в трансформированных или трансгенных клетках растений и растениях или их ДНК. Эти векторы, микроорганизмы, клетки растений и растения, а также их ДНК могут быть получены специалистами в данной области при использовании имеющегося описания, в частности, последовательностей SEQ ID N1 и SEQ ID N2, приведенными в конце описания, в соответствии с общеизвестными и/или обычными способами и методами. В связи с настоящим изобретением под “чужеродной” ДНК следует понимать такую ДНК, которая обычно не содержится в определенном геноме прокариот и эукариот (включая растения), но при действии человека (трансформация) соединяется с этим геномом. “Дополнительной” ДНК является такая ДНК, которая почти всегда имеется в соответствующем геноме прокариот или эукариот, однако, в дополнительном количестве воспринимается этим геномом в результате воздействия человека (трансформация). “Чужеродная” или “дополнительная” ДНК может быть встроена в одном или нескольких экземплярах в соответствии с потребностью и видом представленного случая. В качестве особенно предпочтительных векторов можно назвать векторные плазмиды рЕТ3а-GSTIIIc и pSS-GSTIIIc. Оба вектора содержат GSTIIIc-ДНК по изобретению в соответствии с последовательностью SEQ ID N1. Плазмида рЕТ3а-GSTIIIc содержит GSTIIIc-ДНК в фрагменте NdeI/BamHI. Для построения этой плазмиды клонировали GSTIIIc-ДНК в соответствии с последовательностью SEQ ID N1 в полученных при расщеплении с помощью Ndel и BamHI положениях вектора рЕТ3а (Novagen/Madison) (Studier F.W., Moffatt B.A, J. Mol.Biol. 189:113-130; Studier F.W.J. Mol. Biol. 219:37-44 (1991)). Эта плазмида (5306 П.н.) представлена на фиг.1. Направление стрелок указывает направление промотора и гена или GSTIIIc-ДНК с стартовым кодоном ATG. “Аmр” означает ген с устойчивостью к ампициллину. Для конструирования плазмиды pSS-GSTIIIc выделяли в чистом виде GSTI Нс-ДНК в виде фрагмента XbaI/BamHI из вектора рЕТ3а- GSTIIIc и клонировали в плазмиде Bluescript-SKII (линеаризированной Xbal/BamHI; Stratagene). Затем GSTIIIc-ДНК при рестрикционном расщеплении с участием SstI/SmaI была выделена из полученной таким образом плазмиды Bluescript-SKII-GSTIIIc и лигирована в вектор pRT101 (линеаризированный Sstl/SmaI; Topfer и др. 1987). Затем GSTIIIc-ДНК в виде фрагмента EcoRI/SmaI была выделена в чистом виде из полученного таким образом вектора pRT101-GSTIIIc и клонирована в бинарном векторе pSS (линеаризированном EcoRI/SmaI; Vou и др. 1994). В возникшем векторе pSS-GSTIIIc кодирующая GSTIIIc-ДНК находится под контролем РНК двойного промотора CaMV 35S. Плазмида pSS-GSTIIIc (10000 П.н.) представлена на фиг.2. GSTIIIc-ДНК согласно изобретению может быть при необходимости выделена специалистами из названных плазмид в соответствии с общепринятыми способами и методами. В качестве особенно предпочтительных микроорганизмов, в которые включают предлагаемую ДНК, следует назвать выделенные из Escherichia coli штаммы рЕТ3а-GSTIIIc и pSS-GSTIIIc. Штамм рЕТ3а-GSTIIIc содержит плазмиду рЕТ3а-GSTIIIc, а штамм pSS-GSTIIIc содержит плазмиду pSS-GSTIIIc. Эти штаммы могут быть размножены общепринятыми способами. Плазмиды рЕТ3а-GSTIIIc и pSS-GSTIIIc могут быть также выделены из этих микроорганизмов в соответствии с общепринятыми способами. Штамм Escherichia coli рЕТ3а-GSTIIIc был депонирован в Германской Коллекции Микроорганизмов (DSM), Машеродер Ber 16,D-38124 Брауншвейг, Федеративная Республика Германия, по соглашению в соответствии с постановлением Будапештского Договора о международном признании хранения микроорганизмов для целей патентования (дата депонирования: 17. 01. 1995). Штамм депонирован под номером DSM 9677. Как уже указывалось выше, предлагаемую ДНК можно также использовать для создания новых растений, проявляющих повышенную устойчивость по отношению к гербицидам, преимущественно по отношению к гетероарилоксиацетамидным гербицидам. Культуры этих трансгенных растений могут быть обработаны гербицидами для борьбы с нежелательными растениями без нанесения вреда культурным растениям. Трансгенные клетки растений (включая протопласты) и растения (включая части растений и семена) с повышенной устойчивостью по отношению к гербицидам можно получать тем, что (а) один или несколько экземпляров GSTIIIc-ДНК и/или рекомбинантной ДНК согласно изобретению, содержащих GSTIIIc-ДНК, которые кодируют белок GSTIIIc, вставляют в геном клеток растений (включая протопласты) и при необходимости, (б) из трансформированных клеток растений (включая протопласты) регенерируют полностью трансформированные растения, и при необходимости размножают, и при необходимости; (в) из полученных таким образом трансгенных растений родительского поколения или из дальнейших выведенных из них поколений выращивают желаемые части растений (включая семена). Стадии (а), (б) и (в) могут быть проведены известными способами и методами с использованием обычных приемов. Существует целый ряд различных способов для встраивания GSTIIIc-ДНК, при желании в виде конструкции с двойным промотором CaMV 35S в виде “чужеродной” или “дополнительной” ДНК в генетический материал растений или клеток растений. Перенос гена может быть осуществлен общеизвестными способами, при этом специалист без труда может найти подходящий способ. Плазмида Ti Agrobacterium tumefaciens является особенно удобным и часто вставляемым вектором для осуществления переноса “чужеродной” или “дополнительной” ДНК в геном двудольных или однодольных растений. Генетический материал, кодирующий белок GSTIIIc, вставляется при необходимости вместе с регуляторными последовательностями ДНК в Т-ДНК подходящих Ti-плазмид (например, Zambrysk: и др., 1983) и переносится путем заражения растения, заражения частей растений или тканей растений, как, например, пластинки листьев, стебли, подсемядольные колена, семядоли, меристемы и происходящие из них ткани, как, например, вторичные эмбрионы и каллюсы, или с помощью сокультивирования протопластов Agrobacterium tumefaciens. Альтернативой является инкубирование очищенной ДНК, содержащей желаемый ген или желаемую ДНК, в протопластах растений (например, Hain и др., 1985; Krens и др., 1982; Paszkowski и др., 1984) в присутствии поликатионов или солей кальция и полиэтиленгликоля. Включению ДНК может также дополнительно благоприятствовать электрическое поле (электропорация) (например, Fromm и др., 1986). Известным способом ДНК может быть также введена через луковицы растений, когда луковицы или другие части растений, которые переносят ДНК, “бомбардируют” (физически ускоряемыми частицами (см. заявку ЕР N 0270356). Регенерацию растений удается осуществить известным способом с помощью подходящих питательных сред (например, Nagy и Maliga 1976). В предпочтительном варианте осуществления способа по изобретению клонируют GSTIIIc-ДНК из плазмиды рЕТ3а-GSTIIIc в бинарном экспрессирующем векторе (например, VoB и др. (1994)). Химерная генная конструкция затем переносится в агробактерию tumefaciens (Koncz и Schell, 1986). Альтернативно химерная генная конструкция переносится обычным способом в вектор pSS-GSTIIIc путем прямого генного переноса в протопласты растений (например, Main и др., 1985). При этом плазмида может существовать в кругообразной форме, однако, предпочтительно в линейной форме. При использовании этой плазмиды с репортерным геном были затем проверены на экспрессию GSTIIIc устойчивые к канамицину протопласты. Трансформированные (трансгенные) растения или клетки растений получаются известными способами, например путем трансформации пластинок листьев (например, Horsch и др., 1985), с помощью сокультивирования регенерирующих протопластов растений или клеточных культур с агробактерией tumefaciens (например, Marton и др. , 1979, Hain и др., 1985) или путем прямой трансфекции ДНК. Подтверждение и доказательство получающихся трансформированных растений осуществляется либо путем селекции для экспрессии репортерного гена, например путем фосфорилирования канамицинсульфата in vitro (Reiss и др. , 1984; Schreiner и др., 1985), либо путем экспрессии нопалинсинтазы (по Aerts и др. , 1983), либо с GSTIIIc путем анализа с применением Нозерн-блоттинга и Вестерн-блоттинга. Белок GSTIIIc может также быть обнаружен в трансформированных растениях известным способом при анализе Вестерн-блоттингом с помощью специфических антител. Культивирование трансформированных клеток растений, как и регенерация в полные растения, удается с помощью общеизвестных способов, в каждом случае с использованием подходящих питательных сред. Как трансформированные клетки растений, так и трансформированные растения, содержащие GSTIIIc-ДНК согласно изобретению, проявляют значительно более высокую устойчивость по отношению к гербицидам, в частности, по отношению к гетероарилоксиацетамидным гербицидам. В связи с настоящим изобретением выражение “растения” означает как полные растения, так и части растений, такие как листья, семена, клубни, черенки и так далее. “Клетки растений” включают протопласты, линии клеток, каллюсы растений и так далее. “Материал для размножения” означает растения и клетки растений, которые могут быть использованы для размножения трансформированных растений и клеток растений. К растениям, которые при встраивании (трансформации) GSTIIIc-ДНК согласно изобретению могут приобрести повышенную устойчивость по отношению к гербицидам, относятся практически все растения. Особую потребность в приобретении устойчивости естественно испытывают культурные растения, такие как лесные растения, например пихта, ель, лжесуга, сосна, лиственница, бук и дуб, а также растения, поставляющие пищевые средства и сырье, например зерновые (в частности, пшеница, рожь, ячмень, овес, просо, рис и кукуруза), картофель, бобовые (как стручковые плоды и, в частности, люцерна, соевые бобы), овощи (в частности, различные сорта капусты и томаты), фрукты (в частности, яблоки, груши, вишня, виноград, цитрусовые, ананасы и бананы), пальмовое масло, кустарники чая, какао и кофе, табак, сизальская пенька и хлопчатник, а также лекарственные растения, как раувольфия и дигиталис. Как особенно предпочтительные упоминаются картофель, сахарная свекла, сахарный тростник, зерновые, например пшеница, ячмень и сорго, и рис. Преимущественно GSTIIIc-ДНК согласно изобретению встраивается в геном растений как “чужеродная” ДНК. Преимущественно, гербициды, в отношении которых согласно изобретению может быть проявлена повышенная устойчивость, относятся к группе гетероарилоксиацетамидов. Особенно предпочтительны при этом гетероарилоксиацетамиды общей формулы I, Met-O-CH2-CO-NR1R2 в которой Met означает в данном случае замещенный гетероароматический остаток пре имущественно с пятичленным кольцом, содержащим преимущественно, как минимум, один атом азота и один атом серы или атом кислорода, при этом особенно предпочтительным остатком следует назвать 5-трифтор-метил-1,3,4-тиадиазол-2-ильный остаток; R1 может означать замещенный алкил или алкоксигруппу (в каждом случае предпочтительно содержащую 1 – 4 атомов углерода); и R2 может означать замещенный арильный остаток (предпочтительно фенильный остаток, который предпочтительно замещен галогеном). Такие гербициды уже хорошо известны (сравните, например, заявку ЕР N 18497 и соответствующий патент США N 4645525, заявку ЕР N 94541 и соответствующий патент США N 4585471, а также заявку ЕР N 348737 и соответствующий патент США N 4968342). Упомянутые в указанных источниках гербициды особенно предпочтительны в связи с настоящим изобретением. В частности предпочитается придание растениям устойчивости по отношению к упомянутому в заявке ЕР N 348737 и в соответствующем патенте США N 4968342 гербициду с химическим названием: N-изопропил-N-(4-фторфенил)амид(5-трифторметил-1,3,4-тиадиазол- 2-ил-окси)уксусной кислоты (предложенное торговое название: тиафлуамид). Эта устойчивость позволяет вводить упомянутый гербицид также в такие культуры, которые в нерезистентной форме были заражены гербицидом неприемлемым способом. Настоящее изобретение подробнее поясняется следующими примерами осуществления: I. Выделение GSTIIIc-ДНК из кукурузы При выделении GSTIIIc-ДНК используются известные способы и методы молекулярной биологии, которые, например, описываются в следующем справочнике: Maniatis Т. , Fritsch E.F., Sambrook J: Molecular cloning, A Laboratory Manual: Cold Spring Habor Laboratory, второе издание, 1989. Для выделения GSTIIIc-ДНК сначала выделяют белок в чистом виде из этиолированных ростков кукурузы (Zea mays) сорта Mutin (1) и полностью определяют аминокислотную последовательность с помощью анализа последовательности белка (2). Также из ростков кукурузы выделяют мРНК (3) и с помощью обратной транскриптазы ферментативно переводят в “ДНК (4). Полученную таким образом кДНК встраивают в качестве матрицы в полимеразную цепную реакцию (Mullis К. В. , Faloona F. А. , (1987), Methods Enzymol. 155:335-350) для выделения GSTIIIc-ДНК. 1. Выделение GSTIIIc-белка из кукурузы сорта Mutin Для очистки GSTIIIc-белка ростки кукурузы переводят в удобное для переработки состояние и смешивают с 0,2 М Трис/HCl, pH 7,8, 1 мМ этилендиаминтетрауксусной кислотой (ЭДТК) (2 мл/г живого веса). Суспензию центрифугируют и белковую фракцию надосадочной жидкости получают при фракционированном осаждении сульфатом аммония с насыщением 30 и 70%. Выделение GSTIIIc-белка осуществляют при хроматографии на следующих колонках в приведенных буферах: А) Сефадекс G-100 (среда для разделения на декстрановой основе), объем 500 мл (Phramacia) Буфер: А: 50 мМ фосфат калия, pH 7,3; Б) ДЭАЭ-сефароза (матрица из поперечно-сшитой агарозы с ковалентно присоединенной диэтиламиноэтильной группой), объем 50 мл (Pharmacia) Буфер А: 10 мМ фосфат калия, pH 7,3 Буфер Б: 1,0 М фосфат калия, pH 7,3 Градиент: 0-100% Б в 500 мл: В) Глутатион-сульфобромфталеин-агароза, объем 20 мл (Sigma) Буфер: А: 50 мМ фосфат калия, pH 7,3 Буфер: Б: 50 мМ фосфат калия, pH 8,0, 5 мМ глутатион; Г) Моно Q HR 5/5 (анионообменная смола на основе поперечно-сшитой агарозы с заряженными триметиламмонийметильными группами, размер частиц 10  5 мкм), объем 1 мл (Pharmacia) 5 мкм), объем 1 мл (Pharmacia)Буфер: А: 20 мМ Трис/HCl, pH 7,5 Буфер: Б: 20 мМ Трис/HCl, pH 8,0, 1,0 М хлористый натрий Градиент: 0-25% Б в 20 мл. 2. Анализ последовательности GSTIIIc-белка Выделенный из кукурузы (сорта Mutin) GSTIIIc-белок подвергают восстановлению, карбоксиметилированию и диализу против 0,2 М гидрокарбоната аммония (Glazer A.N., Delange R.J., Sigman D.S., (1975), “Chemical modification of proteins”, изд. Elsevier Biomedical Press, Амстердам). Последующее расщепление белка эндопротеазами Asp-N (с чистотой для секвенирования, Берингер Маннхайм) или трипсином (обработанным N-тозил-L-фенилаланинхлорметилкетоном, Worthington) проводят при 23oC в течение 16 ч при соотношении белок – протеаза 1: 100. Реакцию расщепления прекращают при добавлении 0,1% трифторуксусной кислоты. Нерастворимые пептиды отделяются при центрифугировании, растворимые пептиды отделяют друг от друга с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии в следующих условиях: Колонка: Vydac С 18 (гель для разделения на основе двуокиси кремния с алифатическими цепочками (Cis)), 0,46 см x 25 см Элюент А: 0,1% трифторуксусная кислота Элюент Б: 0,1% трифторуксусная кислота, 90% ацетонитрил Градиент: 0 – 60% Б в 40 мин Скорость потока: 0,25 мл/мин Аминокислотную последовательность выделенных пептидов определяют с помощью секвенаторов белка 470А и 473А (Applied Biosystems). Полная белковая последовательность GSTI Hc-белка представлена последовательностью SEQ ID N 2. 3. Выделение поли(А) + мРНК из кукурузы (сорт Mutin) GSTIIIc-ДНК, мРНК и соответствующие кДНК содержат нуклеотидные последовательности, которые могут быть производными друг друга. Для выделения GSTIIIc-ДНК сначала приготавливают полиаденилированную мРНК из этиолированных ростков кукурузы. Выделение осуществляют с помощью шариков фирмы Динал с олигр(тимидин)25 в соответствии с протоколом изготовителя (Dynal, Осло, Норвегия; Jakobsen K. S., Breivold Е., (1990), Nucleic Acids Res. 18: 3669). Этот способ очистки поли(А) + РНК основывается на связывании пар оснований между поли(А) + остатки мРНК на 3′ конце и остатками олиго(тимидина), которые ковалентно связываются на поверхности магнитных металлических шариков (шарики фирмы Dynal). На 1 мг таких шариков вставляют 0,2 мг растительного материала. Выделенная таким способом мРНК используется для ферментативного синтеза кДНК без дальнейшей очистки. 4. Ферментативный синтез кДНК Получение кДНК проводится с помощью “First Strand cDNA Synthesis Kit” (Pharmacia P-L Biochemicals Inc.). Этот способ основывается на ферментативной активности вирусных ДНК-полимераз (обратных транскриптаз), которые синтезируют ДНК по матрице РНК (Maniatis Т., Fritsch Е. F., Sam-brook J., (1982), Molecular Cloning: A Laboratory Manual, Cold Spring Habor Laboratory. В соответствии с данными изготовителя реакцию проводят следующим образом. 5 мкм поли(А) + мРНК из кукурузы сорта Mutin смешивали с 1 мкм 0,5 М дитиоэритрита, 1 мкм праймера (тимидин)16-18, 1 мкм реакционной смеси (основная реакционная смесь), состоящей изобратной транскриптазы мыши, 135 мМ Трис/HCl, pH 8,3, 204 мМ хлористого калия, 27 мМ хлористого магния, 0,24 мг/мл бычьего сывороточного альбумина, 5,4 мМ дезоксиа-денозин-5′-трифосфата, дезоксицитидин-5′-трифосфата, дезоксигуанозин-5′-трифосфата, тимидин-5′-трифосфата. После проведения реакции в течение одного часа при 37oC мРНК удаляют при щелочном гидролизе. Синтезированную кДНК осаждают и используют в качестве матрицы в полимеразной цепной реакции. 5. Амплификация, клонирование и установление последовательности GSTI Hc-ДНК. Для выделения GSTIIIc-ДНК нуклеотидную последовательность, кодирующую GSTIIIc, сначала подвергают амплификации с помощью полимеразной цепной реакции (Mullis К. В., Faloona FA, (1987), Methods Enzymol. 155:335-350). Матрицей для реакции служит кДНК, полученная из мРНК кукурузы. Для специфического обогащения GSTIIIc-ДНК используют праймер 1 (прямой) согласно последовательности SEQ ID N3 и праймер 2 (обратный) согласно последовательности SEQ ID N4 (приведены в конце описания). Получают реакционные смеси следующего состава: 5 мкм кДНК (200 нг/мкл) 1 мкм 50 мкМ праймера 1 мкм 50 мкМ праймера 2 4 мкл 250 мкМ дезоксиаденозин – 5 – трифосфата, дезоксицитидин-5′-трифосфата, дезоксигуанозин-5′-трифосфата, тимидин-5′-трифосфата 5 мкл 200 мМ Трис/HCl, pH 8,8, 100 мМ хлористого калия, 60 мМ сульфата аммония, 15 мМ хлористого магния, 1% Тритона Х-100 34 мкл воды. Полимеразную цепную реакцию осуществляют в термоустройстве для управления циклом при амплификации гена при полимеразной цепной реакции (9600-Thermocycler, Perkin Elmer). В качестве устойчивой к нагреванию полимеразы прибавляют 1 мкл бляшкообразующей единицы ДНК-полимеразы (Stratagene, 2500 Ед./мл). Всего проводят 35 реакционных циклов при следующих температурах и времени реакции: 45 с при 94oC, 45 секунд при 58oC, 45 с при 72oC. Амплифицированный фрагмент ДНК, содержащий кодирующую GSTIIIc нуклеотидную последовательность, очищают с помощью электрофореза на агарозном геле и, как уже описывали, клонируют в векторе рЕТ3а. Полную последовательность ДНК GSTIIIc-ДНК (SEQ ID N1) определяют с помощью набора для секвенирования последовательностей ДНК с использованием секвеназы (United States Biochemical, Cleveland) (Sanger F., Coulson R., (1975), J.Mol. Biol. 94:441-448). II. Трансформация риса Трансформация риса (Oryza sativa) может быть проведена в соответствии со способами, описанными в следующей литературе. Zhang Н. М. , Yang Н., Rech Е.L, Golds Т.J., Davis A.S., Mulligan B.J., (1988). Transgenic rice plants produced by electroporation-medited plasmid uptake into protoplasts. Plant Cell Rep. 7:379-384. Zhang W. , Wu R., (1988). Efficient regeneration of transgenic plants from rice protoplasats and correctly regulated expression of the foreign gene in the plant. Theor. Appl. Gen. 76:835-840. Shimamoto K., Terada R., Izawa Т., Fujimoto H., (1989). Fertile transgenic rice plants regenerated from transformed protoplasts. Nature 338:274-276. Datta S. K. , Peterhans A., Datta K., Potrykus I., (1990). Genetically engineered fertile indica-rice recovered from protoplast. Biotechnol. 6: 736-740. Hayashimoto A. , Li Z., Murai N (1990). A polyethylene clycolmediated transformation system for production of fertile transgenic rice plants. Plant Physiol. 93:857-863. Для переноса вектора pSS-GSTIIIc в pmce использовали способ Hayashimoto и др. (1990) без изменений. Устойчивые к канамицину трансформанты были проконтролированы в экспериментах с Нозерн-блоттингом на экспрессию GSTIIIc-белка. Образование GSTIIIc-белка обнаруживали с помощью специфических антител. Ферментативная активность белка может быть продемонстрирована в экстракте-сырце трансформированных растений риса по наличию катализируемой ферментом модификации гербицида, N-изопропил-N-(4-фторфенил)амида (5-трифторметил-1,3,4-тиадиазол-2-ил-окси)уксусной кислоты. Трансгенные растения риса проявляют устойчивость по отношению к указанному гербициду по сравнению с нетрансформированными контрольными растениями. III. Трансформация табака а) Культивирование побегов табака и выделение протопластов табака: Табак (Petit Havanna SRI) размножают при стерильном культивировании побегов на среде ЛС без гормонов (Linsmeier Skoog, (1965)). С промежутками примерно в 6-8 недель пересаживают кусочки побегов на свежую среду ЛС. Культуры побегов содержатся при освещении 12 ч (1000-3000 лк) в помещении для культивирования при 24-26oC. Для выделения протопластов листьев около 2 г листьев (длиной примерно 3-5 см) разрезают чистым лезвием на маленькие кусочки (0,5 x 1 см). Листовой материал инкубируют в 20 мл ферментного раствора, состоящего из среды K3 (Nady и Maliga, 1976). 0,4 М сахарозы, pH 5,6, 2% целлюлазы R10 (Serva), 0,5% мацероцима R10 (Serva), в течение 14-16 ч при комнатной температуре. Затем протопласты отделяют от остатков клеток при фильтрации через стальное сито 0,3 мм и 0,1 мм. Фильтрат центрифугируют 10 мин при 100 х g. Во время такого центрифугирования интактные протопласты всплывают и собираются в слой на поверхности ферментного раствора. Осадок из остатков клеток и ферментный раствор отсасывают с помощью стеклянного капилляра. К предварительно очищенным протопластам добавляют свежую среду K3 (0,4 М сахароза как осмотический раствор) до 10 мл и заново дают им всплыть. Среду для промывки отсасывают, а протопласты разбавляют до 1-2 x 105/мл для культивирования или последующего заражения агробактериями (сокультивирование). Концентрацию протопластов определяют в счетной камере. б) Построение вектора pSS-GSTIIIc и перенос в агробактерию tumefaciens GSTIIIc-ДНК и последовательность Шайна-Дальгарно вырезались в виде фрагмента XbaI/BamHI из вектора рЕТ3а-GSTIIIc, подвергались очистке и клонированию в плазмиде Bluescript II Sk +/-(Stratagene, La Jolla, Калифорния), в дальнейшем обозначаемой как pBS-SKII. Использовались рестрикционные сайты XbaI и BamHI. Затем GSTIIIc-ДНК вырезали по сайтам рестрикции SstI и SmaI из вектора pBS-SKII-GSTIIIc, выделяли и лигировали в вектор pRT101 (линеаризированный SstI/SmaI) (Topfer R., Matzeit V., Gronenborn B., Schell J., SteinbiB H.H., (1987), Nucleic Acids Res. 14:5890). Затем GSTIIIc-ДНК выделяли в чистом виде как фрагмент EcoRI/SmaI из вектора pRT101-GSTIIIc и клонировали в экспрессирующем векторе pSS (линеаризированном EcoRI/SmaI, (VoB А. и др. , Мо1ес. Breeding 1:15-26(1995)). Вместо названных векторов могут быть задействованы любые другие экспрессирующие векторы и промежуточные векторы, содержащие соответствующие рестрикционные сайты, при этом специалист, располагая вышеупомянутыми данными, может легко сделать подходящий выбор. Получающийся в результате промежуточный вектор pSS-GSTIIIc, который содержит GSTIIIc-ДНК, переносится на Agrobacterium tumefaciens, содержащий функциональный участок vir (Koncz и Schell, 1986, van Haute и др., 1983). в) Трансформация регенерирующих протопластов табака путем сокультивирования с Agrobacterium tumefaciens. В дальнейшем используется способ Мартона и др., 1979, с небольшими изменениями. Протопласты выделяют, как описано, и инкубируют при плотности 1-2 x 105/мл в среде K3 (0,4 М сахароза,  -нафтилуксусная кислота в концентрации 0,1 мг/мл, 0,2 мг кинетина) в течение 2 дней в темноте и 1-2 дня при слабом освещении (500 лк) при 26oC.
Как только появляются первые части протопластов, прибавляют к 3 мл регенерирующих протопластов 30 мкл суспензии агробактерии согласно разделу б) в минимальном количестве среды А (Ам) (плотность около 109 агробактерий/мл). Продолжительность сокультивирования составляет 3-4 дня при 20oC в темноте. После чего клетки табака помещают в пробирки для центрифугирования емкостью 12 мл, разбавляют морской водой (600 мОсм/кг) до 10 мл и осаждают центрифугированием при 60 x g в течение 10 мин. Эту процедуру промывки повторяют еще 1-2 раза, чтобы удалить наибольшую часть агробактерии. Клеточную суспензию культивируют при плотности 5 x 104/ мл в среде K3 (0,3 М сахароза) с -нафтилуксусная кислота в концентрации 0,1 мг/мл, 0,2 мг кинетина) в течение 2 дней в темноте и 1-2 дня при слабом освещении (500 лк) при 26oC.
Как только появляются первые части протопластов, прибавляют к 3 мл регенерирующих протопластов 30 мкл суспензии агробактерии согласно разделу б) в минимальном количестве среды А (Ам) (плотность около 109 агробактерий/мл). Продолжительность сокультивирования составляет 3-4 дня при 20oC в темноте. После чего клетки табака помещают в пробирки для центрифугирования емкостью 12 мл, разбавляют морской водой (600 мОсм/кг) до 10 мл и осаждают центрифугированием при 60 x g в течение 10 мин. Эту процедуру промывки повторяют еще 1-2 раза, чтобы удалить наибольшую часть агробактерии. Клеточную суспензию культивируют при плотности 5 x 104/ мл в среде K3 (0,3 М сахароза) с  -нафтилуксусной кислотой в концентрации 1 мг/л, кинетином в концентрации 0,2 мг/л и цефалоспориновым антибиотиком цефотаксимом в концентрации 500 мг/л. Клеточную суспезию каждую неделю разбавляют свежей средой K3, и величина осмотического давления среды постепенно понижается с уменьшением молярности раствора сахарозы на 0,05 М (около 60 мОсм/кг) за неделю. Селекцию с канамицином канамицинсульфат 100 мг/л /Sigma/, 660 мг/г активного канамицина) начинают через 2-3 недели после сокультивирования в агарозе, применяя “шариковый тип культивирования” (Shillito и др., 1983). Устойчивые к канамицину колонии можно различить на фоне оставшихся колоний через 3-4 недели после начала селекции.
г) Прямая трансформация протопластов табака с ДНК. Трансформация с использованием нитрата кальция и полиэтиленгликоля.
В чашке Петри осторожно смешивают около 106 протопластов в 180 мкл среды K3 с 20 мкл водного раствора ДНК, содержащего 20 мкг плазмиды pSS-GSTIIIc. Плазмиду pSS-GSTIIIc получают известным способом из плазмид рЕТ3а-GSTIIIc, pRT101, pBS-SKII и pSS. Затем осторожно прибавляют 200 мкл раствора для слияния (0,1М азотнокислый кальций, 0,45М маннит, 25% полиэтиленгликоль /ПЭГ 6000/, pH 9). Через 15 мин добавляют 5 мл промывного раствора (0,275 М азотнокислый кальций, pH 6) и еще через 5 мин протопласты переносят в центрифужную пробирку и центрифугируют при 60 x g. Осадок после центрифугирования помещают в небольшое количество среды K3 и культивируют, как описано в следующем ниже разделе. Альтернативно можно трансформировать протопласты по Hain и др., 1985.
д) Культивирование инкубированных с ДНК протопластов и селекция устойчивых к канамицину каллюсов: -нафтилуксусной кислотой в концентрации 1 мг/л, кинетином в концентрации 0,2 мг/л и цефалоспориновым антибиотиком цефотаксимом в концентрации 500 мг/л. Клеточную суспезию каждую неделю разбавляют свежей средой K3, и величина осмотического давления среды постепенно понижается с уменьшением молярности раствора сахарозы на 0,05 М (около 60 мОсм/кг) за неделю. Селекцию с канамицином канамицинсульфат 100 мг/л /Sigma/, 660 мг/г активного канамицина) начинают через 2-3 недели после сокультивирования в агарозе, применяя “шариковый тип культивирования” (Shillito и др., 1983). Устойчивые к канамицину колонии можно различить на фоне оставшихся колоний через 3-4 недели после начала селекции.
г) Прямая трансформация протопластов табака с ДНК. Трансформация с использованием нитрата кальция и полиэтиленгликоля.
В чашке Петри осторожно смешивают около 106 протопластов в 180 мкл среды K3 с 20 мкл водного раствора ДНК, содержащего 20 мкг плазмиды pSS-GSTIIIc. Плазмиду pSS-GSTIIIc получают известным способом из плазмид рЕТ3а-GSTIIIc, pRT101, pBS-SKII и pSS. Затем осторожно прибавляют 200 мкл раствора для слияния (0,1М азотнокислый кальций, 0,45М маннит, 25% полиэтиленгликоль /ПЭГ 6000/, pH 9). Через 15 мин добавляют 5 мл промывного раствора (0,275 М азотнокислый кальций, pH 6) и еще через 5 мин протопласты переносят в центрифужную пробирку и центрифугируют при 60 x g. Осадок после центрифугирования помещают в небольшое количество среды K3 и культивируют, как описано в следующем ниже разделе. Альтернативно можно трансформировать протопласты по Hain и др., 1985.
д) Культивирование инкубированных с ДНК протопластов и селекция устойчивых к канамицину каллюсов:Для описываемых далее культивирования и селекции устойчивых к канамицину колоний используется модифицированная методика “шарикового типа культивирования” (Shillito и др., 1983). Через неделю после обработки протопластов с помощью ДНК (сравните с разделом г) смешивают в чашке Петри диаметром 5 см суспензию клеток (3 мл) с 3 мл среды K3 (0,3 М сахароза + гормон; 1,2% низкоплавящаяся агароза (Морские Коллоиды)). Для этой цели агарозу в сухом виде автоклавируют и после добавления среды К3 быстро кипятят в микроволновой печи. После затвердевания агарозы кружочки агарозы (“шарики”) вместе с включенными внутрь микрокаллюсами табака переносят для дальнейшего культивирования и селекции в чашки Петри диаметром 10 см и прибавляют по 10 мл среды K3 (0,3 М сахароза,  -нафтилуксусная кислота в концентрации 1 мг/л, кинетин в концентрации 0,2 мг/л) и канамицинсульфат /100 мг/л/ (Sigma). Жидкую среду заменяют каждую неделю. При этом осмотическое давление среды ступенчато понижается. За неделю в обмениваемой среде (K3 + канамицин) молярная концентрация сахарозы понижается на 0,05 М (около 60 мОсм). Схема селекции устойчивых к канамицину колоний табака после трансформации с помощью ДНК: -нафтилуксусная кислота в концентрации 1 мг/л, кинетин в концентрации 0,2 мг/л) и канамицинсульфат /100 мг/л/ (Sigma). Жидкую среду заменяют каждую неделю. При этом осмотическое давление среды ступенчато понижается. За неделю в обмениваемой среде (K3 + канамицин) молярная концентрация сахарозы понижается на 0,05 М (около 60 мОсм). Схема селекции устойчивых к канамицину колоний табака после трансформации с помощью ДНК: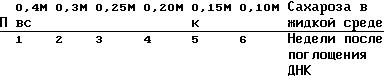 (Среда K3  -нафтилуксусная кислота 1 мг/л кинетин 0,2 мг/л); -нафтилуксусная кислота 1 мг/л кинетин 0,2 мг/л);П = поглощение ДНК; В = включение в агарозу; С = селекция с канамицином (канамицинсульфат 100 мг/л); К = устойчивые к канамицину колонии, которые можно однозначно различить на фоне. е) Регенерация устойчивых к канамицину растений. Как только устойчивые к канамицину колонии достигают диаметра около 0,5 см, половину помещают на среду для регенерации (среда ЛС, 2% сахароза, бензиламинопурин (БАП) в концентрации 0,5 мг/л) и выдерживают при освещении в течение 12 ч (3000-5000 лк) и при температуре 24oC в помещении для культивирования. Другую половину размножают в виде культуры каллюса на среде ЛС с  -нафтилуксусной кислотой в концентрации 1 мг/л, кинетином в концентрации 0,2 мг/л, БАП в концентрации 0,1 мг/л и канамицинсульфатом в концентрации 100 мг/л. Когда регенерированные побеги достигают величины около 1 см, их вырезают и помещают на 1/2 среды ЛС (1% сахароза, 0,8% агар) без регуляторов роста для того, чтобы они пустили корни. Побеги пускают корни на 1/2 среды ЛС с канамицинсульфатом в концентрации 100 мг/л, а позднее их пересаживают в землю.
ж) Трансформация пластинок листьев под действием агробактерии tumefaciens.
Для трансформации пластинок листьев (Horsch и др., 1985) листья длиной 2-3 см после стерильного культивирования побегов нарезают пластинками диаметром в 1 см и инкубируют с суспензией соответствующих агробактерии (около 109/ мл) (сравните с разделом в) в среде Ам, см. ниже) примерно в течение 5 мин. Зараженные кусочки листьев выдерживают в среде Murashige и Skoog (МС) без гормонов в течение 3-4 дней при температуре около 24oC. В течение этого времени агробактерия прорастает на кусочках листьев. Эти кусочки листьев затем промывают в среде МС (БАП 0,5 мг/мл, -нафтилуксусной кислотой в концентрации 1 мг/л, кинетином в концентрации 0,2 мг/л, БАП в концентрации 0,1 мг/л и канамицинсульфатом в концентрации 100 мг/л. Когда регенерированные побеги достигают величины около 1 см, их вырезают и помещают на 1/2 среды ЛС (1% сахароза, 0,8% агар) без регуляторов роста для того, чтобы они пустили корни. Побеги пускают корни на 1/2 среды ЛС с канамицинсульфатом в концентрации 100 мг/л, а позднее их пересаживают в землю.
ж) Трансформация пластинок листьев под действием агробактерии tumefaciens.
Для трансформации пластинок листьев (Horsch и др., 1985) листья длиной 2-3 см после стерильного культивирования побегов нарезают пластинками диаметром в 1 см и инкубируют с суспензией соответствующих агробактерии (около 109/ мл) (сравните с разделом в) в среде Ам, см. ниже) примерно в течение 5 мин. Зараженные кусочки листьев выдерживают в среде Murashige и Skoog (МС) без гормонов в течение 3-4 дней при температуре около 24oC. В течение этого времени агробактерия прорастает на кусочках листьев. Эти кусочки листьев затем промывают в среде МС (БАП 0,5 мг/мл,  -нафтилуксусная кислота 0,1 мг/мл) и помещают на подобную среду (0,8% агар) с цефотаксимом в концентрации 500 мкг/мл и канамицинсульфатом в концентрации 100 мкг/мл. Через две недели среду следует обновить. Трансформированные устойчивые к канамицину побеги видны через следующие 2-3 недели.
Биохимические способы доказательства трансформации -нафтилуксусная кислота 0,1 мг/мл) и помещают на подобную среду (0,8% агар) с цефотаксимом в концентрации 500 мкг/мл и канамицинсульфатом в концентрации 100 мкг/мл. Через две недели среду следует обновить. Трансформированные устойчивые к канамицину побеги видны через следующие 2-3 недели.
Биохимические способы доказательства трансформацииФерментативный тест с неомицин-фосфотрансферазой (НФТ II): Активность НФТ II в тканях растений определяют путем in situ фосфорилирования канамицина, как описано ReiB и др. (1984) и модифицировано Schreier и др. (1985), следующим образом. При прибавлении стеклянного порошка гомогенизируют во льду 50 мг ткани растений в 50 мкл буфера для экстракции (10% глицерина, 5% 2-меркаптоэтанола, 0,1% додецилсульфата натрия, 0,025% бромфенолового синего, 62,5 мМ Трис, pH 6,8) и в течение 10 мин центрифугируют при 4oC в центрифуге Эппендорфа. Надосадочную жидкость в количестве 50 мкл переносят в нативный полиакриламидный гель (145 x 110 x 1,2 мм; гель для разделения: 10% акриламида, 0,33% бисакриламида, 0,375 М Трис, pH 8,8, гель для сбора: 5% акриламида, 0,165% бисакриламида, 0,125М Трис, pH 6,8) и подвергают электрофорезу в течение ночи при oC и 60 В. Как только индикатор бромфеноловый синий выделяется из геля, гель промывают дважды дистиллированной водой в течение 10 мин и один раз 30 мин буфером для реакции (67 мМ Трис-малеат, pH 7,1; 42 мМ хлористый магний, 400 мМ хлористый аммоний). Гель помещают на стеклянную пластину такого же размера и покрывают сверху 40 мл 1%-ной агарозы в буфере для реакции, содержащем в качестве субстратов канамицинсульфат (20 мкг/мл) и меченый 32P аденозин-5′-трифосфат (Amersham) с радиоактивностью 20-200 мкКи. Сэндвич-гель инкубируют 30 мин при комнатной температуре, а затем на агарозу укладывают лист фосфоцеллюлозной бумаги Р81 (Whatman). На него укладывают в четыре слоя фильтровальную бумагу 3 MM (Whatman) и несколько бумажных полотенец. Перенос фосфорилированного in situ радиоактивного канамицинфосфата на бумагу Р81 прекращается через 3-4 ч. Бумагу Р81 инкубируют 30 мин в растворе протеиназы К и 1% додецилсульфата натрия при 60oC, а затем промывают 3-4 раза в 250 мл 10 мМ фосфатного буфера с pH 7,5 при 80oC, сушат и подвергают авторадиографии в течение 1-12 ч при -70oC (пленка Kodak XAR5). Все результаты в процентах как в вышеупомянутых, так и в приводимых далее примерах, рассчитываются как весовые проценты, если не указано иначе. В полученных таким образом в соответствии с вышеуказанными примерами клетках растений и растениях присутствие GSTIIIc-ДНК устанавливали с помощью анализа с использованием Саузерн-блоттинга. Экспрессию GSTIIIc-ДНК подтверждали анализом с использованием Нозерн-блоттинга и Вестерн-блоттингом с помощью специфических антител. Далее описываются некоторые среды, применяемые при трансформации растений или клеток растений: Среда Ам 3,5 г вторичного кислого фосфата калия 2 г глюкозы в 1 л Среда для стерильного культивирования побегов табака Макроэлементы 1/2 концентрации солей среды МС Микроэлементы 1/2 концентрации солей среды МС Fe-ЭДТК (среда Murashige и Skoog) Миоинозит – 100 мг/л Сахароза – 10 мг/л Агар – 8 мл/г Витамины пантотенат кальция – 1 мг/л биотин – 10 мг/л никотиновая кислота – 1 мг/л пиридоксин – 1 мг/л тиамин – 1 мг/л pH 5,7 перед автоклавированием 1,5 г – первичного кислого фосфата калия 0,5 г – цитрата натрия 0,1 г – сульфата магния гептагидрата 1 г – сульфата аммония Среда K3 Для культивирования табака Nicotiana tabacum petit Havanna SR1, табака Nicotiana tabacum Wisconsin 38 и протопластов табака Nicotiana plymaginifolia (Nagy и Maliga, 1976) Макроэлементы нитрат аммония – 250 мг/л нитрат калия – 2500 мг/л хлористый кальций дигидрат – 900 мг/л сульфат магния гептагидрат – 250 мг/л мононатрийфосфат гидрат – 150 мг/л вторичный кислый фосфат кальция гидрат – 50 мг/л Микроэлементы орто-борная кислота – 3 мг/л (сульфат марганца (2)гидрат – 10 мг/л сульфат цинка тетрагидрат – 2 мг/л йодистый калий – 0,75 мг/л молибдат натрия дигидрат – 0,25 мг/л сульфат меди (2) пентагидрат – 0,025 мг/л хлорид кобальта (2) гексагидрат – 0,025 мг/л Fe-ЭДТК динатриевая соль ЭДТК – 37,2 мг/л сульфат железа (2) гептагидрат – 27,8 мг/л Инозит – 100 мг/л Сахароза – 137 мг/л (= 0,4 М) Ксилоза – 250 мг/л Витамины никотиновая кислота – 1 мг/л пиридоксин – 1 мг/л тиамин – 10 мг/л Гормоны  -нафтилуксусная кислота – 1 мг/л -нафтилуксусная кислота – 1 мг/лкинетин – 0,2 мг/л pH 5,6 стерилизовать на фильтре Среда Линсмайера и Скуга (Linsmaier и Skoog, 1965) Для культивирования регенерирующих протопластов и для культивирования ткани опухолей табака и каллюса. Среда Линсмайера и Скуга (ЛС) представляет из себя среду Мурашиге и Скуга (Muraschige и Skoog, 1962) со следующими модификациями: – Тиамин используется в более высокой концентрации 0,4 мг/л вместо 0,1 мг/л; – Глицин, пиридоксин и никотиновая кислота отсутствуют. Макроэлементы нитрат аммония – 1650 мг/л нитрат калия – 1900 мг/л хлористый кальций дигидрат – 440 мг/л сульфат магния гептагидрат – 370 мг/л первичный кислый фосфат калия – 170 мг/л Микроэлементы орто-борная кислота – 6,2 мг/л сульфат марганца(2) гидрат – 22,3 мг/л сульфат цинка тетрагидрат – 8,6 мг/л йодистый калий – 0,83 мг/л молибдат натрия дигидрат – 0,25 мг/л сульфат меди (2) пентагидрат – 0,025 мг/л хлорид кобальта (2) гексагидрат – 0,025 мг/л Fe-ЭДТК динатриевая соль ЭДТК – 37,2 мг/л сульфат железа (2) гептагидрат – 27,8 мг/л Инозит – 100 мг/л Сахароза – 30 мг/л Агар – 8 мг/л Витамины тиамин – 0,4 мг/л Гормоны  -нафтилуксусная кислота – 1 мг/л -нафтилуксусная кислота – 1 мг/лкинетин – 0,2 мг/л pH 5,7. Повышенная устойчивость трансформированных согласно изобретению растений поясняется следующим опытом. Подтверждение повышенной устойчивости трансформированных растений. Для доказательства повышенной устойчивости по отношению к обладающим гербицидным действием гетерооксиацетамидам определяют заражение трансформированных согласно изобретению растений при сравнении с контрольными растениями. В качестве испытываемого гербицида используют N-изо-пропил-N-(4-трифторфенил)амид (5-трифторметил-1,3,4-тиадиазол-2-ил-окси) уксусной кислоты. Семена поколения F1 трансформированных растений помещают в оранжерее в горшки (диаметром 11 см) с землей, содержащей 3% перегноя. Выращивание растений осуществляют при температуре 23oC и относительной влажности воздуха 70 – 80%. Обработка вышеназванным гербицидом в форме 70%-ного смачиваемого порошка производится через 24 ч после высаживания семян с использованием концентраций, соответствующих затраченному количеству в 2000 – 4000 г активного вещества/га. Оценку производят через 20 дней после обработки гербицидом. Оценивается в процентах общий вред, нанесенный трансгенным растениям, по сравнению с соответствующими контрольными растениями, которые были обработаны такими же концентрациями активного вещества. Трансформированные табачные растения, в которые встраивали GSTIIIc-ДНК согласно изобретению, показали четкую повышенную устойчивость по отношению к высоким затраченным количествам гербицида (2000 – 4000 г/га) по сравнению с нетрансформированными соответствующими контрольными растениями. Формула изобретения
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 11.01.2004
Извещение опубликовано: 27.04.2005 БИ: 12/2005
|
||||||||||||||||||||||||||
