Патент на изобретение №2169118
|
||||||||||||||||||||||||||
(54) ТИТАНАТ НАТРИЯ С ЧАСТИЧНО КРИСТАЛЛИЧЕСКОЙ СЛОИСТОЙ СТРУКТУРОЙ
(57) Реферат: Изобретение относится к новым соединениям титаната натрия, предназначенным для использования в качестве ионита для стронция. Титанат натрия имеет частично кристаллическую слоистую структуру с межплоскостным расстоянием 8 – 9,9 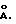 Удельная поверхность 25 – 200 мг/г. Ширина максимума отражения (001) на половине высоты пика – 2 – 4,5°. Композиционный ионит на основе титаната натрия содержит 40-95 мас.% титаната натрия и 5-60 мас.% связующего. Титанат натрия получают гидротермальной обработкой геля титаната натрия, полученного кипячением с конденсацией и обратным стоком при 150 – 170°С в присутствии гидроокиси натрия в течение 1 – 5 ч. Результат изобретения: поглощение стронция с высокой селективностью из высокощелочных растворов. 5 с. и 11 з.п.ф-лы, 19 табл., 12 ил. Удельная поверхность 25 – 200 мг/г. Ширина максимума отражения (001) на половине высоты пика – 2 – 4,5°. Композиционный ионит на основе титаната натрия содержит 40-95 мас.% титаната натрия и 5-60 мас.% связующего. Титанат натрия получают гидротермальной обработкой геля титаната натрия, полученного кипячением с конденсацией и обратным стоком при 150 – 170°С в присутствии гидроокиси натрия в течение 1 – 5 ч. Результат изобретения: поглощение стронция с высокой селективностью из высокощелочных растворов. 5 с. и 11 з.п.ф-лы, 19 табл., 12 ил.
Объектом данного изобретения является новый нонатитанат натрия, имеющий частично кристаллическую слоистую структуру. Новый нонатитанат натрия обладает ионообменными свойствами и создан специально для использования в качестве ионита для стронция. С тех пор, как в конце второй мировой войны было создано ядерное оружие, на различных промышленных установках производятся и направляются на хранение большие объемы радиоактивных отходов. Для удаления радиоактивных отходов, состоящих большей частью из побочных продуктов производства и очистки урана и плутония, раньше использовали способы, которые в то время казались подходящими, но сейчас, считаются неприемлемыми. В настоящее время большая часть радиоактивных отходов хранится в контейнерах в виде высокощелочной смеси солей и жидкостей, которая, если ее не извлечь и не подвергнуть надлежащей химической обработке, способна в будущем породить тяжелые экологические проблемы. Большая часть хранящихся водных радиоактивных отходов является щелочной (pH 14) и содержит в больших количествах азотнокислый натрий. В контейнерах содержатся различные комплексообразователи, продукты распада, трансурановые элементы и другие материалы. Большинство хранящихся радиоактивных отходов находятся в форме осадка, выпадающего при добавлении к ним щелочей с целью предотвращения коррозии контейнера. Некоторые радиоактивные материалы входят в состав солевых отложений, образовавшихся в результате испарения растворенного в воде щелочного материала. Радиоактивные элементы желательно удалить из материала отходов, чтобы сделать возможным последующее безопасное удаление нерадиоактивных материалов. Особую важность имеет удаление двух из металлических радионуклидов – цезия и стронция, так как они имеют период полураспада, достаточно большой для того, чтобы длительное время представлять собой источник радиационной опасности. Нонатитанат натрия известен как ионит стронция. J. Lehto описывает ионообменные качества Na4Ti9O20  xH2O по отношению к стронцию (J. Radioanal. Chem. Letters, 118: 1-13 (1987). Рассматриваемый здесь титанат натрия был приготовлен гидротермальным способом при температуре 300oC и подвергнут последующему кипячению в среде NaOH.
К другим источникам, раскрывающим приготовление титанатов натрия и их применение в качестве ионитов стронция, относятся: R.G. Dosch “Заключительный отчет о применении титанатов, ниобатов и танталатов для нейтрализации загрязняющих отходов оборонной промышленности. Свойства материалов. Физические формы и технология регенерации. Национальная служба технической информации”. (1981), R.M. Merrill; Journal of Radioanalytical Chemistry; 43: 93-100 (1978), J. Lehto et al.: J. Chem. Soc. Dalton Trans., 101-103 (1989), и S.P. Mishra et al.: Journal of Radioanalytical and Nuclear Chemistry, Articles; 162:2,299-305 (1992).
В ранее опубликованных источниках описаны различные типы титанатов натрия, а также различные способы применения титанатов натрия в качестве ионита, поглощающего ионы металлов, отличных от стронция. M. Watanabe описывает способ приготовления титанатов натрия путем проведения в гидротермальных условиях химических реакций с участием двуокиси титана и гидроокиси натрия (Journal of Solid State Chemistry, 36: 91-96 (1981). Рассмотренные в этой работе титанаты имеют формулу TiO2, Na2O xH2O по отношению к стронцию (J. Radioanal. Chem. Letters, 118: 1-13 (1987). Рассматриваемый здесь титанат натрия был приготовлен гидротермальным способом при температуре 300oC и подвергнут последующему кипячению в среде NaOH.
К другим источникам, раскрывающим приготовление титанатов натрия и их применение в качестве ионитов стронция, относятся: R.G. Dosch “Заключительный отчет о применении титанатов, ниобатов и танталатов для нейтрализации загрязняющих отходов оборонной промышленности. Свойства материалов. Физические формы и технология регенерации. Национальная служба технической информации”. (1981), R.M. Merrill; Journal of Radioanalytical Chemistry; 43: 93-100 (1978), J. Lehto et al.: J. Chem. Soc. Dalton Trans., 101-103 (1989), и S.P. Mishra et al.: Journal of Radioanalytical and Nuclear Chemistry, Articles; 162:2,299-305 (1992).
В ранее опубликованных источниках описаны различные типы титанатов натрия, а также различные способы применения титанатов натрия в качестве ионита, поглощающего ионы металлов, отличных от стронция. M. Watanabe описывает способ приготовления титанатов натрия путем проведения в гидротермальных условиях химических реакций с участием двуокиси титана и гидроокиси натрия (Journal of Solid State Chemistry, 36: 91-96 (1981). Рассмотренные в этой работе титанаты имеют формулу TiO2, Na2O nTi2NaxTiO2. J. Akimoto et al. описывает синтез первичных титанатов натрия NaTi8O13, отличающихся от рассматриваемых в настоящем описании нонатитанатов натрия (Journal of Solid State Chemistry, 90: 147-154 (1991). H. Leinonen et al. описывает использование титанатов натрия в качестве ионитов для никеля и цинка (Reactive Polymers, 23:221-228 (1994).
Lehto et al. исследует вопросы влияния гамма-излучения на титанат натрия и другие твердые иониты (Radiochem. Radioanal. Letters, 50:6, 375-384 (1982). В результате этого исследования был сделан вывод о том, что гамма-излучение оказывает очень незначительное влияние на ионообменную емкость титаната натрия по отношению к стронцию.
В PCT-заявке N WO 94/19277 раскрываются силикотитанаты и способы их получения и применения. Раскрытые в этой публикации силикотитанаты применимы для удаления цезия из радиоактивных отходов. В патенте США N 4,156,646 раскрывается удаление плутония и америция из водных щелочных растворов радиоактивных отходов с использованием ионитов на основе титанатов натрия.
В патенте США N 5,352,644 раскрывается связанный двуокисью титана цеолит, полученный путем соединения цеолита, слабокислотного связующего на основе двуокиси титана и суспензии гидроокиси титана в воде.
Целью настоящего изобретения является получение нового титаната натрия с частично кристаллической слоистой структурой, который обладает хорошими ионообменными качествами в отношении стронция.
Еще одной целью настоящего изобретения является получение нового титаната натрия с частично кристаллической слоистой структурой, который способен поглощать ионы стронция из высокощелочных растворов.
Следующей целью настоящего изобретения является получение нового титаната натрия с частично кристаллической слоистой структурой, который имеет межплоскостное расстояние, составляющее примерно от 8 до 9,9 ангстрем.
И наконец, еще одной целью настоящего изобретения является разработка нового способа получения титаната натрия.
Один из вариантов изобретения относится к титанату натрия с частично кристаллической слоистой структурой, у которого межплоскостное расстояние составляет примерно от 8 до 9,5 ангстрем.
Еще один вариант изобретения относится к титанату натрия с частично кристаллической слоистой структурой, который имеет межплоскостное расстояние, составляющее примерно от 9,0 до 9,9 ангстрем, удельную поверхность по Ленгмюру, составляющую примерно от 60 до 110 м2/г, и ширину максимума отражения (001) при рентгеноструктурном анализе, находящуюся между 1o и 4,5o.
Следующий вариант изобретения относится к титанату натрия с частично кристаллической слоистой структурой, в котором дифракция рентгеновских лучей характеризуется рентгенограммой, представленной на фиг. 1, и который получен путем гидротермальной обработки геля титаната натрия при температуре примерно от 120oC до 200oC в присутствии водного раствора гидроокиси натрия NaOH, продолжительностью примерно от 1 до 20 часов.
И еще один вариант изобретения относится к титанату натрия с частично кристаллической слоистой структурой, который имеет межплоскостное расстояние, составляющее примерно от 9,0 до 9,9 ангстрем, ширину максимума отражения (001) при рентгеноструктурном анализе, находящуюся между 2o и 4,5o, и который получен способом, включающим в себя гидротермальную обработку геля титаната натрия, приготовленного способом кипячения с конденсацией и обратным стоком, и последующую гидротермальную обработку продукта кипячения при температуре примерно от 150oC до 170oC в присутствии добавленного водного раствора гидроокиси натрия NaOH, с продолжительностью обработки примерно от 1 до 20 часов.
Предпочтительные варианты предложенного титаната натрия с частично кристаллической слоистой структурой иллюстрируются следующими фигурами графических материалов.
На фиг. 1 представлена рентгенограмма, характеризующая дифракцию рентгеновских лучей в предложенном титанате натрия с частично кристаллической слоистой структурой, имеющем межплоскостное расстояние 9,4 ангстрем.
На фиг. 2 представлены рентгенограммы, характеризующие дифракцию рентгеновских лучей в образцах от 1-1 до 1-6 титаната натрия с частично кристаллической слоистой структурой, полученных способом, соответствующим примеру 1.
На фиг. 3 представлены рентгенограммы, характеризующие дифракцию рентгеновских лучей в образцах от 1-7 до 1-13 титаната натрия с частично кристаллической слоистой структурой, полученных способом, соответствующим примеру 1.
На фиг. 4 представлена рентгенограмма, характеризующая дифракцию рентгеновских лучей в образце 2-1 титаната натрия с частично кристаллической слоистой структурой, полученном способом, соответствующим примеру 2.
На фиг. 5 представлен график зависимости lg (Kd) от pH при поглощении стронция титанатом натрия.
На фиг. 6 представлена рентгенограмма, характеризующая дифракцию рентгеновских лучей в предложенном дегидратированном титанате натрия с частично кристаллической слоистой структурой, полученном способом, соответствующим примеру 9, и имеющем межплоскостное расстояние 9,0 ангстрем.
На фиг. 7 представлена рентгенограмма, характеризующая дифракцию рентгеновских лучей в предложенном гидратированном титанате натрия с частично кристаллической слоистой структурой, полученном способом, соответствующим примеру 9, и имеющем межплоскостное расстояние 10,2 ангстрем.
На фиг. 8 представлен график зависимости поглощения стронция титанатом натрия с частично кристаллической слоистой структурой, полученным в примере 5, от ширины максимума отражения (001) при рентгеноструктурном анализе на половине его высоты, где ширина максимума на половине его высоты связана с кристалличностью структуры титаната натрия обратно пропорциональной зависимостью.
На фиг. 9 представлен график зависимости внутренней температуры в реакторе от продолжительности гидротермальной обработки титаната натрия.
На фиг. 10A, 10B, 10C и 10D представлены полученные с помощью электронного сканирующего микроскопа (с 3.000-кратным увеличением) изображения структуры образцов титаната натрия с частично кристаллической слоистой структурой, взятых из порций, полученных на экспериментальной установке путем гидротермальной обработки в соответствии с примером 5.
На фиг. 11 представлен график изменения концентрации стронция в сточных водах после взаимодействия в насадочной колонне с титанатом натрия, имеющим частично кристаллическую слоистую структуру, до и после регенерации титаната натрия.
На фиг. 12 представлен график, отражающий кинетику поглощения стронция связанным и несвязанным титанатом натрия с частично кристаллической слоистой структурой, предложенным в данном изобретении.
Объектом изобретения является титанат натрия с частично кристаллической слоистой структурой, который имеет межплоскостное расстояние, составляющее примерно от 8 до 9,9 ангстрем и ширину максимума отражения (001) при рентгеноструктурном анализе, составляющую примерно от 1o до 4,5o. Новый титанат натрия с частично кристаллической слоистой структурой обладает сильными ионообменными качествами по отношению к стронцию, которые обусловлены его физическими свойствами, отличающими его от всех других титанатов натрия.
Предложенный в данном изобретении титанат натрия с частично кристаллической слоистой структурой имеет формулу Na3,4-4,4Ti8,4-9,2O18,5-20,6 nTi2NaxTiO2. J. Akimoto et al. описывает синтез первичных титанатов натрия NaTi8O13, отличающихся от рассматриваемых в настоящем описании нонатитанатов натрия (Journal of Solid State Chemistry, 90: 147-154 (1991). H. Leinonen et al. описывает использование титанатов натрия в качестве ионитов для никеля и цинка (Reactive Polymers, 23:221-228 (1994).
Lehto et al. исследует вопросы влияния гамма-излучения на титанат натрия и другие твердые иониты (Radiochem. Radioanal. Letters, 50:6, 375-384 (1982). В результате этого исследования был сделан вывод о том, что гамма-излучение оказывает очень незначительное влияние на ионообменную емкость титаната натрия по отношению к стронцию.
В PCT-заявке N WO 94/19277 раскрываются силикотитанаты и способы их получения и применения. Раскрытые в этой публикации силикотитанаты применимы для удаления цезия из радиоактивных отходов. В патенте США N 4,156,646 раскрывается удаление плутония и америция из водных щелочных растворов радиоактивных отходов с использованием ионитов на основе титанатов натрия.
В патенте США N 5,352,644 раскрывается связанный двуокисью титана цеолит, полученный путем соединения цеолита, слабокислотного связующего на основе двуокиси титана и суспензии гидроокиси титана в воде.
Целью настоящего изобретения является получение нового титаната натрия с частично кристаллической слоистой структурой, который обладает хорошими ионообменными качествами в отношении стронция.
Еще одной целью настоящего изобретения является получение нового титаната натрия с частично кристаллической слоистой структурой, который способен поглощать ионы стронция из высокощелочных растворов.
Следующей целью настоящего изобретения является получение нового титаната натрия с частично кристаллической слоистой структурой, который имеет межплоскостное расстояние, составляющее примерно от 8 до 9,9 ангстрем.
И наконец, еще одной целью настоящего изобретения является разработка нового способа получения титаната натрия.
Один из вариантов изобретения относится к титанату натрия с частично кристаллической слоистой структурой, у которого межплоскостное расстояние составляет примерно от 8 до 9,5 ангстрем.
Еще один вариант изобретения относится к титанату натрия с частично кристаллической слоистой структурой, который имеет межплоскостное расстояние, составляющее примерно от 9,0 до 9,9 ангстрем, удельную поверхность по Ленгмюру, составляющую примерно от 60 до 110 м2/г, и ширину максимума отражения (001) при рентгеноструктурном анализе, находящуюся между 1o и 4,5o.
Следующий вариант изобретения относится к титанату натрия с частично кристаллической слоистой структурой, в котором дифракция рентгеновских лучей характеризуется рентгенограммой, представленной на фиг. 1, и который получен путем гидротермальной обработки геля титаната натрия при температуре примерно от 120oC до 200oC в присутствии водного раствора гидроокиси натрия NaOH, продолжительностью примерно от 1 до 20 часов.
И еще один вариант изобретения относится к титанату натрия с частично кристаллической слоистой структурой, который имеет межплоскостное расстояние, составляющее примерно от 9,0 до 9,9 ангстрем, ширину максимума отражения (001) при рентгеноструктурном анализе, находящуюся между 2o и 4,5o, и который получен способом, включающим в себя гидротермальную обработку геля титаната натрия, приготовленного способом кипячения с конденсацией и обратным стоком, и последующую гидротермальную обработку продукта кипячения при температуре примерно от 150oC до 170oC в присутствии добавленного водного раствора гидроокиси натрия NaOH, с продолжительностью обработки примерно от 1 до 20 часов.
Предпочтительные варианты предложенного титаната натрия с частично кристаллической слоистой структурой иллюстрируются следующими фигурами графических материалов.
На фиг. 1 представлена рентгенограмма, характеризующая дифракцию рентгеновских лучей в предложенном титанате натрия с частично кристаллической слоистой структурой, имеющем межплоскостное расстояние 9,4 ангстрем.
На фиг. 2 представлены рентгенограммы, характеризующие дифракцию рентгеновских лучей в образцах от 1-1 до 1-6 титаната натрия с частично кристаллической слоистой структурой, полученных способом, соответствующим примеру 1.
На фиг. 3 представлены рентгенограммы, характеризующие дифракцию рентгеновских лучей в образцах от 1-7 до 1-13 титаната натрия с частично кристаллической слоистой структурой, полученных способом, соответствующим примеру 1.
На фиг. 4 представлена рентгенограмма, характеризующая дифракцию рентгеновских лучей в образце 2-1 титаната натрия с частично кристаллической слоистой структурой, полученном способом, соответствующим примеру 2.
На фиг. 5 представлен график зависимости lg (Kd) от pH при поглощении стронция титанатом натрия.
На фиг. 6 представлена рентгенограмма, характеризующая дифракцию рентгеновских лучей в предложенном дегидратированном титанате натрия с частично кристаллической слоистой структурой, полученном способом, соответствующим примеру 9, и имеющем межплоскостное расстояние 9,0 ангстрем.
На фиг. 7 представлена рентгенограмма, характеризующая дифракцию рентгеновских лучей в предложенном гидратированном титанате натрия с частично кристаллической слоистой структурой, полученном способом, соответствующим примеру 9, и имеющем межплоскостное расстояние 10,2 ангстрем.
На фиг. 8 представлен график зависимости поглощения стронция титанатом натрия с частично кристаллической слоистой структурой, полученным в примере 5, от ширины максимума отражения (001) при рентгеноструктурном анализе на половине его высоты, где ширина максимума на половине его высоты связана с кристалличностью структуры титаната натрия обратно пропорциональной зависимостью.
На фиг. 9 представлен график зависимости внутренней температуры в реакторе от продолжительности гидротермальной обработки титаната натрия.
На фиг. 10A, 10B, 10C и 10D представлены полученные с помощью электронного сканирующего микроскопа (с 3.000-кратным увеличением) изображения структуры образцов титаната натрия с частично кристаллической слоистой структурой, взятых из порций, полученных на экспериментальной установке путем гидротермальной обработки в соответствии с примером 5.
На фиг. 11 представлен график изменения концентрации стронция в сточных водах после взаимодействия в насадочной колонне с титанатом натрия, имеющим частично кристаллическую слоистую структуру, до и после регенерации титаната натрия.
На фиг. 12 представлен график, отражающий кинетику поглощения стронция связанным и несвязанным титанатом натрия с частично кристаллической слоистой структурой, предложенным в данном изобретении.
Объектом изобретения является титанат натрия с частично кристаллической слоистой структурой, который имеет межплоскостное расстояние, составляющее примерно от 8 до 9,9 ангстрем и ширину максимума отражения (001) при рентгеноструктурном анализе, составляющую примерно от 1o до 4,5o. Новый титанат натрия с частично кристаллической слоистой структурой обладает сильными ионообменными качествами по отношению к стронцию, которые обусловлены его физическими свойствами, отличающими его от всех других титанатов натрия.
Предложенный в данном изобретении титанат натрия с частично кристаллической слоистой структурой имеет формулу Na3,4-4,4Ti8,4-9,2O18,5-20,6 xH2O. В предпочтительном варианте титанат натрия с частично кристаллической слоистой структурой имеет формулу Na4Ti9O20 xH2O. В предпочтительном варианте титанат натрия с частично кристаллической слоистой структурой имеет формулу Na4Ti9O20 xH2O.
Предложенный в данном изобретении некристаллический титанат натрия представляет собой аморфный титанат натрия. Ниже будет рассмотрено, что комбинация титаната натрия с частично кристаллической слоистой структурой и аморфного титаната натрия достигается в результате гидротермальной обработки геля титаната натрия при определенных условиях. Получаемый титанат натрия с частично кристаллической слоистой структурой имеет уникальную картину дифракции рентгеновских лучей в кристаллической решетке, а также уникальные физические и химико-технологические характеристики.
Рецептура и способ получения предложенного в изобретении титаната натрия с частично кристаллической слоистой структурой разработаны с расчетом на максимально возможное увеличение его ионообменной емкости и селективности к стронцию. Способность поглощать стронций в процессе ионного обмена придана предложенному в изобретении титанату натрия путем специального подбора параметров гидротермальной обработки, позволяющих получить в итоге титанат натрия с частично кристаллической структурой. Переменными параметрами гидротермальной обработки, влияющими на кристалличность структуры продукта титаната натрия, а значит – и на его ионообменную емкость и селективность к стронцию, являются: температура гидротермальной обработки, длительность обработки и концентрация гидроокиси натрия в растворе, используемом при гидротермальной обработке. Дополнительное преимущество гидротермальной обработки заключается в том, что она делает титанат натрия практически нерастворимым в сильнощелочных растворах.
Гель титаната натрия для гидротермальной обработки получают различными способами. В примерах осуществления изобретения подробно описаны два способа: способ кипячения с конденсацией и обратным стоком и золь-гелевый способ. Способ получения геля титаната натрия существенно не влияет на ионообменные качества титаната натрия по отношению к стронцию.
Для оценки степени ионообменной аффинности к стронцию используют коэффициент распределения Kd Коэффициент распределения Kd вычисляют по следующему уравнению: xH2O.
Предложенный в данном изобретении некристаллический титанат натрия представляет собой аморфный титанат натрия. Ниже будет рассмотрено, что комбинация титаната натрия с частично кристаллической слоистой структурой и аморфного титаната натрия достигается в результате гидротермальной обработки геля титаната натрия при определенных условиях. Получаемый титанат натрия с частично кристаллической слоистой структурой имеет уникальную картину дифракции рентгеновских лучей в кристаллической решетке, а также уникальные физические и химико-технологические характеристики.
Рецептура и способ получения предложенного в изобретении титаната натрия с частично кристаллической слоистой структурой разработаны с расчетом на максимально возможное увеличение его ионообменной емкости и селективности к стронцию. Способность поглощать стронций в процессе ионного обмена придана предложенному в изобретении титанату натрия путем специального подбора параметров гидротермальной обработки, позволяющих получить в итоге титанат натрия с частично кристаллической структурой. Переменными параметрами гидротермальной обработки, влияющими на кристалличность структуры продукта титаната натрия, а значит – и на его ионообменную емкость и селективность к стронцию, являются: температура гидротермальной обработки, длительность обработки и концентрация гидроокиси натрия в растворе, используемом при гидротермальной обработке. Дополнительное преимущество гидротермальной обработки заключается в том, что она делает титанат натрия практически нерастворимым в сильнощелочных растворах.
Гель титаната натрия для гидротермальной обработки получают различными способами. В примерах осуществления изобретения подробно описаны два способа: способ кипячения с конденсацией и обратным стоком и золь-гелевый способ. Способ получения геля титаната натрия существенно не влияет на ионообменные качества титаната натрия по отношению к стронцию.
Для оценки степени ионообменной аффинности к стронцию используют коэффициент распределения Kd Коэффициент распределения Kd вычисляют по следующему уравнению:Kd = (Ci – Cf)/CfЧ(V/W), где Ci и Cf – начальная и конечная концентрация ионов стронция или любого другого исследуемого элемента в растворе, V – начальный объем опытного раствора, и W – вес опытного образца ионита. Kd обычно выражают в мл/г. Коэффициент распределения Kd стронция определяют, вводя образец титаната натрия, имеющего известные характеристики, во взаимодействие с раствором, имеющим определенную концентрацию стронция, на определенное время, предпочтительно – на 24 часа. Коэффициент распределения Kd стронция зависит от состава раствора, поэтому следует отметить, что большинство приведенных в данном описании значений Kd было получено при следующих концентрациях компонентов раствора: 5 моль/л азотнокислого натрия, 0,1 моль/л гидроокиси натрия и 55 млн-1 стронция. Если указываемое значение коэффициента распределения Kd было получено при использовании стронцийсодержащего раствора с другими характеристиками, то при этом делается ссылка на состав этого раствора. Кроме того, коэффициент распределения Kd стронция зависит от размера образца ионита, поэтому следует отметить, что в каждом эксперименте, где рассчитывались значения Kd, использовали 20 мл раствора и 20 мг образца твердого ионита (отношение V/M равно 100 мл/г), если специально не указаны иные условия эксперимента. Авторами изобретения установлено, что коэффициент распределения Kd стронция при поглощении стронция титанатом натрия зависит от степени кристалличности структуры титаната натрия. Когда конечный титанат натрия имеет слишком упорядоченную кристаллическую структуру, массоперенос в титанате натрия будет замедлен, что означает уменьшение Kd стронция. Аналогичным образом, когда степень упорядоченности атомов в кристаллической структуре титаната натрия является недостаточно высокой, между слоями атомов титаната натрия не будет существовать межплоскостное расстояние, требуемое для хорошего поглощения стронция в процессе ионного обмена, и Kd стронция будет низким. Таким образом, признаком предложенного в данном изобретении титаната натрия является “частично кристаллическая” структура, т.е. структуру предложенного титаната натрия целенаправленно формируют в процессе гидротермальной обработки, контролируя межплоскостное расстояние и другие физические характеристики таким образом, чтобы обеспечить наибольший Kd при поглощении стронция частично кристаллическим титанатом натрия. Существуют, по меньшей мере, три физических показателя предложенного в изобретении титаната натрия с частично кристаллической слоистой структурой, определяющие степень его эффективности в качестве ионита, поглощающего стронций. Этими показателями являются коэффициент распределения Kd стронция, расстояние между плоскостями атомов в кристаллической решетке и ширина максимума отражения (001) на половине его высоты. Два последних показателя определяют рентгеноструктурным анализом предложенной частично кристаллической слоистой структуры титаната натрия. Взаимосвязь между межплоскостным расстоянием и углом отражения рентгеновских лучей установлена законом Брэгга: 2dsin 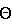 =n =n , ,где d – межплоскостное расстояние, в ангстремах, n – целое число,  – длина волны рентгеновского излучения, в ангстремах, и – длина волны рентгеновского излучения, в ангстремах, и 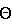 – угол отражения рентгеновских лучей, в градусах. Уравнение закона Брэгга служит полезным инструментом теоретического анализа результатов рентгеноструктурных исследований, так как картина расположения дифракционных полос зависит от 2 – угол отражения рентгеновских лучей, в градусах. Уравнение закона Брэгга служит полезным инструментом теоретического анализа результатов рентгеноструктурных исследований, так как картина расположения дифракционных полос зависит от 2 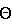 .
Расстояние между слоями титаната натрия, называемое межплоскостным расстоянием, определяют в процессе рентгеноструктурного анализа его кристаллической структуры и рассчитывают по уравнению Брэгга. Кристаллическая решетка титаната натрия состоит из слоев атомов титана и кислорода, разделенных пустотами, которые заполнены ионами натрия и водой. Межплоскостное расстояние – это расстояние от одного атома титана и кислорода до такого же атома в соседнем слое кристаллической решетки. Межплоскостное расстояние включает в себя толщину одного слоя титаната и толщину одной пустоты. С точки зрения достижения оптимальной ионообменной емкости по отношению к стронцию, предложенный в изобретении титанат натрия должен иметь межплоскостное расстояние, составляющее от 8 до 9,9 ангстрем, предпочтительно – от 9,0 до 9,9 ангстрем. Титанат натрия, имеющий требуемое межплоскостное расстояние, пропускает в себя гидратированный стронций, оставаясь закрытым для гидратированного натрия, и имеет коэффициент распределения Kd стронция свыше 20.000 мл/г.
Создание титаната натрия, структура которого имеет оптимальную, с точки зрения ионообменного поглощения стронция, кристалличность, явилось результатом работы авторов изобретения по изучению природы влияния гидротермальной обработки промежуточного продукта – гелей титаната натрия – на свойства кристаллической решетки конечного продукта – титаната натрия с частично кристаллической структурой. Эта работа привела к установлению того факта, что оптимальная кристалличность структуры, с точки зрения применения в качестве ионита по отношению к стронцию, характерна для нонатитаната натрия. Для количественной оценки оптимальной кристалличности структуры можно измерять ширину максимума отражения (001) на половине его высоты, выражаемую в градусах. Ширина максимума отражения (001) на половине его высоты обратно пропорциональна кристалличности структуры титаната натрия, т.е. чем больше ширина максимума отражения (001) на половине его высоты, тем менее кристалличной является структура материала. Высокие значения Kd стронция получают, когда ширина максимума отражения (001) на половине его высоты находится примерно между 1o и 4,5o, а предпочтительно – между 2o и 4,5o.
Способность предложенного титаната натрия с частично кристаллической структурой к селективному обмену своих ионов на ионы стронция обусловлена его слоистым строением. Между слоями частично кристаллического титаната натрия существуют промежутки, достаточно большие, чтобы принимать ионы гидратированного стронция, но вместе с тем достаточно маленькие, чтобы не пропускать ионы гидратированного натрия, и благодаря этому гидратированный натрий не конкурирует с гидратированным стронцием за свободные места в структуре ионита.
Удельная поверхность титаната натрия определяет интенсивность обмена ионами между ионитом и раствором. Чем больше удельная поверхность, тем интенсивнее поглощение стронция. Как правило, чем больше кристалличность структуры нонатитаната натрия, тем меньше его удельная поверхность. Так что в этом аспекте тоже существует тонкий баланс между кристалличностью структуры и интенсивностью ионного обмена. Предложенный в изобретении частично кристаллический титанат натрия должен иметь удельную поверхность, составляющую от 25 до 200 м2/г. При этом предпочтительным диапазоном значений удельной поверхности предложенного в изобретении титаната натрия является 60-110 м2/г.
Предложенные в изобретении титанаты натрия с частично кристаллической слоистой структурой можно получить, по меньшей мере, двумя способами: золь-гелевым способом и способом кипячения с конденсацией и обратным стоком. Оба способа позволяют получить гель титаната натрия, который затем должен быть подвергнут гидротермальной обработке, при которой происходит кристаллизация по меньшей мере части геля титаната натрия, с получением конечного титаната натрия с частично кристаллической слоистой структурой.
Параметры гидротермальной обработки, в том числе концентрация гидроокиси натрия, являются теми условиями, выполнение которых играет важную роль в получении частично кристаллического титаната натрия, имеющего желательные значения таких показателей, как коэффициент распределения Kd, межплоскостное расстояние и ширина максимума отражения (001) на половине его высоты.
Золь-гелевый способ приготовления геля титаната натрия включает в себя смешение изопропилата титана и метанола в весовой пропорции от 1:1 до 1:100 с образованием первой реакционной смеси. Вторую реакционную смесь готовят смешением гидроокиси натрия с метанолом в такой весовой пропорции, при которой гидроокись натрия полностью растворяется в метаноле. Первую реакционную смесь добавляют ко второй, после чего для инициирования гелеобразования медленно добавляют третью реакционную смесь, состоящую из воды и метанола. Конечную смесь желатинизируют от 15 минут до двух часов и больше. В предпочтительном варианте, реактор герметично изолирован и снабжен мешалкой, интенсивно перемешивающей реагенты в течение 30 минут или дольше, для поддержания геля титаната натрия в текучем состоянии. Затем растворитель и побочные продукты выпаривают из геля титаната натрия в вакуумной печи при температуре примерно от 40 до 80oC в течение 2-24 часов или дольше, до тех пор, пока растворитель метанол и побочный продукт реакции изопропанол не испарятся из геля титаната натрия.
Альтернативой этому способу и предпочтительным способом приготовления геля титаната натрия является способ кипячения с конденсацией и обратным стоком. Этот способ не предусматривает использования метанола, а его побочным продуктом является, соответственно исходным реагентам, только изопропанол. Благодаря этому выделение летучих веществ и отходов, образующихся при образовании геля титаната натрия, уменьшается, а восстановление растворителя становится более легким и менее энергоемким. На первой стадии кипячения с конденсацией и обратным стоком готовят раствор гидроокиси натрия, растворяя гранулы гидроокиси натрия в деионизированной воде, с получением первого раствора, содержащего от 10 до 19,2 моль/л гидроокиси натрия. Затем неразбавленный (99%-ный) изопропилат титана (TiP) медленно добавляют в первый раствор до тех пор, пока молярное отношение титана к натрию в смеси не составит от 1: 1 до 1:10, предпочтительно – от 1:5 до 1:9. Затем, для получения аморфного геля титаната натрия, смесь гидроокиси натрия и изопропилата титана подвергают кипячению при температуре 100-150oC с конденсацией и обратным стоком в течение 1-4 часов.
Для получения предложенного в изобретении титаната натрия с частично кристаллической слоистой структурой гель титаната натрия, приготовленный любым из двух рассмотренных способов, необходимо подвергнуть гидротермальной обработке. Такую гидротермальную обработку проводят в реакторе при избыточном давлении от 311 кПа (45 фунт на кв. дюйм) до 6900 кПа (1000 фунт на кв. дюйм) и температуре от 100 до 250oC. Продолжительность гидротермальной обработки титаната натрия колеблется от одного часа до одних суток и больше.
В процессе гидротермальной обработки вместе с повышением температуры в реакторе растет давление. Поэтому предпочтительное среднее избыточное давление в реакторе во время гидротермальной обработки составляет – в зависимости от температуры реакции – примерно от 345 кПа (50 фунт на кв. дюйм) до 2415 кПа (350 фунт на кв. дюйм). Гидротермальную обработку можно проводить в щелочных условиях, которые можно создать, добавив воду или раствору гидроокиси натрия в гель титаната натрия перед тем, как ввести гель в реактор для гидротермальной обработки, или автоклав, или после того. Для повышения кристалличности структуры частично кристаллического титаната натрия стадию гидротермальной обработки можно, по меньшей мере, однократно повторить.
Для получения титаната натрия с частично кристаллической слоистой структурой, обладающего существенными признаками настоящего изобретения, гидротермальную обработку в предпочтительном варианте проводят в течение 1-20 часов при температуре 160-200oC. При снижении температуры гидротермальной обработки с 200oC до 160oC самоустанавливающееся абсолютное давление в автоклаве снижается с 1704 кПа (247 фунт на кв. дюйм) до 621 кПа (90 фунт на кв. дюйм), что делает процесс более безопасным и позволяет применять менее дорогостоящее технологическое оборудование. Уменьшение длительности обработки с 20 до 5 часов повышает общую производительность процесса.
В некоторых случаях после гидротермальной обработки частично кристаллический титанат натрия имеет кристалличность, недостаточную для достижения физических качеств, необходимых с точки зрения настоящего изобретения. В такой ситуации, для достижения желательного уровня кристалличности, частично кристаллический титанат натрия можно подвергнуть гидротермальной обработке при указанных выше условиях второй раз, а возможно, и еще несколько раз.
Приведенные ниже в таблице 1 данные показывают, что коэффициент распределения Kd стронция для титаната натрия с частично кристаллической слоистой структурой в некоторых случаях можно повысить путем проведения второй гидротермальной обработки. Проведя гидротермальную обработку один, два и более раз, при точном соблюдении параметров гидротермальной обработки можно достичь оптимальной – с точки зрения наиболее полного поглощения стронция – кристалличности структуры титаната натрия.
Предложенный титанат натрия с частично кристаллической слоистой структурой имеет формулу Na3,4-4,4Ti8,4-9,2O18,5-20,6. Частично кристаллический титанат натрия извлекают из реактора, промывают деионизированной водой и отфильтровывают. Промытый продукт просушивают при температуре примерно от 50 до 100oC при продолжительности сушки, колеблющейся от трех часов до двух суток и больше.
Количество гидроокиси натрия, добавляемое в гель титаната натрия, может оказаться существенным параметром гидротермальной обработки, поэтому для достижения оптимальной – с точки зрения полного ионообменного поглощения стронция – кристалличности структуры титаната натрия, его нужно строго контролировать. Для получения частично кристаллического титаната натрия, имеющего межплоскостное расстояние примерно от 8 до 9,9 ангстрем и ширину максимума отражения (001) на половине его высоты, составляющую от 1o до 4,5o, концентрация гидроокиси натрия в растворе, добавляемом в гель титаната натрия во время гидротермальной обработки, должна составлять примерно от 0 до 6 моль/л, а предпочтительно – от 0,5 до 1,5 моль/л. Гель титаната натрия уже сам по себе содержит гидроокись натрия. Так что гидроокись натрия будет растворяться в любой воде, добавляемой в гель титаната натрия во время гидротермальной обработки этого геля. При этом водный раствор гидроокиси натрия с ее мольной концентрацией, соответствующей указанным выше интервалам значений, следует добавлять в гель титаната натрия предпочтительно перед гидролизом.
Оптимальная температура гидротермальной обработки составляет примерно от 100 до 250oC, предпочтительно – от 160 до 200oC. В конечном итоге, предпочтительное значение коэффициента распределения Kd стронция для частично кристаллического титаната натрия составляет как минимум 20.000 мл/г при том условии, что на 20 мл раствора с концентрацией азотнокислого натрия 5 моль/л, гидроокиси натрия – 0,1 моль/л и стронция – 55 млн-1, приходится 200 мг твердого ионита.
При использовании в качестве ионита предложенный частично кристаллический титанат натрия очень эффективен. Для того чтобы использовать порошковый частично кристаллический титанат натрия в качестве ионита, его, для уменьшения перепада давления в ионообменной колонне и для облегчения обращения с ним, необходимо связать в частицы большего размера. С этой целью может быть использовано любое связующее, широко применяемое в технике для связывания катализаторов и ионитов. Но нужно учитывать, что предложенный в изобретении связанный титанат натрия очень эффективен при удалении стронция и других радиоактивных отходов из высококаустических водных растворов. Поэтому следует отдавать предпочтение связующим из числа материалов, устойчивых к радиации и щелочным условиям, причем такой материал не должен затруднять или блокировать проникновение ионов стронция или других элементов в частично кристаллическую структуру титаната натрия. Предпочтительным является композиционный материал, состоящий из 40-95% (вес.) частично кристаллического титаната натрия и 5-60% (вес.) связующего.
Для получения связанного ионита для стронция частично кристаллический титанат натрия можно смешивать как с органическими, так и с неорганическими связующими. При использовании в области удаления радиоактивных отходов неорганические связующие имеют преимущество с их более высокой устойчивостью к радиации. В других областях применения предпочтение может быть отдано органическим связующим, которые легче, чем неорганические, поддаются гранулированию и таблетированию.
Примерами неорганических связующих являются: двуокись кремния или силикагель, карбид кремния, глины и силикаты, включая синтезированные и встречающиеся в природе силикаты, которые могут быть подвергнуты или не подвергнуты кислотной обработке, например, аттапульговая глина, каолин, диатомовая земля, фуллерова земля и т.д.; керамика, фарфор, раскрошенный огнеупорный кирпич, боксит; огнеупорные неорганические окислы, такие как окись алюминия, двуокись титана, двуокись циркония, окись хрома, окись бериллия, окись ванадия, окись церия, окись гафния, окись цинка, окись магния, окись бора, окись тория, система двуокиси кремния и окиси алюминия (силлиманит, муллит), система двуокиси кремния и окиси магния, система окиси хрома и окиси алюминия, система окиси алюминия и окиси бора, система двуокиси кремния и двуокиси циркония (циркон) и т.д.; кристаллические цеолитовые алюмосиликаты, такие как встречающийся в природе и синтезированный мордернит и/или фуязит, например, содержащие водород или катионы металла, заместившие водород; шпинели, такие как MgAl2O4, AnAl2O4, CaAl2O4 и другие аналогичные соединения; а также материалы из одной или нескольких указанных групп в сочетании друг с другом.
Другими примерами неорганических связующих являются различные металлические соли в форме порошка, золя или геля. Также для связывания титаната натрия любого типа можно использовать графит и гидроцемент. Кроме того, хорошими связующими для титаната натрия являются алюминат кальция (глиноземистый цемент марки “Ciment Fondu XR”), портландцемент типа III (быстротвердеющий), обладающие отличной прочностью и стойкостью в высокощелочной среде. Когда в качестве связующего используются цементы, связанный титанат натрия можно формовать в виде таблеток с помощью соответствующих пресс-форм или экструдеров.
Для связывания частично кристаллического титаната натрия также можно использовать органические связующие. К органическим связующим относятся полимеры, крахмалы, целлюлоза, ацетат целлюлозы и другие известные органические связующие катализаторов и ионитов.
Для улучшения пористости и увеличения удельной поверхности в частично кристаллический титанат натрия перед его связыванием, во время связывания или после него, можно вводить порообразующие добавки, добавки, увеличивающие удельную поверхность, и другие материалы. Предпочтительным порообразователем является такой, который можно удалить из ионита химическим или термическим путем перед использованием связанного материала в качестве ионита.
Предпочтительным связующим является гидролизуемое титановое соединение. Гидролизуемое титановое соединение эффективно в качестве связующего для титанатов натрия в любой форме, в том числе кристаллических титанатов натрия, кристаллических титановых кислот, и предпочтительного с точки зрения настоящего изобретения частично кристаллического титаната натрия. Согласно данному изобретению, используемое в качестве связующего гидролизуемое титановое соединение должно иметь формулу TiXXIXIIXIII, где X – любой элемент, а каждый из компонентов XI, XII и XIII выбран из группы, в которую входят Cl, Br, I, группа OR, где R – любая ацильная или алкильная группа, содержащая 10 атомов углерода, и где R может иметь одну или две связи с титаном и кислородом.
К предпочтительным гидролизуемым титановым соединениям относятся алкоголяты и особенно изопропилат титана. Гидролизуемое титановое соединение предпочтительно используют для фиксации формы кристаллического титаната натрия, который является эффективным ионитом по отношению к стронцию, так как получаемое в итоге связующее в виде двуокиси титана оказывает совсем незначительное отрицательное влияние на Kd стронция ионита в связанном состоянии. Предпочтительным кристаллическим титанатом натрия является частично кристаллический титанат натрия, имеющий формулу Na3,4-4,4Ti8,4-9,2O18,5-20,6, межплоскостное расстояние от 8,0 до 9,9 ангстрем и ширину максимума отражения (001) на половине его высоты, составляющую примерно от 1o до 4,5o.
При связывании ионита смешивают гидролизуемое титановое соединение, предпочтительно – изопропилат титана, и кристаллический титанат натрия, и под действием воды из воздуха и кристаллического титаната натрия происходит медленное гидролитическое расщепление гидролизуемого титанового соединения, результатом которого является образование кристаллического титаната натрия, связанного двуокисью титана.
Кристаллический титанат натрия, связанный двуокисью титана, можно просушить при атмосферных условиях или в сушильной печи. Предпочтительным способом сушки кристаллического титаната натрия, связанного двуокисью титана, является сушка в печи при температуре примерно от 75 до 100oC продолжительностью, колеблющейся от 1 до 12 часов или больше.
Высушенный кристаллический титанат натрия, связанный двуокисью титана, можно использовать в качестве ионита сразу, без дополнительной обработки, можно мелко размолоть и просеять для использования, а также можно подвергнуть дальнейшей обработке с целью улучшения его механических качеств. В данном случае предпочтение отдается дополнительной обработке кристаллического титаната натрия, связанного двуокисью титана, первым этапом которой является прессование, а вторым – кальцинация. Высушенный кристаллический титанат натрия, связанный двуокисью титана, можно прессовать сразу после его получения, либо сначала раскрошить до состояния мелкой крошки или размолоть в порошок, а затем уже прессовать. В данном случае предпочтительно сначала перемолоть высушенный кристаллический титанат натрия, связанный двуокисью титана, с получением мелких частиц, которые затем можно легко прессовать.
Прессование кристаллического титаната натрия, связанного двуокисью титана, можно проводить на любом оборудовании для прессования порошков, которое, как известно, включает в себя литьевые прессы, таблеточные прессы и экструдеры. Литьевой пресс включает в себя собственно пресс с механическим или гидравлическим приводом и пресс-форму, состоящую из двух прикрепленных к плитам пресса частей, при этом одна часть входит внутрь другой. Под действием давления и нагрева твердые частицы плавятся и заполняют объем пресс-формы.
Таблеточные прессы придают формуемому материалу более простые формы и имеют более высокую, по сравнению с литьевыми прессами, производительность. Однопозиционный пресс – это такой пресс, который работает в фиксированном положении и состоит из верхнего пуансона, нижнего пуансона и пресс-формы. В роторных прессах используется роторный держатель с несколькими пуансонами и пресс-формами. Более старые роторные установки являются односторонними, т.е. в них имеется одна позиция загрузки пресс-материала в пресс-формы и одна позиция прессования, при этом за один оборот ротора формуется одна таблетка. Современные же высокоскоростные роторные установки являются двусторонними, т. е. в них имеется две позиции загрузки пресс-материала в пресс-формы и две позиции прессования, при этом за один оборот ротора формуется две таблетки.
Кристаллический титанат натрия, связанный двуокисью титана, можно гранулировать сухим способом. При сухом гранулировании смешанные в сухом состоянии ингредиенты сначала уплотняют на вращающемся таблеточном прессе большой мощности, получая таблетки. Эти таблетки впоследствии размалывают, получая частицы заданного размера, необходимого для нормального осуществления ионного обмена. Уплотнение можно также проводить с использованием роторной линии прессования и гранулирования. Третий способ уплотнения – способ прямого прессования – предусматривает использование сложного оборудования для подачи смешанных сухих ингредиентов непосредственно в высокоскоростной ротационный пресс-автомат.
Для таблетирования кристаллического титаната натрия, связанного двуокисью титана, также можно использовать валковые прессы, подавая порошок в зазор между двумя валками, вращающимися с одинаковой скоростью. Размер и форма получаемых таблеток определяются геометрией поверхностей валков. Попадая в выемки или углубления на поверхностях валков, порошок образует брикеты массой от нескольких грамм до 2,23 кг (5 фунтов) и больше. На валках с гладкой или рифленой поверхностью получают сплошной лист, который затем можно раздробить до желательного размера частиц на обычном оборудовании для измельчения.
Смазывающие агенты, добавляемые в прессуемый порошок, способствуют лучшей передаче на частицы уплотняющих сил и уменьшают прилипание материала к поверхностям пресс-форм. Перед прессованием кристаллического титаната натрия, связанного двуокисью титана, в него можно ввести смазывающие агенты, которые удаляются из связующего при температурах кальцинации. К таким смазывающим агентам относятся: борная кислота, графит, различные масла, мыло, крахмал, стеариновая кислота и воск. Предпочтительным смазывающим агентом является стеариновая кислота, а ее содержание в направляемом на прессование порошке предпочтительно составляет примерно 0,1-4,0% (вес.).
На этапе прессования должны быть получены таблетки или брикеты уплотненного материала с плотностью примерно 1,5-2,5 г/мл. Наиболее предпочтительные значения плотности прессованных частиц кристаллического титаната натрия, связанного двуокисью титана, находятся в интервале от 1,8 до 2,2 г/мл.
Прессованные частицы кристаллического титаната натрия, связанного двуокисью титана, подвергают кальцинации при температуре примерно от 150 до 500oC продолжительностью от 30 минут до 10 часов или дольше. Предпочтительным вариантом кальцинации частиц является прокаливание в присутствии воздуха при температуре примерно от 200 до 400oC продолжительностью примерно от 30 минут до 5 часов. Наиболее предпочтительно проводить кальцинацию частиц при указанных выше условиях во влажном воздухе.
Использование ионитов на основе связанного и несвязанного титаната натрия дает положительный эффект при удалении стронция и других радиоактивных и нерадиоактивных металлов из водных растворов, когда связанный или несвязанный титанат натрия загружают в колонну и орошают его потоком подаваемого в колонну водного раствора, в результате чего происходит извлечение заданных металлов из этого раствора. При использовании такой технологической схемы кристаллический титанат натрия способен поглощать металлы из больших объемов водных растворов. Иониты на основе титаната натрия можно также регенерировать кислотой и повторно использовать без потери их эффективности. Кроме того, связанный кристаллический титанат натрия способен без существенной потери своей ионообменной емкости или целостности физической структуры удалять стронций из орошающих водных растворов, в которых pH составляет, по меньшей мере, от 9,95 до 13 или больше, а мольная концентрация ионов натрия составляет примерно от 1,0 до 5,0 моль/л.
Ионообменные колонны, используемые для обработки радиоактивных отходов, должны быть выполнены из стекла и могут иметь полимерное покрытие для защиты от едкой среды. После израсходования ионита титанат натрия вместе со стеклянной колонной может быть остеклован для надежной изоляции радиоактивного стронция.
Предложенный в изобретении несвязанный и связанный титанат натрия эффективен как ионит, используемый для поглощения металлов, отличных от стронция. В частности, титанат натрия, как в несвязанном, так и в связанном состоянии, эффективно удаляет из водных растворов актиниды, особенно уран. В число других актинидов, которые могут аналогичным образом удаляться титанатом натрия, входят торий, плутоний и америций.
Титанат натрия можно использовать в качестве ионита без замещения натрия водородом или можно преобразовать в титановую кислоту и использовать в качестве ионита, поглощающего ионы таких металлов, как иттербий, цирконий, молибден, серебро, таллий, свинец, хром, ванадий, железо, цезий, олово, мышьяк, а также других металлов с высокой аффинностью к титановой кислоте.
Предложенный в изобретении титанат натрия, как в несвязанном, так и в связанном состоянии, также эффективно поглощает в щелочных условиях широкий круг металлов. Эти металлы перечислены в приведенной ниже таблице 2 с убыванием по их интенсивности их ионообменного поглощения титанатом натрия. Например, литий, магний, никель, кобальт и барий поглощаются титанатом натрия при ионном обмене в более высоких количествах, чем стронций. Среди металлов, вносящих основной вклад в загрязнение окружающей среды, частично кристаллический титанат натрия имеет высокую аффинность к цинку, меди, кадмию, ртути, таллию и свинцу. Среди исследованных благородных металлов очень хорошо поглощается титанатом натрия серебро. Приведенные в таблице 2 данные показывают, что титанат натрия можно использовать для удаления металлов из промышленных сточных вод и других отходов, содержащих растворенные в воде металлы, а также для извлечения заданных материалов.
Указанные в таблице 2 результаты ионного обмена получены при использовании 200 мг титаната натрия (образец 5-1 из рассматриваемого ниже примера 5), 20 мл водного раствора, с концентрацией ионов удаляемого металла, равной 20 млн-1, при щелочных условиях (pH 10-11). Во всех образцах присутствовал натрий, и приведенные результаты иллюстрируют высокую селективность титаната натрия к ионам указанных металлов на фоне натрия. Титанат натрия эффективен только в качестве катионита, поэтому при высоких pH он проявлял слабую активность при ионном обмене с растворами, содержавшими ионы некоторых металлов, в числе которых мышьяк, сурьма, молибден и свинец.
Пример 1 .
Расстояние между слоями титаната натрия, называемое межплоскостным расстоянием, определяют в процессе рентгеноструктурного анализа его кристаллической структуры и рассчитывают по уравнению Брэгга. Кристаллическая решетка титаната натрия состоит из слоев атомов титана и кислорода, разделенных пустотами, которые заполнены ионами натрия и водой. Межплоскостное расстояние – это расстояние от одного атома титана и кислорода до такого же атома в соседнем слое кристаллической решетки. Межплоскостное расстояние включает в себя толщину одного слоя титаната и толщину одной пустоты. С точки зрения достижения оптимальной ионообменной емкости по отношению к стронцию, предложенный в изобретении титанат натрия должен иметь межплоскостное расстояние, составляющее от 8 до 9,9 ангстрем, предпочтительно – от 9,0 до 9,9 ангстрем. Титанат натрия, имеющий требуемое межплоскостное расстояние, пропускает в себя гидратированный стронций, оставаясь закрытым для гидратированного натрия, и имеет коэффициент распределения Kd стронция свыше 20.000 мл/г.
Создание титаната натрия, структура которого имеет оптимальную, с точки зрения ионообменного поглощения стронция, кристалличность, явилось результатом работы авторов изобретения по изучению природы влияния гидротермальной обработки промежуточного продукта – гелей титаната натрия – на свойства кристаллической решетки конечного продукта – титаната натрия с частично кристаллической структурой. Эта работа привела к установлению того факта, что оптимальная кристалличность структуры, с точки зрения применения в качестве ионита по отношению к стронцию, характерна для нонатитаната натрия. Для количественной оценки оптимальной кристалличности структуры можно измерять ширину максимума отражения (001) на половине его высоты, выражаемую в градусах. Ширина максимума отражения (001) на половине его высоты обратно пропорциональна кристалличности структуры титаната натрия, т.е. чем больше ширина максимума отражения (001) на половине его высоты, тем менее кристалличной является структура материала. Высокие значения Kd стронция получают, когда ширина максимума отражения (001) на половине его высоты находится примерно между 1o и 4,5o, а предпочтительно – между 2o и 4,5o.
Способность предложенного титаната натрия с частично кристаллической структурой к селективному обмену своих ионов на ионы стронция обусловлена его слоистым строением. Между слоями частично кристаллического титаната натрия существуют промежутки, достаточно большие, чтобы принимать ионы гидратированного стронция, но вместе с тем достаточно маленькие, чтобы не пропускать ионы гидратированного натрия, и благодаря этому гидратированный натрий не конкурирует с гидратированным стронцием за свободные места в структуре ионита.
Удельная поверхность титаната натрия определяет интенсивность обмена ионами между ионитом и раствором. Чем больше удельная поверхность, тем интенсивнее поглощение стронция. Как правило, чем больше кристалличность структуры нонатитаната натрия, тем меньше его удельная поверхность. Так что в этом аспекте тоже существует тонкий баланс между кристалличностью структуры и интенсивностью ионного обмена. Предложенный в изобретении частично кристаллический титанат натрия должен иметь удельную поверхность, составляющую от 25 до 200 м2/г. При этом предпочтительным диапазоном значений удельной поверхности предложенного в изобретении титаната натрия является 60-110 м2/г.
Предложенные в изобретении титанаты натрия с частично кристаллической слоистой структурой можно получить, по меньшей мере, двумя способами: золь-гелевым способом и способом кипячения с конденсацией и обратным стоком. Оба способа позволяют получить гель титаната натрия, который затем должен быть подвергнут гидротермальной обработке, при которой происходит кристаллизация по меньшей мере части геля титаната натрия, с получением конечного титаната натрия с частично кристаллической слоистой структурой.
Параметры гидротермальной обработки, в том числе концентрация гидроокиси натрия, являются теми условиями, выполнение которых играет важную роль в получении частично кристаллического титаната натрия, имеющего желательные значения таких показателей, как коэффициент распределения Kd, межплоскостное расстояние и ширина максимума отражения (001) на половине его высоты.
Золь-гелевый способ приготовления геля титаната натрия включает в себя смешение изопропилата титана и метанола в весовой пропорции от 1:1 до 1:100 с образованием первой реакционной смеси. Вторую реакционную смесь готовят смешением гидроокиси натрия с метанолом в такой весовой пропорции, при которой гидроокись натрия полностью растворяется в метаноле. Первую реакционную смесь добавляют ко второй, после чего для инициирования гелеобразования медленно добавляют третью реакционную смесь, состоящую из воды и метанола. Конечную смесь желатинизируют от 15 минут до двух часов и больше. В предпочтительном варианте, реактор герметично изолирован и снабжен мешалкой, интенсивно перемешивающей реагенты в течение 30 минут или дольше, для поддержания геля титаната натрия в текучем состоянии. Затем растворитель и побочные продукты выпаривают из геля титаната натрия в вакуумной печи при температуре примерно от 40 до 80oC в течение 2-24 часов или дольше, до тех пор, пока растворитель метанол и побочный продукт реакции изопропанол не испарятся из геля титаната натрия.
Альтернативой этому способу и предпочтительным способом приготовления геля титаната натрия является способ кипячения с конденсацией и обратным стоком. Этот способ не предусматривает использования метанола, а его побочным продуктом является, соответственно исходным реагентам, только изопропанол. Благодаря этому выделение летучих веществ и отходов, образующихся при образовании геля титаната натрия, уменьшается, а восстановление растворителя становится более легким и менее энергоемким. На первой стадии кипячения с конденсацией и обратным стоком готовят раствор гидроокиси натрия, растворяя гранулы гидроокиси натрия в деионизированной воде, с получением первого раствора, содержащего от 10 до 19,2 моль/л гидроокиси натрия. Затем неразбавленный (99%-ный) изопропилат титана (TiP) медленно добавляют в первый раствор до тех пор, пока молярное отношение титана к натрию в смеси не составит от 1: 1 до 1:10, предпочтительно – от 1:5 до 1:9. Затем, для получения аморфного геля титаната натрия, смесь гидроокиси натрия и изопропилата титана подвергают кипячению при температуре 100-150oC с конденсацией и обратным стоком в течение 1-4 часов.
Для получения предложенного в изобретении титаната натрия с частично кристаллической слоистой структурой гель титаната натрия, приготовленный любым из двух рассмотренных способов, необходимо подвергнуть гидротермальной обработке. Такую гидротермальную обработку проводят в реакторе при избыточном давлении от 311 кПа (45 фунт на кв. дюйм) до 6900 кПа (1000 фунт на кв. дюйм) и температуре от 100 до 250oC. Продолжительность гидротермальной обработки титаната натрия колеблется от одного часа до одних суток и больше.
В процессе гидротермальной обработки вместе с повышением температуры в реакторе растет давление. Поэтому предпочтительное среднее избыточное давление в реакторе во время гидротермальной обработки составляет – в зависимости от температуры реакции – примерно от 345 кПа (50 фунт на кв. дюйм) до 2415 кПа (350 фунт на кв. дюйм). Гидротермальную обработку можно проводить в щелочных условиях, которые можно создать, добавив воду или раствору гидроокиси натрия в гель титаната натрия перед тем, как ввести гель в реактор для гидротермальной обработки, или автоклав, или после того. Для повышения кристалличности структуры частично кристаллического титаната натрия стадию гидротермальной обработки можно, по меньшей мере, однократно повторить.
Для получения титаната натрия с частично кристаллической слоистой структурой, обладающего существенными признаками настоящего изобретения, гидротермальную обработку в предпочтительном варианте проводят в течение 1-20 часов при температуре 160-200oC. При снижении температуры гидротермальной обработки с 200oC до 160oC самоустанавливающееся абсолютное давление в автоклаве снижается с 1704 кПа (247 фунт на кв. дюйм) до 621 кПа (90 фунт на кв. дюйм), что делает процесс более безопасным и позволяет применять менее дорогостоящее технологическое оборудование. Уменьшение длительности обработки с 20 до 5 часов повышает общую производительность процесса.
В некоторых случаях после гидротермальной обработки частично кристаллический титанат натрия имеет кристалличность, недостаточную для достижения физических качеств, необходимых с точки зрения настоящего изобретения. В такой ситуации, для достижения желательного уровня кристалличности, частично кристаллический титанат натрия можно подвергнуть гидротермальной обработке при указанных выше условиях второй раз, а возможно, и еще несколько раз.
Приведенные ниже в таблице 1 данные показывают, что коэффициент распределения Kd стронция для титаната натрия с частично кристаллической слоистой структурой в некоторых случаях можно повысить путем проведения второй гидротермальной обработки. Проведя гидротермальную обработку один, два и более раз, при точном соблюдении параметров гидротермальной обработки можно достичь оптимальной – с точки зрения наиболее полного поглощения стронция – кристалличности структуры титаната натрия.
Предложенный титанат натрия с частично кристаллической слоистой структурой имеет формулу Na3,4-4,4Ti8,4-9,2O18,5-20,6. Частично кристаллический титанат натрия извлекают из реактора, промывают деионизированной водой и отфильтровывают. Промытый продукт просушивают при температуре примерно от 50 до 100oC при продолжительности сушки, колеблющейся от трех часов до двух суток и больше.
Количество гидроокиси натрия, добавляемое в гель титаната натрия, может оказаться существенным параметром гидротермальной обработки, поэтому для достижения оптимальной – с точки зрения полного ионообменного поглощения стронция – кристалличности структуры титаната натрия, его нужно строго контролировать. Для получения частично кристаллического титаната натрия, имеющего межплоскостное расстояние примерно от 8 до 9,9 ангстрем и ширину максимума отражения (001) на половине его высоты, составляющую от 1o до 4,5o, концентрация гидроокиси натрия в растворе, добавляемом в гель титаната натрия во время гидротермальной обработки, должна составлять примерно от 0 до 6 моль/л, а предпочтительно – от 0,5 до 1,5 моль/л. Гель титаната натрия уже сам по себе содержит гидроокись натрия. Так что гидроокись натрия будет растворяться в любой воде, добавляемой в гель титаната натрия во время гидротермальной обработки этого геля. При этом водный раствор гидроокиси натрия с ее мольной концентрацией, соответствующей указанным выше интервалам значений, следует добавлять в гель титаната натрия предпочтительно перед гидролизом.
Оптимальная температура гидротермальной обработки составляет примерно от 100 до 250oC, предпочтительно – от 160 до 200oC. В конечном итоге, предпочтительное значение коэффициента распределения Kd стронция для частично кристаллического титаната натрия составляет как минимум 20.000 мл/г при том условии, что на 20 мл раствора с концентрацией азотнокислого натрия 5 моль/л, гидроокиси натрия – 0,1 моль/л и стронция – 55 млн-1, приходится 200 мг твердого ионита.
При использовании в качестве ионита предложенный частично кристаллический титанат натрия очень эффективен. Для того чтобы использовать порошковый частично кристаллический титанат натрия в качестве ионита, его, для уменьшения перепада давления в ионообменной колонне и для облегчения обращения с ним, необходимо связать в частицы большего размера. С этой целью может быть использовано любое связующее, широко применяемое в технике для связывания катализаторов и ионитов. Но нужно учитывать, что предложенный в изобретении связанный титанат натрия очень эффективен при удалении стронция и других радиоактивных отходов из высококаустических водных растворов. Поэтому следует отдавать предпочтение связующим из числа материалов, устойчивых к радиации и щелочным условиям, причем такой материал не должен затруднять или блокировать проникновение ионов стронция или других элементов в частично кристаллическую структуру титаната натрия. Предпочтительным является композиционный материал, состоящий из 40-95% (вес.) частично кристаллического титаната натрия и 5-60% (вес.) связующего.
Для получения связанного ионита для стронция частично кристаллический титанат натрия можно смешивать как с органическими, так и с неорганическими связующими. При использовании в области удаления радиоактивных отходов неорганические связующие имеют преимущество с их более высокой устойчивостью к радиации. В других областях применения предпочтение может быть отдано органическим связующим, которые легче, чем неорганические, поддаются гранулированию и таблетированию.
Примерами неорганических связующих являются: двуокись кремния или силикагель, карбид кремния, глины и силикаты, включая синтезированные и встречающиеся в природе силикаты, которые могут быть подвергнуты или не подвергнуты кислотной обработке, например, аттапульговая глина, каолин, диатомовая земля, фуллерова земля и т.д.; керамика, фарфор, раскрошенный огнеупорный кирпич, боксит; огнеупорные неорганические окислы, такие как окись алюминия, двуокись титана, двуокись циркония, окись хрома, окись бериллия, окись ванадия, окись церия, окись гафния, окись цинка, окись магния, окись бора, окись тория, система двуокиси кремния и окиси алюминия (силлиманит, муллит), система двуокиси кремния и окиси магния, система окиси хрома и окиси алюминия, система окиси алюминия и окиси бора, система двуокиси кремния и двуокиси циркония (циркон) и т.д.; кристаллические цеолитовые алюмосиликаты, такие как встречающийся в природе и синтезированный мордернит и/или фуязит, например, содержащие водород или катионы металла, заместившие водород; шпинели, такие как MgAl2O4, AnAl2O4, CaAl2O4 и другие аналогичные соединения; а также материалы из одной или нескольких указанных групп в сочетании друг с другом.
Другими примерами неорганических связующих являются различные металлические соли в форме порошка, золя или геля. Также для связывания титаната натрия любого типа можно использовать графит и гидроцемент. Кроме того, хорошими связующими для титаната натрия являются алюминат кальция (глиноземистый цемент марки “Ciment Fondu XR”), портландцемент типа III (быстротвердеющий), обладающие отличной прочностью и стойкостью в высокощелочной среде. Когда в качестве связующего используются цементы, связанный титанат натрия можно формовать в виде таблеток с помощью соответствующих пресс-форм или экструдеров.
Для связывания частично кристаллического титаната натрия также можно использовать органические связующие. К органическим связующим относятся полимеры, крахмалы, целлюлоза, ацетат целлюлозы и другие известные органические связующие катализаторов и ионитов.
Для улучшения пористости и увеличения удельной поверхности в частично кристаллический титанат натрия перед его связыванием, во время связывания или после него, можно вводить порообразующие добавки, добавки, увеличивающие удельную поверхность, и другие материалы. Предпочтительным порообразователем является такой, который можно удалить из ионита химическим или термическим путем перед использованием связанного материала в качестве ионита.
Предпочтительным связующим является гидролизуемое титановое соединение. Гидролизуемое титановое соединение эффективно в качестве связующего для титанатов натрия в любой форме, в том числе кристаллических титанатов натрия, кристаллических титановых кислот, и предпочтительного с точки зрения настоящего изобретения частично кристаллического титаната натрия. Согласно данному изобретению, используемое в качестве связующего гидролизуемое титановое соединение должно иметь формулу TiXXIXIIXIII, где X – любой элемент, а каждый из компонентов XI, XII и XIII выбран из группы, в которую входят Cl, Br, I, группа OR, где R – любая ацильная или алкильная группа, содержащая 10 атомов углерода, и где R может иметь одну или две связи с титаном и кислородом.
К предпочтительным гидролизуемым титановым соединениям относятся алкоголяты и особенно изопропилат титана. Гидролизуемое титановое соединение предпочтительно используют для фиксации формы кристаллического титаната натрия, который является эффективным ионитом по отношению к стронцию, так как получаемое в итоге связующее в виде двуокиси титана оказывает совсем незначительное отрицательное влияние на Kd стронция ионита в связанном состоянии. Предпочтительным кристаллическим титанатом натрия является частично кристаллический титанат натрия, имеющий формулу Na3,4-4,4Ti8,4-9,2O18,5-20,6, межплоскостное расстояние от 8,0 до 9,9 ангстрем и ширину максимума отражения (001) на половине его высоты, составляющую примерно от 1o до 4,5o.
При связывании ионита смешивают гидролизуемое титановое соединение, предпочтительно – изопропилат титана, и кристаллический титанат натрия, и под действием воды из воздуха и кристаллического титаната натрия происходит медленное гидролитическое расщепление гидролизуемого титанового соединения, результатом которого является образование кристаллического титаната натрия, связанного двуокисью титана.
Кристаллический титанат натрия, связанный двуокисью титана, можно просушить при атмосферных условиях или в сушильной печи. Предпочтительным способом сушки кристаллического титаната натрия, связанного двуокисью титана, является сушка в печи при температуре примерно от 75 до 100oC продолжительностью, колеблющейся от 1 до 12 часов или больше.
Высушенный кристаллический титанат натрия, связанный двуокисью титана, можно использовать в качестве ионита сразу, без дополнительной обработки, можно мелко размолоть и просеять для использования, а также можно подвергнуть дальнейшей обработке с целью улучшения его механических качеств. В данном случае предпочтение отдается дополнительной обработке кристаллического титаната натрия, связанного двуокисью титана, первым этапом которой является прессование, а вторым – кальцинация. Высушенный кристаллический титанат натрия, связанный двуокисью титана, можно прессовать сразу после его получения, либо сначала раскрошить до состояния мелкой крошки или размолоть в порошок, а затем уже прессовать. В данном случае предпочтительно сначала перемолоть высушенный кристаллический титанат натрия, связанный двуокисью титана, с получением мелких частиц, которые затем можно легко прессовать.
Прессование кристаллического титаната натрия, связанного двуокисью титана, можно проводить на любом оборудовании для прессования порошков, которое, как известно, включает в себя литьевые прессы, таблеточные прессы и экструдеры. Литьевой пресс включает в себя собственно пресс с механическим или гидравлическим приводом и пресс-форму, состоящую из двух прикрепленных к плитам пресса частей, при этом одна часть входит внутрь другой. Под действием давления и нагрева твердые частицы плавятся и заполняют объем пресс-формы.
Таблеточные прессы придают формуемому материалу более простые формы и имеют более высокую, по сравнению с литьевыми прессами, производительность. Однопозиционный пресс – это такой пресс, который работает в фиксированном положении и состоит из верхнего пуансона, нижнего пуансона и пресс-формы. В роторных прессах используется роторный держатель с несколькими пуансонами и пресс-формами. Более старые роторные установки являются односторонними, т.е. в них имеется одна позиция загрузки пресс-материала в пресс-формы и одна позиция прессования, при этом за один оборот ротора формуется одна таблетка. Современные же высокоскоростные роторные установки являются двусторонними, т. е. в них имеется две позиции загрузки пресс-материала в пресс-формы и две позиции прессования, при этом за один оборот ротора формуется две таблетки.
Кристаллический титанат натрия, связанный двуокисью титана, можно гранулировать сухим способом. При сухом гранулировании смешанные в сухом состоянии ингредиенты сначала уплотняют на вращающемся таблеточном прессе большой мощности, получая таблетки. Эти таблетки впоследствии размалывают, получая частицы заданного размера, необходимого для нормального осуществления ионного обмена. Уплотнение можно также проводить с использованием роторной линии прессования и гранулирования. Третий способ уплотнения – способ прямого прессования – предусматривает использование сложного оборудования для подачи смешанных сухих ингредиентов непосредственно в высокоскоростной ротационный пресс-автомат.
Для таблетирования кристаллического титаната натрия, связанного двуокисью титана, также можно использовать валковые прессы, подавая порошок в зазор между двумя валками, вращающимися с одинаковой скоростью. Размер и форма получаемых таблеток определяются геометрией поверхностей валков. Попадая в выемки или углубления на поверхностях валков, порошок образует брикеты массой от нескольких грамм до 2,23 кг (5 фунтов) и больше. На валках с гладкой или рифленой поверхностью получают сплошной лист, который затем можно раздробить до желательного размера частиц на обычном оборудовании для измельчения.
Смазывающие агенты, добавляемые в прессуемый порошок, способствуют лучшей передаче на частицы уплотняющих сил и уменьшают прилипание материала к поверхностям пресс-форм. Перед прессованием кристаллического титаната натрия, связанного двуокисью титана, в него можно ввести смазывающие агенты, которые удаляются из связующего при температурах кальцинации. К таким смазывающим агентам относятся: борная кислота, графит, различные масла, мыло, крахмал, стеариновая кислота и воск. Предпочтительным смазывающим агентом является стеариновая кислота, а ее содержание в направляемом на прессование порошке предпочтительно составляет примерно 0,1-4,0% (вес.).
На этапе прессования должны быть получены таблетки или брикеты уплотненного материала с плотностью примерно 1,5-2,5 г/мл. Наиболее предпочтительные значения плотности прессованных частиц кристаллического титаната натрия, связанного двуокисью титана, находятся в интервале от 1,8 до 2,2 г/мл.
Прессованные частицы кристаллического титаната натрия, связанного двуокисью титана, подвергают кальцинации при температуре примерно от 150 до 500oC продолжительностью от 30 минут до 10 часов или дольше. Предпочтительным вариантом кальцинации частиц является прокаливание в присутствии воздуха при температуре примерно от 200 до 400oC продолжительностью примерно от 30 минут до 5 часов. Наиболее предпочтительно проводить кальцинацию частиц при указанных выше условиях во влажном воздухе.
Использование ионитов на основе связанного и несвязанного титаната натрия дает положительный эффект при удалении стронция и других радиоактивных и нерадиоактивных металлов из водных растворов, когда связанный или несвязанный титанат натрия загружают в колонну и орошают его потоком подаваемого в колонну водного раствора, в результате чего происходит извлечение заданных металлов из этого раствора. При использовании такой технологической схемы кристаллический титанат натрия способен поглощать металлы из больших объемов водных растворов. Иониты на основе титаната натрия можно также регенерировать кислотой и повторно использовать без потери их эффективности. Кроме того, связанный кристаллический титанат натрия способен без существенной потери своей ионообменной емкости или целостности физической структуры удалять стронций из орошающих водных растворов, в которых pH составляет, по меньшей мере, от 9,95 до 13 или больше, а мольная концентрация ионов натрия составляет примерно от 1,0 до 5,0 моль/л.
Ионообменные колонны, используемые для обработки радиоактивных отходов, должны быть выполнены из стекла и могут иметь полимерное покрытие для защиты от едкой среды. После израсходования ионита титанат натрия вместе со стеклянной колонной может быть остеклован для надежной изоляции радиоактивного стронция.
Предложенный в изобретении несвязанный и связанный титанат натрия эффективен как ионит, используемый для поглощения металлов, отличных от стронция. В частности, титанат натрия, как в несвязанном, так и в связанном состоянии, эффективно удаляет из водных растворов актиниды, особенно уран. В число других актинидов, которые могут аналогичным образом удаляться титанатом натрия, входят торий, плутоний и америций.
Титанат натрия можно использовать в качестве ионита без замещения натрия водородом или можно преобразовать в титановую кислоту и использовать в качестве ионита, поглощающего ионы таких металлов, как иттербий, цирконий, молибден, серебро, таллий, свинец, хром, ванадий, железо, цезий, олово, мышьяк, а также других металлов с высокой аффинностью к титановой кислоте.
Предложенный в изобретении титанат натрия, как в несвязанном, так и в связанном состоянии, также эффективно поглощает в щелочных условиях широкий круг металлов. Эти металлы перечислены в приведенной ниже таблице 2 с убыванием по их интенсивности их ионообменного поглощения титанатом натрия. Например, литий, магний, никель, кобальт и барий поглощаются титанатом натрия при ионном обмене в более высоких количествах, чем стронций. Среди металлов, вносящих основной вклад в загрязнение окружающей среды, частично кристаллический титанат натрия имеет высокую аффинность к цинку, меди, кадмию, ртути, таллию и свинцу. Среди исследованных благородных металлов очень хорошо поглощается титанатом натрия серебро. Приведенные в таблице 2 данные показывают, что титанат натрия можно использовать для удаления металлов из промышленных сточных вод и других отходов, содержащих растворенные в воде металлы, а также для извлечения заданных материалов.
Указанные в таблице 2 результаты ионного обмена получены при использовании 200 мг титаната натрия (образец 5-1 из рассматриваемого ниже примера 5), 20 мл водного раствора, с концентрацией ионов удаляемого металла, равной 20 млн-1, при щелочных условиях (pH 10-11). Во всех образцах присутствовал натрий, и приведенные результаты иллюстрируют высокую селективность титаната натрия к ионам указанных металлов на фоне натрия. Титанат натрия эффективен только в качестве катионита, поэтому при высоких pH он проявлял слабую активность при ионном обмене с растворами, содержавшими ионы некоторых металлов, в числе которых мышьяк, сурьма, молибден и свинец.
Пример 1В этом примере описывается применение способа кипячения с конденсацией и обратным стоком для производства геля титаната натрия, предусмотренного настоящим изобретением, с последующим проведением гидротермальной обработки и получением частично кристаллического титаната натрия. Гидроокись натрия NaOH в количестве 5,85 г растворили в 14 мл дистиллированной деионизированной воды. Затем в гидроокись натрия медленно добавили 32 мл изопропилата титана (TiP). Потом эту смесь подвергли кипячению с конденсацией и обратным стоком в течение 3 часов, после чего с помощью дистиллированной деионизированной воды ее переместили в бомбу с внутренним тефлоновым покрытием (за исключением образца 1-2, где использовали 20 мл раствора гидроокиси натрия с концентрацией 0,82 моль/л). Бомба была герметизирована, помещена в печь с температурой 190oC и выдержана в ней 20 часов для проведения реакции. Продукт реакции выделили фильтрацией и промыли один раз дистиллированной деионизированной водой и три раза метанолом. Начальная концентрация титана в бомбе составляла 1,58 моль/л, а начальная концентрация гидроокиси натрия – 2,46 моль/л. Отношение Ti:Na составляло 1:1,56. В таблице 3 приведены характеристики частично кристаллических титанатов натрия, полученных способом, который был использован в данном примере. Раствор, на основе которого рассчитывали Kd стронция, содержал 5 моль/л азотнокислого натрия, 0,1 моль/л гидроокиси натрия и 90-95 млн-1 Sr2+. Отношение объема раствора к весу образца ионита составляло 200:1, если отдельно не указаны другие значения. Рентгенограммы образцов 1-1 … 1-13 представлены на фиг. 2 и 3. Для каждого из образцов 1-6, 1-7 и 1-10 межплоскостное расстояние находится в пределах 8,0 и 9,9 ангстрем, а ширина максимума отражения (001) на половине его высоты – в пределах 1o и 4,5o. Пример 2 В этом примере описывается способ получения титаната натрия, обозначенного как образец 2-1, путем проведения второй гидротермальной обработки образца 1-2, полученного в примере 1. Образец 1-2 массой 3,5 г был помещен в бомбу с внутренним тефлоновым покрытием. К твердому иониту добавили 38 мл раствора гидроокиси натрия с концентрацией гидроокиси натрия 4,2 моль/л. Затем смесь подвергли гидротермальной обработке продолжительностью 2 суток при температуре 170oC. Образец ионита выделили из смеси фильтрацией и промыли один раз дистиллированной деионизированной водой, четыре раза метанолом и два раза этанолом. Рентгенограмма образца 2-1 представлена на фиг. 4. Как следует из таблицы 5, перед второй гидротермальной обработкой Kd был равен 3.060 мл/г (образец 1-5), а после нее составил 1.270 мл/г (образец 2-1). Пример 3 В этом примере подробно рассмотрено получение предложенного в изобретении титаната натрия с частично кристаллической слоистой структурой с применением золь-гелевого способа. В пластмассовом химическом стакане приготовили раствор B, растворив таблетки 98,4%-ной гидроокиси натрия массой 40,793 г в 400 мл метанола. Гидроокись натрия плохо растворяется в метаноле, поэтому смесь более 30 минут перемешивали магнитной мешалкой. Раствор A приготовили, смешав в реакционном сосуде 294,2 г изопропилата титана (TiP) и 250 мл метанола. Смешение сопровождалось выделением теплоты (температура достигла 72oC). В качестве реакционного сосуда использовался стеклянный химический стакан вместимостью 2 л, обернутый изоляционной пленкой. Затем к раствору A в реакционном сосуде медленно добавили раствор B. Содержимое стакана перемешали магнитной мешалкой и нагрели на горячей плите до температуры 53oC. Раствор C приготовили, смешав в химическом стакане вместимостью 100 мл 20 мл воды и 50 мл метанола. С помощью бюретки раствор C по каплям добавили к нагретой до 53oC смеси растворов A и B. Получившийся в результате гель титаната натрия перемешивали еще 15 минут, после чего переместили в керамическую емкость для выпаривания. Емкость оставили на ночь в вытяжном шкафу для испарения жидкости. Затем, примерно половину количества геля поместили в литровую колбу с круглым дном, которую затем соединили с роторным испарителем. Гель сушили в условиях разрежения при температуре 60-75oC в течение полутора часов. Процесс выпаривания с помощью роторного испарителя повторили для второй порции геля. В итоге было получено 135 г высушенного геля. Для получения конечного продукта титаната натрия 20 г полученного перед этим геля смешивали либо с 40 мл деионизированной воды, либо с 40 мл раствора гидроокиси натрия с концентрацией гидроокиси натрия 1 моль/л в автоклаве Парра с внутренним тефлоновым покрытием. Затем содержимое автоклава подвергли гидротермальной обработке продолжительностью 5-20 часов при температуре 160-200oC. Пример 4 В этом примере подробно описывается получение предложенного в изобретении частично кристаллического титаната натрия способом кипячения с конденсацией и обратным стоком с последующим проведением гидротермальной обработки. Растворив таблетки 98,4%-ной гидроокиси натрия массой 419,88 г в 956 г деионизированной воды, приготовили 30%-ный раствор гидроокиси натрия. Затем этот раствор перелили в трехлитровую реакционную колбу с тремя горловинами и круглым дном. В раствор гидроокиси натрия, находящийся в этой колбе, из полулитровой дозирующей воронки капельным методом ввели 295,3 г изопропилата титана (TiP). Одновременно с этим содержимое колбы перемешивали со скоростью 500 об/мин. Из раствора выпало в осадок большое количество твердого белого вещества. Реакционный сосуд установили на нагревательное кольцо, подключили к нему конденсатор, термопару, связанную с регулятором температуры, и мешалку. В течение 5 часов 15 минут смесь кипятили с конденсацией и обратным стоком, перемешивая ее со скоростью 250 об/мин. Полученный гель титаната натрия оставили на ночь остынуть и отстояться. Затем воду сцедили, а твердый продукт сушили два дня при температуре 60oC. В итоге было получено 152 г геля титаната натрия. Для получения конечного продукта титаната натрия 20 г полученного геля смешивали либо с 40 мл деионизированной воды, либо с 40 мл раствора гидроокиси натрия с концентрацией гидроокиси натрия 1 моль/л в автоклаве Парра с внутренним тефлоновым покрытием. Затем содержимое автоклава подвергли гидротермальной обработке продолжительностью 5-20 часов при температуре 160-200oC. Пример 5 В этом примере было приготовлено 10 кг геля титаната натрия золь-гелевым способом. В реактор вместимостью 227 л (50 галлонов) загрузили 30 кг изопропилата титана и 20,6 кг метанола. В эту смесь медленно добавляли раствор 4,2 кг гидроокиси натрия в 32,8 кг метанола, находившийся в одном из нескольких смесительных резервуаров вместимостью 91 л (20 галлонов). Затем, для инициирования гелеобразования, туда же медленно добавили раствор, содержащий 2,1 кг воды и 4,1 кг метанола. Благодаря избыточному давлению в реакторе и высокой скорости перемешивания (3,4 м/с, или 681 фут/мин) метанол не испарялся, и гель оставался текучим. Это означает, что после 30-минутного гелеобразования гель при опорожнении реактора слили самотеком. Гель был слит в поддоны, которые затем поместили в вакуумную печь с температурой 60oC и разрежением 91 кПа (27 дюймов рт.ст.) на 12 часов. В печи были выпарены растворитель метанол (в количестве около 56 кг) и побочный продукт изопропанол (около 21 кг). Высушенный гель разделили на четыре порции и подвергли гидротермальной обработке в автоклаве с внутренней камерой из нержавеющей стали вместимостью 23 л (5 галлонов). Автоклав был укупорен крышкой с тефлоновым покрытием. В приведенной ниже таблице 4 обобщены параметры гидротермальной обработки каждой порции геля. Порции 5-1 и 5-2 сухого геля массой по 4,5 кг подвергли гидротермальной обработке продолжительностью 20 часов в 9 кг воды при температуре 160-200oC. Порции 5-3 и 5-4 сухого геля массой по 2,6 кг обрабатывали в течение 5 часов в 5,2 кг воды при температуре 160-200oC. Каждая из порций геля, которые обрабатывались без перемешивания, после завершения автоклавирования превратилась в кусковой твердый материал. Этот твердый материал был способен легко диспергироваться в воде. Порцию 5-4 перемешивали на протяжении всей обработки. Продукт, полученный из порции 5-4, представлял собой тонкодиспергированную взвесь частиц, и поэтому очень легко извлекался из автоклава. Из автоклава откачали верхний слой воды, а оставшуюся суспензию слили в мешочный фильтр центрифуги. Твердые частицы, прилипшие к боковым стенкам автоклава, смыли 7 кг деионизированной воды. Для удаления воды твердые частицы центрифугировали в течение 10 минут. Затем, для промывки твердого продукта, в него дополнительно добавили 4 кг воды с последующим центрифугированием. Продукт гидротермальной обработки оставили на ночь сушиться в печи с температурой 65oC и обдувом азотом. Совокупным продуктом гидротермальной обработки всех четырех порций геля явилось 9,2 кг частично кристаллического титаната натрия. Пример 6 Материалы, полученные в примерах 1 и 2, были подвергнуты рентгеноструктурному анализу методом порошка, в результате чего были получены рентгенограммы, представленные на фиг. 1-3. Эти рентгенограммы показывают, что для образцов, полученных с использованием способа кипячения с конденсацией и обратным стоком, кристалличность структуры титаната натрия увеличивается вместе с ростом молярного отношения натрия к титану, и при достижении Na:Ti = 5 образуется то, что можно назвать соединением, имеющим структуру с пониженной кристалличностью. Образцы 1-8 и 1-9 с наибольшей кристалличностью были получены при наибольших отношениях гидроокиси натрия к титану и в самых сильных основных растворах. Рентгенограмма образца 2-1 показывает, что этот образец, подвергнутый второй гидротермальной обработке, имеет структуру более высокой кристалличности, чем образец 1-2, являющийся продуктом предшествующей гидротермальной обработки. У образцов 2-1, 1-8 и 1-9 значения Kd были существенно ниже, чем у образцов с меньшей кристалличностью структуры. Например, у образца 1-8 значение коэффициента распределения Kd стронция для титаната натрия составило 7.000 мл/г при концентрации в растворе азотнокислого натрия 0,1 моль/л. При тех же условиях у образца 1-1 значение коэффициента распределения Kd стронция для титаната натрия превысило 100.000 мл/г. Анализ рентгенограмм приводит к тому выводу, что полученные образцы можно разбить на различные группы, а именно: группу образцов со структурой более высокой кристалличности, очевидно, подобной структуре образца 2-1, к которой относятся образцы 1-1, 1-2, 1-3 и 1-5, группу образцов с более гелеобразной структурой, к которой относятся образцы 1-6, 1-7 и 1-10, а также образец 1-4, который по своей кристалличности находится между двумя указанными группами. Образцами с наибольшим Kd являются образцы 1-7 и 1-10. Образец 1-13 (полученный с использованием золь-гелевого способа) и образец 1-2 (полученный с использованием способа кипячения с конденсацией и обратным стоком) имеют близкие друг к другу значения молярного отношения Na: Ti, гидротермальную обработку этих образцов проводили с одной и той же продолжительностью и при одинаковой температуре, однако в итоге эти образцы представляют собой нонатитанаты различной структуры. Образец, полученный с использованием золь-гелевого способа, по рентгенограмме был похож на образец 1-10, полученный при высоком молярном отношении Na:Ti, однако имеет гораздо более низкую ионообменную селективность к Sr2+. После сравнения рентгенограмм образца 1-12 и образца 1-3 можно предположить, что увеличение продолжительности гидротермальной обработки не приводит к изменению кристалличности структуры соединения, но оказывает определенное влияние на его ионообменные качества. Пример 7 В этом примере анализируются результаты расчетов коэффициента распределения Kd для титанатов натрия, полученных в примерах 1 и 2. В данном примере коэффициент распределения рассчитывали как отношение концентрации ионов Sr2+ в ионите к равновесной концентрации ионов Sr2+ в растворе. Поскольку для расчетов использовали весовую концентрацию, в данном примере обычная размерность Kd – “мл/г” – заменена на “г/г”. Из всех образцов для трех: 1-1, 1-10 и 2-1, были выведены зависимости Kd от pH раствора. Эти зависимости представлены графически на фиг. 5. С уменьшением pH раствора уменьшается селективность ионита к стронцию. Указывается, что при pH выше 11 коэффициент распределения Kd превышает 300.000, так как при данном pH концентрация стронция была ниже предела обнаружения измерительной установки, и для расчета Kd было взято значение 0,1 млн-1. Здесь важно отметить, что начальный pH стронцийсодержащих растворов и pH равновесного раствора после ионного обмена, как правило, сильно отличаются друг от друга. Это обусловлено гидролизом нонатитаната натрия, уравнение которого приведено ниже. Такую особенность обнаруживают все титанаты со слоистой структурой. Na4Ti9O20 + xH2O —> HxNa4-xTi9O20 + xNaOH Значения коэффициента распределения Kd Sr2+ были определены для тех же самых образцов также в присутствии азотнокислого натрия с концентрацией 5 моль/л, гидроокиси натрия с концентрацией 1 моль/л и стронция с концентрацией 90-95 млн-1. Результаты представлены в приведенной ниже таблице 5. При данных условиях эксперимента наибольшую эффективность показал образец 1-10. При сравнительном исследовании образцов, подвергнутых более длительной гидротермальной обработке, с образцами, имеющими похожие рентгенограммы, но обрабатывавшимися более короткое время (образец 1-12 и образец 1-3), установлено, что в первых коэффициент распределения Kd стронция в два раза меньше, чем в последних. Это позволяет предположить, что при очень короткой гидротермальной обработке получаются высокоселективные материалы. При уменьшении концентрации стронция в растворе наблюдался соответствующий рост Kd. Например, для образца 1-10 коэффициент распределения стронция возрос до 58.700. Увеличение Kd после уменьшения объема раствора с 400 до 200 мл свидетельствует о том, что в большем объеме раствора содержится достаточно большое количество ионов стронция, которое превышает емкость ионита при концентрации катионов натрия 6 моль/л. Допустим, что Kd = 58.700 г/г соответствует 99%-ному поглощению добавленного Sr2+. Ионообменная емкость нонатитаната натрия равна 4,75 мэкв/г, а извлечение стронция из 200 г раствора составило 0,2 мэкв/г. Таким образом, в эксперименте, где отношение массы раствора к массе ионита составляло 400, и было получено значение Kd = 13.400 г/г, ионообменная емкость ионита была использована на 4,2%. Расчеты показывают, что из раствора было извлечено 97% SR2+. Так что количество поглощенного стронция составило 2 Ч 0,2 Ч 0,92 = 0,388 мэкв или 8% ионообменной емкости ионита. Это значение говорит об очень высоком поглощении стронция для такого сильного раствора с таким высокой концентрацией ионов натрия. Пример 8 Фрагмент образца 1-6 положили на лист ватмановской фильтровальной бумаги и поместили в колбу с длинной горловиной и круглым дном, в которую перед этим была налита дистиллированная деионизированная вода. Колбу слегка подогрели для образования паров, которые должны были проникать в образец титаната натрия с частично кристаллической слоистой структурой. Второй фрагмент образца 1-6 поместили в печь с температурой 75oC до востребования. Для проведения измерений Kd, термогравиметрического и рентгеноструктурного анализа этого высушенного материала второй фрагмент образца 1-6 вынули из печи и сразу же, во избежание впитывания им влаги, перенесли в специальный испытательный контейнер. С помощью раствора, содержавшего 5 моль/л азотнокислого натрия, 1 моль/л гидроокиси натрия и 91,67 млн-1 стронция, были проведены измерения Kd. Результаты измерений представлены в приведенной ниже таблице 6. Рентгенограммы (фиг. 6 и 7) позволяют определить, что у дегидратированного образца 1-6 межплоскостное расстояние составляет 9,0-9,9 ангстрем, тогда как у гидратированного образца межплоскостное расстояние составляет 9,4-10,2 ангстрем. Представленные в таблице 6 результаты показывают, что начальное среднее межплоскостное расстояние менее 9,9 ангстрем у титаната натрия играет значительную роль в увеличении поглощения стронция и связан с состоянием гидратации ионита до его взаимодействия с раствором. Пример 9 В этом примере проводится анализ влияния гидротермальной обработки на Kd стронция для частично кристаллического титаната натрия. Исследовались четыре параметра: способ получения геля (способ кипячения с конденсацией и обратным стоком или золь-гелевый способ), концентрация гидроокиси натрия в автоклаве, длительность и температура гидротермальной обработки. Приведенные в таблице 7 результаты исследований показывают, что для частично кристаллических титанатов натрия, полученных путем гидротермальной обработки аморфных титанатов натрия, Kd стронция в случае обработки в течение 5 часов при температуре 160oC в два раза больше, чем в случае обработки в течение 20 часов при температуре 200oC. Статистический анализ показывает, что при фиксированной длительности гидротермальной обработки в 24 часа наиболее значимым для Kd переменным параметром является соотношение между концентрацией гидроокиси натрия и температурой гидротермальной обработки. Для достижения точно заданной кристалличности структуры конечного продукта необходимо регулировать оба этих показателя. Пример 10 В этом примере проведена количественная оценка коэффициента распределения Kd стронция для частично кристаллического титаната натрия, полученного в примере 5. В приведенной ниже таблице 8 обобщены параметры гидротермальной обработки и показатели четырех порций титаната натрия, полученных в примере 5. Образцы порций 1 и 2, которые были подвергнуты наиболее длительной гидротермальной обработке (20 часов при температуре 160-200oC), оказались наиболее кристалличными, о чем на их рентгенограмме свидетельствует малая ширина главного максимума отражения, взятая на половине его высоты. Материалы, имеющие наибольшую кристалличность структуры, также имеют самые низкие значения Kd, так как высокая кристалличность препятствует диффузии обмениваемых ионов в межслойное пространство кристаллической решетки ионита, что обуславливает низкое поглощение стронция. Во всех четырех порциях титаната натрия был достигнут высокий коэффициент распределения Kd стронция. Вместе с тем, для порций, которые обрабатывались в течение 5 часов, Kd был в два раза больше, чем для порций, которые обрабатывались 20 часов (20.500 против 11.500 мл/г). Такое различие в значениях Kd можно соотнести со степенью кристалличности структуры образцов. На фиг. 8 построен график зависимости значений Kd, полученных для разных порций, от ширины максимума отражения (001) на половине его высоты, определенной при рентгеноструктурном анализе образцов. Чем больше эта ширина, тем менее кристалличной является структура материала. Материалы с более высокой кристалличностью структуры (порции 1 и 2) имеют меньший Kd. На рентгенограмме образца из порции 2 показано, что главный максимум отражения приходится на межплоскостное расстояние 8,76 ангстрем. Главный максимум не исчезает после введения в раствор гидроокиси натрия с концентрацией 0,1 моль/л. Этот факт свидетельствует о том, что этот новый максимум вызван не образованием фазы H4Ti9O20 (что могло бы иметь место, если бы для промывки образца в экспериментальной установке использовали слишком большое количество воды). Образец порции 2 может содержать еще одну фазу титаната натрия, возможно – Na2Ti3O7, для которой главный максимум отражения соответствует межплоскостному расстоянию 8,27 ангстрем. Образцы всех остальных порций содержат только нонатитанат. На фиг. 9 показано, что в сравнении с образцами других порций образец порции 2 дольше всех (18 часов) подвергался действию температуры 200oC. Возможно, эта длительная выдержка при высокой температуре стала причиной образования новой фазы. На фиг. 10A, 10B, 10C и 10D представлены полученные с помощью электронного сканирующего микроскопа (с 3.000-кратным увеличением) изображения структуры образцов из каждой порции, обрабатывавшейся на экспериментальной установке. Как видно на фиг. 10A, 10B, 10C, структура образцов частично кристаллического титаната натрия из порций 1-3 имеет видимые образования в виде ядер, тогда как в показанной на фиг. 10D структуре образца из порции 4 наблюдаются удлиненные группы волокон. При том, что перемешивание не влияет на конечный Kd стронция, оно оказывает влияние на макроструктуру ионита. Перемешивание геля во время гидротермальной обработки порождает касательные напряжения в структуре образующегося титаната натрия, что, в свою очередь, выражается в большем количестве отдельных и сгруппированных волокон. Пример 11 Для получения связанного титаната натрия 8,6 г цемента марки “XR Fondu” соединили с 20 г титаната натрия в виде порошка крупностью примерно 0,07 мм (что соответствует номеру сита 200 меш), полученного в примере 5, энергично перемешав сухие компоненты в течение 5 минут. Затем при непрерывном перемешивании в сухую смесь добавили 14,7 г деионизированной воды. Смеси дали настояться еще 5 минут, после чего пастообразную смесь размазали тонким слоем по листам с тефлоновым покрытием. Листы уложили в накрытые чаны, поместили их в печь с водонасыщенной средой и температурой 30oC и оставили для затвердевания на 48 часов. Отвердевшие пласты с помощью ступки и пестика размололи до крупности, соответствующей номеру сита – 20 Ч (40 меш). Пример 12 В этом примере подробно описывается способ получения кристаллического титаната натрия, связанного аморфным титанатом натрия. В химическом стакане, установленном на горячую плиту с магнитной мешалкой, 293 г изопропилата титана (TiP) смешали с 250 мл метанола. Раствор подогрели до температуры 50oC. Затем в химический стакан добавили раствор 40,7 г гидроокиси натрия в 400 мл метанола. В эту смесь добавили 10 г титаната натрия в виде порошка крупностью примерно 0,07 мм (что соответствует номеру сита 200 меш), полученного в примере 5. После добавления раствора, состоящего из 50 мл метанола и 20 мл воды, суспензию порошка в растворе перемешивали в течение одного часа. Получившуюся при этом густую пасту размазали по листу с тефлоновым покрытием и оставили твердеть в воздушной среде на 6 суток. Отвердевший пласт размололи с помощью ступки и пестика и просеяли через сито с размером ячейки 20-40 меш (размер частиц 0,42-0,84 мм). Полученным связанным ионитом является полукристаллический титанат натрия, связанный аморфным титанатом натрия. Пример 13 В этом примере подробно рассматривается предпочтительный способ получения частично кристаллического титаната натрия, связанного двуокисью титана. 6 г порошка титаната натрия крупностью примерно 0,07 мм (что соответствует номеру сита 200 меш), приготовленного в примере 5, смешали с 10 мл изопропилата титана (TiP). Смесь перемешивали до тех пор, пока она не превратилась в густую пасту. Затем эту пасту размазали по листу с тефлоновым покрытием и оставили застывать на воздухе в течение 45 минут. После этого застывший на воздухе пласт поместили на ночь в печь с температурой 85oC для окончательного твердения. Отвердевший пласт размололи с помощью ступки и пестика и просеяли через сито с размером ячейки 20-40 меш (размер частиц 0,42-0,84 мм). Полученным композиционным материалом явился частично кристаллический титанат натрия, связанный аморфной двуокисью титана. Пример 14 Для оценки эффективности ионита в условиях динамического контакта с раствором были проведены экспериментальные исследования в ионообменной колонне, с использованием образца 1-2 (нонатитанат натрия) и опытного раствора. Состав опытного раствора был следующим: 5 моль/л азотнокислого натрия, 1 моль/л гидроокиси натрия, 0,15 моль/л хлористого калия, 13,9 млн-1 цезия, 8,75 млн-1 стронция и 4,08 млн-1 кальция. Объем сорбента составлял 0,85 см3, высота неподвижного слоя сорбента – 155 мм, размер гранул сорбента – не более 0,1 мм, и расход подаваемого раствора – 3 объема слоя сорбента в час. Регенерацию ионита осуществляли путем пропускания через колонну 15 мл раствора, содержащего 0,5 моль/л соляной кислоты со скоростью 0,5 объема слоя сорбента в час, с последующей обработкой сорбента 20 мл раствора, содержащего 5 моль/л гидроокиси натрия, 0,15 моль/л хлористого калия, подаваемого со скоростью 0,5 объема слоя сорбента в час, с получением регенерированного частично кристаллического титаната натрия. На фиг. 11 приведен график, иллюстрирующий зависимость конечной концентрации стронция в растворе от суммарного объема пропущенного через колонну раствора. Из этого графика видно, что частично кристаллический титанат натрия до первой регенерации эффективно очищает опытный раствор в количестве примерно 700 объемов колонны, а после первой регенерации – почти в два раза больше – 1200 объемов колонны (из этого предложения следует, что размерностью оси абсцисс графика должно быть количество объемов колонны (column volumes), тогда как на фиг. 11 указано, что размерностью оси абсцисс является количество объемов слоя сорбента (bed volumes) – примеч. пер.). Пример 15 Образцы титаната натрия, полученного способом, использованным в примере 5, смешанные с портландцементом или алюминатом кальция (глиноземистый цемент марки “Ciment Fondu”), были гранулированы способом, описанным в примере 11, при этом состав композиционного материала для разных образцов указан в приведенной ниже таблице 9. В таблице 9 представлены результаты измерений Kd стронция, когда в качестве связующего были использованы портландцемент и цемент “Ciment Fondu”, при различном времени отверждения. Как следует из таблицы, полученные для связанного титаната натрия значения Kd стронция при любой длительности отверждения связующего существенно уступают Kd (1633 мл/г), полученному для несвязанного порошкового (крупностью 0,07 мм или 200 меш) титаната натрия. При использовании в качестве связующего цемента марки “Ciment Fondu” ионит имеет несколько более высокий Kd стронция, чем при использовании портландцемента. При этом очевидного влияния длительности отверждения на свойства частично кристаллических титанатов натрия в неорганической связующей матрице не наблюдается. Для того чтобы определить, имеет ли место инкапсуляция титаната натрия неорганическим связующим, образцы композиционного материала были исследованы методом азотной порометрии. Результаты этого исследования представлены в приведенной ниже таблице 10 и свидетельствуют, что некоторые из порошков титаната натрия оказались инкапсулированными неорганическими связующими, что выражается в уменьшении удельной поверхности по методу БЭТ (адсорбционный метод Бруннауэра, Эммета и Теллера) и удельной поверхности по Ленгмюру образцов связанного титаната натрия по сравнению с несвязанным порошком титаната натрия. Для того чтобы выяснить, в какой степени такая инкапсуляция затрудняет массоперенос, в течение 120 часов были проведены измерения коэффициента распределения Kd стронция для связанных и несвязанных образцов. Из графика на фиг. 12 и таблицы 10 видно, что наибольшую скорость поглощения стронция из раствора демонстрирует несвязанный титанат натрия (в оригинале ошибочно указано “связанный” – примеч. пер.). Как органические, так и неорганические связующие замедляют поглощение стронция. Органическое связующее, примененное в комплексе с порообразователем, обеспечивает относительно интенсивное поглощение стронция и, в конечном итоге, достижение такой же конечной концентрации стронция в растворе, как и порошковый титанат натрия. Однако при использовании неорганических связующих поглощение стронция идет очень медленно, при этом конечная концентрация стронция в растворе, которую обеспечивает порошковый титанат натрия, асимптотически не достигается. Как было отмечено выше, неорганическое связующее, по-видимому, частично инкапсулирует порошок титаната натрия. Поскольку кривая конечной концентрации стронция в растворе не стремится к уровню, достигаемому при использовании порошкового титаната натрия, определенная доля частиц порошка титаната натрия, вероятно, полностью инкапсулирована связующим. Композиционные иониты, где в качестве связующего использован только чистый цемент, обладают механической прочностью и стойкостью в едко-щелочных средах, однако массообменная способность у таких ионитов несколько ухудшена влиянием связующего. Пример 16 В этом примере описываются способы создания пористости в системе “неорганическое связующее – ионит” с целью улучшения массопереноса. За счет повышения пористости гранулы ионита возрастает переход катионов из раствора в ионит, т. е. увеличивается поглощение радиоактивных катионов. Двумя исследованными способами повышения пористости были газовое вспенивание композиции связующего и ионита и добавление в композицию связующего и ионита инертных наполнителей. Инертный наполнитель был подвергнут выщелачиванию и получен в виде пористых гранул. Все образцы ионита, на которых исследовался эффект порообразователей, были приготовлены в общем соответствии с технологией, изложенной в примере 15. По первому способу получения пористых гранул, в смесь связующего и ионита добавили алюминий, индуцирующий образование газов в системе “связующее – ионит”. В едко-щелочных условиях алюминий реагирует с водой с выделением молекулярного водорода. Благодаря выделению водорода в гранулах образуются пузыри или пустоты. В таблице 11 приведены результаты исследования при переменных содержании алюминия и размере его частиц. Все образцы прошли стандартное испытание на стойкость в едко-щелочной среде. Образцы 16-1 и 16-2 были подвергнуты воздействию небольшой нормальной силы путем установки на лист небольшого груза. Эти образцы не расширились в объеме в той же степени, что и другие образцы, и масса конечного продукта при их получении была несколько меньше, чем в случае других образцов. Для всех пористых гранул были получены значения Kd, существенно более низкие, чем для несвязанного порошка частично кристаллического титаната натрия, у которого Kd обычно превышает 10.000 мл/г. Один из вспененных алюминием пористых образцов был подвергнут азотной порометрии для определения удельной поверхности. Удельная поверхность по Ленгмюру составила 111,1 м2/г, удельная поверхность по методу БЭТ составила 63,2 м2/г, а средний радиус пор – 32,3 ангстрем. Благодаря введению алюминиевого наполнителя значения как удельной поверхности по Ленгмюру, так и удельной поверхности по методу БЭТ в образце связанного титаната натрия увеличились до уровня, близкого к аналогичным показателям несвязанного титаната нутрия. Но даже при увеличенной удельной поверхности Kd стронция для этого образца остался небольшим. По второму способу получения пористых гранул, неорганические или органические наполнители были смешаны и введены в систему “связующее – ионит” с последующим отверждением способом, описанным в примере 11. В качестве неорганических наполнителей использовались углекислый кальций и сернокислый кальций, а в качестве органического наполнителя – углеводородный воск с низким молекулярным весом. Эти наполнители плохо растворяются в воде, но могут быть выщелочены соответствующими растворами. Характерные результаты для двух неорганических наполнителей представлены в таблице 12. Каждый из этих образцов был подвергнут выщелачиванию кислотой, а титанат натрия регенерировали с использованием гидроокиси натрия. Для всех гранул связанного титаната натрия, содержащих наполнители в форме неорганических солей, были получены значения Kd, более низкие, чем у несвязанного порошка титаната натрия. Для увеличения пористости без внесения в систему дополнительного кальция использовали органические порообразователи. Органические порообразователи добавляли в систему в разных объемных пропорциях, что отражено в таблице 13. Повышение пористости за счет использования выщелоченного воска не привело к увеличению Kd. Коэффициент распределения Kd стронция повысился лишь в образцах 16-13 и 16-14 за счет увеличения содержания ионита в системе. Этот эффект наблюдался и для неорганических наполнителей. Предположительно, существует определенный верхний предел, до которого можно повышать содержание ионита без потери композиционным материалом механической прочности. И в этом случае, для исследованных образцов связанного титаната натрия были получены значения Kd, более низкие, чем у несвязанного порошка титаната натрия. Пример 17 Титанат натрия, связанный цементом или обменным кальцием, можно в полном объеме регенерировать промывкой сначала кислым, а затем щелочным растворами. Однако при экспериментальной промывке титаната натрия, связанного цементом или обменным кальцием, гранула рассыпалась, свидетельствуя о нестойкости связующего к воздействию кислоты. Для выбора наилучшей регенерирующей кислоты, которая не разрушает связующее, нами была измерена концентрация катионов кальция в растворе после того, как 500 мг титаната кальция или отвердевшего цемента (без ионита) взбалтывали в опытных растворах в течение 72 часов. Титанат кальция получили взбалтыванием титаната натрия в растворе, содержащем 2 моль/л хлористого кальция, в течение нескольких суток. Опытные растворы были приготовлены из уксусной кислоты, азотной кислоты, азотной кислоты с 1 моль/л хлористого натрия и хлористого натрия, смешанных в различных пропорциях. Для каждого типа раствора более сильная экстракция Ca2+ из титаната наблюдалась при более низких pH. При pH ниже 5,5 самым лучшим регенерационным растворителем, извлекающим почти весь Ca2+ из титаната кальция, оказалась азотная кислота, содержащая 1 моль/л хлористого натрия. Для замещения Ca2+ ионом водорода необходима кислая среда. Присутствие в растворе хлористого натрия способствует еще лучшему извлечению Ca2+ из ионита за счет повышения концентрации ионов в растворе, что, в свою очередь, увеличивает силу, заставляющую кальций оставить ионит. Те же самые опытные растворы, которые использовались в эксперименте с титанатом кальция, были использованы при исследовании стойкости цемента, не содержащего ионит. Независимо от состава раствора цемент рассыпался при pH  2. При pH 2. При pH  3 цемент очень плохо отдавал Ca2+ во всех растворах, кроме уксусной кислоты. С учетом этих наблюдений самым лучшим регенерационным раствором является раствор, содержащий 0,01 моль/л азотной кислоты плюс 1 моль/л хлористого натрия (начальный pH 3,1).
Также была проведена оценка процессов регенерации связанного титаната натрия (предположительно как в Ca-форме, так и в Na-форме) в титанат с более высоким содержанием натрия, с проведением такой регенерации в две стадии. На первой стадии раствор, содержавший 0,01 моль/л азотной кислоты плюс 1 моль/л хлористого натрия, пропустили через колонну, загруженную двуокисью титана, связанной с цементом марки “Ciment Fondu XR” в пропорции 50:50 по весу (образец 16-1). Кислый раствор пропускали через колонну до тех пор, пока pH сточных вод не достиг 4 (суммарный расход раствора составил 350 объемов колонны). Затем одну половину образца, промытого кислым раствором, обработали 82 мл раствора, содержавшего 0,1 моль/л гидроокиси натрия, а другую половину – 68 мл раствора, содержавшего 2 моль/л гидроокиси натрия. Оба образца после обработки сохранили механическую прочность.
Необработанный образец, образец после кислой промывки и образец, обработанный раствором, содержавшим 0,1 моль/л гидроокиси натрия, продемонстрировали почти одинаковое поглощение стронция (полученные для этих образцов значения d лежали в пределах 161-264 мл/г, при этом за массу ионита принималась масса титаната натрия в грануле). Однако для образца, регенерированного промывкой в растворе, содержавшем 2 моль/л гидроокиси натрия, поглощение стронция оказалось в 3,9 раза выше, чем у исходного (перед регенерацией) образца (623 против 161 мл/г).
Такой низкий Kd у регенерированного образца связанного ионита, в сравнении с несвязанным порошком титаната натрия, возможно, указывает на то, что массоперенос внутри гранулы необходимо улучшить путем повышения пористости.
Пример 18 3 цемент очень плохо отдавал Ca2+ во всех растворах, кроме уксусной кислоты. С учетом этих наблюдений самым лучшим регенерационным раствором является раствор, содержащий 0,01 моль/л азотной кислоты плюс 1 моль/л хлористого натрия (начальный pH 3,1).
Также была проведена оценка процессов регенерации связанного титаната натрия (предположительно как в Ca-форме, так и в Na-форме) в титанат с более высоким содержанием натрия, с проведением такой регенерации в две стадии. На первой стадии раствор, содержавший 0,01 моль/л азотной кислоты плюс 1 моль/л хлористого натрия, пропустили через колонну, загруженную двуокисью титана, связанной с цементом марки “Ciment Fondu XR” в пропорции 50:50 по весу (образец 16-1). Кислый раствор пропускали через колонну до тех пор, пока pH сточных вод не достиг 4 (суммарный расход раствора составил 350 объемов колонны). Затем одну половину образца, промытого кислым раствором, обработали 82 мл раствора, содержавшего 0,1 моль/л гидроокиси натрия, а другую половину – 68 мл раствора, содержавшего 2 моль/л гидроокиси натрия. Оба образца после обработки сохранили механическую прочность.
Необработанный образец, образец после кислой промывки и образец, обработанный раствором, содержавшим 0,1 моль/л гидроокиси натрия, продемонстрировали почти одинаковое поглощение стронция (полученные для этих образцов значения d лежали в пределах 161-264 мл/г, при этом за массу ионита принималась масса титаната натрия в грануле). Однако для образца, регенерированного промывкой в растворе, содержавшем 2 моль/л гидроокиси натрия, поглощение стронция оказалось в 3,9 раза выше, чем у исходного (перед регенерацией) образца (623 против 161 мл/г).
Такой низкий Kd у регенерированного образца связанного ионита, в сравнении с несвязанным порошком титаната натрия, возможно, указывает на то, что массоперенос внутри гранулы необходимо улучшить путем повышения пористости.
Пример 18На стойкость к радиации были исследованы титанат натрия с частично кристаллической слоистой структурой в несвязанном состоянии и титанат натрия, связанный цементом марки “Ciment Fondu”, с содержанием связующего 50% (вес. ). Образцы получили различные дозы облучения: 250, 500, 750 и 100 Мрад. Все облученные порошки титаната натрия имели Kd, приблизительно равный 40.000 мл/г. Для всех облученных образцов связанного титаната натрия Kd стронция составил 150 мл/г, что согласуется с данными, представленными в таблице 9. Необлученный образец имел несколько более высокий Kd, причем эта разность Kd может укладываться в погрешность метода измерений. После облучения и обработки щелочным раствором все образцы связанного титаната натрия при качественной оценке показали отличную механическую прочность. Пример 19 В этом примере гель титаната натрия был испытан в качестве связующего для частично кристаллического титаната натрия. В результате было установлено, что гель титаната натрия обладает хорошей механической прочностью, стоек к едко-щелочной среде и повышает поглощение стронция титанатом натрия. Поскольку гель титаната натрия является неорганическим соединением, это связующее обладает хорошей стойкостью к радиации. Связывание титаната натрия, полученного, как описано в примере 5, гелем титаната натрия проводили двумя разными способами. По первому способу, соответствующему примеру 12, связующее получали путем приготовления золь-геля титаната натрия (из метанола, гидроокиси натрия и изопропилата титана) и введения в него ионита (частично кристаллический титанат натрия) перед отверждением. По второму, и предпочтительному, способу, соответствующему примеру 13, изопропилат титана (TiP) смешивали с ионитом (частично кристаллический титанат натрия) и перед отверждением помещали во влажный воздух на застывание. В таблице 14 представлены данные, свидетельствующие об эффективности применения титаната в качестве связующего для титаната натрия, с точки зрения ионообменной емкости и механической прочности. Образцы связанного ионита испытывали, погружая в растворы, содержавшие 64 млн-1 стронция, 5 моль/л азотнокислого натрия и 0,1 моль/л гидроокиси натрия, со взбалтыванием в течение 24 часов. Те образцы, которые выдержали это испытание на прочность, отмечены в соответствующем столбце таблицы 14 знаком “+”, а которые не выдержали – знаком “-“. Присутствие связующего на основе титаната усиливает поглощение стронция титанатом натрия. В сравнении с несвязанным титанатом натрия (образец 19-1), для образцов 19-2 и 19-3, которые были связаны путем приготовления золь-геля, поглощение стронция было в 1,76 раза больше, а для образца 19-6, который был связан путем смешения ионита с изопропилатом титана, в 2,9 раза больше. Аморфный титанат натрия (гель) сам по себе имеет высокий Kd стронция (17.000 мл/г). Так что высокий Kd стронция может быть обусловлен сочетанием связующего, усиливающего массоперенос, и порошка, имеющего высокую ионообменную емкость по отношению к стронцию. Пример 20 В этом примере дается анализ результатов измерений равновесной обменной емкости для титаната натрия, связанного двуокисью титана, полученного способом, соответствующим примеру 13, а также для каждой из порций, приготовленных на экспериментальной установке в примере 5. Как показано в таблице 15, значение Kd, полученное для титаната натрия, связанного двуокисью титана (через 24 часа после начала ионного обмена), в 3,5 раза превышает Kd, полученный для порошка титаната натрия (37.000 против 10.800 мл/г при следующих концентрациях компонентов раствора: 64 млн-1 стронция, 5,1 моль/л азотнокислого натрия, 0,1 моль/л гидроокиси натрия). Вместе с тем, титанат натрия, связанный двуокисью титана, имеет почти такую же емкость, как у несвязанного ионита (порция 2). Поскольку присутствие связующей двуокиси титана не оказывает влияния на емкость, связующее само способно поглощать стронций. Это подтверждается результатами измерений Kd для связующей двуокиси титана (получен Kd = 17.000 мл/г при следующих концентрациях компонентов раствора: 64 млн-1 стронция, 5,1 моль/л азотнокислого натрия, 0,1 моль/л гидроокиси натрия). Порошок, объединенный со связующим, имеет более высокую способность к поглощению стронция, чем порошок связующего сам по себе. Результатом связывания ионита двуокисью титана является композиционный материал с повышенной способностью к массопереносу. Пример 21 В этом примере подробно описывается способ производства гранулированного ионита, где для связывания титаната натрия используется органическое связующее с повышенной пористостью, что обеспечивает улучшенный массоперенос внутри гранулы. Порошок частично кристаллического титаната натрия, полученного в примере 5, имел коэффициент распределения Kd стронция, равный 16.900 мл/г. Этот порошок титаната натрия был связан ацетатом целлюлозы, содержание которой в композиционном материале составило 20% (вес.). Хотя предварительные исследования первых гранул дали положительные результаты (Kd кальция составил 2.500), впоследствии Kd был неизменно низким – менее 300. Такое резкое уменьшение Kd было обусловлено ухудшенным массопереносом через ацетат целлюлозы. Увеличение пористости гранулы путем использования связующего с порообразователем привело к восстановлению Kd до стабильно достигаемого уровня – свыше 1600 мл/г. Согласно способу гранулирования ионита с использованием порообразователя ацетат целлюлозы (22,5% (вес.)) растворили в смеси ацетона (47,5% (вес.)) и формамида (30,0% (вес.)). Порообразование в связующем происходит за счет инверсии фаз в системе “ацетон – формамид – вода”, при последующей экструзии гранулы в воду. Этот раствор смешали с титанатом натрия в такой пропорции, чтобы вес ацетата целлюлозы относился к весу ионита как 1:4. Затем эту смесь перемешивали для улетучивания ацетона и образования густой пасты. Эту пасту экструдировали в ванну с промывочной водой, содержавшей 0,1% поверхностно-активного вещества “Triton XL-80N”, 50% гликоля и 25% глицерола, при температуре 10oC. Целью использования водяной ванны является выщелачивание растворителя – смеси ацетона и формамида и уменьшение до минимума смятия пор из-за высыхания их мембран. Низкая температура способствует осаждению полимера и “замораживанию” пористой структуры. Поверхностно-активное вещество уменьшает смятие пор после высыхания за счет капиллярного давления. Причина ухудшения массопереноса после связывания наглядно иллюстрируется данными таблицы 16. Удельная поверхность несвязанного титаната натрия превышает 139 м2/г, а удельная поверхность связанного ионита после экструзии порошка титаната натрия, смешанного с ацетатом целлюлозы и ацетоном, оказалась очень малой – менее 1 м2/г. Ацетат целлюлозы инкапсулировал частицы порошка титаната натрия. Благодаря введению в раствор порообразователя и использованию охлажденной водяной ванны с поверхностно-активным веществом удельная поверхность увеличилась более чем до 91 м2/г. Кроме того, в результате применения новой технологии связывания также увеличилась смачиваемость гранул. Благодаря наличию на поверхности гранул неповрежденных пор, а также присутствию в порах остатков поверхностно-активного вещества, гранулы, полученные с использованием порообразователя, смачивались более легко. Пример 22 Этот пример показывает, что термическая обработка повышает механическую прочность титаната натрия, связанного двуокисью титана. При смешении в воздушной среде частично кристаллического титаната натрия с гидролизуемым соединением титана и перемешивании этой смеси примерно в течение одного часа получается пастообразный материал, что обусловлено гидролизом изопропилата титана с образованием двуокиси титана и гидроокиси титана. Затем этому пастообразному материалу дали отвердеть при комнатной температуре в воздушной среде, после чего просушили в течение ночи при температуре 90oC. После сушки материал размололи до размера частиц менее 0,4 мм. Полученный порошок титаната натрия, связанного двуокисью титана, спрессовали в таблеточной машине до плотности таблетки 1,8-2,2 г/мл. Затем таблетки подвергли кальцинации при различных температурах: 200oC, 300oC и 400oC. После 4 часов прокаливания таблетки были испытаны на раздавливание по методу D4179 ASTM (американское общество по испытанию материалов). Для сравнения был также испытан таблетированный цеолит марки AW-300 производства фирмы Des Plaines, штат Иллинойс, США. Испытания проводили на стенде “Instron”, модель 4502, с использованием тензодатчика “100 Newton”. Результаты испытаний представлены в таблице 17. Все кальцинированные таблетки титаната натрия, связанного двуокисью титана, продемонстрировали очень хорошую механическую прочность с высокой устойчивостью к разрушению в щелочном растворе. Неразмолотые таблетки, а также таблетки, размолотые до размера частиц 0,15-0,40 мм (что соответствует номерам сит от 100 до 40 меш), были подвергнуты исследованиям на определение коэффициента распределения Kd стронция, результаты которых представлены в таблице 18. Пример 23 Частично кристаллический титанат натрия, полученный способом, соответствующим примеру 5, добавили в водную суспензию двуокиси титана. В качестве органического связующего добавили метилцеллюлозу. Полученную смесь экструдировали и кальцинировали при температуре 560oC в течение 4 часов. Кальцинированные экструдаты показали хорошую механическую прочность, но в щелочном растворе рассыпались в порошок. Пример 24 Частично кристаллический титанат натрия, полученный способом, соответствующим примеру 5, смешали с порошком гидрата двуокиси титана. Смесь спрессовали в таблетки плотностью 1,8-2,2 г/мл. Затем эти таблетки кальцинировали при температурах 400oC и 560oC. После четырех часов прокаливания таблетки имели достаточно хорошую механическую прочность, но в щелочном растворе рассыпались в порошок. Пример 25 Порошок титаната натрия, связанного двуокисью титана, полученный описанным в примере 13 способом, смешали с порошком гидрата двуокиси титана. Смесь спрессовали в таблетки плотностью 1,8-2,2 г/мл. Затем эти таблетки кальцинировали при температурах 400oC и 560oC. После четырех часов прокаливания все таблетки показали очень хорошую механическую прочность с высокой устойчивостью к разрушению в щелочном растворе. Пример 26 В этом примере описывается способ производства таблеток кристаллического титаната натрия, связанного двуокисью титана, с помощью таблеточной машины, в котором прессуемость порошка улучшают добавлением твердого смазывающего агента, в частности, стеариновой кислоты. Порошок кристаллического титаната натрия, связанного двуокисью титана, смешали со стеариновой кислотой, содержание которой в смеси составило 0,5-4%, и с помощью таблеточного пресса типа “Coulton 215” спрессовали в таблетки плотностью 1,8-2,2 г/мл. Затем эти таблетки кальцинировали при температуре 400oC в воздухе обычной влажности или в воздухе, насыщенном водяным паром при комнатной температуре. После четырех часов прокаливания все таблетки имели очень хорошую механическую прочность с высокой устойчивостью к разрушению в щелочном растворе. Коэффициент распределения Kd стронция был измерен для трех образцов: неразмолотых таблеток, таблеток, размолотых до размера частиц 0,35-1,19 мм (что соответствует номерам сит от 45 до 16), и таблеток, размолотых до размера частиц менее 0,35. Для неразмолотых таблеток Kd был равен 11,860 мл/г. Для размолотого материала с размером частиц 0,35-1,19 мм Kd был равен 11,531 мл/г. Для размолотого материала с размером частиц менее 0,35 Kd был равен 12,813 мл/г. Пример 27 В этом примере связанный двуокисью титана кристаллический титанат натрия, полученный способом, раскрытым в примере 13, используют для удаления урана из водного раствора. В химический стакан поместили 200 мг гранул связанного двуокисью титана титаната натрия размером 0,42-0,84 мм (что соответствует номерам сит от 40 до 20). В этот же стакан залили 25 мл раствора с концентрацией урана 50 млн-1 и оставили раствор взаимодействовать с твердым титанатом натрия на 24 часа. Через 24 часа концентрация урана в растворе составила 3 млн-1. Это соответствует Kd урана свыше 1600 мл/г. Пример 28 В этом примере описывается способ преобразования частично кристаллического титаната натрия в кристаллическую титановую кислоту с последующим исследованием свойств титановой кислоты как ионита. 10 г частично кристаллического титаната натрия, полученного способом, раскрытым в примере 5, добавили в 1 л раствора, содержавшего 0,1 моль азотной кислоты. Смесь взбалтывали на протяжении 18 часов, после чего pH раствора увеличился с 1,38 до 1,46. Твердую фазу из раствора отфильтровали, собрали и просушили. Полученную кристаллическую титановую кислоту исследовали на способность обменивать свои ионы на ионы различных металлов. Результаты исследований представлены в таблице 19. Формула изобретения
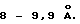 2. Титанат натрия с частично кристаллической слоистой структурой по п.1, имеющий удельную поверхность, составляющую примерно 25 – 200 м2/г. 3. Титанат натрия с частично кристаллической слоистой структурой по п.1, имеющий рентгенограмму, представленную на фиг.1. 4. Титанат натрия с частично кристаллической слоистой структурой по п.1, имеющий межплоскостное расстояние, составляющее 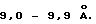 5. Титанат натрия с частично кристаллической слоистой структурой по п.1, имеющий при рентгеноструктурном анализе ширину максимума отражения (001) на половине его высоты, составляющую примерно более 2 и менее 4,5o. 6. Титанат натрия с частично кристаллической слоистой структурой по п.1, имеющий коэффициент распределения Kd стронция, равный, по меньшей мере, 20000 мл/г при продолжительности ионного обмена 24 ч и следующем составе раствора: 55 млн-1 стронция, 5 моль/л азотнокислого натрия и 0,1 моль/л гидроокиси натрия. 7. Титанат натрия с частично кристаллической слоистой структурой по п.1, имеющий формулу Na3,4-4,4Ti8,4-9,2O18,5-20,6. 8. Композиционный ионит, содержащий примерно 40 – 95 вес.% титаната натрия с частично кристаллической слоистой структурой по п.1 и примерно 5 – 60 вес.% связующего. 9. Композиционный ионит по п.8, отличающийся тем, что связующим является органическое связующее из группы, к которой относятся полимеры, крахмалы, целлюлоза и ацетат целлюлозы. 10. Композиционный ионит по п.8, отличающийся тем, что связующим является неорганическое связующее из группы, к которой относятся двуокись кремния, глины, силикаты, керамические материалы, окись алюминия, двуокись титана, двуокись циркония, окись хрома, окись бериллия, окись ванадия, окись церия, окись гафния, окись цинка, окись магния, окись бора, окись тория, система двуокиси кремния и окиси алюминия, система двуокиси кремния и окиси магния, система окиси хрома и окиси алюминия, система окиси алюминия и окиси бора, система двуокиси кремния и двуокиси циркония, и кристаллические цеолитовые алюмосиликаты. 11. Композиционный ионит по п.8, отличающийся тем, что связующим является ацетат целлюлозы. 12. Титанат натрия с частично кристаллической слоистой структурой, имеющий межплоскостное расстояние, составляющее 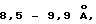 удельную поверхность, составляющую 25 – 200 м2/г, и имеющий при рентгеноструктурном анализе ширину максимума отражения (001) на половине его высоты, составляющую примерно более 1 и менее 4,5o.
13. Титанат натрия с частично кристаллической слоистой структурой, имеющий рентгенограмму, представленную на фиг.1, и полученный путем гидротермальной обработки геля титаната натрия при температуре, примерно составляющей 120 – 200oC, в присутствии гидроокиси натрия.
14. Титанат натрия с частично кристаллической слоистой структурой по п. 13, отличающийся тем, что продолжительность гидротермальной обработки составляет примерно 1 – 20 ч.
15. Титанат натрия с частично кристаллической слоистой структурой по п. 13, отличающийся тем, что гель титаната натрия получен золь-гелевым способом или способом кипячения с конденсацией и обратным стоком.
16. Титанат натрия с частично кристаллической слоистой структурой, имеющий межплоскостное расстояние, составляющее удельную поверхность, составляющую 25 – 200 м2/г, и имеющий при рентгеноструктурном анализе ширину максимума отражения (001) на половине его высоты, составляющую примерно более 1 и менее 4,5o.
13. Титанат натрия с частично кристаллической слоистой структурой, имеющий рентгенограмму, представленную на фиг.1, и полученный путем гидротермальной обработки геля титаната натрия при температуре, примерно составляющей 120 – 200oC, в присутствии гидроокиси натрия.
14. Титанат натрия с частично кристаллической слоистой структурой по п. 13, отличающийся тем, что продолжительность гидротермальной обработки составляет примерно 1 – 20 ч.
15. Титанат натрия с частично кристаллической слоистой структурой по п. 13, отличающийся тем, что гель титаната натрия получен золь-гелевым способом или способом кипячения с конденсацией и обратным стоком.
16. Титанат натрия с частично кристаллической слоистой структурой, имеющий межплоскостное расстояние, составляющее 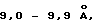 удельную поверхность, составляющую 60 – 110 м2/г, имеющий при рентгеноструктурном анализе ширину максимума отражения (001) на половине его высоты, составляющую примерно более 2 и менее 4,5o, полученный способом, включающим в себя гидротермальную обработку геля титаната натрия, приготовленного способом кипячения с конденсацией и обратным стоком, при температуре, примерно составляющей 150 – 170oC, в присутствии гидроокиси натрия, продолжительностью примерно 1 – 5 ч. удельную поверхность, составляющую 60 – 110 м2/г, имеющий при рентгеноструктурном анализе ширину максимума отражения (001) на половине его высоты, составляющую примерно более 2 и менее 4,5o, полученный способом, включающим в себя гидротермальную обработку геля титаната натрия, приготовленного способом кипячения с конденсацией и обратным стоком, при температуре, примерно составляющей 150 – 170oC, в присутствии гидроокиси натрия, продолжительностью примерно 1 – 5 ч.
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 19.10.2002
Извещение опубликовано: 20.11.2004 БИ: 32/2004
|
||||||||||||||||||||||||||
