Патент на изобретение №2168987
|
||||||||||||||||||||||||||
(54) ГИПОТЕНЗИВНОЕ СРЕДСТВО
(57) Реферат: Изобретение относится к медицине, в частности к кардиологии, и касается применения алкилиденовых производных бензамидразониевых солей в качестве гипотензивных средств. Применение алкилиденовых производных бензамидразониевых солей позволило расширить ассортимент имеющихся гипотензивных средств и повысить эффективность и безопасность лечения гипертонии. 1 табл. Изобретение относится к органической химии и касается фармакологически активных веществ. Ближайшими по структуре соединениями, обладающими гипотензивной активностью, являются производные гуанидина, по механизму действия относящиеся к постганглионарным адренергическим блокаторам (симпатолитикам). К данной группе относится широко применяемое в клинической практике гипотензивное средство – октадин (гуанетидин, изобарин и др.). При внутривенном введении гуанетидина наблюдается кратковременное повышение давления (через 10-20 мин), сменяющееся длительным его снижением, гипотензивный эффект при пероральном приеме развивается медленно, достигает максимума лишь на 7-8 день лечения, но сохраняется длительно. Препарат вызывает ортостатическую гипотонию и усиливает суточные колебания артериального давления, продолжительное применение препарата может привести к отеку легких и развитию резистентности. Из других побочных эффектов возможны жалобы на мышечную слабость, поносы, сухость во рту, головную боль, тошноту (рвоту), усталость, обмороки, нарушение половой функции у мужчин. При применении октадина возникает опасность сердечной недостаточности, нередка резкая брадикардия. Следует соблюдать большую осторожность при назначении его больным с церебральным атеросклерозом, при нарушениях функции почек, абсолютно противопоказан при феохромоцитоме [1]. Более кратковременно по сравнению с октадином действует другой симпатолитик – гуанодрел [2], в ряде случаев ему отдают предпочтение в связи с лучшей переносимостью, однако и он вызывает ряд побочных явлений, характерных для октадина. Побочные эффекты препаратов дебризоквин и гуанаклин схожи с таковыми для гуанетидина, а также они вызывают редкие для октадина явления: дебризоквин – обильное потоотделение и сильную головную боль, гуанаклин – тахикардию, задержку мочи, приступы дурноты, отек, запор, гинекомастию, обмороки. Гуанаклор и гуаноксан помимо недостатков, характерных для октадина, являются гипатотоксичными [1]. Применение другого аналога гуанидина – гуанабенза вызывает ряд побочных эффектов, так возможны жалобы на вялость, сухость во рту, извращение вкуса, частое мочеиспускание и потоотделение, зубную и головную боль, дрожание конечностей, кожную сыпь, нервозность. Для этого препарата также характерен синдром отмены [1]. Исходя из вышесказанного, проблема направленного поиска новых антигипертензивных лекарственных средств, сочетающих в себе терапевтическую эффективность и максимальную безопасность при продолжительном применении, остается по-прежнему актуальной. Среди ранее исследованных соединений известны некоторые производные аминогуанидина, обладающие гипотензивным эффектом [41. Ближайшие аналоги гуанидина – производные амидразонов, изучены мало, однако и среди них найдены некоторые вещества, понижающие кровяное давление [5]. В этой связи представлялось целесообразным продолжить поиск в данном направлении. Фармакологическая активность предлагаемых веществ ранее не была описана, данные соединения использовали только для изучения химических превращений и явления кольчато-цепной таутомерии [6,7). Задача изобретения – создание новых эффективных и безопасных гипотензивных средств, расширение ассортимента имеющихся. Поставленная задача реализуется применением алкилиденовых производных солей бензамидразония в качестве гипотензивных средств. Была исследована гипотензивная активность 1-алкилиден(арилиден)бензамидразоний иодидов. С данной целью получены продукты конденсации бензамидразоний иодида (I) с моно-(II) (анисовый альдегид, ацетон) и дикарбонильными (III) (бензоилуксусный альдегид, ацетилацетон,  – метилацетилацетон, – метилацетилацетон,  , , – -диметилацетилацетон, бензоилацетон, ацетоуксусный эфир) соединениями. – -диметилацетилацетон, бензоилацетон, ацетоуксусный эфир) соединениями.
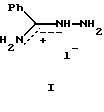 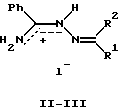 IIа: R1=H, R2=(n-СН3О)С6H5; IIб: R1=R2=CH3; IlIa: R1=H, R2=CH2COC6H5; IIIб: R1=CH3, R2=CH2COCH3; IIIв: R1=CH3, R2=CH(CH3)COCH3; IIIг: R1=CH3, R2=С(CH3)2COCH3; IIIд: R1=CH3, R2=CH2COC6H5; IIIe: R1=CH3, R2=CH2COOC2H5; IIIд: X=Cl, остальные – X=I Бензамидразоний иодид (I) получен по методу [8), перекристаллизован из этанола, т. пл. 176-178oC. Соединения IIб, IIIб-г,д получены по известным методикам: 1-(2′-пропилиден)бензамидразоний иодид (IIб) – по методу [6); 1-бензимидоил-5-окси-3,5-диметил-2-пиразолиний иодид (IIIб), а также 1-бензимидоил-5-окси-3,4,5-триметил-2-пиразолиний иодид (IIIв), 3,3-диметил-2,4-пентандиона бензамидразоний иодид (IIIг) и 1-этокси-1,3-бутандиона бензамидразоний иодид (IIIe)-по общему методу [7]. 1-(4′-Метоксибензилиден)бензамидразоний иодид (IIа) синтезирован аналогично соединению IIб по методу [6) с выходом 97%. Т.пл. 168-171oC, перекристаллизован из этанола. Найдено, %: С 47,22; H 4,21; N 10,92. С15H16N3OI. Вычислено, %: С 47,26; H 4,23; N 11,02. ПМР-спектр (DMFA-d7),  м.д.: 3,90 с (OCH3); 7,0-7,4, 7,6-8,2 м (Hаром.); 8,90 с (CH), 9,84, 10,15 уш. с.(NH); сигнал NH+ делокализован.
1-Фенил-1,3-пропандиона бензамидразоний иодид (IIIa) м.д.: 3,90 с (OCH3); 7,0-7,4, 7,6-8,2 м (Hаром.); 8,90 с (CH), 9,84, 10,15 уш. с.(NH); сигнал NH+ делокализован.
1-Фенил-1,3-пропандиона бензамидразоний иодид (IIIa)Растворяли 0,08 моль (21,04 г) бензамидразоний иодида в 40 мл метанола и при перемешивании и охлаждении прикапывали к раствору 0,085 моль (12,58 г) бензоилуксусного альдегида. Смесь выдерживали при t= 18-25oC в течение 24 ч, затем растворитель отгоняли в вакууме (при 15 мм рт. ст.) без нагревания, твердый остаток перекристаллизовывали или переосаждали эфиром из раствора в хлороформе. Выход 64%. Т.пл. 60-63oC, очищен переосаждением эфиром из хлороформенного раствора. Найдено, %: С 63,70; H 5,32; N 13,91. С16H16N3OI. Вычислено, %: С 63,74; H 5,35; N 13,94. ПМР-спектр (DMSO-d6),  м.д.: 4,28 д (CH2, 6 Гц); 6,03 д (CH, 10 Гц); 7,2-8,2 м (Hаром.); 9,55,9,90 уш.с.(NH); 12,90 уш.с.(NH+).
1-Фенил-1,3-бутандиона бензамидразоний хлорид (IIIд). Насыщенные водные растворы 0,08 моль (21,04 г) бензамидразоний иодида и 0,1 моль (18,50 г) натриевой соли бензоилацетона сливали при перемешивании, выдерживали на холоду (t= 4-6oC) до выпадения желтого осадка свободного основания (обычно 24 ч). Отфильтровывали, твердый осадок при необходимости перекристаллизовывали, затем растворяли в диэтиловом эфире. Хлорид 1-фенил-1,3-бутандиона бензамидразония получен пропусканием эквимолярного количества хлороводорода через эфирный раствор его основания (до полного обесцвечивания раствора). Выпавшие кристаллы отфильтровывали, сушили. Общий выход 47 %. Т.пл. 182-187oC. Найдено, %: С 64,68; H 5,71; N 13,31. C17H18N3OCl. Вычислено, %: С 64,72; H 5,75; N 13,32. ПМР-спектр (DMFA-d7), м.д.: 4,28 д (CH2, 6 Гц); 6,03 д (CH, 10 Гц); 7,2-8,2 м (Hаром.); 9,55,9,90 уш.с.(NH); 12,90 уш.с.(NH+).
1-Фенил-1,3-бутандиона бензамидразоний хлорид (IIIд). Насыщенные водные растворы 0,08 моль (21,04 г) бензамидразоний иодида и 0,1 моль (18,50 г) натриевой соли бензоилацетона сливали при перемешивании, выдерживали на холоду (t= 4-6oC) до выпадения желтого осадка свободного основания (обычно 24 ч). Отфильтровывали, твердый осадок при необходимости перекристаллизовывали, затем растворяли в диэтиловом эфире. Хлорид 1-фенил-1,3-бутандиона бензамидразония получен пропусканием эквимолярного количества хлороводорода через эфирный раствор его основания (до полного обесцвечивания раствора). Выпавшие кристаллы отфильтровывали, сушили. Общий выход 47 %. Т.пл. 182-187oC. Найдено, %: С 64,68; H 5,71; N 13,31. C17H18N3OCl. Вычислено, %: С 64,72; H 5,75; N 13,32. ПМР-спектр (DMFA-d7),  м.д.: 2,12, 2,26 с и 2,34 с (CH3); 4,30 с (CH2); 5,48 и 5,69 с (CH); 7,2-7,6; 7,8- 8,1 м (Hаром.), сигналы NH-протонов частично перекрыты мультиплетом Hаром., частично делокализованы.
Гипотензивное действие соединений изучали на нормотензивных крысах линии Вистар, а также гипертензивных животных линии SHR обоего пола, наркотизированных гексеналом (60 мг/кг внутрибрюшинно). Изменение давления контролировали прямым способом. Все вещества вводили в виде водных растворов внутривенно в дозах 0,01-200 мг/кг.
Острую токсичность определяли на белых мышах при внутрибрюшинном введении, LD50 вычисляли методом Миллера-Тейнтера [9).
Установлено, что при однократном внутривенном введении лабораторным животным соединения вызывали значительное и продолжительное (в течение 24 ч наблюдения) падение артериального давления. Диапазон эффективных доз колебался в широких пределах от 0,01 до 150 мг/кг (см. табл.).
Обнаружено, что при введении в малых дозах (менее 2-5 мг/кг) все вещества вызывали продолжительную стабильную гипотензию. Увеличение вводимой дозы для большинства исследуемых соединений приводило к многофазному изменению артериального давления, характерному для симпатолитиков. Так, сначала развивалась короткая фаза гипотензии, затем наблюдалось некоторое повышение кровяного давления, которое продолжалось в среднем 10-30 мин и сопровождалось усилением и учащением сердечных сокращений. После гипертензивной фазы развивалась длительная гипотензия.
Как видно из табл. эффективные дозы соединений в основном не превышают 5 мг/кг, т. е. их гипотензивное действие при внутривенном введении, в отличие от октадина, не сопровождается нежелательной прессорной реакцией.
Гипотензивный эффект всех изученных веществ в малых дозах у нормо- и гипертензивных животных был выражен в равной степени. При увеличении дозы (более 10-15 мг/кг) были отмечены различия: в одних и тех же дозах понижение артериального давления у нормо- и гипертензивных животных различалось. Так, чем выше было кровяное давление до введения препаратов, тем в большей степени проявлялось их гипотензивное действие.
При сопоставлении полученных веществ с известными средствами – клонидином и гуанетидином [10] – становится очевидным, что изученные соединения по многим показателям, таким как широта терапевтического действия, величина и длительность гипотензивного эффекта, низкая токсичность и др., превосходят применяемые в медицинской практике гипотензивные препараты как симпатолитического, так и других механизмов действия (см. табл.). Наличие же выраженного эффекта пролонгации у синтезированных соединений позволит сократить как терапевтическую дозу, так и частоту их приема.
Обнаружено, что помимо нормализации артериального давления соединения I, IIб, IIIв вызывают снижение эмоциональной нагрузки, снятие болевого синдрома, нормализуют сердечный ритм, устраняют гипоксию, упомянутые эффекты благоприятствуют лечению гипертонической болезни.
Таким образом, все предложенные вещества в той или иной степени проявляют гипотензивное действие, что делает их перспективными для дальнейших углубленных исследований.
СПИСОК ЛИТЕРАТУРЫ м.д.: 2,12, 2,26 с и 2,34 с (CH3); 4,30 с (CH2); 5,48 и 5,69 с (CH); 7,2-7,6; 7,8- 8,1 м (Hаром.), сигналы NH-протонов частично перекрыты мультиплетом Hаром., частично делокализованы.
Гипотензивное действие соединений изучали на нормотензивных крысах линии Вистар, а также гипертензивных животных линии SHR обоего пола, наркотизированных гексеналом (60 мг/кг внутрибрюшинно). Изменение давления контролировали прямым способом. Все вещества вводили в виде водных растворов внутривенно в дозах 0,01-200 мг/кг.
Острую токсичность определяли на белых мышах при внутрибрюшинном введении, LD50 вычисляли методом Миллера-Тейнтера [9).
Установлено, что при однократном внутривенном введении лабораторным животным соединения вызывали значительное и продолжительное (в течение 24 ч наблюдения) падение артериального давления. Диапазон эффективных доз колебался в широких пределах от 0,01 до 150 мг/кг (см. табл.).
Обнаружено, что при введении в малых дозах (менее 2-5 мг/кг) все вещества вызывали продолжительную стабильную гипотензию. Увеличение вводимой дозы для большинства исследуемых соединений приводило к многофазному изменению артериального давления, характерному для симпатолитиков. Так, сначала развивалась короткая фаза гипотензии, затем наблюдалось некоторое повышение кровяного давления, которое продолжалось в среднем 10-30 мин и сопровождалось усилением и учащением сердечных сокращений. После гипертензивной фазы развивалась длительная гипотензия.
Как видно из табл. эффективные дозы соединений в основном не превышают 5 мг/кг, т. е. их гипотензивное действие при внутривенном введении, в отличие от октадина, не сопровождается нежелательной прессорной реакцией.
Гипотензивный эффект всех изученных веществ в малых дозах у нормо- и гипертензивных животных был выражен в равной степени. При увеличении дозы (более 10-15 мг/кг) были отмечены различия: в одних и тех же дозах понижение артериального давления у нормо- и гипертензивных животных различалось. Так, чем выше было кровяное давление до введения препаратов, тем в большей степени проявлялось их гипотензивное действие.
При сопоставлении полученных веществ с известными средствами – клонидином и гуанетидином [10] – становится очевидным, что изученные соединения по многим показателям, таким как широта терапевтического действия, величина и длительность гипотензивного эффекта, низкая токсичность и др., превосходят применяемые в медицинской практике гипотензивные препараты как симпатолитического, так и других механизмов действия (см. табл.). Наличие же выраженного эффекта пролонгации у синтезированных соединений позволит сократить как терапевтическую дозу, так и частоту их приема.
Обнаружено, что помимо нормализации артериального давления соединения I, IIб, IIIв вызывают снижение эмоциональной нагрузки, снятие болевого синдрома, нормализуют сердечный ритм, устраняют гипоксию, упомянутые эффекты благоприятствуют лечению гипертонической болезни.
Таким образом, все предложенные вещества в той или иной степени проявляют гипотензивное действие, что делает их перспективными для дальнейших углубленных исследований.
СПИСОК ЛИТЕРАТУРЫ1. Ред. В.В. Закусов. Клиническая фармакология. Медицина, М., 1978, с. 92, 174. 2. Л.Н.Яхонтов, С.C.Либерман. УФЖ, N 3, с. 269-286, 1987. 3. Ed. J.E.F. Reynolds, Martindale The Extra Pharmacopoeia, 28 Edition, The Pharmaceuti-cal Press, London, 1982, pp. 142-148. 4. J.Augstein, S.M.Green, A.M.Monro, ets. J.Med.Chem., Vol. 10 (3), pp. 391- 400, 1967. 5. Ch. St. Davis, Patent USA 3458500, 1969. РЖХим 17H279, 1970. 6. B. A.Хрустален, В.П.Сергутина, К.Н.Зеленин и др. ХГС, N 9, с. 1264-1267, 1982. 7. В.А.Хрусталев, О.В.Солод, К.Н.Зеленин. ЖОрХ, Т. 22 (3), с. 500, 1986. 8. K.M. Doyle, F.Kurzer, Synthesis, N 8, pp. 583-584, 1974. 9. М. Л. Беленький. Элементы количественной оценки фармакологического эффекта. Гос. издат. мед. литературы, Л., 1963, с. 72, 10. R.A.Maxwell, A.J.Plummer, F.Schneider etc., J.Pharm.Exp.Ther., vol. 128 (1), pp. 22-29, 1960; C.T. Dollery, B.Sc. Birm, D.Emslie-Smith etc., Lancet, ii, pp. 381-387, 1960; LH. Page, H.P.Dustan, JAMA, vol. 170 (11), p. 1265, 1959. Формула изобретения
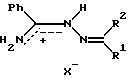 где при R1 = H, R2 = -(n-CH3O)C6H5, -CH2COC6H5, X = I; при R1 = CH3, R2 = CH3, -CH2COCH3, -CH(CH3)COCH3, C(CH3)2COCH3, -CH2COOC2H5, X = I; при R1 = CH3, R2 = CH2COC6H5, X = Cl. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 16.04.2005
Извещение опубликовано: 27.03.2006 БИ: 09/2006
|
||||||||||||||||||||||||||

 -дикетонами. Журнал органической химии. Т.XXII. Вып.3. 1986.
-дикетонами. Журнал органической химии. Т.XXII. Вып.3. 1986.