Патент на изобретение №2399378
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ЭКСТРАКТ КОРЫ ДЕРЕВА РОДА CORYNANTHE И ЕГО ПРИМЕНЕНИЕ, ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПИЩЕВЫЕ ПРОДУКТЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ЕГО СОДЕРЖАЩИЕ
(57) Реферат:
Настоящее изобретение относится к медицине. Экстракт коры дерева Corynanthe pachyceras предназначен для лечения и/или профилактики заболеваний нижних отделов мочевыводящих путей, сексуальных расстройств, нарушений метаболизма липидов, заболеваний сердечно-сосудистой системы и острых и хронических болевых состояний, содержит полифенолы и алкалоиды. Его получают следующим способом: проводят (a) экстрагирование сухой и измельченной коры дерева Corynanthe pachyceras органическим растворителем или смесью нескольких органических растворителей или смесью одного или нескольких органических растворителей и воды при температуре от 10 до 100°С, причем органический растворитель представляет собой спирт или кетон, (b) отделение экстрагированного растительного материала от экстрагирующего раствора, например, при помощи фильтрации, (c) при необходимости повторное экстрагирование растительного материала при помощи растворителя в соответствии со стадией (а) с последующей сепарацией в соответствии со стадией (b), (d) объединение экстрагированных растворов, полученных на стадиях (b) и (с), (е) выпаривание и высушивание объединенного раствора, полученного на стадии (d), с получением сухого экстракта. На основе экстракта получают лекарственное средство, пищевой продукт и фармацевтическую композицию. Изобретения позволяют реализовать указанное назначение. 4 н. и 5 з.п. ф-лы, 6 табл., 1 ил.
Настоящее изобретение относится к экстрактам коры деревьев рода Corynanthe, в частности Corynanthe Pachyceras, а также к их использованию для лечения и профилактики заболеваний нижних отделов мочевыводящих путей, сексуальных расстройств, нарушений метаболизма липидов, сердечно-сосудистых заболеваний, а также острых и хронических болевых состояний. Настоящее изобретение также относится к лекарственным средствам, диетическим пищевым продуктам и фармацевтическим композициям, содержащим указанные экстракты. Доброкачественная гиперплазия предстательной железы (ВРН, от англ. Benign Prostatic Hyperplasia) и сопутствующие симптомы со стороны нижних отделов мочевыводящих путей (LUTS, от англ. Lower Urinary Tract Symptoms) являются одной из самых частых урологических патологий у мужчин. Статистические данные свидетельствуют о том, что у одной трети мужчин в возрасте старше 50 лет имелись симптомы LUTS в течение жизни и 25% из них требуется хирургическое вмешательство. Процент мужчин, страдающих от BPH/LUTS, достигает более 90% на 9 десятке жизни. В Федеративной Республике Германия около 4 миллионов пациентов получают лечение по поводу указанного комплекса симптомов в течение года. В связи с увеличением средней продолжительности предстоящей жизни и ухудшением общего состояния здоровья популяции ожидается рост частоты данной патологии в будущем (R.В.Moreland et al., J. Pharmacol. Exp. Ther. 2004, 308, 797). Несмотря на существенную клиническую важность BPH/LUTS этиология и патогенез указанных заболеваний к настоящему времени недостаточно изучены. Считается, что помимо пожилого возраста эндогенная продукция андрогенов также является важным предрасполагающим фактором в развитии ВРН. Таким образом, считается, что ВРН является эндокринной патологией стареющих мужчин, которая является следствием перестройки гормонального фона с увеличением возраста. С гистологической точки зрения, ВРН представляет собой доброкачественный рост эпителия и стромальных компонентов предстательной железы. Поскольку предстательная железа расположена в уретре, рядом с начальным отделом мочеиспускательного канала, при ее увеличении появляются признаки обструкции мочевыводящих путей, которые сопровождаются такими симптомами, как поллакиурия, никтурия, ощущение неполного опорожнения мочевого пузыря и отсроченное мочеиспускание. Результатом застоя мочи на поздних стадиях может быть развитие почечной недостаточности и уремии. Кроме того, в результате застоя мочи и расширения мочеиспускательного тракта может развиваться абактериальный простатит, сопутствующие и рецидивирующие инфекции мочеполового тракта, которые также способствуют развитию нарушений мочеиспускания в дополнение к обструктивному компоненту. Помимо статического компонента, обусловленного увеличением предстательной железы, и механических нарушений мочеиспускания в патогенезе BPH/LUTS присутствует и динамический компонент, который объясняется повышенным тонусом гладкой мускулатуры. Выраженность каждого из указанных компонентов может существенно варьировать от пациента к пациенту. Это объясняет тот факт, что между размером предстательной железы и выраженностью симптомов имеется лишь несущественная корреляция (C.G.Roehbrom and D.A.Schwinn, J.Urol. 2004, 171, 1029). В сущности, аналогичные изменения тонуса гладкой мускулатуры участвуют в патогенезе других заболеваний нижних отделов мочевыводящих путей, в том числе и у женщин, таких как стрессовое недержание мочи, неотложное недержание мочи и заболевания, связанные с опорожнением мочевого пузыря. В то время как термин ВРН относится к гистологическому или макроскопическому диагнозу гиперплазии предстательной железы, сопутствующий термин LUTS, который объединяет такие состояния, как поллакиурия и никтурия, а также неполное или отсроченное мочеиспускание, играет более важную роль для самих пациентов. Существует множество способов лечения ВРН, от тактики “жди и наблюдай” (“настороженное наблюдение”) до открытой простатэктомии. Благодаря своей эффективности, трансуретральная резекция предстательной железы, которая осуществляется в Германии приблизительно 33500 мужчинам ежегодно, считается золотым стандартом хирургии. Однако поскольку любое инвазивное вмешательство сопровождается риском летального исхода и не осуществимо у большинства пациентов, в особенности у пациентов с небольшой степенью ВРН, необходимо искать новые подходы к лечению с использованием лекарственных средств. Помимо фито-фармацевтических препаратов, которые обычно используются на ранних стадиях заболевания, существует множество лекарственных средств, к которым относятся, главным образом, Применение В целом, ВРН развивается в присутствии биологически активных мужских половых гормонов. В действительности, ВРН никогда не наблюдается у мужчин, которым была осуществлена кастрация в возрасте до 40 лет, или у которых андрогены в предстательной железе не синтезируются или синтезируются в недостаточном количестве в результате гипофункции гипофиза. Аналогично, нормальное развитие предстательной железы и развитие ВРН не происходит в том случае, когда имеется наследственный дефект или отсутствуют рецепторы к андрогенам (например, в случае синдрома тестикулярной феминизации). С биологической точки зрения наиболее важным андрогеном является дигидротестостерон (DHT, от англ. Dihydrotestosteron), который образуется из тестостерона при воздействии 5- Несмотря на то что андрогены играют ключевую роль в нормальном развитии и функционировании предстательной железы, а также в развитии ВРН, лишь только одних мужских половых гормонов недостаточно для роста клеток предстательной железы. В множестве экспериментальных исследований было показано, что стимулирующий эффект андрогенов на рост клеток in vivo опосредуется локальным синтезом факторов роста, а дисфункция паракринного или аутокринного механизма за контролем роста эпителиальных и стромальных компонентов предстательной железы играет существенную роль в развитии ВРН. В настоящее время в предстательной железе идентифицировано множество факторов роста и их рецепторов (например, эпидермальный фактор роста [EGF], альфа-трансформирующий фактор роста- Факторы роста осуществляют свое биологическое действие путем связывания со специфическими рецепторами на поверхности клеток, которые обладают существенной тирозинкиназной активностью. После связывания с лигандом во внутриклеточных доменах рецепторов происходит фосфорилирование остатков тирозина, что запускает последовательный каскад внутриклеточных реакций. Среди указанных реакций необходимо отметить стимулирование синтеза белка и ДНК, а также активацию пролиферации клеток. Следовательно, считается, что на основе ингибиторов тирозинкиназы можно получить лекарственные средства, которые будут эффективными для лечения заболеваний, сопровождающихся повышенной пролиферацией клеток (например, раковых заболеваний, атеросклероза, псориаза) (A.Levitzki and A.Gazit, Science, 1782-1788 (19995)). Однако в настоящее время мало внимания уделяется указанному механизму действия в свете лечения ВРН. В последние годы в различных эпидемиологических исследованиях было показано, что между BPH/LUTS и частотой эректильной дисфункции (ED, от англ. Erectile Dysfunction) существует тесная корреляция. Например, в исследовании MSAM-7 было показано, что распространенность ED у мужчин без LUTS в возрасте от 50 до 80 лет составляет приблизительно 25%. Данный показатель возрастает у пациентов, имеющих тяжелые симптомы, вплоть до 80%. Кроме того, частота возникновения ED увеличивается с появлением других сопутствующих заболеваний, таких как гипертензия, диабет, гиперхолестеринемия, стенокардия и депрессия (М.Shabbir et al., Curr. Med. Res. Opin. 20, 603, 2004). Расслабление пениса главным образом опосредуется связыванием норадреналина с Революционным в лечении ED стало открытие препарата силденафил, ингибитора PDE5, который ингибирует деградацию cGMP. Однако силденафил имеет множество побочных эффектов (таких как головная боль, нарушение зрения, диспепсия, гемодинамические эффекты). Кроме того, имеются доказательства в пользу того, что эффективность препарата уменьшается с увеличением продолжительности лечения (М. Shabbir et al., Curr. Med. Res. Opin. 20, 603, 2004). Кроме того, приблизительно у 30-60% пациентов силденафил не может использоваться по причине тяжести заболевания и наличия противопоказаний. В настоящее время нет большого клинического опыта по применению новых PDE5 ингибиторов. Также для лечения ED активным соединением является PGE1, однако его необходимо вводить непосредственно в уретру. Другая возможность лечения ED заключается в применении апоморфина, который является агонистом допамина в центральной нервной системе. Его можно использовать для лечения относительно легких случаев ED. Несмотря на то что данный препарат имеет относительно мало побочных эффектов (тошнота, реакции со стороны сердечно-сосудистой системы), его сублингвальное применение, направленное на то, чтобы избежать первого этапа метаболизма в печени, в настоящее время считается неблагоприятным (R.В.Moreland et al., J.Pharmacol. Exp. Ther. 2004, 308, 797). Таким образом, остается необходимость в поиске эффективных лекарственных средств для лечения ED, которые имеют мало побочных эффектов. В публикации 1999 года исследователи с удивлением сообщают о том, что количество женщин с сексуальной дисфункцией значительно превышает количество мужчин с данной проблемой (приблизительно 31%) в США (Е.О.Laumann et al., JAMA 281, 537, 1999). В целом, сексуальную дисфункцию у женщин классифицируют на четыре основных категории: пониженное сексуальное влечение или половая аверсия, пониженная сексуальная возбудимость, болезненный половой акт (вагинизм, диспарейния) и нарушения оргазма. Указанные нарушения наблюдаются в следующих процентных соотношениях: 30% (пониженное сексуальное влечение), 20% (пониженная сексуальная возбудимость), 10-15% (болезненный половой акт) и 10-15% (нарушения оргазма), хотя между всеми указанными вариантами имеется тесная взаимосвязь. Регулярная сексуальная функция у мужчин и у женщин контролируется посредством ряда циклических процессов, которые включают: ментальное ожидание (сексуальное влечение), эффективное кровенаполнение сосудов (эрекция у мужчин, набухание клитора и увлажнение влагалища у женщин), оргазм и конечное расслабление. Вся указанная последовательность событий обеспечивается сбалансированным действием парасимпатической и симпатической нервной системы. Ключевым моментом является кровенаполнение сосудов половых органов. Поскольку существует аналогия между пенисом и клитором, благодаря схожей анатомической структуре и иннервации пещеристых тел, считается, что те фармакологические механизмы, которые применяются для лечения эректильной дисфункции у мужчин, могут быть эффективными и для лечения сексуальных нарушений у женщин, в особенности, связанных с пониженной сексуальной возбудимостью. Таким образом, целью настоящего изобретения является создание лекарственных средств, которые положительно влияют на динамический и статический компонент ВРН за счет ингибирования В соответствии с настоящим изобретением поставленная цель осуществляется за счет использования экстрактов коры растений рода Corynanthe, предпочтительно растений вида Corynanthe pachyceras, для лечения и профилактики заболеваний нижних отделов мочевыводящих путей у мужчин и женщин (например, доброкачественной гиперплазии предстательной железы, LUTS, карциномы предстательной железы, нарушений опорожнения мочевого пузыря, задержки мочи, стрессового недержания мочи и неотложного недержания мочи), сексуальных расстройств у мужчин и женщин (например, импотенции, эректильной дисфункции, преждевременной эякуляции, нарушений либидо, фригидности и аноргазмии), нарушений липидного обмена (например, гиперхолестеринемии, гиперлипидемии, гипертриглицеридемии), заболеваний сердечно-сосудистой системы (например, дисфункции эндотелия, гипертонии, атеросклероза или рестеноза после вазодилятации или операций шунтирования), а также острых и хронических болевых состояний, таких как мигрень, нейропатические боли (например, в случае сахарного диабета), фантомные боли в конечностях, аллодиния, боли после повреждения тканей или в случае воспалительных заболеваний (например, постгерпетическая невралгия). Другим объектом настоящего изобретения являются экстракты растений рода Corynanthe, предпочтительно растений вида Corynanthe pachyceras, которые имеют сбалансированное соотношение эффективных компонентов, а также лекарственные средства и пищевые продукты, предназначенные для лечения и профилактики заболеваний нижних отделов мочевыводящих путей, сексуальных расстройств, нарушений липидного обмена, сердечно-сосудистых заболеваний, а также острых и хронических болевых состояний, которые характеризуются содержанием экстракта, заявленного в соответствии с настоящим изобретением, а также фармацевтические композиции для перорального, парентерального или местного применения. Используемый здесь термин “пищевой продукт” относится к диетическому пищевому продукту, диетической пищевой добавке, а также к лекарственным пищевым добавкам и диетическим пищевым добавкам. Corynanthe pachyceras (сем. Мареновые) – это дерево высотой 15-20 м с диаметром ствола до 60 см, растущее в вечнозеленых влажных тропических лесах в Восточной Африке (от Сьерра-Лионе до Заира). Древесина обычно используется для строительства, а также для получения цемента и штукатурки. Высушенная кора широко используется в традиционной медицине. Кору жуют при простуде и используют в форме отвара при лепре, расстройствах желудка, диареи или нарушений со стороны сердечно-сосудистой системы и почек. Кору заваривают как чай и применяют в качестве антипиретического агента в случае малярии и в качестве афродизиака и расслабляющего средства. Кора дерева Corynanthe pachyceras содержит приблизительно 6% индоалкалоидов, которые подразделяют на следующие группы: алкалоиды кориантеина (например, дигидрокориантеин, кориантеин, кориантеидин) или алкалоиды йохимбина (например, кориантин,
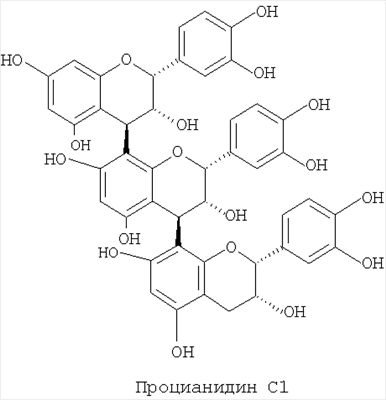
В заявке на патент от 1971 года раскрывается антигипертензивное и седативное действие водного раствора сухого экстракта коры дерева вида Corynanthe pachyceras (ВЕ 758049, Omnium Chimique SA, 1971). Авторами настоящего изобретения было обнаружено, что спиртовые или кетоновые, предпочтительно водно-спиртовые экстракты коры деревьев рода Corynanthe, в частности дерева рода Corynanthe pachyceras, обладают множеством дополнительных биологических эффектов, включая ингибирование клеточной пролиферации, эндотелио-зависимая способность расширять сосуды, способность понижать уровень холестерина, анальгетический и антиоксидантный эффекты, помимо антагонистического действия в отношении Экстракты коры дерева рода Corynanthe pachyceras, заявленные в соответствии с настоящим изобретением и содержащие полифенолы и алкалоиды, могут быть получены при помощи следующего способа: (a) экстрагирование сухой и измельченной коры дерева рода Corynanthe органическим растворителем или водой или смесью одного или более органического растворителя и/или воды при температуре от 10 до 100°С; (b) отделение экстрагированного растительного материала от экстрагирующего раствора, например, при помощи фильтрации; (c) при необходимости, повторное экстрагирование растительного материала при помощи растворителя в соответствии со стадией (а) с последующей сепарацией в соответствии со стадией (b); (d) объединение экстрагированных растворов, полученных на стадиях (b) и (с); (e) выпаривание и высушивание объединенного раствора, полученного на стадии (d), с получением сухого экстракта. Предпочтительными органическими растворителями, которые могут использоваться на стадии (а), являются спирты и кетоны, при этом из спиртов предпочтительно используется этанол. Наиболее предпочтительно использовать смесь спирта и воды. При осуществлении экстракции на стадии (а) необходимо принимать во внимание возможность дополнительного осуществления выщелачивания и фильтрации. Согласно общему правилу стадия (с) осуществляется однократно, однако изменение стадии (с) или множественное повторение также возможно. Высушивание на стадии (е) может осуществляться при помощи любого известного способа, такого как лиофилизация или высушивание в вакууме при комнатной или повышенной температуре. Дерево вида Corynanthe pachyceras применяется как наиболее предпочтительный представитель рода Corynanthe. Экстракты коры дерева рода Corynanthe, заявленные в соответствии с настоящим изобретением, содержат как полифенолы, так и алкалоиды в соотношении, необходимом для оптимального использования. Следовательно, содержание полифенолов предпочтительно составляет по крайней мере 15%, более предпочтительно по крайней мере 24%, а содержание алкалоидов предпочтительно составляет по крайней мере 8%, наиболее предпочтительно по крайней мере 12%. Типичными полифенолами, которые были выделены авторами настоящего изобретения из дерева вида Corynanthe pachyceras, являются эпикатехин, процианидин В2 и процианидин С1. Конечно, полифенолы Corynanthe pachyceras не ограничиваются тремя указанными соединениями.
Содержание отдельных полифенолов определяют путем установления общего содержания полифенолов при помощи метода Фолина-Чикальтеу. Дополнительно или альтернативно можно определить также содержание эпикатехина, процианидина В2 и процианидина С1. Содержание указанных алкалоидов является суммой количеств отдельных алкалоидов коринантина, Экстракты и фракции экстрактов, заявленные в соответствии с настоящим изобретением, могут вводиться в форме капель, порошка, гранул, таблеток, покрытых оболочкой (драже), или капсул предпочтительно перорально. Однако возможно парентеральное введение в форме раствора для инъекций или местное введение в форме крема, мази, суппозиториев, пластырей или аналогичных лекарственных форм. Для получения таблеток экстракт смешивают с подходящим фармацевтически доступным адъювантом, таким как лактоза, целлюлоза, диоксид силикона, кроскармеллоза и стеарат магния, и прессуют в таблетки, которые могут, при необходимости, иметь покрытие, состоящее, например, из гидроксиметилпропилцеллюлозы, полиэтиленгликоля, красителей (таких как диоксид титана, оксид железа) и талька. Экстракты, заявленные в соответствии с настоящим изобретением, также могут быть включены в состав капсул, возможно, при добавлении адъювантов, таких как стабилизаторы, наполнители и т.д. Ежедневно вводится доза экстракта, составляющая от 5 до 2000 мг, предпочтительно от 10 до 1000 мг и особенно предпочтительно от 50 до 500 мг. Эффективность экстрактов коры дерева рода Corynanthe pachyceras, заявленных в соответствии с настоящим изобретением, подтверждается в экспериментах, описанных ниже. Фармакологические исследования Исследование способности связываться с Исследование взаимодействий экстрактов дерева вида Corynanthe и фракций указанных экстрактов с Экстракты, заявленные в соответствии с настоящим изобретением, или их алкалоидные или полифенольные фракции растворяют при помощи DMSO в 150 мкл связывающего буфера и инкубируют вместе с 50 мкл мембран клеток головного мозга (2.5 мг/мл белка) и 50 мкл радиоактивного лиганда в связывающем буфере в течение 45 минут при комнатной температуре. Для исследования взаимодействий с Результаты исследования представлены в Таблице 1. Очевидно, что экстракт коры дерева рода Corynanthe, заявленный в соответствии с настоящим изобретением, ингибирует связывание 3Н-празозина с
Исследование ингибирования клеточной пролиферации, опосредованной факторами роста Влияние экстрактов в целом и их отдельных фракций на клеточную пролиферацию, индуцированную факторами роста, изучают на фибробластах линии NIN-3T3 мышей. Клетки культивируют в среде Игла, модифицированной по Дульбекко (DMEM), обогащенной 10% фетальной телячьей сывороткой (FCS), 2 мМ глутамина и раствором антибиотика/антимикотика. Культивационную среду регулярно заменяют дважды в неделю. Через 4 дня после последнего пересева адгезированные клетки открепляют от поверхности колбы для культивирования клеток при помощи раствора трипсин/ЭДТА и суспендируют при плотности 50000 клеток на мл в DMEM, обогащенной 0.5% FCS. Затем клетки переносят в объеме 200 мкл на лунку на планшеты для микротитрования (F-форма) и инкубируют при 37°С в течение 96 часов. После замещения среды (DMEM без FCS) и добавления соединений через 60 минут добавляют рекомбинантный человеческий фактор роста тромбоцитов ВВ (PDGF-BB) в концентрации 10 нг/мл. Затем клетки культивируют снова в течение 24 часов при 37°С в инкубаторе. За 6 часов до сбора клеток в каждую лунку добавляют 0.5 мкКи метил-3Н-тимидина. По окончании периода инкубации планшеты для микротитрования центрифугируют в течение 5 минут при 400 g, а клеточный супернатант аккуратно собирают пипеткой. Клетки открепляют от поверхности колбы при помощи раствора трипсин/ЭДТА и затем собирают на стекловолоконных фильтрах (тип G-10, ICH-201) при помощи клеточного коллектора (Inotech). Включение 3Н-тимидина в новые синтезированные ДНК определяют при помощи линейного анализатора (LB 2842, Berthold). Ингибирование клеточной пролиферации в присутствии экстрактов и их фракций определяют при сравнении с контролем, который анализируют параллельно в каждом случае. Результаты исследования представлены в Таблице 2. Полученные результаты демонстрируют, что экстракты, заявленные в соответствии с настоящим изобретением, обладают способностью ингибировать клеточную пролиферацию, при этом данный эффект обусловлен главным образом полифенольной фракцией.
Исследование сосудорасширяющего эффекта Для изучения сосудорасширяющего эффекта экстрактов и их фракций, заявленных в соответствии с настоящим изобретением, исследуют их влияние на сокращение изолированной аорты крыс линии Спраг-Доули (Janvier, Le Genest, France). Сразу после извлечения органы переносят в раствор Тирода (в мМ: NaCl 118.2, NaHCO3 24.8, KCl 4.6, CaCl2 2.5, MgSO4 1.2, KН2РО4 1.2, глюкоза 10) и оставляют для очищения от прилегающей соединительной ткани. Затем приготавливают сосудистые кольца толщиной 4 мм. Для отдельных экспериментов удаляют эндотелий. Для этой цели кольца аорты помещают на стальную канюлю, аккуратно сдавливают на канюле, при этом самый внутренний слой удаляется путем вращения с последующим продвижением в продольном направлении. Кольца аорты фиксируют в чане для органов (20 мл; Hugo Sachs, Hugstetten), заполненном раствором Тирода, при помощи металлических крючков. Среду для культивирования (37°С) постоянно насыщают углеводом (рН 7.4). В экспериментах по определению расширения сосудов, предварительно суженных фенилэфрином (РЕ), к раствору Тирода последовательно добавляют следующие соединения: пропанолол-НСl (6 мкМ, RBI), кортикостерон-HCl (6 мкМ, Sigma) и дезипрамин (0.6 мкМ, Sigma). Для экспериментов по определению расширения сосудов после стимуляции при помощи U-46619 добавляют индометацин (2.8 мкМ, Sigma). Давление органов измеряют изометрически при помощи силового трансдуктора (Statham UC2, Hugo Sachs) под предварительной нагрузкой 1.0 г и регистрируют при помощи 4-канального записывающего устройства (Linearcorder, Graphtec). После фазы уравновешивания в течение 30 минут добиваются четырех сокращений при помощи РЕ (0.15 мкг/мл, ЕК 0.74 мкМ) с интервалом в 15 минут для достижения надлежащего сокращения органов. После четвертого добавления РЕ добавляют тестируемые соединения в нарастающих концентрациях до достижения концентрационного максимума (кумулятивный эффект). В конце эксперимента зависимость расширения сосудов от эндотелия тестируют путем введения ацетилхолина (0.25 мкг/мл, ЕК 1.38 мкМ). Аналогичный эксперимент осуществляют также для изучения расслабляющего эффекта на кольца аорты без эндотелия. После фазы уравновешивания в течение 30 минут добиваются трех сокращений при помощи РЕ (0.15 мкг/л, ЕК 0.74 мкМ). После достижения максимального сокращения после третьего введения РЕ наносят ацетилхолин (0.25 мкг/мл, ЕК 1.38 мкМ), чтобы подтвердить полное удаление эндотелия. После вымывания ацетилхолина через 25 минут индуцируют сокращение при помощи РЕ и добавляют тестируемое соединение в нарастающих концентрациях. Анализ расслабляющего эффекта после индуцированного сокращения U-46619 (0.022 мкг/мл, ЕК 0.063 мкМ) или KCl (3 мг/мл, ЕК 40 мМ) осуществляют аналогично тому, как и при использовании РЕ. Расслабляющий эффект экстрактов в отношении агонистов определяют в процентах. Величины IC50 определяют при помощи нелинейного регрессионного анализа кривых концентрация-эффект при помощи программы Prism 3.0 (GraphPad Sowftware Inc.). Результаты эксперимента показаны в Таблице 3, представленной ниже. Полученные данные свидетельствуют о том, что сосудорасширяющий эффект экстрактов, заявленных в соответствии с настоящим изобретением, после стимуляции РЕ, оказывают как алкалоидные фракции, так и фракции, не содержащие алкалоидов. Расслабляющий эффект фракции, не содержащей алкалоидов, полностью зависит от наличия интактного эндотелия. Сосудорасширяющий эффект данной фракции, зависимый от эндотелия, также можно заметить после предварительного сокращения сосудистых колец U-46619 или KCl-деполяризации, очевидно, он основан на повышенном выбросе NO клетками эндотелия. В противоположность этому, эффект алкалоидных фракций главным образом основан на присутствии ингредиентов, обладающих
Изучение антигиперхолестеринемического эффекта Эффект экстрактов, заявленных в соответствии с настоящим изобретением, на уровень холестерина в плазме изучают на мышах линии NMRI (Janvier, Le Genest, France) с гиперхолестеринемией, индуцированной введением раствора Triton WE-1339. Мышей содержат в стандартных условиях (21°С, 60% относительной влажности, 12/12 часовой цикл смены дня и ночи), они имеют свободный доступ к воде и гранулированной пище (Altromin 1324). Triton WE-1339 (400 мг/кг, Sigma) растворяют в физиологическом растворе и вводят животным в каудальную вену (10 мл/кг). Для перорального введения тестируемым животным экстракт разводят в 0.2% суспензии агара и вводят за 24 ч и 1 ч до инъекции раствора Triton WE-1339, а также через 6 часов после инъекции через зонд (450 мг/кг в 10 мл/кг). Животным из контрольной группы вводят только носитель (0.2% агар, 10 мл/кг). За час до введения раствора Triton WE-1339, а также через 6 ч, 24 ч и 48 ч после инъекции у мышей из каудальной вены забирают образцы крови (32 мкл) при помощи гепаринизированного катетера и немедленно измеряют уровень холестерина (Reflotron, Boehringer Mannheim). На чертеже показано влияние перорального введения экстракта (450 мг/кг), заявленного в соответствии с настоящим изобретением, на уровень холестерина у мышей с Triton WR1339-индуцированной гиперхолестеринемией (# означает Р<0.05 по сравнению с контролем (t-критерий)). Результаты эксперимента показывают, что лечение экстрактами, заявленными в соответствии с настоящим изобретением и получаемыми, как описано в Примере 1, приводит к существенному уменьшению уровня холестерина в плазме. Исследование анальгетических свойств Для изучения анальгетических свойств используют формалиновый тест у мышей. Местное введение формалина в задние лапы мышей вызывает у животных очень сильное болевое ощущение, которое имеет две разделенные по времени фазы. Первая фаза опосредуется прямой стимуляцией болевых рецепторов за счет высвобождения субстанции Р, брадикинина и возбуждающих аминокислот (например, глутамин). В последующей второй фазе происходит аккумуляция гистамина, серотонина и простагландинов в тканях, что приводит к локальной воспалительной реакции и функциональным изменениям в центральной нервной системе. Для эксперимента используют мышей мужского пола линии NMRI (Janvier, Le Genest, France) весом от 22 до 26 г. Животным перорально вводят экстракты, заявленные в соответствии с настоящим изобретением, или их фракции. Через час в левую ступню мышам вводят 20 мкл 3.5% раствора формалина. Затем животных по отдельности помещают в проволочные клетки, а количество болевых реакций (лизание лапки) регистрируют в течение 45 минут. Анальгетический эффект определяют при сравнении с тестируемой группой, которую исследуют одновременно с тестируемой группой. Животные из контрольной группы получают только носитель (0.2% суспензия агара, 10 мл/кг). Результаты, представленные в Таблице 4, наглядно показывают, что экстракты дерева рода Corynanthe обладают потенциальным анальгетическим эффектом, который главным образом обусловлен алкалоидной фракцией.
Исследование антиоксидантных свойств Аутооокисление липидов ассоциировано с эмиссией света. Определение указанной чрезвычайно слабой хемилюминесценции может использоваться для количественного определения пероксидов и для оценки эффективности антиоксидантов. Мозговую ткань мышей мужского пола (NMRI, 20-30 г, Centre d
Примеры Определение общего содержания фенолов по методу Фолина-Чикальтеу Общее содержание фенолов определяют фотометрически после воздействия молибдат-вольфрамового реагента по аналогии с методами фармакопеи для дубящих соединений (DAB). Для этой цели экстракт растворяют в водном этаноле, алкализируют раствором карбоната натрия и добавляют молибдат-вольфрамовый реагент. После центрифугирования абсорбцию раствора супернатанта измеряют относительно воды при 720 нм. Расчет основан на эпикатехине. Пример 1: Сухой экстракт коры дерева Corynanthe pachyceras, заявленный в соответствии с настоящим изобретением 500 г измельченной коры дерева рода Corynanthe pachyceras дважды перемешивают в течение одного часа при 60°С с использованием 3.5 кг 60% по весу этанола каждый раз. После фильтрации через фильтр Seitz Supra 1500 комбинированный раствор экстракта выпаривают приблизительно при 50°С при пониженном давлении и высушивают при 50°С в вакууме: 183.8 г (36.8%). Экстракт содержит 14.62% алкалоидов (4.75% кориантина, 0.81% Сравнительный Пример 1: Полифенольная фракция (свободная от алкалоидов) Раствор 445 г сухого экстракта, полученного в Примере 1, в 4 кг этанола (50% по объему) помещают на колонку ионнобменника, содержащего 3.4 л сильной кислоты (Merck I), и элюируют этанолом (50% по объему). 9 л элюата собирают, выпаривают при 50°С и пониженном давлении и высушивают в камере при 50°С и 12 мбар: 352.4 г (79.2%). Экстракт не содержит ни одного алкалоида (кориантин, Сравнительный Пример 2: Алкалоидная фракция Ионообменную колонку, которая использовалась в Сравнительном Примере 1, дополнительно элюируют с использованием смеси 50% по объему этанола и 5% раствора NH3 (с концентрацией 25%). Получают 16 л элюата, его выпаривают и высушивают, как в Примере 1: 46.8 г (10.5%). Экстракт содержит 69.28% алкалоидов (24.01% коринантина, 2.25% Пример 2: Таблетки Сухой экстракт коры дерева вида Corynanthe pachyceras (экстракт, заявленный в соответствии с настоящим изобретением, получаемый, как описано в Примере 1) смешивают с адъювантами и прессуют в таблетки (ядро таблетки=пункты 1-6). Таблетки имеют оболочку, состоящую из гидроксипропилметилцеллюлозы (пункты 7-10).
Формула изобретения
1. Экстракт коры дерева Corynanthe pachyceras, предназначенный для лечения и/или профилактики заболеваний нижних отделов мочевыводящих путей, сексуальных расстройств, нарушений метаболизма липидов, заболеваний сердечно-сосудистой системы и острых и хронических болевых состояний, содержащий полифенолы и алкалоиды, полученный следующим способом: 2. Экстракт по п.1, отличающийся тем, что спирт представляет собой этанол. 3. Экстракт по п.2, отличающийся тем, что экстрагирующий раствор представляет собой смесь этанола и воды. 4. Экстракт по п.1, отличающийся тем, что он содержит, по меньшей мере, 15% полифенолов и, по меньшей мере, 8% алкалоидов. 5. Экстракт по п.4, отличающийся тем, что он содержит, по меньшей мере, 24% полифенолов. 6. Экстракт по п.4 или 5, отличающийся тем, что он содержит, по меньшей мере, 12% алкалоидов. 7. Лекарственное средство для лечения и/или профилактики заболеваний нижних отделов мочевыводящих путей, сексуальных расстройств, нарушений метаболизма липидов, заболеваний сердечно-сосудистой системы и острых и хронических болевых состояний, содержащее экстракт по любому из пп.1-6. 8. Пищевой продукт для лечения и/или профилактики заболеваний нижних отделов мочевыводящих путей, сексуальных расстройств, нарушений метаболизма липидов, заболеваний сердечно-сосудистой системы и острых и хронических болевых состояний, содержащий экстракт по любому из пп.1-6. 9. Фармацевтическая композиция, содержащая экстракт по любому из пп.1-6 и подходящий адъювант, приготовленная в форме для перорального, парентерального или местного введения.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 6, 2000, Seiten 531-536.
6, 2000, Seiten 531-536. 1-антагонисты и ингибиторы 5-
1-антагонисты и ингибиторы 5- , основной фактор роста фибробластов (bFGF), фактор роста кератиноцитов [KGF], фактор роста нервов [NGF], инсулиноподобный фактор роста I [IGF-I]. Поскольку ВРН очень часто сопровождается воспалительной реакцией, которая играет важную роль в патогенезе заболевания, фактор роста тромбоцитов (PDGF), секретируемый, например, фибробластами, тромбоцитами и лейкоцитами, возможно, является особенно важным фактором для пролиферации клеток предстательной железы (С.J.Vlahos et al., J. Cell Biochem. 52, 404-413 (1993)).
, основной фактор роста фибробластов (bFGF), фактор роста кератиноцитов [KGF], фактор роста нервов [NGF], инсулиноподобный фактор роста I [IGF-I]. Поскольку ВРН очень часто сопровождается воспалительной реакцией, которая играет важную роль в патогенезе заболевания, фактор роста тромбоцитов (PDGF), секретируемый, например, фибробластами, тромбоцитами и лейкоцитами, возможно, является особенно важным фактором для пролиферации клеток предстательной железы (С.J.Vlahos et al., J. Cell Biochem. 52, 404-413 (1993)).







 Elevage Janvier, Le Genest-Saint Isle, France), богатую липидами ткань, получают и хранят, как описано выше. После извлечения головной мозг отмывают ледяным фосфатно-буферным солевым раствором (PBS, рН 7.4) и удаляют мозговые оболочки и оставшуюся кровь. Образцы ткани помещают в четырехкратный объем PBS (v/w) для гомогенизации и центрифугируют в течение 10 минут при 1000 g и 4°С. Супернатант незамедлительно разводят трехкратно тем же буфером и хранят на льду. 250 мкл растворенного супернатанта переносят в пробирку для тестирования и инкубируют в течение 10 минут при 37°С в 6-канальном люменметре (Multi-Biolumat LB 9505 С, Berthold, Bad Wildbad). После добавления 25 мкл соединения II в PBS с 2.5% DMSO продолжают инкубацию еще в течение 10 минут. Затем в течение 60 минут определяют интенсивность хемилюминесценции (CL). Процент ингибирования аутоокисления рассчитывают по сравнению с контрольной группой, которую исследуют одновременно (PBS с 2.5% DMSO). Как видно из результатов, представленных в Таблице 5, экстракт, заявленный в соответствии с настоящим изобретением, обладает потенциальными антиоксидантными свойствами, которые обусловлены, главным образом, полифенольной фракцией.
Elevage Janvier, Le Genest-Saint Isle, France), богатую липидами ткань, получают и хранят, как описано выше. После извлечения головной мозг отмывают ледяным фосфатно-буферным солевым раствором (PBS, рН 7.4) и удаляют мозговые оболочки и оставшуюся кровь. Образцы ткани помещают в четырехкратный объем PBS (v/w) для гомогенизации и центрифугируют в течение 10 минут при 1000 g и 4°С. Супернатант незамедлительно разводят трехкратно тем же буфером и хранят на льду. 250 мкл растворенного супернатанта переносят в пробирку для тестирования и инкубируют в течение 10 минут при 37°С в 6-канальном люменметре (Multi-Biolumat LB 9505 С, Berthold, Bad Wildbad). После добавления 25 мкл соединения II в PBS с 2.5% DMSO продолжают инкубацию еще в течение 10 минут. Затем в течение 60 минут определяют интенсивность хемилюминесценции (CL). Процент ингибирования аутоокисления рассчитывают по сравнению с контрольной группой, которую исследуют одновременно (PBS с 2.5% DMSO). Как видно из результатов, представленных в Таблице 5, экстракт, заявленный в соответствии с настоящим изобретением, обладает потенциальными антиоксидантными свойствами, которые обусловлены, главным образом, полифенольной фракцией.