|
|
(21), (22) Заявка: 2007106728/13, 22.07.2005
(24) Дата начала отсчета срока действия патента:
22.07.2005
(30) Конвенционный приоритет:
22.07.2004 GB 0416392.9
10.06.2005 GB 0511881.5
(43) Дата публикации заявки: 27.08.2008
(46) Опубликовано: 10.09.2010
(56) Список документов, цитированных в отчете о
поиске:
WO 02085944 A2, 31.10.2002. WO 02085945 A2, 31.10.2002. WO 2004049794 A2, 17.06.2004. РОЙТ А. с соавт. Иммунология.: Изд. “Мир”, 2000, с.107-112.
(85) Дата перевода заявки PCT на национальную фазу:
22.02.2007
(86) Заявка PCT:
GB 2005/002892 20050722
(87) Публикация PCT:
WO 2006/008548 20060126
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег.  517 517
|
(72) Автор(ы):
КРЭЙГ Роджер Кингдон (GB),
ГРОСВЕЛД Франклин Герардус (NL),
ЯНССЕНС Ричард Вилхелм (NL),
ДРАБЕК Дубравка (NL)
(73) Патентообладатель(и):
ЭРАСМУС ЮНИВЕРСИТИ МЕДИКАЛ СЕНТР РОТТЕРДАМ (NL),
КРЭЙГ Роджер Кингдон (GB)
|
(54) СПОСОБ ПОЛУЧЕНИЯ АНТИГЕН-СВЯЗЫВАЮЩЕГО ДОМЕНА Vh ИСПОЛЬЗОВАНИЕ
(57) Реферат:
Способ получения антиген-связывающего домена VH, в котором отсутствует удлиненная CDR3 петля, подобная петле верблюда, включает трансформирование клетки млекопитающего гетерологичным локусом тяжелой цепи VH. Локус содержит ген, кодирующий вариабельную область, по меньшей мере содержащий один сегмент гена VH, один сегмент гена D, не являющийся верблюжьим, один сегмент гена J, не являющийся верблюжьим, одну константную область тяжелой цепи, при условии, что ни один из генов, кодирующих константные области, не кодирует функциональный домен Сн1. Сегменты генов V, D и J способны к рекомбинации с образованием кодирующей последовательности VDJ. Трансформированная клетка способна экспрессировать антитело только с тяжелыми цепями, содержащими антиген-связывающий домен VH и константную эффекторную область, лишенную функционального домена Сн1. Клетку используют для получения трансгенного животного, которое иммунизируют представляющим интерес антигеном. Далее выделяют клетки или ткани, экспрессирующие специфические антитела к интересующему антигену только с тяжелыми цепями, выделяют нуклеиновую кислоту, кодирующую домен VH специфического антитела только с тяжелыми цепями, и экспрессируют указанный антиген-связывающий домен VH. Указанные VH домены могут быть использованы для создания слитых белков или связывающих комплексов моновалентного, бивалентного или мультивалентного полипептида. Изобретение позволяет получать антигенспецифические антитела человека любого класса, обладающие высокой аффинностью. 2 н. и 9 з.п. ф-лы, 26 ил.
Область техники, к которой относится изобретение
Настоящее изобретение относится к производству широкого набора функциональных антител, имеющих только тяжелую цепь, прошедших процесс созревания аффинности, и к их применению. Настоящее изобретение также относится к производству и применению широкого набора класс-специфических антител, имеющих только тяжелую цепь, и к производству и применению мультивалентных полипептидных комплексов с функциональными свойствами тяжелой цепи антител, предпочтительно, со связывающими функциональными свойствами тяжелой цепи антител, эффекторной активностью константной области и, необязательно, дополнительными эффекторными функциями.
Настоящее изобретение также относится к способу получения у трансгенных мышей антител, имеющих только тяжелую цепь и обладающих полными функциональными свойствами, в ответ на антигенную стимуляцию. В частности, настоящее изобретение относится к способу получения антигенспецифических высокоаффинных антител человека, имеющих только тяжелую цепь, любого класса или смеси классов и выделению и экспрессии полностью функциональных VH антигенсвязывающих доменов.
Настоящее изобретение также относится к получению мультивалентных полипептидных комплексов, имеющих функциональные свойства тяжелых цепей, предпочтительно, эффекторную активность тяжелых цепей и имеющих другие связывающие и эффекторные функции.
Также описаны антитела, имеющие только тяжелую цепь, и другие мультивалентные связывающие комплексы, получаемые способами по настоящему изобретению, и их применение.
Уровень техники
Моноклональные антитела или их варианты будут составлять высокий процент новых лекарственных препаратов, которые будут выпускать в XXI веке. Терапия с использованием монокланальных антител уже принята в качестве предпочтительного способа лечения ревматоидного артрита и болезни Крона, и имеется значительный прогресс в лечении рака. Также на основе антител разрабатываются продукты для лечения сердечно-сосудистых и инфекционных заболеваний. Большинство продаваемых продуктов на основе моноклональных антител распознают и связывают один хорошо определяемый эпитоп на мишеневом лиганде (например, TNF ). Производство антител человека для терапии по-прежнему зависит от клеточных культур млекопитающих. Сборка комплекса, состоящего из двух тяжелых цепей и двух легких цепей (комплекса H2L2), и последующий процесс пост-трансляционного гликозилирования препятствуют использованию бактериальных систем. Стоимость продукции и высокие затраты для производства антител с помощью клеточной культуры млекопитающих являются высокими и могут ограничить потенциальные возможности терапии на основе антител при отсутствии приемлемых альтернатив. Множество трансгенных организмов способно экспрессировать полностью функциональные антитела. Такие организмы включают растения, насекомых, цыплят, коз и крупный рогатый скот, но никто из них до сих пор не использовался для производства коммерчески доступных терапевтических продуктов. ). Производство антител человека для терапии по-прежнему зависит от клеточных культур млекопитающих. Сборка комплекса, состоящего из двух тяжелых цепей и двух легких цепей (комплекса H2L2), и последующий процесс пост-трансляционного гликозилирования препятствуют использованию бактериальных систем. Стоимость продукции и высокие затраты для производства антител с помощью клеточной культуры млекопитающих являются высокими и могут ограничить потенциальные возможности терапии на основе антител при отсутствии приемлемых альтернатив. Множество трансгенных организмов способно экспрессировать полностью функциональные антитела. Такие организмы включают растения, насекомых, цыплят, коз и крупный рогатый скот, но никто из них до сих пор не использовался для производства коммерчески доступных терапевтических продуктов.
Функциональные фрагменты антител могут генерироваться E. coli, но продукт обычно имеет низкую стабильность в сыворотке, кроме пегилированного в процессе производства.
Комплексы биспецифических антител представляют собой молекулы на основе Ig, способные к связыванию двух различных эпитопов либо на одинаковых, либо на разных антигенах. Биспецифические антитела, содержащие связывающие белки, отдельно или в комбинации с другими связывающими агентами, обладают перспективой использования в способах лечения, в которых зарегистрированные иммунные функции человека вызывают терапевтический эффект, например элиминацию патогенов (Van Spriel et al., (1999) J. Infect. Diseases, 179, 661-669; Tacken et al., (2004) J. Immunol, 172, 4934-4940; патент США  5487890), лечение рака (Glennie and van der Winkel, (2003) Drug Discovery Today, 8, 503-5100); и иммунотерапию (Van Spriel et al., (2000) Immunol. Today, 21, 391-397; Segal et al., (2001) J. Immunol. Methods, 248, 1-6; Lyden et al., (2001) Nat. Med., 7, 1194-1201). 5487890), лечение рака (Glennie and van der Winkel, (2003) Drug Discovery Today, 8, 503-5100); и иммунотерапию (Van Spriel et al., (2000) Immunol. Today, 21, 391-397; Segal et al., (2001) J. Immunol. Methods, 248, 1-6; Lyden et al., (2001) Nat. Med., 7, 1194-1201).
Проблемы при производстве возникают, когда продукт биспецифических антител основан на двух или более комплексах H2L2. Например, коэкспрессия двух или нескольких наборов генов тяжелых и легких цепей может привести к образованию до 10 различных комбинаций, из которых только одна является желательным гетеродимером (Suresh et al., (1986) Methods Enzymol, 121, 210-228).
Для решения таких проблем разработано несколько стратегий получения биспецифических форматов IgG (BsIgG) полной длины в клетках млекопитающих, которые сохраняют эффекторную функцию тяжелых цепей. Для BsIgG требуются разработанные “knob and hole” тяжелые цепи для предотвращения образования гетеродимеров, и используются идентичные L-цепи, чтобы избежать ошибочного спаривания L-цепей (Carter, (2001) J. Immunol. Methods, 248, 7-15). Также описаны альтернативные химические методики перекрестного связывания для получения комплексов из фрагментов антител, каждый из которых узнает различные антигены (Ferguson et al., (1995) Arthritis and Rheumatism, 38, 190-200), или перекрестного связывания с фрагментами антител других связывающих белков, например коллектинов (Tacken et al., (2004) J. Immunol., 172, 4934-4940).
Разработка рекомбинантных димерных антител или миниантител (BsAb), обычно не обладающих эффекторными функциями тяжелых цепей, также преодолевает гетеродимерный избыток. Такие минитела содержат минимальные одноцепочечные антитела, имеющие VH и VL связывающие участки (scFv), которые впоследствии сворачиваются и димеризуются, формируя бивалентные биспецифические антитела, моновалентные к каждому из своих мишеневых антигенов (Holliger et al., (1993) PNAS, 90, 6444-6448; Muller et al., (1998) FEBS Lett, 422, 259-264). Одновременно, для образования биспецифических миниантител в качестве доменов гетеродимеризации использовали CH1 и L-константные домены (Muller et al., (1998) FEBS Lett., 259-264). Для получения BsAb разработано множество рекомбинантных способов, основанных на системах экспрессии E. сoli, (Hudson, (1999) Curr. Opin. Immunol., 11, 548-557), хотя очевидно, что стоимость и объем производства мультивалентных антител со степенью чистоты для клинического применения остаются основным препятствием для клинического применения (Segal et al., (2001) J. Immunol. Methods, 248, 1-6).
В последнее время концепция BsAb была расширена до рассмотрения двойных рекомбинантных биспецифических антител, тетравалентных биспецифических антител, в которых домены VH и VL в каждой из цепей H и L заменены разработанной парой связывающих доменов scFv. Такие конструкции, пока сложные для разработки, могут быть собраны в клетках млекопитающих в культуре в отсутствии гетеродимерной избыточности (Lu et al., (2003) J. Immunol. Methods, 279, 219-232).
Структура иммуноглобулинов хорошо известна. Большинство природных иммуноглобулинов содержат две тяжелые цепи и две легкие цепи. Тяжелые цепи соединены друг с другом при помощи дисульфидных связей между шарнирными доменами, расположенными приблизительно посередине каждой тяжелой цепи. Легкая цепь связана с каждой тяжелой цепью с N-терминальной стороны шарнирного домена. Каждая легкая цепь обычно связана с соответствующей тяжелой цепью дисульфидной связью, находящейся рядом с шарнирным доменом.
Если молекула Ig укладывается правильно, то каждая цепь укладывается в несколько отдельных глобулярных доменов, соединенных более линейной полипептидной последовательностью. Например, легкая цепь укладывается в вариабельный (VL) и константный (CL) домены. Тяжелые цепи имеют один вариабельный домен VH, смежный с вариабельным доменом легкой цепи, первый константный домен, шарнирный домен и два или три дополнительных константных домена. Взаимодействие вариабельных доменов тяжелой (VH) и легкой (VL) цепей приводит к образованию антигенсвязывающей области (Fv). Обычно как VH, так и VL необходимы для связывания антигена, хотя показано, что димеры тяжелой цепи и аминотерминальные фрагменты сохраняют активность в отсутствии легкой цепи (Jaton et al., (1968) Biochemistry, 7, 4185-4195).
С появлением новых молекулярных технологий идентифицировано наличие антител, имеющих только тяжелую цепь (лишенных легкой цепи), у человека при B-клеточных пролиферативных нарушениях (заболевание тяжелых цепей) и в системах мышиных моделей. Анализ заболевания тяжелых цепей на молекулярном уровне показал, что мутации и делеции на уровне генома могут приводить к несоответствующей экспрессии домена CH1 тяжелой цепи, увеличивая экспрессию антитела, имеющего только тяжелую цепь, которое лишено связывающей способности легкой цепи (смотрите Hendershot et al., (1987) J. Cell Biol, 104, 761-767; Brandt et al., (1984) Mol. Cell. Biol, 4, 1110-1211).
Независимые исследования выделенных доменов VH человека, полученных из фаговых библиотек, показали антигенспецифическое связывание доменов VH, но оказалось, что указанные домены VH имеют низкую растворимость. К тому же, было подтверждено, что селекцией доменов VH человека с характеристиками специфического связывания, показанными на фаговых матрицах, можно формировать связывающие блоки для разработанных антител (Ward et al., (1989) Nature, 341, 544-546).
Исследования, использующие другие виды позвоночных, показали, что у верблюдов в результате мутаций природного гена синтезируются функциональные димеры IgG2 и IgG3, имеющие только тяжелые цепи, которые не способны связываться с легкой цепью из-за отсутствия связывающей области CH1 легкой цепи (Hamers-Casterman et al., (1993) Nature, 363, 446-448), и что виды, такие как акула, продуцируют семейство связывающих белков, подобных только тяжелой цепи, которые вероятно относятся к Т-клеточному рецептору млекопитающих или легкой цепи иммуноглобулинов (Stanfield et al., (2004) Science, 305, 1770-1773).
Отличительной особенностью антитела верблюдов, имеющего только тяжелую цепь, является домен VH верблюда, который обеспечивает улучшенную растворимость по сравнению с доменом VH человека. Для улучшения характеристик растворимости может быть разработан VH человека (смотрите Davies and Riechmann, (1996) Protein Eng., 9 (6), 531-537; Lutz and Muyldermans, (1999) J. Immuno. Methods, 231, 25-38), или растворимость может быть достигнута посредством естественного отбора in vivo (смотрите Tanha et al., (2001) J. Biol. Chem., 216, 24114-24180). Однако там, если связывающие домены VH получены из фаговых библиотек, то присущая им аффинность к антигену сохраняется в диапазоне от низких микромолей до высоких наномолей несмотря на применение стратегий для улучшения аффинности, включающих, например, рандомизацию аффинности в  горячей точке горячей точке (Yau et al., (2005) J. Immunol Methods, 291, 213-224). (Yau et al., (2005) J. Immunol Methods, 291, 213-224).
VH антитела верблюда также отличаются модифицированной петлей CDR3. Указанная петля CDR3 в среднем длиннее петли, обнаруженной в антителах других животных, и является особенностью, которая, как предполагается, главным образом влияет на общую аффинность к антигену и специфичность, которая компенсируется отсутствием домена VL у антител верблюда, имеющих только тяжелую цепь (Desmyter et al., (1996) Nat. Struct. Biol, 3, 803-811, Riechmann and Muyldermans, (1999) J. Immunol. Methods, 23, 25-28).
Структурные исследования, проведенные в последние годы, антител верблюда подтвердили, что такое многообразие антител в значительной степени запускается in vivo процессами созревания, зависящими от событий V(D)J-рекомбинации и соматической мутации (De Genst et al., (2005) J. Biol. Chem., 280 (14), 14114-14121).
В последние годы были разработаны способы получения антител, имеющих только тяжелые цепи, у трансгенных млекопитающих (смотрите WO02/085945 и WO02/085944). Функциональное антитело, имеющее только тяжелые цепи, вероятно, любого класса (IgM, IgG, IgD, IgA или IgE) и полученное от любого млекопитающего (включая человека) может быть продуцировано трансгенными млекопитающими (предпочтительно мышами) в результате антигенной стимуляции.
Обычный локус тяжелой цепи иммуноглобулина содержит множество генных сегментов V, несколько генных сегментов D и несколько генных сегментов J. Каждый генный сегмент V кодирует домен V от N-конца почти до C-конца. C-конец каждого домена V кодируется генным сегментом D и генным сегментом J. VDJ-перестройка в B-клетках, за которой следует созревание аффинности, дает связывающие домены VH, которые с связывающими доменами VL затем формируют участок узнавания антигена или участок связывания. Во взаимодействии тяжелой и легкой цепей участвует область CH1 тяжелой цепи и область  или или  легкой цепи, которая облегчает взаимодействие. легкой цепи, которая облегчает взаимодействие.
Для получения антитела, имеющего только тяжелую цепь, локус тяжелой цепи в зародышевой линии содержит генные сегменты, кодирующие некоторые или все возможные константные области. Во время созревания перестроенный связывающий домен VH подвергается сплайсингу с образованием сегмента, кодирующего константную область CH2, обеспечивая перестроенный ген, кодирующий тяжелую цепь, которая лишена домена CH1 и, следовательно, не способна связываться с легкой цепью иммуноглобулина.
Моноклональные антитела, имеющие только тяжелую цепь, могут быть получены из B-клеток селезенки с помощью стандартной технологии клонирования или получены из B-клеточной мРНК с помощью технологии фагового дисплея (Ward et al., (1989) Nature, 341, 544-546). Антитела, имеющие только тяжелую цепь, полученные от верблюда или трансгенных животных, являются высокоаффинными. Анализ последовательности нормальных тетрамеров H2L2 показал, что многообразие, главным образом, является результатом комбинации VDJ-перестройки и соматической гипермутации (Xu and Davies, (2000) Immunity, 13, 37-45). Анализ последовательности экспрессированной мРНК только тяжелой цепи, продуцируемой только верблюдами либо трансгенными животными, подтверждает это наблюдение (De Genst et al., (2005) J. Biol. Chem., 280, 14114-14121).
Важная и общая особенность природных областей VH верблюда и человека заключается в том, что каждая область связывается в виде мономера, вне зависимости от димеризации, с областью VL для обеспечения оптимальной растворимости и аффинности связывания. Эта особенность рассматривается как особенно эффективная для продуцирования блокирующих агентов и агентов тканевой проницаемости.
Гомо- или гетеродимеры также могут быть сконструированы путем ферментативного расщепления антител, имеющих только тяжелую цепь, или синтетическими способами (Jaton et ah, (1968) Biochemistry, 7, 4185-4195 и патент США  2003/0058074 A1). Однако полезные свойства связывающего домена мономерных антител до сих пор не были использованы для получения преимуществ при конструировании мультимерных протеинов в качестве терапевтических и диагностических реагентов. 2003/0058074 A1). Однако полезные свойства связывающего домена мономерных антител до сих пор не были использованы для получения преимуществ при конструировании мультимерных протеинов в качестве терапевтических и диагностических реагентов.
VH человека или VHH верблюда, полученный технологией фагового дисплея, лишен преимуществ улучшенных характеристик в результате соматических мутаций и дополнительного разнообразия, обеспечиваемого рекомбинацией областей D и J в области CDR3 участка связывания нормального антитела (Xu and Davies, (2000) Immunity, 13, 37-45). Хотя VHH верблюда и имеет преимущества в растворимости по сравнению с VH человека, для человека он является антигенным и должен быть синтезирован при иммунизации верблюда или при помощи технологии фагового дисплея.
Введение связывающих доменов VH имеет явное преимущество над использованием scFv, которые необходимо конструировать из доменов VH и VL со связанной с этим потенциальной возможностью потери специфичности и авидности. Связывающие домены VH, полученные из семейств родственных генов, такие как T-клеточные рецепторы или семейство иммуноглобулинов акулы, также предоставляют альтернативные варианты scFv для генерации би- или мультиспецифических связывающих молекул. Также могут быть использованы другие природные связывающие белки и их домены, включая, например, растворимые фрагменты рецепторов.
Классы антител отличаются своими физиологическими функциями. Например, IgG играет решающую роль в зрелом иммунном ответе. IgM вовлечен в фиксирование и агглютинацию комплемента. IgA является обширным классом Ig в секретах, т.е. слезной жидкости, слюне, молозиве, слизи, и, таким образом, играет роль в местном иммунитете. Включение класс-специфических константных областей тяжелой цепи при конструировании мультивалентных связывающих комплексов обеспечивает терапевтические преимущества эффекторной функции in vivo в зависимости от требуемых функциональных свойств. Разработка отдельных эффекторных областей также может привести к добавлению или потере функционального свойства (Van Dijk and van der Winkel, Curr. Opin. Chem. Biol., (2001) Aug 5 (4), 368-374). По-видимому, для оптимальной продукции и селекции антител, имеющих только тяжелую цепь, которые содержат высокоаффинные связывающие домены VH (либо человека, либо верблюда, либо имеющие другое происхождение), будут использоваться альтернативные подходы для получения указанных антител в зависимости от выбора из рандомизированных фаговых библиотек, которые не облегчают in vivo рекомбинацию и созревание аффинности.
Таким образом, включение функционального свойства константной области IgA могло бы привести к улучшенному функционированию слизистой против патогенов (Leher et al., (1999) Exp. Eye. Res., 69, 75-84), хотя наличие функционального свойства константных областей IgG1 обеспечивает увеличение стабильности in vivo в сыворотке. Наличие константных доменов CH2 и CH3 тяжелой цепи обеспечивает основу для стабильной димеризации, которую можно наблюдать в природных антителах, и обеспечивает участки узнавания для пост-трансляционного гликозилирования. Наличие CH2 и CH3 также обеспечивает возможность вторичного узнавания антител, если в качестве реагентов и диагностических средств используются биспецифические и мультивалентные комплексы.
Выделенные предварительно перестроенные последовательности вариабельных областей только тяжелых цепей верблюда предварительно клонируют перед шарнирной областью и эффекторным доменом IgG1 человека, встроенным в вектора и экспрессированным в клетках COS для продукции антитела. Антитела, экспрессированные в такой in vitro среде, уже были подвергнуты процессам переключения классов (изотипа) и созревания (гиперсозревания) аффинности in vivo у верблюда, и они могут связываться с антигеном (Riechmann and Muyldermans, (1999) J. Immunol. Methods, 231, 25-38).
В данной области техники остается необходимость в максимальном увеличении разнообразия антител, имеющих только тяжелую цепь, и в B-клеточном ответе in vivo и, в частности, в получении функционального набора класс-специфических антител человека, имеющих только тяжелую цепь, и функциональных связывающих доменов VH только тяжелой цепи, которые сохраняют максимальный антигенсвязывающий потенциал, для использования в разнообразных клинических, промышленных и научных применениях.
В данной области техники также остается необходимость в растворимых бивалентных или мультивалентных связывающих полипептидных комплексах, содержащих по меньшей мере часть тяжелой цепи антитела отдельно или в комбинации с эффекторной (легкой) цепью, которая является физиологически стабильной и имеет эффекторную функцию.
Краткое описание настоящего изобретения
Настоящее изобретение относится к способу получения антитела, имеющего только тяжелую цепь VH или только тяжелую цепь VH (VHH) верблюда, трансгенным млекопитающим, в котором предусмотрен этап экспрессии гетерологичного локуса тяжелой цепи VH или тяжелой цепи VH (VHH) верблюда у такого млекопитающего, причем указанный локус тяжелой цепи VH или тяжелой цепи VH (VHH) верблюда содержит константную область тяжелой цепи, которая не кодирует домен CH1, и локус, которой при экспрессии способен формировать антитела, имеющие только тяжелую цепь, определенного класса или классов.
Локус тяжелой цепи VH или локус тяжелой цепи VH (VHH) верблюда может содержать один или несколько генных сегментов V верблюда или другого животного. Предпочтительно, генный сегмент V отобран или разработан таким образом, чтобы обладать улучшенными характеристиками растворимости. Предпочтительно, V генный сегмент извлекают у человека.
Константаная область локуса тяжелой цепи может содержать ген константой области C 1 и/или C 1 и/или C 2, C 2, C , C , C , C , C и/или Cµ тяжелой цепи. Кроме того, константная область локуса тяжелой цепи может содержать более одной из следующих константных областей: C и/или Cµ тяжелой цепи. Кроме того, константная область локуса тяжелой цепи может содержать более одной из следующих константных областей: C 1, C 1, C 2, C 2, C , C , C , C , C , Cµ. , Cµ.
Предпочтительно локус тяжелой цепи VH содержит вариабельную область, содержащую по меньшей мере один генный сегмент V человека или верблюда, по меньшей мере один сегмент D и по меньшей мере один сегмент J, причем генный сегмент V человека или верблюда, генный сегмент D и генный сегмент J способны к рекомбинации, формируя VDJ-кодирующую последовательность. Локус тяжелой цепи, предпочтительно, содержит двадцать или более генных сегментов D и/или пять или более генных сегментов J. Предпочтительно, сегменты D и J являются генными сегментами позвоночного, предпочтительно человека. Петля CDR3 может быть получена путем использования генных сегментов D и J, полученных у позвоночного или, предпочтительно, человека.
Локус тяжелой цепи VH также может содержать рекомбинантную последовательность (rss), способную к рекомбинации генного сегмента J непосредственно с генной константной областью тяжелой цепи.
Константная область тяжелой цепи гетерологичного локуса тяжелой цепи является константной областью человека или позвоночного, например верблюда. В качестве альтернативы константная область может не являться константной областью тяжелой цепи имуноглобулина.
Предпочтительно, способы настоящего изобретения по существу приводят к нормальному B-клеточному созреванию. Настоящее изобретение также относится к антителу, имеющему только тяжелые цепи, или его фрагменту, или смеси классов антител, имеющих только тяжелые цепи, полученные или получаемые по способу настоящего изобретения. Такое антитело, имеющее только тяжелые цепи, может представлять собой моноклональное антитело или его фрагмент, такой как связывающий домен VH человека или верблюда. Связывающий домен VH по настоящему изобретению может не содержать верблюдоподобную удлиненную CDR3 петлю или, в качестве альтернативы, может содержать верблюдоподобную удлиненную CDR3 петлю.
Настоящее изобретение также относится к вектору, содержащему гетерологичный локус тяжелой цепи настоящего изобретения, и к клетке-хозяину, трансформированной таким вектором.
Настоящее изобретение также относится к трансгенному млекопитающему, экспрессирующему гетерологичный локус тяжелой цепи, описанному в настоящем описании. Предпочтительно, трансгенное млекопитающее по настоящему изобретению обладает пониженной способностью к продукции антител, содержащих легкие цепи.
Также изобретение относится к использованию антитела, имеющего только тяжелые цепи, или к его фрагменту, по настоящему изобретению для изготовления лекарственного средства для иммунотерапии. Антитела настоящего изобретения, имеющие только тяжелые цепи, также могут использоваться в качестве диагностических средств, реагентов, абзимов или ингибиторов. Также изобретение относится к фармацевтической композиции, содержащей антитело, имеющее только тяжелые цепи, или его фрагмент, по настоящему изобретению, и фармацевтически приемлемый носитель.
Настоящее изобретение также относится к способу получения и селекции антител, имеющих только тяжелые цепи, в котором предусмотрены этапы:
(a) инъекции антигена трансгенному млекопитающему, как описано в настоящем описании;
(b) выделения клетки или ткани, экспрессирующей представляющее интерес антигенспецифическое антитело, имеющее только тяжелые цепи; и
(c) создания гибридомы из клетки или ткани этапа (b) и
(d) необязательно, клонирования мРНК антитела, имеющего только тяжелые цепи, из указанной гибридомы для последующей продукции в системе гетерологичной экспрессии, такой как система млекопитающих, растений, насекомых, бактерий, грибов, или в альтернативной системе.
Затем связывающие домены VH могут быть продуцированы путем идентификации и выделения антигенспецифического домена VH из клонированной мРНК из этапа c).
Связывающие домены VH по настоящему изобретению также могут быть получены путем:
(a) инъекции антитела трансгенному млекопитающему, описанному в настоящем описании;
(b) выделения клетки или ткани, экспрессирующей представляющее интерес антигенспецифическое антитело, имеющее только тяжелые цепи;
(c) клонирования локуса VH из мРНК, полученной из выделенной клетки или ткани;
(d) отображения кодируемого белока, используя фаговую или аналогичную библиотеку;
(e) идентификации антигенспецифического домена (доменов) VH; и
(f) экспрессии домена (доменов) VH отдельно или в виде слитого белка в бактериальных, дрожжевых или альтернативных системах экспрессии.
Подробное описание изобретения
Настоящее изобретение позволяет преодолеть ограничения уровня техники и в нем показано, что трансгенные животные, в частности мыши, могут быть созданы при помощи “микролокусов” для продукции класс-специфических антител, имеющих только тяжелую цепь, или смеси различных классов антител, имеющих только тяжелую цепь, которые секретируются плазмой или B-клетками. Затем их можно использовать либо для получения надежной доставки класс-специфических антител, имеющих только тяжелые цепи, используя отлаженную технологию гибридом, либо в качестве источника функциональных связывающих доменов VH (VHH) верблюда или связывающих доменов VH только тяжелой цепи, предпочтительно растворимых связывающих доменов VH только тяжелой цепи человека, которые лишены эффекторных функций, но которые сохраняют связывающую функцию.
Антитела, имеющие только тяжелые цепи (включая антитела верблюда), которые могут быть получены способами настоящего изобретения, проявляют высокую аффинность связывания, которая является результатом перестроек генных сегментов V, D и J и соматических мутаций, обычно без удлиненной петли CDR3. По существу обычное B-клеточное созревание наблюдается при высоких уровнях антител, имеющих только тяжелые цепи, в выделенной плазме (предполагается, что домен CH1 отсутствует во всех классах антител, находящихся в рекомбинантном локусе). B-клеточное созревание и секреция собранных димеров (например, IgG) или мультимеров (например, IgM) не зависит от наличия или экспрессии генов легкой цепи.
Анализ нуклеотидной последовательности антигенспецифической мРНК, кодирующей антигенспецифическую тяжелую цепь, выделенную из гибридом, полученных от трансгенных мышей, показал, что разнообразие антител, имеющих только тяжелую цепь, в основном является функцией VDJ-рекомбинации. Кроме того, авторами настоящего изобретения было показано, что разнообразие антител образуется в области CDR3 функционального антигенсвязывающего домена антител, имеющих только тяжелые цепи, с более ограниченным вкладом соматических мутаций в доменах VH. Используя способы, раскрытые в настоящем описании, функциональные домены VН могут быть клонированы и могут быть экспрессированы в бактериальных системах для получения связывающих доменов VH, при этом полностью сохраняя антигенсвязывающую способность, специфичность и аффинность. Кроме того, класс-специфические димеры или мультимеры тяжелой цепи могут секретироваться в культуре гибридомных клеточных линий.
На основании настоящего изобретения также показано, что трансгенные мыши могут быть запрограммированы на продукцию предпочтительных классов антител, имеющих только тяжелую цепь, в ответ на антигенную стимуляцию, например только IgG или против только IgM, или смесь из, например, IgA, IgG и IgM.
Авторами настоящего изобретения ранее было описано (смотрите заявки на патент WO02/085945 и WO02/085944) создание трансгенных мышей, экспрессирующих минимальный лишенный экзона CН1 локус константной области тяжелой цепи IgG человека, соединенный сегментами человека D и J с двумя генами VHH ламы. При антигенной стимуляции они продуцировали функциональное высокоаффинное антигенспецифическое IgG антитело, имеющее только тяжелые цепи. Смеси классов антител (IgM и IgG), имеющих только тяжелые цепи, могут быть получены переключением классов in vivo путем использования генных конструкций, включая константные области тяжелой цепи в тандеме (при условии, что все гены константных областей лишены домена CH1 и, если имеется, CH4 домена).
Усовершенствования, описанные в настоящем описании, показывают, что мышь, сконструированная с таким же локусом константной области IgG, соединенным при помощи сегментов человека D и J с двумя генами VHH ламы, и локусом константной области IgM человека, лишенного экзона локуса CH1, который соединен при помощи таких же генных сегментов человека D и J с генами VHH ламы, также продуцирует высокомолекулярное (мультимерное) антитело IgM, имеющее только тяжелые цепи, и антитело IgG (димер), имеющее только тяжелые цепи. Интересно то, что по существу нормальное B-клеточное созревание и продукция антител зависит от полного отсутствия последовательностей CH1 в каждой константной области тяжелой цепи, которая имеется в трансгенном локусе. Более того, если имеется экзон CН4, то его удаление не требуется.
Таким образом, например, трансгенное животное, несущее локус тяжелой цепи IgM человека с функциональным экзоном CH1, соединенным при помощи таких же генных сегментов человека D и J с двумя генными сегментами V ламы, и локус константной области тяжелой цепи IgG, лишенный экзона CH1, который соединен при помощи таких же генных сегментов человека D и J с двумя генными сегментами V ламы, продуцирует незначительное количество антител, имеющих только тяжелые цепи, и не проявляет наличие B-клеточного созревания.
Другие эффекторные домены, включая домен CH4, могут быть включены или не включены, по желанию, с целью введения или удаления из полученного антитела, имеющего только тяжелые цепи, эффекторных свойств.
Авторы настоящего изобретения обнаружили, что продуктивную экспрессию антитела (то есть B-клеточное созревание) можно получить в результате использования любого генного сегмента V, находящегося в конструкции. Выделение и секвенирование мРНК антитела, полученного из B-клеток, показало, что происходит рекомбинация генных сегментов D и J, гененрируя разнообразие CDR3. Сравнение последовательностей полученных доменов VH выявило соматические мутации, указывающие, что в рекомбинантных генных сегментах D и J, а также в домене VH полученной экспрессированной мРНК антитела произошли события аффинного созревания.
Предпочтительные конструкции включают генные сегменты V, отобранные или разработанные для улучшенной растворимости и связанные с кластером цепей D и J для рекомбинации и генерации CDR3. Предпочтительно, VDJ-последовательности связаны с константным эффекторным доменом (доменами) выбора в тандеме, каждый из которых лишен экзона CН1.
Настоящее изобретение не ограничено получением и продукцией класс-специфического антитела человека или верблюда, имеющего только тяжелые цепи, или связывающих доменов VH человека (предпочтительно, растворимых связывающих доменов VH) (одиночных или связанных с эффекторным доменом по выбору), но охватывает продукцию химерных комбинаций любого генного сегмента V, полученного от позвоночного животного (необязательно, сконструированного с улучшенными характеристиками растворимости), связанного с генными сегментами D и J. Предпочтительно, генные сегменты V являются генными сегментами человека и не являются генными сегментами V верблюда. Полученные домены VH могут не содержать удлиненной верблюдоподобной петли CDR3, за исключением того, что сегменты D и J получены от верблюда. В результате это дает домен VH, проявляющий разнообразие CDR3 и аффинное созревание, необязательно связанное с эффекторной константной областью. Последняя гарантирует функциональную секрецию и, необязательно, сборку в родительском трансгенном позвоночном животном по выбору, а также обеспечивает последующий выбор эффекторной функции в случае, если это необходимо.
Эти сведения имеют важные результаты для улучшенной и упрощенной разработки класс-специфичкских антител, имеющих только тяжелые цепи, и получения высокоаффинных растворимых доменов VH, которое включает созревание аффинности посредством соматической мутации. Введение выбранных эффекторных функций константной области тяжелой цепи (лишенной CН1) или их смесей делает возможной продукцию антител, имеющих только тяжелые цепи, любого класса или любой смеси антител, имеющих только тяжелые цепи, без необходимости дополнительной разработки антител. Домены VH могут экспрессироваться отдельно в бактериальных системах или в системах других микроорганизмов или в виде функционального антитела, имеющего только тяжелые цепи и содержащего эффекторные домены, которое секретируется гибридомами или трансфецированными клетками в культуре. Антитела и связывающие домены VH человека широко применяются в области здравоохранения в виде лекарственных средств, диагностических средств и реагентов, а также находят применение в сельском хозяйстве, в областях, связанных с защитой окружающей среды, и в промышленной области.
Таким образом, в первом аспекте настоящее изобретение относится к способу получения антитела, имеющего только тяжелые цепи VH, трансгенными млекопитающими, в котором предусмотрен этап экспрессии гетерологичного локуса тяжелой цепи VH в указанном млекопитающем. Предпочтительно, локус тяжелой цепи VH содержит константную область тяжелой цепи, которая не кодирует домен CH1, и локус, которой способен формировать при экспрессии разнообразные наборы полных антител, имеющих только тяжелые цепи.
Первый аспект настоящего изобретения также относится к способу продукции антитела, имеющего только тяжелые цепи VH верблюда, трансгенными млекопитающими, в котором предусмотрен этап экспрессии локуса тяжелой цепи VH верблюда в таком млекопитающем, причем локус тяжелой цепи VH содержит константную область тяжелой цепи, которая не кодирует домен CH1, и локус которой при экспрессии способен формировать разнообразный набор полных антител, имеющих только тяжелые цепи, включая VDJ-перестройку и созревание аффинности в ответ на антигенную стимуляцию.
Эффекторные молекулы тяжелых цепей могут быть сконструированы таким образом, чтобы представлять собой свободные функциональные домены, например карбоксиконцевые домены CH4, при условии, что их создание не влияло на секреторные механизмы, предотвращающие сборку на клеточной поверхности и, следовательно, B-клеточное созревание. Из гетерологичного локуса удаляют или в этом локусе отсутствуют одни только экзоны CH1. В локусе могут быть разработаны дополнительные особенности, например, для улучшения гликозилирования или дополнительной функции.
Предпочтительно, гетерологичный локус при экспрессии способен формировать функциональные молекулы IgA, IgE, IgG, IgD или IgM или их изотопы. Также могут быть получены отдельные классы антител или смеси классов антител или их изотопы.
Следовательно, гетерологичный локус тяжелой цепи конструируют для продукции предпочтительных классов или смесей антител, имеющих только тяжелые цепи, в зависимости от требуемого класса(классов) антител, с по существу нормальным B-клеточным созреванием. Применение генных сегментов V, D и J верблюда и эффекторных областей верблюда будет давать антитела верблюда с особенностями, специфическими для верблюда, например антитела с удлиненными петлями CDR3. Использование генных сегментов человека V, D и J, содержащих генные сегменты V, выбранные произвольно или выбранные или сконструированные для усиления растворимости, будет продуцировать антитела человека, имеющие только тяжелые цепи.
Антитела, полученные по настоящему изобретению, имеют преимущества перед антителами предшествующего уровня техники, заключающиеся в том, что антитела по настоящему изобретению представляют собой любой один или известный класс и, предпочтительно, являются человеческими. Антитела являются высокоаффинными благодаря комбинации VDJ-рекомбинации и созреванию аффинности in vivo. Антитела и их фрагменты могут быть выделены, охарактеризованы и получены с помощью хорошо известных способов, известных специалистам в данной области техники.
Гетерологичный локус тяжелой цепи
В контексте настоящего изобртения термин  гетерологичный гетерологичный относится к нуклетидной последовательности или локусу, как описано в настоящем описании, который не является эндогенным для млекопитающего, у которого он находится. относится к нуклетидной последовательности или локусу, как описано в настоящем описании, который не является эндогенным для млекопитающего, у которого он находится.  Локус тяжелой цепи VH Локус тяжелой цепи VH в контексте настоящего изобретения относится к минимальному микролокусу, кодирующему домен VH, содержащий один или несколько генных сегментов V, один или несколько генных сегментов D и один или несколько генных сегментов J, необязательно связанных с одной или несколькими эффекторными областями тяжелой цепи (каждая из которых лишена домена CH1). Предпочтительно, первичным источником изменчивости набора антител является область CDR3, сформированная посредством селекции генных сегментов D и J при помощи соединений V-D и D-J. в контексте настоящего изобретения относится к минимальному микролокусу, кодирующему домен VH, содержащий один или несколько генных сегментов V, один или несколько генных сегментов D и один или несколько генных сегментов J, необязательно связанных с одной или несколькими эффекторными областями тяжелой цепи (каждая из которых лишена домена CH1). Предпочтительно, первичным источником изменчивости набора антител является область CDR3, сформированная посредством селекции генных сегментов D и J при помощи соединений V-D и D-J.
Преимуществом настоящего изобретения является тот факт, что набор и разнообразие антител, получаемых в перестроенных генных последовательностях VH, можно максимально увеличить путем использования множества генных сегментов D и J. Последующая соматическая мутация достигается, хотя и используется минимальный локус (микролокус), без необходимости большого количества генных сегментов локусов V или VL и Lc (легкая цепь) иммуноглобулина.
Предпочтительно, локус тяжелой цепи VH содержит от двух до пяти (2, 3, 4 или 5) генных сегментов V, полученных от любого вида позвоночного животного.
Предпочтительно, генные сегменты V являются человеческими, необязательно, выбраны или сконструированы для улучшения растворимости.
Предпочтительно, локус тяжелой цепи VH содержит от двух до сорока (2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 30 или 40) или более генных сегментов D. Генные сегменты D могут быть получены от любого вида позвоночного животного, наиболее предпочтительно, генные сегменты D представляют собой генные сегменты человека D (обычно 25 функциональных генных сегмента D).
Предпочтительно, локус тяжелой цепи VH содержит от двух до двадцати (2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18 или 20) или более генных сегментов J. Генные сегменты J могут быть получены от любого вида позвоночного животного, но наиболее предпочтительно, генные сегменты J представляют собой генные сегменты J человека (обычно 6 генных сегментов J).
Предпочтительно, локус тяжелой цепи VH содержит два или несколько генных сегментов V, двадцать пять функциональных генных сегментов D человека и 6 генных сегментов человека J.
Термин  генный сегмент V генный сегмент V охватывает встречающийся в природе генный сегмент V, полученный от позвоночного животного, включая верблюда и человека, который не обязательно является отобранным, мутированным или разработанным для улучшения характеристик, таких как растворимость. Генные сегменты V также обнаружены у других видов, таких как акула (смотрите Kokubu et al., (1988) EMBO. J., 7, 3413-3422), или они эволюционировали для обеспечения разнообразных VH-подобных семейств связывающих белков, иллюстрацией чего, например, является эволюция набора иммуноглобулиновой легкой цепи VL или набора VH T-клеточных рецепторов. охватывает встречающийся в природе генный сегмент V, полученный от позвоночного животного, включая верблюда и человека, который не обязательно является отобранным, мутированным или разработанным для улучшения характеристик, таких как растворимость. Генные сегменты V также обнаружены у других видов, таких как акула (смотрите Kokubu et al., (1988) EMBO. J., 7, 3413-3422), или они эволюционировали для обеспечения разнообразных VH-подобных семейств связывающих белков, иллюстрацией чего, например, является эволюция набора иммуноглобулиновой легкой цепи VL или набора VH T-клеточных рецепторов.
Предпочтительные способы улучшения растворимости домена VH включают логические, в противоположность только случайным, средства и описаны Davies и Reichmann, (1996) Protein Eng., 9 (6), 531-537 и Riechmann и Muyldermans, (1999) J Immunol. Methods, 231, 25-38. Также может происходить естественная селекция in vivo в результате созревания аффинности и добавление полезных мутаций в ген VH после VDJ-перестройки.
Генный сегмент V должен быть способен к рекомбинации с генным сегментом D, генным сегментом J и константной (эффекторной) областью тяжелой цепи (которая может содержать несколько экзонов, но лишена экзона CH1) согласно настоящему изобретению для генерации антител, имеющих только тяжелые цепи VH, в случае экспрессии нуклеиновой кислоты.
Генный сегмент V согласно настоящему изобретению также включает в пределах своего объема любую генную последовательность, кодирующую гомологичный, модифицированный или белковый фрагмент, который способен к рекомбинации с генным сегментом D, генным сегментом J и константной областью тяжелой цепи (содержащей один или несколько экзонов, но не имеющей экзона CH1) согласно настоящему изобретению для генерации антитела, имеющего только тяжелую цепь, как определено в настоящем описании.
Таким образом, VH кодирующие последовательности могут быть получены от встречающегося в природе источника или они могут быть синтезированы при помощи способов, известных специалистам в данной области техники.
 Домен VH Домен VH в контексте настоящего изобретения относится к продукту экспрессии генного сегмента V после рекомбинации с генным сегментом D и генным сегментом J, как определено выше. Предпочтительно, домен VH, как используется в настоящем описании, остается в растворе и является активным в физиологической среде без необходимости в каком-либо другом факторе для поддержания растворимости. Предпочтительно, способность растворимого домена VH связывать антиген улучшена благодаря VDJ-рекомбинации и соматической мутации. Отсутствует зависимость от наличия или отсутствия удлиненной петли CDR3, характерной для видов верблюдов. Домен VH также способен связывать антиген в виде мономера и в случае объединения с эффекторными константными областями может быть продуцирован в виде моноспецифических, биспецифических, мультиспецифических, бивалентных или мультивалентных форм, в зависимости от выбора и разработки используемых эффекторных молекул (например, IgG, IgA IgM и т.д.) или альтернативных механизмов димеризации и мультимеризации. Любая вероятность связывания с доменом VL в случае экспрессиии в виде части растворимого антитела, имеющего только тяжелую цепь, комплекс – элиминируется удалением экзона CH1 (смотрите Sitia et al., (1990) Cell, 60, 781-790). Один домен VH также может быть сконструирован с различными белковыми доменами для продуцирования слитых белков для целевых терапевтических и диагностических задач, например с токсинами, ферментами и агентами визуализации. в контексте настоящего изобретения относится к продукту экспрессии генного сегмента V после рекомбинации с генным сегментом D и генным сегментом J, как определено выше. Предпочтительно, домен VH, как используется в настоящем описании, остается в растворе и является активным в физиологической среде без необходимости в каком-либо другом факторе для поддержания растворимости. Предпочтительно, способность растворимого домена VH связывать антиген улучшена благодаря VDJ-рекомбинации и соматической мутации. Отсутствует зависимость от наличия или отсутствия удлиненной петли CDR3, характерной для видов верблюдов. Домен VH также способен связывать антиген в виде мономера и в случае объединения с эффекторными константными областями может быть продуцирован в виде моноспецифических, биспецифических, мультиспецифических, бивалентных или мультивалентных форм, в зависимости от выбора и разработки используемых эффекторных молекул (например, IgG, IgA IgM и т.д.) или альтернативных механизмов димеризации и мультимеризации. Любая вероятность связывания с доменом VL в случае экспрессиии в виде части растворимого антитела, имеющего только тяжелую цепь, комплекс – элиминируется удалением экзона CH1 (смотрите Sitia et al., (1990) Cell, 60, 781-790). Один домен VH также может быть сконструирован с различными белковыми доменами для продуцирования слитых белков для целевых терапевтических и диагностических задач, например с токсинами, ферментами и агентами визуализации.
В контексте настоящего изобретения термины  генный сегмент D генный сегмент D и и  генный сегмент J генный сегмент J включает встречающиеся в природе последовательности генных сегментов D и J. Предпочтительно, генные сегменты D и J получают от одного и того же позвоночного животного, от которого получают генный сегмент V. Например, если генный сегмент V получают от человека и затем повышают растворимость или разрабатывают его, генные сегменты D и J также предпочтительно получают от человека. В качестве альтернативы генные сегменты V могут быть получены, например, от верблюда, а генные сегменты D и J – от человека или наоборот. включает встречающиеся в природе последовательности генных сегментов D и J. Предпочтительно, генные сегменты D и J получают от одного и того же позвоночного животного, от которого получают генный сегмент V. Например, если генный сегмент V получают от человека и затем повышают растворимость или разрабатывают его, генные сегменты D и J также предпочтительно получают от человека. В качестве альтернативы генные сегменты V могут быть получены, например, от верблюда, а генные сегменты D и J – от человека или наоборот.
Термины “генный сегмент D” и “генный сегмент J” также охватывают производные, гомологи и их фрагменты при условии, что полученный сегмент может рекомбинировать с оставшимися компонентами локуса тяжелой цепи антитела, как раскрыто в настоящем описании, для генерации антитела, имеющего только тяжелые цепи, как раскрыто в настоящем описании. Генные сегменты D и J могут быть получены из встречающихся в природе источников или они могут быть синтезированы при помощи способов, знакомых специалистам в данной области техники и раскрытых в настоящем описании. Генные сегменты V, D и J способны к рекомбинации и предпочтительно подвержены соматической мутации.
Генные сегменты V, D и J, предпочтительно, получают от одного вида позвоночного животного. Это может быть любое позвоночное животное, но предпочтительно – человек.
Кроме того, гетерологичный локус тяжелой цепи согласно настоящему изобретению содержит область ДНК, кодирующую константную область тяжелой цепи, которая обеспечивает эффекторные функции in vivo (например, IgG, IgM, IgA, IgE, IgD или их изотипы).
Настоящее изобретение также предоставляет антигенспецифическое антитело, имеющее только тяжелую цепь, полученное или получаемое способами настоящего изобретения.
Константная область тяжелой цепи
Функционально, константная область тяжелой цепи кодируется природным или сконструированным генным сегментом, который способен к рекомбинации с генным сегментом V, генным сегментом D и генным сегментом J в B-клетке. Предпочтительно, константную область тяжелой цепи получают из иммуноглобулинового локуса.
Согласно этому аспекту настоящего изобретения каждая константная область тяжелой цепи по существу содержит по меньшей мере один ген константной области тяжелой цепи, который экспрессируется без функционального домена CH1 таким образом, чтобы было возможно получение антитела, имеющего только тяжелые цепи. Каждая константная область тяжелой цепи также может содержать один или несколько дополнительных экзонов константной области тяжелой цепи, которые выбирают из группы, состоящей из С , С , С 1-4, Сµ, С 1-4, Сµ, С и С и С 1-2, с условием, что дополнительные гены константной области тяжелой цепи также не экспрессируют функциональный домен CH1. Генные сегменты константной области тяжелой цепи выбирают в зависимости от требуемого предпочтительного класса или смеси классов антител. Необязательно, гетерологичный локус тяжелой цепи лишен Cµ и C 1-2, с условием, что дополнительные гены константной области тяжелой цепи также не экспрессируют функциональный домен CH1. Генные сегменты константной области тяжелой цепи выбирают в зависимости от требуемого предпочтительного класса или смеси классов антител. Необязательно, гетерологичный локус тяжелой цепи лишен Cµ и C . .
Например, известно, что молекулы Ig класса M играют важную роль в активации макрофагов и пути комплемента. Поскольку их участки связывания находятся в непосредственной близости, IgM имеет высокую авидность к патогенам, включая вирусы. Однако также известно, что IgM трудно использовать в быстрых способах иммуноанализа, в то время как Ig класса G могут быть использованы в этих способах без труда. Для таких применений обычно полезно выбирать предпочтительный класс антител, то есть IgG или IgM.
Экспресия всего или части гетерологичного локуса тяжелой цепи С , лишенного CН1, необязательно будет продуцировать некоторые или все изотипы IgG в зависимости от наличия в гетерологичном локусе IgG изотипов IgG1, IgG2, IgG3 и IgG4. В качестве альтернативы тяжелые цепи могут содержать гены C , лишенного CН1, необязательно будет продуцировать некоторые или все изотипы IgG в зависимости от наличия в гетерологичном локусе IgG изотипов IgG1, IgG2, IgG3 и IgG4. В качестве альтернативы тяжелые цепи могут содержать гены C . В терапии также может быть использована полученная молекула IgE. . В терапии также может быть использована полученная молекула IgE.
В качестве альтернативы могут быть получены выбранные смеси антител. Например, IgA и IgM могут быть получены, если константная область тяжелой цепи содержит гены C и Cµ. и Cµ.
Предпочтительно, константная область тяжелой цепи согласно настоящему изобретению имеет человеческое происхождение, в частности, если антитело, имеющее только тяжелые цепи, должно использоваться с целью терапевтических применений в отношении человека. Там, где антитела, имеющие только тяжелые цепи, должны использоваться с диагностической или ветеринарной целью, константную область тяжелой цепи предпочтительно получают от организма-мишени, позвоночного или млекопитающего, в отношении которого или над которым проводят диагностические исследования или ветеринарную терапию.
Во время экспрессии константная область тяжелой цепи лишается функционального домена CH1. Экзон CH1 и необязательно константные области Cµ и C могут быть подвергнуты мутации, делеции или замене. Предпочтительно, экзон CH1 подвергается делеции. Наличие, например, IgM с функциональным доменом CH1 ингибирует B-клеточное созревание и, следовательно, ограничивает продуктивную экспрессию IgG (лишенного CH1), имеющего только тяжелые цепи в пределах того же локуса, поскольку B-клеточное созревание ингибировано. могут быть подвергнуты мутации, делеции или замене. Предпочтительно, экзон CH1 подвергается делеции. Наличие, например, IgM с функциональным доменом CH1 ингибирует B-клеточное созревание и, следовательно, ограничивает продуктивную экспрессию IgG (лишенного CH1), имеющего только тяжелые цепи в пределах того же локуса, поскольку B-клеточное созревание ингибировано.
 Экзон константной области тяжелой цепи Экзон константной области тяжелой цепи ( ( экзон CH экзон CH ), как раскрыто в настоящем описании, включает последовательности встречающихся в природе экзонов CH позвоночного животного, но особенно млекопитающего. Экзон CH изменяется класс-специфическим образом. Например, IgG и IgA естественным образом лишены домена CH4. Термин ), как раскрыто в настоящем описании, включает последовательности встречающихся в природе экзонов CH позвоночного животного, но особенно млекопитающего. Экзон CH изменяется класс-специфическим образом. Например, IgG и IgA естественным образом лишены домена CH4. Термин  экзон CH экзон CH также включает в пределах своего объема производных гомологи и фрагменты, поскольку экзон CH способен формировать функциональное антитело, имеющее только тяжелую цепь, как определено в настоящем описании, если он представляет собой компонент константной области тяжелой цепи. также включает в пределах своего объема производных гомологи и фрагменты, поскольку экзон CH способен формировать функциональное антитело, имеющее только тяжелую цепь, как определено в настоящем описании, если он представляет собой компонент константной области тяжелой цепи.
Необязательно, если присутствует, CH4 или другие функциональные домены могут быть разработаны или делетированы внутри трансгена, при условии, что такой процесс не ингибирует внутриклеточный секреторный процесс, B-клеточное созревание или связывающую активность полученного полипептида антитела.
Млекопитающие
Трансгенное млекопитающее, используемое в способах настоящего изобретения, не является человеком. Трансгенное млекопитающее предпочтительно представляет собой грызунов, таких как кролик, морская свинка, крыса или мышь. Особенно предпочтительны мыши. Также могут использоваться альтернативные млекопитающие, такие как козы, овцы, кошки, собаки или другие животные.
Предпочтительно трансгенных животных создают, используя общепринятую технологию инъецирования ооцитов и, в случае, если разработаны, ES-клеточную технологию или клонирование.
Преимущественно, согласно способам настоящего изобретения локусы тяжелой цепи и необязательно легкой цепи иммуноглобулинов, эндогенных относительно животного, подвергают делеции или сайлесингу, когда экспрессируется антитело, имеющее только тяжелые цепи.
Такой подход генерации антител, имеющих только тяжелые цепи, как описано выше, может иметь конкретное применение для генерации антител для терапевтического применения относительно человека в виде частого введения антител особи позвоночного, которое отличается происхождением от источника антител, что приводит к проявлению иммунного ответа против указанных введенных антител.
Следовательно, в дополнительном аспекте настоящее изобретение предоставляет трансгенное млекопитающее, экспрессирующее гетерологичный локус тяжелой цепи согласно настоящему изобретению.
Трансгенное млекопитающее может быть создано таким образом, чтобы оно имело пониженную способность продуцировать антитела, которые включают легкие цепи.
Антителопродуцирующие клетки могут быть получены от трансгенных животных согласно настоящему изобретению и использованы, например, при создании гибридов для продуцирования антител, имеющих только тяжелые цепи, как определено в настоящем изобретении. Дополнительно или в качестве альтернативы последовательности нуклеиновых кислот могут быть выделены от трансгенных млекопитающих согласно настоящему изобретению и использованы для продуцирования антител, имеющих только домены VH тяжелых цепей или их биспецифические/бифункциональные комплексы, используя технологии рекомбинантной ДНК, которые известны специалистам в данной области техники.
В качестве альтернативы или дополнительно согласно настоящему изобретению, антигенспецифические антитела, имеющие только тяжелые цепи, можно генерировать иммунизацией трансгенного животного.
Таким образом, в дополнительном аспекте настоящее изобретение представляет способ продуцирования антител, имеющих только тяжелые цепи, иммунизацией антигеном трансгенного млекопитающего согласно настоящему изобретению.
В предпочтительном варианте осуществления указанного аспекта настоящего изобретения млекопитающее является мышью.
Антитела, имеющие только тяжелые цепи, и их фрагменты
В дополнительном аспекте настоящее изобретение представляет антитело, имеющее только тяжелые цепи, получаемое согласно способу настоящего изобретения, и его функциональные фрагменты и производные. Фрагменты, охватывающие связывающий домен VH, могут быть получены ферментативным расщеплением или расщеплением цианогенбромидом антитела настоящего изобретения, имеющего только тяжелые цепи, то есть лишенного легких цепей (Jaton et al., (1968) Biochemistry, 7, 4185-4195).
Предпочтительный функциональный фрагмент представляет собой антигенспецифический связывающий домен только тяжелой цепи, то есть связывающий домен VH, как экспрессируемый локусом VH в результате рекомбинации между единичными генными сегментами V, D и J, за которой позже следует соматическая мутация. Согласно этому аспекту настоящего изобретения локусы VH могут быть клонированы из, например, мРНК, выделенной из антителопродуцирующей клетки иммунизированного трансгенного животного, как описано выше. Клонированные последовательности могут быть затем отображены при помощи библиотек фагового (Ward et al., (1989) Nature, 341, 544-546) или аналогичного дисплея, например, путем использования систем на основе дрожжей (Boder and Wittrup, (1997) Nat. Biotechnol., 15, 553-7), а антигенспецифические связывающие домены VH идентифицированы. Антигенспецифические связывающие домены тяжелой цепи затем могут быть произведены либо отдельно, либо в виде слитых белков в размерно варьируемых бактериальных, дрожжевых или альтернативных системах экспрессии. Последовательности, кодирующие связывающие домены VH, также могут быть клонированы из охарактеризованных гибридом, полученных классическими процедурами от иммунизированных трансгенных мышей. Затем они могут использоваться для продуцирования связывающих доменов VH и их производных, включая разработку определенных классов антител (например, IgE или IgA), и их вариантов с различными эффекторными функциями.
Следовательно, настоящее изобретение также предоставляет способ продуцирования связывающего домена VH, содержащий этапы, на которых:
a) выделяют клетку или ткань, экспрессирующую представляющее интерес антигенспецифическое антитело, имеющее только тяжелые цепи (предпочтительно, представляющее интерес растворимое антигенспецифическое антитело, имеющее только тяжелые цепи);
b) клонируют последовательность, кодирующую связывающий домен VH из мРНК, полученной из выделенной клетки или ткани;
c) отображают кодированный белок, используя фаговую или аналогичную библиотеку;
d) идентифицируют антигенспецифические связывающие домены VH, и
e) экспрессируют связывающие домены VH отдельно или в виде слитого белка в системах экспрессии в бактериях, дрожжах, млекопитающих или альтернативных системах.
В качестве альтернативы фрагменты, содержащие домен VH, могут быть сгенерированы из антител настоящего изобретения, имеющих только тяжелые цепи, путем использования ферментативных или химических способов расщепления и последующим отделением фрагмента, содержащего домен VH, от других продуктов расщепления.
Там, где связывающий домен VH выделен из охарактеризованной гибридомы, клонированная последовательность связывающего домена VH, полученная из мРНК, может быть клонирована непосредственно в вектор экспрессии без источника дополнительных этапов селекции, использующих системы фагового или другого дисплея.
Системы продуцирования антитела, имеющего только тяжелые цепи, содержащего эффекторные области, включают клетки млекопитающих в культуре (например, клетки CHO), растений (например, маиса), трансгенных коз, кроликов, крупного рогатого скота, овец, цыплят и личинок насекомых, подходящих для технологии массового разведения. Другие системы продуцирования, включая инфицирование вирусом (например, бакуловирус в личинках насекомых и клеточные линии), представляют собой альтернативные подходы, использующие клеточные культуры и зародышевые линии. Другие способы продуцирования также хорошо известны специалистам в данной области техники. Там, где требуется сборка IgA или IgM, имеющих только тяжелые цепи, полезна коэкспрессия  цепи J цепи J . Подходящие способы продуцирования антитела верблюда, имеющего только тяжелые цепи, или одних связывающих доменов VH известны в данной области техники. Например, связывающие домены VH верблюда были продуцированы в бактериальных системах, а гомодимеры верблюда, имеющие только тяжелые цепи, были продуцированы в гибридомах и трансфецированных клетках млекопитающих (смотрите Reichmann and Muyldermans, (1999) J. Immunol. Methods, 231, 25-38). . Подходящие способы продуцирования антитела верблюда, имеющего только тяжелые цепи, или одних связывающих доменов VH известны в данной области техники. Например, связывающие домены VH верблюда были продуцированы в бактериальных системах, а гомодимеры верблюда, имеющие только тяжелые цепи, были продуцированы в гибридомах и трансфецированных клетках млекопитающих (смотрите Reichmann and Muyldermans, (1999) J. Immunol. Methods, 231, 25-38).
Также общепринятыми являются способы экспрессии разработанных связывающих доменов VH человека, полученных при помощи технологии фагового дисплея (Tanha et al., (2001) J. Biol. Chem., 276, 24774-24780 и ссылки, приведенные там).
Показано, что личинки насекомых от линий трансгенных мух продуцируют функциональные фрагменты антитела, имеющего только тяжелые цепи, в гемолимфе с признаками, неотличимыми от такого же антитела, продуцированного клетками млекопитающих (PCT/GB2003/0003319). Настоящее изобретение также предоставляет антигенспецифический мономерный или димерный связывающий домен VН, получаемый согласно способу этого аспекта настоящего изобретения.
Настоящее изобретение также предоставляет полинуклеолтидную последовательность, состоящую из гетерологичного локуса тяжелой цепи, выделенного полинуклеотида, кодирующего антитело настоящего изобретения, имеющее только тяжелые цепи, и вектор, содержащий гетерологичный локус тяжелой цепи, или его фрагмент, или выделенный полинуклеотид, кодирующий антитело, имеющее только тяжелые цепи, согласно настоящему изобретению.
Настоящее изобретение также предоставляет клетку-хозяина, трансформированную гетерологичным локусом тяжелой цепи или его фрагментом, или выделенным полинуклеотидом, кодирующим антитело, имеющее только тяжелые цепи, или фрагмент антитела согласно настоящему изобретению.
Во втором аспекте настоящее изобретение предоставляет полипептидный комплекс, содержащий антигенспецифический связывающий домен VH согласно настоящему изобретению, имеющий прикрепленный к нему эффекторный участок, который обеспечивает эффекторную активность. Эта эффекторная активность может быть дополнительной к эффекторной активности, обеспечиваемой константной областью тяжелой цепи и может быть расположена на амино- или карбоксиконце молекулы. Такие полипептидные комплексы сохраняют физиологическую функцию, которой их наделяет антигенспецифический связывающий домен VH в комбинации с дополнительными нацеливающей функцией и эффекторной функцией эффекторных участков. Такие полипептидные комплексы могут быть в виде функциональных мономеров или в зависимости от разработки и взаимодействия эффекторных участков димерами, тетрамерами, пентамерами, мультимерами или другими комплексами, включающими различные связывающие домены VН, поэтому обеспечивая мультивалентность и мультиспецифичность. Связывающие домены VH могут находиться на амино- или карбоксиконце связывающей молекулы (смотрите фиг.1 для примера димера).
Если эффекторный участок содержит связывающий домен, он может иметь специфичность, отличную от антигенспецифического связывающего домена VH. Преимущество такой структуры заключается в том, что полипептидный комплекс может облегчить образование поперечных связей различных мишеней. Например, биспецифический полипептидный комплекс может быть использован для усиления взаимодействий клетка-клетка и взаимодействий клетка/патоген. В таком варианте осуществления полипептидный комплекс настоящего изобретения может использоваться, например, для образования мостика между двумя типами клеток, такими как патоген и макрофаг (смотрите Biburger et al., (2005) J. Mol. Biol, 346, 1299-1311). В таких биспецифических разработках использование связывающих доменов VH предпочтительнее использования связывающих доменов scFV. Связывающие домены VH имеют высокую аффинность связывания и могут быть введены в такие полипептидные комплексы при помощи минимальной векторной конструкции и без учета разработки, необходимой для поддержания специфичности и аффинности scFV относительно их тетрамерной родительской молекулы. Там, где предусмотрены димеры или мультимерные полипептидные комплексы, вводят домены димеризации, например включают домены CH2 и CH3, полученные из константных областей тяжелых цепей иммуноглобулинов (смотрите фиг.2).
Термин  эффекторный участок эффекторный участок , как используется в настоящем описании, включает любой участок, который опосредует в клетке желательный биологический эффект. Эффекторный участок предпочтительно является растворимым и может представлять собой пептид, полипептид или белок, или может иметь непептидную структуру. Например, эффекторный участок может представлять собой фермент, гормон, цитокин, лекарство, пролекарство, токсин, в частности белковый токсин, радионуклид в хелатной структуре, связывающий домен, домен димеризации или взаимодействия, агент визуализации, альбумин или ингибитор. , как используется в настоящем описании, включает любой участок, который опосредует в клетке желательный биологический эффект. Эффекторный участок предпочтительно является растворимым и может представлять собой пептид, полипептид или белок, или может иметь непептидную структуру. Например, эффекторный участок может представлять собой фермент, гормон, цитокин, лекарство, пролекарство, токсин, в частности белковый токсин, радионуклид в хелатной структуре, связывающий домен, домен димеризации или взаимодействия, агент визуализации, альбумин или ингибитор.
Альбумин может быть использован в качестве эффекторного участка для увеличечния стабильности или фармакокинетических, и/или фармакодинамических свойств антигенспецифического связывающего домена VH (Sung et al., (2003) J. Interferon Cytokine Res., 23 (1): 25-36). В качестве альтернативы эффекторный участок может представлять собой пэгилированную структуру или естественным образом гликозилированную структуру для улучшения фармакодинамических свойств.
Эффекторный участок может представлять собой пептид, связанный с антигенспецифическим связывающим доменом VH, или он может быть химически связан с антгенспецифическим доменом VH тяжелой цепи, например, при помощи химической связывающей структуры, такой как малеимидный линкер. В качестве альтернативы полипептидные комплексы настоящего изобретения могут быть экспрессированы в виде слитых белков. По существу настоящее изобретение также охватывает полинуклеотидную последовательность, состоящую из гетерологичного локуса тяжелой цепи или выделенного полинуклеотида, кодирующего антитело настоящего изобретения, имеющего только тяжелую цепь, причем полинуклеотид дополнительно содержит в рамке считывания один или несколько экзонов, кодирующих эффекторный участок. Такой экзон может находиться на 5′- или 3′-конце полинуклеотида. Например, полинуклеотид может содержать, в порядке следования и в рамке считывания, VH и генный сегмент связывающего домена/эффекторного участка. В случае генетических слияний прикрепление различных доменов может достигаться при помощи конструкции рекомбинантной ДНК, которая кодирует аминокислотную последовательность слитого белка, с ДНК, кодирующей различные домены, расположенные в той же рамке считывания. Такие конструкции являются ценными в качестве диагностических и терапевтических средств. В качестве диагностического средства эффекторный домен может представлять собой флуоресцентный белок (например, GFP) или фермент (например,  -gal). В качестве альтернативы эффекторный домен может представлять собой тэг для усиления связывания с субстратом (например, полигистидин или биотин) и антиген для обеспечения участка прикрепления для вторичных антител или лециновую молнию, или аналогичный связывающий мотив, который может служить в качестве участка прикрепления флуоресцентных маркеров. -gal). В качестве альтернативы эффекторный домен может представлять собой тэг для усиления связывания с субстратом (например, полигистидин или биотин) и антиген для обеспечения участка прикрепления для вторичных антител или лециновую молнию, или аналогичный связывающий мотив, который может служить в качестве участка прикрепления флуоресцентных маркеров.
Полипептидные комплексы
Авторы настоящего изобретения также предположили, что существует возможность продуцирования бивалентного или мультивалентного полипептидного комплекса, содержащего по меньшей мере часть тяжелой цепи антитела одного или в комбинации с отдельной эффекторной (легкой) цепью, содержащей комплементарный домен сборки и имеющей дополнительную эффекторную активность. Полипептидные комплексы согласно настоящему изобретению сохраняют физиологическую функцию, обеспечиваемую константной областью тяжелой цепи в комбинации с дополнительными функциями эффекторного участка, связанного с эффекторной цепью (фиг.3).
По существу в третьем аспекте полипептидный комплекс содержит тяжелые цепи в комбинации с одной или несколькими эффекторными цепями (легкими цепями). Второй аспект настоящего изобретения предоставляет полипептидный комплекс, содержащий пару тяжелых цепей и пару эффекторных цепей, причем:
тяжелые цепи пары связаны друг с другом;
одна из эффекторных цепей связана с одной из тяжелых цепей, а другая эффекторная цепь связана с другой тяжелой цепью;
каждая тяжелая цепь содержит связывающий домен, домен димеризации, предпочтительно содержащий по меньшей мере домены CH2, CH3 и необязательно CН4 константной области, и эффекторный участок, способный связываться с комплементарным доменом сборки эффекторной цепи; и
эффекторная цепь содержит комплементарный домен сборки, имеющий прикрепленный к нему эффекторный участок,
при этом домен сборки и комплементарный домен сборки связаны друг с другом при помощи нековалентных взаимодействий.
Предпочтительно, эффекторный участок в тяжелой цепи отличается от эффекторного участка в эффекторной цепи.
Необязательно, полипептидный комплекс включает гибкий шарнироподобный домен на карбоксильном конце домена CH3 (или домена CH4, если он присутствует), связывающий его с доменом сборки. Предпочтительно, полипептидный комплекс включает природный шарнирный домен или гибкий разработанный шарнироподобный домен между связывающим доменом и доменом CH2. Наличие шарнирных областей облегчает независимое функционирование связывающих доменов и эффекторных участков в полученных полипептидных комплексах.
Эффекторный участок в первой полипептидной тяжелой цепи необязательно имеет специфичность, отличную от специфичности эффекторного участка во второй полипептидной тяжелой цепи. Согласно настоящему изобретению эффекторный участок полипептидного комплекса может быть заменен связывающим доменом. Предпочтительно, связывающий домен содержит домен VH (как определено в первом аспекте настоящего изобретения) или домен, связывающий клеточный рецептор. Полученный тетравалентный димерный связывающий белок (полипептидный комплекс) может содержать до четырех различных эффекторных участков. Предпочтительно эффекторные участки на аминотерминальном конце тяжелой цепи идентичны, и эффекторные участки на карбоксильном терминальном конце идентичны (но узнают антиген или эпитоп, отличный от антигена или эпитопа на аминотерминальном конце), облегчая сборку единичного гомодимера. Такая молекула может оказаться более эффективной при захвате патогенов, при этом эффекторная функциональность обеспечивается включением подходящих функциональных доменов тяжелой цепи (например, IgA или IgM).
Иллюстративный полипептидный комплекс согласно третьему аспекту настоящего изобретения является полезным для цитохимического мечения, способов нацеливания или терапии, например, если эффекторная молекула содержит антигенспецифический связывающий домен VH, который нацеливается на поверхностный маркер раковой клетки, а эффекторный участок содержит связывающий домен, специфический для фермента, преобразующего пролекарство (эффекторная цепь). Антигенспецифический связывающий домен VH связывается с мишенью и доставляет эффекторный участок в непосредственную близость от мишени так, что при связывании эффекторной цепи он может оказывать биологическое влияние на мишень в присутствии пролекарства (например, нитроредуктаза с CB1954). Включение эффекторной функции тяжелой цепи иммуноглобулина в качестве домена димеризации также может быть полезным для элиминации мишеневой клетки.
Эффекторная цепь
Эффекторная цепь содержит комплементарный связывающий домен и эффекторный участок, который связан с тяжелой цепью при помощи эффекторного участка тяжелой цепи, образуя собранный связывающий полипептидный комплекс. Комплементарный домен сборки эффекторной цепи может представлять собой интегральный компонент эффекторного участка или белок, или альтернативный лиганд, слитый или химически связанный с эффекторным участком. Тяжелые цепи собранного связывающего полипептидного комплекса связываются с мишенью и доставляют участок эффекторной (легкой) цепи в непосредственную близость от мишени, так что могут оказывать влияние на мишень.
Эффекторный участок
Термин  эффекторный участок эффекторный участок , как используется в настоящем описании, включает любой участок, который опосредует желательное биологическое влияние на клетку. Эффекторный домен может представлять собой клетку, например T-клетку, пептид, полипептид или белок, или может представлять собой непептидную структуру. Например, эффекторный домен может представлять собой фермент, лекарство, пролекарство, токсин, в частности белковый токсин, радионуклид в хелатной структуре или связывающий домен. Эффекторный участок, связанный с комплементарным доменом сборки, может быть клеточным, белковоподобным, иметь органическое или неорганическое происхождение, в зависимости от желательного эффекта. , как используется в настоящем описании, включает любой участок, который опосредует желательное биологическое влияние на клетку. Эффекторный домен может представлять собой клетку, например T-клетку, пептид, полипептид или белок, или может представлять собой непептидную структуру. Например, эффекторный домен может представлять собой фермент, лекарство, пролекарство, токсин, в частности белковый токсин, радионуклид в хелатной структуре или связывающий домен. Эффекторный участок, связанный с комплементарным доменом сборки, может быть клеточным, белковоподобным, иметь органическое или неорганическое происхождение, в зависимости от желательного эффекта.
Термин  связывающий домен связывающий домен , как используется в настоящем описании в отношении всех вышеуказанных аспектов настоящего изобретения, включает полипептидный домен, который является активным в физиологической среде. Такой связывающий домен также должен иметь способность к связыванию с мишенью в физиологических условиях. , как используется в настоящем описании в отношении всех вышеуказанных аспектов настоящего изобретения, включает полипептидный домен, который является активным в физиологической среде. Такой связывающий домен также должен иметь способность к связыванию с мишенью в физиологических условиях.
Такие связывающие домены включают домены, которые могут опосредовать связывание или адгезию на клеточной поверхности. Подходящие домены, которые могут быть использованы в полипептидных комплексах настоящего изобретения, представляют собой молекулы адгезии клеток млекопитающих, прокариотических клеток или вирусов, цитокины, факторы роста, рецепторные антагонисты или агонисты, лиганды, рецепторы клеточной поверхности, регуляторные факторы, структурные белки и пептиды, белки сыворотки, секретируемые белки, белки, связанные с плазмалеммой, вирусные антигены, бактериальные антигены, протозойные антигены, антигены паразитов, липопротеины, гликопротеины, гормоны, нейротрансмиттеры, факторы свертывания крови, разработанную единичную цепь Fvs и т.п. Предпочтительно связывающий домен представляет собой домен VH позвоночного животного, более предпочтительно домен VH млекопитающего, такой как домен VH человека.
Связывающий домен может содержать домен VH (VHH) верблюда или может содержать домен VH, полученный от другого животного. Предпочтительно связывающий домен представляет собой домен VH человека. Связывающие домены VH предпочтительно происходят от B-клеток, полученных от трансгенных животных или верблюда (как описано выше), в противоположность доменам VH, полученным из синтетических фаговых библиотек, поскольку первый будет иметь более высокую аффинность в результате генерации в ответ на антигенную стимуляцию in vivo благодаря VDJ-перестройке и соматической мутации.
Если эффекторный участок содержит связывающий домен, он предпочтительно имеет специфичность, отличную от связывающего домена тяжелой цепи. Преимущество такого строения заключается в том, что полипептидный комплекс может облегчать перекрестное сшивание различных мишеней или связывать различные антигены на клетке-мишене (например, патоген).
Связывающий домен в первой тяжелой цепи может иметь специфичность, отличную от специфичности связывающего домена второй тяжелой цепи. Таким образом, полипептидный комплекс может быть по меньшей мере бивалентным и может перекрестно сшивать различные мишени, и эффекторный домен может оказывать влияние на обе мишени. Мультивалентный полипептидный комплекс может быть создан посредством связи таких тетравалентных тяжелых цепей с эффекторными цепями, содержащими эффекторные домены с различной специфичностью (специфичностями) и функциональностью. Также эффекторный участок первой тяжелой цепи может иметь специфичность, отличную от специфичности эффекторного участка второй тяжелой цепи, позволяя захватывать более одной эффекторной цепи, каждая из которых обладает отличной функциональностью.
Комплементарный домен сборки связывается с эффекторным участком
Если тяжелая цепь связана с эффекторной цепью, термины  эффекторный участок эффекторный участок и и  комплементарный домен сборки комплементарный домен сборки , как используются в настоящем описании, включают любые участки, которые могут формировать по меньшей мере прикрепление друг к другу нековалентным способом. Например, эффекторный участок и комплементарный домен сборки могут представлять собой белок, пептидный фрагмент или иметь консенсусную последовательность, способную формировать взаимодействие белок-белок, например, которое присутствует между доменом CH1 тяжелой цепи иммуноглобулина и константной областью легкой цепи иммуноглобулина; в лейциновой молнии; VCAM и VLA-4; интегринами и внеклеточными белками матрикса; интегринами и молекулами клеточной поверхности, такими как CD54 или CD102; ALCAM и SRCR доменами; scFv и антигеном или связывающим доменом VH и антигеном. , как используются в настоящем описании, включают любые участки, которые могут формировать по меньшей мере прикрепление друг к другу нековалентным способом. Например, эффекторный участок и комплементарный домен сборки могут представлять собой белок, пептидный фрагмент или иметь консенсусную последовательность, способную формировать взаимодействие белок-белок, например, которое присутствует между доменом CH1 тяжелой цепи иммуноглобулина и константной областью легкой цепи иммуноглобулина; в лейциновой молнии; VCAM и VLA-4; интегринами и внеклеточными белками матрикса; интегринами и молекулами клеточной поверхности, такими как CD54 или CD102; ALCAM и SRCR доменами; scFv и антигеном или связывающим доменом VH и антигеном.
Тяжелые цепи
Там, где домены димеризации тяжелых цепей содержат константные области тяжелых цепей иммуноглобулинов, константные области (экзоны CH) могут обеспечивать дополнительную физиологическую функциональность связывающего полипептидного комплекса. В частности, константные домены тяжелых цепей иммуноглобулинов могут обеспечивать, среди прочего, фиксацию комплемента, активацию макрофага и связывание с Fc-рецепторами в зависимости от класса или подкласса константных доменов антитела.
Как обсуждалось выше, хорошо известно, что класс экспрессированных тяжелых цепей играет большую роль в эффекторной функции in vivo. Созданная клеточная линия может продуцировать полипептидный комплекс, имеющий полезное нацеливание и биологический эффект, но константная область тяжелой цепи может относиться к классу, который является нежелательным с точки зрения диагностики или терапии, или он может не секретироваться в эффективных количествах. Соотвественно, константные домены тяжелой цепи полипептидных комплексов настоящего изобретения могут специфическим образом изменяться или частично, или полностью исключаться для введения или удаления компонентов тяжелых цепей иммуноглобулинов.
Например, известно, что молекулы Ig класса M играют важную роль в активации макрофагов и пути комплемента. Благодаря расположению в непосредственной близости от связывающих участков IgM имеет высокую авидность к патогенам, включая вирусы. Однако также известно, что IgM трудно использовать в быстрых способах иммуноанализа, тогда как Ig класса G можно без труда использовать в этих способах. Для таких применений было бы полезным переключение класса тяжелой цепи с µ- на  -домены. -домены.
Экспрессия только локуса тяжелой цепи C будет продуцировать IgG, включая изотипы IgG1, IgG2, IgG3 и IgG4, некоторые из которых также будут активировать комплемент. IgG антитела связывают и активируют макрофаги и гранулоциты и могут проникать через плаценту. будет продуцировать IgG, включая изотипы IgG1, IgG2, IgG3 и IgG4, некоторые из которых также будут активировать комплемент. IgG антитела связывают и активируют макрофаги и гранулоциты и могут проникать через плаценту.
Дополнительные применения классов различных антител обсуждались выше.
Константные области тяжелых цепей полипептидных комплексов настоящего изобретения могут происходить от человека, могут происходить от кроликов, крыс или мышей, как определено выше. Предпочтительно, они происходят от человека.
Полипептидные комплексы настоящего изобретения также могут быть использованы исключительно для блокирования связывания лигандов с их рецепторами при помощи доменов димеризации, которые не обеспечивают эффекторные фукции. При помощи мультиспецифического полипептидного комплекса может быть блокировано множество рецепторов.
В четвертом аспекте настоящего изобретения эффекторная молекула может содержать домен димеризации, такой, что эффекторная молекула может быть связана с отдельной эффекторной молекулой. Такой домен димеризации может содержать один или несколько доменов CH2, СH3 или CН4 константной области антитела и/или цепь J. В этом варианте осуществления настоящего изобретения две или более эффекторные молекулы могут быть связаны с продуцированием димера или мультимера эффекторных молекул. Эффекторные молекулы могут быть одинаковыми (позволяя продуцирование гомодимера или гомомультимера эффекторных молекул) или разными (позволяя продуцирование гетеродимера или гетеромультимера эффекторных молекул). Предпочтительно, димер или мультимер эффекторных молекул является бивалентным или мультивалентным. Предпочтительно, константные области двух или более эффекторных молекул (т.е. домены димеризации) являются идентичными, таким образом, уменьшая вероятность гетерогенности продукта.
Согласно четвертому аспекту настоящего изобретения предоставляется полипептидный комплекс, содержащий димер, состоящий из первой тяжелой цепи полипептида и второй тяжелой цепи полипептида, причем:
каждая тяжелая цепь полипептида содержит связывающий домен и домен димеризации, который необязательно содержит по меньшей мере домены CH2, CH3 и необязательно CH4 константного участка антитела; и, необязательно, эффекторный участок, при этом предпочтительно:
связывающий домен первой тяжелой цепи полипептида имеет такую же специфичность, как и связывающий домен второй тяжелой цепи полипептида; и
константные области (домены димеризации) для двух тяжелых цепей полипептида идентичны.
Предпочтительно, первая и вторая цепи имеют одинаковые эффекторные участки.
Предпочтительно, домен димеризации содержит по меньшей мере домены CH2, CН3 и необязательно CН4 константной области антитела.
Четвертый аспект настоящего изобретения также предоставляет полипептидный комплекс, содержащий множество полипептидных димеров тяжелой цепи и цепь J, причем:
множество димеров полипептидной тяжелой цепи собраны при помощи цепи J;
каждая полипептидная тяжелая цепь содержит связывающий домен и идентичные домены CH2, CH3 и необязательно CH4 цепей µ,  , ,  или или  ; и ; и
в полипептидном комплексе существует по меньшей мере два связывающих домена, имеющих различные специфичности (смотрите фиг.4 и 5).
Как определено выше для первого аспекта настоящего изобретения, каждая константная область тяжелой цепи предпочтительно содержит по меньшей мере один ген константной области тяжелой цепи, который экспрессируется без функционального домена CН1 так, что может происходить получение антитела, имеющего только тяжелые цепи. Каждая константная область тяжелой цепи также может содержать один или несколько дополнительных генов константной области тяжелой цепи, которые выбирают из группы, состоящей из C , C , C 1-4; Cµ, C 1-4; Cµ, C и C и C 1-2 при условии, что дополнительные гены константных областей тяжелой цепи также не экспрессируют функциональный домен CH1. Гены константной области тяжелой цепи выбирают в зависимости от требуемого предпочтительного класса или смеси классов антител. 1-2 при условии, что дополнительные гены константных областей тяжелой цепи также не экспрессируют функциональный домен CH1. Гены константной области тяжелой цепи выбирают в зависимости от требуемого предпочтительного класса или смеси классов антител.
Предпочтительно, существует только два связывающих домена различных спцифичностей в экспрессированных IgA и IgM.
В одном из вариантов осуществления каждая из тяжелых цепей включает домен CH4, причем константные домены представляют собой домены  , а полипептидный комплекс включает цепь J. , а полипептидный комплекс включает цепь J.
В другом варианте осуществления каждая из тяжелых цепей включает домен CH4, причем константные домены представляют собой домены µ, а антитело включает цепь J.
Сборка полипептидного комплекса
Модульная доменная конструкция полипептидных комплексов настоящего изобретения дает возможность конструировать их с большим количеством возможных перестановок. Такие изменения в доменной архитектуре и аминокислотной последовательности полипептидного комплекса могут достигаться подходящей мутацией или неполным синтезом и заменой подходящих областей, соответствующих кодирующих последовательностей ДНК. Замена или дополнительные домены могут быть получены из совместимых рекомбинантных последовательностей ДНК. Например, тяжелые цепи могут включать природный шарнирный или разработанный гибкий полипептидный домен, оба из которых находятся между связывающим доменом и аминоконцом домена CH2 и между эффекторным доменом и C-терминальным концом тяжелой цепи (CH3 или CН4).
Тяжелые цепи в полипептидном комплексе настоящего изобретения экспрессируются в виде слитых белков. Эффекторные цепи в полипептидном комплексе указанного аспекта настоящего изобретения могут эксперссироваться в виде слитых белков или могут быть собраны при помощи химических средств или, в случае их клеточного происхождения, могут быть выделены из крови или ткани, или захвачены in vivo (например, альбумином).
В случае генетических слияний прикрепление различных доменов может достигаться при помощи рекомбинантной конструкции ДНК, которая кодирует аминокислотную последовательность слитого белка, с ДНК, кодирующей различные домены, находящиеся в той же рамке считывания.
Эффекторный участок, если присутствует в виде части слитого белка, может находиться либо на амино-, либо на карбоксиконце комплементарного домена сборки.
В качестве альтернативы домены эффекторной цепи могут быть собраны при помощи обычных способов химии пептидов, как известно в данной области техники, а не синтезированы в виде слитого белка.
Связь может быть сформирована при помощи пептидной связи или при помощи химической связи. Например, эффекторный участок может представлять собой пептид, связанный с комплементарным доменом сборки, или он может быть химически связан с комплементарным доменом сборки, например, при помощи химической связывающей структуры, такой как малеимидный линкер.
Эффекторный участок может быть расположен в любом месте тяжелой цепи. Например, эффекторный участок может быть расположен на C-терминальном конце тяжелой цепи или между связывающим доменом и либо доменом CH2, либо шарнирным доменом полипептидного комплекса. Предпочтительным является, чтобы домен сборки не находился между доменами CH2 и CH3, поскольку он может интерферировать с эффекторной функцией и доменами димеризации. Предпочтительно, чтобы эффекторный участок прикреплялся к аминоконцу или карбоксиконцу тяжелой цепи при помощи пептидного гибкого линкера или шарнироподобной области с тем, чтобы облегчить независимое связывание/функционирование эффекторных участков.
Полинуклеотидные последовательности, векторы и клетки-хозяева
Настоящее изобретение также предоставляет полинуклеотидную последовательность, кодирующую тяжелую цепь любого одного из полипептидных комплексов настоящего изобретения, вектор, содержащий одну или несколько полинуклеотидных последовательностей, относящихся к вышеуказанной последовательности, и клетку-хозяина, трансформированную вектором, кодирующим тяжелую цепь полипептидного комплекса настоящего изобретения. Полинуклеотиды предпочтительно включают последовательности, которые позволяют секретирование экспрессированных тяжелых цепей в виде гомодимеров в среду, в которой растет клетка-хозяин. Клетка-хозяин может иметь любое происхождение, включая бактериальные и дрожжевые клетки, но предпочтительной является клетка-хозяин позвоночного животного, более предпочтительна клетка-хозяин млекопитающего.
Трансфекция одной и той же клетки-хозяина вторым вектором, кодирующим тяжелую цепь, содержащую связывающий домен со специфичностью к другой мишени, приводит к коэкспрессии двух конструкций и сборке смеси гомодимеров и гетеродимеров. Гомодимеры будут проявлять специфичность к родственному антигену, а гетеродимеры будут связывать оба антегена.
Настоящее изобретение также предоставляет клетку-хозяина, трансформированную вектором, кодирующим по меньшей мере одну эффекторную цепь полипептидного комплекса настоящего изобретения. Клетка-хозяин может иметь любое происхождение, включая бактериальную и дрожжевую клетки, но предпочтительной является клетка-хозяин позвоночного животного, более предпочтительна клетка-хозяин млекопитающего. В качестве альтернативы эффекторная цепь может быть синтезирована при помощи способов, известных в данной области техники.
Настоящее изобретение также предоставляет клетку-хозяина, трансформированную вектором, кодирующим по меньшей мере одну тяжелую цепь полипептидного комплекса настоящего изобретения. Клетка-хозяин может иметь любое происхождение, включая бактериальную и дрожжевую клетки, но предпочтительной является клетка-хозяин позвоночного животного, более предпочтительна клетка-хозяин млекопитающего. В качестве альтернативы тяжелая цепь может быть синтезирована при помощи способов, известных в данной области техники.
Настоящее изобретение также предоставляет клетку-хозяина, трансформированную вектором, кодирующим по меньшей мере одну тяжелую цепь и по меньшей мере одну эффекторную цепь полипептидного комплекса настоящего изобретения. Клетка-хозяин может иметь любое происхождение, включая бактериальную и дрожжевую клетки, но предпочтительной является клетка-хозяин позвоночного животного, более предпочтительна клетка-хозяин млекопитающего. В качестве альтернативы цепи могут быть синтезированы независимо и собраны при помощи способов, известных в данной области техники.
Помимо этого, настоящее изобретение предоставляет трансгенный организм, экспрессирующий по меньшей мере один гомо- или гетеродимерный полипептидный комплекс из тяжелых цепей настоящего изобретения. Трансгенный организм может представлять собой позвоночное животное или млекопитающее, не являющееся человеком, растение или насекомое.
Настоящее изобретение также предоставляет способ продуцирования класс-специфических антител, имеющих только тяжелые цепи, и их домены VH согласно первому аспекту настоящего изобретения путем иммунизации антигеном трансгенного организма настоящего изобретения. В предпочтительном варианте этого аспекта настоящего изобретения организм представляет собой мышь.
Продуцирование антител и полипептидных комплексов для применений в здравоохранении требует широкомасштабных систем производства, примеры которых более подробно обсуждались выше. Такие системы включают растения (например, маис), трансгенный крупный рогатый скот и овец, цыплят и личинок насекомых, подходящих для технологии массового разведения. Специалистам в данной области техники также знакомы другие системы продуцирования, включая инфицирование вирусом (например, бакуловирусом личинки насекомого и клеточные линии) в качестве альтернативы клеточным культурам и зародышевым линиям.
Эти способы и другие подходящие способы, известные в данной области техники, могут быть использованы для продуцирования связывающих полипептидных комплексов настоящего изобретения. Путем использования этих способов может быть достигнуто получение гомодимеров и/или гетеродимеров.
Применение антител, имеющих только тяжелые цепи, и полипептидных комплексов настоящего изобретения
Антитела, имеющие только тяжелые цепи и связывающие полипептидные комплексы настоящего изобретения, имеют множество применений.
Антитела, имеющие только тяжелые цепи, и полипептидные комплексы настоящего изобретения содержат би- и мультиспецифические полипептидные комплексы. Эти комплексы являются особенно полезными, например, в качестве терапевтических средств для лечения и предупреждения инфекционных заболеваний.
Антитела, имеющие только тяжелые цепи, и полипептидные связывающие комплексы настоящего изобретения полезны для цитохимического мечения, способов нацеливания, терапии и в качестве диагностических средств.
При терапии моноклональными антителами ускользание патогена, например, вследствие мутации, приводящей к потере одного связывающего участка, будет аннулировать терапевтический эффект антитела. Продуцирование гетеродимерных полинуклеотидных комплексов, узнающих различные антигены на одном и том же патогене, может решить эту задачу. Использование по меньшей мере двух связывающих доменов, имеющих различные специфичности, в полипептидных комплексах настоящего изобретения также может использоваться для усиления как взаимодействий клетка-клетка, так и взаимодействий клетка/патоген.
В таком варианте осуществления полипептидные комплексы настоящего изобретения могут использоваться, например, для образования мостиковых полипептидных комплексов между двумя клеточными типами, такими как патоген и макрофаг или раковая клетка и T-клетка. В качестве альтернативы полипептидный комплекс может узнавать два или несколько эпитопов на одном и том же патогене, при этом эффекторная функция обеспечивается только константной областью тяжелой цепи.
В качестве альтернативы биспецифические связывающие полипептидные комплексы могут использоваться для нацеливания на клетки и ткани in vivo, затем для захвата циркулирующих эффекторных молекул или агента визуализации. Например, биспецифические агенты, нацеленные на опухоли, могут использоваться для захвата комплексов, превращающих пролекарства, для последующего локализованного превращения пролекарства в агент визуализации. Би- и мультиспецифические связывающие комплексы в комбинации с эффекторными агентами также могут использоваться для связывания или разрушения одного или нескольких патогенов в зависимости от выбора связывающих доменов. В качестве альтернативы наличие двух или более связывающих доменов, которые узнают различные антигены на одном и том же патогене, обеспечивает клинические преимущества, уменьшает вероятность ускользания патогена и избыток лекарственных веществ как результат мутации патогена.
Настоящее изобретение предоставляет антитела, имеющие только тяжелые цепи, или их фрагменты согласно первому аспекту настоящего изобретения, полипептидные цепи и комплексы согласно второму аспекту настоящего изобретения; эффекторые цепи и полипептидные комплексы согласно третьему аспекту настоящего изобретения. Все они являются подходящими для фармацевтического использования в отношении человека, и таким образом настоящее изобретение предоставляет фармацевтическую композицию, содержащую антитело, имеющее только тяжелые цепи, полипептидную цепь, эффекторную цепь или полипептидный комплекс настоящего изобретения. Настоящее изобретение также предоставляет применение антитела, имеющего только тяжелые цепи, полипептидную цепь, эффекторную цепь или полипептидный комплекс настоящего изобретения в изготовлении лекарственных средств для профилактики и/или лечения заболевания. Тяжелая и эффекторная цепи могут использоваться в лекарственной форме совместно или отдельно, в зависимости от способа введения или действия лекарственного средства.
Фармацевтические композиции и лекарственные средства обычно составляют в лекарственные формы до введения пациенту.
Например, антитела, имеющие только тяжелые цепи, или полипептидные комплексы могут быть смешаны со стабилизаторами, в частности, если они должны быть лиофилизированы. Обычно во время лиофилизации стабильность обеспечивает добавление сахаров (например, маннита, сахарозы или трегалозы), а предпочтительным стабилизатором является маннит. В качестве стабилизатора также может быть добавлен сывороточный альбумин человека (предпочтительно рекомбинантный). Также могут использоваться смеси сахаров, например сахарозы и маннита, трегалозы и маннита и т.д.
В композицию может быть добавлен буфер, например трис-буфер, гистидиновый буфер, глициновый буфер или предпочтительно фосфатный буфер (например, содержащий дигидрофосфат натрия и гидрофосфат натрия). Является предпочтительным добавление буфера для получения pH между 7,2 и 7,8, и более конкретно – pH, равного примерно 7,5.
Для восстановления после лиофилизации может быть использована стерильная вода для инъекций. Также лиофилизированную лепешку можно восстановить водной композицией, содержащей сывороточный альбумин человека (предпочтительно рекомбинантный).
Обычно антитела, имеющие только тяжелые цепи, и полипептидные комплексы используются в чистом виде совместно с фармакологически приемлемыми носителями.
Таким образом, настоящее изобретение предоставляет способ лечения пациента, содержащий введение пациенту фармацевтической композиции настоящего изобретения. Пациент предпочтительно представляет собой человека и может быть ребенком (например, ребенком ясельного возраста или младенцем), подростком или взрослым, но обычно является взрослым.
Настоящее изобретение также предоставляет антитела, имеющие только тяжелые цепи, полипептидные цепи, эффекторные цепи или полипептидный комплекс настоящего изобретения для использования в качестве лекарственного средства.
Настоящее изобретение также предоставляет применение антител, имеющих только тяжелые цепи, полипептидных цепей, эффекторных цепей или комплексов полипептидных цепей настоящего изобретения в производстве лекарственных средств для лечения пациента.
Эти применения, способы и лекарственные средства являются предпочтительными для лечения одного из следующих заболеваний или нарушений: заживление ран, клеточные пролиферативные заболевания, включая неоплазму, меланому, опухоль легкого, колоректальную опухоль, остеосаркому, ректальный рак, опухоль яичников, саркому, цервикальный рак, опухоль пищевода, опухоль молочной железы, опухоль поджелудочной железы, опухоль мочевого пузыря, опухоли головы и шеи и другие твердые опухоли; миелопролиферативные заболевания, такие как лейкемию, неходжкинскую лимфому, лейкопению, тромбоцитопению, нарушение ангиогенеза, саркому Капоши; аутоимунные/воспалительные нарушения, включая аллергию, воспалительные заболевания кишечника, артрит, псориаз и воспаление дыхательного тракта, астму, иммунные нарушения и отторжение трансплантированных органов; сердечно-сосудистые и сосудистые нарушения, включая гипертензию, отеки, ангину, атеросклероз, тромбоз, сепсис, шок, нарушение реперфузии и ишемию; нейроглиальные нарушения, включая заболевания центральной нервной системы, болезнь Альцгеймера, нарушения работы головного мозга, амиотрофный латеральный склероз и боль; нарушения в развитии; метаболические нарушения, включая сахарный диабет, остеопороз и ожирение, СПИД и почечную недостаточность; инфекции, включая вирусные инфекции, бактериальные инфекции, грибные инфекции и паразитические инфекции; патологические состояния, связанные с плацентой и другими патологическими условиями и для использования в иммунотерапии.
В дополнительном аспекте настоящее изобретение предоставляет использование антитела, имеющего только тяжелые цепи, или связывающего полипептидный комплекс настоящего изобретения в качестве диагностического, прогностического или терапевтического агента визуализации. Более того, настоящее изобретение предоставляет использование гомо- или гетеродимера тяжелых цепей настоящего изобретения отдельно или в комбинации с одной или несколькими эффекторными (легкими) цепями настоящего изобретения в качестве терапевтического агента визуализации, цитохимического реагента или диагностического агента.
Настоящее изобретение предоставляет использование антитела, имеющего только тяжелые цепи, или его фрагмента, как описано выше, в качестве межклеточного связывающего реагента или абзима. Предпочтительные фрагменты антител, имеющих только тяжелые цепи, представляют собой растворимые антигенспецифичиские связывающие домены VH.
Настоящее изобретение также предоставляет использование антитела, имеющего одну антигенспецифическую цепь, или связывающего домена VH согласно настоящему изобретению в качестве ингибитора фермента или рецепторного блокатора. Предпочтительные фрагменты антител, имеющих только тяжелые цепи, являются растворимыми антигенспецифическими связывающими доменами VH.
Настоящее изобретение также предоставляет использование домена VH, слитого с эффекторной молекулой, для использования в качестве терапевтического средства, агента визуализации, диагностического средства, абзима или реагента.
Краткое описание чертежей
Фиг.1A и 1B: показан полипептидный комплекс, содержащий домен димеризации (необязательно CH2, CH3 и CH4) связывающего домена (VH), и эффекторный участок (EM). Связывающие домены и эффекторные участки могут быть расположены на амино- или карбокситерминальных концах доменов димеризации.
Указаны гибкие линкеры (<-) и шарнирные ( ) области. ) области.
Фиг.2A и 2B: показаны различные конфигурации связывающих доменов и замена эффекторного участка дополнительными связывающими доменами. A. Предпочтительная опция, поскольку продуцируются гомодимеры. Не требуется разделение продуктов. B. Продуцируется смесь гомодимеров и гетеродимеров. Требуется разделение продуктов.
Фиг.3: показан полипептидный комплекс тяжелых цепей, связанный с эффекторной цепью. Эффекторная цепь содержит комплементарный связывающий домен (CBD) и эффекторный участок (EM). CBD узнается EM тяжелой цепи. CBD является слитым с эффектором или представляет собой часть эффектора, например фермент, токсин, хелатор, агент визуализации. Эффекторная цепь может синтезироваться отдельно от тяжелой цепи.
На фиг.4 показан бивалентный секреторный IgA, связанный с цепью J.
На фиг.5 показан мультивалентный IgM-подобный полипептидный комплекс, имеющий только тяжелые цепи, собранный при помощи цепи J.
Фиг.6: показана стратегия создания трансгенных мышей, экспрессирующих локус IgG, и функциональная генерация антител, имеющих только тяжелые цепи, и доменов VH в результате антигенной стимуляции.
Фиг.7: показана стратегия создания трансгенных мышей, экспрессирующих локус IgM, и функциональная генерация антител, имеющих только тяжелые цепи, и доменов VH в результате антигенной стимуляции.
Фиг.8: показана стратегия создания трансгенных мышей, экспрессирующих локус IgA, и функциональная генерация антител, имеющих только тяжелые цепи, и доменов VH в результате антигенной стимуляции.
Фиг.9: последовательное выравнивание продуктов ПЦР, полученных из кДНК костного мозга при помощи праймеров VHH1 и VHH2 в комбинации с праймером человека C 2 от мышей, содержащих локус с константными областями, которые имеют мутацию сплайсинга верблюда для удаления CH1. Результаты показывают, что CH1 не удален. 2 от мышей, содержащих локус с константными областями, которые имеют мутацию сплайсинга верблюда для удаления CH1. Результаты показывают, что CH1 не удален.
Фиг.10-13: структура конструкции VH/конструкции VH (VHH) верблюда. 1-n поддерживает любое количество генов VH или сегментов D или J. Нормальный комплемент локуса человека имеет 51 ген V, 25 функциональных сегментов D (плюс 2 нефункциональных сегмента) и 6 сегментов J. В случае области Cµ (для IgM) или C (для IgE) отсутствует область H, и имеется дополнительный экзон CH4 между CH3 и M1. Ген (гены) VH мутировал для обеспечения растворимости, как описано в публично доступных источниках. (для IgE) отсутствует область H, и имеется дополнительный экзон CH4 между CH3 и M1. Ген (гены) VH мутировал для обеспечения растворимости, как описано в публично доступных источниках.
Гены VH, сегменты D и J и экзоны C предпочтительно являются от человека, но могут быть от любого другого вида, включая верблюда. В последнем случае гены VH (VHH) верблюда могут быть немутированными, поскольку они являются естественно растворимыми.
Фиг.14: график иммунизации мышей и анализ антител для получения IgG против HSP70 E. coli, имеющих только тяжелые цепи.
Фиг.15: поточно-цитометрический анализ и результаты иммунохимии для клеток селезенки, полученных от трансгенных мышей.
Фиг.16: результаты анализа ELISA трансгенных мышей, иммунизированных DKTP, и анализ последовательности, полученной библиотеки антител.
Фиг.17: примеры соматических мутаций и VDJ-перестройки, наблюдаемые у иммунизированных трансгенных мышей.
Фиг.18: результаты анализа иммуноокрашивания клеточной линии Tet-on, трансфецированной повышающей чувствительность плазмидой, содержащей антитело A5.
Фиг.19: результаты вестерн-блот анализа сывороток линий трансгенных мышей.
Фиг.20: фракционирование по размеру IgM человека, смешанного с IgM человека с одной цепью, продуцированного мышами, содержащими локус IgM плюс IgG.
Фиг.21: результаты анализа ELISA антител IgM и IgG с одной цепью, вырабатываемых против TNF человека. человека.
Фиг.22: показана стратегия создания гомодимерной плазмиды с аффинностью связывания для HSP70 и  GAG. GAG.
Фиг.23: функциональная экспрессия гомодимерного полипептидного комплекса в клетках CHO.
Фиг.24: показано функциональное связывание и одновременно гомодимерный полипептидный комплекс с альфа  GAG и HSP70. Схематичное представление бивалентного, биспецифического антитела. Вторая вариабельная область (VHH2 направленная против gag) клонирована в карбокситерминальном конце антитела, имеющего только тяжелые цепи, имеющего другую специфичность (VHH1, направленная против HSP70). Шарнирная область между CH3 и VHH2 замещена областью линкера, в которой все цистеины замещены пролином (стрелки). Планшет ELISA, покрытый Gag, блокировали 1% молоком/1% BSA в PBS, сначала инкубировали в среде с рекомбинантными биспецифическими антителами (разбавление 1:2) и затем в клеточном лизате BI21 (содержащем HSP70) (разбавление 1:2). Элюировали связанные белки буфером для образцов =2-меркаптоэтанол и разгоняли в 8% геле. Окрашивали поли/моноклональными антителами против Gag, рекомбинантного биспецифического антитела и HSP70. GAG и HSP70. Схематичное представление бивалентного, биспецифического антитела. Вторая вариабельная область (VHH2 направленная против gag) клонирована в карбокситерминальном конце антитела, имеющего только тяжелые цепи, имеющего другую специфичность (VHH1, направленная против HSP70). Шарнирная область между CH3 и VHH2 замещена областью линкера, в которой все цистеины замещены пролином (стрелки). Планшет ELISA, покрытый Gag, блокировали 1% молоком/1% BSA в PBS, сначала инкубировали в среде с рекомбинантными биспецифическими антителами (разбавление 1:2) и затем в клеточном лизате BI21 (содержащем HSP70) (разбавление 1:2). Элюировали связанные белки буфером для образцов =2-меркаптоэтанол и разгоняли в 8% геле. Окрашивали поли/моноклональными антителами против Gag, рекомбинантного биспецифического антитела и HSP70.  Gag: кроличьи поликлональные/свиные антикроличьи-AP (голубые). Gag: кроличьи поликлональные/свиные антикроличьи-AP (голубые).  HSP70: моноклональные/козьи античеловеческие IgG-HRP (коричневые), рекомбинантные биспецифические HSP70: моноклональные/козьи античеловеческие IgG-HRP (коричневые), рекомбинантные биспецифические  антитела: козьи античеловеческие IgG-HRP (коричневые). Линия 1: Gag/рекомбинантное биспецифическое антитело/BI21 клеточный лизат. Линия 2: Gag/культуральная среда (представляет собой отрицательный контроль на рекомбинантное биспецифическое антитело)/BI21. Линия 3: -молоко-BSA/рекомбинантное биспецифическое антитело/BI21. Линия 4: -молоко-BSA/культуральная среда/BI21. Линия 5: Gag/рекомбинантное биспецифическое антитело/-молоко-BSA. Линия 6: Gag/культуральная среда/-молоко-BSA. антитела: козьи античеловеческие IgG-HRP (коричневые). Линия 1: Gag/рекомбинантное биспецифическое антитело/BI21 клеточный лизат. Линия 2: Gag/культуральная среда (представляет собой отрицательный контроль на рекомбинантное биспецифическое антитело)/BI21. Линия 3: -молоко-BSA/рекомбинантное биспецифическое антитело/BI21. Линия 4: -молоко-BSA/культуральная среда/BI21. Линия 5: Gag/рекомбинантное биспецифическое антитело/-молоко-BSA. Линия 6: Gag/культуральная среда/-молоко-BSA.
Фиг.25: показана стратегия создания гомодимерных полипептидных комплексов, необязательно связанных с эффекторными цепями, несущими IgA эффекторную функцию.
Фиг.26: показана стратегия создания гомодимерных полипептидных комплексов, необязательно связанных с эффекторными цепями, несущими IgA эффекторную функцию.
Основные технологии
Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют то же самое значение, как они обычно понимаются специалистами в данной области техники (например, в области культур клеток, молекулярной генетике, химии нуклеиновых кислот, технологиях гибридизации и биохимии). В молекулярных, генетических, биохимических способах (смотрите обзор, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed. (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y. and Ausubel et al., Short Protocols in Molecular Biology (1999) 4th Ed., John Wiley & Sons, Inc.) и химических способах используются стандартные технологии. Дополнительно смотрите ссылки Harlow & Lane, A Laboratory Manual, Cold Spring Harbor, N. Y в случае стандартных иммунологических технологий.
Может быть использована любая подходящая технология рекомбинантной ДНК для продуцирования би- и мультивалентных полипептидных комплексов, антител, имеющих одну тяжелую цепь, и их фрагментов согласно настоящему изобретению. Обычные векторы экспрессии, такие как плазмиды, сконструированы содержащими последовательности ДНК, кодирующие каждую из цепей полипептидного комплекса или антитела. Может быть использована любая подходящая разработанная технология для ферментативного или химического фрагментирования иммуноглобулинов и разделения полученных фрагментов.
Настоящее изобретение также предоставляет векторы, включающие конструкции для экспрессии антител, имеющих только тяжелые цепи, в трансгенных мышах, конструирование и экспрессию полипептидных комплексов настоящего изобретения.
Очевидно, что может быть сконструирован единичный вектор, который содержит последовательности ДНК, кодирующие более одной полипептидной цепи. Например, последовательности ДНК, кодирующие две различные тяжелые цепи, могут быть введены в разных позициях на одной и той же плазмиде.
В качестве альтернативы ДНК последовательность, кодирующая каждую полипептидную цепь, может быть отдельно вставлена в плазмиду, таким образом, продуцируя несколько сконструированных плазмид, каждая из которых кодирует конкретную полипептидную цепь. Предпочтительно, плазмиды, в которые вставлены последовательности, являются совместимыми.
Затем каждая плазмида используется для трансформации клетки-хозяина так, чтобы каждая клетка-хозяин содержала ДНК последовательность, кодирующую каждую из полипептидных цепей в полипептидном комплексе.
Подходящие векторы экспрессии, которые могут быть использованы для клонирования в бактериальных системах, включают плазмиды, такие как Col E1, pcR1, pBR322, pACYC 184 и RP4, ДНК фага, или любые производные от них.
Для использования при клонировании в дрожжевых системах подходящие векторы экспрессии включают плазмиды размером 2 микрона.
Любая плазмида, содержащая подходящую промоторную генную последовательность млекопитающего, может быть использована для клонирования в системах млекопитающих. Промоторные последовательности насекомых или бакуловируса могут быть использованы для генной экспрессии в клетках насекомых. Такие векторы включают плазмиды, полученные, например, из pBR322, бычьего вируса папилломы, ретровирусов, ДНК вирусов и вакцинных вирусов.
Подходящие клетки-хозяева, которые могут быть использованы для экспрессии полипептидного комплекса или антитела, включают бактерии, дрожжи и эукариотические клетки, такие как клеточные линии насекомых или млекопитающих, трансгенные растения, насекомые, млекопитающие и другие системы экспрессии позвоночных и непозвоночных животных.
Полипептидные комплексы и антитела, имеющие одну тяжелую цепь, настоящего изобретения
Необходимо отметить, что термины  полипептидный комплекс полипептидный комплекс , ,  антитело, имеющее одну тяжелую цепь антитело, имеющее одну тяжелую цепь и и  гетерологичный локус тяжелой цепи гетерологичный локус тяжелой цепи настоящего изобретения также включают гомологичные полипептиды и нуклеиновые последовательности, полученные из любого источника, например соотвествующих клеточных гомологов, гомологов из других видов, и их варианты или производные. настоящего изобретения также включают гомологичные полипептиды и нуклеиновые последовательности, полученные из любого источника, например соотвествующих клеточных гомологов, гомологов из других видов, и их варианты или производные.
Таким образом, настоящее изобретение охватывает варианты, гомологи или производные полипептидных комплексов и антител, как раскрыто в настоящем описании.
В контексте настоящего изобретения гомологичные последовательности включают аминокислотную последовательность, которая является по меньшей мере на 80, 85, 90, 95, 96, 97, 98, 99, 99,5, 99,6, 99,7, 99,8, 99,9% идентичной, предпочтительно по меньшей мере на 98 или 99% идентичной на уровне аминокислот, в количестве более по меньшей мере 30, предпочтительно 50, 70, 90 или 100 аминокислот. Хотя гомологичность также может рассматриваться в терминах сходства (т.е. аминокислотных остатков, имеющих аналогичные химические свойства/функции), в контексте настоящего изобретения предпочтительно выражать гомологичность в терминах идентичности последовательностей.
Настоящее изобретение также включает сконструированные векторы экспрессии и трансформированные клетки-хозяева для использования при продуцировании полипептидных комплексов и антител настоящего изобретения.
После экспрессии отдельных цепей в одной и той же клетке-хозяине они могут быть восстановлены для обеспечения полного полипептидного комплекса или антитела, имеющего только тяжелые цепи в активной форме.
Имеется в виду, что в предпочтительных вариантах настоящего изобретения отдельные тяжелые цепи могут быть подвергнуты процессингу в клетке-хозяине для формирования полного полипептидного комплекса или антитела, которое преимущественно ею секретируется. Предпочтительно эффекторная цепь продуцируется отдельно либо клеткой-хозяином, либо синтетическими средствами.
Способы получения полипептидных комплексов рекомбинантных антител описаны в вышеприведенных ссылках, а также, например, в EP-A-0623679; EP-A-0368684 и EP-A-0436597.
Иммунизация трансгенного организма
В дополнительном аспекте настоящее изобретение предоставляет способ продуцирования антител настоящего изобретения, содержащий введение антигена в трансгенный организм настоящего изобретения.
Антитела и полипептидные комплексы, продуцированные трансгенными животными настоящего изобретения, включают поликлональные и моноклональные антитела и их фрагменты. Если требуются поликлональные антитела, трансгенное животное (например, мышь, кролик, коза, лошадь и т.д.) может быть иммунизировано антигеном, и сыворотку иммунизированного животного собирают и обрабатывают известными процедурами. Если сыворотка, содержащая поликлональные антитела, содержит антитела к другим антигенам, представляющие интерес поликлональные антитела могут быть очищены при помощи иммунноаффинной хроматографии и подобными способами, которые известны специалистам в данной области техники. Способы продуцирования и обработки поликлональной антисыворотки также известны в данной области техники.
Применения связывающих полипептидных комплексов и антител настоящего изобретения
Полипептидные комплексы и антитела, включая их фрагменты, согласно настоящему изобретению могут быть использованы в: in vivo терапевтических и профилактических применениях, in vitro и in vivo диагностических применениях, анализах in vitro и применениях реагентов и т.п.
Терапевтические и профилактические применения полипептидных комплексов и антител настоящего изобретения включают введение вышеуказанному млекопитающему реципиенту, такому как человек.
По существу чистые полипептидные комплексы и антитела, включая их фрагменты по меньшей мере при 90-95% гомогенности, являются предпочтительными для введения млекопитающему, и при 98-99% или более гомогенность является наиболее предпочтительной для фармацевтического использования, особенно если млекопитающим является человек. После очистки, неполной или до гомогенности, по желанию, полипептидные комплексы и антитела, имеющие только тяжелые цепи, как раскрыто в настоящем описании, могут быть использованы для диагностики или терапии (включая экстрокорпоральное использование) или при разработке или выполнении процедур анализа при помощи способов, известных специалистам в данной области техники.
Обычно полипептидные комплексы и антитела настоящего изобретения используются в очищенном виде совместно с фармакологически приемлемыми носителями. Обычно такие носители включают водные или спиртовые/водные растворители, эмульсии или суспензии, которые могут включать физиологический раствор и/или забуференную среду. Парентеральные наполнители включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия и лактат Рингера.
Подходящие физиологически приемлемые адьюванты, если необходимо поддерживать полипептидный комплекс в суспензии, могут быть выбраны из загустителей, таких как карбоксиметилцеллюлоза, поливинилпирролидон, желатин и альгинаты.
Для внутривенного введения наполнители включают жидкости и питательные добавки и добавки-электролиты, такие как на основе декстрозы Рингера. Также могут присутствовать консерванты и другие добавки, такие как противомикробные агенты, антиоксиданты, хелатирующие агенты и инертные газы (Mack (1982) Remington’s Pharmaceutical Sciences, 16th Edition).
Полипептидные комплексы и антитела, включая их фрагменты, согласно настоящему изобретению могут использоваться в виде отдельно вводимых композиций или в сочетании с другими агентами. Они могут включать различные иммунотерапевтические лекарственные вещества, такие как циклоспорин, метотрексат, адриамицин, цисплатину или иммунотоксин. В качестве альтернативы полипептидные комплексы могут быть использованы в сочетании с ферментами для превращения пролекарств в их участках активности.
Фармацевтические композиции могут включать  коктейли коктейли различных цитотоксических или других агентов в сочетании с выбранными антителами настоящего изобретения или даже комбинациями выбранных антител настоящего изобретения. различных цитотоксических или других агентов в сочетании с выбранными антителами настоящего изобретения или даже комбинациями выбранных антител настоящего изобретения.
Способ введения фармацевтических композиций настоящего изобретения может быть любым из способов, известных специалистам в данной области техники. Для терапии, включая без ограничений иммунотерапию, полипептидные комплексы или антитела настоящего изобретения могут вводиться любому пациенту согласно стандартным технологиям. Введение может осуществляться любым подходящим способом, включая парентеральное, внутривенное, внтуримышечное, интраперитонеальное, трансдермальное, через легочные пути или также соответствующим образом путем прямой инфузии при помощи катетера. Дозирование и частота введения будет зависеть от возраста, пола и состояния пациента, также учитываются конкурентное введение других лекарственных веществ, противопоказания и другие параметры.
Полипептидные комплексы и антитела настоящего изобретения могут быть лиофилизированы для хранения и восстановлены в подходящем носителе перед использованием. Могут быть использованы известные способы лиофилизации и восстановления. Специалистам в данной области техники очевидно, что лиофилизация и восстановление могут приводить к некоторой потере функциональной активности и указанные применяемые уровни должны быть слегка увеличены с целью компенсации такой потери.
Кроме того, полипептидные комплексы и антитела настоящего изобретения могут быть использованы для диагностических целей. Например, антитела, как раскрыто в настоящем описании, могут быть образованы или получены против антигенов, которые специфическим образом экспрессируются во время болезненных состояний или чьи уровни меняются во время данных болезненных состояний.
Для некоторых целей, например с целью диагностики или регистрации, могут быть добавлены метки. Подходящие метки включают, без ограничений, любые из следующего: радиоактивные метки, ЯМР спиновые метки и флуоресцентные метки. Средства детектирования меток хорошо известны специалистам в данной области техники.
Композиции, содержащие полипептидные комплексы и антитела настоящего изобретения или их коктейли, могут быть введены для профилактического и/или терапевтического лечения.
Композиции, содержащие один или несколько полипептидных комплексов или антител настоящего изобретения, могут быть использованы в профилактических или терапевтических наборах с целью изменения, инактивации, уничтожения или удаления выбранной мишеневой клеточной популяции у млекопитающих. Кроме того, выбранные наборы полипептидных комплексов и антител, раскрытых в настоящем изобретении, могут быть использованы экстракорпорально или in vitro селективно с целью уничтожения, очищения или каким-либо иным способом эффективного удаления мишеневой клеточной популяции из гетерогенной коллекции клеток.
Пример 1
В подготовительных экспериментах трансгенных мышей подготавливали для экспрессии локуса тяжелой цепи, в котором два экзона VHH ламы соединяли с сегментами человека вариабельными (D) и соединяющими (J) тяжелой цепи и, затем генами человека Cµ, C , C , C 2, C 2, C 3 константных областей и 3′-LCR человека тяжелой цепи иммуноглобулина. Гены человека C 3 константных областей и 3′-LCR человека тяжелой цепи иммуноглобулина. Гены человека C 2 и C 2 и C 3 содержали G-A мутацию сплайсинга. Наличие участка Frt давало возможность создания трансгенной мыши c единичной копией трансгена из мультикопийного трансгенного массива при помощи рекомбинации, опосредованной Flp. Однако последовательности из трансгенного локуса с G-A мутацией сплайсинга показывали неправильный сплайсинг, но имели полностью удаленный CH1 (фиг.9). 3 содержали G-A мутацию сплайсинга. Наличие участка Frt давало возможность создания трансгенной мыши c единичной копией трансгена из мультикопийного трансгенного массива при помощи рекомбинации, опосредованной Flp. Однако последовательности из трансгенного локуса с G-A мутацией сплайсинга показывали неправильный сплайсинг, но имели полностью удаленный CH1 (фиг.9).
Конструкции
Для решения этой проблемы скринировали космидную геномную библиотеку для клонов, содержащих гены VH, используя стандартные способы. Один (или несколько) различных VH зародышевой линии выбирали случайным образом, исходя из их последовательности (классы пяти семейств в случае VH человека). Гидрофильные аминокислотные кодоны вводили в позиции 42, 49, 50 и 52 согласно нумерации imgT (Lefranc et al., (1999)). Гены VH объединяли в вектор BAC при помощи стандартных процедур, таких как прямое клонирование, при помощи изготовленных на заказ линкеров или гомологичной рекомбинации.
Отбирали два клона геномной Pac библиотеки RPCI-11 человека (BACPAC Recource Center, USA): клон 1065 N8, содержащий сегменты D и J тяжелой цепи, Cµ (IgM) и C (IgD), и клон 1115 N15, содержащий гены C (IgD), и клон 1115 N15, содержащий гены C 3 (IgG3). Bac клон 11771 из другой геномной библиотеки человека (Incyte Genomics, CA, USA) использовали в качестве источника гена C 3 (IgG3). Bac клон 11771 из другой геномной библиотеки человека (Incyte Genomics, CA, USA) использовали в качестве источника гена C 2 (IgG2) и LCR тяжелой цепи иммуноглобулина (Mills et al., (1997) J. Exp Med., 15;186(6):845-58). 2 (IgG2) и LCR тяжелой цепи иммуноглобулина (Mills et al., (1997) J. Exp Med., 15;186(6):845-58).
Используя стандартные технологии, гены C 3 и C 3 и C 2 отдельно субклонировали в вектор pFastBac (Invitrogen). Аналогично любую из других константных областей Ig можно было клонировать из этих BAC (IgA, IgE). Полная делеция экзона CH1 была достигнута путем гомологичной рекомбинации (Imam et al., (2001)) при помощи последовательностей, которые располагались с обоих концов экзона CH1 каждой константной области. Необязательно можно было вводить участок frt перед областью Cµ переключения для обеспечения возможности генерации однокопийных локусов из многокопийных локусов обработкой flp рекомбиназой in vivo стандартными способами, например путем выведения мышей rosa-flp (фиг.10). 2 отдельно субклонировали в вектор pFastBac (Invitrogen). Аналогично любую из других константных областей Ig можно было клонировать из этих BAC (IgA, IgE). Полная делеция экзона CH1 была достигнута путем гомологичной рекомбинации (Imam et al., (2001)) при помощи последовательностей, которые располагались с обоих концов экзона CH1 каждой константной области. Необязательно можно было вводить участок frt перед областью Cµ переключения для обеспечения возможности генерации однокопийных локусов из многокопийных локусов обработкой flp рекомбиназой in vivo стандартными способами, например путем выведения мышей rosa-flp (фиг.10).
Отдельные гены VH, сегменты D и J и экзоны C и LCR клонировали в один BAC либо при помощи обычного рестрикционного расщепления и лигирований, либо при помощи гомологичной рекомбинации (или комбинацией обоих), либо при помощи любой другой технологии клонирования.
Затем могли быть созданы дополнительные конструкции.
Локус, содержащий только IgM
Для получения конструкции IgM (фиг.11) один или несколько генов VH (предпочтительно разработанных генов VH человека для обеспечения растворимости или генов VHH верблюда), за которыми следовали сегменты человека D и J тяжелой цепи и Cµ, клонировали в BAC. Методологию смотрите выше. В этом случае в конечный BAC клонировали только область Cµ.
Локус IgM плюс IgG (C является необязательным) является необязательным)
Для получения конструкции IgM плюс IgG (фиг.12) один или несколько генов VH (предпочтительно разработанных сегментов VH человека для обеспечения растворимости или генов VHH верблюда), за которыми следовали сегменты человека D и J тяжелой цепи, Cµ (без экзона CH1, но с экзоном CH4), (необязательно C ) и модифицированные гены человека C ) и модифицированные гены человека C 2 и C 2 и C 3 и 3′-LCR, клонировали в BAC. Для генерации локуса, содержащего только IgG, участки loxP вводили во время стандартных этапов клонирования (описано выше) и BAC размножали в линии E. coli 294 Cre (Buscholz et al.), и посредтвом cre-опосредованной рекомбинации получали бактерии, продуцирующие локус, содержащий только IgG. Подробности относительно дополнительных конструкций смотрите выше. 3 и 3′-LCR, клонировали в BAC. Для генерации локуса, содержащего только IgG, участки loxP вводили во время стандартных этапов клонирования (описано выше) и BAC размножали в линии E. coli 294 Cre (Buscholz et al.), и посредтвом cre-опосредованной рекомбинации получали бактерии, продуцирующие локус, содержащий только IgG. Подробности относительно дополнительных конструкций смотрите выше.
Локус IgM плюс IgG (C является необязательным) является необязательным)
Для получения конструкции IgM плюс IgG (фиг.13) один или несколько генов VH (предпочтительно разработанных генов VH человека для обеспечения растворимости или генов VHH верблюда), за которыми следовали сегменты человека D и J тяжелой цепи, Cµ (с CH1 и CH4), (необязательно C ) и модифицированные гены человека C ) и модифицированные гены человека C 2 и C 2 и C 3 и 3′-LCR, клонировали в BAC. Для генерации локуса, содержащего только IgG, участки loxP вводили во время стандартных этапов клонирования (описано выше) и BAC размножали в линии E. coli 294 Cre (Buscholz et al.), и посредством cre-опосредованной рекомбинации получали бактерии, продуцирующие локус, содержащий только IgG. 3 и 3′-LCR, клонировали в BAC. Для генерации локуса, содержащего только IgG, участки loxP вводили во время стандартных этапов клонирования (описано выше) и BAC размножали в линии E. coli 294 Cre (Buscholz et al.), и посредством cre-опосредованной рекомбинации получали бактерии, продуцирующие локус, содержащий только IgG.
Трансгенные мыши, выведение и генотипирование
Конечный BAC вводили трансгенным мышам при помощи стандартной инъекции в оплодотворенные яйцеклетки или при помощи технологии трансфецирования эмбриональных стволовых клеток.
Трансгенные локусы проверяли на целостность и количество копий при помощи саузерн-блот анализа ДНК из хвостов мышей (Southern 1975), используя зонды для 5′- и 3′-концов локуса. Основателей разводили в виде линий на фоне µМТ-/-. Генотипирование проводили стандартным ПЦР анализом, используя праймеры для каждой из различных областей указанного локуса. Анализ последовательностей RT-ПЦР продуктов, полученных из BM кДНК трансгенных мышей, у которых был делетирован весь экзон CH1 из обоих C 2 и C 2 и C 3 (один с генами Cµ и C 3 (один с генами Cµ и C (линии HLL) и один без этих генов), показал, что трансгенные локусы были не только способны к VDJ рекомбинации, но и что IgG транскрипты похожи на IgG транскрипты, обнаруженные в HCAb ламы и верблюда. (линии HLL) и один без этих генов), показал, что трансгенные локусы были не только способны к VDJ рекомбинации, но и что IgG транскрипты похожи на IgG транскрипты, обнаруженные в HCAb ламы и верблюда.
Иммуногистохимия
Помещали селезенки в среду OCT. Замороженные 5-мкм криостатные срезы фиксировали в ацетоне и вводили одинарную или двойную метку, как описано ранее (Leenen et al., 1998). Анти-B220/RA3-6B2, анти-CD11c/N418 моноклональные антитела (Steinman et al., 1997) использовали в виде супернатантов культур гибридомных клеток. Использовали пероксидазу, связанную с козьими античеловеческими IgG и античеловеческими IgM производства Sigma. Реагенты второго этапа представляли собой меченные пероксидазой козьи антикрысиные Ig (DAKO5 Glostrup, Denmark) или антихомячьи Ig (Jackson ImmunoResearch Laboratories, West Grove, PA) и щелочную фосфатазу с козьими антикрысиными Ig (Southern Biotechnology, Birmingam, AL, USA).
На фиг.15 показан иммуногистохимический анализ 5-мкм замороженных срезов селезенки из µMT-/-, WT и HLL и HLL-MD трансгенных мышей на фоне µMT-/-. Срезы окрашивали анти-B220 (голубой) для B-клеток и анти-CD11c/N418 (коричневый) для дендритных клеток. Стрелки указывают на положение небольших кластеров B-клеток.
Поточный цитометрический анализ
Суспензии из единичных клеток получали из лимфоидных органов в PBS, как описано ранее (Slieker et al., 1993). Приблизительно 1×106 клеток инкубировали с антителами в PBS/0,5% бычьего сывороточного альбумина (BSA) в 96-луночных планшетах в течение 30 минут при 4°C. Клетки дважды промывали PBS/0,5% BSA. Для каждого образца отсчитывали 3×104 событий, используя анализатор FACScan (Becton Dickinson, Sunnyvale, CA). Данные FACS анализировали, используя программное обеспечение CellQuest, версия 1.0. Четырехцветный анализ выполняли на Becton Dickinson FACS Calibur. Следующие mAb получали из BD Pharmingen (San Diego, CA): FITC-конъюгированные анти-B220-RA3-6B2, PE-конъюгированные анти-CD19. Данные FACS сканирования клеток селезенки, окрашенные анти-CD19 и анти-B220, показаны в нижней части фиг.15.
В левой части фигуры представлена Flp-рекомбинация in vivo, полученная в результате выведения HLL линий в трансгенную линию FlpeR, и подтверждающие данные FACS сканирования рекомбинантов клеток селезенки, показывающие выживание B-клеток, наблюдаемое в непосредственно созданных исходных линиях HLL-MD. В правой части представлена Cre-рекомбинация in vivo, полученная в результате выведения в трансгенную линию Cag Cre, и данные FACS однокопийного рекомбинанта клеток селезенки.
Иммунизация и продуцирование гибридом (фиг.14)
Создавали трансгенных мышей, содержащих локус антитела, имеющего только тяжелые цепи, состоящий из двух доменов VHH ламы, областей человека D и J и константных областей IgG2 и 3 (без CH1 домена).
Восьминедельных мышей иммунизировали любым белком теплового шока 70 (hsp70) E. сoli. 20 мкг или 5 мкг антигена с адьювантом Specol (IDDLO, Lelystadt, NL), инъецировали соответственно s.c. на 0, 14, 28, 42 дни и i.p. на 50 день. Кровь брали на 0, 14 и 45 дни. После трех бустер-инъекций низкий титр антигенспецифических антител детектировали у 1 из 3 мышей HLL-MD1, иммунизированных Hsp70 (фиг.14).
Проводили стандартную фузию клеток селезенки с клеточной линией миеломы, получая моноклональную гибридомную клеточную линию, генерирующую моноклональные антитела против hsp70 белка. Анти-HSP 70 HCAb состоял из сегмента VHH ламы, расположенного в непосредственной близости от области D (VHH 2), рекомбинированного с сегментом IgHD3-10 человека (acc.num. X13972) и сегментом IgHJ4-02 человека (acc.num.X86355). Хотя и не с высокой частотой, VHH имел несколько мутаций, которые приводили к аминокислотным заменам, как показано на фиг.9A, по сравнению с конфигурацией зародышевой линии. Анализ RT-ПЦР также показал только один продуктивный транскрипт IgH в гибридоме, подтверждая, что другие транскрипты не образовывались. IgG2 антитело  HSP70 секретировалось в виде димера, имеющего только тяжелые цепи (вестерн-блот в денатурирующем геле (димер) и неденатурирующем геле (мономер), фиг.14). Клетки селезенки сливали с клетками миеломы Sp2-O-Ag14 (предоставленные R. Haperen) на 56 день, используя набор ClonalCellTM-HY (StemCell Technologies, UK) согласно инструкции производителя. HSP70 секретировалось в виде димера, имеющего только тяжелые цепи (вестерн-блот в денатурирующем геле (димер) и неденатурирующем геле (мономер), фиг.14). Клетки селезенки сливали с клетками миеломы Sp2-O-Ag14 (предоставленные R. Haperen) на 56 день, используя набор ClonalCellTM-HY (StemCell Technologies, UK) согласно инструкции производителя.
Трансгенных мышей, содержащих локус антитела, имеющего только тяжелые цепи, состоящий из двух доменов VHH ламы, областей человека D и J, константных областей человека IgM и IgG2 и 3 (все без CH1 домена, фиг.12), иммунизировали TNF для получения антител HC-IgM. У одной из трех мышей выявили сыворотки, положительные в стандартном анализе ELISA. Стандартное слияние миеломы дало положительную IgM гибридому (фиг.16). После гель-фильтрации на сефарозе 6B в невосстанавливающих условиях каждую фракцию, присутствующую в колонке, загружали в гель в восстанавливающих условиях и детектировали для получения антител HC-IgM. У одной из трех мышей выявили сыворотки, положительные в стандартном анализе ELISA. Стандартное слияние миеломы дало положительную IgM гибридому (фиг.16). После гель-фильтрации на сефарозе 6B в невосстанавливающих условиях каждую фракцию, присутствующую в колонке, загружали в гель в восстанавливающих условиях и детектировали  IgM-HRP человека (фиг.20). Фракционирование в невосстанавливающих условиях показало, что HC-IgM секретируется в виде мультимерного антитела такого же размера, как и контрольный IgM человека (после вычитания молекулярного веса легких цепей и домена CH1, который отсутствовал в HC-IgM). Гель-фракционирование каждой фракции в колонке в восстанавливающих условиях выявило ожидаемый мономер (фиг.20). IgM-HRP человека (фиг.20). Фракционирование в невосстанавливающих условиях показало, что HC-IgM секретируется в виде мультимерного антитела такого же размера, как и контрольный IgM человека (после вычитания молекулярного веса легких цепей и домена CH1, который отсутствовал в HC-IgM). Гель-фракционирование каждой фракции в колонке в восстанавливающих условиях выявило ожидаемый мономер (фиг.20).
ELISA Ig в сыворотке
Кровь от 15-25-недельных мышей собирали в пробирки, покрытые ЭДТА, центрифугировали в течение 15 минут при комнатной температуре, и супернатант разбавляли 1:5 в PBS. 96-луночный планшет покрывали на 2 часа 5 мг/мл козьими античеловеческими IgG (YES Biotechnology) или козьими античеловеческими IgM (Sigma), промывали PBS, блокировали в течение 1 часа при комнатной температуре блокирующим раствором (1,5% BSA/1,5% порошковое молоко/0,1% Tween-20/PBS) и промывали три раза PBS. Загружали серии разбавлений образцов сыворотки и стандартов (IgG2 человека или IgM человека (Sigma, Zwijndrecht, NL)) и инкубировали в течение 2-4 часов, и планшеты промывали 6 раз PBS перед добавлением вторичного антитела (1:2000 разбавленного козьего античеловеческого IgG или козьего античеловеческого IgM, связанного с HRP (Sigma, Zwijndrecht, NL)). Все разведения были сделаны в блокирующем растворе. После 1-2 часов инкубации при комнатной температуре и промывки в PBS добавляли субстрат POD (Roche).
ELISA для детектирования антигенспецифических растворимых sdAb из IgG2 фаговой библиотеки показаны на фиг.16. Растворимые sdAb использовали в качестве первичных антител на планшетах, покрытых антигеном, за которыми следовали мышиные антитела  myc и HRP-конъюгированные козьи антимышиные антитела. POD использовали в качестве субстрата. В нижней части фигуры показаны пептидные карты клонов с рестрикционным ферментом Hinf I, показывающие 5 различных вставок, кодирующих sdAb против B. Pertusis. myc и HRP-конъюгированные козьи антимышиные антитела. POD использовали в качестве субстрата. В нижней части фигуры показаны пептидные карты клонов с рестрикционным ферментом Hinf I, показывающие 5 различных вставок, кодирующих sdAb против B. Pertusis.
Конструирование и скрининг библиотеки антител
Тотальную РНК выделяли из селезенок иммунизированных DKTP мышей, имеющих однокопийный IgG (фиг.12 после обработки сre), используя систему выделения РНК Ultraspec (Biotecx Laboratories Inc, Houston, Texas, USA). Получали кДНК, используя олиго-dT. Фрагменты ДНК, кодирующие фрагменты VHHDJ, амплифицировали ПЦР, используя специфические праймеры: обратный Sfi I праймер vh1 (Dekker et al., 2003) в комбинации с праймером hIgG2hingrev (5′-AATCTGGGCAGCGGCCGCCTCGACACAACATTTGCGCTC-3′). Амплифицированные VHH DJ (~400 п.о.) расщепляли Sfi I/Not I, очищали с помощью геля и клонировали в вектор фагемиды pHEN-1, расщепленный Sfi I/Not I.
Трансформация в электрокомпетентные клетки TG1 давала библиотеку антител человека с одним доменом. Выполняли два этапа селекции, используя пэннинг на антигены вакцины, адсорбированные на пластике (иммунопробирках, покрытых неразбавленной вакциной). Рестрикционный анализ и секвенирование проводили стандартными способами.
RT-ПЦР локуса только тяжелой цепи
Затем исследовали, функционирует ли локус HLL-MD как нормальный локус при продуцировании набора разнообразных антител, путем секвенирования RT-ПЦР продуктов, полученных при помощи IgG2- и IgG3-специфических праймеров для кДНК из пейеровых бляшек. На фиг.17 показано несколько примеров соматических мутаций клонов неиммунизированных мышей (левая часть фигуры) и иммунизированных мышей (правая часть фигуры). Мыши имели локусы, содержащие только IgG, и были иммунизированы hsp70 E. coli, лизатом Pertussis, столбнячным токсином. Серым тоном отмечена шарнирная область IgG2, начиная с ERKCCV.
Хотя анализ RT-ПЦР на пейеровых бляшках показал, что используются оба VH, все секвенированные антитела имели перестроенный VH2. Источник изменчивости набора заключается в CDR3 области, формируемой при помощи селекции сегментов D и J и при помощи соединений V-D и D-J. Использование сегментов человека J аналогично таковому, наблюдаемому в перестройках у человека, причем сегменты JH4 и JH6 используются наиболее часто.
Этот анализ показал, что оба VH, различные сегменты человека D и все сегменты человека J дают вклад в создание разнообразного набора антител. Это также показывает наличие IgG3-переключаемых B-клеток и наличие соматических мутаций при сравнении каждого перестроенного гена с его аналогом в зародышевой линии, т.e. оригинальным VH в трансгенной конструкции (смотрите фиг.17). Следовательно, антигенный рецептор IgG человека, имеющего только тяжелые цепи, может предоставлять необходимые сигналы для B-клеточного созревания.
Иммуноокрашивание
На фиг.18 показаны результаты иммуноокрашивания одной из клеточных линий Tet-on, дополнительно трансфецированной повышающей чувствительность плазмидой, содержащей A5 антитело (Dekker et al., 2003). В верхней части фигуры показано доксициклин-индуцированное продуцирование A5 антитела (красный) в цитоплазме и окрашивание ядер клеток DAPI (синий). В нижней части фигуры показано, что клетки, экспрессирующие rtTA в ядрах, представляют собой клетки, при индукции продуцирующие A5 (верхняя часть фигуры). Окрашивание проводили одним из HCAb человека против rtTA (зеленый), имеющего приведенную ниже последовательность. FITC-конъюгированный козий античеловеческий IgG использовали на втором этапе. A5 детектировали, как описано ранее у Dekker et al., 2003. rTTA антитело представляло собой IgG3, имеющего следующую последовательность:


Шарнир IgG3 начинается с аминокислоты 198 ELKTPL. Для сравнения смотрите шарнирную область IgG2 на фиг.17.
Вестерн-блот анализ
На фиг.19 показаны данные вестерн-блот анализа сывороток различных линий трансгенных мышей, содержащих локус IgM плюс IgG (фиг.10) после обработки cre (то есть IgM делетирован, оставлен только IgG). Сыворотки очищали при помощи белка G, фракционировали в геле в восстанавливающих условиях (фиг.19, справа) и в невосстанавливающих условиях (фиг.19, слева). Контроли представляли собой мышей с фоном KO и образец нормальной сыворотки человека. Следует отметить разницу размеров между двумя гелями, демонстрирующую, что IgG человека, имеющий только тяжелые цепи, представляет собой димер.
Сигнал, показанный на фиг.19, детектировали, используя античеловеческое IgG-антитело при помощи стандартных процедур.
Фракционирование по размеру IgM человека, продуцированного мышью, имеющей локус IgM плюс IgG
Сыворотку мыши, имеющей IgM плюс IgG (фиг.13), фракционировали гель-фильтрацией в невосстанавливающих условиях после смешивания с образцом сыворотки человека в качестве контроля. Результаты приведены на фиг.20. Молекулярные веса комплексов в колонке уменьшаются с каждой полосой (представляющей каждую фракцию) слева направо. Фракции (каждую линию) анализировали гель-электрофорезом в восстанавливающих условиях.
Анализ ELISA выполняли на нескольких гибридомах, созданных из иммунизированных человеческим TNF мышей, содержащих локус IgM плюс IgG (фиг.13). Результаты показаны на фиг.21. Два верхних ряда на фиг.21 анализировали, используя античеловеческий IgG, следующие два ряда – используя античеловеческий IgM. Образцы сыворотки (стрелки) показали, что мышь генерировала как IgG, так и IgM антитела против TNF мышей, содержащих локус IgM плюс IgG (фиг.13). Результаты показаны на фиг.21. Два верхних ряда на фиг.21 анализировали, используя античеловеческий IgG, следующие два ряда – используя античеловеческий IgM. Образцы сыворотки (стрелки) показали, что мышь генерировала как IgG, так и IgM антитела против TNF . Одиночная стрелка показывает положительную IgM гибридому. Лунки покрывали коммерчески доступным TNF . Одиночная стрелка показывает положительную IgM гибридому. Лунки покрывали коммерчески доступным TNF человека. Все используемые процедуры были стандартными. человека. Все используемые процедуры были стандартными.
Пример 2
Биспецифическое бивалентное антитело генерировали путем комбинации двух моноспецифических антител, имеющих только тяжелые цепи. Первое антитело формировало каркас, привнося первую специфичность и эффекторные функции (вариабельный участок и константный участок, соответственно). Его объединяли со вторым антителом со второй специфичностью при помощи заново разработанного шарнира. Этот шарнир был аналогичен существующей шарнирной последовательности IgG2, но был изменен заменой цистеинов пролинами для предотвращения поперечного связывания цистеинов в димер антитела и для предоставления дополнительной гибкости благодаря пролинам, что исключало пространственное ограничение второго антитела, что в противном случае могло ингибировать его функционирование.
Начальное каркасное антитело представляло собой антитело, вырабатываемое против белка HSP70 E. coli. Антиген HSP70 инъецировали трансгенным мышам, которые содержали локус антитела, имеющего только тяжелые цепи, как описано выше (смотрите фиг.14). Моноклональное антитело создавали от этих животных при помощи стандартной технологии гибридомного слияния (смотрите выше). Затем клонировали кДНК, кодирующую  HSP-антитело, стандартными методами RT-ПЦР рекомбинантной ДНК, получая плазмиду, содержащую кДНК полной длины, которая включает 5′-конец – 3′-конец (в белке от N-конца до COOH-конца) старт-кодон ATG, сигнальную пептидную последовательность, вариабельный домен VHH1 (смотрите Janssens et al.), рекомбинированную область D и J и константную область C HSP-антитело, стандартными методами RT-ПЦР рекомбинантной ДНК, получая плазмиду, содержащую кДНК полной длины, которая включает 5′-конец – 3′-конец (в белке от N-конца до COOH-конца) старт-кодон ATG, сигнальную пептидную последовательность, вариабельный домен VHH1 (смотрите Janssens et al.), рекомбинированную область D и J и константную область C 2 (без области CH1), но включая стоп-кодон и поли-A-участок (фиг.22 слева вверху). кДНК, кодирующую 2 (без области CH1), но включая стоп-кодон и поли-A-участок (фиг.22 слева вверху). кДНК, кодирующую  HSP70-антитело, амплифицировали ПЦР для клонирования, используя прямой праймер и обратный праймер. HSP70-антитело, амплифицировали ПЦР для клонирования, используя прямой праймер и обратный праймер.
Прямой праймер представлял собой: 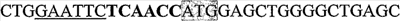 , обеспечивая участок EcoRI с целью клонирования (подчеркнутый) последовательности (жирный шрифт), достаточной для начала трансляции, и нормальный старт-кодон (обозначен серым). , обеспечивая участок EcoRI с целью клонирования (подчеркнутый) последовательности (жирный шрифт), достаточной для начала трансляции, и нормальный старт-кодон (обозначен серым).
Обратный праймер представлял собой: 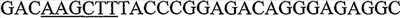 , обеспечивая участок клонирования (подчеркнутый) HindIII и сохраняя нормальный старт-кодон. , обеспечивая участок клонирования (подчеркнутый) HindIII и сохраняя нормальный старт-кодон.
Следовательно, амплификация дает фрагмент EcoRI/HindIII, содержащий участок EcoRI (подчеркнутый), последовательность (жирный шрифт), достаточную для начала трансляции, и нормальный старт-кодон гена антитела  HSP (обозначен серым, смотрите фиг.22). HSP (обозначен серым, смотрите фиг.22).
Обратный 3′-концевой праймер представлял собой: 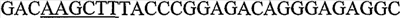 , обеспечивая участок клонирования HindIII (подчеркнутый) и удаляя нормальный стоп-кодон. Это дает фрагмент (фиг.22 сверху, второй слева) с участком EcoRI для клонирования в последовательность промотора и участком HindIII для клонирования 5′-конца в плазмиду для экспрессии и 3′-конца в новой шарнирной последовательности (смотрите ниже). Наконец, фрагмент разрезали EcoRI и HindIII для обеспечения подходящих однонитевых концов для клонирования. , обеспечивая участок клонирования HindIII (подчеркнутый) и удаляя нормальный стоп-кодон. Это дает фрагмент (фиг.22 сверху, второй слева) с участком EcoRI для клонирования в последовательность промотора и участком HindIII для клонирования 5′-конца в плазмиду для экспрессии и 3′-конца в новой шарнирной последовательности (смотрите ниже). Наконец, фрагмент разрезали EcoRI и HindIII для обеспечения подходящих однонитевых концов для клонирования.
Второе клонированное антитело, привносящее вторую специфичность, содержало домен VHH антитела ламы к gag антигену ретровируса (PERV) свиньи (Dekker et ah, (2003) J Virol, 11 (22): 12132-9, фиг.22 сверху справа).  gag амплифицировали при помощи стандартной ПЦР амплификации, используя следующие праймеры: gag амплифицировали при помощи стандартной ПЦР амплификации, используя следующие праймеры:
прямой:  и обратный праймер: и обратный праймер: 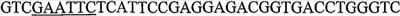 . Это дает амплифицированный фрагмент (фиг.22 справа, второй сверху) с участком XhoI (обозначен серым) для клонирования 5′-конца в рамке с новым шарниром (смотрите ниже) и участком EcoRI (подчеркнутый) для клонирования 3′-конца в плазмиду для экспрессии (фиг.22, справа в центре). Наконец, фрагмент разрезали EcoRI и XhoI для получения однонитевых концов для клонирования. . Это дает амплифицированный фрагмент (фиг.22 справа, второй сверху) с участком XhoI (обозначен серым) для клонирования 5′-конца в рамке с новым шарниром (смотрите ниже) и участком EcoRI (подчеркнутый) для клонирования 3′-конца в плазмиду для экспрессии (фиг.22, справа в центре). Наконец, фрагмент разрезали EcoRI и XhoI для получения однонитевых концов для клонирования.
Две последовательности антител объединяли в одну последовательность рекомбинантного биспецифического антитела при помощи нового шарнира. Новый шарнир создавали из двух олигонуклеотидов, которые вместе формировали двухнитевой олигонуклеотид с 5′- и 3′-липкими концами (соответственно HindIII и XhoI-совместимые) с целью клонирования. Он был разработан так, чтобы находился в рамке, которая заканчивалась последовательностью  HSP70 и начиналась последовательностью HSP70 и начиналась последовательностью  gag. Образование сульфидных мостиков, обычно присутствующее в шарнире IgG2 человека, предотвратили заменой цистеинов (обозначены серым) пролинами (подчеркнутые). Пролины добавляли экстрагибкость шарниру, позволяя должное функционирование домена вторичного антитела, который связывается с COOH-концом первого антитела при помощи шарнира. gag. Образование сульфидных мостиков, обычно присутствующее в шарнире IgG2 человека, предотвратили заменой цистеинов (обозначены серым) пролинами (подчеркнутые). Пролины добавляли экстрагибкость шарниру, позволяя должное функционирование домена вторичного антитела, который связывается с COOH-концом первого антитела при помощи шарнира.
Нормальная шарнирная последовательность IgG (цистеиновые кодоны, обозначены серым, пролиновые кодоны, подчеркнуты) 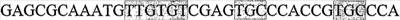 и ее комплемент замещали и ее комплемент замещали 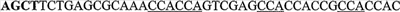 и ее комплементом и ее комплементом 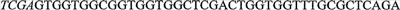 ). Это также предоставляло фрагмент (шарнир в белом прямоугольнике, фиг.22, в центре) с двумя однонитевыми концами, совместимыми с участками HindIII (жирный шрифт) и XhoI (наклонный шрифт) для клонирования. ). Это также предоставляло фрагмент (шарнир в белом прямоугольнике, фиг.22, в центре) с двумя однонитевыми концами, совместимыми с участками HindIII (жирный шрифт) и XhoI (наклонный шрифт) для клонирования.
Три фрагмента ( HSP70 IgG2, шарнир и HSP70 IgG2, шарнир и  gag) последовательно лигировали в плазмиду экспрессии bluescript (Pbluescript11 sk+), которая содержала актиновый промотр цыпленка и последовательность CMV энхансера (фиг.22, плазмида экспрессии), при помощи стандартной технологии рекомбинантной ДНК. При экспрессии этой плазмиды (смотрите ниже) получается рекомбинантное биспецифическое антитело, показанное в нижней части фиг.22. gag) последовательно лигировали в плазмиду экспрессии bluescript (Pbluescript11 sk+), которая содержала актиновый промотр цыпленка и последовательность CMV энхансера (фиг.22, плазмида экспрессии), при помощи стандартной технологии рекомбинантной ДНК. При экспрессии этой плазмиды (смотрите ниже) получается рекомбинантное биспецифическое антитело, показанное в нижней части фиг.22.
Плазмиду экспрессии рекомбинантного биспецифического антитела размножали и котрансфецировали плазмидой pGK-hygro (чтобы обеспечить селекцию трансферцированных клеток) стандартными способами (Superfect) в клетках CHO (фиг.23). Позитивные клоны отбирали в среде, содержащей гидромицин, и позитивно идентифицировали как экспрессирующие рекомбинантное биспецифическое антитело путем выполнения стандартного  gag ELISA (Dekker et al., J.Virol. 2003) среды роста, содержащей рекомбинантное биспецифическое антитело, секретируемое клетками CHO, используя детектирование gag ELISA (Dekker et al., J.Virol. 2003) среды роста, содержащей рекомбинантное биспецифическое антитело, секретируемое клетками CHO, используя детектирование  IgG-HRP человека. Позитивное тестирование IgG-HRP человека. Позитивное тестирование  -gag активности указывает на наибольшую вероятность того, что данный клон экспрессирует полное рекомбинантное биспецифическое антитело, поскольку gag-специфичность находится на заднем конце (COOH-конец) рекомбинантного биспецифического антитела. Последующий ELISA для HSP70 также был позитивным. Вестерн-блот этих клонов, выбранных при помощи ELISA, в невосстанавливающих и в восстанавливающих условиях выполняли, чтобы показать, что белок, экспрессированный из плазмиды, представляет собой димер 110 кДа (как показано в нижней части фиг.23) по сравнению с мономером 55 кДа (в невосстанавливающих и в восстанавливающих условиях и вестерн-блот, фиг.23 справа). Таким образом, ELISA и вестерн-блот вместе показали, что рекомбинантное биспецифическое антитело экспрессируется и секретируется в среде в виде димера при помощи трансфецированных клеток CHO (при >70 нг/мл), и что антитело может связывать антигены HSP70 и gag. Однако не показано, что такая же димерная молекула рекомбинантного биспецифического антитела может связывать оба антигена в одно и то же время. -gag активности указывает на наибольшую вероятность того, что данный клон экспрессирует полное рекомбинантное биспецифическое антитело, поскольку gag-специфичность находится на заднем конце (COOH-конец) рекомбинантного биспецифического антитела. Последующий ELISA для HSP70 также был позитивным. Вестерн-блот этих клонов, выбранных при помощи ELISA, в невосстанавливающих и в восстанавливающих условиях выполняли, чтобы показать, что белок, экспрессированный из плазмиды, представляет собой димер 110 кДа (как показано в нижней части фиг.23) по сравнению с мономером 55 кДа (в невосстанавливающих и в восстанавливающих условиях и вестерн-блот, фиг.23 справа). Таким образом, ELISA и вестерн-блот вместе показали, что рекомбинантное биспецифическое антитело экспрессируется и секретируется в среде в виде димера при помощи трансфецированных клеток CHO (при >70 нг/мл), и что антитело может связывать антигены HSP70 и gag. Однако не показано, что такая же димерная молекула рекомбинантного биспецифического антитела может связывать оба антигена в одно и то же время.
Соответственно, был осуществлен следующий эксперимент. Первый антиген gag фиксировали на дне пластиковых лунок (первая лунка фиг.24, в центре). Затем захватывали рекомбинантное биспецифическое антитело (фиг.24, сверху) первым антигеном (gag) после нанесения CHO клеточного супернтатанта из 1 клона (вторая лунка, фиг.24, в центре). Затем интенсивно промывали и наносили второй антиген (HSP 70, фиг.24, третья лунка в центре), после чего снова интенсивно промывали. Если молекула рекомбинантного биспецифического антитела могла связать оба антигена, она должна была быть захваченной на дне лунки путем связывания первым антигеном (gag) и затем захватом вторым антигеном (HSP70). Когда затем элюировали полный комплекс из лунки (фиг.24, в центре, правая лунка) на вестерн-блоте были видны как рекомбинантное биспецифическое антитело, так и антигены (фиг.24, внизу).
Чтобы собрать секретированное рекомбинантное биспецифическое антитело, клоны CHO выращивали в тех же самых стандартных условиях и в среде (среда SIGMA для гибридом, без сыворотки), используемой для сбора антител из гибридом.
Способы: Лунки планшета Nunc-иммуно (Maxisorp) покрывали очищенным рекомбинантным белком gag (12,5 мкг/мкл в PBS) O/N 4C. Блокировали в течение двух часов 1% молоко/1% BSA в PBS. Среду CHO-DB клона-1, наполовину разбавленную PBS-молоко-BSA (или контроли), инкубировали в течение 3 часов при комнатной температуре. Бактериальный клеточный лизат Bl21 (содержащий белок HSP70), наполовину рабавленный PBS-молоко-BSA, инкубировали в течение 3 часов при комнатной температуре и промывали. Связанные белки элюировали буфером Laemmli для образцов, содержащим 2-меркаптоэтанол. Образцы анализировали вестерн-блот анализом и после этого прогоняли в 10% SDS-PAGE и переносили на нитроцеллюлозную мембрану. Блот блокировали в течение двух часов PBS-молоко-BSA и инкубировали с первичными антителами. Продукты визуализировали стандартными способами, используя вторичные антитела, соединенные с ферментами, которые позволяли визуальное окрашивание. Использовались следующие реагенты:
 Gag: кроличье поликлональное (1:2000), 2 часа, комнатная температура Gag: кроличье поликлональное (1:2000), 2 часа, комнатная температура
рекомбинантное биспецифическое  антитело: козьи античеловеческие IgG-HRP (1:2500), 2 часа, комнатная температура антитело: козьи античеловеческие IgG-HRP (1:2500), 2 часа, комнатная температура
 HSP70: моноклональное G20-380 среднее (1:2), 2 часа, комнатная температура. HSP70: моноклональное G20-380 среднее (1:2), 2 часа, комнатная температура.
Вторичные антитела: козьи антикроличьи-AP (1:2000), 2 часа, комнатная температура, и козьи античеловеческие IgG-HRP (1:2500), 2 часа, комнатная температура, против моноклонального HSP70.
Для визуализации белковых полос использовали первый субстрат NBT/BCIP (красный), реагирующий с щелочной фосфатазой (AP), и второй субстрат DAB (коричневый), реагирующий с пероксидазой хрена (HRP).
Все этапы промывания проводили PBS-0,05% Tween-20.
Контроль выполняли путем исключения одного из компонентов или добавления среды из клеток CHO, не продуцирующих рекомбинантные биспецифические антитела (фиг.24), то есть без нанесения рекомбинантных биспецифических антител (среда из нетрансфецированных клеток CO) и, следовательно, имели только gag (дорожка 2); не имели gag на дне лунки (заменен белком молока) и, следовательно, не должны были иметь продукты (дорожка 3); отсутствие gag и рекомбинантного биспецифического антитела и отсутствие продукта (дорожка 4); отсутствие антигена HSP70 (заменен белком молока) и, следовательно, должны были иметь только рекомбинантное биспецифическое антитело и gag (дорожка 5); отсутствие HSP70 и рекомбинантное биспецифическое антитело должно было иметь только gag (дорожка 6).
Тот факт, что все три компонента (рекомбинантное биспецифическое антитело плюс оба антигена) находились только в лунке дорожки 1, которая получила все три компонента (смотрите также маркированное дно фиг.24), показывает, что единичное рекомбинантное биспецифическое антитело одновременно связывает оба антигена.
Генерация биспецифических IgA или мультиспецифических IgM
Генерация биспецифического IgA по существу является такой, как описано для IgG (выше), но используя дополнительно Vhsol, D и J, константную область C , приводящую к генерации IgA (фиг.25). , приводящую к генерации IgA (фиг.25).
Генерация IgM в значительной степени является аналогичной, но проявляет дополнительную возможность, поскольку молекулы IgM могут формировать большие мультимеры (с или без J цепей). Таким образом, дополнительно к молекулам, аналогичным молекулам, описанным выше (фиг.26, внизу справа, после элиминирования последовательностей мультимеризации), также можно генерировать мультимеры, просто коэкспрессируя IgM с различными специфичностями (фиг.26, слева внизу).
Пример 3
Вектор экспрессии, кодирующий полипептидный комплекс, содержащий тяжелую цепь, включая связывающий домен, который связывается с PSCA (антиген стволовых клеток предстательной железы), домен сборки, содержащий мотив лейциновой молнии Jun и шарнир антитела, домены CH2 и CH3; и легкую цепь, включающую комплементарный домен сборки, состоящий из мотива лейциновой молнии Fos, конструировали, используя технологии молекулярной биологии, как описано у Sambrook et al., ((1989) Molecular Cloning – A Laboratory Manual, Cold Spring Harbor Laboratory Press).
Вектор экспрессии затем трансфецировали в подходящую клетку-хозяин при помощи технологии превращений для продуцирования трансфецированной клетки-хозяина для оптимизированной экспрессии вектора. Трансфецированную или трансформированную клетку-хозяина затем культивировали, используя любую подходящую технологию, известную специалистам в данной области техники, для продуцирования полипептидного комплекса настоящего изобретения.
После продуцирования полипептидные комплексы очищали стандартными процедурами в данной области техники, включая перекрестную фильтрацию, преципитацию сульфата аммония и аффинную колоночную хроматографию (например, белок A).
Растворимый эффекторный домен, состоящий из 3,3′-дииндолилметана (DIM), затем сливали с комплементарным доменом сборки, используя технологии, известные специалистам в данной области техники.
Пример 4
Вектор экспрессии, кодирующий тяжелую цепь полипептидного комплекса настоящего изобретения, содержащий растворимый связывающий домен VHH, который связывается с AFP (Alpha-Fetoprotein), и домен сборки, содержащий мотив лейциновой молнии Jun, и шарнир антитела, домены CH2 и CH3, сконструировали, используя технологии молекулярной биологии, как описано Sambrook et al.
Второй вектор экспрессии, кодирующий легкую цепь полипептидного комплекса настоящего изобретения, также сконструировали. Он содержал комплементарный домен сборки, состоящий из мотива лейциновой молнии Fos.
Векторы экспрессии затем трансфецировали в подходящую клетку-хозяин обычной технологией для продуцирования котрансфецированной клетки-хозяина для оптимизированной экспрессии вектора. Трансфецированную или трансформированную клетку-хозяин затем культивировали, используя любую подходящую технологию, известную специалистам в данной области техники для продуцирования полипептидного комплекса настоящего изобретения.
После продуцирования полипептидные комплексы очищали стандартными процедурами данной области техники, включая перекрестную фильтрацию, преципитацию сульфата аммония и аффинную колоночную хроматографию (например, белок A).
Растворимый эффекторный домен, состоящий из 3,3′-дииндолилметана (DIM), затем сливали с комплементарным доменом сборки, используя технологии, известные специалистам в данной области техники.
Пример 5. VCAM и VLA-4
Вектор экспрессии, кодирующий полипептидный комплекс, содержащий тяжелую цепь, включающую связывающий домен, который связывается с PSCA (антиген стволовых клеток простаты), домен сборки, содержащий VCAM и шарнир антитела, домены CH2 и CH3; и легкую цепь, включающую комплементарный домен сборки, состоящий из VLA-4, слитый с токсином A лицина, сконструировали, используя технологии молекулярной биологии, как описано Sambrook et al.
Затем вектор экспрессии трансфецировали в подходящую клетку-хозяин обычной технологией для продуцирования трансфецированной клетки-хозяина, для оптимизированной экспрессии вектора. Трансфецированную или трансформированную клетку-хозяин затем культивировали, используя любую подходящую технологию, известную специалистам в данной области техники, для продуцирования полипептидного комплекса настоящего изобретения.
После продуцирования полипептидные комплексы очищали стандартными процедурами данной области техники, включая перекрестную фильтрацию, преципитацию сульфатом аммония и аффинную колоночную хроматографию (например, белок A).
Пример 6
Вектор экспрессии, кодирующий полипептидный комплекс, содержащий тяжелую цепь, включающую связывающий домен, который связывается с PSCA (антиген стволовых клеток простаты), домен сборки, содержащий мотив лейциновой молнии Jun и шарнир антитела, домены CH2 и CH3; и легкую цепь, включающую комплементарный домен сборки, состоящий из мотива лейциновой молнии Fos и растворимый эффекторный домен, кодирующий пурин-нуклеозид-фосфорилазу (PNP), сконструировали, используя технологии молекулярной биологии, как описано Sambrook et al.
Вектор экспрессии затем трансфецировали в подходящую клетку-хозяин обычными технологиями для продуцирования трансфецированной клеткой-хозяином для оптимизированной экспрессии вектора. Трансфецированную или трансформированную клетку-хозяин затем культивировали, используя любую подходящую технологию, известную специалистам в данной области техники, для продуцирования полипептидного комплекса настоящего изобретения. После продуцирования полипептидные комплексы очищали стандартными процедурами настоящего изобретения, включая перекрестную фильтрацию, преципитацию сульфатом аммония и аффинную колоночную хроматографию (например, белок A).
PNP превращает флударабин в токсический метаболит 2-фтораденин, который убивает клетки, содержащие PNP фермент, и дополнительно диффундирует, убивая окружающие неинфицированные клетки, локальный эффект наблюдателя.
Пример 7
Вектор экспрессии, кодирующий первую тяжелую цепь полипептидного комплекса настоящего изобретения, содержащий растворимый связывающий домен VHH, который связывается с областью V3-PND гликопротеинового антигена gp120, и домен сборки, содержащий мотив лейциновой молнии Jun и шарнир антигена, домены CH2 и CH3, сконструировали, используя технологии молекулярной биологии, как описано Sambrook et al.
Второй вектор экспрессии, кодирующий вторую тяжелую цепь полипептидного комплекса настоящего изобретения, который также сконструировали, содержит растворимый связывающий домен VHH, который связывается с GP-41, домен сборки, состоящий из мотива лейциновой молнии Jun и шарнира антитела, доменов CH2 и CH3.
Третий вектор экспрессии, кодирующий легкую цепь полипептидного комплекса настоящего изобретения, также сконструировали. Он содержит комплементраный домен сборки, состоящий из мотива лейциновой молнии Fos. Затем векторы экспрессии трансфецировали в подходящую клетку-хозяин обычной технологией для продуцирования котрансфецированной клетки-хозяина для оптимизированной экспрессии вектора. Трансфецированную или трансформированную клетку-хозяин затем культивировали, используя любую подходящую технологию, известную специалистам в данной области техники, для продуцирования полипептидного комплекса настоящего изобретения.
После продуцирования полипептидный комплекс очищали стандартными процедурами данной области техники, включая перекрестную фильтрацию, преципитацию сульфатом аммония и аффинную колоночную хроматографию (например, белок A).
Растворимый эффекторный домен, содержащий HIV-1 MN V3 (PND), пептидный иммуноген затем сливали с комплементарным доменом сборки, используя технологии, известные специалистам в данной области техники.
Пример 8
Вектор экспрессии, кодирующий первую тяжелую цепь полипептидного комплекса настоящего изобретения, содержащий растворимый связывающий домен VHH, который связывается с областью V3-PND гликопротеинового антигена, сконструированного при помощи технологии молекулярной биологии, описанной Sambrook et al., ((1989) Molecular Cloning – A Laboratory Manual, Cold Spring Harbor Laboratory Press).
Второй вектор экспрессии, кодирующий вторую тяжелую цепь полипептидного комплекса настоящего изобретения, который также сконструирован, содержит растворимый связывающий домен VHH, который связывается с GP-41.
Две тяжелые цепи отличались тем, что константные области двух тяжелых цепей содержали идентичные домены µ, CH2, CH3 и CH4.
Затем векторы экспрессии трансфецировали в клетку-хозяин, которая конститутивно экспрессировала цепь J, при помощи обычной технологии для продуцирования котрансфецированной клетки-хозяина для оптимизированной экспресии вектора. Трансфецированную или трансформированную клетку-хозяин затем культивировали, используя любую подходящую технологию, известную специалистам в данной области техники для продуцирования полипептидного комплекса настоящего изобретения.
После продуцирования полипептидный комплекс очищали стандартными процедурами данной области техники, включая перекрестную фильтрацию, преципитацию сульфатом аммония и аффинную колоночную хроматографию (например, белок A).
Растворимый эффекторный домен, состоящий из HIV-1 MN V3 (PND), пептидного иммуногена, затем сливали с комплементарным доменом сборки, используя технологии, известные специалистам в данной области техники.
Все упомянутые выше публикации включены в настоящее описание во всей своей полноте в качестве ссылки.
Различные модификации и изменения описанных способов и систем настоящего изобретения очевидны специалистам в данной области техники без отступления от объема и сущности настоящего изобретения. Хотя настоящее изобретение описано в связи с предпочтительными вариантами осуществления, необходимо отметить, что настоящее изобретение, как заявлено в формуле изобретения, не является ограниченным ненадлежащим конкретными вариантами осуществления. Напротив, различные модификации описанных вариантов осуществления настоящего изобретения, которые очевидны специалистам в биохимии, молекулярной биологии и биотехнологии или родственных областях, следует срассматривать как входящие в объем нижеприведенной формулы изобретения.
Формула изобретения
1. Способ получения антиген-связывающего домена VH, в котором отсутствует удлиненная CDR3 петля, подобная CDR3 петле верблюда, включающий:
трансформирование клетки млекопитающего, не являющегося человеком, гетерологичным локусом тяжелой цепи VH, причем:
локус тяжелой цепи VH содержит ген, кодирующий вариабельную область, содержащий по меньшей мере один сегмент гена VH, по меньшей мере один сегмент гена D, не являющегося верблюжьим, по меньшей мере один сегмент гена J, не являющегося верблюжьим, и по меньшей мере одну константную область тяжелой цепи;
ни один из генов, кодирующих константные области, не кодирует функциональный домен Сн1;
сегмент гена V, сегмент гена D и сегмент гена J способны к рекомбинации с образованием кодирующей последовательности VDJ;
при экспрессии локус способен образовывать антитело только с тяжелыми цепями, содержащими антиген-связывающий домен VH и константную эффекторную область, лишенную функционального домена Сн1;
культивирование клетки млекопитающего, не являющегося человеком, для последующего получения трансгенного млекопитающего;
иммунизацию указанного трансгенного млекопитающего, не являющегося человеком, представляющим интерес антигеном;
выделение клетки или ткани, экспрессирующей интересующие специфичные в отношении антигена антитела только с тяжелыми цепями,
где антитело имеет домен VH, в котором отсутствует удлиненная CDR3 петля, подобная CDR3 петле верблюда;
идентификацию и выделение из выделенных клеток или тканей нуклеиновой кислоты, кодирующей домен VH, интересующего специфичного в отношении антигена антитела только с тяжелыми цепями; и
экспрессию указанного антиген-связывающего домена VH указанной выделенной нуклеиновой кислоты.
2. Способ по п.1, в котором после иммунизации указанного трансгенного млекопитающего, не являющегося человеком, происходит созревание аффинности антитела за счет соматической мутации в антиген-связывающем домене VH.
3. Способ по п.1 или 2, в котором экспрессия указанного гетерологичного локуса тяжелой цепи VH у указанного трансгенного млекопитающего, не являющегося человеком, не зависит от наличия или экспрессии генов легкой цепи.
4. Способ по п.1, в котором указанное трансгенное млекопитающее, не являющееся человеком, имеет пониженную способность продуцировать эндогенные антитела, которые содержат легкие цепи.
5. Способ по п.1, в котором:
указанное трансгенное млекопитающее, не являющееся человеком, иммунизируют антигеном с помощью инъекции;
нуклеиновая кислота, кодирующая антиген-связывающий домен VH, представляет собой мРНК, клонированную из гибридомы, продуцируемой клеткой или тканью, продуцирующими специфичные в отношении антигена антитела только с тяжелыми цепями; и антиген-специфичный антиген-связывающий домен VH экспрессируется в гетерологичной системе экспрессии.
6. Способ по п.1, в котором:
указанное трансгенное млекопитающее, не являющееся человеком, иммунизируют антигеном с помощью инъекции;
нуклеиновую кислоту, кодирующую антиген-связывающий домен VH, получают путем клонирования антиген-связывающего домена VH из мРНК антитела только с тяжелыми цепями, полученного из выделенной клетки или ткани;
кодированный антиген-связывающий домен VH выбирают с помощью фагового дисплея или аналогичной библиотеки; и
экспрессируют антиген-связывающий домен VH отдельно или в виде слитого белка в бактериальной, дрожжевой или альтернативной системе экспрессии.
7. Способ по п.1, в котором локус тяжелой цепи VH содержит природные сегменты гена V, D и J человека.
8. Способ по п.1, в котором локус тяжелой цепи VH содержит более одного сегмента гена V, более одного сегмента гена D и более одного сегмента гена J.
9. Способ по п.1, где по меньшей мере один сегмент гена V, выбранный или полученный способами генной инженерии, обладает улучшенными свойствами растворимости.
10. Способ по п.1, где по меньшей мере один из сегментов гена V, присутствующий в локусе тяжелой цепи, получен из домена VH, в который введены предпочтительные мутации при созревании аффинности, после перетасовки VDJ.
11. Применение одного или нескольких связывающих доменов VH одного и того же или различных специфично-связывающихся антигенов, полученных способами по любому из пп.1-10, вместе или без дополнительных эффекторных доменов, для создания слитых белков или связывающих комплексов моновалентного, бивалентного или мультивалентного полипептида.
РИСУНКИ
|
|