|
|
(21), (22) Заявка: 2007120521/13, 31.10.2005
(24) Дата начала отсчета срока действия патента:
31.10.2005
(30) Конвенционный приоритет:
02.11.2004 ES P200402635
(43) Дата публикации заявки: 10.12.2008
(46) Опубликовано: 10.09.2010
(56) Список документов, цитированных в отчете о
поиске:
US 20030054409 A1, 20.03.2003. RU 99119224 A, 20.08.2001.
(85) Дата перевода заявки PCT на национальную фазу:
04.06.2007
(86) Заявка PCT:
EP 2005/011714 20051031
(87) Публикация PCT:
WO 2006/048252 20060511
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. А.В.Мицу
|
(72) Автор(ы):
АЛЬВАРЕС ВАЛЛИНА Луис (ES),
САНЧЕС-АРЕВАЛО ЛОБО Виктор Ксавьер (ES),
КУЭСТА МАРТИНЕС Анхель (ES),
САНС АЛКОБЕР Лаура (ES),
ВАРГАС НУНЬЕС Хуан (ES),
КОМТЕ ГРАУ Марта (ES)
(73) Патентообладатель(и):
УНИВЕРСИДАД АУТОНОМА ДЕ МАДРИД (ES)
|
(54) МНОГОФУНКЦИОНАЛЬНЫЕ И ПОЛИВАЛЕНТНЫЕ ИНГИБИТОРЫ АНГИОГЕНЕЗА
(57) Реферат:
Изобретение относится к биотехнологии. Получены многофункциональные и поливалентные ингибиторы на основе слитых белков, содержащих полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, и полипептид, содержащий домен олигомеризации и функционально активный модулирующий или ингибирующий процесс ангиогенеза участок, отделенный чувствительным к протеиназам участком. Эти ингибиторы пригодны для лечения и профилактики патологий, возникающих посредством процесса ангиогенеза, например злокачественной опухоли, ревматоидного артрита или псориаза. 8 н. и 17 з.п. ф-лы, 6 ил., 1 табл.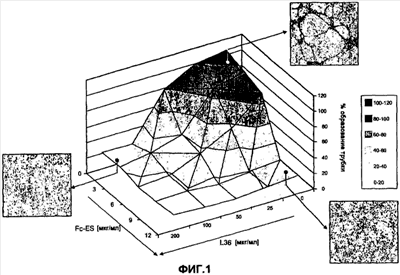
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к слитым белкам, пригодным в качестве многофункциональных и поливалентных ингибиторов ангиогенеза, содержащим полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, и полипептид, содержащий домен олигомеризации и функционально активный ингибирующий или модулирующий процесс ангиогенеза участок, разделенные чувствительным к протеиназам участком. Настоящее изобретение также относится к генным конструкциям и конструкциям векторов, пригодным для получения указанных слитых белков.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Ангиогенез представляет собой биологический процесс, приводящий к формированию новых кровеносных сосудов из ранее существующих сосудов в органе или ткани. Ангиогенез начинается с разрушения базальной мембраны вследствие действия протеиназ, секретируемых эндотелиальными клетками, продолжается миграцией и пролиферацией указанных эндотелиальных клеток, завершаясь формированием просвета, базальной мембраны и окружения из периферических клеток.
Ангиогенез не происходит в нормальных физиологических условиях у здоровых взрослых, за исключением процессов, связанных с менструальным циклом у женщин и заживлением ран. Однако дисбаланс в процессе ангиогенеза приводит к развитию патологических нарушений, например, таких как ревматоидный артрит, псориаз, бартонеллез, отторжение трансплантированного органа, геморрагия и неоваскуляризация глаза (один из наиболее частых случаев слепоты), диабетическая ретинопатия, ретролентальная фиброплазия, дегенерация желтого пятна, неоваскулярная глаукома, окклюзия вен сетчатки, окклюзия артерий сетчатки, птеригий, покраснение радужки, вновь образованные сосуды, солидные опухоли, гемангиома и пролиферация и метастазы опухоли.
Кроме того, ангиогенез играет важную роль в прогрессирующем росте и метастатическом распространении опухолей. Для того чтобы иметь возможность роста, опухоль должна постоянно стимулировать развитие новых капилляров. Новые сосуды, образованные в опухоли, обеспечивают путь для злокачественных клеток, с помощью которого они могут проникать в кровообращение и формировать метастазы в отдаленных областях. Если ангиогенную активность подавить или устранить, тогда, несмотря на существование опухоли, она не может развиваться.
По этой причине различные исследовательские группы проводят работу для выявления соединений, выполняющих ингибирующее воздействие на ангиогенез (ингибиторы ангиогенеза или антиангиогенные средства), пригодных в качестве лекарственных средств для лечения или профилактики патологий, возникающих при развитии ангиогенеза.
В отношении опухолей полагают, что опухоли не могут расти или образовывать метастазы в другом органе без образования новых кровеносных сосудов, таким образом, в качестве раннего события при прогрессировании опухоли происходит ангиогенное переключение. Было описано несколько антиангиогенных стратегий, вмешивающихся на различных уровнях ангиогенного каскада: блокирование активности фактора роста; ингибирование протеиназ внеклеточного матрикса (ECM); направление непосредственно на эндотелиальные клетки (EC); повышенное регулирование эндогенных ингибиторов и т.д. Эндогенные ингибиторы ангиогенеза получили особое внимание в отношении лечения злокачественных опухолей, поскольку оказалось, что они являются нетоксичными и неиммуногенными средствами. Было выявлено по меньшей мере 10 эндогенных ингибиторов ангиогенеза [O’Reilly, M.S. et al., Cell, 88: 277-285, 1997], среди которых наиболее хорошо известными являются ангиостатин и эндостатин.
Эндостатины (ES) представляют собой ингибиторы миграции эндотелиальных клеток и ангиогенеза, и в моделях на животных было показано, что они снижают рост опухоли. Механизмы, вовлеченные в указанные действия, не ясны, хотя было предположено, что в них участвуют связывание рецепторов клеточной поверхности (интегрины и гепарансульфаты, VEGFR-2), металлопротеиназы и компоненты ECM. Источником ES является домен NCI коллагенов XV и XVIII, откуда они протеолитически высвобождаются в форме тримера, и далее они превращаются в мономерные эндостатины массой приблизительно 20 кДа. На N-конце NC1 находится домен тримеризации приблизительно из 60 остатков, соединенный с элементом ES из приблизительно 180 остатков посредством гибкой шарнирной области, содержащей различные чувствительные к протеиназам участки, посредством которых после протеолитического расщепления высвобождается эндостатин.
Boehm et al. [Nature, 390:404 (1997)] описывают использование в качестве экспериментальной модели мышей, которым трансплантировали несколько опухолей (карцинома легких Льюиса, фибросаркома и меланома). У мышей, которым не вводили ES, указанные опухоли росли быстро, приводя к смерти животных. Напротив, у мышей, которым вводили ES после развития опухоли, наблюдалось уменьшение объема опухоли вплоть до достижения почти микроскопического размера. Циклическое введение ES мышам с опухолью приводило к полной регрессии опухолей в моделях на животных. Однако клинические испытания, проведенные для ES, не подтвердили существенного ингибирования роста опухоли, и регрессия опухоли наблюдалась редко. К сожалению, это не является единичным примером, и другие клинические испытания, включающие различные антиангиогенные молекулы, также не оправдали надежд, несмотря на значительные противоопухолевые эффекты в моделях на животных. В связи с указанным кажется логичным сочетать несколько ингибиторов ангиогенеза для лечения злокачественных опухолей у человека. Альтернативно повышенная биологическая активность (ES + ангиостатин) и направленное против опухоли действие [ES + RGD (аргинин-глицин-аспарагиновая кислота)] потенциально могут улучшить ингибирование роста опухоли.
С другой стороны, был продемонстрирован терапевтический потенциал одноцепочечного фрагмента Fv (scFv) антитела против ламинина (L36) с антиангиогенной активностью как in vivo, так и in vitro. Результаты показали, что изменение морфогенетического потенциала матриксов, ассоциированных с клетками, является эффективным способом предотвращения формирования ассоциированных с опухолью кровеносных сосудов in vivo.
Несмотря на проведенные к настоящему времени попытки, все еще является необходимой разработка соединений ингибиторов ангиогенеза, пригодных в качестве лекарственных средств для лечения или профилактики патологий, возникающих вследствие развития ангиогенеза.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является предоставление соединений с антиангиогенной активностью, потенциально пригодных в качестве лекарственных средств для профилактики и/или лечения патологий, возникающих вследствие ангиогенеза, например псориаза, ревматоидного артрита, ретинопатий, злокачественной опухоли и т.д.
Решение проблемы в соответствии с настоящим изобретением основано на слитых белках, потенциально пригодных в качестве многофункциональных и поливалентных ингибиторов ангиогенеза, содержащих (a) полипептид, содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, и (b) полипептид, содержащий домен олигомеризации и функционально активный ингибирующий или модулирующий процесс ангиогенеза участок, разделенные чувствительным к протеиназе участком.
Иллюстрацией настоящего изобретения являются конструкции нескольких белковых химер. Один из слитых белков (смотрите пример) содержит одноцепочечный фрагмент Fv (scFv) моноклонального антитела против ламинина L36 и домен NC1 коллагена XVIII, содержащий домен тримеризации и домен эндостатина (ES), связанные шарнирным пептидом, содержащим чувствительные к протеиназам участки, посредством которых после протеолитического расщепления высвобождаются мономерные ES. Уровни протеиназ повышаются в микроокружении опухоли, таким образом, из указанного слитого белка высвобождаются in situ как мономеры ES, так и тримеры scFv. Секреция указанного слитого белка осуществлялась посредством генетически модифицированных клеток человека в функционально активной форме. Полная форма обладала молекулярной массой приблизительно 210 кДа, что указывает на то, что в физиологических условиях отдельные субъединицы являются не ковалентно связанными с образованием тримерной структуры. Указанный тримерный слитый белок значительно ингибировал способность эндотелиальных клеток мигрировать в ответ на факторы роста и образовывать сосуды капиллярного типа при выращивании на субстрате матригель. Более того, указанный слитый белок обрабатывали несколькими различными протеиназами. Данные показали, что катепсин L, панкреатическая эластаза и некоторые матриксные металлопротеиназы (MMP) образуют как мономеры типа ES, так и тримерные фрагменты антитела (scFv). Кроме того, слитые белки преобразовывались правильно, когда они продуцировались генетически модифицированными продуцирующими MMP клетками опухоли, но не тогда, когда они продуцировались генетически модифицированными клетками, которые не продуцировали MMP. Эти результаты открывают путь для новой стратегии генной терапии против злокачественной опухоли с использованием указанного типа слитых белков, которые составляют часть нового поколения ингибиторов ангиогенеза, пригодных в качестве лекарственных средств для лечения заболеваний, обусловленных дисбалансом в указанном ангиогенезе.
Таким образом, в одном аспекте настоящее изобретение относится к генной конструкции, содержащий функционально связанные по меньшей мере одну последовательность нуклеиновой кислоты (A), содержащую нуклеотидную последовательность, кодирующую полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и последовательность нуклеиновой кислоты (B), содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком, где 3′-конец указанной первой последовательности нуклеиновой кислоты (A) связан с 5′-концом указанной второй последовательности нуклеиновой кислоты (B).
В другом аспекте настоящее изобретение относится к экспрессирующей кассете, содержащей указанную генную конструкцию, функционально связанную с контролирующей экспрессию последовательностью.
В другом аспекте настоящее изобретение относится к рекомбинантному вектору, содержащему указанную генную конструкцию или указанную экспрессирующую кассету. В другом аспекте настоящее изобретение относится к клетке-хозяину, содержащей указанную генную конструкцию, или указанную экспрессирующую кассету, или указанный рекомбинантный вектор.
В другом аспекте настоящее изобретение относится к слитому белку, получаемому посредством экспрессии последовательности нуклеиновой кислоты, находящейся в указанной генной конструкции. Указанный слитый белок, как правило, содержит полипептид (A’), содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и полипептид (B’), содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей либо указанный слитый белок совместно с по меньшей мере одним фармацевтически приемлемым эксципиентом, либо вектор, содержащий генную конструкцию по настоящему изобретению или экспрессирующую кассету по настоящему изобретению, и необязательно по меньшей мере один фармацевтически приемлемый эксципиент.
В другом аспекте настоящее изобретение относится к применению указанного слитого белка или указанной генной конструкции, или указанной экспрессирующей кассеты, или указанного рекомбинантного вектора для изготовления фармацевтической композиции для предотвращения, лечения, торможения или минимизации развития ангиогенеза.
В другом аспекте настоящее изобретение относится к применению указанного слитого белка или указанной генной конструкции, или указанной экспрессирующей кассеты, или указанного рекомбинантного вектора для изготовления фармацевтической композиции для лечения и/или профилактики патологий, возникающих вследствие ангиогенеза.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлено картографическое изображение, на котором показано действие на морфогенез капилляров отдельного лечения и сочетанного лечения различными концентрациями рекомбинантного моноклонального антитела (L36) в форме scFv [одноцепочечный фрагмент Fv моноклонального антитела L36 против ламинина] и димерного слитого белка Fc-ES (слитый белок домена ES и фрагмента Fc иммуноглобулина).
На фиг.2 представлена иллюстрация продукции слитого белка в соответствии с настоящим изобретением и его протеолитической обработки. На фиг.2A схематично представлена последовательность, кодирующая ген  1 (коллаген XVIII) и домен NC1. На фиг.2B схематично представлен указанный домен NC1, содержащий соединительный пептид, домен тримеризации, шарнирный пептид и домен ES. На фиг.2C схематично представлен слитый белок, или химера, образованный рекомбинантным моноклональным антителом против ламинина (L36) в форме scFv и доменом NC1 коллагена XVIII. На фиг.2D представлен результат протеолитической обработки указанного слитого белка, где наблюдалось формирование тримерного и мономерного антитела против ES. 1 (коллаген XVIII) и домен NC1. На фиг.2B схематично представлен указанный домен NC1, содержащий соединительный пептид, домен тримеризации, шарнирный пептид и домен ES. На фиг.2C схематично представлен слитый белок, или химера, образованный рекомбинантным моноклональным антителом против ламинина (L36) в форме scFv и доменом NC1 коллагена XVIII. На фиг.2D представлен результат протеолитической обработки указанного слитого белка, где наблюдалось формирование тримерного и мономерного антитела против ES.
На фиг.3A схематично представлена структура гена антитела в форме scFv и несколько генных конструкций, содержащих (или не содержащих) кодирующую последовательность домена ES. На фиг.3B представлены результаты вестерн-блот анализа очищенных слитых белков; иммуноблотинг проводили с моноклональным антителом против myc (mAb) и/или с mAb против ES [дорожка 1: scFv L36; дорожка 2: scFv L36-NC1ES-; дорожка 3: scFv L36-NC1ES+; дорожка 4: NC1; и дорожка 5: ES].
На фиг.4A представлен градиент седиментационного равновесия для доменА scFv NC1ES- (1 мг/мл в фосфатно-солевом буфере (PBS)) при 11000 об/мин и 20°C. Светлыми кружками показаны данные, тремя сплошными линиями представлены теоретические градиенты мономера scFv (37148 Да), димера (74296 Да) и тримера (111444 Да). В верхнем квадрате указанной фиг.4A представлено распределение скорости седиментации слитого белка scFv L36-NC1ES- (1 мг/мл в буфере PBS) при 42000 об/мин и 20°C. На фиг.4B представлен график, показывающий аффинность связывания ламинина, иммобилизованного на пластмассовой подложке [в большей степени в случае слитого белка scFv L36-NC1ES- (тримерный), чем в случае scFv L36 (мономерный)]. На фиг.4C представлен график, на котором показано зависимое от дозы модулирование дифференцировки клеток эндотелия (в ответ на различные концентрации scFv или концентрации scFv L36-NC1ES-) в стандартном анализе с матригелем. Каждая точка отображает среднее значение для двух лунок +/- стандартное отклонение. На фиг.4D представлены результаты воздействия на слитый белок scFv L36-NC1ES- различных протеиназ (MMP, панкреатической эластазы свиньи и катепсина L).
На фиг.5 представлено распределение скорости седиментации scFv L36-NC1ES+ (фиг.5A) и NC1 (фиг.5B). На фиг.5C представлены кривые насыщения, полученные с указанными концентрациями scFv L36-NC1ES+ и NC1. На фиг.5D представлен график, отображающий зависимое от дозы модулирование дифференцировки клеток эндотелия (в ответ на различные концентрации scFv L36, scFv L36-NC1ES+, NC1 или Fc-ES) в стандартном анализе с матригелем. Каждая точка отображает среднее значение для двух лунок +/- стандартное отклонение. На фиг.5E представлена гистограмма, на которой показано модулирование в анализе эндотелиальных клеток HUVEC посредством scFv L36 (L36), NC1, scFv L36-NC1ES+ или Fc-ES (ES) [PBS использовали в качестве контроля].
На фиг.6A представлен результат обработки scFv L36-NC1ES+ различными протеиназами (MMP, панкреатической эластазой свиньи и катепсином L), а на фиг.6B представлены результаты указанной обработки для NC1. Очищенные белки инкубировали в течение указанных периодов времени с различными протеиназами, как указано в примере (смотрите раздел “Материалы и способы”), и реакционные смеси анализировали посредством SDS-PAGE (фиг.6C) или посредством вестерн-блота с mAb против эндостатина. Расстояния пробега маркеров молекулярной массы и NC1 показаны слева от указанных фигур. Указателями в виде пустых стрелок на фиг.6A и 6B показаны протеолитические продукты.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к генной конструкции, в дальнейшем в настоящем описании генной конструкции по настоящему изобретению, содержащей функционально связанные по меньшей мере:
a) первую последовательность нуклеиновой кислоты (A), содержащую нуклеотидную последовательность, кодирующую полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и
b) вторую последовательность нуклеиновой кислоты (B), содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком;
где 3′-конец указанной первой последовательности нуклеиновой кислоты (A) связан с 5′-концом указанной второй последовательности нуклеиновой кислоты (B).
Последовательность нуклеиновой кислоты (A) содержит нуклеотидную последовательность, кодирующую полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза. Иллюстративные примеры молекул, вовлеченных в процесс ангиогенеза, включают белки внеклеточного матрикса (ECM), ангиогенные факторы, рецепторы клеточной мембраны и т.д. Белки ECM включают коллаген, протеогликаны, фибронектин, ламинин, тенасцин, энтактин и тромбоспондин. В конкретном варианте осуществления указанная молекула, вовлеченная в процесс ангиогенеза, представляет собой ламинин, такой как ламинин млекопитающих, например ламинин крысы, мыши или человека. Ангиогенные факторы включают семейство сосудисто-эндотелиальных факторов роста (VEGF) и т.д. Рецепторы указанных ангиогенных факторов, например рецептор 2 VEGF (VEGFR-2), интегрины и т.д., также можно упомянуть в качестве рецепторов клеточной мембраны, вовлеченных в ангиогенез.
В соответствии с настоящим изобретением можно использовать практически любой полипептид, содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, такой как антитело, например моноклональное или поликлональное антитело, которое распознает молекулу, вовлеченную в процесс ангиогенеза, или ее рекомбинантный фрагмент, содержащий участок, который распознает указанную молекулу, вовлеченную в процесс ангиогенеза, например, в его рекомбинантной одноцепочечной форме (одноцепочечный фрагмент Fv или scFv), бифункциональной форме (димер), полной форме (Fab + Fc) и т.д.; кроме того, в конкретном варианте осуществления последовательность нуклеиновой кислоты (A) кодирует рекомбинантное одноцепочечное антитело (scFv), полученное из mAb, против ламинина L36 (пример 1), содержащее вариабельный участок тяжелой цепи (VH) моноклонального антитела L36, слитое посредством линкера, такого как пептид, содержащий последовательность G4S, с вариабельным участком легкой цепи (VL) mAb L36 (фиг.2C), последовательность которого описана Sanz L. et al. [Cancer Immunology and Immunotherapy, 2001 Dec; 50(10)557-65], где 3′-конец последовательности, кодирующей VL, связан с 5′-концом последовательности, кодирующей указанный линкер, и 3′-конец нуклеотидной последовательности, кодирующей указанный линкер, связан с 5′-концом последовательности, кодирующей VL.
mAb L36 распознает ламинины различных видов животных, например мыши, крысы, человека и т.д., поскольку оно взаимодействует с участком, который является высоко консервативным среди различных видов животных [Sanz L. et al., EMBO J 2003, Vol. 22(7):1508-1517].
Благодаря своим свойствам, указанный полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, такой как антитело в любой его форме (scFv, бифункциональной или полной), может распознавать и блокировать функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, и может направлять антиангиогенный полипептид, слитый с указанным полипептидом, к молекулам, вовлеченным в процесс ангиогенеза, например белкам ECM, ангиогенным факторам, рецепторам клеточной мембраны и т.д., и блокировать функционально активные участки указанных молекул.
Последовательность нуклеиновой кислоты (B) содержит нуклеотидную последовательность, кодирующую полипептид, содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации (i) и указанным функционально активным в процессе ангиогенеза участком (ii).
Домен олигомеризации представляет собой домен, который обеспечивает образование олигомеров (например, димеров, тримеров, тетрамеров и т.д., пептидов или белков). Для осуществления настоящего изобретения на практике можно использовать практически любой домен олигомеризации, например домен димеризации, тримеризации или тетрамеризации и т.д., представленный в различных белках как эукариотического, так и прокариотического происхождения, способных рекомбинантно экспрессироваться и формировать белковый олигомер белка, который его содержит. В конкретном варианте осуществления указанный домен олигомеризации представляет собой домен тримеризации, такой как домен тримеризации домена NC1 коллагена XVIII или коллагена XV.
Функционально активный в процессе ангиогенеза участок включает любой функционально активный в процессе ангиогенеза пептид или белок, такой как ингибитор процесса ангиогенеза или модулирующий пептид или белок. В соответствии с настоящим изобретением можно использовать практически любой функционально активный в процессе ангиогенеза пептид или белок; хотя в конкретном варианте осуществления указанный функционально активный в процессе ангиогенеза участок включает эндостатин (ES) млекопитающих, такой как ES, находящийся в домене NC1 коллагена XV или коллагена XVIII.
Чувствительный к протеиназам участок расположен между указанным доменом олигомеризации (i) и указанным функционально активным в процессе ангиогенеза участком (ii) и содержит полипептидную последовательность, чувствительную к действию протеиназ. Несмотря на то что в соответствии с настоящим изобретением можно использовать любую пептидную последовательность, чувствительную к любой протеиназе, на практике предпочтительной для указанной протеиназы является протеиназа, экспрессируемая только в области опухоли, чтобы слитый белок по настоящему изобретению “преобразовывался” с образованием функционально активных в процессе ангиогенеза пептидных или белковых мономеров и тримерных полипептидных молекул, способных распознавать и блокировать функционально активный участок молекулы, вовлеченной в процесс ангиогенеза. Таким образом, в конкретном варианте осуществления указанный чувствительный к протеиназам участок содержит шарнирный участок, находящийся в домене NC1 коллагена XV или XVIII млекопитающих между доменом тримеризации и доменом ES или участком указанного домена NC1, поскольку указанный участок является чувствительным к действию протеиназ, экспрессируемых только в области опухоли.
Таким образом, в особенно предпочтительном варианте осуществления последовательность нуклеиновой кислоты (B) содержит нуклеотидную последовательность, кодирующую домен NC1 коллагена XVIII млекопитающих или домен NC1 коллагена XV млекопитающих. Как известно, указанный домен NC1 коллагена XVIII (и коллагена XV) содержит домен тримеризации и домен ES, связанные шарнирным пептидом (фиг.2B). Последовательности указанных доменов NC1 коллагена XV и XVIII известны; в качестве иллюстрации, последовательность домена NC1 коллагена XVIII описана ранее Sasaki et al. [Sasaki et al., Structure, function and tissue forms of the C-terminal globular domain of collagen XVIII containing the angiogenesis inhibitor endostatin. EMBO J. 1998 Aug 3; 17(15):4249-56]. В примере 1 описано получение нуклеотидной последовательности, содержащей участок, кодирующий домен NC1 коллагена XVIII мыши.
Для осуществления настоящего изобретения на практике можно использовать любой другой домен, сходный с доменом NC1 коллагена XVIII, содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком, предпочтительно участок, чувствительный к протеиназам, экспрессируемым в области опухоли.
Как правило, последовательность нуклеиновой кислоты (A) не является непосредственно слитой с последовательностью нуклеиновой кислоты (B), а предпочтительным является введение гибкого связующего пептида (или спейсерного пептида) между полипептидами, кодируемыми указанными последовательностями нуклеиновых кислот (A) и (B). Таким образом, если необходимо, генная конструкция по настоящему изобретению также может дополнительно содержать третью последовательность нуклеиновой кислоты (C), содержащую нуклеотидную последовательность, кодирующую подвижный связывающий пептид, расположенный между указанными последовательностями нуклеиновой кислоты (A) и (B), где 5′-конец указанной последовательности нуклеиновой кислоты (C) связан с 3′-концом указанной последовательности нуклеиновой кислоты (A) и 3′-конец указанной последовательности нуклеиновой кислоты (C) связан с 5′-концом указанной последовательности нуклеиновой кислоты (B). Предпочтительно указанный спейсерный пептид (C) представляет собой пептид со структурной гибкостью. Можно использовать практически любой пептид со структурной гибкостью. В качестве иллюстрации, указанный гибкий пептид может содержать повторы аминокислотных остатков, в частности остатков Gly и Ser, или любой другой пригодный повтор аминокислотных остатков. В соответствии с настоящим изобретением можно использовать практически любую пептидную последовательность, определяющую гибкий связующий пептид. Иллюстративные примеры гибких связующих белков включают последовательности, такие как Gly-Ser-Pro-Gly (GSPG), или последовательность (Gly-Ser)4. Тем не менее, в конкретном варианте осуществления указанный гибкий связующий белок содержит последовательность Leu-Glu-Gly-Ala-Gly-Gly-Ser-Gly-Gly-Ser-Ser-Gly-Ser-Asp-Gly-Ala-Ser-Gly-Ser. Таким образом, в конкретном варианте осуществления генная конструкция по настоящему изобретению в дополнение к указанным последовательностям нуклеиновых кислот (A) и (B) содержит третью последовательность нуклеиновой кислоты (C), содержащую нуклеотидную последовательность, кодирующую пептид Leu-Glu-Gly-Ala-Gly-Gly-Ser-Gly-Gly-Ser-Ser-Gly-Ser-Asp-Gly-Ala-Ser-Gly-Ser.
Также в целях упрощения выделения и очистки слитого белка, полученного с помощью настоящего изобретения, генная конструкция по настоящему изобретению может содержать, если это необходимо, последовательность нуклеиновой кислоты, кодирующую пептид, который можно использовать в целях выделения и очистки слитого белка. Таким образом, в конкретном варианте осуществления генная конструкция по настоящему изобретению включает, если это необходимо, последовательность нуклеиновой кислоты (D), содержащую нуклеотидную последовательность, кодирующую пептид, который можно использовать в целях выделения или очистки, известный как маркерный пептид. Указанная последовательность нуклеиновой кислоты (D) может быть расположена в любом положении, которое не изменяет функциональности любого из полипептидов, экспрессируемых указанными последовательностями нуклеиновых кислот (A) и (B). В качестве иллюстрации, указанная последовательность нуклеиновой кислоты (D) может быть расположена в направлении 5′ 3′ от 3′-конца указанной последовательности нуклеиновой кислоты (B). Можно использовать практически любой пептид, или пептидную последовательность, который обеспечивает выделение и очистку слитого белка, например полигистидиновые последовательности, пептидные последовательности, которые могут распознавать антитела, которые могут использоваться для очистки полученного слитого белка посредством иммуноаффинной хроматографии, такие как маркерные пептиды и т.д., например эпитопы, полученные из гемагглютинина вируса лихорадки, или эпитоп C-myc и т.д. 3′ от 3′-конца указанной последовательности нуклеиновой кислоты (B). Можно использовать практически любой пептид, или пептидную последовательность, который обеспечивает выделение и очистку слитого белка, например полигистидиновые последовательности, пептидные последовательности, которые могут распознавать антитела, которые могут использоваться для очистки полученного слитого белка посредством иммуноаффинной хроматографии, такие как маркерные пептиды и т.д., например эпитопы, полученные из гемагглютинина вируса лихорадки, или эпитоп C-myc и т.д.
Генную конструкцию по настоящему изобретению можно получать посредством применения хорошо известных в данной области способов [Sambrook et al., “Molecular cloning, a Laboratory Manual”, 2nd; ed., Cold Spring Harbor Laboratory Press, N.Y., 1989. Vol 1-3]. Указанная генная конструкция по настоящему изобретению может включать функционально связанную регуляторную последовательность экспрессии последовательностей нуклеиновых кислот, кодирующих полипептиды, кодируемые последовательностями нуклеиновых кислот (A) и (B), таким образом, составляя экспрессирующую кассету. Как используют в настоящем описании, выражение “функционально связанный” означает, что полипептиды, кодируемые последовательностями нуклеиновых кислот (A) и (B), и, когда это целесообразно, (C), экспрессируются в правильной открытой рамке считывания под контролем последовательностей контроля экспрессии и регуляторных последовательностей.
Таким образом, в другом аспекте настоящее изобретение относится к экспрессирующей кассете, содержащей генную конструкцию по настоящему изобретению, функционально связанную с последовательностью контроля экспрессии нуклеотидной последовательности, кодирующей слитый белок в соответствии с настоящим изобретением, содержащий (a) полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, и (b) полипептид, содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком. Контролирующие последовательности представляют собой последовательности, которые контролируют и регулируют транскрипцию, и, когда это целесообразно, трансляцию указанного слитого белка, и включают промоторные последовательности, последовательности, кодирующие регуляторы транскрипции, связывающие рибосомы последовательности (RBS) и/или последовательности терминатора транскрипции. В конкретном варианте осуществления указанная последовательность контроля экспрессии является функциональной в прокариотических клетках и организмах, например бактериях и т.д., в то время как в другом конкретном варианте осуществления указанная последовательность контроля экспрессии является функциональной в эукариотических клетках и организмах, например в клетках насекомых, клетках растений, клетках млекопитающих и т.д. Иллюстративные примеры промоторов, которые могут быть представлены в экспрессирующей кассете в соответствии с настоящим изобретением, включают промотор цитомегаловируса человека (hCMV) и т.д.
Предпочтительно указанная экспрессирующая кассета дополнительно содержит маркер или ген, кодирующий мотив или фенотип, которые позволяют проводить селекцию клетки-хозяина, трансформированной указанной экспрессирующей кассетой. Иллюстративные примеры указанных маркеров, которые могут находиться в экспрессирующей кассете по настоящему изобретению, включают гены устойчивости к антибиотикам, гены устойчивости к токсичным соединениям, и, главным образом, все гены, которые обеспечивают селекцию генетически трансформированных растений.
Генная конструкция по настоящему изобретению или экспрессирующая кассета в соответствии с настоящим изобретением могут быть встроены в пригодный вектор. Таким образом, в другом аспекте настоящее изобретение относится к вектору, такому как экспрессирующий вектор, содержащему указанную генную конструкцию по настоящему изобретению или указанную экспрессирующую кассету. Выбор вектора зависит от клетки-хозяина, в которую его затем вводят. В качестве иллюстрации, вектор, в который встраивают последовательность нуклеиновой кислоты, может представлять собой плазмиду или вектор, которые при введении в клетку-хозяина либо встраиваются, либо не встраиваются в геном указанной клетки. Указанный вектор можно получать общепринятыми способами, известными специалистам в данной области [Sambrook et al., 1989, смотрите выше]. В конкретном варианте осуществления указанный рекомбинантный вектор представляет собой вектор, который пригоден для трансформации в клетки животных.
Указанный вектор можно использовать для трансформации, трансфекции или инфицирования клеток, способных быть трансформированными, трансфицированными или инфицированными указанным вектором. Указанные клетки могут представлять собой прокариотические или эукариотические клетки. Таким образом, в другом аспекте настоящее изобретение относится к клетке-хозяину, которая трансформирована, трансфицирована или инфицирована вектором в соответствии с настоящим изобретением. Указанная трансформированная, трансфицированная или инфицированная клетка содержит, таким образом, генную конструкцию по настоящему изобретению или указанную экспрессирующую кассету или вектор в соответствии с настоящим изобретением. Трансформированные, трансфицированные или инфицированные клетки можно получать общепринятыми способами, известными специалистам в данной области [Sambrook et al., 1989, смотрите выше]. В конкретном варианте осуществления указанная клетка-хозяин представляет собой клетку животных, которая трансформирована, трансфицирована или инфицирована пригодным вектором, где указанная трансформированная, трансфицированная или инфицированная клетка животных способна экспрессировать слитый белок в соответствии с настоящим изобретением, таким образом, указанные векторы можно использовать для экспрессии в клетках животных слитого белка в соответствии с настоящим изобретением.
Генную конструкцию по настоящему изобретению можно использовать для получения слитых белков, содержащих (a) полипептид (A’), содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и (b) полипептид (B’), содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком.
Таким образом, в другом аспекте настоящее изобретение относится к способу получения указанного слитого белка в соответствии с настоящим изобретением, который включает выращивание клетки или организма в соответствии с настоящим изобретением в условиях, которые обеспечивают продукцию указанного слитого белка. Условия для оптимизации культуры указанной клетки или организма зависят от используемой клетки или организма. Если это необходимо, способ получения представляющего интерес продукта в соответствии с настоящим изобретением дополнительно включает выделение и очистку указанного слитого белка. В другом аспекте настоящее изобретение относится к слитому белку, получаемому посредством экспрессии последовательности нуклеиновой кислоты, содержащейся в генной конструкции по настоящему изобретению. Более конкретно, настоящее изобретение относится к слитому белку, содержащему:
(a) полипептид (A’), содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и
(b) полипептид (B’), содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком.
Иллюстративные примеры молекул, вовлеченных в процесс ангиогенеза, включают белки ECM, ангиогенные факторы, рецепторы клеточной мембраны и т.д. Белки ECM включают коллаген, протеогликаны, фибронектин, ламинин, тенасцин, энтактин и тромбоспондин. В конкретном варианте осуществления указанная молекула, вовлеченная в процесс ангиогенеза, представляет собой ламинин, такой как ламинин млекопитающих, например ламинин крысы, мыши или человека.
В соответствии с настоящим изобретением можно использовать практически любой полипептид, содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, такой как антитело, например моноклональное антитело, которое распознает молекулу, вовлеченную в процесс ангиогенеза, или его рекомбинантный фрагмент, который распознает указанную молекулу, вовлеченную в ангиогенный процесс, например одноцепочечный фрагмент Fv (scFv) антитела, который распознает указанную молекулу, вовлеченную в ангиогенный процесс, или биспецифичное антитело или димер, который распознает указанную молекулу, вовлеченную в ангиогенный процесс, или его полную рекомбинантную форму (Fab + Fc); хотя в конкретном варианте осуществления указанный полипептид (A’), который содержит участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, представляет собой рекомбинантный scFv, полученный из mAb против ламинина L36 (пример 1), содержащий вариабельный участок тяжелой цепи (VH) моноклонального антитела L36, слитый посредством линкера, такого как пептид, содержащий последовательность G4S, с вариабельным участком легкой цепи (VL) mAb L36 (фиг.2C), и последовательность которого описана Sanz L. et al. [Cancer Immunology and Immunotherapy, 2001 Dec; 50(10)557-65], где 3′-конец кодирующей VL последовательности связан с 5′-концом последовательности, кодирующей указанный линкер, и 3′-конец нуклеотидной последовательности, кодирующей указанной линкер, связан с 5′-концом кодирующей VL последовательности. Как известно, mAb L36 распознает ламинины различных видов животных, например мыши, крысы, человека и т.д., поскольку оно взаимодействует с участком, который является высоко консервативным в различных видах животных [Sanz L. et al., EMBO J 2003, vol. 22(7):1508-1517].
Указанный полипептид (A’) может распознавать и блокировать функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, и может направлять антиангиогенный пептид, слитый с указанным полипептидом, к молекулам, вовлеченным в процесс ангиогенеза, например к белкам ECM, ангиогенным факторам, рецепторам клеточной мембраны и т.д., и блокировать функционально активные участки указанных молекул.
Полипептид (B’) содержит (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком. Как упоминалось ранее, указанный домен олигомеризации может представлять собой практически любой домен, обеспечивающий образование олигомера, например димеров, тримеров, тетрамеров и т.д., пептидов или белков, которые могут рекомбинантно экспрессироваться, и образующий белковый олигомер содержащего его белка. Тем не менее, в конкретном варианте осуществления указанный домен олигомеризации представляет собой домен тримеризации, такой как домен тримеризации домена NC1 коллагена XVIII или коллагена XV млекопитающих.
Функционально активный в процессе ангиогенеза участок содержит любой функционально активный в процессе ангиогенеза пептид или белок, такой как ингибитор процесса ангиогенеза или модулирующий пептид или белок. В соответствии с настоящим изобретением можно использовать практически любой функционально активный в процессе ангиогенеза пептид или белок; хотя в конкретном варианте осуществления указанный функционально активный в процессе ангиогенеза участок содержит эндостатин (ES) млекопитающих, такой как ES, находящийся в домене NC1 коллагена XV или коллагена XVIII.
Чувствительный к протеиназам участок расположен между указанным доменом олигомеризации (i) и указанным функционально активным в процессе ангиогенеза участком (ii) и содержит пептидную последовательность, чувствительную к действию протеиназы. Несмотря на то что в соответствии с настоящим изобретением можно использовать практически любую пептидную последовательность, чувствительную к действию любой протеиназы, указанная протеиназа предпочтительно представляет собой протеиназу, экспрессируемую только в области опухоли, чтобы слитый белок по настоящему изобретению “преобразовывался” с образованием мономеров функционально активных в процессе ангиогенеза пептидов или белков (например, ES) и полипептидных тримерных молекул, способных распознавать и блокировать функционально активный участок молекулы, вовлеченной в процесс ангиогенеза (например, scFv). Таким образом, в конкретном варианте осуществления указанный чувствительный к протеиназам участок содержит шарнирную область, находящуюся в домене NC1 коллагена XV или XVIII млекопитающих, между доменом тримеризации и участком ES или доменом указанного домена NC1, поскольку указанный участок является чувствительным к действию протеиназ, которые экспрессируются только в области опухли.
Как известно, указанный домен NC1 коллагена XVIII (и коллагена XV) содержит домен тримеризации и домен ES, связанные шарнирными пептидами (фиг.2B). Таким образом, в конкретном варианте осуществления слитый белок по настоящему изобретению содержит полипептид (B’), содержащий домен NC1 коллагена XV или домен NC1 коллагена XVIII, который содержит домены тримеризации и ES указанных доменов NC1, связанные посредством шарнирных пептидов указанных доменов NC1. Последовательности указанных доменов NC1 коллагена XV и коллагена XVIII известны; в качестве иллюстрации, последовательность домена NC1 коллагена XVIII была описана ранее Sasaki et al. [Sasaki et al., Structure, function and tissue forms of the C-terminal globular domain of collagen XVIII containing the angiogenesis inhibitor endostatin. EMBO J. 1998 Aug 3; 17(15):4249-56].
Таким образом, в качестве иллюстрации, в конкретном варианте осуществления настоящее изобретение относится к слитому белку, содержащему:
(i) полипептид, выбранный из группы, образуемой целым mAb L36, mAb L36 в бифункциональной форме и рекомбинантным scFv, содержащим вариабельный участок тяжелой цепи (VH) mAb L36, слитый, посредством гибкого пептида, с вариабельным участком легкой цепи (VL) mAb L36; и
(ii) полипептид (B’), содержащий домен NC1 коллагена XVIII млекопитающих.
Однако для осуществления настоящего изобретения на практике в целях получения многофункциональных и поливалентных ингибиторов ангиогенеза можно использовать любой другой домен, сходный с доменом NC1 коллагена XVIII, содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком, предпочтительно участок, чувствительный к протеиназам, экспрессируемым в области опухоли.
Cлитый белок в соответствии с настоящим изобретением может дополнительно содержать, если это необходимо, третий полипептид (C’), содержащий аминокислотную последовательность гибкого связующего пептида между указанными полипептидами (A’) и (B’) и/или (b) пептид (D’) для упрощения выделения и очистки слитого белка.
Как упоминалось выше, указанный полипептид (C’) может содержать практически любую пептидную последовательность, определяющую гибкий связующий пептид. Иллюстративные примеры гибких связующих белков включают последовательности, такие как Gly-Ser-Pro-Gly, или последовательность (Gly-Ser)4. Однако в конкретном варианте осуществления указанный гибкий связующий пептид содержит последовательность Leu-Glu-Gly-Ala-Gly-Gly-Ser-Gly-Gly-Ser-Ser-Gly-Ser-Asp-Gly-Ala-Ser-Gly-Ser.
В целях упрощения выделения и очистки слитого белка по настоящему изобретению указанный слитый белок также может содержать, если это необходимо, пептид (D’), который можно использовать для целей выделения или очистки слитого белка, такой как маркерный пептид. Указанный пептид (D’) может быть расположен в любом положении слитого белка, которое не изменяет функциональности любого из полипептидов (A’) и (B’), например указанный пептид (D’) может быть расположен после полипептида (B’). Можно использовать практически любой пептид или пептидную последовательность, обеспечивающие выделение или очистку слитого белка, например полигистидиновые последовательности, пептидные последовательности, которые могут распознавать антитела, которые могут быть пригодны для очистки полученного слитого белка иммуноаффинной хроматографией, такие как маркерные пептиды и т.д., например эпитопы, полученные из гемагглютинина вируса лихорадки или эпитоп C-myc и т.д.
Слитый белок в соответствии с настоящим изобретением содержит полипептид (A’), содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и полипептид (B’), содержащий (i) домен олигомеризации, (ii) функционально активный в процессе ангиогенеза участок и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком. В результате такого слияния и вследствие действия определенных протеиназ, экспрессируемых только в области опухоли, слитый белок “преобразуется” с образованием мономеров функционально активных в процессе ангиогенеза пептидов или белков (например, ES) и полипептидных тримерных молекул, способных распознавать и блокировать функционально активный участок молекулы, вовлеченной в процесс ангиогенеза (например, scFv). Таким образом, настоящее изобретение относится к многофункциональным и поливалентным соединениям ингибиторов ангиогенеза, поскольку на процесс ангиогенеза воздействуют совместно несколькими различными путями.
Таким образом, благодаря собственным свойствам слитого белка по настоящему изобретению, его можно применять для лечения и/или профилактики развития процессов ангиогенеза и, таким образом, для лечения и/или профилактики патологий, возникающих посредством процессов ангиогенеза. Таким образом, в другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей либо слитый белок в соответствии с настоящим изобретением совместно с, по меньшей мере, одним фармацевтически приемлемым эксципиентом, либо вектор, содержащий генную конструкцию по настоящему изобретению, или экспрессирующую кассету по настоящему изобретению, и необязательно по меньшей мере один фармацевтически приемлемый эксципиент.
В конкретном варианте осуществления фармацевтическая композиция по настоящему изобретению содержит по меньшей мере один слитый белок в соответствии с настоящим изобретением в терапевтически эффективном количестве. В значении, используемом в настоящем описании, выражение “терапевтически эффективное количество” относится к количеству слитого белка по настоящему изобретению, вычисленному для получения желательного эффекта и, главным образом, определяемому, наряду с другими факторами, собственными свойствами слитого белка и терапевтическим эффектом, который необходимо получить.
В другом конкретном варианте осуществления фармацевтическая композиция в соответствии с настоящим изобретением представляет собой композицию, предназначенную для применения ее в генной терапии, содержащую вирусный или невирусный вектор в соответствии с настоящим изобретением, содержащий генную конструкцию по настоящему изобретению или экспрессирующую кассету по настоящему изобретению. В качестве иллюстрации, указанные векторы могут представлять собой вирусные векторы, например, на основе ретровируса, аденовируса и т.д., или невирусные, такие как комплексы ДНК-липосома, ДНК-полимер, ДНК-полимер-липосома и т.д. [смотрите “Nonviral Vectors for Gene Therapy”, под редакцией Huang, Hung and Wagner, Academic Press (1999)]. Указанные векторы, которые содержат генную конструкцию по настоящему изобретению или указанную экспрессирующую кассету, можно вводить непосредственно в организм человека или животного общепринятыми способами. Указанные векторы альтернативно можно использовать для трансформации, трансфекции или инфицирования клеток, например клеток млекопитающих, включая клетки человека, ex vivo, а затем имплантации их в организм человека или животного с получением требуемого терапевтического эффекта.
Фармацевтическую композицию в соответствии с настоящим изобретением можно вводить любым пригодным способом введения, например перорально или парентерально. Эксципиенты, которые можно использовать для изготовления фармацевтической композиции в соответствии с настоящим изобретением, зависят, наряду с другими факторами, от способа введения указанной фармацевтической композиции. Обзор различных способов введения активного ингредиента, предназначенных для применения эксципиентов и процессов их получения, можно найти в Tratado de Farmacia Galenica, C. Fauli i Trillo, Luzan 5, S. A. de Ediciones, 1993.
В другом аспекте настоящее изобретение также относится к применению слитого белка в соответствии с настоящим изобретением или генной конструкции по настоящему изобретению, или экспрессирующей кассеты в соответствии с настоящим изобретением, или рекомбинантного вектора в соответствии с настоящим изобретением для изготовления фармацевтической композиции для профилактики, лечения, торможения или минимизации развития ангиогенеза.
В другом аспекте настоящее изобретение относится к применению слитого белка в соответствии с настоящим изобретением или генной конструкции по настоящему изобретению, или экспрессирующей кассеты в соответствии с настоящим изобретением, или рекомбинантного вектора в соответствии с настоящим изобретением для изготовления фармацевтической композиции для лечения и/или профилактики патологий, возникающих вследствие ангиогенеза. Иллюстративные неограничивающие примеры патологий, возникающих вследствие ангиогенеза, включают злокачественную опухоль, гемангиому, ревматоидный артрит, псориаз, бартонеллез, отторжение трансплантированного органа, кровотечение, неоваскуляризацию глаза (один из наиболее частых случаев слепоты), ретинопатии (диабетическую или раннюю ретинопатии и т.д.), дегенерацию желтого пятна, неоваскулярную глаукому, окклюзию вен сетчатки, окклюзию артерий сетчатки, птеригий, покраснение радужки или неоваскуляризацию роговицы. В конкретном варианте осуществления слитый белок по настоящему изобретению, генная конструкция по настоящему изобретению, экспрессирующая кассета в соответствии с настоящим изобретением или рекомбинантный вектор в соответствии с настоящим изобретением, в частности, пригодны для лечения злокачественной опухоли, включая лечение солидных опухолей, и пролиферации и метастазов опухоли.
Следующий пример может использоваться для иллюстрации настоящего изобретения, и его не следует рассматривать как ограничивающий объем настоящего изобретения.
ПРИМЕР 1
Разработка и экспрессия ингибитора ангиогенеза, состоящего из олигомеров фрагмента антитела и коллагена XVIII
Было получено несколько генных конструкций (фиг.3A), способных экспрессировать следующие продукты:
– одноцепочечный фрагмент Fv (scFv) моноклонального антитела против ламинина L36 (scFv L36),
– слитый белок, определяемый как scFv L36-NC1ES-, образованный из scFv L36, слитого с доменом тримеризации, находящимся в домене NC1 коллагена XVIII мыши (остатки с 10 по 60), посредством гибкого соединяющего пептида (линкера),
– слитый белок, определяемый как scFv L36-NC1ES+, образованный из scFv L36, слитого с доменом NC1 коллагена XVIII мыши (остатки с 10 по 325), посредством указанного линкера,
– домен NC1 коллагена XVIII мыши (остатки с 10 по 315) (NC1) и
– эндостатин (ES) из домена NC1 коллагена XVIII мыши (остатки с 130 по 315), который протеолитически высвобождается в тримерной форме, а затем превращается в мономерный ES массой приблизительно 20 кДа (фиг.2A и 2B).
В целях упрощения иммунологического анализа белков получают генные конструкции, дополнительно содержащие последовательность, кодирующую маркер, конкретно, последовательность, кодирующую his6myc, чтобы указанный маркер был связан с C-концом различных белков.
Указанные генные конструкции клонировали в экспрессирующие векторы млекопитающих под контролем промотора цитомегаловируса человека (hCMV), содержащего сигнальную последовательность онкостатина M человека [Sanz L. et al., Gene Therapy (2002) 15:1049]. Экспрессирующие векторы для ES (положения 130-315) и NC1 мыши (1-315) использовали в качестве контролей.
Указанные рекомбинантные белки использовали в анализах образования капиллярной структуры в матригеле, а также в анализах миграции клеток в целях оценки их потенциала в качестве антиангиогенного средства.
I. МАТЕРИАЛЫ И СПОСОБЫ
Клетки и условия культивирования
Клетки HEK-293 (эпителий почки человека; ATCC CRL-1573), клетки HT-1080 (фибросаркома человека; ATCC CCL-121) и клетки B16-F10 (меланома мыши; ATCC CRL-6475) культивировали в среде Игла, модифицированной по Дульбекко (DMEM), дополненной 10% эмбриональной телячьей сывороткой (FBS) (Life Technologies, Gaithersburg, MD, U.S.A.).
Первичные эндотелиальные клетки пуповинной вены человека (HUVEC) были предоставлены Dr. B. Gimenez (Instituto de Investigaciones Biomedicas, Madrid, Spain) и их культивировали в среде Хэма F12K (Life Technologies) с 10% FBS, 50 мкг/мл добавки для роста клеток эндотелия (ECGS), полученной из гипофиза быка, и 100 мкг/мл гепарина (Sigma Biosciences, St. Louis, MO, U.S.A.).
Линия клеток эндотелия микрососудов человека HMEC-1 (Ades E.W. et al., 1992, Journal of Investigative Dermatology, 99:683-690) была поставлена Dr. E. W. Ades (Center for Disease Control, Atlanta, GA, U.S.A.) и ее культивировали в среде MCBD 131 (Life Technologies), дополненной 10% FBS, 10 нг/мл EGF (эпидермального фактора роста) и 1 мг/мл гидрокортизона (Sigma Biosciences).
Конструирование экспрессирующего вектора
Последовательность домена NC1, содержащую последовательность, кодирующую соединяющий пептид, домен тримеризации, шарнирный пептид и домен ES (фиг.2B), амплифицировали посредством полимеразной цепной реакций (ПЦР) из клона mc3b  1 (коллаген XVIII) мыши [Oh et al., Genomics. 1994 Feb; 19(3):494-9], предоставленного Dr. B. Olsen (Harvard Medical School, Boston, MA, U.S.A.), посредством пары праймеров 1 и 2 (смотрите таблицу, содержащую последовательности различных праймеров, используемых для конструкции вектора и последующей проверки последовательностей векторов). 1 (коллаген XVIII) мыши [Oh et al., Genomics. 1994 Feb; 19(3):494-9], предоставленного Dr. B. Olsen (Harvard Medical School, Boston, MA, U.S.A.), посредством пары праймеров 1 и 2 (смотрите таблицу, содержащую последовательности различных праймеров, используемых для конструкции вектора и последующей проверки последовательностей векторов).
Таблица
Последовательности олигонуклеотидов |
| Номер |
Последовательность (5′  3′) 3′) |
| 1. |
ATTCAGATCTTGGGCAGGTGAGGAT |
| 2. |
TTCATGACCTCTTTCTCCAAAGCGGCCGCTAAACTAT |
| 3. |
ATATAGCGCGGCCGCGAATTCAGATCTTGGGCAGGTGAGGAT |
| 4. |
TAGAAGGCACAGTCGAGG |
| 5. |
TCTGGCTCCAAGTCTGGC |
| 6. |
AATTCAGGCGCCGGTGGATCTGGTGGCTCCTCTGGCTCAGACGGAGCGTCGGGTTCGCGA |
| 7. |
GATCTCGCGAACCCGACGCTCCGTCTGAGCCAGAGGAGCCACCAGATCCACCGGCGCCTG |
| 8. |
CGATACA |
| 9. |
GATCTGTAT |
| 10. |
CCTAGATCTTGCTCATACTCATCAGGACTTTCAG |
| 11. |
GTCCTAGGTGCGGCCGCGAAT |
| 12. |
ATAGTTTAGCGGCCGCCTCATTGCCCGTGCCTCTCAG |
Продукт ПЦР снова амплифицировали посредством пары праймеров 2 и 3 (таблица) и полученный продукт ПЦР, расщепленный посредством NotI, присоединяли к участку NotI плазмиды pCR3.1-L36 [Sanz L. et al., Gene Therapy (2002) 15:1049] с получением плазмиды pCR3.1-L36-NC1. Последовательность проверяли с использованием праймеров 4 и 5 (таблица).
Для получения генной конструкции, определяемой как scFv L36-NC1ES+ (фиг.3A), “соединительный пептид”, соединяющий тройную спираль коллагена с доменом тримеризации NC1, ответственным за высвобождение домена NC1 из исходного коллагена XVIII заменяли “гибким пептидным соединительным элементом” (“гибким линкером”) Leu-Glu-Gly-Ala-Gly-Gly-Ser-Gly-Gly-Ser-Ser-Gly-Ser-Asp-Gly-Ala-Ser-Gly-Ser [LEGAGGSGGSSGSDGASGS] (фиг.2B и 2C), в целях предотвращения возможного расщепления домена NC1 на аминоконце scFv L36, с учетом того, что “пептидный соединительный элемент” является чувствительным к действию различных металлопротеиназ (MMP). Для этого пару олигонуклеотидов (праймеры 6 и 7) (таблица), содержащих последовательность, кодирующую указанный “гибкий соединительный пептид” (“гибкий линкер”), присоединяли к участку EcoRI-BglII в рCR3.1-L36-NC1, в результате чего получали плазмиду pCR3.1-L36-линкер-NC1.
Плазмиду pCR3.1-NC1 конструировали посредством удаления фрагмента ClaI-BglII из плазмиды pCR3.1-L36-линкер-NC1 (содержащей полный scFv L36) и встраивания пары олигонуклеотидов (праймеры 8 и 9) (таблица), содержащих участок NruI.
Конструкцию плазмиды pCR3.1-ES, компонента, представляющего собой эндостатин мыши (ES) (остатки с 130 по 315 домена NC1) [Sasaki et al., Structure, function and tissue forms of the C-terminal globular domain of collagen XVIII containing the angiogenesis inhibitor endostatin. EMBO J. 1998 Aug 3;17(15):4249-56], амплифицировали из плазмиды pCR3.1-NC1 посредством пары праймеров 2 и 10 (таблица). Фрагмент из ПЦР, расщепленный посредством BglII/NotI, связывали с плазмидой pCR3.1-NC1, расщепленной BglII/NotI. Последовательность проверяли с использованием праймера 4 (таблица).
Домен тримеризации, находящийся в домене NC1 [Sasaki et al., Structure, function and tissue forms of the C-terminal globular domain of collagen XVIII containing the angiogenesis inhibitor endostatin. EMBO J. 1998 Aug 3;17(15):4249-56], амплифицировали из плазмиды pCR3.1-NC1 посредством пары праймеров 11 и 12 (таблица). Фрагмент из ПЦР, расщепленный NotI, лигировали с плазмидой pCR3.1-L36, расщепленной посредством NotI, с получением плазмиды pCR3.1-L36-тример. Последовательность проверяли с использованием праймера 4 (таблица).
Трансфекции клеток
Клетки HEK-293, HT-1080 и B16-F10 трансфицировали пригодными экспрессирующими векторами (pCR3.1, pCR3.1-L36, pCR3.1-L36-тример, pCR3.1-ES, pCR3.1-NC1 или pCR3.1-L36-линкер-NC1) с использованием системы на основе липофектамина (Life Technologies). Для получения стабильных клеточных линий проводили селекцию трансфицированных клеток HEK-293, HT-1080 и B16-F10 в DMEM с 0,5 мг/мл, 0,6 мг/мл или 3 мг/мл G-418 (Life Technologies). Пролиферацию исходных клеток опухоли, трансдуцированных различными векторами, анализировали каждые сутки в течение 4 последующих суток в анализах с 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразоилбромидом (MTT, Promega). Супернатанты промежуточных и стабильных популяций клеток анализировали для определения экспрессии белка посредством SDS-PAGE [Sanz L. et al., Gene Therapy (2002) 15:1049], ELISA [Sanz L. et al., Gene Therapy (2002) 15:1049] и вестерн-блоттинга (иммуноблоттинга) [Blanco et al., J. Immunol (2003) 171:1070] с использованием mAb (моноклональных антител) против myc (Life Technologies) или против эндостатина (Upstate Biotechnology, Lake Placid, NY, U.S.A.).
Экспрессия и очистка рекомбинантных белков
Трансфицированные стабильные клетки HEK-293 использовали в культуральных средах, кондиционированных без сыворотки. Для снижения протеолиза в среду добавляли сочетание (“коктейль”) ингибиторов протеиназ (апротинин, бестатин, леупептин, пепстатин A и E-64) (Sigma Biosciences). Среду (приблизительно 1 л) концентрировали (×10) посредством фильтра Vivaflow 50 10000 MWCO (Vivascience AG, Germany), проводили диализ против PBS (фосфатно-солевой буфер), pH 7,4 и помещали в 1-мл колонку HisTrap HP (Amersham Biosciences, Uppsala, Sweden). Белки, содержащие ES, дополнительно очищали на 1-мл колонке HiTrap Heparin HP (Amersham Biosciences). Элюирование проводили посредством линейного градиента 0,1-2,0 NaCl. Проводили диализ очищенных белков против PBS и хранили при -20°C. Слитый белок домена ES и Fc (Fc-ES) [Cuo C.J. et al., J Cell Biol. 2001 152:1233] был предоставлен Dr. K. Javaherian (Boston Children’s Hospital, Boston, MA, U.S.A.). Указанный слитый белок Fc-ES представляет собой димерный слитый белок (домена ES и фрагмента Fc иммуноглобулина), и он блокирует морфогенез капилляров.
Аналитическое центрифугирование
Эксперименты с центрифугированием проводили при 20°C в аналитической ультрацентрифуге Optima XL-A (Beckman-Coulter Inc.), оборудованной оптикой для УФ-области спектра, с использованием ротора An50Ti с 3-мм двухсекторным центральным элементом из активированного угля Epon. Степень седиментации при низкой скорости оценивали в короткой колонке (23 мкл) при трех последовательных скоростях (5000, 6000 и 11000 об/мин) и изображения для степени получали (через 20 часов) при длине волны 280 нм. Внимание сосредотачивали на сохранении белковой массы в растворимой форме в процессе эксперимента. В контрольных экспериментах по скорости седиментации не было показано какой-либо агрегации в течение периода времени 45 часов. Контрольный сигнал определяли после центрифугирования на высокой скорости (5 часов при 42000 об/мин). Среднюю молекулярную массу по кажущейся массе цельных клеток получали с использованием программы EQASSOC [Minton, A. P. (1994) в Modern Analytical Ultracentrifugation (Schuster, T., and Laue, T., eds), pp. 81-93, Birkhauser Boston, Inc., Cambridge, MA]. Эксперимент по скорости седиментации проводили при 42000 об/мин и изображения для поглощения получали при 280 нм. Коэффициенты седиментации вычисляли посредством модели уравнения Ламма для непрерывного распределения c(s) [P. Schuck. Size-Distribution Analysis of Macromolecules by Sedimentation Velocity Ultracentrifugation and Lamm Equation Modeling. Biophysical Journal 78 (2000), pp. 1606-1619], которую осуществляли посредством программы SEDFIT. Эти экспериментальные значения для седиментации корректировали в соответствии с обычными условиями с получением соответствующих значений s20,w с использованием программы SEDNTERP [T.M. Laue, B.D. Shah, T.M. Ridgeway and S.L. Pelletier, Computer-aided interpretation of analytical sedimentation data for proteins. В: S. E. Harding, AJ. Rowe and J. C. Horton, Editors, Analytical Ultracentrifugation in Biochemistry and Polymer Science, Royal Society of Chemistry, Cambridge, UK (1992), pp. 90-125]. Дополнительные гидродинамические анализы (т.е. вычисление соотношения коэффициентов трения) проводили посредством программы SEDFIT с получением распределения c(M) [P. Schuck. Size-Distribution Analysis of Macromolecules by Sedimentation Velocity Ultracentrifugation and Lamm Equation Modeling. Biophysical Journal 78 (2000), pp. 1606-1619].
Фильтрационная хроматография на аналитическом геле
Указанные эксперименты проводили при комнатной температуре с системой ДKTA FPLC с использованием колонки Superdex 200 10/300GL. Образцы различных рекомбинантных белков объемом 0,1 мл (scFv L36, scFv L36-NC1ES-, scFv L36-NC1ES+ и NC1) в PBS инъецировали в концентрации 0,5-1,0 мг/мл и разделяли при скорости потока 0,5 мл/мин. Колонку калибровали посредством высокомолекулярных и низкомолекулярных маркеров (Amersham). Соотношения объемов элюирования относительно объема вытеснения и молекулярных масс маркеров приводили в соответствие экспоненциальной кривой, которую использовали для вычисления молекулярной массы образцов.
Протеиназы
Матриксные протеиназы (MMP) человека MMP-1 и MMP-9 приобретали в Oncogene Research Products (San Diego, CA, U.S.A.), а MMP человека MMP-3, MMP-8 и MMP-14 (MT1-MMP) приобретали в Calbiochem (San Diego, CA, U.S.A.). Катепсин L человека и панкреатическую эластазу свиньи также приобретали в Calbiochem.
Протеолитическая обработка
Рекомбинантные белки scFv L36-NC1ES-, scFv L36-NC1ES+ и NC1 инкубировали в концентрации 0,6 мкМ при 37°C в течение 10 минут с:
– 10 нМ катепсином L человека в 50 мМ ацетате натрия, pH 5,5, 2 мМ дитиотреитоле (DTT), 5 мМ этилендиаминтетрауксусной кислоте (ЭДТА) (для обработки катепсином L человека);
– 25 нМ эластазой свиньи в 50 мМ ацетате натрия, pH 6,0 (для обработки эластазой свиньи) и
– 25 нМ металлопротеиназой в 50 мМ Трис-HCl, pH 7,5, 10 мМ CaCl2, 150 мМ NaCl, 0,05% Brij-35, 50 мкМ ZnSO4 (для обработки используемыми металлопротеиназами).
Затем аликвоты подвергали электрофорезу в 12% полиакриламидном геле в редуцирующих условиях в присутствии додецилсульфата натрия (SDS-PAGE). Гели окрашивали нитратом серебра (Sigma BioScience) или подвергали вестерн-блоттингу с использованием mAb мыши против ES.
Анализ образования трубки в матригеле
Для анализов образования подобной капилляру структуры (CLS) получали матрикс мембраны на основе матригеля (Becton Dickinson, Bedford, MA, U.S.A.) на предварительно замороженном 72-луночном планшете Terasaki (Nunc, Roskilde, Denmark) с 2 мкл/лунка, а затем оставляли для затвердевания при 37°C на 30 минут. 3×103 EC (HMEC-1 или HUVEC) в 10 мкл пригодной среды, дополненной 0,5% FBS, высевали на загущенный матрикс. Общий объем среды в лунке доводили до 25 мкл, в то время как клетки получали и инкубировали в течение 16 часов при 37°C в увлажненной атмосфере с 5% CO2. Ингибиторное действие анализируемых рекомбинантных белков (scFv L36, scFv L36-NC1ES-, scFv L36-NC1ES+, NC1 и ES) на формирование трубки определяли посредством добавления 15 мкл очищенного рекомбинантного белка, разбавленного в среде, пригодной в соответствии с используемой клеточной линией (HMEC-1 или HUVEC), в различных концентрациях (фиг.5D), в покрытые матригелем планшеты во время культивирования клеток. Эксперименты проводили в трех экземплярах.
Анализ цифрового изображения
Цифровые изображения каждой лунки получали посредством микроскопа Axiovert 100 (Carl Zeiss, Germany) с использованием камеры SPOT (Diagnostics Instruments, Inc.) и хранили в качестве изображений BMP с 8-битной шкалой серых тонов с количеством пикселей 328×256. Изображения обрабатывали с использованием нового программного обеспечения AD на основе Matlab 5.3 [Sanz, L. et al., Microvasc Res. 2002 May; 63(3):335].
Анализ миграции клеток
Для исследований миграции EC вкладыши фильтра на основе терефталата полиэтилена с порами размером 3,0 мкм и диаметром 6,5 мм (Becton Dickinson) покрывали матригелем в концентрации 1,25 мкг/мл в не содержащей сыворотки среде при 4°C на ночь. Клетки HUVEC (1,5×105) предварительно инкубировали в не содержащей сыворотки среде в течение 30 минут при 37°C в увлажненной атмосфере с 5% CO2 в присутствии 20 мкг/мл очищенного белка (scFv L36, scFv L36-NC1ES-, ES, NC1 и scFv L36-NC1ES+), а затем их переносили в верхнюю камеру. 600 мкл среды, содержащей сыворотку, добавляли в нижнюю камеру. Через 16 часов клетки фиксировали 1% глутаральдегидом в PBS, окрашивали 0,1% кристаллическим фиолетовым и исследовали под микроскопом.
II. РЕЗУЛЬТАТЫ
Сочетанное действие эндостатина и scFv антитела против ламинина (L36) в анализе формирования эндотелиальной трубки
Было показано, что олигомерный ES модулирует зависимый от внеклеточного матрикса (ECM) морфогенез клеток эндотелия (EC) [Cuo C.J. et al., J Cell Biol. 2001 152:1233]. Обработка димерным ES в форме Fc-ES во время культивирования клеток на матригеле значительно ингибировала сборку в трубчатые структуры, сохраняя EC диспергированными и демонстрируя морфологию, которая была аналогична морфологии клеток на пластмассе. Эти морфологические изменения были сходны с изменениями, наблюдаемыми, когда культуры EC обрабатывали scFv L36 (фиг.1).
Конструирование и экспрессия слитых белков scFv L36-ES
Источником ES, который протеолитически высвобождается в тримерной форме, а затем превращается в мономерную ES массой приблизительно 20 кДа (фиг.2A и 2B), является домен NC1 коллагена XVIII. Были сконструированы различные химерные гены, экспрессирующие различные белки.
В конкретном варианте осуществления был сконструирован химерный ген, называемый scFv L36-NC1ES+, состоящий из scFv mAb против ламинина L36, слитого с доменом NC1 коллагена мыши XVIII (остатки с 10 по 315) (фиг.2C и 3A). На N-конце NC1 коллагена XVIII находится домен тримеризации из приблизительно 60 аминокислотных остатков, присоединенный рядом с элементом ES из приблизительно 180 аминокислотных остатков, посредством гибкой шарнирной области из приблизительно 70 аминокислотных остатков, содержащей несколько участков, которые являются чувствительными к протеиназам, с помощью которых после протеолитического расщепления высвобождается ES (фиг.2B). “Соединительный пептид”, соединяющий тройную спираль коллагена с доменом тримеризации NC1, ответственным за высвобождение домена NC1 из исходного коллагена XVIII, является чувствительным к действию различных MMP. Таким образом, для предотвращения возможного расщепления домена NC1 на аминоконце L36 указанный “соединительный пептид” заменяют “гибким линкером” из 17 аминокислот (фиг.2B и 2C).
Также, в другом конкретном варианте осуществления сконструировали химерный ген, называемый scFv L36-NC1ES-, более короткий, чем предыдущий ген, содержащий кодирующие последовательности для scFv L36, указанный гибкий линкер и только домен тримеризации NC1 (фиг.3A).
Для упрощения иммунологического анализа к C-концу слитых белков присоединяли маркер his6myc.
Генные конструкции клонировали в пригодные экспрессирующие векторы млекопитающих под контролем промотора hCMV, содержащего главную последовательность онкостатина M человека. Экспрессирующие векторы для ES (положения 130-315) и NC1 мыши (1-315) использовали в качестве контроля (фиг.3A).
Получали стабильные линии клеток HEK 293 и очищали слитые белки из кондиционированной среды. Вестерн-блот анализ показал, что характер миграции очищенных белков согласовывался с предполагаемой молекулярной массой (фиг.3B) [дорожка 1: scFv L36; дорожка 2: scFv L36-NC1ES-; дорожка 3: scFv L36-NC1ES+; дорожка 4: NC1 и дорожка 5: ES].
В редуцирующих условиях mAb против myc 9E10 формировали отдельные полосы с кажущейся молекулярной массой (MW) 26, 36, 67,5 и 22 кДа (фиг.3B), которая соответствует вычисленной MW 28,8, 37,6, 65,6 и 23,8 кДа для мономерного scFv L36, тримерного scFv L36, scFv L36-NC1 и мономерного ES, соответственно. В вестерн-блот анализах с белками, содержащими домен NC1, mAb 9E10 распознавали единичную полосу массой приблизительно 24 кДа, соответствующую мономерному ES, и парную полосу 39-44 кДа, соответствующую необработанному белку (фиг.3B). Обе полосы в парной полосе были положительными в вестерн-блот анализе с mAb против ES (Upstate Biotechnology, Lake Placid, NY 12946, USA). Парная полоса может возникать вследствие посттрансляционной модификации или вследствие собственных действий сборки белка.
Также mAb против ES формировало полосу массой 24 кДа и дополнительную полосу с кажущейся MW приблизительно 23 кДа, которая может соответствовать немаркированным мономерам ES-типа (фиг.3B). Посредством вестерн-блот анализа с белками scFv L36-NC1ES+, mAb против ES распознавало полосу необработанного слитого белка массой 67,5 кДа и 24 кДа, не определяемую посредством mAb 9E10, соответствующую обработанному домену ES (фиг.3B). Очищенные ES представляли собой парную полосу массой 22-23 кДа при обработке mAb против ES (фиг.3B).
Характеризация слитого белка scFv L36-NC1ES-
Состояние олигомеризации различных слитых белков оценивали посредством аналитической хроматографии с гель-фильтрацией и посредством экспериментов с аналитическим центрифугированием с идентичными образцами. Слитый белок scFv L36-NC1ES- очищали посредством IMAC (аффинная хроматография с иммобилизованным металлом), элюировали из колонки для гель-фильтрации по существу в виде одного пика (90% общей площади) в объеме, который соответствовал молекулярной массе 109 кДа, которая указывала на то, что белок представлял собой тример. Для скорости седиментации также был показан главный отдельный пик с массой 112 кДа, и результатом анализа седиментационного равновесия было распределение масс, которое могло соответствовать тримерным образцам и не соответствовало мономерным или димерным (фиг.4A). В целом, все эти результаты показали тримерную природу слитого белка scFv L36-NC1ES-, свойство, придаваемое доменом тримеризации NC1, поскольку scFv L36 является мономерным в таких же условиях, как показано в экспериментах по гель-фильтрации и скорости седиментации (данные не представлены). Тримерные scFv L36 (scFv L36-NC1ES-) показали более высокую аффинность связывания ламинина, иммобилизованного на пластмассе, и были значительно более эффективными, чем мономер, в отношении блокирования дифференцировки EC на субстратах на основе матригеля (фиг.4B и 4C).
Для экспериментальных целей необходимо, чтобы слитый белок scFv L36-NC1ES- оставался стабильным и функциональным в присутствии протеиназ. Таким образом, определяли его функциональность после инкубации с широким диапазоном протеиназ в известных молярных концентрациях активного фермента. Протеиназы включали представителей нескольких классов протеиназ, т.е. катепсин L семейства цистеиновых протеиназ; MMP-1, MMP-3; MMP-8; MMP-9, MMP-14 семейства металлопротеиназ, и панкреатическую эластазу семейства сериновых протеиназ. Как представлено на фиг.4D, тримерный scFv L36 (scFv L36-NC1ES-) не расщеплялся в присутствии большинства анализируемых протеиназ. MMP-14 частично преобразовывала тример (scFv L36-NC1ES-), однако даже после 4-часового взаимодействия посредством ELISA определяли функционально активное антитело. Только катепсин L осуществлял полную деградацию слитого белка scFv L36-NC1ES-.
Характеризация слитого белка scFv L36-NC1ES+
Гель-фильтрация показала, что очищенный слитый белок scFv L36-NC1ES+ элюировался в виде главного пика с приблизительной молекулярной массой 210 кДа, соответствующей тримеру, и другого пика с кажущейся молекулярной массой 117 кДа, которая могла соответствовать фрагменту, лишенному части ES (фиг.5A). Для скорости седиментации также было выявлено два вида с массами 181 кДа и 83 кДа.
Рекомбинантный белок NC1 элюировался в качестве главного пика с приблизительной молекулярной массой 123 кДа, которая соответствовала тримерному образцу, и других пиков меньших размеров, один из них с массой 19 кДа, которая соответствовала мономерам ES (фиг.5B). Основной образец с молекулярной массой 116 кДа был выявлен посредством экспериментов по скорости седиментации. Эти данные показали, что рекомбинантный белок NC1 был изначально тримерным, но гетерологичным, возможно, вследствие деградации, что согласовывалось с результатами, полученными другими исследователями, которые наблюдали сходную гетерогенность рекомбинантных белков NC1 [Sasaki T. et al., EMBO J. 1998 17:4249-56].
Как ожидалось, для слитого белка scFv L36-NC1ES+ была показана аффинность связывания ламинина, иммобилизованного на пластмассе, немного более высокая, чем аффинность рекомбинантного белка NC1 (фиг.5C). Аналогично, указанный слитый белок scFv L36-NC1ES+ (биспецифичный) был значительно более эффективным, чем рекомбинантный белок NC1 (моноспецифичный) в отношении блокирования дифференцировки EC на субстратах матригеля (фиг.5D).
Фиг.5E включает результаты анализа миграции EC и на ней показано, что миграция клеток HUVEC в присутствии слитого белка scFv L36-NC1ES+ меньше, чем миграция, достигаемая в присутствии анализируемых рекомбинантных белков (scFv L36 и NC1), и обладает таким же порядком величины, которую достигают посредством рекомбинантного ES.
Протеолитическая обработка слитого белка scFv L36-NC1ES+. Образование мономерного ES и мультимерного scFv
В целях проведения исследования образования ES посредством нескольких протеиназ, слитый белок scFv L36-NC1ES+ инкубировали и реакционную смесь анализировали посредством вестерн-блот анализа с использованием mAb против ES (Upstate Biotechnology, Lake Placid, NY 12946, USA). Слитый белок обрабатывали пятью анализируемыми MMP (MMP-1, MMP-3, MMP-8, MMP-9 и MMP-14), наблюдая значительные различия эффективности преобразования белка scFv L36-NC1ES+ между указанными MMP, где MMP-3 и MMP-14 оказались наиболее эффективными. Полное преобразование слитого белка scFv L36-NC1ES+ наблюдали через 4 часа. Основными накопленными продуктами были полипептиды с молекулярными массами, находящимися между 20 и 25 кДа (фиг.6A). MMP-3, MMP-8, MMP-9 и MMP-14 продуцировали фрагменты ES, которые накапливались через 4 часа, что позволяет предположить, что указанные MMP не могут их деградировать. Как представлено на фиг.6A, эластаза и катепсин L не только приводили к образованию фрагментов типа ES из слитого белка scFv L36-NC1ES+, а также они их быстро деградировали, только небольшие количества ES оставались через 4 часа инкубации. Этот характер протеолитического преобразования был почти идентичным характеру, наблюдаемому для природного белка NC1 мыши (фиг.6B). Результаты показали, что добавление к N-концу фрагмента антитела, содержащего участок распознавания эпитопа, такой как scFv, в домене NC1 не препятствовало ни протеолитической обработке слитого белка протеиназами, ни образованию ES.
В целях исследования эффективности протеиназ для получения фрагментов антитела (scFv L36), реакционные смеси подвергали SDS-PAGE в редуцирующих условиях и окрашивали нитратом серебра. Как представлено на фиг.6C, наиболее эффективной для получения ES протеиназой была MMP-14, которая также приводила к образованию scFv L36. Образованные scFv L36 и ES были стабильными и накапливались через 4 часа, что указывало на то, что в этих экспериментальных условиях протеиназа не могла их деградировать. Взаимоотношение между интенсивностью для тримерного scFv L36 и интенсивностью для ES предполагает сбалансированное преобразование слитого белка scFv L36-NC1ES+. Для других MMP наблюдались сходные результаты (данные не представлены).
Формула изобретения
1. Олигомерный белок, применяемый как многофункциональный и поливалентный ингибитор или модулятор ангиогенеза, содержащий 2, 3 или 4 слитых белка, где каждый слитый белок содержит:
a) полипептид (А’), содержащий участок, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, где указанный полипептид представляет собой антитело, которое распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, или его рекомбинантный фрагмент, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и
b) полипептид (В’), содержащий (i) домен олигомеризации, (ii) ингибирующий или модулирующий процесс ангиогенеза пептид или белок, и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком.
2. Олигомерный белок по п.1, где указанная молекула, вовлеченная в процесс ангиогенеза, представляет собой белок внеклеточного матрикса (ЕСМ), ангиогенный фактор или рецептор клеточной мембраны.
3. Олигомерный белок по п.2, где указанная молекула, вовлеченная в процесс ангиогенеза, представляет собой коллаген, протеогликан, фибронектин, ламинин, тенасцин, энтактин, тромбоспондин, сосудисто-эндотелиальный фактор роста (VEGF), рецептор 2 VEGF (VEGFR-2) или интегрин.
4. Олигомерный белок по п.3, где указанный ламинин представляет собой ламинин млекопитающих, предпочтительно ламинин крысы, мыши или человека.
5. Олигомерный белок по любому из пп.1-4, где указанный полипептид (А’) представляет собой одноцепочечный фрагмент Fv (scFv) антитела, которое распознает функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, или димер, распознающий указанную молекулу, вовлеченную в процесс ангиогенеза.
6. Олигомерный белок по п.1, где указанный полипептид (В’) содержит домен NC1 коллагена XV млекопитающих или домен NC1 коллагена XVIII млекопитающих.
7. Олигомерный белок по п.1, содержащий, между указанными полипептидами (А’) и (В’), третий полипептид (С’), содержащий аминокислотную последовательность гибкого связующего белка.
8. Олигомерный белок по п.1, где указанный олигомерный белок представляет собой тример, состоящий из 3 слитых белков, где каждый слитый белок содержит:
a) полипептид (А’), где указанный полипептид (А’) представляет собой одноцепочечный фрагмент Fv (scFv) антитела, которое распознает ламинин, и
b) полипептид (В’), где указанный полипептид (В’) содержит домен NC1 коллагена XVIII млекопитающих.
9. Фармацевтическая композиция для профилактики, лечения, торможения или минимизации развития ангиогенеза у пациента, нуждающегося в этом, содержащая терапевтически эффективное количество олигомерного белка по любому из пп.1-8 совместно с по меньшей мере одним фармацевтически приемлемым эксципиентом.
10. Фармацевтическая композиция по п.9, применяемая для лечения и профилактики патологий, возникающих вследствие ангиогенеза.
11. Фармацевтическая композиция по п.10, где указанные патологии, возникающие вследствие ангиогенеза, включают злокачественную опухоль, гемангиому, ревматоидный артрит, псориаз, бартонеллез, отторжение трансплантированного органа, кровотечение, неоваскуляризацию глаза, ретинопатии, дегенерацию желтого пятна, неоваскулярную глаукому, окклюзию вен сетчатки, окклюзию артерий сетчатки, птеригий, покраснение радужки или неоваскуляризацию роговицы.
12. Применение олигомерного белка по любому из пп.1-8 для изготовления фармацевтической композиции для профилактики, лечения, торможения или минимизации развития ангиогенеза.
13. Применение олигомерного белка по любому из пп.1-8 для изготовления фармацевтической композиции для лечения или профилактики патологий, возникающих вследствие ангиогенеза.
14. Применение по п.13, где указанная патология, возникающая вследствие ангиогенеза, включает злокачественную опухоль, гемангиому, ревматоидный артрит, псориаз, бартонеллез, отторжение трансплантированного органа, кровотечение, неоваскуляризацию глаза, ретинопатии, дегенерацию желтого пятна, неоваскулярную глаукому, окклюзию вен сетчатки, окклюзию артерий сетчатки, птеригий, покраснение радужки или неоваскуляризацию роговицы.
15. Экспрессирующая кассета, кодирующая олигомерный белок по любому из пп.1-8, содержащая функционально связанную с контролирующей экспрессию последовательностью генную конструкцию, содержащую функционально связанные по меньшей мере:
а) первую последовательность нуклеиновой кислоты (А), содержащую нуклеотидную последовательность, кодирующую полипептид, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, где указанный полипептид представляет собой антитело, которое распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза, или его рекомбинантный фрагмент, который распознает и блокирует функционально активный участок молекулы, вовлеченной в процесс ангиогенеза; и
b) вторую последовательность нуклеиновой кислоты (В), содержащую нуклеотидную последовательность, кодирующую полипептид, содержащий (i) домен олигомеризации, (ii) ингибирующий или модулирующий процесс ангиогенеза пептид или белок, и (iii) чувствительный к протеиназам участок между указанным доменом олигомеризации и указанным функционально активным в процессе ангиогенеза участком;
где 3′-конец указанной первой последовательности нуклеиновой кислоты (А) связан с 5′-концом указанной второй последовательности нуклеиновой кислоты (В).
16. Экспрессирующая кассета по п.15, где указанная молекула, вовлеченная в процесс ангиогенеза, представляет собой белок внеклеточного матрикса (ЕСМ), ангиогенный фактор или рецептор клеточной мембраны.
17. Экспрессирующая кассета по п.16, где указанная молекула, вовлеченная в процесс ангиогенеза, представляет собой коллаген, протеогликан, фибронектин, ламинин, тенасцин, энтактин, тромбоспондин, сосудисто-эндотелиальный фактор роста (VEGF), рецептор 2 VEGF (VEGFR-2) или интегрин.
18. Экспрессирующая кассета по п.17, где указанный ламинин представляет собой ламинин млекопитающих, предпочтительно ламинин крысы, мыши или человека.
19. Экспрессирующая кассета по п.15, где указанная первая последовательность нуклеиновой кислоты (А) содержит последовательность нуклеиновой кислоты, кодирующую одноцепочечный фрагмент Fv (scFv) антитела, которое распознает указанную молекулу, вовлеченную в процесс ангиогенеза, или димер, который распознает указанную молекулу, вовлеченную в процесс ангиогенеза.
20. Экспрессирующая кассета по п.15, где указанная вторая последовательность нуклеиновой кислоты (В) содержит нуклеотидную последовательность, кодирующую домен NC1 коллагена XV млекопитающих, или нуклеотидную последовательность, кодирующую домен NC1 коллагена XVIII млекопитающих, содержащую нуклеотидную последовательность, соответствующую доменам тримеризации и эндостатину (ES) указанных доменов NC1, и нуклеотидную последовательность, кодирующую шарнирные пептиды указанных доменов NC1.
21. Экспрессирующая кассета по п.15, содержащая, в дополнение к указанным последовательностям нуклеиновых кислот (А) и (В), третью последовательность нуклеиновой кислоты (С), содержащую нуклеотидную последовательность, кодирующую гибкий связующий белок, где 5′-конец указанной третьей последовательности нуклеиновой кислоты (С) связан с 3′-концом указанной первой последовательности нуклеиновой кислоты (А).
22. Экспрессирующая кассета по п.15, где указанная первая последовательность нуклеиновой кислоты (А) содержит последовательность нуклеиновой кислоты, кодирующую одноцепочечный фрагмент Fv (scFv) антитела, которое распознает ламинин, и указанная вторая последовательность нуклеиновой кислоты (В) содержит нуклеотидную последовательность, кодирующую домен NC1 коллагена XVIII млекопитающих, содержащую нуклеотидную последовательность, соответствующую домену тримеризации и эндостатину (ES) указанного домена NC1.
23. Экспрессирующий вектор, содержащий экспрессирующую кассету по любому из пп.15-22.
24. Клетка-хозяин, применяемая для продуцирования олигомерного белка по любому из пп.1-8, содержащая экспрессирующую кассету по любому из пп.15-22 или вектор по п.23.
25. Способ получения олигомерного белка по любому из пп.1-8, включающий выращивание клетки, где указанная клетка содержит экспрессирующую кассету по любому из пп.15-22 или вектор по п.23, в условиях, которые обеспечивают продукцию указанного олигомерного белка, и, если это необходимо, выделение и очистку указанного олигомерного белка.
РИСУНКИ
|
|